FISICOQUÍMICA MÓDULO I: TERMODINÁMICA SEMINARIO 2
|
|
|
- Óscar Chávez Toledo
- hace 6 años
- Vistas:
Transcripción
1 FISICOQUÍMICA MÓDULO I: ERMODINÁMICA SEMINARIO Conceptos Importantes Entropía y segunda ley de la termodinámica. El cambio de entropía como criterio de espontaneidad de un proceso. Energía libre. El cambio de energía libre como criterio de espontaneidad. Fórmulas básicas qrev q ds, ds ds ds ds 0 u s a irrev SN, V, E kb ln N, V, E G H S dg 0, a y P constante Preguntas Conceptuales 1) Es la entropía una función de estado? Con qué propiedad microscópica de un sistema se relaciona la entropía? ) Indique porqué es falsa la siguiente afirmación: de acuerdo con el segundo principio de la termodinámica, la entropía de un sistema siempre aumenta en un proceso espontáneo. 3) Es posible determinar el valor absoluto de la entalpía de un sistema a partir de mediciones calorimétricas? Y de la entropía? 4) Elija la o las palabras del interior de los paréntesis que hagan que las afirmaciones siguientes sean correctas. Al menos una de las palabras es correcta. Justifique sus respuestas. a) La segunda ley de la termodinámica afirma que la entropía de un sistema aislado siempre (aumenta, permanece constante, disminuye) durante un proceso espontáneo. b) Durante un proceso isotérmico reversible, S para el sistema es (menor que, igual a, mayor que) el calor absorbido. c) S para un proceso isotérmico, espontáneo, irreversible es (menor que, igual a, mayor que) el calor absorbido por el sistema. d) Cuando una muestra de líquido se convierte reversiblemente a su vapor en su punto de ebullición normal (Q, W,, V, E, H, S, G, ninguno de estos) es igual a cero para el sistema. e) Si el líquido del inciso anterior se deja evaporar isotérmicamente, hacia una cámara previamente evacuada cuyo volumen es tal que la presión final del vapor es 1 atm, (Q, W, E, H, S, G) tendrán valores diferentes que en la evaporación reversible. 5) Indique en qué condiciones el cambio de energía libre de un sistema puede ser considerado como criterio de espontaneidad de un proceso.
2 6) Partiendo de la definición de G, deduzca las siguientes relaciones para las derivadas parciales de la energía libre de Gibbs G S G P P V Problemas típicos Problema 1 Considere un sistema aislado como el de la figura, formado por dos subsistemas idénticos a las temperaturas 1 =400K y =00K, respectivamente. 1 a) Si el sistema se deja evolucionar espontáneamente hacia el equilibrio, cuál de los siguientes estados finales será alcanzado? 1 = 300K, = 300K 1 = 500K, = 100K b) El hecho de que se alcance cualquiera de estos dos estados contradice el primer principio de la termodinámica? Problema Un mol de CO se transforma desde un estado inicial caracterizado por i =30K y V i =80,0l a un estado final caracterizado por f = 650K y V f =10,0l. Asuma que el CO sigue la ecuación de estado del gas ideal y calcule el cambio de entropia para: a) El proceso es reversible y cv 31,08J/K mol. b) El proceso es irreversible y cv 31,08J/K mol. c 5 C) El proceso es reversible y V 31, , JK mol K K Problema 3 Dos moles de un gas ideal sufren una transformación adiabática contra una presión externa de 0.75 atm por la cual pasan de un estado con P= 1.5 atm, V= 3,0l hasta un estado con V=4.0l P=0,75 atm. a) Calcule el trabajo y el cambio de energía interna del sistema. b) Es correcto asumir que el cambio de entropía del sistema es cero? c) Si su respuesta es no, calcule el cambio de entropía del sistema. Si su respuesta es si, piénselo de nuevo.
3 Problema 4 Considere el siguiente ciclo realizado por 1 mol de gas ideal inicialmente a 5C y 1 atm de presión. Etapa 1: Expansión adiabática contra contra el vacío hasta duplicar el volumen. Etapa : Compresión isotérmica reversible de 0.5 atm hasta 1 atm. a) Haga un esquema del proceso en un gráfico P-V. b) Calcule el calor puesto en juego en cada etapa. c) Calcule el S sist y S alr en cada etapa. d) El S univ para el ciclo. Problema 5 Elija la o las palabras dentro de los paréntesis que hagan correctas las afirmaciones siguientes. Considere el proceso en que 1 mol de agua gaseosa a 1 atm de presión condensa reversiblemente a agua líquida a 100ºC por una lenta pérdida de calor hacia los alrededores. a) En este proceso la entropía del sistema (aumenta, no cambia, disminuye) b) La entropía del universo (aumenta, no cambia, disminuye) c) Puesto que el proceso de condensación sucede a y P constantes, el respectivo cambio de energía libre será (positivo, cero, negativo). d) Si la misma transformación se lleva a cabo irreversiblemente, se observarán diferentes valores para (el cambio de entropía del sistema, el cambio de entropía de los alrededores, el cambio de entropía del universo, el cambio de energía libre del sistema). Problema 6 Para los siguientes procesos indique si cada una de las cantidades termodinámicas listadas será mayor, menor o igual a cero. Enuncie cualquier suposición que deba hacer para dar una respuesta. Considere a todos los gases como ideales. a) Un gas ideal se expande adiabática y reversiblemente hasta veces su volumen inicial. (Q, W, P,, V, E, H, S). b) Una muestra de agua líquida, sobreenfriada a -10ºC se coloca en un recipiente térmicamente aislado y sufre una cristalización espontánea para formar una mezcla de hielo y agua líquida en equilibrio. (Q, W,, E, H, S, G). Considere presión constante. Problema 7 Una sugerencia para resolver la escasez de combustible es utilizar potencia eléctrica (obtenida de la energía solar) para formar hidrógeno y oxígeno gaseosos. El hidrógeno se podría utilizar como combustible no contaminante. a) Utilizando datos de tablas calcule los cambios de H, S y G al quemar 1 gramo de hidrógeno a agua líquida a 5ºC y 1 atm. b) Calcule los cambios de H, S y G al quemar 1 gramo de n-octano(g) a agua líquida y CO (g) a 5ºC y 1 atm. Problema 8 Para la reacción: 1 CH3OH( l) CH4( g) O( g) a) Calcule H 98, S 98 y G 98.
4 b) Estime E 98. Indique que las aproximaciones que utilizó para hacer la estiamción. c) Escriba las ecuaciones necesarias para obtener H, S y G a 500 ºC. Indique qué datos extra necesitaría. Problema 9 Considere la condensación reversible de 1 mol de agua gaseosa a 100ºC y 1 atm. Dato H cond 40, 67kJ mol, 373 b) Estime E. c) Calcule las variaciones de S y G para el proceso de condensación d) El sistema absorbe o entrega calor? e) El sistema hace trabajo o lo recibe? Adicionales Problema 10 Un mol de gas ideal realiza un ciclo de Carnot utilizando un reservorio a C y otro a C. a) Calcule el cambio de entropía del gas en cada una de las etapas del ciclo considerando que en la primera etapa se realiza un trabajo correspondiente a 10 kj/mol. b) Si la primera etapa se realizase de manera irreversible, espera que el calor puesto en juego sea mayor o menor al correspondiente calor del ciclo reversible? Problema 11 La mezcla de articulos de limpieza para el hogar a temperatura ambiente (=98K) puede resultar en la produccion de ácido clorhídrico HCl(g) que no solo es tóxico en sí mismo sino que reacciona con oxigeno formando Cl y vapor de H O mediante la siguiente reacción: 4HCl(g) + O (g) Cl (g) + H O(l) Determine el E 0, H 0 y G 0 a partir de los siguientes datos: H 0 f(98k), HCl = -185 kj/mol; H 0 f(98k), HO = 85.8 kj/mol; S 0 (98K),O= 05.1 J/( mol.k); S 0 (98K),Cl=.9 J/( mol.k); S 0 (98K),ClH= 8640 J/( mol.k); S 0 (98K),HO(l)= J/( mol.k) Problema 1 1 mol de gas ideal se expande adiabática e isotérmicamente a 300K desde un volumen de 50 lt a un volumen de 150 lt. Determine S para el sistema, el medio circundante y total. Indique la espontaneidad o no del proceso. Problema 13 Un sistema está formado por m = 100,0 g de hielo a p o = 1,00 atm y = 0,00º C. Dicho sistema se pone en contacto con un medio ambiente a p o = 1,00 atm y o = 0,0º C. Sabiendo que el H fus,ho = 80,0 cal/g y el calor específico del agua es c = 1,00 cal/gk, determinar los incrementos de entropía que experimentan el sistema y el universo entre el estado inicial descrito y el final de equilibrio mutuo.
5 Problema 14 Dos moles de metano inicialmente a 5 C y 1 atm son calentados a presión constante desde 5 C a 1000 C. Calcule el H, E y S, si en ese rango de, la capacidad calorífica molar del metano es C P JK mol 34 48, 110,. Problema 15 Considere que una cadena polipeptídica tiene una única conformación de α-hélice, mientras que en el estado desnaturalizado cada aminoácido puede adoptar 3 orientaciones diferentes. a) Calcule el S para el proceso helice random - coil asumiendo que el polipéptido tiene 100 residuos. b) Qué valor de H por residuo sería requerido para que el punto de transición entre las dos especies sea de 50 C? Compare este valor con la energía de un puente de hidrógeno estimada en 0-1kJ/mol. Problema 16 Una molécula de proteína, en su estado nativo plegado, tiene una conformación favorecida. Sin embargo, cuando se desnaturaliza, se convierte en un ovillo aleatorio con muchas conformaciones posibles a) Cómo espera que sea el signo de S para el proceso de desnaturalización? Ayuda: mire lo que calculó en el problema anterior. b) Cuál debe ser el signo de H para el proceso de desnaturalización considerando que las proteínas existen en estructuras plegadas estables? Problema 17 Cuando una sustancia hidrófoba como un hidrocarburo se disuelve en agua se forma una jaula de moléculas de agua ordenadas a su alrededor. Estas estructuras se conocen como clartratos. Qué signo espera que tenga S para este proceso? Dado que el interior de las proteínas es mayormente hidrofóbico, estructuras de tipo clartrato se forman en el agua durante los procesos de desnatuzalización. Discuta cómo afecta este hecho la estabilidad de las proteínas.
Limitaciones de la 1ra. ley de la termodinámica
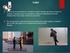
 Termodinámica Tema 9 (segunda parte) Química General e Inorgánica A Limitaciones de la 1ra. ley de la termodinámica Procesos espontáneos o irreversibles Una cascada corre cuesta abajo Un terrón de azúcar
Termodinámica Tema 9 (segunda parte) Química General e Inorgánica A Limitaciones de la 1ra. ley de la termodinámica Procesos espontáneos o irreversibles Una cascada corre cuesta abajo Un terrón de azúcar
CRITERIOS DE ESPONTANEIDAD
 CRITERIOS DE ESPONTANEIDAD Con ayuda de la Primera Ley de la Termodinámica podemos considerar el equilibrio de la energía y con La Segunda Ley podemos decidir que procesos pueden ocurrir de manera espontanea,
CRITERIOS DE ESPONTANEIDAD Con ayuda de la Primera Ley de la Termodinámica podemos considerar el equilibrio de la energía y con La Segunda Ley podemos decidir que procesos pueden ocurrir de manera espontanea,
En el transcurso de una reacción química se rompen enlaces de los reactivos y se forman nuevos enlaces que dan lugar a los productos.
 Termoquímica En el transcurso de una reacción química se rompen enlaces de los reactivos y se forman nuevos enlaces que dan lugar a los productos. Para romper enlaces se consume energía y al formar otros
Termoquímica En el transcurso de una reacción química se rompen enlaces de los reactivos y se forman nuevos enlaces que dan lugar a los productos. Para romper enlaces se consume energía y al formar otros
TERMODINÁMICA - PREGUNTAS DE TEST
 TERMODINÁMICA - PREGUNTAS DE TEST Grupo A: DEFINICIONES DE VARIABLES. CONCEPTOS GENERALES Grupo B: MAQUINAS TÉRMICAS: Grupo C: PRIMER PRINCIPIO: Grupo D: SEGUNDO PRINCIPIO: Grupo E: ESPONTANEIDAD DE LAS
TERMODINÁMICA - PREGUNTAS DE TEST Grupo A: DEFINICIONES DE VARIABLES. CONCEPTOS GENERALES Grupo B: MAQUINAS TÉRMICAS: Grupo C: PRIMER PRINCIPIO: Grupo D: SEGUNDO PRINCIPIO: Grupo E: ESPONTANEIDAD DE LAS
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
Capítulo 4: Termoquímica
 Capítulo 4: Termoquímica ACTIVIDADES DE RECAPITULACIÓN 1*. Razona si las siguientes afirmaciones son ciertas o falsas, referidas a la energía interna de un sistema: a) Su variación en el transcurso de
Capítulo 4: Termoquímica ACTIVIDADES DE RECAPITULACIÓN 1*. Razona si las siguientes afirmaciones son ciertas o falsas, referidas a la energía interna de un sistema: a) Su variación en el transcurso de
HOJA DE PROBLEMAS 1: ENUNCIADOS
 Tema: TERMODINÁMICA HOJA DE PROBLEMAS 1: ENUNCIADOS 1. ( ) Discuta la veracidad o falsedad de las siguientes afirmaciones: a) Cuando un sistema termodinámico abierto experimenta un ciclo termodinámico
Tema: TERMODINÁMICA HOJA DE PROBLEMAS 1: ENUNCIADOS 1. ( ) Discuta la veracidad o falsedad de las siguientes afirmaciones: a) Cuando un sistema termodinámico abierto experimenta un ciclo termodinámico
TERMOQUÍMICA. + q W SISTEMA. - q W + = = = =
 TERMOQUÍMICA 1. Primer Principio de la Termodinámica "La energía de un sistema más la de sus alrededores se conserva". Es decir, la variación de la energía interna de un sistema es igual a la suma del
TERMOQUÍMICA 1. Primer Principio de la Termodinámica "La energía de un sistema más la de sus alrededores se conserva". Es decir, la variación de la energía interna de un sistema es igual a la suma del
TEMA 13: Termodinámica
 QUÍMICA I TEMA 13: Termodinámica Tecnólogo Minero Temario ü Procesos espontáneos ü Entropía ü Segunda Ley de la Termodinámica ü Energía libre de Gibbs ü Energía libre y equilibrio químico Procesos espontáneos
QUÍMICA I TEMA 13: Termodinámica Tecnólogo Minero Temario ü Procesos espontáneos ü Entropía ü Segunda Ley de la Termodinámica ü Energía libre de Gibbs ü Energía libre y equilibrio químico Procesos espontáneos
FISICOQUÍMICA MÓDULO I: TERMODINÁMICA SEMINARIO 1
 FISICOQUÍMICA - 008 MÓDULO I: TERMODINÁMICA SEMINARIO 1 Conceptos Importantes Sistema, alrededores y paredes. Relación entre el tipo de paredes y los procesos que puede sufrir un sistema. Estados de equilibrio
FISICOQUÍMICA - 008 MÓDULO I: TERMODINÁMICA SEMINARIO 1 Conceptos Importantes Sistema, alrededores y paredes. Relación entre el tipo de paredes y los procesos que puede sufrir un sistema. Estados de equilibrio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio 6, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio 6, Opción B Reserva 3, Ejercicio
1. Primer principio de la termodinámica.
 1. Primer principio de la termodinámica. Conceptos previos La termodinámica es la parte de la Física que se encarga de estudiar los cambios en los sistemas físicos en los que interviene el calor. En primer
1. Primer principio de la termodinámica. Conceptos previos La termodinámica es la parte de la Física que se encarga de estudiar los cambios en los sistemas físicos en los que interviene el calor. En primer
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 14 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 14 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 3, Opción A Reserva 3,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 3, Opción A Reserva 3,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 8 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 5, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 8 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 5, Opción B Reserva 3, Ejercicio
SERIE 8: Segunda Ley de la Termodinámica
 SERIE 8: Segunda Ley de la Termodinámica I. Ciclos y máquinas térmicas 1. Un mol de gas ideal (C v = 3 / 2 R) realiza el siguiente ciclo: AB) Se expande contra una presión exterior constante, en contacto
SERIE 8: Segunda Ley de la Termodinámica I. Ciclos y máquinas térmicas 1. Un mol de gas ideal (C v = 3 / 2 R) realiza el siguiente ciclo: AB) Se expande contra una presión exterior constante, en contacto
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 3, Opción A Reserva 3,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 3, Opción A Reserva 3,
Física 2 (Biólogos y Geólogos) SERIE 8
 Física 2 (Biólogos y Geólogos) SERIE 8 i) Máquinas térmicas 1. Un mol de gas ideal (C v = 3 / 2 R) realiza el siguiente ciclo: AB) Se expande contra una presión exterior constante, en contacto térmico
Física 2 (Biólogos y Geólogos) SERIE 8 i) Máquinas térmicas 1. Un mol de gas ideal (C v = 3 / 2 R) realiza el siguiente ciclo: AB) Se expande contra una presión exterior constante, en contacto térmico
EQUILIBRIO QUÍMICO. 1. Equilibrio químico. 2. La constante de equilibrio. 3. EL principio de LeChatelier. Química 2º bachillerato Equilibrio químico 1
 EQUILIBRIO QUÍMICO 1. Equilibrio químico. 2. La constante de equilibrio. 3. EL principio de LeChatelier. Química 2º bachillerato Equilibrio químico 1 0. CONOCIMIENTOS Los conocimientos previos que son
EQUILIBRIO QUÍMICO 1. Equilibrio químico. 2. La constante de equilibrio. 3. EL principio de LeChatelier. Química 2º bachillerato Equilibrio químico 1 0. CONOCIMIENTOS Los conocimientos previos que son
FyQ Rev 01. IES de Castuera. 1 Introducción. 2 Clasificación de los Sistemas Materiales. 3 Las Variables Termodinámicas
 Física y Química 1º Bachillerato LOMCE IES de Castuera Tema 6 Termoquímica FyQ 1 2015 2016 Rev 01 1 Introducción 2 Clasificación de los Sistemas Materiales 3 Las Variables Termodinámicas 4 Primer Principio
Física y Química 1º Bachillerato LOMCE IES de Castuera Tema 6 Termoquímica FyQ 1 2015 2016 Rev 01 1 Introducción 2 Clasificación de los Sistemas Materiales 3 Las Variables Termodinámicas 4 Primer Principio
Máquinas térmicas y Entropía
 Física 2 (Biólogos y Geólogos) SERIE 10 Máquinas térmicas y Entropía 1. Un mol de gas ideal (C v = 3 / 2 R) realiza el siguiente ciclo: AB) Se expande contra una presión exterior constante, en contacto
Física 2 (Biólogos y Geólogos) SERIE 10 Máquinas térmicas y Entropía 1. Un mol de gas ideal (C v = 3 / 2 R) realiza el siguiente ciclo: AB) Se expande contra una presión exterior constante, en contacto
Entropía, Energía Libre, y Equilibrio
 Entropía, Energía Libre, y Equilibrio Capítulo 18 Procesos ísicos y químicos espontáneos Una cascada corre hacia abajo Un cubo de azúcar se disuelve en una taza de cae A 1 atm, el agua se congela por debajo
Entropía, Energía Libre, y Equilibrio Capítulo 18 Procesos ísicos y químicos espontáneos Una cascada corre hacia abajo Un cubo de azúcar se disuelve en una taza de cae A 1 atm, el agua se congela por debajo
GUIA DE EJERCICIOS II. (Primera Ley Segunda Ley - Ciclo de Carnot)
 UNIVERSIDAD PEDRO DE VALDIVIA TERMODINAMICA. GUIA DE EJERCICIOS II. (Primera Ley Segunda Ley - Ciclo de Carnot) 1. Deducir qué forma adopta la primera ley de la termodinámica aplicada a un gas ideal para
UNIVERSIDAD PEDRO DE VALDIVIA TERMODINAMICA. GUIA DE EJERCICIOS II. (Primera Ley Segunda Ley - Ciclo de Carnot) 1. Deducir qué forma adopta la primera ley de la termodinámica aplicada a un gas ideal para
QUÍMICA 2º DE BACHILLERATO EQUILIBRIO QUÍMICO
 EQUILIBRIO QUÍMICO 1. En un recipiente de 4 litros, a una cierta temperatura, se introducen las cantidades de HCl, O 2 y Cl 2 indicadas en la tabla, estableciéndose el siguiente equilibrio: calcule: a)
EQUILIBRIO QUÍMICO 1. En un recipiente de 4 litros, a una cierta temperatura, se introducen las cantidades de HCl, O 2 y Cl 2 indicadas en la tabla, estableciéndose el siguiente equilibrio: calcule: a)
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 1 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 4, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 1 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 4, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio
UNIVERSIDAD SIMÓN BOLÍVAR INGENIERÍA GEOFÍSICA PRINCIPIOS FISICOQUÍMICOS I GC-2112 TRIMESTRE: ENERO - MARZO PROBLEMARIO
 UNIERSIDAD SIMÓN BOLÍAR INGENIERÍA GEOFÍSICA RINCIIOS FISICOQUÍMICOS I GC- RIMESRE: ENERO - MARZO ROBLEMARIO. Se introduce una muestra de XeF4 en un frasco de 6 ml a 749 mmhg y C. Calcule el peso molecular
UNIERSIDAD SIMÓN BOLÍAR INGENIERÍA GEOFÍSICA RINCIIOS FISICOQUÍMICOS I GC- RIMESRE: ENERO - MARZO ROBLEMARIO. Se introduce una muestra de XeF4 en un frasco de 6 ml a 749 mmhg y C. Calcule el peso molecular
(Cs. de la atmósfera y los océanos) Primer cuatrimestre de 2015 Guía 2: Segundo principio de la termodinámica. Entropía.
 Física 3 (Cs. de la atmósfera y los océanos) Primer cuatrimestre de 2015 Guía 2: Segundo principio de la termodinámica. Entropía. 1. Demostrar que: (a) Los postulados del segundo principio de Clausius
Física 3 (Cs. de la atmósfera y los océanos) Primer cuatrimestre de 2015 Guía 2: Segundo principio de la termodinámica. Entropía. 1. Demostrar que: (a) Los postulados del segundo principio de Clausius
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2001 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 1 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 1 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
TEMA 4.- Termoquímica
 Cuestiones y problemas resueltos de Química 2º Bachillerato Curso 213-214 TEMA 4.- Termoquímica CUESTIONES 31.- a) Enuncie el primer principio de la Termodinámica. b) Razone si cuando un sistema gaseoso
Cuestiones y problemas resueltos de Química 2º Bachillerato Curso 213-214 TEMA 4.- Termoquímica CUESTIONES 31.- a) Enuncie el primer principio de la Termodinámica. b) Razone si cuando un sistema gaseoso
Un área importante en el estudio de las ciencias es la Termodinámica y un aspecto de este estudio, relacionado con los cambios químicos, es la
 Termoquímica. Todos los cambios que experimenta la materia, sean físicos o químicos, deben satisfacer principios fundamentales: conservación de la masa conservación de la energía Un área importante en
Termoquímica. Todos los cambios que experimenta la materia, sean físicos o químicos, deben satisfacer principios fundamentales: conservación de la masa conservación de la energía Un área importante en
Cuestiones de Termodinámica
 Cuestiones de Termodinámica 1. Llamamos alrededores a a. La parte del universo que está cerca del nuestro objeto de estudio. b. La parte del universo que no es nuestro objeto de estudio. c. La parte del
Cuestiones de Termodinámica 1. Llamamos alrededores a a. La parte del universo que está cerca del nuestro objeto de estudio. b. La parte del universo que no es nuestro objeto de estudio. c. La parte del
FÍSICA Usando la convención gráfica según la cual una máquina simple que entrega trabajo positivo se representa como en la figura:
 FÍSICA 4 PRIMER CUARIMESRE DE 05 GUÍA : SEGUNDO PRINCIPIO, MÁUINAS ÉRMICAS. Demostrar que: (a) Los postulados del segundo principio de Clausius y de Kelvin son equivalentes (b) Ninguna máquina cíclica
FÍSICA 4 PRIMER CUARIMESRE DE 05 GUÍA : SEGUNDO PRINCIPIO, MÁUINAS ÉRMICAS. Demostrar que: (a) Los postulados del segundo principio de Clausius y de Kelvin son equivalentes (b) Ninguna máquina cíclica
PROBLEMAS Propiedades termodinámicas de los fluidos. La energía interna es 32 J bar
 242 6. Propiedades termodinámicas de los fluidos La energía interna es 34 10 bar 32 J Estos resultados concuerdan mucho más con los valores experimentales que los del supuesto caso del vapor de l-buteno
242 6. Propiedades termodinámicas de los fluidos La energía interna es 34 10 bar 32 J Estos resultados concuerdan mucho más con los valores experimentales que los del supuesto caso del vapor de l-buteno
Problemas de Química General Curso de C. Químicas Grupo 911 Hoja 5
 Problemas de Química General Curso 2014-2015 1 de C. Químicas Grupo 911 Hoja 5 1. A partir de los datos sobre las reacciones que se dan seguidamente, determinar la entalpía de reacción estándar para el
Problemas de Química General Curso 2014-2015 1 de C. Químicas Grupo 911 Hoja 5 1. A partir de los datos sobre las reacciones que se dan seguidamente, determinar la entalpía de reacción estándar para el
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 6 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 3, Opción B Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 6 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 3, Opción B Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
3. TERMODINÁMICA. PROBLEMAS I: PRIMER PRINCIPIO
 TERMOINÁMI PROLEMS I: PRIMER PRINIPIO Problema 1 Un gas ideal experimenta un proceso cíclico ---- como indica la figura El gas inicialmente tiene un volumen de 1L y una presión de 2 atm y se expansiona
TERMOINÁMI PROLEMS I: PRIMER PRINIPIO Problema 1 Un gas ideal experimenta un proceso cíclico ---- como indica la figura El gas inicialmente tiene un volumen de 1L y una presión de 2 atm y se expansiona
Principios de calorimetría
 Principios de calorimetría Principios Si entran en contacto dos cuerpos o sustancias a distinta temperatura, y no hay intercambio de calor con los alrededores, el cuerpo con mayor temperatura cederá energía
Principios de calorimetría Principios Si entran en contacto dos cuerpos o sustancias a distinta temperatura, y no hay intercambio de calor con los alrededores, el cuerpo con mayor temperatura cederá energía
Tema 10. Tema 10: Termodinámica química Definiciones básicas de la Termodinámica. Sistemas MATERIA. El calor es energía desordenada
 ema 1: ermodinámica química 1.1 Definiciones básicas de la ermodinámica 1.2 Primer Principio de la ermodinámica 1.2.1 Energía interna 1.2.2 Procesos a presión constante: Entalpía 1.2.3 ermoquímica y es
ema 1: ermodinámica química 1.1 Definiciones básicas de la ermodinámica 1.2 Primer Principio de la ermodinámica 1.2.1 Energía interna 1.2.2 Procesos a presión constante: Entalpía 1.2.3 ermoquímica y es
RESOLUCIÓN DE CUESTIONES
 1 RESOLUCIÓN DE CUESTIONES Cuestión 1 Indique, razonadamente, si cada una de las siguientes proposiciones, relativas a la variación de energía libre de Gibbs, ΔG, es verdadera o falsa: a) Puede ser positiva
1 RESOLUCIÓN DE CUESTIONES Cuestión 1 Indique, razonadamente, si cada una de las siguientes proposiciones, relativas a la variación de energía libre de Gibbs, ΔG, es verdadera o falsa: a) Puede ser positiva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 5 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 5 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio
TERMOQUÍMICA. Transformaciones energéticas en las reacciones químicas. Espontaneidad de las reacciones químicas
 TERMOQUÍMICA Transformaciones energéticas en las reacciones químicas. Espontaneidad de las reacciones químicas Contenidos Programación didáctica: contenidos y criterios de evaluación 1.- Sistemas, estados
TERMOQUÍMICA Transformaciones energéticas en las reacciones químicas. Espontaneidad de las reacciones químicas Contenidos Programación didáctica: contenidos y criterios de evaluación 1.- Sistemas, estados
TERMOQUÍMICA. Transformaciones energéticas en las reacciones químicas. Espontaneidad de las reacciones químicas
 TERMOQUÍMICA Transformaciones energéticas en las reacciones químicas. Espontaneidad de las reacciones químicas Contenidos Programación didáctica: contenidos y criterios de evaluación 1.- Sistemas, estados
TERMOQUÍMICA Transformaciones energéticas en las reacciones químicas. Espontaneidad de las reacciones químicas Contenidos Programación didáctica: contenidos y criterios de evaluación 1.- Sistemas, estados
Unidad 1. 2º Bachillerato Química Colegio Hispano Inglés S.A. TERMOQUÍMICA
 CONTENIDOS TERMOQUÍMICA 1.- Sistemas, estados y funciones de estado. 2.- Primer principio de la Termodinámica. 3.- Energía interna y entalpía. Reacciones a volumen y a presión constante. 3.1. Relación
CONTENIDOS TERMOQUÍMICA 1.- Sistemas, estados y funciones de estado. 2.- Primer principio de la Termodinámica. 3.- Energía interna y entalpía. Reacciones a volumen y a presión constante. 3.1. Relación
FÍSICA 4. P = RT V a V 2. U(T,V) = U 0 +C V T a V? α α T = C 1 = C 2. v = 1.003cm 3 /g. α = 1 v
 FÍSICA 4 SEGUNDO CUARIMESRE DE 2009 GUÍA 3: OENCIALES ERMODINÁMICOS, CAMBIOS DE FASE 1. Sean x,, z cantidades que satisfacen una relación funcional f(x,, z) = 0. Sea w una función de cualquier par de variables
FÍSICA 4 SEGUNDO CUARIMESRE DE 2009 GUÍA 3: OENCIALES ERMODINÁMICOS, CAMBIOS DE FASE 1. Sean x,, z cantidades que satisfacen una relación funcional f(x,, z) = 0. Sea w una función de cualquier par de variables
ΔS > 0 aumento del desorden. ΔS < 0 disminución del desorden.
 PRIMER PRINCIPIO La Energía del universo (sistema + entorno) se conserva. A + B C La energía del universo se conservará asimismo para: C A + B Los cambios pueden ocurrir en ambos sentidos? Qué determina
PRIMER PRINCIPIO La Energía del universo (sistema + entorno) se conserva. A + B C La energía del universo se conservará asimismo para: C A + B Los cambios pueden ocurrir en ambos sentidos? Qué determina
Problemas Química Propuestos en las P.A.U. Termoquímica
 A) Relaciones Termoquimicas ( H, U) 1.- Calcula la variación de energía interna ( Uº) para la reacción de combustión del benceno líquido, C 6 H 6 (l), si el proceso se realiza a presión de 1 atm y 25ºC.
A) Relaciones Termoquimicas ( H, U) 1.- Calcula la variación de energía interna ( Uº) para la reacción de combustión del benceno líquido, C 6 H 6 (l), si el proceso se realiza a presión de 1 atm y 25ºC.
al volume n molar V cuando se expande según un proceso isotérmico reversible, desde el volumen molar, V
 9.- Un sistema cerrado inicialmente en reposo sobre la tierra es sometido a un proceso en el que recibe una transferencia neta de energía por trabajo igual a 00KJ. durante este proceso hay una transferencia
9.- Un sistema cerrado inicialmente en reposo sobre la tierra es sometido a un proceso en el que recibe una transferencia neta de energía por trabajo igual a 00KJ. durante este proceso hay una transferencia
Tema 3. Termodinámica Química
 Tema 3. Termodinámica Química Indice 1. Definiciones 2. Primer principio de la termodinámica 3. Entalpía y Calor de reacción 4. Espontaneidad 5. Segundo y Tercer Principios de la Termodinámica 6. Energía
Tema 3. Termodinámica Química Indice 1. Definiciones 2. Primer principio de la termodinámica 3. Entalpía y Calor de reacción 4. Espontaneidad 5. Segundo y Tercer Principios de la Termodinámica 6. Energía
Tema 1. Termodinámica
 Tema 1. Termodinámica 1.1 Energía, calor y trabajo 1.2 Principios de la Termodinámica 1.3 Entalpía, entropía y energía libre. Estados estándar 1.4 Cálculo del calor de reacción 1.5 Ley de Hess 1.6 Balance
Tema 1. Termodinámica 1.1 Energía, calor y trabajo 1.2 Principios de la Termodinámica 1.3 Entalpía, entropía y energía libre. Estados estándar 1.4 Cálculo del calor de reacción 1.5 Ley de Hess 1.6 Balance
TERMOQUÍMICA. Química General e Inorgánica Licenciatura en Ciencias Biológicas Profesorado en Biología Analista Biológico
 Química General e Inorgánica Licenciatura en Ciencias Biológicas Profesorado en Biología Analista Biológico TERMOQUÍMICA La termoquímica es la aplicación de la Primera Ley de la Termodinámica al estudio
Química General e Inorgánica Licenciatura en Ciencias Biológicas Profesorado en Biología Analista Biológico TERMOQUÍMICA La termoquímica es la aplicación de la Primera Ley de la Termodinámica al estudio
La segunda ley de La termodinámica se puede establecer de tres formas diferentes.
 La segunda ley de La termodinámica se puede establecer de tres formas diferentes. 1.- La energía calorífica fluye espontáneamente desde un objeto mas caliente a uno más frio, pero no en sentido inverso.
La segunda ley de La termodinámica se puede establecer de tres formas diferentes. 1.- La energía calorífica fluye espontáneamente desde un objeto mas caliente a uno más frio, pero no en sentido inverso.
TERMOQUÍMICA PAU ASTURIAS
 TERMOQUÍMICA PAU ASTURIAS 1. (PAU 08) La observación experimental de H con respecto al producto T S, para una reacción simple, A B, permite la representación gráfica de la figura: Observando, la misma,
TERMOQUÍMICA PAU ASTURIAS 1. (PAU 08) La observación experimental de H con respecto al producto T S, para una reacción simple, A B, permite la representación gráfica de la figura: Observando, la misma,
SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD
 6 TERMOQUÍMICA SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD Enería, trabajo y calor 1. Calcula el trabajo que desarrolla el as encerrado en un cilindro cuando sufre una expansión de 50 cm 3 sometido
6 TERMOQUÍMICA SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD Enería, trabajo y calor 1. Calcula el trabajo que desarrolla el as encerrado en un cilindro cuando sufre una expansión de 50 cm 3 sometido
TEMA 7 TERMOQUÍMICA. MICA. LA COMBUSTIÓN
 TEMA 7 TERMOQUÍMICA. MICA. LA COMBUSTIÓN 1 Contenidos: 1. Sistemas y transformaciones termodinámicas. 2. Primer principio de la termodinámica. Energía interna 3. Ecuación calorimétrica. 4. Transformaciones
TEMA 7 TERMOQUÍMICA. MICA. LA COMBUSTIÓN 1 Contenidos: 1. Sistemas y transformaciones termodinámicas. 2. Primer principio de la termodinámica. Energía interna 3. Ecuación calorimétrica. 4. Transformaciones
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
CINÉTICA QUÍMICA. Dr. Hugo Cerecetto. Prof. Titular de Química
 CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
Calor: energía transferida debida únicamente a diferencias de temperatura
 TERMODINÁMICA La termodinámica estudia la energía y sus transformaciones. Energía: capacidad para realizar trabajo. Formas de energía Energía radiante Energía térmica Energía química Energía potencial
TERMODINÁMICA La termodinámica estudia la energía y sus transformaciones. Energía: capacidad para realizar trabajo. Formas de energía Energía radiante Energía térmica Energía química Energía potencial
Hoja Junio-13 PAU Alicante Química 2º BAT FerMates
 Hoja Junio-13 PAU Alicante Química 2º BAT FerMates Soluciones (versión β) http://www.fermates.com/seccion-10/quimica.htm Op A c1.- Considere los elementos X e Y cuyos números atómicos son 8 y 17, respectivamente,
Hoja Junio-13 PAU Alicante Química 2º BAT FerMates Soluciones (versión β) http://www.fermates.com/seccion-10/quimica.htm Op A c1.- Considere los elementos X e Y cuyos números atómicos son 8 y 17, respectivamente,
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2006 PRIMERA PARTE
 PAU Química. Junio 2006 PRIMERA PARTE Cuestión. Sabiendo que el boro es el primer elemento del grupo trece del Sistema Periódico, conteste razonadamente si las siguientes afirmaciones son verdaderas o
PAU Química. Junio 2006 PRIMERA PARTE Cuestión. Sabiendo que el boro es el primer elemento del grupo trece del Sistema Periódico, conteste razonadamente si las siguientes afirmaciones son verdaderas o
QUÍMICA de 2º de BACHILLERATO TERMOQUÍMICA
 QUÍMICA de 2º de BACHILLERATO TERMOQUÍMICA PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 21) VOLUMEN I DOMINGO
QUÍMICA de 2º de BACHILLERATO TERMOQUÍMICA PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 21) VOLUMEN I DOMINGO
EXÁMENES DE OTROS CURSOS
 EXÁMENES DE OTROS CURSOS 1.- Responda razonadamente a las siguientes cuestiones: a) Cuál sería el signo de Q, W, E, S e G para la vaporización del agua a su temperatura normal de vaporización (100ºC)?.
EXÁMENES DE OTROS CURSOS 1.- Responda razonadamente a las siguientes cuestiones: a) Cuál sería el signo de Q, W, E, S e G para la vaporización del agua a su temperatura normal de vaporización (100ºC)?.
GUIA DE EJERCICIOS (Equilibrio Químico y Cinética Química Empírica)
 Universidad de Santiago de Chile Departamento de Ingeniería Química GUIA DE EJERCICIOS (Equilibrio Químico y Cinética Química Empírica) Autor: Prof. Julio Romero 1. Describa aplicando el principio de Le
Universidad de Santiago de Chile Departamento de Ingeniería Química GUIA DE EJERCICIOS (Equilibrio Químico y Cinética Química Empírica) Autor: Prof. Julio Romero 1. Describa aplicando el principio de Le
QUÍMICA de 2º de BACHILLERATO EL EQUILIBRIO QUÍMICO
 QUÍMICA de 2º de BACHILLERATO EL EQUILIBRIO QUÍMICO PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010)
QUÍMICA de 2º de BACHILLERATO EL EQUILIBRIO QUÍMICO PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010)
MATERIAL DE APOYO DE USO ESCLUSIVO DEL CENTRO DE ESTUDIOS MATEMÁTICOS. C.E.M.
 1-. Una cubeta con hielo recibe constantemente calor de un B. mechero como se aprecia en la figura. C. D. De la gráfica de temperatura como función del tiempo, para la muestra, se concluye que entre A.
1-. Una cubeta con hielo recibe constantemente calor de un B. mechero como se aprecia en la figura. C. D. De la gráfica de temperatura como función del tiempo, para la muestra, se concluye que entre A.
EJERCICIOS DE SELECTIVIDAD: CINÉTICA Y EQUILIBRIO QUÍMICOS
 EJERCICIOS DE SELECTIVIDAD: CINÉTICA Y EQUILIBRIO QUÍMICOS 1.- a) Dibuje el diagrama entálpico de la reacción: CH 2 = CH 2 + H 2 CH 3 CH 3 sabiendo que la reacción directa es exotérmica y muy lenta, a
EJERCICIOS DE SELECTIVIDAD: CINÉTICA Y EQUILIBRIO QUÍMICOS 1.- a) Dibuje el diagrama entálpico de la reacción: CH 2 = CH 2 + H 2 CH 3 CH 3 sabiendo que la reacción directa es exotérmica y muy lenta, a
Tema Introducción n a la la Termodinámica mica Química
 Tema 5. 5. Introducción n a la la Termodinámica mica Química 1. 1. Algunos términos termodinámicos. 2. 2. Energía interna. 1ª 1ª Ley de de la la termodinámica. 3. 3. Relación entre energía interna, calor
Tema 5. 5. Introducción n a la la Termodinámica mica Química 1. 1. Algunos términos termodinámicos. 2. 2. Energía interna. 1ª 1ª Ley de de la la termodinámica. 3. 3. Relación entre energía interna, calor
Guía de Trabajo Procesos Termodinámicos. Nombre: No. Cuenta:
 Guía de Trabajo Procesos Termodinámicos Nombre: No. Cuenta: Resolver cada uno de los ejercicios de manera clara y ordenada en hojas blancas para entregar. 1._a) Determine el trabajo realizado por un fluido
Guía de Trabajo Procesos Termodinámicos Nombre: No. Cuenta: Resolver cada uno de los ejercicios de manera clara y ordenada en hojas blancas para entregar. 1._a) Determine el trabajo realizado por un fluido
FUNDAMENTOS DE TERMODINÁMICA PROBLEMAS
 FUNDAMENOS DE ERMODINÁMICA ROBLEMAS 1.- Clasifique cada propiedad como extensiva o intensiva: a) temperatura, b) masa, c) densidad, d) intensidad del campo eléctrico, e) coeficiente de dilatación térmica,
FUNDAMENOS DE ERMODINÁMICA ROBLEMAS 1.- Clasifique cada propiedad como extensiva o intensiva: a) temperatura, b) masa, c) densidad, d) intensidad del campo eléctrico, e) coeficiente de dilatación térmica,
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio Fase general OPCIÓN A
 1 PAU Química. Junio 2010. Fase general OPCIÓN A Cuestión 1A. El elemento de número atómico 12 se combina fácilmente con el elemento de número atómico 17. Indique: a) La configuración electrónica de los
1 PAU Química. Junio 2010. Fase general OPCIÓN A Cuestión 1A. El elemento de número atómico 12 se combina fácilmente con el elemento de número atómico 17. Indique: a) La configuración electrónica de los
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2009 PRIMERA PARTE
 1 PAU Química. Septiembre 2009 PRIMERA PARTE Cuestión 1. Considere los elementos A (Z = 12) y B (Z = 17). Conteste razonadamente: a) Cuáles son las configuraciones electrónicas de A y de B? Cuál es el
1 PAU Química. Septiembre 2009 PRIMERA PARTE Cuestión 1. Considere los elementos A (Z = 12) y B (Z = 17). Conteste razonadamente: a) Cuáles son las configuraciones electrónicas de A y de B? Cuál es el
TEMA 6. TERMOQUÍMICA
 @quimicapau: Quien fuera energía Para estar en Julio!! TEMA 6. TERMOQUÍMICA Cuáles son los conceptos y ejercicios clave a repasar? CONCEPTO A REPASAR EJERCICIO Relación entre calores de reacción a presión
@quimicapau: Quien fuera energía Para estar en Julio!! TEMA 6. TERMOQUÍMICA Cuáles son los conceptos y ejercicios clave a repasar? CONCEPTO A REPASAR EJERCICIO Relación entre calores de reacción a presión
Exámenes Selectividad Comunidad Valenciana de la especialidad de Química: EJERCICIOS SOBRE TERMOQUÍMICA
 Exámenes Selectividad Comunidad Valenciana de la especialidad de Química: EJERCICIOS SOBRE TERMOQUÍMICA Septiembre 2012; Opción B; Problema 2.- La combustión de mezclas de hidrógeno-oxígeno se utiliza
Exámenes Selectividad Comunidad Valenciana de la especialidad de Química: EJERCICIOS SOBRE TERMOQUÍMICA Septiembre 2012; Opción B; Problema 2.- La combustión de mezclas de hidrógeno-oxígeno se utiliza
Conceptos Previos. ΔP (camino 1)= ΔP (camino 2) = P 1 -P 2 ΔT (camino 1)= ΔT (camino 2) =T 1 -T 2
 TEMA 4 TERMOQUÍMICA Conceptos previos TERMOQUÍMICA: Parte de la Química que se ocupa del intercambio de energía que tiene lugar en el transcurso de una reacción química SISTEMA TERMODINÁMICO: Parte del
TEMA 4 TERMOQUÍMICA Conceptos previos TERMOQUÍMICA: Parte de la Química que se ocupa del intercambio de energía que tiene lugar en el transcurso de una reacción química SISTEMA TERMODINÁMICO: Parte del
TEMA 5: EL EQUILIBRIO EN LAS REACCIONES QUÍMICAS.
 TEMA 5: EL EQUILIBRIO EN LAS REACCIONES QUÍMICAS. 5.1.- Se introduce en un matraz de 2 litros una mezcla de 2 moles de Cl 2 y 2 moles de Br 2. A cierta temperatura se produce la reacción Br 2 (g) + Cl
TEMA 5: EL EQUILIBRIO EN LAS REACCIONES QUÍMICAS. 5.1.- Se introduce en un matraz de 2 litros una mezcla de 2 moles de Cl 2 y 2 moles de Br 2. A cierta temperatura se produce la reacción Br 2 (g) + Cl
ESPOL / ICQA / II TERMINO 2011/ 3era EVALUACIÓN QUÍMICA GENERAL I / NOMBRES APELLIDOS No. en LISTA PARALELO
 ESPOL / ICQA / II TERMINO 2011/ 3era EVALUACIÓN QUÍMICA GENERAL I / 2012.02.15 NOMBRES APELLIDOS No. en LISTA PARALELO NOTA: PARA ESTA EVALUACIÓN EL SIGNO COMA (,) SE TOMARÁ PARA REPRESENTAR MILES, EJEMPLO:
ESPOL / ICQA / II TERMINO 2011/ 3era EVALUACIÓN QUÍMICA GENERAL I / 2012.02.15 NOMBRES APELLIDOS No. en LISTA PARALELO NOTA: PARA ESTA EVALUACIÓN EL SIGNO COMA (,) SE TOMARÁ PARA REPRESENTAR MILES, EJEMPLO:
Termoquímica. Química General II era Unidad
 Termoquímica Química General II 2011 1era Unidad Termodinámica Es el estudio científico de la conversión del calor a otras formas de energía Energía Es la capacidad de efectuar un trabajo. Algunas formas
Termoquímica Química General II 2011 1era Unidad Termodinámica Es el estudio científico de la conversión del calor a otras formas de energía Energía Es la capacidad de efectuar un trabajo. Algunas formas
los H y queda un par electrónico sin compartir. Molécula
 1 PAU Química. Septiembre 2007 PRIMERA PARTE Cuestión 1. Dadas las siguientes moléculas: P 3, 2 S, C 3 O, BeI 2 a) Escriba sus estructuras de Lewis. b) Razone si forman o no enlaces de hidrógeno. c) Deduzca
1 PAU Química. Septiembre 2007 PRIMERA PARTE Cuestión 1. Dadas las siguientes moléculas: P 3, 2 S, C 3 O, BeI 2 a) Escriba sus estructuras de Lewis. b) Razone si forman o no enlaces de hidrógeno. c) Deduzca
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 5 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 5 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio
Segunda ley de la termodinámica: la entropía Biofísica, FCEFyN, 2010 Dra. Dolores C. Carrer
 La segunda ley Segunda ley de la termodinámica: la entropía Biofísica, FCEFyN, 2010 Dra. Dolores C. Carrer dcarrer@gmail.com El cambio de entropía del universo en cualquier proceso será siempre igual *
La segunda ley Segunda ley de la termodinámica: la entropía Biofísica, FCEFyN, 2010 Dra. Dolores C. Carrer dcarrer@gmail.com El cambio de entropía del universo en cualquier proceso será siempre igual *
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2009 PRIMERA PARTE
 1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
QUÍMICA de 2º de BACHILLERATO EL EQUILIBRIO QUÍMICO
 QUÍMICA de 2º de BACHILLERATO EL EQUILIBRIO QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013)
QUÍMICA de 2º de BACHILLERATO EL EQUILIBRIO QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013)
1.- Conceptos básicos. Sistemas, variables y procesos. 2.- Energía, calor y trabajo. 1 er Principio de la Termodinámica. 3.- Entalpía. 4.
 1.- Conceptos básicos. Sistemas, variables y procesos. 2.- Energía, calor y trabajo. 1 er Principio de la Termodinámica. 3.- Entalpía. 4.- Calor de reacción. Ley de Hess. 5.- Entalpías estándar de formación.
1.- Conceptos básicos. Sistemas, variables y procesos. 2.- Energía, calor y trabajo. 1 er Principio de la Termodinámica. 3.- Entalpía. 4.- Calor de reacción. Ley de Hess. 5.- Entalpías estándar de formación.
QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO
 QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) DOMINGO
QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) DOMINGO
Ejercicios Equilibrio Químico
 Ejercicios Equilibrio Químico 1. En un recipiente de 10,0 L a 800K, se encierran 1,00 mol de CO(g) y 1,00 mol de H 2 O(g). Cuando se alcanza el equilibrio: CO(g) + H 2 O(g) CO 2 (g) + H 2 (g) se hallan
Ejercicios Equilibrio Químico 1. En un recipiente de 10,0 L a 800K, se encierran 1,00 mol de CO(g) y 1,00 mol de H 2 O(g). Cuando se alcanza el equilibrio: CO(g) + H 2 O(g) CO 2 (g) + H 2 (g) se hallan
Principios de Bioquímica Esquema general:
 Principios de Bioquímica Esquema general: Principios de la termodinámica Interacciones a nivel atómico Moléculas básicas: características Macroestructuras subcelulares Principios de la Termodinámica Definición
Principios de Bioquímica Esquema general: Principios de la termodinámica Interacciones a nivel atómico Moléculas básicas: características Macroestructuras subcelulares Principios de la Termodinámica Definición
TEMA 2: PRINCIPIOS DE TERMODINÁMICA. MÁQUINA TÉRMICA Y MÁQUINA FRIGORÍFICA
 TEMA 2: PRINCIPIOS DE TERMODINÁMICA. MÁQUINA TÉRMICA Y MÁQUINA FRIGORÍFICA La termodinámica es la parte de la física que se ocupa de las relaciones existentes entre el calor y el trabajo. El calor es una
TEMA 2: PRINCIPIOS DE TERMODINÁMICA. MÁQUINA TÉRMICA Y MÁQUINA FRIGORÍFICA La termodinámica es la parte de la física que se ocupa de las relaciones existentes entre el calor y el trabajo. El calor es una
(a) Un gas ideal. (b) Un fluido incompresible. (c) Un gas que obedece la ecuación virial truncada en el segundo término.
 PROBLEMA 1. Fórmulas para el calor específico Deduzca una expresión para el como función de y evalúela para: (a) Un gas ideal. (b) Un fluido incompresible. (c) Un gas que obedece la ecuación virial truncada
PROBLEMA 1. Fórmulas para el calor específico Deduzca una expresión para el como función de y evalúela para: (a) Un gas ideal. (b) Un fluido incompresible. (c) Un gas que obedece la ecuación virial truncada
Problemas Química Propuestos en las P.A.U. Equilibrio Químico
 Ley de Chatelier 1.- Indica, justificando brevemente la respuesta, si son ciertas o falsas las siguientes afirmaciones: a) Para la reacción N 2 (g) + 3 H 2 (g) 2 NH 3 (g) un aumento de la presión, manteniendo
Ley de Chatelier 1.- Indica, justificando brevemente la respuesta, si son ciertas o falsas las siguientes afirmaciones: a) Para la reacción N 2 (g) + 3 H 2 (g) 2 NH 3 (g) un aumento de la presión, manteniendo
TERMODINÁMICA 1. En la fermentación de la glucosa (C6H12O6) se obtiene etanol (C2H5OH) y CO2. Si la entalpía de combustión de la glucosa es de 15.
 TERMODINÁMICA 1. En la fermentación de la glucosa (C6H12O6) se obtiene etanol (C2H5OH) y CO2. Si la entalpía de combustión de la glucosa es de 15.63 kj/g y la del etanol es de 29.72 kj/g, a) Calcular la
TERMODINÁMICA 1. En la fermentación de la glucosa (C6H12O6) se obtiene etanol (C2H5OH) y CO2. Si la entalpía de combustión de la glucosa es de 15.63 kj/g y la del etanol es de 29.72 kj/g, a) Calcular la
Química 2º Bach. Recuperación 1ª Evaluación 13/01/05
 Química º Bach. Recuperación 1ª Evaluación 13/1/5 DEPARTAMENT DE FÍSIA E QUÍMIA Nombre: 1. alcula a partir de qué temperatura será espontánea la reacción de descomposición del tetraóxido de dinitrógeno
Química º Bach. Recuperación 1ª Evaluación 13/1/5 DEPARTAMENT DE FÍSIA E QUÍMIA Nombre: 1. alcula a partir de qué temperatura será espontánea la reacción de descomposición del tetraóxido de dinitrógeno
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2013 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELETIVIDAD ANDALUÍA 13 QUÍMIA TEMA 4: ENERGÍA DE LAS REAIONES QUÍMIAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción A Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELETIVIDAD ANDALUÍA 13 QUÍMIA TEMA 4: ENERGÍA DE LAS REAIONES QUÍMIAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción A Reserva 3, Ejercicio
Departamento de Química del Cinvestav
 Departamento de Química del Cinvestav Preguntas tipo examen de admisión de Fisicoquímica I. Mecánica Clásica. Cual de los siguientes cuerpos está sometido a la acción de la mayor fuerza, tomando como referencia
Departamento de Química del Cinvestav Preguntas tipo examen de admisión de Fisicoquímica I. Mecánica Clásica. Cual de los siguientes cuerpos está sometido a la acción de la mayor fuerza, tomando como referencia
TEMA IV: ENERGÍA DE LAS REACCIONES QUÍMICAS
 TEMA IV: ENERGÍA DE LAS REACCIONES QUÍMICAS 1.- INTRODUCCIÓN A LA TERMODINÁMICA 2.- PRIMER PRINCIPIO DE LA TERMODINÁMICA 3.- ENTALPIAS DE REACCIÓN Y DE FORMACIÓN 4.- ECUACIONES TERMOQUÍMICAS.REACCIONES
TEMA IV: ENERGÍA DE LAS REACCIONES QUÍMICAS 1.- INTRODUCCIÓN A LA TERMODINÁMICA 2.- PRIMER PRINCIPIO DE LA TERMODINÁMICA 3.- ENTALPIAS DE REACCIÓN Y DE FORMACIÓN 4.- ECUACIONES TERMOQUÍMICAS.REACCIONES
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
TERMODINAMICA. Rosa Devés Programa de Fisiología y Biofísica 2007
 TERMODINAMICA Rosa Devés Programa de Fisiología y Biofísica 2007 TERMODINAMICA Principios generales Intercambios de energía Direccionalidad Existe un invariante en la naturaleza: Primera Ley de la Termodinámica
TERMODINAMICA Rosa Devés Programa de Fisiología y Biofísica 2007 TERMODINAMICA Principios generales Intercambios de energía Direccionalidad Existe un invariante en la naturaleza: Primera Ley de la Termodinámica
Electricidad y calor. Webpage: Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
6. ESPONTANEIDAD DE LAS REACCIONES QUÍMICAS
 - 107-6. ESPONTANEIDAD DE LAS REACCIONES QUÍMICAS Algunas cosas ocurren libremente; otras no. El deterioro sucede libremente; la reconstrucción requiere trabajo. Una chispa es suficiente para ocasionar
- 107-6. ESPONTANEIDAD DE LAS REACCIONES QUÍMICAS Algunas cosas ocurren libremente; otras no. El deterioro sucede libremente; la reconstrucción requiere trabajo. Una chispa es suficiente para ocasionar
Tema 3: Termoquímica. Termoquímica Conceptos básicos Primer principio Entalpía Ley de Hess Segundo principio
 Tema 3: Termoquímica Objetivos. Principios y conceptos básicos. Primera ley de la termodinámica. Energía interna y entalpía. Calores de reacción. Ley de Hess. Segunda ley de la termodinámica. Entropía.
Tema 3: Termoquímica Objetivos. Principios y conceptos básicos. Primera ley de la termodinámica. Energía interna y entalpía. Calores de reacción. Ley de Hess. Segunda ley de la termodinámica. Entropía.
Unidad 7: Equilibrio químico
 Unidad 7: Equilibrio químico 1. INTRODUCCIÓN Una reacción reversible es aquella en la cual los productos vuelven a combinarse para generar los reactivos. En estos procesos ocurren simultáneamente dos reacciones:
Unidad 7: Equilibrio químico 1. INTRODUCCIÓN Una reacción reversible es aquella en la cual los productos vuelven a combinarse para generar los reactivos. En estos procesos ocurren simultáneamente dos reacciones:
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción A Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción A Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
