TREONIN PROTEINASAS: EL PROTEASOMA
|
|
|
- Sofia Murillo Sevilla
- hace 6 años
- Vistas:
Transcripción
1 TREONIN PROTEINASAS: EL PROTEASOMA
2 Clan PB, Familia T1 El descubrimiento de un quinto tipo catalítico se produjo cuando se determinó la estructura cristalográfica del proteasoma eucariótico de S. cerevisiae, que mostró una treonina N-terminal en el sitio activo. El tipo catalítico del proteasoma había sido un misterio hasta entonces, por su resistencia a la inhibición por la mayoría de los inhibidores standard de peptidasas. CLAN PB Descripción: Thr, Ser or Cys como nucleófilo en el N-terminal de la enzima madura. El Clan PB contiene endopeptidasas y proteínas autoprocesantes. Las Familias se asignan al clan PB en base a plegamiento similar o a un nucleófilo N-terminal. El clan contiene cistein, serin y treonin peptidasas. El residuo N- terminal de la proteína madura es catalítico, siendo tanto el nucleófilo como la base general (el grupo amino). Por esta razón, las proteínas con este plegamiento se conocen como N-terminal nucleophile (Ntn) hydrolases.
3 - El proteasoma, inicialmente llamado proteasa multicatalítica por tener (los eucarióticos) tres actividades, denominadas trypsin-like, chymotrypsin-like y peptidylglutamyl peptide hydrolase (tambien llamada caspase-like ), en tanto que el de Thermoplasma acidophilum tiene sólo una, la chymotrypsin-like, fué descubierto por microscopía electrónica mucho antes de demostrarse su actividad proteolítica. - Visto de costado da una imagen rectangular, y de frente una imagen circular. Tiene la forma de un barrilito, que consta de cuatro anillos formados por siete subunidades cada uno, de MW entre 22 y 34 kda, los externos por las subunidades a y los internos por las subunidades b. Los sitios activos están en las subunidades b. El proteasoma de T. acidophilum tiene 7 subunidades b con sitio activo; el eucariotico tiene solo 3 subunidades b activas, cada una con una especificidad. El MW del proteasoma 20S es 700 kda; cuando se le agregan las tapas de 19S para formar el proteasoma 26S (eucariótico) el MW aumenta a alrededor de 2000 kda. Los proteasomas se localizan en el citoplasma (algunos asociados a la cara externa del retículo endoplásmico) y en el núcleo. - El mecanismo catalítico involucra a un residuo de Thr N-terminal, que en algunos casos puede ser reemplazado por Ser, conservando actividad, pero Thr se requiere para el procesamiento de la prosubunidad. El pro-dominio de las subunidades puede variar en longitud entre unos pocos residuos (8 en T. acidophilum) hasta mas de 60. En la síntesis, se ensamblan primero los anillos a y luego sobre ellos se agregan y procesan las subunidades b. - El proteasoma es inhibido por diversos inhibidores; algunos inhiben tambien otras proteinasas, como el Z-leucinyl-leucinyl-leucinal y el inhibidor I de calpaína, y otros son mas específicos, como la lactacistina. Funciones: degradación de proteínas mal plegadas, de proteínas de vida corta, de factores de transcripción y proteínas involucradas en el ciclo celular. El inmunoproteasoma participa en la presentación de peptidos antígenicos al MHC I.
4 Proteasoma 20 S de Thermoplasma acidophilum.
5 Subunidad b del proteasoma de Thermoplasma acidophilum.
6 Arqueas Eucariotes Bacterias
7 ESTRUCTURA DEL PROTEASOMA 26S El proteasoma 20 S es activado por particulas regulatorias o tapas, que se unen a sus extremos e inducen un cambio conformacional que abre el canal interno del proteasoma, de las cuales se conocen 4. La mejor estudiada es la particula 19S, que consiste de 19 subunidades que agregan un peso de unos 900 kda. El complejo de una o dos de estas tapas con el 20S se denomina proteasoma 26 S. Las subunidades de 19S reconocen a los sustratos, los despliegan y los translocan al interior de la particula 20S para su degradacion en peptidos cortos. La mayor parte de esta tapa consiste de 6 subunidades de ATPasa AAA, con un dominio ATPasa y un dominio OB, y de 7 subunidades de andamiaje, que van desde el extremo del proteasoma hasta el anillo de subunidades a. A estas subunidades se les agregan dos grandes subunidades que sirven de plataformas de interaccion, Rpn1 y Rpn2. Rpn1 liga Ubl-UBA proteinas, que son receptores adicionales de Ub, en tanto que Rpn2 organiza los dos receptores de Ub, Rpn10 y Rpn13, La tapa contiene tambien un par de subunidades de metalopeptidasa, Rpn11 (enzimaticamente activa) y Rpn8; la primera cliva las cadenas de poliubiquitina a medida que el sustrato va entrando al canal de 20S. Proteínas adaptadoras UbL-UBA: UbL (ubiquitin-like, como Rad23) se une al proteasoma, y UBA (ubiquitinassociated) a proteínas ubiquitinadas.
8 Schematic representation of the degradation cycle of the ubiquitin proteasome system. Proteins are targeted to the proteasome by a two-part degradation signal or degron. It consists of a disordered region within the substrate and a reversibly attached polyubiquitin tag (Ub n ). Polyubiquitin tag is attached by a E1 E2 E3 ubiquitination cascade and this process can be reversed by DUBs (top left). The proteasome recognizes its substrates at the ubiquitin tag through ubiquitin receptors (Rpn10 and Rpn13; green) (top) and initiates degradation at the unstructured region (right). Once the proteasome has engaged its substrate, it unravels the protein by translocating it into a central cavity in the core particle, where the protein is proteolysed (bottom). The polyubiquitin tag is cleaved off by the intrinsic DUB Rpn11 (skyblue) as unfolding and degradation begins
9 The proteasome recognizes substrates in three different modes; ubiquitin-dependent (left), adaptermediated (middle), and ubiquitin-independent (right) modes. In all three modes, an intrinsically disordered region in the substrate is recognized by the ATPase motor to allow the proteasome to initiate degradation. This aspect of proteasomal degradation resembles the targeting mechanisms predominant with the bacterial and archaeal analogs of the proteasome. Ubiquitin tags can be either recognized by the two intrinsic proteasome receptors Rpn10 and Rpn13 (left), or by non-stoichiometric proteasome subunits that serve as substrate adaptors such as UbL-UBA proteins (middle). The UbL- UBA proteins might bind substrates by themselves (second right) or together with the intrinsic substrate receptors (second from left) and facilitate degradation of by positioning the disordered region properly. Finally, some substrates may be recognized only by their initiation sites.
10 En presencia de citokinas inflamatorias como el IFNg o el TNFa, se sintetiza una variante del proteasoma, el inmunoproteasoma, que tiene reemplazadas 3 subunidades b, por subunidades b específicas, resultando en una actividad caspaselike muy disminuída y en una chymotrypsin-like aumentada. Además, el complejo 19S es reemplazado por el complejo 11S, el cual permite la apertura del canal del 20S sin necesidad de ubiquitinación de la proteína a degradar. Puede haber inmunoproteasomas híbridos, con ambas caps, 19S y 11S, una en cada extremo.
11 El inmunoproteasoma se ensambla de novo, y lleva a un incremento considerable de la formación de péptidos inmunogénicos, que serán presentados por el MHC clase I.
12 Chaperonas: HsP70, HsP90a, TriC. TAP1 y TAP2: Transportadores asociados con el procesamiento de antigenos. ERAP 1 y 2: aminopeptidasas del RE. b2m: b2 microglobulina. ERp57: oxidoreductasa del RE. TCR: receptor de la célula T.
13 ASPARTIL PROTEINASAS
14 Aspartil Peptidasas Las proteasas aspárticas son una familia de proteasas que usa dos residues de Asp altamente conservados en el sitio activo para catalizar el clivaje de sus sustratos. El mecanismo de acción generalmente aceptado es un mecanismo general ácido-base que involucra la coordinación de una molécula de agua entre los dos residuos de Asp altamente conservados. Un aspartato activa el agua quitándole un protón, permitiendo que el agua ataque el carbono del carbonilo de la unión a romper en el sustrato, generando un intermediario tetraédrico oxianion. El rearreglo de este intermediario lleva a la protonación de la amida a cortar.
15 PEPSINA (CLAN AA, FLIA A1) La pepsina es la principal proteasa ácida del estómago. Se la reconoce generalmente como la primera enzima descubierta (en el Siglo XVIII) y recibió su nombre de T. Schwann en La pepsina fué la segunda enzima cristalizada (Northrop,1930), después de la ureasa (Sumner, 1926). La secreción de la pepsina por la mucosa gástrica es estimulada por la gastrina. La pepsina es sintetizada en la mucosa gástrica y secretada a la luz del estómago como un zimógeno, el pepsinógeno, que contiene un propéptido extra de 44 residuos en el N-terminal. Al llegar al medio ácido del estómago, el pepsinógeno es convertido en pepsina por la remoción del propéptido. La pepsina es una endopeptidasa con especificidad amplia. El rango de ph para la hidrólisis de péptidos es desde menos de 1 hasta alrededor de 6, con un óptimo kcat / Km cerca de ph 3.5
16 PEPSINA Complejo con pepstatina
17 PEPSINOGENO
18 Quimosinas naturales (Clan AA, Flia A1) Aspartil proteasa. Producida por las células principales en el estómago de las vacas. Su rol en la digestión consiste en coagular la leche en el estómago, un proceso muy importante en animales jóvenes. Si la leche no se coagulara fluiría muy rápidamente a través del estómago y se perdería la oportunidad para la digestión inicial de sus proteínas. La quimosina cliva proteolíticamente e inactiva a la caseína kappa, convirtiéndola en para-kappa caseína y una proteína más pequeña llamada macropéptido. La para-kappa caseína no tiene la capacidad de estabilizar la estructura micelar y las caseínas insolubles por calcio precipitan.
19 Retropepsina del HIV (Clan AA, Flia A2) La proteasa del HIV (HIV-1 PR), se ha transformado en el sistema mas profundamente estudiado en la historia de las enzimas. Esto es notable, dado que el descubrimiento inicial de la enzima data del informe de la secuencia de nucleótidos del genoma viral en 1985 (Ratner et al., 1985). La Food and Drug Administration (FDA) de USA aprobó para el tratamiento antiviral en humanos seis compuestos (Junio de 2003). Debido a la rápida mutación de la proteína viral, han debido generarse muchos nuevos inhibidores, y obtener estructuras de la enzima en complejo con ellos. Al 30 de Mayo de 2016 había 306 estructuras, la mayoría en complejos con inhibidores, en PDB. Las proteasas virales tienen la función de cortar la poliproteína viral inicialmente formada por traducción del mrna viral, para dar las unidades constitutivas funcionales del virus. La proteasa del HIV necesita dimerizarse para formar una enzima funcional. En la familia de la pepsina (A1) un ácido aspártico es contribuido por el dominio N-terminal (residuo 32 en la pepsina) y otro por el dominio C-terminal (residuo 215 en la pepsina) para formar la maquinaria catalítica. En las retropepsinas, la proteasa viral contribuye uno de los Asps en la secuencia -Xaa-Xaa-Asp-Thr- Gly- (donde Xaa es un residuo hidrofóbico). Se requieren dos de estos monómeros unidos para formar la enzima funcional.
20 RETROPEPSINA (HIV)
21 Inhibidores de APs Casi todas las aspartil proteasas son inhibidas por la pepstatina, un hexa-péptido natural que contiene el aminoácido inusual estatina (Sta, ácido (3S,4S)-4- amino-3-hidroxi-6-metilheptanoico).
22 METALOPEPTIDASAS
23 Metalopeptidasas: Mecanismo de reacción. Generally accepted catalytic mechanism of monometallic MPs. The catalytic solvent molecule is bound first to the catalytic metal ion (white sphere) and the general base/acid in the active site in the absence of a peptidic substrate (I) Once the substrate is accommodated in the cleft and the Michaelis complex is formed (II), the polarized solvent molecule attacks the scissile carbonyl group, which leads to the tetrahedral reaction intermediate (III). The latter resolves in scissile bond breakage and double proton transfer to the newly formed a-amino group to render a double-product complex (IV).
24 Matrilisina (Matriz metalopeptidasa-7) humana The catalytic zinc is shown as a light grey sphere. Structural calcium ions are shown as yellow spheres. The zinc ligands are shown in ball-and-stick representation: His214, His218 and His224 in purple. The catalytic Glu215 is shown in blue. Bound inhibitor is shown in grey in ball-andstick representation
25 LEISHMANOLISINA - Leishmania major
26 OTRAS CLASES CATALÍTICAS: GLUTAMIL PEPTIDASAS Y ASPARAGINIL PEPTIDASAS.
27
28 Familia N8: Asparaginil peptidasas. Incluye a la proteína de cápside de tipo VPO autoclivable del poliovirus. En la figura, se muestra la proteína similar del rhinovirus 14. La Asn 68 es la catalítica. Hay 5 clanes de asparaginil peptidasas; la mostrada pertenece al Clan NA.
29 Familia N4: El dominio autoclivable asociado a Tsh de E. coli. Los autotransportadores son factores de virulencia secretados por bacterias patógenas. El propéptido C-terminal forma un poro en la membrana externa a través del cual la peptidasa (el dominio pasajero) puede pasar. El autoclivage en Asn 1100 libera la peptidasa.
30 PROBLEMAS QUE PRESENTAN LAS PROTEINASAS EN LA PURIFICACIÓN DE OTRAS PROTEÍNAS. APLICACIONES DE LAS PROTEINASAS EN BIOQUÍMICA, BIOLOGÍA CELULAR Y BIOLOGÍA MOLECULAR.
31 LAS PROTEINASAS COMO UN PROBLEMA EN PURIFICACION DE PROTEÍNAS. SINTOMAS QUE SUGIEREN UN PROBLEMA PROTEOLITICO: 1) Ausencia de una proteína específica (por actividad o inmunorreactividad). 2) Bajos rendimientos en la purificación o pérdida de actividad, por ejemplo durante el almacenamiento de las muestras. 3) Cambios en la actividad de la proteína. P.ej.: especificidad, dependencia del ph, etc. Puede deberse a proteólisis limitada. P.ej.: la tirosina aminotransferasa (TAT) de hígado de mamífero cuya región N-terminal se conoció sólo al secuenciar el cdna, pues se proteoliza al romper los hepatocitos. 4) Discrepancias en las propiedades de la misma proteína purificada en distintos laboratorios o por métodos alternativos (patrón de isoformas, datos de secuencia N-terminal).
32 SINTOMAS EN SDS-PAGE QUE SUGIEREN UN PROBLEMA PROTEOLITICO. 1) Pobre resolución de bandas y alto background de tinción. 2) Pérdida de bandas de alto peso molecular y aumento del material de bajo peso molecular. 3) Discrepancias en el valor de peso molecular informado por diversos laboratorios, o de la misma proteína obtenida por métodos alternativos. 4) Disminución del peso molecular aparente durante el almacenamiento. 5) Aparición de dos bandas con peso molecular menor, con pérdida de una única banda con peso molecular igual a su suma. 6) Número variable de subunidades en preparaciones de proteínas multifuncionales.
33 PROBLEMAS PROTEOLITICOS QUE PUEDEN SUCEDER DURANTE LA SDS-PAGE. 1) Las condiciones desnaturalizantes empleadas en SDS-PAGE despliegan a las proteínas y las hacen mas vulnerables a la proteólisis. 2) Algunas proteinasas no se inactivan completamente en condiciones desnaturalizantes standard, sobre todo si no se hierve la muestra a sembrar. 3) Los complejos proteinasa-inhibidor se disocian. 4) Los agentes reductores, como el b-mercaptoetanol, activan a las cisteina proteinasas.
34 FORMAS DE EVITAR (O MINIMIZAR) LA PROTEOLISIS DURANTE LA PURIFICACION DE UNA PROTEINA. 1) ph y buffers: Buscar un buffer y un valor de ph que no sea el óptimo para las proteinasas conocidas en el material de partida. 2) Temperatura: Trabajar en frío y guardar las muestras congeladas (a - 70 o C de ser posible), salvo que la proteína no lo soporte. 3) Tiempo: Trabajar tan rápido como sea posible. Usar inhibidores de proteinasas durante las etapas que insumen mucho tiempo (p. ej.: una diálisis de toda la noche). 4) Agentes estabilizadores: P. ej.: glicerol, al %, o DMSO, al 10 % 5) Agregado de proteínas exógenas: P. ej.: 1-5 mg de seroalbúmina bovina por ml. 6) Agregado de efectores: Sustratos, análogos de sustratos, cofactores, efectores alostéricos, si el complejo de la proteína y el efector es mas estable que la proteína sola. 7) Uso de cócteles de inhibidores de proteinasas.
35
36 USO DE PROTEINASAS EN SECUENCIACION DE PROTEINAS Para la digestión parcial de las proteínas previa a su secuenciación por Edman o MS, se utilizan distintas proteinasas con diferentes especificidades. Serin proteinasas: Tripsina - Quimotripsina - Subtilisina - Glu-C - Lys-C - Arg-C. Cistein proteinasas: Papaína. Metaloproteinasas: Termolisina. Aspartil proteinasas. Pepsina. Actualmente lo mas frecuente es efectuar la digestión en el fragmento de gel de proliacrilamida, y luego extraer los péptidos para efectuar RP- HPLC o MS.
37
38 ALGUNAS PROTEINAS ESTUDIADAS POR PROTEOLISIS LIMITADA. ES ESENCIAL DETENER LA PROTEÓLISIS CON UN INHIBIDOR ADECUADO 1) MIOSINA. Clivaje con quimotripsina, detenido con PMSF. Produce las meromiosinas pesada y liviana. 2) COMPLEJO ASPARTOQUINASA-HOMOSERINA DEHIDROGENASA. Clivaje con quimotripsina, detenido con PMSF. Se aísla el fragmento C- terminal de 55 kda que contiene la actividad de homoserina dehidrogenasa. 3) DNA POLIMERASA I. Clivaje con subtilisina, en presencia de DNA. Detenido con PMSF. Separa el fragmento N-terminal de 35 kda del fragmento C-terminal de 68 kda. Este último es el fragmento Klenow, con actividad de polimerasa y 3-5 -exonucleasa.
39 USO DE PROTEINASAS PARA DETERMINAR LA TOPOLOGIA DE PROTEINAS DE MEMBRANA
40 USO DE PROTEINASAS PARA DETERMINAR LA TRANSLOCACIÓN DE PROTEINAS A ORGANELAS.
41
42
43 USO DE PROTEINASAS PARA PROCESAR PROTEINAS EXPRESADAS COMO PROTEINAS DE FUSION.
44
45 Urogastrona (human epidermic growth factor). La proteína intacta es rápidamente degradada por E. coli, pero se la estabiliza fusionando la proteína TrpE al N-terminal y se facilita su purificación fusionando poli-arg al C-terminal. Va a cuerpos de inclusión. Se solubiliza con urea y se purifica por intercambio iónico aprovechando la poli-arg. Se digiere con tripsina para eliminar las fusiones, pero debe controlarse muy bien la digestión.
46
47 Purificación de aspartato aminotransferasa fusionada a 7 residuos de Arg en el C-terminal, que se eliminan usando la carboxipeptidasa B, específica para aminoácidos básicos en el C-terminal.
LAS PROTEINASAS COMO UN PROBLEMA EN PURIFICACION DE PROTEÍNAS. SINTOMAS QUE SUGIEREN UN PROBLEMA PROTEOLITICO:
 LAS PROTEINASAS COMO UN PROBLEMA EN PURIFICACION DE PROTEÍNAS. SINTOMAS QUE SUGIEREN UN PROBLEMA PROTEOLITICO: 1) Ausencia de una proteína específica (por actividad o inmunorreactividad). 2) Bajos rendimientos
LAS PROTEINASAS COMO UN PROBLEMA EN PURIFICACION DE PROTEÍNAS. SINTOMAS QUE SUGIEREN UN PROBLEMA PROTEOLITICO: 1) Ausencia de una proteína específica (por actividad o inmunorreactividad). 2) Bajos rendimientos
Degradación de Proteínas
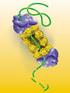 Degradación de Proteínas La degradación de las proteínas desempeña importantes funciones, ya sea por la modulación de los niveles intracelulares de proteínas específicas (proteólisis limitada), como por
Degradación de Proteínas La degradación de las proteínas desempeña importantes funciones, ya sea por la modulación de los niveles intracelulares de proteínas específicas (proteólisis limitada), como por
Modificaciones post-traduccionales
 Facultad de Química, UNAM 1630 Genética y Biología Molecular Modificaciones post-traduccionales Modificaciones post-traduccionales No siempre un polipéptido recién sintetizado es una proteína funcional.
Facultad de Química, UNAM 1630 Genética y Biología Molecular Modificaciones post-traduccionales Modificaciones post-traduccionales No siempre un polipéptido recién sintetizado es una proteína funcional.
PEPTIDASAS. Peptidasas: Hidrolizan la unión entre el carboxilo de un aminoácido y el α-amino del siguiente (unión peptídica) en una proteína.
 PEPTIDASAS Peptidasas: Hidrolizan la unión entre el carboxilo de un aminoácido y el α-amino del siguiente (unión peptídica) en una proteína. Pueden ser exopeptidasas, si hidrolizan a partir del extremo
PEPTIDASAS Peptidasas: Hidrolizan la unión entre el carboxilo de un aminoácido y el α-amino del siguiente (unión peptídica) en una proteína. Pueden ser exopeptidasas, si hidrolizan a partir del extremo
Digestión y absorción de PROTEÍNAS. Marijose Artolozaga Sustacha, MSc
 Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
Antibióticos inhibidores de traduccion
 Antibióticos inhibidores de traduccion Antibiótico/Toxina Organismo Función Tetraciclina Procarionte Sitio A subunidad 30S Cloramfenicol Procarionte Centro PTC subunidad 50S Puromicina Procarionte/Eucarionte
Antibióticos inhibidores de traduccion Antibiótico/Toxina Organismo Función Tetraciclina Procarionte Sitio A subunidad 30S Cloramfenicol Procarionte Centro PTC subunidad 50S Puromicina Procarionte/Eucarionte
Digestión y absorción de PROTEÍNAS. Marijose Artolozaga Sustacha, MSc
 Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
Biomoléculas. Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos
 Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
PROTEÍNAS. Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas:
 PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
Procesamiento de proteínas y modificaciones post-traduccionales
 Procesamiento de proteínas y modificaciones post-traduccionales Las proteínas después de sintetizadas en los ribosomas, deben ser procesadas para que logren tener su conformación nativa y ser activas Eventos
Procesamiento de proteínas y modificaciones post-traduccionales Las proteínas después de sintetizadas en los ribosomas, deben ser procesadas para que logren tener su conformación nativa y ser activas Eventos
introducción Propiedades que las diferencian de otros tipos de reordenamientos en proteínas:
 introducción En 1990 se descubre la primera inteína Propiedades que las diferencian de otros tipos de reordenamientos en proteínas: Secuencia característica de la inteína. Reacción autocatalítica en ausencia
introducción En 1990 se descubre la primera inteína Propiedades que las diferencian de otros tipos de reordenamientos en proteínas: Secuencia característica de la inteína. Reacción autocatalítica en ausencia
Modificaciones de Proteínas
 Modificaciones de Proteínas Bibliografía: M. en C. Elva Carolina Chávez Hernández Alberts Molecular Biology of the Cell. 4a Ed disponible online. (2002, 2008). Lehninger Principles of Biochemistry 4ª,
Modificaciones de Proteínas Bibliografía: M. en C. Elva Carolina Chávez Hernández Alberts Molecular Biology of the Cell. 4a Ed disponible online. (2002, 2008). Lehninger Principles of Biochemistry 4ª,
BIOLOGIA CELULAR Y MOLECULAR DISTRIBUCIÓN Y TRANSPORTE DE PROTEINAS
 BIOLOGIA CELULAR Y MOLECULAR DISTRIBUCIÓN Y TRANSPORTE DE PROTEINAS RETICULO ENDOPLASMATICO Red de túbulos y sacos (cisternas) rodeados de membrana que se extiende desde la membrana nuclear por todo el
BIOLOGIA CELULAR Y MOLECULAR DISTRIBUCIÓN Y TRANSPORTE DE PROTEINAS RETICULO ENDOPLASMATICO Red de túbulos y sacos (cisternas) rodeados de membrana que se extiende desde la membrana nuclear por todo el
Etapas de la Traducción. la traducción consta de tres partes
 Traducción Etapas de la Traducción la traducción consta de tres partes Iniciación el ribosoma se desplaza en dirección 5-3 hasta encontrar una señal que le indique el inicio de la traducción la señal de
Traducción Etapas de la Traducción la traducción consta de tres partes Iniciación el ribosoma se desplaza en dirección 5-3 hasta encontrar una señal que le indique el inicio de la traducción la señal de
Universidad Nacional Autónoma de México
 Universidad Nacional Autónoma de México Facultad de Química Curso Genética y Biología Molecular (1630) Licenciatura Químico Farmacéutico Biológico Dra. Herminia Loza Tavera Profesora Titular de Carrera
Universidad Nacional Autónoma de México Facultad de Química Curso Genética y Biología Molecular (1630) Licenciatura Químico Farmacéutico Biológico Dra. Herminia Loza Tavera Profesora Titular de Carrera
Secuencia de Aminoácidos en las Proteínas. Tema 7 SECUENCIACIÓN PEPTÍDICA. Etapas para el conocimiento de una secuencia peptídica (I)
 Secuencia de Aminoácidos en las Proteínas Es característica para cada proteína Tema 7 SECUENCIACIÓN PEPTÍDICA Es codificada por una secuencia de nucleótidos del DNA Por lo tanto, es una forma de información
Secuencia de Aminoácidos en las Proteínas Es característica para cada proteína Tema 7 SECUENCIACIÓN PEPTÍDICA Es codificada por una secuencia de nucleótidos del DNA Por lo tanto, es una forma de información
Bioquímica Estructural y Metabólica. Tema 2. Aminoácidos
 TEMA 2. Aminoácidos. Estructura y propiedades de los aminoácidos. Estereoisomería. Clasificación de los aminoácidos según sus cadenas laterales. Aminoácidos esenciales y no esenciales. Modificaciones post-
TEMA 2. Aminoácidos. Estructura y propiedades de los aminoácidos. Estereoisomería. Clasificación de los aminoácidos según sus cadenas laterales. Aminoácidos esenciales y no esenciales. Modificaciones post-
CÓMO SE PUEDE DETERMINAR LA SECUENCIA DEL DNA A PARTIR DE UNA PROTEÍNA? DR. MANUEL E. AQUINO
 Alianza para el Aprendizaje de Ciencias y Matemáticas CÓMO SE PUEDE DETERMINAR LA SECUENCIA DEL DNA A PARTIR DE UNA PROTEÍNA? DR. MANUEL E. AQUINO GUÍA DEL MAESTRO ESTÁNDARES ATENDIDOS: 1. LA NATURALEZA
Alianza para el Aprendizaje de Ciencias y Matemáticas CÓMO SE PUEDE DETERMINAR LA SECUENCIA DEL DNA A PARTIR DE UNA PROTEÍNA? DR. MANUEL E. AQUINO GUÍA DEL MAESTRO ESTÁNDARES ATENDIDOS: 1. LA NATURALEZA
Enzimas de origen marino. Dr. José Luis Cárdenas López
 Enzimas de origen marino Dr. José Luis Cárdenas López Enzimas endógenas de importancia en los productos marinos Proteinasas digestivas Lipasas y fosfolipasas Enzimas que degradan el TMAO Polifenoloxidasa
Enzimas de origen marino Dr. José Luis Cárdenas López Enzimas endógenas de importancia en los productos marinos Proteinasas digestivas Lipasas y fosfolipasas Enzimas que degradan el TMAO Polifenoloxidasa
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO
 LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
1. QUIMOTRIPSINA 2. PROTEASA DE VIH 3. HEXOKINASA 4. ENOLASA 5. LISOZIMA 6. TRANSPEPTIDASA
 TAREA PARA EL LUNES CONVERTIRSE EN EXPERTOS SECCIÓN 6.4 DEL LIBRO (FINAL DE 6.2) 1. QUIMOTRIPSINA 2. PROTEASA DE VIH 3. HEXOKINASA 4. ENOLASA 5. LISOZIMA 6. TRANSPEPTIDASA INHIBICIÓN http://upload.wikimedia.org/wikipedia/commons/4/42/cox-2_inhibited_by_aspirin.png
TAREA PARA EL LUNES CONVERTIRSE EN EXPERTOS SECCIÓN 6.4 DEL LIBRO (FINAL DE 6.2) 1. QUIMOTRIPSINA 2. PROTEASA DE VIH 3. HEXOKINASA 4. ENOLASA 5. LISOZIMA 6. TRANSPEPTIDASA INHIBICIÓN http://upload.wikimedia.org/wikipedia/commons/4/42/cox-2_inhibited_by_aspirin.png
Proteólisis Limitada MODIFICACIONES PROTEICAS POSTRADUCCIONALES. Procesamiento de POMC. Proteólisis limitada. Recambio proteico ENZIMAS PROTEOLÍTICAS
 Proteólisis Limitada Probablemente todas las proteínas maduras deben ser modificadas de esta manera, a todas debe removérsele su metionina líder (o fmet), después de que emergen del ribosoma Proteólisis
Proteólisis Limitada Probablemente todas las proteínas maduras deben ser modificadas de esta manera, a todas debe removérsele su metionina líder (o fmet), después de que emergen del ribosoma Proteólisis
REPLICACIÓN DEL ADN. Procesos de replicación, transcripción y traducción.
 REPLICACIÓN DEL ADN Procesos de replicación, transcripción y traducción. La transmisión de información implica que el ADN es capaz de duplicarse de manera de obtener dos moléculas iguales a partir de la
REPLICACIÓN DEL ADN Procesos de replicación, transcripción y traducción. La transmisión de información implica que el ADN es capaz de duplicarse de manera de obtener dos moléculas iguales a partir de la
Capítulo 12 REGULACIÓN DE LA EXPRESIÓN GÉNICA. Factores de Transcripción. Metilación. Procesamiento del ARN. Post-traduccional
 REGULACIÓN DE LA EXPRESIÓN GÉNICA - Mecanismos de Regulación Regulación Procariontes Eucariontes Operón Lactosa Operón Triptofano Transcripcional Procesamiento del ARN Traduccional Post-traduccional Factores
REGULACIÓN DE LA EXPRESIÓN GÉNICA - Mecanismos de Regulación Regulación Procariontes Eucariontes Operón Lactosa Operón Triptofano Transcripcional Procesamiento del ARN Traduccional Post-traduccional Factores
Biosíntesis de Ácidos nucleicos (ARN) y Proteínas
 Biosíntesis de Ácidos nucleicos (ARN) y Proteínas Núcleo celular Dogma central de la Biología Molecular Repasando los Ácidos nucleicos. Empaquetamiento de ADN 46 cromosomas en las células somáticas del
Biosíntesis de Ácidos nucleicos (ARN) y Proteínas Núcleo celular Dogma central de la Biología Molecular Repasando los Ácidos nucleicos. Empaquetamiento de ADN 46 cromosomas en las células somáticas del
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Proteínas Dr. Mynor A. Leiva Enríquez 1 PROTEÍNAS: Las proteínas
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Proteínas Dr. Mynor A. Leiva Enríquez 1 PROTEÍNAS: Las proteínas
Proteolisis intracelular
 Proteolisis intracelular Bibliografía: Cuervo, AM. Molecular and Cellular Biochemistry 263: 55 72, 2004. Hershko y Ciechanover. Annu. Rev. Biochem. 1998. 67:425 79 Proteolisis intracelular Proceso altamente
Proteolisis intracelular Bibliografía: Cuervo, AM. Molecular and Cellular Biochemistry 263: 55 72, 2004. Hershko y Ciechanover. Annu. Rev. Biochem. 1998. 67:425 79 Proteolisis intracelular Proceso altamente
Aminoácidos, péptidos y proteinas
 Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
NOMENCLATURA BASE + AZUCAR + FOSFATO: Base Azúcar Fosfatos Nucleótido Ac. nucleico
 NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
UNIDAD II. Sistema de membranas. Compartimientos celulares Retículo endoplásmico
 UNIDAD II. Sistema de membranas Compartimientos celulares Retículo endoplásmico Evolución RE Entre organismos El RE fue descubierto en 1945 por K. Porter Contenido de membranas Componentes de membrana
UNIDAD II. Sistema de membranas Compartimientos celulares Retículo endoplásmico Evolución RE Entre organismos El RE fue descubierto en 1945 por K. Porter Contenido de membranas Componentes de membrana
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Apoptosis. Término que hace referencia a los procesos morfológicos que llevan a la autodestrucción celular controlada
 APOPTOSIS Apoptosis Término que hace referencia a los procesos morfológicos que llevan a la autodestrucción celular controlada Esta muerte es necesaria y parte integral del ciclo de vida de los organismos
APOPTOSIS Apoptosis Término que hace referencia a los procesos morfológicos que llevan a la autodestrucción celular controlada Esta muerte es necesaria y parte integral del ciclo de vida de los organismos
ANÁLISIS DE LA FUNCIÓN GÉNICA:
 ANÁLISIS DE LA FUNCIÓN GÉNICA: SILENCIAMIENTO Y SOBREEXPRESIÓN PROTEÓMICA DISRUPCIÓN GÉNICA DISRUPCIÓN GÉNICA - Disrupción génica. Reemplazamiento génico por doble entrecruzamiento gena Southern Northern
ANÁLISIS DE LA FUNCIÓN GÉNICA: SILENCIAMIENTO Y SOBREEXPRESIÓN PROTEÓMICA DISRUPCIÓN GÉNICA DISRUPCIÓN GÉNICA - Disrupción génica. Reemplazamiento génico por doble entrecruzamiento gena Southern Northern
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
Organelos citoplasmáticos
 Escuela Universitaria de Tecnología Médica - Escuela de Parteras Facultad de Medicina Universidad de la República UTI Biología Celular y Tisular Organelos citoplasmáticos Luciana Negro Departamento de
Escuela Universitaria de Tecnología Médica - Escuela de Parteras Facultad de Medicina Universidad de la República UTI Biología Celular y Tisular Organelos citoplasmáticos Luciana Negro Departamento de
Sistema endomembranoso. Retículo endoplásmático liso Retículo endoplasmático rugoso Aparato de Golgi. Dra. Sandra Orellana Verdejo Clase 15
 Sistema endomembranoso Retículo endoplásmático liso Retículo endoplasmático rugoso Aparato de Golgi Dra. Sandra Orellana Verdejo Clase 15 CÉLULA EUCARIOTA El citoplasma se encuentra compartimentalizado
Sistema endomembranoso Retículo endoplásmático liso Retículo endoplasmático rugoso Aparato de Golgi Dra. Sandra Orellana Verdejo Clase 15 CÉLULA EUCARIOTA El citoplasma se encuentra compartimentalizado
METABOLISMO DE AMINOACIDOS
 METABOLISMO DE AMINOACIDOS BIOSÍNTESIS DE AMINOÁCIDOS El ion amonio se incorpora a los aminoácidos a través de glutamato y de glutamina El glutamato y la glutamina desempeñan un papel crucial en la la
METABOLISMO DE AMINOACIDOS BIOSÍNTESIS DE AMINOÁCIDOS El ion amonio se incorpora a los aminoácidos a través de glutamato y de glutamina El glutamato y la glutamina desempeñan un papel crucial en la la
Proteínas de Choque Térmico (HSP)
 Traducción Proteínas de Choque Térmico (HSP) son proteínas altamente conservadas tanto en células procariotas como eucariotas. estabilizan y facilitan el plegamiento de proteínas parcialmente desnaturalizadas
Traducción Proteínas de Choque Térmico (HSP) son proteínas altamente conservadas tanto en células procariotas como eucariotas. estabilizan y facilitan el plegamiento de proteínas parcialmente desnaturalizadas
Incorporación de nitrógeno. Prots. vegetales DIETA HUMANA. AA en intestino. AA en sangre. AA en células. Proteínas celulares
 Tema 25. Panorámica general del metabolismo de los aminoácidos. Panorámica general del metabolismo de los aminoácidos. Origen de los aminoácidos corporales. Aminoácidos esenciales. Enzimas proteolíticas
Tema 25. Panorámica general del metabolismo de los aminoácidos. Panorámica general del metabolismo de los aminoácidos. Origen de los aminoácidos corporales. Aminoácidos esenciales. Enzimas proteolíticas
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL
 CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
Metabolismo de los aminoácidos
 Metabolismo de los aminoácidos Introducción Aminoácidos Función más conocida: parte de las proteínas Precursores de neurotransmisores y hormonas Combustible à Gluconeogénesis Combustible à Cuerpos cetónicos
Metabolismo de los aminoácidos Introducción Aminoácidos Función más conocida: parte de las proteínas Precursores de neurotransmisores y hormonas Combustible à Gluconeogénesis Combustible à Cuerpos cetónicos
DISTRIBUCIÓN Y TRANPORTE DE PROTEINAS RETÍCULO ENDOPLASMÍCO, APRATO DE GOLGI Y LISOSOMAS
 DISTRIBUCIÓN Y TRANPORTE DE PROTEINAS RETÍCULO ENDOPLASMÍCO, APRATO DE GOLGI Y LISOSOMAS RETÍCULO ENDOPLÁSMICO: RED DE TUBOS Y SACOS APLANADOS (CISTERNAS) RETÍCULO ENDOPLASMÍCO RUGOSO RETÍCULO ENDOPLASMÍCO
DISTRIBUCIÓN Y TRANPORTE DE PROTEINAS RETÍCULO ENDOPLASMÍCO, APRATO DE GOLGI Y LISOSOMAS RETÍCULO ENDOPLÁSMICO: RED DE TUBOS Y SACOS APLANADOS (CISTERNAS) RETÍCULO ENDOPLASMÍCO RUGOSO RETÍCULO ENDOPLASMÍCO
Area Química Biológica Curso: Bioquímica. Tema 6: PROTEINAS. Dra. Silvia M. Varas
 Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Biología General: Macromoléculas biológicas. Prof. Bernal Gerardo Garro Mora
 Biología General: Macromoléculas biológicas Prof. Bernal Gerardo Garro Mora Objetivos: Al finalizar la clase el estudiante será capaz de: Definir a las moléculas orgánicas y los principales grupos funcionales
Biología General: Macromoléculas biológicas Prof. Bernal Gerardo Garro Mora Objetivos: Al finalizar la clase el estudiante será capaz de: Definir a las moléculas orgánicas y los principales grupos funcionales
Unidad curricular Introducción a la biología celular y molecular (preguntas 51 a 80)
 Unidad curricular Introducción a la biología celular y molecular (preguntas 51 a 80) 51. Cuál es la normalidad de una solución de NaOH 20 g/l? Dato: peso molecular del NaOH es 40 g/mol a. 0,35 N b. 0,50
Unidad curricular Introducción a la biología celular y molecular (preguntas 51 a 80) 51. Cuál es la normalidad de una solución de NaOH 20 g/l? Dato: peso molecular del NaOH es 40 g/mol a. 0,35 N b. 0,50
Es una estructura determinada por la cadena polipeptídica de la estructura primaria.
 Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
FLUJO DE INFORMACIÓN EN LAS CÉLULAS: REPLICACIÓN TRANSCRIPCIÓN TRADUCCIÓN
 FLUJO DE INFORMACIÓN EN LAS CÉLULAS: REPLICACIÓN TRANSCRIPCIÓN TRADUCCIÓN ÁCIDOS NUCLEICOS Existen dos tipos: ADN (ácido desoxirribonucleico) ARN (ácido ribonucleico) Son polímeros constituidos por nucleótidos
FLUJO DE INFORMACIÓN EN LAS CÉLULAS: REPLICACIÓN TRANSCRIPCIÓN TRADUCCIÓN ÁCIDOS NUCLEICOS Existen dos tipos: ADN (ácido desoxirribonucleico) ARN (ácido ribonucleico) Son polímeros constituidos por nucleótidos
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012 Proteínas Dr. Dr. Mynor A. A. Leiva Enríquez Las proteínas son
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012 Proteínas Dr. Dr. Mynor A. A. Leiva Enríquez Las proteínas son
Estructura y función de proteínas
 Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
UNIVERSIDAD AUTÓNOMA DE CHIAPAS FACULTAD DE CIENCIAS QUÍMICAS EXTENSION OCOZOCOAUTLA DE ESPINOZA
 INTEGRANTES: ERIKA VANESSA MOLINA MURILLO KARLA AYDE SANCHEZ GUILLEN YATZENY GPE. RUIZ MOLINA TOMAS ALEJANDRO LOPEZ ESCOBAR OBET MAZA NAFATE UNIVERSIDAD AUTÓNOMA DE CHIAPAS FACULTAD DE CIENCIAS QUÍMICAS
INTEGRANTES: ERIKA VANESSA MOLINA MURILLO KARLA AYDE SANCHEZ GUILLEN YATZENY GPE. RUIZ MOLINA TOMAS ALEJANDRO LOPEZ ESCOBAR OBET MAZA NAFATE UNIVERSIDAD AUTÓNOMA DE CHIAPAS FACULTAD DE CIENCIAS QUÍMICAS
ESTUDIOS CINÉTICOS SE MIDE LA VELOCIDAD DE LA REACCIÓN CATALIZADA. La velocidad de reacciones químicas: Para una reacción:
 ESTUDIOS CINÉTICOS SE MIDE LA VELOCIDAD DE LA REACCIÓN CATALIZADA La velocidad de reacciones químicas: Para una reacción: A B La velocidad depende de la concentración del reactante: v = k[a] k = constante
ESTUDIOS CINÉTICOS SE MIDE LA VELOCIDAD DE LA REACCIÓN CATALIZADA La velocidad de reacciones químicas: Para una reacción: A B La velocidad depende de la concentración del reactante: v = k[a] k = constante
Metabolismo celular I. Reacciones enzimáticas
 Metabolismo celular I Reacciones enzimáticas Reacciones químicas: Son transformaciones, por medio de las cuales unas sustancias se convierten en otras. Podemos distinguir dos grupos: 1) reacciones químicas
Metabolismo celular I Reacciones enzimáticas Reacciones químicas: Son transformaciones, por medio de las cuales unas sustancias se convierten en otras. Podemos distinguir dos grupos: 1) reacciones químicas
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012 Proteínas Dr. Dr. Mynor A. A. Leiva Enríquez 1 Las proteínas
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012 Proteínas Dr. Dr. Mynor A. A. Leiva Enríquez 1 Las proteínas
Apoptosis. Prof. Carla Lozano M. Biología y Genética II Facultad Odontología 2010
 Apoptosis Prof. Carla Lozano M. Biología y Genética II Facultad Odontología 2010 Muerte Celular Proceso necesario Balance celular Proceso controlado En Apoptosis Las células presentan: Cambios Morfológicos
Apoptosis Prof. Carla Lozano M. Biología y Genética II Facultad Odontología 2010 Muerte Celular Proceso necesario Balance celular Proceso controlado En Apoptosis Las células presentan: Cambios Morfológicos
BIOSINTESIS de PROTEINA = TRADUCCION
 BIOSINTESIS de PROTEINA = TRADUCCION 1.) activación de amino ácidos 2.) iniciación 3.) elongación 4.) terminación y liberación 5.) plegamiento y procesamiento post-traduccional Actores: -amino ácidos -trnas
BIOSINTESIS de PROTEINA = TRADUCCION 1.) activación de amino ácidos 2.) iniciación 3.) elongación 4.) terminación y liberación 5.) plegamiento y procesamiento post-traduccional Actores: -amino ácidos -trnas
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO
 IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
SEÑALES Y NÚCLEO (Docentes: Marina González Gabriela Gómez - Sede Montes de Oca)
 SEÑALES Y NÚCLEO (Docentes: Marina González Gabriela Gómez - Sede Montes de Oca) SEÑALES 1) El AMPc se produce: a. como respuesta a la activación de una proteína G b. como respuesta a un segundo mensajero
SEÑALES Y NÚCLEO (Docentes: Marina González Gabriela Gómez - Sede Montes de Oca) SEÑALES 1) El AMPc se produce: a. como respuesta a la activación de una proteína G b. como respuesta a un segundo mensajero
AMINOÁCIDOS y proteínas
 AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
INTITUCIÓN EDUCATIVA COLEGIO ARTISTICO RAFAEL CONTRERAS NAVARRO GUIA DE APRENDIZAJE METABOLISMO CELULAR
 INTITUCIÓN EDUCATIVA COLEGIO ARTISTICO RAFAEL CONTRERAS NAVARRO GUIA DE APRENDIZAJE METABOLISMO CELULAR PROFESOR: Jesús Alonso Paba León GRADO: Undecimo GUÍA DE ESTUDIO METABOLISMO CELULAR La vida de cualquier
INTITUCIÓN EDUCATIVA COLEGIO ARTISTICO RAFAEL CONTRERAS NAVARRO GUIA DE APRENDIZAJE METABOLISMO CELULAR PROFESOR: Jesús Alonso Paba León GRADO: Undecimo GUÍA DE ESTUDIO METABOLISMO CELULAR La vida de cualquier
METABOLISMO DE PROTEINAS Y AMINOACIDOS
 sección III, metabolismo de proteínas y aminoácidos. Harper, bioquímica, 28a edición. ALFREDO ABADIA G. RESIDENTE III AÑO MD DE LA ACTIVIDAD FISICA Y EL DEPORTE FUCS-HISJ. METABOLISMO DE PROTEINAS Y AMINOACIDOS
sección III, metabolismo de proteínas y aminoácidos. Harper, bioquímica, 28a edición. ALFREDO ABADIA G. RESIDENTE III AÑO MD DE LA ACTIVIDAD FISICA Y EL DEPORTE FUCS-HISJ. METABOLISMO DE PROTEINAS Y AMINOACIDOS
Biología Celular 1 er Curso. 5.1 Retículo endoplásmico. 5.2 Aparato de Golgi. 5.3 Mecanismo de transporte de las vesículas. 5.4 Lisosomas.
 Grado Medicina Biología Celular 1 er Curso TEMA 5 DISTRIBUCIÓN Y TRANSPORTE DE PROTEÍNAS: RETÍCULO ENDOPLÁSMICO, APARATO DE GOLGI Y LISOSOMAS. 5.1 Retículo endoplásmico. 5.2 Aparato de Golgi. 5.3 Mecanismo
Grado Medicina Biología Celular 1 er Curso TEMA 5 DISTRIBUCIÓN Y TRANSPORTE DE PROTEÍNAS: RETÍCULO ENDOPLÁSMICO, APARATO DE GOLGI Y LISOSOMAS. 5.1 Retículo endoplásmico. 5.2 Aparato de Golgi. 5.3 Mecanismo
TRADUCCION SINTESIS DE PROTEÍNAS
 TRADUCCION SINTESIS DE PROTEÍNAS Traducción = síntesis de proteínas. Proceso que involucra la participación ordenada de más de 100 macromoléculas, Ribosomas (ARNr y proteínas) ARN mensajero ARN de transferencia
TRADUCCION SINTESIS DE PROTEÍNAS Traducción = síntesis de proteínas. Proceso que involucra la participación ordenada de más de 100 macromoléculas, Ribosomas (ARNr y proteínas) ARN mensajero ARN de transferencia
Proteínas: Métodos para su Estudio
 Proteínas: Métodos para su Estudio Propiedades Espectroscópicas Todos los aminoácidos absorben luz en la región infraroja Sólo Phe, Tyr, & Trp absorben UV Absorbancia a 280 nm es un buen diagnóstico para
Proteínas: Métodos para su Estudio Propiedades Espectroscópicas Todos los aminoácidos absorben luz en la región infraroja Sólo Phe, Tyr, & Trp absorben UV Absorbancia a 280 nm es un buen diagnóstico para
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR
 INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - MACROMOLECULAS - Acidos nucleícos - ADN Fosfatos Base Azucar 1 Acidos nucleícos - ADN Acidos nucleícos 2 Acidos nucleícos Complementaridad de bases 3 Formas
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - MACROMOLECULAS - Acidos nucleícos - ADN Fosfatos Base Azucar 1 Acidos nucleícos - ADN Acidos nucleícos 2 Acidos nucleícos Complementaridad de bases 3 Formas
ENZIMAS ENZYMES. Dra. Jeannett Alejandra Izquierdo Vega
 Dra. Jeannett Alejandra Izquierdo Vega Presentación realizada en el curso de Bioquímica dentro de la Licenciatura de Médico Cirujano del Área Académica de Medicina. Enero Julio 2012. ENZIMAS ENZYMES Área
Dra. Jeannett Alejandra Izquierdo Vega Presentación realizada en el curso de Bioquímica dentro de la Licenciatura de Médico Cirujano del Área Académica de Medicina. Enero Julio 2012. ENZIMAS ENZYMES Área
Regulación de la Expresión Genética
 Facultad de Química, UNAM 1630 Genética y Biología Molecular Regulación de la Expresión Genética Unidad 8 En el flujo de la información desde DNA hasta una proteína activa, hay varios pasos regulatorios.
Facultad de Química, UNAM 1630 Genética y Biología Molecular Regulación de la Expresión Genética Unidad 8 En el flujo de la información desde DNA hasta una proteína activa, hay varios pasos regulatorios.
Regulación de la Expresión Genética
 Facultad de Química, UNAM En el flujo de la información desde DNA hasta una proteína activa, hay varios pasos regulatorios. Eucariontes Procariontes 1630 Genética y Biología Molecular Regulación de la
Facultad de Química, UNAM En el flujo de la información desde DNA hasta una proteína activa, hay varios pasos regulatorios. Eucariontes Procariontes 1630 Genética y Biología Molecular Regulación de la
Regulación de la expresión génica
 Regulación de la expresión génica Estrategias de la regulación metabólica. A. Regulación de la cantidad de una proteína B. Regulación de su actividad Procesos regulatorios que afectan los niveles de una
Regulación de la expresión génica Estrategias de la regulación metabólica. A. Regulación de la cantidad de una proteína B. Regulación de su actividad Procesos regulatorios que afectan los niveles de una
Compartimentos intracelulares y distribución de proteínas
 Compartimentos intracelulares y distribución de proteínas 1 2 3 regulado 4 Péptido y zona de señal 5 6 7 8 9 Las proteínas con señales de localización nuclear vuelven a entrar al núcleo 10 11 Retículo
Compartimentos intracelulares y distribución de proteínas 1 2 3 regulado 4 Péptido y zona de señal 5 6 7 8 9 Las proteínas con señales de localización nuclear vuelven a entrar al núcleo 10 11 Retículo
Cuestiones de Bioquímica
 1º de Química, gr. D http://www.uv.es/bbm Tema 4 Cuestiones de Bioquímica 1) Una reacción enzimática puede escribirse como dos reacciones sucesivas, donde el complejo ES es el intermediario en la conversión
1º de Química, gr. D http://www.uv.es/bbm Tema 4 Cuestiones de Bioquímica 1) Una reacción enzimática puede escribirse como dos reacciones sucesivas, donde el complejo ES es el intermediario en la conversión
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,013
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,013 Proteínas Dr. Dr. Mynor A. A. Leiva Enríquez Las proteínas son
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,013 Proteínas Dr. Dr. Mynor A. A. Leiva Enríquez Las proteínas son
Centro Medico Nacional Siglo XXI Hospital de Especialidades. Alergia e Inmunología Clínica
 Centro Medico Nacional Siglo XXI Hospital de Especialidades Complejo Mayor de Histocompatibilidad Dra. Patricia María O Farrill Romanillos R3AIC México, D.F. a 21 de Junio del 2012 Definición Moléculas
Centro Medico Nacional Siglo XXI Hospital de Especialidades Complejo Mayor de Histocompatibilidad Dra. Patricia María O Farrill Romanillos R3AIC México, D.F. a 21 de Junio del 2012 Definición Moléculas
FOSFORILACIÓN OXIDATIVA 2- SÍNTESIS DE ATP.
 FOSFORILACIÓN OXIDATIVA 2- SÍNTESIS DE ATP http://www.thebuddhacenter.org/wordpress/wp-content/uploads/2013/02/mandala-2.jpg MODELO QUIMIOSMÓTICO LA ENERGÍA ELECTROQUÍMICA CREADA POR LA DIFERENCIA EN LA
FOSFORILACIÓN OXIDATIVA 2- SÍNTESIS DE ATP http://www.thebuddhacenter.org/wordpress/wp-content/uploads/2013/02/mandala-2.jpg MODELO QUIMIOSMÓTICO LA ENERGÍA ELECTROQUÍMICA CREADA POR LA DIFERENCIA EN LA
IV electivo. Unidad 1: Integración célula organismo Genes, proteínas y enzimas
 IV electivo Unidad 1: Integración célula organismo Genes, proteínas y enzimas Objetivo Analizar la composición de un gen y la respectiva formación de proteínas Material genético Material genético Cromosoma
IV electivo Unidad 1: Integración célula organismo Genes, proteínas y enzimas Objetivo Analizar la composición de un gen y la respectiva formación de proteínas Material genético Material genético Cromosoma
Tema 10. Regulación de la actividad enzimática
 Tema 10. Regulación de la actividad enzimática Control de la actividad enzimática Regulación por cambios en la concentración de enzima Regulación alostérica Modificaciones covalentes reversibles Activación
Tema 10. Regulación de la actividad enzimática Control de la actividad enzimática Regulación por cambios en la concentración de enzima Regulación alostérica Modificaciones covalentes reversibles Activación
FUNCIONES DE LOS AA???
 1 Unidades básicas para Péptidos Proteínas Precursores de Oxoácidos Aminas biógenas Glucosa Nucleótidos Hemo, creatina FUNCIONES DE LOS AA??? Neurotransmisores Glutamato Aspartato Glicina Molécs. de transporte
1 Unidades básicas para Péptidos Proteínas Precursores de Oxoácidos Aminas biógenas Glucosa Nucleótidos Hemo, creatina FUNCIONES DE LOS AA??? Neurotransmisores Glutamato Aspartato Glicina Molécs. de transporte
Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular
 Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular Aislamiento, análisis y manipulación de ácidos nucleicos Generación de moléculas de DNA recombinante Ingeniería Genética AISLAMIENTO
Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular Aislamiento, análisis y manipulación de ácidos nucleicos Generación de moléculas de DNA recombinante Ingeniería Genética AISLAMIENTO
Tema 11: Proteínas. Estructura primaria. Síntesis de péptidos
 Tema 11: Proteínas. Estructura primaria. Síntesis de péptidos 1 idrólisis química total y análisis cuali-cuantitativo de aminoácidos 2 Determinación de grupos terminales 3 Reducción u oxidación de puentes
Tema 11: Proteínas. Estructura primaria. Síntesis de péptidos 1 idrólisis química total y análisis cuali-cuantitativo de aminoácidos 2 Determinación de grupos terminales 3 Reducción u oxidación de puentes
Introducción I.1. Las proteasas y su clasificación
 I. Introducción I.1. Las proteasas y su clasificación Las enzimas proteolíticas o proteasas catalizan la hidrólisis de los enlaces peptídicos de las proteínas. Una de las características más importantes
I. Introducción I.1. Las proteasas y su clasificación Las enzimas proteolíticas o proteasas catalizan la hidrólisis de los enlaces peptídicos de las proteínas. Una de las características más importantes
IBCM 1 GUIA DE PROBLEMAS DE PROTEINAS
 IBCM 1 1-Complete los esquemas II y III. Además señale: extremo NH2 terminal, extremo 5 del mrna, extremo 3 del trna, sitio P, sitio A, codones y anticodones (complételos con las bases correspondientes)
IBCM 1 1-Complete los esquemas II y III. Además señale: extremo NH2 terminal, extremo 5 del mrna, extremo 3 del trna, sitio P, sitio A, codones y anticodones (complételos con las bases correspondientes)
Tecnología del ADN recombinante.
 Tecnología del ADN recombinante. Genética molecular procariota Principios de regulación. Ejemplos. La célula procariótica es más sencilla Las células de plantas y animales son diferentes La mayoría de
Tecnología del ADN recombinante. Genética molecular procariota Principios de regulación. Ejemplos. La célula procariótica es más sencilla Las células de plantas y animales son diferentes La mayoría de
Etapas de la traducción. Inicio Alargamiento Terminación
 Etapas de la traducción Inicio Alargamiento Terminación En procariontes: la traducción continúa a la transcripción La proteína se sintetiza empezando en el amino terminal Sitios en el ribosoma Centro
Etapas de la traducción Inicio Alargamiento Terminación En procariontes: la traducción continúa a la transcripción La proteína se sintetiza empezando en el amino terminal Sitios en el ribosoma Centro
Estructura celular. Teoría Celular. Cap. 4. Los organismos se componen de una o más células. La célula es la unidad más pequeña de la vida.
 Estructura celular Cap. 4 Teoría Celular Los organismos se componen de una o más células. Procesos metabólicos y de la herencia ocurren dentro de la célula. La célula es la unidad más pequeña de la vida.
Estructura celular Cap. 4 Teoría Celular Los organismos se componen de una o más células. Procesos metabólicos y de la herencia ocurren dentro de la célula. La célula es la unidad más pequeña de la vida.
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA. FACULTAD DE AGRONOMÍA. ÁREA DE CIENCIAS. SUBÁREA DE CIENCIAS QUÍMICAS. BIOQUÍMICA DICIEMBRE 2015.
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA. FACULTAD DE AGRONOMÍA. ÁREA DE CIENCIAS. SUBÁREA DE CIENCIAS QUÍMICAS. BIOQUÍMICA DICIEMBRE 2015. GUÍA DE ESTUDIO EXAMEN PARCIAL 1 Serie 1 Responder a los siguientes
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA. FACULTAD DE AGRONOMÍA. ÁREA DE CIENCIAS. SUBÁREA DE CIENCIAS QUÍMICAS. BIOQUÍMICA DICIEMBRE 2015. GUÍA DE ESTUDIO EXAMEN PARCIAL 1 Serie 1 Responder a los siguientes
Metabolismo de aminoácidos. Marijose Artolozaga Sustacha, MSc
 Metabolismo de aminoácidos Marijose Artolozaga Sustacha, MSc Energía metabólica generada en los tejidos: 90% proviene de la oxidación de carbohidratos y triglicéridos Sólo 10% de la oxidación de las proteínas
Metabolismo de aminoácidos Marijose Artolozaga Sustacha, MSc Energía metabólica generada en los tejidos: 90% proviene de la oxidación de carbohidratos y triglicéridos Sólo 10% de la oxidación de las proteínas
SISTEMA MAYOR DE HISTOCOMPATIBILIDAD II
 Departamento de Especialidades Médicas Facultad de Medicina Universidad de Concepción Cómo Reconocemos lo propio de lo ajeno? SISTEMA MAYOR DE HISTOCOMPATIBILIDAD II Por que rechazamos un órgano no compatible?
Departamento de Especialidades Médicas Facultad de Medicina Universidad de Concepción Cómo Reconocemos lo propio de lo ajeno? SISTEMA MAYOR DE HISTOCOMPATIBILIDAD II Por que rechazamos un órgano no compatible?
Aminoácidos Pi Primera Parte
 Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
ENZIMAS. Kuhne en el año de 1876 les llamó enzima a los catalizadores que producían
 ENZIMAS Dr. Santiago René Anzaldúa Arce. Kuhne en el año de 1876 les llamó enzima a los catalizadores que producían fermentaciones de diversos compuestos, La palabra enzima significa en la levadura, pues
ENZIMAS Dr. Santiago René Anzaldúa Arce. Kuhne en el año de 1876 les llamó enzima a los catalizadores que producían fermentaciones de diversos compuestos, La palabra enzima significa en la levadura, pues
Plegamiento Proteico
 Plegamiento Proteico A medida que la cadena polipeptídica va siendo sintetizada se produce el plegamiento de la cadena naciente. Si se calculan la cantidad de formas que podría adquirir una proteína en
Plegamiento Proteico A medida que la cadena polipeptídica va siendo sintetizada se produce el plegamiento de la cadena naciente. Si se calculan la cantidad de formas que podría adquirir una proteína en
El flujo de la información genética: TRADUCCIÓN
 El flujo de la información genética: TRADUCCIÓN SÍNTESIS DE PROTEÍNAS Dirigida por un molde de mrna Tres fases: iniciación, elongación de la cadena y terminación Fase preliminar: formación de un precursor
El flujo de la información genética: TRADUCCIÓN SÍNTESIS DE PROTEÍNAS Dirigida por un molde de mrna Tres fases: iniciación, elongación de la cadena y terminación Fase preliminar: formación de un precursor
2. ESTRUCTURA Y PROPIEDADES DE PROTEÍNAS. Purificación de LDH de músculo de Gallus gallus
 2. ESTRUCTURA Y PROPIEDADES DE PROTEÍNAS Purificación de LDH de músculo de Gallus gallus TRIS 2-amino-2-hidroximetilpropano-1,3-diol pk a = 8.07 Buffer efectivo en un rango de ph= 7.07 y 9.07 PMSF Fluoruro
2. ESTRUCTURA Y PROPIEDADES DE PROTEÍNAS Purificación de LDH de músculo de Gallus gallus TRIS 2-amino-2-hidroximetilpropano-1,3-diol pk a = 8.07 Buffer efectivo en un rango de ph= 7.07 y 9.07 PMSF Fluoruro
CELUL U A E UC U A C RIO I TA T NUCLEO
 CELULA EUCARIOTA NUCLEO 3. Responda las siguientes preguntas: a) Enumere las funciones de la membrana plasmática. b) Qué tipo de proteínas se diferencian en la membrana de acuerdo con el modelo de "mosaico
CELULA EUCARIOTA NUCLEO 3. Responda las siguientes preguntas: a) Enumere las funciones de la membrana plasmática. b) Qué tipo de proteínas se diferencian en la membrana de acuerdo con el modelo de "mosaico
2. ESTRUCTURA Y PROPIEDADES DE PROTEÍNAS. 25 Agosto, 2009
 2. ESTRUCTURA Y PROPIEDADES DE PROTEÍNAS. 25 Agosto, 2009 El genoma haploide de un humano contiene 20,000-25,000 genes que codifican a proteínas. Transportadores Enzimas Receptores Estructurales Hormonas
2. ESTRUCTURA Y PROPIEDADES DE PROTEÍNAS. 25 Agosto, 2009 El genoma haploide de un humano contiene 20,000-25,000 genes que codifican a proteínas. Transportadores Enzimas Receptores Estructurales Hormonas
Genes. Estructura. Promotores. Intrones y exones. Pseudogenes. Genética 1 er Curso. Facultad de Medicina TEMA 0-2
 Facultad de Medicina Genética 1 er Curso TEMA 0-2 EXPRESIÓN GÉNICA:FLUJO DE INFORMACIÓN GENÉTICA Genes. El código genético. Dogma central de la Biología Molecular.. Genes Apartados Estructura Promotores
Facultad de Medicina Genética 1 er Curso TEMA 0-2 EXPRESIÓN GÉNICA:FLUJO DE INFORMACIÓN GENÉTICA Genes. El código genético. Dogma central de la Biología Molecular.. Genes Apartados Estructura Promotores
Dra. Carmen Aída Martínez
 Dra. Carmen Aída Martínez Es la síntesis de proteínas mediada por un molde da ARNm. Proteínas : Cadena de aminoácidos Enzimas Estructurales Señalización Transporte Almacenamiento Dirección de lectura del
Dra. Carmen Aída Martínez Es la síntesis de proteínas mediada por un molde da ARNm. Proteínas : Cadena de aminoácidos Enzimas Estructurales Señalización Transporte Almacenamiento Dirección de lectura del
Cómo se logra esa diversidad funcional? estructuras tridimensionales posibles. diversidad de secuencias primarias
 Proteínas Proteínas cumplen diversas funciones en sistemas biológicos: enzimática (enzimas intervienen en todos procesos biológicos y químicos en la célula) estructural (colágeno, queratina, elastina)
Proteínas Proteínas cumplen diversas funciones en sistemas biológicos: enzimática (enzimas intervienen en todos procesos biológicos y químicos en la célula) estructural (colágeno, queratina, elastina)
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo
 Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
Reacciones Bi-Bi. Mecanismos Secuenciales. a.1 Ordenado (riguroso orden de adición) EA EAB EQ EQP
 Reacciones Bi-Bi Mecanismos Secuenciales a.1 Ordenado (riguroso orden de adición) E EA EAB EQ EQP Dehidrogenasas, A es NAD(P) y Q es NAD(P)H + H + (reactantes directores u obligatorios) Reacciones Bi-Bi
Reacciones Bi-Bi Mecanismos Secuenciales a.1 Ordenado (riguroso orden de adición) E EA EAB EQ EQP Dehidrogenasas, A es NAD(P) y Q es NAD(P)H + H + (reactantes directores u obligatorios) Reacciones Bi-Bi
