Comunicación Dirigida a Profesionales Sanitarios. Madrid, 13 de Mayo 2013
|
|
|
- Ana Ramos Lucero
- hace 5 años
- Vistas:
Transcripción
1 Madrid, 13 de Mayo 2013 Comunicación Dirigida a Profesionales Sanitarios Información importante respecto a las restricciones de utilización de ranelato de estroncio (Protelos /Osseor ) tras el análisis de nuevos datos que han mostrado un aumento del riesgo de infarto de miocardio Estimado profesional sanitario, Esta carta es para informarle acerca de la restricción de indicaciones, así como de las nuevas contraindicaciones y advertencias que han sido establecidas para el ranelato de estroncio (Protelos/Osseor). La adopción de estas medidas tiene como finalidad reducir el riesgo de acontecimientos adversos cardiacos que se han observado tras realizar un análisis rutinario reciente de los datos de seguridad procedentes de pacientes en tratamiento con Protelos/Osseor. La Agencia Europea del Medicamento realizará a lo largo de los próximos meses una evaluación completa de los beneficios y riesgos de Protelos/Osseor en las indicaciones autorizadas. Cualquier conclusión adicional que resulte de esta evaluación será puntualmente puesta en conocimiento de los profesionales sanitarios. Resumen: Los datos disponibles de ensayos clínicos randomizados sobre la seguridad cardiaca de Protelos/Osseor en el tratamiento de la osteoporosis han mostrado un incremento del riesgo de infarto de miocardio sin que se observe riesgo de mortalidad. El uso de Protelos/Osseor se ha limitado al tratamiento de osteoporosis severa o en mujeres postmenopáusicas con alto riesgo de fracturas o en hombres con riesgo elevado de fractura. El tratamiento con ranelato de estroncio sólo debe ser iniciado por un médico con experiencia en el tratamiento de la osteoporosis. La decisión de prescribir este medicamento deberá adoptarse sólo después de haber realizado una valoración individual de los riesgos globales de cada paciente. Protelos/Osseor no debe utilizarse en pacientes que tengan o hayan tenido cardiopatía isquémica, enfermedad arterial periférica y/o enfermedad cerebrovascular, así como en pacientes con hipertensión arterial no controlada. Adicionalmente: o Se aconseja a los prescriptores que, antes de comenzar el tratamiento y después a intervalos regulares, evalúen el riesgo del paciente de desarrollar una enfermedad cardiovascular. o Los pacientes que presentan factores de riesgo cardiovascular (ej.: hipertensión, hiperlipidemia, diabetes mellitus, fumadores) deben ser tratados con ranelato de estroncio únicamente después de haber realizado una cuidadosa valoración individualizada. o El tratamiento con Protelos /Osseor debe interrumpirse si el paciente desarrolla cardiopatía isquémica, enfermedad arterial periférica, enfermedad cerebrovascular o en casos de hipertensión arterial no controlada. El contenido de esta carta ha sido acordado con la Agencia Europea de Medicamentos (EMA) y con la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)
2 Información adicional sobre seguridad: Una revisión reciente de todos los datos de seguridad disponibles para ranelato de estroncio, ha suscitado dudas sobre su seguridad cardiovascular más allá del riesgo ya conocido de tromboembolismo venoso. El análisis de los datos procedentes de ensayos clínicos randomizados ha identificado un incremento de riesgo de trastornos cardiacos graves, incluyendo infarto de miocardio (IM) sin que se haya observado riesgo de mortalidad. Esta conclusión se basa fundamentalmente en datos agrupados de estudios controlados con placebo en pacientes postmenopáusicas con osteoporosis (3803 pacientes tratadas con ranelato de estroncio, correspondientes a pacienteaños de tratamiento, y 3769 pacientes tratadas con placebo, correspondientes a pacienteaños de tratamiento). En este conjunto de datos, se observó un aumento significativo del riesgo de infarto de miocardio en las pacientes tratadas con ranelato de estroncio en comparación con aquellas que recibieron placebo (1,7% versus 1,1%), con un riesgo relativo de 1,6 (95% CI = [1,07 ; 2,38]). Asimismo se ha observado una diferencia en el número de acontecimientos cardiacos graves, incluyendo infarto de miocardio, en dos estudios realizados con ranelato de estroncio (un estudio fue realizado en hombres con osteoporosis y el otro en artrosis). Adicionalmente, y teniendo en cuenta el potencial trombótico del ranelato de estroncio, se considera que puede existir un posible mecanismo explicativo para el incremento del riesgo de trastornos cardiacos graves, incluyendo IM. Para minimizar el riesgo de IM la información del producto ha sido actualizada, tal y como se ha detallado anteriormente, incluyendo la restricción de las indicaciones y la adición de contraindicaciones y advertencias, así como recomendando que los prescriptores basen su decisión de utilizar ranelato de estroncio después de haber realizado una valoración individual de los riesgos globales de cada paciente. Notificación de sospechas de reacciones adversas Recuerde que debe notificar cualquier sospecha de reacción adversa tras el uso de Protelos/Osseor al Sistema Español de Farmacovigilancia a través del Centro Autonómico de Farmacovigilancia correspondiente mediante el sistema de Tarjeta Amarilla. Estas notificaciones también podrán realizarse online en la página web de la AEMPS a través del siguiente enlace: Adicionalmente, también puede notificarlas al Departamento de Farmacovigilancia de Laboratorios Servier S.L. y de Laboratorios Farmacéuticos Rovi, S.A. (ver datos de contacto a continuación). Datos de contacto de la Compañía Farmacéutica: En caso de duda, o de requerir información adicional, puede ponerse en contacto con: Laboratorios Servier S.L. Regina Ibañez Responsable de Farmacovigilancia Avda. de los Madroños, Madrid Tel / Fax: / regina.ibanez@es.netgrs.com Muy atentamente, Laboratorios Farmacéuticos Rovi, S.A. Carola Gómez de la Bárcena Responsable de Farmacovigilancia Calle Julián Camarillo, Madrid Tel / Fax: / farmacovigilancia@rovi.es Olivier Vilagines Director General Laboratorios Servier S.L. Juan LópezBelmonte Consejero Delegado Laboratorios Farmacéuticos Rovi, S.A.
3 Anexo: secciones relevantes de la Ficha Técnica que han sido revisadas (cambios resaltados) 4.1 Indicaciones terapéuticas Tratamiento de la osteoporosis severa en mujeres posmenopáusicas con alto riesgo de fracturas a fin de reducir el riesgo de fracturas vertebrales y de cadera (ver sección 5.1). Tratamiento de la osteoporosis severa en hombres adultos con riesgo elevado de fractura (ver sección 5.1). La decisión de prescribir ranelato de estroncio debe estar basada en la valoración individual de los riesgos globales de cada paciente (ver sección 4.3 y 4.4). 4.2 Posología y forma de administración [ ] El tratamiento sólo debe ser iniciado por un médico con experiencia en el tratamiento de la osteoporosis. 4.3 Contraindicaciones Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. Episodios de tromboembolismo venoso (TEV) actuales o previos, incluyendo trombosis venosa profunda y embolismo pulmonar. Inmovilización permanente o temporal debida p. ej. a recuperación postquirúrgica o reposo prolongado en cama. Episodios actuales o antecedentes de cardiopatía isquémica, enfermedad arterial periférica y/o enfermedad cerebrovascular. Hipertensión arterial no controlada. 4.4 Advertencias y precauciones especiales de empleo [ ] Cardiopatía isquémica En estudios agrupados randomizados controlados con placebo en pacientes postmenopáusicas con osteoporosis, se ha observado un aumento significativo de infarto de miocardio en las pacientes tratadas con PROTELOS/OSSEOR en comparación con placebo (ver sección 4.8). Los pacientes deben ser evaluados con respecto al riesgo cardiovascular, antes de comenzar el tratamiento y después a intervalos regulares. Los pacientes con factores de riesgo significativos de eventos cardiovasculares (ej.: hipertensión, hiperlipidemia, diabetes mellitus, fumadores) deben ser tratados con ranelato de estroncio únicamente tras una cuidadosa consideración (ver sección 4.3 y 4.8). El tratamiento debe interrumpirse si el paciente desarrolla cardiopatía isquémica, enfermedad arterial periférica, enfermedad cerebrovascular o si la hipertensión arterial no está controlada (ver sección 4.3). 4.8 Reacciones adversas [ ] En estudios agrupados randomizados controlados con placebo en pacientes postmenopáusicas con osteoporosis, se ha observado un aumento significativo de infarto de miocardio en las pacientes tratadas con PROTELOS/OSSEOR en comparación con placebo (1,7% versus 1,1%), con un riesgo relativo de 1,6 (95% CI = [1,07 ; 2,38]).
4 Tabla de reacciones adversas Las siguientes reacciones adversas han sido notificadas durante los ensayos clínicos y/o durante la utilización postcomercialización con Ranelato de estroncio. Las reacciones adversas, definidas como los acontecimientos adversos al menos posiblemente atribuibles al ranelato de estroncio, que sucedieron en los estudios de fase III se enumeran a continuación empleando la convención siguiente (frecuencia frente al placebo): muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/ a <1/1.000); muy raras (<1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Grupo Sistémico Categoría de frecuencias Reacciones adversas Porcentaje de Pacientes que experimentan la reacción adversa Tratamiento Ranelato de estroncio (n=3352) Placebo (n=3317) Trastornos psiquiátricos Estado de confusión Insomnio Trastornos del sistema nervioso Cefalea 3,3% 2,7% Trastornos de la consciencia 2,6% 2,1% Pérdida de memoria 2,5% 2,0% Poco frecuentes: Crisis convulsivas Parestesia Mareo Vértigo 0,4% 0,1% Trastornos cardiacos Frecuentes d : Infarto de miocardio 1,7% 1,1% Trastornos vasculares Tromboembolia venosa (TEV) 2,7% 1,9% Trastornos respiratorios, torácicos y mediastínicos Hiperreactividad bronquial Trastornos gastrointestinales Náuseas 7,1% 4,6% Diarrea 7,0% 5,0% Heces blandas 1,0% 0,2%
5 Vómitos Dolor abdominal Irritación de la mucosa oral (estomatitis y/o úlceras bucales) Reflujo gastroesofágico Dispepsia Estreñimiento Flatulencia Xerostomía Trastornos hepatobiliares Aumento de las transaminasas séricas (asociado con reacciones de hipersensibilidad cutánea) Hepatitis Trastornos de la piel y del tejido subcutáneo Dermatitis 2,3% 2,0% Eccema 1,8% 1,4% Raras: DRESS (ver sección 4.4) Muy raras: Reacciones adversas cutáneas graves (SCARs): síndrome de Stevens Johnson y necrólisis epidérmica tóxica* (ver sección 4.4) Reacciones de hipersensibilidad cutánea (erupción cutánea, prurito, urticaria, angioedema) Alopecia Trastornos musculoesqueléticos y del tejido conjuntivo Artromialgias (calambres musculares, mialgias, dolores óseos, artralgias y dolores en las extremidades) Trastornos generales y alteraciones en el lugar de administración Edema periférico Fiebre (asociada con reacciones de hipersensibilidad cutánea) Malestar general Trastornos de la sangre y del sistema linfático Insuficiencia de la médula ósea Eosinofilia (asociada con reacciones de hipersensibilidad cutánea) Linfadenopatía (asociada con reacciones de hipersensibilidad cutánea) Exploraciones complementarias Aumento de la Creatinafosfocinasa sanguínea (CPK) b 1,4% 0,6% a. Experiencia postcomercialización
6 b. c. d. Fracción musculoesquelética >3 veces el límite superior de la normalidad. En la mayoría de los casos, estos valores revirtieron espontáneamente a la normalidad sin modificar el tratamiento. * Notificadas como raras en los países asiáticos En estudios agrupados controlados con placebo en pacientes postmenopáusicas con osteoporosis, pacientes tratadas con ranelato de estroncio(n=3803, pacienteaños de tratamiento) comparado con placebo (N=3769, pacienteaños de tratamiento).
La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos.
 Pág. 1 de 5 La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad y eficacia de los medicamentos basados
Pág. 1 de 5 La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad y eficacia de los medicamentos basados
3. Cómo tomar PROTOS 4. Posibles efectos adversos 5. Conservación de PROTOS 6. Información adicional
 INFORMACIÓN PARA EL PACIENTE PROTOS RANELATO DE ESTRONCIO Granulado para Suspensión Oral Venta bajo receta Industria Francesa Composición de PROTOS: Cada sobre contiene 2 g de ranelato de estroncio. Excipientes:
INFORMACIÓN PARA EL PACIENTE PROTOS RANELATO DE ESTRONCIO Granulado para Suspensión Oral Venta bajo receta Industria Francesa Composición de PROTOS: Cada sobre contiene 2 g de ranelato de estroncio. Excipientes:
27 de Septiembre de Estimado profesional sanitario, Resumen
 Información para Profesionales Sanitarios sobre la restricción en las indicaciones de productos que contienen Trimetazidina (Idaptan, Trimetazidina EFG). Estimado profesional sanitario, Resumen 27 de Septiembre
Información para Profesionales Sanitarios sobre la restricción en las indicaciones de productos que contienen Trimetazidina (Idaptan, Trimetazidina EFG). Estimado profesional sanitario, Resumen 27 de Septiembre
Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana
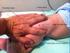 Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana Desde la aparición de dos casos de adolescentes que experimentaron una posible reacción
Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana Desde la aparición de dos casos de adolescentes que experimentaron una posible reacción
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
FOLLETO DE INFORMACIÓN AL PROFESIONAL
 PROTELOS GRANULADO PARA SUS`PENSIÓN ORAL 2g EN SOBRES Reg. ISP Nº F-15570 FOLLETO DE INFORMACIÓN AL PROFESIONAL 1. a a 2,4 DE basado en NHANES III) y una edad 74 años (n=1977, es decir, 40% de la población
PROTELOS GRANULADO PARA SUS`PENSIÓN ORAL 2g EN SOBRES Reg. ISP Nº F-15570 FOLLETO DE INFORMACIÓN AL PROFESIONAL 1. a a 2,4 DE basado en NHANES III) y una edad 74 años (n=1977, es decir, 40% de la población
Prospecto: información para el paciente. Carnicor 200 mg/ml solución inyectable L-carnitina
 Prospecto: información para el paciente Carnicor 200 mg/ml solución inyectable L-carnitina Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante
Prospecto: información para el paciente Carnicor 200 mg/ml solución inyectable L-carnitina Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante
Comunicación dirigida a profesionales sanitarios
 Julio 2013 Comunicación dirigida a profesionales sanitarios Diclofenaco nuevas contraindicaciones y advertencias tras la revisión europea de su seguridad cardiovascular Estimado profesional sanitario,
Julio 2013 Comunicación dirigida a profesionales sanitarios Diclofenaco nuevas contraindicaciones y advertencias tras la revisión europea de su seguridad cardiovascular Estimado profesional sanitario,
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
El tratamiento sólo debe ser iniciado por un médico con experiencia en el tratamiento de la osteoporosis.
 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
La Ciproterona acetato- Etinilestradiol como principios activos a dosis fija en Anticonceptivos orales y riesgo de Eventos Tromboembólicos.
 Pág. 1 de 6 La Ciproterona acetato- Etinilestradiol como principios activos a dosis fija en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad
Pág. 1 de 6 La Ciproterona acetato- Etinilestradiol como principios activos a dosis fija en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad
Comunicación dirigida a los profesionales sanitarios
 Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
FICHA TÉCNICA. Adultos y adolescentes mayores de 12 años: de 250 a 500 mg al día distribuidos en dos tomas (mañana y noche)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TÉCNICA. Pacientes de edad avanzada No se requiere ajuste de dosis para el tratamiento de pacientes de edad avanzada.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO GLUFAN 625 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido contiene 750 mg de hidrocloruro de glucosamina, equivalente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO GLUFAN 625 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido contiene 750 mg de hidrocloruro de glucosamina, equivalente
Comunicación dirigida a Profesionales Sanitarios
 Comunicación dirigida a Profesionales Sanitarios Julio de 2015 XGEVA (denosumab): medidas establecidas para minimizar el riesgo de osteonecrosis mandibular Estimado Profesional Sanitario, Amgen S.A. de
Comunicación dirigida a Profesionales Sanitarios Julio de 2015 XGEVA (denosumab): medidas establecidas para minimizar el riesgo de osteonecrosis mandibular Estimado Profesional Sanitario, Amgen S.A. de
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Otilonio Qualigen 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 40 mg de otilonio bromuro. Para
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Otilonio Qualigen 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 40 mg de otilonio bromuro. Para
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
PROTOS RANELATO DE ESTRONCIO
 PROTOS RANELATO DE ESTRONCIO Granulado para Suspensión Oral Venta bajo receta Industria Francesa Composición Cada sobre contiene: Ranelato de estroncio 2 g. Excipientes: Aspartamo (E951), maltodextrina,
PROTOS RANELATO DE ESTRONCIO Granulado para Suspensión Oral Venta bajo receta Industria Francesa Composición Cada sobre contiene: Ranelato de estroncio 2 g. Excipientes: Aspartamo (E951), maltodextrina,
DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA Comunicación sobre cambios en la información de seguridad de Sibutramina para profesionales sanitarios Mayo de 2010 NOTA INFORMATIVA
DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA Comunicación sobre cambios en la información de seguridad de Sibutramina para profesionales sanitarios Mayo de 2010 NOTA INFORMATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. 2.1 Descripción general
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Las cápsulas son ovales, con el cuerpo y la tapa de color blanco.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Las cápsulas son ovales, con el cuerpo y la tapa de color blanco.
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea
 FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Entero-Silicona 9 mg/ml emulsión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de emulsión oral contiene:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Entero-Silicona 9 mg/ml emulsión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de emulsión oral contiene:
3. PROPIEDADES FARMACOLOGICAS Grupo farmacoterapéutico: Simpaticomiméticos usados como descongestivos. Código ATC: S01GA
 1. NOMBRE DEL PRINCIPIO ACTIVO (DCI) NAFAZOLINA CLORHIDRATO 2. VIA DE ADMINISTRACION TOPICO NASAL 3. PROPIEDADES FARMACOLOGICAS Grupo farmacoterapéutico: Simpaticomiméticos usados como descongestivos.
1. NOMBRE DEL PRINCIPIO ACTIVO (DCI) NAFAZOLINA CLORHIDRATO 2. VIA DE ADMINISTRACION TOPICO NASAL 3. PROPIEDADES FARMACOLOGICAS Grupo farmacoterapéutico: Simpaticomiméticos usados como descongestivos.
SISTEMA NACIONAL DE REGISTRO SANITARIO DE PRODUCTOS FARMACEUTICOS CERTIFICADO DE CONDICIONES DE COMERCIALIZACION
 SISTEMA NACIONAL DE REGISTRO SANITARIO DE PRODUCTOS FARMACEUTICOS CERTIFICADO DE CONDICIONES DE COMERCIALIZACION El Instituto Nacional de Higiene Rafael Rangel de conformidad con lo previsto en los artículos
SISTEMA NACIONAL DE REGISTRO SANITARIO DE PRODUCTOS FARMACEUTICOS CERTIFICADO DE CONDICIONES DE COMERCIALIZACION El Instituto Nacional de Higiene Rafael Rangel de conformidad con lo previsto en los artículos
TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO
 TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO Estimado profesional sanitario, Febrero 2014 Teofarma S.r.l,
TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO Estimado profesional sanitario, Febrero 2014 Teofarma S.r.l,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Saccharomyces boulardii 250 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Saccharomyces boulardii 250 mg Excipientes con efecto conocido:
Valdoxan /Thymanax (agomelatina)
 Valdoxan /Thymanax (agomelatina) Información de seguridad para profesionales sanitarios Recomendaciones sobre cómo realizar el control de la función hepática del paciente Información sobre prevención de
Valdoxan /Thymanax (agomelatina) Información de seguridad para profesionales sanitarios Recomendaciones sobre cómo realizar el control de la función hepática del paciente Información sobre prevención de
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Ultra Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Ultra Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TÉCNICA. No exceder la dosis máxima de 480 mg de simeticona (4 comprimidos masticables) al día.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA. No exceder la dosis máxima de 480 mg de simeticona (4 comprimidos masticables) al día.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA. 1. DENOMINACIÓN DEL MEDICAMENTO: GLUCOSAMINA GINELADIUS 625 mg comprimidos recubiertos con película
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO: GLUCOSAMINA GINELADIUS 625 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido contiene 750 mg de Hidrocloruro
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO: GLUCOSAMINA GINELADIUS 625 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido contiene 750 mg de Hidrocloruro
1. QUÉ ES CAPROAMIN FIDES
 Prospecto: Información para el usuario CAPROAMIN FIDES 4g solución inyectable Acido aminocaproico Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. Conserve este prospecto, ya
Prospecto: Información para el usuario CAPROAMIN FIDES 4g solución inyectable Acido aminocaproico Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. Conserve este prospecto, ya
FICHA TÉCNICA. 250 mg
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii CNCM I-745 250 mg Excipientes
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii CNCM I-745 250 mg Excipientes
FICHA TÉCNICA. Polisacárido Vi de Salmonella typhi (cepa Ty2)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
HIPERLIPEN. Ciprofibrato. Tableta. 100,0 mg
 RESUMEN DE CARACTERISTICAS DE PRODUCTO Nombre del producto: HIPERLIPEN (Ciprofibrato) Forma farmacéutica: Fortaleza: Tableta 100,0 mg Presentación: Titular del Registro Sanitario, país: Fabricante, país:
RESUMEN DE CARACTERISTICAS DE PRODUCTO Nombre del producto: HIPERLIPEN (Ciprofibrato) Forma farmacéutica: Fortaleza: Tableta 100,0 mg Presentación: Titular del Registro Sanitario, país: Fabricante, país:
* cultivados en huevos de gallina embrionados procedentes de pollos sanos ** hemaglutinina
 1. NOMBRE DEL MEDICAMENTO LEVRISON, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe fraccionados*,
1. NOMBRE DEL MEDICAMENTO LEVRISON, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe fraccionados*,
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol.
 1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada película bucodispersable contiene 16 mg de extracto (como extracto seco) de hoja
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada película bucodispersable contiene 16 mg de extracto (como extracto seco) de hoja
PROSPECTO : INFORMACIÓN PARA EL USUARIO. Famotidina ratiopharm 40 mg comprimidos EFG Famotidina
 PROSPECTO : INFORMACIÓN PARA EL USUARIO Famotidina ratiopharm 40 mg comprimidos EFG Famotidina Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya
PROSPECTO : INFORMACIÓN PARA EL USUARIO Famotidina ratiopharm 40 mg comprimidos EFG Famotidina Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya
INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS
 Stelara (ustekinumab) INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS Por favor, además de la ficha técnica del producto (FT) lea detenidamente esta guía. Por favor, informe a sus pacientes sobre
Stelara (ustekinumab) INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS Por favor, además de la ficha técnica del producto (FT) lea detenidamente esta guía. Por favor, informe a sus pacientes sobre
ANEXO III ENMIENDA DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y PROSPECTO
 ANEXO III ENMIENDA DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y PROSPECTO 1 ENMIENDA A INCLUIR EN LAS SECCIONES RELEVANTES DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL
ANEXO III ENMIENDA DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y PROSPECTO 1 ENMIENDA A INCLUIR EN LAS SECCIONES RELEVANTES DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. FABROVEN 150 mg/150 mg/100 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1 NOMBRE DEL MEDICAMENTO FABROVEN 150 mg/150 mg/100 mg cápsulas duras 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una cápsula dura contiene: Extracto seco de Ruscus valorado en heterósidos esterólicos
FICHA TÉCNICA 1 NOMBRE DEL MEDICAMENTO FABROVEN 150 mg/150 mg/100 mg cápsulas duras 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una cápsula dura contiene: Extracto seco de Ruscus valorado en heterósidos esterólicos
Anexo III. Modificaciones a las secciones relevantes de ficha técnica y prospecto
 Anexo III Modificaciones a las secciones relevantes de ficha técnica y prospecto Nota: La ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados posteriormente
Anexo III Modificaciones a las secciones relevantes de ficha técnica y prospecto Nota: La ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados posteriormente
Excipientes con efecto conocido: Lactosa monohidrato 6,5 mg Sacarosa 92,30 mg Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Saccharomyces boulardii 50 mg. Excipientes con efecto conocido: Lactosa
1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Saccharomyces boulardii 50 mg. Excipientes con efecto conocido: Lactosa
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS INZITAN (DEXAMETASONA, TIAMINA, CIANOCOBALAMINA, LIDOCAÍNA): SUSPENSIÓN DE COMERCIALIZACIÓN Fecha de publicación: 30 de noviembre
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS INZITAN (DEXAMETASONA, TIAMINA, CIANOCOBALAMINA, LIDOCAÍNA): SUSPENSIÓN DE COMERCIALIZACIÓN Fecha de publicación: 30 de noviembre
Prospecto: información para el usuario
 Prospecto: información para el usuario Sugiran 20 microgramos polvo para solución para perfusión Alprostadil Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. Conserve este prospecto,
Prospecto: información para el usuario Sugiran 20 microgramos polvo para solución para perfusión Alprostadil Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. Conserve este prospecto,
Anexo III Modificaciones a las secciones relevantes de la Ficha Técnica o Resumen de las características del producto y Prospecto
 Anexo III Modificaciones a las secciones relevantes de la Ficha Técnica o Resumen de las características del producto y Prospecto 34/42 A. FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 4.1.
Anexo III Modificaciones a las secciones relevantes de la Ficha Técnica o Resumen de las características del producto y Prospecto 34/42 A. FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 4.1.
FICHA TÉCNICA. Polisacárido capsular Vi purificado de Salmonella typhi (cepa Ty2) microgramos
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
FICHA TÉCNICA. Cada cápsula contiene 625 mg de glucosamina (equivalente a 750 mg de hidrocloruro de glucosamina).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Duartron 625 mg, cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene 625 mg de glucosamina (equivalente a 750 mg de hidrocloruro de glucosamina).
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Duartron 625 mg, cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene 625 mg de glucosamina (equivalente a 750 mg de hidrocloruro de glucosamina).
FICHA TÉCNICA. Tratamiento de los síntomas relacionados con la insuficiencia venosa leve en adultos.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DAFLON 500 mg comprimidos recubiertos con película. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principios Activos: Fracción flavónica purificada, bajo forma micronizada
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DAFLON 500 mg comprimidos recubiertos con película. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principios Activos: Fracción flavónica purificada, bajo forma micronizada
Prospecto: información para el usuario. DEFLAZACORT ALTER 30 mg comprimidos EFG
 Prospecto: información para el usuario DEFLAZACORT ALTER 30 mg comprimidos EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto. Puede tener que volver
Prospecto: información para el usuario DEFLAZACORT ALTER 30 mg comprimidos EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto. Puede tener que volver
PROSPECTO: INFORMACIÓN PARA EL USUARIO. ATERINA 15 mg cápsulas blandas Sulodexida
 PROSPECTO: INFORMACIÓN PARA EL USUARIO ATERINA 15 mg cápsulas blandas Sulodexida Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
PROSPECTO: INFORMACIÓN PARA EL USUARIO ATERINA 15 mg cápsulas blandas Sulodexida Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
Manual CTO. Oposiciones de Enfermería. Temario específico. Comunidad Autónoma de Castilla-La Mancha Temas
 Manual CTO Oposiciones de Enfermería Temario específico Comunidad Autónoma de Castilla-La Mancha 36-50 Temas NOTA La medicina es una ciencia sometida a un cambio constante. A medida que la investigación
Manual CTO Oposiciones de Enfermería Temario específico Comunidad Autónoma de Castilla-La Mancha 36-50 Temas NOTA La medicina es una ciencia sometida a un cambio constante. A medida que la investigación
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Descripción general
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Descripción general Las cápsulas son ovales, con el cuerpo y la tapa de color blanco.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Descripción general Las cápsulas son ovales, con el cuerpo y la tapa de color blanco.
FICHA TÉCNICA. Afecciones agudas y crónicas de las vías respiratorias que requieran tratamiento secretolítico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUXIMED JARABE EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 5 ml de jarabe contiene 15 mg de ambroxol (hidrocloruro). Excipientes: ácido benzoico (E210) 10 mg,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUXIMED JARABE EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 5 ml de jarabe contiene 15 mg de ambroxol (hidrocloruro). Excipientes: ácido benzoico (E210) 10 mg,
Prospecto: información para el usuario
 Prospecto: información para el usuario Doxium Fuerte 500 mg cápsulas duras Dobesilato de calcio Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario Doxium Fuerte 500 mg cápsulas duras Dobesilato de calcio Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
SISTEMA NACIONAL DE REGISTRO SANITARIO DE PRODUCTOS FARMACEUTICOS CERTIFICADO DE CONDICIONES DE COMERCIALIZACION
 SISTEMA NACIONAL DE REGISTRO SANITARIO DE PRODUCTOS FARMACEUTICOS CERTIFICADO DE CONDICIONES DE COMERCIALIZACION El Instituto Nacional de Higiene Rafael Rangel de conformidad con lo previsto en los artículos
SISTEMA NACIONAL DE REGISTRO SANITARIO DE PRODUCTOS FARMACEUTICOS CERTIFICADO DE CONDICIONES DE COMERCIALIZACION El Instituto Nacional de Higiene Rafael Rangel de conformidad con lo previsto en los artículos
FICHA TÉCNICA. Posología Administrar cuando sea necesario, o según criterio médico. Como norma general administrar:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MICRALAX Citrato/Lauril sulfoacetato 450 mg/ 45 mg solución rectal Citrato de sodio / Lauril sulfoacetato de sodio 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MICRALAX Citrato/Lauril sulfoacetato 450 mg/ 45 mg solución rectal Citrato de sodio / Lauril sulfoacetato de sodio 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por
ANEXO III Modificaciones a las secciones relevantes de Ficha Técnica y Prospecto
 ANEXO III Modificaciones a las secciones relevantes de Ficha Técnica y Prospecto Nota: Si procede, la ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados
ANEXO III Modificaciones a las secciones relevantes de Ficha Técnica y Prospecto Nota: Si procede, la ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados
FICHA TÉCNICA. Excipientes con efecto conocido: Cada pastilla para chupar contiene 1,37 g de sorbitol (E420) y 6,3 mg de sacarosa.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lizipadol 20 mg pastillas para chupar 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una pastilla para chupar contiene 20 mg de ambroxol hidrocloruro. Excipientes con
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lizipadol 20 mg pastillas para chupar 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una pastilla para chupar contiene 20 mg de ambroxol hidrocloruro. Excipientes con
FICHA TÉCNICA. 250 mg. Cápsulas duras Las cápsulas son ovales, con el cuerpo y la tapa de color blanco
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Saccharomyces boulardii CNCM I-745 Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Saccharomyces boulardii CNCM I-745 Excipientes con efecto conocido:
PROSPECTO: INFORMACIÓN PARA EL USUARIO. ATERINA 15 mg cápsulas blandas Sulodexida
 PROSPECTO: INFORMACIÓN PARA EL USUARIO ATERINA 15 mg cápsulas blandas Sulodexida Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
PROSPECTO: INFORMACIÓN PARA EL USUARIO ATERINA 15 mg cápsulas blandas Sulodexida Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
FICHA TÉCNICA. Solución oral. Solución oral de color rojo trasparente y olor a frambuesa característico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FRIMUCE 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de solución oral contiene: Carbocisteína 750 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FRIMUCE 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de solución oral contiene: Carbocisteína 750 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. CARTISORB 1500 mg polvo para solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO CARTISORB 1500 mg polvo para solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.884 mg de sulfato
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO CARTISORB 1500 mg polvo para solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.884 mg de sulfato
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/7 1. NOMBRE DEL MEDICAMENTO CODEROL 1.500 mg polvo para solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1.500 mg
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/7 1. NOMBRE DEL MEDICAMENTO CODEROL 1.500 mg polvo para solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1.500 mg
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. ETAMBUTOL 400 mg (Etambutol ) Tableta revestida. 400,0 mg
 Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Titular del Registro Sanitario, país: Fabricante, país: ETAMBUTOL 400 mg (Etambutol ) Tableta
Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Titular del Registro Sanitario, país: Fabricante, país: ETAMBUTOL 400 mg (Etambutol ) Tableta
Prospecto: Información para el usuario. Cetirizina Sandoz 10 mg/ml gotas orales en solución EFG
 Prospecto: Información para el usuario Cetirizina Sandoz 10 mg/ml gotas orales en solución EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: Información para el usuario Cetirizina Sandoz 10 mg/ml gotas orales en solución EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Para consultar la lista completa de excipientes ver sección Lista de excipientes.
 NOMBRE DEL MEDICAMENTO Montelukast Kern Pharma 4 mg comprimidos masticables EFG Montelukast Kern Pharma 5 mg comprimidos masticables EFG COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido masticable
NOMBRE DEL MEDICAMENTO Montelukast Kern Pharma 4 mg comprimidos masticables EFG Montelukast Kern Pharma 5 mg comprimidos masticables EFG COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido masticable
CENTRO PARA EL DESARROLLO DE LA FARMACOEPIDEMIOLOGIA UNIDAD COORDINADORA NACIONAL DE FARMACOVIGILANCIA
 CENTRO PARA EL DESARROLLO DE LA FARMACOEPIDEMIOLOGIA UNIDAD COORDINADORA NACIONAL DE FARMACOVIGILANCIA INFORME DE SOSPECHAS DE RAM A LA MEDICINA NATURAL Y TRADICIONAL 2do TRIMESTRE AÑO 2008 Durante el
CENTRO PARA EL DESARROLLO DE LA FARMACOEPIDEMIOLOGIA UNIDAD COORDINADORA NACIONAL DE FARMACOVIGILANCIA INFORME DE SOSPECHAS DE RAM A LA MEDICINA NATURAL Y TRADICIONAL 2do TRIMESTRE AÑO 2008 Durante el
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Regender 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 120 mg de extracto
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Regender 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 120 mg de extracto
SISTEMA NACIONAL DE REGISTRO SANITARIO DE PRODUCTOS FARMACEUTICOS CERTIFICADO DE CONDICIONES DE COMERCIALIZACION
 SISTEMA NACIONAL DE REGISTRO SANITARIO DE PRODUCTOS FARMACEUTICOS CERTIFICADO DE CONDICIONES DE COMERCIALIZACION El Instituto Nacional de Higiene Rafael Rangel de conformidad con lo previsto en los artículos
SISTEMA NACIONAL DE REGISTRO SANITARIO DE PRODUCTOS FARMACEUTICOS CERTIFICADO DE CONDICIONES DE COMERCIALIZACION El Instituto Nacional de Higiene Rafael Rangel de conformidad con lo previsto en los artículos
Prospecto: información para el usuario. Betahistina STADA 16 mg comprimidos EFG Dihidrocloruro de betahistina
 Prospecto: información para el usuario Betahistina STADA 16 mg comprimidos EFG Dihidrocloruro de betahistina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario Betahistina STADA 16 mg comprimidos EFG Dihidrocloruro de betahistina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: Información para el usuario. Deflazacort Kern Pharma 6 mg comprimidos EFG Deflazacort
 Prospecto: Información para el usuario Deflazacort Kern Pharma 6 mg comprimidos EFG Deflazacort Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto. Puede
Prospecto: Información para el usuario Deflazacort Kern Pharma 6 mg comprimidos EFG Deflazacort Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto. Puede
Prospecto: información para el usuario. Deflazacort Kern Pharma 30 mg comprimidos EFG Deflazacort
 Prospecto: información para el usuario Deflazacort Kern Pharma 30 mg comprimidos EFG Deflazacort Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto. Puede
Prospecto: información para el usuario Deflazacort Kern Pharma 30 mg comprimidos EFG Deflazacort Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto. Puede
FICHA TÉCNICA. Óvulo de color blanquecino, aproximadamente de 10 mm x 30 mm, en forma de torpedo.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cyclogest 400 mg óvulos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene 400 mg de progesterona. Para consultar la lista completa de excipientes, ver
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cyclogest 400 mg óvulos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene 400 mg de progesterona. Para consultar la lista completa de excipientes, ver
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Passiflorine solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Passiflorine solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: 100 mg de extracto líquido de partes aéreas de Passiflora incarnata L, (pasiflora)
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Passiflorine solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: 100 mg de extracto líquido de partes aéreas de Passiflora incarnata L, (pasiflora)
RELIF 1g comprimidos Nabumetona. Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento.
 RELIF 1g comprimidos Nabumetona Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya que puede tener que volver a leerlo. - Si tiene alguna duda, consulte
RELIF 1g comprimidos Nabumetona Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya que puede tener que volver a leerlo. - Si tiene alguna duda, consulte
FICHA TÉCNICA. Normoreum 400 mg comprimidos recubiertos con película
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Normoreum 400 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: 400 mg de extracto
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Normoreum 400 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: 400 mg de extracto
FICHA TÉCNICA. Alivio a corto plazo (de dos o tres meses) del edema y síntomas relacionados con la insuficiencia venosa crónica.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Troxerutina NORMON 1000 mg granulado para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Excipientes: Isomaltosa,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Troxerutina NORMON 1000 mg granulado para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Excipientes: Isomaltosa,
FICHA TÉCNICA. Excipientes con efecto conocido: Cada comprimido contiene: 200 mg de sacarosa y 240 mg de sorbitol (E-420).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Simeticona Normon 40 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona... 40 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Simeticona Normon 40 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona... 40 mg Excipientes con efecto conocido:
