sustancias no iónicas (agua) a través de las membranas celulares
|
|
|
- Blanca Toro Martín
- hace 5 años
- Vistas:
Transcripción
1 República Bolivariana de Venezuela Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Departamento de Ciencias Funcionales Sección de Fisiología Fuerzas responsables del movimiento de sustancias no iónicas (agua) a través de las membranas celulares Prof. Joanna Santeliz, MD, PhD jsanteliz@ucla.edu.ve
2 Ósmosis (del griego osmos, empujar ) En 1748, Abbe Jean Antoine Nollet demostró que
3 Ósmosis Es un proceso de transporte pasivo de solvente (agua) a través de una membrana selectivamente permeable para el soluto Si a ambos lados de una membrana semipermeable se colocan dos soluciones con diferentes concentraciones de soluto, el agua se va a mover de la solución mas diluida a la más concentrada
4 Ósmosis
5 Propiedades Coligativas Son aquellas propiedades físicas que presenta una solución y que depende del número de partículas de soluto presentes en la solución (es independiente del tipo de soluto) Existen cuatro propiedades coligativas: Disminución de la presión de vapor Descenso del punto de congelación Aumento del punto de ebullición Presión osmótica
6 Qué ocurre cuando agregamos sal a una olla con agua? Ocurre un aumento en el punto de ebullición
7 Qué ocurre cuando agregamos sal al hielo? Ocurre un descenso en el punto de congelación
8 La propiedad coligativa más fácil de medir es la disminución del punto de congelación ó DESCENSO CRIOSCÓPICO Descenso Crioscópico = Temperatura de congelación del agua pura - Temperatura de congelación de la solución Existe una PROPORCIONALIDAD entre el número de partículas de soluto y el descenso crioscópico Dc = Kc. Osmolalidad 2da Ley de Raoult Kc: constante de proporcionalidad Osmolalidad: número de partículas por kilogramo de solvente (osmol/kg)
9 La determinación del descenso crioscópico se realiza a través de un osmómetro Osmómetro de Dutrochet Osmómetro de Pfeffer
10 Kc Agua = -1,86ºC/osmol Dc = -1,86ºC por cada 1 osmol de soluto disuelto en agua Qué es un osmol? Un Osmol es la cantidad de cualquier soluto que agregado a 1 litro de agua hace descender el punto de congelación de ésta en 1,86ºC Conociendo el punto de congelación de cualquier solución será posible predecir la cantidad de partículas osmóticamente activas en la misma
11 Determinación del número de osmoles osmol = mol x n Mol = PM (gramos) = 6,02 x partículas de soluto n: número de partículas en las que se disocia el soluto Ejemplos 1 mol de Na + = 1 osmol Na + 1 mol de NaCl = 2 osmoles de NaCl 1 mol de CaCl 2 = 3 osmoles de CaCl 2 1 mol de glucosa = 1 osmol de glucosa
12 Osmolaridad - Osmolalidad Osmolaridad Es la cantidad de partículas osmóticamente activas (osmoles) disueltas en un volumen total de 1 litro de solvente (osm/l) Osmolalidad Es la cantidad de osmoles disueltas en un kilogramo de solvente (osm/kg)
13 Estimación de la osmolaridad sanguínea El plasma de un paciente congela a una temperatura de -0,53 a -0,55 o C Despejando: Osmolalidad = Dc / Kc Dc = Kc. Osmolalidad Osmolalidad = -0,53 a -0,55 / -1,86 = 0,285 a 0,295 El plasma humano tiene una osmolalidad de mosm/kg
14 Cálculo de la osmolalidad plasmática Osmolalidad = 2(Na + ) + Urea + glucosa (todos en mmol/l) Osmolalidad = 2(Na + ) + Urea/5.6 + glucosa/18 (mg/dl) La osmolalidad plasmática está determinada principalmente por el Na + Insuficiencia renal Diabetes Mellitus
15 Gap osmolar Es la diferencia entre la osmolaridad medida y la osmolaridad calculada Su valor normal está entre 15 a +10 mosm/kg Su incremento indica la presencia de sustancias osmóticamente activas en sangre Ej: metanol, diuréticos (manitol), etanol, cetoacidosis diabética, etc.
16 Paso de agua a través de una membrana Coeficiente de permeabilidad osmótica (P) Determina el flujo de agua a través de distintos tipos celulares a favor de un gradiente osmótico P agua cm/seg Túbulo proximal (rata) 0,231 Túbulo colector (rata) 0,038 Mucosa gástrica (perro) 0,069 Intestino (rata) 0,011 Piel (sapo) 0,002
17 Presión Osmótica Presión Osmótica La presión osmótica presión osmótica es equivalente a la fuerza que hay que aplicar para contrarrestar la presión de difusión del agua
18 Cálculo de la Presión Osmótica π = R x T x OsmM Ley de van t Hoff n: equivalentes molares de soluto V: volumen en litros, T: temperatura en ºK, R: constante molar de los gases (0,082 L.atm/ºK.mol) La presión osmótica de una solución es igual a la presión que el soluto ejercía en el estado gaseoso, ocupando el mismo volumen de la solución en la misma temperatura
19 Cálculo de la Presión Osmótica 1 2 Conc. 0,9 g/100ml 0,45 g/100ml mm ,5 OsmM 0,310 0,155 PM NaCl: 58 g/mol, T = 20ºC, π = R x T x OsmM π1 = (0,082 L.atm/osmol.ºK) x (293ºK) x (0,310 osmol/l) = 7,2 atm π2 = (0,082 L.atm/osmol.ºK) x (293ºK) x (0,155 osmol/l) = 3,6 atm Δπ = π1 π2 = 7,2 3,6 = 3,6 atm
20 Tonicidad La tonicidad de una solución se define en base a la respuesta de las células inmersas en una solución
21 Tonicidad
22 Tonicidad Empleo de soluciones isotónicas: en los casos de intervenciones quirúrgicas, quemaduras, diarreas, vómitos repetidos, etc La solución de NaCl al 0,9% o la de dextrosa al 5% son isosmóticas, así como también son isotónicas No ocurre igual con la solución isosmótica de urea
23 El caso de la Urea PM Urea = 60 g/mol - Se emplean 18 g/l de urea para obtener 300 mosm/l de Urea = El Hecho osmolaridad del plasma Al colocar glóbulos rojos en una solución de urea 300 mosm/l ocurre hemólisis. Esto indica que la solución no es isotónica Por qué???
24 Membranas permeables, semipermeables, impermeables Coeficiente de Reflexión (σ) Coeficiente de reflexión (σ) de Staverman π = R x T x Osmolaridad Esta ecuación considera el caso de que todos los solutos son impermeables a la membrana La permeabilidad relativa disminuye la presión osmótica por debajo del cálculo teórico
25 π corregida = R x T x Osmolaridad x σ (σ) es el coeficiente de reflexión de Staverman σ = 1 indicará una membrana impermeable a cualquier soluto σ = 0 indicará una membrana totalmente permeable a cualquier soluto Cálculo de σ: σ = π real π teórico
26 Valores de coeficiente de reflexión de varios compuestos Permeante Valor de Acetamida 0.58 Malonamida 0.83 Urea 0.20 Tiourea 0.85 Etanodiol 0.63 Glicerol 0.88 NaCl 0.97
27 El Caso de la Urea El Hecho: al colocar glóbulos rojos en una solución de urea 300 mosm/l ocurre hemólisis. Esto indica que la solución no es isotónica El coeficiente de reflexión para la urea es de σ = 0,20 La osmolaridad teórica es 300 mosm/l pero la osmolaridad real es 60 mosm/l En este caso la solución de urea 18 g/l es isosmótica pero no es isotónica
28 Aplicación de σ Urea = 18 g/l = 300 mm = 300 mosmm T = 20 C = 293 K R = 0,082 L.atm/osmol. K σ urea = 0,2 π = R x T x Osmolaridad Sin σ π = (0,082 L.atm/osmol.ºK) x (293ºK) x (0,3 osmol/l) = 7,2 atm Con σ π = (0,082 L.atm/osmol.ºK) x (293ºK) x (0,3 osmol/l) x (0,2) = 1,4 atm
29 Donde ocurre la ósmosis?
30 Fenómeno frecuente Filtración Agua plasmática y solutos que llegan al intersticio a través de canales en las paredes capilares (depende del tamaño del soluto) La fuerza impulsora es la presión arterial (hidrostática) y no la termodinamia Este proceso puede ser denominado como Flujo de soluto por arrastre
31 Filtración
PROPIEDADES COLIGATIVAS. OSMOSIS. Membrana semipermeable = R. T. C. Clase de problemas Nº 4 PROPIEDADES COLIGATIVAS. Las propiedades coligativas son:
 Clase de problemas Nº 4 PROPIEDADES COLIGATIVAS. OSMOSIS PROPIEDADES COLIGATIVAS Las propiedades coligativas son: Descenso del punto de congelación Ascenso del punto de ebullición Disminución de la presión
Clase de problemas Nº 4 PROPIEDADES COLIGATIVAS. OSMOSIS PROPIEDADES COLIGATIVAS Las propiedades coligativas son: Descenso del punto de congelación Ascenso del punto de ebullición Disminución de la presión
EJERCITACION SOLUCIONES Y OSMOSIS-TONICIDAD
 EJERCITACION SOLUCIONES Y OSMOSIS-TONICIDAD 1) Se disuelven 74,5 g de KCl agregando agua destilada hasta 1 litro de solución obteniéndose una solución 1 M. Esta solución se fracciona en dos frascos de
EJERCITACION SOLUCIONES Y OSMOSIS-TONICIDAD 1) Se disuelven 74,5 g de KCl agregando agua destilada hasta 1 litro de solución obteniéndose una solución 1 M. Esta solución se fracciona en dos frascos de
Universidad Centroccidental Lisandro Alvarado Decanato de Medicina Dep. Ciencias Funcionales Sección Fisiología
 Universidad Centroccidental Lisandro Alvarado Decanato de Medicina Dep. Ciencias Funcionales Sección Fisiología Problemario de Biofísica. Fisiología Prof. Miguel Skirzewski ntroducción El presente problemario
Universidad Centroccidental Lisandro Alvarado Decanato de Medicina Dep. Ciencias Funcionales Sección Fisiología Problemario de Biofísica. Fisiología Prof. Miguel Skirzewski ntroducción El presente problemario
Tema 2: Disoluciones. Tipos de disoluciones. Composición de las disoluciones: formas de expresión. Diluciones. Propiedades coligativas.
 Tema 2: Disoluciones Tipos de disoluciones. Composición de las disoluciones: formas de expresión. Diluciones. Propiedades coligativas. Presión de vapor. Presión osmótica. Aumento ebulloscópico y descenso
Tema 2: Disoluciones Tipos de disoluciones. Composición de las disoluciones: formas de expresión. Diluciones. Propiedades coligativas. Presión de vapor. Presión osmótica. Aumento ebulloscópico y descenso
FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO
 FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO 2007 Ximena PáezP TEMA 11 I. ABSORCIÓN N AGUA Y ELECTROLITOS II. SECRECIÓN ELECTROLITOS III. ABS. MINERALES, VIT HIDROSOLUBLES IV. MALABSORCIÓN ENTRADAS
FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO 2007 Ximena PáezP TEMA 11 I. ABSORCIÓN N AGUA Y ELECTROLITOS II. SECRECIÓN ELECTROLITOS III. ABS. MINERALES, VIT HIDROSOLUBLES IV. MALABSORCIÓN ENTRADAS
FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO
 FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO 2006 Ximena Páez TEMA 11 I. ABSORCIÓN AGUA Y ELECTROLITOS II. SECRECIÓN ELECTROLITOS III. ABSORCIÓN MINERALES, VIT HIDROSOLUBLES IV. MALABSORCIÓN I.
FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO 2006 Ximena Páez TEMA 11 I. ABSORCIÓN AGUA Y ELECTROLITOS II. SECRECIÓN ELECTROLITOS III. ABSORCIÓN MINERALES, VIT HIDROSOLUBLES IV. MALABSORCIÓN I.
MECANISMOS DISIPATIVOS Y SUS FUERZAS IMPULSORAS
 MECANISMOS DISIPATIVOS Y SUS FUERZAS IMPULSORAS Temas de Biofísica Mario Parisi Bibliografía Capítulo 3: Los Grandes Mecanismos Disipativos y sus Fuerzas Impulsoras Gradiente Variación de una cierta cantidad
MECANISMOS DISIPATIVOS Y SUS FUERZAS IMPULSORAS Temas de Biofísica Mario Parisi Bibliografía Capítulo 3: Los Grandes Mecanismos Disipativos y sus Fuerzas Impulsoras Gradiente Variación de una cierta cantidad
Profesor: Carlos Gutiérrez Arancibia
 Objetivo: Reconocer las propiedades coligativas de las disoluciones estableciendo comparaciones y diferencias entre el comportamiento del disolvente puro y de la disolución. Profesor: Carlos Gutiérrez
Objetivo: Reconocer las propiedades coligativas de las disoluciones estableciendo comparaciones y diferencias entre el comportamiento del disolvente puro y de la disolución. Profesor: Carlos Gutiérrez
UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE MEDICINA DEPARTAMENTO DE CIENCIAS FUNCIONALES SECCIÓN DE FISIOLOGÍA
 UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE MEDICINA DEPARTAMENTO DE CIENCIAS FUNCIONALES SECCIÓN DE FISIOLOGÍA EL FENOMENO DE LA OSMOSIS Selección de Material Audiovisual Preparado por:
UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE MEDICINA DEPARTAMENTO DE CIENCIAS FUNCIONALES SECCIÓN DE FISIOLOGÍA EL FENOMENO DE LA OSMOSIS Selección de Material Audiovisual Preparado por:
PSU MÓDULO COMÚN QUÍMICA PROPIEDADES COLIGATIVAS
 DEPARTAMENTO DE CIENCIAS PSU_MÓDULO COMÚN DE QUÍMICA PSU MÓDULO COMÚN QUÍMICA PROPIEDADES COLIGATIVAS Corresponden a las nuevas propiedades del solvente, debido que el soluto altera al solvente puro en
DEPARTAMENTO DE CIENCIAS PSU_MÓDULO COMÚN DE QUÍMICA PSU MÓDULO COMÚN QUÍMICA PROPIEDADES COLIGATIVAS Corresponden a las nuevas propiedades del solvente, debido que el soluto altera al solvente puro en
Aprendizajes esperados
 Disoluciones II Aprendizajes esperados Identificar diluciones. Identificar los factores que afectan la solubilidad. Definir propiedades coligativas. Pregunta oficial PSU Al bajar gradualmente la temperatura,
Disoluciones II Aprendizajes esperados Identificar diluciones. Identificar los factores que afectan la solubilidad. Definir propiedades coligativas. Pregunta oficial PSU Al bajar gradualmente la temperatura,
SOLUCIONES. Coordinadora de Enseñanza de Bioquímica y Biología Molecular. Fac. de Medicina. UNAM
 SOLUCIONES M. en C. Alicia Cea Bonilla Coordinadora de Enseñanza de Bioquímica y Biología Molecular. Fac. de Medicina. UNAM 1 Qué es una solución? Es una mezcla homogénea de dos o más sustancias. La sustancia
SOLUCIONES M. en C. Alicia Cea Bonilla Coordinadora de Enseñanza de Bioquímica y Biología Molecular. Fac. de Medicina. UNAM 1 Qué es una solución? Es una mezcla homogénea de dos o más sustancias. La sustancia
Propiedades de soluciones líquidas
 Soluciones Propiedades de soluciones líquidas Es una mezcla homogénea de dos o mas sustancias químicas tal que el tamaño molecular de la partículas sea inferior a 10-9 m. Cuando el tamaño de partícula
Soluciones Propiedades de soluciones líquidas Es una mezcla homogénea de dos o mas sustancias químicas tal que el tamaño molecular de la partículas sea inferior a 10-9 m. Cuando el tamaño de partícula
Propiedades de soluciones líquidas
 Propiedades de soluciones líquidas Dra. Patricia Satti, UNRN PROPIEDADES DE LAS SOLUCIONES Soluciones Es una mezcla homogénea de dos o mas sustancias químicas tal que el tamaño molecular de la partículas
Propiedades de soluciones líquidas Dra. Patricia Satti, UNRN PROPIEDADES DE LAS SOLUCIONES Soluciones Es una mezcla homogénea de dos o mas sustancias químicas tal que el tamaño molecular de la partículas
Tema 2: Dispersiones III parte Propiedades Coligativas. Propiedades de las disoluciones. Material preparado por: Licda.
 Tema 2: Dispersiones III parte Propiedades de las disoluciones Material preparado por: Licda. Victoria Chan Propiedades de las Disoluciones Propiedades constitutivas: propiedades físicas que dependen de
Tema 2: Dispersiones III parte Propiedades de las disoluciones Material preparado por: Licda. Victoria Chan Propiedades de las Disoluciones Propiedades constitutivas: propiedades físicas que dependen de
Tema 2: Disoluciones. Tipos de disoluciones. Composición de las disoluciones: formas de expresión. Diluciones. Propiedades coligativas.
 Tema 2: Disoluciones Tipos de disoluciones. Composición de las disoluciones: formas de expresión. Diluciones. Propiedades coligativas. Presión de vapor. Presión osmótica. Aumento ebulloscópico y descenso
Tema 2: Disoluciones Tipos de disoluciones. Composición de las disoluciones: formas de expresión. Diluciones. Propiedades coligativas. Presión de vapor. Presión osmótica. Aumento ebulloscópico y descenso
PROPIEDADES COLIGATIVAS
 PROPIEDADES COLIGATIVAS Muchas de las propiedades de las disoluciones verdaderas se deducen del pequeño tamaño de las partículas dispersas. En general, forman disoluciones verdaderas las sustancias con
PROPIEDADES COLIGATIVAS Muchas de las propiedades de las disoluciones verdaderas se deducen del pequeño tamaño de las partículas dispersas. En general, forman disoluciones verdaderas las sustancias con
SOLUCIONES Fuente: Soluciones porcentuales
 SOLUCIONES Fuente: Manual de prácticas de laboratorio. Bioquímica. Facultad de Medicina. UNAM. URL: ttp://www.facmed.unam.mx/fm/pa/2010/practicas/practicas_bioquimica.pdf Una solución es una mezcla homogénea
SOLUCIONES Fuente: Manual de prácticas de laboratorio. Bioquímica. Facultad de Medicina. UNAM. URL: ttp://www.facmed.unam.mx/fm/pa/2010/practicas/practicas_bioquimica.pdf Una solución es una mezcla homogénea
PROPIEDADES COLIGATIVAS
 PROPIEDADES COLIGATIVAS Son aquellas propiedades que dependen directamente del numero de partículas de soluto en la solución y no de la naturaleza de las partículas de soluto. PROPIEDADES COLIGATIVAS Los
PROPIEDADES COLIGATIVAS Son aquellas propiedades que dependen directamente del numero de partículas de soluto en la solución y no de la naturaleza de las partículas de soluto. PROPIEDADES COLIGATIVAS Los
A continuación se detallan cada una de las propiedades coligativas:
 PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES
 PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES Propiedades Coligativas Son aquellas propiedades físicas de las soluciones que dependen más bien de la cantidad de soluto que de su naturaleza. Cuatro son las
PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES Propiedades Coligativas Son aquellas propiedades físicas de las soluciones que dependen más bien de la cantidad de soluto que de su naturaleza. Cuatro son las
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº6
 CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº6 TEMA: PROPIEDADES COLIGATIVAS OBJETIVOS: Aplicar las propiedades coligativas para el cálculo de masas molares de solutos y de las propiedades físicas de las soluciones.
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº6 TEMA: PROPIEDADES COLIGATIVAS OBJETIVOS: Aplicar las propiedades coligativas para el cálculo de masas molares de solutos y de las propiedades físicas de las soluciones.
DISOLUCIONES DILUIDAS IDEALES. LEY DE HENRY. MODELO DE LA DISOLUCIÓN DILUIDA IDEAL
 DISOLUCIONES DILUIDAS IDEALES. LEY DE HENRY. Muchas disoluciones se desvían bastante del modelo de disolución ideal. or ello resulta útil definir otro modelo: MODELO DE LA DISOLUCIÓN DILUIDA IDEAL 1) Descripción
DISOLUCIONES DILUIDAS IDEALES. LEY DE HENRY. Muchas disoluciones se desvían bastante del modelo de disolución ideal. or ello resulta útil definir otro modelo: MODELO DE LA DISOLUCIÓN DILUIDA IDEAL 1) Descripción
Por qué es importante conocer. componentes de una disolución química?
 Por qué es importante conocer la proporción de los componentes de una disolución química? Qué será más conveniente cuando calentamos agua para cocinar algún alimento: agregar sal antes o después que hierva
Por qué es importante conocer la proporción de los componentes de una disolución química? Qué será más conveniente cuando calentamos agua para cocinar algún alimento: agregar sal antes o después que hierva
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES La molécula de agua La molécula de agua Líquido, sólido o gaseoso: existen los tres en la tierra Solvente Universal: por lo que es casi imposible
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES La molécula de agua La molécula de agua Líquido, sólido o gaseoso: existen los tres en la tierra Solvente Universal: por lo que es casi imposible
Coloides y Suspensiones Osmosis y Diálisis. SEMANA 10 Licda. Lilian Judith Guzmán Melgar
 Coloides y Suspensiones Osmosis y Diálisis SEMANA 10 Licda. Lilian Judith Guzmán Melgar SUSPENSIONES Las suspensiones son mezclas heterogéneas formadas por una fase sólida (polvo o pequeñas partículas
Coloides y Suspensiones Osmosis y Diálisis SEMANA 10 Licda. Lilian Judith Guzmán Melgar SUSPENSIONES Las suspensiones son mezclas heterogéneas formadas por una fase sólida (polvo o pequeñas partículas
Movimiento de las Moléculas a través de las membranas celulares. Dr. Ricardo Curcó
 Movimiento de las Moléculas a través de las membranas celulares Dr. Ricardo Curcó Membrana celular Estructura que rodea la célula, y está compuesta principalmente por fosfolípidos (bicapa). Bicapa de Fosfolípidos:
Movimiento de las Moléculas a través de las membranas celulares Dr. Ricardo Curcó Membrana celular Estructura que rodea la célula, y está compuesta principalmente por fosfolípidos (bicapa). Bicapa de Fosfolípidos:
Coloides y Suspensiones Osmosis y Diálisis. SEMANA 10 Licda. Lilian Judith Guzmán Melgar
 Coloides y Suspensiones Osmosis y Diálisis SEMANA 10 Licda. Lilian Judith Guzmán Melgar SUSPENSIONES Las suspensiones son mezclas heterogéneas formadas por una fase sólida (polvo o pequeñas partículas
Coloides y Suspensiones Osmosis y Diálisis SEMANA 10 Licda. Lilian Judith Guzmán Melgar SUSPENSIONES Las suspensiones son mezclas heterogéneas formadas por una fase sólida (polvo o pequeñas partículas
PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES
 PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES Los estudios teóricos y experimentales han permitido establecer, que los líquidos poseen propiedades físicas características. Entre ellas cabe mencionar: la densidad,
PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES Los estudios teóricos y experimentales han permitido establecer, que los líquidos poseen propiedades físicas características. Entre ellas cabe mencionar: la densidad,
Compartimentos Corporales
 Introducción Compartimentos Corporales Agua corporal total El porcentaje de agua corporal total es calculado según el peso grupo etario de la persona. Se estima que: Dr. Duarte Resumen por: Abigail González
Introducción Compartimentos Corporales Agua corporal total El porcentaje de agua corporal total es calculado según el peso grupo etario de la persona. Se estima que: Dr. Duarte Resumen por: Abigail González
Solución. Propiedades Físicas de las Disoluciones. Tipos de soluciones (tabla 12.1) 8/20/2010. Mezcla homogénea de 2 ó mas sustancias
 8/2/21 Propiedades Físicas de las Disoluciones Basado en Capítulo 12 de Química (Chang, 9 na edición, 27) Ramón L. Hernández Castillo, Ph.D Solución Mezcla homogénea de 2 ó mas sustancias Soluto sustancia(s)
8/2/21 Propiedades Físicas de las Disoluciones Basado en Capítulo 12 de Química (Chang, 9 na edición, 27) Ramón L. Hernández Castillo, Ph.D Solución Mezcla homogénea de 2 ó mas sustancias Soluto sustancia(s)
Medio Interno, Agua Corporal y Compartimentos Hídricos
 Medio Interno, Agua Corporal y Compartimentos Hídricos Características del medio interno Volumen constante ± 20 %PV (1/3 ACT) Osmolaridad constante ± 290 mosm/l Composición iónica específica constante
Medio Interno, Agua Corporal y Compartimentos Hídricos Características del medio interno Volumen constante ± 20 %PV (1/3 ACT) Osmolaridad constante ± 290 mosm/l Composición iónica específica constante
Unidad III CLASE Nº 4. Propiedades Coligativas
 UNIVERSIDD NCIONL EXPERIMENTL POLITECNIC NTONIO JOSÉ DE SUCRE VICERRECTORDO RQUISIMETO DEPRTMENTO DE INGENIERÍ QUÍMIC QUÍMIC GENERL Unidad III CLSE Nº 4 Preparación de soluciones y Propiedades Coligativas
UNIVERSIDD NCIONL EXPERIMENTL POLITECNIC NTONIO JOSÉ DE SUCRE VICERRECTORDO RQUISIMETO DEPRTMENTO DE INGENIERÍ QUÍMIC QUÍMIC GENERL Unidad III CLSE Nº 4 Preparación de soluciones y Propiedades Coligativas
DISOLUCIONES. Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables.
 DISOLUCIONES Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables. Soluto es la sustancia que se encuentra en menor proporción. Disolvente es la sustancia
DISOLUCIONES Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables. Soluto es la sustancia que se encuentra en menor proporción. Disolvente es la sustancia
SUSTANCIAS. Nombre Grupo: 3E Fecha Asignatura: Ciencias III (Química) Profra: Hilda Santillán Vargas
 SUSTANCIAS Nombre Grupo: 3E Fecha Asignatura: Ciencias III (Química) Profra: Hilda Santillán Vargas Las sustancias que se pueden observar se clasifican en sustancias puras y mezclas. Se llama sustancia
SUSTANCIAS Nombre Grupo: 3E Fecha Asignatura: Ciencias III (Química) Profra: Hilda Santillán Vargas Las sustancias que se pueden observar se clasifican en sustancias puras y mezclas. Se llama sustancia
Disoluciones III: solubilidad y propiedades coligativas
 Disoluciones III: solubilidad y propiedades coligativas Resumen de la clase anterior Concentración Unidades porcentuales Unidades químicas % masa/masa % masa/volumen Mol Molaridad Molalidad % volumen/volumen
Disoluciones III: solubilidad y propiedades coligativas Resumen de la clase anterior Concentración Unidades porcentuales Unidades químicas % masa/masa % masa/volumen Mol Molaridad Molalidad % volumen/volumen
EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES
 Preuniversitario Liceo de Aplicación Química 4º 2010 Profesora Paola Lizama V. GUÍA 4: DISOLUCIONES EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES 01.- Calcular la cantidad de sosa cáustica (NaOH) y de agua que
Preuniversitario Liceo de Aplicación Química 4º 2010 Profesora Paola Lizama V. GUÍA 4: DISOLUCIONES EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES 01.- Calcular la cantidad de sosa cáustica (NaOH) y de agua que
PROPIEDADES COLIGATIVAS. - Qué son? - Cuáles son? - Cómo se calculan? - Aplicaciones?
 PROPIEDADES COLIGATIVAS - Qué son? - Cuáles son? - Cómo se calculan? - Aplicaciones? 7 PROPIEDADES COLIGATIVAS Qué son? Propiedades de las soluciones líquidas que dependen de la concentración de partículas
PROPIEDADES COLIGATIVAS - Qué son? - Cuáles son? - Cómo se calculan? - Aplicaciones? 7 PROPIEDADES COLIGATIVAS Qué son? Propiedades de las soluciones líquidas que dependen de la concentración de partículas
PRÁCTICA # 01 PREPARACIÓN DE DISOLUCIONES
 REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA DEFENSA AVIACIÓN MILITAR VENEZOLANA U.E.A.M LIBERTADOR ASIGNATURA: QUÍMICA PROF(A): ANGÉLICA RODRÍGUEZ MARBELIS MELENDEZ CURSO: 4to
REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA DEFENSA AVIACIÓN MILITAR VENEZOLANA U.E.A.M LIBERTADOR ASIGNATURA: QUÍMICA PROF(A): ANGÉLICA RODRÍGUEZ MARBELIS MELENDEZ CURSO: 4to
Propiedades coligativas de las disoluciones
 Propiedades coligativas de las disoluciones Química II medio 2017 Las propiedades coligativas tienen tanta importancia en la vida común como en las disciplinas científicas y tecnológicas, entre otras
Propiedades coligativas de las disoluciones Química II medio 2017 Las propiedades coligativas tienen tanta importancia en la vida común como en las disciplinas científicas y tecnológicas, entre otras
PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES
 PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES Los estudios teóricos y experimentales han permitido establecer, que los líquidos poseen propiedades físicas características. Entre ellas cabe mencionar: la densidad,
PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES Los estudios teóricos y experimentales han permitido establecer, que los líquidos poseen propiedades físicas características. Entre ellas cabe mencionar: la densidad,
TRANSPORTE DE SUSTANCIAS A TRAVES DE LA MEMBRANA CELULAR. Gershom Axel Roque Rojas Estudiante de la C.A.P. Medicina Humana
 TRANSPORTE DE SUSTANCIAS A TRAVES DE LA MEMBRANA CELULAR Gershom Axel Roque Rojas Estudiante de la C.A.P. Medicina Humana Composición química de los líquidos Extracelular e intracelular: diferencias Responda
TRANSPORTE DE SUSTANCIAS A TRAVES DE LA MEMBRANA CELULAR Gershom Axel Roque Rojas Estudiante de la C.A.P. Medicina Humana Composición química de los líquidos Extracelular e intracelular: diferencias Responda
DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES. MSc. Marilú Cerda Lira
 DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES MSc. Marilú Cerda Lira DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES Introducción Definición Métodos de separación de las soluciones Principales clases de soluciones
DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES MSc. Marilú Cerda Lira DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES Introducción Definición Métodos de separación de las soluciones Principales clases de soluciones
10. Porque no es posible cocer un huevo en el Everest? A) No hay suficiente presión atmosférica. B) No hay suficiente oxígeno. C) Hace mucho frío
 DISOLUCIONES ---------------------------------------------------------------------------------------------------------------- -- 1. De las siguientes propiedades Cuál es una propiedad coligativa? A) Presión
DISOLUCIONES ---------------------------------------------------------------------------------------------------------------- -- 1. De las siguientes propiedades Cuál es una propiedad coligativa? A) Presión
Sistemas fisicoquímicos (II)
 Sistemas fisicoquímicos (II) Catania, P. (s/f). El hombre como sistema fisicoquímico (I). Biofísica (pp. 1-21). Universidad Nacional del Cuyo. Espacio de Formación Multimodal EL HOMBRE COMO SISTEMA FISICOQUÍMICO
Sistemas fisicoquímicos (II) Catania, P. (s/f). El hombre como sistema fisicoquímico (I). Biofísica (pp. 1-21). Universidad Nacional del Cuyo. Espacio de Formación Multimodal EL HOMBRE COMO SISTEMA FISICOQUÍMICO
Universidad de La Frontera Fac. Ing.Cs. y Adm. Dpto. Cs. Químicas. Soluciones. Prof. Josefina Canales
 Universidad de La Frontera Fac. Ing.Cs. y Adm. Dpto. Cs. Químicas Soluciones Prof. Josefina Canales Una disolución es una mezcla homogénea de dos o más sustancias. Soluto El más pequeño (en masa) de los
Universidad de La Frontera Fac. Ing.Cs. y Adm. Dpto. Cs. Químicas Soluciones Prof. Josefina Canales Una disolución es una mezcla homogénea de dos o más sustancias. Soluto El más pequeño (en masa) de los
Tema 3: Ecuaciones químicas y concentraciones
 Tema 3: Ecuaciones químicas y concentraciones Reacciones químicas y la ecuación química. Estequiometría. Concepto y determinación del reactivo limitante. Rendimiento de la reacción. Definición de disolución.
Tema 3: Ecuaciones químicas y concentraciones Reacciones químicas y la ecuación química. Estequiometría. Concepto y determinación del reactivo limitante. Rendimiento de la reacción. Definición de disolución.
DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES. MSc. Marilú Cerda Lira
 DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES MSc. Marilú Cerda Lira DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES Introducción Definición Principales clases de soluciones Clasificación Modos de expresar las concentraciones
DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES MSc. Marilú Cerda Lira DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES Introducción Definición Principales clases de soluciones Clasificación Modos de expresar las concentraciones
MEDIO INTERNO HOMEOSTASIS. Estructura del medio interno. Se denomina asi al medio extracelular, el medio que rodea a las celulas
 MEDIO INTERNO Se denomina asi al medio extracelular, el medio que rodea a las celulas HOMEOSTASIS Estructura del medio interno El agua representa el 40-60% del peso corporal del organismo. 1 Distribución
MEDIO INTERNO Se denomina asi al medio extracelular, el medio que rodea a las celulas HOMEOSTASIS Estructura del medio interno El agua representa el 40-60% del peso corporal del organismo. 1 Distribución
TEMA 7. DISOLUCIONES Y PROPIEDADES COLIGATIVAS
 TEMA 7. DISOLUCIONES Y PROPIEDADES COLIGATIVAS 1. Una solución saturada A) Contiene más soluto que disolvente. B) Contiene más disolvente que soluto. C) Contiene el mismo número de moles de soluto que
TEMA 7. DISOLUCIONES Y PROPIEDADES COLIGATIVAS 1. Una solución saturada A) Contiene más soluto que disolvente. B) Contiene más disolvente que soluto. C) Contiene el mismo número de moles de soluto que
Disoluciones. Tema 8. Una disolución es una mezcla homogénea de dos o más sustancias. disolución
 Disoluciones Tema 8 Química General e Inorgánica A Una disolución es una mezcla homogénea de dos o más sustancias disolución soluto disolvente El soluto es la sustancia que se encuentra en menor cantidad
Disoluciones Tema 8 Química General e Inorgánica A Una disolución es una mezcla homogénea de dos o más sustancias disolución soluto disolvente El soluto es la sustancia que se encuentra en menor cantidad
Clase de Físicoquímica de soluciones. Milton de la Fuente. 3 de abril de 2007
 3 de abril de 2007 Definición Solución es una mezcla homogénea a nivel molecular Son el aire? la leche? una mezcla agua/aceite? Solubilidades de varias sustancias en agua Sustancia Solubilidad (g/100 ml)
3 de abril de 2007 Definición Solución es una mezcla homogénea a nivel molecular Son el aire? la leche? una mezcla agua/aceite? Solubilidades de varias sustancias en agua Sustancia Solubilidad (g/100 ml)
MECANISMOS RENALES PARA LA CONCENTRACIÓN Y LA DILUCIÓN DE LA ORINA
 MECANISMOS RENALES PARA LA CONCENTRACIÓN Y LA DILUCIÓN DE LA ORINA Miryam Romero, MSc., PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas UNIVERSIDAD DEL VALLE 1 En circunstancias normales,
MECANISMOS RENALES PARA LA CONCENTRACIÓN Y LA DILUCIÓN DE LA ORINA Miryam Romero, MSc., PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas UNIVERSIDAD DEL VALLE 1 En circunstancias normales,
Apuntes Disoluciones. Fórmula empírica y molecular. Propiedades coligativas Física y Química. 1º bachiller
 Apuntes Disoluciones. Fórmula empírica y molecular. Propiedades coligativas Física y Química. 1º bachiller 27-10-2016 DISOLUCIONES CONCEPTO DE DISOLUCIÓN Una disolución es una mezcla homogénea de sustancias
Apuntes Disoluciones. Fórmula empírica y molecular. Propiedades coligativas Física y Química. 1º bachiller 27-10-2016 DISOLUCIONES CONCEPTO DE DISOLUCIÓN Una disolución es una mezcla homogénea de sustancias
Tema 6: Disoluciones. Propiedades coligativas
 Tema 6: Disoluciones. Propiedades coligativas 1-Una solución saturada A) Contiene más soluto que solvente. B) Contiene más solvente que soluto. C) Contiene el mismo número de moles de soluto que de solvente.
Tema 6: Disoluciones. Propiedades coligativas 1-Una solución saturada A) Contiene más soluto que solvente. B) Contiene más solvente que soluto. C) Contiene el mismo número de moles de soluto que de solvente.
Bioquímica. Facultad de Enfermería Universidad de la República ESFUNO 2015 Amalia Ávila SOLUCIONES
 Bioquímica Facultad de Enfermería Universidad de la República ESFUNO 2015 Amalia Ávila SOLUCIONES CONCEPTO: mezcla homogénea de dos o mas sustancias. Solvente: componente que se encuentra en mayor proporción
Bioquímica Facultad de Enfermería Universidad de la República ESFUNO 2015 Amalia Ávila SOLUCIONES CONCEPTO: mezcla homogénea de dos o mas sustancias. Solvente: componente que se encuentra en mayor proporción
Expresar la concentración como un porcentaje
 Concentración de una solución A qué nos referimos cuando hablamos de la concentración de una solución y cómo puede calcularse? En general nos referimos a la cantidad de soluto respecto a la cantidad total
Concentración de una solución A qué nos referimos cuando hablamos de la concentración de una solución y cómo puede calcularse? En general nos referimos a la cantidad de soluto respecto a la cantidad total
DISTRIBUCIÓN DE LOS FLUÍDOS CORPORALES
 Lección 1. Estructura y composición física de la membrana celular. Mecanismos de transporte. Difusión. Permeabilidad. Osmosis y presión osmótica. Transporte mediado: Transporte facilitado, Transporte activo
Lección 1. Estructura y composición física de la membrana celular. Mecanismos de transporte. Difusión. Permeabilidad. Osmosis y presión osmótica. Transporte mediado: Transporte facilitado, Transporte activo
FyQ 1. IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química Unidad Didáctica 2
 Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 2015 2016 Unidad Didáctica 2 Rev 01 Las Disoluciones. Métodos Actuales para el Análisis de Sustancias
Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 2015 2016 Unidad Didáctica 2 Rev 01 Las Disoluciones. Métodos Actuales para el Análisis de Sustancias
GUIA DE ESTUDIO Nº 6: Soluciones
 Página19 GUIA DE ESTUDIO Nº 6: Soluciones I.- Conceptos básicos: Propiedades generales de las disoluciones acuosas. Soluciones: tipos de soluciones, concepto de solubilidad y relación con la temperatura.
Página19 GUIA DE ESTUDIO Nº 6: Soluciones I.- Conceptos básicos: Propiedades generales de las disoluciones acuosas. Soluciones: tipos de soluciones, concepto de solubilidad y relación con la temperatura.
COMPARTIMIENTOS LÍQUIDOS DEL CUERPO Y SU COMPOSICIÓN
 COMPARTIMIENTOS LÍQUIDOS DEL CUERPO Y SU COMPOSICIÓN Miryam Romero, MSc., PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas UNIVERSIDAD DEL VALLE 1 Compartimientos fluidos de un humano
COMPARTIMIENTOS LÍQUIDOS DEL CUERPO Y SU COMPOSICIÓN Miryam Romero, MSc., PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas UNIVERSIDAD DEL VALLE 1 Compartimientos fluidos de un humano
SOLUCIONES Y PROPIEDADES COLIGATIVAS
 SOLUCIONES Y PROPIEDADES COLIGATIVAS 1.- Se requiere preparar 400 cm 3 de una solución 10 %p/p de ácido clorhídrico, cuya densidad es 1,02 g/ml. Calcular: a) Cuál es la masa de soluto y de solvente necesaria?
SOLUCIONES Y PROPIEDADES COLIGATIVAS 1.- Se requiere preparar 400 cm 3 de una solución 10 %p/p de ácido clorhídrico, cuya densidad es 1,02 g/ml. Calcular: a) Cuál es la masa de soluto y de solvente necesaria?
QUÉ SON LAS DISOLUCIONES?
 LICEO FEMENINO MERCEDES NARIÑO IED ÁREA CIENCIAS NATURALES Y ED. AMBIENTAL- QUÍMICA GRADO 11 DISOLUCIONES Prof. Juan Gabriel Perilla Jiménez Propósito General: Reconocer la presencia, comportamiento, importancia
LICEO FEMENINO MERCEDES NARIÑO IED ÁREA CIENCIAS NATURALES Y ED. AMBIENTAL- QUÍMICA GRADO 11 DISOLUCIONES Prof. Juan Gabriel Perilla Jiménez Propósito General: Reconocer la presencia, comportamiento, importancia
1 UNIVERSIDAD DON BOSCO DEPARTAMENTO DE CIENCIAS BÁSICAS QUÍMICA GENERAL Y QUÍMICA I CICLO I-2009 UNIDAD 4: SOLUCIONES
 1 UNIVERSIDAD DON BOSCO DEPARTAMENTO DE CIENCIAS BÁSICAS QUÍMICA GENERAL Y QUÍMICA I CICLO I-2009 DISCUSIÓN DE PROBLEMAS Nº 4 UNIDAD 4: SOLUCIONES OBJETIVOS: El estudiante al finalizar esta discusión de
1 UNIVERSIDAD DON BOSCO DEPARTAMENTO DE CIENCIAS BÁSICAS QUÍMICA GENERAL Y QUÍMICA I CICLO I-2009 DISCUSIÓN DE PROBLEMAS Nº 4 UNIDAD 4: SOLUCIONES OBJETIVOS: El estudiante al finalizar esta discusión de
INTRODUCCIÓN DISOLUCIONES
 QUIMICA COMUN INTRODUCCIÓN DISOLUCIONES EBULLICIÓN V/S EVAPORACIÓN Ambos conceptos tienen relación con la presión de vapor. La presión de vapor es la fuerza que tienen las moléculas de un líquido para
QUIMICA COMUN INTRODUCCIÓN DISOLUCIONES EBULLICIÓN V/S EVAPORACIÓN Ambos conceptos tienen relación con la presión de vapor. La presión de vapor es la fuerza que tienen las moléculas de un líquido para
2. Disoluciones. Química (1S, Grado Biología) UAM
 2. Disoluciones Química (1S, Grado Biología) UAM 2. Disoluciones Contenidos Tipos de disoluciones Expresiones de la concentración Dilución ropiedades coligativas de las disoluciones resión de vapor [de
2. Disoluciones Química (1S, Grado Biología) UAM 2. Disoluciones Contenidos Tipos de disoluciones Expresiones de la concentración Dilución ropiedades coligativas de las disoluciones resión de vapor [de
TEST DE QUÍMICA CON ENUNCIADOS FORMATIVOS Disoluciones 4
 TEST DE QUÍMICA CON ENUNCIADOS FORMATIVOS Disoluciones 4 70.En 1748, el francés Nollet, siendo profesor del Colegio de Navarra, adscrito a la Universidad de París, descubre que el alcohol guardado en una
TEST DE QUÍMICA CON ENUNCIADOS FORMATIVOS Disoluciones 4 70.En 1748, el francés Nollet, siendo profesor del Colegio de Navarra, adscrito a la Universidad de París, descubre que el alcohol guardado en una
PROPIEDADES COLIGATIVAS SOLUCIONES DE NO ELECTROLITO
 Universidad Nacional Autónoma de México Facultad de Química PROPIEDADES COLIGATIVAS SOLUCIONES DE NO ELECTROLITO Profesora: M. en C. Gregoria Flores Rodríguez 1 PROPIEDADES COLIGATIVAS. SOLUCIONES DE NO
Universidad Nacional Autónoma de México Facultad de Química PROPIEDADES COLIGATIVAS SOLUCIONES DE NO ELECTROLITO Profesora: M. en C. Gregoria Flores Rodríguez 1 PROPIEDADES COLIGATIVAS. SOLUCIONES DE NO
MOVIMIENTO DE AGUA A TRAVÉS DE BARRERAS BIOLÓGICAS Osmosis, osmolaridad y osmolaridad efectiva
 MOVIMIENTO DE AGUA A TRAVÉS DE BARRERAS BIOLÓGICAS Osmosis, osmolaridad y osmolaridad efectiva Miryam Romero, MSc., PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas UNIVERSIDAD DEL VALLE
MOVIMIENTO DE AGUA A TRAVÉS DE BARRERAS BIOLÓGICAS Osmosis, osmolaridad y osmolaridad efectiva Miryam Romero, MSc., PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas UNIVERSIDAD DEL VALLE
J Curso Tratamiento de agua con Intercambio Iónico y Ósmosis Inversa
 Curso Tratamiento de agua con Intercambio Iónico y Ósmosis Inversa Conceptos Básicos de Ósmosis Inversa Septiembre de 2016 INDICE Espectro de Filtración Conceptos Básicos Factores que afectan el desempeño
Curso Tratamiento de agua con Intercambio Iónico y Ósmosis Inversa Conceptos Básicos de Ósmosis Inversa Septiembre de 2016 INDICE Espectro de Filtración Conceptos Básicos Factores que afectan el desempeño
QUÉ SON LAS DISOLUCIONES?
 LICEO FEMENINO MERCEDES NARIÑO IED ÁREA CIENCIAS NATURALES Y ED. AMBIENTAL- QUÍMICA GRADO 10 DISOLUCIONES DOCENTES: VERONICA PINZÓN - JUAN GABRIEL PERILLA Propósito General: Reconocer la presencia, comportamiento,
LICEO FEMENINO MERCEDES NARIÑO IED ÁREA CIENCIAS NATURALES Y ED. AMBIENTAL- QUÍMICA GRADO 10 DISOLUCIONES DOCENTES: VERONICA PINZÓN - JUAN GABRIEL PERILLA Propósito General: Reconocer la presencia, comportamiento,
Repaso de Sistemas de concentración molar
 Repaso de Sistemas de concentración molar Prof. José A. Pérez Química Analítica 1 Unidades de Concentración molaridad, molalidad, % masa, % volumen, %masa/volumen, partes por mil (ppmil), partes por millón
Repaso de Sistemas de concentración molar Prof. José A. Pérez Química Analítica 1 Unidades de Concentración molaridad, molalidad, % masa, % volumen, %masa/volumen, partes por mil (ppmil), partes por millón
Algunos ejercicios resueltos de FISICOQUIMICA - I (curso , Grupo C) Hoja nº 2 (Modulo 1, Disoluciones: temas 4 a 7) 1000g. 360g 917.
 Hoja nº 2 1 Algunos ejercicios resueltos de FISICOQUIMICA - I (curso 2008-09, Grupo C) Hoja nº 2 (Modulo 1, Disoluciones: temas 4 a 7) 2) Una disolución de glicerol (C 3 H 8 O 3 ) en agua al 36 % (w/w)
Hoja nº 2 1 Algunos ejercicios resueltos de FISICOQUIMICA - I (curso 2008-09, Grupo C) Hoja nº 2 (Modulo 1, Disoluciones: temas 4 a 7) 2) Una disolución de glicerol (C 3 H 8 O 3 ) en agua al 36 % (w/w)
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Disoluciones III: solubilidad y propiedades coligativas SGUICES045CB33-A16V1 Ítem Alternativa Habilidad 1 D Comprensión 2 B Reconocimiento 3 E Reconocimiento 4 D Reconocimiento
SOLUCIONARIO Guía Estándar Anual Disoluciones III: solubilidad y propiedades coligativas SGUICES045CB33-A16V1 Ítem Alternativa Habilidad 1 D Comprensión 2 B Reconocimiento 3 E Reconocimiento 4 D Reconocimiento
TEMA 6 MEZCLAS Y DISOLUCIONES
 TEMA 6 MEZCLAS Y DISOLUCIONES 1 Contenidos: 1. Tipos de disoluciones 2. El proceso de disolución 3. Formas de expresar la concentración. 4. Solubilidad. Factores que afectan a la solubilidad 5. Propiedades
TEMA 6 MEZCLAS Y DISOLUCIONES 1 Contenidos: 1. Tipos de disoluciones 2. El proceso de disolución 3. Formas de expresar la concentración. 4. Solubilidad. Factores que afectan a la solubilidad 5. Propiedades
Tema 8: Disoluciones y sus propiedades
 Tema 8: Disoluciones y sus propiedades Francisco G. Calvo-Flores Contenidos 8-1 Disoluciones y tipos 8-2 Unidades de concentración 8-3 Disoluciones ideales y no ideales 8-4 Formación de disoluciones: equilibrio
Tema 8: Disoluciones y sus propiedades Francisco G. Calvo-Flores Contenidos 8-1 Disoluciones y tipos 8-2 Unidades de concentración 8-3 Disoluciones ideales y no ideales 8-4 Formación de disoluciones: equilibrio
GUÍA N 2 PROPIEDADES COLIGATIVAS 2018-I. Laboratorio N 2: Propiedades Coligativas LABORATORIO DE FISICOQUÍMICA - UNIVERSIDAD TECNOLÓGICA DEL PERÚ
 GUÍA N 2 PROPIEDADES COLIGATIVAS 2018-I Laboratorio N 2: Propiedades Coligativas LABORATORIO DE FISICOQUÍMICA - UNIVERSIDAD TECNOLÓGICA DEL PERÚ LABORATORIO N 2 I. OBJETIVOS PROPIEDADES COLIGATIVAS Reconocer
GUÍA N 2 PROPIEDADES COLIGATIVAS 2018-I Laboratorio N 2: Propiedades Coligativas LABORATORIO DE FISICOQUÍMICA - UNIVERSIDAD TECNOLÓGICA DEL PERÚ LABORATORIO N 2 I. OBJETIVOS PROPIEDADES COLIGATIVAS Reconocer
Problemas resueltos de propiedades coligativas.
 Problemas resueltos de propiedades coligativas. Propiedades aditivas: las propiedades son aditivas cuando son iguales a la suma de los valores aislados de sus componentes Propiedades constitutivas: una
Problemas resueltos de propiedades coligativas. Propiedades aditivas: las propiedades son aditivas cuando son iguales a la suma de los valores aislados de sus componentes Propiedades constitutivas: una
12) Qué cantidad de agua (en gramos) hay que añadir a 100 g de una solución de HCl al 20% para obtener una solución de HCl al 15%? R: g.
 1) Se prepara una solución con 45 g de benceno (C 6 H 6 ) y 80.0 g de tolueno (C 7 H 8 ). Calcular: a) El porcentaje en peso de cada componente. b) La fracción molar de cada componente. c) La molalidad
1) Se prepara una solución con 45 g de benceno (C 6 H 6 ) y 80.0 g de tolueno (C 7 H 8 ). Calcular: a) El porcentaje en peso de cada componente. b) La fracción molar de cada componente. c) La molalidad
Fundamentos de Química. Horario de Tutorías
 Fundamentos de Química Segundo Cuatrimestre Horario de Tutorías Martes 12:00-14:00 16:00-19:00 Edificio 24B.Tercera Planta 14/02/2006 Tema 11: Propiedades de las disoluciones 11.1 Definición de disolución
Fundamentos de Química Segundo Cuatrimestre Horario de Tutorías Martes 12:00-14:00 16:00-19:00 Edificio 24B.Tercera Planta 14/02/2006 Tema 11: Propiedades de las disoluciones 11.1 Definición de disolución
FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO
 FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO 2009 Ximena PáezP TEMA 11 I. ABSORCIÓN N AGUA Y ELECTROLITOS II. SECRECIÓN ELECTROLITOS III. ABS. MINERALES, VIT HIDROSOLUBLES IV. MALABSORCIÓN * ENTRADAS
FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO 2009 Ximena PáezP TEMA 11 I. ABSORCIÓN N AGUA Y ELECTROLITOS II. SECRECIÓN ELECTROLITOS III. ABS. MINERALES, VIT HIDROSOLUBLES IV. MALABSORCIÓN * ENTRADAS
LAS DISOLUCIONES Una disolución es una mezcla homogénea y está formada por varios componentes: DISOLVENTE Y SOLUTOS.
 LAS DISOLUCIONES Una disolución es una mezcla homogénea y está formada por varios componentes: DISOLVENTE Y SOLUTOS. El DISOLVENTE es el componente mayoritario de la disolución. No obstante, si uno de
LAS DISOLUCIONES Una disolución es una mezcla homogénea y está formada por varios componentes: DISOLVENTE Y SOLUTOS. El DISOLVENTE es el componente mayoritario de la disolución. No obstante, si uno de
GUÍA DE ESTUDIO Semana 10. COLOIDES Y SUSPENSIONES OSMOSIS Y DIALISIS Elaborado por: Licda. Lilian Judith Guzmán Melgar
 NIVERSIDAD DE SAN CARLOS DE GUTEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO GUÍA DE ESTUDIO 2015 Semana 10 COLOIDES Y SUSPENSIONES OSMOSIS Y DIALISIS Elaborado por: Licda.
NIVERSIDAD DE SAN CARLOS DE GUTEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO GUÍA DE ESTUDIO 2015 Semana 10 COLOIDES Y SUSPENSIONES OSMOSIS Y DIALISIS Elaborado por: Licda.
UNIDAD EDUCATIVA COLEGIO SAN ANTONIO DEL TUY OCUMARE DEL TUY, ESTADO MIRANDA
 UNIDAD EDUCATIVA COLEGIO SAN ANTONIO DEL TUY OCUMARE DEL TUY, ESTADO MIRANDA CURSO: 4 TO AÑO PROFESOR: CARLOS M. LANDAETA H. GUÍA N 2: SOLUCIONES. UNIDADES DE CONCENTRACIÓN. LEY DE RAOULT Y PROPIEDADES
UNIDAD EDUCATIVA COLEGIO SAN ANTONIO DEL TUY OCUMARE DEL TUY, ESTADO MIRANDA CURSO: 4 TO AÑO PROFESOR: CARLOS M. LANDAETA H. GUÍA N 2: SOLUCIONES. UNIDADES DE CONCENTRACIÓN. LEY DE RAOULT Y PROPIEDADES
Tema 5: Disoluciones. (Químic General) Disoluciones 6 de noviembre de / 38
 Tema 5: Disoluciones Tipos de disoluciones. Concentración. Solubilidad de gases. Diagramas de fases de dos componentes. Propiedades coligativas: presión osmótica, disminución del punto de fusión y aumento
Tema 5: Disoluciones Tipos de disoluciones. Concentración. Solubilidad de gases. Diagramas de fases de dos componentes. Propiedades coligativas: presión osmótica, disminución del punto de fusión y aumento
TEMA 3 LAS DISOLUCIONES
 TEMA 3 LAS DISOLUCIONES 1.- DISOLUCIÓN: COMPONENTES Y TIPOS DE DISOLUCIONES 1.1- EL PROCESO DE DISOLUCIÓN - FACTORES QUE AFECTAN AL PROCESO DE DISOLUCIÓN 1.2-LA CONCENTRACIÓN - % EN MASA -% EN VOLUMEN
TEMA 3 LAS DISOLUCIONES 1.- DISOLUCIÓN: COMPONENTES Y TIPOS DE DISOLUCIONES 1.1- EL PROCESO DE DISOLUCIÓN - FACTORES QUE AFECTAN AL PROCESO DE DISOLUCIÓN 1.2-LA CONCENTRACIÓN - % EN MASA -% EN VOLUMEN
BIENVENIDOS A BIOQUÍMICA DE LA NUTRICIÓN AÑO Prof. Dr. Marcelo Osvaldo Lucentini
 BIENVENIDOS A BIOQUÍMICA DE LA NUTRICIÓN AÑO 2017 Prof. Dr. Marcelo Osvaldo Lucentini ORGANIZACIÓN DE LA MATERIA: CLASES TEÓRICAS OPTATIVAS: Se cursa todos los miércoles de 18 a 21 horas, desde el 22 de
BIENVENIDOS A BIOQUÍMICA DE LA NUTRICIÓN AÑO 2017 Prof. Dr. Marcelo Osvaldo Lucentini ORGANIZACIÓN DE LA MATERIA: CLASES TEÓRICAS OPTATIVAS: Se cursa todos los miércoles de 18 a 21 horas, desde el 22 de
TRANSPORTE A TRAVÉS DE LA MEMBRANA CELULAR
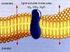 TRANSPORTE A TRAVÉS DE LA MEMBRANA CELULAR Introducción Compartimientos Acuosos separados por Barreras Biológicas Organelos selectivos, autocatalíticos, autoreproductivos, competitivos, adaptativos...
TRANSPORTE A TRAVÉS DE LA MEMBRANA CELULAR Introducción Compartimientos Acuosos separados por Barreras Biológicas Organelos selectivos, autocatalíticos, autoreproductivos, competitivos, adaptativos...
GUIA DE QUIMICA 2 MEDIO
 Unidad: Disoluciones Tema: Dilución y Propiedades Coligativas Objetivos GUIA DE QUIMICA 2 MEDIO Determinar procedimiento matemático para diluir una solución Comprender las propiedades de una solución en
Unidad: Disoluciones Tema: Dilución y Propiedades Coligativas Objetivos GUIA DE QUIMICA 2 MEDIO Determinar procedimiento matemático para diluir una solución Comprender las propiedades de una solución en
Las propiedades coligativas de las soluciones. de soluto, sin importar si las partículas son iones o moléculas.
 PROPIEDADES COLIGATIVAS DE SOLUCIONES DE ELECTROLITOS Las propiedades coligativas de las soluciones dependen de la concentración total de partículas de soluto, sin importar si las partículas son iones
PROPIEDADES COLIGATIVAS DE SOLUCIONES DE ELECTROLITOS Las propiedades coligativas de las soluciones dependen de la concentración total de partículas de soluto, sin importar si las partículas son iones
1. Líquidos corporales. 2. Anatomía y función renal. 3. Hormonas ADH y aldosterona
 1. Líquidos corporales 2. Anatomía y función renal 3. Hormonas ADH y aldosterona Propiedades de la Homeostasis 1. Importancia tanto del sistema nervioso como del endocrino. 2. Controles antagónicos. 3.
1. Líquidos corporales 2. Anatomía y función renal 3. Hormonas ADH y aldosterona Propiedades de la Homeostasis 1. Importancia tanto del sistema nervioso como del endocrino. 2. Controles antagónicos. 3.
HOJA DE PROBLEMAS 5: ENUNCIADOS
 Tema: SISTEMAS DISPERSOS HOJA DE PROBLEMAS 5: ENUNCIADOS 1. ( ) Calcule la molaridad de un disolución preparada disolviendo 23.4 g de sulfato de sodio hasta obtener 125 ml de disolución. 2. ( ) Cuantos
Tema: SISTEMAS DISPERSOS HOJA DE PROBLEMAS 5: ENUNCIADOS 1. ( ) Calcule la molaridad de un disolución preparada disolviendo 23.4 g de sulfato de sodio hasta obtener 125 ml de disolución. 2. ( ) Cuantos
1.- Definiciones. Formas de expresar la concentración. 2.- Concepto de disolución ideal. Ley de Raoult. 3.- Magnitudes termodinámicas de mezcla. 4.
 1.- Definiciones. Formas de expresar la concentración. 2.- Concepto de disolución ideal. Ley de Raoult. 3.- Magnitudes termodinámicas de mezcla. 4.- Disoluciones binarias ideales. Diagramas P-x y T-x.
1.- Definiciones. Formas de expresar la concentración. 2.- Concepto de disolución ideal. Ley de Raoult. 3.- Magnitudes termodinámicas de mezcla. 4.- Disoluciones binarias ideales. Diagramas P-x y T-x.
Propiedades Coligativas de las Disoluciones Acuosas
 Propiedades Coligativas de las Disoluciones Acuosas Universidad Tecnológica de Panamá Facultad de Ingeniería Civil Nombres: Tatiana González, 4-790-129; Dylann Aguilar, 4-788-664 RESUMEN Para este experimento
Propiedades Coligativas de las Disoluciones Acuosas Universidad Tecnológica de Panamá Facultad de Ingeniería Civil Nombres: Tatiana González, 4-790-129; Dylann Aguilar, 4-788-664 RESUMEN Para este experimento
MEMBRANA Y TRANSPORTE
 MEMBRANA Y TRANSPORTE Membrana Celular Qué organización tiene la membrana en el esquema? Los componentes de la membrana tienen una disposición asimétrica, es decir, cada mitad tiene una disposición diferente
MEMBRANA Y TRANSPORTE Membrana Celular Qué organización tiene la membrana en el esquema? Los componentes de la membrana tienen una disposición asimétrica, es decir, cada mitad tiene una disposición diferente
DETERMINACIÓN DE LA MASA MOLECULAR POR ELEVACIÓN DEL PUNTO DE EBULLICIÓN DE UNA DISOLUCIÓN
 DETERMINACIÓN DE LA MASA MOLECULAR POR ELEVACIÓN DEL PUNTO DE EBULLICIÓN DE UNA DISOLUCIÓN OBJETIVO El alumno determinará la masa molecular de un compuesto puro, por elevación del punto de ebullición de
DETERMINACIÓN DE LA MASA MOLECULAR POR ELEVACIÓN DEL PUNTO DE EBULLICIÓN DE UNA DISOLUCIÓN OBJETIVO El alumno determinará la masa molecular de un compuesto puro, por elevación del punto de ebullición de
Consecuencias de la disminución de la presión de vapor de una solución Disminuye la presión de vapor 2. Aumento del punto de ebullición de la solución
 Algunas propiedades físicas de las soluciones dependen de la cantidad de soluto no volátil disuelto, aunque no de su naturaleza A atm de presión, el agua pura congela a C y ebulle a C pero una disolución
Algunas propiedades físicas de las soluciones dependen de la cantidad de soluto no volátil disuelto, aunque no de su naturaleza A atm de presión, el agua pura congela a C y ebulle a C pero una disolución
Disoluciones: La disolución ideal y propiedades coliga4vas
 Disoluciones: La disolución ideal y propiedades coliga4vas CLASE 06 Dr. Abel Moreno Cárcamo Ins8tuto de Química, UNAM Disolución: es una mezcla homogénea de especies químicas diversas a escala molecular,
Disoluciones: La disolución ideal y propiedades coliga4vas CLASE 06 Dr. Abel Moreno Cárcamo Ins8tuto de Química, UNAM Disolución: es una mezcla homogénea de especies químicas diversas a escala molecular,
POTENCIAL QUIMICO Y POTENCIAL AGUA A NIVEL CELULAR
 Espacio curricular FISIOLOGIA VEGETAL POTENCIAL QUIMICO Y POTENCIAL AGUA A NIVEL CELULAR UNIDAD TEMATICA 4 Absorción y movimiento del agua en la planta: Potencial químico y potencial agua. Componentes
Espacio curricular FISIOLOGIA VEGETAL POTENCIAL QUIMICO Y POTENCIAL AGUA A NIVEL CELULAR UNIDAD TEMATICA 4 Absorción y movimiento del agua en la planta: Potencial químico y potencial agua. Componentes
