La vacunación frente a la tos ferina: no es sólo para niños
|
|
|
- Alfonso Marín Revuelta
- hace 8 años
- Vistas:
Transcripción
1 GSKEDC-SPN-2010-Boostrix-1210_D12:Layout 1 6/14/2010 6:39 PM Page 1 La vacunación frente a la tos ferina: no es sólo para niños La tos ferina es una de las enfermedades infecciosas más contagiosas y actualmente sigue causando un número significativo de visitas médicas, hospitalizaciones y muertes a nivel mundial 1,2 En los últimos años, el patrón epidemiológico de la tos ferina se ha modificado afectando predominantemente a lactantes menores de 6 meses (no vacunados o parcialmente primovacunados) y a los adolescentes y adultos 3 Printing Process: Offset GD: Size: 210 x 297 mm Pages: 8 Colors: C M Y K (4 Colors) Native File: Quark Xpress 7.3 Windows Generated in: Acrobat Distiller 8.0
2 GSKEDC-SPN-2010-Boostrix-1210_D12:Layout 1 6/14/2010 6:39 PM Page 2 Tos ferina una enfermedad infradiagnosticada A pesar de las altas coberturas vacunales en niños, se ha observado un aumento en la incidencia de tos ferina en adolescentes y adultos. Se han notificado más de casos en todas las edades entre 1998 y 2002 en 16 países europeos 2 La inmunidad natural y la inmunidad adquirida tras la vacunación frente a la tos ferina disminuyen a lo largo del tiempo 4 Existe una importante infradeclaración, sobre todo en los casos ocurridos en la edad adulta 5 La infección notificada representa una proporción muy pequeña respecto a la infección real 6 Infecciones notificadas Infecciones sintomáticas no notificadas Infecciones asintomáticas Figura 1. La incidencia de infecciones por Bordetella pertussis notificadas representa sólo la punta del iceberg 6. Reimpresión de Trends in Microbiology 2004; 12(3):116-9, van Boven et al. Copyright 2009, con permiso de Elsevier. Las tasas de tos ferina notificadas son de 40 a 160 veces menores que las tasas de enfermedad reales y las infecciones asintomáticas son de 4 a 22 veces más frecuentes que las infecciones sintomáticas 7
3 GSKEDC-SPN-2010-Boostrix-1210_D12:Layout 1 6/14/2010 6:40 PM Page 3 La necesidad de vacunación de recuerdo frente a la tos ferina en adolescentes y adultos La inmunidad adquirida frente a la tos ferina disminuye a los 4-12 años después de la vacunación 4 Los casos de tos ferina están aumentando, especialmente en los adolescentes y adultos 5, <1 año 1 9 años años Casos de tos ferina años 20 años Año Figura 2. Número de casos de tos ferina notificados en EEUU, por año y grupo de edad 8. Reproducido con permiso del CDC Morb Mortal Wkly Rep Aunque la tos ferina en los adolescentes y adultos es generalmente leve, puede causar tos nocturna prolongada y grave 9 Los adolescentes y adultos son una fuente de infección para los lactantes que todavía no han completado la pauta de primovacunación 9
4 GSKEDC-SPN-2010-Boostrix-1210_D12:Layout 1 6/14/2010 6:40 PM Page 4 La vacunación de recuerdo frente a la tos ferina está recomendada para adolescentes La vacunación de recuerdo frente a la tos ferina en adolescentes contribuye al control de la enfermedad en esta población y podría evitar también la transmisión de B.pertussis a lactantes no vacunados 10 El Comité Asesor de Vacunas de la AEP recomienda la vacunación de recuerdo frente a la tos ferina en adolescentes entre años con dtpa 11. CALENDARIO DE VACUNACIONES DE LA ASOCIACIÓN ESPAÑOLA DE PEDIATRÍA 2010 Comité Asesor de Vacunas VACUNA Hepatitis B 1 Edad en meses Edad en años HB HB HB HB Difteria, tetanos y tos ferina 2 DTPa DTPa DTPa DTPa DTPa Tdpa Poliomielitis 3 VPI VPI VPI VPI Haemophilus influenzae tipo b 4 Hib Hib Hib Hib Meningococo C 5 MenC MenC MenC Neumococo 6 VNC VNC VNC VNC Sarampión, rubeola y parotiditis 7 SRP SRP Virus del papiloma humano 8 VPH - 3 d. Rotavirus 9 RV - 2 ó 3 dosis Varicela 10 Var Var Var - 2 d. Gripe 11 Gripe Hepatitis A 12 HA - 2 dosis Sistemática Recomendada Grupos de riesgo
5 GSKEDC-SPN-2010-Boostrix-1210_D12:Layout 1 6/14/2010 6:40 PM Page 5 La vacunación de recuerdo frente a la tos ferina está recomendada para familias con recién nacidos La fuente de transmisión de la infección a lactantes son los padres, hermanos y otros familiares y personas en contacto con el recién nacido, representando un 75-85% de los casos 12 En más del 50% de los casos, son los nuevos padres (especialmente las madres) la fuente de infección para los lactantes 12 El CDC* y la SEMPSPH** recomiendan la vacunación de recuerdo frente a tos ferina para: 5,13,14 Los adultos y adolescentes que esperan tener contacto con niños menores de 12 meses (por ej. padres, abuelos y cuidadores) para prevenir la transmisión a niños susceptibles La vacunación de recuerdo con dtpa cumple tres objetivos: Protege frente a la tos ferina Protege frente al tétanos y la difteria Reduce la transmisión de la tos ferina de adolescentes y adultos a lactantes menores de 6 meses y otros con mayor riesgo de complicaciones graves y de mortalidad por la enfermedad 12 *Centers for Disease Control and Prevention de EEUU **Sociedad Española de Medicina Preventiva, Salud Pública e Higiene
6 GSKEDC-SPN-2010-Boostrix-1210_D12:Layout 1 6/14/2010 6:40 PM Page 6 Boostrix La vacuna combinada dtpa Boostrix es comparable a las vacunas combinadas de difteria y tétanos, con protección añadida frente a tos ferina ,8% 99,5% (99,0-100,0%) (97,4-) 98,7% (97,3-99,5%) 99,4% (98,4-99,9%) (99,3-) Boostrix Inmunogenicidad Seroprotección (%) ,0% 93,2% (90,4-95,0%) (88,8-96,2%) dt Difteria Tétanos Toxoide pertúsico Pertactina Hemaglutinina filamentosa Figura 3. Tasas de seroprotección para difteria, tétanos y tos ferina con Boostrix y una vacuna dt en adultos 15. Se han observado resultados similares en niños y adolescentes. Gráfica construida a partir de los datos de Van Dame y Burgess. Vaccine Los antígenos de B.pertussis contenidos en Boostrix son una parte integral de la combinación antitos ferina acelular de la vacuna pediátrica (Infanrix ), para la que se ha demostrado su eficacia tras vacunación primaria en un estudio de eficacia en contactos en el ámbito familiar. 18
7 GSKEDC-SPN-2010-Boostrix-1210_D12:Layout 1 6/14/2010 6:40 PM Page 7 con demostrada inmunogenicidad y seguridad Protección a largo plazo con Boostrix en adultos y adolescentes: La seroprotección/seropositividad con Boostrix persiste 5 años después de la vacunación 18. Seroprotección Antígeno Difteria Seroprotección/ seropositividad 0,1 UI/ml 0,016 UI/ml* Persistencia de 5 años 84,1-86,8 % 94,4-99,2 % Tétanos 0,1 UI/ml 96,2-100 % Tos ferina Toxoide pertúsico Hemaglutinia filamentosa Pertactina 5 U EL./ml 76,8-89,5% 95,0-98,1% *Porcentaje de sujetos con concentraciones de anticuerpos asociadas a protección frente a enfermedad ( 0,1 UI/ml por ensayo de ELISA ó 0,016 UI/ml por un ensayo de neutralización in-vitro con células Vero). Boostrix es bien tolerada, con un perfil de seguridad comparable al de las vacunas dt 17 Seguridad La reactogenicidad local de Boostrix (15 días post vacunación) es similar a la de la vacuna dt 17 dolor en el lugar de la inyección: 73% Boostrix ; 85% dt enrojecimiento: 32% Boostrix ; 39% dt inflamación: 21% Boostrix ; 30% dt
8 GSKEDC-SPN-2010-Boostrix-1210_D12:Layout 1 6/14/2010 6:40 PM Page 8 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO: Boostrix suspensión inyectable en jeringa precargada antitosferina (componente acelular) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: 1 dosis (0,5 ml) contiene: Toxoide diftérico 1 no menos de 2 Unidades Internacionales (UI) Toxoide tetánico 1 no menos de 20 Unidades Internaciones (UI) Antígenos de Bordetella pertussis Toxoide pertúsico 1 8 microgramos Hemaglutinina filamentosa 1 8 microgramos Pertactina 1 2,5 microgramos 1 adsorbidos en hidróxido de aluminio hidratado (Al(OH) 3) 0,3 miligramos Al y fosfato de aluminio (AlPO 4) 0,2 miligramos Al. Para consultar la lista completa de excipientes ver sección FORMA FARMACÉUTICA: Suspensión inyectable en jeringa precargada. Boostrix es una suspensión blanca turbia. 4. DATOS CLÍNICOS: 4.1. Indicaciones terapéuticas - Boostrix está indicada para la vacunación de recuerdo frente a difteria, tétanos y tos ferina a partir de 4 años de edad (ver sección 4.2). Boostrix no está indicada para la inmunización primaria Posología y forma de administración - Posología: Se recomienda una única dosis de 0,5 ml de la vacuna. Boostrix se puede administrar a partir de 4 años de edad. Boostrix se debe administrar de acuerdo con las recomendaciones oficiales y/o las prácticas médicas locales en relación al uso de vacunas que proporcionan una dosis baja de antígeno de difteria (adulto), antígeno de tétanos y antígenos de tos ferina. En sujetos de edad 40 años que no hayan recibido ninguna vacuna antidiftérica o antitetánica en los últimos 20 años, una dosis de Boostrix induce respuesta de anticuerpos frente a tos ferina y protege frente a tétanos y difteria, en la mayoría de los casos. Dos dosis adicionales de vacuna antidiftérica o antitetánica administradas uno y seis meses después de la primera dosis, maximizarán la respuesta de la vacuna frente a difteria y tétanos (Ver sección 5.1). Boostrix se puede utilizar en el manejo de heridas potencialmente tetanígenas en personas que han recibido previamente una serie primaria de vacunación con vacuna con toxoide tetánico y en las que está indicada una dosis de recuerdo frente a difteria y tos ferina. Se debe administrar inmunoglobulina antitetánica de forma concomitante, de acuerdo a las recomendaciones oficiales. La vacunación repetida frente a difteria y tétanos debe realizarse en los intervalos establecidos en las recomendaciones oficiales (generalmente 10 años). Forma de administración: Boostrix se debe inyectar por vía intramuscular profunda preferiblemente en la región deltoidea (ver sección 4.4) Contraindicaciones - Hipersensibilidad a los principios activos o a alguno de los excipientes. Hipersensibilidad después de la administración previa de vacunas antidiftérica, antitetánica o antitosferina. Boostrix está contraindicada si la persona ha presentado una encefalopatía de etiología desconocida en los 7 días siguientes a la vacunación previa con una vacuna con componente antitosferina. En estas circunstancias se debe utilizar una vacuna combinada frente a difteria-tétanos tipo adulto. Boostrix no debe ser administrada a sujetos que hayan experimentado trombocitopenia transitoria o complicaciones neurológicas (para convulsiones o episodios de hipotonía-hiporrespuesta, ver sección 4.4), tras una inmunización previa frente a difteria y/o tétanos. Como con otras vacunas, se debe posponer la administración de Boostrix en personas que padecen enfermedades febriles agudas graves. La presencia de una infección leve no es una contraindicación Advertencias y precauciones especiales de empleo - La vacunación debe ir precedida por una revisión de la historia médica (en particular respecto a las vacunaciones anteriores y la posible aparición de acontecimientos adversos). Si se produce alguno de los siguientes acontecimientos en relación temporal con la administración de una vacuna con componente antitosferina, se deberá considerar cuidadosamente la decisión de administrar nuevas dosis de vacunas que contengan el componente antitosferina: Fiebre 40,0ºC en las primeras 48 horas, no debida a otra causa identificable. Colapso o estado similar al shock (episodio hipotónico-hiporreactivo) en las 48 horas siguientes a la vacunación. Llanto inconsolable, persistente de 3 horas de duración, producido en las 48 horas siguientes a la vacunación. Convulsiones con o sin fiebre, producidas en los 3 días siguientes a la vacunación. Pueden existir circunstancias, tales como una elevada incidencia de tos ferina, en las que los potenciales beneficios superen los posibles riesgos. Como ocurre con cualquier vacuna, debe valorarse cuidadosamente el riesgo-beneficio de la inmunización con Boostrix o del retraso en la vacunación, de niños o lactantes que sufran un nuevo episodio o progresión de un trastorno neurológico grave. Como con todas las vacunas inyectables, se deberá disponer en todo momento del tratamiento y supervisión médica adecuados, para el caso poco común de aparición de una reacción anafiláctica tras la administración de la vacuna. Boostrix se debe administrar con precaución en individuos con trombocitopenia (ver sección 4.3) o algún trastorno hemorrágico, ya que puede producirse una hemorragia tras la administración intramuscular en estos individuos. Debe ejercerse una presión firme en el lugar de inyección (sin frotar) durante al menos dos minutos. Boostrix no se debe, bajo ninguna circunstancia, administrar por vía intravascular. La existencia de una historia familiar de convulsiones y acontecimientos adversos tras la vacunación con DTP, no constituyen contraindicaciones. La infección por el VIH no se considera una contraindicación. Tras la vacunación de pacientes inmunodeprimidos podría no obtenerse la respuesta inmunológica esperada. Al igual que con cualquier vacuna, puede que no se produzca una respuesta inmune protectora en todos los vacunados Interacción con otros medicamentos y otras formas de interacción - No se ha estudiado el uso concomitante de Boostrix con otras vacunas o con inmunoglobulina. No es probable que la administración conjunta provoque interferencias con las respuestas inmunes. Cuando se considere necesario, Boostrix se puede administrar simultáneamente con otras vacunas o inmunoglobulina en sitios diferentes de inyección. Como con otras vacunas, en pacientes que reciban terapia inmunosupresora puede no alcanzarse una respuesta adecuada Embarazo y lactancia - No se dispone de datos adecuados en humanos del uso de Boostrix durante el embarazo y no se han realizado estudios de toxicidad reproductiva en animales. Como con otras vacunas inactivadas, no se espera que la vacunación con Boostrix dañe al feto. Sin embargo, la vacuna debe utilizarse durante el embarazo sólo cuando sea claramente necesario, y los beneficios potenciales superen los posibles riesgos para el feto. No se ha evaluado el efecto de la administración de Boostrix durante la lactancia. Sin embargo, no se espera que suponga un riesgo para el lactante, puesto que Boostrix contiene toxoides o antígenos inactivados. El médico debe evaluar cuidadosamente el balance beneficio-riesgo de administrar Boostrix a mujeres que estén dando el pecho a sus hijos Efectos sobre la capacidad para conducir y utilizar máquinas - Es poco probable que la vacuna tenga algún efecto sobre la capacidad de conducir vehículos y utilizar máquinas Reacciones adversas - Aproximadamente vacunados han recibido una dosis de Boostrix en los ensayos clínicos realizados. Las reacciones adversas que ocurrieron más frecuentemente tras la administración de la vacuna fueron reacciones locales en el lugar de inyección (dolor, enrojecimiento e hinchazón) comunicadas en un 50-92% de los sujetos en cada ensayo. Estos normalmente aparecían dentro de las 48 horas después de la vacunación. Todas resolvieron sin secuelas. Las reacciones adversas con al menos una relación causal con la vacunación se listan a continuación. Las frecuencias se reportan como sigue: Muy frecuentes: ( 1/10) Frecuentes: ( 1/100 a < 1/10) Poco frecuentes: ( 1/1.000 a < 1/100) Raras: ( 1/ a 1/1.000) Muy raras: (< 1/10.000) Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. - En niños a partir de los 4 años de edad. (N=436) Ensayos clínicos: Trastornos del sistema nervioso. Muy frecuentes: somnolencia Trastornos gastrointestinales. Frecuentes: diarrea, vómitos Trastornos del metabolismo y de la nutrición. Muy frecuentes: anorexia Trastornos generales y alteraciones en el lugar de administración. Muy frecuentes: pirexia (fiebre > 37,5ºC), reacciones en el lugar de la inyección (tales como enrojecimiento y/o inflamación), dolor en el lugar de la inyección Frecuentes: inflamación edematosa de la extremidad en que se aplicó la inyección, pirexia (fiebre 39,0ºC) Trastornos psiquiátricos. Muy frecuentes: irritabilidad Vigilancia postcomercialización: Trastornos del sistema nervioso. Episodios de hipotonía e hiporrespuesta, convulsión Trastornos del sistema inmunológico. Reacción anafiláctica, reacción alérgica. -En adultos y adolescentes a partir de los 10 años. (N=1.515) Ensayos clínicos: Trastornos de la sangre y del sistema linfático. Poco frecuentes: linfadenopatía Trastornos del sistema nervioso. Muy frecuentes: dolor de cabeza Frecuentes: mareo Poco frecuentes: hipertonía Trastornos gastrointestinales: Poco frecuentes: vómitos Trastornos de la piel y del tejido subcutáneo. Poco frecuentes: hiperhidrosis, prurito Trastornos musculoesqueléticos y del tejido conjuntivo. Poco frecuentes: mialgia, rigidez articular Infecciones e infestaciones. Poco frecuentes: faringitis Trastornos generales y alteraciones en el lugar de administración. Muy frecuentes: reacciones en el lugar de la inyección (tales como enrojecimiento y/o inflamación), dolor en el lugar de la inyección Frecuentes: pirexia (fiebre 37,5ºC), malestar general, fatiga Poco frecuentes: pirexia (fiebre > 39ºC), masa en la zona de inyección, absceso estéril en la zona de inyección, dolor Vigilancia postcomercialización: Trastornos generales y alteraciones en el lugar de administración. Inflamación edematosa en la extremidad en donde se aplicó la inyección Trastornos del sistema inmunológico. Reacción anafiláctica, reacción alérgica Los datos obtenidos en 146 sujetos sugieren que puede haber un ligero aumento en la reactogenicidad local (dolor, enrojecimiento, inflamación) con las dosis sucesivas de acuerdo a la pauta 0, 1, 6 meses en adultos (> 40 años). Después de la administración de vacunas que contienen toxoide tetánico, en muy raras ocasiones se han comunicado reacciones adversas del sistema nervioso central o periférico, incluyendo parálisis ascendente o incluso parálisis respiratoria (p.e. Síndrome de Guillain-Barré) Sobredosis - No se ha comunicado ningún caso de sobredosis. 5. PROPIEDADES FARMACOLÓGICAS: 5.1. Propiedades farmacodinámicas - Grupo farmacoterapéutico: Vacunas bacterianas, vacuna antitosferina, código ATC: J07A J52. Un mes después de la vacunación, las respuestas inmunitarias a Boostrix fueron las siguientes: Antígeno Respuesta Adultos y adolescentes desde los 10 años de edad en adelante (% de vacunados) Niños desde los 4 años de edad en adelante (% de vacunados) Difteria 0,1 UI/ml 0,016 UI/ml* 81,2 90,0% 99,4 N/A Tétanos 0,1 UI/ml 99,2 Tos ferina - Toxoide pertúsico - Hemaglutinina filamentosa - Pertactina Respuesta a la vacuna Respuesta a la vacuna Respuesta a la 89,0-95,0-94,8-94,9-98,3% 88,9-98,3% 94,8-96,6% vacuna * Porcentaje de sujetos con concentraciones de anticuerpo asociadas a la protección frente a enfermedad ( 0,1 UI/ml por ensayo de ELISA o 0,016 UI/ml por un ensayo de neutralización in vitro con células Vero). En adultos y adolescentes, los estudios comparativos han demostrado que un mes después de la vacunación, los títulos de anticuerpos frente a difteria son similares a los de las vacunas dt tipo adulto con el mismo contenido antigénico
9 GSKEDC-SPN-2010-Boostrix-1210_D12:Layout 1 6/14/2010 6:40 PM Page 9 que Boostrix; se observaron títulos de anticuerpos antitetánicos más bajos cuando se compararon con vacunas dt tipo adulto. Como con otras vacunas dt tipo adulto, Boostrix induce títulos más altos de anticuerpos anti-d y anti-t en niños y en adolescentes que en adultos. Las tasas de seroprotección/índices de seropositividad observados 3 a 3,5 años y 5 a 6 años después de la vacunación con Boostrix fueron las siguientes: Antígeno Difteria Seroprotección/ seropositividad 0,1 UI/ml 0,016 UI/ml* Adultos y adolescentes desde los 10 años de edad en adelante (% vacunados) Persistencia de 3-3,5 años Persistencia de 5 años 71,2-91,6% 84,1-86,8% 97,4-94,4-99,2% Niños desde los 4 años de edad en adelante (% vacunados) Persistencia de 3-3,5 años 97,5% Persistencia de 5-6 años 94,2% No determinado Tétanos 0,1 UI/ml 94,8-96,2-98,4% 98,5% Tos ferina Toxoide pertúsico Hemaglutinia filamentosa Pertactina 5 U EL./ml 81,6-90,6% 94,8-99,2% 76,8-89.5% 95,0-98,1% 58,7% 99,2% 51,5% * Porcentaje de sujetos con concentraciones de anticuerpos asociadas a protección frente a enfermedad ( 0,1 UI/ml por ensayo de ELISA ó 0,016 UI/ml por un ensayo de neutralización in vitro con células Vero). Los antígenos de B. pertussis contenidos en Boostrix, son una parte integral de la combinación antitosferina acelular de la vacuna pediátrica (Infanrix), para la que se ha demostrado su eficacia tras vacunación primaria en un estudio de eficacia en contactos en el ámbito familiar. Después de la vacunación con Boostrix, los títulos de anticuerpos para los tres componentes de B. pertussis son más elevados que los observados durante el ensayo de eficacia en contactos en el ámbito familiar. Basándose en estas comparaciones, Boostrix proporcionaría protección frente a tos ferina, sin embargo el grado y la duración de la protección proporcionada por la vacuna no se han determinado. Tras la administración de una dosis de Boostrix a 139 adultos de edad 40 años que no habían recibido ninguna dosis de vacuna antidiftérica y antitetánica en los últimos 20 años, más del 98,5% de los adultos fueron seropositivos para los tres antígenos pertúsicos y el 81,5% y el 93,4% fueron seroprotegidos frente a difteria y tétanos respectivamente. Tras la administración de dos dosis adicionales uno y seis meses después de la primera dosis, la tasa de seropositividad fue del para los tres antígenos pertúsicos y las tasas de seroprotección para difteria y tétanos alcanzaron el 99,3% y el respectivamente Propiedades farmacocinéticas - No se requiere evaluación de las propiedades farmacocinéticas para las vacunas Datos preclínicos sobre seguridad - Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de seguridad, toxicidad específica y compatibilidad de los componentes. 6. DATOS FARMACÉUTICOS: 6.1. Lista de excipientes - Cloruro de sodio Agua para preparaciones inyectables. Para adjunvantes, ver sección Incompatibilidades - Boostrix no debe mezclarse en la misma jeringa con otras vacunas Período de validez - 3 años Precauciones especiales de conservación - Conservar en nevera (entre 2ºC y 8ºC). Una vez fuera de la nevera, la vacuna es estable durante 8 horas a 21ºC. No congelar. Conservar en el embalaje original para protegerlo de la luz Naturaleza y contenido del envase - 0,5 ml de suspensión inyectable en jeringa precargada (vidrio Tipo I) con tapón (goma butilo) con o sin agujas en tamaños de envases de 1, 10, 20, 25 ó 50. Puede que solamente estén comercializados algunos tamaños de envases Precauciones especiales de eliminación y otras manipulaciones - Antes de la administración, la vacuna se debe agitar bien, para obtener una suspensión blanca, turbia y homogénea y se debe examinar visualmente para observar si existe alguna partícula extraña y/o variación del aspecto físico. En caso de apreciarse alguna de estas circunstancias, desechar la vacuna. 7.TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN: GlaxoSmithKline, S.A. PTM C/ Severo Ochoa Tres Cantos Madrid 8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN: Nº PRM: DE/H/210/001/Nºreg: FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN: 20 de junio de 2001/3 de agosto de FECHA DE REVISIÓN DEL TEXTO: Febrero de CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN: Con receta médica. No reembolsable por el Sistema Nacional de Salud. P.V.P. 18,61, P.V.P. IVA 19,36. Referencias: 1. Campins Martí M, Moraga Llop FA. Tos ferina. Situación epidemiológica y nuevas estrategias de vacunación. Vacunas 2002; 3: Tozzi AE, Pandolfi E, Pastore Celentano L et al. Comparison of pertussis surveillance systems in Europe. Vaccine 2007; 25(2): Gil R, Moraga-Llop FA, Santos JM, Álvaro A, Gil A. Epidemiología de las hospitalizaciones atribuibles a tos ferina en niños menores de 12 meses en España ( ). Vacunas 2009; 10(2): Wendelboe AM, Van Rie A, Salmaso S, Englund JA. Duration of immunity against pertussis after natural infection or vaccination. Pediatr Infect Dis J, (5 Suppl): S Salleras L, Bayas JM, Calbo F et al. Vacunación anti-tos ferina de los adolescentes y adultos. Puesta al día. Vacunas 2007; 1: van Boven M, Ferguson NM, van Rie A. Unveiling the burden of pertussis. Trends Microbiol 2004; 12(3): Cherry JD. Epidemiology of pertussis. Pediatr Infect Dis J, (4): CDC, Pertussis --- United States, MMWR, (50): Campins-Martí M, Cheng HK, Forsyth K et al. Recommendations are needed for adolescent and adult pertussis immunisation: rationale and strategies for consideration. Vaccine 2002; 20: Cherry JD. How can we erradicate pertussis. Adv Exp Med Biol. 2009;634: Marès Bermúdez J, van Esso Arbolave D, Arístegui Fernández J, et al. Vaccination schedule of the spanish association of paediatrics: recommendations An Pediatr (Barc) Apr 24. [Epub ahead of print] 12. Gerbie MV, Tan TQ. Pertussis disease in new mothers. Effect on young infants and strategies for prevention. Obstet Gynecol, : CDC. Preventing tetanus, diphtheria, and pertussis among adolescents: use of tetanus toxoid, reduced diphtheria toxoid and acelular pertussis vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2006;55(No. RR-3). 14. CDC. Preventing tetanus, diphtheria, and pertussis among adults: use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2006;55(No. RR-17). 15. Van Damme P, Burgess M. Immunogenicity of a combined diphtheria tetanus acelular pertussis vaccine in adults. Vaccine (3-4): Tran Minh NN, He Q, Ramalho A, et al. Acellular vaccines containing reduced quantities of pertussis antigens as a booster in adolescents. Pediatrics 1999;. 104(6): e Turnbull FM, Heath TC, Jalaludin BB, Burges MA, Ramalho AC. A randomized trial of two acellular pertussis vaccines (dtpa and pa) and a licensed diphtheria-tetanus vaccine (Td) in adults. Vaccine 2001; 19(6): Ficha Técnica Boostrix (febrero 2010). 19. Cherry JD. The Epidemiology of Pertussis: A Comparison of the Epidemiology of the Disease Pertussis With the Epidemiology of Bordetella pertussis Infection. Pediatrics 2005;115; Advisory committee on immunization practices. Vaccines for children program. Vaccines to prevent diphtheria, tetanus and pertussis. Accessed: 14 de mayo Referencias calendario vacunal de la AEP: 1. Vacuna antihepatitis B (HB).- 3 dosis según dos pautas equivalentes: 0, 2, 6 m ó 2, 4, 6 m, ambas adecuadas para hijos de madres seronegativas (HBsAg neg.). Los hijos de madres HBsAg positivas recibirán en las primeras 12 h de vida la 1ª dosis de vacuna y 0,5 ml de inmunoglobulina antihepatitis B, la segunda dosis de vacuna a la edad de 1 ó 2 meses y la tercera dosis a los 6 m. Si la serología materna es desconocida debe administrarse la 1 a dosis de vacuna en las primeras 12 horas de vida e investigar la serología inmediatamente y, si resultara positiva, administrar la inmunoglobulina antihepatitis B en la primera semana de vida (preferentemente en las primeras 72 horas de vida). La administración de 4 dosis de vacuna HB es aceptable si se emplea la vacuna combinada hexavalente a los 2, 4 y 6 meses de edad en niños vacunados de la primera dosis al nacer. Los niños y adolescentes no vacunados según las pautas anteriores recibirán a cualquier edad 3 dosis según la pauta 0, 1, 6 m. 2. Vacuna frente a difteria, tétanos y tos ferina acelular (DTPa/Tdpa).- 6 dosis: primovacunación con 3 dosis de vacuna DTPa; refuerzo a los m (cuarta dosis), 4-6 años (quinta dosis) con DTPa y a los años (sexta dosis) con el preparado para adultos de baja carga antigénica de difteria y tos ferina (Tdpa). 3. Vacuna antipoliomielitis inactivada (VPI)- 4 dosis: primovacunación con 3 dosis y refuerzo a los m (cuarta dosis). 4. Vacuna conjugada frente a Haemophilus influenzae tipo b (Hib).- 4 dosis: primovacunación a los 2, 4, 6 m y refuerzo a los m (cuarta dosis). 5. Vacuna conjugada frente a meningococo C (MenC).- 3 dosis: la primera a los 2 m, la segunda a los 4 ó 6 m y la tercera entre los 12 y 18 m de edad. 6. Vacuna conjugada frente a neumococo (VNC).- 4 dosis: las tres primeras a los 2, 4, 6 m con un refuerzo entre los 12 y 18 meses de edad (cuarta dosis). 7. Vacuna frente a sarampión, rubeola y parotiditis (SRP).- 2 dosis de vacuna sarampión-rubeola-parotiditis (triple vírica). La primera a los m y la segunda a los 3-4 años de edad. 8.Vacuna frente al virus del papiloma humano (VPH).- Solo para niñas. 3 dosis entre años. Pauta vacunal según preparado comercial: Gardasil pauta 0, 2, 6 m y Cervarix pauta 0, 1, 6 m. 9. Vacuna antirrotavirus (RV).- 2 ó 3 dosis de vacuna frente a rotavirus según el preparado comercial: Rotarix 2 dosis a los 2, 4 m y RotaTeq 3 dosis a los 2, 4, 6 m (o a los 2, 3, 4 m), y la pauta debe completarse antes de la edad de 24 ó 26 semanas, respectivamente. 10. Vacuna frente a varicela (Var).- 2 dosis: la primera a los m y la segunda a los 3-4 años de edad. En pacientes susceptibles fuera de las anteriores edades, vacunación con 2 dosis con un intervalo entre ellas de, al menos, un mes. 11. Vacuna antigripal (Gripe).- 1 dosis de vacuna antigripal inactivada a partir de los 6 m de edad. Vacunación anual de pacientes con factores de riesgo para gripe; 1 dosis en mayores de 9 años; entre 6 m y 9 años se administrarán 2 dosis la primera vez con un intervalo de un mes y vacunación anual con 1 dosis en los años siguientes si persiste el factor de riesgo. A la edad de 6 a 35 meses la dosis es de 0,25 ml, mientras que a partir de 36 meses es de 0,5 ml. 12. Vacuna antihepatitis A (HA).- 2 dosis con un intervalo de 6-12 m a partir de los 12 m de edad. Vacunación de pacientes con indicación por viajes internacionales a países con endemicidad intermedia o alta, o por pertenecer a grupos de riesgo.
10 GSKEDC-SPN-2010-Boostrix-1210_D12:Layout 1 6/14/2010 6:41 PM Page 10 Boostrix La vacunación de recuerdo frente a la tos ferina en adolescentes y adultos puede disminuir la circulación de B.pertussis y contribuir a la eliminación del microorganismo de la población. 19 El CDC recomienda la vacunación de recuerdo frente a la tos ferina para: 14,20 niños de 4-6 años adolescentes entre años, para reemplazar la dosis de recuerdo frente a dt adultos, para reemplazar la dosis de recuerdo frente a dt adultos que tienen o que van a tener contacto cercano con niños menores de 1 año (por ejemplo, padres, abuelos, cuidadores y profesionales sanitarios), deben recibir una dosis única de dtpa para reducir el riesgo de transmisión de la tos ferina Boostrix es una vacuna combinada de carga antigénica reducida, conteniendo difteria, tétanos y tos ferina acelular, y está registrada como recuerdo en niños a partir de 4 años. Boostrix es una marca registrada del grupo de compañías de GlaxoSmithKline GlaxoSmithKline grupo de compañías. Todos los derechos reservados. S-4851 (Junio 2010)
REEMBOLSO DE GASTOS DE FARMACIA 2016
 REEMBOLSO DE GASTOS DE FARMACIA 2016 Garantía prestada desde 1 de enero de 2014 exclusivamente para clientes particulares de los productos Caser Salud Prestigio, Caser Salud Integral y Caser Salud Activa.
REEMBOLSO DE GASTOS DE FARMACIA 2016 Garantía prestada desde 1 de enero de 2014 exclusivamente para clientes particulares de los productos Caser Salud Prestigio, Caser Salud Integral y Caser Salud Activa.
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO. 25 μg
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA INGREDIENTES ACTIVOS Cada dosis de 0,5 ml de vacuna reconstituida contiene:
 1. NOMBRE DEL MEDICAMENTO PENTAVAC Vacuna de difteria, tétanos, tosferina acelular y poliomielitis inactivada, adsorbida y Vacuna de Haemophilus influenzae tipo b conjugada. 2. COMPOSICIÓN CUALITATIVA
1. NOMBRE DEL MEDICAMENTO PENTAVAC Vacuna de difteria, tétanos, tosferina acelular y poliomielitis inactivada, adsorbida y Vacuna de Haemophilus influenzae tipo b conjugada. 2. COMPOSICIÓN CUALITATIVA
Documentos Técnicos n.º 2
 Documentos Técnicos n.º 2 1 PAUTAS HABITUALES DE VACUNACIÓN Y ACTUALIZACIÓN DE CALENDARIO DE VACUNACIONES. AÑO 2006. Lo deseable es incorporar al niño que comienza o completa su vacunación al calendario
Documentos Técnicos n.º 2 1 PAUTAS HABITUALES DE VACUNACIÓN Y ACTUALIZACIÓN DE CALENDARIO DE VACUNACIONES. AÑO 2006. Lo deseable es incorporar al niño que comienza o completa su vacunación al calendario
Prospecto: información para el usuario
 Prospecto: información para el usuario Boostrix, Suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
Prospecto: información para el usuario Boostrix, Suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
Vacunaciones en grupos de riesgo
 Actividades: 1. Niño con inmunodeficiencia. 2. Niño con diatesis hemorrágica. 3. Niño prematuro. 4. Niño con infección VIH. 5. Niño viajero. 6. Niño con otras condiciones, enfermedades o riesgos. Actividad
Actividades: 1. Niño con inmunodeficiencia. 2. Niño con diatesis hemorrágica. 3. Niño prematuro. 4. Niño con infección VIH. 5. Niño viajero. 6. Niño con otras condiciones, enfermedades o riesgos. Actividad
Vacunación Infantil. www.madrid.org
 Vacunación Infantil www.madrid.org INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los
Vacunación Infantil www.madrid.org INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los
INFORMACIÓN ADICIONAL
 DE: DIRECCIÓN GENERAL DE SALUD PÚBLICA 01/12/2015 VACUNACIÓN FRENTE A TOS FERINA EN EL TERCER TRIMESTRE ASUNTO: DEL EMBARAZO INFORMACIÓN ADICIONAL Referencia: mmd VACUNA A EMPLEAR Hasta nueva indicación
DE: DIRECCIÓN GENERAL DE SALUD PÚBLICA 01/12/2015 VACUNACIÓN FRENTE A TOS FERINA EN EL TERCER TRIMESTRE ASUNTO: DEL EMBARAZO INFORMACIÓN ADICIONAL Referencia: mmd VACUNA A EMPLEAR Hasta nueva indicación
FICHA TECNICA. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Liofilizado (para una
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Liofilizado (para una
NUEVAS ESTRATEGIAS DE VACUNACIÓN FRENTE A TOS FERINA: VACUNACIÓN DE LA GESTANTE
 NUEVAS ESTRATEGIAS DE VACUNACIÓN FRENTE A TOS FERINA: VACUNACIÓN DE LA GESTANTE Alba Vilajeliu i Balagué avilajel@clinic.ub.es Servicio de Medicina Preventiva y Epidemiología Hospital Clínic de Barcelona
NUEVAS ESTRATEGIAS DE VACUNACIÓN FRENTE A TOS FERINA: VACUNACIÓN DE LA GESTANTE Alba Vilajeliu i Balagué avilajel@clinic.ub.es Servicio de Medicina Preventiva y Epidemiología Hospital Clínic de Barcelona
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
Vacunas Varicela- Herpes Zoster. Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC
 Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
Vacuna frente a la difteria, tétanos y tos ferina. (Comentarios a las fichas técnicas)
 Vacuna frente a la difteria, tétanos y tos ferina (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
Vacuna frente a la difteria, tétanos y tos ferina (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. TRIAXIS, suspensión inyectable.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TRIAXIS, suspensión inyectable. Vacuna de difteria, tétanos, tos ferina (componente acelular) (adsorbida, contenido de antígenos reducido). 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TRIAXIS, suspensión inyectable. Vacuna de difteria, tétanos, tos ferina (componente acelular) (adsorbida, contenido de antígenos reducido). 2. COMPOSICIÓN CUALITATIVA
CHARLA DE VACUNACIÓN INFANTIL PARA MADRES Y PADRES
 CHARLA DE VACUNACIÓN INFANTIL PARA MADRES Y PADRES José Tomás Rojas Centro de Salud Zaidín Sur INFECCIONES Enfermedades producidas por microbios (microscópicos), muy frecuente en la infancia, la mayoría
CHARLA DE VACUNACIÓN INFANTIL PARA MADRES Y PADRES José Tomás Rojas Centro de Salud Zaidín Sur INFECCIONES Enfermedades producidas por microbios (microscópicos), muy frecuente en la infancia, la mayoría
FICHA TÉCNICA. Nota: La utilización de Priorix debe realizarse de acuerdo a las recomendaciones oficiales.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
FICHA TÉCNICA. * cultivados en huevos de gallina embrionados procedentes de pollos sanos ** hemaglutinina
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
INFORME DE UTILIDAD TERAPÉUTICA VACUNA ANTINEUMOCÓCICA CONJUGADA DE 13 SEROTIPOS, PREVENAR 13
 INFORME DE UTILIDAD TERAPÉUTICA VACUNA ANTINEUMOCÓCICA CONJUGADA DE 13 SEROTIPOS, PREVENAR 13 Este informe está destinado al personal sanitario Fecha de elaboración del informe: 11 de abril de 2013 Versión
INFORME DE UTILIDAD TERAPÉUTICA VACUNA ANTINEUMOCÓCICA CONJUGADA DE 13 SEROTIPOS, PREVENAR 13 Este informe está destinado al personal sanitario Fecha de elaboración del informe: 11 de abril de 2013 Versión
CALENDARIO VACUNAL INFANTIL. 2013
 CALENDARIO VACUNAL INFANTIL. 2013 2013 Dr. Fernando Malmierca Sánchez Salamanca 2013 CALENDARIO VACUNAL INFANTIL. 2013 PREHISTORIA DE LAS VACUACIONES EL MÉTODO CIENTÍFICO DE JENNER (1796) Inoculó material
CALENDARIO VACUNAL INFANTIL. 2013 2013 Dr. Fernando Malmierca Sánchez Salamanca 2013 CALENDARIO VACUNAL INFANTIL. 2013 PREHISTORIA DE LAS VACUACIONES EL MÉTODO CIENTÍFICO DE JENNER (1796) Inoculó material
Preguntas y respuestas sobre el cambio del calendario común de vacunación infantil: Razones para la implantación de un nuevo esquema de vacunación
 Preguntas y respuestas sobre el cambio del calendario común de vacunación infantil: Razones para la implantación de un nuevo esquema Contenido del documento: 1. Qué es el calendario común 2. Cuál es el
Preguntas y respuestas sobre el cambio del calendario común de vacunación infantil: Razones para la implantación de un nuevo esquema Contenido del documento: 1. Qué es el calendario común 2. Cuál es el
PROSPECTO: INFORMACIÓN PARA EL USUARIO. PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos
 PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
VACUNACIÓN EN HUESPEDES ESPECIALES
 VACUNACIÓN EN HUESPEDES ESPECIALES E N F E R M E R A V A N E S A A R G Ü E L L O INMUNIDAD BACTERIANAS VIRALES VIVAS ATENUADAS BCG Sarampión Paperas Rubéola Varicela OPV Fiebre Amarilla Rotavirus INACTIVADAS
VACUNACIÓN EN HUESPEDES ESPECIALES E N F E R M E R A V A N E S A A R G Ü E L L O INMUNIDAD BACTERIANAS VIRALES VIVAS ATENUADAS BCG Sarampión Paperas Rubéola Varicela OPV Fiebre Amarilla Rotavirus INACTIVADAS
PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado)
 1. NOMBRE DEL MEDICAMENTO PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe*
1. NOMBRE DEL MEDICAMENTO PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe*
53 casos de tos ferina desde enero 39 casos en menores de 10 años Por norma se registran unos 70 casos al año como mucho
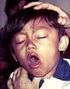 Girona registra 50 casos de tos ferina en los últimos dos meses Europa Press 24 de marzo de 2011 53 casos de tos ferina desde enero 39 casos en menores de 10 años Por norma se registran unos 70 casos al
Girona registra 50 casos de tos ferina en los últimos dos meses Europa Press 24 de marzo de 2011 53 casos de tos ferina desde enero 39 casos en menores de 10 años Por norma se registran unos 70 casos al
CALENDARIO DE VACUNACIONES PARA ADOLESCENTES Y ADULTOS.
 Calendario de vacunaciones sistemáticas del adulto y recomendaciones de vacunación para los adultos que presentan determinadas condiciones médicas o conductas de riesgo Grupo de Vacunas de la Sociedad
Calendario de vacunaciones sistemáticas del adulto y recomendaciones de vacunación para los adultos que presentan determinadas condiciones médicas o conductas de riesgo Grupo de Vacunas de la Sociedad
POLIOMIELITIS INTRODUCCIÓN INDICACIONES
 POLIOMIELITIS 3 INTRODUCCIÓN Es una enfermedad vírica aguda, a menudo identificada por la parálisis flácida aguda, pero con una amplia diversidad de presentaciones clínicas. El agente infeccioso es el
POLIOMIELITIS 3 INTRODUCCIÓN Es una enfermedad vírica aguda, a menudo identificada por la parálisis flácida aguda, pero con una amplia diversidad de presentaciones clínicas. El agente infeccioso es el
PROTOCOLO DE VACUNACIÓN DE PACIENTES ESPLENECTOMIZADOS
 DATOS DEL PACIENTE Apellidos: Nombre: Nº Historia Clínica: ; Fecha de nacimiento: ; Edad: años INDICACION Vacunación de pacientes esplenectomizados. Fecha de la intervención: VACUNACIÓN VACUNA ANTINEUMOCOCICA
DATOS DEL PACIENTE Apellidos: Nombre: Nº Historia Clínica: ; Fecha de nacimiento: ; Edad: años INDICACION Vacunación de pacientes esplenectomizados. Fecha de la intervención: VACUNACIÓN VACUNA ANTINEUMOCOCICA
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Servicio de Vigilancia Epidemiológica Dirección General de Salud Pública Consejería de Sanidad
 Servicio de Vigilancia Epidemiológica Dirección General de Salud Pública Consejería de Sanidad El Programa de Vacunaciones de Asturias desea agradecer a todos los profesionales implicados, sanitarios y
Servicio de Vigilancia Epidemiológica Dirección General de Salud Pública Consejería de Sanidad El Programa de Vacunaciones de Asturias desea agradecer a todos los profesionales implicados, sanitarios y
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela
 Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
Terapia de reposición en adultos y niños en síndromes de inmunodeficiencia primaria tales como:
 1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
Esquema nacional de vacunación 2015
 Esquema nacional de vacunación 2015 Definiciones en el PAI Susceptible Cualquier persona o animal que supuestamente no posee suficiente resistencia contra un agente patógeno determinado, que le proteja
Esquema nacional de vacunación 2015 Definiciones en el PAI Susceptible Cualquier persona o animal que supuestamente no posee suficiente resistencia contra un agente patógeno determinado, que le proteja
FICHA TÉCNICA. Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
Universidad de Cantabria. Inmunizaciones
 Universidad de Cantabria Inmunizaciones Errores frecuentes Las vacunas no son compatibles. Una serie de vacunaciones interrumpida debe volverse a iniciar. Las enfermedades agudas leves obligan a retrasar
Universidad de Cantabria Inmunizaciones Errores frecuentes Las vacunas no son compatibles. Una serie de vacunaciones interrumpida debe volverse a iniciar. Las enfermedades agudas leves obligan a retrasar
CALENDARIO VACUNAL PARA EL NIÑO CON INMUNOSUPRESIÓN GRAVE: NEOPLASIAS HEMATOLÓGICAS Y TUMORES SÓLIDOS (NO APLICABLE A PACIENTES CON TPH)
 Hospital CALENDARIO VACUNAL PARA EL NIÑO CON INMUNOSUPRESIÓN GRAVE: NEOPLASIAS HEMATOLÓGICAS Y TUMORES SÓLIDOS (NO APLICABLE A PACIENTES CON TPH) Las vacunas atenuadas están en general contraindicadas
Hospital CALENDARIO VACUNAL PARA EL NIÑO CON INMUNOSUPRESIÓN GRAVE: NEOPLASIAS HEMATOLÓGICAS Y TUMORES SÓLIDOS (NO APLICABLE A PACIENTES CON TPH) Las vacunas atenuadas están en general contraindicadas
BOLETÍN EPIDEMIOLÓGICO DE CASTILLA-LA MANCHA DICIEMBRE 2002/ Vol.14 /No 50 PREVENCIÓN Y CONTROL DE LA GRIPE (II)*
 BOLETÍN EPIDEMIOLÓGICO DE CASTILLA-LA MANCHA DICIEMBRE 2002/ Vol.14 /No 50 PREVENCIÓN Y CONTROL DE LA GRIPE (II)* RECOMENDACIONES DEL COMITÉ ASESOR DE ESTRATEGIAS DE INMUNIZACIÓN RECOMENDACIONES PARA EL
BOLETÍN EPIDEMIOLÓGICO DE CASTILLA-LA MANCHA DICIEMBRE 2002/ Vol.14 /No 50 PREVENCIÓN Y CONTROL DE LA GRIPE (II)* RECOMENDACIONES DEL COMITÉ ASESOR DE ESTRATEGIAS DE INMUNIZACIÓN RECOMENDACIONES PARA EL
Qué son las vacunas y cómo actúan?
 Qué son las vacunas y cómo actúan? Cuando se sufre una infección, el organismo reacciona produciendo unas sustancias llamadas anticuerpos, que nos defienden de la enfermedad y protegen frente a futuras
Qué son las vacunas y cómo actúan? Cuando se sufre una infección, el organismo reacciona produciendo unas sustancias llamadas anticuerpos, que nos defienden de la enfermedad y protegen frente a futuras
GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE
 FOLLETO DE INFORMACIÓN AL PROFESIONAL GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE 1. INDICACIONES Y USO 1.1 Niñas y Mujeres GARDASIL 9 es una vacuna
FOLLETO DE INFORMACIÓN AL PROFESIONAL GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE 1. INDICACIONES Y USO 1.1 Niñas y Mujeres GARDASIL 9 es una vacuna
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. DURAMUNE CACHORROS DP + C Liofilizado y disolvente para suspensión inyectable para perros
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
FICHA TÉCNICA. No se han establecido la seguridad y efectividad en niños menores de 12 meses.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vaqta 25 Unidades/0,5 ml suspensión inyectable en jeringa precargada. Vacuna antihepatitis A, inactivada, adsorbida. Para niños y adolescentes. 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vaqta 25 Unidades/0,5 ml suspensión inyectable en jeringa precargada. Vacuna antihepatitis A, inactivada, adsorbida. Para niños y adolescentes. 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
Department of Health and Human Services Food and Drug Administration 5600 Fishers Lane (HFI-40) Rockville, MD 20857. January 2002 (FDA) 02-9019S
 Department of Health and Human Services Food and Drug Administration 5600 Fishers Lane (HFI-40) Rockville, MD 20857 January 2002 (FDA) 02-9019S La Administración de Drogas y Alimentos, (FDA) es una agencia
Department of Health and Human Services Food and Drug Administration 5600 Fishers Lane (HFI-40) Rockville, MD 20857 January 2002 (FDA) 02-9019S La Administración de Drogas y Alimentos, (FDA) es una agencia
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
Guía de Referencia Rápida. Vacunación en la Embarazada GPC. Guía de Práctica Clínica. Catálogo maestro de guías de práctica clínica: IMSS-580-12
 Guía de Referencia Rápida Vacunación en la Embarazada GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-580-12 Guía de Referencia Rápida Z24 Necesidad de inmunización contra
Guía de Referencia Rápida Vacunación en la Embarazada GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-580-12 Guía de Referencia Rápida Z24 Necesidad de inmunización contra
Se recomienda beber un vaso de agua después de cada dosis y abundante líquido durante el día.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
Actualización de vacunas en el medio laboral
 Actualización de vacunas en el medio laboral Congreso de la Sociedad Española de Salud Laboral en la Administración Pública Reus, del 12 al 14 de mayo de 2004 Dra Anna Vilella Centro de Vacunación de Adultos.Servicio
Actualización de vacunas en el medio laboral Congreso de la Sociedad Española de Salud Laboral en la Administración Pública Reus, del 12 al 14 de mayo de 2004 Dra Anna Vilella Centro de Vacunación de Adultos.Servicio
FICHA TÉCNICA. STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada. Vacuna (viva) frente a la fiebre amarilla. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada. Vacuna (viva) frente a la fiebre amarilla. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Focetria suspensión inyectable en jeringa precargada Vacuna antigripal pandémica (antígenos de superficie,
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Focetria suspensión inyectable en jeringa precargada Vacuna antigripal pandémica (antígenos de superficie,
Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
FICHA TÉCNICA. Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125 g Lisozima hidrocloruro...0,100 g Neomicina (sulfato)...
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
Vacuna triple vírica (sarampión, rubeola, parotiditis)
 Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS
 VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS Mª Concepción n Fariñas as Álvarez Servicio de Medicina Preventiva, Calidad y Seguridad del Paciente. Hospital Sierrallana Jornadas de vacunación en
VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS Mª Concepción n Fariñas as Álvarez Servicio de Medicina Preventiva, Calidad y Seguridad del Paciente. Hospital Sierrallana Jornadas de vacunación en
ENFERMERA MIRIAM WOLFEL VACUNAS DEL CALENDARIO
 ENFERMERA MIRIAM WOLFEL VACUNAS DEL CALENDARIO VACUNAS Han contribuido de forma fundamental al bienestar de la población, reduciendo en forma importante la incidencia de enfermedades inmunoprevenibles.
ENFERMERA MIRIAM WOLFEL VACUNAS DEL CALENDARIO VACUNAS Han contribuido de forma fundamental al bienestar de la población, reduciendo en forma importante la incidencia de enfermedades inmunoprevenibles.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Synflorix suspensión inyectable Vacuna conjugada antineumocócica de polisacáridos (adsorbida) 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Synflorix suspensión inyectable Vacuna conjugada antineumocócica de polisacáridos (adsorbida) 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Sustancias activas: Virus RSB, cepa EV908, inactivado mínimo 10 5,5 *
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BOVIPAST RSP, suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BOVIPAST RSP, suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
Prospecto: información para el usuario. DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral)
 Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
Prevención y control de enfermedades
 Nutrición Durante el control del sobrepeso y la obesidad, se recomienda pesarse y medir la cintura cada quince días para valorar la evolución. Acuda con su médico familiar para recibir indicaciones del
Nutrición Durante el control del sobrepeso y la obesidad, se recomienda pesarse y medir la cintura cada quince días para valorar la evolución. Acuda con su médico familiar para recibir indicaciones del
PROTOCOLO VACUNAS y EMBARAZO
 1 PROTOCOLO VACUNAS y EMBARAZO Unitat Clínica d Infeccions Perinatals, Servei de Medicina Materno Fetal Institut Clínic de Ginecologia, Obstetrícia i Neonatologia. Hospital Clínic de Barcelona Centre de
1 PROTOCOLO VACUNAS y EMBARAZO Unitat Clínica d Infeccions Perinatals, Servei de Medicina Materno Fetal Institut Clínic de Ginecologia, Obstetrícia i Neonatologia. Hospital Clínic de Barcelona Centre de
Equino: Alivio de la inflamación y el dolor en trastornos músculo-esqueléticos agudos y crónicos. Alivio del dolor asociado al cólico equino.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
Por qué está aumentando la tos ferina?
 Por qué está aumentando la tos ferina? Fernando A. Moraga Llop Unidad de Patología Infecciosa. Área Pediátrica. Hospital Universitari Vall d Hebron. Universitat Autònoma de Barcelona. Barcelona, 2 de noviembre
Por qué está aumentando la tos ferina? Fernando A. Moraga Llop Unidad de Patología Infecciosa. Área Pediátrica. Hospital Universitari Vall d Hebron. Universitat Autònoma de Barcelona. Barcelona, 2 de noviembre
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
CALENDARIO DE VACUNACIONES 2014
 CALENDARIO DE VACUNACIONES 2014 El calendario comienza a estar vigente a partir del 1 de enero de 2014 MODIFICACIONES EN EL CALENDARIO DE VACUNACIONES Para adaptar el calendario de vacunaciones de Andalucía
CALENDARIO DE VACUNACIONES 2014 El calendario comienza a estar vigente a partir del 1 de enero de 2014 MODIFICACIONES EN EL CALENDARIO DE VACUNACIONES Para adaptar el calendario de vacunaciones de Andalucía
LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
CALENDARIO DE VACUNACIÓN INFANTIL 2015 Sistemático, acelerado y otras recomendaciones
 CALENDARIO DE VACUNACIÓN INFANTIL 2015 Sistemático, acelerado y otras recomendaciones Enero 2015 INTRODUCCIÓN La Ley General de Salud Pública aprobada en 2011 establece que el Consejo Interterritorial
CALENDARIO DE VACUNACIÓN INFANTIL 2015 Sistemático, acelerado y otras recomendaciones Enero 2015 INTRODUCCIÓN La Ley General de Salud Pública aprobada en 2011 establece que el Consejo Interterritorial
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
Más allá de proteger al vacunado. Dra. Juanita Zamorano R. Pediatra-Infectologa Universidad de los Andes Clínica Santa María
 Más allá de proteger al vacunado Dra. Juanita Zamorano R. Pediatra-Infectologa Universidad de los Andes Clínica Santa María Más allá de proteger al vacunado Inmunidad de rebaño Estrategia capullo Inmunización
Más allá de proteger al vacunado Dra. Juanita Zamorano R. Pediatra-Infectologa Universidad de los Andes Clínica Santa María Más allá de proteger al vacunado Inmunidad de rebaño Estrategia capullo Inmunización
PORQUE VACUNAR A NUESTROS NIÑOS?
 PORQUE VACUNAR A NUESTROS NIÑOS? A diario en todo el mundo se indican y se insiste con la necesidad de vacunar a los niños, ya que es la única forma de prevenir enfermedades infecciosas endémicas, causantes
PORQUE VACUNAR A NUESTROS NIÑOS? A diario en todo el mundo se indican y se insiste con la necesidad de vacunar a los niños, ya que es la única forma de prevenir enfermedades infecciosas endémicas, causantes
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Por dosis de 0,4 ml de vacuna reconstituida con el diluyente (agua para preparaciones inyectables):
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac KC 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 0,4 ml de vacuna reconstituida con el diluyente
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac KC 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 0,4 ml de vacuna reconstituida con el diluyente
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
LA VIGILANCIA DE LA SALUD COMO HERRAMIENTA DE PROMOCION DE LA SALUD. Desplazamiento de trabajadores a otros países
 LA VIGILANCIA DE LA SALUD COMO HERRAMIENTA DE PROMOCION DE LA SALUD Reus 14 de Mayo de 2004 Desplazamiento de trabajadores a otros países Pedro José Bernal González Técnico Responsable de Programas Vacunales
LA VIGILANCIA DE LA SALUD COMO HERRAMIENTA DE PROMOCION DE LA SALUD Reus 14 de Mayo de 2004 Desplazamiento de trabajadores a otros países Pedro José Bernal González Técnico Responsable de Programas Vacunales
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPCh FeLV 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio(s) activo(s) Por dosis de 1 ml:
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPCh FeLV 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio(s) activo(s) Por dosis de 1 ml:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
Vacunación frente al neumococo (estudio piloto) Instrucción
 Vacunación frente al neumococo (estudio piloto) Instrucción Esta instrucción puede ser consultada en la página web de laa Dirección Xeral de Innovación e Xestión da Saúde Pública: http://dxsp.sergas.es
Vacunación frente al neumococo (estudio piloto) Instrucción Esta instrucción puede ser consultada en la página web de laa Dirección Xeral de Innovación e Xestión da Saúde Pública: http://dxsp.sergas.es
POR QUÉ SE VACUNA CUANDO SON TAN PEQUEÑOS Y TANTAS VECES?
 2.5.- LAS VACUNAS La vacunación consiste en la administración de un germen (bacteria o virus), o parte de él, modificados para que no produzcan enfermedad, con objeto de producir defensas contra las enfermedades
2.5.- LAS VACUNAS La vacunación consiste en la administración de un germen (bacteria o virus), o parte de él, modificados para que no produzcan enfermedad, con objeto de producir defensas contra las enfermedades
PROTOCOLO DE SEGUIMIENTO DEL RIESGO DE INFECCIÓN POR EXPOSICIÓN LABORAL A PATOGENOS HEMATICOS EN PERSONAL DEL SERVICIO MURCIANO DE SALUD
 PROTOCOLO DE SEGUIMIENTO DEL RIESGO DE INFECCIÓN POR EXPOSICIÓN LABORAL A PATOGENOS HEMATICOS EN PERSONAL DEL SERVICIO MURCIANO DE SALUD 1. OBJETO El presente procedimiento tiene por objeto establecer
PROTOCOLO DE SEGUIMIENTO DEL RIESGO DE INFECCIÓN POR EXPOSICIÓN LABORAL A PATOGENOS HEMATICOS EN PERSONAL DEL SERVICIO MURCIANO DE SALUD 1. OBJETO El presente procedimiento tiene por objeto establecer
INFORME DE UTILIDAD TERAPÉUTICA VACUNA ANTIMENINGOCÓCICA TETRAVALENTE CONJUGADA, NIMENRIX
 INFORME DE UTILIDAD TERAPÉUTICA VACUNA ANTIMENINGOCÓCICA TETRAVALENTE CONJUGADA, NIMENRIX Este informe está destinado al personal sanitario Fecha de elaboración del informe: 30 de mayo 2013 Versión: 1
INFORME DE UTILIDAD TERAPÉUTICA VACUNA ANTIMENINGOCÓCICA TETRAVALENTE CONJUGADA, NIMENRIX Este informe está destinado al personal sanitario Fecha de elaboración del informe: 30 de mayo 2013 Versión: 1
Menalgil B 6 Comprimidos
 agencia española de medicamentos y productos sanitarios Menalgil B 6 Comprimidos 1. NOMBRE DEL MEDICAMENTO MENALGIL B 6 Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA MENALGIL B 6 Comprimidos Cada
agencia española de medicamentos y productos sanitarios Menalgil B 6 Comprimidos 1. NOMBRE DEL MEDICAMENTO MENALGIL B 6 Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA MENALGIL B 6 Comprimidos Cada
Lactofilus polvo oral
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
FICHA TÉCNICA. Carbocisteína 50 mg
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
Cada sobre de MOVICOL Pediátrico contiene los siguientes principios activos:
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
TÉTANOS INTRODUCCIÓN INDICACIONES DE LA VACUNACIÓN EFICACIA E INMUNOGENICIDAD
 TÉTANOS 6 INTRODUCCIÓN El tétanos es una enfermedad aguda inducida por una exotoxina del bacilo tetánico, el clostridium tetani, que crece en condiciones de anaerobiosis en las heridas. El reservorio está
TÉTANOS 6 INTRODUCCIÓN El tétanos es una enfermedad aguda inducida por una exotoxina del bacilo tetánico, el clostridium tetani, que crece en condiciones de anaerobiosis en las heridas. El reservorio está
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
VACUNAS COMBINADAS: HEXAVALENTES
 VACUNAS COMBINADAS: HEXAVALENTES Introducción Con el término de Vacunas Combinadas nos referimos a preparaciones en las que dos o más antígenos, pertenecientes a cepas diferentes de microorganismos patógenos
VACUNAS COMBINADAS: HEXAVALENTES Introducción Con el término de Vacunas Combinadas nos referimos a preparaciones en las que dos o más antígenos, pertenecientes a cepas diferentes de microorganismos patógenos
PROTOCOLO DE VACUNACIÓN DE PACIENTES ADULTOS CON TRASPLANTE DE ÓRGANO SÓLIDO
 Los pacientes trasplantados presentan un mayor riesgo de padecer enfermedades infecciosas y mayor gravedad. La necesidad de vacunación de estos pacientes se justifica por la disminución de su capacidad
Los pacientes trasplantados presentan un mayor riesgo de padecer enfermedades infecciosas y mayor gravedad. La necesidad de vacunación de estos pacientes se justifica por la disminución de su capacidad
Reflexiones de los cambios en el calendario vacunal
 Reflexiones de los cambios en el calendario vacunal Javier González de Dios Servicio de Pediatría. Hospital General Universitario de Alicante. Departamento de Pediatría. Universidad Miguel Hernández. Alicante.
Reflexiones de los cambios en el calendario vacunal Javier González de Dios Servicio de Pediatría. Hospital General Universitario de Alicante. Departamento de Pediatría. Universidad Miguel Hernández. Alicante.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
CONSEJERÍA DE SALUD Y POLÍTICA SOCIAL
 5310 CONSEJERÍA DE SALUD Y POLÍTICA SOCIAL DECRETO 24/2013, de 5 de marzo, por el que se modifica el Decreto 161/2006, de 6 de septiembre, por el que se aprueba el calendario íntegro de vacunaciones de
5310 CONSEJERÍA DE SALUD Y POLÍTICA SOCIAL DECRETO 24/2013, de 5 de marzo, por el que se modifica el Decreto 161/2006, de 6 de septiembre, por el que se aprueba el calendario íntegro de vacunaciones de
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
Vacunación Anti Influenza 2009. Mientras Antes se Vacune, Mejor
 Vacunación Anti Influenza 2009 Mientras Antes se Vacune, Mejor Qué es la Influenza? Es una enfermedad viral altamente contagiosa que afecta el sistema respiratorio. Es una de las enfermedades más severas
Vacunación Anti Influenza 2009 Mientras Antes se Vacune, Mejor Qué es la Influenza? Es una enfermedad viral altamente contagiosa que afecta el sistema respiratorio. Es una de las enfermedades más severas
COOPEXXONMOBIL Y CRECER CENTRO DE VACUNACIÓN LTDA. Entidad que busca fomentar la promoción y el control de enfermedades infecciosas, brindando
 COOPEXXONMOBIL Y CRECER CENTRO DE VACUNACIÓN LTDA. Entidad que busca fomentar la promoción y el control de enfermedades infecciosas, brindando siempre una atención profesional con alto conocimiento científico.
COOPEXXONMOBIL Y CRECER CENTRO DE VACUNACIÓN LTDA. Entidad que busca fomentar la promoción y el control de enfermedades infecciosas, brindando siempre una atención profesional con alto conocimiento científico.
 I Jornada de vacunación en Enfermería IRUÑA-PAMPLONA, 13 Y 14 DE NOVIEMBRE DE 2013 CONCEPTOS BÁSICOS Y GENERALIDADES DE LAS VACUNAS DECÁLOGO Definición Características y tipos Técnicas y zonas de aplicación
I Jornada de vacunación en Enfermería IRUÑA-PAMPLONA, 13 Y 14 DE NOVIEMBRE DE 2013 CONCEPTOS BÁSICOS Y GENERALIDADES DE LAS VACUNAS DECÁLOGO Definición Características y tipos Técnicas y zonas de aplicación
NEISVAC-C 0,5 ML. Suspensión inyectable en jeringa precargada VACUNA CONJUGADA DE POLISACÁRIDO FRENTE A MENINGOCOCO DEL GRUPO C (ADSORBIDA)
 NEISVAC-C 0,5 ML Suspensión inyectable en jeringa precargada VACUNA CONJUGADA DE POLISACÁRIDO FRENTE A MENINGOCOCO DEL GRUPO C (ADSORBIDA) Lea todo el prospecto detenidamente antes de empezar a usar esta
NEISVAC-C 0,5 ML Suspensión inyectable en jeringa precargada VACUNA CONJUGADA DE POLISACÁRIDO FRENTE A MENINGOCOCO DEL GRUPO C (ADSORBIDA) Lea todo el prospecto detenidamente antes de empezar a usar esta
PREGUNTAS FRECUENTES SOBRE CAMPAÑA DE VACUNACIÓN CONTRA EL SARAMPIÓN Y RUBÉOLA 2013-2014.
 PREGUNTAS FRECUENTES SOBRE CAMPAÑA DE VACUNACIÓN CONTRA EL SARAMPIÓN Y RUBÉOLA 2013-2014. A quiénes está dirigida la campaña? A todas aquellas personas nacidas entre 1967 y 1986 que no puedan comprobar
PREGUNTAS FRECUENTES SOBRE CAMPAÑA DE VACUNACIÓN CONTRA EL SARAMPIÓN Y RUBÉOLA 2013-2014. A quiénes está dirigida la campaña? A todas aquellas personas nacidas entre 1967 y 1986 que no puedan comprobar
Prospecto: información para el usuario. INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína
 Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
