TRABAJO PRÁCTICO N 1 LÍQUIDOS CORPORALES: SANGRE EXPLORACIÓN DE LOS MECANISMOS FISIOLÓGICOS INVOLUCRADOS EN EL EQUILIBRIO OSMÓTICO 1. OBJETIVOS 1.
|
|
|
- María Carmen Ramos Ortiz
- hace 8 años
- Vistas:
Transcripción
1 TRABAJO PRÁCTICO N 1 LÍQUIDOS CORPORALES: SANGRE EXPLORACIÓN DE LOS MECANISMOS FISIOLÓGICOS INVOLUCRADOS EN EL EQUILIBRIO OSMÓTICO 1. OBJETIVOS 1. A. OBJETIVOS GENERALES - Obtener muestra de un líquido corporal (sangre entera) y explorar su comportamiento ante soluciones de distintas osmolaridades. 1. B. OBJETIVOS ESPECÍFICOS - Conocer y aplicar la técnica de extracción de sangre por venopunción. Normas. - Conocer las normas generales de bioseguridad en el laboratorio. - Aplicar estrictamente las normas de bioseguridad en el laboratorio para la técnica de venopunción y el manejo de la muestra obtenida. - Conceptualizar y diferenciar suero y plasma. - Conocer los tipos de anticoagulantes y sus proporciones con respecto a la muestra y a las determinaciones a realizar. - Realizar la determinación de microhematocrito. - Distinguir la importancia del mantenimiento de la osmolaridad en los líquidos corporales 2. CONOCIMIENTOS NECESARIOS - Concepto de medio interno. Liquido intra y extracelular, composición. - Características del medio interno. Fijeza. - Cantidad de líquidos intra y extracelular. - Osmolaridad y tonicidad, estimación de la osmolaridad del plasma. Cambios de la osmolaridad provocados por el ingreso y egreso de líquidos. - Soluciones fisiológicas. - Medición de los líquidos corporales. - Normas internacionales para la extracción de sangre. Normas de bioseguridad. - Anticoagulantes, tipos, usos, proporciones. 3. DESARROLLO DEL TRABAJO PRÁCTICO 3.a. Fundamentos del TP La distribución de lo solutos en el organismo depende de si una sustancia puede atravesar la membrana celular, ya sea por difusión simple, transporte mediado por proteínas o transporte de vesículas. El agua es capaz de desplazarse libremente hacia adentro y hacia fuera de casi cualquier célula en el organismo, atravesando canales iónicos llenos de agua y canales de agua especiales creados por la proteína Acuaporinas. En este Trabajo práctico estudiaremos el efecto de soluciones con osmolaridades diferentes sobre una célula en particular: el Eritrocito. 3.b. Materiales TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 1
2 3.b.1. Materiales de limpieza (por comisión): Detergente Rejilla alcohol gel Cepillo para lavar tubos de hemólisis Rollos de cocina. 3.b.2. Extracción de Sangre por venopunción (Traer materiales para extracción) - jeringa (5 ml) y aguja descartable (25 x 0,8 ) para extracción de sangre. - algodón - alcohol - lazo - guantes - recipiente (tubos o frascos pequeños) para recepcionar la muestra con EDTA - descartador de elementos punzo cortantes - descartador de jeringas y algodón 3.b.3. Determinación del hematocrito -sangre entera con EDTA -capilares -microcentrífuga -plastilina -ábaco 3.c. Técnica 3.c.1. Extracción de Sangre por venopunción. Repasar procedimientos. Recomendaciones precautorias para la práctica segura de las venopunciones 1. Asegúrese de que el paciente cuente con el apoyo adecuado en caso de síncope. 2. Cuando se use una jeringa para extraer la sangre, se evitará la inyección de aire en la vena, al comprobar que el émbolo está completamente hasta el fondo del barril. 3. De ser posible, se evitará la extracción en la extremidad en que haya una venoclisis o transfusión de sangre, soluciones glucosadas o con electrólitos, porque diluye la muestra obtenida. Si es necesario obtener sangre cerca de un sitio en que funciona una venoclisis, se escogerá una zona por debajo de la misma. 4. El operador tendrá la seguridad de introducir la aguja con el ángulo exacto, para disminuir el riesgo de perforar la pared contraria de la vena y ocasionar un hematoma. 5. Evitar la Hemoconcentración: no dejar más de 2 minutos colocado el torniquete. 6. Liberar el torniquete antes de extraer la aguja esto evitará que aparezca un hematoma. Sitios de punción venosa TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 2
3 El sitio más usado para la punción venosa es el pliegue del codo como lo indica la Figura Nº 9 (Ver material de estudio); otros sitios son la muñeca y el dorso de la mano o el pie. Cuando se extraiga la muestra con el enfermo acostado, se le pedirá que permanezca sobre su dorso, con su cabeza un poco elevada y sus brazos reposando sobre los lados del cuerpo. Al extraer la sangre a un sujeto ambulatorio, se le indicará que se siente en una silla y apoye su brazo en el portabrazos o en la mesa de extracciones. Otras zonas: En adultos: venas superficiales del dorso de la mano o del dorso del pie. En niños de corta edad: vena yugular o femoral. En recién nacidos: vena yugular, vena femoral, vena umbilical, senos venosos del cráneo. Técnica de la punción venosa (Adaptado de NCCLS Pub H3 - A3, 1991) ***NATIONAL COMMITEE FOR CLINICAL LABORATORY STANDARS. USA. *** 1. Verificar el pedido original. 2. Preguntar al paciente sus nombres y apellido completo. No tomar ninguna muestra sin Identificación. 3. Preguntar al paciente sí esta en ayunas. 4. Informar al paciente que se le va a hacer. Tranquilizar al mismo. 5. El extraccionista debe tener identificación visible. 6. Posicionar al paciente adecuadamente para un acceso adecuado y confortable de la fosa antecubital. 7. Prepare todo el equipo necesario. 8. Dígale al paciente que cierre el puño. 9. Seleccione una vena adecuada. Se prefiere la cubital media o la cefálica. Si un brazo tiene una vía endovenosa, sacar del otro. 10. Limpiar con etanol 70%. Empezar en la zona de puntura y seguir con movimiento circular. Esperar que se seque. No volver a tocar. 11. Aplicar el torniquete. No dejar el torniquete puesto más de 1 minuto. 12. Fijar la vena con la otra mano. 13. Punzar. Penetrar la piel en ángulo de 15 grados con el brazo, con el bisel hacia arriba. Seguir la geografía de la vena con la aguja. Punzar suavemente. No introducir tan profundamente la aguja. Tirar del émbolo suavemente para no hemolizar. 14. Libere el torniquete cuando la sangre comienza a fluir. Nunca saque la aguja con el torniquete puesto. 15. Permita que el paciente se relaje. 16. Coloque suavemente un algodón sobre la punción y retire la aguja. Descarte la misma. Luego presione sobre el sitio. 17. Coloque un adhesivo sobre el sitio de punción. 18. Invierta los tubos con anticoagulante. No los agite. Llene los tubos suavemente para evitar hemólisis. 19. Chequee la condición del paciente. 20. Descarte los elementos en los recipientes apropiados para cada uno. No reencapsule las agujas. No remueva la aguja con la mano. Use el descartador. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 3
4 21. Enviar los tubos al laboratorio para su procesamiento. Obtención de muestras de sangre en niños Seguir correctamente las indicaciones propuestas anteriormente. Realizar el procedimiento valiéndose de ayuda de compañeros de trabajo si es necesario. Sujetar firmemente el brazo del niño, aún cuando el pequeño paciente no oponga resistencia al procedimiento; usualmente los niños tienden a reaccionar bruscamente al introducir la aguja. Esta reacción puede producir una herida mayor en el niño. Ventajas de las muestras obtenidas por punción venosa 1. La sangre venosa puede obtenerse en cantidad suficiente, haciendo posible la realización de exámenes múltiples y repetidos con la misma muestra. 2. Las alícuotas de plasma y suero pueden congelarse para futuras referencias. 3. Teóricamente, la punción venosa entraña menos problemas que la arterial: a) las presiones son más bajas, y por lo tanto, la hemorragia no significa un problema mayor; b) existen abundantes vasos colaterales venosos, de modo que la obstrucción de una vena periférica raras veces tiene importancia; c) la interrupción del flujo venoso compromete menos la viabilidad de los tejidos que la del flujo arterial. Desventaja de las muestras obtenidas por punción venosa 1. La punción venosa es un procedimiento un poco largo y puede ser difícil en niños, pacientes obesos y pacientes en estado de síncope. Precauciones 1. La estasis venosa prolongada hace a la muestra inapropiada, pues provoca hemoconcentración. 2. Algunos componentes no son estables en sangre anticoagulada y por eso los recuentos de plaquetas y el índice de sedimentación deben hacerse no más de dos horas después de obtener la sangre. 3. La sangre venosa no debe aspirarse de la misma extremidad que se usa para el tratamiento intravenoso. Qué hacer si un paciente pierde el conocimiento durante el procedimiento? Retire inmediatamente la aguja del lugar de la punción. Sostenga al apaciente con fuerza para evitar que caiga y se golpee. Solicite ayuda. Coloque sobre la herida de la punción, un apósito, algodón o gasa con sostenida presión, para evitar que siga sangrando. Puede acostarse al paciente en el suelo o en una camilla y deben levantarse sus piernas (Posición de Trendelemburg). Coloque un algodón impregnado con alcohol frente a la nariz del paciente. Permita que el paciente tenga buena ventilación. Abra el cuello de su camisa y desajuste la corbata si es el caso. El paciente por si solo sabrá cuando podrá incorporarse. Si las circunstancias lo permiten, haga medición de la presión sanguínea. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 4
5 3.c.2. Microhematocrito por centrifugación Sangre entera anticoagulada con EDTA: Homogeneizar la muestra durante varios minutos. Cargar luego 2 capilares (sin heparina azules) hasta sus 2/3 partes con sangre del tubo de hemograma. Sellar uno de sus extremos con plastilina. Centrifugar durante 5 minutos a R.P.M. Lectura: Luego de la centrifugación se procede a la lectura de los capilares con el Ábaco. 1. Ajuste al 100% 2. Lectura sobre la línea que separa los glóbulos rojos de los blancos y paquetas. 3. Si esta capa es muy delgada, proceder igualmente midiendo el hematocrito sobre el borde superior de la fracción de glóbulos rojos. Plasma Glóbulos Blancos y Plaquetas Glóbulos Rojos TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 5
6 TABLA 1: VALORES DE REFERENCIA HEMATOLÓGICOS PARA RECIÉN NACIDOS A TÉRMINO, NIÑOS Y ADULTOS (Rosario Htal. Centenario 2002)3.c.3. Experiencia Hb Hto GR VCM HCM CHCM (g/dl) (%) (10 6 /ul) (fl) (pg) (g/dl) Nacimiento * día días días días días meses meses meses meses meses años años años Hombres Mujeres Homb. Y Muj Edad Procedimiento: TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 6
7 Proceder a la extracción de sangre por venopunción según el punto 3.c.1., la muestra obtenida dispensarla en un tubo con EDTA, homogeneizar. Seguidamente, distribuir 0,5 ml en cuatro tubos A, B, C y D y agregar: Tubo A: 0,5 ml de solución hipertónica. Tubo B: 0,5 ml de agua destilada. Tubo C: 0,5 ml de solución fisiológica. Tubo D: Muestra de sangre entera sin dilución alguna. Realizar un microhematocrito con el contenido de los tubos A, B, C y D. 3.d. Resultados Consignar los valores obtenidos en la siguiente tabla: TUBO HEMATOCRITO HEMOLISIS (SI/NO) A B C D 3.e. Conclusiones A partir de los valores obtenidos explique cuáles fueron los mecanismos fisiológicos implicados y qué importancia tiene el mantenimiento de la osmolalidad del plasma. 4. GUÍA DE ESTUDIO 1) Qué elementos tiene que tener preparados y a disposición antes de realizar la venopunción? 2) Complete: Una vez realizada la venopunción, Cuál es el procedimiento para descartar el material utilizado en la misma? a) Agujas b) Jeringas c) Algodón d) Guantes 3) Indique las diluciones de lavandina a utilizar para: a) Desinfectar elementos con restos de material biológico b) Desinfectar la mesada de trabajo c) Cómo las prepararía a partir de una lavandina comercial de concentración 55gCl/l si desea obtener 2 litros de cada dilución? 4) Qué diferencia hay entre sangre entera y suero? Cómo se obtiene plasma? 5) En el práctico Ud. realizará hematocritos: a) Qué tipo de muestra debe obtener? Cómo la obtiene? b) Si quisiera realizar dosaje de iones, por ejemplo sodio y calcio, le serviría esa muestra? 6) Qué es la bioseguridad? 7) Cuántos tipos de riesgo existen en un laboratorio? TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 7
8 8) Qué medidas de bioseguridad tomará Ud durante el presente trabajo práctico? 9) Cuáles son los objetivos de este trabajo práctico? 10) A que se debe la Osmolaridad del Plasma? Cuál es su valor? 5. BIBLIOGRAFÍA Textos de cabecera Cingolani, H. E.; Houssay, A. B. y Col: Fisiología Humana de Houssay. 7ª Edición. Editorial El Ateneo. Buenos Aires Dvorkin, M. A.; Cardinali, D. P.; Iermoli, R. H.: Best & Taylor. Bases Fisiológicas de la Práctica Médica. 14ª Edición. Editorial Médica Panamericana. Buenos Aires Guyton, A. C.: Tratado de Fisiología Médica. 11ª Edición. Editorial Elsevier. Madrid Koeppen, B.M.; Stanton, B.A.: Berne & Levy. Fisiología. 6ª Edición. Editorial Elsevier Mosby. Madrid, Silvernagl, S; Despopoulos, A.: Fisiología. Texto y Atlas. 7ª Edición. Editorial Médica Panamericana. Madrid, Silverthorn, D. U.: Fisiología Humana. Un Enfoque Integrado; 4ª Edición. Editorial Médica Panamericana. Buenos Aires Coppo, J. A.: Fisiología Comparada del Medio Interno. 2ª Edición corregida y aumentada. Editorial Universidad Católica de Salta. Departamento Editorial EUCASA. Salta Textos de consulta Henry, J.B.: El Laboratorio en El Diagnóstico Clínico: Homenaje a Todd-Stanford & Davidsohn. Tomos I y II. Editorial Marbán Brunetti, Alba Beatriz: Anticoagulantes. Curso PARÁMETROS DEL HEMOGRAMA. UTILIDAD E INTERPRETACIÓN. Resolución 811/08 C.D. Corrientes, 16 de octubre de Gauna Pereira, María del Carmen: Bioseguridad en el laboratorio. Curso PARÁMETROS DEL HEMOGRAMA. UTILIDAD E INTERPRETACIÓN. Resolución 811/08 C.D. Corrientes, 16 de octubre de Gauna Pereira, María del Carmen: Obtención de muestras sanguíneas. Curso PARÁMETROS DEL HEMOGRAMA. UTILIDAD E INTERPRETACIÓN. Resolución 811/08 C.D. Corrientes, 16 de octubre de Iovine, E.; Atilio Se Iva, A.: El Laboratorio en la Clínica. 3ª Edición. Editorial Médica Panamericana TRABAJO PRÁCTICO N 2 FISIOLOGÍA LEUCOCITARIA TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 8
9 1. OBJETIVOS 1. A. OBJETIVOS GENERALES - Relacionar las variaciones fisiológicas de la concentración de Leucocitos y de la Fórmula Leucocitaria Relativa con los procesos de defensa involucrados en diferentes situaciones. 1. B. OBJETIVOS ESPECÍFICOS - Diferenciar morfológicamente los distintos tipos de leucocitos en frotis coloreados. - Conocer el procedimiento para el recuento de leucocitos en cámara de Neubauer. - Desarrollar destreza en la realización de frotis sanguíneo para posterior observación microscópica. - Observar una fórmula leucocitaria relativa en un frotis teñido con coloración de May Gründwald Giemsa. 2. CONOCIMIENTOS NECESARIOS - Leucopoyesis. - Fisiología Leucocitaria. Fagocitosis. Mecanismos microbicidas dependientes e independientes de oxígeno. - Variaciones fisiológicas de la concentración de leucocitos. - Variación fisiológica de la fórmula leucocitaria relativa. 3. DESARROLLO DEL TRABAJO PRÁCTICO 3.a. FUNDAMENTOS 3.a.1. Recuento de leucocitos en Cámara de Neubauer El recuento de Leucocitos es la técnica que permite calcular el número de glóbulos blancos que se encuentran en un volumen de sangre. Una forma de expresar el resultado es como el número de leucocitos por mm 3. El recuento orienta en el diagnóstico y evolución de un sujeto en estudio. Los leucocitos protegen al organismo de las infecciones y colaboran en la respuesta inmunológica. Si se desarrolla una infección, los leucocitos atacan y destruyen las bacterias, hongos o virus causantes de la infección, razón por la cual las variaciones están frecuentemente asociadas a la presencia de enfermedad. También se utiliza para controlar tratamientos antiinfecciosos y/o antiinflamatorios y, entre otros estudios, para el control de tratamientos quimioterápicos o con radiación. Algunos medicamentos que pueden alterar los resultados: Indometacina. Drogas antitiroideas. Antiinflamatorios no esteroideos. Anticonvulsivantes. Fentoína. Antibióticos y quimioterápicos, no obstante no debemos olvidar que existen variaciones fisiológicas del numero de leucocitos tales como: nacimiento, estrés, ejercicio y digestión. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 9
10 3.a.2. Frotis coloreado de sangre Es un examen que permite diferenciar y cuantificar los distintos tipos de leucocitos que se hallan circulando en sangre como así también la observación de las plaquetas. La observación microscópica de frotis coloreados permite reconocer los elementos morfológicamente normales y en distinto estado de maduración y aquellos que presentan formas alteradas. 3.b. MATERIALES 3.b.1. Recuento de leucocitos en cámara de Neubauer o Sangre anticoagulada con EDTA o Líquido de Türk: (ácido acético glacial 2% V/V, con 5 gotas de azul de metileno 0,3% P/V cada 100 ml de solución). o Cámara de Neubauer. o Microscopio. 3.b.2. Frotis coloreado de sangre o Sangre anticoagulada con EDTA o Portaobjetos Extensores. o Colorantes: May Gründwald Giemsa o Aceite de inmersión o Microscopio 3.b.3. Limpieza (por comisión): Detergente Rejilla alcohol gel Cepillo para lavar tubos de hemólisis Rollos de cocina. 3.c. TÉCNICA 3.c.1. Recuento de leucocitos en cámara de Neubauer Realizar una dilución 1/20 de sangre entera anticoagulada con EDTA, en solución o líquido de Türk. Este último, destruye los eritrocitos por hemólisis y deja intactos a los glóbulos blancos. Proporción sugerida: 20 μl de sangre y 0,38 ml de Türk. Luego de cargar la sangre en la pipeta, limpie su exterior con papel absorbente y verifique que la sangre continúa en el mismo nivel. Cuando descargue la sangre sobre el líquido diluyente, enjuague la pipeta aspirando y expulsando este líquido tres veces. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 10
11 Monte la laminilla de vidrio (cubrecámara) en la cámara para recuento (Fig. 1), presionándola cuidadosamente para colocarla en su sitio. Cuando ha sido montada adecuadamente, entre las dos superficies del vidrio se observan unas bandas de color, llamadas anillos de Newton. Con la micropipeta cargue la cámara por capilaridad para el recuento. Evite llenarla más allá del área cuadriculada (Fig. 2). Si el líquido se derramar en el canal que se encuentra entre las dos cámaras, o a los lados, la operación se deberá repetir (quite y limpie la laminilla de vidrio y la cámara). Fig. 1 Fig. 2 Deje reposar la cámara sobre la mesa de trabajo durante 3 minutos a fin de que las células se asienten y sedimenten por su mayor densidad con respecto al solvente. Coloque la cámara en la platina del microscopio y obsérvela con el objetivo de 10X. Cámara de Neubauer: 1 área de la cámara = 9 mm 2 2 profundidad de la cámara = 0,1 mm Contar las células en un área de 4 mm 2 utilizando los cuadros numerados 1, 3, 7 y 9, (cuadrados secundarios) como se indica en la figura. Incluir en este recuento las células que se observen sobre las líneas de dos lados de cada cuadro revisados, por ej.: incluya a los leucocitos sobre las líneas de arriba y a la derecha, y no cuente los que están sobre las líneas de abajo y a la izquierda; así evita contar dos veces a la misma célula. Cálculo del número de células en un litro de sangre: Células por mm 3 = células contadas x 10 x 20 = células contadas x 50 4 Cada uno de los cuatro cuadrados primarios tiene un área de 1 mm 2 ; como se cuentan 4 de ellos el área mide 4 mm 2. La profundidad de la cámara es de 0,1 mm; en consecuencia, el volumen en que se cuentan las células es 0,4 mm 3. De este modo la división por 4 y la multiplicación por 10, dará el número de TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 11
12 leucocitos que haya en 1 mm 3 de sangre diluida. Ya que la dilución es 1/20, la multiplicación por 20 dará el número de células en 1 mm 3 de sangre sin diluir. Valor de referencia para hombres y mujeres adultos: a células/mm 3 En el caso de encontrar leucocitosis, se realizará una nueva dilución de 1/40; y en el caso de leucopenia, de 1/10. Esto permitirá contar las células de manera más clara y aumentar la precisión. 3.c.2. Frotis coloreado de sangre Se realizará el extendido, colocando una gota de sangre directamente de la jeringa sobre un portaobjetos limpio y seco; luego con un extensor apoyado sobre la gota, en un ángulo de 45 se procede a realizar la extensión de sangre. Dejarlo secar a temperatura ambiente y una vez seco el portaobjetos se lo puede identificar escribiendo sobre el extendido con lápiz (Nº de orden o el apellido del paciente). Identificados los extendidos se procede a su coloración. Un frotis bien confeccionado debe constar de una zona inicial gruesa (cabeza), una zona central (cuerpo) de mediano espesor (zona ideal para la lectura) y la zona final (cola) delgada que termina en un borde convexo en forma de serrucho. El recuento diferencial se realiza preferentemente en el cuerpo del expendido, contando 100 leucocitos siguiendo un desplazamiento como indica la figura. Se elige un campo microscópico, se registra los diferentes tipos de leucocitos observados y se pasa al siguiente hasta completar los 100 elementos. Los resultados obtenidos se expresan en porcentaje. Coloración de May- Grundwald- Giemsa. 1. Sobre el extendido seco e identificado colocar una película del colorante May- Gründwald (que cubra toda la superficie del portaobjetos) durante 3 minutos. Fase de fijación. 2. Sin volcar agregar igual cantidad de agua corriente, dejando por el lapso de 2 minutos una película de agua y colorante. Luego lavar con agua. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 12
13 3. Colocar por último una solución acuosa de Giemnsa a razón de 2 gotas del colorante por cada ml de agua, durante 15 minutos. Lavar con agua corriente. 4. Escurrir y dejar secar. 5. Observar al microscopio, con un objetivo de 40X y luego con uno de 100X utilizando aceite de inmersión. Posibles causas de error en la confección del extendido - Portaobjetos sucios, húmedos, viejos. - Excesiva cantidad de sangre, extensiones gruesas. - No esperar a que se seque completamente. - Prolongado tiempo de tinción. - Lavado inadecuado. Valores de Referencia de fórmula leucocitaria relativa para un adulto LEUCOCITOS Valor Porcentual (%) Valor absoluto /mm 3 Neutrófilo Segmentado Neutrófilo en Cayado Eosinófilo Basófilo Linfocitos Monocitos Fuente: Manual de Técnicas Básicas para un Laboratorio de Salud OPS Nº Morfología: Neutrófilos: El citoplasma es abundante y se tiñe de color rosado. En él hay numerosas granulaciones neutrófilas que se tiñen de color rosa-azulado y son de pequeño tamaño. El núcleo se tiñe intensamente de azul, es irregular y polisegmentado, variando el número de lóbulos de 2 a 5. Eosinófilos: se llaman así por el color rojo con el que aparecen al microscopio por una tinción con eosina. La estructura de estas células se parece a la de los neutrófilos segmentados, pero con algunas diferencias. El núcleo se tiñe algo menos y tiene 2 lóbulos, normalmente dispuestos en forma de anteojos. Las granulaciones citoplasmáticas son de mayor tamaño, redondo u ovalado. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 13
14 Basófilos: Poseen un núcleo con forma de S. Contienen gránulos gruesos Basófilos de color azul-violeta intenso que se ubican sobre el núcleo cubriéndolo por completo. Linfocitos: Tienen un núcleo celular único. El núcleo del linfocito se tiñe de color azul oscuro. El citoplasma es escaso y se tiñe de un color azul pálido. Monocito: Es la célula de mayor tamaño de la sangre normal. Contiene un único núcleo, generalmente excéntrico y con forma redondeada, lobulada o en forma de herradura. Se tiñe de un azul más débil que los linfocitos. El citoplasma es abundante y se tiñe de un color azul grisáceo conteniendo a veces gránulos finos de color entre rojo y púrpura, menos diferenciados y pequeños que los gránulos de los neutrófilos. 3.d. Experiencia 3.d.1. Recuento de Leucocitos en cámara de Neubauer o Preparar la dilución para el recuento de leucocitos según técnica indicada previamente. o Observar al microscopio con aumento de 10X. 3.d.2. Frotis de sangre coloreado o Realizar un frotis sanguíneo según técnica indicada previamente. o Colorear el frotis realizado. o Observar al microscopio con aumento de 40x y 100x (objetivo). 3.e. Informe y Resultados 3.e.1. Recuento de Leucocitos en cámara de Neubauer o Calcular el recuento absoluto de leucocitos en muestra procesada. o Indicar si los valores hallados están dentro del intervalo de referencia para le edad y el sexo. o Interpretar los valores del Recuento Leucocitario del caso proporcionado en el presente TP. 3.e.2. Frotis de sangre coloreado o Realizar el recuento diferencial de leucocitos en el frotis coloreado y calcular su concentración absoluta teniendo en cuenta el valor hallado de la concentración de leucocitos en el recuento en cámara de Neubauer. o Dibujar los leucocitos observados con los diferentes aumentos y relacionarlos con los eritrocitos. o Interpretar los valores de la Fórmula Leucocitaria Relativa del caso proporcionado en el presente TP y calcular los correspondientes Valores Absolutos para cada tipo de leucocito. 3.f. Conclusiones TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 14
15 En base a los conocimientos previos, indique cómo espera encontrar un recuento absoluto de leucocitos y su fórmula relativa en los siguientes casos: a. Infestación por larva migrans: b. Embarazo tercer trimestre: c. Inmediatamente luego de hacer un ejercicio físico intenso: Justifique cada respuesta. 4. GUÍA DE ESTUDIO 1. Qué muestra se utiliza para realizar un recuento de glóbulos blancos? 2. Qué anticoagulante se emplea para realizar un recuento de Glóbulos Blancos? 3. Utiliza anticoagulante en la muestra para realizar el frotis? Explique brevemente. 4. Cuáles son las posibles causas de error analítico que se puede cometer en el desarrollo de las técnicas del recuento de glóbulos blancos y frotis sanguíneos? 7. Teniendo en cuenta los valores de referencia citados en ambos casos, haga un listado de las variaciones fisiológicas y por lo menos dos fisiopatológicas en cada determinación y explique brevemente. 5. BIBLIOGRAFÍA TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 15
16 Textos de cabecera Cingolani, H. E.; Houssay, A. B. y Col: Fisiología Humana de Houssay. 7ª Edición. Editorial El Ateneo. Buenos Aires Dvorkin, M. A.; Cardinali, D. P.; Iermoli, R. H.: Best & Taylor. Bases Fisiológicas de la Práctica Médica. 14ª Edición. Editorial Médica Panamericana. Buenos Aires Guyton, A. C.: Tratado de Fisiología Médica. 11ª Edición. Editorial Elsevier. Madrid Koeppen, B.M.; Stanton, B.A.: Berne & Levy. Fisiología. 6ª Edición. Editorial Elsevier Mosby. Madrid, Silvernagl, S; Despopoulos, A.: Fisiología. Texto y Atlas. 7ª Edición. Editorial Médica Panamericana. Madrid, Silverthorn, D. U.: Fisiología Humana. Un Enfoque Integrado; 4ª Edición. Editorial Médica Panamericana. Buenos Aires Coppo, J. A.: Fisiología Comparada del Medio Interno. 2ª Edición corregida y aumentada. Editorial Universidad Católica de Salta. Departamento Editorial EUCASA. Salta Textos de consulta Henry, J.B.: El Laboratorio en el Diagnóstico Clínico: Homenaje a Todd-Stanford & Davidsohn. Tomos I y II. Editorial Marbán Cristaldo, Daniel Osmar: Pruebas que Conforman el Hemograma. Curso PARÁMETROS DEL HEMOGRAMA. UTILIDAD E INTERPRETACIÓN. Resolución 811/08 C.D. Corrientes, 16 de octubre de Gauna Pereira, María del Carmen: Bioseguridad en el Laboratorio. Curso PARÁMETROS DEL HEMOGRAMA. UTILIDAD E INTERPRETACIÓN. Resolución 811/08 C.D. Corrientes, 16 de octubre de Ióvine, E.; Atilio SeIva, A.: El Laboratorio en la Clínica. 3ª Edición. Editorial Médica Panamericana Levy-Lambert: Manual de técnicas Básicas para un Laboratorio de Salud. Organización Panamericana de la Salud TRABAJO PRÁCTICO Nº 3 TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 16
17 PROPIEDADES DE LA SANGRE DETERMINACIÓN DE GRUPOS SANGUÍNEOS INTERPRETACIÓN FISIOLÓGICA DE LAS PRUEBAS 1. OBJETIVOS Que, a partir de los conocimientos teóricos, los alumnos logren: - Reconocer los factores plasmáticos y globulares que influyen en la velocidad de sedimentación globular. - Interpretar los procesos fisiológicos involucrados en la Resistencia Globular Osmótica - Comprender los procesos fisiológicos que se desencadenan ante la incompatibilidad sanguínea. - Adquirir destreza en la determinación e interpretación de los grupos sanguíneos de interés clínico. - Reconocer y evitar errores comunes en la determinación de los grupos sanguíneos. - Aplicar continuamente las condiciones de bioseguridad en todos los trabajos de laboratorio. 2. CONOCIMIENTOS TEÓRICOS NECESARIOS Eritrocitos. Membrana. Estructura. Sangre entera. Plasma Sanguíneo. Composición. Sistemas de grupos sanguíneos. Características antigénicas de los grupos sanguíneos de importancia clínica. Anticuerpos del sistema ABO y sistema Rh. Nociones básicas de antígeno anticuerpo. Reacciones in vitro e in vivo. Pruebas de aglutinación. 3. DESARROLLO DEL TRABAJO PRÁCTICO 3.a. FUNDAMENTOS 3.a.1. Eritrosedimentación Si se impide la coagulación de la sangre se produce, al cabo de un tiempo, la sedimentación de los eritrocitos. Esta determinación se basa en la diferencia existente entre las densidades y los volúmenes de los compartimientos sanguíneos. Depende de un factor globular (densidad y masa del glóbulo rojo) y de uno plasmático (resistencia que opone a la sedimentación de las células rojas). La sangre es, en esencia, una suspensión de corpúsculos en el plasma. Como éstos poseen mayor peso específico, en la sangre hecha incoagulable los eritrocitos se depositan gradualmente en el fondo del recipiente, fenómeno llamado eritrosedimentación. En la gran mayoría de las personas normales la eritrosedimentación se realiza lentamente, pero en muchas enfermedades se hace rápida y en algunos casos esta rapidez es proporcional a la gravedad de la enfermedad. La determinación de la velocidad de eritrosedimentación constituye una prueba de laboratorio TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 17
18 que ha resultado ser útil en el diagnóstico de enfermedades ocultas o en la confirmación y evolución de ciertas manifestaciones de enfermedad. No tiene valor diagnóstico por sí sola, pero dados los factores que la influyen, la modificación de alguno de ellos habla de una alteración orgánica que demanda ser atendida. La eritrosedimentación se determina colocando sangre hecha incoagulable en pipetas especiales (pipetas de Westergreen de 2,5 mm de diámetro, graduadas de 0 a 200 mm) y midiendo la distancia en milímetros que los eritrocitos caen por unidad de tiempo, generalmente una hora. El factor determinante se encuentra en el plasma, porque cuando los eritrocitos de una sangre con alta velocidad de sedimentación son pasados a un plasma normal la eritrosedimentación se normaliza. La velocidad de sedimentación de los glóbulos rojos es mayor en el plasma que en el suero (éste no contiene fibrinógeno). Las modificaciones de la densidad del plasma no constituyen el factor causal, ya que la dilución de la sangre con solución fisiológica no acelera la eritrosedimentación. El agregado de fibrinógeno aumenta la velocidad de sedimentación globular, y el hallazgo de que la concentración de fibrinógeno plasmático suele estar aumentada cuando la eritrosedimentación está acelerada sugiere que la concentración de aquél es importante en su determinación. El tamaño de la partícula que sedimenta constituye un factor de importancia primordial como determinante de la velocidad de eritrosedimentación. Cuanto mayor sea el volumen de la partícula, menor será su superficie relativa y menor la superficie expuesta al medio. Puede decirse que las variaciones de la eritrosedimentación se deben a modificaciones en la carga superficial de los eritrocitos, lo cual determina que se aglomeren, y que estas modificaciones guardan relación con alteraciones plasmáticas. Los eritrocitos están cargados negativamente y normalmente se repelen entre sí (potencial Z). Es probable que la alteración de la composición química del piasma modifique las cargas eléctricas y que como resultado de ello los eritrocitos se aglomeren. Los valores de referencia de la eritrosedimentación son distintos en el varón y en la mujer. En el primero es de 3-7 mm en la 1 hora y en las mujeres de 9-14 mm. Aumenta francamente durante el embarazo, a partir del tercer mes y se normaliza hacia la tercera o cuarta semana del puerperio. 3.a.2. Resistencia Globular Osmótica (RGO) La presión osmótica de la sangre se debe en parte a los electrolitos osmóticamente activos y a los componentes orgánicos (principalmente a los coloides plasmáticos). Se denomina presión oncótica a la desarrollada por las micelas al incorporar agua e hincharse. Las proteínas plasmáticas (micelas) ejercen TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 18
19 una presión osmótica (dada por su concentración molecular) y una presión oncótica (debida principalmente a las albúminas). Hemólisis: es la salida de hemoglobina fuera de los eritrocitos por alteración de la permeabilidad de su membrana debido a agentes físicos o químicos. Hemólisis osmótica: los eritrocitos cuentan con una permeabilidad selectiva, por la que el agua se intercambia con particular rapidez. Cuando se sumergen en soluciones hipertónicas ceden agua, retrayéndose y adoptando una forma arrugada. Ello resulta de una alteración de la membrana y fuga de la hemoglobina. Por el contrario cuando se suspenden glóbulos rojos en soluciones hipotónicas, toman agua del medio y aumentan de volumen hasta estallar. Se denomina RESISTENCIA GLOBULAR OSMOTICA (RGO) a la fragilidad osmótica que presentan los eritrocitos frente a soluciones hipotónicas de distinta concentración. Se investiga mediante diluciones salinas de título decreciente, estableciéndose la concentración en la que inicia la hemólisis (RGO mínima) y la concentración donde la hemólisis es completa (RGO máxima). Los valores de referencia se expresan en concentraciones de NaCl (%). RGO Mínima: 0,42 0,46 % RGO Máxima: 0,30 0,34 % Variaciones: la RGO varía según la edad del eritrocito: cuanto más viejo, más frágil. Diversas enfermedades modifican la RGO. El determinante principal de la fragilidad osmótica de un eritrocito es su forma. En la esferocitosis (espesor aumentado) y, por el contrario, en la leptocitosis (espesor disminuido), disminuye la fragilidad. Es una importante ayuda diagnóstica en las anemias hemolíticas donde la RGO se encuentra disminuida. 3.a.3. Grupos Sanguíneos Los grupos sanguíneos se transmiten hereditariamente. Existen una gran variedad de sistemas de grupos con sus antígenos, de los cuales los más importantes son el Sistema ABO y el Sistema Rh. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 19
20 El sistema ABO es el más significativo por que es el único en el cual el suero de la mayoría de las personas no expuestas a eritrocitos humanos posee anticuerpos recíprocos constantes y previsibles. Las pruebas directas o también llamadas eritrocitarias que se utilizan de rutina para la tipificación ABO y Rh consisten en el análisis de los glóbulos rojos con anticuerpos anti-a, anti-b y anti-d. Además se puede realizar el análisis del suero o el plasma con glóbulos rojos A 1 y B (prueba inversa de grupo). Características de los antígenos y anticuerpos del Sistema ABO Características de los antígenos y anticuerpos del Sistema Rh 3.a.5 Titulación de los anticuerpos anti-a y anti-b Las personas poseen anticuerpos dirigidos contra los antígenos A o B ausentes en sus glóbulos rojos. Una de las hipótesis que explica el desarrollo de estos anticuerpos se basa en que las configuraciones TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 20
21 responsables de los determinantes antigénicos A y B de la membrana eritrocitaria también existen en otras entidades biológicas, en particular las paredes celulares bacterianas. La distribución de las bacterias es muy amplia y su presencia en la flora intestinal, el polvo, los alimentos y otros sustratos asegura la exposición constante de todas las personas a antígenos de tipo A o B. Los individuos inmnunocompetentes reaccionan contra los antígenos ambientales produciendo anticuerpos contra aquellos ausentes en el organismo. Así las personas de los grupos O y B sintetizan anticuerpos anti-a y las de los grupos O y A, anti-b. Las del grupo AB, que exhiben ambos antígenos, no generan anticuerpos. Momento de aparición. Los anticuerpos anti-a y anti-b se detectan en suero después de los primeros 3 a 6 meses de vida. La síntesis de los anticuerpos aumenta, alcanza los niveles del adulto a los 5 10 años y en las etapas tardías de la vida, declina. Reactividad de los anticuerpos anti-a y anti-b. Las inmunoglobulinas anti-a predominantes en los individuos del grupo B, y las inmunoglobulinas anti-b en los del grupo A, son IgM. También se advierten pequeñas cantidades de IgG. Las IgG son las anti-a y anti-b predominantes en el suero del grupo O. Como la IgG atraviesa la placenta con facilidad, no así las IgM, en los hijos de grupo sanguíneo A o B con madres del grupo O, el riesgo de enfermedad hemolítica del recién nacido por este sistema de grupo, es mayor que en los hijos de madres del grupo A o B. 3.a.4 Prueba de Compatibilidad Sanguínea: Pruebas Cruzadas Para detectar reacciones antígeno-anticuerpo antes de que una transfusión se lleve a cabo es necesario examinar y clasificar de forma individual la sangre del donante y del receptor (o paciente). Una transfusión sanguínea es clínicamente aceptable si la sangre del dador es ABO y Rh compatible con la sangre del receptor, pero también es necesario conocer que no interfiere ningún otro fenómeno de inmunización para lo cual se emplean las pruebas cruzadas. Son dos pruebas llamadas Mayor y Menor, la más importante es la prueba cruzada mayor. Prueba Cruzada Mayor Enfrentar hematíes del donante y suero del receptor Prueba Cruzada Menor Enfrentar hematíes del receptor y suero del donante La prueba cruzada no revela diferencias de grupo que pudieran causar producción de anticuerpos en el receptor como efecto de la transfusión, pero es útil para detectar anticuerpos ya existentes que pueden causar reacción. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 21
22 El rol del laboratorio es relevante por todas las demás determinaciones que aportan datos para disminuir el riesgo en una transfusión y para que ésta sea exitosa. 3.b. MATERIALES 3.b.1. Eritrosedimentación - Anticoagulante TP (solución de citrato al 3,8%) - Muestra de sangre obtenida por punción venosa. - Tubos de Kahn - Pipetas Westergreen - Cronómetro o timer 3.b.2. Resistencia Globular Osmótica (RGO) - Anticoagulante - Tubos de Kahn - Pipeta 20 l - Espectrofotómetro (leer a 540 nm) - Centrífuga - Sangre + EDTA: 2,5 ml Sangre + 20 l AC - Muestra: Sangre venosa de reciente extracción. Solución madre (SM): equivale a una solución de NaCl al 10%. NaCl 18 g (H 2 PO 4 )Na. 2H 2 O 0,486 g (HPO 4 )Na 2 2,731 g Agua destilada c.s.p. 200 ml Reactivo de Trabajo (RT): equivale a una solución de NaCl al 1%. Solución Madre (SM) Agua destilada c.s.p. 10 ml 90 ml 3.b.3. Grupos Sanguíneos - Sangre entera anticoagulada con EDTA - Suero o Plasma anticoagulado con EDTA - Placa de toque - Anticuerpos Anti A Anti B Anti D - Suspensión de Glóbulos Rojos de referencia al 10% A 1, B y 0. - Goteros - Palillos mezcladores TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 22
23 - Cronómetro 3.b.4. Titulación de Anticuerpos anti-a y anti-b - Tubos de Kahn - Solución Fisiológica Mercaptoetanol - Solución 2-4% de Glóbulos rojos A o B. - Centrífuga - Baño de 37 C. 3.b.4. Pruebas cruzadas mayor y menor. - Suspensión 2-4% de Glóbulos rojos del donante y del receptor. - Suero o plasma del donante y del receptor. - Centrífuga. - Baño de 37 C. 3.b.5. Limpieza (por comisión) Detergente Rejilla alcohol gel Cepillo para lavar tubos de hemólisis Rollos de cocina 3.c. TÉCNICA 3.c.1. Eritrosedimentación Primer ensayo 1. En tubo de Khan, realizar la dilución de la sangre con el anticoagulante TP en la proporción indicada: Relación Anticoagulante (TP: citrato 3,8 %) - Sangre: 4 +1 (2ml + 0.5ml). Homogeneizar suavemente. 2. Sumergir en el mismo la pipeta de Westergreen y, ajustando al tubo la sangre con el tapón correspondiente, la sangre subirá por presión debiéndose enrasar en la marca Colocar la gradilla en un lugar que no se produzcan vibraciones asegurándose que quede perfectamente vertical. 4. Dejar reposar una hora. 5. Leer y anotar la eritrosedimentación Segundo ensayo Se procederá a extraer una muestra de sangre de 10 ml. Se dividirá la muestra en tres tubos de ensayo previamente anticoagulada con EDTA: Tubos Nº 1, 2 y 3. Se procederá a constituir las siguientes muestras: Tubo 1: Sangre normal anticoagulada. Tubo 2: El tubo N 2, previo a haber marcado el nivel de sangre contenida, será centrifugado durante 20 minutos a 3500 rpm. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 23
24 Separar plasma de eritrocitos. A la porción globular remanente de la centrifugación, se agregar solución salina (solución fisiológica) hasta restituir el volumen inicial, constituyendo una muestra de sangre sin el componente plasmático. Tubo 3: A la sangre normal de este tubo se le agregará el plasma obtenido de centrifugar el Tubo 2, constituyendo una muestra de sangre hemodiluida. Para cada una de estas muestras se procederá de la misma forma que en el Primer ensayo ya vista. Los resultados de la observación se volcaran en la siguiente grilla: MUESTRA Valor Sangre normal Sangre sin plasma Sangre hemodiluida Informe y Resultados o Registre los valores obtenidos de las distintas experiencias de eritrosedimentación. o Interpretar los valores obtenidos en cada caso. 3.c.2. Resistencia Globular Osmótica (RGO) Numerar 12 tubos del 1 al 12 y proceder a realizar las siguientes diluciones: Tubos RT (ml) H 2 O (ml) Dilución obtenida Lectura % Hemólisis 1 8,5 1,5 0,85 2 7,5 2,5 0,75 3 7,0 3,0 0,70 4 6,5 3,5 0,65 5 6,0 4,0 0,60 6 5,5 4,5 0,55 7 5,0 5,0 0,50 8 4,5 5,5 0,45 9 4,0 6,0 0, ,5 6,5 0, ,0 7,0 0, ,0 8,0 0,20 TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 24
25 Una vez colocada la solución de NaCl y el agua, homogeneizar agitando los tubos. Luego agregar una gota (20 l) de sangre a cada uno de los mismos. Invertir suavemente. Dejar en reposo durante 30 minutos. Volver a invertirlos suavemente. Centrifugar 10 minutos a revoluciones/ minuto (RPM). Tomar el sobrenadante con una pipeta y, colocando en una cubeta, leer su absorbancia (densidad óptica) a 540 nm, ajustando a cero con el sobrenadante del tubo N 1 (0% de hemólisis). Se considerará 100% de hemólisis al tubo N 12 y para calcular los porcentajes intermedios se aplicará la siguiente expresión: Cálculo RGO Informe y Resultados o o Con los valores de absorbancias obtenidos, confeccione la curva correspondiente, indicando los valores de RGO mínima y máxima. Interprete los valores hallados y relacionarlos con los conocimientos teóricos de la fisiología eritrocitaria y plasmática. Absorbancia tubo X.100 RGO Absorbancia tubo 12 3.c.3. Grupos Sanguíneos Prueba Directa Colocar sobre una placa de toque, tres gotas (50 µl) de sangre (una en cada zona de la placa). Se coloca sobre la misma placa empezando desde la izquierda una gota de suero anti A, luego separada una gota de suero anti B y luego una gota de suero anti D, sobre cada gota de sangre; se homogeiniza con un palillo y se rota la placa suavemente. Observar la presencia o ausencia de aglutinación macroscópica. Interpretación grupo ABO: TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 25
26 Grupos sanguíneos A B AB O Suero anti A Suero anti B Interpretación factor Rh: El procedimiento es el mismo que el seguido para la determinación de los antígenos ABO, utilizando como reactivo un suero anti D. Suero antid: si aglutina es Rh (+), si no aglutina, se debe confirmar un Rh ( ) con una prueba de Coombs para descartar una variante D u. Prueba Inversa Colocar sobre una placa de toque dos gotas de suspensión al 10% de eritrocitos A 1, B y O. Agregar a cada una de las dos gotas de glóbulos rojos dos gotas del plasma o suero que se va a ensayar. Mezclar la preparación con un palillo y rotar la placa para terminar de homogeneizar. El tamaño de la aglutinación varía de una persona a otra (dependiendo de la concentración de anticuerpos anti-a o anti-b que haya en el suero). Las aglutinaciones suelen ser más pequeñas que las que se observan al ensayar glóbulos rojos y antisueros, aunque su aspecto es similar. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 26
27 Grupos sanguíneos A B AB O Células A Células B Células O Informe y Resultados o Registrar la hemoclasificación realizada para la muestra obtenida. o Comparar y combinar los resultados de las pruebas directa e inversa. o En base a la hemoclasificación realizada, indique la estructura antigénica que posee y los anticuerpos presentes en el plasma, mencionando su origen. 3.c.4. Titulación de anticuerpos anti-a y anti-b Titulación de Inmunoglobulinas Totales Numerar once tubos de Kahn y colocar en cada uno de ellos 100 µl de solución fisiológica. Luego en el tubo N 1 colocar 100 µl de suero homogenizar, tomar 100 µl de esa dilución y pasar al tubo N 2 y así sucesivamente hasta el último tubo. En cada tubo se colocan dos gotas de suspensión al 2 4 % de Glóbulos Rojos A o B según la aglutinina que se desee estudiar. Centrifugar 5 minutos a 2500 rpm. Luego invertir cada tubo con suavidad y observar si ha ocurrido la aglutinación. El título del anticuerpo que se investiga es la última dilución donde se observa aglutinación. 100 µl suero µl sol fisiológica 100 µl 100 µl 100 µl Solución Fisiológica Titulación de IgG TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 27
28 En el primer tubo colocar 100 µl de 5-mercaptoetanol y 100 µl de suero e incubar 5 minutos a 37 C. En el resto de los tubos colocar 100 µl de solución fisiológica y realizar las diluciones correspondientes. Colocar dos gotas de suspensión al 2 4 % de Glóbulos Rojos A o B e incubar 30 minutos a 37ºC. Centrifugar y luego realizar las lecturas. Informe y Resultados o Registrar el título de anticuerpos totales e IgG para la muestra estudiada. o Comparar y explicar la diferencia entre los títulos obtenidos para los anticuerpos totales e IgG. 3.c.5. Pruebas de Compatibilidad: Pruebas Cruzadas Para realizar esta prueba se utilizan 5 6 ml de sangre de cada uno (dador y receptor). La sangre se distribuye en dos tubos: 3 4 ml se dejan coagular en un tubo de hemólisis para obtener suero. Con el resto se prepara una suspensión de glóbulos rojos al 2-4% en solución fisiológica. En un tubo de Kahn se colocan dos gotas de la suspensión de eritrocitos del dador (o receptor) más dos gotas del suero del receptor (o dador). Incubar 15 a 30 minutos a 37 C. Luego centrifugar a 2500 RPM y observar si hay hemólisis o aglutinación. PRUEBA MAYOR Hematíes del donante + Suero del receptor PRUEBA MENOR Hematíes del receptor + Suero del donante Informe y Resultados o Registrar e interpretar los resultados obtenidos o Pensar los posibles resultados de las pruebas y en cada caso analizar si es factible la transfusión. 4. GUÍA DE ESTUDIO TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 28
29 1. Cuál es el porcentaje de descendencia esperado de una madre heterocigota del grupo A y un padre homocigota del grupo B? Esquematizar todos los casos como se ha desarrollado en clase teórica. 2. Cuál es el porcentaje de descendencia esperado de una madre homocigota del grupo A y un padre homocigota del grupo B? Esquematizar todos los casos como se ha desarrollado en clase teórica. 3. Qué tipo de anticuerpos posee el sistema ABO y el sistema Rh? Cuáles son las diferencias entre ambos? 4. Cuál es la importancia de controlar a una mujer embarazada que posee el grupo Rh negativo? 5. Por qué suele denominarse al grupo O como dador universal? Cuál es la limitación? 6. De qué factores depende la eritrosedimentación? Explíquelos. 7. Qué es el potencial Z? 8. Cuál es la osmolaridad del plasma? De qué depende? 9. A qué se debe la hemólisis de los eritrocitos al enfrentarlo con una solución hipotónica? 5. BIBLIOGRAFÍA Textos de cabecera Cingolani, H. E.; Houssay, A. B. y Col: Fisiología Humana de Houssay. 7ª Edición. Editorial El Ateneo. Buenos Aires Dvorkin, M. A.; Cardinali, D. P.; Iermoli, R. H.: Best & Taylor. Bases Fisiológicas de la Práctica Médica. 14ª Edición. Editorial Médica Panamericana. Buenos Aires Guyton, A. C.: Tratado de Fisiología Médica. 11ª Edición. Editorial Elsevier. Madrid Koeppen, B.M.; Stanton, B.A.: Berne & Levy. Fisiología. 6ª Edición. Editorial Elsevier Mosby. Madrid, Silvernagl, S; Despopoulos, A.: Fisiología. Texto y Atlas. 7ª Edición. Editorial Médica Panamericana. Madrid, Silverthorn, D. U.: Fisiología Humana. Un Enfoque Integrado; 4ª Edición. Editorial Médica Panamericana. Buenos Aires TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 29
30 Coppo, J. A.: Fisiología Comparada del Medio Interno. 2ª Edición corregida y aumentada. Editorial Universidad Católica de Salta. Departamento Editorial EUCASA. Salta Textos de consulta Henry, J.B.: El Laboratorio en el Diagnóstico Clínico: Homenaje a Todd-Stanford & Davidsohn. Tomos I y II. Editorial Marbán Gauna Pereira, María del Carmen: Bioseguridad en el Laboratorio. Curso PARÁMETROS DEL HEMOGRAMA. UTILIDAD E INTERPRETACIÓN. Resolución 811/08 C.D. Corrientes, 16 de octubre de Ióvine, E.; Atilio SeIva, A.: El Laboratorio en la Clínica. 3ª Edición. Editorial Médica Panamericana Levy-Lambert: Manual de Técnicas Básicas para un Laboratorio de Salud. Organización Panamericana de la Salud Bishop, M.: Química Clínica Principios, Procedimientos y Correlaciones. McGraw Hill. 5º Edición u otro equivalente de Química Clínica. Coppo, J.A.; Gauna Pereira, M.C.: Grupos sanguíneos. Revisión bibliográfica aprobada por Resolución N 238/01 CD de la FaCENA y Resolución N 170/00 CD de la Facultad de Ciencias Veterinarias de la UNNE. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 30
31 TRABAJO PRÁCTICO Nº 4 FISIOLOGIA DE LA HEMOSTASIA ESTUDIO DE LOS PROCESOS FISIOLÓGICOS PUESTOS EN JUEGO DURANTE LA HEMOSTASIA PRIMARIA Y SECUNDARIA 1. OBJETIVOS Con los conocimientos adquiridos en la clase teórica: 1. a. OBJETIVOS GENERALES Conocer los mecanismos fisiológicos involucrados en la hemostasia. Comprender el rol de las plaquetas, el endotelio y los factores de coagulación en la regulación del proceso hemostático. 1. b. OBJETIVOS ESPECÍFICOS Comprender la importancia de la Hemostasia primaria en el mantenimiento de la integridad del organismo. Relacionar la estructura de las plaquetas con su función dentro de los mecanismos hemostáticos. Comprender el concepto de hemostasia Secundaria y su papel en el equilibrio homeostático del organismo. Conocer los Factores de la coagulación, su lugar de síntesis y función. Integrar los procesos involucrados en el mecanismo de la coagulación: formación del coágulo y fibrinólisis. Relacionar la Teoría de la Cascada con los eventos observados in Vitro y los que ocurren in Vivo explicados por el nuevo modelo basado en superficies celulares. 2. CONOCIMIENTOS TEÓRICOS NECESARIOS Hemostasia primaria: Plaquetas. Estructura. Función. Hemostasia Secundaria: Factores de la coagulación. Mecanismo de la coagulación. Teoría de la Cascada. Nuevo Modelo basado en superficies celulares. 3. DESARROLLO DEL TRABAJO PRÁCTICO 3.a. Fundamento El término Hemostasia se refiere al conjunto de interacciones entre los componentes de la sangre y los de la pared vascular, responsables de impedir la fuga de la sangre de dicho compartimiento. El proceso hemostático a menudo es esquematizado en cinco fenómenos consecutivos que pueden superponerse: vasoconstricción localizada, adhesión de las plaquetas al subendotelio, formación del tapón plaquetario, reforzamiento de éste a través del depósito de fibrina y finalmente degradación del material depositado a través de la fibrinólisis. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 31
32 3.b. Recuento de plaquetas: El recuento plaquetario en sangre entera refleja, en individuos normales, el equilibrio que existe entre la producción en médula ósea y las plaquetas en circulación periférica. Debe trabajarse con material plástico o vidrio siliconado, ya que las plaquetas tienden a adherirse y agregarse sobre cualquier superficie que no tenga calidad de endotelio normal. Es conveniente observar al microscopio un frotis de sangre periférica, independientemente del método de recuento utilizado, donde se evaluará, número distribución, forma y tamaño plaquetario. Los métodos de recuento pueden ser manuales, semiautomáticos y automáticos. Materiales y método: Sangre entera anticoagulada con EDTA disódico o dipotásico al 10% (p/v). Oxalato de amonio 1%. Se guarda en heladera. Conviene preparar y fraccionar en alícuotas. Se filtra en el momento de usar. Micropipetas calibradas o automáticas. Cámara de Neubauer. Cámara Húmeda (Caja de papel con filtro humedecido) Microscopio de contraste de fase o normal. La muestra de sangre venosa anticoagulada con Edta, se homogeiniza y se toma una muestra con micropipeta calibrada o semiautomática, 20 µl en 1,80 ml de solución de Oxalato de amonio 1%. (dil 1/100) Se homogeniza suavemente y se deja reposar 10 minutos para favorecer la hemólisis de los Glóbulos rojos. Pasado ese tiempo, se agita y se carga la cámara de Neubauer y se realiza el recuento como si fueran Glóbulos rojos (ver TP Nº 2) El resultado obtenido se multiplica por 1000 ya que la dilución que se realiza es de 1/100 y el volumen contado es 0,1 mm 3. El resultado se expresa por mm 3 Valores de Referencia: /mm 3 3.c. Tiempo de Sangría Cuando se produce una injuria tisular quedan expuestos los componentes del subendotelio (fundamentalmente colágeno tipo IV y V donde las plaquetas se adhieren y luego se agregan. El tiempo de sangría (TS) se basa en esta propiedad y mide el tiempo que tarda en cohibirse la salida de sangre provocada por una incisión estandarizada realizada en los vasos superficiales pequeños. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 32
33 Es una prueba global de la hemostasia primaria. Está influenciada por factores técnicos que se deben estandarizar cuidadosamente: profundidad, ubicación y dirección de la incisión; también depende del tipo de piel del paciente y de la habilidad del operador. El TS depende fundamentalmente de la calidad y cantidad plaquetaria. Se puede realizar por varias técnicas. Nosotros en el Trabajo Práctico realizaremos el TS según la técnica de Ivy. Material y Métodos: Esfingomanómetro Lancetas descartables. Cronómetro Papel de filtro Procedimiento Se realiza una incisión con lanceta en el antebrazo donde se ha colocado un esfingomanómetro a una presión constante (40 mm de Hg) para llenar los capilares en forma homogénea y eliminar la variabilidad del tono capilar. Se elige una zona donde no haya vasos capilares visibles y esté libre de vellos. Se efectúa en el antebrazo 3 incisiones con lanceta descartable (profundidad 1mm) Se pone en marcha el cronómetro y cada 30 seg. Con papel de filtro, se absorben las gotas de sangre formadas sin tocar las heridas para no remover el coágulo en formación, hasta que cese de fluir la sangre. Valor de Referencia: 3 5 minutos 3.d. Tiempo de coagulación ( Método de Lee- White modificada) El tiempo de coagulación (TC) es el tiempo que tarda en generarse la trombina in vitro para formar el coágulo, como resultado de la interacción de los factores involucrados contenidos en la sangre. Un TC normal no descarta la existencia de una alteración en el sistema de coagulación, pero si es prolongado indica la existencia de un defecto severo, debido a que esta técnica tiene baja sensibilidad para detectar alteraciones de la función hemostática. Materiales y método: Sangre entera sin anticoagulante Tubos de hemólisis de vidrios Baño termostático a 37º C Cronómetro TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 33
34 Colocar en un baño a 37ºC tres tubos de hemólisis. Realizar una punción venosa en la forma habitual (ver TP Nº 1). Extraer aproximadamente 3 ml de sangre y verter por las paredes 1ml en cada tubo. Activar el cronómetro. A los 7 minutos retirar uno de los tubos del baño termostático, inclinarlo ligeramente e investigar el deslizamiento de la sangre por la pared. Repetir la operación cada 30 segundos hasta que no se observe deslizamiento (formación del coágulo). Inmediatamente comenzar a inclinar el tubo 2 hasta que no se observe deslizamiento. A partir de ese momento comenzar a mirar el tercer tubo. Valor de referencia: menor de 15 minutos 3.e. Tiempo de Protrombina en una etapa Muestra: el anticoagulante que se utiliza es citrato de sodio en una relación 1+9 ó dilución 1/10, entonces por ejemplo para 250 ul de anticoagulante se necesita 2,5 ml de sangre. Centrifugar a 3000 rpm durante 15 min y separar el plasma en otro tubo de plástico, proceder a realizar una segunda centrifugación a 3000 rpm por 15 min, de esta manera se obtiene un plasma pobre en plaquetas. Es necesario que no haya plaquetas porque estas ya se estudian en las pruebas que evalúan la hemostasia primaria, ahora sólo se van a estudiar los factores de la coagulación. El plasma además de no contener plaquetas no tiene calcio por que el citrato de sodio compleja el calcio. El plasma se debe procesar dentro de las 4 horas después de obtener la muestra porque muchos factores se degradan in vitro con el transcurso el tiempo. Evalúa la eficiencia del sistema extrínseco de la coagulación midiendo la formación del coagulo plasmático en presencia de extractos tisulares (fosfolípidos) y CaCl 2. Es más sensible al déficit de factores VII, X y V que a la deficiencia de protrombina. Se prolonga con déficit severo de fibrinógeno. Materiales y Método Citrato de Sodio 0,1 M Baño termostatizado a 37 C Pipetas automáticas de 100 µl y 200 µl. Tubos de vidrio para realizar las pruebas Tubos de plástico para recolección de la muestra TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 34
35 Centrífuga Cronómetro Reactivos: Tromboplastina cálcica recombinante o tromboplastina cálcica de cerebro de conejo que aportan los fosfolípidos y el calcio. Estabilidad en días luego de reconstituida. El reactivo se debe mantener a 37 C durante la realización de las pruebas. A 37 C sólo dura 60 min. En un tubo de vidrio en baño a 37 C colocar 100 µl del plasma pobre en plaquetas. Incubar por lo menos 1 minuto. Agregar 200 µl de tromboplastina cálcica y simultáneamente poner en marcha el cronómetro. Mover el tubo suavemente por inclinación hasta que se forma el coágulo y detener el tiempo. Anotar el tiempo. Los resultados se expresan en tiempo y en porcentaje de actividad interpolando el tiempo correspondiente a la muestra en la curva de calibración. Valor de Referencia: % 3.f. Tiempo de Tromboplastina Parcial Activado Mide el tiempo de coagulación del plasma en presencia de cefalina (tromboplastina parcial, sustituto plaquetario) aporta los fosfolípidos que son el sitio de anclaje donde se realizan las reacciones; un activador (caolín, ácido elágico, sílice, celita) aporta cargas negativas para activar la coagulación y los iones calcio que se agrega en forma de CaCl 2. Con esta prueba se estudian los factores de la vía intrínseca de la coagulación y se prolonga ante los descensos de los factores XII, XI, IX, VIII, X, II ó V. La muestra que se utiliza es la misma que para el tiempo de protrombina, es decir un plasma pobre en plaquetas. Materiales y método Citrato de sodio 0,1 M Reactivo de APTT comercial CaCl 2 0,025 M Baño termostatizado a 37 C Pipetas automáticas de 100 µl Tubos de vidrio Tubos de plástico para recolección de la muestra TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 35
36 Centrífuga Cronómetro En un tubo de vidrio en baño a 37 C colocar 100 µl de muestra e incubar 1 minuto. Luego agregar 100 µl de reactivo de APTT e incubar 3 minutos (etapa de activación) Agregar 100 µl de CaCl 2 y poner en marcha el cronómetro. Controlar la formación del coágulo de plasma sumergiendo y sacando el tubo. Detener el cronómetro cuando se visualiza la red de fibrina. El resultado se expresa en segundos. Valor de Referencia: seg. Además se realizarán las pruebas utilizando un coagulómetro, (Fibrintimer 2) El coagulómetro Fibrintimer 2, es un analizador compacto de lectura turbidimétrica que es óptimo para sistematizar todas las determinaciones rutinarias de Hemostasia Principio de acción: Turbodensitométrico, cuenta con cubetas de lectura (microcubetas) con un volumen total: µl de plasma citratado (1+9) Procedimiento: Tiempo de Quick Tiempo de Protrombina TP 1. Elegir en el menú principal la determinación a realizar (Tiempo de Protorombina) 2. Introducir 100 µl de plasma en la microcubeta de trabajo esperar que se incube a 37 C 3. Cuando el aparato lo indique en el display agregar de una vez 200 µl del Reactivo de TP. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 36
37 4. Al cabo de unos segundos aparecerá el valor en la pantalla. El equipo informa el tiempo y la tasa de protrombina en %. Tomar nota del resultado obtenido. Tiempo de Tromboplastina parcial Activado (APTT) 1. Elegir en el menú principal la determinación a realizar (APTT ) 5. Introducir 100 µl de plasma µl del reactivo de APTT en la microcubeta de trabajo y esperar que se incube a 37 C 6. Cuando el aparato lo indique en el display agregar de una vez 100 µl de solución de Cl 2 Ca 0,025 M 7. Al cabo de unos segundos aparecerá el valor en la pantalla. El equipo informa el tiempo en segundos. Tomar nota del resultado obtenido. Materiales de limpieza (por comisión): Detergente Rejilla Alcohol gel Cepillo 3.e. Conclusiones: Explique en forma sintética los mecanismos fisiológicos puestos en juego en cada una de las determinaciones y técnicas de evaluación de la hemostasia, indicando que aspectos se ponen en evidencia. 1. Recuento de Plaquetas 2. Tiempo de sangría 3. Tiempo de coagulación 4. TP 5. APTT 4. GUÍA DE ESTUDIO 1. Qué proceso fisiológico se evalúa con un Tiempo de Sangría? 2. De qué factores depende la adhesión plaquetaria al endotelio? 3. Qué proceso fisiológico se explora con la determinación del Tiempo de Coagulación? 4. Cómo está formado el complejo protrombinasa? Cuál es su función? 5. Qué sucede con el coágulo de fibrina luego de la reparación de la injuria vascular? 6. Por qué la sangre en condiciones fisiológicas y en ausencia de daño endotelial circula sin coagularse? 7. Cuáles son las funciones procoagulantes y antitrombóticas de la trombina? 8. Cuáles son las funciones antitrombóticas y procoagulantes del endotelio? TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 37
38 5. BIBLIOGRAFÍA Textos de cabecera Cingolani, H. E.; Houssay, A. B. y Col: Fisiología Humana de Houssay. 7ª Edición. Editorial El Ateneo. Buenos Aires Dvorkin, M. A.; Cardinali, D. P.; Iermoli, R. H.: Best & Taylor. Bases Fisiológicas de la Práctica Médica. 14ª Edición. Editorial Médica Panamericana. Buenos Aires Guyton, A. C.: Tratado de Fisiología Médica. 11ª Edición. Editorial Elsevier. Madrid Koeppen, B.M.; Stanton, B.A.: Berne & Levy. Fisiología. 6ª Edición. Editorial Elsevier Mosby. Madrid, Silvernagl, S; Despopoulos, A.: Fisiología. Texto y Atlas. 7ª Edición. Editorial Médica Panamericana. Madrid, Silverthorn, D. U.: Fisiología Humana. Un Enfoque Integrado; 4ª Edición. Editorial Médica Panamericana. Buenos Aires Coppo, J. A.: Fisiología Comparada del Medio Interno. 2ª Edición corregida y aumentada. Editorial Universidad Católica de Salta. Departamento Editorial EUCASA. Salta Textos de consulta Henry, J.B.: El Laboratorio en el diagnóstico clínico: Homenaje a Todd-Stanford & Davidsohn. Tomos I y II. Editorial Marbán Gauna Pereira, María del Carmen: Bioseguridad en el laboratorio. Curso PARÁMETROS DEL HEMOGRAMA. UTILIDAD E INTERPRETACIÓN. Resolución 811/08 C.D. Corrientes, 16 de octubre de Ióvine, E.; Atilio SeIva, A.: El Laboratorio en la Clínica. 3ª Edición. Editorial Médica Panamericana Levy-Lambert: Manual de técnicas básicas para un laboratorio de salud. Organización Panamericana de la Salud J Sans Sabrafen; C. Besses; Raebel, J. L; Vives Corrons: "Hematología Clínica" 6º edición, Ediciones Harcourt, Barcelona, España. L. Kordich; A. Blanco; G. Cerrato y Quintana; A. Vazquez; M. Vizcargüenaga: "Fundamentos para el manejo práctico del laboratorio de Hemostasia. 2ª Edición Ediciones Grupo CAHT. Buenos Aires, Argentina. Colman et Al: "Hemostasis and Thrombosis" 4º edición. J.B. Lippincott Co. Philadelphia, TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 38
39 TRABAJO PRÁCTICO Nº 5 FISIOLOGÍA DE LA REPRODUCCIÓN APARATO REPRODUCTOR FEMENINO Y GESTACIÓN 1. OBJETIVOS A partir de los contenidos teóricos: 1.a. OBJETIVOS GENERALES Comprender la regulación del eje Hipotálamo Hipófisis Gónadas y los mecanismos de control positivos y negativos que ejercen los esteroides circulantes. Describir las modificaciones en las mamas, endometrio y vagina asociadas a los cambios hormonales. Conocer el origen y función de la Gonadotropina Coriónica Humana y su importancia en el mantenimiento del embarazo. 1.b. OBJETIVOS ESPECÍFICOS Conocer la función y los efectos de las hormonas que intervienen en el ciclo sexual femenino. Relacionar los cambios morfológicos observados en el epitelio vaginal con los niveles hormonales durante el ciclo sexual femenino. Detectar la presencia de Gonadotropina Coriónica Humana (GCH) en sangre y orina de mujer como marcador de embarazo. Reconocer el origen y función de la placenta. 2. CONOCIMIENTOS NECESARIOS Órganos reproductores femeninos. Regulación hipotalámica de los ovarios. Ciclo menstrual. Cambios hormonales, endometriales, mamarios y ováricos. Estrógeno y Progesterona: secreción, transporte, órganos blancos y funciones. Embarazo. Papel hormonal del Cuerpo Lúteo, de la Placenta y de la Hipófisis. Gonadotropina Coriónica Humana (GCH): origen y función. Pruebas de detección. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 39
40 3. DESARROLLO DEL TRABAJO PRÁCTICO 3.a. Fundamento 3.a.1. Urocitograma. Las modificaciones cíclicas corporales en el sexo femenino son reguladas por el eje Hipotálamo Hipófisis anterior Gónadas, siendo sus principales efectores el útero, trompas, vagina y glándulas mamarias, como también diversos procesos metabólicos. Para evaluar los distintos períodos del ciclo se pueden realizar diversos estudios: dosajes hormonales, excreción de metabolitos (pregnandiol), biopsias, modificaciones del cuello uterino (cristalización y filancia del mucus cervical), variaciones de la temperatura basal y modificaciones del epitelio vaginal. Por la simplicidad de la técnica en este trabajo práctico se realizará un urocitograma, puesto que el epitelio de la parte inferior del tracto urogenital, vagina y uretra, presentan variaciones tróficas de acuerdo con el estado funcional del ovario. En la fase folicular aumenta la proliferación celular del epitelio y su estratificación, diferenciándose hasta la cornificación de las capas superficiales. Durante la fase lútea se produce la descamación en colgajos, desapareciendo la cornificación y disminuyendo la proliferación celular. El efecto de la disminución de las hormonas ováricas se traduce en una inhibición del crecimiento epitelial, por lo que se observan células de las capas parabasales y basales, lo cual también sucede en la etapa prepuberal y post - menopáusica. 3.a.2. Detección de Embarazo La GCH es secretada por las vellocidades coriónicas y la placenta, aparece en sangre y orina poco después de la implantación del embrión, siendo la responsable del mantenimiento del cuerpo lúteo. La detección de la fracción beta (cadena beta) de esta hormona en sangre y orina permite diagnosticar el embarazo. Para ello se han desarrollado diversos procedimientos biológicos e inmunológicos. 3.b. Materiales 3.b.1.- Urocitograma Extendidos de sedimentos de orina, de mujeres en distintos momentos del ciclo menstrual, concentradas por centrifugación y teñidos con el colorante de Shörr. Microscopio. Aceite de inmersión. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 40
41 3.b.2. Detección de embarazo. Muestra: sangre u orina. Tiras reactivas para la detección de embarazo por método inmunológico. 3.b.3. Materiales de limpieza (por comisión): Detergente Rejilla alcohol gel Cepillo rollo de cocina. 3.c. Técnica 3.c.1. Urocitograma Observar los extendidos en el microscopio con objetivos de 40x y 100x. Dibujar las células observadas. Indicar el momento probable del ciclo correspondiente. 3.c.2. Detección de embarazo Técnica en sangre: Obtener sangre por punción venosa. Dejar coagular y separar el suero. Colocar en un tubo de hemólisis 500µl del suero. Sumergir una tira reactiva para detección de GCH. Dejar difundir el suero durante algunos segundos y observar el resultado y registrarlo. Técnica en orina: Proceder de la misma manera que en suero pero utilizando como muestra la primer orina de la mañana. Observar el resultado obtenido y registrarlo. 3.e. Conclusiones: 3.e.1. Urocitograma Luego de la observación microscópica de los diferentes extendidos, indique con qué niveles hormonales se corresponde cada uno. 3.e.2. Detección de embarazo A partir del resultado obtenido en la prueba de embarazo, fundamente relacionándolo con los procesos fisiológicos que están interviniendo. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 41
42 4. GUIA DE ESTUDIO 1. Cómo se realiza la regulación del eje hipotálamo hipófisis ovario? Esquematice el eje hormonal correspondiente. 2. Cómo se produce la ovulación? 3. Cuál es la función del cuerpo Lúteo? 4. Cuál es la función del Estradiol? Cómo se regula su síntesis y liberación? 5. Cuál es la función de la progesterona? Cómo se regula su síntesis y liberación? 6. Dónde se sintetiza la Gonadotrofina Coriónica Humana? 7. Qué efectos morfológicos se producen en el epitelio vaginal por efecto de los estrógenos y la progesterona durante el ciclo sexual femenino? 8. Cómo se realizará la detección de Gonadotrofina Coriónica Humana en el Trabajo Práctico? 5. BIBLIOGRAFÍA Cingolani, H. E.; Houssay, A. B. y Col: Fisiología Humana de Houssay. 7ª Edición. Editorial El Ateneo. Buenos Aires Dvorkin, M. A.; Cardinali, D. P.; Iermoli, R. H.: Best & Taylor. Bases Fisiológicas de la Práctica Médica. 14ª Edición. Editorial Médica Panamericana. Buenos Aires Guyton, A. C.: Tratado de Fisiología Médica. 11ª Edición. Editorial Elsevier. Madrid Koeppen, B.M.; Stanton, B.A.: Berne & Levy. Fisiología. 6ª Edición. Editorial Elsevier Mosby. Madrid, Silvernagl, S; Despopoulos, A.: Fisiología. Texto y Atlas. 7ª Edición. Editorial Médica Panamericana. Madrid, Silverthorn, D. U.: Fisiología Humana. Un Enfoque Integrado; 4ª Edición. Editorial Médica Panamericana. Buenos Aires Henry, J.B.: El Laboratorio en el diagnóstico clínico: Homenaje a Todd-Stanford & Davidsohn. Tomos I y II. Editorial Marbán Ióvine, E.; Atilio SeIva, A.: El Laboratorio en la Clínica. 3ª Edición. Editorial Médica Panamericana Coppo, J. A.: Guía de Trabajos Prácticos. Cátedra de Fisiología Facultad de Ciencia Veterinarias. U.N.N.E. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 42
43 TRABAJO PRÁCTICO Nº 6 FISIOLOGIA DE LA REPRODUCCIÓN APARATO REPRODUCTOR MASCULINO 1. OBJETIVOS Con los conocimientos de los contenidos de la clase teórica: 1.a. OBJETIVOS GENERALES Explicar la regulación del eje Hipotálamo Hipófisis Testículo y los mecanismos de control. Conocer el origen y función de la Testosterona y su importancia en gónadas y caracteres sexuales secundarios. 1.b. OBJETIVOS ESPECIFICOS Conocer el efecto de la Testosterona sobre la espermatogénesis. Conocer la función de las glándulas anexas y su contribución a la formación del plasma seminal. Observar microscópicamente la morfología de los Espermatozoides (SPTZ) y relacionarla con el movimiento y la funcionalidad de los mismos. Observar y describir los distintos movimientos observados de los SPTZ y relacionarlo con su función. 2. CONOCIMIENTOS NECESARIOS Principales hormonas del eje Hipotálamo Hipófisis Testicular. Regulación hipotalámica de la síntesis y secreción de la Testosterona. Hormonas Foliculoestimulante Luteinizante Inhibina Activina - Folistatina. Funciones. Órgano reproductor masculino. Anatomía. Formación y desarrollo. Funciones. Testosterona: secreción, transporte, órganos blancos y funciones. 3. DESARROLLO DEL TRABAJO PRÁCTICO 3.a. Fundamento EVALUACIÓN DEL LÍQUIDO SEMINAL ESPERMOGRAMA Consiste en determinaciones cuali y cuantitativas encaminadas a valorar la aptitud reproductiva masculina y a determinar funcionalidad de los testículos y glándulas accesorias. En la TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 43
44 composición del semen intervienen las secreciones de Testículo y Glándulas Anexas en diferentes proporciones siendo mayor la contribución de la vesícula seminal. El plasma seminal tiene propiedades buffer debida a carbonatos, citratos y fosfatos. Está formado por un 85-98% de agua y un 2-15% de materia seca que contiene elementos inorgánicos (oligoelementos electrolitos dióxido de carbono) y orgánicos (espermina colina creatina glúcidos citratos compuestos fosforados vitaminas y otros elementos). La muestra a utilizar en el trabajo práctico es el líquido seminal, obtenido por masturbación. El sujeto deberá tener tres días de abstinencia sexual y no más de 5, recolectar en frasco estéril y remitir al laboratorio dentro de los 30 minutos. 3.b. Materiales Líquido seminal. Microscopio. Cámara de Neubauer. Portaobjetos Cubreobjetos. Papel indicador de ph. Extendidos de semen coloreados con May Grundwald Giemnsa. - Materiales de limpieza (por comisión): Detergente Rejilla alcohol gel Cepillo Rollos de papel 3.c. Técnica A partir de la muestra obtenida observar y registrar: Aspecto Color Volumen Determinación de ph Determinación de la concentración: Colocar en un tubo de Kahn 500 µl de semen. Llevarlo a baño térmico de ºC durante 2-3 minutos. (inmoviliza los SPTZ). Realizar una dilución 1:20 en Solución Fisiológica (0.38 ml S.F + 20µl de semen). TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 44
45 Cargar la cámara de Neubauer dejándola reposar durante 2 minutos en cámara húmeda. El recuento se realiza como si se tratara de glóbulos rojos (cuadrados Terciaros de la cámara de Neubauer) y el total contado se lo multiplica por Por ejemplo si se contaron 27 células en los 5 cuadrados terciarios, serán 27x10 6 SPTZ/ ml. Si el total eyaculado fue de 4.1 ml entonces serán: x 4.1 = SPTZ/eyaculado. Registrar los resultados obtenidos. Observación Morfológica: Observar el extendido teñido con May Grundwald Giemnsa en microscopio óptico con objetivo de 100X Dibujar las células observadas. Teniendo en cuenta las proporciones y morfología de cabeza, cuello, cola y acrosoma normales Describa la muestra analizada. Observación de la movilidad: Colocar una gota de semen en un portaobjetos y cubrirlo con un cubreobjeto. Observar los distintos tipos de movimientos que presentan los SPTZ de acuerdo a la siguiente lista: TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 45
46 a: movimiento progresivo rápido. b: movimiento progresivo lento. c: movimiento no progresivo. d: Inmóviles. 3.e. Conclusiones: Teniendo en cuenta contenidos teóricos (Clases Teóricas Bibliografía Recomendada) escriba relacionando los aspectos observados con los procesos fisiológicos involucrados en lo observado durante el Trabajo Práctico. 4. GUIA DE ESTUDIO 1. Cuáles son las funciones de la Testosterona en la ontogenia del individuo? 2. Cómo se regula la síntesis y secreción de Testosterona? 3. Cuál es la función de las células de Leydig? 4. Cuál es la función de las Células de Sértoli? 5. Esquematice un espermatozoide normal indicando cada una de sus partes. 5. BIBLIOGRAFIA Cingolani, H. E.; Houssay, A. B. y Col: Fisiología Humana de Houssay. 7ª Edición. Editorial El Ateneo. Buenos Aires Dvorkin, M. A.; Cardinali, D. P.; Iermoli, R. H.: Best & Taylor. Bases Fisiológicas de la Práctica Médica. 14ª Edición. Editorial Médica Panamericana. Buenos Aires Guyton, A. C.: Tratado de Fisiología Médica. 11ª Edición. Editorial Elsevier. Madrid Koeppen, B.M.; Stanton, B.A.: Berne & Levy. Fisiología. 6ª Edición. Editorial Elsevier Mosby. Madrid, Silvernagl, S; Despopoulos, A.: Fisiología. Texto y Atlas. 7ª Edición. Editorial Médica Panamericana. Madrid, Silverthorn, D. U.: Fisiología Humana. Un Enfoque Integrado; 4ª Edición. Editorial Médica Panamericana. Buenos Aires Henry, J.B.: El Laboratorio en el diagnóstico clínico: homenaje a Todd-Stanford & Davidsohn. Tomos I y II. Editorial Marbán Ióvine, E.; Atilio SeIva, A.: El Laboratorio en la Clínica. 3ª Edición. Editorial Médica Panamericana Coppo, J. A.: Guía de Trabajos Prácticos. Cátedra de Fisiología Facultad de Ciencia Veterinarias. U.N.N.E. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 46
47 TRABAJO PRÁCTICO Nº 7 MECANISMOS ENDÓCRINOS QUE REGULAN LA CONCENTRACIÓN DE GLUCOSA EN PLASMA: PRUEBA DE TOLERANCIA ORAL A LA GLUCOSA 1. OBJETIVOS A partir de los conocimientos teóricos: 1.a. OBJETIVOS GENERALES - Conocer los mecanismos que regulan la concentración plasmática de glucosa. 1.b. OBJETIVOS ESPECÍFICOS - Realizar una Prueba de Sobrecarga Oral con Glucosa. - Interpretar los resultados obtenidos y elaborar conclusiones. 2. CONOCIMIENTOS NECESARIOS - Mecanismos de acción de las hormonas que intervienen en el mantenimiento y regulación de la glucosa. - Insulina: Estructura. Acción. Secreción. Regulación de su secreción. 3. DESARROLLO DEL TRABAJO PRÁCTICO 3.a. Fundamento La concentración de glucosa plasmática (Glucemia) se mantiene dentro de un rango estrecho de mg/dl ( mg%). El aporte de glucosa a la circulación está dado por los siguientes mecanismos: 1 - Absorción intestinal: a través de la hidrólisis de hidratos de carbono que forman parte de la dieta, los cuales se absorben por un mecanismo de cotransporte con Na + y pasan rápidamente al torrente sanguíneo. 2 - Glucogenólisis: degradación de glucógeno almacenado en el hígado. 3 - Gluconeogénesis: formación de glucosa a partir de sustratos no hidratos de carbono: piruvato, aminoácidos como alanina y menos frecuentemente glicerol. Las hormonas Pancreáticas Insulina y Glucagón son las principales hormonas reguladoras de la captación y producción hepática de la glucosa. Además otras como los Glucocorticoides, Hormonas del Crecimiento y Catecolaminas, forman parte de este sistema de regulación. De éstas la única hipoglucemiante es la Insulina; las demás tienden a aumentar la concentración de glucosa en sangre. La Insulina, esencial para la vida, además de ser hipoglucemiante, tiene acciones como antilipolítica y anabólica proteica. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 47
48 Considerando los valores obtenidos de glucemia en ayunas, se pueden presentar los siguientes casos: Estado Glucemia plasma en ayunas mg/dl Normal 70 a 110 Glucemia en ayunas alterada (GAA) 110 a 126 Diabetes Mellitus (DM) > 126 Fuente: Sociedad Americana de Diabetes (2011). Si la glucemia en ayuna supera los 126 mg/dl en dos ocasiones diferentes con el ayuno respectivo, puede hacerse el diagnóstico de Diabetes Mellitus (DM), mientras que si se encuentra en el rango de mg/dl puede decirse que la glucosa de ayuno se encuentra alterada. 3.b. Materiales 3.b.1. Extracción de sangre: Ver Trabajo Práctico Nº 1. Anticoagulante de elección: EDTA/ Fluoruro (Anticoagulante G de Wiener). 3.b.2. Determinación de glucosa: - Centrífuga. - Micropipetas Automáticas de 10 μl. - Tubos de hemólisis. - Baños termostatizados a 37ºC. - Reactivos para determinación de Glucosa en líquidos corporales. Método GOD/POD. - Espectrofotómetro. 3.b.3. Limpieza (por comisión): Detergente Rejilla Alcohol gel Cepillo para lavar tubos de hemólisis Rollos de cocina. 3.c. Técnica - Extracción de Sangre por venopunción. Ver Trabajo Práctico Nº 1. - Determinación de Glucosa en plasma: o o Previamente dejar que el reactivo de trabajo tome temperatura ambiente En tres tubos de hemólisis: B (blanco), E (estándar), D (desconocido) colocar: B E D TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 48
49 Muestra μl Estándar - 10 μl Reactivo 1 ml 1 ml 1 ml o Mezclar. Incubar 15 minutos a 37 ºC o o o Leer en espectrofotómetro a 505 nm llevando a cero con el blanco de reactivo. Estabilidad del color 60 minutos. Cálculo: 3.c.3. Experiencia Preparar una solución acuosa de glucosa: En adultos 75g de glucosa anhidra en 375ml de agua (puede ser acidulada con jugo de limón natural), a temperatura ambiente. En menores de 12 años o peso < 30 Kg: solución al 20% con 1,75g de glucosa por Kg de peso. Realizar una extracción de sangre por punción venosa en ayunas usando anticoagulante EDTA-G (EDTA con fluoruro). Separar el plasma dentro de los 15 minutos. Administrar la solución de glucosa, controlando que el paciente beba toda la solución en un tiempo no mayor a 5 min. Registrar tiempo de inicio de la ingesta. Realizar extracciones de sangre por punción venosa a los 30, 60 y 120 minutos de iniciada la ingestión de glucosa. [Glucosa (g/l)] = Absorbancia Desconocido x Estándar (g/l) Absorbancia Estándar Realizar la determinación de Glucemia en cada una de las muestras. 3.d. Resultados Registrar los resultados obtenidos en la siguiente tabla y realizar un gráfico de la variación de la concentración de glucosa en plasma en el tiempo. Tiempo Basal 30 minutos 60 minutos 120 minutos Glucemia (mg/dl) 3.e. Conclusiones Relacionar los resultados hallados en el trabajo práctico con los mecanismos homeostáticos puestos en juego para la regulación de la glucemia. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 49
50 4. GUÍA DE ESTUDIO 1. Halle la diferencia entre el transporte de glucosa para entrar en las células intestinales y para entrar en las células musculares. 2. Cómo interviene la regulación nerviosa en la homeostasis de la glucosa? 3. Cuál es la importancia de la acción de las incretinas? 4. Por qué se denomina al hígado amortiguador del metabolismo de la glucosa? 5. Cuál es el valor de referencia de la concentración de glucosa en plasma? 6. Cuándo se recomienda la realización de una prueba de tolerancia oral a la glucosa? 7. Qué se debe evaluar ANTES de realizar el estudio? 8. Qué contraindicaciones presenta? 9. Por qué la liberación de insulina al torrente sanguíneo es bifásica? 10. Para investigar: Se sigue el mismo procedimiento en los niños? 5. ANEXO PTOG Considerando los valores de Glucemia Plasmática en ayunas: A qué individuos debe realizarse PSOG y Para qué Personas que presentan riesgos de desarrollar DM aún cuando no presentan manifestaciones clínicas de DM (detección precoz). Para confirmar o descartar DM. Personas que presentan signos y/o síntomas que sugieren DM. Para confirmar o descartar DM. Personas con diagnóstico reciente de DM tipo 2, y se desea conocer el grado de Insulinoresistencia hepática y periférica. En cada muestra se hará el dosaje de Insulina y analizar su nivel respecto a la Glucemia de la misma muestra. Contraindicaciones para realizar la PSOG: no debe realizarse cuando: Cuando el paciente tiene 2 Glucemias en ayunas > 126 mg/dl sin causas de hiperglucemia secundaria. Pacientes que presentan hiperglucemia secundaria por inflamación del páncreas o pancreatectomía; enfermedades endocrinas (Acromegalia, Cushing), por fármacos. Individuos que tengan factores que disminuyen la tolerancia a la glucosa oral: 2. Inactividad física durante los últimos 3 días. 3. Dieta hipocalórica de hasta una semana. 4. Fármacos (diuréticos, glucocorticoides) en los últimos 5 días. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 50
51 5. Enfermedades intercurrentes (insuficiencia renal, cirrosis hepática). Estrés severo hace menos de una semana (accidentes, traumatismos). Estados malabsortivos (náuseas, vómitos, dolor abdominal). Procedimiento correcto para la realización de PSOG Interrogar y registrar: motivo de consulta al médico, micción (aumento de frecuencia y volumen, aumento en la micción nocturna), aumento de sed, mayor apetito, aumento de peso, si posee familiares directos con D.M. Investigar si el paciente presenta alguna contraindicación. En caso positivo avisar al médico solicitante la imposibilidad de realizar la prueba hasta que se elimine la contraindicación. Investigar si está recibiendo medicación, en caso positivo, consultar lista de drogas interferentes a la PSOG. Avisar al médico solicitante la imposibilidad de realizar la PSOG hasta suspensión de la medicación interferente por 5 días. Indicar dieta previa: Consumir panes, arroz, fideos, pastas, (en adultos se busca entre 150 y 400 g de carbohidratos/día), durante 3 días previos a la realización de la prueba. Un bajo aporte de carbohidratos puede dar resultados falsos positivos debido a que se puede producir un estado de inercia pancreática frente a la sobrecarga glucídica de la prueba, y la cantidad de insulina secretada será insuficiente para los requerimientos, aún en paciente normales. Explicar al paciente que se debe concurrir al laboratorio, por la mañana con 8 a 12 horas de ayuno, el procedimiento a seguir, y la necesidad de permanecer en reposo por 2 hs, en el laboratorio; (se debe realizar la PSOG por la mañana para evitar las variaciones diurnas de la glucemia por el ritmo circadiano de secreción de insulina). Al momento de realizar la PSOG en el laboratorio: Verificar cumplimiento de dieta, y ausencia de contraindicaciones para realizar la PSOG. Registrar todos los datos del paciente y del médico solicitante. Preparar una solución acuosa de glucosa: En adultos 75g de glucosa anhidra en 375ml de agua (puede ser acidulada con jugo de limón natural), a temperatura ambiente. En menores de 12 años o peso < 30 Kg: solución al 20% con 1,75g de glucosa por Kg de peso. Previo reposo del paciente por 5 minutos, realizar una extracción de sangre por punción venosa en ayunas (usar heparina o EDTA). Separar el plasma dentro de los 15 minutos. Administrar la solución de glucosa, en un lugar del laboratorio libre de ruidos, controlar que el paciente beba toda la solución en 5 min. Registrar tiempo de inicio de la ingesta. Indicar y controlar que el paciente permanezca sentado en el laboratorio, durante 2 hs, sin fumar, comer ni beber. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 51
52 Realizar extracciones de sangre por punción venosa a los 30, 60 y 120 minutos de iniciada la ingestión de glucosa. Dosar glucemia por método de rutina calibrado y validado, utilizar controles interno y externos. Si el paciente en algún momento vomita después de la administración de glucosa la prueba queda suspendida y no se continúa. 6. BIBLIOGRAFÍA Cingolani, H. E.; Houssay, A. B. y Col: Fisiología Humana de Houssay. 7ª Edición. Editorial El Ateneo. Buenos Aires Dvorkin, M. A.; Cardinali, D. P.; Iermoli, R. H.: Best & Taylor. Bases Fisiológicas de la Práctica Médica. 14ª Edición. Editorial Médica Panamericana. Buenos Aires Guyton, A. C.: Tratado de Fisiología Médica. 11ª Edición. Editorial Elsevier. Madrid Koeppen, B.M.; Stanton, B.A.: Berne & Levy. Fisiología. 6ª Edición. Editorial Elsevier Mosby. Madrid, Silvernagl, S; Despopoulos, A.: Fisiología. Texto y Atlas. 7ª Edición. Editorial Médica Panamericana. Madrid, Silverthorn, D. U.: Fisiología Humana. Un Enfoque Integrado; 4ª Edición. Editorial Médica Panamericana. Buenos Aires Henry, J.B.: El Laboratorio en el diagnóstico clínico: Homenaje a Todd-Stanford & Davidsohn. Tomos I y II. Editorial Marbán Ióvine, E.; Atilio SeIva, A.: El Laboratorio en la Clínica. 3ª Edición. Editorial Médica Panamericana Coppo, J. A.: Guía de Trabajos Prácticos. Cátedra de Fisiología Facultad de Ciencia Veterinarias. U.N.N.E. TRABAJO PRÁCTICO Nº 8 FISIOLOGÍA DEL SISTEMA CARDIOVASCULAR 1. OBJETIVOS Conocer los focos cardíacos de auscultación y los ruidos cardíacos. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 52
53 Reconocer los principales lugares de medición del pulso arterial y sus características básicas. Aprender la técnica de medición de la Presión Arterial (P.A). Realizar un Electrocardiograma (ECG) e interpretar los registros básicos del mismo. 2. CONOCIMIENTOS NECESARIOS: El corazón. Ciclo cardíaco. Propiedades. Electrocardiograma normal. Regulación de la fuerza de contracción y frecuencia cardíaca. Volumen minuto cardíaco y retorno venoso. Resistencia periférica. Presión arterial. Regulación. 3. DESARROLLO DEL TRABAJO PRÁCTICO 3.a. Fundamentos Auscultación cardíaca: La evaluación directa más simple de la función cardiaca consiste en escuchar el corazón a través de la caja torácica por medio de la auscultación cardíaca. En su forma más simple, la auscultación se realiza apoyando una oreja sobre el tórax. Pero en la actualidad suele realizarse utilizando un estetoscopio. Normalmente existen dos ruidos audibles: el primero (R 1 ), dum se asocia con el cierre de las válvulas aurículo-ventriculares. El segundo (R 2 ) lup se asocia con el cierre de las válvulas semilunares. Se puede registrar otros dos ruidos con estetoscopios electrónicos, muy sensibles. El tercer ruido cardíaco es causado por el flujo sanguíneo turbulento en los ventrículos durante el llenado ventricular y el cuarto ruido se asocia con turbulencias durante la contracción auricular. En ciertas condiciones anormales estos dos últimos ruidos pueden oírse con un simple estetoscopio. Otros ruidos: El tercer (R 3 ) y cuarto (R 4 ) ruido puede estar o no presente. Su interpretación, como fenómeno normal o patológico, depende del contexto global. Clic aórtico: ruido producido por la apertura de la aorta. Chasquido de apertura: ruido producido por la apertura de la mitral. Frote pericárdico: ruidos producidos por el roce del pericardio con los movimientos cardíacos en la pericarditis. Soplos de diferentes tipos y causas. Pulso: Es una onda de presión y expansión que se produce por la expulsión de sangre desde el ventrículo izquierdo hacia la aorta y se transmite a todas las arterias, siendo visible en algunas de ellas y palpable en aquellas accesibles a exploración manual. Lo que se explora en el pulso es la frecuencia es decir el número de latidos en la unidad de tiempo (minuto). Valor de referencia en adultos en reposo: latidos x TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 53
54 minuto. En la práctica se estima en 15 segundos y se multiplica por 4 para estimar el minuto siempre y cuando el pulso sea regular. Determinación de la Presión Arterial: Es una medición de la fuerza que se aplica sobre las paredes de las arterias a medida que el corazón bombea sangre a través del cuerpo. La presión está determinada por la fuerza y el volumen de sangre bombeada, así como por el tamaño y la flexibilidad de las arterias. La sangre ejerce presión hidrostática contra las paredes vasculares la cual puede ser registrada directamente o indirectamente. Debido a que los ventrículos expelen la sangre a los grandes vasos en forma pulsátil, el flujo y la presión arterial son pulsátiles. Durante la sístole ventricular la presión arterial se incrementa y desciende durante la diástole. La presión arterial sistólica es el pico de presión intravascular alcanzado durante la sístole por la eyección de sangre ventricular y la presión arterial diastólica es presión intravascular alcanzada al final de la diástole ventricular. La presión sistólica: es la presión máxima que se alcanza en la sístole. Esta depende fundamentalmente del débito sistólico, la volemia y la distensibilidad de la aorta y las grandes arterias. La presión diastólica: es la mínima presión de la sangre contra las arterias y ocurre durante la diástole. Depende fundamentalmente de la resistencia vascular periférica. Presión media: es la fuerza promedio con la que la sangre se introduce a todos los órganos del cuerpo. La tensión arterial cambia a lo largo del día, con el deporte, las situaciones de estrés, tabaco, fármacos estimulantes, etc., y es probable que si se toma la tensión inmediatamente después de alguna de estas situaciones estará más alta de lo normal. Por esta razón, las mediciones deben realizarse en condiciones de reposo, y privación de tabaco y fármacos o sustancias estimulantes. Para que una persona sea considerada hipertensa, ha de tener la tensión arterial elevada en tres mediciones a lo largo de dos semanas. Las presiones arteriales sistólica y diastólica pueden ser registradas en forma directa por medio de un catéter localizado en el interior de cualquier arteria y conectado por medio de una columna de solución salina a un transductor de presión, no es un método usado corrientemente en clínica. Igualmente, las presiones arteriales sistólica y diastólica pueden ser registradas en forma indirecta. Esto requiere el uso de un fonendoscopio y un esfigmomanómetro aneroide o de mercurio ("tensiómetro"); éste último dispositivo consiste en: una bolsa inflable conectada a una bomba manual la cual posee una válvula unidireccional que permite la salida del aire; por otro lado está también conectada a un manómetro graduado en milímetros de mercurio. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 54
55 Ruidos de Korotkoff El flujo sanguíneo en las arterias es laminar, por lo tanto silencioso. Cuando son auscultadas con un fonendoscopio no es posible oír ningún ruido. Cuando el esfigmomanómetro es inflado a una presión arterial por encima de la presión arterial sistólica, la arteria se cierra y el flujo sanguíneo en ella se detiene, por lo cual no es posible oír ningún ruido. Cuando la presión del tensiómetro empieza a descender y su presión se encuentra entre la presión arterial sistólica y diastólica, el flujo sanguíneo que pasa a través de una arteria comprimida produce un flujo turbulento, causando vibraciones en la arteria que son oídas por medio del fonendoscopio. Estos sonidos son conocidos como Ruidos de Korotkoff, el primer médico que los describió. Los ruidos de Korotkoff son divididos en 5 fases con base al volumen y la calidad de los sonidos: Fase 1. Sonidos fuertes y claros, como un chasquido, los cuales se intensifican a medida que se desinfla el manguito. Fase 2. Se oyen como una serie de murmullos. En esta fase los sonidos pueden desaparecer (brecha auscultatoria). Fase 3. Sonidos de gran intensidad, similares a la primera fase. Es de corta duración. Fase 4. Sonidos amortiguados que reemplazan la fase 3. Fase 5. Los sonidos desaparecen. Condiciones y consideraciones para el método auscultatorio indirecto de la presión arterial: No haber fumado ni comido en los últimos 30 minutos. Estar tranquilo y tener la vejiga vacía. Tomar la presión arterial en tres oportunidades diferentes y en ambos brazos. El paciente debe estar sentado cómodamente y haber reposado 5 minutos. Desnudar la extremidad superior, y colocarla sobre una superficie firme con la palma de la mano mirando hacia arriba. Tomar la presión arterial en el brazo, el paciente no debe padecer frío. La espalda recta o bien apoyada sobre el espaldar de la silla. No cruzar las piernas. No hablar durante la medición. La cámara neumática del tensiómetro se debe colocar a la altura del corazón. El ancho de la cámara neumática debe cubrir por lo menos el 40% del brazo. El largo de la cámara neumática debe rodear al menos el 80% del brazo. Colocar el centro de la cámara neumática sobre la arteria humeral. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 55
56 El borde inferior del manguito se coloca 3 cm. por encima de la pliegue del codo. El reloj del manómetro debe estar a la altura de lo ojos el examinador y ser bien visible. El fonendoscopio debe medir máximo 40 cm. Colocar la campana sobre la arteria braquial. No debe hacer contacto con el tensiómetro. Electrocardiograma Los fundamentos teóricos necesarios se adjuntan en anexo específico. 3.b. Material Auscultación cardíaca: Estetoscopio Pulso: Paciente-examinador Presión Arterial: Tensiómetros Estetoscopios (fonendoscopios) Electrocardiograma: Electrocardiógrafo Papel cuadriculado y milimetrado. Materiales de limpieza (por comisión): Detergente Rejilla Alcohol gel Cepillo 3.c. Procedimiento: Auscultación cardíaca: Para efectuar la auscultación del corazón la sala debe estar silenciosa. El estetoscopio se aplica directamente sobre la región precordial (porción media e inferior de la región torácica anterior e izquierda). La mayoría de los ruidos se escuchan bien con el diafragma del estetoscopio, que se apoya ejerciendo algo de presión. La campana identifica mejor ruidos de tono bajo, como los soplos. Se debe aplicar ejerciendo una presión suficiente para producir un sello que aísle de los ruidos del ambiente, pero sin ejercer mucha presión ya que en esas condiciones la piel se estira y actúa como membrana, pudiéndose dejar de escuchar algunos ruidos. La membrana se usa para auscultar toda el área cardíaca, y la campana se usa, de preferencia, para el ápex (la punta del corazón) y el borde esternal izquierdo en su porción baja. Conviene comenzar la auscultación con el paciente en decúbito supino para después pasar a una posición semilateral izquierda. Después conviene auscultar estando el paciente sentado e inclinado hacia adelante, solicitándole que sostenga la respiración unos segundos en espiración: TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 56
57 se buscan soplos de insuficiencia aórtica y frotes pericárdicos. Se debe examinar el corazón siguiendo un orden determinado de modo de identificar bien los distintos ruidos y soplos. Se debe seguir su trayectoria para determinar dónde se escuchan mejor y hacia dónde se irradian. Algunas personas prefieren partir auscultando desde el ápex y otros desde la base del corazón, desplazando el estetoscopio de forma de cubrir toda el área precordial. También es necesario ser metódico para identificar los distintos ruidos: partir reconociendo el primero (R 1 ) y el segundo ruido (R 2 ), luego los ruidos y soplos que ocurran en la sístole y luego en la diástole. Es necesario ser capaz de sustraer de la auscultación otros ruidos que se interponen, como los de la respiración. Evaluación del pulso: El pulso se evalúa con el pulpejo de 2 dedos (índice y medio) o 3 (índice, medio y anular) Los sitios de evaluación mas frecuentes son: Carotídeo: en el cuello, sobre cada arteria del mismo nombre. Axilar: en los huecos axilares. Humeral: en el pliegue de los codos, en su cara anterior, medial. Radial: en cada muñeca, en el lado externo de la cara anterior. Cubital: en cada muñeca, en el lado interno de la cara anterior. Femoral: bajo el pliegue inguinal, a cada lado. Poplíteo: detrás de las rodillas. Tibial posterior: detrás de los maléolos internos de cada tobillo. Pedio: en el dorso de los pies. Ritmo: cuando las pausas que separan las ondas de pulso son iguales decimos que el pulso es regular; de lo contrario hablamos de pulso arrítmico. Amplitud: magnitud con que se eleva la onda de pulso en cada latido. Está relacionada a la intensidad y velocidad con que se llena y vacía la arteria. La amplitud representa la presión diferencial entre la máxima y la mínima (presión de pulso). Exploración del pulso radial El pulso arterial depende de las contracciones del ventrículo izquierdo, TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 57
58 la cantidad de sangre que es eyectada en cada sístole, la frecuencia y ritmicidad con que ocurre, y la onda de presión que se produce a través del sistema arterial que depende también de la distensibilidad de la aorta y de las principales arterias, y de la resistencia arteriolar periférica. El pulso normal se palpa como una onda cuya fase ascendente es más rápida y el descenso más suave. Normalmente tiene una amplitud que permite palparlo fácilmente y una ritmicidad regular. Representación gráfica de los pulsos Para presentar en forma resumida el resultado del examen de los distintos pulsos, en lo que se refiere a su amplitud, se recurre a un dibujo esquemático de la figura humana o un esquema lineal. Estas representaciones tienen la ventaja que comparan la intensidad de los pulsos en los distintos sectores y de un lado del cuerpo respecto a su homólogo. La escala usada es la siguiente: No se palpan ( ) Se palpan disminuidos (+) Se palpan normales (++) Ejemplo: Sitios para la determinación del pulso (Tabla) Pulso Carotideo Braquial Radial Femoral Poplíteo Tibial P. Pedio Derecha Izquierdo Determine el pulso de su compañero (Carotídeo Braquial Radial Femoral Poplíteo Tibial y Pedio) Confeccione la tabla correspondiente con los datos obtenidos teniendo en cuenta la escala arriba indicada. Medición de la Presión Arterial (PA): 1. Ubique la arteria radial y localice el pulso. 2. Coloque el brazo apoyado sobre una superficie firme a Localice la arteria braquial en la fosa antecubital. Recuerde su relación anatómica con el tendón del bíceps. 4. Cierre la válvula unidireccional del manguito inflable. 5. Infle el manguito del tensiómetro hasta cuando desaparezca el pulso radial. Registre así la presión arterial sistólica palpatoria. Desinfle rápidamente. 6. Espere un minuto. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 58
59 7. Infle el manguito del tensiómetro 30 mm Hg por encima de la presión arterial sistólica palpatoria encontrada. 8. Coloque el fonendoscopio sobre la fosa antecubital y ajuste suavemente. 9. Desinfle lentamente el manguito abriendo cuidadosamente la válvula unidireccional dejando que la aguja descienda a una velocidad de 1 2 mm Hg por segundo. 10. Lea la presión arterial sistólica cuando oiga la Primera fase de lo ruidos de Korotkoff. 11. Lea la presión arterial diastólica cuando desaparezca el sonido. Fase V de Korotkoff. 12. En ocasiones en los jóvenes menores de 13 años el sonido continua hasta 0. En este caso de debe informar la terminación de las fases IV y V. 13. Espere 2 minutos y repita la medición. 14. Registre los valores obtenidos. Fórmulas: Presión de pulso: Presión arterial sistólica - presión arterial diastólica. Presión arterial media: Presión de pulso / 3 + presión arterial diastólica. Electrocardiograma Realizar un ECG. Con el registro obtenido calcular: o Intensidad de R (mv) o Duración del intervalo PQ (seg). o Polaridad del segmento ST. o Frecuencia Cardíaca (FC) (a partir del intervalo RR) o Calcular el eje eléctrico a partir de DI (mm) y avf (mm) indicando el signo y los grados del mismo. 3.d. Resultados: Con los datos obtenidos se realizará una tabla. 3.e. Conclusiones: Correlaciones los datos obtenidos de la auscultación, medición del pulso y presión arterial. Calcule la frecuencia cardíaca. 4. GUÍA DE ESTUDIO 1. Qué funciones cumple el corazón? 2. Cómo es su estructura? 3. Cómo está inervado el corazón? TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 59
60 4. Esquematizar la pequeña y la gran circulación, indicando las presiones en los tramos correspondientes para comprender el mecanismo circulatorio de la sangre. 5. Cuáles son las propiedades del músculo cardíaco? 6. Qué tipo de potencial desarrolla el músculo cardíaco? 7. El corazón, se tetaniza? Por qué? 8. Qué es un ciclo cardíaco? 9. Qué es el volumen latido? 10. Qué es el volumen minuto? 11. Cómo de regula la función cardíaca? 12. A qué se denomina escape vagal? 13. Qué es el electrocardiograma? 14. Qué son las derivaciones? 15. Cómo las clasifica? 16. Dibuje un registro similar a lo que puede verse fisiológicamente en una derivación DII y marque las ondas correspondientes y qué indica cada una. 5. ANEXO ELECTROCARDIOGRAMA Derivaciones electrocardiográficas La actividad eléctrica del corazón genera diferencia de potencial (ddp) en la superficie del cuerpo que son posibles de detectar y registrar. Se llama electrocardiograma (ECG) al registro gráfico de estos cambios de voltaje en función del tiempo. Como los potenciales que se registran son muy pequeños, del orden de los milivoltios (mv), es necesario utilizar un sistema amplificador que produzca corrientes suficientemente fuertes para impulsar un galvanómetro que mueve una aguja inscriptora caliente sobre un papel termosensible. (Fig. 1). Datos básicos que genera el equipo: Selección de las derivaciones. Calibración de la aguja inscriptora para el eje de ordenadas. (Ej: 1 mv = 10 mm o 1 mv = 5 mm) Regulación de la velocidad de corrida de la cinta. El electrocardiógrafo así constituido está conectado al paciente mediante electrodos de metal inoxidable cubierto por una película de pasta conductora que se sujetan firmemente a los miembros del paciente. Un sistema de llaves permite seleccionar la forma de conexión entre los cables de paciente y los terminales del amplificador. Este está conectado a través de condensadores que eliminan las corrientes continuas o de TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 60
61 variación muy lenta, como las producidas por los procesos electrolíticos entre los electrodos, la pasta, la respiración, etc., y facilitan la obtención de una línea de base estable. El Terminal, que frente a potenciales positivos provoca deflexiones hacia arriba en el registro, recibe este signo. Cada una de las diferentes formas de conexión entre el paciente y los terminales del electrocardiógrafo recibe el nombre de derivación ; también se llama así al registro obtenido con cada una de ellas. Las derivaciones bipolares registran diferencias de potenciales entre dos puntos; las más usadas son las derivaciones bipolares de los miembros Standard o clásicas. Con ellas se registran diferencias de potencial entre ambos brazos (D I), o entre la pierna izquierda y el brazo derecho (D II), o entre la pierna y el brazo izquierdo (D III). En estas derivaciones la pierna izquierda se une al Terminal positivo (D II y D III) y el brazo derecho al Terminal negativo (D I y D II). Esta convención fue arbitrariamente establecida por Eindhoven, que lo dispuso así para que las deflexiones más grandes registradas en un sujeto normal fuesen hacia arriba en el registro. Posteriormente Wilson, con el propósito de registra potenciales netos en un punto, creó las derivaciones unipolares. En ellas el punto del cuerpo del que se quieren registrar potenciales se conecta mediante un electrodo explorador al terminal positivo del electrocardiógrafo, mientras que los otros tres miembros se conectan mediante resistencias al otro Terminal (Terminal central de Wilson). El potencial de este Terminal, dada la simetría de los miembros con respecto a los potenciales generados en el corazón, no debería ser influenciado por los cambios en la actividad eléctrica del órgano, manteniendo un nivel de referencia o cero. Las derivaciones unipolares se designan con la letra V para indicar que usan el Terminal central de Wilson como referencia. Las más usadas son las precordiales numeradas de V1 a V6, según la posición ocupada por el electrodo explorador, según se indica en la Fig.2. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 61
62 Las derivaciones unipolares de los miembros son VR, VL y VF donde R, L y F corresponden a las palabras en inglés Rigth, Left y Foot que indican el miembro conectado al electrodo explorador. Son más usadas para los miembros las derivaciones unipolares aumentadas, que miden la ddp entre el miembro conectado al electrodo explorador y los otros dos que se conectan entre sí y al Terminal negativo del electrocardiógrafo. Se las designa agregando una letra a (de aumentada) a las denominaciones anteriores (avr, avl y avf respectivamente). Vectores eléctricos El potencial que registra un electrodo depende de la variación en el tamaño, la geometría y las posiciones que ocupa sucesivamente la superficie que separa el área activa de la de reposo durante la despolarización y la repolarización. Durante la despolarización, el área activa será negativa con respecto a la que aún está en reposo; es decir que la excitación se propaga como un frente que lleva cargas positivas en la cabeza y cargas negativas en la cola. Estos dipolos tienen una manifestación electrocardiográfica con la que se los puede relacionar trazando un vector que se dirija hacia la parte positiva y cuya intensidad depende de la superficie libre del órgano que está despolarizada. Si ese vector se proyecta sobre una línea de derivación, el tamaño y la polaridad de la onda que se registra en ese momento. Para la proyección de vectores en el plano frontal, se supone que los miembros forman los vértices de un triángulo equilátero (Triángulo de Eindhoven) cuyo centro es el corazón y cuyos lados constituyen las líneas de derivación DI, DII y DIII. Se supone también que el cuerpo se comporta como un conductor homogéneo. Los vectores se proyectan trazando perpendiculares a las líneas de derivación que pasen por el extremo del vector (Fig.3-A). La proyección se facilita si en lugar del triángulo se usan tres ejes paralelos a las líneas de derivación que se cortan en el centro del triángulo (sistema triaxial) (Fig.3-B). TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 62
63 Si se superpone a este sistema las líneas de derivación unipolares o unipolares aumentadas, queda así formado el sistema hexaaxial. Los signos de los extremos de los ejes corresponden a los terminales del electrocardiógrafo a los que se conectan las derivaciones correspondientes. Para localizar los vectores se usa una graduación sexagesimal de 0º a 180º con signo positivo para la semicircunferencia inferior y negativo para la superior (Fig. 4). Intervalos y segmentos del ECG Además de las diferencias debidas a la posición de los electrodos en cada derivación del ECG, las características de las ondas y segmentos varían con la edad, tipo morfológico, frecuencia cardíaca (FC) y otros factores fisiológicos (Fig. 5). La onda P se inscribe como una pequeña deflexión redondeada que representa la excitación de ambas aurículas; su duración es menor cuanto mayor es la FC teniendo un promedio de 85 ± 15 mseg. La amplitud de esta onda varía entre y mv, dependiendo de la derivación considerada. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 63
64 El complejo QRS representa la activación de los ventrículos, y su duración varía entre 80 y 160 mseg. Cuando la primera deflexión es negativa, se la denomina como onda Q; todas las ondas positivas son designadas con la letra R, llamándose ondas S a las deflexiones negativas que siguen a una onda R. La onda Q normalmente no sobrepasa el valor del 30% de la onda R en DI o del 40% en DII. En DII puede llagar a ser del 150% de la onda P pero con la característica que disminuye con la inspiración profunda. La onda T representa la repolarización ventricular, su duración no tiene mayor importancia práctica; tiene por característica que su rama ascendente es más lenta que la descendente; generalmente es positiva en todas las derivaciones salvo en avr. El segmento P-R se mide desde el final de la onda P hasta el comienzo de QRS, normalmente no debe presentar desniveles mayores a 0.5 mm; representa el retraso que sufre la onda de activación a nivel de la región aurículo-ventricular. El segmento S-T se mide desde el final del QRS hasta el comienzo de la onda T. normalmente no presenta mayores desniveles mayores de 1 mm. El intervalo PR comprende la onda P y el segmento P-R. El intervalo QT representa toda la actividad eléctrica ventricular, se mide desde el complejo QRS hasta el final de la onda T. Resumiendo: DI, Derivaciones de las extremidades Derivaciones bipolares DII y DIII registran las diferencias de potencial entre la extremidad superior izquierda (LA) y la extremidad superior derecha (RA), la extremidad inferior izquierda (LF) y la extremidad superior derecha (RA), y la extremidad inferior izquierda (LF) y la extremidad superior izquierda (LA) respectivamente. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 64
65 Derivaciones monopolares Se obtienen conectando las tres extremidades a un punto denominado "central terminal" que a efectos prácticos se considera que tiene un potencial cero y sirve como electrodo indiferente o de referencia. Esto permite que, al colocar el electrodo explorador en la extremidad superior derecha, la extremidad superior izquierda o la extremidad inferior izquierda, se puedan registrar los potenciales eléctricos en dicha extremidad. La letra "V" identifica a la derivación monopolar y las letras "R", "L" y "F" a las extremidades respectivas. Si se desconecta de la central terminal la extremidad en la que estamos realizando el registro, se obtiene un aumento de la amplitud y por este motivo se denomina a estas derivaciones avr, avl y avf. Ritmo sinusal (normal) Es el que se origina en el nodo sinusal y que presenta frecuencias entre 60 y 100 x min. La onda P es positiva en DI, DII y avf y negativa en avr. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 65
66 6. BIBLIOGRAFIA Textos de cabecera Cingolani, H. E.; Houssay, A. B. y Col: Fisiología Humana de Houssay. 7ª Edición. Editorial El Ateneo. Buenos Aires Dvorkin, M. A.; Cardinali, D. P.; Iermoli, R. H.: Best & Taylor. Bases Fisiológicas de la Práctica Médica. 14ª Edición. Editorial Médica Panamericana. Buenos Aires Guyton, A. C.: Tratado de Fisiología Médica. 11ª Edición. Editorial Elsevier. Madrid Koeppen, B.M.; Stanton, B.A.: Berne & Levy. Fisiología. 6ª Edición. Editorial Elsevier Mosby. Madrid, Silvernagl, S; Despopoulos, A.: Fisiología. Texto y Atlas. 7ª Edición. Editorial Médica Panamericana. Madrid, Silverthorn, D. U.: Fisiología Humana. Un Enfoque Integrado; 4ª Edición. Editorial Médica Panamericana. Buenos Aires Coppo, J. A.: Fisiología Comparada del Medio Interno. 2ª Edición corregida y aumentada. Editorial Universidad Católica de Salta. Departamento Editorial EUCASA. Salta Textos de consulta Guía de Trabajos Prácticos de Fisiología de la UAP TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 66
67 TRABAJO PRÁCTICO Nº 9 FISIOLOGÍA RESPIRATORIA 1. OBJETIVOS 1.a. OBJETIVOS GENERALES - Conocer los procesos involucrados en la mecánica respiratoria y hematosis. 1.b. OBJETIVOS ESPECÍFICOS TEÓRICOS El alumno debe ser capaz de: Comprender los principios generales de la mecánica respiratoria Conocer los volúmenes y capacidades pulmonares. Conocer las características del transporte de Oxígeno y de Dióxido de Carbono. Analizar la curva de saturación de la Hemoglobina. Comprender la relación entre la ventilación alveolar y la perfusión del sistema respiratorio. Conocer la regulación de la respiración. 1.c. OBJETIVOS ESPECÍFICOS DEL TRABAJO PRÁCTICO - Definir los volúmenes y capacidades pulmonares. - Utilizar un espirómetro. - Determinar capacidad vital. - Demostración de la presencia de CO 2 en el aire espirado. 2. CONOCIMIENTOS NECESARIOS - Características estructurales del pulmón. Músculos respiratorios. Interacción tórax pulmón. - Mecanismos de ventilación pulmonar. Volúmenes y capacidades pulmonares - Presión pleural, alveolar y transpulmonar. Tensión superficial y agente tensioactivo. - Curvas de distensibilidad pulmonar. - Resistencia al flujo aéreo. Factores que regulan el diámetro de las vías aéreas. - Difusión pulmonar. Transporte de gases por la sangre. Curva de saturación del Oxígeno de la Hemoglobina. Efecto Bohr y Haldane. Concepto de hipoxemia. - Características principales de la circulación pulmonar. - Relación ventilación/perfusión. Centros respiratorios y su participación en el control de la respiración. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 67
68 3. DESARROLLO DEL TRABAJO PRÁCTICO 3.a. Fundamento 3.a.1. Espirometría Figura Nº 1 El espirómetro es un instrumento con el que puede evaluarse la fisiología del aparato respiratorio. Con éste (Figura N 1) se puede medir el volumen corriente, los de reserva inspiratoria y espiratoria y las capacidades. Ofrecen una mayor rapidez en la lectura, la posibilidad de almacenar los datos, exhibición digital y lecturas ayudadas por computadora. La utilización de software facilita la evaluación del sistema respiratorio en el diagnóstico y seguimiento de las alteraciones Constan de un sistema de recogida de aire (puede ser de fuelle o campana) y de un sistema de inscripción montado sobre un soporte que se desplaza a la velocidad deseada. La adición de un potenciómetro que genera una señal proporcional al desplazamiento de la campana permite trasformar la señal mecánica en eléctrica. 3.a.2. Demostración de CO 2 en el aire espirado. El aire espirado presenta un tenor de CO 2, producto de las combustiones internas, que es capaz de precipitar una solución de Ca(OH) 2 (agua de cal) como CaCO 3. En el aire espirado existe un porcentaje de CO 2 del 3.6% aproximadamente, en comparación con el aire atmosférico cuya proporción es de 0.04%. 3.b. Materiales 3.b.1. Materiales para mecánica respiratoria: - Espirómetro 3.b.2. Materiales y para determinación de CO 2 en aire espirado: - Solución saturada agua de cal. - Vasos de precipitado. - Sorbetes individuales por alumno. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 68
69 - Materiales de limpieza (por comisión): Detergente Rejilla alcohol gel Cepillo 3.c. Procedimiento 3.c.1. Registro de la capacidad vital - El alumno debe realizar una inspiración profunda y utilizando la boquilla una espiración máxima, registrando el volumen de aire expirado. Capacidad vital: es el volumen de aire que puede ser expulsado por un esfuerzo máximo luego de una inspiración forzada. Puede medirse directamente con el espirómetro; se puede hacer sin límite de tiempo: rápida o lentamente. La Capacidad vital determinada en cualquier sujeto puede compararse con intervalos de referencia para una edad considerando las variaciones por peso y altura. Se consideran fisiológicas a las variaciones del orden del 20% del valor teórico. Todas las mediciones deben repetirse varias veces y calcular un promedio. 3.c.2. Demostración de CO 2 en el aire espirado. - En 3 tubos de ensayos cargar 10 ml de la solución saturada de agua de cal, rotularlos como A, B y C. - En el tubo A hacer burbujear aire atmosférico con la ayuda de una pipeta Pasteur. - En el tubo B (estado de reposo F.R.= 12 ciclos/min aprox.), espirar haciendo burbujear en el seno de la solución durante 5 segundos. - En el tubo C (estado alterado* F.R.= 35 ciclos/min aprox.), espirar haciendo burbujear en el seno de la solución durante 5 segundos. * Estado alterado obtenido por jadeo profundo durante un minuto. 3.d. Resultados 3.d.1. Determinación y registro de Capacidad vital: Todos los alumnos deberán medirse la capacidad vital y registrar los datos obtenidos en la tabla indicada mas abajo. Calcular la media correspondiente. CAPACIDAD VITAL X 1 X 2 X 3 X 3.d.2. Demostración de CO 2 en el aire espirado. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 69
70 Con lo observado en los tubos A, B y C: - Escriba la reacción que demuestra la presencia de dióxido de carbono en el agua de cal. - Explique las diferencias observadas en los 3 tubos. 3.e. Conclusiones Relacionar los resultados hallados en el trabajo práctico con los mecanismos homeostáticos puestos en juego. 4. GUÍA DE ESTUDIO 1. Cuál es la diferencia entre ventilación pulmonar y ventilación alveolar? 2. Cuál es la diferencia entre ventilación y respiración? 3. Qué entiende por espacio muerto anatómico y por espacio muerto fisiológico? 4. Cuál es la diferencia entre volúmenes y capacidades pulmonares? Defina e indique cuáles son los valores normales de estos parámetros en un adulto joven. 5. Qué es el factor surfactante y cuál es su función? 6. Cuál es la composición del aire atmosférico? 7. A qué se denomina hematosis? Una vez que el O 2 pasa a la sangre arterial, cómo es ésta con respecto a la po 2 alveolar? A qué se debe esta diferencia? 8. Cómo se transporta el O 2 y el CO 2 en la sangre? 9. Grafique la curva de disociación de la hemoglobina (% de saturación vs po 2 ) A qué se debe la forma sigmoidea de la curva y como se interpreta la zona de la meseta? 10. Qué factores modifican la afinidad de la hemoglobina por el O 2 y en qué forma lo hacen? 11. Qué entiende por hipoxia? Enumere por lo menos 4 causas. 5. BIBLIOGRAFÍA Cingolani, H. E.; Houssay, A. B. y Col: Fisiología Humana de Houssay. 7ª Edición. Editorial El Ateneo. Buenos Aires Dvorkin, M. A.; Cardinali, D. P.; Iermoli, R. H.: Best & Taylor. Bases Fisiológicas de la Práctica Médica. 14ª Edición. Editorial Médica Panamericana. Buenos Aires Guyton, A. C.: Tratado de Fisiología Médica. 11ª Edición. Editorial Elsevier. Madrid Koeppen, B.M.; Stanton, B.A.: Berne & Levy. Fisiología. 6ª Edición. Editorial Elsevier Mosby. Madrid, Silvernagl, S; Despopoulos, A.: Fisiología. Texto y Atlas. 7ª Edición. Editorial Médica Panamericana. Madrid, Silverthorn, D. U.: Fisiología Humana. Un Enfoque Integrado; 4ª Edición. Editorial Médica Panamericana. Buenos Aires TRABAJO PRÁCTICO N 10 TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 70
71 CONCENTRACIÓN Y DILUCIÓN DE LA ORINA COMPOSICIÓN DE LA ORINA: URIANÁLISIS 1. OBJETIVOS - Determinar densidad y ph de una muestra de orina. - Describir el esquema experimental y los fundamentos de una prueba de sobrecarga funcional renal. - Realizar una prueba de sobrecarga funcional renal. - Explicar las modificaciones observadas en la orina después de realizadas las distintas pruebas de sobrecarga. - Realizar un examen microscópico del sedimento urinario. 2. CONOCIMIENTOS NECESARIOS: Circulación renal: Descripción anatómica del nefrón. Distribución del flujo renal sanguíneo. Gradientes de presión y resistencia de flujo. Regulación nerviosa y humoral del flujo renal. Autorregulación. Filtración glomerular. Factores que determinan la presión efectiva de filtración a nivel del glomérulo Reabsorción y secreción tubular: transporte activo con limitación del transporte máximo en la unidad de tiempo. Transporte pasivo. Sustancias que se reabsorben y/o secretan utilizando cada tipo de mecanismo. Pruebas de aclaramiento que permiten evaluar: 1. filtración glomerular; 2. función tubular; 3. circulación plasmática renal. 3. DESARROLLO DEL TRABAJO PRÁCTICO 3.a. Modificaciones de la Función Renal por sobrecarga de agua y electrolitos 3.a.1. Bases Teóricas La sobrecarga de un organismo con una solución hipoosmótica, con una solución isoosmótica o una solución hiperosmótica y alcalina, lleva a un desequilibrio en el volumen y la composición de su líquido extracelular, poniéndose en juego una serie de procesos y mecanismos que tienden a llevarlos nuevamente a su situación normal. La intervención del riñón en estos procesos y mecanismos puede ser detectada indirectamente, por las modificaciones en la orina emitida después de dicha sobrecarga. Por ejemplo: si un individuo recibe una sobrecarga de agua, sufrirá un aumento de volumen de sus líquidos extracelulares y una modificación (disminución) de la osmolaridad de los mismos. Esta situación será detectada por los osmorreceptores y a través del sistema hipotálamo-hipofisiario con intervención de la Hormona Antidiurética TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 71
72 (ADH), se adecuará la respuesta renal y en un plazo no mayor de 2 3 horas, el organismo se habrá librado del excedente de agua retornando a la normalidad. 3.a.2. Material necesario: 2 matraces de ml. 1 matraz de 500 ml. 3 vasos de precipitado de 250 ml. 3 vasos para beber 1 probeta de 50 ml. 1 probeta de 500 ml. 1 densímetro de orina Papel indicador de ph 1 pinza Solución de Cloruro de Sodio 150 g/l. 3.a.3. Desarrollo del Experimento: En este experimento intervendrán 3 alumnos. El alumno N 1: bebe 750 ml de agua; El alumno N 2: bebe 750 ml de solución de CINa (PM: 58) al 0.9% Antes de la ingesta, cada alumno vaciará completamente su vejiga, recogiendo la orina emitida, la que se denominará: ORINA DE TIEMPO CERO Después de la ingesta recogerán la orina de la misma manera cada 20 minutos, hasta obtener, un total de 5 muestras de orina, además de la del tiempo 0. En cada muestra se harán las siguientes determinaciones: 3.a.4. Determinaciones: i. Volumen: Se vuelca cada muestra de orina en una probeta graduada y se realiza la lectura. ii. Densidad: Se realiza con un densímetro calibrado entre densidades de y 1,060. La determinación de densidades de los líquidos mediante densímetros, se basa en la medición del volumen sumergido cuando el cuerpo flota libremente, en cuyo caso se ha equilibrado el peso del cuerpo con el empuje que sufre. El densímetro consta de un bulbo y una varilla en la cual se encuentra la escala en la que se lee directamente la densidad del líquido, con coincidencia con la superficie libre del líquido. Hay dos tipos de densímetro: 1- para medir TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 72
73 densidades de líquidos con densidad inferior a y 2- aquellos para medir densidades superiores a En ambos tipos, el valor mínimo de la escala se encuentra en el extremo superior de la varilla. Técnica: Llenar una probeta de 50 ml hasta 2 ó 3 ml por debajo del borde superior y colocar el densímetro lentamente haciéndolo girar. (Al colocar la orina en la probeta, cuidar que la misma escurra por las paredes para evitar la formación de espuma). El densímetro no debe tocar ni el fondo ni las paredes de la probeta. La densidad de la orina corresponde a la división de la escala que coincide con la superficie libre del líquido. Después de cada medición, lavar con cuidado la probeta y el densímetro. Si en alguna de las muestras el volumen de orina no alcanzara para medir la densidad, se realizará la siguiente operación: Medir el volumen de orina, previa separación de 2 o 3 ml, para el resto de las determinaciones y agregar agua destilada hasta alcanzar el volumen adecuado para poder utilizar el densímetro. Determinar la densidad de la muestra y averiguar la densidad original de la orina mediante la siguiente relación: Do = (Vm x Dm) (Va x Da) Vo Do: Densidad de orina Dm: Densidad de mezcla Da: Densidad de agua Vo: Volumen de orina Vm: Volumen de mezcla Va: Volumen de agua Otra manera de deterrminar la densidad es por medio de un refractómetro. La refractometría determina la concentración de partículas disueltas en una muestra mediante la medición del índice de refracción. Este último es una comparación entre la velocidad de la luz en el aire y la velocidad de la luz en una solución. La concentración de las partículas disueltas presentes en la solución determina la velocidad y el ángulo en que la luz pasa a través de una solución. Los refractómetros clínicos se basan en los principios de la luz mediante el empleo de un prisma para dirigir una longitud de onda específica (monocromática) de la luz día contra una escala de densidad calibrada por el fabricante. La concentración de la muestra determina el ángulo por el que el haz de luz ingresa al prisma. El refractómetro proporciona la ventaja distintiva de determinar la densidad con un volumen de muestra pequeño (una o dos gotas). TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 73
74 Cuando se utiliza el refractómetro se coloca una gota de orina sobre el prisma, el instrumento se centra en una buena fuente de luz y la lectura se realiza directamente sobre la escala de la densidad. iii. ph de orina: Se puede determinar con un electrodo o con papel indicador. Un indicador de ión hidrógeno, es una sustancia que, dentro de ciertos límites, varía su color de acuerdo con la concentración de iones hidrógeno del medio en el cual se coloca. Los indicadores son ácidos orgánicos débiles (indicadores ácidos) o bases orgánicas débiles (indicadores básicos) cuya forma disociada tiene un color diferente al de la forma no disociada. El grado de disociación depende del ph del medio. En consecuencia, el color que presenta el indicador depende del ph del medio. Cada indicador, en forma individual, vira de color en un rango de ph de 2 unidades aproximadamente, por lo cual es evidente que se necesitan varios indicadores para abarcar el intervalo entre 0 y 14, es decir desde soluciones completamente ácidas hasta soluciones completamente alcalinas. Por eso resultan de gran utilidad en la determinación aproximada del ph las mezclas de indicadores llamadas: indicadores universales, que nos darán el ph del medio, abarcando toda la escala (0-14) con diferentes colores. Se pueden utilizar indicadores líquidos o tiras de papel embebidas con los mismos. Técnica: Sumergir un extremo de la tira de papel indicador en la orina. Luego de algunos segundos, comparar el color obtenido con la escala de colores del envase. iv. Osmolaridad de las soluciones ingeridas: La osmolaridad de una solución se expresa en osmoles/ litro y depende del número de partículas de soluto disuelto por unidad de volumen del solvente. Ejemplo: Una solución de 1 Mol o molécula gramo de cualquier compuesto no disociable (como ser 180 grs. de glucosa) en 1 litro de agua, es decir una solución 1 Osmolar ejerce una presión osmótica de 22.4 atm. En cambio, 1 mol de un compuesto disociable (como ser 74.5 grs. de Cloruro de Potasio) en 1 litro de agua se disocia en 2 iones, es decir una solución 2 osmolar, ejerce una presión osmótica de 44.8 atm. 3.a.5. Resultados: En las siguientes tablas anote los resultados obtenidos en las determinaciones realizadas en las 5 muestras de orina de cada alumno. ALUMNO N 1 (ingirió ) ml TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 74
75 Muestra N Volumen Total Volumen Minuto Urinario Densidad ph ALUMNO N 2 (ingirió ) ml Muestra N Volumen Total Volumen Minuto Urinario Densidad ph - Osmolaridad de la solución de ClNa al 0.9% 3.a.6. Aplicación: i. Comparando con la osmolaridad plasmática, las soluciones ingeridas fueron: Alumno N 1:... Alumno N 2: ii. Grafique la diuresis obtenida en cada una de las pruebas de sobrecarga, en función del tiempo. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 75
76 iii. Grafique la densidad de las muestras de orina obtenidas en las distintas pruebas en función del tiempo densidad iv. Complete el siguiente ejercicio. En el cuadro siguiente se describen las alteraciones clínicas mas frecuentes que pueden ocurrir en los fluidos corporales debido a cambios en el volumen del compartimiento extracelular (EC) y/o en la osmolaridad del mismo. Complete el cuadro indicando que ocurriría con la osmolaridad (OSM) y el volumen del compartimiento intracelular (IC) en cada caso. Considere que: indica disminución, indica aumento y indica que no existe variación. Condición Ejemplo LEC LIC TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 76
77 OSM Volumen OSM Volumen Expansión Ingesta excesiva de hiposmótica agua Contracción Pérdida de sales hiposmótica por el riñón Expansión Edema, infusión isoosmótica intravenosa (IV) Contracción Hemorragia, isoosmótica quemaduras Expansión Ingesta de bebidas hiperosmótica muy saladas Contracción Transpiración hiperosmótica severa DETERMINACIONES QUÍMICAS EN ORINA TIRAS REACTIVAS: son bandas que contienen celdillas en número variable (desde 1 hasta 9-10 determinaciones), para efectuar pruebas rápidas en orina. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 77
78 El papel reactivo sufrirá cambios de color bien definidos y reproducibles (cambios progresivos acorde a la concentración de la sustancia). Se utiliza orina de reciente emisión bien mezclada (no centrifugada). La tira se sumerge en la orina, se escurre, y a los 60 (15 para leucocitos) se comparan los colores desarrollados por cada celdilla con la escala cromática del kit. Veamos las interpretaciones para cada hallazgo: Determinación de leucocitos: Las esterasas leucocitarias desdoblan un éster indoxilo contenido en la celda correspondiente de la tira, que se oxida y da un color azul. Son detectables a partir de 10 leucocitos por µl de orina (incluso si están lisados). Aparecen en las inflamaciones o infecciones del tracto urinario (pielonefritis, glomerulonefritis, cistitis, uretritis, prostatitis, etc.) También pueden dar positividad: tuberculosis renal o genitourinaria, urolitiasis o tumores obstructivos, infecciones específicas como tricomonas o gonococos. Resultados falsos negativos pueden ocurrir cuando existen altas concentraciones de albúminas o ácido ascórbico. Determinación de Nitritos: los gérmenes responsables de la mayoría de las infecciones de las vías urinarias reducen los nitratos presentes en la orina, a nitritos. Estos, en contacto con la celdilla, producen un color rosado a rojo. El análisis debe efectuarse lo más rápidamente posible, para evitar contaminaciones, preferentemente con orina matinal (primera emisión). Falsos negativos pueden obtenerse por permanencias demasiado cortas de la orina en la vejiga o altas dosis de vitamina C. Falsos positivos en la administración de fenazopiridina. Reacción (ph): Los indicadores rojo de metilos y azul de bromotimol manifiestan variaciones cromáticas en la zona existente entre los ph 5 y 9. El ph varía con la dieta oscilando entre 4,5 y 8,0. Existe disminución del ph en acidosis, diabetes mellitas, fiebres, dietas hiperproteicas, diarrea grave, enfisema crónico, medicación con ClNH 4, ayuno prolongado, etc. La elevación del ph puede ser consecuencia de afecciones de las vías urinarias, vómitos, anemias, hiperventilación pulmonar, medicamentos alcalinizantes, etc. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 78
79 Determinación de Proteínas: el viraje cromático e amarillo a verde de la celda correspondiente indica la presencia de proteínas (especialmente albúminas). Puede dar falsa positividad por infusiones de polivinilpirrolidona o restos de desinfectantes tipo amonio cuaternario. Las albuminurias fisiológicas se deben al frío, emociones, fatiga, estasis sanguínea en la vena renal en la estación (ortostática) especialmente en la joven edad, etc. Las proteinurias patológicas pueden ser de tipo morfológicas (Descamación, degeneración o destrucción de células, bacteria, leucocitos, eritrocitos en el tracto urogenital) o por filtración como ocurre en síndromes nefróticos, glomerulonefritis, pielonefritis, riñón poliquístico, glomeruloesclerosis, riñón gotoso, nefropatía por fenacetina, TBC renal, deficiencia cronica de potasio, insuficiencia cardíaca, fiebres, acidosis, neoplasias (proteína Bence-Jones del mieloma), Hodking, ascitis, etc. Determinación de Glucosa: se basa en el método específico de glusosaoxidasa-peroxidasa, donde un viraje de anaranjado a pardo indica positividad. El límite ptráctico de detección es de 40mg/dl de orina. Se produce glucosuria cuando existen hiperglucemias que superan el umbral plasmático para este azúcar. Fisiológicamente puede ocurrir en el periodo postprandial, gestación y lactancia. Patológicamente en la diabetes mellitus, glucosuria renal, hipertiroidismo, hiperpituarismo, hipersuprarrenalismo, infarto de miocardio, etc. Resultados falsos positivos pueden darse cuando existan residuo de desinfectantes oxidantes en los envases de orina. Falsos negativos pueden ocurrir por altas dosis de vitamina C. Determinación de Cuerpos cetónicos: son detectados por encima de un límite que para el ácido acético es de 40mg/dl de orina. La positividad se indica por un viraje al color violeta, que puede significar insuficiencia hepática, diabetes pancreática descompensada, cetoacidosis, trastornos del metabolismo lipídico, hiperémesis gravídica, ayuno-inanición, diabetes renales. Determinación de Urobilinógeno (UBG): reacciona con una sal diazoica estable produciendo un colorante azoico rojo. Aumenta en ictericias hepatocelulares y hemolíticas, en insuficiencias hepáticas, cirrosis, estados post infecciosos y en la digestión. Disminuye (desaparece) en la ictericia obstructiva y o trastornos de la flora bacteriana intestinal. Determinación de Bilirrubina: se combina con una sal diazoica dando coloraciones desde rojo claro a violeta, aparece en orina en forma patológica cuando excede su umbral plasmático debido a obstrucciones del drenaje biliar, ictericia hepatocelular y hemolíticas crónicas. Determinación de Sangre (eritrocitos o Hb): el panel reactivo de la celda contiene hidroperóxido orgánico que produce la oxidación del indicador bajo la acción de la hemoglobina y de la mioglobina. Existen 2 escalas cromáticas separadas, para eritrocitos y Hb. Ocurren hematurias falsas por contaminación genital o hemorroidal. La hematuria verdadera se puede deber a traumatismos, cálculos, uretritis, glomerulonefritis, cistitis, TBC renal intoxicaciones, etc. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 79
80 La hemoglobinuria será registrada en enfermedades hemolíticas, infecciones, quemaduras, intoxicaciones. Falsos negativos pueden existir por administración de vitamina C. falsos positivos por residuos de desinfectantes oxidantes. Ciertos trastornos musculares (inflamatorios o degenerativos), pueden cursar con mioglobinuria. EXAMEN MICROSCÓPICO DEL SEDIMENTO URINARIO Se realiza con orina recién emitida (hay elementos que se destruyen a los 15 minutos); caso contrario, la muestra deberá ser refrigerada. La interpretación correcta dependerá de la técnica de recolección y el examen posterior. Se homogeneiza bien la muestra, se centrifugan 10 ml de orina durante 3-5 minutos a baja velocidad ( rpm) para evitar la deformación de los elementos a examinar. Se elimina el sobrenadante y el sedimento emulsionado con el resto de la orina se coloca entre porta y cubre. A veces resulta necesario diluir el sedimento con más orina para mayor claridad. Observar al microscopio primero con pequeño y luego con gran aumento. El sedimento urinario puede presentar Cristales (sustancias orgánicas e inorgánicas poco solubles), elementos celulares (bacterias, eritrocitos, leucocitos, células epiteliales de la nefrona o del tracto urinario), sustancias o elementos organizados en forma de cilindros, bacterias, hifas de hongos, protozoarios. CRISTALES a) Orinas ácidas * Cristales de ácido úrico: se observan como rosetas prismáticas, prismas rómbicos, formas estrelladas, etc. Son de color amarillo intenso o rojizo (por el pigmento de uroeritrina). A veces son incoloros o ligeramente amarillos. Su presencia puede indicar patologías como gota, fiebre aguda, nefritis crónicas, litiasis úricas, etc. * Cristales de urato de sodio: son pequeños, con forma de agujas o prismas delgados, incoloros o amarillos que se presentan en grupos o racimos. * Cristales de uratos amorfos: se observan en orinas concentradas, muy ácidas, propio de regimenes hiperproteicos, enfermedades febriles, sudoraciones profusas, leucemias, cirrosis hepáticas. * Cristales de oxalato de calcio: incoloros, en forma de sobre de carta o esferulados. Se presentan en los vegetarianos y en las litiasis cálcicas, ingesta exagerada de naranjas, tomates y espárragos. * Cristales de Leucina y Tirosina: son raros de observar y constituyen productos de degradación proteica. Aparecen en la degeneración grasa del hígado, intoxicaciones por fosforados, etc. La leu se observa como esferas aceitosas de color amarillento con estrías radiales y concéntricas. La Tyr presenta forma de agujas finas de color negro, dispuestas en haces. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 80
81 * Cristales de Cistina: hexagonales e incoloros, de bordes netos. Pueden indicar cálculos renales o vesicales. * Cristales de Colesterol: son placas de gran tamaño, planas transparentes, con una muesca en uno o más angulos. b) Orinas alcalinas * Cristales de fosfato amónico-magnésico: tienen forma de tapa de ataúd o cristales plumosos. Se encuentran en orinas con fermentación amoniacal, en retención urinaria vesical, cistitis crónica e hipertrofias prostáticas. * Cristales de fosfato neutro de calcio: presentan formas de prismas, agrupados en rosetas, o estrellados; también forma de agujas largas y brillantes. * Cristales de fosfato amorfo: conglomerado granular abundante, se observa en trastornos del metabolismo fosfo-cálcico, (osteopatías, hiperparatiroidismo), alcalosis, etc. * Cristales de carbonato de calcio: gránulos amorfos, raramente se presentan como esferas incoloras. Son solubles en ácido acético con desprendimiento de gas (CO2) a diferencia de los cristales de oxalato de calcio que se disuelven en HCl. ELEMENTOS CELULARES Células epiteliales: productos de descamación de los distintos epitelios del árbol urinario. Su aumento indica un proceso inflamatorio. Pueden ser: a. Escamosas o pavimentosas: planas, de tamaño grande y protoplasma transparente. Núcleo pequeño, ovalado, o redondo, provienen de las capas superficiales de la vagina y uretra femenina y de la porción inferior de la uretra masculina. Representa el desprendimiento celular normal y no tienen importancia patológica. b. Redondas o poliédricas: de mayor tamaño que un neutrófilo, núcleo esférico y grueso, pueden provenir de cualquier capa profunda de las vías urinarias o de los túbulos renales. Leucocitos: normalmente se observan escasos leucocitos (4-5 por campo). Su aumento (piuria) indica un proceso patológico del sistema urinario (nefritis, pielonefritis, uretritis, cistitis, etc.) Eritrocitos: la orina normal contiene algunos eritrocitos pero sólo cuando aumentan demasiado puede hablarse de hematuria. La presencia de hematíes en la orina no siempre indica lesión renal, pueden provenir de lesiones de las vías urinarias inferiores. En la orina, los eritrocitos se deforman (estrellados, globulares). Otros elementos: pueden hallarse espermatozoides, reconocibles por su característica estructura, no tienen significación clínica. Pueden visualizarse bacterias (no existen normalmente, pero tener cuidado que TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 81
82 no se trate de una contaminación in-vitro), tienen motilidad y abundan en casos de cistitis, pielonefritis, etc.; hongos (hifas); parásitos (tricomonas, giardias, filarias, etc.); levaduras. Las células de los túbulos renales absorben lípidos que están presentes en el filtrado glomerular, por esto, aparecen muy refringentes. Estas células que contienen lípidos se conocen como cuerpos ovales grasos. Gotitas de grasa: esferas de distintos tamaños, refringentes, se tiñen con ácido ósmico o Sudán III. Aparecen por ingestión de hígado de bacalao y otros lípidos. Artefactos: Elementos que no corresponden a la orina: Fibras, vidrio, pelos, partículas de talco, etc. CILINDROS Representan generalmente coágulos de sustancias proteicas que se expulsan con la orina; tienen el contorno de la luz de los túbulos renales donde se formaron (usualmente se generan en distales y colectores). Se los halla en gran número de congestiones renales, transitorias, pero no constituyen por sí solos un trastorno orgánico del riñón. Desde el punto de vista cualitativo, distinguimos los siguientes tipos: Hialinos: proteicos, homogéneos, semitransparentes o incoloros, de forma de cigarro. Aparecen con ph ácido, en congestiones renales, fiebre, anestesia etérea, exceso de ejercicio. Granulosos: son los anteriores, que englobaron gránulos (productos de la desintegración del epitelio tubular). Implican la existencia de nefropatías inflamatorias. Céreos: más opacos, homogéneos o granulosos, de color gris. Aparecen en nefritis, degeneraciones renales tipo amiloideas (pronóstico desfavorable). Epiteliales: las células tubulares se agrupan formando cilindros ovales, alargados o planos. Significado: nefritis agudas, degeneración tubular. Eritrocíticos: homogéneos, amarillos o anaranjados. Indican hemorragias en túbulos o glomérulos, congestión renal. Adiposos: Contienen gotitas incoloras, refringentes. Aparecen en lesiones tubulares degenerativas, diabetes mellitus, en inflamaciones renales subagudas o crónicas. Leucocíticos (purulentos): procesos supurantes (abscesos renales, pielonefritis). Bacterianos: raros, indican enfermedad séptica del riñón. ACTIVIDAD: Observar el sedimento urinario y registrar el resultado: TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 82
83 ORINA CÉLULAS EPITELIALES:... LEUCOCITOS:... HEMATÍES:... CILINDROS:... CRISTALES:... OTROS: CUESTIONARIO GUÍA 1. Qué es la osmolaridad de una solución? 2. Cuáles son las características del sistema multiplicador por contracorriente? 3. Qué ventajas brinda este sistema? 4. Cómo debe prepararse al paciente para efectuar las pruebas de Volhard? 5. En qué tipo de nefronas es importante este mecanismo? Por qué? 6. Enuncie tres objetivos del trabajo práctico del día de la fecha. 7. Cómo prepara a un paciente para recoger la primera orina de la mañana? 8. Porqué se elige esta muestra y no otra de cualquier horario del día? 9. Los análisis de rutina en la denominada orina completa, son cualitativos o cuantitativos? Justifique su respuesta. 10. Dentro de la etapa analítica, cómo se agrupan las determinaciones que se efectúan? 11. Seleccione dos determinaciones químicas y explique qué espera encontrar de estos analitos en la orina (si no deben aparecer, si es frecuente o normal que aparezcan, etc. y porqué). 12. Enumere tres elementos que pueden verse en un sedimento urinario normal. 5. BIBLIOGRAFÍA Cingolani, H. E.; Houssay, A. B. y Col: Fisiología Humana de Houssay. 7ª Edición. Editorial El Ateneo. Buenos Aires TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 83
84 Dvorkin, M. A.; Cardinali, D. P.; Iermoli, R. H.: Best & Taylor. Bases Fisiológicas de la Práctica Médica. 14ª Edición. Editorial Médica Panamericana. Buenos Aires Guyton, A. C.: Tratado de Fisiología Médica. 11ª Edición. Editorial Elsevier. Madrid Koeppen, B.M.; Stanton, B.A.: Berne & Levy. Fisiología. 6ª Edición. Editorial Elsevier Mosby. Madrid, Silvernagl, S; Despopoulos, A.: Fisiología. Texto y Atlas. 7ª Edición. Editorial Médica Panamericana. Madrid, Silverthorn, D. U.: Fisiología Humana. Un Enfoque Integrado; 4ª Edición. Editorial Médica Panamericana. Buenos Aires Coppo, J. A.: Fisiología Comparada del Medio Interno. 2ª Edición corregida y aumentada. Editorial Universidad Católica de Salta. Departamento Editorial EUCASA. Salta Consultas: Coppo, J. A.: Apuntes de Fisiología Humana y Animal - Iovine, E Y Selva, A.A.: El Laboratorio En La Clínica, 2 Edición, Panamericana, Buenos Aires, TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 84
85 TRABAJO PRÁCTICO N 11 ROL DE LAS PROTEÍNAS EN EL ORGANISMO PROTEINOGRAMA ELECTROFORETICO 1. OBJETIVOS Determinar en forma cualitativa las proteínas del plasma. Reconocer las proteínas de cada fracción en la corrida electroforética. Evaluar la importancia de una técnica económica y sencilla en la determinación de patologías por comparación con muestra de referencia. Reconocer las actividades de proteínas que integran las diferentes bandas y relacionarlas con su función fisiológica a modo de integración de los temas dictados. 2. CONOCIMIENTOS TEORICOS NECESARIOS Proteínas plasmáticas: Composición Funciones tamaños peso molecular. Electroforesis. 3. DESARROLLO DEL TRABAJO PRÁCTICO FUNDAMENTOS Las proteínas son polímeros de aminoácidos, las cuales poseen grupos aminos con cargas + y grupos carboxilos con cargas -, del balance de estas resulta la carga neta. Dado que estas cargas dependen del ph de la solución, en este método, se trabaja a un ph constante en el cual la mayoría de las proteínas se cargan en forma negativa; esta estrategia permite que la separación de las distintas fracciones ocurra desde el cátodo (-) al ánodo (+). La albúmina es la que posee mayor movilidad, le siguen las fracciones alfa1, alfa2, beta1, beta2 y las gamma (esta última permanece en el punto de siembra). La concentración normal de proteínas plasmáticas es de 6,0-8,0 g/dl, las cuales podemos dividirlas en: Prealbúmina (0,1 0,3 g/dl) Albúmina (3,6 4,6 g/dl): pequeña y globular de Daltons. Negativa a ph fisiológico. Fracción Alfa 1 globulinas (0,1 0,3 g/dl): α1 antitripsina, transcortina, globulina fijadora de tiroxina, αfetoproteina, α lipoproteína, α 1 glicoproteína acida. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 85
86 Fracción Alfa2 globulinas (0,5 0,7 g/dl): α2 macroglobulina, haptoglobina, ceruloplasmina, eritropoyetina. Fracción Beta globulinas (0,6-1,0 g/dl): transferrina, hemopexina, complemento, plasminogeno. Fracción Gamma globulinas (0,8-1,3 g/dl): inmunoglobulinas. La migración de partículas cargadas por influencia de una corriente eléctrica, se denomina ELECTROFORESIS. La velocidad de migración depende de la magnitud de la carga, el tamaño, la forma y la fuerza iónica del medio. Dentro de los factores a tener en cuenta: Potencial, temperatura y tiempo: a mayor potencial, mayor velocidad, por tanto, menor tiempo; pero a la vez existe aumento de temperatura lo cual puede desnaturalizar las proteínas. Fuerza iónica: a mayor fuerza iónica, mayor competencia entre los iones, lo cual lleva a migración más lenta, se observaran bandas menos separadas pero más nítidas. Soporte: existen diferentes soportes. en este trabajo práctico utilizaremos el de acetato de celulosa gelificado, el cual separa las proteínas en 6 fracciones. MATERIALES Muestra: suero (libre de hemólisis), orina o LCR. No usar plasma porque el fibrinógeno interfiere. Soporte (tiras) de acetato de celulosa gelificado conservadas en metanol al 40 % a 4 C. No dejar secar las tiras Cuba electroforética y fuente de poder. Sembrador, tijera, pinza para cejas, papel de filtro, recipientes para decolorar. Pipetas de: 10ml, 2ml y 1ml. Buffer: Solución de Boro acetato. Dilución 1:10 en agua destilada. Solución colorante: Rojo Ponceau S: 0,5g en 100ml de acido tricloroacetico 5%. Amido Schwart: 0,5g en 45ml metanol + 45ml agua + 10ml acido acético. Soluciones decolorantes: Para Rojo Ponceau S: acido acético 5%. Para Amido Schwart: acido acético 5% y ac. acético+metanol (1+9). Deshidratante: metanol puro. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 86
87 Solución para Transparentizar: preparar en el momento de uso: 8,5ml metanol + 1,4 ml ac. acético + 0,1ml glicerol. Cuba electroforética y fuente TÉCNICA Colocar las tiras de acetato de celulosa (manipulándolas siempre con pinza para no contaminar) en el buffer durante 10 minutos previo a la utilización. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 87
88 Secar suavemente las tiras con papel absorbente para eliminar el exceso de buffer, evitando la eliminación de la superficie gelificada. Cortar las tiras por la mitad y realizar un chanfle en la parte inferior derecha, esto nos indicará la posición de la tira en la cual se realiza la siembra (lado más opaco). Colocar las tiras en la cuba con la precaución de que la superficie más opaca (superficie activa para las proteínas) mire hacia arriba; apretar ambos extremos con papel absorbente embebido en buffer, este actúa como puente entre las tiras y el buffer y permite la rigidez de las tiras para una buena siembra. Colocar una gota de la muestra patrón y los desconocidos sobre portaobjetos y ensayar la siembra sobre papel con sembrador (semi micro). El sembrador se carga por capilaridad (no tocar el portaobjetos) y se descarga una sola vez. Realizar las siembras en el extremo catódico, rotular las tiras, tapar la cuba y conectarla a la fuente de poder. Regular el amperaje en 2,5 ma por tiras, a un voltaje constante de V. Dejar correr min en estas condiciones y controlando los ma. Desconectar la fuente y la cuba y retirar las tiras. Proceder a colorear durante 5 min y luego lavar levemente con agua de la canilla. La solución colorante se recupera. Realizar la decoloración pasando por las sucesivas soluciones de ac. acético (1,2 y 3) durante 5 min c/u. Recuperar las soluciones. Deshidratar con metanol puro 30 segundos. Transparentar sumergiendo las tiras 2 min en solución pertinente, recogerlas y acomodarlas sobre portaobjetos; llevar a estufa (el tiempo varia con la temperatura). INFORME Y RESULTADOS Reconocer por visualización directa las diferentes fracciones proteicas, relacionando la movilidad de cada una con tamaño, peso molecular y cargas. Indicar posibles causas de errores. TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 88
89 TRABAJOS PRÁCTICOS FISIOLOGÍA HUMANA FaCENA UNNE 89
TRABAJO PRÁCTICO N 2 FISIOLOGÍA LEUCOCITARIA
 TRABAJO PRÁCTICO N 2 FISIOLOGÍA LEUCOCITARIA 1. OBJETIVOS 1. A. OBJETIVOS GENERALES - Relacionar las variaciones fisiológicas de la concentración de Leucocitos y de la Fórmula Leucocitaria Relativa con
TRABAJO PRÁCTICO N 2 FISIOLOGÍA LEUCOCITARIA 1. OBJETIVOS 1. A. OBJETIVOS GENERALES - Relacionar las variaciones fisiológicas de la concentración de Leucocitos y de la Fórmula Leucocitaria Relativa con
TRABAJO PRÁCTICO N 1 LÍQUIDOS CORPORALES: SANGRE EXPLORACIÓN DE LOS MECANISMOS FISIOLÓGICOS INVOLUCRADOS EN EL EQUILIBRIO OSMÓTICO 1. OBJETIVOS 1.
 TRABAJO PRÁCTICO N 1 LÍQUIDOS CORPORALES: SANGRE EXPLORACIÓN DE LOS MECANISMOS FISIOLÓGICOS INVOLUCRADOS EN EL EQUILIBRIO OSMÓTICO 1. OBJETIVOS 1. A. OBJETIVOS GENERALES - Obtener muestra de un líquido
TRABAJO PRÁCTICO N 1 LÍQUIDOS CORPORALES: SANGRE EXPLORACIÓN DE LOS MECANISMOS FISIOLÓGICOS INVOLUCRADOS EN EL EQUILIBRIO OSMÓTICO 1. OBJETIVOS 1. A. OBJETIVOS GENERALES - Obtener muestra de un líquido
TRABAJO PRÁCTICO Nº 3 PROPIEDADES DE LA SANGRE DETERMINACIÓN DE GRUPOS SANGUÍNEOS INTERPRETACIÓN FISIOLÓGICA DE LAS PRUEBAS
 TRABAJO PRÁCTICO Nº 3 PROPIEDADES DE LA SANGRE DETERMINACIÓN DE GRUPOS SANGUÍNEOS INTERPRETACIÓN FISIOLÓGICA DE LAS PRUEBAS 1. OBJETIVOS Que, a partir de los conocimientos teóricos, los alumnos logren:
TRABAJO PRÁCTICO Nº 3 PROPIEDADES DE LA SANGRE DETERMINACIÓN DE GRUPOS SANGUÍNEOS INTERPRETACIÓN FISIOLÓGICA DE LAS PRUEBAS 1. OBJETIVOS Que, a partir de los conocimientos teóricos, los alumnos logren:
TRABAJO PRÁCTICO N 2 FISIOLOGÍA LEUCOCITARIA
 TRABAJO PRÁCTICO N 2 FISIOLOGÍA LEUCOCITARIA 1. OBJETIVOS 1. A. OBJETIVOS GENERALES - Relacionar las variaciones fisiológicas de la concentración de Leucocitos y de la Fórmula Leucocitaria Relativa con
TRABAJO PRÁCTICO N 2 FISIOLOGÍA LEUCOCITARIA 1. OBJETIVOS 1. A. OBJETIVOS GENERALES - Relacionar las variaciones fisiológicas de la concentración de Leucocitos y de la Fórmula Leucocitaria Relativa con
El término de tejido sanguíneo es un tejido conectivo altamente especializado, cuya matriz extracelular es liquida y se denomina plasma
 Trabajo Práctico N o 10: Tejido sanguíneo Nombre... Comisión... Objetivos 1. Identificar en microscopio óptico los elementos del tejido sanguíneo 2. Observar cristales de hemoglobina 3. Comprender los
Trabajo Práctico N o 10: Tejido sanguíneo Nombre... Comisión... Objetivos 1. Identificar en microscopio óptico los elementos del tejido sanguíneo 2. Observar cristales de hemoglobina 3. Comprender los
Trabajo Práctico Nº 8 SANGRE
 Trabajo Práctico Nº 8 SANGRE Este tejido conectivo líquido se estudia mediante los frotis sanguíneos. Estos consisten en la colocación de una gota de sangre sobre el portaobjetos que será extendida con
Trabajo Práctico Nº 8 SANGRE Este tejido conectivo líquido se estudia mediante los frotis sanguíneos. Estos consisten en la colocación de una gota de sangre sobre el portaobjetos que será extendida con
Hemograma. El Hemograma es una parte del análisis de sangre que nos proporciona el recuento de glóbulos rojos, blancos y plaquetas.
 10.Prevención de la salud Hemograma El Hemograma es una parte del análisis de sangre que nos proporciona el recuento de glóbulos rojos, blancos y plaquetas. 11 Para poder realizar un hemograma la sangre
10.Prevención de la salud Hemograma El Hemograma es una parte del análisis de sangre que nos proporciona el recuento de glóbulos rojos, blancos y plaquetas. 11 Para poder realizar un hemograma la sangre
TRABAJO PRÁCTICO Nº 6 FISIOLOGIA DE LA REPRODUCCIÓN APARATO REPRODUCTOR MASCULINO 1. OBJETIVOS
 TRABAJO PRÁCTICO Nº 6 FISIOLOGIA DE LA REPRODUCCIÓN APARATO REPRODUCTOR MASCULINO 1. OBJETIVOS Con los conocimientos de los contenidos de la clase teórica: 1.a. OBJETIVOS GENERALES Explicar la regulación
TRABAJO PRÁCTICO Nº 6 FISIOLOGIA DE LA REPRODUCCIÓN APARATO REPRODUCTOR MASCULINO 1. OBJETIVOS Con los conocimientos de los contenidos de la clase teórica: 1.a. OBJETIVOS GENERALES Explicar la regulación
ABAJO PRÁCTICO Nº 5 FISIOLOGIA DE LA REPRODUCCIÓN APARATO REPRODUCTOR MASCULINO 1. OBJETIVOS
 TRABAJO PRÁCTICO Nº 5 FISIOLOGIA DE LA REPRODUCCIÓN APARATO REPRODUCTOR MASCULINO 1. OBJETIVOS Con los conocimientos de los contenidos de la clase teórica: 1.a. OBJETIVOS GENERALES Explicar la regulación
TRABAJO PRÁCTICO Nº 5 FISIOLOGIA DE LA REPRODUCCIÓN APARATO REPRODUCTOR MASCULINO 1. OBJETIVOS Con los conocimientos de los contenidos de la clase teórica: 1.a. OBJETIVOS GENERALES Explicar la regulación
INSTRUCCIÓN TÉCNICA DISTRIBUCIÓN: Jefe de la Unidad de Calidad SUMARIO DE MODIFICACIONES
 Determinación del antígeno D Débil Du Página 1 de 5 DISTRIBUCIÓN: DEPARTAMENTO Dirección Hematología Enfermería RESPONSABLE Jefe de la Unidad de Calidad Jefe de la Unidad de Hematología Coordinadora de
Determinación del antígeno D Débil Du Página 1 de 5 DISTRIBUCIÓN: DEPARTAMENTO Dirección Hematología Enfermería RESPONSABLE Jefe de la Unidad de Calidad Jefe de la Unidad de Hematología Coordinadora de
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE
 PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
UNIVERSIDAD INTERAMERICANA DE PUERTO RICO RECINTO DE ARECIBO DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA BIOL 3405: LABORATORIO DE INMUNOLOGÍA
 UNIVERSIDAD INTERAMERICANA DE PUERTO RICO RECINTO DE ARECIBO DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA BIOL 3405: LABORATORIO DE INMUNOLOGÍA I. TÍTULO Dilución II. OBJETIVOS Repasar el concepto de dilución
UNIVERSIDAD INTERAMERICANA DE PUERTO RICO RECINTO DE ARECIBO DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA BIOL 3405: LABORATORIO DE INMUNOLOGÍA I. TÍTULO Dilución II. OBJETIVOS Repasar el concepto de dilución
PREGUNTAS EXÁMENES SANGRE
 PREGUNTAS EXÁMENES SANGRE No es seguro que la respuesta CORRECTA sea la de verdad Señale cual de las siguientes afirmaciones sobre los procesos de inmunidad es CORRECTA: a) La inmunidad específica depende
PREGUNTAS EXÁMENES SANGRE No es seguro que la respuesta CORRECTA sea la de verdad Señale cual de las siguientes afirmaciones sobre los procesos de inmunidad es CORRECTA: a) La inmunidad específica depende
Cuando la sustancia que se difunde es el agua, y cuando la difusión se lleva a cabo a través de una membrana semi-permeable el proceso se llama
 OSMOSIS Cuando la sustancia que se difunde es el agua, y cuando la difusión se lleva a cabo a través de una membrana semi-permeable el proceso se llama ósmosis. También el movimiento del agua hacia abajo
OSMOSIS Cuando la sustancia que se difunde es el agua, y cuando la difusión se lleva a cabo a través de una membrana semi-permeable el proceso se llama ósmosis. También el movimiento del agua hacia abajo
TEMA 3. RECOGIDA Y MANIPULACIÓN N DE MUESTRAS. COLORANTES EN HEMATOLOGÍA
 TEMA 3. RECOGIDA Y MANIPULACIÓN N DE MUESTRAS. COLORANTES EN HEMATOLOGÍA NORMAS PARA CORRECTA EXTRACCIÓN SANGUÍNEA #Punción venosa Región antecubital, yugular o femoral en RN, dorso de la mano y pie en
TEMA 3. RECOGIDA Y MANIPULACIÓN N DE MUESTRAS. COLORANTES EN HEMATOLOGÍA NORMAS PARA CORRECTA EXTRACCIÓN SANGUÍNEA #Punción venosa Región antecubital, yugular o femoral en RN, dorso de la mano y pie en
ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD
 Práctico 2 Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 2: ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten;
Práctico 2 Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 2: ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten;
Método de flotación con sulfato de zinc de densidad. heces por flotación. Rina G. de Kaminsky
 Método de flotación con sulfato de zinc de densidad 118o120 1.18 1.20. Método de concentración de heces por flotación. Rina G. de Kaminsky Métodos de concentración Cuando el examen directo de heces resulta
Método de flotación con sulfato de zinc de densidad 118o120 1.18 1.20. Método de concentración de heces por flotación. Rina G. de Kaminsky Métodos de concentración Cuando el examen directo de heces resulta
Prácticas Integrales I Año Lectivo 2007-2008 Modulo I Procedimientos e instrumentación Básica en el Laboratorio
 Práctica N 2 Mediciones y Tipos de Errores 1.- Objetivos: Seleccionar el instrumento más apropiado para realizar una medición considerando su precisión y exactitud. Realizar transformaciones de unidades
Práctica N 2 Mediciones y Tipos de Errores 1.- Objetivos: Seleccionar el instrumento más apropiado para realizar una medición considerando su precisión y exactitud. Realizar transformaciones de unidades
TEJIDO SANGUÍNEO Qué es la sangre?
 TEJIDO SANGUÍNEO Qué es la sangre? La sangre es un tejido conectivo muy especializado formado por diferentes poblaciones celulares. Es el líquido que mantiene la vida y circula a través de las siguientes
TEJIDO SANGUÍNEO Qué es la sangre? La sangre es un tejido conectivo muy especializado formado por diferentes poblaciones celulares. Es el líquido que mantiene la vida y circula a través de las siguientes
RECOGIDA Y MANIPULACIÓN N DE MUESTRAS COLORANTES EN HEMATOLOGÍA
 RECOGIDA Y MANIPULACIÓN N DE MUESTRAS COLORANTES EN HEMATOLOGÍA 1. La sangre. Normas para su correcta extracción. - Características de la punción venosa - Características de la punción capilar 2. Anticoagulantes
RECOGIDA Y MANIPULACIÓN N DE MUESTRAS COLORANTES EN HEMATOLOGÍA 1. La sangre. Normas para su correcta extracción. - Características de la punción venosa - Características de la punción capilar 2. Anticoagulantes
PRÁCTICA # 3 COLORACIÓN DE WRIGHT Y GIEMSA
 PRÁCTICA # 3 COLORACIÓN DE WRIGHT Y GIEMSA A. Introducción Con el fin de estudiar satisfactoriamente los frotis sanguíneos, es necesario colorearlos. En la mayoría de los laboratorios los colorantes más
PRÁCTICA # 3 COLORACIÓN DE WRIGHT Y GIEMSA A. Introducción Con el fin de estudiar satisfactoriamente los frotis sanguíneos, es necesario colorearlos. En la mayoría de los laboratorios los colorantes más
PROPIEDADES DE LOS FLUIDOS
 PROPIEDADES DE LOS FLUIDOS CRUDO Objetivo: Determinar las propiedades importantes del Crudo, tales como la Densidad, Gravedad API, Viscosidad Cinemática y Viscosidad Dinámica; utilizando diferentes métodos.
PROPIEDADES DE LOS FLUIDOS CRUDO Objetivo: Determinar las propiedades importantes del Crudo, tales como la Densidad, Gravedad API, Viscosidad Cinemática y Viscosidad Dinámica; utilizando diferentes métodos.
Técnicas de aglutinación En estas técnicas se hacen visibles los complejos Ag-Ac por la aglutinación que producen los anticuerpos cuando el Ag forma
 Técnicas de aglutinación En estas técnicas se hacen visibles los complejos Ag-Ac por la aglutinación que producen los anticuerpos cuando el Ag forma parte, o se ha unido artificialmente, a la superficie
Técnicas de aglutinación En estas técnicas se hacen visibles los complejos Ag-Ac por la aglutinación que producen los anticuerpos cuando el Ag forma parte, o se ha unido artificialmente, a la superficie
TRABAJO PRÁCTICO Nº 2 CÉLULA Y MATERIAL ÓPTICO
 TRABAJO PRÁCTICO Nº 2 CÉLULA Y MATERIAL ÓPTICO OBJETIVOS: Alumno:.... - Analizar las características y el funcionamiento del instrumental óptico. - Aprender las normas básicas para el cuidado, manejo y
TRABAJO PRÁCTICO Nº 2 CÉLULA Y MATERIAL ÓPTICO OBJETIVOS: Alumno:.... - Analizar las características y el funcionamiento del instrumental óptico. - Aprender las normas básicas para el cuidado, manejo y
Se tiene que preparar el frotis con anticipación y debes enfocar con el menor aumento y asi
 Frotis sanguíneo Material Porta objetos Microscopio Lanceta Placa excava de porcelana Tècnica Se limpia el dedo con alcohol y se hace una punción en el mismo hasta que caiga la gota de sangre que es necesaria
Frotis sanguíneo Material Porta objetos Microscopio Lanceta Placa excava de porcelana Tècnica Se limpia el dedo con alcohol y se hace una punción en el mismo hasta que caiga la gota de sangre que es necesaria
TEMA 17: VALORACIÓN DE LA RESPUESTA INMUNE DE BASE CELULAR. Separación de células en la respuesta inmune. Pruebas de funcionalidad.
 TEMA 17: VALORACIÓN DE LA RESPUESTA INMUNE DE BASE CELULAR. Separación de células en la respuesta inmune. Pruebas de funcionalidad. OBJETIVOS - Conocer la importancia de la valoración de la respuesta inmune
TEMA 17: VALORACIÓN DE LA RESPUESTA INMUNE DE BASE CELULAR. Separación de células en la respuesta inmune. Pruebas de funcionalidad. OBJETIVOS - Conocer la importancia de la valoración de la respuesta inmune
QUE ES? Es la búsqueda de anticuerpos preformados contra los linfocitos de un posible donante en el suero de un paciente.
 CROSS MATCH QUE ES? Es la búsqueda de anticuerpos preformados contra los linfocitos de un posible donante en el suero de un paciente. Pueden estar específicamente dirigidos contra los antígenos HLA o contra
CROSS MATCH QUE ES? Es la búsqueda de anticuerpos preformados contra los linfocitos de un posible donante en el suero de un paciente. Pueden estar específicamente dirigidos contra los antígenos HLA o contra
TEMA 2 LA SANGRE. Dra. Olga Briceño
 TEMA 2 LA SANGRE Dra. Olga Briceño LA SANGRE Líquido rojo único, claro u oscuro de composición variable que circula a través de los vasos sanguíneos del cuerpo humano cumpliendo con todas las actividades
TEMA 2 LA SANGRE Dra. Olga Briceño LA SANGRE Líquido rojo único, claro u oscuro de composición variable que circula a través de los vasos sanguíneos del cuerpo humano cumpliendo con todas las actividades
6.Prevención de la salud. Qué es la anemia?
 6 6.Prevención de la salud Qué es la anemia? La anemia es la disminución en el hematocrito (volumen que ocupan los glóbulos rojos en la sangre), número de glóbulos rojos o en la concentración de hemoglobina
6 6.Prevención de la salud Qué es la anemia? La anemia es la disminución en el hematocrito (volumen que ocupan los glóbulos rojos en la sangre), número de glóbulos rojos o en la concentración de hemoglobina
Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre. La hemoglobina aumenta la capacidad de la sangre para transportar oxígeno.
 Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre La sangre transporta los gases respiratorios por todo el organismo. El O2 se transporta desde los pulmones hasta todos los tejidos del
Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre La sangre transporta los gases respiratorios por todo el organismo. El O2 se transporta desde los pulmones hasta todos los tejidos del
GenPE: estudio Internacional de Genética en Preeclampsia
 GenPE: estudio Internacional de Genética en Preeclampsia INSTRUCTIVO Toma de muestra proyecto GenPE PAQUETE PARA CAPTACIÓN DE PACIENTE Y TOMA DE MUESTRA. Cuando llegue a su institución la caja del proyecto
GenPE: estudio Internacional de Genética en Preeclampsia INSTRUCTIVO Toma de muestra proyecto GenPE PAQUETE PARA CAPTACIÓN DE PACIENTE Y TOMA DE MUESTRA. Cuando llegue a su institución la caja del proyecto
Que es la fluorescencia?
 INMUNOFLUORESCENCIA Que es la fluorescencia?....es la propiedad de una sustancia de emitir luz cuando es expuesta a radiaciones de baja longitud de onda y alta energía a (UV Rx). Las radiaciones absorbidas
INMUNOFLUORESCENCIA Que es la fluorescencia?....es la propiedad de una sustancia de emitir luz cuando es expuesta a radiaciones de baja longitud de onda y alta energía a (UV Rx). Las radiaciones absorbidas
Determinación del Grupo Sanguíneo
 Determinación del Grupo Sanguíneo INTRODUCCIÓN Qué es el grupo sanguíneo? El grupo sanguíneo es una forma de clasificar la sangre de los humanos en función de la presencia o no de determinados glucolípidos
Determinación del Grupo Sanguíneo INTRODUCCIÓN Qué es el grupo sanguíneo? El grupo sanguíneo es una forma de clasificar la sangre de los humanos en función de la presencia o no de determinados glucolípidos
I Determinación de la velocidad de sedimentación eritrocitaria (VSE o VSG).
 I Determinación de la velocidad de sedimentación eritrocitaria (VSE o VSG). Técnica. 1 Extraiga sangre del tubo o frasco con una pipeta Pasteur. 2 Transfiérala a un tubo de Wintrobe y llénelo hasta la
I Determinación de la velocidad de sedimentación eritrocitaria (VSE o VSG). Técnica. 1 Extraiga sangre del tubo o frasco con una pipeta Pasteur. 2 Transfiérala a un tubo de Wintrobe y llénelo hasta la
Introducción. Descripción de la tarea
 ACTIVIDADES DE INVESTIGACIÓN Introducción El análisis de los componentes del medio interno es un método ideal para conocer qué ocurre en el interior de un animal. La variación en la concentración de sustancias
ACTIVIDADES DE INVESTIGACIÓN Introducción El análisis de los componentes del medio interno es un método ideal para conocer qué ocurre en el interior de un animal. La variación en la concentración de sustancias
Tema 3: Ecuaciones químicas y concentraciones
 Tema 3: Ecuaciones químicas y concentraciones Definición de disolución. Clases de disoluciones. Formas de expresar la concentración de una disolución. Proceso de dilución. Solubilidad. Diagramas de fases
Tema 3: Ecuaciones químicas y concentraciones Definición de disolución. Clases de disoluciones. Formas de expresar la concentración de una disolución. Proceso de dilución. Solubilidad. Diagramas de fases
SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación.
 PRÁCTICA Nº 2 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de una muestra problema. Realizar la destilación
PRÁCTICA Nº 2 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de una muestra problema. Realizar la destilación
INSTRUMENTOS DE MEDIDAS Y TEORÍA DEL ERROR
 INSTRUMENTOS DE MEDIDAS Y TEORÍA DEL ERROR Adaptación del Experimento Nº1 de la Guía de Ensayos y Teoría del Error del profesor Ricardo Nitsche, página 36-42. Autorizado por el Autor. Materiales: Cilindros
INSTRUMENTOS DE MEDIDAS Y TEORÍA DEL ERROR Adaptación del Experimento Nº1 de la Guía de Ensayos y Teoría del Error del profesor Ricardo Nitsche, página 36-42. Autorizado por el Autor. Materiales: Cilindros
Extracción de Sangre Venosa Periférica
 Extracción de Sangre Venosa Periférica Introducción La extracción venosa de sangre es un proceso muy acequiado en el análisis biológico dado que es posible detectar diversas enfermedades o condiciones
Extracción de Sangre Venosa Periférica Introducción La extracción venosa de sangre es un proceso muy acequiado en el análisis biológico dado que es posible detectar diversas enfermedades o condiciones
ρ 20º/20º = ρ a /ρ ref (I)
 Práctica N 1 Determinación de Densidad en los Alimentos Objetivos Determinar la densidad de diferentes muestras de alimentos utilizando el picnómetro. Determinar la densidad de diferentes muestras de alimentos
Práctica N 1 Determinación de Densidad en los Alimentos Objetivos Determinar la densidad de diferentes muestras de alimentos utilizando el picnómetro. Determinar la densidad de diferentes muestras de alimentos
SANGRE ENTERA: Hematología. Parásitos hemáticos
 SANGRE ENTERA: Hematología Parásitos hemáticos Extraer la sangre de la vena evitando la hemólisis y llenar el tubo hasta el límite aconsejado. Agitar el tubo con suavidad invirtiéndolo de 10 a 20 veces
SANGRE ENTERA: Hematología Parásitos hemáticos Extraer la sangre de la vena evitando la hemólisis y llenar el tubo hasta el límite aconsejado. Agitar el tubo con suavidad invirtiéndolo de 10 a 20 veces
Revisado en noviembre de 2009 (11/09)
 El dispositivo medicinal Eclipse es una manera fácil, segura y portátil de administrar los medicamentos por vía intravenosa (IV) en el hogar o cuando se encuentre fuera del hospital. Se puede utilizar
El dispositivo medicinal Eclipse es una manera fácil, segura y portátil de administrar los medicamentos por vía intravenosa (IV) en el hogar o cuando se encuentre fuera del hospital. Se puede utilizar
3) Modelo e identificación de las cámaras de recuento:
 Cámara de recuento: 1) Qué es una cámara de recuento y dónde se utiliza? La cámara de recuento es un apárato de precisión hecho de vidrio óptico especial. Se utiliza para contar células u otras partículas
Cámara de recuento: 1) Qué es una cámara de recuento y dónde se utiliza? La cámara de recuento es un apárato de precisión hecho de vidrio óptico especial. Se utiliza para contar células u otras partículas
PRACTICA DE LABORATORIO SEMANA 23. IDENTIFICACION DE UNA MUESTRA DESCONOCIDA No. 2 Elaborado por: Licda. Lilian Judith Guzmán Melgar
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO PRACTICA DE LABORATORIO SEMANA 23 IDENTIFICACION DE UNA MUESTRA DESCONOCIDA No. 2 Elaborado
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO PRACTICA DE LABORATORIO SEMANA 23 IDENTIFICACION DE UNA MUESTRA DESCONOCIDA No. 2 Elaborado
TRABAJO PRÁCTICO N 11 ROL DE LAS PROTEÍNAS EN EL ORGANISMO PROTEINOGRAMA ELECTROFORETICO
 TRABAJO PRÁCTICO N 11 ROL DE LAS PROTEÍNAS EN EL ORGANISMO PROTEINOGRAMA ELECTROFORETICO 1. OBJETIVOS Determinar en forma cualitativa las proteínas del plasma. Reconocer las proteínas de cada fracción
TRABAJO PRÁCTICO N 11 ROL DE LAS PROTEÍNAS EN EL ORGANISMO PROTEINOGRAMA ELECTROFORETICO 1. OBJETIVOS Determinar en forma cualitativa las proteínas del plasma. Reconocer las proteínas de cada fracción
GUÍA DE APRENDIZAJE. b) Cada cápsula blanda de Actron 6002 contiene: Ibuprofeno 600 mg. Excipientes: 1152 mg
 GUÍA DE APRENDIZAJE Prof: Víctor Manuel Reyes Feest N 4 Contenido: Razón, proporción y porcentaje. 1) Un medicamento está formado por 0,7 partes de excipientes, 0,2 partes de cierto antibiótico A y el
GUÍA DE APRENDIZAJE Prof: Víctor Manuel Reyes Feest N 4 Contenido: Razón, proporción y porcentaje. 1) Un medicamento está formado por 0,7 partes de excipientes, 0,2 partes de cierto antibiótico A y el
EL TEXTO EN COLOR ROJO HA SIDO MODIFICADO
 COMENTARIOS Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de agosto y hasta el 30
COMENTARIOS Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de agosto y hasta el 30
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas IDENTIFICACION CUALITATIVA DE COMPUESTOS ORGANICOS
 UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas IDENTIFICACION CUALITATIVA DE COMPUESTOS ORGANICOS Experimento No. 1 QUIM 2222 A. Introducción El químico
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas IDENTIFICACION CUALITATIVA DE COMPUESTOS ORGANICOS Experimento No. 1 QUIM 2222 A. Introducción El químico
CÁTEDRA DE QUÍMICA II BIOINGENIERÍA
 Departamento de Electrónica y Automática Facultad de Ingeniería CÁTEDRA DE QUÍMICA II BIOINGENIERÍA GUÍA DE TRABAJOS PRÁCTICOS DE LABORAORIO Nº 3 LIPIDOS Apellido y Nombre Registro SOLUBILIDAD DE LAS GRASAS
Departamento de Electrónica y Automática Facultad de Ingeniería CÁTEDRA DE QUÍMICA II BIOINGENIERÍA GUÍA DE TRABAJOS PRÁCTICOS DE LABORAORIO Nº 3 LIPIDOS Apellido y Nombre Registro SOLUBILIDAD DE LAS GRASAS
TITULACIÓN ACIDO BASE.
 1. INTRODUCCION El análisis volumétrico es una técnica basadas en mediciones de volumen para calcular la cantidad de una sustancia en solución, y consiste en una valoración (titulación), que es el proceso
1. INTRODUCCION El análisis volumétrico es una técnica basadas en mediciones de volumen para calcular la cantidad de una sustancia en solución, y consiste en una valoración (titulación), que es el proceso
EXTRACCIÓN DE ADN (1)
 EXTRACCIÓN DE ADN (1) UN EXPERIMENTO AMBIGUO EN EL LABORATORIO DE ENSEÑANZA Muchos estudios de Biología Molecular comienzan con la extracción de ácidos nucleicos. La lisis celular libera las moléculas
EXTRACCIÓN DE ADN (1) UN EXPERIMENTO AMBIGUO EN EL LABORATORIO DE ENSEÑANZA Muchos estudios de Biología Molecular comienzan con la extracción de ácidos nucleicos. La lisis celular libera las moléculas
TRABAJO PRÁCTICO Nº 7 MECANISMOS ENDÓCRINOS QUE REGULAN LA CONCENTRACIÓN DE GLUCOSA EN PLASMA: PRUEBA DE TOLERANCIA ORAL A LA GLUCOSA 1.
 TRABAJO PRÁCTICO Nº 7 MECANISMOS ENDÓCRINOS QUE REGULAN LA CONCENTRACIÓN DE GLUCOSA EN PLASMA: PRUEBA DE TOLERANCIA ORAL A LA GLUCOSA 1. OBJETIVOS A partir de los conocimientos teóricos: 1.a. OBJETIVOS
TRABAJO PRÁCTICO Nº 7 MECANISMOS ENDÓCRINOS QUE REGULAN LA CONCENTRACIÓN DE GLUCOSA EN PLASMA: PRUEBA DE TOLERANCIA ORAL A LA GLUCOSA 1. OBJETIVOS A partir de los conocimientos teóricos: 1.a. OBJETIVOS
PRACTICA No.7 DENSIDAD Y USO DEL TERMOMETRO
 PRACTICA No.7 DENSIDAD Y USO DEL TERMOMETRO INTRODUCCION. El conocimiento de las propiedades físicas puede ser una herramienta útil en la identificación de materiales desconocidos. Ciertas propiedades
PRACTICA No.7 DENSIDAD Y USO DEL TERMOMETRO INTRODUCCION. El conocimiento de las propiedades físicas puede ser una herramienta útil en la identificación de materiales desconocidos. Ciertas propiedades
Componentes de la sangre: Elementos celulares (glóbulos rojos, glóbulos blancos y plaquetas) Elemento líquido o plasma.
 Componentes de la sangre: Elementos celulares (glóbulos rojos, glóbulos blancos y plaquetas) Elemento líquido o plasma. Hematopoyesis: Proceso de formación de células sanguíneas (glóbulos rojos glóbulos
Componentes de la sangre: Elementos celulares (glóbulos rojos, glóbulos blancos y plaquetas) Elemento líquido o plasma. Hematopoyesis: Proceso de formación de células sanguíneas (glóbulos rojos glóbulos
Inmunohematología. Dra. Ana Cecilia Haro
 Inmunohematología 2016 Dra. Ana Cecilia Haro Sensibilización Aglutinación Ag + Ac Ag-Ac Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo de Ac Densidad antigénica Tiempo de incubación Fuerza
Inmunohematología 2016 Dra. Ana Cecilia Haro Sensibilización Aglutinación Ag + Ac Ag-Ac Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo de Ac Densidad antigénica Tiempo de incubación Fuerza
Fecha de realización:... Fecha de entrega:... Comisión:... Apellidos Nombres:...
 ASIGNATURA: FÍSICA I TRABAJO PRÁCTICO Nº 1: GRÁFICOS Y ESCALAS Fecha de realización:... Fecha de entrega:... Comisión:... Apellidos Nombres:... y......... 1. Objetivo del trabajo: Construcción de gráficos,
ASIGNATURA: FÍSICA I TRABAJO PRÁCTICO Nº 1: GRÁFICOS Y ESCALAS Fecha de realización:... Fecha de entrega:... Comisión:... Apellidos Nombres:... y......... 1. Objetivo del trabajo: Construcción de gráficos,
PRÁCTICA No. 5 Estados del flujo en un canal
 PRÁCTICA No. 5 Estados del flujo en un canal Laboratorio de Hidráulica I OBJETIVO: Observar la generación y el comportamiento de diversos estados del flujo en un canal. INTRODUCCIÓN Para poder comprender
PRÁCTICA No. 5 Estados del flujo en un canal Laboratorio de Hidráulica I OBJETIVO: Observar la generación y el comportamiento de diversos estados del flujo en un canal. INTRODUCCIÓN Para poder comprender
TRANSPORTE A TRAVÉS DE LA MEMBRANA PRÁCTICA UNIDAD TEMÁTICA 9
 TRANSPORTE A TRAVÉS DE LA MEMBRANA PRÁCTICA UNIDAD TEMÁTICA 9 PERMEABILIDAD DIFERENCIAL DE LA MEMBRANA I. INTRODUCCIÓN. Las membranas que rodean a las células y organelos, poseen permeabilidad diferencial,
TRANSPORTE A TRAVÉS DE LA MEMBRANA PRÁCTICA UNIDAD TEMÁTICA 9 PERMEABILIDAD DIFERENCIAL DE LA MEMBRANA I. INTRODUCCIÓN. Las membranas que rodean a las células y organelos, poseen permeabilidad diferencial,
Guía de Laboratorio 3. Asignatura: Química General Básica. Práctica 6: Estudio de las Soluciones
 Guía de Laboratorio 3 Asignatura: Química General Básica Práctica 6: Estudio de las Soluciones I. Objetivos 1. Valorar la importancia de las soluciones. 2. Interpretar los factores que afectan la solubilidad
Guía de Laboratorio 3 Asignatura: Química General Básica Práctica 6: Estudio de las Soluciones I. Objetivos 1. Valorar la importancia de las soluciones. 2. Interpretar los factores que afectan la solubilidad
Evitar hemorragias (coagulación sanguínea) Regulación de la temperatura corporal
 Transporte: Nutrientes Gases respiratorios (O 2 - CO 2 ) Desechos metabólicos Hormonas Anticuerpos Evitar hemorragias (coagulación sanguínea) Regulación de la temperatura corporal Corazón Arterias Sistema
Transporte: Nutrientes Gases respiratorios (O 2 - CO 2 ) Desechos metabólicos Hormonas Anticuerpos Evitar hemorragias (coagulación sanguínea) Regulación de la temperatura corporal Corazón Arterias Sistema
TEMA 13 MICROBIOLOGÍA CLÍNICA
 TEMA 13 MÉTODOS INMUNOLÓGICOS EN MICROBIOLOGÍA CLÍNICA Tema 13. Principios y métodos del diagnóstico inmunológico Métodos inmunológicos 1.Detección de antígenos Obtención de anticuerpos Marcado de las
TEMA 13 MÉTODOS INMUNOLÓGICOS EN MICROBIOLOGÍA CLÍNICA Tema 13. Principios y métodos del diagnóstico inmunológico Métodos inmunológicos 1.Detección de antígenos Obtención de anticuerpos Marcado de las
SOLUCIONES. Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva Santiago (Concepción)
 SOLUCIONES Dr. José Francisco Acuña Elgueta Docente de Química Facultad de Agronomía Universidad de Concepción Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva
SOLUCIONES Dr. José Francisco Acuña Elgueta Docente de Química Facultad de Agronomía Universidad de Concepción Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva
TOMA DE MUESTRA SANGUINEA
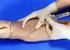 DEFINICIÓN: TOMA DE MUESTRA Procedimiento que permite acceder al torrente sanguíneo para extraer una pequeña muestra de sangre, que será utilizada en diversas pruebas. Dr. Eddie Alonzo RIII Medicina Interna
DEFINICIÓN: TOMA DE MUESTRA Procedimiento que permite acceder al torrente sanguíneo para extraer una pequeña muestra de sangre, que será utilizada en diversas pruebas. Dr. Eddie Alonzo RIII Medicina Interna
Mediciones y Tipos de Errores
 1. Objetivos Práctica N 2 Mediciones y Tipos de es 1. Seleccionar el instrumento más apropiado para reizar una medición considerando su precisión y exactitud. 2. Reizar transformaciones de unidades en
1. Objetivos Práctica N 2 Mediciones y Tipos de es 1. Seleccionar el instrumento más apropiado para reizar una medición considerando su precisión y exactitud. 2. Reizar transformaciones de unidades en
TRANSPORTE EN MEMBRANA CELULAR
 TRANSPORTE EN MEMBRANA CELULAR TRANSPORTE MICROMOLECULAR Dos Tipos Difusión pasiva Transporte activo DIFUSIÓN PASIVA La difusión simple se puede realizar directamente con la doble capa de fosfolípidos
TRANSPORTE EN MEMBRANA CELULAR TRANSPORTE MICROMOLECULAR Dos Tipos Difusión pasiva Transporte activo DIFUSIÓN PASIVA La difusión simple se puede realizar directamente con la doble capa de fosfolípidos
LABORATORIO N 2 PREPARACIÓN DE SOLUCIONES
 LABORATORIO N 2 PREPARACIÓN DE SOLUCIONES I.- INTRODUCCIÓN A) Soluciones La materia puede presentarse en forma de mezclas o sustancias puras. Cuando una mezcla tiene una composición uniforme, en cualquier
LABORATORIO N 2 PREPARACIÓN DE SOLUCIONES I.- INTRODUCCIÓN A) Soluciones La materia puede presentarse en forma de mezclas o sustancias puras. Cuando una mezcla tiene una composición uniforme, en cualquier
Nombre: Marga Alcover Cargo: Coordinadora de Enfermería Fecha: 29/01/07
 Determinación del Grupo AB0 Página 1 de 10 DISTRIBUCIÓN: DEPARTAMENTO Dirección Hematología Enfermería RESPONSABLE Jefe de la Unidad de Calidad Jefe de la Unidad de Hematología Coordinadora de Enfermería
Determinación del Grupo AB0 Página 1 de 10 DISTRIBUCIÓN: DEPARTAMENTO Dirección Hematología Enfermería RESPONSABLE Jefe de la Unidad de Calidad Jefe de la Unidad de Hematología Coordinadora de Enfermería
PROCEDIMIENTO PARA LA EXTRACCIÓN DE HEMOCULTIVOS EN EL SERVICIO DE URGENCIAS
 Página 1 de 5 PROCEDIMIENTO PARA LA EXTRACCIÓN DE HEMOCULTIVOS EN EL SERVICIO DE URGENCIAS Página 2 de 5 TOMA DE MUESTRA PARA HEMOCULTIVOS DESCRIPCIÓN Es la obtención de muestra de sangre para cultivo
Página 1 de 5 PROCEDIMIENTO PARA LA EXTRACCIÓN DE HEMOCULTIVOS EN EL SERVICIO DE URGENCIAS Página 2 de 5 TOMA DE MUESTRA PARA HEMOCULTIVOS DESCRIPCIÓN Es la obtención de muestra de sangre para cultivo
2ª PRÁCTICA DE MICROBIOLOGÍA:
 2ª PRÁCTICA DE MICROBIOLOGÍA: INTRODUCCIÓN A LA MICROBIOLOGÍA MOLECULAR Y AMBIENTAL INTRODUCCIÓN A. MICROBIOLOGÍA MOLECULAR El objetivo de esta práctica es poder distinguir entre distintos tipos de moléculas
2ª PRÁCTICA DE MICROBIOLOGÍA: INTRODUCCIÓN A LA MICROBIOLOGÍA MOLECULAR Y AMBIENTAL INTRODUCCIÓN A. MICROBIOLOGÍA MOLECULAR El objetivo de esta práctica es poder distinguir entre distintos tipos de moléculas
Fisiología de la Reproducción 1
 TRABAJO PRÁCTICO Nº 5 FISIOLOGÍA DE LA REPRODUCCIÓN APARATO REPRODUCTOR FEMENINO Y GESTACIÓN 1. OBJETIVOS A partir de los contenidos teóricos: 1.a. OBJETIVOS GENERALES Comprender la regulación del eje
TRABAJO PRÁCTICO Nº 5 FISIOLOGÍA DE LA REPRODUCCIÓN APARATO REPRODUCTOR FEMENINO Y GESTACIÓN 1. OBJETIVOS A partir de los contenidos teóricos: 1.a. OBJETIVOS GENERALES Comprender la regulación del eje
TECHNOLOGY. CROSSMATCH TEST canino. primer test inmunocromatografico para reaccion cruzada con antiglobulina canina especifica.
 CROSSMATCH TEST canino primer test inmunocromatografico para reaccion cruzada con antiglobulina canina especifica 20 minutos TECHNOLOGY - ahorra tiempo - facil manipulacion - resultados fiables - facil
CROSSMATCH TEST canino primer test inmunocromatografico para reaccion cruzada con antiglobulina canina especifica 20 minutos TECHNOLOGY - ahorra tiempo - facil manipulacion - resultados fiables - facil
El linfoma de Hodgkin en adultos es una enfermedad por la cual se forman células malignas (cancerosas) en el sistema linfático.
 Linfoma de Hodgkin El linfoma de Hodgkin en adultos es una enfermedad por la cual se forman células malignas (cancerosas) en el sistema linfático. El linfoma de Hodgkin en adultos es un tipo de cáncer
Linfoma de Hodgkin El linfoma de Hodgkin en adultos es una enfermedad por la cual se forman células malignas (cancerosas) en el sistema linfático. El linfoma de Hodgkin en adultos es un tipo de cáncer
MEDICIONES DE RESISTENCIA Y POTENCIA DC
 PRACTICA Nº 3 MEDICIONES DE RESISTENCIA Y POTENCIA DC Objetivos Analizar el funcionamiento del Puente de Wheatstone y efectuar mediciones de resistencias aplicando el método de detección de cero. Efectuar
PRACTICA Nº 3 MEDICIONES DE RESISTENCIA Y POTENCIA DC Objetivos Analizar el funcionamiento del Puente de Wheatstone y efectuar mediciones de resistencias aplicando el método de detección de cero. Efectuar
Manual de Laboratorio de Química Analítica
 PRÁCTICA 4: DETERMINACIÓN DE LA CONCENTRACIÓN DE ÁCIDO ACÉTICO EN UNA MUESTRA DE VINAGRE BLANCO INTRODUCCIÓN El vinagre blanco es una solución de ácido acético obtenida por fermentación. El análisis se
PRÁCTICA 4: DETERMINACIÓN DE LA CONCENTRACIÓN DE ÁCIDO ACÉTICO EN UNA MUESTRA DE VINAGRE BLANCO INTRODUCCIÓN El vinagre blanco es una solución de ácido acético obtenida por fermentación. El análisis se
PRACTICA Nº 2 CARACTERISTICAS DE LOS DIODOS, CIRCUITO RECTIFICADOR DE MEDIA ONDA. 1.-Explique como opera el osciloscopio en la modalidad X-Y.
 UNIVERSIDAD SIMON BOLIVAR DPTO. ELECTRONICA Y CIRCUITOS CIRCUITOS ELECTRONICOS I EC1177 PRACTICA Nº 2 CARACTERISTICAS DE LOS DIODOS, CIRCUITO RECTIFICADOR DE MEDIA ONDA OBJETIVO Familiarizar al estudiante
UNIVERSIDAD SIMON BOLIVAR DPTO. ELECTRONICA Y CIRCUITOS CIRCUITOS ELECTRONICOS I EC1177 PRACTICA Nº 2 CARACTERISTICAS DE LOS DIODOS, CIRCUITO RECTIFICADOR DE MEDIA ONDA OBJETIVO Familiarizar al estudiante
MATERIAL DE LABORATORIO
 MATERIAL DE LABORATORIO Vasos de precipitado. Pueden ser de dos formas: altos o bajos. Sin graduar o graduados y nos dan un volumen aproximado (los vasos al tener mucha anchura nunca dan volúmenes precisos).
MATERIAL DE LABORATORIO Vasos de precipitado. Pueden ser de dos formas: altos o bajos. Sin graduar o graduados y nos dan un volumen aproximado (los vasos al tener mucha anchura nunca dan volúmenes precisos).
INTRODUCCIÓN AL EXAMEN DEL FROTIS DE SANGRE PERIFÉRICA
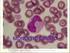 1 INTRODUCCIÓN AL EXAMEN DEL FROTIS DE SANGRE PERIFÉRICA 1 2 SECCIÓN UNO INTRODUCCIÓN Para la evaluación de la morfología celular es esencial realizar la preparación correcta del frotis de sangre. Hay
1 INTRODUCCIÓN AL EXAMEN DEL FROTIS DE SANGRE PERIFÉRICA 1 2 SECCIÓN UNO INTRODUCCIÓN Para la evaluación de la morfología celular es esencial realizar la preparación correcta del frotis de sangre. Hay
SEPARACIÓN DE ASPIRINA, ACETOFENITIDINA Y CAFEÍNA POR CROMATOGRAFÍA DE CAPA FINA
 Facultad de Farmacia Departamento de Química Física Universidad de Granada PRÁCTICA 3 SEPARACIÓN DE ASPIRINA, ACETOFENITIDINA Y CAFEÍNA POR CROMATOGRAFÍA DE CAPA FINA Introducción A menudo, la aspirina,
Facultad de Farmacia Departamento de Química Física Universidad de Granada PRÁCTICA 3 SEPARACIÓN DE ASPIRINA, ACETOFENITIDINA Y CAFEÍNA POR CROMATOGRAFÍA DE CAPA FINA Introducción A menudo, la aspirina,
La riqueza en peso nos dice que en 100 gramos de disolución hay 37 gramos de soluto, de modo que en 1180 gramos de disolución habrá:
 40.- Calcula la concentración en g/l de un ácido clorhídrico comercial de 37 % de riqueza en peso y densidad 1,18 g/ml. En primer lugar expresamos la densidad en g/l : 1180 g/l La riqueza en peso nos dice
40.- Calcula la concentración en g/l de un ácido clorhídrico comercial de 37 % de riqueza en peso y densidad 1,18 g/ml. En primer lugar expresamos la densidad en g/l : 1180 g/l La riqueza en peso nos dice
DETERMINACION DE BACTERIAS AEROBIAS TOTALES EN UNA MUESTRA DE AGUA
 DETERMINACION DE BACTERIAS AEROBIAS TOTALES EN UNA MUESTRA DE AGUA Por bacterias aerobias totales se entienden todas las bacterias aerobias y anaerobias facultativas, heterótrofas, mesófilas y criófilas
DETERMINACION DE BACTERIAS AEROBIAS TOTALES EN UNA MUESTRA DE AGUA Por bacterias aerobias totales se entienden todas las bacterias aerobias y anaerobias facultativas, heterótrofas, mesófilas y criófilas
Inmunohematología 2017
 Inmunohematología 2017 REACCIONES DE HEMAGLUTINACIÓN 1-Sensibilización 2-Aglutinación Ag + Ac Ag-Ac FACTORES QUE AFECTAN LA HEMAGLUTINACIÓN Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo
Inmunohematología 2017 REACCIONES DE HEMAGLUTINACIÓN 1-Sensibilización 2-Aglutinación Ag + Ac Ag-Ac FACTORES QUE AFECTAN LA HEMAGLUTINACIÓN Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo
I.- ACTIVIDADES REALIZADAS. Administrativas
 1 I.- ACTIVIDADES REALIZADAS Administrativas Durante el mes de Octubre (de 01 al 31 de Octubre) continué en el área de serología. Las actividades que realicé fue la recolección de tubos pertenecientes
1 I.- ACTIVIDADES REALIZADAS Administrativas Durante el mes de Octubre (de 01 al 31 de Octubre) continué en el área de serología. Las actividades que realicé fue la recolección de tubos pertenecientes
1/11/2010. Introducción. Corazón. Cavidades del corazón
 Introducción Desde la etapa embrionaria, el sistema circulatorio funciona como el sistema de transporte de materiales que deben ser distribuidos para el desarrollo de tejidos. El sistema de transporte
Introducción Desde la etapa embrionaria, el sistema circulatorio funciona como el sistema de transporte de materiales que deben ser distribuidos para el desarrollo de tejidos. El sistema de transporte
DETERMINACIÓN DE LA LEY EXPERIMENTAL DE RAPIDEZ. ESTUDIO DE LA CINÉTICA DE YODACIÓN DE LA ACETONA. Grupo: Equipo: Fecha: Nombre(s):
 DETERMINACIÓN DE LA LEY EXPERIMENTAL DE RAPIDEZ. ESTUDIO DE LA CINÉTICA DE YODACIÓN DE LA ACETONA. Grupo: Equipo: Fecha: Nombre(s): I. OBJETIVO GENERAL Comprender que la composición de un sistema reaccionante
DETERMINACIÓN DE LA LEY EXPERIMENTAL DE RAPIDEZ. ESTUDIO DE LA CINÉTICA DE YODACIÓN DE LA ACETONA. Grupo: Equipo: Fecha: Nombre(s): I. OBJETIVO GENERAL Comprender que la composición de un sistema reaccionante
9. MEDIDA DE LA DENSIDAD DE LÍQUIDOS
 9. MEDIDA DE LA DENSIDAD DE LÍQUIDOS OBJETIVO El objetivo de la practica es determinar la densidad de líquidos utilizando la balanza de Möhr y su aplicación a la determinación de la densidad de disoluciones
9. MEDIDA DE LA DENSIDAD DE LÍQUIDOS OBJETIVO El objetivo de la practica es determinar la densidad de líquidos utilizando la balanza de Möhr y su aplicación a la determinación de la densidad de disoluciones
PRÁCTICA 3 DETERMINACIÓN ESPECTROFOTOMÉTRICA DEL pk DE UN INDICADOR
 PRÁCTICA 3 DETERMINACIÓN ESPECTROFOTOMÉTRICA DEL pk DE UN INDICADOR Material Productos 2 matraces aforados de 250 ml Hidróxido de sodio en lentejas 2 matraces aforados de 25 ml Disolución de hidróxido
PRÁCTICA 3 DETERMINACIÓN ESPECTROFOTOMÉTRICA DEL pk DE UN INDICADOR Material Productos 2 matraces aforados de 250 ml Hidróxido de sodio en lentejas 2 matraces aforados de 25 ml Disolución de hidróxido
REACCIONES REVERSIBLES. ASPECTOS PRÁCTICOS DEL EQUILIBRIO QUÍMICO
 III 1 PRÁCTICA 3 REACCIONES REVERSIBLES. ASPECTOS PRÁCTICOS DEL EQUILIBRIO QUÍMICO En esta experiencia estudiaremos, cualitativamente, algunos aspectos prácticos del euilibrio uímico. Para ello: Experimentaremos
III 1 PRÁCTICA 3 REACCIONES REVERSIBLES. ASPECTOS PRÁCTICOS DEL EQUILIBRIO QUÍMICO En esta experiencia estudiaremos, cualitativamente, algunos aspectos prácticos del euilibrio uímico. Para ello: Experimentaremos
FICHA ESTÁNDAR DE FAMILIA DEL CATÁLOGO DE BIENES, SERVICIOS Y OBRAS DEL MEF FICHA ESTÁNDAR N 34 FAMILIA 51100006 PIPETAS Y MICROPIPETAS
 PERÚ Ministerio de Economía y Finanzas Oficina General de Tecnologías de la Información FICHA ESTÁNDAR DE FAMILIA DEL CATÁLOGO DE BIENES, SERVICIOS Y OBRAS DEL MEF FICHA ESTÁNDAR N 34 FAMILIA 51100006
PERÚ Ministerio de Economía y Finanzas Oficina General de Tecnologías de la Información FICHA ESTÁNDAR DE FAMILIA DEL CATÁLOGO DE BIENES, SERVICIOS Y OBRAS DEL MEF FICHA ESTÁNDAR N 34 FAMILIA 51100006
PARTE I TERMODINÁMICA QUÍMICA
 PARTE I TERMODINÁMICA QUÍMICA 01-Gonza lez.indd 1 5/6/06 19:26:43 01-Gonza lez.indd 2 5/6/06 19:26:49 Capítulo I Conceptos fundamentales Defi niciones 1,3,9 carácter macroscópico del sistema. Se determina
PARTE I TERMODINÁMICA QUÍMICA 01-Gonza lez.indd 1 5/6/06 19:26:43 01-Gonza lez.indd 2 5/6/06 19:26:49 Capítulo I Conceptos fundamentales Defi niciones 1,3,9 carácter macroscópico del sistema. Se determina
DIFERENCIA ENTRE FLUIDOS Y SÓLIDOS
 DIFERENCIA ENTRE FLUIDOS Y SÓLIDOS Se le llama fluido a toda aquella sustancia continua que puede fluir. Los fluidos pueden ser gaseosos y líquidos. Esta es la diferencia fundamental entre un sólido, cuya
DIFERENCIA ENTRE FLUIDOS Y SÓLIDOS Se le llama fluido a toda aquella sustancia continua que puede fluir. Los fluidos pueden ser gaseosos y líquidos. Esta es la diferencia fundamental entre un sólido, cuya
PARA EL PACIENTE RESERVORIO VENOSO SUBCUTÁNEO INSTITUTO DONOSTIA DE ONCO-HEMATOLOGÍA HOSPITAL DONOSTIA
 PARA EL PACIENTE VENOSO SUBCUTÁNEO INSTITUTO DONOSTIA DE ONCO-HEMATOLOGÍA HOSPITAL DONOSTIA VENOSO SUBCUTÁNEO ÍNDICE Edición: Unidad de Comunicación Hospital Donostia. Depósito Legal: SS-400-2011 Qué es
PARA EL PACIENTE VENOSO SUBCUTÁNEO INSTITUTO DONOSTIA DE ONCO-HEMATOLOGÍA HOSPITAL DONOSTIA VENOSO SUBCUTÁNEO ÍNDICE Edición: Unidad de Comunicación Hospital Donostia. Depósito Legal: SS-400-2011 Qué es
REPÚBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD NACIONAL EXPERIMENTAL POLITÉCNICA ANTONIO JOSÉ DE SUCRE DEPARTAMNETO DE INGENIERIA QUIMICA
 Practica Nº 7: Equilibrio Químico. Principio de Le Chatelier Las reacciones químicas son procesos reversibles, en consecuencia hay condiciones de concentración y temperatura bajo las cuales reaccionantes
Practica Nº 7: Equilibrio Químico. Principio de Le Chatelier Las reacciones químicas son procesos reversibles, en consecuencia hay condiciones de concentración y temperatura bajo las cuales reaccionantes
I-07- ADECUACION EN DIALISIS PERITONEAL. 1. Objeto: Evaluación de adecuación en diálisis peritoneal según últimas guías actualizadas SAN y SEN.
 1. Objeto: Evaluación de adecuación en diálisis peritoneal según últimas guías actualizadas SAN y SEN.. Alcance: Pacientes de diálisis peritoneal. 3. Responsables: Médicos, técnicos. 4. Definiciones: SAN:
1. Objeto: Evaluación de adecuación en diálisis peritoneal según últimas guías actualizadas SAN y SEN.. Alcance: Pacientes de diálisis peritoneal. 3. Responsables: Médicos, técnicos. 4. Definiciones: SAN:
FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUIMICA BIORGÁNICA
 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUIMICA BIORGÁNICA PRÁCTICA 6: PRUEBAS GENERALES PARA LÍPIDOS 1. INTRODUCCION Los lípidos son compuestos insolubles en el agua pero
FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUIMICA BIORGÁNICA PRÁCTICA 6: PRUEBAS GENERALES PARA LÍPIDOS 1. INTRODUCCION Los lípidos son compuestos insolubles en el agua pero
GUIA DE LABORATORIO PRACTICA 5 CELULAS ANIMALES PROGRAMA DE INGENIERIA PECUARIA BIOLOGÍA GENERAL
 GUIA DE LABORATORIO PRACTICA 5 CELULAS ANIMALES PROGRAMA DE INGENIERIA PECUARIA BIOLOGÍA GENERAL Leidy Diana Ardila Leal Docente. INTRODUCCIÓN Las células eucariotas pueden clasificarse de acuerdo a las
GUIA DE LABORATORIO PRACTICA 5 CELULAS ANIMALES PROGRAMA DE INGENIERIA PECUARIA BIOLOGÍA GENERAL Leidy Diana Ardila Leal Docente. INTRODUCCIÓN Las células eucariotas pueden clasificarse de acuerdo a las
MANUAL DE NORMAS Y PROCEDIMIENTOS PROCEDIMIENTO: OPERATIVOS DE ORINAS
 SERVICIO DE LABORATORIO 1 DE 5 1. OBJETIVO El objetivo del presente documento es describir el procedimiento para determinar las características físicas, química y microscópicas de muestras de orinas. 2.
SERVICIO DE LABORATORIO 1 DE 5 1. OBJETIVO El objetivo del presente documento es describir el procedimiento para determinar las características físicas, química y microscópicas de muestras de orinas. 2.
Código-Materia: 26067 LABORATORIO DE QUÍMICA Requisito:
 FACULTAD DE CIENCIAS NATURALES DEPARTAMENTO DE QUIMICA Código-Materia: 26067 LABORATORIO DE QUÍMICA Requisito: 08272: Algebra y Funciones Programa Semestre: Ingeniería industrial Período académico: 2016-2
FACULTAD DE CIENCIAS NATURALES DEPARTAMENTO DE QUIMICA Código-Materia: 26067 LABORATORIO DE QUÍMICA Requisito: 08272: Algebra y Funciones Programa Semestre: Ingeniería industrial Período académico: 2016-2
Composición del plasma: - agua (91-92 %). - sólidos (8-9 %): proteínas, sales, glucosa, urea, lípidos, colesterol, anticuerpos, enzimas, etc.
 Clase 5: Funciones y composición de la sangre Funciones En los mamíferos, la sangre cumple diversas funciones: - respiratoria: realiza el transporte de oxígeno desde los pulmones hasta los tejidos y lleva
Clase 5: Funciones y composición de la sangre Funciones En los mamíferos, la sangre cumple diversas funciones: - respiratoria: realiza el transporte de oxígeno desde los pulmones hasta los tejidos y lleva
Tema 13: La materia Ciencias Naturales 1º ESO página 1. Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
 Tema 13: La materia Ciencias Naturales 1º ESO página 1 TEMA 13: LA MATERIA, BASE DEL UNIVERSO 1. Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
Tema 13: La materia Ciencias Naturales 1º ESO página 1 TEMA 13: LA MATERIA, BASE DEL UNIVERSO 1. Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
