Los Gases y el Aire.
|
|
|
- María del Pilar Blanco Espinoza
- hace 7 años
- Vistas:
Transcripción
1 Los Gases y el Aire. Los Gases La materia puede presentarse en tres estados: sólido, líquido y gaseoso. En este último estado se encuentran las sustancias que denominamos comúnmente gases. El estado Gaseoso: Las variables para el estado gaseoso son: Presión (P): que se puede medir habitualmente en atmósferas (atm), milímetros de mercurio (mmhg), pascales (Pa), bares (bar), entre otros. Volumen (V): que se puede medir en litros (L), mililitro(ml), centímetros cúbicos (cc o cm 3 ). Temperatura (T): que se expresa en grados Celsius (ºC) o Fahrenheit (ºF), o en Kelvin (K). Cantidad de materia (n): que representa la cantidad de moles. Teoría cinética de los gases Las moléculas de una sustancia en estado gaseoso están en constante movimiento. En relación al tamaño de las moléculas, los espacios entre ellas son muy grandes. El movimiento de las moléculas producen choques con las paredes del recipiente y entre sí, originando la presión del gas. Se debe considerar también para el estudio de los gases el hecho de que las moléculas siempre se mueven en línea recta y que los choques son perfectamente elásticos, esto quiere decir que no hay perdida de energía interna en los choques. Un aumento de la temperatura, aumenta la energía cinética de las moléculas del gas, por tanto también aumenta la velocidad de estas. Cabe destacar que los gases adoptan la forma del recipiente que los contiene, por tal motivo diremos que el volumen de un gas es el volumen del recipiente que lo contiene. Esquema demostrativo del movimiento rectilíneo de las moléculas de un gas, contenidas en un volumen, con grandes espacios intermoleculares, lo que permite que sean fáciles de comprimir. Coordinación de Química. Página 1
2 Transformaciones Gaseosas y Leyes Físicas de los Gases Se denominan transformaciones gaseosas a cualquier variación del estado de un gas. Los gases pueden experimentar tres tipos de transformaciones: Transformación isotérmica, en que la temperatura se mantiene constante, variando el volumen y la presión Transformación isobárica, en que la presión es mantenida constante, variando la temperatura y el volumen. Transformación isocórica (o isométrica o isovolumétrica), en que es mantenido el volumen constante variando solo la temperatura y la presión. Las leyes físicas de los gases son experimentales y se refieren al comportamiento de una cierta masa gaseosa en una de las transformaciones ya mencionadas. Ley de Robert Boyle: relación Presión-Volumen a Temperatura constante Observó que la disminución del volumen del gas guardaba cierta relación con el aumento de la presión. Establece que a temperatura constante, el volumen de un gas es inversamente proporcional a la presión que soporta, es decir si doblaba la presión ejercida al gas, el volumen se reducía a la mitad, si lo triplicaba se reducía a la tercera parte y así sucesivamente. Esta relación encontrada la expresó matemáticamente: P V = K (valor constante) para T constante en el tiempo Donde K es una constante de proporcionalidad, esto quiere decir que el valor de la multiplicación entre Presión y Volumen siempre dará un valor fijo. Por lo tanto, para una condición inicial (1) y una condición final (2) de Presión y Volumen (a Temperatura constante) se cumple que: P 1 V 1 = P 2 V 2 Grafica representativa de la relación presión-volumen de la ley de Boyle. A menor presión mayor volumen y viceversa. Coordinación de Química. Página 2
3 1º Ley de Gay-Lussac: relación Volumen-Temperatura a Presión constante La primera ley de Gay-Lussac se conoce también como ley de Charles-Gay Lussac, ya que fue sugerida con anterioridad en una forma semejante por Jacques Charles. Esta ley permite encontrar una relación entre ambas magnitudes físicas en condiciones de presión constante e igual a la presión atmosférica, es decir, a presión constante, el volumen de un gas aumenta proporcionalmente al incremento de temperatura, siendo la constante de proporcionalidad la misma para todos los gases y se expresa matemáticamente mediante la ecuación: = K (valor constante), para P constante Donde K es una constante de proporcionalidad. Por lo tanto, para una condición inicial (1) y una condición final (2) de Volumen y Temperatura (a Presión constante) se cumple que: Grafica representativa de la relación volumen -temperatura. A mayor volumen mayor temperatura, y viceversa. = Las temperaturas siempre deben ser expresadas en Kelvin para esta ley, recordar: 0[ºC] = 273 [K] 2º Ley de Gay-Lussac: relación Presión-Temperatura a Volumen constante Experiencias similares realizadas manteniendo constante el volumen y estudiando la variación de la presión con la temperatura permitieron al químico francés establecer su segunda ley: a volumen constante, la presión de un gas aumenta proporcionalmente al incremento de temperatura, siendo la constante de proporcionalidad la misma para todos los gases. Este anuncio se expresa mediante una ecuación similar al de la primera ley, en la forma: = K (valor constante), para V constante Coordinación de Química. Página 3
4 Donde K es una constante de proporcionalidad. Por lo tanto, para una condición inicial (1) y una condición final (2) de Presión y Temperatura (a Volumen constante) se cumple que: = Esto se debe a que al aumentar la temperatura, las moléculas del gas aumentan su energía interna por lo que comienzan a moverse más rápidamente aumentando su choque contra las paredes del recipiente que lo contiene y así aumentando la presión, este efecto es inverso al disminuir la temperatura. Igualmente las temperaturas deben ser expresadas en Kelvin para esta ley. Esquema que representa la relación entre presión-temperatura a volumen fijo. En este caso se muestra un recipiente inmerso en hielo (baja temperatura) y otro en agua hirviendo (alta temperatura), con sus respectivas presiones. El recipiente a baja temperatura muestra una presión interna baja y el recipiente a alta temperatura muestra una presión más alta. Ley de Avogaro: relación Volumen-Cantidad a Temperatura y Presión constante Esto dice que el volumen de un gas es directamente proporcional a la cantidad de gas, si aumentamos la cantidad de gas aumentamos el volumen y viceversa. Recuerda que la cantidad de gas la medimos en moles. Esta ley se puede expresar matemáticamente de forma: = K (valor constante), para P y T constante Coordinación de Química. Página 4
5 Donde n es la cantidad de gas en moles y K es una constante de proporcionalidad. Por lo tanto, para una condición inicial (1) y una condición final (2) de Volumen y cantidad de gas (a Presión y Temperatura constante) se cumple que: = Estas leyes sobre el comportamiento de los gases, aunque son aplicables dentro de una buena aproximación a los gases existentes en la naturaleza, son tanto más imprecisas cuando mayor es la densidad, la presión o la temperatura del gas. Por ello los gases que cumplen con exactitud dichas leyes físicas se denomina gases perfectos o gases ideales. Ecuación de Gases ideales Un gas ideal es un gas hipotético cuyo comportamiento de presión, volumen y temperatura se puede describir completamente por la ecuación de gas ideal. Las moléculas de un gas ideal no se atraen o se repelen entre sí, su volumen es despreciable en comparación con el volumen del recipiente que lo contiene y están en continuo movimiento en dirección aleatoria, es decir, al azar, y con frecuencia chocan unas contra otras y con las paredes del recinto que las contiene. En la naturaleza no existe en rigor un gas ideal. Sin embargo, en la práctica a la presión atmosférica y a temperatura ambiente los gases se comportan como ideales. Es posible combinar las leyes de los gases en una sola ecuación sencilla siempre y cuando la temperatura se exprese en la escala absoluta o Kelvin. Obteniéndose la siguiente expresión: Donde n es el número de moles de la muestra gaseosa considerada y R es la llamada constante de los gases ideales igual a: [ ] Volumen molar de un gas Es el volumen ocupado por un mol de moléculas de un gas cualquiera en condiciones normales de temperatura y presión (CNTP), es decir: Temperatura = 0 [ C] ó 273 [K] Presión = 1 [atm] (atmósfera) ó 760 [mmhg] Se verifica experimentalmente que su valor es prácticamente el mismo para cualquier gas, por tanto el volumen de un mol de cualquier gas se considera igual a 22,4 litros. Coordinación de Química. Página 5
6 El Aire El aire es una mezcla de gases que constituye la atmósfera terrestre, que permanecen alrededor del planeta Tierra por acción de la fuerza de gravedad. Composición de la Atmosfera La Troposfera, alberga a casi todos los seres vivos y las actividades humanas, es la región donde los fenómenos meteorológicos corrientes ocurren, su espesor se calcula en unos 15 km. La Estratosfera cubre un espesor de 50 km aproximadamente, en esta es donde se encuentra la capa de ozono que protege a los seres vivos de la mortal radiación ultravioleta. La Mesosfera, cuya parte inferior es llamada Ionosfera, se constituye de aire altamente ionizado. La Ionosfera tiene gran influencia en las comunicaciones inalámbricas, pues es sus distintas capas ionizadas se reflejan las ondas electromagnéticas, dirigiéndose nuevamente hacia la Tierra y haciendo posible su propagación a distancias muy grandes. La parte superior de la mesosfera es la Termosfera. Se trata de una zona de alta temperatura debido a la absorción de los rayos ultravioletas. La Exosfera es la capa más externa, su espesor va de 700 a 1200 km por sobre la superficie terrestre. Capas de la atmosfera en sus distintas alturas Sabías qué a mayor altura en la atmosfera menor será la densidad de los gases y menor la temperatura, excepto en la Termosfera donde se acumula la temperatura alcanzando más de 1000 ⁰C? Composición del Aire El aire es el principal componente de atmosfera. En la siguiente tabla se muestran la cantidad de moléculas de cada sustancia por moléculas de aire, además de su correspondiente porcentaje: Coordinación de Química. Página 6
7 Elemento Cantidad Porcentaje [%] Nitrógeno (N 2 ) ,083 Oxígeno (O 2 ) ,944 Argón (Ar) 934 0,934 Dióxido de Carbono (CO 2 ) 36 0,036 También existen fracciones de: Neón, Helio, Metano, Kriptón, Hidrógeno, Xenón, Ozono, dióxido de azufre (SO 2 ), dióxido de nitrógeno (NO 2 ), amoniaco (NH 3 ), monóxido de carbono (CO) y yodo (I 2 ). Contaminantes atmosféricos y su composición: En la atmósfera existen diversos contaminantes, los cuales afectan de distintas formas al medio ambiente, entre estos tenemos: SMOG: El smog es una forma de contaminación que se origina a partir de la combinación del aire con diversos contaminantes. Existen dos tipos de esmog. El SMOG industrial: El aire contaminado asociado a las actividades industriales se conoce como smog industrial, y se caracteriza por la presencia de humo, niebla, dióxido de azufre y material en partículas como cenizas y hollín. La mayor parte del smog industrial se debe a la combustión de hulla o carbón, sobre todo el que tiene alto contenido de azufre. CARBÓN + FUEGO SMOG INDUSTRIAL El SMOG fotoquímico: Se forma por la combinación de óxidos de nitrógeno y compuestos orgánicos volátiles procedentes del escape de los vehículos los que reaccionan, catalizados por la radiación solar, para formar ozono y NOx. Este provoca un Coordinación de Química. Página 7
8 oscurecimiento de la atmósfera, tiñendo sus capas bajas de un color pardo rojizo y cargándola de componentes dañinos para todos los seres vivos. Óxidos de azufre: El azufre de la hulla y de diversos procesos industriales se quema, y forma dióxido de azufre, según la siguiente reacción. S + O 2 SO 2 Parte del dióxido de azufre reacciona con el oxígeno del aire para formar trióxido de azufre. 2 S0 2 + O 2 2 SO 3 Luego, el trióxido de azufre reacciona con agua para formar ácido sulfúrico Óxidos de nitrógeno: S0 3 + H 2 O H 2 SO 4 Además del dióxido de carbono, el monóxido de carbono y los hidrocarburos no quemados, en los automóviles se produce óxido de nitrógeno. Esto se debe a que dentro de los motores existen grandes presiones y temperaturas haciendo que el nitrógeno y el oxígeno del aire reaccionen de la siguiente forma. N 2(g) + O 2(g) 2 NO (g) El oxígeno de la atmósfera oxida el monóxido de nitrógeno a dióxido de nitrógeno (NO 2 ) 2 NO (g) + O 2(g) 2 NO 2(g) Luego, el dióxido de nitrógeno reacciona con agua para formar ácido nítrico: 3NO 2 + H 2 O NO + 2HNO 3 (ácido nítrico) El dióxido de nitrógeno es un gas de color ámbar, éste absorbe un fotón de la luz solar y se descompone en monóxido de nitrógeno y átomos de oxígeno reactivos. NO 2(g) + luz solar NO (g) + O (g) Coordinación de Química. Página 8
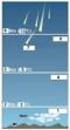
9 Los átomos de oxígeno reaccionan con otros componentes del escape de los automóviles y con la atmosfera para producir diversas sustancias irritantes y tóxicas, como la formación de ozono. Ozono: Es un componente natural de la estratosfera, donde protege la Tierra de la radiación ultravioleta, que es extremadamente peligrosa para la vida. Si este se encuentra en la troposfera es un contaminante que al ser inhalado, es una sustancia muy tóxica y peligrosa. Clorofluorocarbonos (C.F.C): Estos compuestos se han utilizado como gases dispersores en latas de aerosoles y como refrigerantes. A temperatura ambiente, los CFC son gases o líquidos con bajo punto de ebullición. Son químicamente inertes por lo tanto persisten durante mucho tiempo en el entorno sin reaccionar. Los CFC se difunden en la estratosfera, donde la radiación ultravioleta los descompone. Los átomos de cloro que se forman en este proceso rompen las moléculas de ozono que protegen a la Tierra de la dañina radiación ultravioleta. Consecuencias de la contaminación atmosférica. Producto de la contaminación atmosférica se generan varios problemas medioambientales, entre estos tenemos: La inversión térmica: Normalmente la temperatura de la atmosfera disminuye con la altura, el aire está más caliente cerca del suelo. En las noches despejadas el suelo se enfría más rápidamente, pero el viento por lo general mezcla el aire frío cerca del suelo con aire más caliente que está arriba. De vez en cuando, el aire se queda quieto y la capa inferior de aire frío queda atrapada por la capa de aire caliente que está arriba. Esta condición se conoce como inversión atmosférica o inversión térmica. Los contaminantes que hay en el aire frío también quedan atrapados cerca del suelo, y el aire puede acumular una Coordinación de Química. Página 9
10 concentración peligrosa de contaminantes si el viento tarda varios días en volver a soplar. Esquema característico de inversión térmica en donde los gases contaminantes se acumulan a baja altura. Lluvia ácida: La lluvia ácida se define como lluvia que tiene un ph menor a 5,6. Es capaz de caer en forma de lluvia o nieve, o se depositan como niebla ácida. Las dos principales fuentes de lluvia ácida son el dióxido de azufre (S0 2 ) y el monóxido de nitrógeno (NO). Estos óxidos reaccionan con vapor de agua presente en el aire para formar H 2 SO 4 y HNO 3, respectivamente. Estos ácidos fuertes posteriormente se diluyen en el agua de las nubes formando la lluvia ácida. Debido al efecto de los vientos estos ácidos se transportan a cientos de kilómetros de sus fuentes, provocando que el daño no se dé sólo en ciudades contaminadas. Los ácidos corroen los metales y pueden llegar a carcomer los edificios y estatuas de piedra. El efecto invernadero: Dióxido de carbono y calentamiento global. Por más limpio que sea un motor de combustión o una fábrica, en tanto queme carbón o productos de petróleo, producirá dióxido de carbono (CO 2 ). La concentración de éste en la atmosfera ha aumentado cerca de un 20% en este siglo, y lo sigue haciendo pues, las principales fuentes de energía son en base al carbono. En general ni siquiera se considera al dióxido de carbono como un contaminante ya que, es un componente natural del entorno, sin embargo su elevada concentración es la principal causa del calentamiento general de la superficie terrestre. Coordinación de Química. Página 10
11 En el efecto invernadero la luz solar (luz visible) que atraviesa la atmosfera se absorbe y calienta la superficie de la Tierra. La superficie caliente emite radiación infrarroja. Parte de esta radiación es absorbida por gases como CO 2, vapor de agua, metano (CH 4 ), entre otros y se retienen en la atmosfera para mantener una temperatura global. Pero si estos gases aumentan su concentración en la atmosfera mayor parte de la radiación emitida por la Tierra no podrá ser devuelta al espacio, por lo que la temperatura de la Tierra aumenta considerablemente, este fenómeno se conoce como calentamiento global. Esquema del efecto invernadero natural de la Tierra Ejercicios 1. Cuando aumenta el volumen de una muestra de gas a temperatura constante, entonces aumenta: I) La presión. II) El tamaño de las moléculas. III) La separación entre las moléculas. Es (son) correcta(s) A) sólo I. B) sólo II. C) sólo III. D) sólo II y III. E) I, II y III. 2. En un laboratorio hay 5 globos. Cada uno de ellos contiene un gas diferente, según el siguiente esquema: Globo nº Gas H 2 He O 2 N 2 CH 4 Coordinación de Química. Página 11
12 Cada globo tiene la misma masa de gas a la misma presión y temperatura. Luego, el globo de mayor volumen es el que contiene: A) H 2 B) He C) O 2 D) N 2 E) CH 4 3. Se tiene una muestra de 22 [L] de hidrógeno gaseoso a la presión de 2,0 [atm]. Qué volumen ocupará dicha muestra, si la presión sobre ella disminuye a la mitad y la temperatura se mantiene constante? A) 11 [L]. B) 22 [L] C) 44 [L] D) 66 [L] E) 88 [L] 4. Cuál de los siguientes compuestos químicos contribuye principalmente a la formación de la lluvia ácida? A) CO 2 B) O 3 C) SO 2 D) CO E) CH 4 5. EL Volumen de un gas: I) Aumenta con el aumento de la temperatura, a presión constante. II) Disminuye con el aumento de la presión, a temperatura constante. III) Permanece siempre constante cuando, simultáneamente, aumentan la presión y la temperatura. Es (son) correcta(s) A) sólo I. B) sólo II. C) sólo III. D) sólo I y II. E) sólo I y III. 6. Una muestra de CO tiene una presión de 2,0 [atm] y un volumen de 0,20 [L]. Cuando el CO se expande, a temperatura constante, hasta un volumen de 1,0 L, la presión del gas es: A) 0,2 [atm] Coordinación de Química. Página 12
13 B) 0,4 [atm] C) 0,5 [atm] D) 1,0 [atm] E) 2,0 [atm] 7. Cuántos moles de N 2 hay en 44,8 [L] de este gas medidos a 0 [ C] y 1 [atm] de presión? A) 0,5 [mol] B) 1,0 [mol] C) 1,5 [mol] D) 2,0 [mol] E) 4,0 [mol] 8. El smog fotoquímico es aquel que A) Posee alta cantidad de partículas sólidas. B) Presenta escasa cantidad de óxidos de carbono. C) Posee alta cantidad de óxidos de nitrógeno. D) Se produce en zonas costeras. E) Tiene escasa concentración de polvo cósmico. 9. Los gases se caracterizan por qué: I) Tienden a ocupar todo el espacio disponible. II) Se pueden comprimir. III) Sus moléculas están en constante movimiento. Es (son) correcta(s) A) Sólo I. B) Sólo II. C) Sólo III. D) Sólo I y II. E) I, II y III. 10. Las lluvias ácidas son dañinas porque: I) Contribuyen al efecto invernadero. II) Alteran la composición de los suelos agrícolas. III) Corroen monumentos y edificios. Es (son) correcta(s) A) Sólo I. B) Sólo II. C) Sólo III. Coordinación de Química. Página 13
14 D) Sólo II y III. E) I y III 11. Inmediatamente inferior a la Estratosfera (a menor altura), se encuentra la: A) Ionosfera B) Exosfera C) Termosfera D) Troposfera E) Mesosfera 12. Respecto de un gas ideal, cuál de las siguientes afirmaciones es incorrecta? A) Las moléculas del gas están en movimiento al azar. B) Su volumen decrece en la medida que disminuye la presión a temperatura constante. C) La energía cinética de las moléculas aumenta con la temperatura. D) El gas siempre se expande por calentamiento. E) A volumen constante, la presión de un gas es directamente proporcional a la temperatura absoluta. 13. Si en una jeringa, que contiene sólo aire y cuya salida está cerrada, se ejerce presión sobre el embolo (ver figura). Entonces, se puede inferir que el aire encerrado en la jeringa I) Se comprime II) Disminuye su volumen III) Aumenta la presión Es (son) correcta(s) A) Sólo I. B) Sólo II. C) Sólo III. D) Sólo I y II. E) I, II y III. 14. A 273 Kelvin y 760 mmhg de presión, el volumen (en litros) ocupado por 6, moléculas de CH 4 gaseoso es: A) 1,00 Coordinación de Química. Página 14
15 B) 10,0 C) 11,2 D) 22,4 E) 33,6 15. En algunas ciudades se produce el fenómeno de inversión térmica. Cuando la capa de inversión térmica se sitúa a baja altura, los contaminantes atmosféricos producidos por los vehículos y/o chimeneas: A) Se diluyen B) Se concentran C) Se elevan D) Precipitan E) Desaparecen 16. En una transformación isocórica, la temperatura y la presión de un gas: A) son inversamente proporcionales B) son directamente proporcionales C) tienen el mismo valor siempre D) presentan valores siempre despreciables E) no se relacionan ni equivalen 17. Cuál de los siguientes gases debería ocupar menor volumen si se encuentran en igualdad de condiciones de temperatura y presión?. Asuma la misma masa para todos: A) O 3 B) CO C) SO 2 D) NH 3 E) C 2 H La principal función del ozono (O 3 ) en la estratósfera es: A) Disminuir la temperatura de los rayos solares a niveles tolerables. B) Regenerar el oxígeno atmosférico. C) Disminuir el efecto invernadero. D) Disminuir la inversión térmica. E) Absorber la luz ultravioleta de la radiación. Coordinación de Química. Página 15
El aire en la Tierra. Capitulo 6
 El aire en la Tierra Capitulo 6 Qué es la atmosfera? 1. Es una mezcla de gases (aire) que rodea la Tierra. 2. Esta compuesta por los siguientes gases: Nitrógeno (78%), Oxigeno (21%) y Argón, bióxido de
El aire en la Tierra Capitulo 6 Qué es la atmosfera? 1. Es una mezcla de gases (aire) que rodea la Tierra. 2. Esta compuesta por los siguientes gases: Nitrógeno (78%), Oxigeno (21%) y Argón, bióxido de
EL ESTADO GASEOSO P R E S I Ó N
 EL ESTADO GASEOSO El aire está compuesto, principalmente, de los elementos oxígeno y nitrógeno. Otros elementos no metálicos existen en la naturaleza como gases en condiciones ordinarias como hidrógeno
EL ESTADO GASEOSO El aire está compuesto, principalmente, de los elementos oxígeno y nitrógeno. Otros elementos no metálicos existen en la naturaleza como gases en condiciones ordinarias como hidrógeno
LA ATMÓSFERA. Biología y Geología
 LA ATMÓSFERA Biología y Geología LA ATMÓSFERA La atmósfera es la capa gaseosa que rodea la Tierra. La atmósfera, además de gases, contiene partículas sólidas en suspensión. La partículas que presenta la
LA ATMÓSFERA Biología y Geología LA ATMÓSFERA La atmósfera es la capa gaseosa que rodea la Tierra. La atmósfera, además de gases, contiene partículas sólidas en suspensión. La partículas que presenta la
Tema 12. Gases. Química General e Inorgánica A ESTADOS DE AGREGACION DE LA MATERIA
 Tema 12 Gases Química General e Inorgánica A ESTADOS DE AGREGACION DE LA MATERIA 2.1 2.1 Variables que determinan el estado de agregación Tipo de material o materia Temperatura Presión 2.2 Elementos que
Tema 12 Gases Química General e Inorgánica A ESTADOS DE AGREGACION DE LA MATERIA 2.1 2.1 Variables que determinan el estado de agregación Tipo de material o materia Temperatura Presión 2.2 Elementos que
P V = n R T LEYES DE LOS GASES
 P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
Qué es la atmósfera? Qué características destacarías?
 Qué es la atmósfera? Qué características destacarías? La atmósfera es la capa de gas que rodea a un cuerpo celeste. Los gases son atraídos por la gravedad del cuerpo, y se mantienen en ella si la gravedad
Qué es la atmósfera? Qué características destacarías? La atmósfera es la capa de gas que rodea a un cuerpo celeste. Los gases son atraídos por la gravedad del cuerpo, y se mantienen en ella si la gravedad
Comportamiento de la radiación solar a su paso por la atmósfera terrestre
 ATMÓSFERA Comportamiento de la radiación solar a su paso por la atmósfera terrestre Estructura de la atmósfera atendiendo a su temperatura Estructura de la atmósfera ESTRUCTURA DE LA ATMÓSFERA Capas de
ATMÓSFERA Comportamiento de la radiación solar a su paso por la atmósfera terrestre Estructura de la atmósfera atendiendo a su temperatura Estructura de la atmósfera ESTRUCTURA DE LA ATMÓSFERA Capas de
II. ESTADOS DE AGREGACIÓN. TEORÍA CINÉTICO-MOLECULAR
 II. ESTADOS DE AGREGACIÓN. TEORÍA CINÉTICO-MOLECULAR 1 Índice 1. Los estados de agregación de la materia 2. Los gases y la teoría cinética 3. Las leyes de los gases 4. La teoría cinético-molecular 2 1
II. ESTADOS DE AGREGACIÓN. TEORÍA CINÉTICO-MOLECULAR 1 Índice 1. Los estados de agregación de la materia 2. Los gases y la teoría cinética 3. Las leyes de los gases 4. La teoría cinético-molecular 2 1
UNIDAD 2: ESTADO GASEOSO
 UNIDAD 2: ESTADO GASEOSO 1 CARACTERISTICAS DE LOS GASES Los gases poseen masa y ocupan un determinado volumen en el espacio, este volumen queda determinado por el volumen del recipiente que los contiene.
UNIDAD 2: ESTADO GASEOSO 1 CARACTERISTICAS DE LOS GASES Los gases poseen masa y ocupan un determinado volumen en el espacio, este volumen queda determinado por el volumen del recipiente que los contiene.
La Atmosfera Terrestre: Estructura y Composición Climatología y Fenología Agrícola. Ing. Agronómica. Universidad Nacional de Chilecito
 La Atmosfera Terrestre: Estructura y Composición Climatología y Fenología Agrícola. Ing. Agronómica. Universidad Nacional de Chilecito Biosfera hidrosfera atmósfera litosfera La Tierra está rodeada por
La Atmosfera Terrestre: Estructura y Composición Climatología y Fenología Agrícola. Ing. Agronómica. Universidad Nacional de Chilecito Biosfera hidrosfera atmósfera litosfera La Tierra está rodeada por
Curso Física de la Atmósfera
 Curso Física de la Atmósfera Lección Nro. 1 Unidad Nro. 1 Composición de la Atmosfera La atmósfera (del griego atmos= vapor y sphaira=esfera) es la envoltura gaseosa de nuestro planeta. La materia constitutiva
Curso Física de la Atmósfera Lección Nro. 1 Unidad Nro. 1 Composición de la Atmosfera La atmósfera (del griego atmos= vapor y sphaira=esfera) es la envoltura gaseosa de nuestro planeta. La materia constitutiva
Leyes de los Gases. Prof. Sergio Casas-Cordero E.
 Leyes de los Gases Prof. Sergio Casas-Cordero E. Sustancias gaseosas a 25 ºC y 1 atm Elemento H 2 (Hidrógeno) O 2 (Oxígeno) O 3 (Ozono) F 2 (Fluor) Cl 2 (Cloro) N 2 (Nitrógeno) He (Helio) Ne (neón) Ar
Leyes de los Gases Prof. Sergio Casas-Cordero E. Sustancias gaseosas a 25 ºC y 1 atm Elemento H 2 (Hidrógeno) O 2 (Oxígeno) O 3 (Ozono) F 2 (Fluor) Cl 2 (Cloro) N 2 (Nitrógeno) He (Helio) Ne (neón) Ar
LEYES DE LOS GASES. Leyes de los gases. Leyes de los gases
 LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
Verónica Martín Gómez Climatología 2017
 Verónica Martín Gómez Climatología 2017 TEMA 2: La atmósfera terrestre Objetivo Describir las principales características de la atmósfera terrestre en cuanto a su composición, masa y estructura vertical.
Verónica Martín Gómez Climatología 2017 TEMA 2: La atmósfera terrestre Objetivo Describir las principales características de la atmósfera terrestre en cuanto a su composición, masa y estructura vertical.
Contaminacion del aire Combustion CO2 -Aerosoles O3
 Contaminacion del aire Combustion CO2 -Aerosoles O3 Troposfera. Es la capa más cercana a la Tierra y por 1tanto la más importante. En ella se desarrolla la vida y se producen los fenómenos meteorológicos
Contaminacion del aire Combustion CO2 -Aerosoles O3 Troposfera. Es la capa más cercana a la Tierra y por 1tanto la más importante. En ella se desarrolla la vida y se producen los fenómenos meteorológicos
CIENCIAS: QUÍMICA PLAN GENERAL
 Composición del aire MODULO : EL AIRE El aire es una mezcla de gases, en donde el 78,% corresponden a nitrógeno y aproximadamente un % lo constituye el oxígeno. Otros gases presentes en menores cantidades
Composición del aire MODULO : EL AIRE El aire es una mezcla de gases, en donde el 78,% corresponden a nitrógeno y aproximadamente un % lo constituye el oxígeno. Otros gases presentes en menores cantidades
Los siguientes son elementos que pueden existir como gases a una temperatura de 25 C y 1 atm de presión
 Gases Los siguientes son elementos que pueden existir como gases a una temperatura de 25 C y 1 atm de presión Sustancias que existen como gases a una temperatura de 25 C y 1 atm de presión Características
Gases Los siguientes son elementos que pueden existir como gases a una temperatura de 25 C y 1 atm de presión Sustancias que existen como gases a una temperatura de 25 C y 1 atm de presión Características
EL ESTADO GASEOSO. Los gases son fluidos y están compuestos de partículas en movimientos constante y al azar.
 GASES EL ESTADO GASEOSO Los gases son fluidos y están compuestos de partículas en movimientos constante y al azar. Los gases se expanden hasta llenar el recipiente que los contiene y también, se pueden
GASES EL ESTADO GASEOSO Los gases son fluidos y están compuestos de partículas en movimientos constante y al azar. Los gases se expanden hasta llenar el recipiente que los contiene y también, se pueden
Licenciaturas: Geografía y Ciencias de la Atmósfera TEMA2: LA ATMÓSFERA TERRESTRE
 TEMA: LA ATMÓSFERA TERRESTRE Objetivo: describir las principales características de la atmósfera terrestre en cuanto a su composición, masa y estructura vertical. Contenido (Capítulo 1 del Arhens): 1.
TEMA: LA ATMÓSFERA TERRESTRE Objetivo: describir las principales características de la atmósfera terrestre en cuanto a su composición, masa y estructura vertical. Contenido (Capítulo 1 del Arhens): 1.
ESTADO GASEOSO LEYES PARA GASES IDEALES
 ESTADO GASEOSO LEYES PARA GASES IDEALES Estados de agregación COMPORTAMIENTO DE LOS GASES No tienen forma definida ni volumen propio Sus moléculas se mueven libremente y al azar ocupando todo el volumen
ESTADO GASEOSO LEYES PARA GASES IDEALES Estados de agregación COMPORTAMIENTO DE LOS GASES No tienen forma definida ni volumen propio Sus moléculas se mueven libremente y al azar ocupando todo el volumen
Algunas sustancias gaseosas a T y P ambiente
 LOS GASES Algunas sustancias gaseosas a T y P ambiente Fórmula Nombre Características O2 Oxígeno Incoloro,inodoro e insípido H 2 Hidrógeno Inflamable, más ligero que el aire. He Helio Incoloro, inerte,
LOS GASES Algunas sustancias gaseosas a T y P ambiente Fórmula Nombre Características O2 Oxígeno Incoloro,inodoro e insípido H 2 Hidrógeno Inflamable, más ligero que el aire. He Helio Incoloro, inerte,
También existen en pequeñas proporciones gases como neón, kriptón, helio, xenón, hidrógeno, metano, etc.
 El aire es una mezcla de gases que constituye la atmósfera. CARACTERÍSTICAS - No presenta color ni olor. - Posee peso, aproximadamente: 1,3g por litro, está relacionado a la gravedad terrestre. - Por acción
El aire es una mezcla de gases que constituye la atmósfera. CARACTERÍSTICAS - No presenta color ni olor. - Posee peso, aproximadamente: 1,3g por litro, está relacionado a la gravedad terrestre. - Por acción
ESTÁNDARES DE APRENDIZAJE
 Unidad Atmósfera ESTÁNDARES DE APRENDIZAJE Describe la estructura y composición de la atmósfera Reconoce la composición del aire e identifica los contaminantes principales relacionándolos con su origen
Unidad Atmósfera ESTÁNDARES DE APRENDIZAJE Describe la estructura y composición de la atmósfera Reconoce la composición del aire e identifica los contaminantes principales relacionándolos con su origen
REFUERZO SIMCE 2013 N 4
 REFUERZO SIMCE 2013 N 4 Este refuerzo entra en las pruebas parciales y globales. Se aplicara el reglamento de evaluación en caso de no entrega en la fecha oportuna. Selección Múltiple: Encierre en un círculo
REFUERZO SIMCE 2013 N 4 Este refuerzo entra en las pruebas parciales y globales. Se aplicara el reglamento de evaluación en caso de no entrega en la fecha oportuna. Selección Múltiple: Encierre en un círculo
LAS CAPAS FLUIDAS DE LA TIERRA
 LAS CAPAS FLUIDAS DE LA TIERRA LA ATMÓSFERA La atmósfera es la capa gaseosa que rodea la Tierra. Es fundamental para la vida porque contiene los gases que respiramos y porque nos protege de algunas radiaciones
LAS CAPAS FLUIDAS DE LA TIERRA LA ATMÓSFERA La atmósfera es la capa gaseosa que rodea la Tierra. Es fundamental para la vida porque contiene los gases que respiramos y porque nos protege de algunas radiaciones
El aire en la atmósfera está formado por unos veinte gases cuyas proporciones se mantienen constantes hasta una altura aproximada de 2,5 km.
 Atmósfera La atmósfera es la capa gaseosa que rodea la tierra. Es una mezcla de gases y partículas fundamental para la vida, ya que permite la respiración de los seres vivos y los aísla de las extremas
Atmósfera La atmósfera es la capa gaseosa que rodea la tierra. Es una mezcla de gases y partículas fundamental para la vida, ya que permite la respiración de los seres vivos y los aísla de las extremas
La atmósfera terrestre
 La atmósfera terrestre Matilde Ungerovich March 14, 2017 La atmósfera terrestre We may be able to survive without food for a few weeks, or without water for a few days, but, without our atmosphere, we
La atmósfera terrestre Matilde Ungerovich March 14, 2017 La atmósfera terrestre We may be able to survive without food for a few weeks, or without water for a few days, but, without our atmosphere, we
TEMA 2 EL ESTADO DE LA MATERIA
 TEMA 2 EL ESTADO DE LA MATERIA 1- ESTADOS DE AGREGACIÓN 2- LEYES DE LOS GASES 2.1- LEY DE BOYLE 2.2- LEY DE AOGADRO 2.3- LEY DE CHARLES Y GAY-LUSSAC 2.4- LEY COMBINADA DE LOS GASES 2.- LA ECUACIÓN DE ESTADO
TEMA 2 EL ESTADO DE LA MATERIA 1- ESTADOS DE AGREGACIÓN 2- LEYES DE LOS GASES 2.1- LEY DE BOYLE 2.2- LEY DE AOGADRO 2.3- LEY DE CHARLES Y GAY-LUSSAC 2.4- LEY COMBINADA DE LOS GASES 2.- LA ECUACIÓN DE ESTADO
1. Una cierta cantidad de gas ocupa 500 ml a 1.5 atm y 20 C Qué volumen ocupará a 720 mmhg y 80 C?
 Tema: GASES 1. Una cierta cantidad de gas ocupa 500 ml a 1.5 atm y 20 C Qué volumen ocupará a 720 mmhg y 80 C? 2. A cuántas atmosferas deben someterse 40 L de H 2 que están a 40 C y 0.5 atm para que el
Tema: GASES 1. Una cierta cantidad de gas ocupa 500 ml a 1.5 atm y 20 C Qué volumen ocupará a 720 mmhg y 80 C? 2. A cuántas atmosferas deben someterse 40 L de H 2 que están a 40 C y 0.5 atm para que el
Gases...1. Características: Volumen:...1. Temperatura:
 Índice de contenido Gases......1 Características:......1 Volumen:......1 Temperatura:......1 Presión:......2 Medición de presiones:......2 Ley de Boyle (relación presión volumen):......2 Ley de Charles
Índice de contenido Gases......1 Características:......1 Volumen:......1 Temperatura:......1 Presión:......2 Medición de presiones:......2 Ley de Boyle (relación presión volumen):......2 Ley de Charles
Unidad I Transformaciones de la materia. Tema 1. Los gases y sus leyes.
 Unidad I Transformaciones de la materia. Tema 1. Los gases y sus leyes. 1. Los gases 1.1. Teoría cinético molecular de los gases. 1. Los gases consisten en un número grande de partículas que están a grandes
Unidad I Transformaciones de la materia. Tema 1. Los gases y sus leyes. 1. Los gases 1.1. Teoría cinético molecular de los gases. 1. Los gases consisten en un número grande de partículas que están a grandes
Unidad 5: La parte gaseosa de la Tierra.
 Unidad 5: La parte gaseosa de la Tierra. La parte externa del planeta Tierra tiene estas capas: La atmósfera: formada por gases, entre los que abundan el oxígeno y el nitrógeno. La hidrosfera: formada
Unidad 5: La parte gaseosa de la Tierra. La parte externa del planeta Tierra tiene estas capas: La atmósfera: formada por gases, entre los que abundan el oxígeno y el nitrógeno. La hidrosfera: formada
Física y Química 1º Bach.
 Física y Química 1º Bach. Leyes de los gases. Teoría cinético-molecular 05/11/10 DEPARTAMENTO FÍSICA E QUÍMICA Nombre: OPCIÓN 1 1. Observa el aparato de la Figura. Si la temperatura del aceite se eleva
Física y Química 1º Bach. Leyes de los gases. Teoría cinético-molecular 05/11/10 DEPARTAMENTO FÍSICA E QUÍMICA Nombre: OPCIÓN 1 1. Observa el aparato de la Figura. Si la temperatura del aceite se eleva
Cómo funciona el efecto invernadero
 Cómo funciona el efecto La radiación solar comprende radiaciones luminosas (luz) y radiaciones caloríficas (calor), donde sobresalen las radiaciones infrarrojas. Las radiaciones luminosas son de pequeña
Cómo funciona el efecto La radiación solar comprende radiaciones luminosas (luz) y radiaciones caloríficas (calor), donde sobresalen las radiaciones infrarrojas. Las radiaciones luminosas son de pequeña
Contaminación atmosférica
 qué es la atmosfera? La atmósfera terrestre es una mezcla de gases. Los más abundantes son: Nitrógeno: 78% total del aire. Oxígeno: 21 % del total. Dióxido de carbono: 0,033% del total. Además puede contener
qué es la atmosfera? La atmósfera terrestre es una mezcla de gases. Los más abundantes son: Nitrógeno: 78% total del aire. Oxígeno: 21 % del total. Dióxido de carbono: 0,033% del total. Además puede contener
LA ATMÓSFERA LA ATMÓSFERA PROFESORES: CRISTIAN MARRERO SOLANO FERNANDO ALVAREZ MOLINA. Ciencias Naturales 21/02/2010. Prof Cristian Marrero Solano 1
 LA ATMÓSFERA PROFESORES: CRISTIAN MARRERO SOLANO FERNANDO ALVAREZ MOLINA CIENCIAS NATURALES LA ATMÓSFERA Generalidades 1 Permite la vida sobre la Tierra, ya que podemos respirar aire. 2 Además muchos de
LA ATMÓSFERA PROFESORES: CRISTIAN MARRERO SOLANO FERNANDO ALVAREZ MOLINA CIENCIAS NATURALES LA ATMÓSFERA Generalidades 1 Permite la vida sobre la Tierra, ya que podemos respirar aire. 2 Además muchos de
La materia y sus estados
 La materia y sus estados Física y Química La materia Oxford University Press España, S. A. Física y Química 3º ESO 2 Todo lo que existe en el universo está constituido por materia. La materia se presenta
La materia y sus estados Física y Química La materia Oxford University Press España, S. A. Física y Química 3º ESO 2 Todo lo que existe en el universo está constituido por materia. La materia se presenta
La materia y sus estados
 La materia y sus estados Física y Química La materia Oxford University Press España, S. A. Física y Química 3º ESO 2 Todo lo que existe en el universo está constituido por materia. La materia se presenta
La materia y sus estados Física y Química La materia Oxford University Press España, S. A. Física y Química 3º ESO 2 Todo lo que existe en el universo está constituido por materia. La materia se presenta
LOS GASES Y LAS DISOLUCIONES. Departamento de Física y Química 3º ESO
 LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
Bachillerato. todos los derechos reservados, Macmillan Profesional. QUIMI
 QUIMI A2 Esmog y sus reacciones químicas 2 B2 El esmog es un tipo de niebla, humo y vapores que evidencia la contaminación atmosférica de algunas ciudades. El esmog es el resultado de la combinación de
QUIMI A2 Esmog y sus reacciones químicas 2 B2 El esmog es un tipo de niebla, humo y vapores que evidencia la contaminación atmosférica de algunas ciudades. El esmog es el resultado de la combinación de
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
Unidad 4: Estado Gaseoso Introducción Teórica
 Unidad 4: Estado Gaseoso Introducción Teórica En esta unidad vamos a ampliar y explicar algunas de las características del estado gaseoso que ya han sido tratadas en la Unidad 1, como por ejemplo la de
Unidad 4: Estado Gaseoso Introducción Teórica En esta unidad vamos a ampliar y explicar algunas de las características del estado gaseoso que ya han sido tratadas en la Unidad 1, como por ejemplo la de
CURSO de ELEMENTOS DE METEOROLOGIA Y CLIMA Bolilla I ATMOSFERA
 CURSO de ELEMENTOS DE METEOROLOGIA Y CLIMA 2011 Bolilla I ATMOSFERA Universidad de la República Facultad de Ingeniería Facultad de Ciencias Licenciatura en Ciencias de la Atmósfera M. Bidegain G. Necco
CURSO de ELEMENTOS DE METEOROLOGIA Y CLIMA 2011 Bolilla I ATMOSFERA Universidad de la República Facultad de Ingeniería Facultad de Ciencias Licenciatura en Ciencias de la Atmósfera M. Bidegain G. Necco
La atmósfera terrestre. Matilde Ungerovich 22/8/2018
 La atmósfera terrestre Matilde Ungerovich 22/8/2018 La atmósfera terrestre We may be able to survive without food for a few weeks, or without water for a few days, but, without our atmosphere, we would
La atmósfera terrestre Matilde Ungerovich 22/8/2018 La atmósfera terrestre We may be able to survive without food for a few weeks, or without water for a few days, but, without our atmosphere, we would
TEMA.: EL ESTADO GASEOSO PROPÓSITOS:
 TEMA.: EL ESTADO GASEOSO PROPÓSITOS: Explicar las propiedades de los gases. Determinar la masa molar de los gases. Describir el comportamiento de los gases. Inculcar en la reducción de agentes contaminantes
TEMA.: EL ESTADO GASEOSO PROPÓSITOS: Explicar las propiedades de los gases. Determinar la masa molar de los gases. Describir el comportamiento de los gases. Inculcar en la reducción de agentes contaminantes
LA ATMÓSFERA REALIZADO POR ELENA GARCÍA MARÍN
 LA ATMÓSFERA REALIZADO POR ELENA GARCÍA MARÍN La Atmósfera La atmósfera es la capa de gases que rodea a la Tierra. Se extiende hasta unos 1000 km, aunque en sus 15 primeros km se encuentra el 95% de los
LA ATMÓSFERA REALIZADO POR ELENA GARCÍA MARÍN La Atmósfera La atmósfera es la capa de gases que rodea a la Tierra. Se extiende hasta unos 1000 km, aunque en sus 15 primeros km se encuentra el 95% de los
ATMOSFERAS PLANETARIAS
 ATMOSFERAS PLANETARIAS Las atmósferas es un fluído particular (GASES) en procura del equilibrio. Clasificación: Planetas terrestres: : Venus, Tierra, Marte,, Titan Atmosferas tenues: Mercurio,, Io, Triton,
ATMOSFERAS PLANETARIAS Las atmósferas es un fluído particular (GASES) en procura del equilibrio. Clasificación: Planetas terrestres: : Venus, Tierra, Marte,, Titan Atmosferas tenues: Mercurio,, Io, Triton,
LA ATMÓSFERA TERRESTRE
 LA ATMÓSFERA Y EL CLIMA UNIDAD 2 CIENCIAS SOCIALES 4º EPO 2017/2018 LA ATMÓSFERA Y SU COMPOSICIÓN LA ATMÓSFERA TERRESTRE La atmósfera es la capa de aire que envuelve la Tierra. Su espesor es de unos 1.000
LA ATMÓSFERA Y EL CLIMA UNIDAD 2 CIENCIAS SOCIALES 4º EPO 2017/2018 LA ATMÓSFERA Y SU COMPOSICIÓN LA ATMÓSFERA TERRESTRE La atmósfera es la capa de aire que envuelve la Tierra. Su espesor es de unos 1.000
químicas 4. Ajuste de ecuaciones químicas 5. Estudio de algunas reacciones de interés 6. Impactos medioambientales. Contaminación
 UNIDAD 2: LAS REACCIONES QUÍMICAS Y SU INTERPRETACIÓN MICROSCÓPICA 1. Cambios físicos y químicos 2. Reacciones químicas 3. Representación simbólicade las reacciones químicas 4. Ajuste de ecuaciones químicas
UNIDAD 2: LAS REACCIONES QUÍMICAS Y SU INTERPRETACIÓN MICROSCÓPICA 1. Cambios físicos y químicos 2. Reacciones químicas 3. Representación simbólicade las reacciones químicas 4. Ajuste de ecuaciones químicas
Propiedades Físicas y Químicas del Aire
 Propiedades Físicas y Químicas del Aire PROPIEDADES FISICAS Es de menor peso que el agua. Es de menor densidad que el agua. Tiene Volumen indefinido. No existe en el vacío. Es incoloro, inodoro e insípido.
Propiedades Físicas y Químicas del Aire PROPIEDADES FISICAS Es de menor peso que el agua. Es de menor densidad que el agua. Tiene Volumen indefinido. No existe en el vacío. Es incoloro, inodoro e insípido.
Causas y efectos de la contaminación del aire
 Causas y efectos de la contaminación del aire La contaminación del aire es una de las formas más visibles de contaminación. Cualquiera que haya visto un cielo marrón amarillento sobre una ciudad, o un
Causas y efectos de la contaminación del aire La contaminación del aire es una de las formas más visibles de contaminación. Cualquiera que haya visto un cielo marrón amarillento sobre una ciudad, o un
3. Física del Buceo. Séptima Compañía de Bomberos Acción y Disciplina Tome Dichato Fundada el 24 de Octubre de 1975 GERSA
 3. Física del Buceo Séptima Compañía de Bomberos Acción y Disciplina Tome Dichato Fundada el 24 de Octubre de 1975 GERSA 1. Conceptos básicos y unidades de medida 1.1 Materia y sus estados Es todo aquello
3. Física del Buceo Séptima Compañía de Bomberos Acción y Disciplina Tome Dichato Fundada el 24 de Octubre de 1975 GERSA 1. Conceptos básicos y unidades de medida 1.1 Materia y sus estados Es todo aquello
Ejercicios. Ejercicios. 1. Cuántas moléculas de metano (CH 4) ) hay en 10 moles de dicho compuesto? 2. Calcula la masa de 10 moles de CO 2
 TEMA 3: 3 : LOS GASES EL MOL Ya hemos visto que los átomos y las moléculas de los elementos y compuestos son extremadamente pequeños. En 1 gramo de H 2O hay 3,3. 10 22 moléculas. En cualquier muestra de
TEMA 3: 3 : LOS GASES EL MOL Ya hemos visto que los átomos y las moléculas de los elementos y compuestos son extremadamente pequeños. En 1 gramo de H 2O hay 3,3. 10 22 moléculas. En cualquier muestra de
PROPIEDADES DE LA MATERIA. Departamento de Física y Química 2º ESO
 PROPIEDADES DE LA MATERIA Departamento de Física y Química 2º ESO 0. Mapa conceptual Estados de agregación Sólido Líquido Gaseoso Propiedades MATERIA Teoría cinética Generales Específicas Leyes de los
PROPIEDADES DE LA MATERIA Departamento de Física y Química 2º ESO 0. Mapa conceptual Estados de agregación Sólido Líquido Gaseoso Propiedades MATERIA Teoría cinética Generales Específicas Leyes de los
Sustancia que se caracteriza porque sus moléculas. no tiene forma definida. adquiere la forma del recipiente que lo contiene.
 Qué es un gas? Sustancia que se caracteriza porque sus moléculas están en desorden. tienen gran energía. están muy separadas entre sí. prácticamente no se atraen entre sí. Una sustancia gaseosa no tiene
Qué es un gas? Sustancia que se caracteriza porque sus moléculas están en desorden. tienen gran energía. están muy separadas entre sí. prácticamente no se atraen entre sí. Una sustancia gaseosa no tiene
Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO. Nombre Grupo Matrícula PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P)
 Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO Nombre Grupo Matrícula PROPIEDADES DE LOS GASES: I. Completa correctamente la siguiente tabla. PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P) VOLUMEN (V)
Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO Nombre Grupo Matrícula PROPIEDADES DE LOS GASES: I. Completa correctamente la siguiente tabla. PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P) VOLUMEN (V)
La atmósfera Origen, composición y estructura
 Taller de Introducción a las Ciencias de la Atmósfera Primer Semestre 2016 Gustavo V. Necco Carlomagno IMFIA FING/ IF - FCIEN La atmósfera Origen, composición y estructura Earth S ys te m S c ie nc e s
Taller de Introducción a las Ciencias de la Atmósfera Primer Semestre 2016 Gustavo V. Necco Carlomagno IMFIA FING/ IF - FCIEN La atmósfera Origen, composición y estructura Earth S ys te m S c ie nc e s
QUÍMICA GENERAL GASES IDEALES
 QUÍMICA GENERAL GASES IDEALES INTRODUCCIÓN TEORÍA CINÉTICA DE LOS GASES LEYES DE LOS GASES IDEALES TEORÍA CINÉTICA DE LOS GASES DEFINICIÓN Entre 1850 y 1880 Clausius y Boltzmann desarrollaron esta teoría,
QUÍMICA GENERAL GASES IDEALES INTRODUCCIÓN TEORÍA CINÉTICA DE LOS GASES LEYES DE LOS GASES IDEALES TEORÍA CINÉTICA DE LOS GASES DEFINICIÓN Entre 1850 y 1880 Clausius y Boltzmann desarrollaron esta teoría,
UNIDAD 3: LAS C APA P S F LU L IDA D S DE L A T I T ERRA
 UNIDAD 3: LAS CAPAS FLUIDAS DE LA TIERRA LA ATMÓSFERA La atmósfera es la capa gaseosa que rodea la Tierra. Es fundamental para la vida porque contiene los gases que respiramos y porque nos protege de algunas
UNIDAD 3: LAS CAPAS FLUIDAS DE LA TIERRA LA ATMÓSFERA La atmósfera es la capa gaseosa que rodea la Tierra. Es fundamental para la vida porque contiene los gases que respiramos y porque nos protege de algunas
La hidrosfera: Humos locales, impactos globales. Contaminación atmosférica. Humos locales, impactos globales. Contaminación atmosférica
 La hidrosfera: Humos locales, impactos globales. Contaminación atmosférica La contaminación atmosférica: tipos y origen. Gases contaminantes de la atmósfera. Dispersión de los contaminantes. Efectos de
La hidrosfera: Humos locales, impactos globales. Contaminación atmosférica La contaminación atmosférica: tipos y origen. Gases contaminantes de la atmósfera. Dispersión de los contaminantes. Efectos de
El medio ambiente y la sociedad contemporánea. Contaminación Atmosférica
 S SENSIBILIZACIÓN AMBIENTAL El medio ambiente y la sociedad contemporánea La problemática ambiental Contaminación Atmosférica Existen muchas definiciones de contaminación atmosférica. La Organización Mundial
S SENSIBILIZACIÓN AMBIENTAL El medio ambiente y la sociedad contemporánea La problemática ambiental Contaminación Atmosférica Existen muchas definiciones de contaminación atmosférica. La Organización Mundial
Teoría Mol Nº Avogadro Gases perfectos Física y Química. 1º bachiller CONCEPTOS PREVIOS
 CONCEPTOS PREVIOS Masa atómica: Es la masa de un átomo en reposo. En cursos anteriores denominábamos número atómico a la masa de un átomo (protones + neutrones). Pero los elementos tienen átomos con diferente
CONCEPTOS PREVIOS Masa atómica: Es la masa de un átomo en reposo. En cursos anteriores denominábamos número atómico a la masa de un átomo (protones + neutrones). Pero los elementos tienen átomos con diferente
I. Características físicas y químicas de las diferentes capas que la constituyen.
 Temario: I. Características físicas y químicas de las diferentes capas que la constituyen. II. III. IV. Origen y evolución de la atmósfera. Posibles procesos de desarrollo del oxígeno. Principales pérdidas
Temario: I. Características físicas y químicas de las diferentes capas que la constituyen. II. III. IV. Origen y evolución de la atmósfera. Posibles procesos de desarrollo del oxígeno. Principales pérdidas
Tema 9. La parte gaseosa de la Tierra
 Tema 9 La parte gaseosa de la Tierra ÍNDICE 1. El origen de la atmósfera terrestre. 2. Composición de la atmósfera. 3. Estructura de la atmósfera. 4. La atmósfera regula la temperatura. 5. La presión atmosférica
Tema 9 La parte gaseosa de la Tierra ÍNDICE 1. El origen de la atmósfera terrestre. 2. Composición de la atmósfera. 3. Estructura de la atmósfera. 4. La atmósfera regula la temperatura. 5. La presión atmosférica
2da. Actividad de Reforzamiento
 Prof. María Alicia Vergara Materia: Química Año y Sección: 3ro. A y B 2da. Actividad de Reforzamiento A partir de las clases impartidas en el segundo lapso desarrollar las siguientes actividades: Resolver
Prof. María Alicia Vergara Materia: Química Año y Sección: 3ro. A y B 2da. Actividad de Reforzamiento A partir de las clases impartidas en el segundo lapso desarrollar las siguientes actividades: Resolver
UNIDAD 9: LA ATMÓSFERA (parte gaseosa de la Tierra)
 UNIDAD 9: LA ATMÓSFERA (parte gaseosa de la Tierra) https://www.youtube.com/watch?v=zfhko_zau2u 1. Composición de la atmósfera La atmósfera esta compuesta por una mezcla de gases que llamamos aire 1. Composición
UNIDAD 9: LA ATMÓSFERA (parte gaseosa de la Tierra) https://www.youtube.com/watch?v=zfhko_zau2u 1. Composición de la atmósfera La atmósfera esta compuesta por una mezcla de gases que llamamos aire 1. Composición
La campaña de contaminación urbana 17-24
 La lluvia acida 3-10 Qué es el ozono? 11-16 La campaña de contaminación urbana 17-24 Efecto invernadero La lluvia acida es una precipitacion con un grado de acidez superior al normal Agua Vegetación Suelos
La lluvia acida 3-10 Qué es el ozono? 11-16 La campaña de contaminación urbana 17-24 Efecto invernadero La lluvia acida es una precipitacion con un grado de acidez superior al normal Agua Vegetación Suelos
1 Las reacciones químicas
 1 Las reacciones químicas 1 Los cambios en la naturaleza Cambios físicos y químicos Cuando se produce un cambio en un sistema material, este puede ser físico, si no cambian las sustancias, o químico, si
1 Las reacciones químicas 1 Los cambios en la naturaleza Cambios físicos y químicos Cuando se produce un cambio en un sistema material, este puede ser físico, si no cambian las sustancias, o químico, si
P T = P A + P B + P C.
 6. Ley de Dalton: La ley de Dalton establece que en una mezcla de gases cada gas ejerce su presión como si los restantes gases no estuvieran presentes. La presión específica de un determinado gas en una
6. Ley de Dalton: La ley de Dalton establece que en una mezcla de gases cada gas ejerce su presión como si los restantes gases no estuvieran presentes. La presión específica de un determinado gas en una
GASES INDUSTRIALES
 GASES INDUSTRIALES CONCEPTO Los gases industriales son un grupo de gases manufacturados que se comercializan con usos en diversas aplicaciones. Principalmente son empleados en procesos industriales, tales
GASES INDUSTRIALES CONCEPTO Los gases industriales son un grupo de gases manufacturados que se comercializan con usos en diversas aplicaciones. Principalmente son empleados en procesos industriales, tales
ESTEQUIOMETRÍA DE LAS REACCIONES
 ESTEQUIOMETRÍA DE LAS REACCIONES Es la información cuantitativa acerca de las reacciones entre las masas de los reactivos y productos en un cambio químico, que permite calcular a una gran cantidad de resultados
ESTEQUIOMETRÍA DE LAS REACCIONES Es la información cuantitativa acerca de las reacciones entre las masas de los reactivos y productos en un cambio químico, que permite calcular a una gran cantidad de resultados
EJERCICIOS DE REFUERZO/AMPLIACIÓN Control 1
 EJERCICIOS DE REFUERZO/AMPLIACIÓN Control 1 R-1 Explica qué le ocurre a la densidad de un gas cuando: se dilata se le aumenta la presión a temperatura constante Cuando una sustancia se dilata, su masa
EJERCICIOS DE REFUERZO/AMPLIACIÓN Control 1 R-1 Explica qué le ocurre a la densidad de un gas cuando: se dilata se le aumenta la presión a temperatura constante Cuando una sustancia se dilata, su masa
Teoría: 50 puntos (respuesta correcta= 2 puntos, respuesta incorrecta=-0.5 puntos, no contesta=0 puntos)
 Apellidos: Examen de Contaminación Atmosférica. 15 de Diciembre de 2003. Universidad Pablo de Olavide Nombre: Teoría: 50 puntos (respuesta correcta= 2 puntos, respuesta incorrecta=-0.5 puntos, no contesta=0
Apellidos: Examen de Contaminación Atmosférica. 15 de Diciembre de 2003. Universidad Pablo de Olavide Nombre: Teoría: 50 puntos (respuesta correcta= 2 puntos, respuesta incorrecta=-0.5 puntos, no contesta=0
Capítulo 1. Controles de NOx. 1.1 Generalidades
 Capítulo 1 Controles de NOx 1.1 Generalidades Los óxidos de nitrógeno (NO x ) son compuestos de nitrógeno y oxígeno que se forman en las combustiones con exceso de oxígeno y altas temperaturas. El término
Capítulo 1 Controles de NOx 1.1 Generalidades Los óxidos de nitrógeno (NO x ) son compuestos de nitrógeno y oxígeno que se forman en las combustiones con exceso de oxígeno y altas temperaturas. El término
EPO 11 ESCUELA PREPARATORIA OFICIAL NÚM. 11 FUENTE: VALORACIONES: FECHA: CUAUTITLAN IZCALLI, MEX. MATERIA: QUÍMICA II
 Diagnóstico 1PTO: NO ENTREGADA EN TIEMPO Y FORMA. 2PTS: ACTIVIDAD INCOMPLETA. 3PTS: ACTIVIDA COMPLETA. 1 TEMÁTICA INTEGRADORA ESCENARIO DIDÁCTICO PREGUNTA GENERADORA 2 Desarrolla, analiza e interpreta
Diagnóstico 1PTO: NO ENTREGADA EN TIEMPO Y FORMA. 2PTS: ACTIVIDAD INCOMPLETA. 3PTS: ACTIVIDA COMPLETA. 1 TEMÁTICA INTEGRADORA ESCENARIO DIDÁCTICO PREGUNTA GENERADORA 2 Desarrolla, analiza e interpreta
GUIA: GASES y LEYES QUE LOS RIGEN
 DEPARTAMENTO DE CIENCIAS QUÍMICA Sèptimo Básico GUIA: GASES y LEYES QUE LOS RIGEN 1_ La ley de Gay-Lussac nos dice que, a volumen constante, la presión y la temperatura de un gas son directamente proporcionales
DEPARTAMENTO DE CIENCIAS QUÍMICA Sèptimo Básico GUIA: GASES y LEYES QUE LOS RIGEN 1_ La ley de Gay-Lussac nos dice que, a volumen constante, la presión y la temperatura de un gas son directamente proporcionales
GUÍA ACUMULATIVA/ 8º MEDIO ( Desarrollo de Ejercicios: Leyes de los Gases) Nombre del Alumno: Curso: Fecha:
 Sector: Naturaleza Nivel: 8 Básico Nombre Profesora: Nancy Erazo Rosa Unidad V : Leyes de los gases GUÍA ACUMULATIVA/ 8º MEDIO ( Desarrollo de Ejercicios: Leyes de los Gases) Nombre del Alumno: Curso:
Sector: Naturaleza Nivel: 8 Básico Nombre Profesora: Nancy Erazo Rosa Unidad V : Leyes de los gases GUÍA ACUMULATIVA/ 8º MEDIO ( Desarrollo de Ejercicios: Leyes de los Gases) Nombre del Alumno: Curso:
Preguntas de la Prueba de Acceso Tecnología.
 Colegio Virgen del Carmen Prueba de acceso a ciclos 1 Preguntas de la Prueba de Acceso Tecnología. 1. Definiciones: a. Leva. b. Torno-Torneado. c. Cigüeñal. Un cigüeñal o cigoñal 1 es un eje acodado, con
Colegio Virgen del Carmen Prueba de acceso a ciclos 1 Preguntas de la Prueba de Acceso Tecnología. 1. Definiciones: a. Leva. b. Torno-Torneado. c. Cigüeñal. Un cigüeñal o cigoñal 1 es un eje acodado, con
EJERCICIOS DE REFUERZO/AMPLIACIÓN Control 1
 EJERCICIOS DE REFUERZO/AMPLIACIÓN Control 1 R-1 Explica qué le ocurre a la densidad de un gas cuando: se dilata se le aumenta la presión a temperatura constante Cuando una sustancia se dilata, su masa
EJERCICIOS DE REFUERZO/AMPLIACIÓN Control 1 R-1 Explica qué le ocurre a la densidad de un gas cuando: se dilata se le aumenta la presión a temperatura constante Cuando una sustancia se dilata, su masa
Tiempo (minutos) Temperatura (ºC)
 EXAMEN FINAL 3º ESO. FÍSICA Y QUÍMICA. 1.- Al calentar un cierto sólido se ha obtenido la siguiente tabla de datos: Tiempo (minutos) 0 2 4 6 10 12 16 18 20 Temperatura (ºC) -5 0 5 10 20 20 20 25 30 Representa
EXAMEN FINAL 3º ESO. FÍSICA Y QUÍMICA. 1.- Al calentar un cierto sólido se ha obtenido la siguiente tabla de datos: Tiempo (minutos) 0 2 4 6 10 12 16 18 20 Temperatura (ºC) -5 0 5 10 20 20 20 25 30 Representa
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
UNIVERSIDAD TECNICA LUIS VARGAS TORRES" DE ESMERALDAS
 UNIVERSIDAD TECNICA LUIS VARGAS TORRES" DE ESMERALDAS FACULTAD DE INGENIERIAS Y TECNOLOGIAS ING. PAUL VISCAINO VALENCIA DOCENTE Esmeraldas, 06 de Julio del 2016 UNIVERSIDAD TECNICA "LUIS VARGAS TORRES"
UNIVERSIDAD TECNICA LUIS VARGAS TORRES" DE ESMERALDAS FACULTAD DE INGENIERIAS Y TECNOLOGIAS ING. PAUL VISCAINO VALENCIA DOCENTE Esmeraldas, 06 de Julio del 2016 UNIVERSIDAD TECNICA "LUIS VARGAS TORRES"
Director de Curso Francisco J. Giraldo R.
 Director de Curso Francisco J. Giraldo R. EL AIRE El aire seco es una mezcla de gases: El 78% es Nitrógeno. El 21% es Oxígeno. El 1% es Argón. El Dioxido de carbono (CO 2 ), Helio (He), Neón (Ne), Kripton
Director de Curso Francisco J. Giraldo R. EL AIRE El aire seco es una mezcla de gases: El 78% es Nitrógeno. El 21% es Oxígeno. El 1% es Argón. El Dioxido de carbono (CO 2 ), Helio (He), Neón (Ne), Kripton
TEMA I. Campo conceptual de la Meteorología..- La Meteorología en el contexto de las ciencias de la atmósfera.- Campo y objeto de la Meteorología..
 TEMA I. Campo conceptual de la Meteorología..- La Meteorología en el contexto de las ciencias de la atmósfera.- Campo y objeto de la Meteorología..- Tiempo atmosférico y Estado del tiempo..- Elementos
TEMA I. Campo conceptual de la Meteorología..- La Meteorología en el contexto de las ciencias de la atmósfera.- Campo y objeto de la Meteorología..- Tiempo atmosférico y Estado del tiempo..- Elementos
Termodinámica. Calor y Temperatura
 Termodinámica Calor y Temperatura 1 Temas 3. GASES IDEALES Y ESTADOS TERMODINÁMICOS. 3.1 Concepto y características del gas ideal. 3.2 Ley de Boyle, Ley de Charles, Ley de Gay- Lussac e hipótesis de Avogadro.
Termodinámica Calor y Temperatura 1 Temas 3. GASES IDEALES Y ESTADOS TERMODINÁMICOS. 3.1 Concepto y características del gas ideal. 3.2 Ley de Boyle, Ley de Charles, Ley de Gay- Lussac e hipótesis de Avogadro.
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA
 BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
Conocer y describir cuales son los factores que determinan el comportamiento de los gases en la naturaleza.
 Miss María Cuevas Conocer y describir cuales son los factores que determinan el comportamiento de los gases en la naturaleza. Los Estados de la materia Propiedades de gases, líquidos y sólidos Gas Líquido
Miss María Cuevas Conocer y describir cuales son los factores que determinan el comportamiento de los gases en la naturaleza. Los Estados de la materia Propiedades de gases, líquidos y sólidos Gas Líquido
LEY DE LOS GASES IDEALES 1
 LEY DE LOS GASES IDEALES 1 QUÍMICA GENERAL QUÉ SON LOS GASES IDEALES? 2 ; 3 Las moléculas de los gases se mueven libremente chocando contra las paredes del recipiente que los contiene, lo que origina la
LEY DE LOS GASES IDEALES 1 QUÍMICA GENERAL QUÉ SON LOS GASES IDEALES? 2 ; 3 Las moléculas de los gases se mueven libremente chocando contra las paredes del recipiente que los contiene, lo que origina la
Profesora: Teresa Esparza Araña ASPECTOS CUANTITATIVOS DE LA QUÍMICA. UNIDAD 2: Los gases ideales
 Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
LA ATMÓSFERA TERRESTRE. Cátedra Climatología y Fenología Agrícolas
 LA ATMÓSFERA TERRESTRE Cátedra Climatología y Fenología Agrícolas LA ATMÓSFERA. Composición, características y estratificación. Componentes principales Constitución del planeta tierra La tierra está rodeada
LA ATMÓSFERA TERRESTRE Cátedra Climatología y Fenología Agrícolas LA ATMÓSFERA. Composición, características y estratificación. Componentes principales Constitución del planeta tierra La tierra está rodeada
Las reacciones químicas
 Las reacciones químicas Física y Química Cómo se produce una reacción química? 2 Transformación física Las sustancias cambian su forma, pero no su composición química. Deformación. Fusión. Fragmentación.
Las reacciones químicas Física y Química Cómo se produce una reacción química? 2 Transformación física Las sustancias cambian su forma, pero no su composición química. Deformación. Fusión. Fragmentación.
UNIDAD 4. CONTAMINACIÓN DE LA ATMÓSFERA
 CIENCIAS APLICADAS CONTAMINACIÓN ATMOSFÉRICA Se entiende por contaminación atmosférica la presencia en el aire de sustancias o formas de energía procedentes de emisiones que produzcan daño o molestia a
CIENCIAS APLICADAS CONTAMINACIÓN ATMOSFÉRICA Se entiende por contaminación atmosférica la presencia en el aire de sustancias o formas de energía procedentes de emisiones que produzcan daño o molestia a
Cómo contribuyen las actividades humanas a los cambios climáticos? y Cómo se comparan con las influencias humanas?
 Cómo contribuyen las actividades humanas a los cambios climáticos? y Cómo se comparan con las influencias humanas? Las actividades humanas contribuyen al cambio climático provocando cambios en la atmósfera
Cómo contribuyen las actividades humanas a los cambios climáticos? y Cómo se comparan con las influencias humanas? Las actividades humanas contribuyen al cambio climático provocando cambios en la atmósfera
Cambio climático y energías alternativas. Economía del hidrógeno.
 Cambio climático y energías alternativas. Economía del hidrógeno. Parte I El clima. Flujos naturales de energía. Balance de energía. Absorción y emisión de energía por la tierra. Partículas y nubes. Gases
Cambio climático y energías alternativas. Economía del hidrógeno. Parte I El clima. Flujos naturales de energía. Balance de energía. Absorción y emisión de energía por la tierra. Partículas y nubes. Gases
La Atmósfera. Se extiende hasta unos 1000 km, aunque en sus 15 primeros km se encuentra el 95% de los gases que la componen.
 LA ATMÓSFERA La Atmósfera La atmósfera es la capa de gases que rodea a la Tierra. Se extiende hasta unos 1000 km, aunque en sus 15 primeros km se encuentra el 95% de los gases que la componen. COMPOSICION
LA ATMÓSFERA La Atmósfera La atmósfera es la capa de gases que rodea a la Tierra. Se extiende hasta unos 1000 km, aunque en sus 15 primeros km se encuentra el 95% de los gases que la componen. COMPOSICION
Contenidos 1.- Leyes de los gases: 1.1. Ley de Boyle-Mariotte Ley de Charles Gay.Lussac Ecuación general de un gas ideal
 Los gases 1 2 Contenidos 1.- Leyes de los gases: 1.1. Ley de Boyle-Mariotte. 1.2. Ley de Charles Gay.Lussac. 2.- Gases ideales. 3.- Teoría cinética de los gases. 4.- Ecuación general de un gas ideal. 5.-
Los gases 1 2 Contenidos 1.- Leyes de los gases: 1.1. Ley de Boyle-Mariotte. 1.2. Ley de Charles Gay.Lussac. 2.- Gases ideales. 3.- Teoría cinética de los gases. 4.- Ecuación general de un gas ideal. 5.-
GASES. Contenidos. Leyes de los gases y su aplicación en la resolución de problemas numéricos.
 GASES Contenidos Postulados de la teoría cinética de los gases y su relación con las características (expansión, comprensión y difusión) y las propiedades ( presión, volumen y temperatura) que los definen.
GASES Contenidos Postulados de la teoría cinética de los gases y su relación con las características (expansión, comprensión y difusión) y las propiedades ( presión, volumen y temperatura) que los definen.
GASES IDEALES. P. V = n. R. T
 GASES IDEALES Lic. Lidia Iñigo A esta altura de tus estudios seguramente ya sabés que hay muchas sustancias formadas por moléculas, qué es una molécula, y que una sustancia determinada puede presentarse
GASES IDEALES Lic. Lidia Iñigo A esta altura de tus estudios seguramente ya sabés que hay muchas sustancias formadas por moléculas, qué es una molécula, y que una sustancia determinada puede presentarse
