1. CINÉTICA Y REACTORES IDEALES Año 2010
|
|
|
- Gloria Palma Olivera
- hace 7 años
- Vistas:
Transcripción
1 1. CINÉTICA Y REACTORES IDEALES Año La descomposición del óxido de etileno, C 2 H 4 O CH 4 + CO, se realiza a 687 K y a volumen constante. Se obtuvieron los siguientes resultados: P tot (torr) t (s) Determinar la velocidad de reacción de cada componente En una polimerización en fase gaseosa y a temperatura y presión constante desaparece el 20% de monómero en 34 minutos partiendo de la concentración inicial del monómero de 0.04 mol/l y también cuando se parte de 0.8 mol /L. Hallar la expresión cinética y la constante de reacción a) Una reacción homogénea en fase gaseosa A 2.5 R se lleva a cabo en un reactor discontinuo a 2 atm de presión total, agregando un 20% de inerte al 100% original. En 20 minutos el volumen aumenta 60%. Determinar la constante de velocidad de reacción sabiendo que sigue una cinética de primer orden. b) Determinar el tiempo necesario para que en un sistema cerrado (volumen constante) la presión total final es de 8 atm y la inicial, 5 atm. Se sabe que la presión parcial de inertes es de 2 atm Para la reacción de orden cero, A rr, que se efectúa en una bomba de volumen constante, con 20% de inertes, la presión se eleva de 1 a 1.3 atm en 2 minutos. Para la misma reacción efectuada en un reactor discontinuo de presión constante, cuál es la variación fraccional de volumen en 4 minutos si la alimentación está a 3 atm y contiene 40% de inertes? Calcúlese el orden global de la reacción irreversible 2H 2 + 2NO N 2 + 2H 2 O a partir de los siguientes datos a volumen constante, empleando cantidades equimoleculares de H 2 y NO: Presión total inicial (mmhg) t 1/2 (s) La oxidación irreversible del KI por persulfato de potasio fue acompañada recogiendo muestras en varios tiempos. Se analiza el Yodo liberado titulando con tiosulfato de potasio. El KI está en exceso. Se obtuvieron los siguientes resultados a 25 C: t (min) gasto (ml) Determinar la velocidad de reacción La reacción entre la trietilamina y el yoduro de metilo se da a 20 C: (C 2 H 5 ) 3 N + CH 3 I CH 3 (C 2 H 5 ) 3 NI
2 Partiendo de condiciones iniciales iguales de mol/l para cada reactivo, se acompañó la reacción titulando con CCl 4 y determinando la concentración de amina no reaccionada de acuerdo con la tabla siguiente: t (min) C A (mol/l) Determinar la velocidad de reacción En el estudio de descomposición del acetaldehido a 518 C y a presión atmosférica, (CH 3 CHO CH 4 + CO) se obtuvieron las siguientes conversiones en función del tiempo: t (s) X A Determinar la velocidad de reacción La conversión del ácido γ-hidroxibutírico en fase acuosa a 25 C, A R + S, transcurre de acuerdo con los datos siguientes: tiempo (min) C A (mol/l) C Ao = mol/l C Ro = 0 C So = 55 mol/l Deduzca la ecuación cinética Una pequeña bomba de reacción a volumen constante, equipada con un dispositivo sensible para la medida de presión, se evacua y se carga después con una mezcla de 76.94% de reactante A y de 23.06% de inertes a la presión total de 1 atm. La operación se efectúa a 14 C, temperatura suficientemente baja para que la reacción no transcurra en extensión apreciable. La temperatura se eleva rápidamente a 100 C sumergiendo la bomba en agua hirviendo, obteniéndose los siguientes datos: t (min) P T (atm) La ecuación estequiométrica es A 2R y después de un tiempo suficiente la reacción se completa. Deduzca una ecuación cinética que se ajuste a estos datos expresando las unidades en mol, litro y minuto En la descomposición del dioxano (1,4 dietilendióxido) a 504 C a volumen constante se ha determinado la presión a los 2 minutos partiendo de diferentes presiones iniciales, según la tabla. p Ao (mmhg) p A, 2 min (mmhg) Determinar la expresión de velocidad.
3 La sustancia gaseosa pura A se prepara bajo refrigeración y se introduce en un capilar de pared delgada que actúa como recipiente de reacción, como se muestra en la figura. Durante el manejo no hay reacción apreciable. El recipiente de reacción se introduce rápidamente en un baño de agua hirviendo y el reactante A se descompone completamente de acuerdo con la reacción A R + S, obteniéndose los datos indicados. Calcúlese la ecuación cinética expresándose las unidades en moles, litros y minutos. Hg agua hirviendo 1000 mm capilar tiempo (min) longitud del capilar ocupada por la mezcla de reacción (cm) En un reactor discontinuo se planifica la conversión de A en R. La reacción se efectúa en fase líquida, la estequiometría es A R y la velocidad de reacción es la indicada en la siguiente tabla: C A (mol/l) r A (mol/l.min) Calcúlese el tiempo que ha de reaccionar cada carga para que la concentración descienda de C Ao = 1.3 mol/l hasta C Af = 0.3 mol/l Para la producción de ácido propiónico se disuelve la sal de sodio en HCl según: C 2 H 5 COONa +HCl C 2 H 5 COOH + NaCl La reacción es reversible y de segundo orden (primer orden para cada reactivo). En el laboratorio y a 50 C se recogen muestras de 100 ml a diferentes tiempos neutralizando el HCl con NaOH N. Las concentraciones iniciales de ácido y sal son iguales. t(min) NaOH (ml) Determinar el volumen de un reactor batch para producir 453 kg/día en dos turnos de 8 horas. Se requieren 20 min para cargar el reactor y calentarlo a 50 C y 10 min para enfriarlo y retirar la carga. La conversión final que se pretende es del 75%. Se usa la misma concentración y temperatura que en la experiencia de laboratorio. Determinar la tasa máxima de producción por tachada alcanzable en esas condiciones La reacción H 2 SO 4 + (C 2 H 5 ) 2 SO 4 2 C 2 H 5 SO 4 H se realiza a 22.9 C y una concentración de 5.5 mol/l de ácido sulfúrico y de sulfato de dietilo. Se conocen los datos suministrados por Hellin y Junger (Bull. Soc. Chim., Fr., 1957, p 386):
4 t (min) H 2 SO 4 (mol/l) t (min) H 2 SO 4 (mol/l) Tiempo muerto: 10 min.; tiempo de carga: 20 min; tiempo de descarga 20 min. Se conocen los costos de operación: φ r = 30$/h (reacción); φ m = φ cd = 20$/h (tiempo muerto y de carga-descarga). Precio de los reactivos: H 2 SO 4 : 0.98$/kg; (C 2 H 5 ) 2 SO 4 : 1.54 $/kg; C 2 H 5 SO 4 H: 13.1 $/kg. Volumen de reactor: 100 L. Considerar 2 turnos de 8 horas por día. Determinar la tasa máxima de producción por tachada y la tasa de ganancia máxima diaria Calcúlese el tamaño del reactor de flujo pistón necesario para alcanzar la conversión del 80% con una alimentación de 1000 mola/h (C Ao = 1.5 mol/l) para la misma reacción del problema a) Para la reacción del problema 13 calcúlese el tamaño del reactor de mezcla completa necesario para alcanzar la conversión del 75% con una alimentación de 1000 mola/h (C Ao = 1.2 mol/l). b) Repítase el apartado a) si se duplica el caudal de alimentación, es decir, para tratar 2000 mola/h (C Ao = 1.2 mol/l). c) Repítase el apartado a) si C Ao = 2.4 mol/l, manteniendo la alimentación de 1000 mola/h y C Af = 0.3 mol/l En un reactor de mezcla completa de 1 litro de volumen entran dos corrientes de alimentación gaseosa: una contiene el componente A (C Ao = 0.01 mol/l) y su caudal es de 1 L/min y la otra contiene el componente B (C Bo = 0.02 mol/l) y su caudal es de 3 L/min. En la reacción se forman una serie de productos R, S, T... El caudal de salida es de 6 L/min y el análisis de esta corriente muestra que C Af = mol/l y C Rf = mol/l. Todos los caudales están a la temperatura y presión constantes del reactor. Calcúlese la velocidad de reacción de A y la velocidad de formación de R En un reactor de mezcla completa se realiza la reacción en fase líquida homogénea A R, r A = k.c A 2 y tiene lugar una conversión del 50%. a) Plantear la ecuación de diseño del reactor. b) Calcúlese la conversión si el reactor se sustituye por otro seis veces mayor, sin modificar las demás condiciones. c) Calcúlese la conversión si se sustituye el reactor original de mezcla completa por un reactor de flujo en pistón de igual tamaño, sin modificar las demás condiciones. d) Represente ambos cambios efectuados en forma gráfica Se ha calculado que el tamaño de un reactor en flujo en pistón necesario para un fin determinado (99% de conversión de la alimentación de A puro) era 32 L, con la suposición de que la estequiometría era A R para una reacción de primer orden en fase gaseosa a temperatura y presión constante. Sin embargo la estequiometría real de la reacción es A 3R. Calcúlese el volumen de reactor necesario para la estequiometría correcta.
5 La reacción homogénea en fase gaseosa A 3R se ajusta a una cinética de segundo orden. Para un caudal de alimentación de 4 m 3 /h de A puro a 5 atm y 350 C se obtiene una conversión del 60% de la alimentación en un reactor experimental construido por un tubo de 2.5 cm de diámetro y 2 m de longitud. En una instalación comercial se ha de tratar 320 m 3 /h de una alimentación constituida por 50% de A y 50% de inertes, a 25 atm y 350 C para obtener una conversión del 80% para lo cual se cuenta con tubos iguales al reactor experimental. Asumir que los reactores trabajan a presión y temperatura constante. a) Si Ud. quiere minimizar el número de tubos requeridos, como los conectaría, en serie o en paralelo? b) Cuántos tubos se necesitan en dicha configuración? (Supóngase flujo en pistón, despréciese la pérdida de presión y admítase que el gas presenta comportamiento ideal) Se han obtenido los datos de la tabla para la descomposición de reactante A en fase gaseosa en un reactor discontinuo a volumen constante a 100 C. La estequiometría de la reacción es 2A R + S. Calcúlese el tamaño del reactor de flujo pistón para que operando a 100 C y 1 atm de presión total constante pueda tratar 100 moles de A por hora de una alimentación que contiene 20% de inertes para obtener una conversión de 95% de A. t (s) p A (atm) Para efectuar la reacción indicada en el problema anterior se emplea un tanque de 208 L que puede considerarse como un reactor de mezcla completa. Para idénticas condiciones de la alimentación y funcionamiento, calcúlese la conversión de A que puede lograrse en este reactor La reacción en fase gaseosa homogénea A 2B se efectúa a 100 C a la presión constante de 1 atm en un reactor discontinuo experimental, obteniéndose los datos de la tabla cuando se parte de A puro. Calcúlese el tamaño del reactor de flujo pistón operando a 100 C y 10 atm con una conversión del 90% de A para un caudal de alimentación de 10 mol/s (total) conteniendo un 40% de inertes. t (min) V/V o Se dispone de una mezcla gaseosa ideal que alimenta un reactor tubular a la velocidad de 25 lbmol/h. Se trabaja isotérmicamente a 1000 F y la presión absoluta es de 6 atm. El reactor es un caño de 6 de diámetro interno. La reacción es elemental e irreversible A + B C, con k = 10 5 ft 3 /lbmol.h. La alimentación está compuesta por 40% de A, 40% de B y 20% de C. a) Plantear la ecuación de diseño del reactor. b) Cuál es la longitud del reactor necesaria para lograr una conversión final del 80%?
6 La reacción A + B R es de primer orden respecto a cada reactivo. En la actualidad la reacción está siendo efectuada en fase líquida en un reactor en flujo pistón de 5 ft 3 usando una relación molar de entrada M = C Bo /C Ao = 2, con 90% de conversión de A. Se está considerando usar un reactor de mezcla completa de 25 ft 3. Qué relación molar M permitirá producir la misma cantidad de producto, teniendo la misma concentración inicial y conversión fraccional de A? En dos tanques ideales con agitación de L cada uno conectados en serie se han de tratar 100 L/h de un fluido radiactivo que tiene una vida media de 20 h. Calcúlese el descenso de su actividad a su paso a través del sistema Se investiga la cinética de la descomposición de A en fase acuosa en dos reactores de mezcla completa conectados en serie, el segundo de los cuales tiene doble volumen que el primero. En el estado estacionario, cuando la concentración de la alimentación es de 1 mola/l y el τ = 96 s en el primer reactor la concentración en éste es 0.5 mola/l y en el segundo 0.25 mola/l. Determínese la ecuación cinética para la descomposición Una compañía tiene dos reactores de mezcla completa de distinto tamaño para la producción de un producto específico obtenido por una reacción homogénea de primer orden. Cuál de las dos posibles disposiciones (en serie o en paralelo) permite alcanzar la velocidad de producción máxima? Justifique teóricamente y con ecuaciones. Asumir densidad constante Se polimeriza cierta sustancia en fase líquida por medio de una reacción que se representa con una ecuación cinética de orden 1.5 respecto al monómero. Se está tratando el monómero en dos reactores isotérmicos de igual tamaño de mezcla completa conectados en serie, obteniéndose un producto en el cual el contenido de monómero es aproximadamente del 20%. Se piensa aumentar la producción incorporando un tercer reactor igual a los anteriores conectado en serie. En qué porcentaje puede aumentarse el caudal de alimentación para seguir obteniendo un producto que no tenga más de un 20% de monómero? Se está efectuando la reacción elemental en fase líquida A + B 2R + S en un reactor de flujo en pistón empleando cantidades equimolares de A y B. La conversión es del 96%, con C Ao = C Bo = 1 mol/l. a) Indíquese en cuánto aumentaría la producción si se añadiera un reactor de mezcla completa 10 veces mayor que el de flujo en pistón en serie con la unidad existente y cuál ha de ser el primero en la serie, manteniendo las mismas condiciones de entrada. b) Indíquese si influye la concentración de la alimentación y en caso afirmativo el modo en que lo hace La reacción elemental A + B R + S en fase acuosa tiene lugar en una instalación que consta de un reactor de mezcla completa en el que se introducen las dos disoluciones reactantes, seguido de un reactor en flujo pistón. Se emplea un gran exceso de B para que la reacción sea de primer orden respecto a A. Se han indicado varios
7 métodos para aumentar la producción, uno de los cuales es invertir el orden de las dos unidades de reacción. a) Cómo afecta este cambio a la conversión? b) Si el reactor de mezcla completa tiene un volumen 4 veces el de flujo pistón y el porcentaje de conversión de A es de 99% a la salida del sistema, cuál es la variación en la producción si los dos reactores se conectan en paralelo? La reacción elemental irreversible en fase acuosa A + B R + S se efectúa isotérmicamente del siguiente modo: se introducen caudales iguales de dos corrientes líquidas en un tanque de 4 L; una de las corrientes contiene mola/l y la otra molb/l. La mezcla pasa después a través de un reactor de flujo en pistón de 16L. Se ha encontrado que en el tanque de mezcla se forma algo de R, siendo su concentración, mol/l. Suponiendo que ese tanque actúa como un reactor de mezcla completa, calcúlese la concentración de R a la salida del reactor de flujo en pistón así como la fracción de A inicial que se ha convertido en el sistema La producción actual de un producto R no cubre las necesidades del mercado, por lo cual se debe hacer un estudio exploratorio para aumentarla. El producto R se forma por una reacción elemental irreversible de A con B (A + B R) en un reactor de mezcla completa. A causa del gran exceso de B utilizado en la reacción, ésta puede considerarse de primer orden respecto a A con un coeficiente cinético k. El producto R se separa cuantitativamente de la corriente de salida del reactor y se descarga. El equipo de separación es bastante flexible y puede manejar un amplio rango de caudales. a) Si la alimentación de A (con un costo de α $/kmol) entra al reactor con una concentración de C Ao a razón de F Ao kmol/h, calcúlese la conversión de A para la cual el costo unitario del producto es mínimo. Los costos fijos y de funcionamiento son γ $/h. b) En esas condiciones, cuál es el costo unitario de R? c) Calcúlese el costo unitario de R mínimo, la conversión de A respectiva y la producción de R si α = 300 $/kmol γ = 1500 $/h, y se sabe que cuando F R = 25 kmol/h, la conversión de A es del 95% Se desea expandir las posibilidades operatorias del sistema planteado en el problema anterior para producir más R sin cambio en el costo unitario de R. Se piensa instalar un separador que permita recuperar A no reaccionado de la corriente de salida y reciclarla a la entrada del reactor. El separador tiene una eficiencia de recuperación de A del 96% y la corriente de A recuperado significa el 80% del caudal que entra al separador. Los costos de capital y operación del separador son de 4 $/h $/kmol de A que entra al equipo. Cuál es la nueva producción de R? En un RTFP con reciclo (R = 2) se tiene una conversión del 90% para una alimentación líquida con C A0 = 10 mol/l y una reacción A P, de primer orden respecto a A. Cuánto puede aumentarse el caudal volumétrico de alimentación si se corta el reciclo para poder alcanzar la misma conversión?
8 Las sustancias A y B reaccionan del modo siguiente: 2A R 2 r R = k 1 C A A + B S r S = k 2 C A C B 2B T 2 r T = k 3 C B Calcúlese la relación entre A y B que ha de mantenerse en un reactor de mezcla completa para que la selectividad de S respecto a la suma de productos sea máxima Se dispone de una mezcla de composición 45 mol/l de A y 5 mol/l de B a partir de la cual se ha de preparar otra mezcla en la que la relación molar de A a B ha de ser de 100 a 1. Para ello se añade el componente D que reacciona del modo siguiente: A + D R B + D S r A = 21 C A C D r B = 147 C B C D Suponiendo que las reacciones transcurren hasta la conversión completa, calcúlese la cantidad de D que ha de añadirse a una cantidad dada de mezcla inicial para obtener la mezcla deseada A y B reaccionan del modo siguiente: A + 2B 2R + S 2 (r A ) 1 = k 1 C A C B A + B T + U (r A ) 2 = k 2 C A C B Se introducen cantidades equimolares en un reactor discontinuo y se dejan reaccionar hasta la conversión completa. Cuando se ha consumido todo el componente B se tienen que C A = 0.1 mol/l, siendo C Ao = 1.0 mol/l. Indíquese que información puede deducirse sobre los coeficientes cinéticos (p. ej. la relación entre ambos) El producto R se obtiene de acuerdo a la reacción: A + B R r R = k 1 C A C B Sin embargo, en las condiciones que favorecen esta reacción, B también se dimeriza para formar el producto no desado S: 2B S r S = k 2 C B 2 En un reactor de mezcla completa se está obteniendo R utilizando un gran exceso de A para deprimir la formación del producto no deseado (relación molar 40 a 1). La sustancia A que no ha reaccionado se separa del resto de la corriente de salida y vuelve a entrar al reactor. R y S se obtienen en cantidades equimolares y el 50% del reactante B que ha entrado al reactor no ha reaccionado y se descarga sin utilizar. a) Calcúlese el rendimiento fraccional de R, tomando como base el A consumido, el B consumido, el B total que entra y la suma de los productos formados.
9 b) Para aumentar la utilización de B se conecta un segundo reactor del mismo tamaño en serie, manteniendo las mismas condiciones que en el primer reactor. La separación y recirculación de A tiene lugar después de pasar el fluido a través de los dos reactores. Se puede suponer que la concentración de A es constante en todo el sistema debido a su gran exceso. Calcúlese la fracción de R que está presente en el producto y la fracción de B consumida. c) Con el mismo caudal de alimentación de B y la misma concentración de A en el sistema, repítase el apartado b) si los dos reactores de mezcla completa se conectan en paralelo en lugar de en serie Considérese la producción de meta-xileno por hidrodesalquilación del mesitileno sobre un catalizador: M + H 2 X + CH 4 r M = k 1 C M C H2 1/2 El meta-xileno también reacciona para formar tolueno según: X + H 2 T + CH 4 r T = k 2 C X C H2 1/2 pero esta última reacción no es deseada dado que el tolueno se vende en el mercado a un precio cuatro veces menor que el meta-xileno. A 1500 R las constantes de reacción (que ya incluyen la densidad del catalizador) son: k 1 = (ft 3 /lbmol) 1/2 /h k 2 = (ft 3 /lbmol) 1/2 /h Se desea producir meta-xileno en un reactor de lecho empacado (asimilable a RTFP) trabajando isotérmicamente a 1500 R y 35 atm (constante) con una alimentación compuesta por 66.6% molar de hidrógeno y 33.3% molar de mesitileno. Determinar el τ del reactor para lograr la concentración máxima del producto deseado Se trata el reactante A en un reactor de mezcla completa de 20 L, descomponiéndose del modo siguiente: A R A S r R = (4/h)C A r S = (1/h)C A Calcúlese el caudal de alimentación y la conversión del reactante para que el beneficio global por hora sea máximo y calcularlo. Datos: A cuesta 75 $/mol para C Ao = 1 mol/l; R se vende a 375 $/mol y S no tiene valor. El costo total de funcionamiento del reactor y el de la instalación para separar los productos es de 1800 $/h + 95 $/mol de A que entra al reactor. El A no convertido no se recircula Cuando A (ácido bencilsulfónico, PM = 158) reacciona con B (ácido nítrico, PM = 63) se forman R, S y T (orto, meta y paranitrobencensulfónico, PM = 203) según las reacciones elementales:
10 A + B R A + B S A + B T Durante un test de nitración en el laboratorio donde A y B son mezclados en una relación molar de 2 a 1 en presencia de un agente deshidratante, 1/3 de A es consumido en 40 minutos produciendo 21% de R, 72% de S y 7% de T. Calcular la composición de la mezcla luego de 90 minutos en la producción llevada a cabo en escala comercial con una mezcla de 3160 lb de A con 1260 lb de B en idénticas condiciones a las del laboratorio (igual concentración de A en ambos casos) En un proceso donde R es el producto deseado se llevan a cabo las siguientes reacciones en fase líquida: A R r 1 = k 1 C A A S 2 r 2 = k 2 C A R T r 3 = k 3 C R Hasta el momento se ha trabajado con un RCAI de 200 L, una alimentación que contiene unicamente A y un caudal fijo de entrada de 50 L/h en dos condiciones de concentración, obteniéndose los resultados que se indican a continuación (concentración expresada en mol/l): C Ao C A C R A los efectos de que la separación del producto sea rentable se requiere un rendimiento fraccional de R respecto a A consumido de al menos 65%. Hallar C Ao y la producción de R para estas condiciones. El caudal de alimentación se mantiene en 50 L/h. k k La reacción A 1 R 2 S se realiza en un RCAI de 0.8 m 3 donde se recicla la corriente de salida manteniendo el tiempo de estadía hidráulico en el reactor en 200 segundos. k 1 = 5.1*10-3 s -1 ; k 2 = 3.2*10-3 s -1 ; las concentraciones en la alimentación al sistema son 1.65 kmol/m 3 de A, 0.12 kmol/m 3 de S y nada de R. a) Cuál es la relación de reciclo que hace máxima la concentración de R a la salida? b) Cuáles son los valores de C A, C R y C S a la salida en esas condiciones? c) Qué pasa con la concentración de R a la salida si se duplica la concentración inicial de A? d) Si se duplica el caudal de entrada al sistema y se mantiene la misma relación de reciclo y concentración a la entrada que en a), cuánto aumenta la producción de R? Se quiere obtener el producto P de la reacción de A con B en fase líquida, que también reaccionan para dar el producto no deseado S. En un reactor discontinuo se hicieron los siguientes experimentos: i) Se mezclaron cantidades equimolares de A y B y se mantuvo el reactor isotérmico. En tres pruebas a distintas temperaturas, luego de cierto tiempo t se analizó el contenido del reactor y se encontró P y S en distintas proporciones.
11 ii) En dos pruebas hechas a igual temperatura pero con distinta cantidad inicial de B se obtuvo: C Ao (mol/l) C Bo (mol/l) y t=0 (P/S) r So (mol/l.s) * iii) En una segunda experiencia realizada a igual temperatura que la anterior se obtuvo: C Ao (mol/l) C Bo (mol/l) y t=0 (P/S) r So (mol/l.s) * * * *10-5 Se piensa procesar la mezcla de dos corrientes de A y B de 0.5 m 3 /h cada una en un RCA con concentraciones iguales de 20 kmol/m 3 cada una. Qué volumen de reactor es necesario para lograr que la producción de P sea máxima? Cuál es la conversión correspondiente a esa producción? A y B reaccionan en fase líquida para dar R, S y T siendo las constantes de reacción respectivas k 1, k 2 y k 3. A + B R A + B S A + B T El producto S es el deseado. Se sabe que a T = 295K, k 1 = 1, k 2 = 4.5 y k 3 = 6.5 h -1 kmol - 1 m 3, y a T = 378K, k 1 = 2.1, k 2 = 6.8 y k 3 = 9.2 h -1 kmol -1 m 3. a) A 295K, Con qué tipo de reactor (RCAI o RTFP) se obtiene mayor selectividad global? b) A qué temperatrua se obtiene máxima selectividad? Las constantes siguen la ecuación de Arrhenius. c) Si se dispone de un RCAI de 0.5 m 3 y de un separador que permite reusar A y B reciclándolos con un caudal volumétrico de 2/3 del que entra al separador, qué conversión de A (respecto a la entrada del reactor) minimizará el costo de S en las condiciones de máxima selectividad, cuál es dicho costo y cuál debe ser la velocidad de alimentación de A? Datos: C Ao = C Bo = 8*10-2 kmol/m 3 ; costo de A = 68 $/kmol, costo de B = 14 $/kmol; costo del RCAI = 3.8*10-3 $/m 3.h; costo del separador = 30 $/kmol de A separado. La eficiencia del separador es de 100% en A y en B.
12 EJERCICIOS COMPLEMENTARIOS En una planta industrial se lleva a cabo el siguiente proceso en fase líquida: v, C J0 (J puro) v, C L0 = C JO (L puro) X L V (RCAI) V (RCAI) La reacción química que se lleva a cabo en el sistema, está dada por lo siguiente: L + J Z C r = k. C J L El valor obtenido para X L en la actualidad es muy alto, y se desea reducir. Con motivo de ello el Ingeniero de Procesos de la Planta propone efectuar la siguiente modificación en el sistema. v, C J0 (J puro) v, C L0 = C J0 (L puro) v/2 v/2 X L Se pide: V (RCAI) V (RCAI) a) Demostrar de forma teórica que el nuevo esquema propuesto es capaz de reducir la conversión final del reactivo L (X L < X L ). b) Si se dispone de los siguientes datos: v = 20 m 3 /h C L0 = C J0 = 10 Mol/L V = 100 m 3 X L = 1 Calcular la conversión final para el nuevo esquema propuesto (X L ).
13 1.49. La reacción A + B 2P en fase gaseosa se ensaya en un reactor discontinuo. En la experiencia se parte de cantidades equimoleculares de A y B, y con una P T0 de 2 atm. La experiencia se realizó a 100 ºC y los valores obtenidos por el departamento de análisis se detallan en la siguiente tabla: t(min) P P (atm) 0 0, , , , , ,63 En la planta se realizará la fabricación de P a 150 ºC, temperatura a la cual la reacción da un producto no deseado C (A + B 2C). En bibliografía se encuentra que la E a para la reacción de producción de P es de 5000 cal/mol; y que la reacción de descomposición se puede modelar con una k de valor min -1 a 150ºC. En la planta Ud. tiene un RCAI de 1 m 3 y le proponen comprar un RTFPI para utilizar adicionalmente en el proceso. Se trabaja en condiciones de equimolecularidad con una P T de 2 atm y un caudal volumétrico de entrada de 1 m 3 /h. Se pide: Sabiendo que la Gerencia de Calidad le solicita una conversión de A a la salida del 95%, diseñar la disposición en serie que le permita maximizar la producción de P. Cual es la producción obtenida de P en estas condiciones? En una planta se lleva a cabo la siguiente reacción en fase líquida: A S, de la cual se desconoce su cinética. Con motivo de lo anterior, se diseña una experiencia en batch de la cual se obtienen los siguientes datos: Tiempo (min.) C A (mol/l) 0 10,0 1 6,07 2 3,68 3 2,23 4 1,35 5 0,82 La temperatura durante la experiencia se mantuvo constante e igual a 25 C. Se pide: a) Hallar la expresión cinética de la reacción A S. b) Se quiere llevar adelante dicha reacción en un RCAI a escala industrial a una temperatura de 25 C (constante). Por las características de la materia prima de
14 la cual se parte, se conoce que adicionalmente se desarrollarán las siguientes reacciones parásitas no deseadas. A R r R = k R k R = 0.05 mol.l -1.min -1 a T = 25 C A T r T = k T.C A 2 k T = 0.1 L.mol -1.min -1 a T = 25 C Que volumen de reactor se necesita para que el rendimiento fraccional de S respecto de A sea máximo? Datos: - Caudal a Procesar: 50 L/min. - C A0 : 10 mol.l Un RTFP isotérmico de 10 L trata una corriente líquida de A de concentración 0.1 mol/l, ocurriendo las siguientes reacciones: A R r R = k 1 C A 2A S r S = k 2 C A 2 El producto deseado es R. a) Se tiene la posibilidad de trabajar a altas o bajas temperaturas. Discutir cómo elegiría la temperatura de operación y por qué. b) A la temperatura elegida, k 1 = 0.10 min -1 y k 2 = 2.0 L/mol.min cuál es el caudal de alimentación v o que hace óptima la ganancia neta por unidad de volumen tratado? Datos adicionales: Precio de venta de R: $ 100 / mol de R. Costos de operación: $ 5 / mol de A que entra al reactor. Costos de separación de S: $ 50 / mol de S. c) Discuta alternativas de operación para mejorar la selectividad de R respecto a S.
Operaciones Básicas de Transferencia de Materia Problemas Tema 6
 1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
C: GASES Y PRESIÓN DE VAPOR DEL AGUA
 hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
TEMA 3: CINÉTICA HOMOGÉNEA. REACCIONES SIMPLES CQA-3/1
 TEMA 3: CINÉTICA HOMOGÉNEA. REACCIONES SIMPLES CQA-3/1 CARACTERÍSTICAS DE LAS REACCIONES HOMOGÉNEAS Todas las sustancias reaccionantes se encuentran en una sola fase Velocidad de reacción: Objetivo principal
TEMA 3: CINÉTICA HOMOGÉNEA. REACCIONES SIMPLES CQA-3/1 CARACTERÍSTICAS DE LAS REACCIONES HOMOGÉNEAS Todas las sustancias reaccionantes se encuentran en una sola fase Velocidad de reacción: Objetivo principal
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
de aire. Determinar la composicion de la mezcla resultante. Cuál es el porcentaje en exceso de aire, suponiendo conversion completa?
 C A P Í T U L O 2 Dada la importancia que tienen los procesos de combustión en la generación de contaminantes, en este capítulo se han incluido algunos ejercicios relacionados con la combustión estequiométrica.
C A P Í T U L O 2 Dada la importancia que tienen los procesos de combustión en la generación de contaminantes, en este capítulo se han incluido algunos ejercicios relacionados con la combustión estequiométrica.
TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos
 TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos ÍNDICE 1. Ecuaciones (reacciones) químicas 2. Cálculos estequiométricos. Reactivo limitante y reacciones consecutivas 3. Pureza de un reactivo 4. Rendimiento
TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos ÍNDICE 1. Ecuaciones (reacciones) químicas 2. Cálculos estequiométricos. Reactivo limitante y reacciones consecutivas 3. Pureza de un reactivo 4. Rendimiento
Universidad Tecnológica Nacional Facultad Regional Rosario Cátedra de Ing. De las Reacciones
 Universidad Tecnológica acional Facultad Regional Rosario Cátedra de Ing. e las Reacciones PRCTIC UI RECTORES IELES 01 Ing. Roque Masciarelli - Ing Silvia Stancich - Ing. Stoppani Fernando 1. Un reactor
Universidad Tecnológica acional Facultad Regional Rosario Cátedra de Ing. e las Reacciones PRCTIC UI RECTORES IELES 01 Ing. Roque Masciarelli - Ing Silvia Stancich - Ing. Stoppani Fernando 1. Un reactor
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1)
 PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
Respuesta: a) La fracción molar de NaCl es 0,072 b) La concentración másica volumétrica de NaCl es 0,231 g/cc
 Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
GUÍA N 3: Equilibrio Químico y Cinética Química
 1 PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los siguientes términos: a) Reacción irreversible b) Reacción reversible c) Equilibrio químico d) Constante de equilibrio e) Principio de Le Chatelier
1 PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los siguientes términos: a) Reacción irreversible b) Reacción reversible c) Equilibrio químico d) Constante de equilibrio e) Principio de Le Chatelier
EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES
 Preuniversitario Liceo de Aplicación Química 4º 2010 Profesora Paola Lizama V. GUÍA 4: DISOLUCIONES EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES 01.- Calcular la cantidad de sosa cáustica (NaOH) y de agua que
Preuniversitario Liceo de Aplicación Química 4º 2010 Profesora Paola Lizama V. GUÍA 4: DISOLUCIONES EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES 01.- Calcular la cantidad de sosa cáustica (NaOH) y de agua que
Física y Química 1ºBachillerato Ejemplo Examen. Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Ioduro de Calcio:
 Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2009 PRIMERA PARTE
 1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
Las sustancias reaccionan entre sí. REACCIÓN QUÍMICA: proceso en el cual una o varias sustancias cambian para formar sustancias nuevas
 Las sustancias reaccionan entre sí. REACCIÓN QUÍMICA: proceso en el cual una o varias sustancias cambian para formar sustancias nuevas LEY DE LAVOISIER: Los átomos no se crean ni se destruyen durante cualquier
Las sustancias reaccionan entre sí. REACCIÓN QUÍMICA: proceso en el cual una o varias sustancias cambian para formar sustancias nuevas LEY DE LAVOISIER: Los átomos no se crean ni se destruyen durante cualquier
TEMA 4: CINÉTICA HOMOGÉNEA: REACCIONES MÚLTIPLES Y CATALIZADAS CQA-4/1
 TEMA 4: CINÉTICA HOMOGÉNEA: REACCIONES MÚLTIPLES Y CATALIZADAS CQA-4/1 CINÉTICA DE REACCIONES MÚLTIPLES Reacciones múltiples : Reacciones con más de una ecuación cinética que describe su comportamiento.
TEMA 4: CINÉTICA HOMOGÉNEA: REACCIONES MÚLTIPLES Y CATALIZADAS CQA-4/1 CINÉTICA DE REACCIONES MÚLTIPLES Reacciones múltiples : Reacciones con más de una ecuación cinética que describe su comportamiento.
Ecuaciones diferenciales de primer orden: Aplicaciones a la Ingeniería Química
 Lección 7 Ecuaciones diferenciales de primer orden: Aplicaciones a la Ingeniería Química 1 Ecuaciones Diferenciales en Cinética Química Ecuación estequiométrica: o a A b B = p P q Q 0 = a A b B... p P
Lección 7 Ecuaciones diferenciales de primer orden: Aplicaciones a la Ingeniería Química 1 Ecuaciones Diferenciales en Cinética Química Ecuación estequiométrica: o a A b B = p P q Q 0 = a A b B... p P
Sustancias puras, procesos de cambios de fase, diagramas de fase. Estado 3 Estado 4 Estado 5. P =1 atm T= 100 o C. Estado 3 Estado 4.
 TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4
 Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
MAGNITUDES MOLARES COMPOSICIÓN DE LAS DISOLUCIONES. Actividad 7. Actividad 1. Actividad 8. Actividad 2. Actividad 9. Actividad 3.
 MAGNITUDES MOLARES {Respuesta: [a] 0, mol; [b] 0,82 mol; [c] 0,56 mol} Actividad [a] En qué se parecen y en qué se diferencian las siguientes magnitudes: masa molecular relativa y masa molar? [b] Calcula
MAGNITUDES MOLARES {Respuesta: [a] 0, mol; [b] 0,82 mol; [c] 0,56 mol} Actividad [a] En qué se parecen y en qué se diferencian las siguientes magnitudes: masa molecular relativa y masa molar? [b] Calcula
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Estequiometría (II)
 1(7) Ejercicio nº 1 El metano arde con oxígeno produciendo dióxido de carbono y agua. Si se queman 2 kg de metano calcula: a) Los gramos de oxígeno necesarios. b) Los gramos de dióxido de carbono producidos.
1(7) Ejercicio nº 1 El metano arde con oxígeno produciendo dióxido de carbono y agua. Si se queman 2 kg de metano calcula: a) Los gramos de oxígeno necesarios. b) Los gramos de dióxido de carbono producidos.
Destilación - Método del polo de operación II. Problemas. Problemas de Operaciones Unitarias II Ingeniería Química 1
 Destilación - Método del polo de operación II Problemas PROBLEMA 1. A una columna de agotamiento como la indicada en la figura, ingresa una mezcla etanol/agua en su punto de burbuja, de composición 50
Destilación - Método del polo de operación II Problemas PROBLEMA 1. A una columna de agotamiento como la indicada en la figura, ingresa una mezcla etanol/agua en su punto de burbuja, de composición 50
SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA
 I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
HOJA DE PROBLEMAS 1: ENUNCIADOS
 Tema: DISOLUCIONES HOJA DE PROBLEMAS 1: ENUNCIADOS 1. ( ) Una disolución acuosa de AgNO 3 con una composición del 12 % en peso tiene una densidad de 1.1080 g/cm 3 a 20 C y 1 atm. Calcule la fracción molar,
Tema: DISOLUCIONES HOJA DE PROBLEMAS 1: ENUNCIADOS 1. ( ) Una disolución acuosa de AgNO 3 con una composición del 12 % en peso tiene una densidad de 1.1080 g/cm 3 a 20 C y 1 atm. Calcule la fracción molar,
REACCIONES DE TRANSFERENCIA DE ELECTRONES 2ºBACH
 1. Ajusta las siguientes reacciones redox, utilizando el método del ion electrón: a) HNO 3 + Cu Cu(NO 3 ) 2 + NO 2 + H 2 O b) K 2 Cr 2 O 7 +HI + HClO 4 Cr(ClO 4 ) 3 +I 2 +KClO 4 + H 2 O c) H 2 SO 4 + HI
1. Ajusta las siguientes reacciones redox, utilizando el método del ion electrón: a) HNO 3 + Cu Cu(NO 3 ) 2 + NO 2 + H 2 O b) K 2 Cr 2 O 7 +HI + HClO 4 Cr(ClO 4 ) 3 +I 2 +KClO 4 + H 2 O c) H 2 SO 4 + HI
ANDALUCÍA / JUNIO 2000 LOGSE / QUÍMICA / OPCIÓN A /EXAMEN COMPLETO OPCIÓN A
 OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
Química 2º Bach. Recuperación 1ª Evaluación 13/01/05
 Química º Bach. Recuperación 1ª Evaluación 13/1/5 DEPARTAMENT DE FÍSIA E QUÍMIA Nombre: 1. alcula a partir de qué temperatura será espontánea la reacción de descomposición del tetraóxido de dinitrógeno
Química º Bach. Recuperación 1ª Evaluación 13/1/5 DEPARTAMENT DE FÍSIA E QUÍMIA Nombre: 1. alcula a partir de qué temperatura será espontánea la reacción de descomposición del tetraóxido de dinitrógeno
11. REACTOR DE CONVERSION
 11. REACTOR DE CONVERSION 1. OBJETIVOS 1. Simular, en estado estacionario un reactor de conversión 2. Relacionar dos variables mediante la opción Set de HYSYS 3. Verificar los resultados obtenidos por
11. REACTOR DE CONVERSION 1. OBJETIVOS 1. Simular, en estado estacionario un reactor de conversión 2. Relacionar dos variables mediante la opción Set de HYSYS 3. Verificar los resultados obtenidos por
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
Titulaciones en Química Analítica. Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D.
 Titulaciones en Química Analítica Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D. Introducción En el análisis volumétrico, la concentración se determina midiendo su capacidad de reaccionar con un reactivo
Titulaciones en Química Analítica Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D. Introducción En el análisis volumétrico, la concentración se determina midiendo su capacidad de reaccionar con un reactivo
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
Ingeniería de las Reacciones Químicas 2 2010
 REACTORES CATALÍTICOS Problema 1 Un catalizador para reacciones de hidrogenación se prepara mediante la inmersión de partículas de alúmina (tamaño 100-150 mesh) en una solución acuosa de NiO 3. Después
REACTORES CATALÍTICOS Problema 1 Un catalizador para reacciones de hidrogenación se prepara mediante la inmersión de partículas de alúmina (tamaño 100-150 mesh) en una solución acuosa de NiO 3. Después
TEMA 2: LEYES Y CONCEPTOS BÁSICOS EN QUÍMICA
 1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Química
 Equilibrio Químico Programa de Acceso Inclusivo, Equidad y Permanencia RECUERDA QUE: el Equilibrio Químico, se presenta cuando reacciones opuestas ocurren a velocidades iguales. La velocidad a la que se
Equilibrio Químico Programa de Acceso Inclusivo, Equidad y Permanencia RECUERDA QUE: el Equilibrio Químico, se presenta cuando reacciones opuestas ocurren a velocidades iguales. La velocidad a la que se
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
Problemas de Estequiometría (ampliación) Pág. Nº 1
 Problemas de Estequiometría (ampliación) Pág. Nº 1 MOLES, MOLÉCULAS Y ÁTOMOS: 1.- Calcular la masa de agua que contienen 0,23 moles de agua. Sol: 4,14 g 2.- Calcular la masa de una molécula de agua. Sol:
Problemas de Estequiometría (ampliación) Pág. Nº 1 MOLES, MOLÉCULAS Y ÁTOMOS: 1.- Calcular la masa de agua que contienen 0,23 moles de agua. Sol: 4,14 g 2.- Calcular la masa de una molécula de agua. Sol:
Acuerdo 286. Química. Disoluciones. Recopiló: M.C. Macaria Hernández Chávez
 Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
ACTIVIDADES DE QUÍMICA. TERCERA EVALUACIÓN 1º BACHILLERATO
 ACTIVIDADES DE QUÍMICA. TERCERA EVALUACIÓN 1º BACHILLERATO Profesor: Féli Muñoz Escribe adecuadamente las ecuaciones químicas correspondientes a las reacciones químicas siguientes: a) En el proceso que
ACTIVIDADES DE QUÍMICA. TERCERA EVALUACIÓN 1º BACHILLERATO Profesor: Féli Muñoz Escribe adecuadamente las ecuaciones químicas correspondientes a las reacciones químicas siguientes: a) En el proceso que
LA MATERIA: ESTADOS DE AGREGACIÓN
 LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
EJERCICIOS RESUELTOS DISOLUCIONES
 EJERIIOS RESUELTOS DISOLUIONES 1.- Se disuelven 20 g de NaOH en 560 g de agua. alcula a) la concentración de la en % en masa y b) su molalidad. Ar(Na) 2. Ar(O)16. Ar(H)1. NaOH 20 a) % NaOH.100 % NaOH.100
EJERIIOS RESUELTOS DISOLUIONES 1.- Se disuelven 20 g de NaOH en 560 g de agua. alcula a) la concentración de la en % en masa y b) su molalidad. Ar(Na) 2. Ar(O)16. Ar(H)1. NaOH 20 a) % NaOH.100 % NaOH.100
CAMBIOS QUÍMICOS ACTIVIDADES DE REFUERZO ACTIVIDADES FICHA 1
 FICHA 1 DE REFUERZO 1. Escribe la fórmula y calcula la masa mo lecular de las siguientes sustancias: a) Dióxido de azufre. b) Hidruro de potasio. c) Ácido sulfúrico. d) Cloruro de berilio. 2. En un laboratorio
FICHA 1 DE REFUERZO 1. Escribe la fórmula y calcula la masa mo lecular de las siguientes sustancias: a) Dióxido de azufre. b) Hidruro de potasio. c) Ácido sulfúrico. d) Cloruro de berilio. 2. En un laboratorio
EJEMPLOS DE PREGUNTA. Prueba de QUÍMICA. febrero 2010
 EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
Capítulo 10. Efectos de superficie. Sistema respiratorio
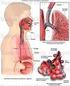 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
CLASE Nº 2 ESTEQUIOMETRÍA
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
Química. Equilibrio ácido-base Nombre:
 Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción A Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción A Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 5 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 5 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio
Problemas del Tema 1. Estequiometria
 Problemas del Tema 1. Estequiometria Esta guía práctica es un material didáctico en construcción, destinada para estudiantes de la asignatura de Química General de la Facultad de Farmacia y Bioanálisis.
Problemas del Tema 1. Estequiometria Esta guía práctica es un material didáctico en construcción, destinada para estudiantes de la asignatura de Química General de la Facultad de Farmacia y Bioanálisis.
Determinar de forma cuantitativa el calor que se absorbe o desprende en una reacción de neutralización en medio acuoso -NaOH+HCl- que evoluciona a
 Determinar de forma cuantitativa el calor que se absorbe o desprende en una reacción de neutralización en medio acuoso -NaOH+HCl- que evoluciona a presión constante, interpretando los resultados obtenidos
Determinar de forma cuantitativa el calor que se absorbe o desprende en una reacción de neutralización en medio acuoso -NaOH+HCl- que evoluciona a presión constante, interpretando los resultados obtenidos
Equilibrio químico. Cajón de Ciencias. Reacciones reversibles e irreversibles
 Equilibrio químico Cajón de Ciencias Reacciones reversibles e irreversibles Hasta ahora, todas las reacciones químicas con las que has trabajado han sido reacciones irreversibles, lo que quiere decir que
Equilibrio químico Cajón de Ciencias Reacciones reversibles e irreversibles Hasta ahora, todas las reacciones químicas con las que has trabajado han sido reacciones irreversibles, lo que quiere decir que
GUIA DE PROBLEMAS. Velocidad de aproximación al equilibrio = kr(c-ceq)
 GUIA DE PROBLEMAS 1. La conversión de hidrógeno molecular de la forma orto a la forma para es catalizada por NiO. Se dipone de un catalizador soportado con un área específica de 305 m 2 /g y un volumen
GUIA DE PROBLEMAS 1. La conversión de hidrógeno molecular de la forma orto a la forma para es catalizada por NiO. Se dipone de un catalizador soportado con un área específica de 305 m 2 /g y un volumen
Clasificación de la materia hasta el nivel atómico
 1. Estequiometría Clasificación de la materia hasta el nivel atómico Materia puede separarse por un proceso físico? SÍ NO Mezcla es homogénea? Sustancia puede descomponerse por un proceso químico? SÍ NO
1. Estequiometría Clasificación de la materia hasta el nivel atómico Materia puede separarse por un proceso físico? SÍ NO Mezcla es homogénea? Sustancia puede descomponerse por un proceso químico? SÍ NO
INGENIERO. JOSMERY SÁNCHEZ
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
TEMA I: REACCIONES Y ESTEQUIOMETRIA
 TEMA I: REACCIONES Y ESTEQUIOMETRIA 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano que quedan. c) Los gramos
TEMA I: REACCIONES Y ESTEQUIOMETRIA 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano que quedan. c) Los gramos
JUNIO FASE GENERAL QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA
 TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA OBJETIVOS Determinación de la variación de entalpía asociada a procesos químicos. Aplicación de conceptos termodinámicos: temperatura, calor, entalpía. Verificación
TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA OBJETIVOS Determinación de la variación de entalpía asociada a procesos químicos. Aplicación de conceptos termodinámicos: temperatura, calor, entalpía. Verificación
Diseño de un Reactor de Flujo de Pistón (PFR)
 Diseño de un Reactor de Flujo de Pistón (PFR) Definición del problema El siguiente problema de diseño de reactor se ha tomado de Fogler [1], pág. 149, ejemplo 4-4: Determine el volumen del reactor de flujo
Diseño de un Reactor de Flujo de Pistón (PFR) Definición del problema El siguiente problema de diseño de reactor se ha tomado de Fogler [1], pág. 149, ejemplo 4-4: Determine el volumen del reactor de flujo
ESPECIFICACIÓN DE LOS ÍTEMES DE PRUEBA
 Técnicas de Panadería Alimentación Química ESPECIFICACIÓN DE LOS ÍTEMES DE PRUEBA Aprendizaje Esperado Establecer relaciones cuantitativas en diversas reacciones químicas 1. Juan, debe diseñar un programa
Técnicas de Panadería Alimentación Química ESPECIFICACIÓN DE LOS ÍTEMES DE PRUEBA Aprendizaje Esperado Establecer relaciones cuantitativas en diversas reacciones químicas 1. Juan, debe diseñar un programa
M A R I A N O B A Q U E R O DPTO. DE FÍSICA Y QUÍMICA EJERCICIOS RESUELTOS
 I E S M A R I A N O B A Q U E R O DPTO. DE FÍSICA Y QUÍMICA EJERCICIOS RESUELTOS Índice general 1. El átomo y el enlace 6 2. Leyes básicas de la Química 9 b1fq-res-atomo.tex 1. El átomo y el enlace Unidad
I E S M A R I A N O B A Q U E R O DPTO. DE FÍSICA Y QUÍMICA EJERCICIOS RESUELTOS Índice general 1. El átomo y el enlace 6 2. Leyes básicas de la Química 9 b1fq-res-atomo.tex 1. El átomo y el enlace Unidad
UNIDAD 2. CINÉTICA QUÍMICA
 UNIDAD 2. CINÉTICA QUÍMICA Introducción. Velocidad de reacción Cómo se producen las reacciones químicas Ecuación de la velocidad de reacción Factores que afectan a la velocidad de reacción Mecanismo de
UNIDAD 2. CINÉTICA QUÍMICA Introducción. Velocidad de reacción Cómo se producen las reacciones químicas Ecuación de la velocidad de reacción Factores que afectan a la velocidad de reacción Mecanismo de
Datos ELV, Fracciones molares de n-c 6 H 14, 1 atm x (líquido) 0,0 0,1 0,3 0,5 0,55 0,7 1,0 y (vapor) 0,0 0,36 0,70 0,85 0,90 0,95 1,0 Sigue
 Método del polo de operación (I) - Destilación Problemas PROBLEMA 1*. Cierta cantidad de una mezcla de vapor de alcohol etílico y agua, 50 % molar, a una temperatura de 190 ºF, se enfría hasta su punto
Método del polo de operación (I) - Destilación Problemas PROBLEMA 1*. Cierta cantidad de una mezcla de vapor de alcohol etílico y agua, 50 % molar, a una temperatura de 190 ºF, se enfría hasta su punto
Seminario de Química 2º Bachillerato LOGSE Unidad 0: Repaso Química 1º Bachillerato
 A) Composición Centesimal y Fórmulas químicas 1.- Determina la composición centesimal del Ca3(PO4)2. Datos: Masas atómicas (g/mol): Ca=40; P=31; O=16 S: Ca= 38,7%; P=20%; O=41,3% 2.- Determina la composición
A) Composición Centesimal y Fórmulas químicas 1.- Determina la composición centesimal del Ca3(PO4)2. Datos: Masas atómicas (g/mol): Ca=40; P=31; O=16 S: Ca= 38,7%; P=20%; O=41,3% 2.- Determina la composición
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
ESTEQUIOMETRÍA. cobre(ii) y se descompone, cuántas moles de dióxido de nitrógeno se formarán? A moles B moles C moles D. 0.
 ESTEQUIOMETRÍA 1 Al calentarse fuertemente, el nitrato de cobre(ii) se descompone en óxido de cobre(ii), dióxido de nitrógeno y oxígeno elemental (O 2 ). Si calentamos 0.10 moles de nitrato de cobre(ii)
ESTEQUIOMETRÍA 1 Al calentarse fuertemente, el nitrato de cobre(ii) se descompone en óxido de cobre(ii), dióxido de nitrógeno y oxígeno elemental (O 2 ). Si calentamos 0.10 moles de nitrato de cobre(ii)
Materiales recopilados por la Ponencia Provincial de Química para Selectividad TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
Departamento de Química Inorgánica e Ingeniería Química. Área de Ingeniería Química REACTORES QUÍMICOS PROBLEMAS CURSO 2010/11
 Departamento de Química Inorgánica e Ingeniería Química. Área de Ingeniería Química REACTORES QUÍMICOS PROBLEMAS CURSO 2010/11 1 PROBLEMAS DE CINÉTICA C1- Un motor cohete quema una mezcla estequiométrica
Departamento de Química Inorgánica e Ingeniería Química. Área de Ingeniería Química REACTORES QUÍMICOS PROBLEMAS CURSO 2010/11 1 PROBLEMAS DE CINÉTICA C1- Un motor cohete quema una mezcla estequiométrica
EJERCICIOS RESUELTOS DISOLUCIONES
 EJERCICIOS RESUELTOS DISOLUCIONES 1- Se disuelven 20 g de NaOH en 560 g de agua Calcula a) la concentración de la en % en masa b) su molalidad Ar(Na) 2 Ar(O)16 Ar(H)1 NaOH 20 a) % NaOH % NaOH % NaOH,45
EJERCICIOS RESUELTOS DISOLUCIONES 1- Se disuelven 20 g de NaOH en 560 g de agua Calcula a) la concentración de la en % en masa b) su molalidad Ar(Na) 2 Ar(O)16 Ar(H)1 NaOH 20 a) % NaOH % NaOH % NaOH,45
LAS REACCIONES QUÍMICAS.
 1 Ajustes de reacciones químicas. LAS REACCIONES QUÍMICAS. Ejercicios de la unidad 8 1.- Ajusta por tanteo las siguientes reacciones químicas: a) C 3 H 8 + O CO + H O; b) Na + H O NaOH + H ; c) KOH + H
1 Ajustes de reacciones químicas. LAS REACCIONES QUÍMICAS. Ejercicios de la unidad 8 1.- Ajusta por tanteo las siguientes reacciones químicas: a) C 3 H 8 + O CO + H O; b) Na + H O NaOH + H ; c) KOH + H
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº6
 CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº6 TEMA: PROPIEDADES COLIGATIVAS OBJETIVOS: Aplicar las propiedades coligativas para el cálculo de masas molares de solutos y de las propiedades físicas de las soluciones.
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº6 TEMA: PROPIEDADES COLIGATIVAS OBJETIVOS: Aplicar las propiedades coligativas para el cálculo de masas molares de solutos y de las propiedades físicas de las soluciones.
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2008 PRIMERA PARTE
 1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
Disoluciones. AUTHOR: VICENTE GUZMÁN BROTÓNS
 Disoluciones AUTHOR: VICENTE GUZMÁN BROTÓNS http://bencenoanhidro.blogspot.com Disoluciones AUTHOR: VICENTE GUZMÁN BROTÓNS http://bencenoanhidro.blogspot.com Problemas de disoluciones 1. Calcula la concentración
Disoluciones AUTHOR: VICENTE GUZMÁN BROTÓNS http://bencenoanhidro.blogspot.com Disoluciones AUTHOR: VICENTE GUZMÁN BROTÓNS http://bencenoanhidro.blogspot.com Problemas de disoluciones 1. Calcula la concentración
Problemas disoluciones
 Problemas disoluciones Determinar la concentración de una disolución expresada de diferentes formas: g/l, % en masa y en volumen, Molaridad y fracción molar Preparar disoluciones a partir de solutos sólidos
Problemas disoluciones Determinar la concentración de una disolución expresada de diferentes formas: g/l, % en masa y en volumen, Molaridad y fracción molar Preparar disoluciones a partir de solutos sólidos
PRACTICA No.9 REACCIONES QUIMICAS I
 PRACTICA No.9 REACCIONES QUIMICAS I INTRODUCCION: Las transformaciones de la materia se conocen como REACCIONES QUIMICAS. En ellas se opera un cambio en la estructura íntima de las sustancias reaccionantes
PRACTICA No.9 REACCIONES QUIMICAS I INTRODUCCION: Las transformaciones de la materia se conocen como REACCIONES QUIMICAS. En ellas se opera un cambio en la estructura íntima de las sustancias reaccionantes
Prácticas de Laboratorio de Hidráulica
 Universidad Politécnica de Madrid E.T.S. Ingenieros de Caminos, Canales y Puertos Prácticas de Laboratorio de Hidráulica Jaime García Palacios Francisco V. Laguna Peñuelas 2010 Índice general 3. Venturi
Universidad Politécnica de Madrid E.T.S. Ingenieros de Caminos, Canales y Puertos Prácticas de Laboratorio de Hidráulica Jaime García Palacios Francisco V. Laguna Peñuelas 2010 Índice general 3. Venturi
TERMOQUÍMICA. Química General e Inorgánica Licenciatura en Ciencias Biológicas Profesorado en Biología Analista Biológico
 Química General e Inorgánica Licenciatura en Ciencias Biológicas Profesorado en Biología Analista Biológico TERMOQUÍMICA La termoquímica es la aplicación de la Primera Ley de la Termodinámica al estudio
Química General e Inorgánica Licenciatura en Ciencias Biológicas Profesorado en Biología Analista Biológico TERMOQUÍMICA La termoquímica es la aplicación de la Primera Ley de la Termodinámica al estudio
Ejercicios 3 (Soluciones) 2) Determinar el peso de 400 ml de ácido clorhídrico cuya densidad es de 1,16 g/ml R: 464 g
 Profesor Bernardo Leal Química %p/p; %v/v, %p/v y densidad: Ejercicios 3 (Soluciones) 1) Cuantos gramos de azúcar deben ser diluidas en 140 g de agua para que la solución resultante tenga una concentración
Profesor Bernardo Leal Química %p/p; %v/v, %p/v y densidad: Ejercicios 3 (Soluciones) 1) Cuantos gramos de azúcar deben ser diluidas en 140 g de agua para que la solución resultante tenga una concentración
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio 6, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio 6, Opción B
6.2.- Reacciones de oxidación reducción
 350 Reacciones de transferencia de electrones 6.2.- Reacciones de oxidación reducción Aspectos teóricos: Valoraciones redox 6.2.1. Valoraciones redox. Equivalentes de oxidación-reducción Las reacciones
350 Reacciones de transferencia de electrones 6.2.- Reacciones de oxidación reducción Aspectos teóricos: Valoraciones redox 6.2.1. Valoraciones redox. Equivalentes de oxidación-reducción Las reacciones
Solución: Según Avogadro, 1 mol de cualquier gas, medido en condiciones normales ocupa 22,4 L. Así pues, manteniendo la relación: =1,34 mol CH 4
 Ejercicios Física y Química Primer Trimestre 1. Calcula los moles de gas metano CH 4 que habrá en 30 litros del mismo, medidos en condiciones normales. Según Avogadro, 1 mol de cualquier gas, medido en
Ejercicios Física y Química Primer Trimestre 1. Calcula los moles de gas metano CH 4 que habrá en 30 litros del mismo, medidos en condiciones normales. Según Avogadro, 1 mol de cualquier gas, medido en
CINÉTICA QUÍMICA. Dr. Hugo Cerecetto. Prof. Titular de Química
 CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE CIENCIAS ESCUELA DE QUÍMICA. Problemas resueltos de cambios de fase de la materia.
 UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE CIENCIAS ESCUELA DE QUÍMICA Problemas resueltos de cambios de fase de la materia. 1. Qué se entiende por sistema y alrededores? Un sistema se define como cualquier
UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE CIENCIAS ESCUELA DE QUÍMICA Problemas resueltos de cambios de fase de la materia. 1. Qué se entiende por sistema y alrededores? Un sistema se define como cualquier
TERMODINÁMICA 1. En la fermentación de la glucosa (C6H12O6) se obtiene etanol (C2H5OH) y CO2. Si la entalpía de combustión de la glucosa es de 15.
 TERMODINÁMICA 1. En la fermentación de la glucosa (C6H12O6) se obtiene etanol (C2H5OH) y CO2. Si la entalpía de combustión de la glucosa es de 15.63 kj/g y la del etanol es de 29.72 kj/g, a) Calcular la
TERMODINÁMICA 1. En la fermentación de la glucosa (C6H12O6) se obtiene etanol (C2H5OH) y CO2. Si la entalpía de combustión de la glucosa es de 15.63 kj/g y la del etanol es de 29.72 kj/g, a) Calcular la
QUÍMICA.SEPTIEMBRE (FE). OPCIÓN A
 1. (2,5 puntos) QUÍMICA.SEPTIEMBRE (FE). OPCIÓN A Las entalpías estándar de combustión del C(s), H 2 (g) y propano gas, C 3 H 8 (g), son -394, -286 y -2220 kj/mol, respectivamente: i. Calcule la entalpía
1. (2,5 puntos) QUÍMICA.SEPTIEMBRE (FE). OPCIÓN A Las entalpías estándar de combustión del C(s), H 2 (g) y propano gas, C 3 H 8 (g), son -394, -286 y -2220 kj/mol, respectivamente: i. Calcule la entalpía
TEMA 1 CÁLCULOS EN QUÍMICA. 1-Mezclas y sustancias puras
 TEMA 1 CÁLCULOS EN QUÍMICA 1-Mezclas y sustancias puras La materia puede encontrarse en la naturaleza como sustancia pura, formada por elementos o compuestos, o formando mezclas. Como la Química trata
TEMA 1 CÁLCULOS EN QUÍMICA 1-Mezclas y sustancias puras La materia puede encontrarse en la naturaleza como sustancia pura, formada por elementos o compuestos, o formando mezclas. Como la Química trata
ESTEQUIOMETRÍA. 3.- LEYES VOLUMÉTRICAS: 3.1. Ley de los volúmenes de combinación de gases o de Gay-Lussac. 3.2. Ley de Avogadro.
 ESTEQUIOMETRÍA 1.- ECUACIONES. SÍMBOLOS Y FÓRMULAS QUÍMICAS. 2.- LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS: 2.1. Ley de la conservación de la masa o de Lavoisier. 2.2. Ley de las proporciones constantes
ESTEQUIOMETRÍA 1.- ECUACIONES. SÍMBOLOS Y FÓRMULAS QUÍMICAS. 2.- LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS: 2.1. Ley de la conservación de la masa o de Lavoisier. 2.2. Ley de las proporciones constantes
Ejercicios de repaso
 Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
FÍSICA Y QUÍMICA -Valdepeñas de Jaén-
 Formulación: 0.- Formule o nombre los compuestos siguientes: a) Cromato de litio b) Carbonato de amonio c) 2,3-dimetilbutano d) Na 2 O 2 e) H 3 PO 4 f) CH 2 =CHCH 2 CH 2 CH 2 CHO Res. a) Li 2 CrO 4 ; b)
Formulación: 0.- Formule o nombre los compuestos siguientes: a) Cromato de litio b) Carbonato de amonio c) 2,3-dimetilbutano d) Na 2 O 2 e) H 3 PO 4 f) CH 2 =CHCH 2 CH 2 CH 2 CHO Res. a) Li 2 CrO 4 ; b)
Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo.
 Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo. N 2 g 3 H 2 g 2 NH 3 g 2 NH 3 g N 2 g 3 H 2 g concentración H 2 N 2 NH 3 concentración NH 3 H 2
Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo. N 2 g 3 H 2 g 2 NH 3 g 2 NH 3 g N 2 g 3 H 2 g concentración H 2 N 2 NH 3 concentración NH 3 H 2
TEMA 7: (productos de la reacción) por la reorganización de los átomos formando moléculas nuevas. Para ello es
 TEMA 7: REACCIONES QUÍMICAS Una Reacción Química es un proceso mediante el cual unas sustancias (reactivos) se transforman en otras (productos de la reacción) por la reorganización de los átomos formando
TEMA 7: REACCIONES QUÍMICAS Una Reacción Química es un proceso mediante el cual unas sustancias (reactivos) se transforman en otras (productos de la reacción) por la reorganización de los átomos formando
TEMA 0: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 0: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
TEMA 0: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
DEPARTAMENTO DE INGENIERÍA QUÍMICA. Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESTADO NO ESTACIONARIO
 DEPARAMENO DE INGENIERÍA QUÍMICA Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESADO NO ESACIONARIO 1. INRODUCCIÓN El sistema al que se va a plantear el balance de energía calorífica consiste
DEPARAMENO DE INGENIERÍA QUÍMICA Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESADO NO ESACIONARIO 1. INRODUCCIÓN El sistema al que se va a plantear el balance de energía calorífica consiste
