Capítulo 16 Equilbrio Iónico Acuoso
|
|
|
- Rosario Hidalgo Ortiz
- hace 7 años
- Vistas:
Transcripción
1 apítulo 16 Equilbrio Iónico Acuoso Adaptado por: Ileana Nieves Martínez opyright 011 Pearson Education, Inc. Amortiguadores Amortiguador o Buffers Soluciones que resisten ph cuando se añade ácido base Neutralizan el ácido o la base añadido. Su capacidad tiene un límite Es una mezcla del par conjugado: ácido débil/base conjugada (sal con anión) o Ejemplo: sangre - mezcla de H O 3 y HO 3 base débil/ácido conjugado (sal con catión). o Ejemplo: (NH 4+ /NH 3 ) opyright 011 Pearson Education, Inc. 1
2 Preparar un amortiguador ácido Ácido débil Base conjugada Sol n amortiguadora Ácido acético H H 3 O Acetato de sodio Na H 3 O 3 opyright 011 Pearson Education, Inc. ómo fucionan los amortiguadores? A nuevo HA (ac) + H O (l) A (ac) + H 3 O + (ac) H O HA A HA A + H 3O + OH añadido Neutralización HA(ac) + OH (ac) A (ac) + H O(l) 4 opyright 011 Pearson Education, Inc.
3 ómo fucionan los amortiguadores? HA (ac) + H O (l) A (ac) + H 3 O + (ac) HA nuevo H O A HA A + H 3O + H 3 O + Añadido Neutralización H 3 O + (ac) + A (ac) HA(ac) + H O(l) 5 opyright 011 Pearson Education, Inc. Qué efecto tiene la presencia de un ión común sobre los amortiguadores? HA nuevo H O A HA A + H 3O + A - Añadido HA (ac) + H O (l) A (ac) + H 3 O + (ac) 6 opyright 011 Pearson Education, Inc. 3
4 Efecto de Ión omún HA (ac) + H O (l) A (ac) + H 3 O + (ac) A (ac) + H O (l) HA (ac) + OH (ac) 7 opyright 011 Pearson Education, Inc. Efecto de Ión omún 8 opyright 011 Pearson Education, Inc. 4
5 Ejemplo 16.1: alcule el ph de un amortiguador que contiene M H H 3 O y M Na H 3 O H H 3 O + H O H 3 O + H 3 O x x Ka = [H 3 O + ] = [H 3 O + ] log Ka = log [H 3 O + ] pka = ph Aproximación válida 9 opyright 011 Pearson Education, Inc. Práctica Determine el ph de un amortiguador con 0.14 M HF (pk a = 3.15) y M KF HF + H O F + H 3 O x x x otejo de Ka Aproximación válida 10 opyright 011 Pearson Education, Inc. 5
6 Derivación de la ecuación de Henderson-Hasselbalch HO 3 A Ka HA A log Ka log H O log ph ph pka 3 HA A ph log HA A pka log HA pka log Válida para x pequeño [HA] 0 y [A ] 0 > ( ) x K a anión dela baseconjugada ácido débil 0 Despejando por ph 11 opyright 011 Pearson Education, Inc. Ejemplo 16.: alcule el ph del amortiguador M H 7 H 5 O y M Na 7 H 5 O K a (H 7 H 5 O )= 6.5 x 10 5 H 7 H 5 O + H O 7 H 5 O + H 3 O + 1 opyright 011 Pearson Education, Inc. 6
7 Práctica Determine el ph de amortiguador 0.14 M HF (pk a = 3.15) y M KF? HF + H O F + H 3 O + 13 opyright 011 Pearson Education, Inc. álculo de ph al añadir OH Equilibrio en el amortiguador HA + H O A + H 3 O + Adición de base: neutralización HA + OH A + H O Moles inicial [HA] 0 [A - ] 0 Moles que rx [-y] rx [+y] rx [+y] rx Moles después de rx [HA] 0 -y [A - ] 0 +y Equilibrio nuevo después HA + H O A + H 3 O de la nuetralización + [HA] 0 -y [A - ] 0 +y 14 opyright 011 Pearson Education, Inc. 7
8 álculo de ph al añadir H 3 O + Equilibrio del amortiguador Adición de ácido: B + H 3 O + HB + + H O neutralización Moles inicial Moles que rx [B] 0 [-y] rx [+y] rx [HB + ] 0 [+y] rx Moles después de rx B + H O HB + + OH [B] 0 -y [HB + ] 0 +y Equilibrio nuevo nuevo después de la nuetralización B + H O HB + + OH [B] 0 -y [HB + ] 0 +y 15 opyright 011 Pearson Education, Inc. Ejemplo 16.3: alcule el ph de un amortiguador con moles H H 3 O y moles de Na H 3 O en 1.00 L al que se le añade moles NaOH neutralización Moles inicial Moles que rx Moles después de rx H H 3 O + OH H 3 O + H O y = y = Si lo que se añade es una base, escriba la reacción de OH con HA. Si añade ácido, escriba la reacción para H 3 O + con A. 16 opyright 011 Pearson Education, Inc. 8
9 ontinuación del Ejemplo 16.3: alcule el ph de un amortiguador con moles H H 3 O y moles de Na H 3 O en 1.00 L al que se le añade moles NaOH Base añadida con amortiguador H H 3 O + H O H 3 O + H 3 O + Base añadida sin amortiguador pk a for H H 3 O = opyright 011 Pearson Education, Inc. Ecuación de Henderson-Hasselbalch para amortiguadores básicos B: + H O H:B + + OH Para aplicar Henderson- Hasselbalch en forma básica Para aplicar Henderson- Hasselbalch la reacción se escribe en forma ácida H:B + + H O B: + H 3 O + Esto no afecta las concentraciones 18 opyright 011 Pearson Education, Inc. 9
10 Amortiguadores Básicos B: (ac) + H O (l) H:B + (ac) + OH (ac) Se pueden preparar mezclando una base débil, (B:), con una sal que contenga su ácido cojugado, H:B + l base débil ácido conjugado H O (l) + NH 3(ac) NH 4 + (ac) + OH (ac) Sol n amortiguadora Amoniaco NH 3 loruro de amonio NH 4 l 19 opyright 011 Pearson Education, Inc. Ejemplo 16.4: alcule el ph de un amortiguador [NH 3 ] = 0.50 M y [NH 4 l] = 0.0 M (pk b = 4.75) NH 3 + H O NH 4+ + OH pk a + pk b = 14 Procedimiento # 1: Procedimiento # : 0 opyright 011 Pearson Education, Inc. 10
11 Intervalo efectivo para el amortiguador 0.1 < [base]:[ácido] < 10 ph más bajo ph más alto Por lo tanto el intervalo efectivo es pk a ± 1 Al escojer amortiguador, debe tener el pk a más cercano al ph requerido. 1 opyright 011 Pearson Education, Inc. Ejemplo 16.5a: uál de los ácidos a continuación será la mejor elección para combinar con su sal de sodio para hacer un amortiguador con ph 4.5? Ácido loroso, HlO pk a = 1.95 Ácido Nitroso, HNO pk a = 3.34 Ácido Fórmico, HHO pk a = 3.74 Ácido Hipocloroso, HlO pk a = 7.54 Respuesta: Ácido Fórmico, HHO pk a = 3.74 El pk a de HHO es el más cercano al ph del amortiguador deseado y junto con su par conjugado será el amortiguador más efectivo. opyright 011 Pearson Education, Inc. 11
12 Ejemplo 16.5b: Determine la razón NaHO : HHO necesaria para preparar un amortiguador con ph 4.5 Ácido Fórmico, HHO, pk a = 3.74 Para preparar el amortiguador de ph 4.5, usará 3.4 veces más cantidad de NaHO que de HHO 3 opyright 011 Pearson Education, Inc. Práctica Determine la masa de Na H 3 O que se debe disolver en 300 ml de una solución H H 3 O 0.5 M para preparar un amortiguador de ph (Ka = 1.8 x 10-5 ) HHO 3 HO HO 3 HO 3 ph HH3O 0.5M 10 0 H3O? 1.8x10 5 Ka x x10 6 H O 3 H O 3 1.8x10 5 HH3O 6 H 3O 8.1x10 H O H 3O 0.56M moles 8.0 g NaH3O g( masa) 0.56 x 0.300L x g( masa) 14g de Na H O L 3 3 mol Tro: hemistry: A Molecular Approach 4 opyright 011 Pearson Education, Inc. 1
13 Titulación En titiulación ácido-base, agente titulante solución que se añade lentamente desde una bureta La solución añadida - concentración desconocida Se añade a solución - cocentración conocida Punto final cuando visiblemente se completa la reacción (detectado con indicador) Indicador especie química que cambia en color en función de ph y se añade para detectar el punto final Punto de equivalencia moles H 3 O + = moles OH 5 opyright 011 Pearson Education, Inc. Titulación monitoreo de ph omienzo de la titulación Punto de equivalencia Medida de conductividad por [H 3 O + ] con sensor específico El punto final punto de equivalencia punto de inflección de la curva se monitorea con un indicador 6 opyright 011 Pearson Education, Inc. 13
14 Indicadores Son ácidos débiles en equilbrio: HInd (ac) + H O (l) Ind (ac) + H 3 O + (ac) ambian de color con ph. Depende de la conentración relativa de [Ind ] : [HInd] o [Ind ] : [HInd] 1, el color mezcla de los colores de [Ind ] y [HInd] o [Ind ] : [HInd] > 10, el color será el color de Ind o [Ind ] : [HInd] < 0.1, el color será de HInd Intervalo Efectivo para el indicador: ph = pk a (indicador) ± 1 7 opyright 011 Pearson Education, Inc. Fenoftaleína Ácido - incoloro básico - rosa 8 opyright 011 Pearson Education, Inc. 14
15 Rojo de Metilo ambio en color de rojo de metilo H H H H (H 3 ) N N N N H H H H H 3 O+ OH- NaOO H H H H H (H 3 ) N N N N H H H NaOO H 9 opyright 011 Pearson Education, Inc. Monitoreo de Titulación con indicador pk a de HInd ph en el punto de equivalencia Indicadores ácido-base 30 opyright 011 Pearson Education, Inc. 15
16 urva de Titulación Gráfica de ph vs. cantidad de agente titulante El punto de inflección es el punto de equivalencia Puntos importantes en la curvas Antes del punto de equivalencia o La solución en el matraz cónico está en exceso, (ph observado es cercano al de la solución en el matraz) En el punto de equivalencia o El ph depende del ph de la sal en solución» Sal neutral, ph = 7» Sal acídica, ph < 7» Sal básica, ph > 7 Después del punto de equivalencia o La solución de la bureta está en exceso dentro del matraz cónico (ph se aproxima al ph de la solución en la bureta) 31 opyright 011 Pearson Education, Inc. Titulación de 5 ml de M Hl con M NaOH urva de titulación de ácido fuerte con NaOH (base fuerte) La concentración de ambas soluciones es igual con estequiometría de 1:1, el volumen consumido en el punto de equivalencia es igual al de la solución original. Antes pto. equivalencia (exceso de ácido Después del pto.equivalencia (base en exceso) En Punto de Equivalencia moles Hl = moles NaOH ph = 7.00 Volumen de NaOH añadidos, (ml) 3 opyright 011 Pearson Education, Inc. 16
17 Titulación de 5 ml de M Hl con M NaOH Inicial: moles H + = moles Hl moles iniciales Hl = M 1 V 1 = Lx0.100 mol/l =.50 x 10 3 Punto de equivalencia Hl (ac) + NaOH (ac) Nal (ac) + H O (ac) M V V 1 1 M V MV M 1 1 neutralización 33 opyright 011 Pearson Education, Inc. Titulación de 5 ml de M Hl con M NaOH Hl (ac) + NaOH (ac) Nal (ac) + H O (ac) punto de equivalencia moles NaOH añadidos = moles iniciales Hl* 0.00 moles Hl y 0.00 moles NaOH (todo reacciona) omo Nal es una sal neutral, el ph en el punto de equivalencia es 7.00 Después punto de equivalencia: ph NaOH en exceso 34 opyright 011 Pearson Education, Inc. 17
18 Titulación de 5 ml de M Hl con M NaOH ph inicial = log(0.100) = 1.00 Neutralización: Inicial: rx: final: Hl ac NaOH ac Nal ac H O M Hl moles x005. L L 5. x10 xv 3 Hl moles 5. x x Antes pto. Equivalencia: ml NaOH M M xv NaOH moles x L L 50. x NaOH 0. x x opyright 011 Pearson Education, Inc. Titulación de 5 ml de M Hl con M NaOH neutralización : Hl ac NaOH ac Nal ac H O 3 inicial : 5. x En pto. Equivalencia : ml NaOH M moles rx : L x 0. 50L final. 5x10. 5x10 final x x10 3 agua 36 opyright 011 Pearson Education, Inc. 18
19 Titulación de 5 ml de M Hl con M NaOH neutralización Hl ac NaOH ac Nal ac H O 3 inicial 5. x Después pto. equivalencia: ml NaOH M x rx : x10 final 5. x10 5. x final x10. 5x opyright 011 Pearson Education, Inc. Añadir M NaOH a M Hl +5.0 ml M Hl mol Hl ph = 1.00 Volumen de NaOH añadidos (ml) ml NaOH moles Hl ph = ml NaOH mol Hl ph = ml NaOH mol Hl ph = ml NaOH mol Hl ph = ml NaOH Punto de equivalencia ph = ml NaOH mol NaOH ph = ml NaOH mol NaOH ph = ml NaOH mol NaOH ph = ml NaOH mol NaOH ph = opyright 011 Pearson Education, Inc. 19
20 Añadir M NaOH a M Hl +5.0 ml M Hl mol Hl ph = 1.00 Volumen de NaOH añadidos (ml) ml NaOH moles Hl ph = ml NaOH mol Hl ph = ml NaOH mol Hl ph = ml NaOH mol Hl ph = ml NaOH Punto de equivalencia ph = ml NaOH mol NaOH ph = ml NaOH mol NaOH ph = ml NaOH mol NaOH ph = ml NaOH mol NaOH ph = opyright 011 Pearson Education, Inc. Titulación de 5 ml de M HHO con M NaOH HA ac H O ac A ac H O Ka = 1.8 x HO 3 KaHA 1 8x10 x x10 0 ph inicial = log(0.0044) =.37 Neutralización: Inicial: rx: final: 3... HA ac NaOH ac NaA ac H O MHAxVHA 0 0 moles Antes pto. Equivalencia: L x0. 05 L ml NaOH M 5. x10 moles moles L x L x10. 5x x x x x ph pka log 4 log ph 3.74 A 40 HA 5x x opyright 011 Pearson Education, Inc. 0
21 Titulación de 5 ml de M HHO con M NaOH neutralización : HA ac NaOH ac NaA ac H O 3 inicial : 5. x En pto. Equivalencia : ml NaOH M moles rx : L x 0. 50L final. 5x10. 5x10 final 5. x x10 A ac H O ac HA ac OH OH Kb A x 167. x x10 5. x x x10 9 HO x10 ph x opyright 011 Pearson Education, Inc. Titulación de 5 ml de M HHO con M NaOH neutralización HA ac NaOH ac NaA ac H O 3 inicial 5. x Después pto. equivalencia: ml NaOH M x rx : x10 final 5. x10 5. x final x10. 5x opyright 011 Pearson Education, Inc. 1
22 Adición de NaOH a HHO Mitad del punto de equivalencia (ph = pka Volumen de NaOH (ml) [HHO ] 0 = mol HHO ph = ml NaOH ml NaOH mol HHO mol NaOH ph = 3.14 ph = ml NaOH mol HHO ph = ml NaOH mol HHO ph = 3.74 = pk a ½ pto. Eq ml NaOH mol HHO ph = ml NaOH ml NaOH mol HHO mol NaOH ph = 4.34 ph = ml NaOH Pto. Eq: mol HO [HO ] init = M [OH ] eq = 1.7 x 10 6 ph = ml NaOH mol NaOH ph = ml NaOH mol NaOH ph = opyright 011 Pearson Education, Inc. Titulación de base fuerte con ácido fuerte Si el ácido está en la bureta y se descarga a una base en el matraz cónico, la curva de titulación será la parecida a la figura. Base fuerte y ácido fuertes punto de equivalencia (ph = 7) Volumen de Hl añadidos, (ml) 44 opyright 011 Pearson Education, Inc.
23 Equilibrio de Solubilidad Los compuestos iónicos se disuelven en agua. Solubles = alta solubilidad (s) Poco solubles = solubilidad intermedia (ps) Insolubles = baja solubilidad (i) Equilibrio de las sales, Keq Útil para medir la solubilidad relativa en agua. Para sólido iónico M n X m, la disociación es: M n X m (s) nm m+ (ac) + mx n (ac) El producto de solubilidad es: K sp = [M m+ ] n [X n ] m Ejemplo: Pbl : Pbl (s) Pb + (ac) + l (ac) K sp = [Pb + ][l ] 45 opyright 011 Pearson Education, Inc. 46 opyright 011 Pearson Education, Inc. 3
24 Solubilidad Molar Solubilidad - es la cantidad de soluto que se disuelve en una cantidad dada de solución a una T dada. La solubilidad molar es el # de moles de soluto que se disuelven en 1 L de solución Es la M del soluto disuelto en una solución saturada. Para la reacción general M n X m (s) nm m+ (ac) + mx n (ac) Solubilidad molar, s M 47 opyright 011 Pearson Education, Inc. Ejemplo 16.8: alcule la solubilidad molar de Pbl en agua pura a 5, Kps = 1.17 x 10-5 [Pb + ] [l ] Inicial 0 0 ambio +S +S Equilibrio S S Pbl s Pb ac l ac x s x s 3 K ps Pb l s s 4s 48 opyright 011 Pearson Education, Inc. 4
25 Práctica Determine el K ps de PbBr si la solubilidad molar en agua a 5 es 1.05 x 10 M PbBr s Pb ac Br ac x s x s 3 K ps Pb Br s s 4s K s. x x10 ps Otra alternativa : ps ps K s s x x K x x x 49 opyright 011 Pearson Education, Inc. K sp y Solubilidad Relativa Tomar en consideración la estequiometría El efecto de ión común sobre la solubilidad, (Le hatelier) Ejemplo Añadir Nal a Pbl disminuye la solubilidad de Pbl Pbl (s) Pb + (ac) + l (ac) Añadir l desplaza el equilibrio hacia la izquierda 50 opyright 011 Pearson Education, Inc. 5
26 Ejemplo 16.10: alcule la solubilidad molar de af en M NaF a 5 [a + ] [F ] Inicial cambio +S +S equilibrio S S s s K ps a F s 0. 1 s K ps x x af s a ac F ac s 01. s s x opyright 011 Pearson Education, Inc. Práctica Determine la concentración de los iones de Ag + en agua de mar donde [l ] = 0.55 M Agl(s) Ag + (ac) + l (ac) K sp = [Ag + ][l ] s K sp = [Ag + ][l ] K sp = (s)( s) K sp = (s)(0.55) s [Ag + ] [l ] Inicial ambio +s +s equilibrio s s 5 opyright 011 Pearson Education, Inc. 6
27 El Efecto de ph en la Solubilidad Para hidróxidos iónicos insolubles, M(OH) n (s) M n+ (ac) + noh (ac) A mayor ph, [OH ] aumenta, solubilidad menor M(OH) n (s) M n+ (ac) + noh (ac) OH A menor ph, [OH ] disminuye, solubilidad mayor M(OH) n (s) M n+ (ac) + noh (ac) OH 53 opyright 011 Pearson Education, Inc. El Efecto de ph en la Solubilidad Para sólidos iónicos insolubles con aniones de ácidos débiles, a menor ph, mayor la solubilidad M (O 3 ) n (s) M n+ (ac) + no 3 (ac) H 3 O + H 3 O + (ac) + O 3 (ac) HO 3 (ac) + H O(l) 54 opyright 011 Pearson Education, Inc. 7
28 Precipitación Ocurre cuando la concentración de los iones excede la solubilidad del compuesto iónico. omparar Q con K ps, se determina si hay precipitación Q = K ps, solución saturada, no-precipita Q < K ps, solución insaturada, no-precipita Q > K ps, solución por encima de saturación, precipita Algunas soluciones con Q > K sp no precipitan a menos que se perturben solución sobresaturada 55 opyright 011 Pearson Education, Inc. Ocure precipitación si Q > K sp Solución sobresaturada se precipita si se añade un cristal semilla 56 opyright 011 Pearson Education, Inc. 8
29 Ejemplo 16.1: Se formará precipitado cuando se mezclan Pb(NO 3 ) (ac) con NaBr (ac) si la concentración al mezclar es M y M respectivamente? Pb(NO 3 ) (ac) + NaBr (ac) PbBr (s) + NaNO 3(ac) Pb(NO 3 ) = M Pb + = M, NO 3 = ( M) NaBr = M Na + = M, Br = M K sp de PbBr = 4.67 x 10 6 PbBr (s) Pb + (ac) + Br (ac) Q < K sp, no hay precipitación 57 opyright 011 Pearson Education, Inc. Práctica Se formará precipitado cuando a(no 3 ) (ac) se mezcla con NaOH (ac) si las concentraciones después de mezclar son iguales a M para ambas especies? a(no 3 ) (ac) + NaOH (ac) a(oh) (s) + NaNO 3(ac) a(no 3 ) = M a + = M, NO 3 = ( M) K sp de a(oh) = 4.68 x 10 6 a(oh) (s) a + (ac) + OH (ac) NaOH = M Na + = M, OH = M Q > K sp, se precipita 58 opyright 011 Pearson Education, Inc. 9
Química. Equilibrio ácido-base Nombre:
 Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción
PRÁCTICA Nº 7 SOLUCIONES AMORTIGUADORAS Y CURVAS DE TITULACIÓN
 PRÁCTICA Nº 7 SOLUCIONES AMORTIGUADORAS Y CURVAS DE TITULACIÓN OBJETIVOS Demostrar que el ph de una solución amortiguadora no depende de la concentración de sus componentes. Comprobar las propiedades de
PRÁCTICA Nº 7 SOLUCIONES AMORTIGUADORAS Y CURVAS DE TITULACIÓN OBJETIVOS Demostrar que el ph de una solución amortiguadora no depende de la concentración de sus componentes. Comprobar las propiedades de
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES
 TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
EQUILIBRIOS DE SOLUBILIDAD
 EQUILIBRIOS DE SOLUBILIDAD EJERCICIOS Y PROBLEMAS RESUELTOS 1.- Una disolución saturada de tetraoxofosfato (V) de plata, contiene 3,4 1 5 moles por litro de ion fosfato. Calcula el producto de solubilidad
EQUILIBRIOS DE SOLUBILIDAD EJERCICIOS Y PROBLEMAS RESUELTOS 1.- Una disolución saturada de tetraoxofosfato (V) de plata, contiene 3,4 1 5 moles por litro de ion fosfato. Calcula el producto de solubilidad
QUÍMICA - 2º DE BACHILLERATO EJERCICIOS DE SELECTIVIDAD UNIDAD 6: ÁCIDO - BASE CUESTIONES 1
 CUESTIONES 1 HOJA 6-1 2003 modelo: Conocidos los ácidos HA (K a =3,6.10-6 ), HB (K a =2,5.10-3 ) y HC (K a =1,2.10-12 ) a) Cuál es el ácido más débil. b) Cuál es el que posee la base conjugada más débil.
CUESTIONES 1 HOJA 6-1 2003 modelo: Conocidos los ácidos HA (K a =3,6.10-6 ), HB (K a =2,5.10-3 ) y HC (K a =1,2.10-12 ) a) Cuál es el ácido más débil. b) Cuál es el que posee la base conjugada más débil.
ANÁLISIS CUALITATIVO DE CATIONES Y ANIONES
 VII 1 PRÁCTICA 7 ANÁLISIS CUALITATIVO DE CATIONES Y ANIONES FORMACIÓN DE PRECIPITADOS Y DISOLUCIÓN DE LOS MISMOS POR FORMACIÓN DE COMPLEJOS FUNDAMENTO DE LA PRÁCTICA En esta práctica llevaremos a cabo
VII 1 PRÁCTICA 7 ANÁLISIS CUALITATIVO DE CATIONES Y ANIONES FORMACIÓN DE PRECIPITADOS Y DISOLUCIÓN DE LOS MISMOS POR FORMACIÓN DE COMPLEJOS FUNDAMENTO DE LA PRÁCTICA En esta práctica llevaremos a cabo
SOLUCIONES BUFFERS. pk = valor de ph en el cual las concentraciones del ácido y la sal son iguales
 SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
Capítulo 6: Reacciones Ácido -Base
 Capítulo 6: Reacciones Ácido -Base ACTIVIDADES DE RECAPITULACIÓN 1. De acuerdo con la teoría de Brönsted-Lowry, indica cuáles de las siguientes especies: HSO 4, HNO3, S, NH 3, y H 3 O. a) Actúan sólo como
Capítulo 6: Reacciones Ácido -Base ACTIVIDADES DE RECAPITULACIÓN 1. De acuerdo con la teoría de Brönsted-Lowry, indica cuáles de las siguientes especies: HSO 4, HNO3, S, NH 3, y H 3 O. a) Actúan sólo como
QUIMICA ANALÍTICA (63.05) SOLUCIONES REGULADORAS DE ph 63.05.12. Lic. Ana María Martín
 QUIMICA ANALÍTICA (63.05) SOLUCIONES REGULADORAS DE ph 63.05.12 Lic. Ana María Martín Lic. Ana María Martín Introducción SOLUCIONES REGULADORAS DE ph Muchas de las reacciones químicas que se producen en
QUIMICA ANALÍTICA (63.05) SOLUCIONES REGULADORAS DE ph 63.05.12 Lic. Ana María Martín Lic. Ana María Martín Introducción SOLUCIONES REGULADORAS DE ph Muchas de las reacciones químicas que se producen en
Tabla 4.1. Reglas de solubilidad para compuestos iónicos a 25ºC
 La disolución y la precipitación de compuestos son fenómenos que se presentan corrientemente en la naturaleza. Por ejemplo la preparación de muchos productos químicos industriales, como el Na 2 CO 3, está
La disolución y la precipitación de compuestos son fenómenos que se presentan corrientemente en la naturaleza. Por ejemplo la preparación de muchos productos químicos industriales, como el Na 2 CO 3, está
Tema 7: Solubilidad. (Fundamentos de Química, Grado en Física) Equilibrio químico Enero Mayo, 2011 1 / 24
 Tema 7: Solubilidad. Producto de solubilidad. Efecto del ion común en la solubilidad. Limitaciones al producto de solubilidad: K ps. Criterios para la precipitación de la sal. Precipitación fraccionada.
Tema 7: Solubilidad. Producto de solubilidad. Efecto del ion común en la solubilidad. Limitaciones al producto de solubilidad: K ps. Criterios para la precipitación de la sal. Precipitación fraccionada.
TEMA 7 ÁCIDOS Y BASES
 TEMA 7 ÁCIDOS Y BASES ÍNDICE 7.1. Concepto de ácido y base Teoría de Arrhenius Teoría de Brönsted-Lowry - Pares ácido-base conjugados 7.2. Fuerza relativa de los ácidos. Contantes y grado de disociación
TEMA 7 ÁCIDOS Y BASES ÍNDICE 7.1. Concepto de ácido y base Teoría de Arrhenius Teoría de Brönsted-Lowry - Pares ácido-base conjugados 7.2. Fuerza relativa de los ácidos. Contantes y grado de disociación
Unidad 4. 2º Bachillerato Química Colegio Hispano Inglés S.A. ÁCIDO-BASE
 ÁCIDO-BASE CONTENIDOS: 1.- Caractetísticas de ácidos y bases..- Evolución histórica del concepto de ácido y base..1. Teoría de Arrhenius. Limitaciones... Teoría de Brönsted-Lowry..3. Teoría de Lewis 3.-
ÁCIDO-BASE CONTENIDOS: 1.- Caractetísticas de ácidos y bases..- Evolución histórica del concepto de ácido y base..1. Teoría de Arrhenius. Limitaciones... Teoría de Brönsted-Lowry..3. Teoría de Lewis 3.-
Reacciones Ácido Base
 Reacciones Ácido Base Prof. Sergio Casas-Cordero E. sacce Contenido: (parte uno) 1. Definiciones 2. Equilibrio iónico del agua 3. Potencial de acidez; escala de ph 4. Fuerza de ácidos y bases 5. Medición
Reacciones Ácido Base Prof. Sergio Casas-Cordero E. sacce Contenido: (parte uno) 1. Definiciones 2. Equilibrio iónico del agua 3. Potencial de acidez; escala de ph 4. Fuerza de ácidos y bases 5. Medición
REACCIONES DE TRANSFERENCIA DE PROTONES
 QUÍMICA 2º BACHILLERATO EJERCICIOS PAU REACCIONES DE TRANSFERENCIA DE PROTONES 1. PAU-16M A. Un vinagre que contiene un 5 % en masa de ácido acético tiene un ph de 2,4. Calcule: a) La concentración molar
QUÍMICA 2º BACHILLERATO EJERCICIOS PAU REACCIONES DE TRANSFERENCIA DE PROTONES 1. PAU-16M A. Un vinagre que contiene un 5 % en masa de ácido acético tiene un ph de 2,4. Calcule: a) La concentración molar
=0,32 moles/l. 0,32-x 0,32
 http://www.educa.aragob.es/iesfgcza/depart/depfiqui.htm 07/07/009 Química ªBachiller 1..Se preparan 0 m de una disolución de amoniaco diluyendo con agua m de amoniaco del 0.0 % en peso y de densidad 0.894
http://www.educa.aragob.es/iesfgcza/depart/depfiqui.htm 07/07/009 Química ªBachiller 1..Se preparan 0 m de una disolución de amoniaco diluyendo con agua m de amoniaco del 0.0 % en peso y de densidad 0.894
6. Equilibrio ácido-base I
 6. Equilibrios ácido-base I Química (1S, Grado Biología) UAM 6. Equilibrio ácido-base I Contenidos Equilibrios ácido-base I Ácidos y bases Producto iónico del agua. Disoluciones neutras, ácidas y básicas.
6. Equilibrios ácido-base I Química (1S, Grado Biología) UAM 6. Equilibrio ácido-base I Contenidos Equilibrios ácido-base I Ácidos y bases Producto iónico del agua. Disoluciones neutras, ácidas y básicas.
Ácidos y bases (III) Disoluciones reguladoras Valoraciones ácido- base. Disoluciones reguladoras del ph
 Ácidos y bases (III) Disoluciones reguladoras Valoraciones ácido- base IES La Magdalena. Avilés. Asturias Disoluciones reguladoras del ph Si añadimos una pequeña cantidad de ácido o base a agua pura, el
Ácidos y bases (III) Disoluciones reguladoras Valoraciones ácido- base IES La Magdalena. Avilés. Asturias Disoluciones reguladoras del ph Si añadimos una pequeña cantidad de ácido o base a agua pura, el
EQUILIBRIO QUIMICO E IONICO
 EQUILIBRIO QUIMICO E IONICO RECORDATORIO: Escribir la ecuación química balanceada. Las concentraciones deben estar expresadas en MOLARIDAD, si no es así se deben calcular. Plantear las concentraciones
EQUILIBRIO QUIMICO E IONICO RECORDATORIO: Escribir la ecuación química balanceada. Las concentraciones deben estar expresadas en MOLARIDAD, si no es así se deben calcular. Plantear las concentraciones
TEMA 9: EQUILIBRIO ACIDO-BASE. 1-Calcula el porcentaje de ionización del ácido acético 0,1M, sabiendo que su Ka es 1,8.
 TEMA 9: EQUILIBRIO ACIDO-BASE 1-Calcula el porcentaje de ionización del ácido acético 0,1M, sabiendo que su Ka es 1,8.10-5 R:1,33% 2- Calcula la concentración de iones OH - en una disolución de ácido clorhídrico
TEMA 9: EQUILIBRIO ACIDO-BASE 1-Calcula el porcentaje de ionización del ácido acético 0,1M, sabiendo que su Ka es 1,8.10-5 R:1,33% 2- Calcula la concentración de iones OH - en una disolución de ácido clorhídrico
1. - DEFINICION DE LOS ÁCIDOS Y DE LAS BASES 2. - REACCIONES ENTRE LOS ACIDOS Y LAS BASES CH 3 COOH + NH 3 CH 3 COO - + NH 4 H 2 O OH - + H +
 1 1. - DEFINICION DE LOS ÁCIDOS Y DE LAS BASES Se define un ácido como cualquier ión o molécula capaz de ceder protones. Por lo contrario, una base es cualquier ión o molécula capaz de fijar protones.
1 1. - DEFINICION DE LOS ÁCIDOS Y DE LAS BASES Se define un ácido como cualquier ión o molécula capaz de ceder protones. Por lo contrario, una base es cualquier ión o molécula capaz de fijar protones.
ÁCIDO BASE QCA 07 ANDALUCÍA
 por ÁCIDO BASE QCA 07 ANDALUCÍA 1.- a) Calcule el ph de una disolución de HClO 4 0 0 M y de una disolución 0 05 M de NaOH. b) Calcule el ph de la disolución obtenida al mezclar 50 ml de cada una de las
por ÁCIDO BASE QCA 07 ANDALUCÍA 1.- a) Calcule el ph de una disolución de HClO 4 0 0 M y de una disolución 0 05 M de NaOH. b) Calcule el ph de la disolución obtenida al mezclar 50 ml de cada una de las
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
Una disolución 0,20 M de ácido acético está ionizada el 0,95 % calcular Ka
 06_ACIDOS_BASES_PAEU CyL.. desde 009 ÁCIDOS - BASES PAU CyL J009 PAU CyL S009 Ka dado α y concentración HCl con mismo ph ph en eceso de base PAEU CyL J010 La adición de 0,4 moles de una base débil ph 11
06_ACIDOS_BASES_PAEU CyL.. desde 009 ÁCIDOS - BASES PAU CyL J009 PAU CyL S009 Ka dado α y concentración HCl con mismo ph ph en eceso de base PAEU CyL J010 La adición de 0,4 moles de una base débil ph 11
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1)
 PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
Ejercicios de Equilibrio Químico Josefina Canales A. 1 EQUILIBRIO QUÍMICO
 Ejercicios de Equilibrio Químico Josefina Canales A. 1 EQUILIBRIO QUÍMICO El equilibrio químico se puede dividir en: Homogéneos : si todas las sustancias se encuentran en el mismo estado físico. Heterogéneos
Ejercicios de Equilibrio Químico Josefina Canales A. 1 EQUILIBRIO QUÍMICO El equilibrio químico se puede dividir en: Homogéneos : si todas las sustancias se encuentran en el mismo estado físico. Heterogéneos
JUNIO FASE GENERAL QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
EXÁMENES SELECTIVIDAD DE ÁCIDO BASE EN LA COMUNIDAD VALENCIANA, ESPECIALIDAD: QUÍMICA
 EXÁMENES SELECTIVIDAD DE ÁCIDO BASE EN LA COMUNIDAD VALENCIANA, ESPECIALIDAD: QUÍMICA Septiembre 2012; Opción A; CUESTION 3 Aplicando la teoría ácido-base de Brönsted-Lowry, explique razonadamente, escribiendo
EXÁMENES SELECTIVIDAD DE ÁCIDO BASE EN LA COMUNIDAD VALENCIANA, ESPECIALIDAD: QUÍMICA Septiembre 2012; Opción A; CUESTION 3 Aplicando la teoría ácido-base de Brönsted-Lowry, explique razonadamente, escribiendo
COLEGIO SAN FRANCISCO JAVIER GUIAS
 COLEGIO SAN FRANCISCO JAVIER GUIAS Código PGF 03 R07 2009 08 V03 Estudiante: Guía Nº: 2 Profesor: Andrés Fernando Rosero Ortiz Grado: 11 Asignatura: Química Sección: ABCD Tema: Equilibrio químico Equilibrio
COLEGIO SAN FRANCISCO JAVIER GUIAS Código PGF 03 R07 2009 08 V03 Estudiante: Guía Nº: 2 Profesor: Andrés Fernando Rosero Ortiz Grado: 11 Asignatura: Química Sección: ABCD Tema: Equilibrio químico Equilibrio
ÁCIDO: Sustancia que en disolución acuosa disocia cationes H +. AH (en disolución acuosa) A + H + Ejemplos:
 EQUILIBRIOS ÁCIDO-BASE QUÍMICA 2ºBACHILLERATO 1.- Características de ácidos y bases. 1.1. Teoría de Arrhenius. Limitaciones. 1.2. Teoría de Brönsted-Lowry. 2.- Equilibrio de ionización del agua. Concepto
EQUILIBRIOS ÁCIDO-BASE QUÍMICA 2ºBACHILLERATO 1.- Características de ácidos y bases. 1.1. Teoría de Arrhenius. Limitaciones. 1.2. Teoría de Brönsted-Lowry. 2.- Equilibrio de ionización del agua. Concepto
DISOLUCION DE PIEZAS DENTALES
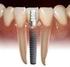 DISOLUCION DE PIEZAS DENTALES Agua ph=7 T 20 C 1. Cuanto dura la pieza dental en contacto con agua? 2. Cuales serian los factores que determinan que se solubilice? 3. En que condiciones se disuelve en
DISOLUCION DE PIEZAS DENTALES Agua ph=7 T 20 C 1. Cuanto dura la pieza dental en contacto con agua? 2. Cuales serian los factores que determinan que se solubilice? 3. En que condiciones se disuelve en
REACCIONES ÁCIDO-BASE
 9 REACCIONES ÁCIDO-BASE SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD Ácidos y bases de Arrhenius y de Brönsted-Lowry 1. Epón brevemente las analogías y diferencias entre las teorías de Arrhenius y la
9 REACCIONES ÁCIDO-BASE SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD Ácidos y bases de Arrhenius y de Brönsted-Lowry 1. Epón brevemente las analogías y diferencias entre las teorías de Arrhenius y la
4. Cuál de las siguientes es una base de Brönsted? A) SO 4
 CUESTIONES ACIDO-BASE ---------------------------------------------------------------------------------------------------------- 1. El ácido conjugado del HSO - 4 es: A) HSO - 4 B) H 2 SO 4 C) H 3 O +
CUESTIONES ACIDO-BASE ---------------------------------------------------------------------------------------------------------- 1. El ácido conjugado del HSO - 4 es: A) HSO - 4 B) H 2 SO 4 C) H 3 O +
DISOLUCIÓN Y PRECIPITACIÓN DE SALES CAPITULO V. 5.1. Solubilidad 5.2. Disolución de compuestos poco solubles. 5.3. Precipitación Fraccionada
 CAPITULO V DISOLUCIÓN Y PRECIPITACIÓN DE SALES 5.1. Solubilidad 5.2. Disolución de compuestos poco solubles. 5.3. Precipitación Fraccionada El fenómeno de precipitación, así como el de disolución de precipitados
CAPITULO V DISOLUCIÓN Y PRECIPITACIÓN DE SALES 5.1. Solubilidad 5.2. Disolución de compuestos poco solubles. 5.3. Precipitación Fraccionada El fenómeno de precipitación, así como el de disolución de precipitados
Práctica 3. Solubilidad
 Práctica 3. Solubilidad PREGUNTS RESPONDER L FINL DE L PRÁTI La concentración es una propiedad intensiva o extensiva? Por qué? Por qué al aumentar la temperatura aumenta la solubilidad de una disolución
Práctica 3. Solubilidad PREGUNTS RESPONDER L FINL DE L PRÁTI La concentración es una propiedad intensiva o extensiva? Por qué? Por qué al aumentar la temperatura aumenta la solubilidad de una disolución
EJERCICIOS PARA EXAMEN U6 Química 2º Bachiller
 2010 Reacciones de intercambio de Protones EJERCICIOS PARA EXAMEN U6 Química 2º Bachiller Recopilación de ejercicios preguntados en exámenes de cursos anteriores Mª Teresa Gómez Ruiz IES Politécnico Cartagena.
2010 Reacciones de intercambio de Protones EJERCICIOS PARA EXAMEN U6 Química 2º Bachiller Recopilación de ejercicios preguntados en exámenes de cursos anteriores Mª Teresa Gómez Ruiz IES Politécnico Cartagena.
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS.
 PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
ESTEQUIOMETRÍA. cobre(ii) y se descompone, cuántas moles de dióxido de nitrógeno se formarán? A moles B moles C moles D. 0.
 ESTEQUIOMETRÍA 1 Al calentarse fuertemente, el nitrato de cobre(ii) se descompone en óxido de cobre(ii), dióxido de nitrógeno y oxígeno elemental (O 2 ). Si calentamos 0.10 moles de nitrato de cobre(ii)
ESTEQUIOMETRÍA 1 Al calentarse fuertemente, el nitrato de cobre(ii) se descompone en óxido de cobre(ii), dióxido de nitrógeno y oxígeno elemental (O 2 ). Si calentamos 0.10 moles de nitrato de cobre(ii)
Finalmente, los autores agradecen a Humberto Bueno su ayuda en la realización de algunas de las figuras incluidas en este trabajo.
 INTRODUCCIÓN El aprendizaje de la Química constituye un reto al que se enfrentan cada año los, cada vez más escasos, estudiantes de 2 de bachillerato que eligen las opciones de Ciencias de la Naturaleza
INTRODUCCIÓN El aprendizaje de la Química constituye un reto al que se enfrentan cada año los, cada vez más escasos, estudiantes de 2 de bachillerato que eligen las opciones de Ciencias de la Naturaleza
TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule
TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule
6. Reacciones de precipitación
 6. Reacciones de precipitación Las reacciones de precipitación son aquellas en las que el producto es un sólido; se utilizan en los métodos gravimétricos de análisis y en las titulaciones por precipitación.
6. Reacciones de precipitación Las reacciones de precipitación son aquellas en las que el producto es un sólido; se utilizan en los métodos gravimétricos de análisis y en las titulaciones por precipitación.
EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE
 Página: 1/7 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE Bibliografía: Química, La Ciencia Central, T.L. Brown, H. E. LeMay, Jr., B. Bursten; Ed. Prentice-Hall, Hispanoamérica,
Página: 1/7 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE Bibliografía: Química, La Ciencia Central, T.L. Brown, H. E. LeMay, Jr., B. Bursten; Ed. Prentice-Hall, Hispanoamérica,
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
Práctica 3. Solubilidad
 PREGUNTS RESPONDER L FINL DE L PRÁTI Práctica 3. Solubilidad Revisaron: M. en. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar QF. Fabiola González Olguín La concentración es una propiedad
PREGUNTS RESPONDER L FINL DE L PRÁTI Práctica 3. Solubilidad Revisaron: M. en. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar QF. Fabiola González Olguín La concentración es una propiedad
ÁCIDO-BASE. Cálculo del ph y constantes de acidez y basicidad.
 ÁCIDO-BASE. Concepto básicos. 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
ÁCIDO-BASE. Concepto básicos. 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
ANALISIS VOLUMETRICO
 ANALISIS VOLUMETRICO FUNDAMENTO La concentración de la sustancia de interés (analito) se determina a través de una medición de volumen. PROCEDIMIENTO GENERAL Preparar un patrón de referencia. Disolver
ANALISIS VOLUMETRICO FUNDAMENTO La concentración de la sustancia de interés (analito) se determina a través de una medición de volumen. PROCEDIMIENTO GENERAL Preparar un patrón de referencia. Disolver
PROBLEMAS EQUILIBRIO ÁCIDO BASE
 PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
ÁCIDO BASE. SELECTIVIDAD UCLM 2ºBACH
 1. Escribe una ecuación que muestre la reacción del ácido nítrico, HNO 3, como un ácido de Brönsted-Lowry, con agua. Cuál es el papel del agua en la reacción? Junio 2001 2. Un ácido débil HA tiene una
1. Escribe una ecuación que muestre la reacción del ácido nítrico, HNO 3, como un ácido de Brönsted-Lowry, con agua. Cuál es el papel del agua en la reacción? Junio 2001 2. Un ácido débil HA tiene una
Acuerdo 286. Química. Disoluciones. Recopiló: M.C. Macaria Hernández Chávez
 Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
REACCIONES DE TRANSFERENCIA DE PROTONES
 REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS Y PROBLEMAS RESUELTOS 1. Dadas las especies: NH 3, CN -, HI, HS -. Escribir reacciones que justifiquen su carácter ácido o básico, en disolución acuosa,
REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS Y PROBLEMAS RESUELTOS 1. Dadas las especies: NH 3, CN -, HI, HS -. Escribir reacciones que justifiquen su carácter ácido o básico, en disolución acuosa,
Disoluciones. AUTHOR: VICENTE GUZMÁN BROTÓNS
 Disoluciones AUTHOR: VICENTE GUZMÁN BROTÓNS http://bencenoanhidro.blogspot.com Disoluciones AUTHOR: VICENTE GUZMÁN BROTÓNS http://bencenoanhidro.blogspot.com Problemas de disoluciones 1. Calcula la concentración
Disoluciones AUTHOR: VICENTE GUZMÁN BROTÓNS http://bencenoanhidro.blogspot.com Disoluciones AUTHOR: VICENTE GUZMÁN BROTÓNS http://bencenoanhidro.blogspot.com Problemas de disoluciones 1. Calcula la concentración
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva 2, Ejercicio 5,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva 2, Ejercicio 5,
EJERCICIOS RESUELTOS DISOLUCIONES
 EJERIIOS RESUELTOS DISOLUIONES 1.- Se disuelven 20 g de NaOH en 560 g de agua. alcula a) la concentración de la en % en masa y b) su molalidad. Ar(Na) 2. Ar(O)16. Ar(H)1. NaOH 20 a) % NaOH.100 % NaOH.100
EJERIIOS RESUELTOS DISOLUIONES 1.- Se disuelven 20 g de NaOH en 560 g de agua. alcula a) la concentración de la en % en masa y b) su molalidad. Ar(Na) 2. Ar(O)16. Ar(H)1. NaOH 20 a) % NaOH.100 % NaOH.100
Concepto de ph. Bases
 Concepto de ph El concepto de ph nace de dos tipos de especies químicas llamadas ácidos y bases, las que se pueden clasificar como tal y predecir su potencia o fuerza de acuerdo al valor de su ph. Características
Concepto de ph El concepto de ph nace de dos tipos de especies químicas llamadas ácidos y bases, las que se pueden clasificar como tal y predecir su potencia o fuerza de acuerdo al valor de su ph. Características
Conceptos Ácido, Base y ph
 Conceptos Ácido, Base y ph AMNER MUÑOZ ACEVEDO Qco, M.Sc., Ph.D. RUBÉN ALBERTO JIMÉNEZ QF, M.Sc. ÁCIDOS Y BASES Ácidos comunes caseros incluye CH 3 COOH (ácido acético vinagre), ácido cítrico (H 3 C 6
Conceptos Ácido, Base y ph AMNER MUÑOZ ACEVEDO Qco, M.Sc., Ph.D. RUBÉN ALBERTO JIMÉNEZ QF, M.Sc. ÁCIDOS Y BASES Ácidos comunes caseros incluye CH 3 COOH (ácido acético vinagre), ácido cítrico (H 3 C 6
Titulaciones en Química Analítica. Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D.
 Titulaciones en Química Analítica Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D. Introducción En el análisis volumétrico, la concentración se determina midiendo su capacidad de reaccionar con un reactivo
Titulaciones en Química Analítica Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D. Introducción En el análisis volumétrico, la concentración se determina midiendo su capacidad de reaccionar con un reactivo
Reacciones en disolución acuosa
 Reacciones en disolución acuosa (no redox) Ramón L. Hernández-Castillo, Ph.D. Química 106 (laboratorio) Objetivos Reglas de Solubilidad en medio acuoso Reacciones típicas en medio acuoso (precipitación,
Reacciones en disolución acuosa (no redox) Ramón L. Hernández-Castillo, Ph.D. Química 106 (laboratorio) Objetivos Reglas de Solubilidad en medio acuoso Reacciones típicas en medio acuoso (precipitación,
] = s = 1'5 10-5 M. a) El equilibrio de ionización del compuesto es: Al(OH) 3 Al 3+ + 3 OH -
![] = s = 1'5 10-5 M. a) El equilibrio de ionización del compuesto es: Al(OH) 3 Al 3+ + 3 OH - ] = s = 1'5 10-5 M. a) El equilibrio de ionización del compuesto es: Al(OH) 3 Al 3+ + 3 OH -](/thumbs/40/21798534.jpg) 1. Se disuelve hidróxido de cobalto(ii) en agua hasta obtener una disolución saturada a una temperatura dada. Se conoce que la concentración de iones OH - es 3 10-5 M. Calcule: a) La concentración de iones
1. Se disuelve hidróxido de cobalto(ii) en agua hasta obtener una disolución saturada a una temperatura dada. Se conoce que la concentración de iones OH - es 3 10-5 M. Calcule: a) La concentración de iones
13 Equilibrio Ácido Base
 Facultad de Farmacia. Universidad de Alcalá 127 13 Equilibrio Ácido Base 13.1 Ácidos y bases 13.2 Autoionización del agua 13.3 Cálculos de ph en disoluciones acuosas de ácidos y bases 13.4 Hidrólisis de
Facultad de Farmacia. Universidad de Alcalá 127 13 Equilibrio Ácido Base 13.1 Ácidos y bases 13.2 Autoionización del agua 13.3 Cálculos de ph en disoluciones acuosas de ácidos y bases 13.4 Hidrólisis de
REACCIONES DE TRANSFERENCIA DE PROTONES
 REACCIONES DE TRANSFERENCIA DE PROTONES 1. Teorías sobre la naturaleza de los ácidos y bases. 2. Electrólitos. 3. Fuerza de los ácidos y bases. Constantes de ionización. 4. Ionización del agua. 5. ph.
REACCIONES DE TRANSFERENCIA DE PROTONES 1. Teorías sobre la naturaleza de los ácidos y bases. 2. Electrólitos. 3. Fuerza de los ácidos y bases. Constantes de ionización. 4. Ionización del agua. 5. ph.
Concepto de ph. ph = - log [H + ]
![Concepto de ph. ph = - log [H + ] Concepto de ph. ph = - log [H + ]](/thumbs/39/19109627.jpg) Fuerza de Ácidos y Bases Concepto de ph Ácidos Los ácidos se diferencian de acuerdo a su capacidad para ceder protones al medio, o químicamente dicho, por su capacidad de disociación, esa también es la
Fuerza de Ácidos y Bases Concepto de ph Ácidos Los ácidos se diferencian de acuerdo a su capacidad para ceder protones al medio, o químicamente dicho, por su capacidad de disociación, esa también es la
VÍDEOS EJERCICIOS ÁCIDO-BASE RESUELTOS: ENUNCIADOS
 VÍDEOS EJERCICIOS ÁCIDO-BASE RESUELTOS: ENUNCIADOS Ejercicio 1 Cálculo del ph de una disolución de ácido fuerte a partir de su concentración. Se dispone de una disolución 0,02M de ácido nítrico. Calcular
VÍDEOS EJERCICIOS ÁCIDO-BASE RESUELTOS: ENUNCIADOS Ejercicio 1 Cálculo del ph de una disolución de ácido fuerte a partir de su concentración. Se dispone de una disolución 0,02M de ácido nítrico. Calcular
E4B.S2007. a) HCl + H 2 O Cl + H 3 O + ácido1 base2 base1 ácido2. b) NH 3 + H 2 O NH 4 + + OH base1 ácido2 ácido1 base2
 TEMA 6. ACIDOS Y BASES E1B.S009 Para las especies CN, HF y CO 3, en disolución acuosa: a) Escriba, según corresponda, la fórmula del ácido o de la base conjugados. b) Justifique, mediante la reacción correspondiente,
TEMA 6. ACIDOS Y BASES E1B.S009 Para las especies CN, HF y CO 3, en disolución acuosa: a) Escriba, según corresponda, la fórmula del ácido o de la base conjugados. b) Justifique, mediante la reacción correspondiente,
ÁCIDO-BASE CONTENIDOS: CARACTERÍSTICAS DE ÁCIDOS Y BASES. DEFINICIÓN DE ARRHENIUS.
 ÁCIDO-BASE CONTENIDOS: 1.- Caractetísticas de ácidos y bases..- Evolución histórica del concepto de ácido y base..1. Teoría de Arrhenius. Limitaciones... Teoría de Brönsted-Lowry..3. Teoría de Lewis (
ÁCIDO-BASE CONTENIDOS: 1.- Caractetísticas de ácidos y bases..- Evolución histórica del concepto de ácido y base..1. Teoría de Arrhenius. Limitaciones... Teoría de Brönsted-Lowry..3. Teoría de Lewis (
Este documento es de distribución gratuita y llega gracias a www.cienciamatematica.com El mayor portal de recursos educativos a tu servicio!
 Este documento es de distribución gratuita y llega gracias a Ciencia Matemática www.cienciamatematica.com El mayor portal de recursos educativos a tu servicio! QUÍMICA GENERAL PROBLEMAS RESUELTOS Dr. D.
Este documento es de distribución gratuita y llega gracias a Ciencia Matemática www.cienciamatematica.com El mayor portal de recursos educativos a tu servicio! QUÍMICA GENERAL PROBLEMAS RESUELTOS Dr. D.
5. Reacciones de neutralización
 5. Reacciones de neutralización Una reacción de neutralización es una reacción entre un ácido y una base, generalmente en las reacciones acuosas ácido-base se forma agua y una sal, un ejemplo es el producto
5. Reacciones de neutralización Una reacción de neutralización es una reacción entre un ácido y una base, generalmente en las reacciones acuosas ácido-base se forma agua y una sal, un ejemplo es el producto
Determinación de la dureza del agua
 Determinación de la dureza del agua La definición práctica de dureza del agua es la concentración total de cationes en una muestra capaz de formar complejos insolubles con jabón. (Un agua dura con alta
Determinación de la dureza del agua La definición práctica de dureza del agua es la concentración total de cationes en una muestra capaz de formar complejos insolubles con jabón. (Un agua dura con alta
PREGUNTAS DE TEST SOBRE ÁCIDOS Y BASES
 PREGUNTAS DE TEST SOBRE ÁCIDOS Y BASES A GENERALIDADES B DEFINICION DE ph C ACIDOS Y BASES FUERTES D ACIDOS Y BASES DEBILES: E DISOLUCIONES DE SALES: F DISOLUCIONES TAMPON: G VALORACIONES ACIDOBASE: H
PREGUNTAS DE TEST SOBRE ÁCIDOS Y BASES A GENERALIDADES B DEFINICION DE ph C ACIDOS Y BASES FUERTES D ACIDOS Y BASES DEBILES: E DISOLUCIONES DE SALES: F DISOLUCIONES TAMPON: G VALORACIONES ACIDOBASE: H
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción
6. Equilibrio ácido-base I
 6. Equilibrios ácido-base I Equilibrios ácido-base I Contenidos Ácidos y bases Producto iónico i del agua. Disoluciones neutras, ácidas y básicas. b Concepto de ph. Ácidos y bases fuertes y débiles: d
6. Equilibrios ácido-base I Equilibrios ácido-base I Contenidos Ácidos y bases Producto iónico i del agua. Disoluciones neutras, ácidas y básicas. b Concepto de ph. Ácidos y bases fuertes y débiles: d
2.- Enuncie los principios o reglas que controlan el llenado de los niveles de energía atómicos permitidos.
 BLOQUE PRIMERO 1.- Un compuesto contiene 85,7% de carbono y 14,3% de hidrógeno y la masa de la molécula del mismo es 42. Calcule la fórmula del compuesto sabiendo que la masa atómica del carbono. 2.- Enuncie
BLOQUE PRIMERO 1.- Un compuesto contiene 85,7% de carbono y 14,3% de hidrógeno y la masa de la molécula del mismo es 42. Calcule la fórmula del compuesto sabiendo que la masa atómica del carbono. 2.- Enuncie
 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 PROBLEMAS 1. TEORÍA 1. Explica que es un ácido y una base, según la teoría de Arrhemius. Qué limitaciones presenta. 2. Qué es un ácido y una base según la teoría
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 PROBLEMAS 1. TEORÍA 1. Explica que es un ácido y una base, según la teoría de Arrhemius. Qué limitaciones presenta. 2. Qué es un ácido y una base según la teoría
[ ][ ] [ ] [ ][ ] [ ] [ ][ ] [ ] [ ] [ ][ ] 4 [ ] [ ][ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ]
![[ ][ ] [ ] [ ][ ] [ ] [ ][ ] [ ] [ ] [ ][ ] 4 [ ] [ ][ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ][ ] [ ] [ ][ ] [ ] [ ][ ] [ ] [ ] [ ][ ] 4 [ ] [ ][ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ]](/thumbs/51/28435674.jpg) - Teniendo en cuenta los valores de las constantes de disociación del EDTA: Ka 0x0 - Ka x0 - Ka 69x0-7 Ka 550x0 - Obtener las expresiones para calcular los coeficientes de reacción laterales del EDTA con
- Teniendo en cuenta los valores de las constantes de disociación del EDTA: Ka 0x0 - Ka x0 - Ka 69x0-7 Ka 550x0 - Obtener las expresiones para calcular los coeficientes de reacción laterales del EDTA con
ANÁLISIS CUALITATIVO DE CATIONES Y ANIONES
 VII 1 PRÁCTICA 7 ANÁLISIS CUALITATIVO DE CATIONES Y ANIONES FORMACIÓN DE PRECIPITADOS Y DISOLUCIÓN DE LOS MISMOS POR FORMACIÓN DE COMPLEJOS FUNDAMENTO DE LA PRÁCTICA En esta práctica llevaremos a cabo
VII 1 PRÁCTICA 7 ANÁLISIS CUALITATIVO DE CATIONES Y ANIONES FORMACIÓN DE PRECIPITADOS Y DISOLUCIÓN DE LOS MISMOS POR FORMACIÓN DE COMPLEJOS FUNDAMENTO DE LA PRÁCTICA En esta práctica llevaremos a cabo
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES
 Preuniversitario Liceo de Aplicación Química 4º 2010 Profesora Paola Lizama V. GUÍA 4: DISOLUCIONES EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES 01.- Calcular la cantidad de sosa cáustica (NaOH) y de agua que
Preuniversitario Liceo de Aplicación Química 4º 2010 Profesora Paola Lizama V. GUÍA 4: DISOLUCIONES EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES 01.- Calcular la cantidad de sosa cáustica (NaOH) y de agua que
9. Importancia de la estadística y la quimiometría en la química analítica
 9. Importancia de la estadística y la quimiometría en la química analítica Durante la realización de una análisis cuantitativo es muy importante tomar en cuenta todas las variables que pueden afectar nuestro
9. Importancia de la estadística y la quimiometría en la química analítica Durante la realización de una análisis cuantitativo es muy importante tomar en cuenta todas las variables que pueden afectar nuestro
QUÍMICA. Solución: i. Reacción de reducción: la que presente el potencial estándar de reducción más alto. Si sólo escribe correctamente la ecuación.
 QUÍMICA OPCIÓN A 1. (2,5 puntos) Dispone de los pares redox (Cr 2 O 2-7 /Cr 3+ ) y (Ag + /Ag), cuyos potenciales estándar de reducción en medio ácido son, respectivamente, + 1,33 y + 0,80 V. Con ellos
QUÍMICA OPCIÓN A 1. (2,5 puntos) Dispone de los pares redox (Cr 2 O 2-7 /Cr 3+ ) y (Ag + /Ag), cuyos potenciales estándar de reducción en medio ácido son, respectivamente, + 1,33 y + 0,80 V. Con ellos
ÁCIDO-BASE. ÁCIDO: Sustancia que en disolución acuosa disocia cationes H +. BASE: Sustancia que en disolución acuosa disocia aniones OH.
 ÁCIDO-BASE Ácidos: 1. CARACTERÍSTICAS DE ÁCIDOS Y BASES. Tienen sabor agrio, son corrosivos para la piel, enrojecen ciertos colorantes, vegetales. Disuelven sustancias, atacan a los metales desprendiendo
ÁCIDO-BASE Ácidos: 1. CARACTERÍSTICAS DE ÁCIDOS Y BASES. Tienen sabor agrio, son corrosivos para la piel, enrojecen ciertos colorantes, vegetales. Disuelven sustancias, atacan a los metales desprendiendo
Sabiendo el porcentaje de disociación del amoníaco, se puede calcular las concentraciones de todas las especies en el equilibrio:
 166 Capítulo 3 19. La metilamina (CH 3 NH ) es una base débil cuya constante de disociación en agua, b 1,9-5. Calcular el ph de una solución 0,4 M de esta amina. Solución: CH 3 NH + H O + CH 3 NH 3 + OH
166 Capítulo 3 19. La metilamina (CH 3 NH ) es una base débil cuya constante de disociación en agua, b 1,9-5. Calcular el ph de una solución 0,4 M de esta amina. Solución: CH 3 NH + H O + CH 3 NH 3 + OH
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS PRUEBA ESPECÍFICA QUÍMICA
 PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
Ácido-base 08/03/06 DEPARTAMENTO DE FÍSICA E QUÍMICA. a) 0,500 M [1 PUNTO] 3 COOH CH 3 COO + H + K a = [CH 3 COO ][H + ] [CH 3 COOH] x 2
![Ácido-base 08/03/06 DEPARTAMENTO DE FÍSICA E QUÍMICA. a) 0,500 M [1 PUNTO] 3 COOH CH 3 COO + H + K a = [CH 3 COO ][H + ] [CH 3 COOH] x 2 Ácido-base 08/03/06 DEPARTAMENTO DE FÍSICA E QUÍMICA. a) 0,500 M [1 PUNTO] 3 COOH CH 3 COO + H + K a = [CH 3 COO ][H + ] [CH 3 COOH] x 2](/thumbs/29/13343175.jpg) Química 2º Bach. Ácido-base 08/03/06 DEPARTAMENTO DE FÍSICA E QUÍMICA Problemas Nombre: 1. Calcula el ph de una disolución de ácido acético (ácido etanoico): a) 0,500 M [1 PUNTO] b) 2,0 10-3 M [1 PUNTO]
Química 2º Bach. Ácido-base 08/03/06 DEPARTAMENTO DE FÍSICA E QUÍMICA Problemas Nombre: 1. Calcula el ph de una disolución de ácido acético (ácido etanoico): a) 0,500 M [1 PUNTO] b) 2,0 10-3 M [1 PUNTO]
Los enlaces C F son polares pero la geometría tetraédrica
 1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
SOLUBILIDAD 1. Solubilidad. 2. Producto de solubilidad. 3. Efecto del ion común.
 SOLUBILIDAD 1. Solubilidad. 2. Producto de solubilidad. 3. Efecto del ion común. Química 2º bachillerato Solubilidad 1 0. CONOCIMIENTOS PREVIOS Los conocimientos previos que son necesarios dominar y ampliar
SOLUBILIDAD 1. Solubilidad. 2. Producto de solubilidad. 3. Efecto del ion común. Química 2º bachillerato Solubilidad 1 0. CONOCIMIENTOS PREVIOS Los conocimientos previos que son necesarios dominar y ampliar
QUÍMICA.SEPTIEMBRE (FE). OPCIÓN A
 1. (2,5 puntos) QUÍMICA.SEPTIEMBRE (FE). OPCIÓN A Las entalpías estándar de combustión del C(s), H 2 (g) y propano gas, C 3 H 8 (g), son -394, -286 y -2220 kj/mol, respectivamente: i. Calcule la entalpía
1. (2,5 puntos) QUÍMICA.SEPTIEMBRE (FE). OPCIÓN A Las entalpías estándar de combustión del C(s), H 2 (g) y propano gas, C 3 H 8 (g), son -394, -286 y -2220 kj/mol, respectivamente: i. Calcule la entalpía
EQUILIBRIOS DE SOLUBILIDAD
 EQUILIBRIOS DE SOLUBILIDAD EJERCICIOS Y PROBLEMAS RESUELTOS PROBLEMA 1.- Una disolución saturada de tetraoxofosfato (V) de plata, contiene, 10 5 moles por litro de ion fosfato. Calcula el producto de solubilidad
EQUILIBRIOS DE SOLUBILIDAD EJERCICIOS Y PROBLEMAS RESUELTOS PROBLEMA 1.- Una disolución saturada de tetraoxofosfato (V) de plata, contiene, 10 5 moles por litro de ion fosfato. Calcula el producto de solubilidad
TEMA 6.- Reacciones de trans- ferencia de protones
 TEMA 6.- Reacciones de trans- ferencia de protones CUESTIONES 51.- Razone la veracidad o falsedad de las siguientes afirmaciones: a) A igual molaridad, cuanto más débil es un ácido menor es el ph de sus
TEMA 6.- Reacciones de trans- ferencia de protones CUESTIONES 51.- Razone la veracidad o falsedad de las siguientes afirmaciones: a) A igual molaridad, cuanto más débil es un ácido menor es el ph de sus
Física y Química 1ºBachillerato Ejemplo Examen. Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Ioduro de Calcio:
 Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
REACCIONES DE PRECIPITACIÓN
 TEMA 12 REACCIONES DE PRECIPITACIÓN Las reacciones de disolución/precipitación en las que un sólido pasa a la disolución o viceversa afectan profundamente la ecología de ríos, lagos y océanos ya que controlan
TEMA 12 REACCIONES DE PRECIPITACIÓN Las reacciones de disolución/precipitación en las que un sólido pasa a la disolución o viceversa afectan profundamente la ecología de ríos, lagos y océanos ya que controlan
Capítulo 5. Introducción a reacciones en soluciones acuosas
 Capítulo 5 Introducción a reacciones en soluciones acuosas 1 Capítulo 5 Reacciones en soluciones acuosas 5.1 - La Naturaleza de soluciones acuosas 5.2 - Reacciones de precipitación 5.3 - Reacciones ácido-base
Capítulo 5 Introducción a reacciones en soluciones acuosas 1 Capítulo 5 Reacciones en soluciones acuosas 5.1 - La Naturaleza de soluciones acuosas 5.2 - Reacciones de precipitación 5.3 - Reacciones ácido-base
REACCIONES DE IONES METÁLICOS
 Actividad Experimental 4 REACCIONES DE IONES METÁLICOS Investigación previa -Investigar las medidas de seguridad para trabajar con amoniaco -Investigar las reglas de solubilidad de las sustancias químicas.
Actividad Experimental 4 REACCIONES DE IONES METÁLICOS Investigación previa -Investigar las medidas de seguridad para trabajar con amoniaco -Investigar las reglas de solubilidad de las sustancias químicas.
JULIO 2012. FASE GENERAL QUÍMICA
 OPCIÓN A JULIO 2012. FASE GENERAL QUÍMICA 1. (2,5 puntos) A partir de los siguientes datos de energías de ruptura de enlaces (ED): Molécula Enlaces ED (kj mol -1 ) H 2 H H 436 N 2 N N 946 NH 3 N-H 389
OPCIÓN A JULIO 2012. FASE GENERAL QUÍMICA 1. (2,5 puntos) A partir de los siguientes datos de energías de ruptura de enlaces (ED): Molécula Enlaces ED (kj mol -1 ) H 2 H H 436 N 2 N N 946 NH 3 N-H 389
1º) Dado el sistema de equilibrio representado por la siguiente ecuación:
 EJERCICIOS DE EQUILIBRIO QUÍMICO 1º) Dado el sistema de equilibrio representado por la siguiente ecuación: NH4HS (s) NH3 (g) + H2S (g) Indique, razonadamente, cómo varían las concentraciones de las especies
EJERCICIOS DE EQUILIBRIO QUÍMICO 1º) Dado el sistema de equilibrio representado por la siguiente ecuación: NH4HS (s) NH3 (g) + H2S (g) Indique, razonadamente, cómo varían las concentraciones de las especies
EQUILIBRIO ÁCIDO-BASE
 EQUIIBRIO ÁCIDO-BASE Electrolito y no electrolito os electrolitos son sustancias (ácidos, bases y sales) que al disolverse en agua o fundidos, pueden conducir la corriente eléctrica. os electrolitos pueden
EQUIIBRIO ÁCIDO-BASE Electrolito y no electrolito os electrolitos son sustancias (ácidos, bases y sales) que al disolverse en agua o fundidos, pueden conducir la corriente eléctrica. os electrolitos pueden
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO.
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 010-011 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN La
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 010-011 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN La
Tema 5. Reacciones de transferencia de protones
 Iniciación a la Química 251 Tema 5 Aspectos Teóricos 5.1. Concepto de ácido y de base De los diferentes modelos que existen de ácidos y bases, en este texto, dadas las limitaciones del mismo, sólo se van
Iniciación a la Química 251 Tema 5 Aspectos Teóricos 5.1. Concepto de ácido y de base De los diferentes modelos que existen de ácidos y bases, en este texto, dadas las limitaciones del mismo, sólo se van
INTRODUCCIÓN AL EQUILIBRIO ÁCIDO BASE. Lic. Ana María Martín
 INTRODUCCIÓN AL EQUILIBRIO ÁCIDO BASE Lic. Ana María Martín EQUILIBRIO ÁCIDO-BASE 1.- Introducción Los solutos que son solubles en agua pueden clasificarse como electrolitos y no electrolitos. Electrolito:
INTRODUCCIÓN AL EQUILIBRIO ÁCIDO BASE Lic. Ana María Martín EQUILIBRIO ÁCIDO-BASE 1.- Introducción Los solutos que son solubles en agua pueden clasificarse como electrolitos y no electrolitos. Electrolito:
10.8. Balances de carga y materia
 10.8. Balances de carga y materia La determinación de la concentración de todas las especies en equilibrio de la disolución acuosa diluida de ácidos y bases se resume a un problema de N ecuaciones no lineales
10.8. Balances de carga y materia La determinación de la concentración de todas las especies en equilibrio de la disolución acuosa diluida de ácidos y bases se resume a un problema de N ecuaciones no lineales
