1. Si tenim un bloc de 100 g d alumini, quants mols d alumini tenim? Operem: 100 g de Al = 3,7 mol de Al. 27 g de Al
|
|
|
- Magdalena Cuenca Jiménez
- hace 6 años
- Vistas:
Transcripción
1 1. Si tenim un bloc de 100 g d alumini, quants mols d alumini tenim? Operem: 1 mol de Al 100 g de Al =,7 mol de Al 7 g de Al. Quants àtoms d alumini tenim en un bloc de 100 g d alumini? I en un de g? En 100 g d alumini hi ha,7 mol d alumini. En g d alumini hi ha 7 mol d alumini. 6,0 10 àtoms 100 g,7 mol 1 mol 6,0 10 àtoms g 7 mol 1 mol 4 =, 10 àtoms de Al 5 =, 10 àtoms de Al. Si tenim 5 10 àtoms d alumini, quants grams d alumini tenim? Recorda que per resoldre aquests exercicis sempre has d utilitzar la conversió a mols com a pas previ. Operem: 5 10 àtoms de Al 1 mol de Al 6,0 10 àtoms de Al =,4 g de Al 7 g de Al = 1mol de Al 4. Calcula quants grams d oxigen hi ha en 1 mol d aigua. I en 1 kg d aigua? 1 mol de O 16 g a) 1 mol = 16 g d'oxigen 1 mol de H O 1 mol de O b) g 1 mol de HO 18 g 1 mol de O 1 mol de H O 16 g de O = 888, 9 g d' oxigen 1 mol de O 5. Calcula quants àtoms d oxigen hi ha en 1 mol d aigua. I en 1 kg d aigua? 6,0 10 molècules de HO 1mol de HO 1 molde H O = 6, 0 10 molècules de HO En cada molècula d aigua hi ha un àtom d oxigen, per tant: en 1 mol d aigua hi ha 6,0 10 àtoms d oxigen. 16
2 SOLUCIONARI La massa molecular de l aigua és = u + 16 u = 18 u 1 mol de HO 6,0 10 molècules de HO g de HO 18 g de H O 1 mol de H O 5 =, 5 10 molècules de H O En cada molècula d aigua hi ha un àtom d oxigen, per tant: en g d aigua hi ha, àtoms d oxigen. = 6. Volem preparar 50 ml d una dissolució aquosa de clorur de calci 1,5 M Calcula quina quantitat de solut necessitem. En aquest cas: n M = n = M V = 1, 5 mol/l 0, 5 L = 0, 75 mol de CaCl V ( l) 7. Tenim 15 ml d una dissolució d hidròxid de calci en aigua 0,5 M. Calcula els mols i els grams d hidròxid de calci que tenim. V = 15 ml = 0,015 l. n M = n = M V = 0, 5 mol/l 0, 015 l = V () l = 0,0075 mol de Ca(OH) Massa molar = 40 u + 16 u + u 74 g/mol. m = 0,0075 mol 74 g/mol = 0,555 g de Ca(OH) 8. Calcula el volum de dissolució d àcid clorhídric 1,5 M que ens cal per tenir 0,5 mol d àcid. Tenim: n n 0, 5 mol M = V = = = 0, 4 l de HCl V () l M 1, 5 mol/l 9. El diòxid de sofre reacciona amb l oxigen per formar triòxid de sofre. a) Escriu i ajusta la reacció. b) Quants grams de diòxid de sofre són necessaris per formar 100 g de triòxid de sofre? a) La reacció química ajustada és: SO + 1 O SO b) Segons la reacció ajustada 1 mol de SO produeix 1 mol de SO Massa molar SO = u + 16 u 64 g/mol. Massa molar SO = u + 16 u 80 g/mol. 17
3 100 g de SO 1 mol de SO 80 g de SO 1 mol de SO 1 mol de SO 64 g de SO = 80 g de SO 1 mol de SO 10. Quan el butà (C 4 H 1O ) reacciona amb l oxigen es formen diòxid de carboni i aigua. Calcula quina quantitat de CO es genera en cremar 100 mol de butà. Partim de la reacció de combustió del butà ajustada per fer els càlculs: C H + 1 O 8 CO + 10 H O 4 10 Segons l estequiometria de la reacció, :8, si cremem 100 mol de butà es generaran 400 mol de diòxid de carboni. 11. El zinc reacciona amb l àcid clorhídric formant clorur de zinc i hidrogen gasós. Calcula quin volum d hidrogen en condicions normals es desprèn quan reaccionen 5 kg de zinc. Escrivim, en primer lloc, la reacció ajustada: Zn + HCl ZnCl + H Calculem la quantitat de substància que hi ha en 5 kg de zinc. La massa atòmica del Zn és 65,4 u. 1 mol de Zn g de Zn = 76,45 mol de Zn 65,4 g de Zn L estequiometria de la reacció és 1:1. Per tant, es desprendran 76,45 mol d hidrogen. Suposant condicions normals: V = 76,45 mol,4 l/mol = 1.71,5 l de H 1. Observa la reacció de l activitat 11 i després calcula el volum d una dissolució de HCl 1 M necessari perquè reaccionin completament 5 kg de zinc. Partim de la reacció de l activitat 11: Zn + HCl ZnCl + H Segons l estequiometria de la reacció, 1:, necessitarem: n = 76,45 mol = 15,9 mol de HCl El volum de dissolució necessari perquè reaccionin completament els 5 kg de zinc és: n n 15, 9 mol M = V = = = 15,9 l V () l M 1 mol/l 18
4 SOLUCIONARI 1. Explica l afirmació: «Una reacció química és un reagrupament d àtoms». Una reacció química es produeix quan les partícules d unes substàncies, anomenades reactius, xoquen entre si i es trenquen enllaços que mantenen units els seus àtoms. Aquests àtoms lliures es reorganitzen i s uneixen formant les noves substàncies: els productes. 14. En què es diferencien les reaccions exotèrmiques de les endotèrmiques? Indica si les reaccions químiques següents són exotèrmiques o endotèrmiques: a) Combustió del butà. b) Descomposició de la calcària per la calor. c) Encesa d un llumí. d) Escalfament de l òxid de mercuri per donar mercuri i oxigen. La ruptura i la formació d enllaços que es produeix en una reacció química implica un intercanvi de calor. Si l energia que es necessita per trencar els enllaços entre els àtoms dels reactius és més petita que la que es desprèn quan es formen els enllaços en els productes, en el procés global es desprèn energia i la reacció s anomena exotèrmica. En cas contrari, el procés global necessita energia i la reacció s anomena endotèrmica. Són exotèrmiques la a) i la c). Són endotèrmiques la b) i la d). 15. Assenyala les magnituds que es conserven de reactius i productes en una reacció química: a) El nombre de molècules. c) La massa. b) El nombre d àtoms. d) El nombre de mols. En una reacció química es conserva: b) El nombre d àtoms. c) La massa. 16 Què entens per velocitat de reacció? Indica quins factors hi influeixen: a) La temperatura. b) La massa molecular de les substàncies. c) La densitat. d) La concentració. La velocitat d una reacció és la rapidesa amb què els reactius es transformen en els productes. Els factors que hi influeixen són: a) La temperatura. d) La concentració. 19
5 17. Anomena els reactius i els productes de les reaccions següents: a) C + O CO c) Mg + O MgO b) NaOH + HCl NaCl + H O d) H + O H O a) Reactius: carboni i oxigen. Producte: diòxid de carboni. b) Reactius: hidròxid de sodi i àcid clorhídric. Productes: clorur de sodi i aigua. c) Reactius: magnesi i oxigen. Producte: òxid de magnesi. d) Reactius: hidrogen i oxigen. Producte: aigua. 18. Una reacció química origina oxigen amb una velocitat de 60 ml/min. Una altra reacció química produeix el mateix gas a una velocitat de 6 cm /s. Quina reacció produeix oxigen més ràpidament? Per poder comparar les velocitats s han d expressar en la mateixa unitat. Transformem, per exemple, la unitat de la segona reacció: 6 cm 60 s v = = 60 cm /min = 60 ml/min 1 s 1 min Les dues reaccions produeixen oxigen amb la mateixa rapidesa. 19. El diòxid de titani és el pigment més important del món; permet obtenir els blancs brillants dels electrodomèstics i les línies de les carreteres. Completa les relacions entre les diferents quantitats d aquest òxid. Masses atòmiques: O = 16 u; Ti = 48 u. Massa molecular (TiO ) = 48 u + 16 u = 80 u 80 g/mol. n = m(g)/m. 1 mol conté 6,0 10 molècules. Massa (g) Quantitat de substància (mol) Nombre de molècules 40 1, , ,1 6, El coure és un element químic essencial per a totes les espècies. Els pops i les aranyes tenen «sang blava» a causa de l hemocianina, que té coure, i que transporta l oxigen pels seus cossos. Una persona té uns 7 mg de coure en el cos, concentrat sobretot en el fetge i en els ossos. Expressa la quantitat de coure que té una persona: a) En mols. b) En nombre d àtoms. 0
6 SOLUCIONARI a) Per calcular els mols de coure necessitem la massa atòmica: 6,5 u. 1 mol de Cu - 7 mg de Cu 0,07 g de Cu = 1,1 10 mol de Cu 6,5 g de Cu b) Per calcular els àtoms de coure utilitzem el nombre d Avogadro: - 6,0 10 àtoms 1,1 10 mol de Cu 1 mol 1. Completa la taula que relaciona, per a un element químic, la seva massa en grams, el nombre d àtoms i la quantitat de substància. n = m(g)/m. 1 mol conté 6,0 10 àtoms. Element Massa atòmica (g/mol) Massa (g) 0 = 6,8 10 àtoms de Cu Quantitat de substància (mol) Nombre d àtoms Alumini , Carboni 1 6 0,5 10 Sodi Calci ,5 10. Completa la taula que relaciona, per a un compost químic, la seva massa en grams, la massa molecular, el nombre d àtoms i la quantitat de substància. Masses atòmiques: H = 1 u; O = 16 u; Na = u; C = 1 u. Compost Massa atòmica (g/mol) Massa (g) Quantitat de substància (mol) Nombre de molècules H O , H O , NaOH , 10 4 CH ,0 10. Et demanen que preparis una dissolució al 0 % en massa de clorur de sodi i creus que significa: 0 g de sal en 100 g de dissolvent. Si ho fas així, quina concentració centesimal tindrà la dissolució obtinguda? La massa de la dissolució és la suma de les masses del solut i del dissolvent, per tant: c (% massa) msolut 0 g = 100 = m 10 g dissolució 100 = 16, 7 % 1
7 4. Completa la frase: Quan diem que tenim una dissolució d alcohol al 96 %, volem expressar que tenim 96 grams d alcohol i 4 g de agua. No volem expressar que hi ha 96 g d alcohol en 100 g de agua. 5. Les bosses de sèrum fisiològic dels hospitals contenen una dissolució al 9 de clorur de sodi, la mateixa concentració que les cèl lules. Quines quantitats utilitzaries per preparar aquesta dissolució? Tria la resposta correcta. a) 9 g de NaCl en 100 g de H O. b) 9 g de NaCl en 1 l d aigua. c) 9 g de NaCl en 91 g d aigua. d) 9 g de NaCl en 991 g d aigua. L opció correcta és la d): 9 g de clorur de sodi en 991 g d aigua. Una dissolució al 9 de clorur sòdic implica 9 g de sal per cada g de dissolució. Per preparar-la necessitem 9 g de sal i 991 g de dissolvent. 6. Una simple sal, el clorur de potassi, essencial per a tots els éssers vius, utilitzada com a substituta de la sal comuna, pot ser letal si s injecta en dissolució a un ésser humà, perquè paralitza el cor, encara que no faci malbé altres òrgans. Completa la taula referida al percentatge en massa d una dissolució de clorur de potassi. Massa dissolució = massa solut + massa dissolvent. c (%massa) msolut = 100 m dissolució Solut (g) Dissolvent (g) % massa , El grau alcohòlic de les begudes s expressa en graus o en tant per cent en volum. Segons la normativa, una cervesa «sense alcohol» pot contenir fins a 1 % en volum, que equival a un grau. Completa la taula relativa al percentatge en volum de diferents begudes alcohòliques.
8 SOLUCIONARI Considerant el volum additiu: c V dissolució = V solut + V dissolvent (% volum) Vsolut = 100 V dissolució Solut (g) Dissolvent (ml) % volum , ,5 8. El lleixiu s obté fent que el clor borbollegi en una columna per la qual es va abocant una solució d hidròxid de sodi, de manera que quan reacciona forma hipoclorit de sodi. Completa la taula relativa a la molaritat d una dissolució d hidròxid de sodi, NaOH. Masses atòmiques: Na = u; O = 16 u; H = 1 u. Massa molecular (NaOH) = u + 16 u + 1 u = 40 u 40 g/mol. n m( g) M = n = M V ; n = m( g) = n M ( NaOH) V () l M ( NaOH) Solut (g) Volum de dissolució Quantitat de substància Molaritat 80 1 l ml,5 1, ml l 7,5 1,5 9. La vitamina B (niacina o àcid nicotínic) és una vitamina hidrosoluble que s obté a partir de la nicotina (verí mortal) i de l àcid nítric (àcid corrosiu). Si necessitem preparar en el laboratori mig litre d una dissolució 0,1 M d àcid nítric: a) Quants mols i grams d àcid nítric pur es necessiten per preparar-la? b) Un cop preparada, hi afegim mig litre d aigua. Quina serà la nova molaritat? a) Massa molecular (àcid nítric) = = 1 u + 14 u + 16 u = 6 u 6 g/mol. n M = n = M V = 0, 1 mol/l 0, 5 l = 0,05 mol V () l m( g) n = m( g) = n M ( HNO) = M ( HNO) = 0, 05 mol 6 g/ mol =,15 g b) Suposant que els volums són additius, tenim 0,05 mol en un volum total d un litre. Per tant, la nova molaritat serà 0,05 mol/l, és a dir 0,05 M.
9 0. L hidròxid de potassi s utilitza en la fabricació de sabons líquids i detergents. Una dissolució d hidròxid de potassi conté 11 g de solut per cada litre de dissolució. a) Calcula la molaritat de la dissolució. b) Si la densitat de la dissolució és d 1,1 g/ml, expressa la concentració en % en massa. Masses atòmiques: K = 9 u; O = 16 u; H = 1 u. a) Massa molecular (KOH) = 9 u +16 u +1 u = 56 u 56 g/mol. m( g) 11 g n = = = mol de KOH M ( KOH) 56 g/mol n M = V ( l) = 1 = mol/l b) m (dissolució) = d V = 1,1 g/ml ml = g. msolut 11 g c( %massa) = 100 = 100 = 10, 18 % m g dissolució 1. L àcid clorhídric està present al nostre estómac per facilitar el procés de digestió. Calcula la quantitat d àcid clorhídric pur que es necessita per preparar 1 l d una dissolució: a) 1 M b) 0,5 M c) M Tenim: n M = n = M V V ( L) Per a un litre de dissolució, la quantitat de solut, en mol, coincideix amb el valor de la concentració; per tant: a) 1 mol. b) 0,5 mol. c) mol.. Completa les frases: M (NaOH) = u + 16 u + 1 u = 40 u 40 g/mol. A a), c) i d) hi ha un mol de solut. a) Una dissolució 1 M de NaOH conté 40 g de NaOH en 1 l de dissolució. b) Una dissolució M de NaOH conté mol de NaOH en 1 l de dissolució. c) Una dissolució M de NaOH conté 40 g de NaOH en 0,5 l de dissolució. d) Una dissolució = 0,5 M de NaOH conté 40 g de NaOH en l de dissolució. 4
10 SOLUCIONARI. Es prepara una dissolució mesclant 100 g de clorur de sodi, 100 g d hidròxid de sodi i 800 g d aigua. Indica les opcions correctes: a) El % en massa del clorur de sodi és igual al de l hidròxid de sodi. b) El % en massa del NaCl és més gran que el % del NaOH. c) El % en massa del NaOH és del 10 %. d) El % en massa del NaCl és del 0 %. e) El % en masa del NaCl és del 15 %. És una dissolució que conté la mateixa quantitat de dos soluts. Per a cadascun d aquests la concentració serà: msolut 100 g c( %massa) = 100 = 100 = 10 % m g dissolució Per tant, són correctes la a) i la c). 4. En la reacció sofre més hidrogen per donar sulfur d hidrogen: es compleix que: Segons la reacció: S + H H S 1 mol de sofre reacciona amb 1 mol d hidrogen per donar 1 mol de sulfur d hidrogen. O també: g de sofre reaccionen amb g d hidrogen per donar 4 g de sulfur d hidrogen. a) mol de sofre es combinen amb mol d hidrogen. b) 0,5 mol d hidrogen originen 0,5 mol de sulfur d hidrogen. c) g de sofre reaccionen amb g d hidrogen. d) 16 g de sofre reaccionen amb 1 g d hidrogen. e) 64 g de sofre originen 68 g de sulfur d hidrogen. 5. L hidrogen, el més lleuger de tots els gasos, es considera el combustible del futur perquè en la seva combustió no origina productes contaminants, només vapor d aigua. Indica quines relacions són correctes per a la reacció: H+ 1 O HO a) g d hidrogen reaccionen amb g d oxigen. b) 4 g d hidrogen reaccionen amb g d oxigen. c) 1 g d hidrogen reacciona amb 16 g d oxigen. d) 16 g d hidrogen reaccionen amb 64 g d oxigen. 5
11 e) mols d hidrogen reaccionen amb mols d oxigen. f) 4 mols d hidrogen produeixen 8 mols d aigua. Masses atòmiques: H = 1 u; O = 16 u. Segons la reacció: 1 mol d hidrogen reacciona 0,5 mol d oxigen per donar 1 mol d aigua. O també: g d hidrogen reaccionen amb 16 g d oxigen per donar 18 g d aigua. Per tant, només és correcta la b). 6. De l equació: S + Fe FeS, podem deduir que: Masses atòmiques: S = u; Fe = 56 u. g de S reaccionen amb 56 g de Fe per donar 88 g de FeS (II). a) g de sofre reaccionen amb 56 g de ferro. b) 16 g de sofre reaccionaran amb 8 g de ferro. c) 8 g de sofre reaccionaran amb 14 g de ferro. d) 4 g de sofre reaccionaran amb 7 g de ferro. 7. L etanol o alcohol etílic és un biocombustible que pot ser l alternativa a la gasolina. Al Brasil i als Estats Units es produeixen grans quantitats d etanol a partir de la canya de sucre, la remolatxa i els cereals, i mig milió de cotxes ja circulen amb etanol a tot el món. a) Què és un biocombustible? b) Es pot considerar l etanol com una font d energia renovable? c) Quins avantatges i desavantatges presenta l etanol com a combustible? d) Escriu i ajusta l equació de fermentació de la glucosa (C 6 H 1 O 6 ), sabent que per l acció d enzims origina etanol i diòxid de carboni. e) Amb 90 g de glucosa, quants mols s obtenen d etanol i de diòxid de carboni? Masses atòmiques: C = 1 u; O = 16 u; H = 1 u. a) Els biocombustibles són combustibles d origen biològic obtinguts de manera renovable a partir de biomassa, és a dir, de restes orgàniques. b) El bioetanol és un alcohol produït a partir de la fermentació dels sucres que hi ha a la remolatxa, el blat de moro, l ordi, el blat, la canya de sucre, la melca o altres conreus energètics, que, barrejats amb la gasolina, produeixen un biocombustible. Es pot considerar una font d energia renovable, perquè els vegetals es poden conrear cada any. No existeix, per tant, el problema de l esgotament que es dóna amb els combustibles fòssils. 6
12 SOLUCIONARI c) L ús de l etanol com a combustible crea una certa controvèrsia. d) Contràriament al que se sol pensar, la combustió l etanol produeix més gasos d efecte hivernacle que la gasolina. Per trobar un avantatge ambiental en aquest combustible caldria recórrer a la idea que amb la seva combustió es torna el diòxid de l atmosfera absorbit durant el creixement de la planta que produeix l etanol. El bioetanol és un biocombustible d alt poder energètic amb característiques semblants a la gasolina, que presenta com a avantatge el fet que és un combustible renovable i, per tant, inesgotable, al contrari que el petroli. C6H1 O6 CH5OH (etanol) + CO e) M (glucosa) = 6 1 u + 1 u u = 180 u 180 g/mol. 1 mol de glucosa n(glucosa) = 90 g de glucosa = 0,5 mol de glucosa 180 g de glucosa Segons l estequiometria de la reacció, 1:, per a totes dues substàncies obtindrem 1 mol d etanol i 1 mol de diòxid de carboni. 8. Encara que l oxigen és el gas essencial de l aire, el més abundant és el nitrogen, que malgrat ser un gas inert, pot reaccionar a una temperatura i una pressió elevades amb l hidrogen per produir amoníac, un bon fertilitzant. a) Escriu la reacció de síntesi de l amoníac i ajusta-la. b) Completa la taula següent: a) N + H NH b) Segons l equació ajustada: 1 mol de nitrogen reacciona amb mol d hidrogen per donar mol d amoníac. O també: 8 g de nitrogen reaccionen amb 6 g d hidrogen per donar 4 g d amoníac. En condicions normals 1 mol de qualsevol gas ocupa un volum de,4 l. 1 mol de qualsevol substància conté el nombre d Avogadro de molècules. N H NH Quantitat de substància (mol) Molècules, ,0 10 6,0 10 Massa (g) 7 1,5 8,5 Volum en CN (l),7 11, 7,47 7
13 9. El gas natural és un combustible format per metà, un gas que es pot obtenir en la descomposició de les aigües residuals i de la matèria orgànica dels abocadors per bacteris anaerobis. Per això es pot considerar una font d energia renovable. En la combustió d 1 kg de metà: a) Quina quantitat d oxigen es consumeix? I d aire? b) Quants mols de diòxid de carboni es desprenen? c) Quina quantitat d energia es desprèn, sabent que en la combustió d un mol de metà s alliberen 890 kj? La reacció de combustió del metà és: a) M (CH 4 ) = 1 u + 4 u = 16 u. M (O ) = 16 u = u g de CH La concentració d oxigen a l aire és del 1 %. La massa d aire corresponent a g de O serà: g g 1% = 100 maire = 100 = ,6 g m 1 aire b) Com que es consumeix 1 kg de CH 4 : g de CH 4 4 CH + O CO + H O 4 1 mol de CH 16 g de CH = g de O 1 mol CH4 16 g de CH 1 mol de CO 1 mol de CH c) Es cremen 6,5 mol de metà. L energia despresa serà: mol de O 1 mol de CH Q = 6,5 mol 890 kj/mol = kj 4 4 g de O 1 mol de O = 6,5 mol de CO 40. El diòxid de carboni és un gas que s utilitza en els extintors per apagar petits focs d interior. Al laboratori es pot obtenir combinant àcid clorhídric i carbonat de calci, que originen, a més, clorur de calci i aigua. a) Escriu l equació química i ajusta-la. b) Calcula quants grams de carbonat de calci han de reaccionar per obtenir 100 g de diòxid de carboni. c) Explica per què s utilitza aquest gas per extingir incendis. a) CaCO + HCl CaCl + CO + H O b) M(CaCO ) = 40 u + 1 u + 16 u = 100 u; M(CO ) = 1 u + u = 44 u. 8
14 SOLUCIONARI La quantitat de substància de CO és: 1 mol de CO n(co ) = 100 g de CO =,7 mol de CO 44 g de CO,7 mol de CO 1 mol de CaCO 100 g de CaCO 1 mol de CO 1 mol de CaCO c) El diòxid de carboni és eficaç com a agent extintor, principalment perquè redueix el contingut d oxigen de l atmosfera mitjançant dilució fins a un punt en què la combustió no pot continuar. = 7, de CaCO 41. El monòxid de carboni és un gas perillós que es forma en les combustions incompletes. Quan reacciona amb l oxigen produeix diòxid de carboni, un gas no perillós utilitzat en les begudes carbòniques. a) Escriu l equació química i ajusta-la. b) Per què és perillós el monòxid de carboni? c) Completa la taula següent: a) La reacció química ajustada és: b) És un gas molt verinós, més perillós encara pel fet que és inodor i incolor. Substitueix de forma irreversible l oxigen a l hemoglobina de la sang. La intoxicació comença amb mals de cap, després marejos i, finalment, la mort. c) M(CO) = 1 u + 16 u = 8 u; M(O ) = 16 u = u; M(CO ) = 1 u + u = 44 u. Segons l equació ajustada: mol de monòxid de carboni reaccionen amb 1 mol d oxigen per donar mol de diòxid de carboni. O també: CO + O CO 56 g de monòxid de carboni reaccionen amb g d oxigen per donar 88 g de diòxid de carboni. En condicions normals 1 mol de qualsevol gas ocupa un volum de,4 l. 1 mol de qualsevol substància conté el nombre d Avogadro de molècules. CO O CO Quantitat de substància (mol) 1 Molècules 6,0 10, ,0 10 Massa (g) Volum en CN (l) 44,8,4 44,8 9
15 4. A les farmacioles de les cases és habitual trobar el pèroxid d hidrogen (H O ) o aigua oxigenada. Aquest medicament es descompon per l acció d un enzim o catalitzador que hi ha a la sang, la catalasa. Si observem que dos mols d aigua oxigenada es descomponen i es redueixen a la meitat en un minut: a) Quina velocitat té aquesta reacció en mol/s? I en g/s? b) Per què l aigua oxigenada actua com a desinfectant? c) Quina funció té la catalasa? a) 1 mol de HO 1 min v = = 0,017 mol/s 1 min 60 s Massa molecular (H O ) = 1 u + u = 4 u 4 g/mol. v = 0,0 mol/s 4 g/mol = 1,1 g/s b) En descompondre s, l aigua oxigenada allibera oxigen, que destrueix els microorganismes anaerobis. c) La catalasa és un enzim present a la sang que actua de catalitzador en la reacció de descomposició de l aigua oxigenada en aigua i oxigen. 4. Es fan reaccionar 49 g d àcid sulfúric amb zinc, segons la reacció: a) Ajusta la reacció química. H SO 4 + Zn ZnSO 4 + H b) Quant zinc es necessita per fer reaccionar totalment els 49 g d àcid sulfúric? c) Quina quantitat d hidrogen s obté? d) Quin volum ocuparà aquest hidrogen gasós mesurat en condicions normals? a) Està ajustada. H SO 4 + Zn ZnSO 4 + H b) Massa molecular (H SO 4 ) = u + u u = 98 u. 1 mol d àcid sulfúric 49 g d àcid sulfúric = 98 g d àcid sulfúric = 0, 5 mol d'àcid sulfúric Com que l estequiometria de la reacció és 1:1, es necessiten 0,5 mol de zinc perquè la reacció es produeixi del tot. m = 0,5 mol 65,4 g/mol =,7 g de Zn c) Segons l estequiometria obtindrem 0,5 mol d hidrogen. m = 0,5 mol g/mol = 1 g de hidrogen d) V = 0,5 mol,4 l/mol = 11, l de hidrogen. 0
16 SOLUCIONARI Els geòlegs, per reconèixer sobre el terreny si un sòl és calcari i conté carbonat de calci, duen un flascó amb àcid clorhídric. Quan el terreny conté CaCO, aquest àcid reacciona amb el HCl i origina efervescència (diòxid de carboni), clorur de calci (CaCl ) i aigua. a) Escriu la reacció química i ajusta-la. b) Quants mols i grams de diòxid de carboni s obtindran en condicions normals a partir de 50 ml de dissolució M d àcid clorhídric? c) Quants mols de carbonat de calci hauran reaccionat? a) CaCO + HCl CaCl + CO + H O b) Calculem els mols d àcid que es consumeixen en la reacció: n M = n = M V = mol/l 0,05 l = 0,15 mol de HCl V () l Segons l estequiometria s obtindran la meitat de mols de CO. 0,15 mol n = = 0,075 mol de CO 44 g de CO m = 0,075 mol de CO =, g de C 1 mol de CO c) Segons l estequiometria de la reacció, 1:, de CaCO en reaccionaran la meitat dels mols que es consumeixen d àcid: 0,075 mol de CaCO. El nostre planeta és verd perquè la molècula de clorofil la, que conté magnesi, pren de la llum solar el blau i el vermell i reflecteix el verd. El magnesi és un element essencial per a tots els éssers vius. Una reacció química característica d aquest metall és que és atacat per l àcid clorhídric i origina hidrogen i clorur de magnesi. Si es fan reaccionar 10 g de magnesi amb HCl en excés: a) Escriu la reacció química i ajusta-la. b) Quina quantitat d àcid es consumeix? c) Quants mols, grams i ml del gas s alliberen en condicions normals? a) Mg + HCl MgCl + H b) Calculem els mols corresponents a 10 g del metall: 1 mol de Mg 10 g de Mg = 0,417 mol de Mg 4 g de Mg Segons l estequiometria de la reacció, 1:, necessitarem el doble de mols d àcid, és a dir: n = 0,417 = 0,8 mol de HCl. c) Segons l estequiometria, obtindrem el mateix nombre de mols d hidrogen que de mols de Mg que es consumeixen, és a dir, 0,4 mol: m = 0,417 mol g/mol = 0,8 g d hidrogen V = 0,417 mol,4 l/mol = 9, l d hidrogen O 1
17 46. Pràcticament tota l energia que consumeix la biosfera procedeix de la fotosíntesi. La fotosíntesi és una reacció produïda per l acció de la llum solar i gràcies a la clorofil la de les plantes verdes, i en la qual a partir de diòxid de carboni (CO ) i aigua (H O) s origina oxigen (O ) i glucosa (C 6 H 1 O 6 ). a) Escriu la reacció química i ajusta-la. b) Quin volum d aigua (a 0 C i 1 atm) cal per reaccionar amb 100 g de CO? c) Calcula la quantitat de diòxid de carboni necessari per formar 100 g de glucosa. d) Quants litres d oxigen, en condicions normals, es desprenen al reaccionar 1 litre de CO amb un 1 litre d aigua? a) 6 CO + 6 H O 6 O + C H O b) En funció de la reacció ajustada i sabent que l aigua a 0 ºC i 1 atm és líquida (densitat kg/m = 1 g/cm ). 1 mol de CO 6 mol de HO 18 g de HO 100 g de CO 44 g de CO 6 mol de CO 1 mol de H O 1 cm de HO 1g de H O = 40, 9 cm = 40, 9 ml c) M(glucosa) = 6 1 u + 1 1u u = 180 u 180 g/mol. En funció de l estequiometria de la reacció, necessitem 6 mol de CO per obtenir 1 mol de glucosa: 100 g de C H O d) Partim del fet que la quantitat de substància d 1 litre de CO (gas) és: 1 l de CO mol de C H O 180 g de C H O 1 mol de CO = 0,045 mol de CO,4 l de CO i que la d 1 litre d aigua (líquida en condicions normals) és: =, mol de CO 6 mol de CO = 1 mol de C H O g de HO 1 l de HO 1 l de H O 1 mol de HO 18 g de H O = 55,56 mol de H O es fa evident que els 0,045 mol de CO són els que condicionen, «limiten», la reacció. Per tant, si segons l estequiometria de la reacció, per cada mol de diòxid de carboni s obté un mol d oxigen per 0,045 mol de diòxid de carboni s obtindran 0,045 mol d oxigen.
18 SOLUCIONARI,4 l d oxigen 0,045 mol d oxigen = 1 litre d oxigen 1 mol d oxigen 47. El vinagre està format per una dissolució al 5 % d àcid acètic. L àcid acètic (CH COOH) és una substància irritant que s origina, juntament amb l aigua, en l oxidació de l etanol o alcohol etílic que hi ha al vi (CH CH OH), per efecte de bacteris anaerobis. a) Escriu la reacció química i ajusta-la. b) Quina quantitat d àcid acètic s origina en l oxidació de 100 g d etanol? c) Què li passa al vi si en deixem una ampolla oberta durant quants dies? a) C H O + O C H O + H O 6 4 b) M (àcid acètic) = 1 u + 4 u + 16 u = 60 u 60 g/mol. M (etanol) = 1 u + 6 u + 16 u = 46 u 46 g/mol. Calculem els mols d etanol equivalents a una massa de 100 g: 1 mol d etanol 100 g d etanol 46 g d etanol =,17 mol d etanol Segons l estequiometria de la reacció, 1:1, aquesta quantitat seran els mols que obtindrem d àcid acètic, es a dir,17 mol d àcid acètic.,17 mol 60 g/mol = 10, 4 g d àcid acètic c) Si es deixa destapada una ampolla de vi uns quants dies, l etanol s oxida en presència de l oxigen de l aire, i es forma àcid acètic. Col loquialment diem que es pica o agreja. 48. Els termòmetres de mercuri ja no es fabriquen a causa de la perillositat que aquest metall pesant té per a les persones i per al medi ambient. Una de les formes d obtenció del mercuri és a partir d òxid de mercuri (II) que, quan s escalfa intensament, es descompon en els seus elements. a) Quins són els reactius i quins són els productes de la reacció? b) Escriu i ajusta la reacció de descomposició. c) És una reacció endotèrmica o exotèrmica? d) Calcula la quantitat de mercuri que es pot obtenir a partir de 100 g d òxid de mercuri (II). e) Investiga sobre els efectes perillosos per al medi ambient que té el mercuri. a) El reactiu és l òxid de mercuri (II), i els productes, oxigen i mercuri. b) HgO Hg + O c) És una reacció endotèrmica; per produir-se necessita aportació de calor.
19 d) Calculem els mols corresponents a 100 g d òxid. 1 mol de HgO 100 g de HgO = 0,46 mol de HgO 16,6 g de HgO Segons l estequiometria de la reacció, 1:1, obtindrem 0,46 mol de Hg. Calculem la massa corresponent a aquesta quantitat de metall: 00,6 g de Hg 0,46 mol de Hg = 9,61 g de Hg 1 mol de Hg e) El mercuri és un metall pesant que persisteix a la natura durant molt de temps. Una certa quantitat la poden produir de manera natural les roques, el sòl o els volcans, però les activitats humanes quasi han triplicat les emissions de mercuri a l atmosfera respecte als nivells preindustrials. La principal font d exposició al mercuri és el consum de peix, ja que els peixos, tant els d aigua dolça com els d aigua salada, en poden acumular grans quantitats en els teixits del seu cos. Una exposició crònica, encara que sigui de baixa intensitat, pot produir danys irreparables en el sistema nerviós, el cervell i els ronyons. 49. El ferro és un metall que s oxida fàcilment per formar òxid de ferro (III). a) Escriu i ajusta la reacció d oxidació del ferro. b) Calcula la quantitat d òxid que es pot obtenir a partir de 00 g de ferro. c) Com es poden protegir de l oxidació les estructures de ferro? a) La reacció ajustada és: 4 Fe + O FeO b) M (òxid) = 55,8 u + 16 u = 159,6 u 159,6 g/mol. Calculem els mols corresponents a 00 g del metall: 1 mol de Fe 00 g de Fe =,6 mol de Fe 55,8 g de Fe Segons l estequiometria de la reacció, 4:, obtindrem 1,8 mol d òxid. Calculem la massa corresponent a aquesta quantitat: 1,8 mol de Fe O 159,6 g de FeO = 86 g de Fe O 1 mol de Fe O c) Per evitar que el ferro estigui en contacte amb l oxigen de l aire, responsable que s oxidi, se sol protegir el metall cobrint-lo amb algun producte com l òxid de plom (IV) (conegut per plom vermell o mini), que forma una barrera entre els dos reactius. 4
20 SOLUCIONARI 50. Indica quin tipus de dissolució, vinagre (àcida) o bicarbonat de sodi (bàsica), utilitzaries per neutralitzar i alleujar les picades següents: a) La d una abella que conté substàncies àcides. b) La d una vespa que té substàncies de característiques bàsiques. c) La d una ortiga que conté àcid metanoic. d) La d una formiga que té substàncies de característiques àcides. a) Bicarbonat de sodi. b) Vinagre. c) Bicarbonat de sodi. d) Bicarbonat de sodi. 51. Indica el caràcter àcid o bàsic de les substàncies. a) Clorur d hidrogen. b) Hidròxid de potassi. c) Àcid sulfúric. d) Amoníac. a) Àcid. b) Bàsic. c) Àcid. d) Bàsic. 5. Indica si les substàncies següents són àcides o bàsiques. a) El suc de la llimona ph =. b) Un sabó detergent ph = 11. c) L aigua pura ph = 7. d) La llet ph = 6,5. e) La sang humana ph = 7,4. a) Àcida. b) Bàsica. c) Neutra. d) Lleugerament àcida. e) Lleugerament bàsica. 5
21 5. Observa les imatges i classifica la substàncies en funció de la seva acidesa o basicitat. a) b) c) a) és neutra b) és bàsica c) és àcida c > a > b 54. L àcid acètic CH COOH neutralitza l hidròxid de potassi KOH formant acetat de potassi CH COOK i aigua. a) Escriu la reacció química i ajusta-la. b) Quants mols d àcid acètic són necessaris per neutralitzar 1 mol de KOH? c) Quina concentració té una dissolució de KOH, si per neutralitzar-ne 0 ml calen 50 ml d àcid acètic 1 M? d) Quin volum d àcid acètic M cal per neutralitzar 50 cm de KOH 0,5 M? a) CH COOH + KOH CH COOK + H O ja està ajustada b) L estequiometria de la reacció entre l àcid acètic i l hidròxid de potassi és 1:1, per tant és necessari 1 mol de CH COOH. c) 1 mol de CHCOOH 1 mol de KOH 50 ml de CHCOOH = ml de CH COOH 1 mol de CH COOH = 0, 05 mol de KOH 0, 05 mol de KOH ml Concentració =,5 M 0 ml de KOH 1 litre d) 50 cm de KOH 1 ml 1 cm 0,5 mol de KOH = 0,05 mol de KOH ml de KOH Volum de CH COOH 0,05 mol de CH COOH ml de CHCOOH mol de CH COOH = 1,5 ml de CH COOH 6
22 SOLUCIONARI 55. Per neutralitzar l àcid fosfòric H PO 4 es pot utilitzar l hidròxid de calci per formar fosfat de calci Ca (PO 4 ) i aigua. a) Escriu i ajusta la reacció química. b) Quants mols de Ca(OH) són necessaris per neutralitzar 1 mol de H PO 4? c) Quina concentració té una dissolució d àcid fosfòric, si per neutralitzar-ne 1 litre cal 1 litre d hidròxid de calci M? d) Quin volum d hidròxid de calci 0,5 M cal per neutralitzar 100 cm d àcid fosfòric 1 M? a) H PO 4 + Ca(OH) Ca (PO 4 ) + 6 H O b) 1 mol de H PO 4 mol de Ca(OH) mol de H PO 4 = 1,5 mol de Ca(OH) c) 1 l Ca(OH) M mol de Ca(OH) mol de Ca(OH) mol de HPO 4 = 1, mol de H PO mol de Ca(OH) 1, mol de H PO4 en 1 l 1 l de HPO 4 1, M 4 d) 100 cm 1 ml 1 cm ml de Ca(OH) 0, 5 mol de Ca(OH) 1 mol de HPO ml de H PO 4 = 00 ml de Ca(OH) mol de Ca(OH) mol de H PO Per valorar una dissolució d hidròxid de magnesi s utilitza àcid sulfhídric i es forma sulfur de magnesi i agua. a) Escriu i ajusta la reacció química. b) Quants mols de H S són necessaris per neutralitzar 1 mol de Mg(OH)? c) Per fer la valoració, posem 10 cm de Mg(OH) a l erlenmeyer, i comprovem que es consumeixen 15 cm de H S 0,5 M que hi havia a la bureta. Quina valoració en resulta? a) H S + Mg(OH) MgS + H O b) L estequiometria de la reacció entre l hidròxid de magnesi i l àcid sulfhídric és 1:1, per tant és necessari 1 mol de H S. c) 15 cm 1 ml 0,5 mol de HS 1 mol de Mg(OH) = 1 cm ml 1 mol de H S = 7,5 10 mol de Mg(OH) 7,5 10 mol de Mg(OH) Concentració HS ml = 0,75 M 10 ml 1 l 7
23 EL RACÓ DE LA LECTURA En el primer text s assenyala que «les reaccions químiques que tenen lloc en aquestes gotetes són complicades». Aporta algun comentari en referència a aquesta afirmació. Vol dir, entre altres coses, que les reaccions no es duen a terme en un sol pas, sinó que hi ha diverses etapes. En el mateix extracte també es parla de «contaminants utilitzats en fluids de refrigeració de neveres i en aerosols que s han anat acumulant en l atmosfera». Aventura alguna solució per resoldre aquest problema. Resposta lliure. Una solució és que es prohibeixi l ús d aquesta mena de substàncies. Per quina raó creus que els científics han d estar especialment amatents a les conseqüències del canvi climàtic en els conreus de casa nostra? Resposta lliure. El canvi climàtic, és a dir, la modificació de les condicions ambientals, pot determinar variacions en les propietats i el desenvolupament dels vegetals conreats. Aporta alguna reflexió crítica referent al segon text pel que fa a les característiques del raïm i dels vins que se n obtindran. Resposta lliure. Com a conseqüència del canvi climàtic (pujada de temperatures i irregularitat de les pluges), el raïm madura més ràpid i assoleix altes concentracions de sucres i un ph més alt. Aquest raïm, amb un desfasament entre la maduresa de la polpa i la de la pell, produirà vins més durs, amb més graduació alcohòlica, menys acidesa i que es mantindran menys temps a l ampolla. En tots dos textos es parla de diferents reaccions químiques. Intenta identificar-les segons el que has après en aquesta unitat. En el primer text, es parla d alguns òxids de nitrogen i de sofre que reaccionen amb l aigua de pluja i formen àcids com l àcid nítric i l àcid sulfúric. NO + 1 / O + H O HNO SO + 1 / O + H O H SO 4 També parla de la destrucció de la capa d ozó, a causa del clor dels compostos clorofluorocarburs (CFC). O + Cl O + ClO En el segon text, es parla que l augment de les temperatures afavoreix la formació d alcohol (etanol) a partir dels sucres (glucosa), i aquest fet incrementa la graduació alcohòlica del vi. C 6 H 1 O 6 CH CH OH + CO 8
1,94% de sucre 0,97% de glucosa
 EXERCICIS DE QUÍMICA 1. Es prepara una solució amb 2 kg de sucre, 1 kg de glucosa i 100 kg d aigua destil lada. Calcula el tant per cent en massa de cada solut en la solució obtinguda. 1,94% de sucre 0,97%
EXERCICIS DE QUÍMICA 1. Es prepara una solució amb 2 kg de sucre, 1 kg de glucosa i 100 kg d aigua destil lada. Calcula el tant per cent en massa de cada solut en la solució obtinguda. 1,94% de sucre 0,97%
Lleis químiques Àtoms, elements químics i molècules Mesura atòmica i molecular Fórmula empírica i fórmula molecular
 Lleis químiques Àtoms, elements químics i molècules Mesura atòmica i molecular Fórmula empírica i fórmula molecular U1 Lleis químiques Lleis ponderals: - Llei de Lavoisier - Llei de Proust Teoria atòmica
Lleis químiques Àtoms, elements químics i molècules Mesura atòmica i molecular Fórmula empírica i fórmula molecular U1 Lleis químiques Lleis ponderals: - Llei de Lavoisier - Llei de Proust Teoria atòmica
LAS REACCIONES QUÍMICAS.
 1 Ajustes de reacciones químicas. LAS REACCIONES QUÍMICAS. Ejercicios de la unidad 8 1.- Ajusta por tanteo las siguientes reacciones químicas: a) C 3 H 8 + O CO + H O; b) Na + H O NaOH + H ; c) KOH + H
1 Ajustes de reacciones químicas. LAS REACCIONES QUÍMICAS. Ejercicios de la unidad 8 1.- Ajusta por tanteo las siguientes reacciones químicas: a) C 3 H 8 + O CO + H O; b) Na + H O NaOH + H ; c) KOH + H
EJERCICIOS DE DISOLUCIONES Y ESTEQUIOMETRÍA
 EJERCICIOS DE DISOLUCIONES Y ESTEQUIOMETRÍA REACCIONES: 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono, medido
EJERCICIOS DE DISOLUCIONES Y ESTEQUIOMETRÍA REACCIONES: 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono, medido
Exercicis amb els applets (1 al 8) de la pàgina :
 IES BELLVITGE SEMINARI DE FÍSICA I QUÍMICA Deures d estiu 2011 Deures d estiu Química de 1r de Batxillerat Exercicis amb els applets (1 al 8) de la pàgina : http://www.xtec.net/~erodri24/pagina_quimica/pagina2quimicap.htm
IES BELLVITGE SEMINARI DE FÍSICA I QUÍMICA Deures d estiu 2011 Deures d estiu Química de 1r de Batxillerat Exercicis amb els applets (1 al 8) de la pàgina : http://www.xtec.net/~erodri24/pagina_quimica/pagina2quimicap.htm
Programa Grumet Èxit Fitxes complementàries
 MESURA DE DENSITATS DE SÒLIDS I LÍQUIDS Activitat 1. a) Digueu el volum aproximat dels següents recipients: telèfon mòbil, un cotxe i una iogurt. Teniu en compte que un brik de llet té un volum de 1000cm3.
MESURA DE DENSITATS DE SÒLIDS I LÍQUIDS Activitat 1. a) Digueu el volum aproximat dels següents recipients: telèfon mòbil, un cotxe i una iogurt. Teniu en compte que un brik de llet té un volum de 1000cm3.
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO
 PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
Àmbit de les matemàtiques, de la ciència i de la tecnologia M14 Operacions numèriques UNITAT 2 LES FRACCIONS
 M1 Operacions numèriques Unitat Les fraccions UNITAT LES FRACCIONS 1 M1 Operacions numèriques Unitat Les fraccions 1. Concepte de fracció La fracció es representa per dos nombres enters que s anomenen
M1 Operacions numèriques Unitat Les fraccions UNITAT LES FRACCIONS 1 M1 Operacions numèriques Unitat Les fraccions 1. Concepte de fracció La fracció es representa per dos nombres enters que s anomenen
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 2, Opción B Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 2, Opción B Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio
Xupa-xup, sucre, respiració i velocitat de reacció
 Xupa-xup, sucre, respiració i velocitat de reacció BASILI MARTÍNEZ ESPINET INS Miquel Martí i Pol (Roda de Ter) RESUM Es presenta una experiència que estudia els factors que influeixen en la reacció d
Xupa-xup, sucre, respiració i velocitat de reacció BASILI MARTÍNEZ ESPINET INS Miquel Martí i Pol (Roda de Ter) RESUM Es presenta una experiència que estudia els factors que influeixen en la reacció d
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
TEMA I: REACCIONES Y ESTEQUIOMETRIA
 TEMA I: REACCIONES Y ESTEQUIOMETRIA 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano que quedan. c) Los gramos
TEMA I: REACCIONES Y ESTEQUIOMETRIA 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano que quedan. c) Los gramos
g/ml. Què volum d aquesta dissolució serà necessari per a preparar 250 ml de HNO 3, 2M?
 Problema 1.- L hidrocarbur età és gas a temperatura ambient. Es disposa de 12 litres d età mesurats en condicions normals. Si es realitza la combustió completa, calculeu: a) El nombre de mols d oxigen
Problema 1.- L hidrocarbur età és gas a temperatura ambient. Es disposa de 12 litres d età mesurats en condicions normals. Si es realitza la combustió completa, calculeu: a) El nombre de mols d oxigen
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
Materiales recopilados por la Ponencia Provincial de Química para Selectividad TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
TEMA 0: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 0: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
TEMA 0: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
3. Calcula la cantidad estequiométrica de hidrógeno molecular, en moles, necesaria para reaccionar con 5 moles de oxígeno en la síntesis del agua.
 CÁLCULOS ESTEQUIOMÉTRICOS BÁSICOS 1. Ajusta las siguientes reacciones químicas: C 3 H 6 (g) + O 2 (g) CO 2 (g) + H 2 O (g) N 2 (g) + H 2 (g) NH 3 (g) KClO 3 (aq) KCl (aq) + O 2 (g) H 2 O 2 (l) O 2 (g)
CÁLCULOS ESTEQUIOMÉTRICOS BÁSICOS 1. Ajusta las siguientes reacciones químicas: C 3 H 6 (g) + O 2 (g) CO 2 (g) + H 2 O (g) N 2 (g) + H 2 (g) NH 3 (g) KClO 3 (aq) KCl (aq) + O 2 (g) H 2 O 2 (l) O 2 (g)
ACTIVIDADES DE QUÍMICA. TERCERA EVALUACIÓN 1º BACHILLERATO
 ACTIVIDADES DE QUÍMICA. TERCERA EVALUACIÓN 1º BACHILLERATO Profesor: Féli Muñoz Escribe adecuadamente las ecuaciones químicas correspondientes a las reacciones químicas siguientes: a) En el proceso que
ACTIVIDADES DE QUÍMICA. TERCERA EVALUACIÓN 1º BACHILLERATO Profesor: Féli Muñoz Escribe adecuadamente las ecuaciones químicas correspondientes a las reacciones químicas siguientes: a) En el proceso que
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
j Unitat 3. Composició de les dissolucions i dispersions col. loïdals
 23 j Unitat 3. Composició de les dissolucions i dispersions col. loïdals Activitats 1. Quin és el percentatge en massa (%) d una dissolució de sucre que en conté 2 g en 500 g de dis solució? 2 g sucre?
23 j Unitat 3. Composició de les dissolucions i dispersions col. loïdals Activitats 1. Quin és el percentatge en massa (%) d una dissolució de sucre que en conté 2 g en 500 g de dis solució? 2 g sucre?
Problemas de Estequiometría (ampliación) Pág. Nº 1
 Problemas de Estequiometría (ampliación) Pág. Nº 1 MOLES, MOLÉCULAS Y ÁTOMOS: 1.- Calcular la masa de agua que contienen 0,23 moles de agua. Sol: 4,14 g 2.- Calcular la masa de una molécula de agua. Sol:
Problemas de Estequiometría (ampliación) Pág. Nº 1 MOLES, MOLÉCULAS Y ÁTOMOS: 1.- Calcular la masa de agua que contienen 0,23 moles de agua. Sol: 4,14 g 2.- Calcular la masa de una molécula de agua. Sol:
UNITAT DONAR FORMAT A UNA PRESENTACIÓ
 UNITAT DONAR FORMAT A UNA PRESENTACIÓ 4 Plantilles de disseny Una plantilla de disseny és un model de presentació que conté un conjunt d estils. Aquests estils defineixen tota l aparença de la presentació,
UNITAT DONAR FORMAT A UNA PRESENTACIÓ 4 Plantilles de disseny Una plantilla de disseny és un model de presentació que conté un conjunt d estils. Aquests estils defineixen tota l aparença de la presentació,
DISOLUCIONES Y ESTEQUIOMETRÍA
 DISOLUCIONES Y ESTEQUIOMETRÍA DISOLUCIONES 1.-/ Se disuelven 7 gramos de NaCl en 50 gramos de agua. Cuál es la concentración centesimal de la disolución? Sol: 12,28 % de NaCl 2.-/ En 20 ml de una disolución
DISOLUCIONES Y ESTEQUIOMETRÍA DISOLUCIONES 1.-/ Se disuelven 7 gramos de NaCl en 50 gramos de agua. Cuál es la concentración centesimal de la disolución? Sol: 12,28 % de NaCl 2.-/ En 20 ml de una disolución
CAMBIOS QUÍMICOS ACTIVIDADES DE REFUERZO ACTIVIDADES FICHA 1
 FICHA 1 DE REFUERZO 1. Escribe la fórmula y calcula la masa mo lecular de las siguientes sustancias: a) Dióxido de azufre. b) Hidruro de potasio. c) Ácido sulfúrico. d) Cloruro de berilio. 2. En un laboratorio
FICHA 1 DE REFUERZO 1. Escribe la fórmula y calcula la masa mo lecular de las siguientes sustancias: a) Dióxido de azufre. b) Hidruro de potasio. c) Ácido sulfúrico. d) Cloruro de berilio. 2. En un laboratorio
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA. 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué?
 REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
EJERCICIOS DE LA PAU CYL TEMA
 EJERCICIOS DE LA PAU CYL TEMA 0 2007-13 CONCEPTO DE MOL: 1. (16-S07) Calcule la masa de cada uno de los elementos presentes en: a) 2,5 moles de Ca. (0,6 puntos) b) 2,0 10 23 átomos de Al. (0,7 puntos)
EJERCICIOS DE LA PAU CYL TEMA 0 2007-13 CONCEPTO DE MOL: 1. (16-S07) Calcule la masa de cada uno de los elementos presentes en: a) 2,5 moles de Ca. (0,6 puntos) b) 2,0 10 23 átomos de Al. (0,7 puntos)
Veure que tot nombre cub s obté com a suma de senars consecutius.
 Mòdul Cubs i nombres senars Edat mínima recomanada A partir de 1er d ESO, tot i que alguns conceptes relacionats amb el mòdul es poden introduir al cicle superior de primària. Descripció del material 15
Mòdul Cubs i nombres senars Edat mínima recomanada A partir de 1er d ESO, tot i que alguns conceptes relacionats amb el mòdul es poden introduir al cicle superior de primària. Descripció del material 15
1. Se dispone de una disolución acuosa de ácido sulfúrico del 98% de riqueza en masa y densidad 1,84 g/ml.
 ESTEQUIOMETRÍA,DISOLUCIONES: ACTIVIDADES DE SELECTIVIDAD. 1. Se dispone de una disolución acuosa de ácido sulfúrico del 98% de riqueza en masa y densidad 1,84 g/ml. a) Qué volumen de esta disolución se
ESTEQUIOMETRÍA,DISOLUCIONES: ACTIVIDADES DE SELECTIVIDAD. 1. Se dispone de una disolución acuosa de ácido sulfúrico del 98% de riqueza en masa y densidad 1,84 g/ml. a) Qué volumen de esta disolución se
Seminario de Química 2º Bachillerato LOGSE Unidad 0: Repaso Química 1º Bachillerato
 A) Composición Centesimal y Fórmulas químicas 1.- Determina la composición centesimal del Ca3(PO4)2. Datos: Masas atómicas (g/mol): Ca=40; P=31; O=16 S: Ca= 38,7%; P=20%; O=41,3% 2.- Determina la composición
A) Composición Centesimal y Fórmulas químicas 1.- Determina la composición centesimal del Ca3(PO4)2. Datos: Masas atómicas (g/mol): Ca=40; P=31; O=16 S: Ca= 38,7%; P=20%; O=41,3% 2.- Determina la composición
TEMA 7: (productos de la reacción) por la reorganización de los átomos formando moléculas nuevas. Para ello es
 TEMA 7: REACCIONES QUÍMICAS Una Reacción Química es un proceso mediante el cual unas sustancias (reactivos) se transforman en otras (productos de la reacción) por la reorganización de los átomos formando
TEMA 7: REACCIONES QUÍMICAS Una Reacción Química es un proceso mediante el cual unas sustancias (reactivos) se transforman en otras (productos de la reacción) por la reorganización de los átomos formando
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Estequiometría (II)
 1(7) Ejercicio nº 1 El metano arde con oxígeno produciendo dióxido de carbono y agua. Si se queman 2 kg de metano calcula: a) Los gramos de oxígeno necesarios. b) Los gramos de dióxido de carbono producidos.
1(7) Ejercicio nº 1 El metano arde con oxígeno produciendo dióxido de carbono y agua. Si se queman 2 kg de metano calcula: a) Los gramos de oxígeno necesarios. b) Los gramos de dióxido de carbono producidos.
SEGUNDA PRACTICA DE QUÍMICA
 UNIVERSIDAD MAYOR DE SAN SIMÓN FACULTAD DE CIENCIAS Y TECNOLOGÍA DEPARTAMENTO DE QUÍMICA CURSO PROPEDÉUTICO ESTADO GASEOSO SEGUNDA PRACTICA DE QUÍMICA 1. El acetileno (C 2 H 2 ) es un combustible utilizado
UNIVERSIDAD MAYOR DE SAN SIMÓN FACULTAD DE CIENCIAS Y TECNOLOGÍA DEPARTAMENTO DE QUÍMICA CURSO PROPEDÉUTICO ESTADO GASEOSO SEGUNDA PRACTICA DE QUÍMICA 1. El acetileno (C 2 H 2 ) es un combustible utilizado
Unitat 10. La Taula Periòdica (Llibre de text Unitat 8, pàg )
 Unitat 10 La Taula Periòdica (Llibre de text Unitat 8, pàg. 267-284) Index D1 10.1. Taula Periòdica actual 10.2. Descripció de la Taula Periòdica actual 10.3. L estructura electrònica i la Taula Periòdica
Unitat 10 La Taula Periòdica (Llibre de text Unitat 8, pàg. 267-284) Index D1 10.1. Taula Periòdica actual 10.2. Descripció de la Taula Periòdica actual 10.3. L estructura electrònica i la Taula Periòdica
Física y Química 1ºBachillerato Ejemplo Examen. Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Ioduro de Calcio:
 Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
Física y Química 4 ESO REACCIONES QUÍMICAS Pág. 1
 Física y Química 4 ESO REACCIONES QUÍMICAS Pág. 1 REACCIONES QUÍMICAS Un proceso físico, o un fenómeno físico, es aquel en el que no se produce cambio en la naturaleza y las propiedades de las sustancias.
Física y Química 4 ESO REACCIONES QUÍMICAS Pág. 1 REACCIONES QUÍMICAS Un proceso físico, o un fenómeno físico, es aquel en el que no se produce cambio en la naturaleza y las propiedades de las sustancias.
Acuerdo 286. Química. Disoluciones. Recopiló: M.C. Macaria Hernández Chávez
 Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
EJERCICIOS DE REACCIONES QUÍMICAS. ESTEQUIOMETRÍA
 EJERCICIOS DE REACCIONES QUÍMICAS. ESTEQUIOMETRÍA La finalidad de esta colección de ejercicios resueltos consiste en que sepáis resolver las diferentes situaciones que se nos plantea en el problema. Para
EJERCICIOS DE REACCIONES QUÍMICAS. ESTEQUIOMETRÍA La finalidad de esta colección de ejercicios resueltos consiste en que sepáis resolver las diferentes situaciones que se nos plantea en el problema. Para
Seminarios de Química 1
 Seminarios de Química 1 Transformaciones Químicas Primera parte: Estequiometría Conceptos importantes Ley de servación de la masa en reacciones químicas. Representación de las reacciones químicas mediante
Seminarios de Química 1 Transformaciones Químicas Primera parte: Estequiometría Conceptos importantes Ley de servación de la masa en reacciones químicas. Representación de las reacciones químicas mediante
4. CAMBIOS QUÍMICOS 4.1. REACTIVIDAD QUÍMICA.
 4. CAMBIOS QUÍMICOS 4.1. REACTIVIDAD QUÍMICA. Las reacciones químicas se conocen desde la antigüedad: unas sustancias son capaces de transformarse en otras sustancias diferentes. De esa manera, se obtuvieron
4. CAMBIOS QUÍMICOS 4.1. REACTIVIDAD QUÍMICA. Las reacciones químicas se conocen desde la antigüedad: unas sustancias son capaces de transformarse en otras sustancias diferentes. De esa manera, se obtuvieron
UNITAT 3 OPERACIONS AMB FRACCIONS
 M Operacions numèriques Unitat Operacions amb fraccions UNITAT OPERACIONS AMB FRACCIONS M Operacions numèriques Unitat Operacions amb fraccions Què treballaràs? En acabar la unitat has de ser capaç de
M Operacions numèriques Unitat Operacions amb fraccions UNITAT OPERACIONS AMB FRACCIONS M Operacions numèriques Unitat Operacions amb fraccions Què treballaràs? En acabar la unitat has de ser capaç de
ACTIVITATS D'ESTEQUIOMETRIA
 5 ACTIVITATS D'ESTEQUIOMETRIA 1. El 21 de setembre de 2001, la planta de productes químics d' AZF situada a poca distància de Toulouse, es va produir una explosió, provocada fonamentalment per la descomposició
5 ACTIVITATS D'ESTEQUIOMETRIA 1. El 21 de setembre de 2001, la planta de productes químics d' AZF situada a poca distància de Toulouse, es va produir una explosió, provocada fonamentalment per la descomposició
Soluciones Actividades Tema 6 CAMBIOS QUÍMIICOS
 Soluciones Actividades Tema 6 CAMBIOS QUÍMIICOS Actividades Unidad Pág. 18.- Cuántos átomos son 0,5 mol de plata? Y 0,5 mol de magnesio? En ambos casos: 05, mol 6 0 10 1 mol 3, átomos 3 3.- Cuántos gramos
Soluciones Actividades Tema 6 CAMBIOS QUÍMIICOS Actividades Unidad Pág. 18.- Cuántos átomos son 0,5 mol de plata? Y 0,5 mol de magnesio? En ambos casos: 05, mol 6 0 10 1 mol 3, átomos 3 3.- Cuántos gramos
C: GASES Y PRESIÓN DE VAPOR DEL AGUA
 hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
ESTEQUIOMETRÍA. 3.- LEYES VOLUMÉTRICAS: 3.1. Ley de los volúmenes de combinación de gases o de Gay-Lussac. 3.2. Ley de Avogadro.
 ESTEQUIOMETRÍA 1.- ECUACIONES. SÍMBOLOS Y FÓRMULAS QUÍMICAS. 2.- LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS: 2.1. Ley de la conservación de la masa o de Lavoisier. 2.2. Ley de las proporciones constantes
ESTEQUIOMETRÍA 1.- ECUACIONES. SÍMBOLOS Y FÓRMULAS QUÍMICAS. 2.- LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS: 2.1. Ley de la conservación de la masa o de Lavoisier. 2.2. Ley de las proporciones constantes
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
TRANSFORMACIONES QUÍMICAS. ESTEQUIOMETRÍA.
 Tema 3 Estequiometría 1 TEMA 3. TRANSFORMACIONES QUÍMICAS. ESTEQUIOMETRÍA. 2. LAS REACCIONES QUÍMICAS. 1.- Señala justificándolas, las respuestas correctas: Se produce un cambio químico: a) Cuando las
Tema 3 Estequiometría 1 TEMA 3. TRANSFORMACIONES QUÍMICAS. ESTEQUIOMETRÍA. 2. LAS REACCIONES QUÍMICAS. 1.- Señala justificándolas, las respuestas correctas: Se produce un cambio químico: a) Cuando las
PROBLEMAS REPASO QUÍMICA.
 PROBLEMAS REPASO QUÍMICA. CÁLCULOS QUÍMICOS A) Concepto de mol, moléculas, leyes de los gases, leyes ponderales. 1.- Cuántos moles, átomos y moléculas hay en 4,6g de etanol (C 2 H 6 O)? Sol: 0,1 moles;
PROBLEMAS REPASO QUÍMICA. CÁLCULOS QUÍMICOS A) Concepto de mol, moléculas, leyes de los gases, leyes ponderales. 1.- Cuántos moles, átomos y moléculas hay en 4,6g de etanol (C 2 H 6 O)? Sol: 0,1 moles;
Disoluciones. AUTHOR: VICENTE GUZMÁN BROTÓNS
 Disoluciones AUTHOR: VICENTE GUZMÁN BROTÓNS http://bencenoanhidro.blogspot.com Disoluciones AUTHOR: VICENTE GUZMÁN BROTÓNS http://bencenoanhidro.blogspot.com Problemas de disoluciones 1. Calcula la concentración
Disoluciones AUTHOR: VICENTE GUZMÁN BROTÓNS http://bencenoanhidro.blogspot.com Disoluciones AUTHOR: VICENTE GUZMÁN BROTÓNS http://bencenoanhidro.blogspot.com Problemas de disoluciones 1. Calcula la concentración
Problemas del Tema 1. Estequiometria
 Problemas del Tema 1. Estequiometria Esta guía práctica es un material didáctico en construcción, destinada para estudiantes de la asignatura de Química General de la Facultad de Farmacia y Bioanálisis.
Problemas del Tema 1. Estequiometria Esta guía práctica es un material didáctico en construcción, destinada para estudiantes de la asignatura de Química General de la Facultad de Farmacia y Bioanálisis.
ESTEQUIOMETRIA. H 2 SO Na Na 2 SO 4 + H 2 Acido sulfúrico Sodio Sulfato de sodio Hidrógeno
 ESTEQUIOMETRIA 1.- Se hace reaccionar 4,00 g de ácido sulfúrico con sodio metálico en condiciones estequiométricas. a) Cuántos moles de sulfato de sodio se obtienen? b) Cuántas moléculas de hidrógeno se
ESTEQUIOMETRIA 1.- Se hace reaccionar 4,00 g de ácido sulfúrico con sodio metálico en condiciones estequiométricas. a) Cuántos moles de sulfato de sodio se obtienen? b) Cuántas moléculas de hidrógeno se
4.7. Lleis de Newton (relacionen la força i el moviment)
 D21 4.7. Lleis de ewton (relacionen la força i el moviment) - Primera Llei de ewton o Llei d inèrcia QUÈ ÉS LA IÈRCIA? La inèrcia és la tendència que tenen el cossos a mantenirse en repòs o en MRU. Dit
D21 4.7. Lleis de ewton (relacionen la força i el moviment) - Primera Llei de ewton o Llei d inèrcia QUÈ ÉS LA IÈRCIA? La inèrcia és la tendència que tenen el cossos a mantenirse en repòs o en MRU. Dit
DIVISIBILITAT. Amb els nombres 5, 7 i 35 podem escriure diverses expressions matemàtiques: 5x7= 35 35 5 35
 ESO Divisibilitat 1 ESO Divisibilitat 2 A. El significat de les paraules. DIVISIBILITAT Amb els nombres 5, 7 i 35 podem escriure diverses expressions matemàtiques: 5x7= 35 35 = 7 5 35 = 5 7 35 7 0 5 35
ESO Divisibilitat 1 ESO Divisibilitat 2 A. El significat de les paraules. DIVISIBILITAT Amb els nombres 5, 7 i 35 podem escriure diverses expressions matemàtiques: 5x7= 35 35 = 7 5 35 = 5 7 35 7 0 5 35
QUÍMICA 2º BACHILLERATO
 DISOLUCIONES: CONCENTRACIÓN DE LAS MISMAS 1.-/ Se disuelven 7 g de cloruro de sodio en 43 g de agua. Determine la concentración centesimal de la disolución, así como la fracción molar de cada componente
DISOLUCIONES: CONCENTRACIÓN DE LAS MISMAS 1.-/ Se disuelven 7 g de cloruro de sodio en 43 g de agua. Determine la concentración centesimal de la disolución, así como la fracción molar de cada componente
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL CURSO DE NIVELACION 1S-2014 EXAMEN FINAL DE QUIMICA Septiembre 9 de 2014
 ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL CURSO DE NIVELACION 1S-2014 EXAMEN FINAL DE QUIMICA Septiembre 9 de 2014 COMPROMISO DE HONOR Yo,.. al firmar este (Escriba aquí sus cuatro nombres) compromiso,
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL CURSO DE NIVELACION 1S-2014 EXAMEN FINAL DE QUIMICA Septiembre 9 de 2014 COMPROMISO DE HONOR Yo,.. al firmar este (Escriba aquí sus cuatro nombres) compromiso,
Reacciones químicas. Aspectos estequiométricos, energéticos, cinéticos, medioambientales y sociales
 Reacciones químicas Aspectos estequiométricos, energéticos, cinéticos, medioambientales y sociales Abordaremos ahora el estudio de los Cambios materiales, Energéticos, Cinéticos, medioambientales y sociales
Reacciones químicas Aspectos estequiométricos, energéticos, cinéticos, medioambientales y sociales Abordaremos ahora el estudio de los Cambios materiales, Energéticos, Cinéticos, medioambientales y sociales
Estequiometria estequio metría
 La estequiometria es el concepto usado para designar a la parte de la química que estudia las relaciones cuantitativas de las sustancias y sus reacciones. En su origen etimológico, se compone de dos raíces,
La estequiometria es el concepto usado para designar a la parte de la química que estudia las relaciones cuantitativas de las sustancias y sus reacciones. En su origen etimológico, se compone de dos raíces,
ÍNDEX 1 DEFINICIÓ 2 PER A QUÈ SERVEIX 3 COM ES REPRESENTA 4 PRIMER CONCEPTE 5 ESCALA DE REDUCCIÓ I ESCALA D AMPLIACIÓ 6 PROCEDIMENT DE CÀLCUL
 Francesc Sala, primera edició, abril de 1996 última revisió, desembre de 2007 ÍNDEX 1 DEFINICIÓ 2 PER A QUÈ SERVEIX COM ES REPRESENTA 4 PRIMER CONCEPTE 5 ESCALA DE REDUCCIÓ I ESCALA D AMPLIACIÓ 6 PROCEDIMENT
Francesc Sala, primera edició, abril de 1996 última revisió, desembre de 2007 ÍNDEX 1 DEFINICIÓ 2 PER A QUÈ SERVEIX COM ES REPRESENTA 4 PRIMER CONCEPTE 5 ESCALA DE REDUCCIÓ I ESCALA D AMPLIACIÓ 6 PROCEDIMENT
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio,
FÍSICA Y QUÍMICA -Valdepeñas de Jaén-
 Formulación: 0.- Formule o nombre los compuestos siguientes: a) Cromato de litio b) Carbonato de amonio c) 2,3-dimetilbutano d) Na 2 O 2 e) H 3 PO 4 f) CH 2 =CHCH 2 CH 2 CH 2 CHO Res. a) Li 2 CrO 4 ; b)
Formulación: 0.- Formule o nombre los compuestos siguientes: a) Cromato de litio b) Carbonato de amonio c) 2,3-dimetilbutano d) Na 2 O 2 e) H 3 PO 4 f) CH 2 =CHCH 2 CH 2 CH 2 CHO Res. a) Li 2 CrO 4 ; b)
L APARELL CIRCULATORI
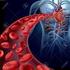 L APARELL CIRCULATORI NOM... CURS... L'aparell circulatori està format pel cor i els vasos sanguinis. El cor impulsa la sang pels vasos sanguinis, que recorren tot el cos. La funció principal de la circulació
L APARELL CIRCULATORI NOM... CURS... L'aparell circulatori està format pel cor i els vasos sanguinis. El cor impulsa la sang pels vasos sanguinis, que recorren tot el cos. La funció principal de la circulació
TRABAJO DE RECUPERACIÓN FÍSICA Y QUÍMICA 4t E.S.O SEPTIEMBRE 2016
 TRABAJO DE RECUPERACIÓN FÍSICA Y QUÍMICA 4t E.S.O SEPTIEMBRE 2016 QUÍMICA 1.Completa: 2. Cuántos electrones pueden existir en cada orbital: 3d, 2p, 4f y 5s? Cuáles son las características de gas noble?
TRABAJO DE RECUPERACIÓN FÍSICA Y QUÍMICA 4t E.S.O SEPTIEMBRE 2016 QUÍMICA 1.Completa: 2. Cuántos electrones pueden existir en cada orbital: 3d, 2p, 4f y 5s? Cuáles son las características de gas noble?
Características de electrones protones y neutrones
 Características de electrones protones y neutrones Carga eléctrica Masa Espín SI (C) Atómica SI(g) Atómica (uma) Protón +1,6021 10-19 +1 1,6725 10-24 1,0073 1/2 neutrón 0 0 1,6748 10-24 1,0087 1/2 electrón
Características de electrones protones y neutrones Carga eléctrica Masa Espín SI (C) Atómica SI(g) Atómica (uma) Protón +1,6021 10-19 +1 1,6725 10-24 1,0073 1/2 neutrón 0 0 1,6748 10-24 1,0087 1/2 electrón
TEMA 0: CONCEPTOS BÁSICOS
 1.- SUSTANCIAS PURAS Y MEZCLAS TEMA 0: CONCEPTOS BÁSICOS Las sustancias puras pueden ser: elementos o compuestos. a) Elementos: sustancias que no pueden descomponerse en otras más sencillas por métodos
1.- SUSTANCIAS PURAS Y MEZCLAS TEMA 0: CONCEPTOS BÁSICOS Las sustancias puras pueden ser: elementos o compuestos. a) Elementos: sustancias que no pueden descomponerse en otras más sencillas por métodos
TERMODINÀMICA. Recordeu que heu de buscar les dades necessàries a les taules
 8 Termodinàmica 1/6 TERMODINÀMICA Recordeu que heu de buscar les dades necessàries a les taules 1. Calor I Fins a quina temperatura s escalfaran 920 g d etanol a 15 ºC si els donem 4850 J? : 17,2 ºC. 2.
8 Termodinàmica 1/6 TERMODINÀMICA Recordeu que heu de buscar les dades necessàries a les taules 1. Calor I Fins a quina temperatura s escalfaran 920 g d etanol a 15 ºC si els donem 4850 J? : 17,2 ºC. 2.
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ESTEQUIOMETRÍA. cobre(ii) y se descompone, cuántas moles de dióxido de nitrógeno se formarán? A moles B moles C moles D. 0.
 ESTEQUIOMETRÍA 1 Al calentarse fuertemente, el nitrato de cobre(ii) se descompone en óxido de cobre(ii), dióxido de nitrógeno y oxígeno elemental (O 2 ). Si calentamos 0.10 moles de nitrato de cobre(ii)
ESTEQUIOMETRÍA 1 Al calentarse fuertemente, el nitrato de cobre(ii) se descompone en óxido de cobre(ii), dióxido de nitrógeno y oxígeno elemental (O 2 ). Si calentamos 0.10 moles de nitrato de cobre(ii)
SGUICEL009QM11-A16V1. Ácido base I: conceptos y teorías
 SGUICEL009QM11-A16V1 Ácido base I: conceptos y teorías Ítem Alternativa Habilidad 1 B Reconocimiento 2 A Comprensión 3 E Reconocimiento 4 E Comprensión 5 E ASE 6 E Comprensión 7 D Comprensión 8 E Comprensión
SGUICEL009QM11-A16V1 Ácido base I: conceptos y teorías Ítem Alternativa Habilidad 1 B Reconocimiento 2 A Comprensión 3 E Reconocimiento 4 E Comprensión 5 E ASE 6 E Comprensión 7 D Comprensión 8 E Comprensión
PRUEBA ACCESO A CICLOS FORMATIVOS DE GRADO SUPERIOR OPCIÓN C QUÍMICA
 PRUEBA ACCESO A CICLOS FORMATIVOS DE GRADO SUPERIOR OPCIÓN C QUÍMICA DATOS DEL ASPIRANTE Apellidos: CALIFICACIÓN PRUEBA Nombre: D.N.I. o Pasaporte: Fecha de nacimiento: / / Instrucciones: Lee atentamente
PRUEBA ACCESO A CICLOS FORMATIVOS DE GRADO SUPERIOR OPCIÓN C QUÍMICA DATOS DEL ASPIRANTE Apellidos: CALIFICACIÓN PRUEBA Nombre: D.N.I. o Pasaporte: Fecha de nacimiento: / / Instrucciones: Lee atentamente
EJERCICIOS DE REACCIONES QUÍMICAS. ESTEQUIOMETRÍA 4º E.S.O.
 EJERCICIOS DE REACCIONES QUÍMICAS. ESTEQUIOMETRÍA 4º E.S.O. NOTA DEL PROFESOR: La finalidad de esta colección de ejercicios resueltos consiste en que sepáis resolver las diferentes situaciones que se nos
EJERCICIOS DE REACCIONES QUÍMICAS. ESTEQUIOMETRÍA 4º E.S.O. NOTA DEL PROFESOR: La finalidad de esta colección de ejercicios resueltos consiste en que sepáis resolver las diferentes situaciones que se nos
EJERCICIOS DE CÁLCULO DE LA CONCENTRACIÓN DE UNA DISOLUCIÓN Y PROPIEDADES COLIGATIVAS. 1º BACHILLERATO
 EJERCICIOS DE CÁLCULO DE LA CONCENTRACIÓN DE UNA DISOLUCIÓN Y PROPIEDADES COLIGATIVAS. 1º La finalidad de este trabajo implica tres pasos: a) Leer el enunciado e intentar resolver el problema sin mirar
EJERCICIOS DE CÁLCULO DE LA CONCENTRACIÓN DE UNA DISOLUCIÓN Y PROPIEDADES COLIGATIVAS. 1º La finalidad de este trabajo implica tres pasos: a) Leer el enunciado e intentar resolver el problema sin mirar
Los tipos de reacciones inorgánicas son: Ácido-base (Neutralización), combustión, solubilización, reacciones redox y precipitación.
 Tipos de reacciones Los tipos de reacciones inorgánicas son: Ácido-base (Neutralización), combustión, solubilización, reacciones redox y precipitación. Desde un punto de vista de la física se pueden postular
Tipos de reacciones Los tipos de reacciones inorgánicas son: Ácido-base (Neutralización), combustión, solubilización, reacciones redox y precipitación. Desde un punto de vista de la física se pueden postular
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 6, Opción A Reserva, Ejercicio, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 6, Opción A Reserva, Ejercicio, Opción
LEYES FUNDAMENTALES DE LA QUÍMICA
 LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
Problemas Química Propuestos en las P.A.U. Termoquímica
 A) Relaciones Termoquimicas ( H, U) 1.- Calcula la variación de energía interna ( Uº) para la reacción de combustión del benceno líquido, C 6 H 6 (l), si el proceso se realiza a presión de 1 atm y 25ºC.
A) Relaciones Termoquimicas ( H, U) 1.- Calcula la variación de energía interna ( Uº) para la reacción de combustión del benceno líquido, C 6 H 6 (l), si el proceso se realiza a presión de 1 atm y 25ºC.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
5) En 20 g de Ni 2 (CO 3 ) 3 : a) Cuántos moles hay de dicha sal? b) Cuántos átomos hay de oxígeno? c) Cuántos moles hay de iones carbonato?
 QUÍMICA 2º BACH. SELECTIVIDAD: MOL-N A 1) Para un mol de agua, justifique la veracidad o falsedad de las siguientes afirmaciones: a) En condiciones normales de presión y temperatura, ocupa un volumen de
QUÍMICA 2º BACH. SELECTIVIDAD: MOL-N A 1) Para un mol de agua, justifique la veracidad o falsedad de las siguientes afirmaciones: a) En condiciones normales de presión y temperatura, ocupa un volumen de
Contenidos. Relación Masa-Número de Unidades. Determinación de fórmula Empírica y Molecular. Ecuación Química. Balance de Ecuaciones Químicas
 Estequiometria 10-1 Contenidos Relación Masa-Número de Unidades Determinación de fórmula Empírica y Molecular Ecuación Química Balance de Ecuaciones Químicas Relaciones Molares en Problemas de Estequiometría
Estequiometria 10-1 Contenidos Relación Masa-Número de Unidades Determinación de fórmula Empírica y Molecular Ecuación Química Balance de Ecuaciones Químicas Relaciones Molares en Problemas de Estequiometría
Districte Universitari de Catalunya
 Proves d accés a la Universitat. Curs 2006-2007 Tecnologia industrial Sèrie 3 La prova consta de dues parts de dos exercicis cadascuna. La primera part és comuna i la segona té dues opcions (A o B), de
Proves d accés a la Universitat. Curs 2006-2007 Tecnologia industrial Sèrie 3 La prova consta de dues parts de dos exercicis cadascuna. La primera part és comuna i la segona té dues opcions (A o B), de
2. Quins aspectes del model atòmic de Dalton es mantenen vigents i quins aspectes s ha demostrat que són incorrectes?
 Unitat 8. de Dalton, Thomson i Rutherford 1. Activitat inicial Per comprovar quins són els teus coneixements previs sobre l estructura atòmica, fes un dibuix que representi com penses que és un àtom. Sobre
Unitat 8. de Dalton, Thomson i Rutherford 1. Activitat inicial Per comprovar quins són els teus coneixements previs sobre l estructura atòmica, fes un dibuix que representi com penses que és un àtom. Sobre
MAGNITUDES MOLARES COMPOSICIÓN DE LAS DISOLUCIONES. Actividad 7. Actividad 1. Actividad 8. Actividad 2. Actividad 9. Actividad 3.
 MAGNITUDES MOLARES {Respuesta: [a] 0, mol; [b] 0,82 mol; [c] 0,56 mol} Actividad [a] En qué se parecen y en qué se diferencian las siguientes magnitudes: masa molecular relativa y masa molar? [b] Calcula
MAGNITUDES MOLARES {Respuesta: [a] 0, mol; [b] 0,82 mol; [c] 0,56 mol} Actividad [a] En qué se parecen y en qué se diferencian las siguientes magnitudes: masa molecular relativa y masa molar? [b] Calcula
Compuesto N. Stock N. tradicional N. sistemática. óxido de hierro (III) óxido férrico trióxido de dihierro
 Ejemplos de óxidos básicos FeO Fe 2 O 3 Cu 2 O CuO CaO PbO 2 óxido de hierro (II) óxido ferroso monóxido de hierro óxido de hierro (III) óxido férrico trióxido de dihierro óxido de cobre (I) óxido cuproso
Ejemplos de óxidos básicos FeO Fe 2 O 3 Cu 2 O CuO CaO PbO 2 óxido de hierro (II) óxido ferroso monóxido de hierro óxido de hierro (III) óxido férrico trióxido de dihierro óxido de cobre (I) óxido cuproso
Formulación Inorgánica Ejercicios (II)
 Ejercicios (II) EJERCICIOS DE FORMULACIÓN INORGÁNICA (II) COMPUESTOS BINARIOS DEL OXÍGENO 1.- Nombrar: Cl2O7 FeO N2O SO3 Cr2O3 Br2O P2O5 CO2 I2O5 2.- Formular: MnO2 Trióxido de dicromo Óxido de nitrógeno
Ejercicios (II) EJERCICIOS DE FORMULACIÓN INORGÁNICA (II) COMPUESTOS BINARIOS DEL OXÍGENO 1.- Nombrar: Cl2O7 FeO N2O SO3 Cr2O3 Br2O P2O5 CO2 I2O5 2.- Formular: MnO2 Trióxido de dicromo Óxido de nitrógeno
UD 2 ENLACE QUÍMICO Y FUERZAS INTERMOLECULARES FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS TERNARIOS
 FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS TERNARIOS Ácidos oxoácidos o ternarios Se formulan añadiendo una molécula de agua a los óxidos no metálicos. Óxidos no metálicos Cl 2 O SO Cl 2 O 3 SO 2 N 2 O 3
FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS TERNARIOS Ácidos oxoácidos o ternarios Se formulan añadiendo una molécula de agua a los óxidos no metálicos. Óxidos no metálicos Cl 2 O SO Cl 2 O 3 SO 2 N 2 O 3
7. CAMBIOS QUÍMICOS. Los cambios químicos. 1. Define reacción química. Distingue entre reacción química y cambio físico.
 7. CAMBIOS QUÍMICOS Los cambios químicos 1. Define reacción química. Distinue entre reacción química y cambio físico. Una reacción química es un proceso por el cual unas sustancias se transforman en otras
7. CAMBIOS QUÍMICOS Los cambios químicos 1. Define reacción química. Distinue entre reacción química y cambio físico. Una reacción química es un proceso por el cual unas sustancias se transforman en otras
Les funcions que apliquen a tots els elements del domini la mateixa imatge es diu funció constant, evidentment han d ésser del tipus f(x) = k (k R)
 1 1 3 FUNCIONS LINEALS I QUADRÀTIQUES 3.1- Funcions constants Les funcions que apliquen a tots els elements del domini la mateixa imatge es diu funció constant, evidentment han d ésser del tipus f(x) k
1 1 3 FUNCIONS LINEALS I QUADRÀTIQUES 3.1- Funcions constants Les funcions que apliquen a tots els elements del domini la mateixa imatge es diu funció constant, evidentment han d ésser del tipus f(x) k
5. Cuánto pesan 1,025 moles de amoníaco más 6, átomos de plata? Expresa el resultado en gramos. Dato: 1 u = 1, g Sol: 125,295 g
 EJERCICIOS DE REPASO 2º BACH CANTIDADES EN QUÍMICA 1. La masa atómica de la plata que encontramos en las tablas es de 107,87 u. Determina la abundancia relativa de los dos isótopos que tiene, sabiendo
EJERCICIOS DE REPASO 2º BACH CANTIDADES EN QUÍMICA 1. La masa atómica de la plata que encontramos en las tablas es de 107,87 u. Determina la abundancia relativa de los dos isótopos que tiene, sabiendo
GUÍA N 9: ESTEQUIOMETRIA
 Preuniversitario Belén UC Química Plan Común Prof. Juan Pastrián Lisboa GUÍA N 9: ESTEQUIOMETRIA La estequiometría tiene por finalidad establecer aquellas relaciones entre reactantes y productos en una
Preuniversitario Belén UC Química Plan Común Prof. Juan Pastrián Lisboa GUÍA N 9: ESTEQUIOMETRIA La estequiometría tiene por finalidad establecer aquellas relaciones entre reactantes y productos en una
COLEGIO AGUSTINIANO CIUDAD SALITRE AREA DE CIENCIAS NATURALES Y EDUCACIÓN AMBIENTAL TALLER DE QUIMICA #1 CUARTO PERIODO 2015 GRADO NOVENO
 TALLER DE QUIMICA #1 TEMA: TALLER DE REPASO Y CLASIFICACIÓN DE REACCIONES QUÍMICAS 1. Escriba, clasifique y balancee las siguientes ecuaciones químicas que se describen en los siguientes procesos: A) Se
TALLER DE QUIMICA #1 TEMA: TALLER DE REPASO Y CLASIFICACIÓN DE REACCIONES QUÍMICAS 1. Escriba, clasifique y balancee las siguientes ecuaciones químicas que se describen en los siguientes procesos: A) Se
AGUA Y SOLUCIONES Elaborado por: Lic. Raúl Hernández M.
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO ESCUELA DE FORMACIÓN DE PROFESORES DE NIVEL MEDIO EFPEM AGUA Y SOLUCIONES Elaborado por:
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO ESCUELA DE FORMACIÓN DE PROFESORES DE NIVEL MEDIO EFPEM AGUA Y SOLUCIONES Elaborado por:
3.- Cuál de las siguientes formulaciones es la correcta para la sal trioxoclorato (V) de litio (clorato de litio)?
 UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
PRUEBA ESPECÍFICA PRUEBA 201
 PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 201 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada ejercicio
PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 201 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada ejercicio
FÍSICA Y QUÍMICA cuaderno de ejercicios
 FÍSICA Y QUÍMICA cuaderno de ejercicios FORMULACIÓN y nomenclatura 1.** Determinen si las siguientes afirmaciones se refieren a metales o a no metales. 1.1. Presentan un brillo característico. 1.2. Los
FÍSICA Y QUÍMICA cuaderno de ejercicios FORMULACIÓN y nomenclatura 1.** Determinen si las siguientes afirmaciones se refieren a metales o a no metales. 1.1. Presentan un brillo característico. 1.2. Los
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
CLASE Nº 2 ESTEQUIOMETRÍA
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
Districte Universitari de Catalunya
 Proves dʼaccés a la Universitat. Curs 2007-2008 Química Sèrie 4 Contesteu les preguntes 1, 2, 3, i la 4 i la 5 d UNA de les dues opcions (A o B). En cap cas podeu fer un exercici de l opció A i un altre
Proves dʼaccés a la Universitat. Curs 2007-2008 Química Sèrie 4 Contesteu les preguntes 1, 2, 3, i la 4 i la 5 d UNA de les dues opcions (A o B). En cap cas podeu fer un exercici de l opció A i un altre
3ºESO-A PROFESORA LUCÍA ROMERO
 PLAN DE REFUERZO ÁREA PENDIENTE DE CIENCIAS NATURALES 3ºESO-A PROFESORA LUCÍA ROMERO BIOLOGÍA Y GEOLOGÍA: Resumen de cada tema del libro y las siguientes actividades: PRIMER TRIMESTRE: - Tema 1: La salud
PLAN DE REFUERZO ÁREA PENDIENTE DE CIENCIAS NATURALES 3ºESO-A PROFESORA LUCÍA ROMERO BIOLOGÍA Y GEOLOGÍA: Resumen de cada tema del libro y las siguientes actividades: PRIMER TRIMESTRE: - Tema 1: La salud
