1. La solidificación. Su proceso y velocidad.
|
|
|
- José Duarte Martínez
- hace 6 años
- Vistas:
Transcripción
1 1. La solidificación. Su proceso y velocidad. La solidificación es un proceso mediante el cual un material metálico, en estado líquido, pasa al estado sólido mediante enfriamiento en un molde, que una vez solidificado, este material tiene forma de lingote. Este proceso industrial es muy importante, ya que casi toda la metalurgia, se basa en este fenómeno. El proceso de solidificación se sigue mediante la curva de enfriamiento, que representa la variación del tiempo frente a la temperatura. Un material en estado sólido, al enfriarse, va desprendiendo energía hasta que llega a la temperatura alrededor del punto de fusión y comienza a solidificar, ordenándose su microestructura. De acuerdo al segundo principio termodinámico: Δ S = H f T ;el valor de la entropía final (S) es menor que la inicial; esto nos indica que el estado del sistema ha pasado ha ser más ordenado. Los núcleos iniciales de solidificación, se inician normalmente en las proximidades del recipiente que contiene el líquido o bien, alrededor de una partícula de alto punto de fusión que se coloca en el seno del líquido. Estos agentes reciben el nombre de nucleantes. Para estudiar la solidificación, se ha de tener en cuenta dos velocidades: la de nucleación (número de núcleos estables formados en la unidad de tiempo) y la velocidad de crecimiento ( determinada por el aumento de la masa de los núcleos con el tiempo). Estos dos factores dependen de la fuerza inductora del proceso y del mecanismo de difusión. La fuerza inductora del proceso se valora por el gradiente de energía entre el punto de fusión ideal y el subenfriado, de tal forma, que cuanto mayor sea el gradiente, mayor será la velocidad de nucleación. La difusión de los gránulos influye notablemente en la velocidad de crecimiento. Esta velocidad de difusión aumenta con la temperatura, por lo que será mayor a temperaturas próximas a la temperatura ideal. Según esto el fenómeno de solidificación, se ve influenciado por dos conceptos contrapuestos, por lo que, si la velocidad de nucleación es mayor que la difusión, la estructura del sólido será altamente granular; si por el contrario, la velocidad de crecimiento es mayor, el tamaño de los gránulos de solidificación será mayor. Desde el punto de vista técnico, interesa un material con unos gránulos pequeños, por lo tanto se debe aumentar la velocidad de nucleación, o bien enfriando el líquido con rapidez ( el grado de subenfriamiento es elevado) o bien fragmentando los gránulos formados en el crecimiento, mediante agitación intensa. 2. Los diagramas de equilibrio Líquido- Sólido. Regla de las fases. Se define como fase a una porción o parte homogénea de una sustancia que difiere de los demás en su composición, estructura o estado de agregación. La representación de las diferentes fases existentes en un material, se representa mediante el diagrama de fases. En un diagrama de fases se representan las dos magnitudes de estado intensivas ( p y T), apareciendo las fases, sólida, líquida y vapor y las fronteras entre cada una de ellas. En el siguiente diagrama se realiza la representación para el caso del agua pura:
2 En el diagrama de fases se puede apreciar la existencia de los tres estados de agregación y las fronteras entre ellos, en forma de líneas de equilibrio donde subsisten las dos fases. El caso el agua presenta una anomalía en cuanto la pendiente de la línea de equilibrio S-L, es negativa. Gibss, utilizando las leyes termodinámicas determinó la regla de las fases, que establece que: F + L = C + 2 F.- es el número de fases. L.- es el grado de libertades, que corresponden a las dos variables termodinámicas (p y T) y a la composición, en el caso de que la sustancia no sea pura. C.- Son los componentes o diferentes estados de agregación. 3. Diagrama de equilibrio en aleaciones. Cuando representamos el diagrama de fases para una sustancia pura a una determinada presión, el diagrama se reducirá a una línea recta definida por la variación de la temperatura, señalando los puntos singulares, correspondientes a los cambios de estado: Cuando se representa, en lugar de una sustancia pura, una aleación formada por dos metales, el diagrama es plano, formado por una abscisa que corresponde a la composición
3 centesimal de cada metal y la ordenada que representa la temperatura. Cuando la composición de la aleación es por ejemplo del 50%, el líquido comenzara a solidificar a una temperatura T 1 inferior a la temperatura de fusión del metal de mayor PF. En este momento empezarán a formarse gránulos de átomos de A y comenzará a aumentar la concentración de átomos de B hasta que solidifica toda la aleación a una temperatura T 2 superior a la temperatura de fusión del B. En el caso de la industria metalúrgica solamente tienen interés los diagramas de fases S-L. Existen dos líneas de equilibrio, que es la línea de líquidus y la línea de sólidus, entre las cuales existirá un equilibrio sólido-líquido. En los puntos sobre estas líneas, al aplicar la regla de las fases, ocurrirá que : 2 + L = 2 +1, los grados de libertad es uno, pudiendo modificar la temperatura o la composición de la mezcla. Se puede cambiar la concentración o la temperatura, pero si una de ellas queda fija, la otra también quedará fijada. En el interior de las dos curvas ocurre exactamente lo mismo. En el interior del dominio del líquido o sólido los grados de libertad son dos, la composición y la temperatura. p = cte B A Como se puede observar la curva de enfriamiento al 50 % no posee tramo horizontal en el punto de fusión. De acuerdo al diagrama de fases establecido, es posible determinar: En el punto A la aleación se encuentra en estado sólido con una composición al 50 % de solubilidad total entre ambos componentes. En el punto B se encuentra la aleación en dos fases coexistiendo una disolución sólida con el estado líquido. En esta situación, es posible determinar la composición química de los componentes atendiendo a la regla horizontal. Para ello se traza una recta horizontal isoterma que pase por el punto B y en los puntos de corte con la líneas de equilibrio nos mostrará la composición de la fase líquida y la fase sólida; así, la fase sólida estará formada por el 75 % de A y la composición de la fase líquida será el 15% de A. Otra forma para determinar la composición será la utilización de la regla de los segmentos inversos :
4 ω L = Csa Ca Csa Cla y ω S = ( 1 ω L ) = Ca Cla Csa Cla siendo ω L y ω S los tantos por uno en peso de las fases líquida y sólida respectivamente, del componente A; Csa, Csb, Cla y Clb, la composición en tanto por ciento en peso de los componentes a y b en las fases sólidas y líquidas; Ca y Cb son la composición de la aleación. Al dividir las dos expresiones anteriores se obtiene : l X = siendo X el brazo : Csa Ca e Y el brazo Ca Cla s Y por lo tanto se cumplirá la regla de la palanca ω L. Y = ω S. X 4. Diagrama de equilibrio en aleaciones eutécticas. Una aleación es eutéctica, cuando una determinada composición es muy estable en fase líquida y solidifica a una temperatura inferior a la de los componentes puros. 90% 85% El diagrama superior representa a dos metales totalmente insolubles entre si en estado
5 sólido, dando lugar a una aleación eutéctica para 75 % de A. En la posición I, la aleación permanecerá en estado fundido hasta la temperatura T 1, coexistiendo las fases sólidas A y B y la fase líquida, no teniendo ningún grado de libertad, la temperatura es constante. Este proceso se repite sucesivamente obteniendo un núcleo de solidificación de A, seguido de otro de B y así sucesivamente, manteniéndose la temperatura constante. La estructura del sólido eutéctico es especial pues está dispuesto de láminas entre mezcladas de A y B. Las aleaciones situadas a la izquierda del punto eutéctico, recibe el nombre de hipoeutéctico y las aleaciones a la derecha son las aleaciones hipereutécticas. En una aleación hipoeutéctica, ( en el caso II) con el 90 % de A, el contenido de átomos de B es inferior al de la composición eutéctica comenzando la solidificación a una temperatura T 2 inferior a la temperatura de fusión T A, peros superior a T 1. Se comenzarán inicialmente a formarse núcleos sólidos del metal puro A. En un punto intermedio, cumplirá la regla de los segmentos o de la palanca: ω S = ω L = Csa Ca Csa Cla Ca Cla Csa Cla = = 0.3 = = 0.4 La solidificación en la condición hipereutéctica será similar a la hipoeutéctica pero teniendo un mayor porcentaje en el componente B, que será puro, rodeado de una matriz eutéctica. En ocasiones los metales que forman parte de las disoluciones eutécticas, poseen una solubilidad parcial; este caso es el más frecuente. El diagrama es el que se muestra a continuación. En el punto eutéctico se forman las soluciones sólidas α + β, cuya composición biene dada por los extremos de la línea horizontal. Al enfriar la solución I por debajo de la temperatura eutéctica irá cambiando la composición de las fases α y β, según se comprueba trazando las rectas horizontales y aplicando la regla de los segmentos inversos. En el caso de la aleación III la solidificación comienza a una temperatura T 2 inferior a la temperatura de fusión del componente A puro, formándose un sólido de fase α de una determinada
6 composición hasta la temperatura T 3 en el que la composición de la fase sólida α iguala a la de la aleación. Antes de llegar la temperatura eutéctica, aparece la solidificación total y entonces el constituyente laminar α + β no se encontrará. Al pasar el dominio de dos fases α + β se transformará al estado sólido. Las curvas de enfriamiento serán las siguientes: 5. Estado de solidificación en no equilibrio. Los diagramas de equilibrio se obtienen en un periodo de tiempo dilatado. Normalmente, los procesos industriales de solidificación se realizan a velocidades de solidificación no lentas, dando lugar a distorsiones de los diagramas de equilibrio, pudiendo aparecer nuevas fases. Si dos metales presentan una solubilidad total en estado sólido, no presentan puntos eutécticos y la solidificación es rápida, el sistema será de no equilibrio. Una solidificación rápida de no equilibrio, al enfriarse comenzará a solidificar a la temperatura T 1, apareciendo el primer núcleo sólido de composición α 1. A la temperatura T 2 se formará un sólido α 2 ; debido a la alta velocidad de solidificación, los fenómenos de difusión no se producen convenientemente y por lo tanto la composición será de un núcleo de x 1 y en la periferia una composición x 2, siendo la composición global la intermedia entre ambas α. A la temperatura T 3 corresponde el final de la solidificación, en este caso se forma un sólido de composición α o igual a la aleación. En condiciones de velocidad rápida de enfriamiento, la composición real de la mezcla será la correspondiente al punto 2. La solidificación de no equilibrio finaliza a la temperatura T f, formándose una última capa de sólido α f, correspondiente al punto 3 del diagrama: Solidificación
7 Los efectos más interesantes que ocurren en la solidificación de no equilibrio son los siguientes: 1. El intervalo de solidificación aumenta pues la temperatura final disminuye. 2. La curva sólidus se desplaza a la izquierda. 3. La composición de los granos no son homogéneos. Las juntas se encuentran enriquecidas del elemento de menor punto de fusión, El efecto se conoce como segregación microscópica. La segregación microscópica presenta inconvenientes en una aleación metálica puesto que produce heterogeneidad en la misma y las juntas del grano se enriquecen en el metal de menor punto de fusión y en impurezas. Las juntas de grano son poco resistentes mecánicamente, produciéndose en ellas fenómenos de corrosión intragranular, por la diferencia electroquímica de sus componentes.. La eliminación de la segregación se realiza mediante el recocido de homogeneización que consiste en calentar la aleación a una temperatura ligeramente inferior a la de la curva solidus del enfriamiento de no equilibrio (T 1 ) y mantenerla durante un tiempo determinado, para que desaparezca el gradiente de composición química del grano. Hay que controlar esta temperatura para que no se llegue a la temperatura de fusión (quemado). En el caso de una transformación eutéctica de dos metales, y que exista enfriamiento rápido, puede provocar al desplazarse la curva solidus a la izquierda la aparición del componente α + β inestable. En este caso se deberá calentar el sólido hasta una temperatura próxima a la eutéctica y mantenerla constante para que tenga lugar el fenómeno de la difusión. 6. La transformación en el estado sólido. En el proceso de solidificación de un metal o aleación, su estructura se mantenía fija solamente en contadas ocasiones, ya que la mayoría de las veces existen en el proceso transformaciones en estado sólido. Estas transformaciones son lentas puesto que influye la difusión de los átomos, realizándose en el proceso fenómenos de nucleación y crecimiento. Normalmente la velocidad a la que se verifica este proceso está relacionada con los defectos estructurales. Un ejemplo de estas modificaciones en estado sólido lo apreciamos en las transformaciones alotrópicas en las que un metal cristaliza en su forma α por debajo de una temperatura T o, mientras que por encima de ella su estructura cristalográfica es β. A esa temperatura T o coexisten las dos formas alotrópicas y según la regla de las fases : F + L = C + 1, los grados de libertad serán 2 + L = 1 + 1, cero, transformándose alotrópicamente a temperatura constante. Es muy común utilizar las curvas TTT para estudiar las transformaciones alotrópicas, que indican tiempo, temperatura y transformación. Para conseguir estas curvas se realiza un calentamiento rápido de este material por encima de T o, enfriando súbitamente el material hasta diferentes temperaturas y manteniendo esas condiciones isotermas, ver la evolución en el tiempo de la transformación en las diferentes estructuras cristalinas. En la siguiente gráfica TTT se pueda apreciar la transformación para un determinado material:
8 De acuerdo a esta gráfica el material se enfría bruscamente desde T o hasta T 1 y se estudia la evolución, isotérmicamente a lo largo del tiempo estableciendo que existe una transición de las formas alotrópicas β α durante el tiempo trascurrido desde t 1 a t 2. La primera zona es metaestable (forma alotrópica β ), una segunda zona de transición y otra tercera zona estable (forma alotrópica α). Cuando un metal que experimenta una transformación alotrópica, se alea con otro, su transformación alotrópica varía sensiblemente ya que la temperatura cambia y ese intervalo de temperaturas no es constante. La transición α + β varía sustancialmente, dependiendo del porcentaje de la sustancia B en la aleación. Un material betágeno, si estabiliza la forma alotrópica β, mientras que actúa como un material alfágeno, si estabiliza la estructura α. Una transformación alotrópica puede tener consecuencias importantes que afectan a las propiedades de estos materiales. Entre ellas caben destacar: 1. La disminución del tamaño del grano, puesto que los nuevos granos comienzan la nucleación en las zonas más inestables de mayor energía y por lo tanto existirá más de un núcleo. 2. Una reducción de la anisotropía que originan los gradientes térmicos durante la solidificación La redistribución de las impurezas. Normalmente las impureza se concentran en los límites o juntas de grano, al realizarse una transformación alotrópica, surgen nuevas nuclealizaciones en zonas de mayor energía, es decir en las juntas de los antiguos granos, quedando las impurezas en el interior de los nuevos granos, por lo que las nuevas juntas de granos son más resistentes aumentando sus propiedades mecánicas. Otra de las transformaciones en estado sólido más habituales son las eutectoides, apareciendo una tercera fase sólida. En esa transformación eutectoide, la temperatura permanece fija, ya que el número de grados de libertad es cero y la aleación estará formada por láminas muy finas de los estados α y β. Como siempre, las aleaciones que se encuentran a la izquierda del punto eutéctico reciben el nombre de hipoeutectoides y las que se encuentran a la derecha son las hipereutectoides.
9 Al contrario de las eutécticas. La fase que precede a la eutectoide es la matriz; la reacción en estado sólido comienza en las juntas de grano de la fase inicial y la fase dispersa será la mezcla α + β. Una aleación (III) solidifica directamente a la fase α y a medida que la temperatura disminuye a una inferior del eutectoide, la solubilidad disminuye y aparece la fase β en aquellos puntos de mayor energía de la estructura α. Las aleaciones de este tipo son fáciles de endurecer, aumentando su resistencia mecánica ; este proceso recibe el nombre de envejecimiento. El objetivo es que las partículas β se distribuyan uniformemente por la matriz α, dificultándose las dislocaciones. El envejecimiento consta de las siguientes fases: 1. Puesta en solución.- La aleación sufre un calentamiento por encima de una determinada temperatura, para que la fase β se disuelva. 2. Hipertemple.- La aleación se enfría súbitamente para evitar que se forme la fase β y se mantenga la fase α en forma metaestable a temperatura ambiente. 3. Maduración.- Se eleva la temperatura moderadamente para lograr que la fase β aparezca finamente dividida. El tratamiento del envejecimiento se muestra en la gráfica siguiente.
TEMA 2: DIAGRAMAS DE FASES
 TEMA 2: DIAGRAMAS DE FASES 1.- LAS ALEACIONES 2.- FUSIÓN Y SOLIDIFICACIÓN 3.- DIAGRAMAS DE EQUILIBRIO O DE FASES 4.- TIPOS DE DIAGRAMAS 5.- REPASO - 1 - 1.- ALEACIONES Una aleación es una sustancia compuesta
TEMA 2: DIAGRAMAS DE FASES 1.- LAS ALEACIONES 2.- FUSIÓN Y SOLIDIFICACIÓN 3.- DIAGRAMAS DE EQUILIBRIO O DE FASES 4.- TIPOS DE DIAGRAMAS 5.- REPASO - 1 - 1.- ALEACIONES Una aleación es una sustancia compuesta
TEMA 3: DIAGRAMAS DE EQUILIBRIO
 TEMA 3: DIAGRAMAS DE EQUILIBRIO 1.- Aleaciones Características Los metales puros tienen poca aplicación en la industria. La mayoría de ellos se combinan con otros metales o no metales para mejorar sus
TEMA 3: DIAGRAMAS DE EQUILIBRIO 1.- Aleaciones Características Los metales puros tienen poca aplicación en la industria. La mayoría de ellos se combinan con otros metales o no metales para mejorar sus
Departamento de Tecnologías 1 IES Valle del Sol. Selectividad 2015 SELECTIVIDAD 2014 SELECTIVIDAD 2013
 1 IES Valle del Sol No hay ejercicios de este tema No hay ejercicios de este tema. Selectividad 2015 SELECTIVIDAD 2014 SELECTIVIDAD 2013 1. Dos metales A y B solidifican a 1000 ºC y 500 ºC respectivamente
1 IES Valle del Sol No hay ejercicios de este tema No hay ejercicios de este tema. Selectividad 2015 SELECTIVIDAD 2014 SELECTIVIDAD 2013 1. Dos metales A y B solidifican a 1000 ºC y 500 ºC respectivamente
MATERIALES METALICOS 2do Ingeniería Mecánica. Diagramas de Equilibrio de Fases
 MATERIALES METALICOS 2do Ingeniería Mecánica Diagramas de Equilibrio de Fases Ing. Víctor Gómez Universidad Tecnológica Nacional Facultad Regional Tucumán Aleaciones Ø Aleación: Sustancia que tiene propiedades
MATERIALES METALICOS 2do Ingeniería Mecánica Diagramas de Equilibrio de Fases Ing. Víctor Gómez Universidad Tecnológica Nacional Facultad Regional Tucumán Aleaciones Ø Aleación: Sustancia que tiene propiedades
3.- Con el diagrama de equilibrio Cu-Ni, haga el análisis de fases para una aleación del 50% de Cu a: 1400ºC, 1300ºC, 1200ºC 1100ºC.
 1.- Con el diagrama de equilibrio Cu-Ni que se adjunta, describir el enfriamiento lento de una aleación del 3% de Ni y determinar su composición a 12ºC. 2.- Una aleación compuesta de 2 Kg de Cu y 2 Kg
1.- Con el diagrama de equilibrio Cu-Ni que se adjunta, describir el enfriamiento lento de una aleación del 3% de Ni y determinar su composición a 12ºC. 2.- Una aleación compuesta de 2 Kg de Cu y 2 Kg
5b. DIAGRAMA HIERRO-CARBONO
 5b. DIAGRAMA HIERRO-CARBONO MATERIALES 13/14 ÍNDICE ACERO DIAGRAMA Fe-C FASES EN EL DIAGRAMA PROPIEDADES MECANICAS DE LAS FASES 2 1. ACERO Constituyentes de las aleaciones Fe-C (fases) Ferrita : Solución
5b. DIAGRAMA HIERRO-CARBONO MATERIALES 13/14 ÍNDICE ACERO DIAGRAMA Fe-C FASES EN EL DIAGRAMA PROPIEDADES MECANICAS DE LAS FASES 2 1. ACERO Constituyentes de las aleaciones Fe-C (fases) Ferrita : Solución
b) Aplicar la regla de las fases a cada una de las regiones, líneas y puntos significativos y determina el número de grados de libertad existentes.
 1.- El platino y el oro son totalmente solubles en estado sólido y en estado líquido. El punto de fusión del platino son 1774 C y el del oro 1063 C. Una aleación formada por un 40% de oro comienza a solidificar
1.- El platino y el oro son totalmente solubles en estado sólido y en estado líquido. El punto de fusión del platino son 1774 C y el del oro 1063 C. Una aleación formada por un 40% de oro comienza a solidificar
Tema 3: Diagramas de fases. Problemas resueltos
 Tema 3: Diagramas de fases Problemas resueltos Problema 1. Dos metales y tienen puntos de fusión a 1400 y 1300 respectivamente. El metal presenta dos cambios alotrópicos a los 900,, y a los 700,, de forma
Tema 3: Diagramas de fases Problemas resueltos Problema 1. Dos metales y tienen puntos de fusión a 1400 y 1300 respectivamente. El metal presenta dos cambios alotrópicos a los 900,, y a los 700,, de forma
TEMA 2. FASES Y TRANSFORMACIONES DE FASES. DIAGRAMAS DE EQUILIBRIO.
 TEMA 2. FASES Y TRANSFORMACIONES DE FASES. DIAGRAMAS DE EQUILIBRIO. Objetivos Este tema tiene por objeto conocer el interés e importancia de las aleaciones y las posibilidades de transformaciones y cambios
TEMA 2. FASES Y TRANSFORMACIONES DE FASES. DIAGRAMAS DE EQUILIBRIO. Objetivos Este tema tiene por objeto conocer el interés e importancia de las aleaciones y las posibilidades de transformaciones y cambios
UNE RAFAEL MARÍA BARALT PROGRAMA DE INGENIERÍA Y TECNOLOGÍA INGENIERÍA EN MTTO MECÁNICO SOLIDIFICACIÓN. Elaborado por: Ing. Roger Chirinos.
 UNE RAFAEL MARÍA BARALT PROGRAMA DE INGENIERÍA Y TECNOLOGÍA INGENIERÍA EN MTTO MECÁNICO SOLIDIFICACIÓN Elaborado por: Ing. Roger Chirinos. MSc Cabimas, Noviembre de 2013 SOLIDIFICACIÓN Fundamentos básicos
UNE RAFAEL MARÍA BARALT PROGRAMA DE INGENIERÍA Y TECNOLOGÍA INGENIERÍA EN MTTO MECÁNICO SOLIDIFICACIÓN Elaborado por: Ing. Roger Chirinos. MSc Cabimas, Noviembre de 2013 SOLIDIFICACIÓN Fundamentos básicos
TRANSFORMACIONES EN ESTADO SOLIDO
 TRANSFORMACIONES EN ESTADO SOLIDO Después de solidificada una aleación puede sufrir transformaciones posteriores. Se presenta en metales que tienen al menos un componente que sufre transformaciones alotrópicas
TRANSFORMACIONES EN ESTADO SOLIDO Después de solidificada una aleación puede sufrir transformaciones posteriores. Se presenta en metales que tienen al menos un componente que sufre transformaciones alotrópicas
5.- Describir la solubilidad del Carbono en el Hierro en función de la temperatura y de sus distintos estados alotrópicos.
 DIAGRAMA HIERRO-CARBONO: 1.- Haciendo uso del diagrama Fe-C, verificar el enfriamiento lento ( en condiciones próximas al equilibrio) de las siguientes aleaciones: a) Acero de 0.17% de C b) Acero de 0.30%
DIAGRAMA HIERRO-CARBONO: 1.- Haciendo uso del diagrama Fe-C, verificar el enfriamiento lento ( en condiciones próximas al equilibrio) de las siguientes aleaciones: a) Acero de 0.17% de C b) Acero de 0.30%
Solidificación e Imperfecciones. en Sólidos
 Preguntas definitivas Capítulo 2 Solidificación e Imperfecciones en Sólidos Ciencia de Materiales 28 PREGUNTA 2.1 Cuándo suele presentar interés el uso de un metal en estado puro?. Justifícalo. Pon un
Preguntas definitivas Capítulo 2 Solidificación e Imperfecciones en Sólidos Ciencia de Materiales 28 PREGUNTA 2.1 Cuándo suele presentar interés el uso de un metal en estado puro?. Justifícalo. Pon un
los Aceros El porqué? Tratamientos térmicos Microestructura) Propiedades d Mecánicas FCEIA-UNR C Materiales FCEIA-UNR C-3.20.
 11. Tratamientos t Térmicos de los Aceros El porqué? Tratamientos térmicos (Temperatura y tiempo) Microestructura) Propiedades d Mecánicas 1 El factor TIEMPO La mayoría de las transformaciones en estado
11. Tratamientos t Térmicos de los Aceros El porqué? Tratamientos térmicos (Temperatura y tiempo) Microestructura) Propiedades d Mecánicas 1 El factor TIEMPO La mayoría de las transformaciones en estado
PROBLEMAS TEMA 2 TECNOLOGÍA INDUSTRIAL II
 1. Dibujar un diagrama de equilibrio entre dos componentes cualesquiera A y B, solubles completamente en estado sólido que solidifican en su estado puro a 1000 y 1300 ºC, respectivamente. Situar en la
1. Dibujar un diagrama de equilibrio entre dos componentes cualesquiera A y B, solubles completamente en estado sólido que solidifican en su estado puro a 1000 y 1300 ºC, respectivamente. Situar en la
TEMA 9. TRANSFORMACIONES DE FASE Y TRATAMIENTOS TÉRMICOS EN ALEACIONES Fe-C
 TEMA 9. TRANSFORMACIONES DE FASE Y TRATAMIENTOS TÉRMICOS EN ALEACIONES Fe-C Los Diagramas de Fase representan estados y transformaciones en condiciones de equilibrio, pero no aportan información sobre
TEMA 9. TRANSFORMACIONES DE FASE Y TRATAMIENTOS TÉRMICOS EN ALEACIONES Fe-C Los Diagramas de Fase representan estados y transformaciones en condiciones de equilibrio, pero no aportan información sobre
Hoja de problemas Tema 7
 Hoja 7 FUNDAMENTOS DE CIENCIA DE MATERIALES 1 Hoja de problemas Tema 7 1. Sea el diagrama de fases esquemático de la figura para el sistema A-B. (a) Indique la posición de las líneas de liquidus, solidus
Hoja 7 FUNDAMENTOS DE CIENCIA DE MATERIALES 1 Hoja de problemas Tema 7 1. Sea el diagrama de fases esquemático de la figura para el sistema A-B. (a) Indique la posición de las líneas de liquidus, solidus
TEMA IV.- ALEACIONES DE HIERRO Y CARBONO
 TEMA IV.- ALEACIONES DE HIERRO Y CARBONO El hierro puro apenas tiene aplicaciones industriales, pero formando aleaciones con el carbono (además de otros elementos), es el metal más utilizado en la industria
TEMA IV.- ALEACIONES DE HIERRO Y CARBONO El hierro puro apenas tiene aplicaciones industriales, pero formando aleaciones con el carbono (además de otros elementos), es el metal más utilizado en la industria
CONSTRUCCIÓN DEL DIAGRAMA Fe- C. FASES DEL FE PURO
 CONSTRUCCIÓN DEL DIAGRAMA Fe- C. FASES DEL FE PURO T Fe Líquido. Amorfo A 1536 C es la T de fusión del Fe. A 1536 C se forma Fe delta-fe - sólido si estoy disminuyendo T. Presenta estructura BCC Fe delta
CONSTRUCCIÓN DEL DIAGRAMA Fe- C. FASES DEL FE PURO T Fe Líquido. Amorfo A 1536 C es la T de fusión del Fe. A 1536 C se forma Fe delta-fe - sólido si estoy disminuyendo T. Presenta estructura BCC Fe delta
TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN. 2.- Formas de encontrar el carbono en las aleaciones férreas
 TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN 1.- Estados alotrópicos del Hierro (Fe) Según las condiciones de, el hierro puede presentar diferentes estados, con mayor o menor capacidad para disolver
TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN 1.- Estados alotrópicos del Hierro (Fe) Según las condiciones de, el hierro puede presentar diferentes estados, con mayor o menor capacidad para disolver
TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN. 2.- Formas de encontrar el carbono en las aleaciones férreas
 TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN 1.- Estados alotrópicos del Hierro (Fe) Según las condiciones de temperatura, el hierro puede presentar diferentes estados, con mayor o menor capacidad
TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN 1.- Estados alotrópicos del Hierro (Fe) Según las condiciones de temperatura, el hierro puede presentar diferentes estados, con mayor o menor capacidad
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN ÍNDICE
 CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
CIDEAD. 2º BACHILLERATO.TECNOLOGÍA INDUSTRIAL II. Tema 5.- Los tratamientos térmicos de los aceros.
 Desarrollo del tema: 1. Estados alotrópicos del hierro. 2. Aleaciones hierro carbono. Su composición 3. Constitución de las aleaciones hierro carbono. 4. Estructura de las aleaciones Fe C 5. Diagrama de
Desarrollo del tema: 1. Estados alotrópicos del hierro. 2. Aleaciones hierro carbono. Su composición 3. Constitución de las aleaciones hierro carbono. 4. Estructura de las aleaciones Fe C 5. Diagrama de
GUÍA DE DISCUSIÓN DE CONCEPTOS Y PROBLEMAS. " DIAGRAMA Fe - Fe 3 C "
 UNIVERSIDAD DON BOSCO FACULTAD DE INGENIERÍA ESCUELA DE INGENIERÍA MECÁNICA Asignatura: CIENCIA DE LOS MATERIALES CUESTIONARIO GUÍA DE DISCUSIÓN DE CONCEPTOS Y PROBLEMAS " DIAGRAMA Fe - Fe 3 C " 1.- Describir
UNIVERSIDAD DON BOSCO FACULTAD DE INGENIERÍA ESCUELA DE INGENIERÍA MECÁNICA Asignatura: CIENCIA DE LOS MATERIALES CUESTIONARIO GUÍA DE DISCUSIÓN DE CONCEPTOS Y PROBLEMAS " DIAGRAMA Fe - Fe 3 C " 1.- Describir
Importancia del hierro en la metalurgia
 DIAGRAMA Fe - C Importancia del hierro en la metalurgia Afinidad química Capacidad de solubilidad de otros elementos Propiedad alotrópica en estado sólido Capacidad para variar sustancialmente la estructura
DIAGRAMA Fe - C Importancia del hierro en la metalurgia Afinidad química Capacidad de solubilidad de otros elementos Propiedad alotrópica en estado sólido Capacidad para variar sustancialmente la estructura
Diagrama de fases de una sustancia pura: el agua
 Diagrama de fases de una sustancia pura: el agua Apellidos, nombre Departamento Centro Lorena Atarés Huerta (loathue@tal.upv.es) Tecnología de Alimentos Escuela Técnica Superior de Ingeniería Agronómica
Diagrama de fases de una sustancia pura: el agua Apellidos, nombre Departamento Centro Lorena Atarés Huerta (loathue@tal.upv.es) Tecnología de Alimentos Escuela Técnica Superior de Ingeniería Agronómica
Equilibrio sólido- líquido en sistemas de dos componentes
 Equilibrio sólido- líquido en sistemas de dos componentes Miscibilidad en fase líquida e inmiscibilidad en fase sólida: sean C y B dos sustancias miscibles en todas las proporciones en la fase líquida
Equilibrio sólido- líquido en sistemas de dos componentes Miscibilidad en fase líquida e inmiscibilidad en fase sólida: sean C y B dos sustancias miscibles en todas las proporciones en la fase líquida
DIAGRAMA HIERRO-CARBONO
 DIAGRAMA HIERRO-CARBONO 1. Con el diagrama hierro-carbono simplificado de la figura, determina: a) Temperatura de solidificación del hierro puro b) Temperatura de solidificación de la ledeburita (el eutéctico)
DIAGRAMA HIERRO-CARBONO 1. Con el diagrama hierro-carbono simplificado de la figura, determina: a) Temperatura de solidificación del hierro puro b) Temperatura de solidificación de la ledeburita (el eutéctico)
FUNDICIONES. Las fundiciones son aleaciones de hierro, también manganeso, fosforo y azufre. Las
 FUNDICIONES Las fundiciones son aleaciones de hierro, carbono y silicio que generalmente contienen también manganeso, fosforo y azufre. Las fundiciones, que son las más utilizadas en la práctica, aparecen
FUNDICIONES Las fundiciones son aleaciones de hierro, carbono y silicio que generalmente contienen también manganeso, fosforo y azufre. Las fundiciones, que son las más utilizadas en la práctica, aparecen
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
Diagrama de fases Sn-Pb
 Práctica 4 Diagrama de fases Sn-Pb Objetivo Determinación del diagrama de fases Temperatura vs. Composición, a presión atmosférica, de la aleación Estaño - Plomo. Fundamento teórico Casi todos los metales
Práctica 4 Diagrama de fases Sn-Pb Objetivo Determinación del diagrama de fases Temperatura vs. Composición, a presión atmosférica, de la aleación Estaño - Plomo. Fundamento teórico Casi todos los metales
Actividad: Cómo ocurren las reacciones químicas?
 Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
Los constituyentes metálicos que se pueden presentar en los aceros al carbono son:
 DE LOS ACEROS Los constituyentes metálicos que se pueden presentar en los aceros al carbono son: Ferrita Cementita Perlita Sorbita Troostita Martensita Bainita Austenita El análisis de las microestructuras
DE LOS ACEROS Los constituyentes metálicos que se pueden presentar en los aceros al carbono son: Ferrita Cementita Perlita Sorbita Troostita Martensita Bainita Austenita El análisis de las microestructuras
TEMA 1 Cambios de fase
 TEMA 1 Cambios de fase 1.1. Introducción CLIMATIZACIÓN: crear y mantener un ambiente térmico en un espacio para desarrollar eficientemente una determinada actividad CONFORT O BIENESTAR: - Térmico - Lumínico
TEMA 1 Cambios de fase 1.1. Introducción CLIMATIZACIÓN: crear y mantener un ambiente térmico en un espacio para desarrollar eficientemente una determinada actividad CONFORT O BIENESTAR: - Térmico - Lumínico
FÍSICA APLICADA Y FISICOQUÍMICA I. Tema 8. Equilibrio de fases en sistemas multicomponentes II
 María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 8 Equilibrio de fases en sistemas multicomponentes II Esquema Tema 8. Equilibrios de fases en sistemas multicomponentes
María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 8 Equilibrio de fases en sistemas multicomponentes II Esquema Tema 8. Equilibrios de fases en sistemas multicomponentes
Líquido. Sólido. Gas Plasma. educacionsanitariaymas.blogspot.com.
 Líquido Sólido www.juntadeandalucia.es educacionsanitariaymas.blogspot.com Gas Plasma www.palimpalem.com En el estado sólido las moléculas se encuentran muy juntas, tienen mucha cohesión. Las partículas
Líquido Sólido www.juntadeandalucia.es educacionsanitariaymas.blogspot.com Gas Plasma www.palimpalem.com En el estado sólido las moléculas se encuentran muy juntas, tienen mucha cohesión. Las partículas
PREGUNTAS PRUEBAS PAU MATERIALES
 PREGUNTAS PRUEBAS PAU MATERIALES JUNIO 2010 FE Opción A Defina brevemente las siguientes propiedades que presentan los compuestos metálicos: a) Elasticidad (0,5 puntos) b) Tenacidad (0,5 puntos) c) Maleabilidad
PREGUNTAS PRUEBAS PAU MATERIALES JUNIO 2010 FE Opción A Defina brevemente las siguientes propiedades que presentan los compuestos metálicos: a) Elasticidad (0,5 puntos) b) Tenacidad (0,5 puntos) c) Maleabilidad
PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERMINACIÓN DE LA MASA MOLECULAR DE UN SOLUTO PROBLEMA POR CRIOSCOPIA
 PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERINACIÓN DE LA ASA OLECULAR DE UN SOLUTO PROBLEA POR CRIOSCOPIA OBJETIVOS: El objetivo de la práctica es el estudio del efecto que produce la adición de un soluto
PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERINACIÓN DE LA ASA OLECULAR DE UN SOLUTO PROBLEA POR CRIOSCOPIA OBJETIVOS: El objetivo de la práctica es el estudio del efecto que produce la adición de un soluto
Tema 5. Aleaciones metálicas. El sistema Fe-C.
 Tema 5. Aleaciones metálicas. El sistema Fe-C. Problemas sobre aleaciones Fe-C, y cinética de las transformaciones (W.D. Callister Ed. Reverté - Cap 9 y 10). 9.47. Cuál es el porcentaje de carbono de un
Tema 5. Aleaciones metálicas. El sistema Fe-C. Problemas sobre aleaciones Fe-C, y cinética de las transformaciones (W.D. Callister Ed. Reverté - Cap 9 y 10). 9.47. Cuál es el porcentaje de carbono de un
CLASIFICACIÓN DE LA MATERIA
 1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
TEMAS Noviembre Belén Molina Sánchez UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I
 TEMAS 16-21 Noviembre 2005 Belén Molina Sánchez 1 Sistema: porción del universo que ha sido aislada de tal modo que sus propiedades pueden ser estudiadas. Microconstituyente: aquello que es observable
TEMAS 16-21 Noviembre 2005 Belén Molina Sánchez 1 Sistema: porción del universo que ha sido aislada de tal modo que sus propiedades pueden ser estudiadas. Microconstituyente: aquello que es observable
La reacción de formación de perlita en aleaciones Fe-C
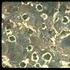 La Transformación Eutectoide ( Tomado de Porter D. A et al Phase Transformations in metals and alloys. Reed Hill R. Principios de Metalurgia Física, Hume Rothery The Structures of alloys of iron ) La reacción
La Transformación Eutectoide ( Tomado de Porter D. A et al Phase Transformations in metals and alloys. Reed Hill R. Principios de Metalurgia Física, Hume Rothery The Structures of alloys of iron ) La reacción
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor. Webpage: Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
SISTEMAS MATERIALES. Departamento de Física y Química 2º ESO
 SISTEMAS MATERIALES Departamento de Física y Química 2º ESO 0. Mapa conceptual MATERIA Sustancias puras Mezclas Heterogéneas Homogéneas Sistemas coloidales Técnicas de separación Disoluciones Soluto Disolvente
SISTEMAS MATERIALES Departamento de Física y Química 2º ESO 0. Mapa conceptual MATERIA Sustancias puras Mezclas Heterogéneas Homogéneas Sistemas coloidales Técnicas de separación Disoluciones Soluto Disolvente
FISICOQUÍMICA APLICADA
 UNIVERSIDAD NACIONAL DE TUCUMAN FACULTAD DE BIOQUIMICA QUIMICA Y FARMACIA INSTITUTO DE QUIMICA FISICA San Miguel de Tucumán República Argentina FISICOQUÍMICA APLICADA Cambio de fase. Superficies. Coloides
UNIVERSIDAD NACIONAL DE TUCUMAN FACULTAD DE BIOQUIMICA QUIMICA Y FARMACIA INSTITUTO DE QUIMICA FISICA San Miguel de Tucumán República Argentina FISICOQUÍMICA APLICADA Cambio de fase. Superficies. Coloides
UNIDAD DIDÁCTICA 2. EL MODELO DE PARTÍCULAS DE LA MATERIA PROPUESTA DIDÁCTICA. LA MATERIA Y EL MODELO DOCUMENTO PARA EL ALUMNO
 UNIDAD DIDÁCTICA 2. EL MODELO DE PARTÍCULAS DE LA MATERIA PROPUESTA DIDÁCTICA. LA MATERIA Y EL MODELO DOCUMENTO PARA EL ALUMNO 1. LOS ESTADOS DE AGREGACIÓN DE LA MATERIA. CAMBIOS DE ESTADO Una misma sustancia
UNIDAD DIDÁCTICA 2. EL MODELO DE PARTÍCULAS DE LA MATERIA PROPUESTA DIDÁCTICA. LA MATERIA Y EL MODELO DOCUMENTO PARA EL ALUMNO 1. LOS ESTADOS DE AGREGACIÓN DE LA MATERIA. CAMBIOS DE ESTADO Una misma sustancia
SEGUNDO DE BACHILLERATO QUÍMICA. a A + b B c C + d D
 TEMA 5. CINÉTICA QUÍMICA a A + b B c C + d D 1 d[a] 1 d[b] 1 d[c] 1 d[d] mol v = = = + = + a dt b dt c dt d dt L s El signo negativo en la expresión de velocidad es debido a que los reactivos desaparecen,
TEMA 5. CINÉTICA QUÍMICA a A + b B c C + d D 1 d[a] 1 d[b] 1 d[c] 1 d[d] mol v = = = + = + a dt b dt c dt d dt L s El signo negativo en la expresión de velocidad es debido a que los reactivos desaparecen,
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
Análisis Gravimétrico
 Análisis Gravimétrico Noviembre, 2012 Clasificación del Análisis Químico Análisis Químico Análisis químico cualitativo Análisis químico cuantitativo Qué hay? Cuánto hay? Identificar los componentes Cuantificar
Análisis Gravimétrico Noviembre, 2012 Clasificación del Análisis Químico Análisis Químico Análisis químico cualitativo Análisis químico cuantitativo Qué hay? Cuánto hay? Identificar los componentes Cuantificar
MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES CONTENIDOS
 MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES CONTENIDOS Generalidades Estructura interna de los metales. Defectos en la estructura cristalina Soluciones sólidas Mecanismos de endurecimiento de los metales
MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES CONTENIDOS Generalidades Estructura interna de los metales. Defectos en la estructura cristalina Soluciones sólidas Mecanismos de endurecimiento de los metales
Tema 2. Diagramas de Equilibrio y TTT
 Tema 2. Diagramas de Equilibrio y TTT 2.1. Regla de las fases. 2.2. Diagramas en sistemas binarios. Eutéctico y peritéctico. 2.3. Curvas temperatura-tiempo-transformación. 2.4. Ciencia de Materiales en
Tema 2. Diagramas de Equilibrio y TTT 2.1. Regla de las fases. 2.2. Diagramas en sistemas binarios. Eutéctico y peritéctico. 2.3. Curvas temperatura-tiempo-transformación. 2.4. Ciencia de Materiales en
LA MATERIA: ESTADOS DE AGREGACIÓN
 LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS
 TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
La materia. Los gases
 1 La materia. Los gases 1 La materia y sus estados de agregación Características de los estados de la materia La materia se puede presentar en varios estados de agregación: sólido, líquido y gas, que tienen
1 La materia. Los gases 1 La materia y sus estados de agregación Características de los estados de la materia La materia se puede presentar en varios estados de agregación: sólido, líquido y gas, que tienen
LOS GASES Y LAS DISOLUCIONES. Departamento de Física y Química 3º ESO
 LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN.
 MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
Laboratorio 8. Diagrama de fase sólido-liquido para un sistema binario
 Laboratorio 8. Diagrama de fase sólido-liquido para un sistema binario Objetivo Construir el diagrama de fase sólido líquido para un sistema binario a partir de las curvas de enfriamiento. Se determinará
Laboratorio 8. Diagrama de fase sólido-liquido para un sistema binario Objetivo Construir el diagrama de fase sólido líquido para un sistema binario a partir de las curvas de enfriamiento. Se determinará
GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS
 A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
FÍSICA 4. P = RT V a V 2. U(T,V) = U 0 +C V T a V? α α T = C 1 = C 2. v = 1.003cm 3 /g. α = 1 v
 FÍSICA 4 SEGUNDO CUARIMESRE DE 2009 GUÍA 3: OENCIALES ERMODINÁMICOS, CAMBIOS DE FASE 1. Sean x,, z cantidades que satisfacen una relación funcional f(x,, z) = 0. Sea w una función de cualquier par de variables
FÍSICA 4 SEGUNDO CUARIMESRE DE 2009 GUÍA 3: OENCIALES ERMODINÁMICOS, CAMBIOS DE FASE 1. Sean x,, z cantidades que satisfacen una relación funcional f(x,, z) = 0. Sea w una función de cualquier par de variables
Diagramas de fase en aleaciones metálicas
 Diagramas de fase en aleaciones metálicas Sólidos Inorgánicos Diagramas de fase de sustancias puras 8000 Hielo VI 6000 Presión/atm Hielo V 0 2000 2 Hielo II Hielo III íquido Temperatura/ C 2000 1500 500
Diagramas de fase en aleaciones metálicas Sólidos Inorgánicos Diagramas de fase de sustancias puras 8000 Hielo VI 6000 Presión/atm Hielo V 0 2000 2 Hielo II Hielo III íquido Temperatura/ C 2000 1500 500
13. SINTERIZADO PULVIMETALURGIA CARACTERÍSTICAS CARACTERIZACÓN DE POLVOS PROPIEDADES DE LA MASA DE POLVOS
 13. SINTERIZADO 1 Materiales I 13/14 ÍNDICE CARACTERÍSTICAS CARACTERIZACÓN DE POLVOS PROPIEDADES DE LA MASA DE POLVOS COMPRESIBILIDAD RESISTENCIA EN VERDE SINTERABILIDAD COMPACTACIÓN DE POLVOS METÁLICOS
13. SINTERIZADO 1 Materiales I 13/14 ÍNDICE CARACTERÍSTICAS CARACTERIZACÓN DE POLVOS PROPIEDADES DE LA MASA DE POLVOS COMPRESIBILIDAD RESISTENCIA EN VERDE SINTERABILIDAD COMPACTACIÓN DE POLVOS METÁLICOS
Estados de la materia y cambios de fase
 3 Año de Química: Sistemas Materiales Prof. Javier Ponce Qué es Ciencia? Ciencia (en latíns cientia, de scire, conocer ), término que en su sentido más amplio se emplea para referirse al conocimiento sistematizado
3 Año de Química: Sistemas Materiales Prof. Javier Ponce Qué es Ciencia? Ciencia (en latíns cientia, de scire, conocer ), término que en su sentido más amplio se emplea para referirse al conocimiento sistematizado
Equilibrio físico. Prof. Jesús Hernández Trujillo. Facultad de Química, UNAM. Equilibrio físico/j. Hdez. T p.
 Equilibrio físico/j. Hdez. T p. 1/34 Equilibrio físico Prof. Jesús Hernández Trujillo jesus.hernandezt@gmail.com Facultad de Química, UNAM Equilibrio físico/j. Hdez. T p. 2/34 Interacciones intermoleculares
Equilibrio físico/j. Hdez. T p. 1/34 Equilibrio físico Prof. Jesús Hernández Trujillo jesus.hernandezt@gmail.com Facultad de Química, UNAM Equilibrio físico/j. Hdez. T p. 2/34 Interacciones intermoleculares
QUÍMICA. La MATERIA REPRESENTACIÓN. Observación Datos Ley Hipótesis Teoría DEFINICIONES BÁSICAS. Propiedades
 QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
Capítulo 7 Diagramas de fase y transformaciones de fase
 Capítulo 7 Diagramas de fase y transformaciones de fase 1 Tema 7: Diagramas de fase y transformaciones de fase 1. Definiciones 2. Diagramas de fase 3. Cinética: nucleación y crecimiento 4. Tratamientos
Capítulo 7 Diagramas de fase y transformaciones de fase 1 Tema 7: Diagramas de fase y transformaciones de fase 1. Definiciones 2. Diagramas de fase 3. Cinética: nucleación y crecimiento 4. Tratamientos
4. DIFUSION EN SÓLIDO
 4. DIFUSION EN SÓLIDO MATERIALES 13/14 ÍNDICE 1. Conceptos generales. Mecanismos de difusión. 3. Leyes de Fick. 1. Estado estacionario.. Estado no estacionario. 4. Factores de difusión. 5. Aplicaciones
4. DIFUSION EN SÓLIDO MATERIALES 13/14 ÍNDICE 1. Conceptos generales. Mecanismos de difusión. 3. Leyes de Fick. 1. Estado estacionario.. Estado no estacionario. 4. Factores de difusión. 5. Aplicaciones
A continuación se detallan cada una de las propiedades coligativas:
 PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
DIAGRAMAS DE FASE. La base de todo el trabajo sobre los diagramas de equilibrio es la regla de fases de Willard Gibbs.
 DIAGRAMAS DE FASE 1. DEFINICIONES Los diagramas de fase son representaciones gráficas de cuales fases están presentes en un sistema material en función de la temperatura, la presión y la composición. Son
DIAGRAMAS DE FASE 1. DEFINICIONES Los diagramas de fase son representaciones gráficas de cuales fases están presentes en un sistema material en función de la temperatura, la presión y la composición. Son
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico.
 FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
Aplicación de los criterios de espontaneidad a una reacción química completa
 Algunas reflexiones sobre el equilibrio químico a partir de consideraciones termodinámicas Prof. Marisa García Dra. María Antonia Grompone 1 Introducción En los programas de Química del Bachillerato Diversificado
Algunas reflexiones sobre el equilibrio químico a partir de consideraciones termodinámicas Prof. Marisa García Dra. María Antonia Grompone 1 Introducción En los programas de Química del Bachillerato Diversificado
TERMODINÁMICA 1. EL CALOR 2. LA TEMPERATURA 3. CONCEPTO DE TERMODINÁMICA 4. PRIMER PRINCIPIO 5. SEGUNDO PRINCIPIO 6.
 TERMODINÁMICA 1. EL CALOR 2. LA TEMPERATURA 3. CONCEPTO DE TERMODINÁMICA 4. PRIMER PRINCIPIO 5. SEGUNDO PRINCIPIO 6. CICLO DE CARNOT 7. DIAGRAMAS ENTRÓPICOS 8. ENTROPIA Y DEGRADACIÓN ENERGÉTICA INTRODUCCIÓN
TERMODINÁMICA 1. EL CALOR 2. LA TEMPERATURA 3. CONCEPTO DE TERMODINÁMICA 4. PRIMER PRINCIPIO 5. SEGUNDO PRINCIPIO 6. CICLO DE CARNOT 7. DIAGRAMAS ENTRÓPICOS 8. ENTROPIA Y DEGRADACIÓN ENERGÉTICA INTRODUCCIÓN
Balance de masa con reacción química. Balances de masa con reacción química en reactores discontinuos y continuos.
 Balance de masa con química. Balances de masa con química en reactores discontinuos y continuos. La aparición de una química en un proceso impone las restricciones adicionales dadas por la ecuación estequiométrica
Balance de masa con química. Balances de masa con química en reactores discontinuos y continuos. La aparición de una química en un proceso impone las restricciones adicionales dadas por la ecuación estequiométrica
BLOQUE IV.- Materiales metálicos. Tema 10.- Fundiciones
 BLOQUE IV.- Materiales metálicos * William F. Smith Fundamentos de la Ciencia e Ingeniería de Materiales. Tercera Edición. Ed. Mc-Graw Hill * James F. Shackerlford Introducción a la Ciencia de Materiales
BLOQUE IV.- Materiales metálicos * William F. Smith Fundamentos de la Ciencia e Ingeniería de Materiales. Tercera Edición. Ed. Mc-Graw Hill * James F. Shackerlford Introducción a la Ciencia de Materiales
7.7 EL DIAGRAMA EQUILIBRIO DE FASES
 7.7 EL DIAGRAMA EQUILIBRIO DE FASES 7.7.1 CÓMO CONSTRUIR UN DIAGRAMA DE FASES Un diagrama de fases es una representación gráfica de las variables del sistema. Diagrama de fases binario: 2 componentes (r=2).
7.7 EL DIAGRAMA EQUILIBRIO DE FASES 7.7.1 CÓMO CONSTRUIR UN DIAGRAMA DE FASES Un diagrama de fases es una representación gráfica de las variables del sistema. Diagrama de fases binario: 2 componentes (r=2).
DIFUSIÓN UNIVERSIDAD TECNOLÓGICA DE PEREIRA TECNOLOGIA MECANICA
 DIFUSIÓN UNIVERSIDAD TECNOLÓGICA DE PEREIRA TECNOLOGIA MECANICA 1 CONTENIDO Concepto de difusión Mecanismos de difusión Difusión en régimen permanente y en régimen transitório Fatores que influeyen en
DIFUSIÓN UNIVERSIDAD TECNOLÓGICA DE PEREIRA TECNOLOGIA MECANICA 1 CONTENIDO Concepto de difusión Mecanismos de difusión Difusión en régimen permanente y en régimen transitório Fatores que influeyen en
Tema 3. Solidificación, defectos y difusión en sólidos
 Tema 3. Solidificación, defectos y difusión en sólidos 2. Defectos a) Defectos puntuales b) Dislocaciones c) Defectos superficiales 3. Difusión en sólidos a) Generalidades b) Mecanismos de difusión c)
Tema 3. Solidificación, defectos y difusión en sólidos 2. Defectos a) Defectos puntuales b) Dislocaciones c) Defectos superficiales 3. Difusión en sólidos a) Generalidades b) Mecanismos de difusión c)
Materia. Mezclas Son aquellas que están formados por 2 o más sustancias.
 Qué es la materia? Materia Sustancias Puras Son aquellas que tienen una composición y propiedades DEFINIDAS. Mezclas Son aquellas que están formados por 2 o más sustancias. Elementos No se pueden separar
Qué es la materia? Materia Sustancias Puras Son aquellas que tienen una composición y propiedades DEFINIDAS. Mezclas Son aquellas que están formados por 2 o más sustancias. Elementos No se pueden separar
METALOGRAFÍA DE LA FUNDICIÓN. Introducción. Tipos De Fundición
 1 METALOGRAFÍA DE LA FUNDICIÓN La metalografía microscópica (o micrografía de metales) estudia los productos metalúrgicos, con el auxilio del microscopio, objetivando determinar sus constituyentes y su
1 METALOGRAFÍA DE LA FUNDICIÓN La metalografía microscópica (o micrografía de metales) estudia los productos metalúrgicos, con el auxilio del microscopio, objetivando determinar sus constituyentes y su
Física y Química. 2º ESO. LA MATERIA Y SUS PROPIEDADES La materia. La materia es todo aquello que tiene masa y ocupa un espacio.
 La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
3. PROPIEDADES Y ESTADOS
 3. PROPIEDADES Y ESTADOS 3.1 LOS CONCEPTOS DE PROPIEDAD Y ESTADO La propiedad es cualquier característica o atributo que se puede evaluar cuantitativamente El volumen La masa La energía La temperatura
3. PROPIEDADES Y ESTADOS 3.1 LOS CONCEPTOS DE PROPIEDAD Y ESTADO La propiedad es cualquier característica o atributo que se puede evaluar cuantitativamente El volumen La masa La energía La temperatura
Unidad6 ENDURECIMIENTO POR ALEACION. ALEACIONES CON SOLUBILIDAD PARCIAL EN ESTADO SOLIDO
 Unidad6 ENDURECIMIENTO POR ALEACION. ALEACIONES CON SOLUBILIDAD PARCIAL EN ESTADO SOLIDO 1 PRESENTACION En esta Unidad se analiza la casuística que aparece cuando en el estado sólido existen componentes
Unidad6 ENDURECIMIENTO POR ALEACION. ALEACIONES CON SOLUBILIDAD PARCIAL EN ESTADO SOLIDO 1 PRESENTACION En esta Unidad se analiza la casuística que aparece cuando en el estado sólido existen componentes
Endurecimiento por aleación. Aleaciones con solubilidad parcial en estado sólido. Luis Íñiguez de Onzoño Sanz
 Endurecimiento por aleación. Aleaciones con solubilidad parcial en estado sólido Luis Íñiguez de Onzoño Sanz Aleación de solubilidad parcial. La práctica anterior trabajamos con aleaciones que tenían solubilidad
Endurecimiento por aleación. Aleaciones con solubilidad parcial en estado sólido Luis Íñiguez de Onzoño Sanz Aleación de solubilidad parcial. La práctica anterior trabajamos con aleaciones que tenían solubilidad
DETERMINACION DEL PM. DE LA FRUCTOSA
 1. INTRODUCCIÓN Las propiedades coligativas de las soluciones son aquellas que dependen del número (cantidad) pero no del tipo de partículas de soluto en una cantidad dada de disolvente, las principales
1. INTRODUCCIÓN Las propiedades coligativas de las soluciones son aquellas que dependen del número (cantidad) pero no del tipo de partículas de soluto en una cantidad dada de disolvente, las principales
Transformación en estado sólido: Aspectos Básicos
 Transformación en estado sólido: Aspectos Básicos Tema: Transformación en estado sólido: aspectos básicos Abstract: En este tema se presentan los aspectos teóricos de la termodinámica asociada a los procesos
Transformación en estado sólido: Aspectos Básicos Tema: Transformación en estado sólido: aspectos básicos Abstract: En este tema se presentan los aspectos teóricos de la termodinámica asociada a los procesos
CINÉTICA QUÍMICA. Dr. Hugo Cerecetto. Prof. Titular de Química
 CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
Clase 2: Sustancias puras
 Teórico Física Térmica 2012 02 de Marzo de 2012 Agenda... 1 Referencias 2 Sustancias puras Intro Propiedades independientes 3 Fases Definiciones Cambios (o transiciones) de fase Mezcla Superficies P-v-T
Teórico Física Térmica 2012 02 de Marzo de 2012 Agenda... 1 Referencias 2 Sustancias puras Intro Propiedades independientes 3 Fases Definiciones Cambios (o transiciones) de fase Mezcla Superficies P-v-T
EFECTO DEL CALOR SOBRE LA MATERIA
 EFECTO DEL CALOR SOBRE LA MATERIA MATERIA: es todo aquello que ocupa un lugar en el espacio y tiene masa LOS EFECTOS QUE PRODUCE EL CALOR SOBRE LA MATERIA SE PUEDEN CLASIFICAR EN: * CAMBIOS FÍSICOS. *
EFECTO DEL CALOR SOBRE LA MATERIA MATERIA: es todo aquello que ocupa un lugar en el espacio y tiene masa LOS EFECTOS QUE PRODUCE EL CALOR SOBRE LA MATERIA SE PUEDEN CLASIFICAR EN: * CAMBIOS FÍSICOS. *
1. MATERIA Y SU ASPECTO
 1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
EL ALUMINIO. Propiedades del aluminio utilizado en la fabricación de carrocerías
 EL ALUMINIO Propiedades del aluminio utilizado en la fabricación de carrocerías Desde hace algunos años el acero está dejando paso a otros materiales a la hora de fabricar elementos de carrocería, entre
EL ALUMINIO Propiedades del aluminio utilizado en la fabricación de carrocerías Desde hace algunos años el acero está dejando paso a otros materiales a la hora de fabricar elementos de carrocería, entre
Materiales. Examen Final (28/06/2011) PARTE I: Seleccione la respuesta correcta. 0.2 p c/u. Una respuesta incorrecta elimina una correcta.
 Nombre: Materiales. Examen Final (28/06/2011) Grupo/profesor: PARTE I: Seleccione la respuesta correcta. 0.2 p c/u. Una respuesta incorrecta elimina una correcta. 1) Un material ferromagnético puede presentar
Nombre: Materiales. Examen Final (28/06/2011) Grupo/profesor: PARTE I: Seleccione la respuesta correcta. 0.2 p c/u. Una respuesta incorrecta elimina una correcta. 1) Un material ferromagnético puede presentar
Apuntes Disoluciones
 Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la propia disolución
Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la propia disolución
Teoría atómica: Leyes de la combinación química
 Teoría atómica: Leyes de la combinación química La materia y la química. Disoluciones vs sustancias. Sustancias puras (elementos y compuestos) I. La materia y la química Uno de los primeros objetivos que
Teoría atómica: Leyes de la combinación química La materia y la química. Disoluciones vs sustancias. Sustancias puras (elementos y compuestos) I. La materia y la química Uno de los primeros objetivos que
Cinética del cambio de fase TEMA 5
 TEMA 5 CINETICA DEL CAMBIO DE FASE 1. INTRODUCCIÓN. El cambio estructural de un sistema se produce por la existencia de una fuerza conductora de ese cambio. Esta fuerza que impulsa el cambio es la diferencia
TEMA 5 CINETICA DEL CAMBIO DE FASE 1. INTRODUCCIÓN. El cambio estructural de un sistema se produce por la existencia de una fuerza conductora de ese cambio. Esta fuerza que impulsa el cambio es la diferencia
CAPÍTULO III TRATAMIENTOS TÉRMICOS DE LAS FUNDICIONES GRISES
 CAPÍTULO III TRATAMIENTOS TÉRMICOS DE LAS FUNDICIONES GRISES 3.1 Introducción a los tratamientos térmicos. El tratamiento térmico de las fundiciones se realiza fundamentalmente para eliminar las tensiones
CAPÍTULO III TRATAMIENTOS TÉRMICOS DE LAS FUNDICIONES GRISES 3.1 Introducción a los tratamientos térmicos. El tratamiento térmico de las fundiciones se realiza fundamentalmente para eliminar las tensiones
Práctica No 12. Determinación experimental de la Presión de vapor de un líquido puro
 Práctica No 12 Determinación experimental de la Presión de vapor de un líquido puro 1. Objetivo general: Evaluar la entalpía de vaporización mediante el modelo de Clausius y Clapeyron. 2. Marco teórico:
Práctica No 12 Determinación experimental de la Presión de vapor de un líquido puro 1. Objetivo general: Evaluar la entalpía de vaporización mediante el modelo de Clausius y Clapeyron. 2. Marco teórico:
Aleaciones Hierro-carbono
 TEMA 8 : ALEACIONES DE BASE HIERRO Introducción. Aleaciones de base hierro y sus tratamientos. Diagrama hierro carbono. Fundiciones. Tratamientos térmicos: recocido, temple, normalizado. Aleaciones Hierro-carbono
TEMA 8 : ALEACIONES DE BASE HIERRO Introducción. Aleaciones de base hierro y sus tratamientos. Diagrama hierro carbono. Fundiciones. Tratamientos térmicos: recocido, temple, normalizado. Aleaciones Hierro-carbono
EJERCICIOS DIAGRAMA DE FASES
 EJERCICIOS DIAGRAMA DE FASES 1. Con el diagrama de equilibrio Cu - Ni. Determinar para una aleación con el 40 % de Ni: a) Curva de enfriamiento, intervalo de solidificación, fases presentes en cada una
EJERCICIOS DIAGRAMA DE FASES 1. Con el diagrama de equilibrio Cu - Ni. Determinar para una aleación con el 40 % de Ni: a) Curva de enfriamiento, intervalo de solidificación, fases presentes en cada una
Tecnólogo en Minería. Equilibrio Químico. Química I
 Tecnólogo en Minería Equilibrio Químico Química I Concepto de equilibrio y constante Pocas reacciones químicas se dan en un sentido Muchas veces las reacciones químicas no se completan, sino que llegan
Tecnólogo en Minería Equilibrio Químico Química I Concepto de equilibrio y constante Pocas reacciones químicas se dan en un sentido Muchas veces las reacciones químicas no se completan, sino que llegan
