Solidificación e Imperfecciones. en Sólidos
|
|
|
- Ignacio Mora Contreras
- hace 9 años
- Vistas:
Transcripción
1 Preguntas definitivas Capítulo 2 Solidificación e Imperfecciones en Sólidos Ciencia de Materiales 28
2 PREGUNTA 2.1 Cuándo suele presentar interés el uso de un metal en estado puro?. Justifícalo. Pon un ejemplo. Cuando se pretende aprovechar alguna propiedad específica del metal puro,la cual pudiera verse afectada si hubiera presentes átomos extraños. Un ejemplo podría presentarlo el cobre, cuya excelente conductividad se ve seriamente mermada con la presencia de átomos de otro elemento. PREGUNTA Qué se suele pretender cuando se diseña realiza una aleación metálica? o Incrementar las propiedades mecánicas o y la mejora la resistencia a corrosión. 29
3 PREGUNTA 2.3 Etapas principales de la solidificación de un metal o aleación? - Formación de un núcleo estable en el fundido, también conocido como nucleación. - Crecimiento de esos núcleos hasta dar origen a cristales y la formación de una estructura granular. PREGUNTA 2.4 Cuáles son los mecanismos principales por los cuales tiene lugar la nucleación de partículas sólidas en un metal? o la nucleación homogénea (cuando el metal fundido proporciona por si mismo los átomos para formar los núcleos). o y la nucleación heterogénea. 30
4 PREGUNTA Qué es necesario para la solidificación de un metal comience en forma cristalina? Para que la solidificación en forma cristalina comience, es necesario que la energía cinética de los átomos disminuya lo suficiente (por disminución de su temperatura) como para que las fuerzas de cohesión superen a la vibración atómica y sitúen a los átomos en las posiciones fijas que les corresponden en la red cristalina. Cuando esto ocurre, en el punto de la masa fundida (líquida) donde haya sucedido, se habrá formado la primera agrupación cristalina formada por uno o varios cristales. 31
5 PREGUNTA 2.5 Representa el esquema de las etapas de solidificación de los metales 32
6 PREGUNTA 2.6 Qué son los embriones en las etapas de solidificación de un metal? - Son las primeras agrupaciones sólidas elementales, formadas por unos pocos cristales, los cuales tienen el peligro de autodestruirse con el calor liberado al formarse debido a la agitación de los átomos. 33
7 PREGUNTA 2.7 Qué concepto representa el tamaño crítico de un embrión en la etapa de solidificación de un metal? Cuál es la situación energética/calorífica en ese? El tamaño crítico r c representa el tamaño a partir del cual los embriones dejan de estar en peligro de autodestrucción y se convierten en núcleos de cristalización con carácter estable. El calor latente emanado por los embriones al solidificar, debe ser fácilmente absorbido por el enfriamiento para evitar que vuelva a calentar y fundir la partícula sólida formada. 34
8 PREGUNTA 2.8 Cuándo se producirá la nucleacion homogénea? La nucleación homogénea ocurre cuando el subenfriamiento se hace lo suficientemente grande como para permitir que el embrión exceda el tamaño crítico necesario y no se funda. 35
9 PREGUNTA 2.9 En la nucleación homogénea Cuál es la expresión matemática que sirve para calcular la energía libre total liberada en la nucleación homogénea? Qué significan cada uno de sus términos? Donde: - G T es el cambio total de energía libre - r es el radio del embrión o núcleo - G v es la energía libre volumétrica G T = 4/3πr 3. G v + 4πr 2. γ - γ es la energía libre superficial específica 36
10 PREGUNTA 2.10 En la nucleación homogénea Cuál es la expresión matemática que relaciona el tamaño crítico de un núcleo con el subenfriamiento? Qué significan cada uno de sus términos? Donde: - r c es el rádio crítico del núcleo - γ es la energía libre superficial - H f es el calor latente de fusión - T es el subenfriamiento r c Tm = 2γ H T - Tm Temperatura de fusión de equilibrio del metal f 37
11 PREGUNTA 2.11 A qué se denomina Nucleación heterogénea? Compara los radios críticos en la nucleación heterogenea frente a la nucleación homogénea? Justifícalo. Se denomina de este modo a la nucleación que se produce en un líquido: - bien sobre las superficies del recipiente que lo contienen, - bien sobre alguna impureza insoluble que se encuentre presente, - sobre otras materias estructurales que reduzcan la energía libre crítica requerida para formar un núcleo estable. - El r c(heterogenea) < r c(homogénea) - Puesto que la energía superficial es más baja para la nucleación heterogénea, el cambio de energía libre total para la formación de un núcleo estable será más bajo, y el tamaño crítico del núcleo, por tanto, será menor. De este modo, la cantidad de 38
12 subenfriamiento requerido para formar un núcleo estable producido por nucleación heterogénea será mucho menor. 39
13 PREGUNTA 2.12 Qué es una solución sólida metálica? Tipos principales y descripción. - Es una aleación de dos o más metales o de un metal con un no metal - Soluciones sólidas principales: de sustitución y de inserción. - Descripción de la solución sólida por sustitución: - Los átomos de soluto son sustituidos por átomos de disolvente en las posiciones de la red cristalina. - La estructura cristalina del elemento disolvente permanece inalterada, pero las posiciones cristalinas se pueden distorsionar debido a la presencia de átomos de soluto, tanto más cuanto mayor sea la diferencia entre los diámetros de los átomos de disolvente y soluto. - Descripción de la Soluciones sólidas de inserción: 40
14 - En este tipo de soluciones sólidas, los átomos de soluto encajan en los espacios (o intersticios) que hay entre los átomos del disolvente. - Las soluciones sólidas de inserción pueden formarse cuando uno de los átomos es mucho mayor que el otro. PREGUNTA 2.13 Condiciones necesarias para que pueda darse una solución sólida de sustitución? - La diferencia entre los diámetros atómicos de los elementos no exceda mas de un 15% de su diámetro. - La estructura cristalina de los dos elementos sea la misma. - No haya diferencias apreciables en las electronegatividades de los dos elementos, para evitar su reacción y por tanto que no formen compuestos. - Los dos elementos tengan la misma valencia. 41
15 PREGUNTA 2.14 Qué es el acero? - Es una aleación de solución sólida de inserción en C en Fe PREGUNTA 2.15 Qué significa la expresión? Para qué se utiliza? Ps/P L = (X A X 3 ) / (X 2 X A ) Regla que se conoce como regla de la palanca y que permite definir las proporciones entre fases a cada temperatura. 42
16 PREGUNTA 2.16 Qué pretende la establecer la Ley de Fases de Gibbs? Cuál es su expresión? y si qué vale para sistemas condensados? - La ley de fases de Gibbs pretende establecer el número de variables independientes, grados de libertad, que un sistema tiene en un entorno del espacio de sus variables para no alterar el equilibrio existente entre las fases presentes si los desplazamientos de los mencionados grados de libertad son infinitesimales. - g = r(n-1) + 2 n(r-1) = n r + 2 regla de las fases de Gibbs. - Para sistemas condensados, se puede prescindir de la presión como variable y se convierte en: g = n r
17 PREGUNTA 2.17 Qué tipo de transformaciones son cada una de estas ecuaciones? Líquido (l) sólido α + sólido β Líquido + Sólido 1 Sólido 2 Sólido 1 Solido 2 + Sólido 3 Transformación eutéctica: Líquido (l) sólido α + sólido β Transformación Peritéctica: Líquido + Sólido 1 Sólido 2 Transformación Eutectoide: Sólido 1 Solido 2 + Sólido 3 44
18 PREGUNTA 2.18 Cómo se clasifican y Cuáles son las principales imperfecciones de las redes cristalinas? - Las imperfecciones de las redes cristalinas se clasifican en función de su geometría y forma. - Las tres principales divisiones son: - Defectos puntuales: vacantes y defectos intersticiales - Defectos de línea o de una dimensión: Dislocaciones - Defectos de superficie que implican dos dimensiones: superficies externas y bordes de grano 45
19 PREGUNTA 2.19 Qué es la difusión? Mecanismos principales de difusión de los átomos en una estructura cristalina? Y descripción de los mismos La difusión es el mecanismo por el cual la materia es transportada a través de la materia. Existen dos mecanismos principales: - Mecanismos de difusión por vacantes o sustitucional. - Mecanismos de difusión intersticial. Mecanismos de difusión por vacantes o sustitucional: Según va aumentando la temperatura del metal se van produciendo más vacantes y habrá más energía térmica disponible. Mecanismos de difusión intersticial. Los átomos se trasladan de un intersticio a otro contiguo sin desplazar permanentemente a ninguno de los átomos de la matriz de la red 46
20 cristalina. Esto implica que los átomos que difunden intersticialmente deberán de ser de pequeño tamaño respecto a los de la red cristalina matriz. 47
21 PREGUNTA 2.19 Cuándo se produce la Difusión en estado estacionario? Qué ley lo gobierna? Describe los términos de la ecuación que lo gobierna? - Se produce cuando no se experimentan cambios en la concentración de átomos de soluto en distintos planos con el tiempo. - Este proceso está gobernado por la primera ley de Fick: Donde: - J es el flujo o corriente neta de átomos J = D dc dx - D es una constante denominada difusividad - dc/dx es el gradiente de la concentración 48
22 PREGUNTA 2.20 Factores y consideraciones sobre los mismos que influyen en la difusividad? - La temperatura. A medida que aumenta la temperatura aumenta la difusividad de los átomos en el metal o aleación. - Tipo de estructura cristalina de la red del disolvente. La difusión se verá favorecida en estructuras o redes de bajo factor de empaquetamiento. - Tipo de imperfecciones cristalinas. Se favorece por los bordes de grano ya que es la zona donde existe un mayor número de vacantes. - Concentración de las especies que se difunden. Este es un factor complejo requiere un estudio de detalle. 49
23 PREGUNTA 2.21 Cuándo se produce la Difusión en estado no estacionario? Qué ley lo gobierna? Describe los términos de la ecuación que lo gobierna para el caso de un gas A difundiendo en sólido B? - Se denomina estado no estacionario, cuando la concentración de los átomos de soluto en cualquier punto del material cambia con el tiempo - Este estado no estacionario de difusión está gobernado por la segunda ley de Fick. dcx dt = d dx D dcx dx En el caso de un gas A difundiendo en un sólido B, la solución para la ecuación anterior resulta: Cs Cx Cs Co = erf x 2 Dt 50
24 Donde: - Cs es la concentración superficial del elemento en el gas que difunde dentro de la superficie - Co es la concentración inicial uniforme del elemento en el sólido - Cx es la concentración del elemento a la distancia x de la superficie en un tiempo t - x es la distancia desde la superficie - T es el tiempo - D la difusividad 51
25 PREGUNTA 2.22 Qué significa la expresión D D e Q RT = 0? y qué significa cada uno de sus términos? Representa la velocidad de difusiónla constante de difusividad con el incremento en función de la temperatura Q es la energía de activación de las especies en difusión J/mol R es la constante molar de los gases (8,31 J/mol.K) T es la temperatura D o es la constante de proporcionalidad m 2 /s independiente de T D es la difusividad en m 2 /s 52
III. DIFUSION EN SOLIDOS
 Metalografía y Tratamientos Térmicos III - 1 - III. DIFUSION EN SOLIDOS III.1. Velocidad de procesos en sólidos Muchos procesos de producción y aplicaciones en materiales de ingeniería están relacionados
Metalografía y Tratamientos Térmicos III - 1 - III. DIFUSION EN SOLIDOS III.1. Velocidad de procesos en sólidos Muchos procesos de producción y aplicaciones en materiales de ingeniería están relacionados
UNE RAFAEL MARÍA BARALT PROGRAMA DE INGENIERÍA Y TECNOLOGÍA INGENIERÍA EN MTTO MECÁNICO SOLIDIFICACIÓN. Elaborado por: Ing. Roger Chirinos.
 UNE RAFAEL MARÍA BARALT PROGRAMA DE INGENIERÍA Y TECNOLOGÍA INGENIERÍA EN MTTO MECÁNICO SOLIDIFICACIÓN Elaborado por: Ing. Roger Chirinos. MSc Cabimas, Noviembre de 2013 SOLIDIFICACIÓN Fundamentos básicos
UNE RAFAEL MARÍA BARALT PROGRAMA DE INGENIERÍA Y TECNOLOGÍA INGENIERÍA EN MTTO MECÁNICO SOLIDIFICACIÓN Elaborado por: Ing. Roger Chirinos. MSc Cabimas, Noviembre de 2013 SOLIDIFICACIÓN Fundamentos básicos
4. DIFUSION EN SÓLIDO
 4. DIFUSION EN SÓLIDO MATERIALES 13/14 ÍNDICE 1. Conceptos generales. Mecanismos de difusión. 3. Leyes de Fick. 1. Estado estacionario.. Estado no estacionario. 4. Factores de difusión. 5. Aplicaciones
4. DIFUSION EN SÓLIDO MATERIALES 13/14 ÍNDICE 1. Conceptos generales. Mecanismos de difusión. 3. Leyes de Fick. 1. Estado estacionario.. Estado no estacionario. 4. Factores de difusión. 5. Aplicaciones
TEMA 2. FASES Y TRANSFORMACIONES DE FASES. DIAGRAMAS DE EQUILIBRIO.
 TEMA 2. FASES Y TRANSFORMACIONES DE FASES. DIAGRAMAS DE EQUILIBRIO. Objetivos Este tema tiene por objeto conocer el interés e importancia de las aleaciones y las posibilidades de transformaciones y cambios
TEMA 2. FASES Y TRANSFORMACIONES DE FASES. DIAGRAMAS DE EQUILIBRIO. Objetivos Este tema tiene por objeto conocer el interés e importancia de las aleaciones y las posibilidades de transformaciones y cambios
TEMA 3: DIAGRAMAS DE EQUILIBRIO
 TEMA 3: DIAGRAMAS DE EQUILIBRIO 1.- Aleaciones Características Los metales puros tienen poca aplicación en la industria. La mayoría de ellos se combinan con otros metales o no metales para mejorar sus
TEMA 3: DIAGRAMAS DE EQUILIBRIO 1.- Aleaciones Características Los metales puros tienen poca aplicación en la industria. La mayoría de ellos se combinan con otros metales o no metales para mejorar sus
TEMA 4. IMPERFECIONES EN SÓLIDOS
 TEMA 4. IMPERFECIONES EN SÓLIDOS En el Tema 3 se ha descrito el SÓLIDO CRISTALINO mediante la aproximación del CRISTAL IDEAL, que tomamos como modelo de perfección cristalina Los sólidos cristalinos reales
TEMA 4. IMPERFECIONES EN SÓLIDOS En el Tema 3 se ha descrito el SÓLIDO CRISTALINO mediante la aproximación del CRISTAL IDEAL, que tomamos como modelo de perfección cristalina Los sólidos cristalinos reales
MATERIALES METALICOS 2do Ingeniería Mecánica. Diagramas de Equilibrio de Fases
 MATERIALES METALICOS 2do Ingeniería Mecánica Diagramas de Equilibrio de Fases Ing. Víctor Gómez Universidad Tecnológica Nacional Facultad Regional Tucumán Aleaciones Ø Aleación: Sustancia que tiene propiedades
MATERIALES METALICOS 2do Ingeniería Mecánica Diagramas de Equilibrio de Fases Ing. Víctor Gómez Universidad Tecnológica Nacional Facultad Regional Tucumán Aleaciones Ø Aleación: Sustancia que tiene propiedades
Estructuras Cristalinas. Julio Alberto Aguilar Schafer
 Estructuras Cristalinas Julio Alberto Aguilar Schafer Modelo del estado líquido los metales Modelo del paso del estado líquido al estado sólido de los metales Equilibrio líquido-vapor Presión de vapor
Estructuras Cristalinas Julio Alberto Aguilar Schafer Modelo del estado líquido los metales Modelo del paso del estado líquido al estado sólido de los metales Equilibrio líquido-vapor Presión de vapor
Tema 3. Solidificación, defectos y difusión en sólidos
 Tema 3. Solidificación, defectos y difusión en sólidos 2. Defectos a) Defectos puntuales b) Dislocaciones c) Defectos superficiales 3. Difusión en sólidos a) Generalidades b) Mecanismos de difusión c)
Tema 3. Solidificación, defectos y difusión en sólidos 2. Defectos a) Defectos puntuales b) Dislocaciones c) Defectos superficiales 3. Difusión en sólidos a) Generalidades b) Mecanismos de difusión c)
DIFUSIÓN UNIVERSIDAD TECNOLÓGICA DE PEREIRA TECNOLOGIA MECANICA
 DIFUSIÓN UNIVERSIDAD TECNOLÓGICA DE PEREIRA TECNOLOGIA MECANICA 1 CONTENIDO Concepto de difusión Mecanismos de difusión Difusión en régimen permanente y en régimen transitório Fatores que influeyen en
DIFUSIÓN UNIVERSIDAD TECNOLÓGICA DE PEREIRA TECNOLOGIA MECANICA 1 CONTENIDO Concepto de difusión Mecanismos de difusión Difusión en régimen permanente y en régimen transitório Fatores que influeyen en
Cinética del cambio de fase TEMA 5
 TEMA 5 CINETICA DEL CAMBIO DE FASE 1. INTRODUCCIÓN. El cambio estructural de un sistema se produce por la existencia de una fuerza conductora de ese cambio. Esta fuerza que impulsa el cambio es la diferencia
TEMA 5 CINETICA DEL CAMBIO DE FASE 1. INTRODUCCIÓN. El cambio estructural de un sistema se produce por la existencia de una fuerza conductora de ese cambio. Esta fuerza que impulsa el cambio es la diferencia
TEMA 2: DIAGRAMAS DE FASES
 TEMA 2: DIAGRAMAS DE FASES 1.- LAS ALEACIONES 2.- FUSIÓN Y SOLIDIFICACIÓN 3.- DIAGRAMAS DE EQUILIBRIO O DE FASES 4.- TIPOS DE DIAGRAMAS 5.- REPASO - 1 - 1.- ALEACIONES Una aleación es una sustancia compuesta
TEMA 2: DIAGRAMAS DE FASES 1.- LAS ALEACIONES 2.- FUSIÓN Y SOLIDIFICACIÓN 3.- DIAGRAMAS DE EQUILIBRIO O DE FASES 4.- TIPOS DE DIAGRAMAS 5.- REPASO - 1 - 1.- ALEACIONES Una aleación es una sustancia compuesta
Tema 4.- Solidificación y Difusión
 BLOQUE II.- ESTRUCTURA * William F. Smith Fundamentos de la Ciencia e Ingeniería de Materiales. Tercera Edición. Ed. Mc-Graw Hill * James F. Shackerlford Introducción a la Ciencia de Materiales para Ingenieros.
BLOQUE II.- ESTRUCTURA * William F. Smith Fundamentos de la Ciencia e Ingeniería de Materiales. Tercera Edición. Ed. Mc-Graw Hill * James F. Shackerlford Introducción a la Ciencia de Materiales para Ingenieros.
IMPERFECCIONES EN SÓLIDOSS
 IMPERFECCIONES EN SÓLIDOSS UN ORDENAMIENTO PERFECTO DE LOS ÁTOMOS EN LOS MATERIALES CRISTALINOS SOLAMENTE PUEDE OCURRIR A UNA TEMPERATURA DE 0 K. TAL SÓLIDO IDEAL NO EXISTE: TODOS TIENEN GRAN NÚMERO DE
IMPERFECCIONES EN SÓLIDOSS UN ORDENAMIENTO PERFECTO DE LOS ÁTOMOS EN LOS MATERIALES CRISTALINOS SOLAMENTE PUEDE OCURRIR A UNA TEMPERATURA DE 0 K. TAL SÓLIDO IDEAL NO EXISTE: TODOS TIENEN GRAN NÚMERO DE
GUÍA DE DISCUSIÓN DE PROBLEMAS 4 TEMA DIFUSIÓN EN MATERIALES DE INGENIERÍA
 UNIVERSIDAD DON BOSCO FACULTAD DE INGENIERÍA ESCUELA DE INGENIERÍA MECÁNICA Asignatura: "Ciencia de los Materiales" I- SECCION DE PREGUNTAS: GUÍA DE DISCUSIÓN DE PROBLEMAS 4 TEMA DIFUSIÓN EN MATERIALES
UNIVERSIDAD DON BOSCO FACULTAD DE INGENIERÍA ESCUELA DE INGENIERÍA MECÁNICA Asignatura: "Ciencia de los Materiales" I- SECCION DE PREGUNTAS: GUÍA DE DISCUSIÓN DE PROBLEMAS 4 TEMA DIFUSIÓN EN MATERIALES
3.- Con el diagrama de equilibrio Cu-Ni, haga el análisis de fases para una aleación del 50% de Cu a: 1400ºC, 1300ºC, 1200ºC 1100ºC.
 1.- Con el diagrama de equilibrio Cu-Ni que se adjunta, describir el enfriamiento lento de una aleación del 3% de Ni y determinar su composición a 12ºC. 2.- Una aleación compuesta de 2 Kg de Cu y 2 Kg
1.- Con el diagrama de equilibrio Cu-Ni que se adjunta, describir el enfriamiento lento de una aleación del 3% de Ni y determinar su composición a 12ºC. 2.- Una aleación compuesta de 2 Kg de Cu y 2 Kg
5.- Describir la solubilidad del Carbono en el Hierro en función de la temperatura y de sus distintos estados alotrópicos.
 DIAGRAMA HIERRO-CARBONO: 1.- Haciendo uso del diagrama Fe-C, verificar el enfriamiento lento ( en condiciones próximas al equilibrio) de las siguientes aleaciones: a) Acero de 0.17% de C b) Acero de 0.30%
DIAGRAMA HIERRO-CARBONO: 1.- Haciendo uso del diagrama Fe-C, verificar el enfriamiento lento ( en condiciones próximas al equilibrio) de las siguientes aleaciones: a) Acero de 0.17% de C b) Acero de 0.30%
5b. DIAGRAMA HIERRO-CARBONO
 5b. DIAGRAMA HIERRO-CARBONO MATERIALES 13/14 ÍNDICE ACERO DIAGRAMA Fe-C FASES EN EL DIAGRAMA PROPIEDADES MECANICAS DE LAS FASES 2 1. ACERO Constituyentes de las aleaciones Fe-C (fases) Ferrita : Solución
5b. DIAGRAMA HIERRO-CARBONO MATERIALES 13/14 ÍNDICE ACERO DIAGRAMA Fe-C FASES EN EL DIAGRAMA PROPIEDADES MECANICAS DE LAS FASES 2 1. ACERO Constituyentes de las aleaciones Fe-C (fases) Ferrita : Solución
MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES CONTENIDOS
 MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES CONTENIDOS Generalidades Estructura interna de los metales. Defectos en la estructura cristalina Soluciones sólidas Mecanismos de endurecimiento de los metales
MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES CONTENIDOS Generalidades Estructura interna de los metales. Defectos en la estructura cristalina Soluciones sólidas Mecanismos de endurecimiento de los metales
Equilibrio sólido- líquido en sistemas de dos componentes
 Equilibrio sólido- líquido en sistemas de dos componentes Miscibilidad en fase líquida e inmiscibilidad en fase sólida: sean C y B dos sustancias miscibles en todas las proporciones en la fase líquida
Equilibrio sólido- líquido en sistemas de dos componentes Miscibilidad en fase líquida e inmiscibilidad en fase sólida: sean C y B dos sustancias miscibles en todas las proporciones en la fase líquida
Departamento de Tecnologías 1 IES Valle del Sol. Selectividad 2015 SELECTIVIDAD 2014 SELECTIVIDAD 2013
 1 IES Valle del Sol No hay ejercicios de este tema No hay ejercicios de este tema. Selectividad 2015 SELECTIVIDAD 2014 SELECTIVIDAD 2013 1. Dos metales A y B solidifican a 1000 ºC y 500 ºC respectivamente
1 IES Valle del Sol No hay ejercicios de este tema No hay ejercicios de este tema. Selectividad 2015 SELECTIVIDAD 2014 SELECTIVIDAD 2013 1. Dos metales A y B solidifican a 1000 ºC y 500 ºC respectivamente
Capítulo 7 Diagramas de fase y transformaciones de fase
 Capítulo 7 Diagramas de fase y transformaciones de fase 1 Tema 7: Diagramas de fase y transformaciones de fase 1. Definiciones 2. Diagramas de fase 3. Cinética: nucleación y crecimiento 4. Tratamientos
Capítulo 7 Diagramas de fase y transformaciones de fase 1 Tema 7: Diagramas de fase y transformaciones de fase 1. Definiciones 2. Diagramas de fase 3. Cinética: nucleación y crecimiento 4. Tratamientos
Tema 20 Propiedades eléctricas de los materiales.
 Tema 20 Propiedades eléctricas de los materiales. Las propiedades eléctricas miden la respuesta del material cuando se le aplica un campo eléctrico. Conductividad eléctrica R i = V ; R= resistencia del
Tema 20 Propiedades eléctricas de los materiales. Las propiedades eléctricas miden la respuesta del material cuando se le aplica un campo eléctrico. Conductividad eléctrica R i = V ; R= resistencia del
los Aceros El porqué? Tratamientos térmicos Microestructura) Propiedades d Mecánicas FCEIA-UNR C Materiales FCEIA-UNR C-3.20.
 11. Tratamientos t Térmicos de los Aceros El porqué? Tratamientos térmicos (Temperatura y tiempo) Microestructura) Propiedades d Mecánicas 1 El factor TIEMPO La mayoría de las transformaciones en estado
11. Tratamientos t Térmicos de los Aceros El porqué? Tratamientos térmicos (Temperatura y tiempo) Microestructura) Propiedades d Mecánicas 1 El factor TIEMPO La mayoría de las transformaciones en estado
b) Aplicar la regla de las fases a cada una de las regiones, líneas y puntos significativos y determina el número de grados de libertad existentes.
 1.- El platino y el oro son totalmente solubles en estado sólido y en estado líquido. El punto de fusión del platino son 1774 C y el del oro 1063 C. Una aleación formada por un 40% de oro comienza a solidificar
1.- El platino y el oro son totalmente solubles en estado sólido y en estado líquido. El punto de fusión del platino son 1774 C y el del oro 1063 C. Una aleación formada por un 40% de oro comienza a solidificar
SEGUNDO DE BACHILLERATO QUÍMICA. a A + b B c C + d D
 TEMA 5. CINÉTICA QUÍMICA a A + b B c C + d D 1 d[a] 1 d[b] 1 d[c] 1 d[d] mol v = = = + = + a dt b dt c dt d dt L s El signo negativo en la expresión de velocidad es debido a que los reactivos desaparecen,
TEMA 5. CINÉTICA QUÍMICA a A + b B c C + d D 1 d[a] 1 d[b] 1 d[c] 1 d[d] mol v = = = + = + a dt b dt c dt d dt L s El signo negativo en la expresión de velocidad es debido a que los reactivos desaparecen,
ALEACIONES 1. INTRODUCCION 2. CLASIFICACION 3. SOLUCIONES SÓLIDAS 4. FASES INTERMEDIAS 5. SOLUCIONES SÓLIDAS ORDENADAS M.V.M.G ALEACIONES 1
 ALEACIONES 1. INTRODUCCION 2. CLASIFICACION 3. SOLUCIONES SÓLIDAS 4. FASES INTERMEDIAS 5. SOLUCIONES SÓLIDAS ORDENADAS 2007-08 ALEACIONES 1 INTRODUCCIÓN Una aleación es la combinación de dos o más metales,
ALEACIONES 1. INTRODUCCION 2. CLASIFICACION 3. SOLUCIONES SÓLIDAS 4. FASES INTERMEDIAS 5. SOLUCIONES SÓLIDAS ORDENADAS 2007-08 ALEACIONES 1 INTRODUCCIÓN Una aleación es la combinación de dos o más metales,
TEMA 9. TRANSFORMACIONES DE FASE Y TRATAMIENTOS TÉRMICOS EN ALEACIONES Fe-C
 TEMA 9. TRANSFORMACIONES DE FASE Y TRATAMIENTOS TÉRMICOS EN ALEACIONES Fe-C Los Diagramas de Fase representan estados y transformaciones en condiciones de equilibrio, pero no aportan información sobre
TEMA 9. TRANSFORMACIONES DE FASE Y TRATAMIENTOS TÉRMICOS EN ALEACIONES Fe-C Los Diagramas de Fase representan estados y transformaciones en condiciones de equilibrio, pero no aportan información sobre
SOLIDIFICACIÓN E IMPERFECCIONES EN SÓLIDOS
 SOLIDIFICACIÓN E IMPERFECCIONES EN SÓLIDOS 1 El uso de los metales puros es limitado y casi siempre presenta interés cuando se pretende aprovechar alguna propiedad específica del metal puro que resulte
SOLIDIFICACIÓN E IMPERFECCIONES EN SÓLIDOS 1 El uso de los metales puros es limitado y casi siempre presenta interés cuando se pretende aprovechar alguna propiedad específica del metal puro que resulte
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
ESTRUCTURA DE LOS MATERIALES 2. 25/02/2012 Elaboró Ing. Efrén Giraldo T. 1
 ESTRUCTURA DE LOS MATERIALES 2 25/02/2012 Elaboró Ing. Efrén Giraldo T. 1 FACTOR DE EMPAQUETAMIENTO FEA = (No de átomos por celda. Vol de un átomo) / V (celda) 25/02/2012 Elaboró Ing. Efrén Giraldo T.
ESTRUCTURA DE LOS MATERIALES 2 25/02/2012 Elaboró Ing. Efrén Giraldo T. 1 FACTOR DE EMPAQUETAMIENTO FEA = (No de átomos por celda. Vol de un átomo) / V (celda) 25/02/2012 Elaboró Ing. Efrén Giraldo T.
PREGUNTAS PRUEBAS PAU MATERIALES
 PREGUNTAS PRUEBAS PAU MATERIALES JUNIO 2010 FE Opción A Defina brevemente las siguientes propiedades que presentan los compuestos metálicos: a) Elasticidad (0,5 puntos) b) Tenacidad (0,5 puntos) c) Maleabilidad
PREGUNTAS PRUEBAS PAU MATERIALES JUNIO 2010 FE Opción A Defina brevemente las siguientes propiedades que presentan los compuestos metálicos: a) Elasticidad (0,5 puntos) b) Tenacidad (0,5 puntos) c) Maleabilidad
TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN. 2.- Formas de encontrar el carbono en las aleaciones férreas
 TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN 1.- Estados alotrópicos del Hierro (Fe) Según las condiciones de, el hierro puede presentar diferentes estados, con mayor o menor capacidad para disolver
TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN 1.- Estados alotrópicos del Hierro (Fe) Según las condiciones de, el hierro puede presentar diferentes estados, con mayor o menor capacidad para disolver
Propiedades de la materia. Características de sólidos, líquidos y gases
 Propiedades de la materia Características de sólidos, líquidos y gases Fluidos Líquidos Ej: H 2 O Estados de la materia Gases Ej: O 2 Amorfos Ej: caucho Cristalinos Ej: sal, azúcar Sólidos Metálicos Enlace
Propiedades de la materia Características de sólidos, líquidos y gases Fluidos Líquidos Ej: H 2 O Estados de la materia Gases Ej: O 2 Amorfos Ej: caucho Cristalinos Ej: sal, azúcar Sólidos Metálicos Enlace
SISTEMAS MATERIALES. Departamento de Física y Química 2º ESO
 SISTEMAS MATERIALES Departamento de Física y Química 2º ESO 0. Mapa conceptual MATERIA Sustancias puras Mezclas Heterogéneas Homogéneas Sistemas coloidales Técnicas de separación Disoluciones Soluto Disolvente
SISTEMAS MATERIALES Departamento de Física y Química 2º ESO 0. Mapa conceptual MATERIA Sustancias puras Mezclas Heterogéneas Homogéneas Sistemas coloidales Técnicas de separación Disoluciones Soluto Disolvente
DEFECTOS E IMPERFECCIONES CRISTALINAS
 DEFECTOS E IMPERFECCIONES CRISTALINAS Realmente no existen cristales perfectos sino que contienen varios tipos de imperfecciones y defectos, que afectan a muchas de sus propiedades físicas y mecánicas
DEFECTOS E IMPERFECCIONES CRISTALINAS Realmente no existen cristales perfectos sino que contienen varios tipos de imperfecciones y defectos, que afectan a muchas de sus propiedades físicas y mecánicas
Física y Química 3º ESO
 1. Física y Química. Ciencias de la medida forman parte de las necesitan Ciencias de la naturaleza medir las propiedades de los cuerpos que se dividen en para lo cual se emplean lo que siempre conlleva
1. Física y Química. Ciencias de la medida forman parte de las necesitan Ciencias de la naturaleza medir las propiedades de los cuerpos que se dividen en para lo cual se emplean lo que siempre conlleva
Materiales usados en la Industria Aeroespacial
 Materiales usados en la Industria Aeroespacial Características del espacio Existe vacío y aparente carencia de gravedad Todo en el espacio se está moviendo, atraído por grandes campos gravitacionales.
Materiales usados en la Industria Aeroespacial Características del espacio Existe vacío y aparente carencia de gravedad Todo en el espacio se está moviendo, atraído por grandes campos gravitacionales.
UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES
 UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES 1. GENERALIDADES... Pág. 49 2. ESTRUCTURA INTERNA DE LOS METALES... Pág. 49 2.1. Estructuras cristalinas... Pág. 49 2.2. Estructura cristalina cúbica
UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES 1. GENERALIDADES... Pág. 49 2. ESTRUCTURA INTERNA DE LOS METALES... Pág. 49 2.1. Estructuras cristalinas... Pág. 49 2.2. Estructura cristalina cúbica
TEMA IV.- ALEACIONES DE HIERRO Y CARBONO
 TEMA IV.- ALEACIONES DE HIERRO Y CARBONO El hierro puro apenas tiene aplicaciones industriales, pero formando aleaciones con el carbono (además de otros elementos), es el metal más utilizado en la industria
TEMA IV.- ALEACIONES DE HIERRO Y CARBONO El hierro puro apenas tiene aplicaciones industriales, pero formando aleaciones con el carbono (además de otros elementos), es el metal más utilizado en la industria
Tema 4 Difusión en estado sólido
 Tema 4 Difusión en estado sólido Sabemos que los materiales están formados por átomos. Se ha modelado el agrupamiento de los átomos como un conjunto de esferas sólidas ordenadas siguiendo un patrón definido.
Tema 4 Difusión en estado sólido Sabemos que los materiales están formados por átomos. Se ha modelado el agrupamiento de los átomos como un conjunto de esferas sólidas ordenadas siguiendo un patrón definido.
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
Difusión ió Fenómeno de transporte de masapormovimiento
 Difusión en sólidos Difusión Difusión ió Fenómeno de transporte de masapormovimiento atómico Mecanismos Gases y Líiquidos movimientoaleatorio (Browniano) Sólidos difusión por vacancias o difusión intersticial.
Difusión en sólidos Difusión Difusión ió Fenómeno de transporte de masapormovimiento atómico Mecanismos Gases y Líiquidos movimientoaleatorio (Browniano) Sólidos difusión por vacancias o difusión intersticial.
Tema 3: Diagramas de fases. Problemas resueltos
 Tema 3: Diagramas de fases Problemas resueltos Problema 1. Dos metales y tienen puntos de fusión a 1400 y 1300 respectivamente. El metal presenta dos cambios alotrópicos a los 900,, y a los 700,, de forma
Tema 3: Diagramas de fases Problemas resueltos Problema 1. Dos metales y tienen puntos de fusión a 1400 y 1300 respectivamente. El metal presenta dos cambios alotrópicos a los 900,, y a los 700,, de forma
Qué es el vidrio? Material amorfo obtenido
 Qué es el vidrio? Material amorfo obtenido por enfriamiento de una masa fundida, cualquiera que sea su composición química y la zona de temperatura en la que tenga lugar su solidificación Debido al aumento
Qué es el vidrio? Material amorfo obtenido por enfriamiento de una masa fundida, cualquiera que sea su composición química y la zona de temperatura en la que tenga lugar su solidificación Debido al aumento
TEMA 1. ESTRUCTURA INTERNA DE LOS MATERIALES.
 TEMA 1. ESTRUCTURA INTERNA DE LOS MATERIALES. INDICE. 1. EL ATOMO. 2. FUERZAS Y ENERGIAS DE INTERACCION ENTRE ATOMOS. 3. ESTRUCTURA ELECTRÓNICA REACTIVIDAD QUIMICA. 4. TIPOS DE ENLACES ATOMICOS Y MOLECULARES.
TEMA 1. ESTRUCTURA INTERNA DE LOS MATERIALES. INDICE. 1. EL ATOMO. 2. FUERZAS Y ENERGIAS DE INTERACCION ENTRE ATOMOS. 3. ESTRUCTURA ELECTRÓNICA REACTIVIDAD QUIMICA. 4. TIPOS DE ENLACES ATOMICOS Y MOLECULARES.
CIDEAD. 2º BACHILLERATO.TECNOLOGÍA INDUSTRIAL II. Tema 5.- Los tratamientos térmicos de los aceros.
 Desarrollo del tema: 1. Estados alotrópicos del hierro. 2. Aleaciones hierro carbono. Su composición 3. Constitución de las aleaciones hierro carbono. 4. Estructura de las aleaciones Fe C 5. Diagrama de
Desarrollo del tema: 1. Estados alotrópicos del hierro. 2. Aleaciones hierro carbono. Su composición 3. Constitución de las aleaciones hierro carbono. 4. Estructura de las aleaciones Fe C 5. Diagrama de
Unidad 2. La materia
 Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN. 2.- Formas de encontrar el carbono en las aleaciones férreas
 TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN 1.- Estados alotrópicos del Hierro (Fe) Según las condiciones de temperatura, el hierro puede presentar diferentes estados, con mayor o menor capacidad
TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN 1.- Estados alotrópicos del Hierro (Fe) Según las condiciones de temperatura, el hierro puede presentar diferentes estados, con mayor o menor capacidad
PROBLEMAS TEMA 2 TECNOLOGÍA INDUSTRIAL II
 1. Dibujar un diagrama de equilibrio entre dos componentes cualesquiera A y B, solubles completamente en estado sólido que solidifican en su estado puro a 1000 y 1300 ºC, respectivamente. Situar en la
1. Dibujar un diagrama de equilibrio entre dos componentes cualesquiera A y B, solubles completamente en estado sólido que solidifican en su estado puro a 1000 y 1300 ºC, respectivamente. Situar en la
TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR
 TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR El calor: Es una forma de energía en tránsito. La Termodinámica y La Transferencia de calor. Diferencias. TERMODINAMICA 1er. Principio.Permite determinar
TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR El calor: Es una forma de energía en tránsito. La Termodinámica y La Transferencia de calor. Diferencias. TERMODINAMICA 1er. Principio.Permite determinar
FOURIER Y NEWTON). LEY DE FICK PARA DIFUSIÓN
 INTRODUCCIÓN. SEMEJANZA ENTRE TRANSFERENCIA DE MASA, CALOR Y MOMENTO (LEYES DE FICK, FOURIER Y NEWTON). LEY DE FICK PARA DIFUSIÓN MOLECULAR. E-mail: [email protected] TRANSFERENCIA DE MASAS El transporte
INTRODUCCIÓN. SEMEJANZA ENTRE TRANSFERENCIA DE MASA, CALOR Y MOMENTO (LEYES DE FICK, FOURIER Y NEWTON). LEY DE FICK PARA DIFUSIÓN MOLECULAR. E-mail: [email protected] TRANSFERENCIA DE MASAS El transporte
CONCEPTOS BÁSICOS DE CATÁLISIS HETEROGÉNEA
 CONCEPTOS BÁSICOS DE CATÁLISIS HETEROGÉNEA Conceptos básicos de catálisis heterogénea 2 Se dice que un reactor opera en fase homogénea si se trabaja en una sola fase. En contraste, el reactor que opera
CONCEPTOS BÁSICOS DE CATÁLISIS HETEROGÉNEA Conceptos básicos de catálisis heterogénea 2 Se dice que un reactor opera en fase homogénea si se trabaja en una sola fase. En contraste, el reactor que opera
Líquido. Sólido. Gas Plasma. educacionsanitariaymas.blogspot.com.
 Líquido Sólido www.juntadeandalucia.es educacionsanitariaymas.blogspot.com Gas Plasma www.palimpalem.com En el estado sólido las moléculas se encuentran muy juntas, tienen mucha cohesión. Las partículas
Líquido Sólido www.juntadeandalucia.es educacionsanitariaymas.blogspot.com Gas Plasma www.palimpalem.com En el estado sólido las moléculas se encuentran muy juntas, tienen mucha cohesión. Las partículas
La reacción de formación de perlita en aleaciones Fe-C
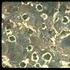 La Transformación Eutectoide ( Tomado de Porter D. A et al Phase Transformations in metals and alloys. Reed Hill R. Principios de Metalurgia Física, Hume Rothery The Structures of alloys of iron ) La reacción
La Transformación Eutectoide ( Tomado de Porter D. A et al Phase Transformations in metals and alloys. Reed Hill R. Principios de Metalurgia Física, Hume Rothery The Structures of alloys of iron ) La reacción
Profesora: Teresa Esparza Araña LA CANTIDAD DE SUSTANCIA EN QUÍMICA. UNIDAD 6: Los gases ideales
 Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla LA CANTIDAD DE SUSTANCIA EN QUÍMICA UNIDAD 6: Los gases ideales 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA DE LA
Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla LA CANTIDAD DE SUSTANCIA EN QUÍMICA UNIDAD 6: Los gases ideales 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA DE LA
Importancia del hierro en la metalurgia
 DIAGRAMA Fe - C Importancia del hierro en la metalurgia Afinidad química Capacidad de solubilidad de otros elementos Propiedad alotrópica en estado sólido Capacidad para variar sustancialmente la estructura
DIAGRAMA Fe - C Importancia del hierro en la metalurgia Afinidad química Capacidad de solubilidad de otros elementos Propiedad alotrópica en estado sólido Capacidad para variar sustancialmente la estructura
EQUILIBRIO QUÍMICO. Concentración. C ó D. Tiempo. Las concentraciones no cambian mucho con el tiempo. El Equilibrio es estable A+B C + D
 EQUILIBRIO QUÍMICO En química definimos equilibrio químico como el balance exacto entre dos procesos, uno de los cuales es opuesto a otro. Cuando ocurre una reacción química, los reactivos se va transformando
EQUILIBRIO QUÍMICO En química definimos equilibrio químico como el balance exacto entre dos procesos, uno de los cuales es opuesto a otro. Cuando ocurre una reacción química, los reactivos se va transformando
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2009 PRIMERA PARTE
 1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
5. Equilibrio químico
 5. Equilibrio químico Química (1S, Grado Biología) UAM 5. Equilibrio químico Contenidos Equilibrio químico Concepto Condición de uilibro químico Energía libre de Gibbs de reacción Cociente de reacción
5. Equilibrio químico Química (1S, Grado Biología) UAM 5. Equilibrio químico Contenidos Equilibrio químico Concepto Condición de uilibro químico Energía libre de Gibbs de reacción Cociente de reacción
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
TEMA 13: Termodinámica
 QUÍMICA I TEMA 13: Termodinámica Tecnólogo Minero Temario ü Procesos espontáneos ü Entropía ü Segunda Ley de la Termodinámica ü Energía libre de Gibbs ü Energía libre y equilibrio químico Procesos espontáneos
QUÍMICA I TEMA 13: Termodinámica Tecnólogo Minero Temario ü Procesos espontáneos ü Entropía ü Segunda Ley de la Termodinámica ü Energía libre de Gibbs ü Energía libre y equilibrio químico Procesos espontáneos
Electricidad y calor. Webpage: Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
TRANSFERENCIA DE CALOR
 Conducción Convección Radiación TRANSFERENCIA DE CALOR Ing. Rubén Marcano Temperatura es una propiedad que depende del nivel de interacción molecular. Específicamente la temperatura es un reflejo del nivel
Conducción Convección Radiación TRANSFERENCIA DE CALOR Ing. Rubén Marcano Temperatura es una propiedad que depende del nivel de interacción molecular. Específicamente la temperatura es un reflejo del nivel
convección (4.1) 4.1. fundamentos de la convección Planteamiento de un problema de convección
 convección El modo de transferencia de calor por convección se compone de dos mecanismos de transporte, que son, la transferencia de energía debido al movimiento aleatorio de las moléculas (difusión térmica)
convección El modo de transferencia de calor por convección se compone de dos mecanismos de transporte, que son, la transferencia de energía debido al movimiento aleatorio de las moléculas (difusión térmica)
FÍSICA Y QUÍMICA 4º ESO. MCU. Características. Magnitudes angulares. Ley del movimiento.
 FÍSICA Y QUÍMICA 4º ESO Unidad 1. El movimiento Sistema de referencia. o Carácter relativo del movimiento. Conceptos básicos para describir el movimiento. o Trayectoria, posición, desplazamiento. o Clasificación
FÍSICA Y QUÍMICA 4º ESO Unidad 1. El movimiento Sistema de referencia. o Carácter relativo del movimiento. Conceptos básicos para describir el movimiento. o Trayectoria, posición, desplazamiento. o Clasificación
Hoja de problemas Tema 7
 Hoja 7 FUNDAMENTOS DE CIENCIA DE MATERIALES 1 Hoja de problemas Tema 7 1. Sea el diagrama de fases esquemático de la figura para el sistema A-B. (a) Indique la posición de las líneas de liquidus, solidus
Hoja 7 FUNDAMENTOS DE CIENCIA DE MATERIALES 1 Hoja de problemas Tema 7 1. Sea el diagrama de fases esquemático de la figura para el sistema A-B. (a) Indique la posición de las líneas de liquidus, solidus
La gran mayoría de los dispositivos de estado sólido que actualmente hay en el mercado, se fabrican con un tipo de materiales conocido como
 1.- Introducción 2.- Clasificación de los materiales. 3.- Semiconductores intrínsecos. Estructura cristalina. 4.- Semiconductores extrínsecos. Impurezas donadoras y aceptadoras. 4.1.- Semiconductores tipo
1.- Introducción 2.- Clasificación de los materiales. 3.- Semiconductores intrínsecos. Estructura cristalina. 4.- Semiconductores extrínsecos. Impurezas donadoras y aceptadoras. 4.1.- Semiconductores tipo
BLOQUE IV.- Materiales metálicos. Tema 10.- Fundiciones
 BLOQUE IV.- Materiales metálicos * William F. Smith Fundamentos de la Ciencia e Ingeniería de Materiales. Tercera Edición. Ed. Mc-Graw Hill * James F. Shackerlford Introducción a la Ciencia de Materiales
BLOQUE IV.- Materiales metálicos * William F. Smith Fundamentos de la Ciencia e Ingeniería de Materiales. Tercera Edición. Ed. Mc-Graw Hill * James F. Shackerlford Introducción a la Ciencia de Materiales
EXTRACCIÓN SÓLIDO - LÍQUIDO. Se le llama también: Lixiviación. Lavado. Percolación Infusión. Decantación por sedimentación
 LIXIVIACIÓN Es la disolución preferente de uno o más componentes de una mezcla sólida por contacto con un disolvente líquido. Es la eliminación de una fracción soluble, en forma de solución, a partir de
LIXIVIACIÓN Es la disolución preferente de uno o más componentes de una mezcla sólida por contacto con un disolvente líquido. Es la eliminación de una fracción soluble, en forma de solución, a partir de
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
Diagramas y transformaciones de fase 7. Transformaciones en estado sólido. Difusionales y no difusionales
 Diagramas y transformaciones de fase 7. Transformaciones en estado sólido. Difusionales y no difusionales Mª Concepción Merino Casals Departamento de Ciencia de los Materiales e Ingeniería Metalúrgica.
Diagramas y transformaciones de fase 7. Transformaciones en estado sólido. Difusionales y no difusionales Mª Concepción Merino Casals Departamento de Ciencia de los Materiales e Ingeniería Metalúrgica.
Balance de masa con reacción química. Balances de masa con reacción química en reactores discontinuos y continuos.
 Balance de masa con química. Balances de masa con química en reactores discontinuos y continuos. La aparición de una química en un proceso impone las restricciones adicionales dadas por la ecuación estequiométrica
Balance de masa con química. Balances de masa con química en reactores discontinuos y continuos. La aparición de una química en un proceso impone las restricciones adicionales dadas por la ecuación estequiométrica
Dinámica de electrones Bloch y Propiedades de Transporte Física del Estado Sólido II
 Dinámica de electrones Bloch y Propiedades de Transporte Física del Estado Sólido II Rubén Pérez Departamento de Física Teórica de la Materia Condensada Universidad Autónoma de Madrid Curso 2010-2011 Índice
Dinámica de electrones Bloch y Propiedades de Transporte Física del Estado Sólido II Rubén Pérez Departamento de Física Teórica de la Materia Condensada Universidad Autónoma de Madrid Curso 2010-2011 Índice
DESGASTE DE DADOS (MATRICES) EN EXTRUSIÓN DE ALUMINIO
 DESGASTE DE DADOS (MATRICES) EN EXTRUSIÓN DE ALUMINIO Composicion quimica del aluminio Par tículas de segunda fase Extrusión de per files Desgaste Composicion quimica del acero Nitruración COMPOSICION
DESGASTE DE DADOS (MATRICES) EN EXTRUSIÓN DE ALUMINIO Composicion quimica del aluminio Par tículas de segunda fase Extrusión de per files Desgaste Composicion quimica del acero Nitruración COMPOSICION
FUNDAMENTOS DE SOLIDIFICACIÓN La solidificación se entiende como el paso de líquido a sólido de un material y con esto la formación de una o varias
 FUNDAMENTOS DE SOLIDIFICACIÓN La solidificación se entiende como el paso de líquido a sólido de un material y con esto la formación de una o varias fases cristalinas. Fases de la solidificación. Líquido
FUNDAMENTOS DE SOLIDIFICACIÓN La solidificación se entiende como el paso de líquido a sólido de un material y con esto la formación de una o varias fases cristalinas. Fases de la solidificación. Líquido
Tema 5. Aleaciones metálicas. El sistema Fe-C.
 Tema 5. Aleaciones metálicas. El sistema Fe-C. Problemas sobre aleaciones Fe-C, y cinética de las transformaciones (W.D. Callister Ed. Reverté - Cap 9 y 10). 9.47. Cuál es el porcentaje de carbono de un
Tema 5. Aleaciones metálicas. El sistema Fe-C. Problemas sobre aleaciones Fe-C, y cinética de las transformaciones (W.D. Callister Ed. Reverté - Cap 9 y 10). 9.47. Cuál es el porcentaje de carbono de un
Materiales. Examen Final (28/06/2011) PARTE I: Seleccione la respuesta correcta. 0.2 p c/u. Una respuesta incorrecta elimina una correcta.
 Nombre: Materiales. Examen Final (28/06/2011) Grupo/profesor: PARTE I: Seleccione la respuesta correcta. 0.2 p c/u. Una respuesta incorrecta elimina una correcta. 1) Un material ferromagnético puede presentar
Nombre: Materiales. Examen Final (28/06/2011) Grupo/profesor: PARTE I: Seleccione la respuesta correcta. 0.2 p c/u. Una respuesta incorrecta elimina una correcta. 1) Un material ferromagnético puede presentar
P V = n R T LEYES DE LOS GASES
 P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS
 A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
Propiedades Térmicas de los Materiales. Tecnología de los Materiales 05/09/2014. Docente: Ing. Janeth Saavedra Vera
 05/09/2014 Propiedades Térmicas de los Materiales Tecnología de los Materiales Docente: Ing. Janeth Saavedra Vera Alumno: 0201313054 PROPIEDADES TÉRMICAS DE LOS MATERIALES. 1. INTRODUCCIÓN: Por propiedad
05/09/2014 Propiedades Térmicas de los Materiales Tecnología de los Materiales Docente: Ing. Janeth Saavedra Vera Alumno: 0201313054 PROPIEDADES TÉRMICAS DE LOS MATERIALES. 1. INTRODUCCIÓN: Por propiedad
CRITERIOS DE ESPONTANEIDAD
 CRITERIOS DE ESPONTANEIDAD Con ayuda de la Primera Ley de la Termodinámica podemos considerar el equilibrio de la energía y con La Segunda Ley podemos decidir que procesos pueden ocurrir de manera espontanea,
CRITERIOS DE ESPONTANEIDAD Con ayuda de la Primera Ley de la Termodinámica podemos considerar el equilibrio de la energía y con La Segunda Ley podemos decidir que procesos pueden ocurrir de manera espontanea,
LA MATERIA. Características de los átomos
 LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
Difusión en Estado Sólido 1 TEMA 3 DIFUSIÓN EN ESTADO SÓLIDO. Mecanismos de difusión. Velocidad de difusión. Procesado de materiales. Sinterización.
 Difusión en Estado Sólido 1 TEMA 3 DIFUSIÓN EN ESTADO SÓLIDO Mecanismos de difusión. Velocidad de difusión. Procesado de materiales. Sinterización. La difusión puede ser considerada como el mecanismo mediante
Difusión en Estado Sólido 1 TEMA 3 DIFUSIÓN EN ESTADO SÓLIDO Mecanismos de difusión. Velocidad de difusión. Procesado de materiales. Sinterización. La difusión puede ser considerada como el mecanismo mediante
LA MATERIA: ESTADOS DE AGREGACIÓN
 LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
TRANSFORMACIONES EN ESTADO SOLIDO
 TRANSFORMACIONES EN ESTADO SOLIDO Después de solidificada una aleación puede sufrir transformaciones posteriores. Se presenta en metales que tienen al menos un componente que sufre transformaciones alotrópicas
TRANSFORMACIONES EN ESTADO SOLIDO Después de solidificada una aleación puede sufrir transformaciones posteriores. Se presenta en metales que tienen al menos un componente que sufre transformaciones alotrópicas
CALCULO DE REACTORES
 CALCULO DE REACTORES Prof. Moira Miranda www.moodle2.ula.ve Bibliografía Elementos de la Ingeniería de las Reacciones Químicas. H. Scott Fogler. Prentice Hall. Ingeniería de las reacciones químicas. Octave
CALCULO DE REACTORES Prof. Moira Miranda www.moodle2.ula.ve Bibliografía Elementos de la Ingeniería de las Reacciones Químicas. H. Scott Fogler. Prentice Hall. Ingeniería de las reacciones químicas. Octave
IEO-394 Semiconductores. Juan E. Martínez P. Docente. UdeA
 IEO-394 Semiconductores Juan E. Martínez P. Docente. UdeA Bandas de Energía Y Corrientes de Portadores en Semiconductores. PARTICION DE LOS NIVELES DE ENERGIA A medida que se traen juntos N átomos Cada
IEO-394 Semiconductores Juan E. Martínez P. Docente. UdeA Bandas de Energía Y Corrientes de Portadores en Semiconductores. PARTICION DE LOS NIVELES DE ENERGIA A medida que se traen juntos N átomos Cada
TEMA 8 SISTEMA PERIÓDICO Y ENLACES
 TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
Equilibrio físico. Prof. Jesús Hernández Trujillo. Facultad de Química, UNAM. Equilibrio físico/j. Hdez. T p.
 Equilibrio físico/j. Hdez. T p. 1/34 Equilibrio físico Prof. Jesús Hernández Trujillo [email protected] Facultad de Química, UNAM Equilibrio físico/j. Hdez. T p. 2/34 Interacciones intermoleculares
Equilibrio físico/j. Hdez. T p. 1/34 Equilibrio físico Prof. Jesús Hernández Trujillo [email protected] Facultad de Química, UNAM Equilibrio físico/j. Hdez. T p. 2/34 Interacciones intermoleculares
CRISTALIZACIÓN Es una operación unitaria de gran importancia en la Industria Química, como método de purificación y de obtención de materiales cristal
 CRISTALIZACIÓN CRISTALIZACIÓN Es una operación unitaria de gran importancia en la Industria Química, como método de purificación y de obtención de materiales cristalinos que tienen múltiples aplicaciones.
CRISTALIZACIÓN CRISTALIZACIÓN Es una operación unitaria de gran importancia en la Industria Química, como método de purificación y de obtención de materiales cristalinos que tienen múltiples aplicaciones.
Elementos ordenados según su número atómico (Z, número de p + ) Hay 18 PERÍODOS
 TABLA PERIÓDICA Elementos ordenados según su número atómico (Z, número de p + ) Columnas Filas GRUPOS PERÍODOS Familias de elementos con propiedades comunes Hay 18 División principal Elementos representativos
TABLA PERIÓDICA Elementos ordenados según su número atómico (Z, número de p + ) Columnas Filas GRUPOS PERÍODOS Familias de elementos con propiedades comunes Hay 18 División principal Elementos representativos
CONCEPTOS DE GRAVIMETRÍA Capítulo 27 Harris Capítulo 12 Skoog CAPÍTULO 7 Y 11 HAGE & CARR. Quim 3025 Rolando Oyola 15 1.
 CONCEPTOS DE GRAVIMETRÍA Capítulo 27 Harris Capítulo 12 Skoog CAPÍTULO 7 Y 11 HAGE & CARR Quim 3025 Rolando Oyola Martínez@2014 15 1 Gravimetría Técnica por excelencia en los siglos 18 y 19. Análisis macro
CONCEPTOS DE GRAVIMETRÍA Capítulo 27 Harris Capítulo 12 Skoog CAPÍTULO 7 Y 11 HAGE & CARR Quim 3025 Rolando Oyola Martínez@2014 15 1 Gravimetría Técnica por excelencia en los siglos 18 y 19. Análisis macro
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs.
 Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
ORIGEN DE LA ENERGÍA GEOTÉRMICA Y MECANISMOS DE PROPAGACIÓN DEL CALOR
 2 ORIGEN DE LA ENERGÍA GEOTÉRMICA Y MECANISMOS DE PROPAGACIÓN DEL CALOR 2 1 Origen de la energía geotérmica La energía que llega cada segundo a la superficie de la Tierra, desde su interior, en forma de
2 ORIGEN DE LA ENERGÍA GEOTÉRMICA Y MECANISMOS DE PROPAGACIÓN DEL CALOR 2 1 Origen de la energía geotérmica La energía que llega cada segundo a la superficie de la Tierra, desde su interior, en forma de
Cuando una pieza de acero durante su tratamiento térmico sufre una oxidación superficial, esta experimenta pérdidas de sus propiedades mecánicas
 Cuando una pieza de acero durante su tratamiento térmico sufre una oxidación superficial, esta experimenta pérdidas de sus propiedades mecánicas reflejada por bajos valores de dureza, produciendo mayor
Cuando una pieza de acero durante su tratamiento térmico sufre una oxidación superficial, esta experimenta pérdidas de sus propiedades mecánicas reflejada por bajos valores de dureza, produciendo mayor
