FICHA TÉCNICA. Cada comprimido recubierto con película de 2,5 mg contiene 2,5 mg de zolmitriptán.
|
|
|
- César Quintana Velázquez
- hace 6 años
- Vistas:
Transcripción
1 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Zomig 2,5 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Zolmitriptán Cada comprimido recubierto con película de 2,5 mg contiene 2,5 mg de zolmitriptán. Excipientes: Cada comprimido recubierto con película de 2,5 mg contiene 100 mg de lactosa anhidra. Para consultar la lista completa de excipientes ver sección FORMA FARMACÉUTICA Comprimido recubierto con película. Comprimidos recubiertos con película, redondos, biconvexos, de color amarillo, que contienen 2,5 mg de zolmitriptán. Los comprimidos llevan la letra Z grabada en una de las caras. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Tratamiento agudo de la cefalea migrañosa con o sin aura. 4.2 Posología y forma de administración La dosis recomendada de Zomig comprimidos para tratar una crisis de migraña es 2,5 mg. Se aconseja que el tratamiento comience lo antes posible tras el inicio de la cefalea migrañosa, aunque Zomig comprimidos también es efectivo si se administra en una etapa posterior. Los comprimidos se tomarán enteros con agua. Si los síntomas de la migraña recurrieran durante las 24 horas que siguen a una respuesta inicial, se puede administrar una segunda dosis; no obstante, si esta segunda dosis es requerida, no se deberá tomar hasta 2 horas después de la dosis inicial. Si un paciente no responde a la primera dosis, es improbable que la segunda le proporcione beneficio durante la misma crisis. Si un paciente no obtiene una mejoría satisfactoria con dosis de 2,5 mg, se podrían considerar dosis de 5 mg de Zomig para crisis posteriores. La dosis diaria total no deberá superar los 10 mg, no debiéndose tomar más de 2 dosis de Zomig en un periodo de 24 horas. 1 de 10
2 Zomig no está indicado en la profilaxis de la migraña. Uso en niños (menores de 12 años) No se ha evaluado la seguridad y eficacia de los comprimidos de zolmitriptán en pacientes pediátricos. Por tanto, no se recomienda el uso de Zomig en niños. Adolescentes (entre 12 y 17 años) No se demostró la eficacia de Zomig comprimidos en un ensayo clínico controlado con placebo en pacientes con edades de 12 a 17 años. Por tanto, no se recomienda el uso de Zomig comprimidos en adolescentes. Uso en pacientes mayores de 65 años La seguridad y eficacia de zolmitriptán en pacientes mayores de 65 años no se han establecido; por tanto, no se recomienda su empleo en pacientes geriátricos. Pacientes con alteración hepática El metabolismo de zolmitriptán está reducido en pacientes con alteración hepática (ver Sección 5.2). En pacientes con alteración hepática moderada o grave, se recomienda una dosis máxima de 5 mg en un periodo de 24 horas. No obstante, para pacientes con alteración hepática leve no se requiere ningún ajuste de dosis. Pacientes con alteración renal No se requiere ajuste de dosis en pacientes con aclaramiento de creatinina superior a 15 ml/minuto. (Ver Sección 4.3. y Sección 5.2.). Interacciones que requieren ajuste de dosis (ver Sección 4.5.) En pacientes que están tomando inhibidores MAO-A, se recomienda una dosis máxima de 5 mg en un periodo de 24 horas. Se recomienda una dosis máxima de 5 mg de zolmitriptán en un periodo de 24 horas en pacientes que están tomando cimetidina. En pacientes que están tomando inhibidores específicos de CYP 1A2, tales como fluvoxamina y quinolonas (por ejemplo, ciprofloxacino), se recomienda una dosis máxima de 5 mg de zolmitriptán en un periodo de 24 horas. 4.3 Contraindicaciones Zomig está contraindicado en pacientes con hipersensibilidad conocida a zolmitriptán o a alguno de los excipientes. Hipertensión moderada o grave e hipertensión leve no controlada. Esta clase de compuestos (agonistas del receptor 5HT 1B/1D ) se ha asociado a vasoespasmo coronario, en consecuencia, los pacientes con cardiopatía isquémica fueron excluidos de los ensayos clínicos. Por tanto, Zomig no deberá ser administrado a pacientes que hayan presentado infarto de miocardio o presenten cardiopatía isquémica, vasoespasmo coronario (angina de Prinzmetal), enfermedad vascular periférica o pacientes con síntomas o signos consistentes con cardiopatía isquémica. Está contraindicada la administración concomitante de zolmitriptán con ergotamina, derivados de ergotamina (incluyendo metisergida), sumatriptán, naratriptán y otros agonistas del receptor 5HT 1B/1D (ver Sección 4.5.). 2 de 10
3 Zolmitriptán no se administrará a pacientes con antecedentes de accidente cerebrovascular (ACV) o de ataque isquémico transitorio (AIT). Zolmitriptán está contraindicado en pacientes con aclaramiento de creatinina inferior a 15 ml/minuto. 4.4 Advertencias y precauciones especiales de empleo Zolmitriptán deberá ser utilizado solamente cuando se haya establecido un diagnóstico claro de migraña. Como con otras terapias para la migraña aguda, antes de tratar las cefaleas en pacientes no diagnosticados previamente como migrañosos y en migrañosos con síntomas atípicos, se deberá tomar la precaución de excluir otras condiciones neurológicas potencialmente graves. Zolmitriptán no está indicado en el tratamiento de la migraña hemipléjica, basilar u oftalmopléjica. En pacientes tratados con agonistas 5HT 1B/1D se han notificado accidentes cerebrovasculares y otros acontecimientos cerebrovasculares. Se debe tener en cuenta que los migrañosos pueden presentar riesgo de ciertos acontecimientos cerebrovasculares. Zolmitriptán no deberá ser administrado a pacientes con síndrome sintomático de Wolff-Parkinson-White, ni en arritmias asociadas a otras vías accesorias de la conducción cardíaca. Como con otros agonistas 5HT 1B/1D, en muy raras ocasiones se han notificado vasoespasmo coronario, angina de pecho e infarto de miocardio. Zomig no deberá ser administrado a pacientes con factores de riesgo de cardiopatía isquémica (por ejemplo tabaquismo, hipertensión, hiperlipidemia, diabetes mellitus, hereditarios) sin evaluación cardiovascular previa (ver Sección 4.3.). Se aplicará consideración especial a mujeres postmenopáusicas y varones con edad superior a 40 años con estos factores de riesgo. Sin embargo, estas evaluaciones podrían no identificar a todos los pacientes con enfermedad cardíaca y, en muy raros casos, se han producido acontecimientos cardíacos graves en pacientes sin enfermedad cardiovascular subyacente. Como con otros agonistas del receptor 5HT 1B/1D, tras la administración de zolmitriptán se han notificado pesadez, presión o tensión sobre el precordio (ver Sección 4.8.). Si apareciese dolor torácico o síntomas consistentes con cardiopatía isquémica, no se deberán tomar dosis adicionales de zolmitriptán hasta que se haya realizado una evaluación médica apropiada. Como con otros agonistas 5HT 1B/1D, se han notificado aumentos transitorios en la presión arterial sistémica en pacientes con y sin antecedentes de hipertensión. Muy raramente, estos aumentos en la presión arterial se han asociado con acontecimientos clínicos significativos. No deberá excederse la recomendación de dosis de zolmitriptán. Los efectos secundarios podrían ser más habituales durante el empleo concomitante de triptanes y preparaciones de fitoterapia que contienen la Hierba de San Juan (Hypericum perforatum). Se ha notificado síndrome serotoninérgico (incluyendo alteración del estado mental, inestabilidad del sistema nervioso autónomo y alteraciones neuromusculares) tras el tratamiento concomitante con triptanes e inhibidores selectivos de la recaptación de serotonina (ISRS) o inhibidores de la recaptación de serotonina y norepinefrina (IRSN). Estas reacciones pueden ser graves. Si el tratamiento concomitante con zolmitriptán y un ISRS o un IRSN estuviera clínicamente justificado, se aconseja una adecuada observación del paciente, especialmente durante el inicio del tratamiento, en aumentos de dosis o en caso de adición de otra medicación serotoninérgica (ver sección 4.5.). El uso prolongado de cualquier tipo de analgésico para las cefaleas puede hacer que éstas empeoren. Si se experimenta o sospecha esta situación, debe obtenerse consejo médico y debe interrumpirse el tratamiento. Se debe sospechar un diagnóstico de cefalea por uso excesivo de medicación en pacientes que presentan cefaleas frecuentes o diarias a pesar de (o debido a) el uso habitual de medicaciones para la cefalea. 3 de 10
4 Este medicamento contiene lactosa. Los pacientes con problemas hereditarios raros de intolerancia a la galactosa, deficiencia de lactasa Lapp o malabsorción de glucosa-galactosa no deben tomar este medicamento. 4.5 Interacción con otros medicamentos y otras formas de interacción No se han observado diferencias clínicamente importantes en la farmacocinética de zolmitriptán o de su metabolito activo en los estudios de interacción realizados con cafeína, ergotamina, dihidroergotamina, paracetamol, metoclopramida, pizotifeno, fluoxetina, rifampicina y propranolol. Los datos obtenidos de los sujetos sanos sugieren que no existen interacciones farmacocinéticas ni clínicamente significativas entre zolmitriptán y ergotamina. Aunque el aumento del riesgo de vasoespasmo coronario es una posibilidad teórica, la administración concomitante está contraindicada. Se aconseja esperar al menos 24 horas tras el empleo de preparaciones que contengan ergotamina antes de administrar zolmitriptán y, por el contrario, esperar al menos seis horas tras el uso de zolmitriptán antes de tomar un producto que contenga ergotamina (ver sección 4.3.). Después de la administración de moclobemida, un inhibidor específico de la MAO-A, se produjo un pequeño aumento (26%) en el AUC de zolmitriptán, e igualmente, un incremento de 3 veces en el mismo parámetro del metabolito activo. Por tanto, se recomienda que, durante 24 horas, la dosis máxima de zolmitriptán sea de 5 mg en pacientes tratados con un inhibidor MAO-A. No deberán emplearse conjuntamente estos medicamentos en caso de administrar dosis de moclobemida superiores a 150 mg dos veces al día. Tras la administración de cimetidina, un inhibidor general de P450, la vida media de zolmitriptán aumentó en un 44% y el AUC aumentó en un 48%. Además, se duplicaron los valores de la vida media y del AUC del metabolito activo, N-desmetilado, (183C91). En pacientes tratados con cimetidina, se recomienda una dosis máxima de zolmitriptán de 5 mg en el plazo de 24 horas. En base al perfil global de interacción, no se puede excluir una interacción con inhibidores específicos de CYP 1A2. En consecuencia, se recomienda la misma reducción posológica con compuestos de este grupo, tales como fluvoxamina y quinolonas (por ejemplo, ciprofloxacino). No se originó ninguna interacción farmacocinética de selegilina (un inhibidor MAO-B) ni de fluoxetina (un ISRS) con zolmitriptán. Sin embargo, se han producido notificaciones que describen pacientes con síntomas compatibles con el síndrome serotoninérgico (incluyendo alteración del estado mental, inestabilidad del sistema nervioso autónomo y alteraciones neuromusculares) tras el uso de inhibidores selectivos de la recaptación de serotonina (ISRS) o inhibidores de la recaptación de serotonina y norepinefrina (IRSN) y triptanes (ver sección 4.4.). Como con otros agonistas del receptor 5HT 1B/1D, zolmitriptán puede retrasar la absorción de otros medicamentos. Debe evitarse la administración concomitante de otros agonistas 5HT 1B/1D en un plazo de 24 horas después del tratamiento con zolmitriptán. Del mismo modo, debe evitarse la administración de zolmitriptán en un plazo de 24 horas después del uso de otros agonistas 5HT 1B/1D. 4.6 Fertilidad, embarazo y lactancia Embarazo No se ha establecido la seguridad de este medicamento para el empleo durante el embarazo en humanos. La evaluación de los estudios experimentales en animales no indica efectos teratogénicos directos. Sin embargo, algunos hallazgos en estudios de embriotoxicidad sugirieron alteración en la viabilidad del embrión. Sólo se deberá considerar la administración de zolmitriptán si los beneficios esperados para la madre son superiores a cualquier posible riesgo para el feto. Lactancia 4 de 10
5 Los estudios han mostrado que zolmitriptán pasa a la leche de animales lactantes. No existen datos de que zolmitriptán pase a la leche materna en humanos. Por tanto, deberá tenerse precaución cuando se administre zolmitriptán a mujeres en periodo de lactancia. Se deberá minimizar la exposición del niño evitando la lactancia durante 24 horas después del tratamiento. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas Con dosis de hasta 20 mg de zolmitriptán, no se produjo una alteración significativa en la realización de las pruebas psicomotoras en un pequeño grupo de sujetos sanos. Se recomienda precaución en pacientes que lleven a cabo actividades que requieran habilidad (por ejemplo, conducción o utilización de maquinaria), ya que se puede producir somnolencia y otros síntomas durante una crisis de migraña. 4.8 Reacciones adversas Las posibles reacciones adversas son habitualmente transitorias, tienden a presentarse en el plazo de cuatro horas tras la administración, no son más frecuentes tras dosis repetidas y se resuelven espontáneamente sin tratamiento adicional. Se aplican las siguientes definiciones a la incidencia de las reacciones adversas: Muy frecuentes ( 1/10); frecuentes ( 1/100, 1/10); poco frecuentes ( 1/1000, 1/100); raras ( 1/10000, 1/1000); muy raras ( 1/10000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Las siguientes reacciones adversas han sido notificadas tras la administración de zolmitriptán: Clasificación por Órganos y Sistemas Trastornos del sistema inmunológico Frecuencia Raras Reacciones Adversas Reacciones de hipersensibilidad incluyendo urticaria, angioedema y reacciones anafilácticas Trastornos del sistema nervioso Frecuentes Anomalías o alteraciones de la sensibilidad; Mareo; Cefalea; Hiperestesia; Parestesia; Somnolencia; Sensación de calor Trastornos cardíacos Frecuentes Palpitaciones Poco frecuentes Taquicardia Muy raras Infarto de miocardio; Angina de pecho; Vasoespasmo coronario Trastornos vasculares Poco frecuentes Ligeros aumentos en la presión arterial; Aumentos transitorios en la presión arterial sistémica 5 de 10
6 Clasificación por Órganos y Frecuencia Reacciones Adversas Sistemas Trastornos gastrointestinales Frecuentes Dolor abdominal; Náuseas; Vómitos; Sequedad de boca; Disfagia Muy raras Isquemia o infarto (por ejemplo, isquemia intestinal, infarto intestinal, infarto esplénico) que pueden presentarse en forma de diarrea sanguinolenta o dolor abdominal Trastornos musculoesqueléticos y del tejido conjuntivo Frecuentes Debilidad muscular; Mialgia Trastornos renales y urinarios Poco frecuentes Poliuria; Aumento de la frecuencia urinaria Muy raras Tenesmo vesical Trastornos generales y alteraciones en el lugar de administración Frecuentes Astenia; Pesadez, tensión, dolor o presión en la garganta, cuello, extremidades o tórax. Ciertos síntomas pueden formar parte de la crisis de migraña per se. Notificación de sospechas de reacciones adversas Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: Sobredosis Los voluntarios que recibieron dosis orales únicas de 50 mg frecuentemente experimentaron sedación. La vida media de eliminación de los comprimidos de zolmitriptán es de 2,5 a 3 horas (ver sección 5.2.); en consecuencia, la monitorización de los pacientes después de la sobredosis con los comprimidos de Zomig deberá continuar durante al menos 15 horas o mientras los síntomas o signos persistan. No existe un antídoto específico para zolmitriptán. En casos de intoxicación grave, se recomiendan procedimientos de cuidados intensivos, incluyendo el establecimiento y el mantenimiento de una vía aérea abierta que asegure la oxigenación y ventilación adecuadas y la monitorización y el apoyo del sistema cardiovascular. El efecto que la hemodiálisis o diálisis peritoneal tienen sobre las concentraciones séricas de zolmitriptán es desconocido. 6 de 10
7 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: Agonistas selectivos de la serotonina (5HT 1 ). Código ATC: N02CC03. Zolmitriptán ha demostrado ser un agonista selectivo de los receptores 5-HT 1B/1D mediadores de la contracción vascular. Zolmitriptán presenta una alta afinidad para los receptores humanos recombinantes 5- HT 1B y 5-HT 1D, y una moderada para los receptores 5-HT 1A. Zolmitriptán no presenta afinidad significativa ni actividad farmacológica en otros subtipos de receptor 5-HT (5-HT 2, 5-HT 3, 5-HT 4 ), ni en los receptores adrenérgicos, histamínicos, muscarínicos o dopaminérgicos. En modelos animales, la administración de zolmitriptán produce vasoconstricción en la circulación arterial carotídea. Adicionalmente, los estudios experimentales en animales sugieren que zolmitriptán inhibe la actividad central y periférica del nervio trigémino, con inhibición de la liberación del neuropéptido (péptido relacionado con el gen de calcitonina (CGRP), péptido vasoactivo intestinal (VIP) y Sustancia P). En estudios clínicos, se observa el inicio de la eficacia a partir de 1 hora, detectándose un aumento en ésta entre las 2 y 4 horas de la presencia de la cefalea y de otros síntomas de la migraña, tales como náuseas, fotofobia y fonofobia. Zolmitriptán es consistentemente efectivo en la migraña con o sin aura y en la migraña asociada a la menstruación. No se ha demostrado que si se administra zolmitriptán durante el aura prevenga la cefalea migrañosa y, por lo tanto, Zomig debe tomarse durante la fase de cefalea de la migraña. Un ensayo clínico controlado en 696 adolescentes con migraña no consiguió demostrar la superioridad de los comprimidos de zolmitriptán a dosis de 2,5 mg, 5 mg y 10 mg sobre placebo. No se demostró eficacia. 5.2 Propiedades farmacocinéticas Después de la administración oral en humanos, zolmitriptán se absorbe bien y rápidamente (al menos 64%). La biodisponibilidad media absoluta del compuesto original es aproximadamente del 40%. Existe un metabolito activo (el metabolito N-desmetil), el cual también es un agonista del receptor 5HT 1B/1D de 2 a 6 veces más potente que zolmitriptán en modelos animales. En sujetos sanos, cuando se administra como una dosis única, zolmitriptán y su metabolito activo, el metabolito N-desmetil, muestran un AUC y C max proporcionales a la dosis sobre el rango posológico de 2,5 a 50 mg. La absorción de zolmitriptán es rápida. En voluntarios sanos, el 75% de la C max se alcanza en el plazo de 1 hora y posteriormente, la concentración de zolmitriptán en plasma se mantiene a aproximadamente este nivel hasta 4-5 horas después de la administración. La absorción de zolmitriptán no está afectada por la presencia de alimentos. No existió evidencia de acumulación después de dosis múltiples de zolmitriptán. La concentración plasmática de zolmitriptán y de sus metabolitos es menor en las primeras 4 horas tras la administración del fármaco durante un periodo de migraña, en comparación con un periodo libre de migraña, lo que sugiere una absorción retardada consistente con la tasa reducida de vaciado gástrico observada durante una crisis de migraña. Zolmitriptán se elimina extensamente por biotransformación hepática, seguida de excreción urinaria de los metabolitos. Existen tres metabolitos principales: el ácido indol-acético (el metabolito principal en plasma y orina) y los análogos N-óxido y N-desmetil. El metabolito N-desmetilado es activo, mientras que los otros no lo son. Las concentraciones plasmáticas del metabolito N-desmetilado son aproximadamente la 7 de 10
8 mitad de las del fármaco original y, por tanto, sería de esperar que contribuyeran a la acción terapéutica de Zomig. Más del 60% de una dosis oral única se excreta en la orina (principalmente como metabolito ácido indol-acético) y aproximadamente el 30% en las heces, fundamentalmente como compuesto original inalterado. Después de la administración intravenosa, la media del aclaramiento plasmático total es aproximadamente 10 ml/min/kg, de la cual una cuarta parte es aclaramiento renal; dicho aclaramiento renal es mayor que la tasa de filtración glomerular, lo que sugiere secreción tubular renal. El volumen de distribución después de la administración intravenosa es 2,4 l/kg. La unión a proteínas plasmáticas de zolmitriptán y del metabolito N-desmetil es baja (aproximadamente 25%). La media de la vida media de eliminación de zolmitriptán es de 2,5 a 3 horas y las vidas medias de sus metabolitos son similares, sugiriendo que su eliminación está limitada por la tasa de formación. El aclaramiento renal de zolmitriptán y de todos sus metabolitos es reducido (7-8 veces) en pacientes con alteración renal moderada a grave en comparación con sujetos sanos, aunque el AUC del compuesto original y del metabolito activo fue sólo ligeramente más alto (16 y 35%, respectivamente), con un incremento de 1 hora en la vida media a 3 a 3,5 horas. Estos parámetros están dentro de los rangos observados en voluntarios sanos. Un estudio para evaluar el efecto de la alteración hepática en la farmacocinética de zolmitriptán mostró que el AUC y la Cmax aumentaron en un 94% y un 50% respectivamente en pacientes con alteración hepática moderada, y en un 226% y un 47% respectivamente en pacientes con alteración hepática grave comparado con voluntarios sanos. Se redujo la exposición a los metabolitos, incluido el metabolito activo. Para el metabolito 183C91, se redujeron el AUC y la Cmax en un 33% y en un 44% respectivamente en pacientes con alteración hepática moderada y en un 82% y en un 90% respectivamente en pacientes con alteración hepática grave. La farmacocinética de zolmitriptán en sujetos geriátricos sanos fue similar a la de voluntarios sanos jóvenes. 5.3 Datos preclínicos sobre seguridad En los estudios de toxicidad con dosis única y repetidas, los efectos preclínicos se observaron sólo con exposiciones muy superiores a la exposición máxima en humanos. Los hallazgos procedentes de estudios de toxicidad genética in vitro e in vivo muestran que no son de esperar efectos genotóxicos de zolmitriptán bajo las condiciones de uso clínico. En los estudios de carcinogenicidad en ratón y en rata, no se observaron tumores relevantes para el empleo clínico. Como con otros agonistas del receptor 5HT 1B/1D, zolmitriptán se une a melanina. 8 de 10
9 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Lactosa anhidra Celulosa microcristalina Carboximetilalmidón sódico (Tipo A) (procedente de almidón de patata) Estearato de magnesio Hipromelosa Macrogol (400 y 8000) Oxido de hierro (E172: amarillo comprimido de 2,5 mg) Dióxido de titanio (E171). 6.2 Incompatibilidades No procede. 6.3 Periodo de validez 3 años. 6.4 Precauciones especiales de conservación No conservar a temperatura superior a 30ºC. 6.5 Naturaleza y contenido del envase Comprimidos de 2,5 mg en envases blister que contienen: 3, 6 (con o sin estuche de bolsillo), 12 ó 18 comprimidos. El blister es de poliamida Al-PVC/Al. Puede que solamente estén comercializados algunos tamaños de envases. 6.6 Precauciones especiales de eliminación y otras manipulaciones Ninguna especial. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN AstraZeneca Farmacéutica Spain, S.A. C/ Serrano Galvache, 56 - Edificio Álamo Madrid España 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN Zomig 2,5 mg comprimidos recubiertos con película: FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN Fecha de la primera autorización: 11-Febrero de 10
10 Fecha de la última revalidación: 30-Noviembre FECHA DE LA REVISIÓN DEL TEXTO Junio Apr.2015 (SE/H/128/ /IAIN /051)/14.Apr.2015 (SmPC) Álamo 10 de 10
FICHA TÉCNICA. Zolmitriptán Flas STADA 2,5 mg comprimidos bucodispersables EFG Zolmitriptán Flas STADA 5 mg comprimidos bucodispersables EFG
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Zolmitriptán Flas STADA 2,5 mg comprimidos bucodispersables EFG Zolmitriptán Flas STADA 5 mg comprimidos bucodispersables EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Zolmitriptán Flas STADA 2,5 mg comprimidos bucodispersables EFG Zolmitriptán Flas STADA 5 mg comprimidos bucodispersables EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
Zomig Flas 2,5 mg comprimidos bucodispersables Zolmitriptán
 Zomig Flas 2,5 mg comprimidos bucodispersables Zolmitriptán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si
Zomig Flas 2,5 mg comprimidos bucodispersables Zolmitriptán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si
FICHA TÉCNICA. La duración estimada del tratamiento será de dos semanas.
 FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
FICHA TÉCNICA. Azelastina hidrocloruro al 0,05% (0,5 mg/ml). Cada gota contiene 0,015 mg de azelastina hidrocloruro
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
PROPUESTA DE FICHA TÉCNICA
 PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
1. NOMBRE DEL MEDICAMENTO. VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
LABORATORIOS NORMON, S.A.
 1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
FICHA TECNICA. ANASTROZOL NORMON 1 mg comprimidos recubiertos con película EFG
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ANASTROZOL NORMON 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de anastrozol. Excipientes:
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ANASTROZOL NORMON 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de anastrozol. Excipientes:
Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.)
 Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.) Las dosis recomendadas son para pacientes adultos. Estas recomendaciones no deberían
Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.) Las dosis recomendadas son para pacientes adultos. Estas recomendaciones no deberían
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
1. Tratamiento del estreñimiento 2. Tratamiento de la encefalopatia hepática (encefalopatía porto-sistémica); coma hepático
 1. NOMBRE DEL MEDICAMENTO Lactulosa Resolution 3,3 g/5 ml, solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 5 mililitros de solución oral contienen 3,3 g de lactulosa Para la lista completa
1. NOMBRE DEL MEDICAMENTO Lactulosa Resolution 3,3 g/5 ml, solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 5 mililitros de solución oral contienen 3,3 g de lactulosa Para la lista completa
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Zomig Flas 2,5 mg comprimidos bucodispersables Zolmitriptán
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Zomig Flas 2,5 mg comprimidos bucodispersables Zolmitriptán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Zomig Flas 2,5 mg comprimidos bucodispersables Zolmitriptán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 64 mg de magnesio (en forma de 550 mg de cloruro de magnesio,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 64 mg de magnesio (en forma de 550 mg de cloruro de magnesio,
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA. KETOISDIN 400 mg óvulos está indicado en adultos para el tratamiento local de
 1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
FICHA TÉCNICA. Vispring 500 microgramos/ml colirio en solución en envases unidosis
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
4.2 Indicaciones de uso, especificando las especies a las que va destinado
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 1 mg comprimidos masticables para perros Metacam 2,5 mg comprimidos masticables para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 1 mg comprimidos masticables para perros Metacam 2,5 mg comprimidos masticables para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO. URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA. El comprimido es redondo, blanco y marcado con el código NL 1.5 en una cara.
 1. NOMBRE DEL MEDICAMENTO NorLevo 1500 microgramos comprimido. FICHA TÉCNICA 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 1500 microgramos de levonorgestrel. Excipientes: Lactosa
1. NOMBRE DEL MEDICAMENTO NorLevo 1500 microgramos comprimido. FICHA TÉCNICA 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 1500 microgramos de levonorgestrel. Excipientes: Lactosa
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Flerudin 5 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Flerudin contiene hidrocloruro
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Flerudin 5 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Flerudin contiene hidrocloruro
MAXALT MAX 5 y 10 mg
 MAXALT MAX 5 y 10 mg 470 FICHA TÉCNICA SPC-MXT-RPD-0698 Tracer MXT-T/E-11935 10/98 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DE LA ESPECIALIDAD MAXALT MAX 5 mg MAXALT MAX 10 mg 2. COMPOSICIÓN
MAXALT MAX 5 y 10 mg 470 FICHA TÉCNICA SPC-MXT-RPD-0698 Tracer MXT-T/E-11935 10/98 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DE LA ESPECIALIDAD MAXALT MAX 5 mg MAXALT MAX 10 mg 2. COMPOSICIÓN
FICHA TÉCNICA. Por sobre: Acetato de calcio, 2,5 g (equivale a 635 mg de calcio), almidón de maíz, manitol (E421)
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
PROSPECTO: INFORMACIÓN PARA EL USUARIO Sumatriptán Bluefish 50 mg comprimidos Sumatriptán
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Sumatriptán Bluefish 50 mg comprimidos Sumatriptán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto ya que puede
PROSPECTO: INFORMACIÓN PARA EL USUARIO Sumatriptán Bluefish 50 mg comprimidos Sumatriptán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto ya que puede
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Principio activo: 18,42 mg de benazepril (equivalente a 20 mg de benazepril hidrocloruro)
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BENAKOR 20 mg COMPRIMIDOS PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BENAKOR 20 mg COMPRIMIDOS PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO. Pexion 100 mg comprimidos para perros Pexion 400 mg comprimidos para perros
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Pexion 100 mg comprimidos para perros Pexion 400 mg comprimidos para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido contiene: Sustancia activa:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Pexion 100 mg comprimidos para perros Pexion 400 mg comprimidos para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido contiene: Sustancia activa:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
IMIGRAN Sumatriptán (D.O.E.) (succinato)
 agencia española de medicamentos y productos sanitarios IMIGRAN Sumatriptán (D.O.E.) (succinato) 1. NOMBRE DEL MEDICAMENTO IMIGRAN 6 mg, Inyectable IMIGRAN 50 mg, Comprimidos 2. COMPOSICIÓN CUALITATIVA
agencia española de medicamentos y productos sanitarios IMIGRAN Sumatriptán (D.O.E.) (succinato) 1. NOMBRE DEL MEDICAMENTO IMIGRAN 6 mg, Inyectable IMIGRAN 50 mg, Comprimidos 2. COMPOSICIÓN CUALITATIVA
TUSQUIM Paracetamol - Dextrometorfano bromhidrato - Fenilefrina clorhidrato Bromhexina clorhidrato Tabletas Recubiertas
 TUSQUIM Paracetamol - Dextrometorfano bromhidrato - Fenilefrina clorhidrato Bromhexina clorhidrato Tabletas Recubiertas TUSQUIM Comprimidos recubiertos Antitusivo Analgésico Antipirético Mucolítico COMPOSICION:
TUSQUIM Paracetamol - Dextrometorfano bromhidrato - Fenilefrina clorhidrato Bromhexina clorhidrato Tabletas Recubiertas TUSQUIM Comprimidos recubiertos Antitusivo Analgésico Antipirético Mucolítico COMPOSICION:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Zomig 5 mg solución para pulverización nasal Zolmitriptán
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Zomig 5 mg solución para pulverización nasal Zolmitriptán Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto, ya
PROSPECTO: INFORMACIÓN PARA EL USUARIO Zomig 5 mg solución para pulverización nasal Zolmitriptán Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto, ya
FICHA TECNICA. (1) Equivalente a 185,2 mg de hidróxido de magnesio.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION Por 5 ml: Principios activos: Gel de hidróxido alumínico... 350 mg Hidróxido magnésico... 20 mg Por comprimido: Principio activo: Hidróxido alumínico...
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION Por 5 ml: Principios activos: Gel de hidróxido alumínico... 350 mg Hidróxido magnésico... 20 mg Por comprimido: Principio activo: Hidróxido alumínico...
FICHA TÉCNICA. 3. FORMA FARMACÉUTICA Comprimidos recubiertos. Biconvexos, ovales, de color blanco o blanquecino grisáceo jaspeado.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FUCIDINE 250 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 250 mg de fusidato de sodio. Excipiente: 72 mg de lactosa por comprimido.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FUCIDINE 250 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 250 mg de fusidato de sodio. Excipiente: 72 mg de lactosa por comprimido.
Prospecto: información para el usuario. Rizatriptán Flas Kern Pharma 10 mg comprimidos bucodispersables EFG
 Prospecto: información para el usuario Rizatriptán Flas Kern Pharma 10 mg comprimidos bucodispersables EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario Rizatriptán Flas Kern Pharma 10 mg comprimidos bucodispersables EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
FICHA TÉCNICA. Cada jeringa precargada contiene: 6mg de sumatriptán (como sumatriptán succinato)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Sumatriptán SUN 6mg/0,5ml solución inyectable EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada jeringa precargada contiene: 6mg de sumatriptán (como sumatriptán
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Sumatriptán SUN 6mg/0,5ml solución inyectable EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada jeringa precargada contiene: 6mg de sumatriptán (como sumatriptán
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO: CLARITYNE FLAS 10 mg Liofilizado Oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada liofilizado oral de CLARYTINE FLAS contiene:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO: CLARITYNE FLAS 10 mg Liofilizado Oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada liofilizado oral de CLARYTINE FLAS contiene:
FICHA TÉCNICA. Cada jeringa precargada contiene 6,0 mg de sumatriptán (como sumatriptán succinato).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO IMIGRAN 6 mg inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA IMIGRAN 6mg inyectable Cada jeringa precargada contiene 6,0 mg de sumatriptán (como sumatriptán
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO IMIGRAN 6 mg inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA IMIGRAN 6mg inyectable Cada jeringa precargada contiene 6,0 mg de sumatriptán (como sumatriptán
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FORDIURAN 1 mg Comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Bumetanida 1 mg. Excipientes: 100 mg de almidón de maíz y 52,3
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FORDIURAN 1 mg Comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Bumetanida 1 mg. Excipientes: 100 mg de almidón de maíz y 52,3
1. NOMBRE DEL MEDICAMENTO. Doxazosina COMBINO PHARM 2 mg comprimidos EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO Doxazosina COMBINO PHARM 2 mg comprimidos EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 2 mg de doxazosina (mesilato). Para excipientes, ver 6.1. 3. FORMA FARMACEUTICA Comprimidos
1. NOMBRE DEL MEDICAMENTO Doxazosina COMBINO PHARM 2 mg comprimidos EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 2 mg de doxazosina (mesilato). Para excipientes, ver 6.1. 3. FORMA FARMACEUTICA Comprimidos
ATENCIÓN FARMACÉUTICA EN PACIENTES CON CEFALEA
 ATENCIÓN FARMACÉUTICA EN PACIENTES CON CEFALEA Puras G, Saenz del Burgo L Atención Farmacéutica. OCW UPV/EHU Esquema 2 1. Definición y clasificación de cefaleas 2. Posibilidades terapéuticas 3. Actuación
ATENCIÓN FARMACÉUTICA EN PACIENTES CON CEFALEA Puras G, Saenz del Burgo L Atención Farmacéutica. OCW UPV/EHU Esquema 2 1. Definición y clasificación de cefaleas 2. Posibilidades terapéuticas 3. Actuación
FICHA TÉCNICA. ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. RESINCALCIO polvo para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RESINCALCIO polvo para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 g de polvo para suspensión oral contienen 99,75 g de poliestireno sulfonato
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RESINCALCIO polvo para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 g de polvo para suspensión oral contienen 99,75 g de poliestireno sulfonato
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
PRUCAL PRUCALOPRIDE Comprimidos recubiertos Vía oral FÓRMULAS
 INDUSTRIA ARGENTINA VENTA BAJO RECETA PRUCAL PRUCALOPRIDE Comprimidos recubiertos Vía oral PRUCAL 1 FÓRMULAS Cada comprimido recubierto contiene: Prucalopride (como Prucalopride Succinato) 1,00 mg. Excipientes:
INDUSTRIA ARGENTINA VENTA BAJO RECETA PRUCAL PRUCALOPRIDE Comprimidos recubiertos Vía oral PRUCAL 1 FÓRMULAS Cada comprimido recubierto contiene: Prucalopride (como Prucalopride Succinato) 1,00 mg. Excipientes:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de 800 mg contiene: Aciclovir (DCI) 800 mg. 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de 800 mg contiene: Aciclovir (DCI) 800 mg. 3. FORMA FARMACÉUTICA
Prospecto: información para el paciente Ebastel Forte 20 mg Comprimidos recubiertos con película. Ebastina
 Prospecto: información para el paciente Ebastel Forte 20 mg Comprimidos recubiertos con película Ebastina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el paciente Ebastel Forte 20 mg Comprimidos recubiertos con película Ebastina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. IDEOS UNIDIA 1000 mg/880 UI granulado efervescente 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO IDEOS UNIDIA 1000 mg/880 UI granulado efervescente 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 8 g contiene : Calcio elemento... 1000 mg ó25 mmol equivalente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO IDEOS UNIDIA 1000 mg/880 UI granulado efervescente 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 8 g contiene : Calcio elemento... 1000 mg ó25 mmol equivalente
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CARPROGESIC 50 mg COMPRIMIDOS PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Sustancia
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CARPROGESIC 50 mg COMPRIMIDOS PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Sustancia
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Levocabastina (como hidrocloruro) equivalente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Levocabastina (como hidrocloruro) equivalente
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO LAMBDALINA 40 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 g de crema contiene 40 mg de lidocaína Excipientes:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO LAMBDALINA 40 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 g de crema contiene 40 mg de lidocaína Excipientes:
FICHA TÉCNICA. Niños menores de 1 año: no se ha establecido la seguridad y eficacia de Thrombocid Forte en niños menores de 1 año.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Thrombocid Forte 5 mg/g pomada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene: Pentosano polisulfato sódico...5 mg Excipientes: Alcohol
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Thrombocid Forte 5 mg/g pomada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene: Pentosano polisulfato sódico...5 mg Excipientes: Alcohol
Agonistas y antagonistas de receptores de Serotonina (5-HT)
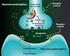 UNIVERSIDAD NACIONAL DE PIURA FACULTAD DE MEDICINA HUMANA Agonistas y antagonistas de receptores de Serotonina (5-HT) USO PARA EL TRATAMIENTO DE LA MIGRAÑA. DOCENTE : Dr. Littner Franco Palacios. CURSO
UNIVERSIDAD NACIONAL DE PIURA FACULTAD DE MEDICINA HUMANA Agonistas y antagonistas de receptores de Serotonina (5-HT) USO PARA EL TRATAMIENTO DE LA MIGRAÑA. DOCENTE : Dr. Littner Franco Palacios. CURSO
FICHA TÉCNICA. Comprimidos recubiertos con película. Comprimidos recubiertos alargados de color amarillo.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Actithiol Mucolítico 500 mg Comprimidos recubiertos con película Actithiol Mucolítico adultos 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Actithiol Mucolítico 500 mg Comprimidos recubiertos con película Actithiol Mucolítico adultos 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
FICHA TÉCNICA. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTOS FICHA TÉCNICA Loratadina NORMON 10 mg Comprimidos EFG. Loratadina NORMON 1 mg/ml Jarabe EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
1. NOMBRE DEL MEDICAMENTOS FICHA TÉCNICA Loratadina NORMON 10 mg Comprimidos EFG. Loratadina NORMON 1 mg/ml Jarabe EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
Prospecto: información para el usuario. Naramig 2,5 mg comprimidos recubiertos con película Naratriptán
 Prospecto: información para el usuario 2,5 mg comprimidos recubiertos con película Naratriptán Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario 2,5 mg comprimidos recubiertos con película Naratriptán Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
3. FORMA FARMACÉUTICA Solución oral. La solución es transparente, de color marrón y con olor característico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FERPLEX 40 mg Solución Oral 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada vial de 15 ml de solución oral contiene: Hierro proteinsuccinilato 800 mg, equivalente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FERPLEX 40 mg Solución Oral 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada vial de 15 ml de solución oral contiene: Hierro proteinsuccinilato 800 mg, equivalente
FICHA TÉCNICA. Alivio sintomático del dolor de intensidad leve a moderada en adultos.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Dolalgial 125 mg comprimidos recubiertos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto contiene 125 mg de clonixino lisina. Para consultar
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Dolalgial 125 mg comprimidos recubiertos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto contiene 125 mg de clonixino lisina. Para consultar
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
 INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1. NOMBRE DEL MEDICAMENTO Disolgas 257,5 mg cápsulas blandas 2. PRINCIPIO(S) ACTIVO(S) 3. LISTA DE EXCIPIENTES Amarillo anaranjado S (E 110), azorrubina
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1. NOMBRE DEL MEDICAMENTO Disolgas 257,5 mg cápsulas blandas 2. PRINCIPIO(S) ACTIVO(S) 3. LISTA DE EXCIPIENTES Amarillo anaranjado S (E 110), azorrubina
Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina.
 1. NOMBRE DEL MEDICAMENTO Bilina 0,5 mg/ml colirio en suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina. Excipiente
1. NOMBRE DEL MEDICAMENTO Bilina 0,5 mg/ml colirio en suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina. Excipiente
Prospecto: información para el usuario. Memantina Cinfa 10 mg comprimidos recubiertos con película EFG Memantina hidrocloruro
 Prospecto: información para el usuario Memantina Cinfa 10 mg comprimidos recubiertos con película EFG Memantina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento,
Prospecto: información para el usuario Memantina Cinfa 10 mg comprimidos recubiertos con película EFG Memantina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento,
FICHA TECNICA FAMOTIDINA ESTEVE, E.F.G. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA FAMOTIDINA ESTEVE, E.F.G. 1. NOMBRE DEL MEDICAMENTO FAMOTIDINA ESTEVE 20 mg Comprimidos EFG FAMOTIDINA ESTEVE 40 mg Comprimidos EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TECNICA FAMOTIDINA ESTEVE, E.F.G. 1. NOMBRE DEL MEDICAMENTO FAMOTIDINA ESTEVE 20 mg Comprimidos EFG FAMOTIDINA ESTEVE 40 mg Comprimidos EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Lactofilus polvo oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lactofilus polvo oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por gramo: Principio activo: Lactobacilos acidófilos 120 millones de unidades formadoras
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lactofilus polvo oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por gramo: Principio activo: Lactobacilos acidófilos 120 millones de unidades formadoras
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DOLPAC COMPRIMIDOS PERROS 1-6 kg 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Sustancias activas:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DOLPAC COMPRIMIDOS PERROS 1-6 kg 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Sustancias activas:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ULCERGOLD 370 mg/g PASTA ORAL PARA EQUINO 2. COMPOSICIÓN CUALITATIVA Y
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ULCERGOLD 370 mg/g PASTA ORAL PARA EQUINO 2. COMPOSICIÓN CUALITATIVA Y
FICHA TECNICA. P R A M O X Pramocaína
 FICHA TECNICA P R A M O X Pramocaína 1. NOMBRE DEL MEDICAMENTO PRAMOX Gel PRAMOX Crema PRAMOX Emulsión 2. COMPOSICION CUALITATIVA Y CUANTITATIVA PRAMOX Gel y Crema :. Cada 100 g contienen: Pramocaína (DCI)
FICHA TECNICA P R A M O X Pramocaína 1. NOMBRE DEL MEDICAMENTO PRAMOX Gel PRAMOX Crema PRAMOX Emulsión 2. COMPOSICION CUALITATIVA Y CUANTITATIVA PRAMOX Gel y Crema :. Cada 100 g contienen: Pramocaína (DCI)
Para la lista completa de excipientes, véase la sección Indicaciones de uso, especificando las especies de destino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
FICHA TÉCNICA. Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Sandoz 50 mg/g crema EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir. Excipientes
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Sandoz 50 mg/g crema EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir. Excipientes
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. Para consultar la lista completa de excipientes, ver sección 6.1.
 FICHA TÉCNICA 1 NOMBRE DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución oral contiene 667 mg de lactulosa Para
FICHA TÉCNICA 1 NOMBRE DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución oral contiene 667 mg de lactulosa Para
FICHA TÉCNICA. Imigran solución para pulverización nasal está indicado para el tratamiento agudo de ataques de migraña con o sin aura.
 1. NOMBRE DEL MEDICAMENTO Imigran 10 mg solución para pulverización nasal. Imigran 20 mg solución para pulverización nasal. FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Imigran 10 mg solución
1. NOMBRE DEL MEDICAMENTO Imigran 10 mg solución para pulverización nasal. Imigran 20 mg solución para pulverización nasal. FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Imigran 10 mg solución
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Clarityne 10 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Clarityne 10 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada cápsula dura contiene:
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
FICHA TÉCNICA. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS CON VITAMINA C pastillas para chupar 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada pastilla para chupar contiene: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS CON VITAMINA C pastillas para chupar 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada pastilla para chupar contiene: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 POSTINOR 750 microgramos comprimidos. 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos.
POSTINOR 750 microgramos comprimidos. 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos.
Psicofàrmacos. Escuela de parteras 2013
 Psicofàrmacos Escuela de parteras 2013 Psicofàrmacos Fàrmacos que actùan sobre las funciones cerebrales como sedantes o estimulantes, lo que produce cambios en la percepciòn, estado de ànimo, conciencia
Psicofàrmacos Escuela de parteras 2013 Psicofàrmacos Fàrmacos que actùan sobre las funciones cerebrales como sedantes o estimulantes, lo que produce cambios en la percepciòn, estado de ànimo, conciencia
Cada comprimido recubierto con película contiene 0,25 mg de ropinirol (como hidrocloruro). Excipiente: 45,3 mg de lactosa (como monohidrato).
 1. NOMBRE DEL MEDICAMENTO ADARTREL 0,25 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 0,25 mg de ropinirol (como hidrocloruro).
1. NOMBRE DEL MEDICAMENTO ADARTREL 0,25 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 0,25 mg de ropinirol (como hidrocloruro).
