FÍSICA GENERAL. MC Beatriz Gpe. Zaragoza Palacios Departamento de Física Universidad de Sonora
|
|
|
- María Ángeles Belmonte San Segundo
- hace 6 años
- Vistas:
Transcripción
1 FÍSICA GENERAL MC Beatriz Gpe. Zaragoza Palacios Departamento de Física Universidad de Sonora
2 TEMARIO 0. Presentación 1. Mediciones y vectores 2. Equilibrio traslacional 3. Movimiento uniformemente acelerado 4. Trabajo, energía y potencia 5. Fluidos 6. Termodinámica 7. Electricidad y magnetismo 8. Óptica 9. Física moderna
3 TEMARIO 7.- TERMODINÁMICA. 1. Temperatura y Dilatación. 2. Calor. 3. Capacidad calorífica. 4. Transferencia de calor. 5. Propiedades térmicas, leyes de los gases. 6. Trabajo y primera ley de la termodinámica. Tópico suplementario: Metabolismo Humano, regulación de la temperatura en animales.
4 TRAER 2 termos 1 con agua fria Otro con agua caliente Otro vaso para mezclarlas Cuchara o palita de madera, metal y plástico.
5 TEMPERATURA Para analizar la temperatura primero debemos definir el sistema que queremos estudiar, éste puede ser cualquier objeto, masa, región del espacio, etc., seleccionado para estudiarlo y aislarlo (mentalmente) de todo lo demás.
6 TEMPERATURA Un sistema aislado es aquel que no puede intercambiar materia ni energía con su entorno. Un sistema cerrado es aquel que sólo puede intercambiar energía con su entorno, pero no materia. Un sistema abierto es aquel que puede intercambiar materia y energía con su entorno.
7 TEMPERATURA. Temperatura: Es la propiedad física de los sistemas que precisa y cuantifica nuestras nociones de caliente y frío. Aunque calor NO es lo mismo que temperatura, los materiales más calientes tienen mayor temperatura
8 TEMPERATURA. La temperatura es una propiedad de un objeto que está relacionada con el hecho de que el objeto esté o no en equilibrio con otro objeto con el cuál está en contacto. Si están en equilibrio el estado de los objetos no cambia. Tendrán el mismo valor de temperatura. Si no están en equilibrio, no tendrán el mismo valor de temperatura. Ocurrirá un proceso que hará que baje la temperatura del más alto y suba la del más bajo para llevarlos a ambos a la misma temperatura y al equilibrio.
9 TEMPERATURA. Si dos o más cuerpos están en contacto, directamente o a través del aire, alcanzan la misma temperatura El equilibrio térmico implica: la misma temperatura en los cuerpos (no el mismo calor) si dos cuerpos están en equilibrio térmico y uno de ellos alcanza el equilibrio con un tercero, el primero también alcanza el equilibrio térmico con el tercero
10 La temperatura es una propiedad de un objeto que está relacionada con el hecho de que el objeto esté o no en equilibrio con otro objeto con el cuál está en contacto. En consecuencia es posible definir una escala de temperaturas. El termómetro es el objeto A que ha sido calibrado con un objeto y se usa para medir la temperatura de un tercer objeto C.
11 TEMPERATURA Termómetro: material que posea una propiedad termométrica: Cambia con la temperatura. Se puede medir fácilmente. L 100 L Para definir una escala, hay que definir dos cosas: El punto cero. El tamaño de la unidad L 0
12 TEMPERATURA Se usan tres escalas en la práctica y es bueno conocerlas. La escala Celsius La escala Fahrenheit La escala Kelvin La escala Celsius 0º C punto congelación agua a 1 atm 100º C punto ebullición agua a 1 atm Si estamos hablando de cambios de temperatura o diferencias de temperatura, entonces ΔT C = ΔT
13 TEMPERATURA. La escala Fahrenheit: Ambos el tamaño de la unidad y el punto cero son diferentes a los anteriores. 32º F punto congelación agua a 1 atm. 212º F punto ebullición agua a 1 atm. Relación matemática entre temperatura Fahrenheit y Celsius y temperatura Kelvin. T F = 1.8 T C + 32 ΔT F = 1.8 ΔT C
14 TEMPERATURA. La escala Kelvin: El punto cero es la temperatura más baja que existe. Ese punto tiene un significado físico especial (no hay movimiento de los átomos). Por eso, esta escala será la más útil especialmente cuando estemos enunciando las leyes de la termodinámica. El tamaño de la unidad lo determina el hecho de que se define el punto triple de agua como la temperatura K. Y es igual que el de la escala Celsius Relación matemática entre temperatura Celsius y temperatura Kelvin: T = T c
15 Relación entre las escalas de Temperatura De hacia Fahrenheit hacia Celsius hacia Kelvin ºF ºF (ºF - 32)*5/9 (ºF-32)*5/ ºC (ºC * 9/5) + 32 ºC ºC K (K )*9/5+32 K K
16 TEMPERATURAS TÍPICAS EN EL UNIVERSO
17 TEMPERATURA. Ejemplo. En un día la temperatura alcanza 50 F, cuál es la temperatura en grados Celsius y en Kelvins? 5 T 32 C TF 10 C 9 T T K C
18 EXPANSIÓN TÉRMICA LINEAL La expansión térmica es una consecuencia del cambio en la separación promedio entre los átomos constituyentes del cuerpo. La expansión se dá en cada una de las direcciones (o dimensiones) y es proporcional al cambio en la temperatura. Es un fenómeno de gran importancia práctica y también muchos termómetros comunes trabajan en base a este fenómeno. Donde L Longitud L L i α Coeficiente de expansión térmica lineal ( C 1 ) T Temperatura. T
19 EXPANSIÓN TÉRMICA LINEAL
20 PREGUNTAS Si calentamos un anillo de metal, El hoyo del anillo se vuelve más grande o más pequeño? Más grande, de manera similar a la que se expandería si se tratara de una moneda.
21 DILATACIÓN LINEAL. Un segmento de vía de ferrocarril de acero tiene una longitud de 30,000 m cuando la temperatura es de 0.0 C. Cuál es su longitud cuando la temperatura es de 40.0 C? 11x10 C 6 1 L L T 0.013m L L L m f
22 DILATACIÓN LINEAL. EJEMPLO Una autopista de concreto se construye con losas de 12m de largo cuando el termómetro marca 68 F Cuánto debe medir la separación entre ellas para evitar que se pandeen dado que en esa región se alcanzan temperaturas de hasta K? α = 12x10 6 / C
23 DILATACIÓN LINEAL. EJEMPLO Un dispositivo electrónico con un mal diseño tiene dos tornillos unidos a diferentes partes del dispositivo que casi se tocan uno con otro en su interior. Los tornillos de acero y latón están a diferentes potenciales eléctricos y, si se tocan, se desarrollará un cortocircuito que dañará al dispositivo. La separación inicial entre los extremos de los tornillos es de 5.0 x 10 6 m a 27 C. A qué temperatura se tocarán los tornillos? Suponga que la distancia entre las paredes del dispositivo no es afectada por el cambio de temperatura. y l 19x10 C 6 1 a 11x10 C 6 1
24 DILATACIÓN LINEAL. EJEMPLO Al aumentar la temperatura los tornillos se expandirán hasta que la distancia entre ellos será 0.0m, por lo tanto: L L 5 m l a Y como: L L i T L L T 5x10 m 6 l il ia 6 5x10 m T 7.4 C L L l il ia T T T 34 C f i
25 EXPANSIÓN TÉRMICA VOLUMÉTRICA El coeficiente de expansión lineal sólo existe para los sólidos pero podemos definir un coeficiente de expansión volumétrica β para líquidos y sólidos; el cual también tiene unidades de grado inverso, de forma que V V T i V f V i 3 V ( T T i f i ) Si el material es un sólido hay una relación entre el coeficiente volumétrico y el coeficiente lineal que se puede calcular considerando un cubo de material de lado L. 3
26 Tabla de coeficientes de expansión térmica para diferentes materiales.
27 INUSUAL EXPANSIÓN TÉRMICA DEL AGUA El agua, en el intervalo de temperaturas de 0 C a 4 C, se contrae al aumentar la temperatura. En este intervalo, su coeficiente de expansión es negativo. Por arriba de 4 C, el agua se expande al calentarse. Por lo tanto, el agua tiene su mayor densidad a 4 C. El agua también se expande al congelarse, lo cual explica por qué se forman jorobas en el centro de los compartimentos de una charola para cubitos de hielo. En cambio, la mayoría de los materiales se contraen al congelarse.
28 INUSUAL EXPANSIÓN TÉRMICA DEL AGUA Un lago se enfría de la superficie hacia abajo; por arriba de los 4 C, el agua enfriada en la superficie se hunde por su mayor densidad; sin embargo, cuando la temperatura superficial baja de 4 C, el agua cerca de la superficie es menos densa que la de abajo, que es más caliente. Por lo tanto, el flujo hacia abajo cesa y el agua cerca de la superficie sigue siendo más fría que en el fondo. Al congelarse la superficie, el hielo flota porque es menos denso que el agua. El agua en el fondo sigue a 4 C hasta que casi todo el lago se congela. Si el agua se comportara como la mayoría de las sustancias, contrayéndose continuamente al enfriarse y congelarse, los lagos se helarían de abajo hacia arriba. La circulación por diferencias de densidad haría subir continuamente el agua más caliente para un enfriamiento más eficiente, y los lagos se congelarían por completo con mucha mayor facilidad. Esto destruiría todas las plantas y animales que no resisten el congelamiento. Si el agua no tuviera esta propiedad especial, la evolución de la vida habría seguido un curso muy diferente.
29 EXPANSIÓN TÉRMICA VOLUMÉTRICA El tanque de gasolina de un auto hecho de acero y con capacidad de 70l está completamente lleno con gasolina a 20 C. Si el auto se estaciona a la luz del sol y el tanque alcanza una temperatura de 40 C Cuánta gasolina se desbordará del tanque? A 36x10 C G 950x10 C La gasolina aumentará V V T 1.3l G G ig Mientras que el tanque dilatará V V T 0.05l T A it Por lo que se derramarán 1.25 l
30 CALOR Dos objetos, con diferentes tamaños, masas y temperaturas, se ponen en contacto térmico. En que dirección viaja la energía? a) La energía viaja del objeto mas grande al objeto mas pequeño. b) La energía viaja del objeto con más masa al que tiene menos masa. c) La energía viaja del objeto con mayor temperatura al objeto con menor temperatura.
31 PREGUNTAS Cuáles de los siguientes tipos de termómetro tienen que estar en equilibrio térmico con el objeto que se mide, con la finalidad de dar lecturas exactas? Un termómetro de mercurio y/o un termómetro para el oido. Un termómetro de mercurio mide su propia temperatura, para que ésta sea igual a la temperatura del objeto que se está midiendo, el termómetro y el objeto deben estar en contacto y en equilibrio térmico. Un termómetro digital detecta la radiación infrarroja en la piel de una persona, así que no hay necesidad de que el detector y la piel estén a la misma temperatura.
32 CALOR Si metemos una cuchara fría en una taza con café caliente, la cuchara se calienta y el café se enfría para establecer el equilibrio térmico. La interacción que causa estos cambios de temperatura es básicamente una transferencia de energía de una sustancia a otra. La transferencia de energía que se da exclusivamente por una diferencia de temperatura se denomina flujo de calor o transferencia de calor, en tanto que la energía así transferida se llama calor.
33 CALOR Las unidades de calor se definen como: La caloría fue definida como la cantidad de calor necesaria para elevar la temperatura de 1 g de agua de 14.5ºC a 15.5ºC. La unidad de calor en el sistema ingles es la unidad térmica británica (BTU: British Thermal Unit), definida como el calor necesario para elevar la temperatura de 1 lb de agua de 63ºF a 64ºF. En el sistema SI la unidad de calor es la unidad de energía, es decir, el Joule. 1BTU 778 ft lb 252cal 1055J
34 CALOR El equivalente mecánico del calor En 1843, mediante el arreglo mostrado, James Prescott Joule ( ) encontró el equivalente mecánico del calor, mostrando que J de energía mecánica elevaban la temperatura de 1 g de agua de 14.5ºC a 15.5ºC. 1 caloría 4.186J
35 CALOR CONVENIO DE LOS SIGNOS DEL CALOR Q>0 Sistema Q<0 Calor absorbido por el sistema Calor cedido por el sistema
36 Capacidad calorífica y calor específico Capacidad calorífica: es la cantidad de calor requerida para aumentar la temperatura de un cuerpo en 1 grado C Si calentamos agua para hacer té, necesitamos el doble de calor para dos tazas que para una, si el intervalo de temperatura es el mismo. La cantidad de calor requerida también depende de la naturaleza del material; se requieren 4190 J de calor para elevar la temperatura de 1 kg de agua 1 C pero sólo 910 J para elevar en 1 C la temperatura de 1 kilogramo de aluminio. C Q T! Propiedad particular de cada cuerpo!
37 Capacidad calorífica y calor específico Calor específico: capacidad calorífica por unidad de masa C e C m! Propiedad particular de sustancia! Sin importar sus dimensiones
38 Tabla de calores específicos
39 La cantidad de calor absorbido o cedido por un cuerpo de masa m, al cambiar su temperatura T, se puede expresar en términos de la capacidad calorífica y del calor específico: Q C T Q mce T
40 CALOR ESPECÍFICO. Cuánta entrada de calor se necesita para elevar la temperatura de una barrica vacía de 20kg, hecha de hierro, desde 10 C a 90 C, Y si contiene 20l de agua? C 450 J J ehierro kg C C eagua 4186 kg C Barrica vacía Con agua Q mc T e J Qbarrica kg C x J kg C J Qagua kg C x J kg C entonces necesitamos una entrada de calor de x10 J
41 T R A N S C F A E d L R e O E R N C I A Conducción: transferencia de energía desde cada porción de materia a la materia adyacente por contacto directo, sin intercambio, mezcla o flujo de cualquier material. Convección: transferencia de energía mediante la mezcla íntima de distintas partes del material: se produce mezclado e intercambio de materia. Radiación: transferencia de energía mediada por ondas electromagnéticas, emanadas por los cuerpos calientes y absorbidas por los cuerpos fríos.
42 CONDUCCIÓN La conducción es el único mecanismo de transmisión del calor posible en los medios sólidos opacos. Cuando en tales medios existe un gradiente de temperatura, el calor se transmite de la región de mayor temperatura a la de menor temperatura debido al contacto directo entre moléculas.
43 Tabla de Conductividades térmicas
44 CONVECCIÓN La convección es un fenómeno de transporte (materia y energía). Cuando un fluido se calienta, se expande; en consecuencia su densidad disminuye. Si una capa de material más fría y más densa se encuentra encima del material caliente, entonces el material caliente asciende a través del material frío hasta la superficie. El material ascendente disipará su energía en el entorno, se enfriará y su densidad aumentará, con lo cual se hundirá reiniciando el proceso.
45 RADIACIÓN El tercer mecanismo de transferencia de calor es la radiación. Es un hecho que todos los cuerpos radían continuamente energía mediante ondas electromagnéticas, debido al movimiento incesante de las moléculas y átomos que lo conforman. Formas familiares de este mecanismos de transferencia de calor son, por ejemplo: la radiación solar que nos brinda energía para la vida en el planeta, la radiación que emana de un horno eléctrico, etc. Radiación: es la transferencia de energía mediada por ondas electromagnéticas, emanadas por los cuerpos calientes y absorbidas por los cuerpos fríos.
46 RADIACIÓN ondas electromagnéticas? E u x E 0 e j( kz t ) X Y Z B u y B 0 e j( kz t ) k
47 RADIACIÓN Espectros de emisión para un cuerpo, a diferentes temperaturas
48 GASES EXAMEN 26/OCT. Una sustancia se considera gas cuando las fuerzas interatómicas (o intermoleculares) entre los distintos átomos (o moléculas) que la forman son tan pequeñas que la sustancia no adopta, ni forma, ni volumen fijo, tendiendo a expandirse todo lo posible para ocupar el recipiente que lo contiene. Refiriéndose a los gases, las condiciones normales de presión y temperatura (CNPT) para la determinación de sus propiedades son, por acuerdo internacional: 0ºC (273.15K) y 1 atm (ó 10 5 Pa), con sabiendo que los medidores de gasto volumétrico se calibran a 25ºC.
49 GASES Es importante mencionar que un gas es una sustancia que se encuentra en ese estado a temperatura y presión normales, mientras que vapor es la forma gaseosa de cualquier sustancia que normalmente es líquida o sólida a condiciones normales. En condiciones normales de presión y temperatura (CNPT) existen elementos que son gaseosos, (las moléculas de) O 2, N 2, H 2, F 2 y Cl 2. El O 2 es esencial para la vida. H 2 S y HCN son venenos mortales. CO, NO 2, O 3, y SO 2, son tóxicos. El He, Ar y Ne son químicamente inertes.
50 GASES Presión de un Gas Los gases ejercen presión sobre cualquier superficie con la que entren en contacto, dado que las moléculas gaseosas están en constante movimiento y chocan con la superficie del recipiente que los contienen.
51 GASES IDEALES Y ECUACIÓN DE ESTADO Se define un gas ideal como aquel en el que todas las colisiones entre los constituyentes (átomos y moléculas) son perfectamente elásticos y en el cual no hay fuerzas atractivas intermoleculares. Este concepto implica que las moléculas del gas no interactúan excepto en las colisiones, y que el volumen molecular es despreciable comparado con el volumen del recipiente. Un gas real se puede considerar como ideal si la interacción entre sus moléculas es despreciable, lo cual se logra manteniéndolo a una presión baja.
52 GASES IDEALES Y ECUACIÓN DE ESTADO Para estudiar un gas de masa m, confinado en un recipiente de volumen V a una presión p y temperatura T, es importante conocer la relación entre estas cantidades. En general, esta relación conocida como Ecuación de estado es bastante complicada; sin embargo, para el caso de un gas ideal es muy simple y se puede encontrar experimentalmente. Antes de construir la ecuación de estado, revisemos tres leyes empíricas que se observa son satisfechas por los gases (de baja presión).
53 LEYES EMPÍRICAS DE LOS GASES: LEY DE BOYLE En 1662, el irlandés Robert Boyle ( ) enuncia la hoy conocida como Ley de Boyle-Mariotte*, que establece: Cuando el gas se mantiene a temperatura constante, su presión es inversamente proporcional a su volumen. P 1 V 1 = P 2 V 2 * En 1660, el francés Edme Mariotte ( ) emprendió investigaciones sobre las deformaciones elásticas de los sólidos e, independientemente de su colega Robert Boyle, enunció una ley relacionada con la compresibilidad de los gases. En su tratado De la naturaleza del aire (1676) formuló la ley de compresibilidad de los gases: "a temperatura constante, el volumen de un gas varía en razón inversa a su presión".
54 LEYES EMPÍRICAS DE LOS GASES: LEY DE CHARLES En 1787, el francés Jacques Alexandre César Charles ( ) enuncia la hoy conocida como ley de Charles, que establece: Cuando la presión del gas se mantiene constante, su volumen es directamente proporcional a su temperatura. V 1 /T 1 = V 2 /T 2
55 LEYES EMPÍRICAS DE LOS GASES: LEY DE GAY-LUSSAC En 1802, el francés Joseph Louis Gay-Lussac ( ) enuncia la hoy conocida como Ley de Gay- Lussac, que establece: Cuando el gas se mantiene en un recipiente a volumen constante, la presión experimentada es directamente proporcional a su temperatura. P 1 /T 1 = P 2 /T 2
56 LEYES EMPÍRICAS DE LOS GASES: LEY GENERAL E HIPÓTESIS DE AVOGADRO. La unificación de estas tres leyes da lugar a lo que se llama ecuación de estado para un gas ideal, a saber pv T constante Es importante señalar que a las cantidades p, V y T se les llama variables termodinámicas y nos permiten caracterizar el estado de un gas, de manera análoga al papel que juegan en mecánica: la posición, la velocidad y la aceleración.
57 LEYES EMPÍRICAS DE LOS GASES: LEY GENERAL E HIPÓTESIS DE AVOGADRO. En 1811, el italiano Amedeo Avogadro ( ) establece la llamada hipótesis de Avogadro: A presión y temperatura constantes, el volumen de un gas es directamente proporcional al número de moles del gas presente, lo que se puede escribir como V constante n donde n es el número de moles y V es el volumen. Es importante mencionar que este resultado es independiente de su naturaleza química y características físicas Esta constante se llama número de Avogadro (N A ) y tiene un valor de x10 23 mol -1.
58 GASES IDEALES Y ECUACIÓN DE ESTADO En el estudio de los gases una cantidad muy importante es el número de moles n, que se define como el cociente entre la masa m del gas y su correspondiente masa molar M, es decir n m M Con la anterior definición, la ecuación de estado de un gas ideal se escribe como pv nrt R J / mol K donde n es número de moles y R es la constante universal de los gases.
59 Ecuación de estado del gas ideal: Resumen Presión Pa pv nrt Temperatura K Volumen (m 3 ) R R J / mol º K atm l / mol º K n m M Constante de los gases Número de moles
60 GASES IDEALES: EJERCICIOS. Un gas está dentro de un contenedor de 8 l a una temperatura de 20 C y una presión de 9 atm. Determine el número de moles del gas en el contenedor De la Ec. de estado podemos escribir. n x10 Pa 8x10 m PV RT J 293K mol K 2.99mol
61 GASES IDEALES: EJERCICIOS. Aplicando la ecuación de estado o la ley de Boyle, y considerando que todo el He pasa a los N globos (manteniendo la temperatura constante): donde hemos considerado que el volumen de un globo es De esta expresión despejamos el número de globos N, es decir = Por lo que podemos inflar 884 globos y nos queda un poco de He sin usar.
62 GASES IDEALES: EJERCICIOS. (a) En esta parte tenemos un proceso isocórico (mismo volumen) si aplicamos la Ley de Gay-Lussac, podemos despejar la temperatura final T 2 (b) Aplicando la Ecuación de Estado
63 CONTINUACIÓN (c) Con los datos presentados, podrías calcular el volumen inicial del gas V 1? Si, usando la ecuación de estado podemos despejar el volumen V nrt p (1 mol)( atm l / mol K)(300 K) 6atm 4.107l El volumen de un mol de oxígeno a una presión de 6.00atm y 27ºC (300K) de temperatura es litros.
64 GASES IDEALES: Considerando que la burbuja contiene un gas ideal, podemos aplicar la ecuación general, de donde despejamos el volumen V 2 PV T P gh V T atm Aquí hemos usado la Ley de Pascal V2 TP 1 2 TP para calcular las presiones p 1 y p 2. 1 atm Numéricamente ,300 Pa (1025 kg m )(9.81 m s )(25.0 m) 1x10 m K V K 101,300Pa de tal forma que el volumen final de la burbuja es 6 3 V x10 m
65 PRIMERA LEY DE LA TERMODINÁMICA La energía interna U de un sistema es el total de todos los tipos de energía que poseen las partículas que conforman el sistema. Por lo general la energía interna consiste de la suma de las energías potencial y cinética de las moléculas de gas que realizan trabajo.
66 PRIMERA LEY DE LA TERMODINÁMICA La energía interna de un sistema, U, tiene la forma de energía cinética y potencial de las moléculas, átomos y partículas subatómicas que constituyen el sistema, es decir, donde U = E int = Ec int + Ep int Ec int es la energía cinética interna que consiste en la suma de la energía cinética de todas las partículas del sistema; y Ep int es la energía potencial interna que consiste en la suma de la energía potencial debida a la interacción de todas las partículas entre si. En particular, para un gas ideal Ep int = 0, por lo que su energía interna solo depende de la temperatura (asociada con el movimiento de las componentes del gas).
67 PRIMERA LEY DE LA TERMODINÁMICA Dos formas de aumentar la energía interna ΔU ΔW (-) realizado sobre el sistema ΔQ (+) Calor dado al sistema
68 PRIMERA LEY DE LA TERMODINÁMICA El cambio de energía interna de un sistema es igual al calor transferido más el trabajo realizado sobre el sistema E Q W int En otras palabras es la forma de expresar la ley de conservación de energía en termodinámica Y sólo depende de las energías internas del estado final y el inicial y no del proceso que se use para llegar de uno al otro Nota: Algunas autores ya toman el trabajo como negativo pensando en que es el trabajo realizado SOBRE el sistema.
69 PRIMERA LEY DE LA TERMODINÁMICA Representación mediante diagramas p-v Estado de un Sistema: Un punto en una gráfica de presión versus volumen (diagrama p-v). Proceso Termodinámico: Una línea continua conectando dos estados del sistema. Si el estado inicial es distinto del estado final, la transformación es abierta. Si los estados inicial y final son iguales, entonces la transformación es cerrada y se conoce como ciclo termodinámico.
70 PRIMERA LEY DE LA TERMODINÁMICA Consideremos primero un sistema aislado Un sistema aislado es aquel que no puede intercambiar materia ni energía con su entorno, por lo que Q = 0 Pero además, si no interacciona con sus alrededores o medio ambiente, entonces tampoco realiza trabajo o se realiza trabajo sobre el, es decir: W = 0 Entonces, de acuerdo a la primera ley tenemos E 0 es decir, no cambia su energía interna
71 PRIMERA LEY DE LA TERMODINÁMICA Ahora consideremos los procesos cíclicos Aquí tenemos que E intf = E inti, es decir ΔE int = 0. por lo que, a partir de la primera ley tenemos Q + W = 0 de donde Q = -W
72 PRIMERA LEY DE LA TERMODINÁMICA Consideremos los procesos adiabáticos Estos procesos se caracterizan por que no hay intercambio de calor con el medio ambiente, es decir Q =0 Paredes aislantes En el caso particular de una expansión libre adiabática se tiene, de entrada Q = 0 P int Estado inicial P int Estado final Considerando que no hay transferencia de calor, la primera ley permite concluir que ΔE = W
73 PRIMERA LEY DE LA TERMODINÁMICA Consideremos los procesos isocóricos En el caso de los procesos isocóricos, estos se caracterizan por que no hay cambio de volumen, lo que implica que W = 0 En este tipo de procesos, el calor introducido o extraído del sistema se traduce directamente en cambios en la energía interna. Q En este caso, la primera ley permite concluir que ya que W = 0 ΔE = Q
74 PRIMERA LEY DE LA TERMODINÁMICA Consideremos los procesos Isotérmicos Este tipo de procesos se caracterizan por que no hay cambio de la temperatura, es decir T = cte. Como T es constante, la energía interna no cambia, así que a partir de la primera ley se tiene que Q + W = 0 Q = -W
75 Cuáles de los siguientes tipos de termómetro tienen que estar en equilibrio térmico con el objeto que se mide, con la finalidad de dar lecturas exactas? Un termómetro de mercurio y/o un termómetro para el oido. La presion en el fondo de un vaso lleno de agua es P. El agua se derrama y el vaso se llena con alcohol etilico Cual es la presion en el fondo del vaso? a) menor que P, b) igual a P, c) mayor que P, d) indeterminado. Si en la carretera un camión nos rebasa, sentimos a) una atracción hacia el camión, b) que nos alejamos del camión, c) ninguna reacción.
76 Dos esferas se hacen del mismo metal y tienen el mismo radio, pero una es hueca y la otra solida. Las esferas se someten al mismo aumento de temperatura. Cual esfera se expande mas? a) La esfera solida se expande mas. b) La esfera hueca se expande mas. c) Ambas se expanden en la misma cantidad. d) No hay suficiente información para decirlo. Un material común para acolchar objetos en los paquetes está hecho de burbujas de aire atrapadas entre hojas de plástico. Este material es más efectivo para evitar que los contenidos del paquete se muevan dentro del empaque en a) un día caliente, b) un día frío, c) días calientes o fríos.
77 La cama de agua El colchón de una cama de agua mide 2.00 m de largo por 2.00 m de ancho y 30.0 cm de profundidad. A) Encuentre el peso del agua en el colchón. B) Encuentre la presión que ejerce el agua sobre el suelo cuando la cama de agua descansa en su posición normal. Suponga que toda la superficie inferior de la cama tiene contacto con el suelo. C) Y si la cama de agua se sustituye con una cama regular de 300 lb que se sostiene en sus cuatro patas? Cada pata tiene una sección transversal circular de 2.00 cm de radio. Qué presión ejerce esta cama sobre el suelo?
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor. Gases. Temas. 3. Gases ideales y estados termodinámicos. Webpage:
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temas 3. Gases ideales y estados termodinámicos. i. Concepto y características del gas ideal.
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temas 3. Gases ideales y estados termodinámicos. i. Concepto y características del gas ideal.
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor. Webpage: Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física 2011
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
CALOR Y TEMPERATURA CALOR
 CALOR Y TEMPERATURA El calor y la temperatura no son sinónimos, podemos decir que están estrictamente relacionados ya que la temperatura puede determinarse por la cantidad de calor acumulado. El calor
CALOR Y TEMPERATURA El calor y la temperatura no son sinónimos, podemos decir que están estrictamente relacionados ya que la temperatura puede determinarse por la cantidad de calor acumulado. El calor
P V = n R T LEYES DE LOS GASES
 P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
Profesora: Teresa Esparza Araña ASPECTOS CUANTITATIVOS DE LA QUÍMICA. UNIDAD 2: Los gases ideales
 Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
ESTO NO ES UN EXAMEN, ES UNA HOJA DEL CUADERNILLO DE EJERCICIOS. Heroica Escuela Naval
 CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
Técnico Profesional FÍSICA
 Programa Técnico Profesional FÍSICA Calor I: calor y temperatura Nº Ejercicios PSU 1. Un recipiente contiene un líquido a temperatura desconocida. Al medir la temperatura del líquido en MTP las escalas
Programa Técnico Profesional FÍSICA Calor I: calor y temperatura Nº Ejercicios PSU 1. Un recipiente contiene un líquido a temperatura desconocida. Al medir la temperatura del líquido en MTP las escalas
LEYES DE LOS GASES. Leyes de los gases. Leyes de los gases
 LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA
 BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
Unidad 16: Temperatura y gases ideales
 Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
MATERIAL DE APOYO DE USO ESCLUSIVO DEL CENTRO DE ESTUDIOS MATEMÁTICOS. C.E.M.
 1-. Una cubeta con hielo recibe constantemente calor de un B. mechero como se aprecia en la figura. C. D. De la gráfica de temperatura como función del tiempo, para la muestra, se concluye que entre A.
1-. Una cubeta con hielo recibe constantemente calor de un B. mechero como se aprecia en la figura. C. D. De la gráfica de temperatura como función del tiempo, para la muestra, se concluye que entre A.
Módulo 2: Termodinámica. mica Temperatura y calor
 Módulo 2: Termodinámica mica Temperatura y calor 1 Termodinámica y estado interno Para describir el estado externo de un objeto o sistema se utilizan en mecánica magnitudes físicas como la masa, la velocidad
Módulo 2: Termodinámica mica Temperatura y calor 1 Termodinámica y estado interno Para describir el estado externo de un objeto o sistema se utilizan en mecánica magnitudes físicas como la masa, la velocidad
CARÁCTERÍSTICAS DE LOS GASES
 DILATACIÓN EN LOS GASES - CARACTERÍSTICAS DE LOS GASES - PRESIÓN EN LOS GASES: CAUSAS Y CARACTERÍSTICAS - MEDIDA DE LA PRESIÓN DE UN GAS: MANÓMETROS - GAS EN CONDICIONES NORMALES - DILATACIÓN DE LOS GASES
DILATACIÓN EN LOS GASES - CARACTERÍSTICAS DE LOS GASES - PRESIÓN EN LOS GASES: CAUSAS Y CARACTERÍSTICAS - MEDIDA DE LA PRESIÓN DE UN GAS: MANÓMETROS - GAS EN CONDICIONES NORMALES - DILATACIÓN DE LOS GASES
Dispositivos Cilindro-Pistón
 Presión ejercida sobre superficies sólidas: sistema cilindro-pistón Un sistema importante desde el punto de vista termodinámico es el sistema cilindro-pistón, ya que se puede estudiar con él el comportamiento
Presión ejercida sobre superficies sólidas: sistema cilindro-pistón Un sistema importante desde el punto de vista termodinámico es el sistema cilindro-pistón, ya que se puede estudiar con él el comportamiento
TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR
 TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR El calor: Es una forma de energía en tránsito. La Termodinámica y La Transferencia de calor. Diferencias. TERMODINAMICA 1er. Principio.Permite determinar
TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR El calor: Es una forma de energía en tránsito. La Termodinámica y La Transferencia de calor. Diferencias. TERMODINAMICA 1er. Principio.Permite determinar
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
ADAPTACIÓN CURRICULAR TEMA 11 CIENCIAS NATURALES 2º E.S.O
 ADAPTACIÓN CURRICULAR TEMA 11 CIENCIAS NATURALES 2º E.S.O Calor y temperatura 1ª) Qué es la energía térmica? La energía térmica es la energía que posee un cuerpo (o un sistema material) debido al movimiento
ADAPTACIÓN CURRICULAR TEMA 11 CIENCIAS NATURALES 2º E.S.O Calor y temperatura 1ª) Qué es la energía térmica? La energía térmica es la energía que posee un cuerpo (o un sistema material) debido al movimiento
UNIDAD 3 ESTADO GASEOSO
 UNIDAD DIDÁCTICA 3 UNIDAD 3 ESTADO GASEOSO En la naturaleza, las sustancias se puede presentar en tres diferentes estados de agregación: sólido, líquido y gaseoso, cada uno de los cuales se distingue por
UNIDAD DIDÁCTICA 3 UNIDAD 3 ESTADO GASEOSO En la naturaleza, las sustancias se puede presentar en tres diferentes estados de agregación: sólido, líquido y gaseoso, cada uno de los cuales se distingue por
Director de Curso Francisco J. Giraldo R.
 Director de Curso Francisco J. Giraldo R. EL AIRE El aire seco es una mezcla de gases: El 78% es Nitrógeno. El 21% es Oxígeno. El 1% es Argón. El Dioxido de carbono (CO 2 ), Helio (He), Neón (Ne), Kripton
Director de Curso Francisco J. Giraldo R. EL AIRE El aire seco es una mezcla de gases: El 78% es Nitrógeno. El 21% es Oxígeno. El 1% es Argón. El Dioxido de carbono (CO 2 ), Helio (He), Neón (Ne), Kripton
Termodinámica Temas Selectos de Física 2. Prof. Daniel Valerio Martínez Universidad La Salle Nezahualcóyotl
 Termodinámica Temas Selectos de Física 2 Prof. Daniel Valerio Martínez Universidad La Salle Nezahualcóyotl Conceptos básicos Termodinámica Sistema Sistema abierto Sistema cerrado Sistema aislado Frontera
Termodinámica Temas Selectos de Física 2 Prof. Daniel Valerio Martínez Universidad La Salle Nezahualcóyotl Conceptos básicos Termodinámica Sistema Sistema abierto Sistema cerrado Sistema aislado Frontera
GUÍA ACUMULATIVA/ 8º MEDIO ( Desarrollo de Ejercicios: Leyes de los Gases) Nombre del Alumno: Curso: Fecha:
 Sector: Naturaleza Nivel: 8 Básico Nombre Profesora: Nancy Erazo Rosa Unidad V : Leyes de los gases GUÍA ACUMULATIVA/ 8º MEDIO ( Desarrollo de Ejercicios: Leyes de los Gases) Nombre del Alumno: Curso:
Sector: Naturaleza Nivel: 8 Básico Nombre Profesora: Nancy Erazo Rosa Unidad V : Leyes de los gases GUÍA ACUMULATIVA/ 8º MEDIO ( Desarrollo de Ejercicios: Leyes de los Gases) Nombre del Alumno: Curso:
Electricidad y calor. Webpage: 2007 Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temas 3. Gases ideales y estados termodinámicos. i. Concepto y características del gas ideal.
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temas 3. Gases ideales y estados termodinámicos. i. Concepto y características del gas ideal.
1. La temperatura en un día de verano en Santiago fue 34 [ C] la máxima y 8 [ C] la mínima. La variación de temperatura en kelvin para ese día fue
![1. La temperatura en un día de verano en Santiago fue 34 [ C] la máxima y 8 [ C] la mínima. La variación de temperatura en kelvin para ese día fue 1. La temperatura en un día de verano en Santiago fue 34 [ C] la máxima y 8 [ C] la mínima. La variación de temperatura en kelvin para ese día fue](/thumbs/50/26248891.jpg) Programa Estándar Anual Nº Guía práctica Calor I: calor y temperatura Ejercicios PSU 1. La temperatura en un día de verano en Santiago fue 34 [ C] la máxima y 8 [ C] la mínima. La variación de temperatura
Programa Estándar Anual Nº Guía práctica Calor I: calor y temperatura Ejercicios PSU 1. La temperatura en un día de verano en Santiago fue 34 [ C] la máxima y 8 [ C] la mínima. La variación de temperatura
TEMPERATURA DILATACIÓN. 9. En la escala Celsius una temperatura varía en 45 C. Cuánto variará en la escala Kelvin y
 TEMPERATURA 1. A cuántos grados kelvin equivalen 50 grados centígrados? a) 303 b) 353 c) 453 d) 253 2. Si un cuerpo presenta una temperatura de 20 C Cuál será la lectura de esta en la escala Fahrenheit?
TEMPERATURA 1. A cuántos grados kelvin equivalen 50 grados centígrados? a) 303 b) 353 c) 453 d) 253 2. Si un cuerpo presenta una temperatura de 20 C Cuál será la lectura de esta en la escala Fahrenheit?
UNIDAD VII TEMPERATURA Y DILATACIÓN
 UNIDAD VII TEMPERATURA Y DILATACIÓN TEMPERATURA Expresión del nivel térmico de un cuerpo Un cuerpo con mucha temperatura tiene mucha cantidad de calor; sin embargo hay cuerpos como el mar con gran cantidad
UNIDAD VII TEMPERATURA Y DILATACIÓN TEMPERATURA Expresión del nivel térmico de un cuerpo Un cuerpo con mucha temperatura tiene mucha cantidad de calor; sin embargo hay cuerpos como el mar con gran cantidad
Gases...1. Características: Volumen:...1. Temperatura:
 Índice de contenido Gases......1 Características:......1 Volumen:......1 Temperatura:......1 Presión:......2 Medición de presiones:......2 Ley de Boyle (relación presión volumen):......2 Ley de Charles
Índice de contenido Gases......1 Características:......1 Volumen:......1 Temperatura:......1 Presión:......2 Medición de presiones:......2 Ley de Boyle (relación presión volumen):......2 Ley de Charles
TRANSFERENCIA DE CALOR
 Conducción Convección Radiación TRANSFERENCIA DE CALOR Ing. Rubén Marcano Temperatura es una propiedad que depende del nivel de interacción molecular. Específicamente la temperatura es un reflejo del nivel
Conducción Convección Radiación TRANSFERENCIA DE CALOR Ing. Rubén Marcano Temperatura es una propiedad que depende del nivel de interacción molecular. Específicamente la temperatura es un reflejo del nivel
Tc / 5 = Tf - 32 / 9. T = Tc + 273
 ENERGIA TERMICA Energía Interna ( U ) : Es la energía total de las partículas que lo constituyen, es decir, la suma de todas las formas de energía que poseen sus partículas; átomos, moléculas e iones.
ENERGIA TERMICA Energía Interna ( U ) : Es la energía total de las partículas que lo constituyen, es decir, la suma de todas las formas de energía que poseen sus partículas; átomos, moléculas e iones.
Física y Química. 2º ESO. LA MATERIA Y SUS PROPIEDADES La materia. La materia es todo aquello que tiene masa y ocupa un espacio.
 La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
TEMA 2: PRINCIPIOS DE TERMODINÁMICA. MÁQUINA TÉRMICA Y MÁQUINA FRIGORÍFICA
 TEMA 2: PRINCIPIOS DE TERMODINÁMICA. MÁQUINA TÉRMICA Y MÁQUINA FRIGORÍFICA La termodinámica es la parte de la física que se ocupa de las relaciones existentes entre el calor y el trabajo. El calor es una
TEMA 2: PRINCIPIOS DE TERMODINÁMICA. MÁQUINA TÉRMICA Y MÁQUINA FRIGORÍFICA La termodinámica es la parte de la física que se ocupa de las relaciones existentes entre el calor y el trabajo. El calor es una
Soluciones. DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I)
 Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
DEPARTAMENTO DE FISICA UNIVERSIDAD DE SANTIAGO DE CHILE GASES IDEALES
 INTRODUCCIÓN GASES IDEALES Las dos primeras unidades del programa de cuarto medio estudian temas estrechamente ligados entre si como lo es la teoría cinética, temperatura, calor, termodinámica. Abordaremos
INTRODUCCIÓN GASES IDEALES Las dos primeras unidades del programa de cuarto medio estudian temas estrechamente ligados entre si como lo es la teoría cinética, temperatura, calor, termodinámica. Abordaremos
FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN
 1 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN 2 Física y Química 3º Curso Educación Secundaria Obligatoria
1 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN 2 Física y Química 3º Curso Educación Secundaria Obligatoria
ALUMNO: AUTORA: Prof. Ma. Laura Sanchez
 h ALUMNO: AUTORA: Prof. Ma. Laura Sanchez 3.1 Temperatura A menudo solemos confundir calor con temperatura, cuando decimos hoy hace calor, ó el helado está frío nos estamos refiriendo a sensaciones térmicas
h ALUMNO: AUTORA: Prof. Ma. Laura Sanchez 3.1 Temperatura A menudo solemos confundir calor con temperatura, cuando decimos hoy hace calor, ó el helado está frío nos estamos refiriendo a sensaciones térmicas
Bases Físicas del Medio Ambiente. Sistemas Termodinámicos
 Bases Físicas del Medio Ambiente Sistemas Termodinámicos Programa VII. SISTEMAS TERMODINÁMICOS. (1h) Introducción. Sistema termodinámico. Estados de equilibrio. Procesos termodinámicos. Equilibrio termodinámico.
Bases Físicas del Medio Ambiente Sistemas Termodinámicos Programa VII. SISTEMAS TERMODINÁMICOS. (1h) Introducción. Sistema termodinámico. Estados de equilibrio. Procesos termodinámicos. Equilibrio termodinámico.
LEYES DE LOS GASES. El volumen es directamente proporcional a la cantidad de gas:
 LEYES DE LOS GASES LEY DE AVOGADRO: Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura
LEYES DE LOS GASES LEY DE AVOGADRO: Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura
TEMPERATURA Y CALOR. Tomás Rada Crespo Ph.D.
 TEMPERATURA Y CALOR Tomás Rada Crespo Ph.D. Temperatura y Calor Tengo Calor!!!! Tengo Frio!!!! Este café esta frío!!!! Uff qué temperatura!!!! Esta gaseosa esta caliente!!!! En el lenguaje cotidiano, es
TEMPERATURA Y CALOR Tomás Rada Crespo Ph.D. Temperatura y Calor Tengo Calor!!!! Tengo Frio!!!! Este café esta frío!!!! Uff qué temperatura!!!! Esta gaseosa esta caliente!!!! En el lenguaje cotidiano, es
GASES IDEALES. P. V = n. R. T
 GASES IDEALES Lic. Lidia Iñigo A esta altura de tus estudios seguramente ya sabés que hay muchas sustancias formadas por moléculas, qué es una molécula, y que una sustancia determinada puede presentarse
GASES IDEALES Lic. Lidia Iñigo A esta altura de tus estudios seguramente ya sabés que hay muchas sustancias formadas por moléculas, qué es una molécula, y que una sustancia determinada puede presentarse
Clase 2. Estructura de la Atmósfera
 Clase 2 Estructura de la Atmósfera Preguntas claves 1. Qué es la presión y temperatura? 2. Cómo varían con la altura? 3. Cuál es la estructura de la atmósfera? La física y dinámica de la atmósfera puede
Clase 2 Estructura de la Atmósfera Preguntas claves 1. Qué es la presión y temperatura? 2. Cómo varían con la altura? 3. Cuál es la estructura de la atmósfera? La física y dinámica de la atmósfera puede
El calor y la temperatura
 2 El calor y la temperatura Contenidos Índice 1 2 3 4 Energía térmica Medida de la temperatura Propagación del calor Equilibrio térmico 1. Energía térmica Se denomina energía térmica a la energía cinética
2 El calor y la temperatura Contenidos Índice 1 2 3 4 Energía térmica Medida de la temperatura Propagación del calor Equilibrio térmico 1. Energía térmica Se denomina energía térmica a la energía cinética
Capítulo 17. Temperatura. t(h) = 100 h h 0
 Capítulo 17 Temperatura t(h) = 100 h h 0 h 1 00 h 0 rincipio cero de la termodinámica. Temperatura empírica. La temperatura empírica de un sistema en equilibrio termodinámico se puede asignar mediante
Capítulo 17 Temperatura t(h) = 100 h h 0 h 1 00 h 0 rincipio cero de la termodinámica. Temperatura empírica. La temperatura empírica de un sistema en equilibrio termodinámico se puede asignar mediante
TEMA 2: LEYES Y CONCEPTOS BÁSICOS EN QUÍMICA
 1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
CAPITULO V TERMODINAMICA - 115 -
 CAPIULO V ERMODINAMICA - 5 - 5. EL GAS IDEAL Es el conjunto de un gran número de partículas diminutas o puntuales, de simetría esférica, del mismo tamaño y de igual volumen, todas del mismo material. Por
CAPIULO V ERMODINAMICA - 5 - 5. EL GAS IDEAL Es el conjunto de un gran número de partículas diminutas o puntuales, de simetría esférica, del mismo tamaño y de igual volumen, todas del mismo material. Por
GASES. Contenidos. Leyes de los gases y su aplicación en la resolución de problemas numéricos.
 GASES Contenidos Postulados de la teoría cinética de los gases y su relación con las características (expansión, comprensión y difusión) y las propiedades ( presión, volumen y temperatura) que los definen.
GASES Contenidos Postulados de la teoría cinética de los gases y su relación con las características (expansión, comprensión y difusión) y las propiedades ( presión, volumen y temperatura) que los definen.
ESTADOS DE LA MATERIA
 ESTADOS DE LA MATERIA M en C Alicia Cea Bonilla 1 Existen tres estados de la materia: sólido, líquido y gaseoso, dependiendo de la distancia entre sus partículas, de las fuerzas de atracción entre éstas
ESTADOS DE LA MATERIA M en C Alicia Cea Bonilla 1 Existen tres estados de la materia: sólido, líquido y gaseoso, dependiendo de la distancia entre sus partículas, de las fuerzas de atracción entre éstas
UNIDAD IV GASES PROPIEDADES FISICAS DE LOS GASES
 UNIDAD IV GASES PROPIEDADES FISICAS DE LOS GASES Muchas sustancias familiares para nosotros existen a temperatura y presión normal en forma gaseosa, éstas incluyen muchos sustancias elementales (H 2, N
UNIDAD IV GASES PROPIEDADES FISICAS DE LOS GASES Muchas sustancias familiares para nosotros existen a temperatura y presión normal en forma gaseosa, éstas incluyen muchos sustancias elementales (H 2, N
Los gases y la Teoría Cinética
 Para practicar Utiliza tu cuaderno y trata de resolver los siguientes ejercicios: 1.-En una tabla similar a la siguiente, introduce las propiedades características de un SÓLIDO, un LÍQUDO o un GAS, como
Para practicar Utiliza tu cuaderno y trata de resolver los siguientes ejercicios: 1.-En una tabla similar a la siguiente, introduce las propiedades características de un SÓLIDO, un LÍQUDO o un GAS, como
El calor y la temperatura
 Unidad 3 El calor y la temperatura DPTO. BIOLOGÍA-GEOLOGÍA BELÉN RUIZ GONZÁLEZ LA ENERGÍA TÉRMICA Lee la primera columna de la página 39 y contesta a continuación las siguientes preguntas: De qué está
Unidad 3 El calor y la temperatura DPTO. BIOLOGÍA-GEOLOGÍA BELÉN RUIZ GONZÁLEZ LA ENERGÍA TÉRMICA Lee la primera columna de la página 39 y contesta a continuación las siguientes preguntas: De qué está
ENERGÍA. Se define como la propiedad que tienen los cuerpos para producir cambios en ellos mismos o en otros cuerpos.
 ENERGÍA La ENERGÍA es una propiedad de los cuerpos que, almacenada en ellos de diferentes maneras, se pone de manifiesto cuando se producen determinadas transformaciones como emisión de luz, aumento de
ENERGÍA La ENERGÍA es una propiedad de los cuerpos que, almacenada en ellos de diferentes maneras, se pone de manifiesto cuando se producen determinadas transformaciones como emisión de luz, aumento de
Según el modelo cinético molecular de la materia, sabemos que las partículas que la forman están sometidas a un movimiento constante.
 Física y Química 4º ESO Energía Térmica página 1 de 7 CONCEPTO DE CALOR Y TEMPERATURA Según el modelo cinético molecular de la materia, sabemos que las partículas que la forman están sometidas a un movimiento
Física y Química 4º ESO Energía Térmica página 1 de 7 CONCEPTO DE CALOR Y TEMPERATURA Según el modelo cinético molecular de la materia, sabemos que las partículas que la forman están sometidas a un movimiento
Conceptos previos: tener la misma temperatura
 Conceptos previos: Un termómetro mide la temperatura. Dos cuerpos en equilibrio térmico deben tener la misma temperatura *las escalas de temperatura Celsius y Fahrenheit se basan en la temperatura de congelación
Conceptos previos: Un termómetro mide la temperatura. Dos cuerpos en equilibrio térmico deben tener la misma temperatura *las escalas de temperatura Celsius y Fahrenheit se basan en la temperatura de congelación
Microscópicamente las moléculas pueden presentar tres tipos de movimiento:
 TEMPERATURA y ESCALAS TERMOMÉTRICAS. TEMPERATURA: Es una forma de energía, que tiene su origen en el movimiento de las moléculas de los cuerpos y que se desarrolla por el roce o choque entre las mismas.
TEMPERATURA y ESCALAS TERMOMÉTRICAS. TEMPERATURA: Es una forma de energía, que tiene su origen en el movimiento de las moléculas de los cuerpos y que se desarrolla por el roce o choque entre las mismas.
Unidad 4: Estado Gaseoso Introducción Teórica
 Unidad 4: Estado Gaseoso Introducción Teórica En esta unidad vamos a ampliar y explicar algunas de las características del estado gaseoso que ya han sido tratadas en la Unidad 1, como por ejemplo la de
Unidad 4: Estado Gaseoso Introducción Teórica En esta unidad vamos a ampliar y explicar algunas de las características del estado gaseoso que ya han sido tratadas en la Unidad 1, como por ejemplo la de
La energía interna. Nombre Curso Fecha
 Ciencias de la Naturaleza 2.º ESO Unidad 10 Ficha 1 La energía interna La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas que la componen.
Ciencias de la Naturaleza 2.º ESO Unidad 10 Ficha 1 La energía interna La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas que la componen.
PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica]
![PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica] PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica]](/thumbs/50/26203302.jpg) Universidad Simón olívar Departamento de Termodinámica y Fenómenos de Transferencia -Junio-007 TF - Termodinámica I Prof. Carlos Castillo PROLEMARIO No. Veinte problemas con respuesta sobre los Temas y
Universidad Simón olívar Departamento de Termodinámica y Fenómenos de Transferencia -Junio-007 TF - Termodinámica I Prof. Carlos Castillo PROLEMARIO No. Veinte problemas con respuesta sobre los Temas y
Física y Química 1º Bach.
 Física y Química 1º Bach. Leyes de los gases. Teoría cinético-molecular 05/11/10 DEPARTAMENTO FÍSICA E QUÍMICA Nombre: OPCIÓN 1 1. Observa el aparato de la Figura. Si la temperatura del aceite se eleva
Física y Química 1º Bach. Leyes de los gases. Teoría cinético-molecular 05/11/10 DEPARTAMENTO FÍSICA E QUÍMICA Nombre: OPCIÓN 1 1. Observa el aparato de la Figura. Si la temperatura del aceite se eleva
Sol.: el cuerpo ha aumentado su energía potencial en J.
 Energía y trabajo Todos los sistemas físicos poseen energía aunque no se esté produciendo ninguna transformación en ellos. Esta energía se transfiere de unos cuerpos a otros, esta transferencia produce
Energía y trabajo Todos los sistemas físicos poseen energía aunque no se esté produciendo ninguna transformación en ellos. Esta energía se transfiere de unos cuerpos a otros, esta transferencia produce
Ley de los Gases Unidad II
 Ley de los Gases Unidad II Introducción Presión Volumen Cantidad de gas Ley de Abogadro Enunciado Ejemplos Recurso Educaplus Ley de Boyle Enunciado Ejemplos Ley de Charles Enunciado Ejemplos Actividades
Ley de los Gases Unidad II Introducción Presión Volumen Cantidad de gas Ley de Abogadro Enunciado Ejemplos Recurso Educaplus Ley de Boyle Enunciado Ejemplos Ley de Charles Enunciado Ejemplos Actividades
GASES IDEALES. 1 atm = 760 mmhg = 760 Torr = 1013 hpa
 GASES IDEALES Para comprender los problemas de este capítulo es necesario leer previamente la Teoría Cinética de los Gases, el concepto de Variables de Estado y las Leyes de los Gases. Ecuación general
GASES IDEALES Para comprender los problemas de este capítulo es necesario leer previamente la Teoría Cinética de los Gases, el concepto de Variables de Estado y las Leyes de los Gases. Ecuación general
Mediciones Confiables con Termómetros de Resistencia i de Platino. Edgar Méndez Lango
 Mediciones Confiables con Termómetros de Resistencia i de Platino Edgar Méndez Lango Termometría, Metrología Eléctrica, CENAM Noviembre 2009 Contenido 2 1. Concepto de temperatura 2. La Escala Internacional
Mediciones Confiables con Termómetros de Resistencia i de Platino Edgar Méndez Lango Termometría, Metrología Eléctrica, CENAM Noviembre 2009 Contenido 2 1. Concepto de temperatura 2. La Escala Internacional
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA DEPARTAMENTO DE FISICOQUÍMICA GUÍA DE ESTUDIO DE TERMODINÁMICA E.T.
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA DEPARTAMENTO DE FISICOQUÍMICA GUÍA DE ESTUDIO DE TERMODINÁMICA E.T. (CLAVE 1212) UNIDAD 1. INTRODUCCIÓN A LA TERMODINÁMICA 1.1 Definición, campo
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA DEPARTAMENTO DE FISICOQUÍMICA GUÍA DE ESTUDIO DE TERMODINÁMICA E.T. (CLAVE 1212) UNIDAD 1. INTRODUCCIÓN A LA TERMODINÁMICA 1.1 Definición, campo
HIDRAULICA DE POTENCIA. Unidad 1. Bases físicas de la hidráulica
 HIDRAULICA DE POTENCIA Unidad 1. Bases físicas de la hidráulica Presión Este término se refiere a los efectos de una fuerza que actúa distribuida sobre una superficie. La fuerza causante de la presión
HIDRAULICA DE POTENCIA Unidad 1. Bases físicas de la hidráulica Presión Este término se refiere a los efectos de una fuerza que actúa distribuida sobre una superficie. La fuerza causante de la presión
GUÍA DE EJERCICIOS GASES
 GUÍA DE EJERCICIOS GASES Área Química Resultados de aprendizaje Aplicar conceptos básicos de gases en la resolución de ejercicios. Desarrollar pensamiento lógico y sistemático en la resolución de problemas.
GUÍA DE EJERCICIOS GASES Área Química Resultados de aprendizaje Aplicar conceptos básicos de gases en la resolución de ejercicios. Desarrollar pensamiento lógico y sistemático en la resolución de problemas.
TEMA 1. LA MATERIA. PROPIEDADES. ESTADOS DE AGREGACIÓN
 TEMA 1. LA MATERIA. PROPIEDADES. ESTADOS DE AGREGACIÓN Propiedades generales de la materia Materia es todo aquello que tiene masa y volumen. La masa (cantidad de materia que posee un cuerpo) y el volumen
TEMA 1. LA MATERIA. PROPIEDADES. ESTADOS DE AGREGACIÓN Propiedades generales de la materia Materia es todo aquello que tiene masa y volumen. La masa (cantidad de materia que posee un cuerpo) y el volumen
DILATACIÓN PREGUNTAS PROBLEMAS
 DILATACIÓN 1. Qué es la temperatura? PREGUNTAS PROBLEMAS 1. Dos barras idénticas de fierro (α = 12 x 10-6 /Cº) de 1m de longitud, fijas en uno de sus extremos se encuentran a una temperatura de 20ºC si
DILATACIÓN 1. Qué es la temperatura? PREGUNTAS PROBLEMAS 1. Dos barras idénticas de fierro (α = 12 x 10-6 /Cº) de 1m de longitud, fijas en uno de sus extremos se encuentran a una temperatura de 20ºC si
IES La Magdalena. Avilés. Asturias GASES
 GASES IES La adalena. Avilés. Asturias Teoría cinética de la materia ara poder explicar (ver preuntas más abajo) y entender el comportamiento de la materia, existe un modelo teórico que se basa en los
GASES IES La adalena. Avilés. Asturias Teoría cinética de la materia ara poder explicar (ver preuntas más abajo) y entender el comportamiento de la materia, existe un modelo teórico que se basa en los
TERMODINÁMICA AVANZADA
 ERMODINÁMICA AANZADA Cantidades fundamentales Cantidades básicas y unidaded Unidad I: ropiedades y Leyes de la ermodinámica Cantidades fundamentales ropiedades de estado Función de estado y ecuación de
ERMODINÁMICA AANZADA Cantidades fundamentales Cantidades básicas y unidaded Unidad I: ropiedades y Leyes de la ermodinámica Cantidades fundamentales ropiedades de estado Función de estado y ecuación de
Tema 8: Temperatura y Principio Cero
 1/30 Tema 8: Temperatura y Principio Cero Fátima Masot Conde Ing. Industrial 2007/08 Tema 8: Temperatura y Principio Cero 2/30 Índice: 1. Introducción. 2. Temperatura y Ley Cero. 3. Termómetros y escalas.
1/30 Tema 8: Temperatura y Principio Cero Fátima Masot Conde Ing. Industrial 2007/08 Tema 8: Temperatura y Principio Cero 2/30 Índice: 1. Introducción. 2. Temperatura y Ley Cero. 3. Termómetros y escalas.
BALANCES DE MASA Y ENERGÍA CAPITULO 1: BALANCES DE MATERIALES
 BALANCES DE MASA Y ENERGÍA CAPITULO 1: BALANCES DE MATERIALES 1.1 INTRODUCCION Proceso: Cualquier operación o serie de operaciones que produce un cambio físico o químico en una sustancia o en una mezcla
BALANCES DE MASA Y ENERGÍA CAPITULO 1: BALANCES DE MATERIALES 1.1 INTRODUCCION Proceso: Cualquier operación o serie de operaciones que produce un cambio físico o químico en una sustancia o en una mezcla
PRÁCTICA 2: CONDUCTIVIDAD TÉRMICA DE LOS METALES
 PRÁCTICA 2: CONDUCTIVIDAD TÉRMICA DE LOS METALES 1. OBJETIVO En esta práctica se determina la conductividad térmica del cobre y del aluminio midiendo el flujo de calor que atraviesa una barra de cada uno
PRÁCTICA 2: CONDUCTIVIDAD TÉRMICA DE LOS METALES 1. OBJETIVO En esta práctica se determina la conductividad térmica del cobre y del aluminio midiendo el flujo de calor que atraviesa una barra de cada uno
Sustancias puras, procesos de cambios de fase, diagramas de fase. Estado 3 Estado 4 Estado 5. P =1 atm T= 100 o C. Estado 3 Estado 4.
 TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO. Nombre Grupo Matrícula PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P)
 Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO Nombre Grupo Matrícula PROPIEDADES DE LOS GASES: I. Completa correctamente la siguiente tabla. PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P) VOLUMEN (V)
Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO Nombre Grupo Matrícula PROPIEDADES DE LOS GASES: I. Completa correctamente la siguiente tabla. PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P) VOLUMEN (V)
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea.
 Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA
 I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
UNIDAD 7: ENERGY (LA ENERGÍA)
 REPASO EN ESPAÑOL C.E.I.P. GLORIA FUERTES UNIDAD 7: ENERGY (LA ENERGÍA) NATURAL SCIENCE 6 La energía está por todos sitios en el Universo y es indestructible. La energía se transfiere de átomo en átomo,
REPASO EN ESPAÑOL C.E.I.P. GLORIA FUERTES UNIDAD 7: ENERGY (LA ENERGÍA) NATURAL SCIENCE 6 La energía está por todos sitios en el Universo y es indestructible. La energía se transfiere de átomo en átomo,
LOS GASES Y LAS DISOLUCIONES. Departamento de Física y Química 3º ESO
 LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
t = Vf Vi Vi= Vf - a t Aceleración : Se le llama así al cambio de velocidad y cuánto más rápido se realice el cambio, mayor será la aceleración.
 Las magnitudes físicas Las magnitudes fundamentales Magnitudes Derivadas son: longitud, la masa y el tiempo, velocidad, área, volumen, temperatura, etc. son aquellas que para anunciarse no dependen de
Las magnitudes físicas Las magnitudes fundamentales Magnitudes Derivadas son: longitud, la masa y el tiempo, velocidad, área, volumen, temperatura, etc. son aquellas que para anunciarse no dependen de
UNIVERSIDAD TECNOLÓGICA DE PUEBLA
 TÉRMICA. PRÁCTICA NÚMERO 1 TEMPERATURA OBJETIVO: 1. Comprender el fundamento termodinámico de la medición de la temperatura. 2. Construirla curva de calentamiento del agua. 3. Obtener mediciones de temperatura
TÉRMICA. PRÁCTICA NÚMERO 1 TEMPERATURA OBJETIVO: 1. Comprender el fundamento termodinámico de la medición de la temperatura. 2. Construirla curva de calentamiento del agua. 3. Obtener mediciones de temperatura
Nombre del trabajo: Termómetro de gas de volumen constante
 laboratorio1.doc Cátedras: Física II (Ing. Civil e Ing. Electromecánica) Laboratorio N 1 Tema : Termometría Nombre del trabajo: Termómetro de gas de volumen constante Temas asociados: Medición de temperatura,
laboratorio1.doc Cátedras: Física II (Ing. Civil e Ing. Electromecánica) Laboratorio N 1 Tema : Termometría Nombre del trabajo: Termómetro de gas de volumen constante Temas asociados: Medición de temperatura,
COLEGIO DE BACHILLERES DEL ESTADO DE QUERÉTARO Plantel No. 7 El Marqués GUIA DE REGULARIZACIÓN DE FÍSICA II UNIDAD 1
 UNIDAD 1 I. INTRODUCCIÓN 1. Investiga y resume los siguientes conceptos: a. HIDRODINÁMICA: b. HIDROSTÁTICA: c. HIDRÁULICA 2. Investiga y resume en qué consiste cada una de las características de los fluidos
UNIDAD 1 I. INTRODUCCIÓN 1. Investiga y resume los siguientes conceptos: a. HIDRODINÁMICA: b. HIDROSTÁTICA: c. HIDRÁULICA 2. Investiga y resume en qué consiste cada una de las características de los fluidos
INGENIERO. JOSMERY SÁNCHEZ
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
Ley de Boyle. A temperatura constante, el volumen de una muestra dada de gas es inversamente proporcional a su presión
 LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
Capítulo 8. Termodinámica
 Capítulo 8 Termodinámica 1 Temperatura La temperatura es la propiedad que poseen los cuerpos, tal que su valor para ellos es el mismo siempre que estén en equilibrio térmico. Principio cero de la termodinámica:
Capítulo 8 Termodinámica 1 Temperatura La temperatura es la propiedad que poseen los cuerpos, tal que su valor para ellos es el mismo siempre que estén en equilibrio térmico. Principio cero de la termodinámica:
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES
 TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
NOCIONES BASICAS ES LA MATERIA QUE INTEGRA UN CUERPO SÓLIDO, UN LIQUIDO O UN GAS.
 SUSTANCIA: ES LA MATERIA QUE INTEGRA UN CUERPO SÓLIDO, UN LIQUIDO O UN GAS. SUSTANCIA DE TRABAJO: ES LA PORCIÓN DE MATERIA QUE ACTUANDO EN UN SISTEMA ES CAPAZ DE ABSORBER O CEDER ENERGÍA. EN ESE PROCESO
SUSTANCIA: ES LA MATERIA QUE INTEGRA UN CUERPO SÓLIDO, UN LIQUIDO O UN GAS. SUSTANCIA DE TRABAJO: ES LA PORCIÓN DE MATERIA QUE ACTUANDO EN UN SISTEMA ES CAPAZ DE ABSORBER O CEDER ENERGÍA. EN ESE PROCESO
MAGNITUDES Y MEDIDAS
 MAGNITUDES Y MEDIDAS 1. EL MÉTODO CIENTÍFICO: Concepto de ciencia: La ciencia trata de explicar los fenómenos que ocurren en el Universo, y trata de encontrar las leyes que los rigen. La Física y la Química
MAGNITUDES Y MEDIDAS 1. EL MÉTODO CIENTÍFICO: Concepto de ciencia: La ciencia trata de explicar los fenómenos que ocurren en el Universo, y trata de encontrar las leyes que los rigen. La Física y la Química
LA MATERIA: ESTADOS FÍSICOS ACTIVIDADES DE REFUERZO ACTIVIDADES FICHA 1
 FICHA 1 DE REFUERZO 1. Justifica, aplicando la teoría cinética: «Los sólidos tienen forma propia, mientras que los líquidos adoptan la forma del recipiente que los contiene». 2. Expresa la presión de 780
FICHA 1 DE REFUERZO 1. Justifica, aplicando la teoría cinética: «Los sólidos tienen forma propia, mientras que los líquidos adoptan la forma del recipiente que los contiene». 2. Expresa la presión de 780
Tema 1 La Materia. Estados de agragación y cambios de estado.
 Materiales curriculares de Física y Química Miguel Duarte Cruz 4 PROGRAMA DE ACTIVIDADES Tema 1 La Materia. Estados de agragación y cambios de estado. 1. Busca en el diccionario el significado de la palabra
Materiales curriculares de Física y Química Miguel Duarte Cruz 4 PROGRAMA DE ACTIVIDADES Tema 1 La Materia. Estados de agragación y cambios de estado. 1. Busca en el diccionario el significado de la palabra
Propiedades térmicas de la materia
 1 Propiedades térmicas de la materia Ahora que hemos comprendido los conceptos de calor y temperatura, procederemos a estudiar el comportamiento térmico de la materia. Para esto, nos interesan cuatro cantidades
1 Propiedades térmicas de la materia Ahora que hemos comprendido los conceptos de calor y temperatura, procederemos a estudiar el comportamiento térmico de la materia. Para esto, nos interesan cuatro cantidades
GASES 09/06/2011. La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: La atmósfera
 La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: GASES Nitrógeno 78% Oxígeno 21% Otros gases 1% La atmósfera también almacena otros gases Vapor
La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: GASES Nitrógeno 78% Oxígeno 21% Otros gases 1% La atmósfera también almacena otros gases Vapor
[CONDUCTIVIDAD TÉRMICA]
![[CONDUCTIVIDAD TÉRMICA] [CONDUCTIVIDAD TÉRMICA]](/thumbs/52/30211878.jpg) Curso 2009-10 Conductividad Térmica D.Reyman U.A.M. Curso 2009-10 Curso2009-10 Página 1 Conductividad Térmica. Ley de Fourier Es un proceso de transporte en el que la energía migra en respuesta a un gradiente
Curso 2009-10 Conductividad Térmica D.Reyman U.A.M. Curso 2009-10 Curso2009-10 Página 1 Conductividad Térmica. Ley de Fourier Es un proceso de transporte en el que la energía migra en respuesta a un gradiente
Guía de Examen Semestral Física II Grupo: 82-A Bachillerato. Prof. Alberto Flores Ferrer
 Guía de Examen Semestral Física II Grupo: 82-A Bachillerato. Prof. Alberto Flores Ferrer Junio/2016 Alumno: Esta Guía se resuelve en el cuaderno y se entrega al iniciar el examen. Describe las siguientes
Guía de Examen Semestral Física II Grupo: 82-A Bachillerato. Prof. Alberto Flores Ferrer Junio/2016 Alumno: Esta Guía se resuelve en el cuaderno y se entrega al iniciar el examen. Describe las siguientes
3. TERMODINÁMICA. PROBLEMAS I: PRIMER PRINCIPIO
 TERMOINÁMI PROLEMS I: PRIMER PRINIPIO Problema 1 Un gas ideal experimenta un proceso cíclico ---- como indica la figura El gas inicialmente tiene un volumen de 1L y una presión de 2 atm y se expansiona
TERMOINÁMI PROLEMS I: PRIMER PRINIPIO Problema 1 Un gas ideal experimenta un proceso cíclico ---- como indica la figura El gas inicialmente tiene un volumen de 1L y una presión de 2 atm y se expansiona
1.- Conceptos básicos. Sistemas, variables y procesos. 2.- Energía, calor y trabajo. 1 er Principio de la Termodinámica. 3.- Entalpía. 4.
 1.- Conceptos básicos. Sistemas, variables y procesos. 2.- Energía, calor y trabajo. 1 er Principio de la Termodinámica. 3.- Entalpía. 4.- Calor de reacción. Ley de Hess. 5.- Entalpías estándar de formación.
1.- Conceptos básicos. Sistemas, variables y procesos. 2.- Energía, calor y trabajo. 1 er Principio de la Termodinámica. 3.- Entalpía. 4.- Calor de reacción. Ley de Hess. 5.- Entalpías estándar de formación.
Capítulo 10. Efectos de superficie. Sistema respiratorio
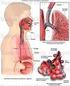 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
