FICHA TECNICA. Virus varicela-zóster* vivos atenuados (cepa Oka) : * obtenidos por propagación en células diploides humanas MRC5
|
|
|
- María Antonia Figueroa Lucero
- hace 6 años
- Vistas:
Transcripción
1 FICHA TECNICA 1. DENOMINACIÓN DEL MEDICAMENTO VARILRIX, 10 3,3 UFP/0,5 ml, polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 dosis (0,5 ml) de vacuna reconstituida contiene: Virus varicela-zóster* vivos atenuados (cepa Oka) : * obtenidos por propagación en células diploides humanas MRC5 no menos de 10 3,3 Unidades Formadoras de Placa (UFP) Lista de excipientes en sección FORMA FARMACÉUTICA Polvo y disolvente para solución inyectable. Solución de rosácea a roja. 4. DATOS CLÍNICOS 4.1. Indicaciones terapéuticas. VARILRIX está indicado para: a) La inmunización activa frente a la varicela en adultos y adolescentes sanos (= 13 años) seronegativos para el virus de la varicela-zóster y que, por lo tanto, tienen riesgo de desarrollar varicela. En el caso de la profilaxis postexposición o de una emergencia médica la vacuna podrá administrarse a sujetos con historia negativa de varicela, siempre bajo estricto control médico. b) La inmunización activa frente a la varicela de pacientes susceptibles de riesgo y sus contactos próximos sanos Se recomienda la vacunación entre otros, en los siguientes casos: - Pacientes con leucemia aguda. Los pacientes leucémicos tienen especial riesgo de padecer una varicela grave y deben vacunarse si son seronegativos. Cuando se vacunan pacientes durante la fase aguda de la leucemia, debe interrumpirse la quimioterapia de mantenimiento una semana antes y una semana después de la vacunación. Los pacientes sometidos a radioterapia no deberían vacunarse durante la fase de tratamiento. - Pacientes en tratamiento inmunosupresor. Los pacientes que reciben tratamiento inmunosupresor (incluida la terapia con corticoesteroides) para tumores sólidos malignos o enfermedades crónicas graves (tales como insuficiencia renal crónica, 1
2 enfermedades autoinmunes, colagenosis, asma bronquial grave) están predispuestos a desarrollar una varicela grave. En general debe vacunarse a los pacientes cuando están en remisión hematológica completa de la enfermedad. Es aconsejable que el recuento total de linfocitos no sea inferior a por mm 3, o no exista otra evidencia de deficiencia inmunitaria celular. - Pacientes con trasplante programado de órgano. En el caso de que se esté considerando un trasplante de órgano (p.e. trasplante renal), la vacuna debe administrarse algunas semanas antes de la instauración del tratamiento inmunosupresor. - Pacientes con enfermedades crónicas. Otras enfermedades crónicas que puedan predisponer a una varicela grave, tales, como enfermedades pulmonares crónicas y cardiovasculares, enfermedad cutánea diseminada y mucoviscidosis. Los niños en tratamiento crónico con salicilatos constituyen también un grupo de riesgo en el que el beneficio de la vacunación es superior al riesgo - Contactos próximos sanos. Los contactos próximos sanos seronegativos de los pacientes que tienen riesgo de padecer una varicela grave deben vacunarse, para reducir el riesgo de transmisión del virus a los pacientes de alto riesgo. Estos incluyen el personal sanitario en contacto con pacientes de alto riesgo. VARILRIX no está indicada para su uso sistemático en niños. Sin embargo, puede ser administrada a niños sanos seronegativos de 1-12 años de edad que sean contactos próximos de pacientes con riesgo elevado de varicela grave. Aunque se dispone de datos de seguridad e inmunogenicidad de la vacuna a partir de los 9 meses de edad, se recomienda su administración a partir de los 12 meses. Debe considerarse que la mayoría de los adultos con una historia incierta de varicela tienen anticuerpos frente al virus varicela-zóster. En principio, la administración de VARILRIX a personas ya inmunes no ofrece beneficio adicional Posología y forma de administración Posología Adolescentes (= 13 años) y adultos Deben administrarse dos dosis (de 0,5 ml de vacuna reconstituida cada una de ellas), con un intervalo entre las dosis de aproximadamente ocho semanas (intervalo mínimo de seis semanas) No hay datos suficientes para determinar la eficacia protectora de la vacuna a largo plazo. Sin embargo, en la actualidad, no hay evidencias de que se requieran de forma sistemática dosis adicionales tras completar una pauta de dos dosis en adolescentes y adultos sanos. Niños de 1-12 años VARILRIX no está indicado para su uso sistemático en niños. Sin embargo, bajo las circunstancias descritas en la sección 4.1, se debe administrar una dosis reconstituida de 0,5 ml. En pacientes de alto riesgo pueden ser necesarias dosis adicionales de vacuna. Ancianos No se dispone de datos sobre la respuesta inmune de VARILRIX en ancianos. 2
3 Pacientes inmunodeprimidos Si es necesaria la administración de VARILRIX a sujetos seronegativos antes de un periodo de inmunosupresión programada o posible en el futuro (como sucede con los pacientes en espera para un trasplante de órgano o pacientes con una enfermedad maligna en remisión), el momento de la vacunación debe tener en cuenta el tiempo que debe transcurrir desde la administración de la segunda dosis hasta el momento en que se espera alcanzar la máxima protección (ver también secciones 4.3, 4.4. y 5.1) Forma de administración VARILRIX debe ser administrada exclusivamente por vía subcutánea. El lugar preferible para la inyección es la parte superior del brazo (región deltoidea). VARILRIX no debe administrarse por vía intradérmica VARILRIX no debe administrarse por vía intravascular bajo ninguna circunstancia. No se dispone de datos de inmunogenicidad cuando se emplean diferentes preparados comerciales de vacuna de varicela-zóster en la primera y segunda dosis. Por lo tanto, se recomienda emplear el mismo preparado comercial para ambas dosis. VARILRIX no debe mezclarse con otros medicamentos en la misma jeringa (ver también secciones 4.5 y 6.2) 4.3. Contraindicaciones VARILRIX está contraindicada en sujetos con historia de hipersensibilidad a la neomicina, o a cualquiera de los componentes de la vacuna o a cualquier otra vacuna antivaricela. No obstante, una historia de dermatitis de contacto a la neomicina no constituye una contraindicación VARILRIX está contraindicada durante el embarazo o la lactancia (ver también secciones 4.4 y 4.6). Como sucede con otras vacunas, se debe posponer la administración de VARILRIX en personas que padezcan una enfermedad febril aguda y grave. VARILRIX no debe administrarse a sujetos con inmunodeficiencia primaria o adquirida, tales como leucemias, linfomas, discrasias sanguíneas, evidencia clínica de infección por el VIH, o pacientes que estén recibiendo tratamiento inmunosupresor (incluyendo la administración de corticoesteroides a dosis elevadas) salvo en las circunstancias descritas en la sección Advertencias y precauciones especiales de empleo Como sucede con todas las vacunas inyectables, debe existir una vigilancia médica y estar disponible un tratamiento en caso de cualquier reacción anafiláctica infrecuente tras la administración de la vacuna. VARILRIX contiene virus varicela-zóster vivos atenuados y su administración está contraindicada durante el embarazo (ver secciones 4.3 y 4.6). Debido a que se desconoce el riesgo que supone la administración de la vacuna para la madre y el feto no debe administrarse durante el embarazo y debe recomendarse a las mujeres candidatas a la vacunación que tomen las precauciones necesarias para evitar un embarazo en el periodo entre la primera y la segunda dosis de vacuna y en los tres meses siguientes a la administración de la segunda dosis. Si accidentalmente una mujer gestante recibe la 3
4 vacuna o queda embarazada en los tres meses siguientes a la administración de la última dosis de vacuna o entre la primera y la segunda dosis deberá ponerlo en conocimiento de su médico. Se recomienda la realización de una prueba de embarazo a todas las mujeres potencialmente fértiles antes de la vacunación. Los estudios de eficacia y la experiencia postcomercialización indican que la vacuna no protege completamente a todos los individuos frente a la varicela natural y que no cabe esperar que se obtenga una protección máxima frente al virus varicela-zóster hasta aproximadamente unas seis semanas después de completar el esquema de vacunación (ver sección 5.1) La administración de VARILRIX a sujetos durante el periodo de incubación de la infección no garantiza la protección frente a las manifestaciones clínicas de la varicela, ni la modificación del curso de la enfermedad. El exantema causado por la infección primaria debida al virus varicela- zóster salvaje puede ser más grave en individuos con lesiones graves de la piel, incluidos los eccemas. Se desconoce si existe un incremento del riesgo de lesiones cutáneas asociado a la vacunación en estas personas, pero esta posibilidad debe ser tenida en cuenta antes de la vacunación. Transmisión de la cepa vacunal Se ha observado la transmisión de la cepa vacunal desde sujetos sanos vacunados a sus contactos, bien fuesen estos individuos sanos, mujeres embarazadas o pacientes inmunodeprimidos. Sin embargo, la transmisión a cualquiera de estos grupos es muy infrecuente y no se ha confirmado en ausencia de exantema postvacunal (ver sección 4.8). En los contactos sanos de los vacunados, en ocasiones se ha producido una seroconversión en ausencia de cualquier manifestación clínica de la infección. Las infecciones sintomáticas debidas a la transmisión de la cepa vacunal, se asocian con un pequeño número de lesiones en la piel y mínimas manifestaciones sistémicas. Sin embargo, si el sujeto vacunado desarrolla un exantema cutáneo que se cree relacionado con la vacunación (especialmente vesicular o papulovesicular) dentro de las cuatro o seis semanas tras la administración de la primera o segunda dosis, debe evitarse el contacto con los siguientes grupos, hasta que el exantema haya desaparecido completamente (ver también las secciones 4.6 y 5.1) - Mujeres embarazadas susceptibles e - Individuos con riesgo de varicela grave, tales como los pacientes con inmunodeficiencias primarias o adquiridas. Estos incluyen individuos con leucemias, linfomas, discrasias sanguíneas, manifestaciones clínicas de infeción por el VIH y pacientes que estén recibiendo terapia inmunosupresora, incluyendo dosis altas de corticoesteroides. En ausencia de exantema en el vacunado, el riesgo de transmisión de la cepa vacunal a los grupos antes mencionados es extremadamente bajo. Sin embargo, los vacunados (p.e. personal sanitario) que tengan una elevada probabilidad de entrar en contacto con los grupos arriba mencionados, deben evitar preferiblemente cualquier contacto durante el periodo entre la administración de las dos dosis de vacuna y durante 4-6 semanas después de la segunda dosis. Si ello no fuera posible, los vacunados deben estar atentos para informar de cualquier exantema cutáneo durante este periodo, y deben tomarse las medidas antes citadas si éste apareciese. Está indicada la vacunación de niños sanos si son contactos próximos de sujetos con riesgo de padecer una varicela grave (ver seccion 4.1 apartado b)). En estas circunstancias, es posible que no 4
5 pueda evitarse el contacto continuo entre el vacunado y el individuo de riesgo. Por lo tanto, debe sopesarse el riesgo de transmisión de la cepa vacunal atenuada frente a la potencial infección por el virus varicela-zóster salvaje en el individuo de riesgo. Recientemente se ha demostrado que la cepa vacunal Oka es sensible al aciclovir Interacción con otros medicamentos y otras formas de interacción. En personas que han recibido inmunoglobulinas o una transfusión sanguínea, debe retrasarse la vacunación durante al menos tres meses, debido a la probabilidad de fracaso vacunal por la presencia de anticuerpos varicela-zóster adquiridos pasivamente. Debe evitarse el uso de salicilatos en el periodo entre las dos dosis de vacuna y durante seis semanas tras la última dosis ya que se ha comunicado la aparición del síndrome de Reye tras el uso de salicilatos durante la infección natural por varicela. En un estudio en el que se administró VARILRIX a niños simultáneamente con vacunas combinadas de parotiditis, sarampión y rubéola, aunque en diferente lugar de inyección, no hubo evidencia de interferencia inmune significativa entre los antígenos virales vivos. Si se considera necesario administrar otra vacuna de virus vivos al mismo tiempo que VARILRIX, las vacunas deben administrarse como inyecciones separadas y en diferentes lugares del cuerpo. Sujetos sanos. Las vacunas inactivadas pueden administrarse con cualquier relación temporal a VARILRIX. Si no se administra la vacuna contra el sarampión al mismo tiempo que VARILRIX, se recomienda se mantenga un intervalo de al menos un mes, ya que se reconoce que la vacunación frente al sarampión puede conducir a una supresión de corta duración de la respuesta inmunitaria mediada por células. Debe esperarse que la reactogenicidad de la administración conjunta de VARILRIX y otras vacunas más reactogénicas, se determine por las reacciones de estas últimas. Pacientes de alto riesgo. VARILRIX no debe administrarse al mismo tiempo que otras vacunas vivas atenuadas. Las vacunas inactivadas pueden administrarse con cualquier relación temporal a VARILRIX, dado que no se ha establecido una contraindicación específica. Diferentes vacunas inyectables deben administrarse siempre en lugares de inyección distintos Embarazo y lactancia Embarazo: El virus varicela-zóster puede causar enfermedad clínica grave en la mujer embarazada, pudiendo dañar al feto y/o causar una varicela perinatal, dependiendo del momento de la gestación en que ocurra la infección. Debido a que se desconocen los posibles efectos de la infección por la cepa vacunal en la madre y en el feto, VARILRIX no debe administrarse a mujeres embarazadas. 5
6 Por ello, debe recomendarse a las mujeres candidatas a la vacunación que tomen precauciones para evitar el embarazo entre las dos dosis de vacuna y durante los tres meses siguientes a la administración de la segunda dosis Lactancia: Los recién nacidos de mujeres seronegativas no han adquirido anticuerpos frente al virus varicelazóster por vía transplacentaria. Por lo tanto, debido al riesgo teórico de transmisión de la cepa vacunal de madre a hijo, las mujeres no deben vacunarse durante la lactancia Efectos sobre la capacidad para conducir y utilizar máquinas. Es poco probable que la vacuna tenga algún efecto sobre la capacidad de conducir vehículos y utilizar maquinaria Reacciones adversas. Estudios Clínicos Las reacciones adversas que sucedieron durante las 4-6 semanas después de la vacunación se registraron mediante el empleo de listados de síntomas. Los acontecimientos adversos que se citan a continuación fueron notificados en relación temporal con la vacunación. La frecuencia, basada en un total de 1141 dosis administradas a adolescentes y adultos es la siguiente: Muy frecuentes: (= 10%) Frecuentes: (= 1% y < 10%) Poco frecuentes: (= 0,1% y < 1%) Tanto en adolescentes como en adultos, la incidencia de reacciones adversas no fue mayor tras la administración de la segunda dosis que tras la primera. Las reacciones adversas listadas a continuación se registraron con una frecuencia similar tras la vacunación de 2624 niños. Reacciones en el lugar de la inyección Muy frecuentes: dolor, enrojecimiento, inflamación Poco frecuentes: tumefacción, induración Sistémicas Frecuentes: astenia, fiebre. Poco frecuentes: dolor torácico, malestar, dolor Sistema nervioso central y periférico Frecuentes: dolor de cabeza Poco frecuentes: mareo, migraña Gastrointestinales 6
7 Poco frecuentes: gastroenteritis, naúseas Musculoesqueléticas Poco frecuentes: artralgia, dolor de espalda, mialgia. Psiquiátricas Poco frecuentes: somnolencia Sistema respiratorio Poco frecuentes: tos, faringitis, rinitis Piel y anejos Frecuentes: exantema papulovesicular Poco frecuentes: prurito Células blancas y sistema retículo endotelial Poco frecuentes: linfadenopatía Vigilancia postcomercialización Se ha observado muy infrecuentemente la transmisión del virus vacunal desde sujetos sanos vacunados a contactos sanos. Se han notificado los siguientes acontecimientos adversos tras la vacunación de niños, adolescentes y adultos, con una frecuencia menor del 0,01% Reacciones en el lugar de la inyección Dolor, enrojecimiento, hinchazón Sistémicas Fiebre, urticaria, reacción anafilactoide Piel y anejos Exantema papulovesicular Se han notificado casos aislados de ataxia, mielitis y trombocitopenia en asociación temporal con la administración de VARILRIX, sin que se haya establecido una relación de causalidad Sobredosificación No hay experiencia de administración de una sobredosis de VARILRIX. La administración accidental de una dosis excesiva es muy poco probable, teniendo en cuenta que la vacuna se presenta en viales monodosis. 5. PROPIEDADES FARMACOLÓGICAS 5.1. Propiedades farmacodinámicas 7
8 Código ATC J07B K01 La cepa Oka contenida en la vacuna VARILRIX se obtuvo inicialmente a partir de un niño con varicela natural, atenuándose el virus mediante pases secuenciales consecutivos en cultivos celulares. La infección natural induce una respuesta inmune humoral y celular frente al virus varicela-zóster, que puede ser rápidamente detectada tras la infección. Normalmente las IgG, IgM e IgA frente a las proteínas virales, aparecen al mismo tiempo en que puede demostrarse la respuesta inmune celular, siendo difícil establecer la relativa contribución de la inmunidad humoral y celular en la progresión de la enfermedad. La vacunación ha mostrado inducción tanto de la inmunidad humoral como de la inmunidad mediada por células. La eficacia de la vacuna fue establecida en dos ensayos clínicos controla dos con placebo en los que se incluyeron 513 niños y 1002 adultos. En el estudio en niños se utilizaron lotes de vacuna con 10 4 y 10 4,2 UFP (la potencia mínima asegurada en el momento de la puesta en el mercado del producto es > 10 4 UFP, y de 10 3,3 UFP al final del periodo de validez), la eficacia de VARILRIX frente a cualquier forma de varicela (1 o más vesículas) fue del 88% a los 29 meses, y del 77% a los cuatro años de seguimiento. Cuando se administraron lotes de vacuna envejecidos artificialmente conteniendo 10 3,1 y 10 2,8 UFP, con potencia inferior a la mínima asegurada al final del periodo de validez de la vacuna (10 3,3 UFP), se obtuvo una eficacia del 55% a los 29 meses y del 46% a los 4 años de seguimiento. No se notificó ningún caso de varicela con más de 30 vesículas en los pacientes que seroconvirtieron tras la vacunación. Los casos de varicela en sujetos que respondieron a la vacunación fueron leves, con menos de 3 vesículas como promedio. En el segundo de los estudios, realizado con adultos, la eficacia de la vacunación con dos dosis frente a cualquier forma de varicela en adultos se estimó en un 76% tras un periodo de seguimiento de 22 meses. El valor protector de la vacuna se ha confirmado en un estudio de efectividad, con un seguimiento a 2 años, realizado en 159 profesionales sanitarios adultos, 2 de los 72 (3%) vacunados que notificaron contactos con casos de varicela natural tras la vacunación, experimentaron una varicela leve. Aproximadamente un tercio de los vacunados mostró un incremento en el título de anticuerpos durante el periodo de seguimiento, indicativo de contacto con el virus, sin evidencia clínica de infección por varicela. El porcentaje de vacunados que desarrollará herpes zóster en el futuro debido a la reactivación de la cepa Oka es actualmente desconocido. Sin embargo, en la actualidad se sabe que el riesgo de zóster después de la vacunación es muy inferior al que pudiera esperarse tras la infección por el virus salvaje, debido a la atenuación de la cepa vacunal. No hay datos suficientes para valorar el nivel de protección frente a complicaciones de la varicela como encefalitis, hepatitis o neumonía, Propiedades farmacocinéticas No se requiere evaluación de las propiedades farmacocinéticas para las vacunas Datos preclínicos sobre seguridad No hay otra información relevante que no haya sido ya expuesta con anterioridad. 5.4 Información concerniente a vacunas 8
9 En personas susceptibles, VARILRIX produce una infección atenuada, clínicamente asintomática. Los estudios clínicos han demostrado la seguridad e inmunogenicidad de VARILRIX en personas sanas y de alto riesgo. En pacientes de alto riesgo, está indicada la determinación periódica de anticuerpos frente a varicela después de la vacunación, para identificar aquellos que puedan beneficiarse de la revacunación. En pacientes gravemente inmunocomprometidos, se produjo varicela clínicamente evidente después de la vacunación, y se han aislado de las vesículas virus vacunales En un estudio la incidencia de herpes zóster en pacientes leucémicos vacunados fue menor que la observada en pacientes leucémicos no vacunados infectados por el virus salvaje. Se ha demostrado la transmisión de la cepa Oka, mediante aislamiento e identificación, en cuatro casos de hermanos de vacunados inmunocomprometidos que presentaron una erupción vesicular. En todos los casos desarrollaron una erupción post-exposiciónmuy leve. 6. DATOS FARMACÉUTICOS 6.1. Relación de excipientes Sulfato de neomicina (máx. 25 µg/dosis), albúmina humana, lactosa; aminoácidos para inyección, sorbitol; manitol. Disolvente: agua para inyección (c.s.p. 0,5 ml) Incompatibilidades VARILRIX no debe mezclarse en la misma jeringa con otras vacunas Periodo de validez Cuando se almacena en las condiciones establecidas, el periodo de validez es de 24 meses. La vacuna debe ser empleada inmediatamente después de su reconstitución. Si no se emplea inmediatamente, los tiempos y las condiciones de almacenamiento antes de su uso son responsabilidad del usuario y normalmente no deben superar una hora a +2ºC/+8ºC (en nevera). No se debe congelar la vacuna una vez reconstituida Precauciones especiales de conservación VARILRIX debe conservarse entre +2ºC y +8ºC. (en nevera). La vacuna liofilizada no se afecta por la congelación Naturaleza y contenido del recipiente VARILRIX se presenta como una pastilla de color rosa claro en un vial de vidrio de 3 ml (vidrio tipo I) con tapón (goma de bromobutilo) y una cápsula desechable (aluminio). El disolvente para la reconstitución es agua para inyección y se presenta en jeringa precargada. Las jeringas son de vidrio neutro tipo I, conforme con los requisitos de la Farmacopea Europea Instrucciones de uso y manipulación 9
10 Debido a pequeñas variaciones del ph, el color de la vacuna reconstituida puede variar del rosa al rojo. El disolvente y la vacuna reconstituida, antes de la administración, deben inspeccionarse visualmente para detectar la presencia de cualquier partícula extraña y/o cambio en el aspecto físico. En ese caso, el disolvente o la vacuna deben desecharse. VARILRIX debe reconstituirse por adición del contenido total del disolvente suministrado, al vial de la vacuna. Después de la adición del disolvente a la pastilla, la mezcla debe ser bien agitada hasta que la pastilla se haya disuelto totalmente. Debe dejarse evaporar de la piel el alcohol o cualquier otro desinfectante empleado antes de la inyección de la vacuna ya que podrían inactivar el virus. Cualquier producto no utilizado o de desecho debe ser eliminado de acuerdo con los requerimientos locales. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN GlaxoSmithKline, S.A. C/ Severo Ochoa TRES CANTOS Madrid Teléfono: Fax: CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN Con receta médica. Diagnostico Hospitalario. Reembolsable por el Sistema Nacional de Salud. P.V.P. 50,09 - P.V.P. IVA 52,10 10
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
Prospecto: información para el usuario Varilrix 10 3,3 UFP/0,5 ml polvo y disolvente para solución inyectable. Vacuna antivaricela (virus vivos)
 Prospecto: información para el usuario Varilrix 10 3,3 UFP/0,5 ml polvo y disolvente para solución inyectable Vacuna antivaricela (virus vivos) Lea todo el prospecto detenidamente antes de que usted/su
Prospecto: información para el usuario Varilrix 10 3,3 UFP/0,5 ml polvo y disolvente para solución inyectable Vacuna antivaricela (virus vivos) Lea todo el prospecto detenidamente antes de que usted/su
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
FICHA TÉCNICA. La vacuna MSD Antirrubéola cumple los requisitos de la OMS para productos biológicos y vacunas Antirrubéola.
 1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela
 Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
PROGRAMA DE VACUNACIONES VACUNACIÓN FRENTE A VARICELA A LOS 11 AÑOS
 PROGRAMA DE VACUNACIONES VACUNACIÓN FRENTE A VARICELA A LOS 11 AÑOS Revisión noviembre 2012 El Calendario Oficial de Vacunaciones de Castilla y León incluye desde 2005 la vacuna frente a la varicela a
PROGRAMA DE VACUNACIONES VACUNACIÓN FRENTE A VARICELA A LOS 11 AÑOS Revisión noviembre 2012 El Calendario Oficial de Vacunaciones de Castilla y León incluye desde 2005 la vacuna frente a la varicela a
K:\Jenner_Public\QSS\VACCINE QUALITY & REGULATION GROUP\Inserts\Spanish\esp_Insert measles rubella Vd2-rev.doc
 MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
FICHA TÉCNICA. VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable
 FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Vacuna contra la poliomielitis. (Comentarios a las fichas técnicas)
 Vacuna contra la poliomielitis (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Composición
Vacuna contra la poliomielitis (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Composición
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Poulvac Marek CVI Suspensión y disolvente para suspensión inyectable para
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Poulvac Marek CVI Suspensión y disolvente para suspensión inyectable para
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA 3. FORMA FARMACÉUTICA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
100 UI 80 mg 95% IgG
 1. NOMBRE DEL MEDICAMENTO IGANTIBE 200 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 100 UI/0,5 ml 600 UI/3 ml 1000 UI/5 ml Inmunoglobulina humana antihepatitis
1. NOMBRE DEL MEDICAMENTO IGANTIBE 200 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 100 UI/0,5 ml 600 UI/3 ml 1000 UI/5 ml Inmunoglobulina humana antihepatitis
Contraindicaciones de las Vacunas
 Contraindicaciones de las Vacunas Alergias Los alérgicos a la levadura no deberían recibir la vacuna de la hepatitis B. Los que tienen una historia de anafilaxia (alergia grave) a la gelatina no deben
Contraindicaciones de las Vacunas Alergias Los alérgicos a la levadura no deberían recibir la vacuna de la hepatitis B. Los que tienen una historia de anafilaxia (alergia grave) a la gelatina no deben
Anexo III. Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos
 Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
Varicela 1. Agente inmunizante 2. Conservación
 Varicela 1. Agente inmunizante Es una vacuna viral atenuada, desarrollada en Japón en 1974; se utiliza el virus varicela-zoster cepa OKA atenuada (aceptada por OMS) obtenida en cultivos de células diploides
Varicela 1. Agente inmunizante Es una vacuna viral atenuada, desarrollada en Japón en 1974; se utiliza el virus varicela-zoster cepa OKA atenuada (aceptada por OMS) obtenida en cultivos de células diploides
La vacuna no es eficaz para la prevención de la otitis media aguda, sinusitis y otras infecciones comunes del tracto respiratorio superior.
 1. NOMBRE DEL MEDICAMENTO Pneumovax 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna contiene 25 microgramos
1. NOMBRE DEL MEDICAMENTO Pneumovax 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna contiene 25 microgramos
ACTUALIZACION DE VARICELA A LA SE 23 DE 2012
 ACTUALIZACION DE VARICELA A LA SE 23 DE 2012 Montevideo, 25 de junio de 2012 La varicela es la principal infección causada por el virus de la varicela zoster (VZV). Es una enfermedad viral aguda generalizada,
ACTUALIZACION DE VARICELA A LA SE 23 DE 2012 Montevideo, 25 de junio de 2012 La varicela es la principal infección causada por el virus de la varicela zoster (VZV). Es una enfermedad viral aguda generalizada,
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
Vacunación en inmunocomprometidos y pacientes crónicos
 Vacunación en inmunocomprometidos y pacientes crónicos Mª Pilar Arrazola Martínez Unidad de Vacunación y Consejo al Viajero Servicio de Medicina Preventiva Hospital Universitario 12 de Octubre 5ª Reunión
Vacunación en inmunocomprometidos y pacientes crónicos Mª Pilar Arrazola Martínez Unidad de Vacunación y Consejo al Viajero Servicio de Medicina Preventiva Hospital Universitario 12 de Octubre 5ª Reunión
FICHA TÉCNICA. no menos de 20 Unidades Internaciones (UI) (5 Lf) 1adsorbidos en hidróxido de aluminio hidratado (Al(OH)3)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Boostrix suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Boostrix suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
Vacuna triple vírica (sarampión, rubeola, parotiditis)
 Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
* producido en levadura Saccharomyces cerevisiae (cepa ) mediante tecnología recombinante de ADN.
 1. NOMBRE DEL MEDICAMENTO HBVAXPRO 40 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis (1 ml) contiene: Antígeno de superficie del virus
1. NOMBRE DEL MEDICAMENTO HBVAXPRO 40 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis (1 ml) contiene: Antígeno de superficie del virus
Fiebre Amarilla. Dr. Fernando Arrieta
 Fiebre Amarilla Dr. Fernando Arrieta Dpto. InmunizacionesCHLA EP Fiebre Amarilla: Es una zoonosis de etiología viral aguda, con alta transmisibilidad bld den presencia de personas susceptibles y mosquitos
Fiebre Amarilla Dr. Fernando Arrieta Dpto. InmunizacionesCHLA EP Fiebre Amarilla: Es una zoonosis de etiología viral aguda, con alta transmisibilidad bld den presencia de personas susceptibles y mosquitos
FICHA TÉCNICA. Nota: La utilización de Priorix debe realizarse de acuerdo a las recomendaciones oficiales.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
El sistema inmune y las vacunas
 SESIÓN DE INFORMACIÓN SOBRE VACUNAS, Santiago, Chile 7 de mayo 9 mayo, 2014 El sistema inmune y las vacunas Dra. Juanita Zamorano R Pediatra- Infectóloga jzamorano@uandes.cl 1 Jenner: En 1796 inicia la
SESIÓN DE INFORMACIÓN SOBRE VACUNAS, Santiago, Chile 7 de mayo 9 mayo, 2014 El sistema inmune y las vacunas Dra. Juanita Zamorano R Pediatra- Infectóloga jzamorano@uandes.cl 1 Jenner: En 1796 inicia la
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Vacuna frente a Haemophilus influenzae tipo b
 Vacuna frente a Haemophilus influenzae tipo b Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Previo al empleo sistemático
Vacuna frente a Haemophilus influenzae tipo b Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Previo al empleo sistemático
La varicela la padecen casi todos los niños, por lo que tiene un coste sanitario y social significativo, si se incluyen:
 VARICELA La varicela, producida por el virus de la varicela-zoster es una enfermedad infantil clásica, frecuente en nuestro país pues aún no se vacuna sistemáticamente contra ella. El 90% de casos aparecen
VARICELA La varicela, producida por el virus de la varicela-zoster es una enfermedad infantil clásica, frecuente en nuestro país pues aún no se vacuna sistemáticamente contra ella. El 90% de casos aparecen
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
PROSPECTO. CEFTRIAXONA REIG JOFRÉ 1 g IM. Polvo y disolvente para solución inyectable. E.F.G. Ceftriaxona (D.C.I.)
 PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
- Como disolvente de medicamentos en polvo o liofilizados, previamente a su administración. - Como diluyente de soluciones y/o medicamentos.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública
 Fiebre Amarilla AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública La fiebre amarilla es una infección aguda causada por un Arbovirus del género flavivirus, transmitida por la picadura
Fiebre Amarilla AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública La fiebre amarilla es una infección aguda causada por un Arbovirus del género flavivirus, transmitida por la picadura
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS ND CLONE 30 Liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS ND CLONE 30 Liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA
Excipiente con efecto conocido: contiene 6 mg de sorbitol (E-420) (ver sección 4.3).
 1. NOMBRE DEL MEDICAMENTO Varilrix 10 3,3 UFP/0,5 ml polvo y disolvente para solución inyectable. Vacuna antivaricela (virus vivos). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Después de la reconstitución,
1. NOMBRE DEL MEDICAMENTO Varilrix 10 3,3 UFP/0,5 ml polvo y disolvente para solución inyectable. Vacuna antivaricela (virus vivos). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Después de la reconstitución,
La gripe o influenza es una enfermedad viral respiratoria que se presenta habitualmente en los meses más fríos del año.
 La gripe o influenza es una enfermedad viral respiratoria que se presenta habitualmente en los meses más fríos del año. Los síntomas suelen aparecer a las 48 horas de efectuado el contagio y la mayoría
La gripe o influenza es una enfermedad viral respiratoria que se presenta habitualmente en los meses más fríos del año. Los síntomas suelen aparecer a las 48 horas de efectuado el contagio y la mayoría
FICHA TECNICA. P R A M O X Pramocaína
 FICHA TECNICA P R A M O X Pramocaína 1. NOMBRE DEL MEDICAMENTO PRAMOX Gel PRAMOX Crema PRAMOX Emulsión 2. COMPOSICION CUALITATIVA Y CUANTITATIVA PRAMOX Gel y Crema :. Cada 100 g contienen: Pramocaína (DCI)
FICHA TECNICA P R A M O X Pramocaína 1. NOMBRE DEL MEDICAMENTO PRAMOX Gel PRAMOX Crema PRAMOX Emulsión 2. COMPOSICION CUALITATIVA Y CUANTITATIVA PRAMOX Gel y Crema :. Cada 100 g contienen: Pramocaína (DCI)
VAQTA VACUNA ANTI-HEPATITIS A PURIFICADA E INACTIVADA Suspensión Inyectable Estéril de uso I.M.
 VAQTA VACUNA ANTI-HEPATITIS A PURIFICADA E INACTIVADA Suspensión Inyectable Estéril de uso I.M. INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FÓRMULA: Formulación para uso pediátrico y en adolescentes Cada
VAQTA VACUNA ANTI-HEPATITIS A PURIFICADA E INACTIVADA Suspensión Inyectable Estéril de uso I.M. INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FÓRMULA: Formulación para uso pediátrico y en adolescentes Cada
Vacunas Varicela- Herpes Zoster. Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC
 Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA. Gotas Óticas. Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g.
 DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
VACUNACIÓN ANTIGRIPAL EN NIÑOS
 Servicio Canario de la Salud DIRECCIÓN GENERAL DE SALUD PÚBLICA VACUNACIÓN ANTIGRIPAL EN NIÑOS PROGRAMA DE VACUNAS SERVICIO DE EPIDEMIOLOGÍA Y PREVENCIÓN DIRECCIÓN GENERAL DE SALUD PÚBLICA OCTUBRE / DICIEMBRE-2008
Servicio Canario de la Salud DIRECCIÓN GENERAL DE SALUD PÚBLICA VACUNACIÓN ANTIGRIPAL EN NIÑOS PROGRAMA DE VACUNAS SERVICIO DE EPIDEMIOLOGÍA Y PREVENCIÓN DIRECCIÓN GENERAL DE SALUD PÚBLICA OCTUBRE / DICIEMBRE-2008
INFLUENZA. Curso de Capacitación para Vacunadores. CHLA-EP Setiembre 2008
 INFLUENZA Curso de Capacitación para Vacunadores. CHLA-EP Setiembre 2008 Infecciones respiratorias agudas de potencial pandemico 1. Influenza estacional 2. Influenza aviar 3. SARS VIRUS INFLUENZA FAMILIA
INFLUENZA Curso de Capacitación para Vacunadores. CHLA-EP Setiembre 2008 Infecciones respiratorias agudas de potencial pandemico 1. Influenza estacional 2. Influenza aviar 3. SARS VIRUS INFLUENZA FAMILIA
Corrección de calendario vacunal abril María Rosa Albañil Pediatra CS Cuzco GPI- AEPap
 Corrección de calendario vacunal abril 2016 María Rosa Albañil Pediatra CS Cuzco GPI- AEPap Niño de 2 años y 3 meses Nacido en Londres, donde ha residido hasta ahora Sano, no patología previa, no recibe
Corrección de calendario vacunal abril 2016 María Rosa Albañil Pediatra CS Cuzco GPI- AEPap Niño de 2 años y 3 meses Nacido en Londres, donde ha residido hasta ahora Sano, no patología previa, no recibe
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Twinrix Adultos, suspensión inyectable Vacuna (HAB) (adsorbida) antihepatitis A (inactivada) y antihepatitis
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Twinrix Adultos, suspensión inyectable Vacuna (HAB) (adsorbida) antihepatitis A (inactivada) y antihepatitis
Inmunizaciones. Vacunas Infantiles. Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Objetivo:
 Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
VACUNACIÓN del personal sanitario
 VACUNACIÓN del personal sanitario 21 INTRODUCCIÓN El personal que trabaja en el ámbito sanitario constituye un grupo de riesgo de adquisición y de transmisión de determinadas enfermedades infecciosas,
VACUNACIÓN del personal sanitario 21 INTRODUCCIÓN El personal que trabaja en el ámbito sanitario constituye un grupo de riesgo de adquisición y de transmisión de determinadas enfermedades infecciosas,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO POULVAC MAREK CVI + HVT 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 dosis de 0,2 ml contiene: Sustancias activas:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO POULVAC MAREK CVI + HVT 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 dosis de 0,2 ml contiene: Sustancias activas:
IM cara anterolateral del muslo en los lactantes o el músculo deltoides de la parte superior del brazo en los niños.
 ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
CENTROS DE VACUNACIÓN
 Vacunación Infantil INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los ciudadanos, pero
Vacunación Infantil INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los ciudadanos, pero
Contraindicaciones y precauciones de vacunas
 Curso Internacional: Vaccinology 2014 Dr. Ciro de Quadros Contraindicaciones y precauciones de vacunas Dra. Cecilia González C Departamento Inmunizaciones Ministerio de Salud Introducción Contraindicaciones
Curso Internacional: Vaccinology 2014 Dr. Ciro de Quadros Contraindicaciones y precauciones de vacunas Dra. Cecilia González C Departamento Inmunizaciones Ministerio de Salud Introducción Contraindicaciones
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO. 25 μg
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
PROSPECTO: INFORMACIÓN PARA EL USUARIO. ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
PROSPECTO: INFORMACIÓN PARA EL USUARIO ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
SUPERINTENDENCIA DE SERVICIOS DE SALUD
 SUPERINTENDENCIA DE SERVICIOS DE SALUD VACUNACIÓN ANTIGRIPAL 2016 VACUNACIÓN ANTIGRIPAL 2016 La gripe o influenza es una enfermedad viral respiratoria que se presenta habitualmente en los meses más fríos
SUPERINTENDENCIA DE SERVICIOS DE SALUD VACUNACIÓN ANTIGRIPAL 2016 VACUNACIÓN ANTIGRIPAL 2016 La gripe o influenza es una enfermedad viral respiratoria que se presenta habitualmente en los meses más fríos
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Oncept IL-2 liofilizado y disolvente para suspensión inyectable para gatos. 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Oncept IL-2 liofilizado y disolvente para suspensión inyectable para gatos. 2. COMPOSICIÓN
FICHA TÉCNICA. ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
CALENDARIO DE VACUNACIÓN INFANTIL 2015 Sistemático, acelerado y otras recomendaciones
 CALENDARIO DE VACUNACIÓN INFANTIL 2015 Sistemático, acelerado y otras recomendaciones (Actualización 17/03/2015) Calle San Martín de Porres, 6, planta baja. 28035 Madrid. Teléfono 913700920 0 INTRODUCCIÓN
CALENDARIO DE VACUNACIÓN INFANTIL 2015 Sistemático, acelerado y otras recomendaciones (Actualización 17/03/2015) Calle San Martín de Porres, 6, planta baja. 28035 Madrid. Teléfono 913700920 0 INTRODUCCIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS IB Ma5 liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS IB Ma5 liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y
FICHA TÉCNICA VACUNA ADSORBIDA ANTIDIFTÉRICA, ANTITETÁNICA Y CONTRA LA TOS FERINA
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Toxoide Diftérico / Toxoide Tetánica / Vacuna Pertussis 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes Cada: Toxoide Diftérico Corynebacterium
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Toxoide Diftérico / Toxoide Tetánica / Vacuna Pertussis 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes Cada: Toxoide Diftérico Corynebacterium
Mononucleosis infecciosa (MI) Dr. Daniel Stamboulian
 Mononucleosis infecciosa (MI) Dr. Daniel Stamboulian Mononucleosis infecciosa Es causada por el virus EB en el 90 al 95% de los casos. Clínicamente, la MI se presenta con mayor frecuencia en la adolescencia
Mononucleosis infecciosa (MI) Dr. Daniel Stamboulian Mononucleosis infecciosa Es causada por el virus EB en el 90 al 95% de los casos. Clínicamente, la MI se presenta con mayor frecuencia en la adolescencia
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HEPTAVAC P PLUS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancias activas:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HEPTAVAC P PLUS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancias activas:
FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO EchinaMed gotas orales en solución 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 1 ml [= 0.905g] contiene: 860 mg de extracto (como tintura) de la parte aérea fresca
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO EchinaMed gotas orales en solución 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 1 ml [= 0.905g] contiene: 860 mg de extracto (como tintura) de la parte aérea fresca
Tos ferina Epidemiología a WHO
 Tos ferina Epidemiología a WHO Los primeros brotes de Tos ferina fueron descritos en el siglo 16. B. pertusis fue aislada en 1906 La introducción de la vacuna de células enteras en 1940 produce un drástico
Tos ferina Epidemiología a WHO Los primeros brotes de Tos ferina fueron descritos en el siglo 16. B. pertusis fue aislada en 1906 La introducción de la vacuna de células enteras en 1940 produce un drástico
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Rabipur Polvo y disolvente para solución inyectable Vacuna antirrábica inactivada
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Rabipur Polvo y disolvente para solución inyectable Vacuna antirrábica inactivada Lea todo el prospecto detenidamente antes de que usted o su hijo reciban Rabipur.
PROSPECTO: INFORMACIÓN PARA EL USUARIO Rabipur Polvo y disolvente para solución inyectable Vacuna antirrábica inactivada Lea todo el prospecto detenidamente antes de que usted o su hijo reciban Rabipur.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA. Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Sandoz 50 mg/g crema EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir. Excipientes
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Sandoz 50 mg/g crema EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir. Excipientes
Prevención del cáncer de cuello de útero
 Prevención del cáncer de cuello de útero Ref. 150/ Febrero 2008 Servicio de Ginecología ( )" " * " " +, % "- Gran Vía Carlos III 71-75 08028 Barcelona Tel. 93 227 47 00 Fax 93 418 78 32 info@dexeus.com
Prevención del cáncer de cuello de útero Ref. 150/ Febrero 2008 Servicio de Ginecología ( )" " * " " +, % "- Gran Vía Carlos III 71-75 08028 Barcelona Tel. 93 227 47 00 Fax 93 418 78 32 info@dexeus.com
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO Gardasil suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorbida).
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO Gardasil suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorbida).
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
Vacunación. Infantil
 Vacunación Infantil E N C A S T I L L A - L A M A N C H A Edición Dirección General de Salud Pública y Consumo Consejería de Sanidad Junta de Comunidades de Castilla-La Mancha Actualizado Febrero 2016
Vacunación Infantil E N C A S T I L L A - L A M A N C H A Edición Dirección General de Salud Pública y Consumo Consejería de Sanidad Junta de Comunidades de Castilla-La Mancha Actualizado Febrero 2016
AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública
 Fiebre tifoidea AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública Es una infección bacteriana aguda causada por una bacteria que recibe el nombre de Salmonella tiphi. La enfermedad que
Fiebre tifoidea AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública Es una infección bacteriana aguda causada por una bacteria que recibe el nombre de Salmonella tiphi. La enfermedad que
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
Calendarios vacunales Dr. José Uberos Fernández Profesor Titular de Universidad acreditado. Universidad de Granada
 Calendarios vacunales Dr. José Uberos Fernández Profesor Titular de Universidad acreditado. Universidad de Granada Ultima revisión: 21 de Julio de 2013 Existen varias definiciones de lo que es un calendario
Calendarios vacunales Dr. José Uberos Fernández Profesor Titular de Universidad acreditado. Universidad de Granada Ultima revisión: 21 de Julio de 2013 Existen varias definiciones de lo que es un calendario
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS MAREXINE CA126 suspensión y disolvente para suspensión inyectable.
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS MAREXINE CA126 suspensión y disolvente para suspensión inyectable.
FICHA TÉCNICA. Esta vacuna puede contener una cantidad residual de neomicina (ver secciones 4.3 y 4.4).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Varivax polvo y disolvente para suspensión inyectable [Vacuna antivaricela (virus vivos)] 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Después de su reconstitución,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Varivax polvo y disolvente para suspensión inyectable [Vacuna antivaricela (virus vivos)] 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Después de su reconstitución,
Prospecto: información para el usuario VARIVAX polvo y disolvente para suspensión inyectable [Vacuna antivaricela (virus vivos)]
![Prospecto: información para el usuario VARIVAX polvo y disolvente para suspensión inyectable [Vacuna antivaricela (virus vivos)] Prospecto: información para el usuario VARIVAX polvo y disolvente para suspensión inyectable [Vacuna antivaricela (virus vivos)]](/thumbs/48/23894877.jpg) Prospecto: información para el usuario VARIVAX polvo y disolvente para suspensión inyectable [Vacuna antivaricela (virus vivos)] Lea todo el prospecto detenidamente antes de que usted o su hijo sean vacunados,
Prospecto: información para el usuario VARIVAX polvo y disolvente para suspensión inyectable [Vacuna antivaricela (virus vivos)] Lea todo el prospecto detenidamente antes de que usted o su hijo sean vacunados,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2011/2012 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2011/2012 2. COMPOSICIÓN
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
3.9. SARAMPIÓN-RUBÉOLA- PAROTIDITIS
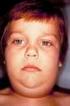 3.9. SARAMPIÓN-RUBÉOLA- PAROTIDITIS CARACTERÍSTICAS DE LAS ENFERMEDADES Sarampión: es una enfermedad exantemática muy contagiosa que comienza con fiebre, coriza, tos y pequeñas manchas eritematosas con
3.9. SARAMPIÓN-RUBÉOLA- PAROTIDITIS CARACTERÍSTICAS DE LAS ENFERMEDADES Sarampión: es una enfermedad exantemática muy contagiosa que comienza con fiebre, coriza, tos y pequeñas manchas eritematosas con
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
Vacuna conjugada frente al neumococo. Javier Díez Domingo, III Jornadas sobre Vacunas en Atención primaria
 Vacuna conjugada frente al neumococo Javier Díez Domingo, III Jornadas sobre Vacunas en Atención primaria Edad Tasa de incidencia por 100.000 niños y año < 2 años < 5 años < 15 años 16,8 10,5 4,6 Díez
Vacuna conjugada frente al neumococo Javier Díez Domingo, III Jornadas sobre Vacunas en Atención primaria Edad Tasa de incidencia por 100.000 niños y año < 2 años < 5 años < 15 años 16,8 10,5 4,6 Díez
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Bibliografía 1. VARICELA. Tema del Mes
 Página 1 de 18 Bibliografía Tema del Mes Tema del mes: Agosto 2005 Documento sobre la vacunación frente a la varicela en el calendario vacunal de la Comunidad de Madrid Autor: Dirección General de Salud
Página 1 de 18 Bibliografía Tema del Mes Tema del mes: Agosto 2005 Documento sobre la vacunación frente a la varicela en el calendario vacunal de la Comunidad de Madrid Autor: Dirección General de Salud
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO MENJUGATE KIT 10 microgramos polvo y disolvente para suspensión inyectable. Vacuna conjugada frente al meningococo
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO MENJUGATE KIT 10 microgramos polvo y disolvente para suspensión inyectable. Vacuna conjugada frente al meningococo
PROSPECTO: INFORMACIÓN PARA EL USUARIO. CITICOLINA Normon 1000 mg solución inyectable EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
