producto Clorhidrato de oxicodona/clorhidrato de naloxona dihidrato Clorhidrato de oxicodona/clorhidrato de naloxona dihidrato
|
|
|
- María José Soto
- hace 5 años
- Vistas:
Transcripción
1 Anexo I Relación de los nombres del medicamento, forma(s) (s), dosis, vía(s) de, titular(es) de la autorización de en los estados s 1
2 Targin 10 mg/5 mg comprimidos de Targin 20 mg/10 mg comprimidos de Targin 5 mg/2,5 mg comprimidos de Targin 40 mg/20 mg comprimidos de Bélgica Mundipharma Comm. VA Blarenberglaan 3C, Mechelen 2800 Belgium Targinact 10 mg/5 mg comprimidos de 2
3 Bélgica Mundipharma Comm. VA Blarenberglaan 3C, Mechelen 2800 Belgium Targinact 20 mg/10 mg comprimidos de Bélgica Mundipharma Comm. VA Blarenberglaan 3C, Mechelen 2800 Belgium Targinact 5 mg/2,5 mg comprimidos de Bélgica Mundipharma Comm. VA Blarenberglaan 3C, Mechelen 2800 Belgium Targinact 40 mg/20 mg comprimidos de Bulgaria Targin 5 mg/2,5 mg comprimidos de Bulgaria Targin 10 mg/5 mg comprimidos de Bulgaria Targin 20 mg/10 mg comprimidos de 3
4 Bulgaria Targin 40 mg/20 mg comprimidos de Chipre Mundipharma Pharmaceuticals Ltd. 13, Othellos Street, Dhali Industrial Zone, Nicosia Cyprus Targinact 5 mg/2,5 mg comprimidos de Chipre Mundipharma Pharmaceuticals Ltd. 13, Othellos Street, Dhali Industrial Zone, Nicosia Cyprus Targinact 10 mg/5 mg comprimidos de Chipre Mundipharma Pharmaceuticals Ltd. 13, Othellos Street, Dhali Industrial Zone, Nicosia Cyprus Targinact 20 mg/10 mg comprimidos de Chipre Mundipharma Pharmaceuticals Ltd. 13, Othellos Street, Dhali Industrial Zone, Nicosia Cyprus Targinact 40 mg/20 mg comprimidos de 4
5 República Checa ( naloxona) Targin 5 mg/2,5 mg tablety s prodlouženým uvolňováním 5 mg/2,5 mg comprimidos de República Checa ( naloxona) Targin 10 mg/5 mg tablety s prodlouženým uvolňováním 10 mg/5 mg comprimidos de República Checa ( naloxona) Targin 20 mg/10 mg tablety s prodlouženým uvolňováním 20 mg/10 mg comprimidos de República Checa ( naloxona) Targin 40 mg/20 mg tablety s prodlouženým uvolňováním 40 mg/20 mg comprimidos de 5
6 Dinamarca Norpharma A/S Slotsmarken 15, Horsholm 2970 Denmark Targin 10 mg/5 mg comprimidos de Dinamarca Norpharma A/S Slotsmarken 15, Horsholm 2970 Denmark Targin 20 mg/10 mg comprimidos de Dinamarca Norpharma A/S Slotsmarken 15, Horsholm 2970 Denmark Targin 5 mg/2,5 mg comprimidos de Dinamarca Norpharma A/S Slotsmarken 15, Horsholm 2970 Denmark Targin 40 mg/20 mg comprimidos de Estonia Targinact 5 mg/2,5 mg comprimidos de Estonia Targinact 10 mg/5 mg comprimidos de 6
7 Estonia Targinact 20 mg/10 mg comprimidos de Estonia Targinact 40 mg/20 mg comprimidos de Finlandia Mundipharma Oy Rajatorpantie 41 B Vantaa Finland Targiniq 10 mg/5 mg comprimidos de Finlandia Mundipharma Oy Rajatorpantie 41 B Vantaa Finland Targiniq 20 mg/10 mg comprimidos de Finlandia Mundipharma Oy Rajatorpantie 41 B Vantaa Finland Targiniq 5 mg/2,5 mg comprimidos de Finlandia Mundipharma Oy Rajatorpantie 41 B Vantaa Finland Targiniq 40 mg/20 mg comprimidos de 7
8 Francia Mundipharma SAS 100, avenue de Suffren, Paris France Targinact 5 mg/2,5 mg comprimidos de Francia Mundipharma SAS 100, avenue de Suffren Paris France Targinact 10 mg/5 mg comprimidos de Francia Mundipharma SAS 100, avenue de Suffren Paris France Targinact 20 mg/10 mg comprimidos de Francia Mundipharma SAS 100, avenue de Suffren Paris France Targinact 40 mg/20 mg comprimidos de Alemania Mundipharma GmbH Mundipharma Str. 2 Limburg Germany Oxynal 10 mg/5 mg comprimidos de Alemania Mundipharma GmbH Mundipharma Str. 2, Limburg Germany Oxynal 20 mg/10 mg comprimidos de 8
9 Alemania Mundipharma GmbH Mundipharma Str. 2, Limburg Germany Targin 5 mg/2,5 mg comprimidos de Alemania Mundipharma GmbH Mundipharma Str. 2 Limburg Germany Targin 10 mg/5 mg comprimidos de Alemania Mundipharma GmbH Mundipharma Str. 2 Limburg Germany Targin 20 mg/10 mg comprimidos de Alemania Mundipharma GmbH Mundipharma Str. 2 Limburg Germany Targin 40 mg/20 mg comprimidos de Hungría Targinact 5 mg/2,5 mg comprimidos de Hungría Targinact 10 mg/5 mg comprimidos de 9
10 Hungría Targinact 20 mg/10 mg comprimidos de Hungría Targinact 40 mg/20 mg comprimidos de Islandia Norpharma A/S Slotsmarken 15, Horsholm 2970 Denmark Targin 10 mg/5 mg comprimidos de Islandia Norpharma A/S Slotsmarken 15, Horsholm 2970 Denmark Targin 20 mg/10 mg comprimidos de Islandia Norpharma A/S Slotsmarken 15, Horsholm 2970 Denmark Targin 5 mg/2,5 mg comprimidos de Islandia Norpharma A/S Slotsmarken 15, Horsholm 2970 Denmark Targin 40 mg/20 mg comprimidos de 10
11 Irlanda Mundipharma Pharmaceuticals Ltd. Millbank House, Arkle Road Sandyford, Dublin 18 Ireland Targin 10 mg/5 mg comprimidos de Irlanda Mundipharma Pharmaceuticals Ltd. Millbank House, Arkle Road Sandyford, Dublin 18 Ireland Targin 20 mg/10 mg comprimidos de Irlanda Mundipharma Pharmaceuticals Ltd. Millbank House, Arkle Road Sandyford, Dublin 18 Ireland Targin 5 mg/2,5 mg comprimidos de Irlanda Mundipharma Pharmaceuticals Ltd. Millbank House, Arkle Road Sandyford, Dublin 18 Ireland Targin 40 mg/20 mg comprimidos de Italia Mundipharma Pharmaceuticals Srl Via G. Serbelloni 4, Milano Italy Targin 5 mg/2,5 mg comprimidos de Italia Mundipharma Pharmaceuticals Srl Via G. Serbelloni 4, Milano Italy Targin 10 mg/5 mg comprimidos de 11
12 Italia Mundipharma Pharmaceuticals Srl Via G. Serbelloni 4, Milano Italy Targin 20 mg/10 mg comprimidos de Italia Mundipharma Pharmaceuticals Srl Via G. Serbelloni 4, Milano Italy Targin 40 mg/20 mg comprimidos de Letonia de naloxona Targin 5 mg/2,5 mg comprimidos de Letonia de naloxona Targin 10 mg/5 mg comprimidos de Letonia de naloxona Targin 20 mg/10 mg comprimidos de Letonia de naloxona Targin 40 mg/20 mg comprimidos de 12
13 Luxemburgo Mundipharma Comm. VA Blarenberglaan 3C, Mechelen 2800 Belgium Targinact 10 mg/5 mg comprimidos de Luxemburgo Mundipharma Comm. VA Blarenberglaan 3C Mechelen 2800 Belgium Targinact 20 mg/10 mg comprimidos de Luxemburgo Mundipharma Comm. VA Blarenberglaan 3C Mechelen 2800 Belgium Targinact 5 mg/2,5 mg comprimidos de Luxemburgo Mundipharma Comm. VA Blarenberglaan 3C Mechelen 2800 Belgium Targinact 40 mg/20 mg comprimidos de Noruega Mundipharma AS Dicks vei 10B, 1366 Lysaker Norway Targiniq 10 mg/5 mg comprimidos de Noruega Mundipharma AS Dicks vei 10B, 1366 Lysaker Norway Targiniq 20 mg/10 mg comprimidos de 13
14 Noruega Mundipharma AS Dicks vei 10B, 1366 Lysaker Norway Targiniq 5 mg/2,5 mg comprimidos de Noruega Mundipharma AS Dicks vei 10B, 1366 Lysaker Norway Targiniq 40 mg/20 mg comprimidos de Polonia Norpharma A/S Slotsmarken 15, Horsholm 2970 Denmark Targin 5 mg/2,5 mg comprimidos de Polonia Norpharma A/S Slotsmarken 15, Horsholm 2970 Denmark Targin 10 mg/5 mg comprimidos de Polonia Norpharma A/S Slotsmarken 15, Horsholm 2970 Denmark Targin 20 mg/10 mg comprimidos de Polonia Norpharma A/S Slotsmarken 15, Horsholm 2970 Denmark Targin 40 mg/20 mg comprimidos de 14
15 Portugal Mundipharma Farmaceutica Lda Rua Duque de Palmela, no 23, Lisboa Portugal Targin 5 mg/2,5 mg comprimidos de Portugal Mundipharma Farmaceutica Lda Rua Duque de Palmela, no 23, Lisboa Portugal Targin 10 mg/5 mg comprimidos de Portugal Mundipharma Farmaceutica Lda Rua Duque de Palmela, no 23, Lisboa Portugal Targin 20 mg/10 mg comprimidos de Portugal Mundipharma Farmaceutica Lda Rua Duque de Palmela, no 23, Lisboa Portugal Targin 40 mg/20 mg comprimidos de Rumania Targin 5 mg/2,5 mg comprimidos de Rumania Targin 10 mg/5 mg comprimidos de 15
16 Rumania Targin 20 mg/10 mg comprimidos de Rumania Targin 40 mg/20 mg comprimidos de República Eslovaca Targin 5 mg/2,5 mg comprimidos de República Eslovaca Targin 10 mg/5 mg comprimidos de República Eslovaca Targin 20 mg/10 mg comprimidos de República Eslovaca Targin 40 mg/20 mg comprimidos de 16
17 Eslovenia Targinact 5 mg/2,5 mg comprimidos de Eslovenia Targinact 10 mg/5 mg comprimidos de Eslovenia Targinact 20 mg/10 mg comprimidos de Eslovenia Targinact 40 mg/20 mg comprimidos de España Mundipharma Pharmaceuticals, S.L. C/ Bahía de Pollensa,11 Madrid Spain Targin 5 mg/2,5 mg comprimidos de 17
18 España Mundipharma Pharmaceuticals, S.L. C/ Bahía de Pollensa,11 Madrid Spain Targin 10 mg/5 mg comprimidos de España Mundipharma Pharmaceuticals, S.L. C/ Bahía de Pollensa,11, Madrid Spain Targin 20 mg/10 mg comprimidos de España Mundipharma Pharmaceuticals, S.L. C/ Bahía de Pollensa,11 Madrid Spain Targin 40 mg/20 mg comprimidos de Suecia Mundipharma AB Mölndalsvägen 30B Göteborg Sweden Targiniq 10 mg/5 mg comprimidos de Suecia Mundipharma AB Mölndalsvägen 30B Göteborg Sweden Targiniq 20 mg/10 mg comprimidos de 18
19 Suecia Mundipharma AB Mölndalsvägen 30B Göteborg Sweden Targiniq 5 mg/2,5 mg comprimidos de Suecia Mundipharma AB Mölndalsvägen 30B Göteborg Sweden Targiniq 40 mg/20 mg comprimidos de Países Bajos Mundipharma Pharmaceuticals B.V. De Wel 20, MV Hoevelaken 3871 The Netherlands Targinact 10 mg/5 mg comprimidos de Países Bajos Mundipharma Pharmaceuticals B.V. De Wel 20, MV Hoevelaken 3871 The Netherlands Targinact 20 mg/10 mg comprimidos de Países Bajos Mundipharma Pharmaceuticals B.V. De Wel 20, MV Hoevelaken 3871 The Netherlands Targinact 5 mg/2,5 mg comprimidos de 19
20 Países Bajos Mundipharma Pharmaceuticals B.V. De Wel 20, MV Hoevelaken 3871 The Netherlands Targinact 40 mg/20 mg comprimidos de Reino Unido Napp Pharmaceuticals Ltd. Cambridge Science Park Milton Road CB4 0GW United Kingdom Targinact 10 mg/5 mg comprimidos de Reino Unido Napp Pharmaceuticals Ltd. Cambridge Science Park Milton Road CB4 0GW United Kingdom Targinact 20 mg/10 mg comprimidos de Reino Unido Napp Pharmaceuticals Ltd. Cambridge Science Park Milton Road CB4 0GW United Kingdom Targinact 5 mg/2,5 mg comprimidos de Reino Unido Napp Pharmaceuticals Ltd. Cambridge Science Park Milton Road CB4 0GW United Kingdom Targinact 40 mg/20 mg comprimidos de 20
21 Anexo II Conclusiones científicas y motivos para la modificación de los términos de la autorización de 21
22 Conclusiones científicas Resumen general de la evaluación científica de Oxynal y Targin y denominaciones asociadas (ver anexo I) Información preliminar Oxynal 10 mg/5 mg, 20 mg/10 mg comprimidos de y Targin 5 mg/2,5 mg, 10 mg/5 mg, 20 mg/10 mg, 40 mg/20 mg comprimidos de y denominaciones asociadas (OXN PR) son s de combinación a dosis fijas que contienen clorhidrato de oxicodona y clorhidrato de naloxona. La indicación actual de OXN PR es «dolor intenso, que no puede controlarse adecuadamente solo con analgésicos opiáceos». El 31 de agosto de 2012, el TAC presentó una variación de tipo II mediante un procedimiento de reconocimiento mutuo (PRM) para Oxynal y Targin y denominaciones asociadas, solicitando que se incluyera la indicación «tratamiento sintomático en pacientes con síndrome de las piernas inquietas idiopático moderado o intenso insuficientemente controlado con terapia dopaminérgica». Durante el procedimiento de arbitraje del CMD(h), la indicación propuesta para el síndrome de las piernas inquietas se restringió a «tratamiento sintomático de segunda línea en pacientes con síndrome de las piernas inquietas idiopático intenso o muy intenso, cuando no ha dado resultado la terapia dopaminérgica». Como el de referencia y los s s afectados no lograron alcanzar un acuerdo respecto a la modificación, el 2 de mayo de 2014 Alemania inició un procedimiento de arbitraje conforme al artículo 13, apartado 2, del Reglamento CE nº 1234/2008. Basándose en las cuestiones planteadas por los Países Bajos, los puntos que debía tomar en consideración el CHMP eran los siguientes: 1. Hay una falta de pruebas que confirmen el mantenimiento de la eficacia y la seguridad a largo plazo, ya que estas no han sido aportadas por la fase de extensión abierta del estudio, dadas sus limitaciones metodológicas. No se han aportado pruebas científicas convincentes, desde el punto de vista de la salud pública, de que los beneficios de la combinación de dosis fijas de oxicodona/naloxona en el tratamiento del síndrome de las piernas inquietas idiopático (SPII) superen a los efectos adversos esperados del uso de opiáceos potentes en dosis equipotentes a la dosis de 90 mg de morfina : dependencia, síndrome de abstinencia, tolerancia, mal uso y abuso. 2. Los datos clínicos disponibles, procedentes de un solo ensayo fundamental de corta duración, se consideran insuficientes para valorar los riesgos. Por tanto, el solicitante debe aportar más justificaciones que los distintos criterios para la aprobación basados en un solo ensayo fundamental. Debate científico Eficacia Para demostrar la eficacia y seguridad de OXN PR en el tratamiento sintomático de pacientes con síndrome de las piernas inquietas idiopático moderado o intenso insuficientemente controlado con terapia dopaminérgica, el expediente de solicitud se basó en un estudio clínico fundamental en fase III (nº OXN 3502) y en la fase de extensión abierta del estudio (nº OXN 3502S). Los resultados del estudio clínico fundamental en fase III se consideraron sólidos y fiables por lo que respecta a los parámetros de eficacia principales y secundarios (que abordaron la intensidad y repercusiones de la enfermedad y la calidad de vida), a las tasas de respuesta al tratamiento y a los distintos análisis de subgrupos. 22
23 Incluso con un enfoque estadístico muy conservador, la magnitud del efecto (disminución media del SPII de 5,9 puntos comparado con placebo) fue similar o incluso ligeramente superior a los resultados obtenidos en los estudios controlados con placebo realizados con agonistas de la dopamina aprobados como primera línea de tratamiento. Por tanto, la eficacia a corto plazo de OXN PR como segunda línea de tratamiento del SPI intenso o muy intenso cuando no ha dado resultado el tratamiento dopaminérgico ha quedado demostrada de forma convincente en el estudio fundamental OXN3502. El mantenimiento de los efectos del tratamiento se investigó en una fase de extensión abierta del estudio fundamental. El 97 % de los pacientes que finalizaron el estudio controlado doble ciego participaron en la fase de extensión. Los resultados al final de la fase de extensión, en la semana 52, demostraron un aumento ligeramente mayor en la suma de las puntuaciones del SPII, comparado con los resultados finales de la fase doble ciego de 12 semanas. La puntuación media del SPII al final del estudio de extensión abierto fue de 9,72 y corresponde a una intensidad de los síntomas leve. El efecto del tratamiento durante la fase de extensión fue independiente del tratamiento recibido durante el estudio fundamental. Además, se observaron otras mejorías en la enfermedad de los pacientes al final de la fase de extensión, en comparación con el final de la fase doble ciego, en los parámetros de eficacia secundarios, como disminución de la intensidad de la enfermedad, mejora del sueño, dolor relacionado con el SPI y calidad de vida, respectivamente. El CHMP señaló que la dosis diaria media de OXN PR utilizada en la fase de extensión fue casi idéntica (e incluso ligeramente inferior) a la dosis diaria media utilizada durante la fase doble ciego (18,12 mg frente a 22,62 mg), sin diferencias en las dosis medias de la fase de extensión entre los subgrupos tratados previamente con OXN PR o placebo. El CHMP reconoció las limitaciones metodológicas del estudio abierto, pero consideró que el TAC aportaba justificaciones razonables para el mantenimiento del efecto hasta 52 semanas de tratamiento. El CHMP señaló que existen pruebas en la literatura científica de que el sistema opioideo endógeno está implicado en la patogenia del SPI a un nivel medular y supramedular y, por tanto, es un argumento plausible para justificar el uso de opiáceos en el tratamiento del SPI 1,2. Además, el CHMP destacó las necesidades médicas no cubiertas para el tratamiento del SPI intenso o muy intenso. Seguridad Se ha llevado a cabo una revisión detallada de los datos de seguridad del estudio doble ciego y de la fase de extensión abierta (OXN3502/S). La frecuencia de acontecimientos adversos y acontecimientos adversos relacionados con el tratamiento fue prácticamente comparable en ambas fases del estudio (OXN3502/S) y apuntaba a una mayor tolerabilidad de OXN PR en la fase de extensión. El perfil de seguridad también se consideró similar al observado para OXN PR en el tratamiento del dolor, donde también se comunican acontecimientos adversos con más frecuencia al inicio del tratamiento. No se observaron diferencias notables en la frecuencia de acontecimientos adversos, acontecimientos adversos intensos y acontecimientos adversos graves (en general y relacionados con el tratamiento) entre pacientes jóvenes y de edad avanzada, ni entre mujeres y hombres. 1 Walters AS et al. Successful treatment of the idiopathic restless legs syndrome in a randomized double-blind trial of oxycodone versus placebo. Sleep 1993; 16: Walters AS et al. The MU Opiate Receptor Knock-out Mouse Shows Increased Sensitivity to Pain, Increased Motor Activity During the Sleep Period and Decreased Serum Iron Parallel to Human Restless Legs Syndrome. Sleep 2011; 34: A
24 No se comunicaron casos de síntomas en aumento, tolerancia, dependencia psicológica (adicción), abuso o mal uso en los estudios OXN3502/S. La revisión de la «dependencia de opiáceos» reveló que durante la fase de extensión se recogieron dos informes de síntomas de abstinencia como parte de los procedimientos estándar de notificación de acontecimientos adversos. Además, 10 pacientes de 176 comunicaron signos de dependencia física a raíz de una visita de seguimiento específica 4 semanas después de finalizar la fase de extensión. Sin embargo, el protocolo no estipularon ajustes de dosis y en la mayoría de esos pacientes no se llevaron a cabo tales ajustes. Estos resultados concuerdan con los datos de farmacovigilancia para OXN PR en el tratamiento del dolor, donde la adicción y el consiguiente abuso se controlan cuidadosamente. El CHMP estuvo de acuerdo en que el riesgo de dependencia física y el síndrome de abstinencia asociado a ella pueden atenuarse y manejarse adecuadamente mediante la recomendación de seguir una estricta reducción de la dosis. Conforme a la experiencia y las directrices clínicas, el posible abuso y mal uso de los analgésicos opiáceos en el tratamiento de control del dolor se considera bajo. También se espera que, en comparación con otros opiáceos, las posibilidades de que OXN PR produzca dependencia psicológica y abuso sean bajas, dado que se trata de una formulación de y, según los conocimientos actualmente aceptados, el riesgo de dependencia psicológica aumenta cuanto más rápida es la del fármaco. Además, se espera que el riesgo de mal uso de OXN PR por vía parenteral o nasal por parte de personas dependientes de los agonistas opioideos sea bajo, ya que se esperan marcados síntomas de abstinencia debido al papel de la naloxona como antagonista de los receptores opioideos. En consecuencia, el CHMP aceptó que el uso de OXN PR en una formulación de de oxicodona y naloxona reduce el riesgo de abuso o mal uso. Además, a fin de aumentar aún más la seguridad y el uso adecuado de OXN PR en la indicación para el SPII, la dosis diaria máxima se ha limitado a 60 mg/día. El CHMP opina que la dosis diaria media de 20 mg/10 mg de clorhidrato de oxicodona/clorhidrato de naloxona utilizada en el estudio fundamental, y sustancialmente más baja que la dosis necesaria en la indicación para el dolor, debe mencionarse en el RCP como guía posológica. El tratamiento del SPI con OXN PR debe supervisarlo un médico con experiencia en el tratamiento del SPII. El tratamiento del SPI con OXN PR está contraindicado en personas con antecedentes de abuso de opiáceos. Se han añadido en la información sobre el advertencias relativas a la somnolencia/crisis de sueño y la capacidad para conducir/manejar maquinaria, de acuerdo con lo señalado en las correspondientes informaciones sobre el de las sustancias dopaminérgicas aprobadas en la indicación para el SPII. Además, se han propuesto respecto a la sección 4.2 del RCP instrucciones claras para reevaluar los beneficios y riesgos en pacientes con SPI de forma periódica (cada 3 meses) y plantearse un régimen de retirada mediante la disminución gradual de la dosis antes de que el tratamiento se prolongue más de 1 año. En la sección 4.4 del RCP se ha incluido la necesidad de una mayor precaución cuando OXN PR se administra a pacientes ancianos, sea cual sea la indicación. Como se solicitó durante el procedimiento del CMDh, el solicitante se ha comprometido además a realizar un estudio sobre el consumo del fármaco (DUS) y a actualizar el plan de gestión de riesgos (PGR) tras la aprobación del DUS, a fin de abordar los problemas derivados de las incertidumbres de 24
25 los datos del estudio clínico, a saber, que en la fase de extensión podría no estar totalmente caracterizado un posible riesgo de tolerancia, dependencia y abuso con el uso a largo plazo en el SPII. Conclusión El CHMP consideró que los datos presentados por el TAC eran suficientes para respaldar el uso de Oxynal y Targin y denominaciones asociadas en el tratamiento sintomático de segunda línea en pacientes con síndrome de las piernas inquietas idiopático intenso o muy intenso, cuando no ha dado resultado la terapia dopaminérgica. El CHMP también tuvo en cuenta los riesgos de dependencia yatrógena, abuso o mal uso del fármaco, síntomas en aumento, tolerancia y dependencia psicológica asociados al tratamiento con Oxynal y Targin y denominaciones asociadas. En general, el CHMP consideró que los beneficios de Oxynal y Targin y denominaciones asociadas en la indicación que se pretende sobrepasan los riesgos, teniendo en cuenta las medidas de minimización de riesgos ya acordadas con el CMD(h) y los cambios recomendados en la información sobre el. Motivos para la modificación de los términos de la autorización de con las modificaciones de las secciones relevantes del resumen de las características del Considerando que El Comité ha estudiado el procedimiento de conformidad con el artículo 13, apartado 2, del Reglamento nº 1234/2008. El Comité ha revisado todos los datos disponibles que respaldan la eficacia y seguridad de Oxynal y Targin y denominaciones asociadas en el «tratamiento sintomático de segunda línea en pacientes con síndrome de las piernas inquietas idiopático intenso o muy intenso, cuando no ha dado resultado la terapia dopaminérgica». El Comité ha considerado que los datos del estudio fundamental en fase III y la fase de extensión del estudio respaldan la eficacia a corto y largo plazo de Oxynal y Targin y denominaciones asociadas en el tratamiento sintomático de segunda línea en pacientes con síndrome de las piernas inquietas idiopático intenso o muy intenso, cuando no ha dado resultado la terapia dopaminérgica. El Comité ha considerado que las modificaciones en la información sobre el son adecuadas para atenuar el riesgo de dependencia yatrógena, abuso o mal uso del fármaco, síntomas en aumento, tolerancia y dependencia psicológica. También se llevará a cabo un estudio sobre el consumo de fármacos para caracterizar con más exactitud el riesgo de tolerancia, dependencia y abuso del fármaco con el uso a largo plazo en el síndrome de las piernas inquietas idiopático. El Comité ha concluido, a la vista de los datos disponibles, que la relación beneficio/riesgo de Oxynal y Targin y denominaciones asociadas en el «tratamiento sintomático de segunda línea en pacientes con síndrome de las piernas inquietas idiopático intenso o muy intenso, cuando no ha dado resultado la terapia dopaminérgica» es positiva. Por tanto, el Comité ha recomendado aceptar la modificación de los términos de las autorizaciones de para los medicamentos indicados en el anexo I, para los cuales quedan como versiones finales los resúmenes de las características del, el etiquetado y los prospectos que se alcanzaron durante el procedimiento del grupo de coordinación como se menciona Directive 2001/82/EC en el anexo III. 25
26 Anexo III Modificaciones en el resumen de las características del Nota: Estas modificaciones se deben incorporar a las versiones finales válidas del resumen de las características del, del etiquetado y del prospecto obtenidas durante el procedimiento del grupo de coordinación. 26
27 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 27
28 [ ] 4. DATOS CLÍNICOS [ ] 4.2 Posología y forma de [ ] Adultos [ ] [La redacción que aparece a continuación debe sustituir la redacción anterior] Se recomienda realizar un ajuste semanal en caso de que sea necesario utilizar dosis más altas. La dosis diaria media en el estudio pivotal fue de 20 mg/10 mg de clorhidrato de oxicodona/clorhidrato de naloxona. Algunos pacientes se pueden beneficiar de dosis diarias más altas hasta un máximo de 60 mg/30 mg de oxicodona. [ ] 28
Anexo II. Conclusiones científicas y motivos para la modificación de los términos de la autorización de comercialización
 Anexo II Conclusiones científicas y motivos para la modificación de los términos de la autorización de comercialización 21 Conclusiones científicas Resumen general de la evaluación científica de Oxynal
Anexo II Conclusiones científicas y motivos para la modificación de los términos de la autorización de comercialización 21 Conclusiones científicas Resumen general de la evaluación científica de Oxynal
Denominación (de fantasía) Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé
 Anexo I Lista de las denominaciones (de fantasía), forma farmacéutica, dosis de los medicamentos, forma de administración, solicitantes/titulares de la autorización de comercialización en los Estados Miembros
Anexo I Lista de las denominaciones (de fantasía), forma farmacéutica, dosis de los medicamentos, forma de administración, solicitantes/titulares de la autorización de comercialización en los Estados Miembros
Clavulanic acid 10 mg. Dosis convencional de 10 mg de amoxicilina/2,5 mg de ácido clavulánico por kg de peso en vivo República Checa
 Anexo I Relación de los nombres, formas farmacéuticas y dosis de los medicamentos veterinarios, y de las especies de destino, vías de administración y solicitantes o titulares de la autorización de comercialización
Anexo I Relación de los nombres, formas farmacéuticas y dosis de los medicamentos veterinarios, y de las especies de destino, vías de administración y solicitantes o titulares de la autorización de comercialización
Marca de fantasía Dosis Forma farmacéutica Vía de administración. comercialización
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN, TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 Estado Miembro Titular de la
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN, TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 Estado Miembro Titular de la
Titular de la autorización de comercialización
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMAS FARMACÉUTICAS, DOSIS, VÍAS DE ADMINISTRACIÓN, TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 Estado miembro Alemania
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMAS FARMACÉUTICAS, DOSIS, VÍAS DE ADMINISTRACIÓN, TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 Estado miembro Alemania
NOMBRE, FORMA FARMACÉUTICA, DOSIS DEL MEDICAMENTO, ESPECIES DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
 ANEXO I NOMBRE, FORMA FARMACÉUTICA, DOSIS DEL MEDICAMENTO, ESPECIES DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN 1/7 Estado miembro Solicitante o titular de la autorización
ANEXO I NOMBRE, FORMA FARMACÉUTICA, DOSIS DEL MEDICAMENTO, ESPECIES DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN 1/7 Estado miembro Solicitante o titular de la autorización
Totana, viernes, 29 de noviembre de 2013 SERGIO BUENDÍA GÁLVEZ 2
 2 Puede prevalecer la SEGURIDAD frente al DISEÑO? Qué sucede en otros sectores productivos en los que la seguridad del trabajador se ve comprometida por riesgos graves o muy graves? 3 FERRARI F150-ITALIA
2 Puede prevalecer la SEGURIDAD frente al DISEÑO? Qué sucede en otros sectores productivos en los que la seguridad del trabajador se ve comprometida por riesgos graves o muy graves? 3 FERRARI F150-ITALIA
Anexo II. Conclusiones científicas
 Anexo II Conclusiones científicas 7 Conclusiones científicas Solu-Medrol 40 mg polvo y disolvente para solución inyectable (en adelante, «Solu-Medrol») contiene metilprednisolona y, como excipiente, lactosa
Anexo II Conclusiones científicas 7 Conclusiones científicas Solu-Medrol 40 mg polvo y disolvente para solución inyectable (en adelante, «Solu-Medrol») contiene metilprednisolona y, como excipiente, lactosa
Conclusiones científicas
 Anexo II Conclusiones científicas y motivos para la revocación o modificación de los términos de las autorizaciones de comercialización y explicación detallada de las diferencias de la recomendación del
Anexo II Conclusiones científicas y motivos para la revocación o modificación de los términos de las autorizaciones de comercialización y explicación detallada de las diferencias de la recomendación del
Anexo I. Relación de los nombres del medicamento, forma farmacéutica, dosis, vía de administración y solicitante en los estados miembros
 Anexo I Relación de los nombres del medicamento, forma farmacéutica, dosis, vía de administración y solicitante en los estados miembros 1 Estado miembro UE/EEE Solicitante nombre de compañía, dirección
Anexo I Relación de los nombres del medicamento, forma farmacéutica, dosis, vía de administración y solicitante en los estados miembros 1 Estado miembro UE/EEE Solicitante nombre de compañía, dirección
Forma farmacéutica. Liofilizado para solución para inyección o perfusión. Polvo para solución para inyección. 2g/250 mg
 ANEXO I Relación de los nombres del medicamento, formas farmacéuticas, dosis, vías de administración, titulares de la en los estados s 1 Austria Bélgica Pfizer Corporation Austria Ges.m.b.H Floridsdorfer
ANEXO I Relación de los nombres del medicamento, formas farmacéuticas, dosis, vías de administración, titulares de la en los estados s 1 Austria Bélgica Pfizer Corporation Austria Ges.m.b.H Floridsdorfer
Titular de la autorización de comercialización Sanofi-Synthelabo S.A. Avenue de la Métrologie Bruxelles Belgium.
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN, TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS CHMP/309507/2007 1/6 EMEA 2007
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN, TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS CHMP/309507/2007 1/6 EMEA 2007
fantasia) Nombre Actocalcio D3 35 mg mg/880 IU Acrelcombi 35 mg mg/880 IU Fortipan Combi D 35 mg mg/880 IU
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1
ANEXO I. EMEA/CVMP/495339/2007-ES Noviembre de /10
 ANEXO I NOMBRE, FORMA FARMACÉUTICA Y DOSIS DE LOS MEDICAMENTOS, ESPECIES DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR/SOLICITANTE DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EMEA/CVMP/495339/2007-ES Noviembre
ANEXO I NOMBRE, FORMA FARMACÉUTICA Y DOSIS DE LOS MEDICAMENTOS, ESPECIES DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR/SOLICITANTE DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EMEA/CVMP/495339/2007-ES Noviembre
POBLACIÓN EN JEREZ DE LA FRONTERA, SEGÚN PROCEDENCIA Nacidos en España Nacidos en la misma Comunidad Nacidos en la misma
 POBLACIÓN EN JEREZ DE LA FRONTERA, SEGÚN PROCEDENCIA Nacidos en España 2011 203.431 Nacidos en la misma Comunidad 2011 191.725 Nacidos en la misma Comunidad y en la misma provincia 2011 179.709 Nacidos
POBLACIÓN EN JEREZ DE LA FRONTERA, SEGÚN PROCEDENCIA Nacidos en España 2011 203.431 Nacidos en la misma Comunidad 2011 191.725 Nacidos en la misma Comunidad y en la misma provincia 2011 179.709 Nacidos
ANEXO I NOMBRE, FORMA FARMACÉUTICA, DOSIS DEL MEDICAMENTO, ESPECIE DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
 ANEXO I NOMBRE, FORMA FARMACÉUTICA, DOSIS DEL MEDICAMENTO, ESPECIE DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN 1/7 Solicitante o titular de la autorización de comercialización
ANEXO I NOMBRE, FORMA FARMACÉUTICA, DOSIS DEL MEDICAMENTO, ESPECIE DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN 1/7 Solicitante o titular de la autorización de comercialización
NOMBRE, FORMA FARMACÉUTICA Y DOSIS DE LOS MEDICAMENTOS, ESPECIES ANIMALES, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
 ANEXO I NOMBRE, FORMA FARMACÉUTICA Y DOSIS DE LOS MEDICAMENTOS, ESPECIES ANIMALES, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EMEA/CVMP/166766/2006-ES Mayo de 2006 1/7 Estado
ANEXO I NOMBRE, FORMA FARMACÉUTICA Y DOSIS DE LOS MEDICAMENTOS, ESPECIES ANIMALES, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EMEA/CVMP/166766/2006-ES Mayo de 2006 1/7 Estado
L 90/106 Diario Oficial de la Unión Europea
 L 90/106 Diario Oficial de la Unión Europea 28.3.2013 DECISIÓN DE LA COMISIÓN de 26 de marzo de 2013 por la que se determinan las asignaciones anuales de emisiones de los Estados miembros para el período
L 90/106 Diario Oficial de la Unión Europea 28.3.2013 DECISIÓN DE LA COMISIÓN de 26 de marzo de 2013 por la que se determinan las asignaciones anuales de emisiones de los Estados miembros para el período
Anexo I. Lista de medicamentos autorizados a nivel nacional y solicitudes de autorización de comercialización
 Anexo I Lista de medicamentos autorizados a nivel nacional y solicitudes de autorización de 1 Anexo IA: Medicamentos recomendados para el mantenimiento y las solicitudes de autorización de para las que
Anexo I Lista de medicamentos autorizados a nivel nacional y solicitudes de autorización de 1 Anexo IA: Medicamentos recomendados para el mantenimiento y las solicitudes de autorización de para las que
ANEXO I. EMEA/CVMP/269630/2006-ES Julio /7
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMAS FARMACEUTICAS, ESPECIES ANIMALES, VÍA DE ADMINISTRACIÓN Y TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS EMEA/CVMP/269630/2006-ES
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMAS FARMACEUTICAS, ESPECIES ANIMALES, VÍA DE ADMINISTRACIÓN Y TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS EMEA/CVMP/269630/2006-ES
Anexo II. Conclusiones científicas y motivos de la denegación presentados por la Agencia Europea de Medicamentos
 Anexo II Conclusiones científicas y motivos de la denegación presentados por la Agencia Europea de Medicamentos 4 Conclusiones científicas Resumen general de la evaluación científica de Furosemide Vitabalans
Anexo II Conclusiones científicas y motivos de la denegación presentados por la Agencia Europea de Medicamentos 4 Conclusiones científicas Resumen general de la evaluación científica de Furosemide Vitabalans
Resumen general de la evaluación científica de los medicamentos que contienen nimesulida para uso sistémico (Ver Anexo I)
 Anexo II Conclusiones científicas y motivos de la modificación de los resúmenes de las características del producto y los prospectos presentados por la EMA 41 Conclusiones científicas Resumen general de
Anexo II Conclusiones científicas y motivos de la modificación de los resúmenes de las características del producto y los prospectos presentados por la EMA 41 Conclusiones científicas Resumen general de
Nombre de fantasía. Tavanic 250 mg Filmtabletten. Tavanic 500 mg Filmtabletten. Tavanic Infusionsflasche. Tavanic 250 mg filmomhulde tabletten
 Anexo I Lista de nombres, formas s, dosis de los medicamentos, vías de, Titulares de la en los Estados Miembros 1 Austria Austria Austria Bulgaria GmbH Leonard-Bernstein- Straße 10, A-1220 Vienna GmbH
Anexo I Lista de nombres, formas s, dosis de los medicamentos, vías de, Titulares de la en los Estados Miembros 1 Austria Austria Austria Bulgaria GmbH Leonard-Bernstein- Straße 10, A-1220 Vienna GmbH
NOMBRE, FORMA FARMACÉUTICA, DOSIS DEL MEDICAMENTO, ESPECIES DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
 ANEXO I NOMBRE, FORMA FARMACÉUTICA, DOSIS DEL MEDICAMENTO, ESPECIES DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN 1/7 Solicitante o titular de la autorización de comercialización
ANEXO I NOMBRE, FORMA FARMACÉUTICA, DOSIS DEL MEDICAMENTO, ESPECIES DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN 1/7 Solicitante o titular de la autorización de comercialización
AYUDA ECONÓMICA PARA BENEFICIARIOS BECA ERASMUS+ CURSO 2015/16
 AYUDA ECONÓMICA PARA BENEFICIARIOS BECA ERASMUS+ CURSO 2015/16 ORGANISMOS FINANCIADORES Servicio Español para la Internacionalización de la Educación (SEPIE). Secretaría del Estado del Ministerio de Educación,
AYUDA ECONÓMICA PARA BENEFICIARIOS BECA ERASMUS+ CURSO 2015/16 ORGANISMOS FINANCIADORES Servicio Español para la Internacionalización de la Educación (SEPIE). Secretaría del Estado del Ministerio de Educación,
Anexo II. Conclusiones científicas y motivos para la modificación de los términos de la autorización de comercialización
 Anexo II Conclusiones científicas y motivos para la modificación de los términos de la autorización de comercialización 8 Conclusiones científicas Resumen general de la evaluación científica de Nasonex
Anexo II Conclusiones científicas y motivos para la modificación de los términos de la autorización de comercialización 8 Conclusiones científicas Resumen general de la evaluación científica de Nasonex
ENCUESTA DE FUERZAS DE TRABAJO UNION EUROPEA (EFT)
 (EFT) EFT-1. EFT-2. EFT-3. EFT-4. EFT-5A. EFT-5B. EFT-6A. EFT-6B. EFT-7A. EFT-7B. EFT-8A. EFT-8B. EFT-9A. EFT-9B. EFT-10. EFT-11. EFT-12. EFT-13. Población de 15 y más años en los países de la Unión Europea,
(EFT) EFT-1. EFT-2. EFT-3. EFT-4. EFT-5A. EFT-5B. EFT-6A. EFT-6B. EFT-7A. EFT-7B. EFT-8A. EFT-8B. EFT-9A. EFT-9B. EFT-10. EFT-11. EFT-12. EFT-13. Población de 15 y más años en los países de la Unión Europea,
Garantía Yamaha para los altavoces activos de la serie DSR en el Espacio Económico Europeo (EEE)* y Suiza
 Garantía Yamaha para los altavoces activos de la serie DSR en el Espacio Económico Europeo (EEE)* y Suiza Estimado cliente, Gracias por haber escogido los altavoces activos DSR de Yamaha. Esperamos que
Garantía Yamaha para los altavoces activos de la serie DSR en el Espacio Económico Europeo (EEE)* y Suiza Estimado cliente, Gracias por haber escogido los altavoces activos DSR de Yamaha. Esperamos que
fantasía Priligy 30 mg Filmtabletten Priligy 60 mg Filmtabletten Priligy 30 mg filmomhulde tablet Priligy 60 mg filmomhulde tablet
 ANEXO I LISTA DE LOS NOMBRES, FORMA FARMACÉUTICA, DOSIS DE LOS MEDICAMENTOS, VÍA DE ADMINISTRACIÓN, SOLICITANTES/TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 Austria Janssen-Cilag
ANEXO I LISTA DE LOS NOMBRES, FORMA FARMACÉUTICA, DOSIS DE LOS MEDICAMENTOS, VÍA DE ADMINISTRACIÓN, SOLICITANTES/TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 Austria Janssen-Cilag
REGLAMENTO DE EJECUCIÓN (UE) 2017/1272 DE LA COMISIÓN
 15.7.2017 L 184/5 REGLAMENTO DE EJECUCIÓN (UE) 2017/1272 DE LA COMISIÓN de 14 de julio de 2017 por el que se establecen los límites máximos presupuestarios aplicables en 2017 a determinados regímenes de
15.7.2017 L 184/5 REGLAMENTO DE EJECUCIÓN (UE) 2017/1272 DE LA COMISIÓN de 14 de julio de 2017 por el que se establecen los límites máximos presupuestarios aplicables en 2017 a determinados regímenes de
Anexo II. Conclusiones científicas
 Anexo II Conclusiones científicas 13 Conclusiones científicas Haldol, que contiene el principio activo haloperidol, es un antipsicótico que pertenece al grupo de las butirofenonas. Es un potente antagonista
Anexo II Conclusiones científicas 13 Conclusiones científicas Haldol, que contiene el principio activo haloperidol, es un antipsicótico que pertenece al grupo de las butirofenonas. Es un potente antagonista
Protección Social en la Unión Europea (PSE)
 Protección Social en la Unión Europea (PSE) PSE-01. Ingresos y gastos de protección social por países. Valores absolutos. PSE-02. Ingresos y gastos de protección social por países. Tasas de variación.
Protección Social en la Unión Europea (PSE) PSE-01. Ingresos y gastos de protección social por países. Valores absolutos. PSE-02. Ingresos y gastos de protección social por países. Tasas de variación.
Encuesta de Fuerzas de Trabajo Unión Europea (EFT)
 Encuesta de Fuerzas de Trabajo Unión Europea (EFT) EFT-01. EFT-02. EFT-03. EFT-04. EFT-05A. EFT-05B. EFT-06A. EFT-06B. EFT-07A. EFT-07B. EFT-08A. EFT-08B. EFT-09A. EFT-09B. EFT-10. EFT-11. EFT-12. EFT-13.
Encuesta de Fuerzas de Trabajo Unión Europea (EFT) EFT-01. EFT-02. EFT-03. EFT-04. EFT-05A. EFT-05B. EFT-06A. EFT-06B. EFT-07A. EFT-07B. EFT-08A. EFT-08B. EFT-09A. EFT-09B. EFT-10. EFT-11. EFT-12. EFT-13.
Propuesta de DECISIÓN DEL CONSEJO. por la que se determina la composición del Comité Económico y Social
 COMISIÓN EUROPEA Bruselas, 11.6.2014 COM(2014) 227 final 2014/0129 (NLE) Propuesta de DECISIÓN DEL CONSEJO por la que se determina la composición del Comité Económico y Social ES ES EXPOSICIÓN DE MOTIVOS
COMISIÓN EUROPEA Bruselas, 11.6.2014 COM(2014) 227 final 2014/0129 (NLE) Propuesta de DECISIÓN DEL CONSEJO por la que se determina la composición del Comité Económico y Social ES ES EXPOSICIÓN DE MOTIVOS
Estado Miembro UE/EEE. Titular de la autorización de comercialización. Nombre Dosis Forma farmacéutica Vía de administración Contenido (Concentración)
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado
Nombre de fantasía Dosis Forma farmacéutica Vía de administración Scutamil C 150 mg carisoprodol/ Comprimidos. comercialización
 ANEXO I RELACION DE LOS NOMBRES DEL MEDICAMENTO, FORMAS FARMACEUTICAS, DOSIS, VIAS DE ADMINISTRACION, Y TITULARES DE AUTORIZACION DE COMERCIALIZACION EN LOS ESTADOS MIEMBROS. 1 Estado miembro Republica
ANEXO I RELACION DE LOS NOMBRES DEL MEDICAMENTO, FORMAS FARMACEUTICAS, DOSIS, VIAS DE ADMINISTRACION, Y TITULARES DE AUTORIZACION DE COMERCIALIZACION EN LOS ESTADOS MIEMBROS. 1 Estado miembro Republica
EVALUACIÓN DE LA CONFORMIDAD LA CERTIFICACIÓN DE PERSONAS
 EVALUACIÓN DE LA CONFORMIDAD LA CERTIFICACIÓN DE PERSONAS Pedro Pablo Morillas Bravo Responsable de Calidad de Laboratorios Canal de Isabel II Evaluador CERPER EVALUACIÓN DE LA CONFORMIDAD ACREDITACIÓN
EVALUACIÓN DE LA CONFORMIDAD LA CERTIFICACIÓN DE PERSONAS Pedro Pablo Morillas Bravo Responsable de Calidad de Laboratorios Canal de Isabel II Evaluador CERPER EVALUACIÓN DE LA CONFORMIDAD ACREDITACIÓN
Encuesta de Fuerzas de Trabajo Unión Europea (EFT)
 Encuesta de Fuerzas de Trabajo Unión Europea (EFT) EFT-01. EFT-02. EFT-03. EFT-04. EFT-05A. EFT-05B. EFT-06A. EFT-06B. EFT-07A. EFT-07B. EFT-08A. EFT-08B. EFT-09A. EFT-09B. EFT-10. EFT-11. EFT-12. EFT-13.
Encuesta de Fuerzas de Trabajo Unión Europea (EFT) EFT-01. EFT-02. EFT-03. EFT-04. EFT-05A. EFT-05B. EFT-06A. EFT-06B. EFT-07A. EFT-07B. EFT-08A. EFT-08B. EFT-09A. EFT-09B. EFT-10. EFT-11. EFT-12. EFT-13.
Anexo II. Conclusiones científicas
 Anexo II Conclusiones científicas 5 Conclusiones científicas Vale Pharmaceuticals presentó al Reino Unido una solicitud de autorización de comercialización, con arreglo al procedimiento descentralizado,
Anexo II Conclusiones científicas 5 Conclusiones científicas Vale Pharmaceuticals presentó al Reino Unido una solicitud de autorización de comercialización, con arreglo al procedimiento descentralizado,
ÍNDICE. Protección Social en los países de la Unión Europea en términos SEEPROS (PSE)
 ÍNDICE Protección Social en los países de la Unión Europea en términos SEEPROS (PSE) CUADROS PSE-01. Ingresos y gastos de protección social, en términos SEEPROS. Valores absolutos PSE-02. Ingresos y gastos
ÍNDICE Protección Social en los países de la Unión Europea en términos SEEPROS (PSE) CUADROS PSE-01. Ingresos y gastos de protección social, en términos SEEPROS. Valores absolutos PSE-02. Ingresos y gastos
MURCIA (Región de) - TOTAL ESTABLECIMIENTOS HOTELEROS
 3. Evolución del número de entrados y pernoctaciones en establecimientos hoteleros según país de residencia. 2016 2015 2014 TOTAL 1.219.281 3.036.300 1.100.370 2.753.987 1.094.380 2.719.537 Residentes
3. Evolución del número de entrados y pernoctaciones en establecimientos hoteleros según país de residencia. 2016 2015 2014 TOTAL 1.219.281 3.036.300 1.100.370 2.753.987 1.094.380 2.719.537 Residentes
Datos estadísticos de la UE y el mundo
 Datos estadísticos de la UE y el mundo Statistics data of EU and the world 59 Principales países productores 217 Main manufacturing countries 217 China 29.15.434 +3,2% USA 11.189.985-8,1% Japón/Japan 9.693.746
Datos estadísticos de la UE y el mundo Statistics data of EU and the world 59 Principales países productores 217 Main manufacturing countries 217 China 29.15.434 +3,2% USA 11.189.985-8,1% Japón/Japan 9.693.746
L 192/4 Diario Oficial de la Unión Europea
 L 192/4 Diario Oficial de la Unión Europea 24.7.2007 REGLAMENTO (CE) N o 866/2007 DEL CONSEJO de 23 de julio de 2007 por el que se modifica el Reglamento (CE) n o 234/2004 relativo a determinadas medidas
L 192/4 Diario Oficial de la Unión Europea 24.7.2007 REGLAMENTO (CE) N o 866/2007 DEL CONSEJO de 23 de julio de 2007 por el que se modifica el Reglamento (CE) n o 234/2004 relativo a determinadas medidas
Nombre. Lansoprazol TEVA 15 mg Kapseln Lansoprazol TEVA 30 mg Kapseln
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado
Conclusiones científicas
 ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO, EL ETIQUETADO Y EL PROSPECTO PRESENTADOS POR LA AGENCIA EUROPEA DE MEDICAMENTOS 15 Conclusiones
ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO, EL ETIQUETADO Y EL PROSPECTO PRESENTADOS POR LA AGENCIA EUROPEA DE MEDICAMENTOS 15 Conclusiones
Forma farmacéutica Vía de administración. Contenido (Concentración) Estado miembro. Nombre. Dinamarca. Vantas 50 mg Implante Subcutánea 50 mg
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN, SOLICITANTE, TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado miembro Dinamarca
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN, SOLICITANTE, TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado miembro Dinamarca
Anexo IV. Conclusiones científicas
 Anexo IV Conclusiones científicas 1 Conclusiones científicas Se han notificado cuatro casos de lesión hepática grave que condujo a un trasplante hepático desde la autorización de comercialización de Esmya.
Anexo IV Conclusiones científicas 1 Conclusiones científicas Se han notificado cuatro casos de lesión hepática grave que condujo a un trasplante hepático desde la autorización de comercialización de Esmya.
CONVOCATORIA DE AYUDAS FINANCIERAS PARA EXPERIENCIAS DE MOVILIDAD ERASMUS + EN EMPRESAS INTERNACIONALES ES01-KA
 CONVOCATORIA DE AYUDAS FINANCIERAS PARA EXPERIENCIAS DE MOVILIDAD ERASMUS + EN EMPRESAS INTERNACIONALES 2018-1-ES01-KA102-048414 CONVOCATORIA ORDINARIA FCTs FORMACIÓN PROFESIONAL BÁSICA Y GRADO MEDIO Curso
CONVOCATORIA DE AYUDAS FINANCIERAS PARA EXPERIENCIAS DE MOVILIDAD ERASMUS + EN EMPRESAS INTERNACIONALES 2018-1-ES01-KA102-048414 CONVOCATORIA ORDINARIA FCTs FORMACIÓN PROFESIONAL BÁSICA Y GRADO MEDIO Curso
DECISIÓN DE EJECUCIÓN DE LA COMISIÓN. de
 COMISIÓN EUROPEA Bruselas, 29.4.2014 C(2014) 2727 final DECISIÓN DE EJECUCIÓN DE LA COMISIÓN de 29.4.2014 por la que se modifica la Decisión nº C(2010)1620 final de la Comisión, de 19 de marzo de 2010,
COMISIÓN EUROPEA Bruselas, 29.4.2014 C(2014) 2727 final DECISIÓN DE EJECUCIÓN DE LA COMISIÓN de 29.4.2014 por la que se modifica la Decisión nº C(2010)1620 final de la Comisión, de 19 de marzo de 2010,
SOLICITUD DE INFORMACIÓN relativa al desplazamiento transnacional de trabajadores en el marco de una prestación de servicios
 FORMULARIO PARA SU UTILIZACIÓN (FACULTATIVA) POR LA ADMINISTRACIÓN SOLICITANTE SOLICITUD DE INFORMACIÓN relativa al desplazamiento transnacional de trabajadores en el marco de una prestación de servicios
FORMULARIO PARA SU UTILIZACIÓN (FACULTATIVA) POR LA ADMINISTRACIÓN SOLICITANTE SOLICITUD DE INFORMACIÓN relativa al desplazamiento transnacional de trabajadores en el marco de una prestación de servicios
H1. LA COMPARACIÓN INTERNACIONAL
 H1.0. Contenido, notas explicativas y fuentes de información Se presenta en este capítulo la situación de la educación de nuestro país en relación a los demás países, a través de una selección de indicadores
H1.0. Contenido, notas explicativas y fuentes de información Se presenta en este capítulo la situación de la educación de nuestro país en relación a los demás países, a través de una selección de indicadores
Propuesta de DECISIÓN DEL CONSEJO. por la que se determina la composición del Comité de las Regiones
 COMISIÓN EUROPEA Bruselas, 11.6.2014 COM(2014) 226 final 2014/0128 (NLE) Propuesta de DECISIÓN DEL CONSEJO por la que se determina la composición del Comité de las Regiones ES ES EXPOSICIÓN DE MOTIVOS
COMISIÓN EUROPEA Bruselas, 11.6.2014 COM(2014) 226 final 2014/0128 (NLE) Propuesta de DECISIÓN DEL CONSEJO por la que se determina la composición del Comité de las Regiones ES ES EXPOSICIÓN DE MOTIVOS
Nombre. Vertimen 8 mg Tabletten. Vertimen 16 mg Tabletten. Vertisan 16 mg Таблетка. Vertisan 8 mg Tableta 8 mg Comprimido Vía oral
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1
Medicamentos que contienen dextropropoxifeno con autorización de comercialización en la Unión Europea. Dosis/dextropropoxifeno/ paracetamol/cafeína
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMAS FARMACÉUTICAS, DOSIS, VÍA DE ADMINISTRACIÓN Y TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 Medicamentos que contienen
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMAS FARMACÉUTICAS, DOSIS, VÍA DE ADMINISTRACIÓN Y TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 Medicamentos que contienen
Pharmaceutical form. inyectable. inyectable
 ANEXO I MARCA, FORMA FARMACÉUTICA, CONCENTRACIÓN, ESPECIES A LAS QUE VA DESTINADO EL MEDICAMENTO, VÍA DE ADMINISTRACIÓN, TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Austria Wyeth Lederle Pharma GmbH,
ANEXO I MARCA, FORMA FARMACÉUTICA, CONCENTRACIÓN, ESPECIES A LAS QUE VA DESTINADO EL MEDICAMENTO, VÍA DE ADMINISTRACIÓN, TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Austria Wyeth Lederle Pharma GmbH,
Fibra Óptica. Producto Fecha Actualización Antes Ahora
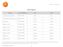 Fibra Óptica Producto Fecha Actualización Antes Ahora Tarifa Plana Empresa Euskadi Noviembre 2007 10 /mes 7 /mes Tarifa Plana Empresa Interprovincial Noviembre 2007 18 /mes 13 /mes Despega 12 M Noviembre
Fibra Óptica Producto Fecha Actualización Antes Ahora Tarifa Plana Empresa Euskadi Noviembre 2007 10 /mes 7 /mes Tarifa Plana Empresa Interprovincial Noviembre 2007 18 /mes 13 /mes Despega 12 M Noviembre
L 168/26 Diario Oficial de la Unión Europea
 L 168/26 Diario Oficial de la Unión Europea 28.6.2012 REGLAMENTO DE EJECUCIÓN (UE) N o 564/2012 DE LA COMISIÓN de 27 de junio de 2012 por el que se establecen los límites máximos presupuestarios aplicables
L 168/26 Diario Oficial de la Unión Europea 28.6.2012 REGLAMENTO DE EJECUCIÓN (UE) N o 564/2012 DE LA COMISIÓN de 27 de junio de 2012 por el que se establecen los límites máximos presupuestarios aplicables
Ayudas Erasmus para participantes en el programa con Necesidades Especiales
 Ayudas Erasmus + 2014-15 para participantes en el programa con Necesidades Especiales DEFINICIÓN Y REQUISITOS Una persona con necesidades especiales es un participante potencial cuya situación física,
Ayudas Erasmus + 2014-15 para participantes en el programa con Necesidades Especiales DEFINICIÓN Y REQUISITOS Una persona con necesidades especiales es un participante potencial cuya situación física,
9281/17 jrb/jrb/psm 1 DG B 1C - DG G 1A
 Consejo de la Unión Europea Bruselas, 12 de junio de 2017 (OR. en) 9281/17 NOTA De: Secretaría General del Consejo ECOFIN 390 UEM 139 SOC 369 EMPL 284 COMPET 387 ENV 486 EDUC 214 RECH 170 ENER 209 JAI
Consejo de la Unión Europea Bruselas, 12 de junio de 2017 (OR. en) 9281/17 NOTA De: Secretaría General del Consejo ECOFIN 390 UEM 139 SOC 369 EMPL 284 COMPET 387 ENV 486 EDUC 214 RECH 170 ENER 209 JAI
ANEXO CONCLUSIONES CIENTÍFICAS Y MOTIVOS DE LA DENEGACIÓN PRESENTADOS POR LA EMEA
 ANEXO CONCLUSIONES CIENTÍFICAS Y MOTIVOS DE LA DENEGACIÓN PRESENTADOS POR LA EMEA CONCLUSIONES CIENTÍFICAS RESUMEN GENERAL DE LA EVALUACIÓN CIENTÍFICA DE LYRICA El titular de la autorización de comercialización
ANEXO CONCLUSIONES CIENTÍFICAS Y MOTIVOS DE LA DENEGACIÓN PRESENTADOS POR LA EMEA CONCLUSIONES CIENTÍFICAS RESUMEN GENERAL DE LA EVALUACIÓN CIENTÍFICA DE LYRICA El titular de la autorización de comercialización
Acceso y sostenibilidad Cómo alcanzar el equilibrio?
 Acceso y sostenibilidad Cómo alcanzar el equilibrio? Federico Plaza Piñol Director Government Affairs, Roche 27 de noviembre de 2014 La sostenibilidad del SNS está vinculada a la situación macroeconómica
Acceso y sostenibilidad Cómo alcanzar el equilibrio? Federico Plaza Piñol Director Government Affairs, Roche 27 de noviembre de 2014 La sostenibilidad del SNS está vinculada a la situación macroeconómica
Nº y año del exped. CONSEJERÍA DE ECONOMÍA Y CONOCIMIENTO. Referencia
 CONSEJERÍA DE ECONOMÍA Y CONOCIMIENTO Nº y año del exped. Referencia DENOMINACIÓN: ACUERDO DE 25 DE ABRIL DE 2017, DEL CONSEJO DE GOBIERNO, POR EL QUE SE TOMA CONOCIMIENTO DE LA ORDEN DEL CONSEJERO DE
CONSEJERÍA DE ECONOMÍA Y CONOCIMIENTO Nº y año del exped. Referencia DENOMINACIÓN: ACUERDO DE 25 DE ABRIL DE 2017, DEL CONSEJO DE GOBIERNO, POR EL QUE SE TOMA CONOCIMIENTO DE LA ORDEN DEL CONSEJERO DE
EL EFECTO PISA : MÁS ALLÁ DE LA METODOLOGÍA Y DE LA COMPARACIÓN
 EL EFECTO PISA : MÁS ALLÁ DE LA METODOLOGÍA Y DE LA COMPARACIÓN Francisco Javier García Crespo javier.gcrespo@mecd.es Cursos de Verano del Escorial 2017 10 Julio 2017 PISA Ciencias Resultados España tiene
EL EFECTO PISA : MÁS ALLÁ DE LA METODOLOGÍA Y DE LA COMPARACIÓN Francisco Javier García Crespo javier.gcrespo@mecd.es Cursos de Verano del Escorial 2017 10 Julio 2017 PISA Ciencias Resultados España tiene
LA CRISIS EN GIPUZKOA Y LA UNIÓN EUROPEA
 > Diciembre de 2009 LA CRISIS EN GIPUZKOA Y LA UNIÓN EUROPEA Presentación A lo largo de 2009 la incidencia de la crisis económica en Gipuzkoa, al igual que en el conjunto de los territorios desarrollados
> Diciembre de 2009 LA CRISIS EN GIPUZKOA Y LA UNIÓN EUROPEA Presentación A lo largo de 2009 la incidencia de la crisis económica en Gipuzkoa, al igual que en el conjunto de los territorios desarrollados
CUOTA ANUAL PARA LA REGIÓN EUROPEA
 CUOTA ANUAL PARA LA REGIÓN EUROPEA Documento 5 La cuota anual ha sido de 40 euros por cada país Miembro. Los ingresos procedentes de las cuotas de afiliación han ascendido a unos 1.100 euros al año. Sin
CUOTA ANUAL PARA LA REGIÓN EUROPEA Documento 5 La cuota anual ha sido de 40 euros por cada país Miembro. Los ingresos procedentes de las cuotas de afiliación han ascendido a unos 1.100 euros al año. Sin
1) Movilidad de estudiantes para estudios hacia países del programa
 MINISTERIO DE EDUCACIÓN, CULTURA Y DEPORTE Unidad de Educación Superior ERASMUS+ CONVOCATORIA 2016 ACCIÓN CLAVE 1: MOVILIDAD DE LAS PERSONAS POR MOTIVOS DE APRENDIZAJE IMPORTES DE LAS AYUDAS DE LA MOVILIDAD
MINISTERIO DE EDUCACIÓN, CULTURA Y DEPORTE Unidad de Educación Superior ERASMUS+ CONVOCATORIA 2016 ACCIÓN CLAVE 1: MOVILIDAD DE LAS PERSONAS POR MOTIVOS DE APRENDIZAJE IMPORTES DE LAS AYUDAS DE LA MOVILIDAD
ANEXO. del. informe de la Comisión al Parlamento Europeo y al Consejo
 COMISIÓN EUROPEA Bruselas, 17.5.2017 COM(2017) 242 final ANNEX 1 ANEXO del informe de la Comisión al Parlamento Europeo y al Consejo relativo al examen de la aplicación práctica del documento europeo único
COMISIÓN EUROPEA Bruselas, 17.5.2017 COM(2017) 242 final ANNEX 1 ANEXO del informe de la Comisión al Parlamento Europeo y al Consejo relativo al examen de la aplicación práctica del documento europeo único
Mayo de 2014 La tasa de desempleo en la zona del euro es del 11,8 % El 10,3 % en la EU-28
 STAT//103-1 de julio de 20 Mayo de 20 La tasa de desempleo en la zona del euro es del 11,8 % El 10,3 % en la EU-28 La tasa de desempleo 1 de la zona del euro 2 (18 Estados miembros) ajustada estacionalmente
STAT//103-1 de julio de 20 Mayo de 20 La tasa de desempleo en la zona del euro es del 11,8 % El 10,3 % en la EU-28 La tasa de desempleo 1 de la zona del euro 2 (18 Estados miembros) ajustada estacionalmente
Propuesta de DECISIÓN DEL CONSEJO
 COMISIÓN EUROPEA Bruselas, 8.12.2014 COM(2014) 721 final 2014/0345 (NLE) Propuesta de DECISIÓN DEL CONSEJO por la que se autoriza a Austria, Bélgica y Polonia a ratificar o a adherirse al Convenio de Budapest
COMISIÓN EUROPEA Bruselas, 8.12.2014 COM(2014) 721 final 2014/0345 (NLE) Propuesta de DECISIÓN DEL CONSEJO por la que se autoriza a Austria, Bélgica y Polonia a ratificar o a adherirse al Convenio de Budapest
DIRECTRICES PARA LA RESOLUCIÓN DE VARIACIONES DE ADECUACIÓN AL RD 1345/2007 Y OTRAS VARIACIONES COEXISTENTES EN EL TIEMPO
 DIRECTRICES PARA LA RESOLUCIÓN DE VARIACIONES DE ADECUACIÓN AL RD 1345/2007 Y OTRAS VARIACIONES COEXISTENTES EN EL TIEMPO Antecedentes 21 de mayo de 2010 La Disposición transitoria tercera del Real Decreto
DIRECTRICES PARA LA RESOLUCIÓN DE VARIACIONES DE ADECUACIÓN AL RD 1345/2007 Y OTRAS VARIACIONES COEXISTENTES EN EL TIEMPO Antecedentes 21 de mayo de 2010 La Disposición transitoria tercera del Real Decreto
1. ALOJAMIENTO Y MANUTENCIÓN
 Anexo VI Normas y niveles aplicables al cálculo de la subvención En 2011- ESPAÑA Esta sección contiene las normas y niveles aplicables al cálculo de la subvención en cumplimiento con la Convocatoria General
Anexo VI Normas y niveles aplicables al cálculo de la subvención En 2011- ESPAÑA Esta sección contiene las normas y niveles aplicables al cálculo de la subvención en cumplimiento con la Convocatoria General
ÍNDICE AGRADECIMIENTOS LA EUROPA MULTICULTURAL Introducción
 ÍNDICE AGRADECIMIENTOS... 17 LA EUROPA MULTICULTURAL... 19 Introducción 1. Unas notas acerca del protocolo... 25 1.1. Orígenes... 25 1.2. Definición... 29 1.3. Utilidad e Importancia... 31 1.4. Tipos de
ÍNDICE AGRADECIMIENTOS... 17 LA EUROPA MULTICULTURAL... 19 Introducción 1. Unas notas acerca del protocolo... 25 1.1. Orígenes... 25 1.2. Definición... 29 1.3. Utilidad e Importancia... 31 1.4. Tipos de
(Texto pertinente a efectos del EEE)
 L 118/18 DECISIÓN DE EJECUCIÓN (UE) 2018/704 DE LA COMISIÓN de 8 de mayo de 2018 relativa a la conformidad de las tarifas unitarias para las zonas de tarificación con los Reglamentos de Ejecución (UE)
L 118/18 DECISIÓN DE EJECUCIÓN (UE) 2018/704 DE LA COMISIÓN de 8 de mayo de 2018 relativa a la conformidad de las tarifas unitarias para las zonas de tarificación con los Reglamentos de Ejecución (UE)
Introducción. Sobre usted
 Consulta para la evaluación del Reglamento (CE) 2679/98 de 7 diciembre 1998 sobre el funcionamiento del mercado interior en relación con la libre circulación de mercancías entre los Estados Miembros. Los
Consulta para la evaluación del Reglamento (CE) 2679/98 de 7 diciembre 1998 sobre el funcionamiento del mercado interior en relación con la libre circulación de mercancías entre los Estados Miembros. Los
Estado Miembro UE/EEE. Marca de fantasía Dosis Forma farmacéutica Vía de administración. Titular de la autorización de comercialización
 ANEXO I LISTA DE LOS NOMBRES, FORMAS FARMACÉUTICAS, DOSIS DEL MEDICAMENTO, VÍAS DE ADMINISTRACIÓN, TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 Estado Miembro UE/EEE Austria
ANEXO I LISTA DE LOS NOMBRES, FORMAS FARMACÉUTICAS, DOSIS DEL MEDICAMENTO, VÍAS DE ADMINISTRACIÓN, TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 Estado Miembro UE/EEE Austria
DECLARACIONES CONJUNTAS DE LAS PRESENTES PARTES CONTRATANTES Y DE LAS NUEVAS PARTES CONTRATANTES EN EL ACUERDO
 DECLARACIONES CONJUNTAS DE LAS PRESENTES PARTES CONTRATANTES Y DE LAS NUEVAS PARTES CONTRATANTES EN EL ACUERDO AF/EEE/BG/RO/DC/es 1 SOBRE LA PRONTA RATIFICACIÓN DEL ACUERDO SOBRE LA PARTICIPACIÓN DE LA
DECLARACIONES CONJUNTAS DE LAS PRESENTES PARTES CONTRATANTES Y DE LAS NUEVAS PARTES CONTRATANTES EN EL ACUERDO AF/EEE/BG/RO/DC/es 1 SOBRE LA PRONTA RATIFICACIÓN DEL ACUERDO SOBRE LA PARTICIPACIÓN DE LA
CONSEJO EUROPEO Bruselas, 31de mayo de 2013 (OR. en)
 CONSEJO EUROPEO Bruselas, 31de mayo de 2013 (OR. en) Expediente interinstitucional: 2013/0900 (NLE) EUCO 110/13 INST 234 POLGEN 69 OC 295 ACTOS JURÍDICOS Asunto: PROYECTO DE DECISIÓN DEL CONSEJO EUROPEO
CONSEJO EUROPEO Bruselas, 31de mayo de 2013 (OR. en) Expediente interinstitucional: 2013/0900 (NLE) EUCO 110/13 INST 234 POLGEN 69 OC 295 ACTOS JURÍDICOS Asunto: PROYECTO DE DECISIÓN DEL CONSEJO EUROPEO
La educación y el contexto social
 22/0/2017 La educación y el contexto social Mag. Gerardo García Oro Investigador IERAL de Fundación Mediterránea Córdoba, 22 de Mayo de 2017 1 La importancia de la educación para aliviar inequidades sociales
22/0/2017 La educación y el contexto social Mag. Gerardo García Oro Investigador IERAL de Fundación Mediterránea Córdoba, 22 de Mayo de 2017 1 La importancia de la educación para aliviar inequidades sociales
EDUCACIÓN SUPERIOR DATOS Y CIFRAS ERASMUS 2012/2013. Jornadas de Movilidad Erasmus+ de Educación Superior
 DATOS Y CIFRAS ERASMUS 2012/2013 Jornadas de Movilidad Erasmus+ de Educación Superior PAÍSES PARTICIPANTES Durante el año académico 2012-13, han participado en el Programa 33 países: los 27 miembros de
DATOS Y CIFRAS ERASMUS 2012/2013 Jornadas de Movilidad Erasmus+ de Educación Superior PAÍSES PARTICIPANTES Durante el año académico 2012-13, han participado en el Programa 33 países: los 27 miembros de
Coste de vida en Europa
 Coste de vida en Europa La guía se divide en dos secciones, en la primera se encuentra los niveles de precios analizados por Europa. En la segunda, figuran los datos facilitados por el índice de análisis
Coste de vida en Europa La guía se divide en dos secciones, en la primera se encuentra los niveles de precios analizados por Europa. En la segunda, figuran los datos facilitados por el índice de análisis
COMUNICACIÓN DE LA COMISIÓN
 COMISIÓN EUROPEA Bruselas, 17.9.2014 C(2014) 6767 final COMUNICACIÓN DE LA COMISIÓN Actualización de los datos para calcular las sumas a tanto alzado y las multas coercitivas que propondrá la Comisión
COMISIÓN EUROPEA Bruselas, 17.9.2014 C(2014) 6767 final COMUNICACIÓN DE LA COMISIÓN Actualización de los datos para calcular las sumas a tanto alzado y las multas coercitivas que propondrá la Comisión
LOS AJUSTES RAZONABLES EN
 LOS AJUSTES RAZONABLES EN LAUE: LUCES Y SOMBRAS DE SU IMPLEMENTACIÓN EN LOS ESTADOS MIEMBROS Maoly Carrasquero Investigadora del Instituto de Estudios Europeos de la Universidad de Valladolid ESTADO DE
LOS AJUSTES RAZONABLES EN LAUE: LUCES Y SOMBRAS DE SU IMPLEMENTACIÓN EN LOS ESTADOS MIEMBROS Maoly Carrasquero Investigadora del Instituto de Estudios Europeos de la Universidad de Valladolid ESTADO DE
H1. LA COMPARACIÓN INTERNACIONAL
 H1.0. Contenido, notas explicativas y fuentes de información Se presenta en este capítulo la situación de la educación de nuestro país en relación a los demás países, a través de una selección de indicadores
H1.0. Contenido, notas explicativas y fuentes de información Se presenta en este capítulo la situación de la educación de nuestro país en relación a los demás países, a través de una selección de indicadores
Encuesta de Fuerzas de Trabajo Unión Europea (EFT)
 Encuesta de Fuerzas de Trabajo Unión Europea (EFT) EFT-01. EFT-02. EFT-03. EFT-04. EFT-05A. EFT-05B. EFT-06A. EFT-06B. EFT-07A. EFT-07B. EFT-08A. EFT-08B. EFT-09A. EFT-09B. EFT-10. EFT-11. EFT-12. EFT-13.
Encuesta de Fuerzas de Trabajo Unión Europea (EFT) EFT-01. EFT-02. EFT-03. EFT-04. EFT-05A. EFT-05B. EFT-06A. EFT-06B. EFT-07A. EFT-07B. EFT-08A. EFT-08B. EFT-09A. EFT-09B. EFT-10. EFT-11. EFT-12. EFT-13.
COMUNICACIÓN DE LA COMISIÓN AL CONSEJO. Información financiera sobre el Fondo Europeo de Desarrollo
 COMISIÓN EUROPEA Bruselas, 15.6.2018 COM(2018) 475 final COMUNICACIÓN DE LA COMISIÓN AL CONSEJO Información financiera sobre el Fondo Europeo de Desarrollo Fondo Europeo de Desarrollo (FED): previsiones
COMISIÓN EUROPEA Bruselas, 15.6.2018 COM(2018) 475 final COMUNICACIÓN DE LA COMISIÓN AL CONSEJO Información financiera sobre el Fondo Europeo de Desarrollo Fondo Europeo de Desarrollo (FED): previsiones
Contenido (concentración) Vía de administración. Estado miembro UE/EEE Bélgica. farmacéutica. fantasía) Nombre Dexamethasone Alapis
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado
Erasmus+ Convocatoria 2017
 Erasmus+ Convocatoria 2017 INFORMACIÓN SOBRE FINANCIACIÓN EN PROYECTOS KA1 y KA2 Todos los sectores educativos 1. INTRODUCCIÓN Este documento aporta información financiera a tener en cuenta por las instituciones
Erasmus+ Convocatoria 2017 INFORMACIÓN SOBRE FINANCIACIÓN EN PROYECTOS KA1 y KA2 Todos los sectores educativos 1. INTRODUCCIÓN Este documento aporta información financiera a tener en cuenta por las instituciones
Garantía para la serie Installation de YAMAHA En el Espacio Económico Europeo (EEE)* y Suiza
 Garantía para la serie Installation de YAMAHA En el Espacio Económico Europeo (EEE)* y Suiza Estimado cliente, Gracias por haber escogido la serie Installation de Yamaha. Esperamos que quede totalmente
Garantía para la serie Installation de YAMAHA En el Espacio Económico Europeo (EEE)* y Suiza Estimado cliente, Gracias por haber escogido la serie Installation de Yamaha. Esperamos que quede totalmente
Pensiones Sostenibles y Suficientes
 Pensiones Sostenibles y Suficientes Jose Ignacio Conde-Ruiz (FEDEA y Universidad Complutense) Universidad Internacional de la Rioja, UNIR 1 Noviembre, 2017 Papers J. Ignacio Conde-Ruiz (2017) Medidas para
Pensiones Sostenibles y Suficientes Jose Ignacio Conde-Ruiz (FEDEA y Universidad Complutense) Universidad Internacional de la Rioja, UNIR 1 Noviembre, 2017 Papers J. Ignacio Conde-Ruiz (2017) Medidas para
LA FISCALIDAD EN LA UNIÓN EUROPEA
 > Setiembre de 2010 LA FISCALIDAD EN LA UNIÓN EUROPEA > La presión fiscal en la Unión Europea, 39,3% del PIB, se mantiene por encima de la de Estados Unidos y Japón El informe de Eurostat Taxation trends
> Setiembre de 2010 LA FISCALIDAD EN LA UNIÓN EUROPEA > La presión fiscal en la Unión Europea, 39,3% del PIB, se mantiene por encima de la de Estados Unidos y Japón El informe de Eurostat Taxation trends
Puede que solamente estén comercializados algunos tamaños de envases.
 aplicador (cubierta exterior de polipropileno, palanca de polioximetileno y boquilla de elastómero termoplástico) se ensamblan antes del primer uso. La tapa de polipropileno es para la conservación después
aplicador (cubierta exterior de polipropileno, palanca de polioximetileno y boquilla de elastómero termoplástico) se ensamblan antes del primer uso. La tapa de polipropileno es para la conservación después
Garantía para los productos seleccionados de etapas de potencia y control de amplificadores en el Espacio Económico Europeo (EEE)* y Suiza
 Garantía para los productos seleccionados de etapas de potencia y control de amplificadores en el Espacio Económico Europeo (EEE)* y Suiza Estimado cliente, Gracias por haber escogido un producto Yamaha.
Garantía para los productos seleccionados de etapas de potencia y control de amplificadores en el Espacio Económico Europeo (EEE)* y Suiza Estimado cliente, Gracias por haber escogido un producto Yamaha.
Rs7. Rs7.4. Tasa de graduados superiores en ciencias, matemáticas y tecnología. Sistema estatal de indicadores de la educación 2007
 .4. Tasa de graduados superiores en ciencias, matemáticas y tecnología Proporción de graduados en ciencias, matemáticas y tecnología por cada 1 habitantes con edades comprendidas entre los 2 y 29 años
.4. Tasa de graduados superiores en ciencias, matemáticas y tecnología Proporción de graduados en ciencias, matemáticas y tecnología por cada 1 habitantes con edades comprendidas entre los 2 y 29 años
Fibra Óptica. Producto Fecha Actualización Antes Después. Despega 12 M Noviembre 2007 75 /mes (87 IVA inc.) 49 /mes (56,84 IVA inc.
 Fibra Óptica Producto Fecha Actualización Antes Después Despega 12 M Noviembre 2007 75 /mes (87 IVA inc.) 49 /mes (56,84 IVA inc.) Despega 12 M 1IP Noviembre 2007 87 /mes (100,92 IVA inc.) 61 /mes (70,76
Fibra Óptica Producto Fecha Actualización Antes Después Despega 12 M Noviembre 2007 75 /mes (87 IVA inc.) 49 /mes (56,84 IVA inc.) Despega 12 M 1IP Noviembre 2007 87 /mes (100,92 IVA inc.) 61 /mes (70,76
Estado miembro EU/EEA. Titular de la autorización de comercialización. Vía de administración. Nombre. farmacéutica
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN Y TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 Estado miembro EU/EEA Titular
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN Y TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 Estado miembro EU/EEA Titular
REGLAMENTO DELEGADO (UE) /... DE LA COMISIÓN. de
 COMISIÓN EUROPEA Bruselas, 7.7.2016 C(2016) 4164 final REGLAMENTO DELEGADO (UE) /... DE LA COMISIÓN de 7.7.2016 sobre la revisión del baremo aplicable a las misiones de los funcionarios y otros agentes
COMISIÓN EUROPEA Bruselas, 7.7.2016 C(2016) 4164 final REGLAMENTO DELEGADO (UE) /... DE LA COMISIÓN de 7.7.2016 sobre la revisión del baremo aplicable a las misiones de los funcionarios y otros agentes
