Guía para profesionales sanitarios LEMTRADA. Información importante de seguridad. (alemtuzumab)
|
|
|
- Juan Luis Jesús Sandoval Escobar
- hace 6 años
- Vistas:
Transcripción
1 LEMTRADA (alemtuzumab) Guía para profesionales sanitarios Información importante de seguridad Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de reacciones adversas asociadas a este medicamento. Material informativo autorizado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) MARZO 2014
2 2 Resumen Descripción general LEMTRADA (alemtuzumab) está indicado en pacientes adultos con esclerosis múltiple remitente recurrente (EMRR) con enfermedad activa definida por manifestaciones clínicas o detectadas por resonancia magnética. Este material está dirigido a los profesionales sanitarios para proporcionar información adicional sobre los posibles riesgos graves asociados al uso de alemtuzumab, que incluyen: Enfermedades autoinmunes, incluidas: > púrpura trombocitopénica inmune (PTI), > nefropatías, incluida la enfermedad anti-membrana basal glomerular (anti-mbg), > trastornos de tiroides Infecciones Esta guía proporciona recomendaciones importantes sobre cómo minimizar estos riesgos mediante un adecuado asesoramiento, monitorización y manejo del paciente. Tenga en cuenta que esta guía no cubre todos los riesgos asociados al uso de LEMTRADA (alemtuzumab) y no sustituye a la Ficha Técnica (disponible en Recuerde que debe notificar cualquier sospecha de reacción adversa al Sistema Español de Farmacovigilancia a través del Centro Autonómico de Farmacovigilancia correspondiente mediante el sistema de Tarjeta Amarilla. Estas notificaciones también podrán realizarse on-line a través del siguiente enlace: ASEGÚRESE DE QUE SUS PACIENTES HAN SIDO INFORMADOS Y COMPRENDEN LOS RIESGOS ASOCIADOS AL TRATAMIENTO CON LEMTRADA Y LAS MEDIDAS PARA REDUCIRLOS Resumen de la monitorización recomendada Afección Actividad Calendario Púrpura trombocitopénica inmune (PTI) Recuento sanguíneo completo con fórmula leucocitaria completa Antes del inicio del tratamiento con LEMTRADA Mensualmente hasta 48 meses después de la última perfusión Nefropatías, incluida la enfermedad anti-mbg Creatinina en suero Antes del inicio del tratamiento con LEMTRADA Mensualmente hasta 48 meses después de la última perfusión Nefropatías, incluida la enfermedad anti-mbg Análisis de orina con microscopía Antes del inicio del tratamiento con LEMTRADA Mensualmente hasta 48 meses después de la última perfusión Trastornos de tiroides Pruebas de función tiroidea (p. ej. TSH) Antes del inicio del tratamiento con LEMTRADA Cada 3 meses hasta 48 meses después de la última perfusión
3 Índice 1> Introducción 04 2> Riesgos importantes asociados al uso de LEMTRADA (alemtuzumab) 06 Enfermedades autoinmunes Infecciones 3> Resumen de la monitorización recomendada 11 4> Manejo de los pacientes tratados con LEMTRADA (alemtuzumab) 12 5> Otra información 13 Vacunas Embarazo y lactancia Reacciones asociadas a la perfusión (RAP) Premedicación Puedo prescribir LEMTRADA (alemtuzumab) a pacientes que están recibiendo otros tratamientos para la EM? 3
4 1> Introducción LEMTRADA (alemtuzumab) es un anticuerpo monoclonal administrado por vía intravenosa. Se une a CD52, un antígeno presente en grandes cantidades en la superficie de los linfocitos T y B, y en menores cantidades en células natural killer, monocitos y macrófagos. No está totalmente claro el mecanismo mediante el cual LEMTRADA (alemtuzumab) ejerce sus efectos terapéuticos en la EM. La investigación sugiere efectos inmunomoduladores por medio de la depleción y la repoblación de linfocitos, incluidos los siguientes: > Alteraciones en el número, las proporciones y las propiedades de algunos grupos de linfocitos tras el tratamiento. > Aumento de la representación de los grupos de linfocitos T reguladores. > Aumento de la representación de linfocitos T y B de memoria. > Efectos transitorios sobre los componentes de la inmunidad innata (es decir, neutrófilos, macrófagos, células natural killer). La reducción del nivel de células B y T circulantes que se obtiene con alemtuzumab y la posterior repoblación podrían explicar el efecto terapéutico. 4 El uso de alemtuzumab ha estado asociado con el riesgo de infecciones graves y enfermedades autoinmunes. Las reacciones autoinmunes pueden darse muchos años después del tratamiento y pueden ser graves o suponer un riesgo para la vida. Con el fin de minimizar los posibles riesgos y efectos adversos, debe monitorizarse a los pacientes desde el inicio del tratamiento hasta 48 meses después de la última perfusión de LEMTRADA (alemtuzumab). Es importante que los pacientes entiendan que deben continuar con la monitorización, incluso si se sienten bien y la EM está bien controlada. Es muy importante que los pacientes: > Cumplan periódicamente con las analíticas previstas. > Identifiquen y notifiquen síntomas de manera temprana. > Reciban, en caso necesario, un tratamiento rápido y apropiado. Para ello será necesaria la colaboración entre usted, su paciente y su equipo de atención médica, junto con una revisión cuidadosa sobre cómo utilizar el material informativo para el paciente.
5 Resumen del tratamiento con LEMTRADA Antes del tratamiento análisis de sangre y orina Curso de tratamiento 1 Curso de tratamiento 2 Análisis mensuales de sangre y orina hasta 4 años después de la última perfusión Tratamiento de 5 días Tratamiento de 3 días Año 1 Año 2 Año 3 Año 4 Año 5 NOTA: Para NOTE la mayoría For most de patients, los pacientes, 2 courses 2 cursos work for funcionarán 2 years or longer. durante 2 años o más. TRATAMIENTO SUPERVISIÓN 5
6 2> Riesgos importantes asociados al uso de LEMTRADA (alemtuzumab) Esta información no incluye todos los riesgos. Consulte el perfil completo de seguridad en la ficha técnica adjunta o disponible en Enfermedades autoinmunes El uso de alemtuzumab está asociado a un riesgo de enfermedades autoinmunes, incluidas las siguientes: > Púrpura trombocitopénica inmune (PTI). > Trastornos de tiroides. > Nefropatías, incluida la enfermedad anti-membrana basal glomerular (anti-mbg). Estos acontecimientos pueden ser graves y provocar morbilidad y/o mortalidad. Pueden aparecer muchos años después del tratamiento. Una detección precoz puede mejorar el resultado de los pacientes que sufren estos acontecimientos. Es importante monitorizar los valores de las pruebas de laboratorio y estar atentos ante la aparición de signos y síntomas. 6 Púrpura trombocitopénica inmune (PTI) La púrpura trombocitopénica inmune (PTI) es un trastorno autoinmune normalmente asociado con anticuerpos antiplaquetarios. La depleción de las plaquetas reduce la capacidad de coagulación de la sangre. La aparición de PTI normalmente se ha dado entre 14 y 36 meses después de la primera administración de alemtuzumab. Es importante detectar y tratar casos potenciales de PTI lo antes posible. Informe a los pacientes sobre los posibles signos y síntomas para que sean capaces de reconocerlos. Signos y síntomas Pueden incluir (pero sin limitarse a estos): > Tendencia a la formación de hematomas. > Petequias. > Sangrado mucocutáneo espontáneo (epistaxis, hemoptisis). Recuerde que la hemoptisis también puede ser signo de una enfermedad anti-mgb. > Sangrado menstrual irregular o más abundante de lo normal. Estos signos clínicos de PTI pueden ser evidentes antes de desarrollar una hemorragia grave.
7 Monitorización de los pacientes: > Recuentos sanguíneos completos con fórmula leucocitaria completa: - Antes de iniciar el tratamiento. - Mensualmente hasta 48 meses después de la última perfusión. > Síntomas clínicos de PTI: - Reconocimiento del paciente. - Informar al paciente y ayudarle a identificarlos. Hacer hincapié en la necesidad de permanecer atento a su aparición. Puede ayudarse del material informativo para pacientes. > Insista al paciente sobre la importancia de cumplir con la monitorización sanguínea mensual desde el inicio del tratamiento hasta 48 meses después de su última perfusión. Si se sospecha de PTI, se debe iniciar inmediatamente la intervención médica adecuada, incluida la derivación inmediata a un especialista. Una hemorragia intensa o generalizada supone un riesgo para la vida y requiere atención inmediata. Se desconoce el riesgo potencial asociado con el retratamiento con alemtuzumab después de la aparición de PTI. 7
8 Nefropatías, incluida la enfermedad anti-membrana basal glomerular (enfermedad anti-mbg) Se han notificado nefropatías, incluida la enfermedad anti-mbg, tras el tratamiento con alemtuzumab que normalmente ocurrieron en los 39 meses siguientes a la última administración. Signos y síntomas Pueden incluir: > Elevación de la creatinina en suero. > Hematuria. > Proteinuria. > Puede producirse hemorragia alveolar con la enfermedad anti-mbg, manifestada como hemoptisis (recuerde que la hemoptisis también puede ser un síntoma de PTI). Monitorización Teniendo en cuenta que los pacientes pueden ser asintomáticos, es importante realizar analíticas periódicamente. 8 > Creatinina en suero: - Antes de iniciar el tratamiento. - Mensualmente hasta 48 meses después de la última perfusión. > Análisis de orina con microscopía: - Antes de iniciar el tratamiento. - Mensualmente hasta 48 meses después de la última perfusión. - Después, las pruebas deben realizarse en base a los hallazgos clínicos sugestivos de nefropatías. A la hora de programar el análisis de orina, tenga en cuenta si las mujeres tienen la menstruación, para evitar falsos positivos. La observación de cambios clínicamente significativos respecto al nivel basal de creatinina en suero, hematuria sin explicación y/o proteinuria requiere una rápida evaluación adicional. Ante la sospecha de nefropatía, derive inmediatamente al paciente a un especialista para una evaluación adicional. La detección y el tratamiento tempranos de las nefropatías pueden reducir el riesgo de resultados desfavorables.
9 La enfermedad anti-mbg supone una amenaza para la vida si no se trata y, por lo tanto, requiere atención inmediata. Si no se inicia un tratamiento con celeridad, los pacientes pueden desarrollar rápidamente insuficiencia renal, necesitando diálisis y/o trasplante, y podría provocar la muerte. Trastornos de tiroides Los trastornos tiroideos (hipo- e hipertiroidismo) fueron muy frecuentes en los ensayos clínicos, la mayoría fue de intensidad leve a moderada y se produjeron durante los 48 meses posteriores a la primera exposición a alemtuzumab. La mayoría fueron tratados con tratamiento médico convencional, aunque algunos pacientes requirieron intervención quirúrgica. Es importante hacer saber al paciente que, dependiendo de la afección tiroidea, puede necesitar un tratamiento para toda la vida (p. ej.: como ocurre con el hipotiroidismo). Monitorización > Pruebas de función tiroidea, como los niveles de la hormona estimulante del tiroides (TSH): - Antes de iniciar el tratamiento. - Trimestralmente durante los 48 meses posteriores a la última perfusión. - Tras este período, deben realizarse en base a los hallazgos clínicos que sugieran una disfunción del tiroides. 9 > Esté atento a la presencia de signos y síntomas de trastornos de tiroides. Enfermedad tiroidea y embarazo La enfermedad tiroidea supone riesgos especiales en mujeres que se quedan embarazadas. Las enfermedades tiroideas no tratadas pueden provocar abortos o daños en el feto y en el bebé recién nacido (como discapacidad intelectual o enanismo). Se debe tener especial cuidado en el caso de mujeres embarazadas con la enfermedad de Basedow (también conocida como enfermedad de Graves), ya que los anticuerpos del receptor de la hormona materna estimulante del tiroides se pueden pasar al feto en desarrollo y provocar temporalmente la enfermedad de Basedow neonatal. El ginecólogo de la paciente debe tener conocimiento del mayor riesgo de trastornos de tiroides debido al tratamiento de la paciente con alemtuzumab, así como de la necesitad de estas pacientes de recibir un tratamiento adecuado.
10 Infecciones El tratamiento con alemtuzumab aumenta el riesgo de infecciones. Estas fueron muy frecuentes en los ensayos clínicos y pueden llegar a ser graves. Informe a los pacientes sobre los posibles signos y síntomas de infección para que sean capaces de reconocerlos. Antes de iniciar el tratamiento se recomienda: > Descartar infección activa. En caso de infección activa considere retrasar el inicio del tratamiento hasta que esté totalmente controlada. > Descartar tuberculosis activa o latente según la normativa local. > Identificar a los pacientes portadores del VHC y/o VHB, debido al riesgo de reactivación del virus y sus posibles consecuencias (daño hepático irreversible). > Medición de anticuerpos del virus varicela-zoster (VVZ). Considere vacunar a los pacientes con resultado negativo (y retrasar 6 semanas el tratamiento desde la vacunación). Durante el tratamiento: > Esté atento a la presencia de signos y síntomas de infecciones. 10 > Se recomienda un cribado anual para el virus del papiloma humano (VPH).
11 3> Resumen de la monitorización recomendada Asegúrese de consultar la sección Contraindicaciones de la Ficha Técnica adjunta antes de iniciar el tratamiento con LEMTRADA (alemtuzumab). Afección Actividad Calendario Púrpura trombocitopénica inmune (PTI) Recuento sanguíneo completo con fórmula leucocitaria completa Antes del inicio del tratamiento con LEMTRADA Mensualmente hasta 48 meses después de la última perfusión Nefropatías, incluida la enfermedad anti- MBG Creatinina en suero Antes del inicio del tratamiento con LEMTRADA Mensualmente hasta 48 meses después de la última perfusión Nefropatías, incluida la enfermedad anti- MBG Análisis de orina con microscopía Antes del inicio del tratamiento con LEMTRADA Mensualmente hasta 48 meses después de la última perfusión 11 Trastornos de tiroides Pruebas de función tiroidea (p. ej. TSH) Antes del inicio del tratamiento con LEMTRADA Cada 3 meses hasta 48 meses después de la última perfusión Como medida de apoyo para recordar a sus pacientes las citas mensuales para la monitorización, se le puede proporcionar un calendario con adhesivos para señalar las fechas de sus análisis. Valore la necesidad de proporcionar este recordatorio a sus pacientes.
12 4> Manejo de los pacientes tratados con LEMTRADA (alemtuzumab) > Informe al paciente sobre los riesgos y beneficios del tratamiento. > Es sumamente importante que su paciente entienda el compromiso de someterse a analíticas de sangre y orina mensuales hasta 48 meses después de la última perfusión, incluso en el caso de que no muestre síntomas y su EM esté bien controlada. > Debe planificar y gestionar junto con su paciente la monitorización periódica. Ayúdele a no olvidar sus citas (mediante alarmas, calendarios ). > Los pacientes no cumplidores pueden necesitar asesoramiento adicional para resaltar los riesgos que suponen saltarse las pruebas de laboratorio programadas. > Debe monitorizar los resultados de sus pruebas y permanecer atento a la presencia de síntomas de efectos adversos. > Explique al paciente los signos y síntomas a los que debe prestar atención, e indíquele los casos en los que debe buscar atención médica. Revise con él la Guía del paciente y el prospecto de LEMTRADA. 12 > Anime al paciente a que lleve consigo la Tarjeta de Paciente en todo momento. Debe mostrar la tarjeta a cualquier profesional sanitario que le trate por cualquier motivo o en caso de urgencia médica. > Deben estar disponibles los especialistas y el equipo necesarios para un rápido diagnóstico y manejo de las reacciones adversas más frecuentes, especialmente las relacionadas con las enfermedades autoinmunes y las infecciones.
13 5> Otra información Vacunas > Es recomendable que los pacientes estén al día de sus vacunas (de acuerdo con las directrices nacionales) al menos 6 semanas antes de comenzar el tratamiento con alemtuzumab. > No se ha estudiado la seguridad de la inmunización con vacunas vivas atenuadas después del tratamiento con alemtuzumab. No se deben administrar este tipo de vacunas a pacientes que hayan recibido recientemente un curso de tratamiento con LEMTRADA (alemtuzumab). > Antes del tratamiento con alemtuzumab, considere la vacunación contra el virus VVZ en pacientes negativos para el anticuerpo (6 semanas antes del tratamiento). Embarazo y lactancia Consulte la sección 4.6 de la ficha técnica. > Las mujeres en edad fértil deben utilizar métodos anticonceptivos eficaces durante el tratamiento con alemtuzumab y durante los 4 meses posteriores a cada curso de tratamiento. > La enfermedad tiroidea implica riesgos especiales en las mujeres embarazadas (consulte la sección 2, Trastornos de tiroides). > Se desconoce si alemtuzumab se excreta a la leche materna. Reacciones asociadas a la perfusión (RAP) 13 Pueden producirse reacciones asociadas a la perfusión (RAP) durante la administración del medicamento y en las siguientes 24 horas. Se recomienda: > Administrar premedicación a los pacientes. > Observación durante las 2 horas posteriores a la perfusión. > Conocer el historial cardiaco del paciente ya que puede incluir síntomas como taquicardia. Si aparece una RAP: > Proporcione el tratamiento sintomático adecuado. > Se puede extender la duración de la perfusión. > Si se producen RAP graves, considere la interrupción inmediata de la perfusión intravenosa. Pueden darse casos de anafilaxia o reacciones graves que precisen la interrupción del tratamiento. Debe haber recursos disponibles para tratar las reacciones graves o de anafilaxia.
14 Premedicación A todos los pacientes: > Corticosteroides inmediatamente antes de la administración de alemtuzumab en cada uno de los 3 primeros días de cualquier curso de tratamiento (1 000 mg de metilprednisolona o equivalente). > Profilaxis oral para la infección por herpes durante el tratamiento y hasta 1 mes después del tratamiento como mínimo (aciclovir 200 mg/12.h o equivalente). Adicionalmente: > Antihistamínicos y/o antipiréticos. Puedo prescribir LEMTRADA (alemtuzumab) a pacientes que están recibiendo otros tratamientos para la EM? Alemtuzumab no se ha administrado para el tratamiento de la EM de forma concomitante o después de tratamientos antineoplásicos o inmunosupresores. Al igual que ocurre con otros tratamientos inmunomoduladores, se deben tener en cuenta los posibles efectos combinados sobre el sistema inmunológico del paciente cuando se considere la administración de alemtuzumab. Su uso concomitante con cualquier otro tratamiento podría aumentar el riesgo de inmunosupresión. 14
15 Notas 15
16 Ver ficha técnica adjunta en documento aparte. GZES.LEMT Junio 2016
Comunicación dirigida a profesionales sanitarios
 Comunicación dirigida a profesionales sanitarios Tecfidera (dimetilfumarato): Nuevas recomendaciones para minimizar el riesgo de leucoencefalopatía multifocal progresiva. Intensificación de las medidas
Comunicación dirigida a profesionales sanitarios Tecfidera (dimetilfumarato): Nuevas recomendaciones para minimizar el riesgo de leucoencefalopatía multifocal progresiva. Intensificación de las medidas
Información importante de seguridad. Material informativo autorizado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) MARZO 2014
 LEMTRADA (alemtuzumab) Guía del paciente Información importante de seguridad Este medicamento está sujeto a seguimiento adicional, es importante comunicar los efectos adversos que pudiera usted tener.
LEMTRADA (alemtuzumab) Guía del paciente Información importante de seguridad Este medicamento está sujeto a seguimiento adicional, es importante comunicar los efectos adversos que pudiera usted tener.
Keytruda es un medicamento biológico
 KEYTRUDA (pembrolizumab) Información importante para Profesionales Sanitarios sobre reacciones adversas inmunorelacionadas Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada
KEYTRUDA (pembrolizumab) Información importante para Profesionales Sanitarios sobre reacciones adversas inmunorelacionadas Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS
 Stelara (ustekinumab) INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS Por favor, además de la ficha técnica del producto (FT) lea detenidamente esta guía. Por favor, informe a sus pacientes sobre
Stelara (ustekinumab) INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS Por favor, además de la ficha técnica del producto (FT) lea detenidamente esta guía. Por favor, informe a sus pacientes sobre
Valdoxan /Thymanax (agomelatina)
 Valdoxan /Thymanax (agomelatina) Información de seguridad para profesionales sanitarios Recomendaciones sobre cómo realizar el control de la función hepática del paciente Información sobre prevención de
Valdoxan /Thymanax (agomelatina) Información de seguridad para profesionales sanitarios Recomendaciones sobre cómo realizar el control de la función hepática del paciente Información sobre prevención de
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
 ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
Toctino (alitretinoína)
 1 GUÍA PARA EL PACIENTE Información importante de seguridad para la paciente a tratamiento con PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
1 GUÍA PARA EL PACIENTE Información importante de seguridad para la paciente a tratamiento con PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Toctino (alitretinoína)
 1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)_Agosto_2016
 KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
Comunicación dirigida a Profesionales Sanitarios
 Comunicación dirigida a Profesionales Sanitarios Julio de 2015 XGEVA (denosumab): medidas establecidas para minimizar el riesgo de osteonecrosis mandibular Estimado Profesional Sanitario, Amgen S.A. de
Comunicación dirigida a Profesionales Sanitarios Julio de 2015 XGEVA (denosumab): medidas establecidas para minimizar el riesgo de osteonecrosis mandibular Estimado Profesional Sanitario, Amgen S.A. de
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
Anexo III. Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto
 Anexo III Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto Nota: Este resumen de las características del producto y prospecto son el resultado del
Anexo III Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto Nota: Este resumen de las características del producto y prospecto son el resultado del
Anexo III. Modificaciones a las secciones relevantes de ficha técnica y prospecto
 Anexo III Modificaciones a las secciones relevantes de ficha técnica y prospecto Nota: La ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados posteriormente
Anexo III Modificaciones a las secciones relevantes de ficha técnica y prospecto Nota: La ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados posteriormente
Debe haber recursos disponibles para tratar los casos de hipersensibilidad y/o reacciones anafilácticas.
 1. NOMBRE DEL MEDICAMENTO LEMTRADA 12 mg concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene 12 mg de alemtuzumab en 1,2 ml (10 mg/ml). Alemtuzumab es
1. NOMBRE DEL MEDICAMENTO LEMTRADA 12 mg concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene 12 mg de alemtuzumab en 1,2 ml (10 mg/ml). Alemtuzumab es
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO LEMTRADA 12 mg concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO LEMTRADA 12 mg concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial
Preguntas para responder
 Preguntas para responder DIAGNÓSTICO DEL LUPUS ERITEMATOSO SISTÉMICO Detección precoz 1. La detección precoz y el tratamiento temprano mejoran el pronóstico y la supervivencia de las personas con lupus
Preguntas para responder DIAGNÓSTICO DEL LUPUS ERITEMATOSO SISTÉMICO Detección precoz 1. La detección precoz y el tratamiento temprano mejoran el pronóstico y la supervivencia de las personas con lupus
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
El reservorio es humano y el modo de transmisión es por vía aérea a través de las secreciones nasofaríngeas de la persona infectada.
 Información general Rubéola La rubéola es una infección vírica que es leve en los niños, pero tiene consecuencias graves en las embarazadas porque puede causar muerte fetal o defectos congénitos en el
Información general Rubéola La rubéola es una infección vírica que es leve en los niños, pero tiene consecuencias graves en las embarazadas porque puede causar muerte fetal o defectos congénitos en el
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
FINGOLIMOD ( GILENYA): NUEVAS CONTRAINDICACIONES DE USO EN PACIENTES CON PATOLOGÍA CARDIACA SUBYACENTE Y RECOMENDACIONES DE REVISIONES DERMATOLÓGICAS
 FINGOLIMOD ( GILENYA): NUEVAS CONTRAINDICACIONES DE USO EN PACIENTES CON PATOLOGÍA CARDIACA SUBYACENTE Y RECOMENDACIONES DE REVISIONES DERMATOLÓGICAS La Agencia Española de Medicamentos y Productos Sanitarios
FINGOLIMOD ( GILENYA): NUEVAS CONTRAINDICACIONES DE USO EN PACIENTES CON PATOLOGÍA CARDIACA SUBYACENTE Y RECOMENDACIONES DE REVISIONES DERMATOLÓGICAS La Agencia Española de Medicamentos y Productos Sanitarios
LEFLUNOMIDA. Información sobre seguridad para los profesionales sanitarios
 LEFLUNOMIDA Información sobre seguridad para los profesionales sanitarios Leflunomida es un fármaco antirreumático modificador de la enfermedad" (FARME) indicado para el tratamiento de pacientes adultos
LEFLUNOMIDA Información sobre seguridad para los profesionales sanitarios Leflunomida es un fármaco antirreumático modificador de la enfermedad" (FARME) indicado para el tratamiento de pacientes adultos
Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib)
 Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib) Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib) Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
El reservorio de los virus es exclusivamente humano, no existiendo reservorio animal ni vectores implicados.
 Información general Parotiditis La parotiditis es una enfermedad transmisible causada por un agente viral, el virus de la Parotiditis, de la familia Paramyxovirus. La primera manifestación clara y más
Información general Parotiditis La parotiditis es una enfermedad transmisible causada por un agente viral, el virus de la Parotiditis, de la familia Paramyxovirus. La primera manifestación clara y más
Prospecto: información para el paciente. LEMTRADA 12 mg concentrado para solución para perfusión alemtuzumab
 Prospecto: información para el paciente LEMTRADA 12 mg concentrado para solución para perfusión alemtuzumab Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva
Prospecto: información para el paciente LEMTRADA 12 mg concentrado para solución para perfusión alemtuzumab Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva
Anexo III. Correcciones a las secciones relevantes del resumen de las características del producto y del prospecto
 Anexo III Correcciones a las secciones relevantes del resumen de las características del producto y del prospecto Nota: Esta Ficha Técnica, Etiquetado y Prospecto son el resultado del proceso de arbitraje.
Anexo III Correcciones a las secciones relevantes del resumen de las características del producto y del prospecto Nota: Esta Ficha Técnica, Etiquetado y Prospecto son el resultado del proceso de arbitraje.
El periodo de incubación de la enfermedad por rotavirus es de unos 2 días hasta la aparición de los síntomas tras el contagio.
 Información general Rotavirus El Rotavirus produce una infección intestinal, siendo la causa más común de diarrea severa en niños, especialmente entre los 6 meses y los 5 años de vida. Las gastroenteritis
Información general Rotavirus El Rotavirus produce una infección intestinal, siendo la causa más común de diarrea severa en niños, especialmente entre los 6 meses y los 5 años de vida. Las gastroenteritis
Cuestiones básicas. Documento de posición de la OMS sobre la vacunación contra el dengue Julio de 2016
 Cuestiones básicas Documento de posición de la OMS sobre la vacunación contra el dengue Julio de 2016 Antecedentes l El número de casos de dengue notificados anualmente a la OMS ha aumentado de 0,4-1,3
Cuestiones básicas Documento de posición de la OMS sobre la vacunación contra el dengue Julio de 2016 Antecedentes l El número de casos de dengue notificados anualmente a la OMS ha aumentado de 0,4-1,3
Anexo IV. Conclusiones científicas
 Anexo IV Conclusiones científicas 1 Conclusiones científicas Se han notificado cuatro casos de lesión hepática grave que condujo a un trasplante hepático desde la autorización de comercialización de Esmya.
Anexo IV Conclusiones científicas 1 Conclusiones científicas Se han notificado cuatro casos de lesión hepática grave que condujo a un trasplante hepático desde la autorización de comercialización de Esmya.
Recién nacido hijo de madre hipertiroidea
 Recién nacido hijo de madre hipertiroidea Introducción La enfermedad de Graves es una enfermedad tiroidea autoinmune, menos frecuente que la tiroiditis de Hashimoto pero con importantes consecuencias potenciales
Recién nacido hijo de madre hipertiroidea Introducción La enfermedad de Graves es una enfermedad tiroidea autoinmune, menos frecuente que la tiroiditis de Hashimoto pero con importantes consecuencias potenciales
Información importante para el profesional sanitario sobre el tratamiento con LADEVINA
 Información importante para el profesional sanitario sobre el tratamiento con LADEVINA INTRODUCCION LADEVINA es un fármaco inmunomodulador. Estudios clínicos fase III, mostraron que en pacientes pretratados
Información importante para el profesional sanitario sobre el tratamiento con LADEVINA INTRODUCCION LADEVINA es un fármaco inmunomodulador. Estudios clínicos fase III, mostraron que en pacientes pretratados
a) Explique qué es un anticuerpo, y dibuje la molécula de uno de ellos señalando sus partes.
 Cuestiones de Selectividad de INMUNOLOGÍA 1.- Considerando la respuesta inmune: a) Defina el concepto de antígeno b) Defina el concepto de anticuerpo c) Mencione e indique el origen de las células sanguíneas
Cuestiones de Selectividad de INMUNOLOGÍA 1.- Considerando la respuesta inmune: a) Defina el concepto de antígeno b) Defina el concepto de anticuerpo c) Mencione e indique el origen de las células sanguíneas
Corro un riesgo importante al tomar la medicación? Puedo prevenir los efectos secundarios?
 Programas educativos en adherencia terapéutica dirigido a pacientes con enfermedad inflamatoria intestinal. Corro un riesgo importante al tomar la medicación? Puedo prevenir los efectos secundarios? Dr.
Programas educativos en adherencia terapéutica dirigido a pacientes con enfermedad inflamatoria intestinal. Corro un riesgo importante al tomar la medicación? Puedo prevenir los efectos secundarios? Dr.
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
12. Seguimiento de la ITU en población pediátrica
 12. Seguimiento de la ITU en población pediátrica 12.1. Urocultivo y/o análisis sistemáticos de orina Preguntas a responder: Se deben realizar urocultivos y/o análisis sistemáticos de orina durante el
12. Seguimiento de la ITU en población pediátrica 12.1. Urocultivo y/o análisis sistemáticos de orina Preguntas a responder: Se deben realizar urocultivos y/o análisis sistemáticos de orina durante el
Prospecto: información para el paciente. LEMTRADA 12 mg concentrado para solución para perfusión alemtuzumab
 Prospecto: información para el paciente LEMTRADA 12 mg concentrado para solución para perfusión alemtuzumab Lea todo el prospecto detenidamente antes de que se le administre este medicamento, porque contiene
Prospecto: información para el paciente LEMTRADA 12 mg concentrado para solución para perfusión alemtuzumab Lea todo el prospecto detenidamente antes de que se le administre este medicamento, porque contiene
Anexo III. Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos
 Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), junio 2015 Disponible en
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), junio 2015 Disponible en
Cuáles son las vacunas que se recomiendan en las enfermedades crónicas?
 Dra. María Andrea Uboldi - Medica pediatra infectóloga - Ministerio de Salud Santa Fe V CONGRESO DE PACIENTES CON ENFERMEDADES REUMÁTICAS Rosario 9 y 10 de octubre de 2017 Cuáles son las vacunas que se
Dra. María Andrea Uboldi - Medica pediatra infectóloga - Ministerio de Salud Santa Fe V CONGRESO DE PACIENTES CON ENFERMEDADES REUMÁTICAS Rosario 9 y 10 de octubre de 2017 Cuáles son las vacunas que se
Síndrome de Goodpasture, Características, Síntomas, Causas, Diagnóstico y Tratamientos
 Síndrome de Goodpasture, Características, Síntomas, Causas, Diagnóstico y Tratamientos El síndrome de Goodpasture es una enfermedad autoinmunitaria en donde el sistema inmunitario ataca y destruye tejidos
Síndrome de Goodpasture, Características, Síntomas, Causas, Diagnóstico y Tratamientos El síndrome de Goodpasture es una enfermedad autoinmunitaria en donde el sistema inmunitario ataca y destruye tejidos
Farmacovigilancia. Curso de Diplomado en Sanidad
 Farmacovigilancia Curso de Diplomado en Sanidad 2010 FARMACOVIGILANCIA Conjunto de procedimientos de detección, registro y evaluación de las reacciones adversas, para la determinación de su incidencia,
Farmacovigilancia Curso de Diplomado en Sanidad 2010 FARMACOVIGILANCIA Conjunto de procedimientos de detección, registro y evaluación de las reacciones adversas, para la determinación de su incidencia,
del Dermatólogo PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 [ D] Guía del Dermatólogo PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)
[ D] Guía del Dermatólogo PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada película bucodispersable contiene 16 mg de extracto (como extracto seco) de hoja
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada película bucodispersable contiene 16 mg de extracto (como extracto seco) de hoja
Lea todo el prospecto detenidamente antes de que se le administre este medicamento porque contiene información importante para usted.
 PROSPECTO: INFORMACION PARA EL USUARIO Indio ( 111 In) oxina Mallinckrodt 37 MBq/ml precursor radiofarmacéutico en solución Oxinato de indio ( 111 In) Lea todo el prospecto detenidamente antes de que se
PROSPECTO: INFORMACION PARA EL USUARIO Indio ( 111 In) oxina Mallinckrodt 37 MBq/ml precursor radiofarmacéutico en solución Oxinato de indio ( 111 In) Lea todo el prospecto detenidamente antes de que se
EFFERALGAN 500 mg EFERVESCENTE Paracetamol
 Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Anexo IV. Conclusiones científicas
 Anexo IV Conclusiones científicas 1 Conclusiones científicas El 7 de junio de 2017, se informó a la Comisión Europea (CE) de un caso mortal de insuficiencia hepática fulminante en un paciente tratado con
Anexo IV Conclusiones científicas 1 Conclusiones científicas El 7 de junio de 2017, se informó a la Comisión Europea (CE) de un caso mortal de insuficiencia hepática fulminante en un paciente tratado con
Endocrinopatías del embarazo
 Endocrinopatías del embarazo Es necesario identificar a las mujeres con riesgo de desarrollar diabetes gestacional para, una vez reconocidas, colocarlas bajo un estricto control glucémico durante la gestación.
Endocrinopatías del embarazo Es necesario identificar a las mujeres con riesgo de desarrollar diabetes gestacional para, una vez reconocidas, colocarlas bajo un estricto control glucémico durante la gestación.
Notificación de acontecimientos adversos en Ensayos clínicos. 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica.
 Notificación de acontecimientos adversos en Ensayos clínicos 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica. ÍNDICE Definiciones Farmacovigilancia Acontecimiento adverso (AA) Reacción
Notificación de acontecimientos adversos en Ensayos clínicos 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica. ÍNDICE Definiciones Farmacovigilancia Acontecimiento adverso (AA) Reacción
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FOLLETO DE INFORMACIÓN AL PROFESIONAL GENTAMICINA SOLUCIÓN OFTÁLMICA 0,3% FOLLETO DE INFORMACIÓN AL PROFESIONAL
 Gentamicina solución oftálmica 0,3% 1. Denominación Gentamicina solución oftálmica 0,3% 2. Composición cuantitativa y cualitativa Gentamicina base 3 mg/ml (como gentamicina sultafo BP) Excipientes: Incluir
Gentamicina solución oftálmica 0,3% 1. Denominación Gentamicina solución oftálmica 0,3% 2. Composición cuantitativa y cualitativa Gentamicina base 3 mg/ml (como gentamicina sultafo BP) Excipientes: Incluir
El sarampión puede producir epidemias que causan muchas muertes y meningoencefalitis, que puede dejar secuelas de retraso mental.
 Información general El sarampión El sarampión es una enfermedad muy contagiosa y grave causada por un virus. El único reservorio del mismo es humano, por lo que reúne todas las condiciones para ser eliminado
Información general El sarampión El sarampión es una enfermedad muy contagiosa y grave causada por un virus. El único reservorio del mismo es humano, por lo que reúne todas las condiciones para ser eliminado
PLAN NACIONAL DE PREPARACIÓN Y RESPUESTA ANTE UNA PANDEMIA DE GRIPE
 PLAN NACIONAL DE PREPARACIÓN Y RESPUESTA ANTE UNA PANDEMIA DE GRIPE Noviembre 2005 La vacunación es la principal estrategia en el control y prevención ante una pandemia de gripe, pero en las primeras
PLAN NACIONAL DE PREPARACIÓN Y RESPUESTA ANTE UNA PANDEMIA DE GRIPE Noviembre 2005 La vacunación es la principal estrategia en el control y prevención ante una pandemia de gripe, pero en las primeras
Información para pacientes
 Información para pacientes. ( ) Este medicamento está sujeto a seguimiento adicional, es importante comunicar los efectos adversos que pudiera usted tener. Puede consultar la forma de hacerlo en el prospecto
Información para pacientes. ( ) Este medicamento está sujeto a seguimiento adicional, es importante comunicar los efectos adversos que pudiera usted tener. Puede consultar la forma de hacerlo en el prospecto
Guía de Práctica Clínica GPC. Terapia Inmunosupresora en el Trasplante Renal. Guía de Referencia Rápida
 Guía de Práctica Clínica GPC Terapia Inmunosupresora en el Trasplante Renal Guía de Referencia Rápida Número de Registro IMSS-112-08 Guía de Referencia Rápida Z94 Órganos y Tejidos Trasplantados GPC Terapia
Guía de Práctica Clínica GPC Terapia Inmunosupresora en el Trasplante Renal Guía de Referencia Rápida Número de Registro IMSS-112-08 Guía de Referencia Rápida Z94 Órganos y Tejidos Trasplantados GPC Terapia
Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.Referencia: MUH (FV), 05/2012
 Fecha de publicación: 29 de marzo de 2012 - Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.Referencia: MUH (FV), 05/2012 Se han producido casos de sobredosis con la administración IV de Perfalgan 10mg/ml
Fecha de publicación: 29 de marzo de 2012 - Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.Referencia: MUH (FV), 05/2012 Se han producido casos de sobredosis con la administración IV de Perfalgan 10mg/ml
III. Pacientes adultos
 rmas Nacionales de Vacunación 229 Vacunas de indicación poco frecuente Antirrábica: puede administrarse a pacientes inmunocomprometidos. Se desconoce el grado de protección logrado en aquellos pacientes
rmas Nacionales de Vacunación 229 Vacunas de indicación poco frecuente Antirrábica: puede administrarse a pacientes inmunocomprometidos. Se desconoce el grado de protección logrado en aquellos pacientes
1. QUÉ ES ACICLOVIR TEDEC 25 mg/ml solución para perfusión Y PARA QUÉ SE UTILIZA
 Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Índice de contenido. Índice 1 INTRODUCCIÓN Infección por el virus de la inmunodeficiencia humana Historia de la enfermedad...
 Índice de contenido 1 INTRODUCCIÓN...1 1.1 Infección por el virus de la inmunodeficiencia humana...1 1.1.1 Historia de la enfermedad... 1 1.1.2 Etiología y mecanismo infectivo del VIH... 5 1.1.2.1 Morfología
Índice de contenido 1 INTRODUCCIÓN...1 1.1 Infección por el virus de la inmunodeficiencia humana...1 1.1.1 Historia de la enfermedad... 1 1.1.2 Etiología y mecanismo infectivo del VIH... 5 1.1.2.1 Morfología
PAMI 8: Diagnóstico de la infección por VIH
 PAMI 8: Diagnóstico de la infección por VIH SITUACIÓN ACTUAL DEL DIAGNÓSTICO EN ESPAÑA NUEVOS DIAGNÓSTICOS DE LA INFECCIÓN A finales del año 2013 la tasa anual de nuevos diagnósticos fue de 70,4/100.000.000
PAMI 8: Diagnóstico de la infección por VIH SITUACIÓN ACTUAL DEL DIAGNÓSTICO EN ESPAÑA NUEVOS DIAGNÓSTICOS DE LA INFECCIÓN A finales del año 2013 la tasa anual de nuevos diagnósticos fue de 70,4/100.000.000
Enfermedad de Kawasaki
 https://www.printo.it/pediatric-rheumatology/sv/intro Enfermedad de Kawasaki Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? La enfermedad de Kawasaki solamente puede diagnosticarse
https://www.printo.it/pediatric-rheumatology/sv/intro Enfermedad de Kawasaki Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? La enfermedad de Kawasaki solamente puede diagnosticarse
Analíticas, serologías, pruebas y prácticas clínicas
 GPC DE ATENCIÓN EN EL EMBARAZO Y PUERPERIO 213 1ª visita 6-10 sg Historia Anamnesis de violencia de género Evaluación del estado psicológico Revisar el calendario vacunal Valoración de los hábitos alimentarios
GPC DE ATENCIÓN EN EL EMBARAZO Y PUERPERIO 213 1ª visita 6-10 sg Historia Anamnesis de violencia de género Evaluación del estado psicológico Revisar el calendario vacunal Valoración de los hábitos alimentarios
PROFILAXIS POST EXPOSICIÓN 1
 PROFILAXIS POST EXPOSICIÓN 1 La Profilaxis Post Exposición No Ocupacional (PPENO) es una medida de prevención secundaria dirigida a evitar el desarrollo de la infección por el VIH tras una exposición accidental
PROFILAXIS POST EXPOSICIÓN 1 La Profilaxis Post Exposición No Ocupacional (PPENO) es una medida de prevención secundaria dirigida a evitar el desarrollo de la infección por el VIH tras una exposición accidental
PURPURA TROMBOCITOPENICA IDIOPATICA (TROMBOCITOPENIA INMUNE ELENA GRACIELA CONARPE 2017
 PURPURA TROMBOCITOPENICA IDIOPATICA (TROMBOCITOPENIA PRIMA ARIA) ELENA GRACIELA CONARPE 2017 Trombocitopenia Inmune Primaria: antes reconocida como PTI (idiopática-inmune) Cifra de plaquetas < 100.000mmᴲ
PURPURA TROMBOCITOPENICA IDIOPATICA (TROMBOCITOPENIA PRIMA ARIA) ELENA GRACIELA CONARPE 2017 Trombocitopenia Inmune Primaria: antes reconocida como PTI (idiopática-inmune) Cifra de plaquetas < 100.000mmᴲ
FICHA TÉCNICA. No exceder la dosis máxima de 480 mg de simeticona (4 comprimidos masticables) al día.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
Preguntas para responder
 Preguntas para responder Despistaje de enfermedad renal crónica 1. En población general adulta, con o sin factores de riesgo para el desarrollo de ERC, qué estrategia de cribado para la detección de enfermedad
Preguntas para responder Despistaje de enfermedad renal crónica 1. En población general adulta, con o sin factores de riesgo para el desarrollo de ERC, qué estrategia de cribado para la detección de enfermedad
Paracetamol: cómo funciona, cuándo debe tomarlo, indicaciones y más
 Paracetamol: cómo funciona, cuándo debe tomarlo, indicaciones y más Para qué enfermedades y síntomas sirve el paracetamol? Usted puede tomar paracetamol en los siguientes casos: Si siente un dolor leve
Paracetamol: cómo funciona, cuándo debe tomarlo, indicaciones y más Para qué enfermedades y síntomas sirve el paracetamol? Usted puede tomar paracetamol en los siguientes casos: Si siente un dolor leve
FICHA TÉCNICA. No exceder la dosis máxima de 480 mg de simeticona (4 comprimidos masticables) al día.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
NOXAP. Gas medicinal comprimido. (Óxido nítrico 200 ppm y 800 ppm mol/mol) Información para Profesionales Sanitarios
 NOXAP (Óxido nítrico 200 ppm y 800 ppm mol/mol) Gas medicinal comprimido Información para Profesionales Sanitarios Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
NOXAP (Óxido nítrico 200 ppm y 800 ppm mol/mol) Gas medicinal comprimido Información para Profesionales Sanitarios Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) junio 2018
 Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) junio 2018 GUÍA DE LA PACIENTE VALPROATO ( DEPAKINE / DEPAKINE CRONO ): MEDIDAS
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) junio 2018 GUÍA DE LA PACIENTE VALPROATO ( DEPAKINE / DEPAKINE CRONO ): MEDIDAS
FICHA DE INFORMACIÓN AL PACIENTE: CITALOPRAM
 FICHA DE INFORMACIÓN AL PACIENTE: CITALOPRAM 1.1 Acción: Antidepresivo. 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.2 Cómo actúa este fármaco: Inhibe la recaptación de serotonina a nivel de la membrana neuronal,
FICHA DE INFORMACIÓN AL PACIENTE: CITALOPRAM 1.1 Acción: Antidepresivo. 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.2 Cómo actúa este fármaco: Inhibe la recaptación de serotonina a nivel de la membrana neuronal,
CONSENTIMIENTO INFORMADO TEST DE ADN LIBRE CIRCULANTE FETAL EN SANGRE MATERNA PARA EL CRIBADO DE TRISOMÍAS 21, 18 Y 13.
 ADENDUM 2 CONSENTIMIENTO INFORMADO TEST DE ADN LIBRE CIRCULANTE FETAL EN SANGRE MATERNA PARA EL CRIBADO DE TRISOMÍAS 21, 18 Y 13. Hoja informativa para realización de la prueba de cribado con ADN libre
ADENDUM 2 CONSENTIMIENTO INFORMADO TEST DE ADN LIBRE CIRCULANTE FETAL EN SANGRE MATERNA PARA EL CRIBADO DE TRISOMÍAS 21, 18 Y 13. Hoja informativa para realización de la prueba de cribado con ADN libre
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Toctino (alitretinoína)
 1 PROGRAMA DE PREVENCIÓN DEL EMBARAZO Información sobre la anticoncepción PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
1 PROGRAMA DE PREVENCIÓN DEL EMBARAZO Información sobre la anticoncepción PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
TAMIZAJE METABOLICO NEONATAL
 COORDINACION TECNICA DISTRITO 17D07 PROMOCIÓN DE LA SALUD TEMA DEL TALLER / CAPACITACIÓN FECHA DE LA CAPACITACIÓN TAMIZAJE METABOLICO NEONATAL 15-02-2017 LUGAR DEL EVENTO HORA DEL EVENTO CS. PUEBLO UNIDO
COORDINACION TECNICA DISTRITO 17D07 PROMOCIÓN DE LA SALUD TEMA DEL TALLER / CAPACITACIÓN FECHA DE LA CAPACITACIÓN TAMIZAJE METABOLICO NEONATAL 15-02-2017 LUGAR DEL EVENTO HORA DEL EVENTO CS. PUEBLO UNIDO
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 FORMULARIO PARA LA NOTIFICACIÓN DE EMBARAZOS PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos
FORMULARIO PARA LA NOTIFICACIÓN DE EMBARAZOS PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos
Nota mensual. Medicamentos. Marzo. sobre. de Uso Humano y Productos Sanitarios. Medicamentos
 Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de los receptores de angiotensina II (ARAII)
 Inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de los receptores de angiotensina II (ARAII) Puede consultar esta información en formato PDF COMUNICACIÓN SOBRE RIESGOS DE MEDICAMENTOS
Inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de los receptores de angiotensina II (ARAII) Puede consultar esta información en formato PDF COMUNICACIÓN SOBRE RIESGOS DE MEDICAMENTOS
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Otilonio Qualigen 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 40 mg de otilonio bromuro. Para
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Otilonio Qualigen 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 40 mg de otilonio bromuro. Para
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS. Esther Salgueiro 10, 17 de Marzo de 2015
 FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
ANEXO III Modificaciones a las secciones relevantes de Ficha Técnica y Prospecto
 ANEXO III Modificaciones a las secciones relevantes de Ficha Técnica y Prospecto Nota: Si procede, la ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados
ANEXO III Modificaciones a las secciones relevantes de Ficha Técnica y Prospecto Nota: Si procede, la ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados
Esclerosis Múltiple. Dra. Irene Treviño Frenk Neuróloga, Especialista en Esclerosis Múltiple Departamento de Neurología y Psiquiatría
 Esclerosis Múltiple Dra. Irene Treviño Frenk Neuróloga, Especialista en Esclerosis Múltiple Departamento de Neurología y Psiquiatría ESCLEROSIS MÚLTIPLE Qué es la esclerosis múltiple? La esclerosis múltiple
Esclerosis Múltiple Dra. Irene Treviño Frenk Neuróloga, Especialista en Esclerosis Múltiple Departamento de Neurología y Psiquiatría ESCLEROSIS MÚLTIPLE Qué es la esclerosis múltiple? La esclerosis múltiple
RETINOPATIA DEL PREMATURO
 RETINOPATIA DEL PREMATURO La Retinopatía del Prematuro (ROP) es un trastorno retinal que se presenta con mayor frecuencia en prematuros de menos de 1500 gramos o menores de 32 semanas al nacer. Es un desarrollo
RETINOPATIA DEL PREMATURO La Retinopatía del Prematuro (ROP) es un trastorno retinal que se presenta con mayor frecuencia en prematuros de menos de 1500 gramos o menores de 32 semanas al nacer. Es un desarrollo
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 CONSENTIMIENTO INFORMADO PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS),
CONSENTIMIENTO INFORMADO PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS),
En España existen vacunas autorizadas de virus vivos atenuados contra
 Vacunación Vacunas disponibles Las vacunas disponibles actualmente en España contra el sarampión se presentan en el mercado en forma de vacuna triple vírica combinada frente al sarampión, la rubeola y
Vacunación Vacunas disponibles Las vacunas disponibles actualmente en España contra el sarampión se presentan en el mercado en forma de vacuna triple vírica combinada frente al sarampión, la rubeola y
Implantación del Calendario de Vacunaciones del Adulto y Vacunación en situaciones especiales, Asturias 2014
 CIRCULAR: 02/2014 de 16 de junio de 2014 ASUNTO: ORIGEN: Implantación del Calendario de Vacunaciones del Adulto y Vacunación en situaciones especiales, Asturias 2014 Implantación del Calendario de Vacunaciones
CIRCULAR: 02/2014 de 16 de junio de 2014 ASUNTO: ORIGEN: Implantación del Calendario de Vacunaciones del Adulto y Vacunación en situaciones especiales, Asturias 2014 Implantación del Calendario de Vacunaciones
FICHA DE INFORMACIÓN AL PACIENTE: LINCOMICINA
 FICHA DE INFORMACIÓN AL PACIENTE: LINCOMICINA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antibiótico con acción bacteriostática. 1.2 Cómo actúa este fármaco: La lincomicina actúa impidiendo que las bacterias
FICHA DE INFORMACIÓN AL PACIENTE: LINCOMICINA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antibiótico con acción bacteriostática. 1.2 Cómo actúa este fármaco: La lincomicina actúa impidiendo que las bacterias
DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA Comunicación sobre cambios en la información de seguridad de Sibutramina para profesionales sanitarios Mayo de 2010 NOTA INFORMATIVA
DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA Comunicación sobre cambios en la información de seguridad de Sibutramina para profesionales sanitarios Mayo de 2010 NOTA INFORMATIVA
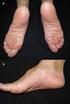
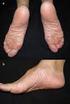
Enfermedad de Kawasaki
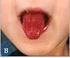 www.printo.it/pediatric-rheumatology/ar/intro Enfermedad de Kawasaki Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? El diagnóstico de la enfermedad de Kawasaki se realiza en base
www.printo.it/pediatric-rheumatology/ar/intro Enfermedad de Kawasaki Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? El diagnóstico de la enfermedad de Kawasaki se realiza en base
CASOS PRÁCTICOS (12) CALENDARIO INFANTIL. BADAJOZ 2016
 CASOS PRÁCTICOS (12) CALENDARIO INFANTIL. BADAJOZ 2016 CASO PRÁCTICO Nº 1 Cuál de las siguientes se considera contraindicación absoluta o permanente a la hora de administrar la vacuna de la tos ferina:
CASOS PRÁCTICOS (12) CALENDARIO INFANTIL. BADAJOZ 2016 CASO PRÁCTICO Nº 1 Cuál de las siguientes se considera contraindicación absoluta o permanente a la hora de administrar la vacuna de la tos ferina:
Vacunas en el Embarazo y en la Etapa Preconcepcional. Conclusión
 Vacunas en el Embarazo y en la Etapa Preconcepcional Conclusión Las vacunas administradas en la etapa preconcepcional, durante el embarazo y el puerperio tienen como finalidad la protección de la salud
Vacunas en el Embarazo y en la Etapa Preconcepcional Conclusión Las vacunas administradas en la etapa preconcepcional, durante el embarazo y el puerperio tienen como finalidad la protección de la salud
Anexo III. Modificaciones en las secciones relevantes de la información del producto
 Anexo III Modificaciones en las secciones relevantes de la información del producto Nota: Estas modificaciones de las secciones relevantes de la Ficha Técnica y Prospecto son el resultado del proceso de
Anexo III Modificaciones en las secciones relevantes de la información del producto Nota: Estas modificaciones de las secciones relevantes de la Ficha Técnica y Prospecto son el resultado del proceso de
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS INZITAN (DEXAMETASONA, TIAMINA, CIANOCOBALAMINA, LIDOCAÍNA): SUSPENSIÓN DE COMERCIALIZACIÓN Fecha de publicación: 30 de noviembre
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS INZITAN (DEXAMETASONA, TIAMINA, CIANOCOBALAMINA, LIDOCAÍNA): SUSPENSIÓN DE COMERCIALIZACIÓN Fecha de publicación: 30 de noviembre
HIJO DE MADRE HIPERTIROIDEA
 HIJO DE MADRE HIPERTIROIDEA Dr. Patricio Romero M. La causa principal de hipertiroidismo neonatal es autoinmune, por paso de anticuerpos estimulantes del receptor de TSH ( TRAb ). Es a esta causa de hipertiroidismo
HIJO DE MADRE HIPERTIROIDEA Dr. Patricio Romero M. La causa principal de hipertiroidismo neonatal es autoinmune, por paso de anticuerpos estimulantes del receptor de TSH ( TRAb ). Es a esta causa de hipertiroidismo
