27ª OLIMPÍADA ARGENTINA DE QUÍMICA 15 DE AGOSTO DE 2017 CERTAMEN INTERCOLEGIAL NIVEL 3
|
|
|
- Natividad Martínez Revuelta
- hace 5 años
- Vistas:
Transcripción
1 27ª OLIMPÍADA ARGENTINA DE QUÍMICA 15 DE AGOSTO DE 2017 CERTAMEN INTERCOLEGIAL NIVEL 3 Utiliza la información de tu tabla periódica para obtener los datos atómicos que consideres necesarios. A menos que se indique lo contrario, puedes suponer que las sustancias en estado gaseoso se comportan idealmente. EJERCICIO 1. (a) Dados los siguientes compuestos: Cuál es la relación de estereoisomería que existe entre ellos? Marca con una cruz (X) las respuestas que consideres correctas. (i) Los compuestos A y B son un par de diasterómeros. (ii) Los compuestos B y D son un par de enantiómeros. (iii) Los compuestos A y D son la misma molécula. (iv) El compuesto A es un compuesto meso. (v) Los compuestos B y C son un par de enantiómeros. (b) Asignar la configuración absoluta de los centros estereogénicos presentes en el compuesto B escribiendo tu respuesta en el correspondiente casillero. H Me Me H B (c) Cuál de los siguientes isómeros presentará mayor energía? Página 1 de 6
2 Me Me Me A B C Marca con una cruz (X) la respuesta que tú consideras correcta. A B C (d) Dibuja el confórmero más estable de la siguiente molécula. EJERCICIO 2. (a) Dibuja todos los alquenos posibles que permitan obtener metilciclohexano (B) a través de una reacción de hidrogenación catalítica. A H 2 / Pt B (b) Escribe en los correspondientes casilleros los reactivos necesarios para realizar las siguientes transformaciones. Reactivos (a) (i) B 2 H 6 ; (ii) Na - H 2 O 2 (b) (i) Hg(OAc) 2 / H 2 O; (ii) NaBH 4 (c) H 2 O / H + (c) En el laboratorio de la OAQ se llevaron a cabo las siguientes reacciones. A Br 2 CH 2 2 B 1 + B 2 B 2 KI DMSO 0ºC C (i) Dibuja las estructuras de los compuestos B 1, B 2 y C, indicando la estereoquímica de los productos en ambas reacciones. (ii) Sabiendo que el nombre IUPAC del compuesto C es (1S,2R)-1-bromo-2-iodo-1-metilciclopentano. Cuáles serán las configuraciones absolutas de los centros estereogénicos del compuesto B 1? Marca con una cruz (X) las respuestas que tú consideras correctas. Página 2 de 6
3 (i) 1S,2S (ii) 1R,2S (iiii) 1S,2R (iv) 1R,2R (iii) Cuál es el mecanismo que ocurre en la transformación de B 2 a C? Marca con una cruz (X) las respuestas que tú consideras correctas. (i) E 1 (ii) S N 2 (iii) E 2 (iv) SEA (d) En otra oportunidad se llevó a cabo la siguiente reacción. CH 3 Z EtOK Et 75 C 1 hora W + X (i) Dibuja las estructuras de los compuestos W y X, sabiendo que el compuesto X es el producto minoritario. (ii) Por qué el compuesto X es el producto minoritario? Marca con una cruz (X) las respuestas que tú consideras correctas. (i) Porque es el alqueno más sustituido (iii) Porque es el único alqueno (ii) Porque es el alqueno menos sustituido (iv) Porque es el alcano menos sustituido EJERCICIO 3. Se cuenta en el laboratorio con las siguientes soluciones acuosas: (1) H de ph = 2; (2) NH 4 0,01 M (pk a NH 4 + = 9,25); (3) HAc 0,01 M (ácido acético, pk a HAc = 4,75); (4) NH 3 0,01 M (pk b NH 3 = 4,75); (5) Na de ph = 12. (Dato adicional: pk w = 14) (a) Si a 50,0 ml de la solución (1) se le agregan agua destilada hasta un volumen final de 250,0 ml, calcula el ph de la solución resultante. ph = Página 3 de 6
4 (b) Determina la concentración de todas las especies presentes en el equilibrio en la solución (2). [NH 3 ] = M [NH 4 + ] = M [H + ] = M [ - ] = M [ - ] = M (c) Si se mezclan 50,0 ml de la solución (1) con 200,0 ml de la solución (2), se obtiene una solución donde el ph = 2,70. Indica cuál/es de las siguientes afirmaciones es/son correctas, marcando con una X en los recuadros correspondientes: i- El NH 4 + no hidroliza apreciablemente en la solución mezcla. ii- El ph de la solución mezcla es prácticamente idéntico al que se hubiese obtenido si los 50,0 ml de la solución (1) se llevaban a 250,0 ml finales con agua destilada. iii- Tanto la disociación del H como la del NH 4 + aportan apreciablemente al ph medido en la solución mezcla. iv- El grado de disociación del NH 4 + en la solución mezcla es idéntico al que se obtendría si los 200,0 ml de la solución (2) se mezclasen con 50,0 ml de agua destilada. v- La concentración de - en el equilibrio es 0,01 M. Página 4 de 6
5 (d) Si se mezclan volúmenes idénticos de las soluciones (3) y (4) se obtiene una solución resultante de NH 4 Ac de ph = 7,00. Determina la concentración de todas las especies presentes en el equilibrio. [NH 3 ] = M [HAc] = M [ - ] = M [NH 4 + ] = M [Ac - ] = M [ - ] = M (e) Indica si las siguientes afirmaciones son Verdaderas (V) o Falsas (F) en los recuadros correspondientes. i- El ph de la solución (3) es mayor al ph de la solución (2). ii- Si se mezclan volúmenes iguales de las soluciones (3) y (5) se obtiene una solución resultante de ph básico. iii- Si se mezclan volúmenes iguales de las soluciones (3) y (4) el ph = 7 ya que pk a HAc = pk b NH 3 y [HAc] analítica = [NH 3 ] analítica. iv- Si se mezclan volúmenes iguales de las soluciones (1) y (4) se obtiene una solución resultante de ph básico. Página 5 de 6
6 (f) Determina el ph si a 50,0 ml de la solución (3) se le agregan 75,0 ml de la solución (5). Puedes suponer que los volúmenes son aditivos. ph = Página 6 de 6
26ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SEPTIEMBRE DE 2016 CERTAMEN INTERCOLEGIAL NIVEL 3
 26ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SEPTIEMBRE DE 2016 CERTAMEN INTERCOLEGIAL NIVEL 3 Utiliza la información de tu tabla periódica para obtener los datos atómicos que consideres necesarios. A menos
26ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SEPTIEMBRE DE 2016 CERTAMEN INTERCOLEGIAL NIVEL 3 Utiliza la información de tu tabla periódica para obtener los datos atómicos que consideres necesarios. A menos
25ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SEPTIEMBRE DE 2015 CERTAMEN INTERCOLEGIAL NIVEL 3
 25ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SEPTIEMBRE DE 2015 CERTAMEN INTERCOLEGIAL NIVEL 3 Utiliza la información de tu tabla periódica para obtener los datos atómicos que consideres necesarios. A menos
25ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SEPTIEMBRE DE 2015 CERTAMEN INTERCOLEGIAL NIVEL 3 Utiliza la información de tu tabla periódica para obtener los datos atómicos que consideres necesarios. A menos
25ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE OCTUBRE DE 2015 CERTAMEN ZONAL NIVEL 3
 25ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE OCTUBRE DE 2015 CERTAMEN ZONAL NIVEL 3 Utiliza la información de tu tabla periódica para obtener los datos atómicos que consideres necesarios. A menos que se indique
25ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE OCTUBRE DE 2015 CERTAMEN ZONAL NIVEL 3 Utiliza la información de tu tabla periódica para obtener los datos atómicos que consideres necesarios. A menos que se indique
24ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE OCTUBRE DE 2014 CERTAMEN ZONAL NIVEL 3
 24ª LIMPÍADA ARGETIA DE QUÍMICA 1 DE CTUBRE DE 2014 CERTAME ZAL IVEL 3 Utiliza la información de tu tabla periódica para obtener los datos atómicos que consideres necesarios. A menos que se indique lo
24ª LIMPÍADA ARGETIA DE QUÍMICA 1 DE CTUBRE DE 2014 CERTAME ZAL IVEL 3 Utiliza la información de tu tabla periódica para obtener los datos atómicos que consideres necesarios. A menos que se indique lo
21ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SETIEMBRE DE 2011 CERTAMEN INTERCOLEGIAL NIVEL 3
 Auspicia y financia Ministerio de Educación UNIVERSIDAD DE BUENOS AIRES FACULTAD DE CIENCIAS EXACTAS Y NATURALES 21ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SETIEMBRE DE 2011 CERTAMEN INTERCOLEGIAL NIVEL 3
Auspicia y financia Ministerio de Educación UNIVERSIDAD DE BUENOS AIRES FACULTAD DE CIENCIAS EXACTAS Y NATURALES 21ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SETIEMBRE DE 2011 CERTAMEN INTERCOLEGIAL NIVEL 3
26ª OLIMPÍADA ARGENTINA DE QUÍMICA 5DE OCTUBRE DE 2016 CERTAMEN ZONAL NIVEL 3
 26ª OLIMPÍADA ARGENTINA DE QUÍMICA 5DE OCTUBRE DE 2016 CERTAMEN ZONAL NIVEL 3 Utiliza la información de tu tabla periódica para obtener los datos atómicos que consideres necesarios. A menos que se indique
26ª OLIMPÍADA ARGENTINA DE QUÍMICA 5DE OCTUBRE DE 2016 CERTAMEN ZONAL NIVEL 3 Utiliza la información de tu tabla periódica para obtener los datos atómicos que consideres necesarios. A menos que se indique
(a) Con el objeto de determinar la estructura del compuesto A, se realizaron las reacciones que se muestran en el esquema: Br 2 H 2 O i) O 3 A
 21ª limpíada Argentina de Química CERTAMEN NACINAL NIVEL 3 SUBNIVEL N ENTRENADS Problema 1. (30 Puntos) 52 Marcas Totales (a) Con el objeto de determinar la estructura del compuesto A, se realizaron las
21ª limpíada Argentina de Química CERTAMEN NACINAL NIVEL 3 SUBNIVEL N ENTRENADS Problema 1. (30 Puntos) 52 Marcas Totales (a) Con el objeto de determinar la estructura del compuesto A, se realizaron las
Universidad de Puerto Rico-Humacao Departamento de Química (www.uprh.edu/~quimorg) ASIGNACION #3: Ejercicios para el Tercer Examen Parcial
 Universidad de Puerto Rico-umacao Departamento de Química (www.uprh.edu/~quimorg) QUIM 0 ASIGNACIN #: Ejercicios para el Tercer Examen Parcial. Para cada uno de los siguientes dé el nombre IUPAC correcto,
Universidad de Puerto Rico-umacao Departamento de Química (www.uprh.edu/~quimorg) QUIM 0 ASIGNACIN #: Ejercicios para el Tercer Examen Parcial. Para cada uno de los siguientes dé el nombre IUPAC correcto,
Ministerio de Educación UNIVERSIDAD DE BUENOS AIRES FACULTAD DE CIENCIAS EXACTAS Y NATURALES
 uspicia y financia Ministerio de ducación UIVRSIDD D BUS IRS FCULTD D CICIS XCTS Y TURLS 20ª LIMPÍD RGTI D QUÍMIC 1 D CTUBR D 2010 CRTM ZL IVL 3 (Utiliza la información de tu tabla periódica para obtener
uspicia y financia Ministerio de ducación UIVRSIDD D BUS IRS FCULTD D CICIS XCTS Y TURLS 20ª LIMPÍD RGTI D QUÍMIC 1 D CTUBR D 2010 CRTM ZL IVL 3 (Utiliza la información de tu tabla periódica para obtener
(a) Dibuja las estructuras de los compuestos B y C en los correspondientes recuadros.
 RESERVAD AQ 23ª limpíada Argentina de Química CERTAMEN NACINAL Ejercicio 1. (30 Puntos) El fotorreordenamiento de Fries es una reacción que se conoce desde 1960 cuando los Drs. Anderson y Reese la descubrieron
RESERVAD AQ 23ª limpíada Argentina de Química CERTAMEN NACINAL Ejercicio 1. (30 Puntos) El fotorreordenamiento de Fries es una reacción que se conoce desde 1960 cuando los Drs. Anderson y Reese la descubrieron
C.I.: PRIMER PARCIAL QUÍMICA II Y QUÍMICA ORGÁNICA I (21 DE OCTUBRE DE 2003) FILA A
 NMBRE: C.I.: LICENCIATURA: PRIMER PARCIAL QUÍMICA II Y QUÍMICA RGÁNICA I (21 DE CTUBRE DE 2003) FILA A 1) (26 PUNTS) a) asifique cada una de las siguientes afirmaciones como verdaderas o falsas (V ó F):
NMBRE: C.I.: LICENCIATURA: PRIMER PARCIAL QUÍMICA II Y QUÍMICA RGÁNICA I (21 DE CTUBRE DE 2003) FILA A 1) (26 PUNTS) a) asifique cada una de las siguientes afirmaciones como verdaderas o falsas (V ó F):
Prueba de proceso I ( ) Alumno:... DNI:...
 Prueba de proceso I (27-11-2012) Alumno:.............................................. DNI:............. 1) Escribir el nombre IUPAC de los siguientes compuestos: (0,4 puntos) (S,E)-4-hexen-2-ol trans-3-bromociclohexanol
Prueba de proceso I (27-11-2012) Alumno:.............................................. DNI:............. 1) Escribir el nombre IUPAC de los siguientes compuestos: (0,4 puntos) (S,E)-4-hexen-2-ol trans-3-bromociclohexanol
2. Un dado elemento químico tiene número atómico 89 y masa atómica 227. Cuál es su número de neutrones? (a) 138 (b) 316 (c) 89 (d) 227
 26ª OLIMPÍADA ARGENTINA DE QUÍMICA 1DE SETIEMBRE DE 2016 CERTAMEN INTERCOLEGIAL NIVEL INICIAL (Utiliza solamente la tabla periódica suministrada por los docentes para resolver el examen) Datos útiles:
26ª OLIMPÍADA ARGENTINA DE QUÍMICA 1DE SETIEMBRE DE 2016 CERTAMEN INTERCOLEGIAL NIVEL INICIAL (Utiliza solamente la tabla periódica suministrada por los docentes para resolver el examen) Datos útiles:
Decir, justificando razonadamente las respuestas, si son VERDADERAS o FALSAS las
 EJERCICIO 1 Decir, justificando razonadamente las respuestas, si son VERDADERAS o FALSAS las siguientes cuestiones: a) El amoniaco es una base de Arrhenius. b) Aunque una disolución acuosa de un ácido
EJERCICIO 1 Decir, justificando razonadamente las respuestas, si son VERDADERAS o FALSAS las siguientes cuestiones: a) El amoniaco es una base de Arrhenius. b) Aunque una disolución acuosa de un ácido
NO DESABROCHES EL CUADERNILLO. NO RESUELVAS CON LÁPIZ.
 RESERVAD AQ 22ª limpíada Argentina de Química CERTAMEN NACINAL NIVEL 3 SUBNIVEL N ENTRENADS Ejercicio 1. (30 Puntos) 72 Marcas Totales (a) Dibuja las estructuras de los compuestos B y C en los correspondientes
RESERVAD AQ 22ª limpíada Argentina de Química CERTAMEN NACINAL NIVEL 3 SUBNIVEL N ENTRENADS Ejercicio 1. (30 Puntos) 72 Marcas Totales (a) Dibuja las estructuras de los compuestos B y C en los correspondientes
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2017 QUÍMICA TEMA 9: ORGÁNICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 017 QUÍMICA TEMA 9: ORGÁNICA Junio, Ejercicio 4, Opción A Reserva1, Ejercicio 4, Opción A Reserva 1, Ejercicio 4, Opción B Reserva, Ejercicio 4, Opción A Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 017 QUÍMICA TEMA 9: ORGÁNICA Junio, Ejercicio 4, Opción A Reserva1, Ejercicio 4, Opción A Reserva 1, Ejercicio 4, Opción B Reserva, Ejercicio 4, Opción A Reserva,
MeONa. MeOH 0ºC. i) S N 1 ii) Sustitución electrofílica aromática
 20ª limpíada rgentina de Química CERTMEN NCINL NIVEL SUBNIVEL N ENTRENDS RESERVD Q - CÓDIG DE Problema 1. (2 Puntos) Reacción estudiada. Me 41 Marcas Totales Br MeNa Me 0ºC + Me + NaBr (9%) B (6%) (a)
20ª limpíada rgentina de Química CERTMEN NCINL NIVEL SUBNIVEL N ENTRENDS RESERVD Q - CÓDIG DE Problema 1. (2 Puntos) Reacción estudiada. Me 41 Marcas Totales Br MeNa Me 0ºC + Me + NaBr (9%) B (6%) (a)
Se desea sintetizar el compuesto F a partir de p-metoxitolueno (A) y para ello se ha planteado el
 26ª limpíada Argentina de Química CERTAMEN NACINAL NIVEL 3 N ENTRENADS RESERVAD PARA LA AQ Problema 1. (30 Puntos) 58 Marcas Totales Se desea sintetizar el compuesto a partir de p-metoxitolueno (A) y para
26ª limpíada Argentina de Química CERTAMEN NACINAL NIVEL 3 N ENTRENADS RESERVAD PARA LA AQ Problema 1. (30 Puntos) 58 Marcas Totales Se desea sintetizar el compuesto a partir de p-metoxitolueno (A) y para
Reacción d e Diels - Alder 150ºC
 22ª limpíada Argentina de Química RESERVAD AQ Ejercicio 1. (30 Puntos) (a) Las reacciones pericíclicas se utilizan en síntesis orgánica debido a que permiten generar nuevas uniones C C. Dichas reacciones
22ª limpíada Argentina de Química RESERVAD AQ Ejercicio 1. (30 Puntos) (a) Las reacciones pericíclicas se utilizan en síntesis orgánica debido a que permiten generar nuevas uniones C C. Dichas reacciones
Nombre: 2. Considere las estructuras de Lewis A, B, y C. a) Cuál estructura contiene un carbono con carga positiva?
 Química Orgánica I (1311). Serie 1: Introducción y repaso, alcanos y estereoquímica Fecha de entrega: miércoles 5 de octubre de 2016. Profesor: M en C. Javier Ordóñez Hernández Nombre: 1. Para los siguientes
Química Orgánica I (1311). Serie 1: Introducción y repaso, alcanos y estereoquímica Fecha de entrega: miércoles 5 de octubre de 2016. Profesor: M en C. Javier Ordóñez Hernández Nombre: 1. Para los siguientes
Ministerio de Educación 21ª OLIMPÍADA ARGENTINA DE QUÍMICA 3 DE OCTUBRE DE 2011 CERTAMEN ZONAL - RESPUESTAS NIVEL 1.
 Auspicia y financia Ministerio de Educación UNIVERSIDAD DE BUENS AIRES FACULTAD DE CIENCIAS EACTAS Y NATURALES 21ª LIMPÍADA ARGENTINA DE QUÍMICA 3 DE CTUBRE DE 2011 CERTAMEN ZNAL - RESPUESTAS La información
Auspicia y financia Ministerio de Educación UNIVERSIDAD DE BUENS AIRES FACULTAD DE CIENCIAS EACTAS Y NATURALES 21ª LIMPÍADA ARGENTINA DE QUÍMICA 3 DE CTUBRE DE 2011 CERTAMEN ZNAL - RESPUESTAS La información
JULIO FASE ESPECÍFICA QUÍMICA. OPCIÓN A
 JULIO 2011. FASE ESPECÍFICA 1. (2,5 puntos) QUÍMICA. OPCIÓN A Calcule la entalpía estándar de formación del metanol líquido a partir de los siguientes datos: ΔHº f [H 2 O(l)] = - 285,5 kj/mol; ΔHº f [CO
JULIO 2011. FASE ESPECÍFICA 1. (2,5 puntos) QUÍMICA. OPCIÓN A Calcule la entalpía estándar de formación del metanol líquido a partir de los siguientes datos: ΔHº f [H 2 O(l)] = - 285,5 kj/mol; ΔHº f [CO
TRANSFERENCIA DE PROTONES. CUESTIONES Y PROBLEMAS. E1B.S2009 Para las especies CN, HF y CO 3
 TRANSFERENCIA DE PROTONES. CUESTIONES Y PROBLEMAS. E1B.S2009 Para las especies CN, HF y CO 3 2, en disolución acuosa: a.- Escriba, según corresponda, la fórmula del ácido o de la base conjugados. b.- Justifique,
TRANSFERENCIA DE PROTONES. CUESTIONES Y PROBLEMAS. E1B.S2009 Para las especies CN, HF y CO 3 2, en disolución acuosa: a.- Escriba, según corresponda, la fórmula del ácido o de la base conjugados. b.- Justifique,
ÁCIDO - BASE º bachillerato QUÍMICA
 Ejercicio 1. Modelo 2.014 El producto de solubilidad del hidróxido de hierro (III) a 25 o C es K s = 2,8 10 39. a. Cuál será el ph de una disolución saturada de esta sal? b. Calcule qué volumen de ácido
Ejercicio 1. Modelo 2.014 El producto de solubilidad del hidróxido de hierro (III) a 25 o C es K s = 2,8 10 39. a. Cuál será el ph de una disolución saturada de esta sal? b. Calcule qué volumen de ácido
19ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE OCTUBRE DE 2009 CERTAMEN ZONAL NIVEL 2-bis
 Auspicia y financia Ministerio de Educación UNIVERSIDAD DE BUENOS AIRES FACULTAD DE CIENCIAS EXACTAS Y NATURALES 19ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE OCTUBRE DE 2009 CERTAMEN ZONAL NIVEL 2-bis (Utiliza
Auspicia y financia Ministerio de Educación UNIVERSIDAD DE BUENOS AIRES FACULTAD DE CIENCIAS EXACTAS Y NATURALES 19ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE OCTUBRE DE 2009 CERTAMEN ZONAL NIVEL 2-bis (Utiliza
Universidad de Puerto Rico Recinto de Río Piedras Facultad de Ciencias Naturales Departamento de Química
 Universidad de Puerto Rico Recinto de Río Piedras Facultad de Ciencias Naturales Departamento de Química QUIM 3031 Nombre: Segundo Examen Parcial Número de Estudiante: 28 de octubre de 2010 Sección de
Universidad de Puerto Rico Recinto de Río Piedras Facultad de Ciencias Naturales Departamento de Química QUIM 3031 Nombre: Segundo Examen Parcial Número de Estudiante: 28 de octubre de 2010 Sección de
Problema 1. (33 Puntos) (a) Dada la siguiente reacción, dibuja el producto que se forma en el correspondiente recuadro.
 27ª limpíada Argentina de Química CERTAMEN NACINAL NIVEL 3 N ENTRENADS RESERVAD PARA LA AQ Problema 1. (33 Puntos) (a) Dada la siguiente reacción, dibuja el producto que se forma en el correspondiente
27ª limpíada Argentina de Química CERTAMEN NACINAL NIVEL 3 N ENTRENADS RESERVAD PARA LA AQ Problema 1. (33 Puntos) (a) Dada la siguiente reacción, dibuja el producto que se forma en el correspondiente
ÁCIDO-BASE. 3.- Calcule: a) El ph de una disolución 0 1 M de ácido acético, CH 3. COOH, cuyo grado de disociación es 1 33%. b) La constante K a
 ÁCIDO-BASE. 2001 1.- La constante K b del NH 3, es igual a 1 8 10 5 a 25 ºC. Calcule: a) La concentración de las especies iónicas en una disolución 0 2 M de amoniaco. b) El ph de la disolución y el grado
ÁCIDO-BASE. 2001 1.- La constante K b del NH 3, es igual a 1 8 10 5 a 25 ºC. Calcule: a) La concentración de las especies iónicas en una disolución 0 2 M de amoniaco. b) El ph de la disolución y el grado
7) a) Calcule el grado de disociación (%) de una disolución 0,02 M de ácido monoprótico acetilsalicílico (aspirina).
 ÁCIDO-BASE PROBLEMAS P.A.U. 1) Escribir las reacciones de disociación, según los modelos de Arrhenius y de Brönsted- Lowry, de las siguientes especies químicas: a) Ácido acético. b) Amoníaco. c) Hidróxido
ÁCIDO-BASE PROBLEMAS P.A.U. 1) Escribir las reacciones de disociación, según los modelos de Arrhenius y de Brönsted- Lowry, de las siguientes especies químicas: a) Ácido acético. b) Amoníaco. c) Hidróxido
Los potenciales difieren debido a que las hemireacciones de reducción X. iii. Los potenciales difieren debido a que en medio ácido la especie ClO 4
 9ª limpíada Argentina de Química CERTAMEN NACINAL NIVELES -BIS - RESPUESTAS Problema. (3 Puntos) Los siguientes diagramas de Latimer resumen los potenciales de reducción (contra el electrodo normal de
9ª limpíada Argentina de Química CERTAMEN NACINAL NIVELES -BIS - RESPUESTAS Problema. (3 Puntos) Los siguientes diagramas de Latimer resumen los potenciales de reducción (contra el electrodo normal de
Reacción de Diels - Alder. HCl + Z Tolueno 150ºC. MeOH OR Z O
 ª limpíada Argentina de Química CERTAMEN NACINAL NIVEL 3 SUBNIVEL N ENTRENADS RESERVAD AQ - CÓDIG DE Ejercicio 1. (30 Puntos) 61 Marcas Totales (a) Las reacciones pericíclicas se utilizan en síntesis orgánica
ª limpíada Argentina de Química CERTAMEN NACINAL NIVEL 3 SUBNIVEL N ENTRENADS RESERVAD AQ - CÓDIG DE Ejercicio 1. (30 Puntos) 61 Marcas Totales (a) Las reacciones pericíclicas se utilizan en síntesis orgánica
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 4, Opción
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO Curso
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO Curso 01-013 MATERIA: QUÍMICA INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN La
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO Curso 01-013 MATERIA: QUÍMICA INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN La
Nombre: 2. Considere las estructuras de Lewis A, B, y C. a) Cuál estructura contiene un carbono con carga positiva?
 Química Orgánica I (1311). Serie 1: Introducción y repaso, alcanos y estereoquímica Fecha de entrega: viernes 06 de octubre de 2017. Profesor: M en C. Javier Ordóñez Hernández Nombre: 1. Para los siguientes
Química Orgánica I (1311). Serie 1: Introducción y repaso, alcanos y estereoquímica Fecha de entrega: viernes 06 de octubre de 2017. Profesor: M en C. Javier Ordóñez Hernández Nombre: 1. Para los siguientes
PROBLEMAS DE SELECTIVIDAD. QUÍMICA ORGÁNICA
 PROBLEMAS DE SELECTIVIDAD. QUÍMICA ORGÁNICA 2017 1) Dado el siguiente compuesto CH 3 CH 2 CHOHCH 3 a) Justifique si presenta o no isomería óptica. b) Escriba la estructura de un isómero de posición y otro
PROBLEMAS DE SELECTIVIDAD. QUÍMICA ORGÁNICA 2017 1) Dado el siguiente compuesto CH 3 CH 2 CHOHCH 3 a) Justifique si presenta o no isomería óptica. b) Escriba la estructura de un isómero de posición y otro
XX OLIMPIADA NACIONAL DE QUÍMICA
 XX OLIMPIADA NACIONAL DE QUÍMICA Córdoba 7-30 de Abril de 007 Asociación Nacional de Químicos de España Universidad de Córdoba INSTRUCCIONES Clave de Identificación A) Este examen consta de cuatro problemas
XX OLIMPIADA NACIONAL DE QUÍMICA Córdoba 7-30 de Abril de 007 Asociación Nacional de Químicos de España Universidad de Córdoba INSTRUCCIONES Clave de Identificación A) Este examen consta de cuatro problemas
Universidad de Puerto Rico-Humacao Departamento de Química (www.uprh.edu/~quimorg)
 Universidad de Puerto ico-umacao Departamento de Química (www.uprh.edu/~quimorg) QUIM 01 AIGNACIN #: oluciones a ejercicios para el Tercer Examen Parcial 1. Para cada uno de los siguientes dé el nombre
Universidad de Puerto ico-umacao Departamento de Química (www.uprh.edu/~quimorg) QUIM 01 AIGNACIN #: oluciones a ejercicios para el Tercer Examen Parcial 1. Para cada uno de los siguientes dé el nombre
QUÍMICA ORGÁNICA I (Parcial 1º)
 QUÍMICA ORGÁNICA I (Parcial 1º) 19-12-2013 Alumn@: DNI: 1 2 3 4 5 6 7 total calificación 1) Añadir los componentes que faltan (materiales de partida, reactivos o productos) de las siguientes reacciones:
QUÍMICA ORGÁNICA I (Parcial 1º) 19-12-2013 Alumn@: DNI: 1 2 3 4 5 6 7 total calificación 1) Añadir los componentes que faltan (materiales de partida, reactivos o productos) de las siguientes reacciones:
UNIVERSIDAD NACIONAL DE JUJUY FACULTAD DE INGENIERIA QUIMICA ORGANICA 2017
 UNIVERSIDAD NACIONAL DE JUJUY FACULTAD DE INGENIERIA QUIMICA ORGANICA 2017 ESTEREOISOMERIA (Parte II): ISOMERIA OPTICA 1- Explique el significado de los siguientes términos: Constitución. Conformación.
UNIVERSIDAD NACIONAL DE JUJUY FACULTAD DE INGENIERIA QUIMICA ORGANICA 2017 ESTEREOISOMERIA (Parte II): ISOMERIA OPTICA 1- Explique el significado de los siguientes términos: Constitución. Conformación.
Química Orgánica II (1411)
 Química Orgánica II (1411) Serie 1: Repaso y reacciones de sustitución nucleofílica alifática y de eliminación en haluros de alquilo y en sustratos Con buenos grupos salientes Fecha de entrega: 01 de abril
Química Orgánica II (1411) Serie 1: Repaso y reacciones de sustitución nucleofílica alifática y de eliminación en haluros de alquilo y en sustratos Con buenos grupos salientes Fecha de entrega: 01 de abril
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 4, Opción
QUÍMICA. ii. Justifique si la reacción del apartado i) será, o no será, espontánea. (1,0 punto)
 OPCIÓN A QUÍMICA. 1. (2,5 puntos) Las entalpías estándar de formación del NH 3 (g) y del H 2 O(l) son -46,11 y -285,8 kj mol -1, respectivamente. La variación de la entalpía estándar para la reacción:
OPCIÓN A QUÍMICA. 1. (2,5 puntos) Las entalpías estándar de formación del NH 3 (g) y del H 2 O(l) son -46,11 y -285,8 kj mol -1, respectivamente. La variación de la entalpía estándar para la reacción:
Grupo E- DISOLUCIONES AMORTIGUADORAS o TAMPÓN
 Grupo E DISOLUCIONES AMORTIGUADORAS o TAMPÓN 5 E01 La constante de ionización del hidróxido amónico a 25ºC es 1,8.10. Calcular: a) El ph de una disolución acuosa 0,02 M de hidróxido de amonio b) El ph
Grupo E DISOLUCIONES AMORTIGUADORAS o TAMPÓN 5 E01 La constante de ionización del hidróxido amónico a 25ºC es 1,8.10. Calcular: a) El ph de una disolución acuosa 0,02 M de hidróxido de amonio b) El ph
EJERCICIOS DE SELECTIVIDAD. Reacciones de transferencia de protones: Reacciones ácido-base
 EJERCICIOS DE SELECTIVIDAD Reacciones de transferencia de protones: Reacciones ácido-base CUESTIONES 1.- Razone la veracidad o falsedad de las siguientes afirmaciones: a) A igual molaridad, cuanto más
EJERCICIOS DE SELECTIVIDAD Reacciones de transferencia de protones: Reacciones ácido-base CUESTIONES 1.- Razone la veracidad o falsedad de las siguientes afirmaciones: a) A igual molaridad, cuanto más
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción B Reserva 2, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción B Reserva 2, Ejercicio
QUÍMICA. OPCIÓN A. 1. (2,5 puntos)
 1. (2,5 puntos) QUÍMICA. OPCIÓN A La combustión completa de 40 g de acetona, C 3 H 6 O(l), libera 1234,5 kj. Si las entalpías estándar de formación del CO 2 (g) y del H 2 O(l) son -393,5 y -285,8 kj mol
1. (2,5 puntos) QUÍMICA. OPCIÓN A La combustión completa de 40 g de acetona, C 3 H 6 O(l), libera 1234,5 kj. Si las entalpías estándar de formación del CO 2 (g) y del H 2 O(l) son -393,5 y -285,8 kj mol
QUÍMICA. En el transcurso de la reacción se rompen y se forman enlaces, y
 OPCIÓN A QUÍMICA. 1. (2,5 puntos) A partir de los siguientes datos: Molécula Enlaces ΔH enlace (kj mol -1 ) H 2 H H - 436 O 2 O O - 496 H 2 O O-H - 463 Estime la entalpía estándar de formación de la molécula
OPCIÓN A QUÍMICA. 1. (2,5 puntos) A partir de los siguientes datos: Molécula Enlaces ΔH enlace (kj mol -1 ) H 2 H H - 436 O 2 O O - 496 H 2 O O-H - 463 Estime la entalpía estándar de formación de la molécula
(i) [X] 65ºC. (iii) S N 2
![(i) [X] 65ºC. (iii) S N 2 (i) [X] 65ºC. (iii) S N 2](/thumbs/82/84981345.jpg) Problema 1. (20 Puntos) Se desea evaluar la reactividad de los grupos carbonilos derivados de cetonas y aldehídos. Para ello se realizan una serie de experimentos que se indican a continuación. En el laboratorio
Problema 1. (20 Puntos) Se desea evaluar la reactividad de los grupos carbonilos derivados de cetonas y aldehídos. Para ello se realizan una serie de experimentos que se indican a continuación. En el laboratorio
ÁCIDO BASE. Julio 2017; Opción B; Cuestión 3 a.- b.- c.- d.- Datos.- Julio 2017; Opción A; Problema 4 a M b % Datos.
 ÁCIDO BASE. Julio 2017; Opción B; Cuestión 3 Justifique si las siguientes afirmaciones son verdaderas o falsas: a.- La mezcla de 10 ml de HCl 0,1 M con 20 ml de NaOH 0,1 M será una disolución neutra. F
ÁCIDO BASE. Julio 2017; Opción B; Cuestión 3 Justifique si las siguientes afirmaciones son verdaderas o falsas: a.- La mezcla de 10 ml de HCl 0,1 M con 20 ml de NaOH 0,1 M será una disolución neutra. F
TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule
TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 2011-2012 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 2011-2012 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN
PROBLEMAS TIPO DE ÁCIDOS Y BASES
 PROBLEMAS TIPO DE ÁCIDOS Y BASES Cálculo de ph 1) Calcula el ph de: a) Una disolución 0'2 M de amoniaco. Kb = 1'8 10 5. b) Una disolución 0'01 M de HCl. c) Una disolución 0'01 M de KOH. d) Una disolución
PROBLEMAS TIPO DE ÁCIDOS Y BASES Cálculo de ph 1) Calcula el ph de: a) Una disolución 0'2 M de amoniaco. Kb = 1'8 10 5. b) Una disolución 0'01 M de HCl. c) Una disolución 0'01 M de KOH. d) Una disolución
Tema 9. Alquenos. Esther Lete Centro Asociado Bizkaia Curso
 Tema 9. Esther Lete Centro Asociado Bizkaia Curso 2011-12 Objetivo Relacionar la estructura con las propiedades físicas y el comportamiento químico de los alquenos, centrado en las REACCIONES de ADICIÓN
Tema 9. Esther Lete Centro Asociado Bizkaia Curso 2011-12 Objetivo Relacionar la estructura con las propiedades físicas y el comportamiento químico de los alquenos, centrado en las REACCIONES de ADICIÓN
Ejercicios de acceso a la Universidad Problemas de Ácidos y Bases
 Ejercicios de acceso a la Universidad Problemas de Ácidos y Bases 68 Si 10,1 ml de vinagre han necesitado 50,5 ml de una base 0,2 N para su neutralización: a) Cuál será la normalidad del ácido en el vinagre?.
Ejercicios de acceso a la Universidad Problemas de Ácidos y Bases 68 Si 10,1 ml de vinagre han necesitado 50,5 ml de una base 0,2 N para su neutralización: a) Cuál será la normalidad del ácido en el vinagre?.
2.-En la reacción de combustión del gas propano Cuántos moles de O 2 se necesitan por mol de CO 2 producido?
 UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2011) UNIVERSIDAD DE ALCALÁ MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste
UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2011) UNIVERSIDAD DE ALCALÁ MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste
19ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SETIEMBRE DE 2009 CERTAMEN INTERCOLEGIAL - RESPUESTAS NIVEL 1
 Auspicia y financia Ministerio de Educación UNIVERSIDAD DE BUENS AIRES FACULTAD DE CIENCIAS EXACTAS Y NATURALES 19ª LIMPÍADA ARGENTINA DE QUÍMICA 1 DE SETIEMBRE DE 2009 CERTAMEN INTERCLEGIAL RESPUESTAS
Auspicia y financia Ministerio de Educación UNIVERSIDAD DE BUENS AIRES FACULTAD DE CIENCIAS EXACTAS Y NATURALES 19ª LIMPÍADA ARGENTINA DE QUÍMICA 1 DE SETIEMBRE DE 2009 CERTAMEN INTERCLEGIAL RESPUESTAS
2. Para cada uno de los siguientes compuestos dibuje sus formas de resonancia, el hibrido de resonancia e indique la hibridación de cada átomo.
 Química Orgánica I (1311). Serie 1 Dr. Norberto Farfán García. 1. Asigne la hibridación correspondiente a cada átomo. 2. Para cada uno de los siguientes compuestos dibuje sus formas de resonancia, el hibrido
Química Orgánica I (1311). Serie 1 Dr. Norberto Farfán García. 1. Asigne la hibridación correspondiente a cada átomo. 2. Para cada uno de los siguientes compuestos dibuje sus formas de resonancia, el hibrido
QUÍMICA 2º Bachillerato Ejercicios: Reacciones Ácido Base
 1(8) Ejercicio nº 1 Completa las siguientes reacciones ácido-base, indicando qué especies químicas son el ácido y la base, y cuáles sus conjugados: a) HA + B b) HCl + NH 3 c) HNO 3 + H 2 O Ejercicio nº
1(8) Ejercicio nº 1 Completa las siguientes reacciones ácido-base, indicando qué especies químicas son el ácido y la base, y cuáles sus conjugados: a) HA + B b) HCl + NH 3 c) HNO 3 + H 2 O Ejercicio nº
2. Proponga estructuras para las moléculas que cumplan las descripciones siguientes:
 Química Orgánica I (1311). Serie 1 Fecha de entrega: martes 02 de octubre de 2012 Dr. Norberto Farfán García. 1. Explique mediante el modelo de hibridación, la geometría de cada compuesto, dibujando los
Química Orgánica I (1311). Serie 1 Fecha de entrega: martes 02 de octubre de 2012 Dr. Norberto Farfán García. 1. Explique mediante el modelo de hibridación, la geometría de cada compuesto, dibujando los
JUNIO FASE GENERAL QUÍMICA. [ΔH afinidad F(g)] = -328 kj mol -1 (0,25 puntos) NaF(s)
![JUNIO FASE GENERAL QUÍMICA. [ΔH afinidad F(g)] = -328 kj mol -1 (0,25 puntos) NaF(s) JUNIO FASE GENERAL QUÍMICA. [ΔH afinidad F(g)] = -328 kj mol -1 (0,25 puntos) NaF(s)](/thumbs/85/91466496.jpg) OPCIÓN A JUNIO 2012. FASE GENERAL QUÍMICA. 1. (2,5 puntos) Dibuje el ciclo de Born-Haber y calcule la energía de red (ΔH red ) del NaF(s) a partir de los siguientes datos: Entalpía estándar de formación
OPCIÓN A JUNIO 2012. FASE GENERAL QUÍMICA. 1. (2,5 puntos) Dibuje el ciclo de Born-Haber y calcule la energía de red (ΔH red ) del NaF(s) a partir de los siguientes datos: Entalpía estándar de formación
PROBLEMAS DE SELECTIVIDAD. TEMA 5: ÁCIDOS Y BASES
 PROBLEMAS DE SELECTIVIDAD. TEMA 5: ÁCIDOS Y BASES 2015 1) a) A 25 ºC la constante de basicidad del NH 3 es 1,8 10 5. Si se tiene una disolución 0,1 M, calcula el grado de disociación. b) Calcula la concentración
PROBLEMAS DE SELECTIVIDAD. TEMA 5: ÁCIDOS Y BASES 2015 1) a) A 25 ºC la constante de basicidad del NH 3 es 1,8 10 5. Si se tiene una disolución 0,1 M, calcula el grado de disociación. b) Calcula la concentración
25ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SEPTIEMBRE DE 2015 CERTAMEN INTERCOLEGIAL NIVEL INICIAL
 25ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SEPTIEMBRE DE 2015 CERTAMEN INTERCOLEGIAL NIVEL INICIAL (Utiliza solamente la tabla periódica suministrada por los docentes para resolver el examen) 1. Indica si
25ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SEPTIEMBRE DE 2015 CERTAMEN INTERCOLEGIAL NIVEL INICIAL (Utiliza solamente la tabla periódica suministrada por los docentes para resolver el examen) 1. Indica si
TEMA 6. ÁCIDOS Y BASES
 TEMA 6. ÁCIDOS Y BASES 9.1) Responda a las siguientes cuestiones: a) Defina el concepto de ácido y base según la teoría de Arrhenius. b) Clasifique, según la definición anterior, las siguientes especies,
TEMA 6. ÁCIDOS Y BASES 9.1) Responda a las siguientes cuestiones: a) Defina el concepto de ácido y base según la teoría de Arrhenius. b) Clasifique, según la definición anterior, las siguientes especies,
QUÍMICA - 2º DE BACHILLERATO EJERCICIOS DE SELECTIVIDAD UNIDAD 6: ÁCIDO - BASE CUESTIONES 1
 CUESTIONES 1 HOJA 6-1 2003 modelo: Conocidos los ácidos HA (K a =3,6.10-6 ), HB (K a =2,5.10-3 ) y HC (K a =1,2.10-12 ) a) Cuál es el ácido más débil. b) Cuál es el que posee la base conjugada más débil.
CUESTIONES 1 HOJA 6-1 2003 modelo: Conocidos los ácidos HA (K a =3,6.10-6 ), HB (K a =2,5.10-3 ) y HC (K a =1,2.10-12 ) a) Cuál es el ácido más débil. b) Cuál es el que posee la base conjugada más débil.
XXXI OLIMPIADA DE QUÍMICA Fase Local EXTREMADURA Nombre:
 TEST DE PREGUNTAS MULTIRRESPUESTA (4 puntos) Se deberá marcar con una cruz en la HOJA de RESPUESTAS (al final del test) la respuesta correcta de cada pregunta (sólo hay una respuesta válida en cada pregunta).
TEST DE PREGUNTAS MULTIRRESPUESTA (4 puntos) Se deberá marcar con una cruz en la HOJA de RESPUESTAS (al final del test) la respuesta correcta de cada pregunta (sólo hay una respuesta válida en cada pregunta).
 REACCIONES DE TRANSFERENCIA DE PROTONES 1.-junio 1997 a) El ph de una disolución 0.2 M de ácido fórmico (ácido metanoico) cuya K a = 10-4 b) El ph y el grado de disociación del ácido fórmico cuando a 40
REACCIONES DE TRANSFERENCIA DE PROTONES 1.-junio 1997 a) El ph de una disolución 0.2 M de ácido fórmico (ácido metanoico) cuya K a = 10-4 b) El ph y el grado de disociación del ácido fórmico cuando a 40
Ministerio de Educación UNIVERSIDAD DE BUENOS AIRES FACULTAD DE CIENCIAS EXACTAS Y NATURALES
 uspicia y financia Ministerio de Educación UNIVERSIDD DE BUENS IRES FCULTD DE CIENCIS ECTS Y NTURLES 20ª LIMPÍD RGENTIN DE QUÍMIC 1 DE CTUBRE DE 2010 CERTMEN ZNL - RESPUESTS La información consignada es
uspicia y financia Ministerio de Educación UNIVERSIDD DE BUENS IRES FCULTD DE CIENCIS ECTS Y NTURLES 20ª LIMPÍD RGENTIN DE QUÍMIC 1 DE CTUBRE DE 2010 CERTMEN ZNL - RESPUESTS La información consignada es
PROBLEMAS QUÍMICA. (Proyecto integrado)
 PROBLEMAS QUÍMICA. (Proyecto integrado) CONCEPTOS FUNDAMENTALES 1. Razone qué cantidad de las siguientes sustancias tiene mayor nº de átomos: a) 0 5 moles de SO 2 b) 14 gramos de nitrógeno molecular. c)
PROBLEMAS QUÍMICA. (Proyecto integrado) CONCEPTOS FUNDAMENTALES 1. Razone qué cantidad de las siguientes sustancias tiene mayor nº de átomos: a) 0 5 moles de SO 2 b) 14 gramos de nitrógeno molecular. c)
REACTIVIDAD DE LOS COMPUESTOS DEL CARBONO
 QUÍMICA 2º BACHILLERATO EJERCICIOS PAU REACTIVIDAD DE LOS COMPUESTOS DEL CARBONO 1. PAU-16M A. El 2 propanol y el etilmetiléter son dos compuestos isómeros con propiedades muy diferentes. a) Formule dichos
QUÍMICA 2º BACHILLERATO EJERCICIOS PAU REACTIVIDAD DE LOS COMPUESTOS DEL CARBONO 1. PAU-16M A. El 2 propanol y el etilmetiléter son dos compuestos isómeros con propiedades muy diferentes. a) Formule dichos
QUÍMICA. [ΔH afinidad I(g)] = - 295,2 kj mol -1 (0,25 puntos) (0,25 puntos) NaI(s)]
![QUÍMICA. [ΔH afinidad I(g)] = - 295,2 kj mol -1 (0,25 puntos) (0,25 puntos) NaI(s)] QUÍMICA. [ΔH afinidad I(g)] = - 295,2 kj mol -1 (0,25 puntos) (0,25 puntos) NaI(s)]](/thumbs/73/69449439.jpg) PRUEBAS DE ACCES A LA UNIVERSIDAD PCIÓN A QUÍMICA. 1. (2,5 puntos) Construya el ciclo de Born-Haber para la formación del NaI(s), a partir de yodo sólido y sodio metálico, y calcule la energía de red (ΔH
PRUEBAS DE ACCES A LA UNIVERSIDAD PCIÓN A QUÍMICA. 1. (2,5 puntos) Construya el ciclo de Born-Haber para la formación del NaI(s), a partir de yodo sólido y sodio metálico, y calcule la energía de red (ΔH
QUÍMICA ORGÁNICA (QUIM 3031)
 1 QUÍMICA RGÁNICA (QUIM 3031) NMBRE: TERCER EXAMEN PARCIAL NÚMER DE ESTUDIANTE: 21 DE NVIEMBRE DE 2013 SECCIÓN: El examen consta de 16 preguntas que suman 105 puntos (de los cuales 5 puntos son bono).
1 QUÍMICA RGÁNICA (QUIM 3031) NMBRE: TERCER EXAMEN PARCIAL NÚMER DE ESTUDIANTE: 21 DE NVIEMBRE DE 2013 SECCIÓN: El examen consta de 16 preguntas que suman 105 puntos (de los cuales 5 puntos son bono).
REACCIONES DE TRANSFERENCIA DE PROTONES
 REACCIONES DE TRANSFERENCIA DE PROTONES Conceptos básicos. 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies
REACCIONES DE TRANSFERENCIA DE PROTONES Conceptos básicos. 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2008 PRIMERA PARTE
 1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
27ª Olimpíada Argentina de Química CERTAMEN NACIONAL NIVEL 3 NO ENTRENADOS RESPUESTAS
 7ª limpíada Argentina de Química CERTAMEN NACINAL NIVEL N ENTRENADS RESERVAD PARA LA AQ Problema 1. ( Puntos) Marcas Totales: 7 Marcas. (a) Dada la siguiente reacción, dibuja el producto que se forma en
7ª limpíada Argentina de Química CERTAMEN NACINAL NIVEL N ENTRENADS RESERVAD PARA LA AQ Problema 1. ( Puntos) Marcas Totales: 7 Marcas. (a) Dada la siguiente reacción, dibuja el producto que se forma en
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2006 PRIMERA PARTE
 PAU Química. Junio 2006 PRIMERA PARTE Cuestión. Sabiendo que el boro es el primer elemento del grupo trece del Sistema Periódico, conteste razonadamente si las siguientes afirmaciones son verdaderas o
PAU Química. Junio 2006 PRIMERA PARTE Cuestión. Sabiendo que el boro es el primer elemento del grupo trece del Sistema Periódico, conteste razonadamente si las siguientes afirmaciones son verdaderas o
CUESTIONES. 3. Concepto de hidrólisis. Deducción de la constante de hidrólisis en una sal de ácido fuerte y base débil (por ejemplo, cloruro amónico)
 CUESTIONES 1. Completar los siguientes equilibrios ácido-base de Brönsted-Lowry, caracterizando los correspondientes pares ácido-base conjugados:...+ H 2 O CO 3 2 + H 3 O + NH +4 + OH H 2 O +......+ H
CUESTIONES 1. Completar los siguientes equilibrios ácido-base de Brönsted-Lowry, caracterizando los correspondientes pares ácido-base conjugados:...+ H 2 O CO 3 2 + H 3 O + NH +4 + OH H 2 O +......+ H
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 5, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 5,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 5, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 5,
EJERCICIOS PARA EL PRIMER EXAMEN PARCIAL
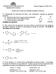 UNIVERSIDAD SIMÓN BLÍVAR Departamento de Química Química rgánica II (QM-2422) EJERCICIS PARA EL PRIMER EXAMEN PARCIAL 1.- Considerando las estructuras del fenol y del ciclohexanol, responda las siguientes
UNIVERSIDAD SIMÓN BLÍVAR Departamento de Química Química rgánica II (QM-2422) EJERCICIS PARA EL PRIMER EXAMEN PARCIAL 1.- Considerando las estructuras del fenol y del ciclohexanol, responda las siguientes
XXVI OLIMPIADA DE QUÍMICA OLIMPIADA LOCAL 2013 Logroño 14 de marzo
 XXVI OLIMPIADA DE QUÍMICA OLIMPIADA LOCAL 2013 Logroño 14 de marzo INSTRUCCIONES A. La duración de la prueba será de 2 horas. B. Conteste en la Hoja de Respuestas. C. Sólo hay una respuesta correcta para
XXVI OLIMPIADA DE QUÍMICA OLIMPIADA LOCAL 2013 Logroño 14 de marzo INSTRUCCIONES A. La duración de la prueba será de 2 horas. B. Conteste en la Hoja de Respuestas. C. Sólo hay una respuesta correcta para
, H 2 SO 4, HSO 4-. HClO 4, ClO 4-, H 2 O, H 3 O +, OH -, S =, H 2 S, HS -, NH 3, NH 4+, CO 3 =, HCO 3
 1 Aplicando la teoría de Bronsted y Lowry, razonar si son ciertas o falsas las siguientes afirmaciones a) Un ácido reacciona con su base conjugada dando lugar a una disolución neutra b) Un ácido reacciona
1 Aplicando la teoría de Bronsted y Lowry, razonar si son ciertas o falsas las siguientes afirmaciones a) Un ácido reacciona con su base conjugada dando lugar a una disolución neutra b) Un ácido reacciona
MODELO DE EXAMEN DE QUIMICA (25 AÑOS) INSTRUCCIONES PREGUNTAS
 MODELO DE EXAMEN DE QUIMICA (25 AÑOS) INSTRUCCIONES a. El examen de química consistirá en 30 preguntas de tipo test b. La duración del examen será de 1,5 horas. c. Sólo hay que elegir una respuesta por
MODELO DE EXAMEN DE QUIMICA (25 AÑOS) INSTRUCCIONES a. El examen de química consistirá en 30 preguntas de tipo test b. La duración del examen será de 1,5 horas. c. Sólo hay que elegir una respuesta por
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2009 PRIMERA PARTE
 1 PAU Química. Septiembre 2009 PRIMERA PARTE Cuestión 1. Considere los elementos A (Z = 12) y B (Z = 17). Conteste razonadamente: a) Cuáles son las configuraciones electrónicas de A y de B? Cuál es el
1 PAU Química. Septiembre 2009 PRIMERA PARTE Cuestión 1. Considere los elementos A (Z = 12) y B (Z = 17). Conteste razonadamente: a) Cuáles son las configuraciones electrónicas de A y de B? Cuál es el
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2013 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 201 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción B Reserva 2, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 201 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción B Reserva 2, Ejercicio
PRUEBAS EBAU QUÍMICA. Juan P. Campillo Nicolás 5 de agosto de 2017
 Juan P. Campillo Nicolás 5 de agosto de 2017 1 1. EL ÁTOMO. ENLACE QUÍMICO. 1. Tres elementos tienen las siguientes configuraciones electrónicas: A: 1s 2 2s 2 2p 6 3s 2 3p 6 ; B: 1s 2 2s 2 2p 6 3s 2 3p
Juan P. Campillo Nicolás 5 de agosto de 2017 1 1. EL ÁTOMO. ENLACE QUÍMICO. 1. Tres elementos tienen las siguientes configuraciones electrónicas: A: 1s 2 2s 2 2p 6 3s 2 3p 6 ; B: 1s 2 2s 2 2p 6 3s 2 3p
Ejercicios Equilibrio Químico
 Ejercicios Equilibrio Químico 1. En un recipiente de 10,0 L a 800K, se encierran 1,00 mol de CO(g) y 1,00 mol de H 2 O(g). Cuando se alcanza el equilibrio: CO(g) + H 2 O(g) CO 2 (g) + H 2 (g) se hallan
Ejercicios Equilibrio Químico 1. En un recipiente de 10,0 L a 800K, se encierran 1,00 mol de CO(g) y 1,00 mol de H 2 O(g). Cuando se alcanza el equilibrio: CO(g) + H 2 O(g) CO 2 (g) + H 2 (g) se hallan
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 5, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 5,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 5, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 5,
Universidad de Puerto Rico Recinto de Río Piedras Facultad de Ciencias Naturales Departamento de Química
 Universidad de Puerto Rico Recinto de Río Piedras acultad de Ciencias Naturales Departamento de Química QUM 3031 Nombre: Segundo Examen Parcial Número de Estudiante: 17 de octubre de 2013 Sección de Conferencia:
Universidad de Puerto Rico Recinto de Río Piedras acultad de Ciencias Naturales Departamento de Química QUM 3031 Nombre: Segundo Examen Parcial Número de Estudiante: 17 de octubre de 2013 Sección de Conferencia:
Tema 3 Estereoquímica
 Tema 3 Estereoquímica Introducción. Concepto de quiralidad. Centros estereogénicos. Atomos de carbono asimétricos. Enantiomería. Relación entre enantiomería y actividad óptica. Especificación de la configuración
Tema 3 Estereoquímica Introducción. Concepto de quiralidad. Centros estereogénicos. Atomos de carbono asimétricos. Enantiomería. Relación entre enantiomería y actividad óptica. Especificación de la configuración
26ª OLIMPÍADA ARGENTINA DE QUÍMICA 1DE SETIEMBRE DE 2016 CERTAMEN INTERCOLEGIAL NIVEL INICIAL - RESPUESTAS
 26ª OLIMPÍADA ARGENTINA DE QUÍMICA 1DE SETIEMBRE DE 2016 CERTAMEN INTERCOLEGIAL NIVEL INICIAL - RESPUESTAS 1. Los puntos de fusión normales del mercurio y del cesio son -39 C y 28 C, respectivamente. Indica
26ª OLIMPÍADA ARGENTINA DE QUÍMICA 1DE SETIEMBRE DE 2016 CERTAMEN INTERCOLEGIAL NIVEL INICIAL - RESPUESTAS 1. Los puntos de fusión normales del mercurio y del cesio son -39 C y 28 C, respectivamente. Indica
QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g)
![QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g) QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g)](/thumbs/49/25837773.jpg) OPCIÓN A QUÍMICA. 1. (2,5 puntos) Construya el ciclo de Born-aber y calcule la energía de red (Δ red ) del KCl(s) a partir de los siguientes datos: Entalpía estándar de formación del KCl(s) [Δ f (KCl)]
OPCIÓN A QUÍMICA. 1. (2,5 puntos) Construya el ciclo de Born-aber y calcule la energía de red (Δ red ) del KCl(s) a partir de los siguientes datos: Entalpía estándar de formación del KCl(s) [Δ f (KCl)]
PROBLEMAS DE SELECTIVIDAD. TEMA 7: QUÍMICA ORGÁNICA
 PROBLEMAS DE SELECTIVIDAD. TEMA 7: QUÍMICA ORGÁNICA 2015 1) Dados los compuestos CH 3 CH 2 CH 2 Br y CH 3 CH 2 CH = CH 2, indica, escribiendo la reacción correspondiente: a) El que reacciona con H 2 O/H
PROBLEMAS DE SELECTIVIDAD. TEMA 7: QUÍMICA ORGÁNICA 2015 1) Dados los compuestos CH 3 CH 2 CH 2 Br y CH 3 CH 2 CH = CH 2, indica, escribiendo la reacción correspondiente: a) El que reacciona con H 2 O/H
Problemas y cuestiones de REACCIONES ÁCIDO-BASE 2º de bachillerato. Química
 1 Problemas y cuestiones de REACCIONES ÁCIDO-BASE 2º de bachillerato. Química 1. Se prepara 500 ml de una disolución que contiene 0,2 moles de un ácido orgánico monoprótico cuyo ph es 5,7. calcule: a)
1 Problemas y cuestiones de REACCIONES ÁCIDO-BASE 2º de bachillerato. Química 1. Se prepara 500 ml de una disolución que contiene 0,2 moles de un ácido orgánico monoprótico cuyo ph es 5,7. calcule: a)
PROBLEMAS TIPO DE CÁLCULOS QUÍMICOS
 PROBLEMAS TIPO DE CÁLCULOS QUÍMICOS Átomos, moléculas y moles 1) Un tubo de ensayo contiene 25 ml de agua. Calcula: a) El número de moles de agua. b) El número total de átomos de hidrógeno. c) La masa
PROBLEMAS TIPO DE CÁLCULOS QUÍMICOS Átomos, moléculas y moles 1) Un tubo de ensayo contiene 25 ml de agua. Calcula: a) El número de moles de agua. b) El número total de átomos de hidrógeno. c) La masa
a) Una disolución acuosa 0,01 M de ácido nítrico tiene ph = 2. ph = log [H+] = log(0,01) = 2
![a) Una disolución acuosa 0,01 M de ácido nítrico tiene ph = 2. ph = log [H+] = log(0,01) = 2 a) Una disolución acuosa 0,01 M de ácido nítrico tiene ph = 2. ph = log [H+] = log(0,01) = 2](/thumbs/58/41715107.jpg) 1 PAU Química. Septiembre 2011. OPCIÓN A Pregunta 1A. Para los elementos A, B, C y D, de números atómicos 3, 10, 20 y 35, respectivamente: a) Escriba la configuración electrónica de cada uno de ellos.
1 PAU Química. Septiembre 2011. OPCIÓN A Pregunta 1A. Para los elementos A, B, C y D, de números atómicos 3, 10, 20 y 35, respectivamente: a) Escriba la configuración electrónica de cada uno de ellos.
ESTEREOQUÍMICA. ISÓMEROS Idéntica fórmula molecular. Tienen la misma conectividad atómica? ISÓMEROS CONSTITUCIONALES CH 3 CH 2 CH 2 OH CH 3 CH 2 OCH 3
 ISÓMERS Idéntica fórmula molecular ESTEREQUÍMICA Tienen la misma conectividad atómica? SI ESTEREISÓMERS N ISÓMERS CNSTITUCINALES C 3 C 2 C 2 C 3 C 2 C 3 Interconversión por rotación de enlaces? N ISÓMERS
ISÓMERS Idéntica fórmula molecular ESTEREQUÍMICA Tienen la misma conectividad atómica? SI ESTEREISÓMERS N ISÓMERS CNSTITUCINALES C 3 C 2 C 2 C 3 C 2 C 3 Interconversión por rotación de enlaces? N ISÓMERS
CENTRO: Examen adaptado a la PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOE) Curso
 CENTRO: Examen adaptado a la PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOE) Clave 9.1S.AN MATERIA: QUÍMICA Curso OPCIÓN A Cuestión 1.- Para el elemento alcalino del tercer periodo y para el tercer elemento
CENTRO: Examen adaptado a la PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOE) Clave 9.1S.AN MATERIA: QUÍMICA Curso OPCIÓN A Cuestión 1.- Para el elemento alcalino del tercer periodo y para el tercer elemento
Los enlaces C F son polares pero la geometría tetraédrica
 1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
