ENLACE QUÍMICO(II). ENLACE IÓNICO
|
|
|
- Francisco Valverde Chávez
- hace 5 años
- Vistas:
Transcripción
1 ENLACE QUÍMICO(II). ENLACE IÓNICO 11Na [Ne] 1s 1 Na + [Ne] 17 Cl [Ne] 3s 3p 5 Cl - [Ne] 3s 3p 6 Na + Cl Na + Cl NaCl sólido blanco p.f = 801ºC
2 Ejemplo 4Li(s) + O (g) Li O(s) P.f= 1700ºC 3Li 1s s 1 Li 1s 3Li 1s s 1 Li 1s 8O 1s s p 4 O 1s s p 6 Representación compacta: O + e - O - y Li Li + + e - Fórmulas de puntos de Lewis: Li + O Li O Ejemplo 3 Ca(s) + O (g) CaO(s) p.f = 580 o C. 0 Ca [Ar] 4s Ca [Ar]1s 8O [He]1s s p 4 O [He]1s s p 6 F Q Q 1 d
3 Formación de sólidos iónicos. Entalpía de red. 1.- Na(s) Na(g) H=9Kj.- 1/Cl (g) Cl(g) H=11Kj 3.- Na(g) Na + (g)+ e - H = 496Kj 4.- Cl(g) )+ e - Cl - (g) H = -349Kj 5.- Na + (g)+cl - (g) NaCl(s) H = -771Kj Hasta ahora: =148Kj Na(s) Na(g) H=9Kj Cl (g) Cl(g) H=11Kj Na(g) Na + (g)+ e - H = 496Kj Cl(g)+ e - Cl - (g) H = -349Kj Na + (g)+cl - (g) NaCl(s) H = -771Kj Na(s) + 1/Cl NaCl(s) H = -411Kj
4 Gráficamente PI=+496KJ Na(g) +Cl(g) Na + (g) +Cl(g) AE=-349KJ Na + (g) +Cl - (g) Hs + 1/ Hd=+9+11KJ HU=-771KJ Na(s) + 1/Cl (g) Hf=-411KJ NaCl(s)
5 Se denomina número de coordinación al número de vecinos más próximos que tiene un átomo o ion dado Entalpía de red:. Se define como la entalpia correspondiente al proceso de ruptura de la red para dar iones gaseosos
6 CICLO DE BORN-HABER Paso 1. entalpía de sublimación Paso. Entalpía de disociación Paso 3. Potencial de Ionización Paso 4. Afinidad electrónica Paso 5. Entalpía de red Paso 6. Entalpía de formación Hs Hd PI AE H U H f H f = Hs + ½ Hd + PI + AE + H U
7
8 Energía de atracción E Coulomb = Ecuación de Born-Lande 1 4πε 0 Z+ Z d Cl- Na+ d Red de NaCl
9 Red teórica d Unidimensional Cl- Na+ Cl- Na+ Cl- Na+ E Coulomb = 1 4πε E Coulomb d Z Z e 1 4πε Z+ Z d 1 4πε Z+ Z d 0 0 d 1 = 4πε 0 d Z+ Z e e e... E Coulomb 1 4πε 0 Z Z d + = e ln la energía de la red será: ln = 1,386 veces la del par iónico
10 CONSTANTE DE MADELUNG Structure M NaCl CsCl ZnS (blende) ZnS (wurtzite) CaF TiO CDI Al O La formula general para un mol de iones será: 1 e E Coulomb = 4 πε 0 NMZ + Z d
11 Energía de repulsión: E Coulomb = Energía total de red 1 4πε 0 NB n d FACTOR DE LANDE Ion Configuration n He 5 Ne 7 Ar 9 Kr 10 Xe 1 U NMZ + = ECoulomb + ERepulsión = + 4πε 0 d 4 1 Z e 1 πε 0 NB n d U 1 NMZ + Z e = ECoulomb + ERepulsión = 4πε 0 d + NB n d
12 du En equilibrio d=d o 0 dd = du dd o 1 4πε + = + n+ 1 0 d0 d0 B = NMZ Z e NMZ + Z e d 4πε n 0 n 1 0 NB = 0 U NMZ Z = + 4πε 0do e 1 1 n
13 Influencia de la entapia de red en las propiedades físicas de los compuestos Iónicos Variación del radio de X - y del punto de fusión para NaX (haluros de sodio) Radio del anión Å Punto de fusión 0 C NaF 1, NaCl 1, NaBr 1, NaI,
14
15 Solubilidad: Hidratación LiCl(s) Li + (ac) + Cl - (ac) Entalpía de disolución Hd Hd es la entalpia del proceso de disolución de un sólido Iónico Li + (g) Li + (ac) Entalpía de hidratación Hh Li + (g) +Cl - (g) H U =861KJ/mol LiCl(s) H H (Li + )+ H H (Cl - )= -558+(-340)=-898KJ/mol Hd=-37KJ Li + (ac) +Cl - (ac)
16 Solubilidad: Hidratación
17 Entalpías de hidratación en Kj/mol de algunos iones Ion Li + Na + K + Cl - Br - I - Li + Be + Al 3+ Hh Ej. Variación de la solubilidad de algunos haluros alcalinos LiF LiCl LiBr NaCl KCl RbCl Entalpía de hidratación Kj/mol Entalpía de red Entalpía de disolución Solubilidad mol/l 0, ,4 4, 6,0 Otras propiedades Sólidos Iónicos son duros y quebradizos Conductividad eléctrica: En estado sólido aislante Conductores de segunda especie en disolución
18 RADIO IONICO Los radios ionicos aumentan al bajar en un grupo. Li + < Na + < K + < Rb + < Cs + Los radios de los iones de la misma carga disminuyen a lo largo de un período Ca+>Mg+>Zn+ Ca+ > Ti+ > V+ Para iones isolelectronicos los aniones son mayores que los cationes, a medida que aumenta la carga nuclear el tamaño disminuye O- > F- > Na+ > Mg+ > Al3+ Cuando un ion puede encontrarse con entornos con indices de coordinación diferentes su radio aumenta a medida que lo hace el indice de coordinación. 4<6<8<10<1 Para un número de coordinación dado el radio iónico disminuye al aumentar el estado de oxidación. Cr+ > Cr3+ > Cr6+
19 METODOS DE DETERMINACIÓN DE RADIOS IONICOS Mediante RayosX se puede medir la distancia d 1 y la distancia d 3. Puesto que d 1 =r A r A =d 1 / La distancia I-I es el doble del radio del anión. 3 1 d r C 3 = = d r A 3 + r C d 1 = d 1 + r C Medidas experimentales de MI y de LiX permite calcular los radio de los cationes M + y de los aniones X - respectivamente.
20 Pauling parte del estudio de estructuras del tipo: NaF, KCl, RbBr, CsI Combinaciones entre un catión y un anión isoelectrónicos con un gas noble. Na + F - isoelectronicos con Ne K + Cl - isoelectronicos con Ar Z Rb + Br - isoelectronicos con Kr efectiva =Z-S Cs + I - isoelectronicos con Xe r = C Z ef C= una constante de proporcionalidad igual para iones isoelectrónicos C d = ra + rc = + Z C = d Z Z efanión efanión efanión + Z Z Z efcatión C efcatión efcatión [ Z ] efanión + ZefCatión = d ZefAnión ZefCatión C
21 RADIOS IÓNICOS Anion radii (6-coordinate) (pm) Elem. Rad. Elem. Rad. Cl(-1) 167 O(-) 16 Br(-1) 18 S(-) 170 F(-1)119 Se(-) 184 I(-1)06 Te(-) 07
22 A.4.1 Cation radii (6-coordinate) (pm) Radii are quoted for common oxidation states up to +3 (4 for Hf, Th, Ti, U, and Zr). Elem. Rad. Elem. Rad. Elem. Rad. Elem. Rad. Ag(+1) 19 Er(+3) Mn(+3) 7/78.5*Ta(+3) 86 Al(+3) 67.5 Eu(+) 131 Mo(+3) 83 Tb(+3) Au(+1) 151 Eu(+3) Na(+1) 116 Th(+4) 108 Au(+3) 99 Fe(+) 75/9.0*Nb(+3) 86 Ti(+) 100 Ba(+) 149 Fe(+3) 69/78.5*Nd(+3) 11.3 Ti(+3) 81.0 Be(+) 59 Ga(+3) 76.0 Ni(+) 83.0 Ti(+4) 74.5 Bi(+3) 117 Gd(+3) Pb(+) 133 Tl(+1) 164 Ca(+) 114 Hf(+4) 85 Pd(+) 100 Tl(+3) 10.5 Cd(+) 109 Hg(+1) 133 Pm(+3) 111 Tm(+3) 10.0 Ce(+3) 115 Hg(+) 116 Pr(+3) 113 U(+3) Ce(+4) 101 Ho(+3) Pt(+) 94 U(+4) 103 Co(+) 79/88.5*In(+3) 94.0 Rb(+1) 166 V(+) 93 Co(+3) 68.5/75*Ir(+3) 8 Rh(+3) 80.5 V(+3) 78.0 Cr(+) 87/94* K(+1) 15 Ru(+3) 8 Y(+3) Cr(+3) 75.5 La(+3) 117. Sb(+3) 90 Yb(+) 116 Cs(+1) 181 Li(+1) 90 Sc(+3) 88.5 Yb(+3) Cu(+1) 91 Lu(+3) Sm(+3) Zn(+) 88.0 Cu(+) 87 Mg(+) 86.0 Sr(+) 13 Zr(+4) 86 Dy(+3) 105. Mn(+) 81/97.0* * Low spin and high spin values (section 8..3)Source: Shannon,R.D. (1976) `Revised effective ionic radii in halides and chalcogenides, Acta Cryst. A3, 751. This includes further oxidation states and coordination numbers.
23 REDES IONICAS
24 RED CÚBICA CENTRADA EN EL CUERPO O RED DEL CLORURO DE CESIO. CsCl Indice de coordinación 8
25 RED CÚBICA CENTRADA EN LAS CARAS O RED DEL CLORURO DE SODIO. NaCl indice de coordinación es 6.
26 RED TETRAEDRICA O DEL SULFURO DE ZINC. ZnS (BLENDA). RED CUBICA CENTRADA EN LAS CARAS. Indice de coordinación=4
27 RED DE LA FLUORITA CaF Los iones Ca + forman una red cúbica centrada en las caras los iones fluoruro F - de los que hay el doble ocupan los huecos tetraédricos
28 RED DEL RUTILO. Toma su nombre del rutilo un mineral de TiO. Cada catión Ti 4+ se rodea de 6 aniones oxido O - octaédricamente, cada aniones oxido se rodea de 3 cationes Titanio en triangulo
29 INDICES DE COORDINACIÓN cos 45 = r A 0.93r r r C A r = 0.707r A = ra + r A A C r = 0.707r C = C
30 D =(r A ) + (r A ) = 8r A r A r C r A r A + r C = 8r A + (r A ) = 3 r A r C = 3 r A -r A r A D r A r C = ( 3 1)r A r C / r A =0,73 Indice de Coordinación Geometria r C /r A Red Lineal <0, Trigonal 0,155-0,5 O - en rutilo 4 Tetraedrica 0,5-0,414 ZnS (Blenda) 4 Planocuadrada 0,414-0, Octaedrica 0,414-0,73 NaCl 8 Cúbica 0,73-1,00 CsCl
31
32
33 Calculo del número neto de iones Na + y Cl - en la celda unitaria de NaCl, (cúbica centrada en las caras) = 4iones 8 Cloruro 1 1() = 4iones Sodio 4 Por lo que la estequiometría para el NaCl es 1:1
34 Cáracter Iónico de los enlaces covalentes ( AB) E( AB) = = E( AA) + E( AB) E( BB) Energía de Resonancia Iónica E( AA) + E( BB) E(AB) se expresa en kj mol -1 (1 electron volt, 1eV, = kjmol -1 χ=χ A - χ B representa la diferencia de electronegatividad entre dos elementos. E( AB) = E( AA) + E( BB) ( χ A χ B )
35 BOND ENERGY BOND ENERGY BOND ENERGY H-H 104. P-H 76.4 Si-Cl 85.7 C-C 83.1 As-H 58.6 Si-Br 69.1 Si-Si 4. O-H Si-I 50.9 Ge-Ge 37.6 S-H 81.1 Ge-Cl 97.5 Sn-Sn 34. Se-H 66.1 N-F 64.5 N-N 38.4 Te-H 57.5 N-Cl 47.7 P-P 51.3 H-F P-Cl 79.1 As-As 3.1 H-Cl 103. P-Br 65.4 Sb-Sb 30. H-Br 87.5 P-I 51.4 Bi-Bi 5 H-I 71.4 As-F O-O 33. C-Si 69.3 As-Cl 68.9 S-S 50.9 C-N 69.7 As-Br 56.5 Se-Se 44.0 C-O 84.0 As-I 41.6 Te-Te 33 C-S 6.0 O-F 44. F-F 36.6 C-F O-Cl 48.5 Cl-Cl 58.0 C-Cl 78.5 S-Cl 59.7 Br-Br 46.1 C-Br 65.9 S-Br 50.7 I-I 36.1 C-I 57.4 Cl-F 60.6 C-H 98.8 Si-O 88. Br-Cl 5.3 Si-H 70.4 Si-S 54. I-Cl 50.3 N-H 93.4 Si-F 19.3 I-Br 4.5
36 ESCALA DE PAULING Li 1,0 Be 1,55 B,0 C,5 N 3,0 O 3,5F 4,0 Na 0,9 Mg 1, Al 1,5 Si 1,8 P,1 S,5Cl 3,0 K 0,8Ca 1,0 Sc 1,3 Ti 1,55 V 1,6 Cr 1,66 Mn 1,5 Fe 1,8 Co 1,9 Ni 1,9 Cu 1,9 Zn 1,6 Ga 1,6 Ge 1,8 As,0 Se,4 Br,8 Rb 0,8 Sr 1,0 Y 1, Zr 1,4 Nb 1,6 Mo 1,8 Tc 1,9 Ru, Rh, Pd, Ag 1,9 Cd 1,7 In 1,7 Sn 1,8 Sb 1,9 Te,1 I,5 Cs 0,7 Ba 0,9 La-Lu 1,0-1, Hf 1,3 Ta 1,5 W 1,7 Re 1,9 Os, Ir, Pt, Au,4 Hg 1,9 Tl 1,8 Pb 1,9 Bi 1,9 Po,0 At, Fr 0,7 Ra 0,9 Ac 1,1 Th 1,3 Pa 1,4 U 1,4 Np-No 1,4-1,3
37 REGLAS DE FAJANS PERMITEN INTERPRETAR EL GRADO DE COVALENCIA DE UN ENLACE IONICO. -Los aniones grandes y de alta carga son blandos, es decir, polarizables. -Los cationes pequeños y de alta carga polarizan más que los grandes de baja carga. -Los cationes de los metales de transición son más polarizantes que los de los grupos pirncipales. Los electrones d apantallan menos la carga que los p Pa r io nic o idealizado (Sin polarizar) Pa r io nic o polarizado
38 BeCl 405ºC LiF 870ºC LiBr 547ºC CaCl 77 LiCl 613 NaBr 755 HgCl 76 LiBr 547 KBr 730 LiI 446 Radio del anión Es más polarizable Grado de covalencia P.fusión Radio del Catión Es menos polarizante Grado de covalencia P.fusión KJ/mol Entalpía de red experimental Entalpía de red teórica MgBr MgI MnBr MnI
CAPITULO 2 LA TABLA PERIODICA
 1.0079 1 H HIDROGENO 6.941 3 Li LITIO 22.989 11 Na SODIO 30.098 19 K POTASIO CAPITULO 2 LA TABLA PERIODICA ORDENAMIENTO ACTUAL GRUPOS Y PERIODOS PROPIEDADES PERIODICAS TAMAÑO POTENCIAL DE IONIZACION AFINIDAD
1.0079 1 H HIDROGENO 6.941 3 Li LITIO 22.989 11 Na SODIO 30.098 19 K POTASIO CAPITULO 2 LA TABLA PERIODICA ORDENAMIENTO ACTUAL GRUPOS Y PERIODOS PROPIEDADES PERIODICAS TAMAÑO POTENCIAL DE IONIZACION AFINIDAD
J. ISASI Ilustraciones: J. Isasi y L. Alcaraz
 J. ISASI Ilustraciones: J. Isasi y L. Alcaraz La Tabla Periódica de los elementos. Propiedades periódicas. Electronegatividad. División de los elementos en metales y no metales. LA TABLA PERIÓDICA DE LOS
J. ISASI Ilustraciones: J. Isasi y L. Alcaraz La Tabla Periódica de los elementos. Propiedades periódicas. Electronegatividad. División de los elementos en metales y no metales. LA TABLA PERIÓDICA DE LOS
Tema 4: Propiedades periódicas de los elementos - 1 -
 Tema 4: Propiedades periódicas de los - - BIBLIOGRAFÍA: * Estructura atómica y enlace químico J. Casabó i Gispert * Química. Curso Universitario B.M. Mahan y R.J. Myers * Química General R.H. Petrucci,
Tema 4: Propiedades periódicas de los - - BIBLIOGRAFÍA: * Estructura atómica y enlace químico J. Casabó i Gispert * Química. Curso Universitario B.M. Mahan y R.J. Myers * Química General R.H. Petrucci,
Masa y composición isotópica de los elementos
 Masa y composición isotópica de los elementos www.vaxasoftware.com Z Sím A isótopo Abndancia natral Vida Prodcto 1 H 1 1,00782503207(10) 99,9885(70) 1,00794(7) estable D 2 2,0141017780(4) 0,0115(70) estable
Masa y composición isotópica de los elementos www.vaxasoftware.com Z Sím A isótopo Abndancia natral Vida Prodcto 1 H 1 1,00782503207(10) 99,9885(70) 1,00794(7) estable D 2 2,0141017780(4) 0,0115(70) estable
OLIMPIADA DEPARTAMENTAL DE QUÍMICA 2011 NIVEL 2
 Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA 2011 NIVEL 2 NOMENCLATURA, FORMULACIÓN Y REACTIVIDAD QUÍMICA (1) Complete el siguiente cuadro indicando nombre (utilizar nomenclatura
Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA 2011 NIVEL 2 NOMENCLATURA, FORMULACIÓN Y REACTIVIDAD QUÍMICA (1) Complete el siguiente cuadro indicando nombre (utilizar nomenclatura
OLIMPIADA DEPARTAMENTAL DE QUÍMICA 2011 NIVEL 3
 Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA 2011 NIVEL 3 NOMENCLATURA, FORMULACIÓN Y REACTIVIDAD INORGÁNICA (1) Complete el siguiente cuadro: En cuanto a la naturaleza química,
Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA 2011 NIVEL 3 NOMENCLATURA, FORMULACIÓN Y REACTIVIDAD INORGÁNICA (1) Complete el siguiente cuadro: En cuanto a la naturaleza química,
elementos Tabla periódica
 Periodicidad de los elementos Tabla periódica Aunque algunos elementos como el oro, plata, estaño, cobre, plomo y mercurio ya eran conocidos desde la antigüedad, el primer descubrimiento científico de
Periodicidad de los elementos Tabla periódica Aunque algunos elementos como el oro, plata, estaño, cobre, plomo y mercurio ya eran conocidos desde la antigüedad, el primer descubrimiento científico de
La tabla periódica. Julius Lothar Meyer. Dimitri Ivanovich Mendeleev
 La tabla periódica Julius Lothar Meyer Dimitri Ivanovich Mendeleev Silvia Ponce López ITESM, Julio 2007 Contenidos Organización de los elementos en la tabla periódica Propiedades periódicas: radio atómico,
La tabla periódica Julius Lothar Meyer Dimitri Ivanovich Mendeleev Silvia Ponce López ITESM, Julio 2007 Contenidos Organización de los elementos en la tabla periódica Propiedades periódicas: radio atómico,
Continuo movimiento al azar. Largas, desiguales
 Gas Fuerzas Orden Distancias Propiedades Despreciables frente a la agitación térmica Continuo movimiento al azar Largas, desiguales Volúmenes variables, fluidos, bajas densidades, se difunden con rapidez
Gas Fuerzas Orden Distancias Propiedades Despreciables frente a la agitación térmica Continuo movimiento al azar Largas, desiguales Volúmenes variables, fluidos, bajas densidades, se difunden con rapidez
XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2012 NIVEL 3
 XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2012 NIVEL 3 Datos del estudiante. Nombre Cédula de identidad Ciudad de origen Ciudad donde toma la prueba Departamento Liceo al que pertenece Año que cursa Nomenclatura,
XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2012 NIVEL 3 Datos del estudiante. Nombre Cédula de identidad Ciudad de origen Ciudad donde toma la prueba Departamento Liceo al que pertenece Año que cursa Nomenclatura,
Oxidación de los metales y propiedades periódicas
 Oxidación de los metales y propiedades periódicas Pregunta a responder al final de la sesión: Cuál de las propiedades periódicas de los elementos varía igual que su tendencia a oxidarse? Introducción En
Oxidación de los metales y propiedades periódicas Pregunta a responder al final de la sesión: Cuál de las propiedades periódicas de los elementos varía igual que su tendencia a oxidarse? Introducción En
Oxidación de los metales y propiedades periódicas
 Oxidación de los metales y propiedades periódicas Pregunta a responder al final de la sesión: Cuál de las propiedades periódicas de los elementos varía igual que su tendencia a oxidarse? Introducción En
Oxidación de los metales y propiedades periódicas Pregunta a responder al final de la sesión: Cuál de las propiedades periódicas de los elementos varía igual que su tendencia a oxidarse? Introducción En
Acidez de los cationes metálicos
 Acidez de los cationes metálicos Pregunta a responder al final de la sesión: Cuáles son las propiedades de un ion metálico que influyen en su fuerza ácida y cómo varía ésta en función de dichas propiedades?
Acidez de los cationes metálicos Pregunta a responder al final de la sesión: Cuáles son las propiedades de un ion metálico que influyen en su fuerza ácida y cómo varía ésta en función de dichas propiedades?
ÁCIDOS Y BASES DUROS Y BLANDOS.
 ÁCIDOS Y BASES DUROS Y BLANDOS. 4602 Pb(CH 3 COO) 2 + 2KI H 2 O PbI 2 + 2 K(CH 3 COO) 4603 2Na + H 2 O 2NaOH + H 2 ACIDOS Y BASES DUROS Y BLANDOS COMO PODEMOS SABER LA DIRECCION EN QUE OCURREN LAS SIGUIENTES
ÁCIDOS Y BASES DUROS Y BLANDOS. 4602 Pb(CH 3 COO) 2 + 2KI H 2 O PbI 2 + 2 K(CH 3 COO) 4603 2Na + H 2 O 2NaOH + H 2 ACIDOS Y BASES DUROS Y BLANDOS COMO PODEMOS SABER LA DIRECCION EN QUE OCURREN LAS SIGUIENTES
Tema 4: Propiedades periódicas de los elementos - 1 -
 Tema 4: Propiedades periódicas de los elementos - - BIBLIOGRAFÍA: * Estructura atómica y enlace químico J. Casabó i Gispert * Química. Curso Universitario B.M. Mahan y R.J. Myers * Química General R.H.
Tema 4: Propiedades periódicas de los elementos - - BIBLIOGRAFÍA: * Estructura atómica y enlace químico J. Casabó i Gispert * Química. Curso Universitario B.M. Mahan y R.J. Myers * Química General R.H.
XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2012 NIVEL 1
 XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2012 NIVEL 1 Datos del estudiante. Nombre Cédula de identidad Ciudad de origen Ciudad donde toma la prueba Departamento Liceo al que pertenece Año que cursa Naturaleza
XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2012 NIVEL 1 Datos del estudiante. Nombre Cédula de identidad Ciudad de origen Ciudad donde toma la prueba Departamento Liceo al que pertenece Año que cursa Naturaleza
CAPITULO 4 SISTEMAS IONICOS
 CAPITULO 4 SISTEMAS IONICOS 1 CUÁL DE LAS SIGUIENTES REACCIONES OCURRE EN SENTIDO INVERSO AL INDICADO? A) HCl + NaBr HBr + NaCl B) CsF + LiBr CsBr + LiF C) CaO + SrS CaS + SrO D) CaSO 4 + 2LiF Li 2 SO
CAPITULO 4 SISTEMAS IONICOS 1 CUÁL DE LAS SIGUIENTES REACCIONES OCURRE EN SENTIDO INVERSO AL INDICADO? A) HCl + NaBr HBr + NaCl B) CsF + LiBr CsBr + LiF C) CaO + SrS CaS + SrO D) CaSO 4 + 2LiF Li 2 SO
CENTRO DE ESTUDIOS MIRASIERRA
 LOS ELECTRONES Y LA TABLA PERIÓDICA CONFIGURACIONES ELECTRONICAS La configuración electrónica del átomo es la designación de los orbitales ocupados por todos los electrones en el átomo. La anotación utilizada
LOS ELECTRONES Y LA TABLA PERIÓDICA CONFIGURACIONES ELECTRONICAS La configuración electrónica del átomo es la designación de los orbitales ocupados por todos los electrones en el átomo. La anotación utilizada
ENLACE IÓNICO. Dra. Silvia Elena Castillo Blum
 ENLACE IÓNICO Dra. Silvia Elena Castillo Blum Enlace Químico ENLACE IÓNICO ENLACE COVALENTE ENLACE METÁLICO 2 Definición IUPAC Hay un enlace químico entre dos átomos o grupos de átomos cuando las fuerzas
ENLACE IÓNICO Dra. Silvia Elena Castillo Blum Enlace Químico ENLACE IÓNICO ENLACE COVALENTE ENLACE METÁLICO 2 Definición IUPAC Hay un enlace químico entre dos átomos o grupos de átomos cuando las fuerzas
Objetivo. Introducción. Palabras clave. Desarrollo. Química Unidad 8 Enlace químico. 1. Interacciones entre átomos
 Química Unidad 8 Enlace químico Objetivo Comprender los conceptos básicos de los modelos de enlace iónico, covalente y metálico. Introducción Los electrones cumplen un papel fundamental en la formación
Química Unidad 8 Enlace químico Objetivo Comprender los conceptos básicos de los modelos de enlace iónico, covalente y metálico. Introducción Los electrones cumplen un papel fundamental en la formación
OLIMPIADA DEPARTAMENTAL DE QUÍMICA 2010 NIVEL 2
 Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA 2010 NIVEL 2 NOMENCLATURA, FORMULACIÓN Y REACTIVIDAD QUÍMICA (1) Complete el siguiente cuadro indicando nombre (utilizar nomenclatura
Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA 2010 NIVEL 2 NOMENCLATURA, FORMULACIÓN Y REACTIVIDAD QUÍMICA (1) Complete el siguiente cuadro indicando nombre (utilizar nomenclatura
OLIMPIADA DEPARTAMENTAL DE QUÍMICA 2010 NIVEL 3
 Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA 2010 NIVEL 3 NOMENCLATURA, FORMULACIÓN Y REACTIVIDAD QUÍMICA (1) Complete el siguiente cuadro indicando nombre (utilizar nomenclatura
Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA 2010 NIVEL 3 NOMENCLATURA, FORMULACIÓN Y REACTIVIDAD QUÍMICA (1) Complete el siguiente cuadro indicando nombre (utilizar nomenclatura
CÚBICA SIMPLE HEXAGONAL ROMBOÉDRICA
 Formas de las celdas CÚBICA SIMPLE HEXAGONAL ROMBOÉDRICA TRICLÍNICA 1 1 2 3 4 C 2 3 4 5 6 5 6 7 B 8 3 1 5 2 8 A 8 6 4 Capa a Capa b Capa a Los cationes (más pequeños) ocupan los huecos formados por el
Formas de las celdas CÚBICA SIMPLE HEXAGONAL ROMBOÉDRICA TRICLÍNICA 1 1 2 3 4 C 2 3 4 5 6 5 6 7 B 8 3 1 5 2 8 A 8 6 4 Capa a Capa b Capa a Los cationes (más pequeños) ocupan los huecos formados por el
Temario INTRODUCCIÓN A LA QUÍMICA INORGÁNICA. Conceptos previos. Clase 2 Cambios energéticos y propiedades químicas. Clase 1. Clase 3 Compuestos del H
 Temario INTRDUCCIÓN A LA QUÍMICA INRGÁNICA Química Inorgánica 7 Introducción a la Química Inorgánica Estructura de elementos y compuestos Metales y aleaciones Ácidos y bases Química en solución acuosa
Temario INTRDUCCIÓN A LA QUÍMICA INRGÁNICA Química Inorgánica 7 Introducción a la Química Inorgánica Estructura de elementos y compuestos Metales y aleaciones Ácidos y bases Química en solución acuosa
Las Propiedades Periódicas. Química Inorgánica I. Sigfrido Escalante Tovar sep-2008
 Las Propiedades Periódicas Química Inorgánica I Sigfrido Escalante Tovar sep-2008 Créditos y referencias Facultad de Química El material que sigue está conformado por trabajo original y material tomado
Las Propiedades Periódicas Química Inorgánica I Sigfrido Escalante Tovar sep-2008 Créditos y referencias Facultad de Química El material que sigue está conformado por trabajo original y material tomado
Acidez de los cationes metálicos
 Acidez de los cationes metálicos Pregunta a responder al final de la sesión: Cuáles son las propiedades de un ion metálico que influyen en su fuerza ácida y cómo varía ésta en función de dichas propiedades?
Acidez de los cationes metálicos Pregunta a responder al final de la sesión: Cuáles son las propiedades de un ion metálico que influyen en su fuerza ácida y cómo varía ésta en función de dichas propiedades?
3.4. FORMULACIÓN Y NOMENCLATURA I.
 3.4. FORMULACIÓN Y NOMENCLATURA I. 3.4.1. SÍMBOLOS QUÍMICOS. Cada elemento químico se identifica con un nombre, aprobado por la IUPAC, International Union of Pure and Applied Chemestry - Unión Internacional
3.4. FORMULACIÓN Y NOMENCLATURA I. 3.4.1. SÍMBOLOS QUÍMICOS. Cada elemento químico se identifica con un nombre, aprobado por la IUPAC, International Union of Pure and Applied Chemestry - Unión Internacional
Estructura de la Materia
 Estructura de la Materia Décimo cuarta sesión Propiedades periódicas de los elementos (2) Energía de Ionización (Potenciales de ionización) Primera Energía de Ionización La primera energía de ionización
Estructura de la Materia Décimo cuarta sesión Propiedades periódicas de los elementos (2) Energía de Ionización (Potenciales de ionización) Primera Energía de Ionización La primera energía de ionización
ESPECTROSCOPIA ATÓMICA Q.F. ALEX SILVA ARAUJO
 Q.F. ALEX SILVA ARAUJO GENERALIDADES La Espectroscopia Atómica se basa en la absorción, emisión o fluorescencia por átomos o iones elementales. Hay tres regiones del espectro que dan información atómica:
Q.F. ALEX SILVA ARAUJO GENERALIDADES La Espectroscopia Atómica se basa en la absorción, emisión o fluorescencia por átomos o iones elementales. Hay tres regiones del espectro que dan información atómica:
Las Propiedades Periódicas. Química Inorgánica I. Sigfrido Escalante Tovar ago-2016
 Las Propiedades Periódicas Química Inorgánica I Sigfrido Escalante Tovar ago-2016 Créditos y referencias El material que sigue está conformado por trabajo original y material tomado de las varias fuentes,
Las Propiedades Periódicas Química Inorgánica I Sigfrido Escalante Tovar ago-2016 Créditos y referencias El material que sigue está conformado por trabajo original y material tomado de las varias fuentes,
Enlace Químico: Compuestos Químicos
 Enlace Químico: Compuestos Químicos Contenidos Introducción. Enlace Iónico. Enlace Covalente. S 8 Enlace Metálico. Introducción. En general los objetos están formados por conjuntos de átomos iguales (elementos)
Enlace Químico: Compuestos Químicos Contenidos Introducción. Enlace Iónico. Enlace Covalente. S 8 Enlace Metálico. Introducción. En general los objetos están formados por conjuntos de átomos iguales (elementos)
QUIMICA DE MATERIALES
 QUIMICA DE MATERIALES UNIDAD 1: ESTRUCTURA ATOMICA Y ELECTRONICA 1.1 Componentes fundamentales de los Atomos Algunos modelos atómicos 188-181 Dalton 1898-194 Thomson 1911 Rutherford 192 Bohr 1 Modelo de
QUIMICA DE MATERIALES UNIDAD 1: ESTRUCTURA ATOMICA Y ELECTRONICA 1.1 Componentes fundamentales de los Atomos Algunos modelos atómicos 188-181 Dalton 1898-194 Thomson 1911 Rutherford 192 Bohr 1 Modelo de
Para qué se unen los átomos? Es la fuerza que mantiene unidos dos átomos cualesquiera.
 Es la fuerza que mantiene unidos dos átomos cualesquiera. Enlace iónico : Es la fuerza que mantiene unidos átomos de electronegatividades muy diferentes. Enlace cova1ente: Es la fuerza que mantiene unidos
Es la fuerza que mantiene unidos dos átomos cualesquiera. Enlace iónico : Es la fuerza que mantiene unidos átomos de electronegatividades muy diferentes. Enlace cova1ente: Es la fuerza que mantiene unidos
2. Sistema Periódico de los elementos
 2. Sistema Periódico de los elementos ACTIVIDADES (pág. 35) La Tabla Periódica consta de 18 grupos porque corresponde a los electrones que caben en los subniveles s, p y d juntos: 2 + 6 + 10 = 18. El número
2. Sistema Periódico de los elementos ACTIVIDADES (pág. 35) La Tabla Periódica consta de 18 grupos porque corresponde a los electrones que caben en los subniveles s, p y d juntos: 2 + 6 + 10 = 18. El número
Las Propiedades Periódicas. Química Inorgánica I Curso Intersemestral. Sigfrido Escalante Tovar ene-2015
 Las Propiedades Periódicas Química Inorgánica I Curso Intersemestral Sigfrido Escalante Tovar ene-2015 Créditos y referencias El material que sigue está conformado por trabajo original y material tomado
Las Propiedades Periódicas Química Inorgánica I Curso Intersemestral Sigfrido Escalante Tovar ene-2015 Créditos y referencias El material que sigue está conformado por trabajo original y material tomado
XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2013 NIVEL 2
 XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2013 NIVEL 2 Datos del estudiante. Nombre Cédula de identidad Ciudad de origen Ciudad donde toma la prueba Departamento Liceo al que pertenece Año que cursa Nomenclatura
XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2013 NIVEL 2 Datos del estudiante. Nombre Cédula de identidad Ciudad de origen Ciudad donde toma la prueba Departamento Liceo al que pertenece Año que cursa Nomenclatura
XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2013 NIVEL 1
 XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2013 NIVEL 1 Datos del estudiante. Nombre Cédula de identidad Ciudad de origen Ciudad donde toma la prueba Departamento Liceo al que pertenece Año que cursa Naturaleza
XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2013 NIVEL 1 Datos del estudiante. Nombre Cédula de identidad Ciudad de origen Ciudad donde toma la prueba Departamento Liceo al que pertenece Año que cursa Naturaleza
UNIVERSIDAD NACIONAL AGRARIA LA MOLINA CENTRO DE ESTUDIOS PREUNIVERSITARIOS SEGUNDO SEMINARIO DE QUIMICA
 UNIVERSIDAD NACIONAL AGRARIA LA MOLINA CENTRO DE ESTUDIOS PREUNIVERSITARIOS SEGUNDO SEMINARIO DE QUIMICA 1. La configuración electrónica del átomo del elemento E es: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
UNIVERSIDAD NACIONAL AGRARIA LA MOLINA CENTRO DE ESTUDIOS PREUNIVERSITARIOS SEGUNDO SEMINARIO DE QUIMICA 1. La configuración electrónica del átomo del elemento E es: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
TEMA 16. Óxidos de los elementos no metálicos I. J. Isasi
 TEMA 16. Óxidos de los elementos no metálicos I. J. Isasi Introducción: tipos de óxidos. Clasificación de los óxidos de los elementos de la tabla periódica. Óxidos de los no metales. Características generales.
TEMA 16. Óxidos de los elementos no metálicos I. J. Isasi Introducción: tipos de óxidos. Clasificación de los óxidos de los elementos de la tabla periódica. Óxidos de los no metales. Características generales.
Los sólidos iónicos. Estructuras características de los sólidos iónicos
 Los sólidos iónicos Los compuestos iónicos suelen presentar una serie de características físicas que los distinguen de los covalentes. Así, los sólidos iónicos como el cloruro sódico y el nitrato de potasio
Los sólidos iónicos Los compuestos iónicos suelen presentar una serie de características físicas que los distinguen de los covalentes. Así, los sólidos iónicos como el cloruro sódico y el nitrato de potasio
Enlace iónico. elemento poco. elemento muy + electronegativo. compuesto iónico (sal) electronegativo
 Enlace iónico Enlace iónico Necesitamos un nuevo modelo para explicar ciertas peculiaridades (Li2O). Este nuevo modelo es el enlace iónico Se forma por transferencia de electrones (no hay reparto equitativo,
Enlace iónico Enlace iónico Necesitamos un nuevo modelo para explicar ciertas peculiaridades (Li2O). Este nuevo modelo es el enlace iónico Se forma por transferencia de electrones (no hay reparto equitativo,
Objetivos del tema. Tema 4 Propiedades atómicas. Contenido del tema. El tamaño de los atomos. Bibliografía!Tema 10 del Petrucci (pag.
 Módulo 12865- Enlace Químico y Estructura de la Materia Responsable: Juan José Borrás (juan.j.borras@uv.es) Grupo D- Aula F-11 http://www.uv.es/~borrasj Tema 4 Propiedades atómicas Bibliografía!Tema 10
Módulo 12865- Enlace Químico y Estructura de la Materia Responsable: Juan José Borrás (juan.j.borras@uv.es) Grupo D- Aula F-11 http://www.uv.es/~borrasj Tema 4 Propiedades atómicas Bibliografía!Tema 10
Prueba experimental NIVEL 3
 DETERMINACIÓN DE LA CONSTANTE DE PRODUCTO DE SOLUBILIDAD DEL NITRATO DE BARIO Prueba experimental NIVEL 3 Total: 100 puntos INTRODUCCIÓN El nitrato de bario es un sólido blanco que se utiliza industrialmente
DETERMINACIÓN DE LA CONSTANTE DE PRODUCTO DE SOLUBILIDAD DEL NITRATO DE BARIO Prueba experimental NIVEL 3 Total: 100 puntos INTRODUCCIÓN El nitrato de bario es un sólido blanco que se utiliza industrialmente
Seminario Cuántos protones, neutrones y electrones hay en el: a) Nitrógeno-14. Numero Atómico de Nitrógeno 7. Protones 7
 Seminario 1 1.- Cuántos protones, neutrones y electrones hay en el: a) Nitrógeno-14 Numero Atómico de Nitrógeno 7 Protones 7 Protones + Neutrones 14 Neutrones 7 Electrones 7 b) Nitrógeno-15 Numero Atómico
Seminario 1 1.- Cuántos protones, neutrones y electrones hay en el: a) Nitrógeno-14 Numero Atómico de Nitrógeno 7 Protones 7 Protones + Neutrones 14 Neutrones 7 Electrones 7 b) Nitrógeno-15 Numero Atómico
No empiece el ejercicio hasta que se le indique. Debe contestar en la plantilla de respuestas.
 UNIVERSIDAD POLITÉCNICA DE VALENCIA OLIMPIADA DE QUÍMICA 2014-2015 FASE LOCAL - CUESTIONES 27 de marzo de 2015 Dispone de un tiempo máximo de noventa minutos para esta parte de la prueba. Sólo hay 1 respuesta
UNIVERSIDAD POLITÉCNICA DE VALENCIA OLIMPIADA DE QUÍMICA 2014-2015 FASE LOCAL - CUESTIONES 27 de marzo de 2015 Dispone de un tiempo máximo de noventa minutos para esta parte de la prueba. Sólo hay 1 respuesta
Tema 2. Enlace químico
 Tema 2 Enlace químico Enlace químico Fuerzas atractivas que mantienen unidos a los átomos o los iones de un compuesto. - Átomos independientes - Mayor energía - Menor estabilidad Energía liberada - Átomos
Tema 2 Enlace químico Enlace químico Fuerzas atractivas que mantienen unidos a los átomos o los iones de un compuesto. - Átomos independientes - Mayor energía - Menor estabilidad Energía liberada - Átomos
CUAL DE LAS SIGUIENTES CARACTERISTICAS DEFINEN MEJOR A UN COMPUESTO IONICO?
 CUAL DE LAS SIGUIENTES CARACTERISTICAS DEFINEN MEJOR A UN COMPUESTO IONICO? A) FORMA CRISTALES B) FUNDE A ALTAS TEMPERATURAS C) CONDUCE ELECTRICIDAD EN DISOLUCION D) ES INCOLORO E) ES DURO 5- CUÁL DE LOS
CUAL DE LAS SIGUIENTES CARACTERISTICAS DEFINEN MEJOR A UN COMPUESTO IONICO? A) FORMA CRISTALES B) FUNDE A ALTAS TEMPERATURAS C) CONDUCE ELECTRICIDAD EN DISOLUCION D) ES INCOLORO E) ES DURO 5- CUÁL DE LOS
PROBLEMAS TIPO DEL ÁTOMO, LA TABLA Y EL ENLACE
 PROBLEMAS TIPO DEL ÁTOMO, LA TABLA Y EL ENLACE Del átomo 1) Dados los conjuntos de números cuánticos: (2,1,2, 1 2); (3,1, 1, 1 2); (2,2,1, 1 2); (3,2, 2, 1 2) a) Razone cuáles no son permitidos. b) Indique
PROBLEMAS TIPO DEL ÁTOMO, LA TABLA Y EL ENLACE Del átomo 1) Dados los conjuntos de números cuánticos: (2,1,2, 1 2); (3,1, 1, 1 2); (2,2,1, 1 2); (3,2, 2, 1 2) a) Razone cuáles no son permitidos. b) Indique
Reacciones de iones hidratados
 Reacciones de iones hidratados Qca. en solución acuosa Reactividad química en agua Especies solubles Partículas suspendidas Complejos discretos ej., [Cl x ] (n-x)+ Partículas coloides, agregados óxidos
Reacciones de iones hidratados Qca. en solución acuosa Reactividad química en agua Especies solubles Partículas suspendidas Complejos discretos ej., [Cl x ] (n-x)+ Partículas coloides, agregados óxidos
Contenido. Minerales
 Contenido Minerales metales Mena, ganga, ley mineral Tipo de minerales Estructura de los materiales Tipo de enlaces: iónico, covalente, metálico, van der Waals, hidrógeno 1 Minerales Minerales sustancia
Contenido Minerales metales Mena, ganga, ley mineral Tipo de minerales Estructura de los materiales Tipo de enlaces: iónico, covalente, metálico, van der Waals, hidrógeno 1 Minerales Minerales sustancia
! Introducción a los sólidos iónicos! Qué elementos los forman?! Qué tipos de fuerzas mantienen la cohesión del cristal?
 Tema 8. Sólidos iónicos Estructura del NaCl Contenidos! Introducción a los sólidos iónicos! Qué elementos los forman?! Qué tipos de fuerzas mantienen la cohesión del cristal?! Propiedades de los sólidos
Tema 8. Sólidos iónicos Estructura del NaCl Contenidos! Introducción a los sólidos iónicos! Qué elementos los forman?! Qué tipos de fuerzas mantienen la cohesión del cristal?! Propiedades de los sólidos
CURSO DE AGUAS SUBTERRANEAS TEMA 13: LA CALIDAD DEL AGUA SUBTERRÁNEA
 CURSO DE AGUAS SUBTERRANEAS 2010 TEMA 13: LA CALIDAD DEL AGUA SUBTERRÁNEA Mario Valencia Cuesta Geólogo AGUAS SUBTERRÁNEAS LTDA. aguassubterraneas@gmail.com INTRODUCCION A LAS AGUAS SUBTERRANEAS 2010 TEMA
CURSO DE AGUAS SUBTERRANEAS 2010 TEMA 13: LA CALIDAD DEL AGUA SUBTERRÁNEA Mario Valencia Cuesta Geólogo AGUAS SUBTERRÁNEAS LTDA. aguassubterraneas@gmail.com INTRODUCCION A LAS AGUAS SUBTERRANEAS 2010 TEMA
ENLACE IÓNICO O ELECTROVALENTE
 ENLACE IÓNICO O ELECTROVALENTE Servicios Educativos Integrales Caracterizado por: o Cesión de electrones por parte de un metal a un no metal o Formación de iones de carga contraria, metal (+) y no metal
ENLACE IÓNICO O ELECTROVALENTE Servicios Educativos Integrales Caracterizado por: o Cesión de electrones por parte de un metal a un no metal o Formación de iones de carga contraria, metal (+) y no metal
Sólidos Iónicos El enlace Iónico (1)
 1 Sólidos Iónicos El enlace Iónico (1) 2 * Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4ª Ed., Harper Collins, 1993. Capítulo 4. * Douglas,
1 Sólidos Iónicos El enlace Iónico (1) 2 * Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4ª Ed., Harper Collins, 1993. Capítulo 4. * Douglas,
Uniones Interatómicas Clasificación Elementos
 Universidad de La Frontera Fac. Ing. Cs. y Adm. Dpto. Cs. Químicas Uniones Interatómicas Clasificación Elementos Prof. Josefina Canales La Materia puede clasificarse ampliamente en 3 tipos: Elemento: Tipo
Universidad de La Frontera Fac. Ing. Cs. y Adm. Dpto. Cs. Químicas Uniones Interatómicas Clasificación Elementos Prof. Josefina Canales La Materia puede clasificarse ampliamente en 3 tipos: Elemento: Tipo
PROPIEDADES PERIÓDICAS Y CONFIGURACIÓN ELECTRÓNICA
 PROPIEDADES PERIÓDICAS Y CONFIGURACIÓN ELECTRÓNICA Se conocen con el nombre de propiedades periódicas a aquellas propiedades relacionadas con la actividad química de los elementos y que varían de forma
PROPIEDADES PERIÓDICAS Y CONFIGURACIÓN ELECTRÓNICA Se conocen con el nombre de propiedades periódicas a aquellas propiedades relacionadas con la actividad química de los elementos y que varían de forma
El Ciclo de Born - Haber. Prof. S. Casas-Cordero E.
 El Ciclo de Born - Haber Prof. S. Casas-Cordero E. La energía del enlace iónico Entalpía reticular H red Cuando un mol de iones gaseosos positivos y un mol de iones gaseosos negativos se aproximan desde
El Ciclo de Born - Haber Prof. S. Casas-Cordero E. La energía del enlace iónico Entalpía reticular H red Cuando un mol de iones gaseosos positivos y un mol de iones gaseosos negativos se aproximan desde
Consideraciones sobre estructuras representativas
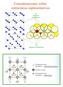 Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
Esquema del tema. Tema 4: Enlace iónico. Un poco de empirismo
 Esquema del tema Modelo iónico Características de los compuestos iónicos Corrigiendo el modelo iónico: Polarización y Módulo 12555- Química Inorgánica Título: Ingeniería Química Responsable: Juan José
Esquema del tema Modelo iónico Características de los compuestos iónicos Corrigiendo el modelo iónico: Polarización y Módulo 12555- Química Inorgánica Título: Ingeniería Química Responsable: Juan José
INTERACCIONES QUIMICAS
 UNIDAD 2 INTERACCIONES QUIMICAS 2.1) PARAMETROS DE ENLACE. DISTANCIA Y ENERGIA. ELECTRONEGATIVIDAD. 2.2) GEOMETRIA MOLECULAR Y MOMENTO DIPOLAR. POLARIZACION 2.3) CLASIFICACION DE INTERACCIONES QUIMICAS
UNIDAD 2 INTERACCIONES QUIMICAS 2.1) PARAMETROS DE ENLACE. DISTANCIA Y ENERGIA. ELECTRONEGATIVIDAD. 2.2) GEOMETRIA MOLECULAR Y MOMENTO DIPOLAR. POLARIZACION 2.3) CLASIFICACION DE INTERACCIONES QUIMICAS
Unidad 1 (Parte III 1.1.2) Objetivo de la presentación: Repasar conceptos de Química General que son fundamentales para Química Orgánica
 Unidad 1 (Parte III 1.1.2) Objetivo de la presentación: Repasar conceptos de Química General que son fundamentales para Química Orgánica Lic. Walter de la Roca 1 Formas de los orbitales: Forma en el espacio
Unidad 1 (Parte III 1.1.2) Objetivo de la presentación: Repasar conceptos de Química General que son fundamentales para Química Orgánica Lic. Walter de la Roca 1 Formas de los orbitales: Forma en el espacio
01 Minerales y estructuras
 01 Minerales y estructuras Año 2017 15/08/2017 1 Contenido Minerales metales Mena, ganga, ley mineral Tipo de minerales Estructura de los materiales Tipo de enlaces: iónico, covalente, metálico, van der
01 Minerales y estructuras Año 2017 15/08/2017 1 Contenido Minerales metales Mena, ganga, ley mineral Tipo de minerales Estructura de los materiales Tipo de enlaces: iónico, covalente, metálico, van der
Unitat 10. La Taula Periòdica (Llibre de text Unitat 8, pàg )
 Unitat 10 La Taula Periòdica (Llibre de text Unitat 8, pàg. 267-284) Index D1 10.1. Taula Periòdica actual 10.2. Descripció de la Taula Periòdica actual 10.3. L estructura electrònica i la Taula Periòdica
Unitat 10 La Taula Periòdica (Llibre de text Unitat 8, pàg. 267-284) Index D1 10.1. Taula Periòdica actual 10.2. Descripció de la Taula Periòdica actual 10.3. L estructura electrònica i la Taula Periòdica
SOLUCIONES QUÍMICA 2º BACHILLERATO HOJA Nº 6 ESTRUCTURA ATÓMICA. SISTEMA PERIÓDICO Y PROPIEDADES. 1.-/ a) λ = 3, m = Å
 SOLUCIONES HOJA Nº 6 Y PROPIEDADES 1.-/ a) λ = 3,03 10-6 m = 30300 Å 2.-/ a) ν = 6,9 10 14 Hz b) ν = 8,24 10 14 Hz 3.-/ a) λ = 4,86 10-7 m = 4862 Å b) Serie de Balmer: espectro visible. 4.-/ a) ν = 4,57
SOLUCIONES HOJA Nº 6 Y PROPIEDADES 1.-/ a) λ = 3,03 10-6 m = 30300 Å 2.-/ a) ν = 6,9 10 14 Hz b) ν = 8,24 10 14 Hz 3.-/ a) λ = 4,86 10-7 m = 4862 Å b) Serie de Balmer: espectro visible. 4.-/ a) ν = 4,57
COMPUESTOS COVALENTES
 COMPUESTOS COVALENTES MODELO DE LEWIS-LANGMUIR RESONANCIA TRPECV IONICO COORDINADO COVALENTE METALICO 3 1 0 %CARACTER IONICO 100 3.3 80 2.64 60 1.98 40 1.32 20 0.66 0 0 MOLECULAS COVALENTES UN GRUPO DE
COMPUESTOS COVALENTES MODELO DE LEWIS-LANGMUIR RESONANCIA TRPECV IONICO COORDINADO COVALENTE METALICO 3 1 0 %CARACTER IONICO 100 3.3 80 2.64 60 1.98 40 1.32 20 0.66 0 0 MOLECULAS COVALENTES UN GRUPO DE
EL TAMAÑO DE LAS MOLECULAS ES FUNDAMENTAL EN ESTOS PROCESOS Y, EN ESTE CASO, LOS MODELOS USADOS DEVALORAN ESTE PARAMETRO
 2500 BIOMOLECULAS (REPRESENTADAS POR MODELOS DE ESFERAS Y TUBOS) A TRAVES DE UN CANAL CELULAR EL TAMAÑO DE LAS MOLECULAS ES FUNDAMENTAL EN ESTOS PROCESOS Y, EN ESTE CASO, LOS MODELOS USADOS DEVALORAN ESTE
2500 BIOMOLECULAS (REPRESENTADAS POR MODELOS DE ESFERAS Y TUBOS) A TRAVES DE UN CANAL CELULAR EL TAMAÑO DE LAS MOLECULAS ES FUNDAMENTAL EN ESTOS PROCESOS Y, EN ESTE CASO, LOS MODELOS USADOS DEVALORAN ESTE
TEMA 8: SÓLIDOS INORGÁNICOS. 2.- Redes bidimensionales y tridimensionales
 TEMA 8: SÓLIDOS INORGÁNICOS 1.- Tipos de sólidos 2.- Redes bidimensionales y tridimensionales 3.- Celda unidad y sus parámetros: - nº de átomos / celda - nº de coordinación (NC) - fracción de volumen ocupado
TEMA 8: SÓLIDOS INORGÁNICOS 1.- Tipos de sólidos 2.- Redes bidimensionales y tridimensionales 3.- Celda unidad y sus parámetros: - nº de átomos / celda - nº de coordinación (NC) - fracción de volumen ocupado
Universidad Central de Venezuela Facultad de Ciencias Escuela de Química Unidad Docente de Principios de Química Principios de Química I
 Tema VI: Tabla periódica Universidad Central de Venezuela Facultad de Ciencias Escuela de Química Unidad Docente de Principios de Química Principios de Química I Guía de Problemas 1) Defina potencial de
Tema VI: Tabla periódica Universidad Central de Venezuela Facultad de Ciencias Escuela de Química Unidad Docente de Principios de Química Principios de Química I Guía de Problemas 1) Defina potencial de
GENERALIDADES. La molécula de agua. Propiedades. Química en Solución acuosa. Aguas ambientales-abundancia 1. Química en solución acuosa 2007
 GENERALIDADES Química en solución acuosa 2007 La molécula de agua Molécula de tipo AX 2 E 2 Angular Enlace O-H Alta energía Alta polaridad Capacidad para formar enlaces de hidrógeno Aguas ambientales-abundancia
GENERALIDADES Química en solución acuosa 2007 La molécula de agua Molécula de tipo AX 2 E 2 Angular Enlace O-H Alta energía Alta polaridad Capacidad para formar enlaces de hidrógeno Aguas ambientales-abundancia
VARIACIONES PERIÓDICAS. Z = 53 Z = 53 Z = 53 Electrones = 54 Electrones = 53 Electrones = 52
 RESOLUCIÓN PRÁCTICO 13 VARIACIONES PERIÓDICAS 1 a) Las variaciones en el tamaño atómico e iónico son el resultado de la influencia del nivel n y de la carga nuclear efectiva (Z ef ). I > I > I Z = 53 Z
RESOLUCIÓN PRÁCTICO 13 VARIACIONES PERIÓDICAS 1 a) Las variaciones en el tamaño atómico e iónico son el resultado de la influencia del nivel n y de la carga nuclear efectiva (Z ef ). I > I > I Z = 53 Z
No obstante, hay muchas excepciones a esta regla y hasta se han logrado sintetizar algunos compuestos de los gases nobles.
 Tema 2 Enlaces químicos Cuando se forma un enlace químico los átomos reciben, ceden o comparten electrones de tal forma que la capa más externa de cada átomo contenga ocho electrones, y así adquiere la
Tema 2 Enlaces químicos Cuando se forma un enlace químico los átomos reciben, ceden o comparten electrones de tal forma que la capa más externa de cada átomo contenga ocho electrones, y así adquiere la
Unidad 3 Termodinámica Inorgánica. Química Inorgánica I. Compuestos iónicos Energía de red cristalina (U 0 ) Ciclo de Born-Haber
 Unidad 3 Termodinámica Inorgánica N N N N N N Química Inorgánica I Compuestos iónicos Energía de red cristalina (U 0 ) Ciclo de Born-aber Sigfrido Escalante Tovar mar-2016 [Co(L) 2 Cl 2 ]: dicloro bis-zoxazolamina
Unidad 3 Termodinámica Inorgánica N N N N N N Química Inorgánica I Compuestos iónicos Energía de red cristalina (U 0 ) Ciclo de Born-aber Sigfrido Escalante Tovar mar-2016 [Co(L) 2 Cl 2 ]: dicloro bis-zoxazolamina
XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2013 NIVEL 3
 XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2013 NIVEL 3 Datos del estudiante. Nombre Cédula de identidad Ciudad de origen Ciudad donde toma la prueba Departamento Liceo al que pertenece Año que cursa Nomenclatura
XVI OLIMPÍADA DEPARTAMENTAL DE QUÍMICA 2013 NIVEL 3 Datos del estudiante. Nombre Cédula de identidad Ciudad de origen Ciudad donde toma la prueba Departamento Liceo al que pertenece Año que cursa Nomenclatura
Ilustración 15.1. El número de coordinación en el NaCl es 6:6. Cada ion esta rodeado por seis iones que tienen carga opuesta a él.
 ENLACE IÓNICO Tú sabes que existen sustancias que forman sólidos cristalinos con altos puntos de fusión, que no conducen la corriente en estado sóliso pero se vuelven buenos conductores al fundirlos o
ENLACE IÓNICO Tú sabes que existen sustancias que forman sólidos cristalinos con altos puntos de fusión, que no conducen la corriente en estado sóliso pero se vuelven buenos conductores al fundirlos o
2 El enlace químico. 2.1 La formación de pares iónicos
 2 El enlace químico 2.1 La formación de pares iónicos 2.2 La formación de sólidos iónicos: entalpía de red 2.3 Influencia de la entalpía de red en algunas propiedades físicas de los compuestos iónicos
2 El enlace químico 2.1 La formación de pares iónicos 2.2 La formación de sólidos iónicos: entalpía de red 2.3 Influencia de la entalpía de red en algunas propiedades físicas de los compuestos iónicos
2 o Bachillerato. Química Estructural I Enlace Iónico y Metálico. Prof. Jorge Rojo Carrascosa
 QUÍMICA 2 o Bachillerato Química Estructural I Enlace Iónico y Metálico Prof. Jorge Rojo Carrascosa Índice general 1. QUÍMICA ESTRUCTURAL I 2 1.1. ENLACE IÓNICO............................ 2 1.1.1. ENERGÍA
QUÍMICA 2 o Bachillerato Química Estructural I Enlace Iónico y Metálico Prof. Jorge Rojo Carrascosa Índice general 1. QUÍMICA ESTRUCTURAL I 2 1.1. ENLACE IÓNICO............................ 2 1.1.1. ENERGÍA
KHIPU DE LA TABLA PERIODICA DE LOS ELEMENTOS QUÍMICOS.
 KHIPU DE LA TABLA PERIODICA DE LOS ELEMENTOS QUÍMICOS. Autor: Ing. Julio Antonio Gutiérrez Samanez (*) Trabajo dedicado a la ASOCIACIÓN CIVIL KHIPU del Cusco, que me otorgó el título de KHIPUKAMAYOQ 2008.
KHIPU DE LA TABLA PERIODICA DE LOS ELEMENTOS QUÍMICOS. Autor: Ing. Julio Antonio Gutiérrez Samanez (*) Trabajo dedicado a la ASOCIACIÓN CIVIL KHIPU del Cusco, que me otorgó el título de KHIPUKAMAYOQ 2008.
NIVEL 3 Total: 100 puntos
 Nombre: Cédula de Identidad: Liceo: PROBLEMA 1 XIII OLIMPIADA NACIONAL DE QUÍMICA NIVEL 3 Total: 100 puntos A la edad de solamente veintiún años, el químico industrial belga Ernest Solvay empezó a trabajar
Nombre: Cédula de Identidad: Liceo: PROBLEMA 1 XIII OLIMPIADA NACIONAL DE QUÍMICA NIVEL 3 Total: 100 puntos A la edad de solamente veintiún años, el químico industrial belga Ernest Solvay empezó a trabajar
EJERCICIOS PROPUESTOS EN PRUEBAS PAU DE ASTURIAS
 Modelo 010 1.- A) La tabla adjunta muestra las temperaturas de ebullición de algunos hidrocarburos y alcoholes. Explicar de forma razonada los valores anormalmente elevados de las temperaturas de ebullición
Modelo 010 1.- A) La tabla adjunta muestra las temperaturas de ebullición de algunos hidrocarburos y alcoholes. Explicar de forma razonada los valores anormalmente elevados de las temperaturas de ebullición
Acidez de cationes y basicidad de oxoaniones
 Acidez de cationes y basicidad de oxoaniones Principles of descriptive inorganic chemistry Gary Wulfsberg La hidratación de un catión metálico: es una reacción ácidobase? M n+ (g) + nh 2 O(l) M n+ (ac)
Acidez de cationes y basicidad de oxoaniones Principles of descriptive inorganic chemistry Gary Wulfsberg La hidratación de un catión metálico: es una reacción ácidobase? M n+ (g) + nh 2 O(l) M n+ (ac)
ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS. SISTEMA PERIÓDICO
 2 ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS. SISTEMA PERIÓDICO SOLUCIONES A LAS CUESTIONES DE INICIACIÓN 1. Las propiedades químicas de los elementos dependen de: a) su número atómico; b) su masa atómica; c)
2 ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS. SISTEMA PERIÓDICO SOLUCIONES A LAS CUESTIONES DE INICIACIÓN 1. Las propiedades químicas de los elementos dependen de: a) su número atómico; b) su masa atómica; c)
Tema 15. Tema 15. Clasificación periódica de los elementos
 Tema 15 Clasificación periódica de los elementos 15.1 Configuración electrónica 15.2 El sistema periódico 15.3 Propiedades atómicas 15.4 Energía de ionización 1 2 15.1 Configuración electrónica La ecuación
Tema 15 Clasificación periódica de los elementos 15.1 Configuración electrónica 15.2 El sistema periódico 15.3 Propiedades atómicas 15.4 Energía de ionización 1 2 15.1 Configuración electrónica La ecuación
Elementos Alcalinos:
 Elementos Alcalinos: Litio (Li) Sodio (Na) Potasio (K) Rubidio (Rb) Cesio (Cs) Francio (Fr) Berilio (Be) Magnesio (Mg) Calcio (Ca) Estroncio (Sr) Bario (Ba) Radio (Ra) 1 Propiedades físicas de los elementos
Elementos Alcalinos: Litio (Li) Sodio (Na) Potasio (K) Rubidio (Rb) Cesio (Cs) Francio (Fr) Berilio (Be) Magnesio (Mg) Calcio (Ca) Estroncio (Sr) Bario (Ba) Radio (Ra) 1 Propiedades físicas de los elementos
IES La Magdalena. Avilés. Asturias. Enlace Iónico
 IES La Magdalena. Avilés. Asturias Si enfrentamos un átomo al que le falten pocos electrones en su capa de valencia para adquirir la configuración de gas noble (muy electronegativo, tendencia a coger electrones),
IES La Magdalena. Avilés. Asturias Si enfrentamos un átomo al que le falten pocos electrones en su capa de valencia para adquirir la configuración de gas noble (muy electronegativo, tendencia a coger electrones),
Laboratorio Geoquímico. Información analítica. Químico responsable: Jaime Martínez # 2-9784121 Coordinadora: Katja Deckart # 2-9784758
 Laboratorio Geoquímico Información analítica Químico responsable: Jaime Martínez # 2-9784121 Coordinadora: Katja Deckart # 2-9784758 Mayo 2012 LÍMITES DE DETECCIÓN elemento ICP-OES [ppm] AAS [ppm] Observaciones
Laboratorio Geoquímico Información analítica Químico responsable: Jaime Martínez # 2-9784121 Coordinadora: Katja Deckart # 2-9784758 Mayo 2012 LÍMITES DE DETECCIÓN elemento ICP-OES [ppm] AAS [ppm] Observaciones
ESTRUCTURA DE LA MATERIA. ENLACE QUÍMICO EJERCICIOS DE SELECTIVIDAD 96/97
 ESTRUCTURA DE LA MATERIA. ENLACE QUÍMICO EJERCICIOS DE SELECTIVIDAD 96/97 1. Comente cada una de las frases siguientes, indicando si son verdaderas o falsas, y explique las razones en las que se basa.
ESTRUCTURA DE LA MATERIA. ENLACE QUÍMICO EJERCICIOS DE SELECTIVIDAD 96/97 1. Comente cada una de las frases siguientes, indicando si son verdaderas o falsas, y explique las razones en las que se basa.
29/09/2010 TEMA 2. CONTENIDO. Continuación Tema 2. Configuración electrónica de cationes y aniones. de elementos representativos.
 2 Continuación Tema 2 Prof(a): María Angélica Sánchez Palacios TEMA 2. CONTENIDO Introducción a la forma y características de la tabla periódica. Introducción a los modelos atómicos. El Método Científico.
2 Continuación Tema 2 Prof(a): María Angélica Sánchez Palacios TEMA 2. CONTENIDO Introducción a la forma y características de la tabla periódica. Introducción a los modelos atómicos. El Método Científico.
TEMA 11. Reactividad de elementos p. Tipos de compuestos. J. Isasi
 TEMA 11. Reactividad de elementos p. Tipos de compuestos. He B C N O FLi Ne He C Si P S Cl Ar Ge Ge As Se Br Kr Sn Sb Te I Xe Pb Bi Po At Rn J. Isasi Tipos de compuestos que forman los elementos p: compuestos
TEMA 11. Reactividad de elementos p. Tipos de compuestos. He B C N O FLi Ne He C Si P S Cl Ar Ge Ge As Se Br Kr Sn Sb Te I Xe Pb Bi Po At Rn J. Isasi Tipos de compuestos que forman los elementos p: compuestos
Olimpiada de Química de Castilla y León año 2017
 Olimpiada de Química de Castilla y León año 2017 Hay una sola opción correcta para cada cuestión. Se sumará 1 punto por cada respuesta correcta y se restará 0,25 puntos por cada una incorrecta. Cuestiones
Olimpiada de Química de Castilla y León año 2017 Hay una sola opción correcta para cada cuestión. Se sumará 1 punto por cada respuesta correcta y se restará 0,25 puntos por cada una incorrecta. Cuestiones
Tema 3. Sistema Periódico. 1. Origen del Sistema Periódico. 2. Sistema Periódico actual. 3. Propiedades periódicas de los elementos.
 Tema 3. Sistema Periódico 1. Origen del Sistema Periódico. 2. Sistema Periódico actual. 3. Propiedades periódicas de los elementos. 1. Origen del Sistema Periódico El estudio del Sistema Periódico comenzó
Tema 3. Sistema Periódico 1. Origen del Sistema Periódico. 2. Sistema Periódico actual. 3. Propiedades periódicas de los elementos. 1. Origen del Sistema Periódico El estudio del Sistema Periódico comenzó
RQ-DRI REQUISITOS PARA EL TRANSPORTE DE MATERIAL RADIACTIVO HACIA, DE Y EN EL PAÍS
 1. INTRODUCCIÓN Considerando que la exposición a las radiaciones ionizantes, constituye un riesgo potencial para la colectividad, personal que las aplica y para quienes se benefician de su uso, es necesario
1. INTRODUCCIÓN Considerando que la exposición a las radiaciones ionizantes, constituye un riesgo potencial para la colectividad, personal que las aplica y para quienes se benefician de su uso, es necesario
