FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Dopacis 90 MBq/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
|
|
|
- Marcos López Maidana
- hace 8 años
- Vistas:
Transcripción
1 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Dopacis 90 MBq/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene 90 MBq de fluorodopa ( 18 F) en la fecha y hora de calibración. La actividad total por vial varía de 90 MBq a 900 MBq en la fecha de calibración. El ión Flúor-18 se desintegra a oxígeno ( 18 O) estable con un semiperíodo de 110 minutos emitiendo una radiación positrónica de energía máxima de 634 kev, seguida por la radiación fotónica de aniquilación de 511 kev. Excipientes: 1 ml de Dopacis contiene 2,6 µg de sodio. Para consultar la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Solución inyectable. Solución transparente e incolora, con un ph entre 4,0 y 5,5. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Este medicamento es únicamente para uso diagnóstico. La fluorodopa ( 18 F) está indicada para su utilización en la obtención de imágenes mediante tomografía por emisión de positrones (PET). Neurología La PET con fluorodopa ( 18 F) está indicada para detectar la pérdida de terminaciones nerviosas dopaminérgicas funcionales del cuerpo estriado en pacientes con síndromes parkinsonianos clínicamente inciertos. Se puede utilizar para diferenciar el temblor esencial de síndromes parkinsonianos relacionados con enfermedades degenerativas que afectan el sistema nigroestriado (enfermedad de Parkinson (EP), atrofia multisistémica y parálisis supranuclear progresiva). La PET con fluorodopa ( 18 F), por sí sola, no tiene capacidad para discriminar entre diferentes síndromes parkinsonianos relacionados con enfermedades degenerativas que afectan el sistema nigroestriado. Tampoco tiene capacidad discriminar entre EP con y sin temblor. Oncología A partir de las exploraciones por imágenes, la PET con fluorodopa ( 18 F) permite un enfoque funcional de las patologías, órganos o tejidos en los que se investiga un aumento del transporte intracelular y de la decarboxilación del aminoácido dihidroxifenilalanina. En particular, se han documentado las siguientes indicaciones: 1 de 10
2 Diagnóstico: - Diagnóstico y localización de un insulinoma en caso de hiperinsulinismo en bebés y niños - Diagnóstico y localización de tumores glómicos en pacientes con una mutación del gen de la subunidad D de la succinato deshidrogenasa - Localización de feocromocitomas y paragangliomas Estadificación: - Feocromocitomas y paragangliomas - Tumores carcinoides bien diferenciados del tracto intestinal Detección en caso de sospecha razonable de enfermedad recurrente o residual - Tumores cerebrales primarios limitados a gliomas de alto grado (grado III y IV) - Feocromocitomas y paragangliomas - Carcinoma medular de tiroides con nivel de calcitonina sérica elevado. - Tumores carcinoides bien diferenciados del tracto intestinal - Otros tumores endocrinos digestivos cuando la centellografía de receptores de somatostatina es negativa Dopacis está indicado: - en adultos para neurología y oncología, en bebés y hasta adolescentes en oncología. 4.2 Posología y forma de administración Posología En oncología, la actividad habitualmente recomendada para un adulto puede variar de 2 a 4 MBq/kg de peso corporal, según el equipo PET y el modo de adquisición de las imágenes que se utilice. En las indicaciones neurológicas, la actividad habitualmente recomendada para un adulto puede variar de 1 a 2 MBq/kg de peso corporal, según el equipo PET y el modo de adquisición obtención de las imágenes que se utilice. Para el uso repetido, ver sección 4.4. Población pediátrica No hay datos clínicos sobre la seguridad y la eficacia de este producto en pacientes menores de 18 años, excepto en la búsqueda de insulinomas en bebés o en niños muy pequeños. El uso en las indicaciones de oncología, tanto en niños como en adolescentes, debe considerarse cuidadosamente en base a la necesidad clínica y valorando la relación riesgo/beneficio en este grupo de pacientes. La actividad a administrar en niños y adolescentes puede variar de 2 a 4 MBq/kg de peso corporal, según el equipo PET y el modo de adquisición de las imágenes utilizado. Pacientes con insuficiencia renal No se han realizado estudios amplios de determinación o ajuste de las dosis con este producto ni en población normal ni poblaciones especiales. No se ha caracterizado la farmacocinética de la fluorodopa ( 18 F) en patientes con disfunción renal. 2 de 10
3 Forma de administración Para la preparación del paciente, ver sección 4.4. La actividad de la fluorodopa ( 18 F) debe medirse con un activímetro inmediatamente antes de la inyección La inyección de fluorodopa ( 18 F) debe ser por vía intravenosa para evitar la irradiación como resultado de una posible extravasación local, así como artefactos en las imágenes. El producto debe administrarse lentamente por vía intravenosa directa durante aproximadamente un minuto. Obtención de imágenes Neurología Obtención de: - imágenes PET dinámicas de cerebro desde la inyección durante 90 a 120 minutos, o - imagen PET estática única a partir de 90 minutos después de la inyección. Oncología - Focos en la zona hepática, pancreática y cervical: obtención de imágenes "estáticas" precoces a partir de los 5 minutos después de la inyección, u obtención de imágenes "dinámicas" inmediatamente después de la inyección durante aproximadamente diez minutos. - Tumores cerebrales: obtención de imágenes estáticas entre 10 y 30 minutos después de la inyección. - Cuerpo entero: imágenes obtenidas generalmente 60 minutos después de la inyección. 4.3 Contraindicaciones Hipersensibilidad al principio activo o a alguno de los excipientes. - Embarazo. 4.4 Advertencias y precauciones especiales de empleo Para instrucciones sobre el embarazo, ver sección 4.6. Justificación del riesgo/beneficio individual Para todos los pacientes, la exposición a la radiación ionizante debe estar justificada en función del posible beneficio. La actividad administrada en cada paciente debe ser la mínima posible para obtener la información diagnóstica requerida. En pacientes con disminución de la función renal se requiere una indicación muy cuidadosa ya que en ellos es posible que aumente la exposición a la radiación. En pacientes con una mutación del gen de la subunidad B de la succinato deshidrogenasa, Dopacis no está indicado para el diagnóstico y localización de tumores glómicos. Población pediátrica Para instrucciones sobre población pediátrica, ver sección 4.2. ó 5.1., según corresponda. Se requiere una consideración cuidadosa de la indicación ya que la dosis efectiva por MBq es mayor que en los adultos (ver sección 11 "Dosimetría"). 3 de 10
4 Uso repetido Los datos sobre el uso repetido de fluorodopa ( 18 F) son limitados. Se recomienda no inyectar Dopacis antes de los 5 días posteriores a la primera administración. Preparación del paciente Para la administración de Dopacis el paciente debe guardar un ayuno de al menos 4 horas, sin limitación para beber agua. Para obtener imágenes de mejor calidad y reducir la exposición de la vejiga a la radiación, se debe pedir a los pacientes que ingieran suficiente cantidad de líquido y que vacíen la vejiga antes y después de la exploración PET. En las indicaciones neurológicas, se recomienda interrumpir cualquier tratamiento antiparkinsoniano al menos 12 horas antes de la prueba. En las indicaciones oncológicas, se recomienda interrumpir cualquier tratamiento con glucagón al menos 12 horas antes de la prueba. En las indicaciones neurológicas, la administración de 200 mg de entacapona una hora antes de la inyección de fluorodopa ( 18 F) es una práctica común. Advertencias generales Se recomienda evitar cualquier contacto directo entre el paciente y los niños pequeños durante las 12 horas siguientes a la inyección. Los radiofármacos deben ser recibidos, utilizados y administrados exclusivamente por personal cualificado, que esté debidamente autorizado para el uso y manipulación de radionucleidos, y en centros asistenciales autorizados. Su recepción, almacenamiento, uso, transporte y eliminación están sujetos a las normas y/o licencias correspondientes de los organismos oficiales competentes. Los radiofármacos deben ser preparados por el usuario de manera que cumplan tanto los requisitos de seguridad radiológica como de calidad farmacéutica. Se deben tomar las precauciones asépticas apropiadas. Advertencias específicas Si se presenta hipersensibilidad o reacciones anafilácticas, debe interrumpirse inmediatamente la administración del medicamento y debe iniciarse tratamiento por vía intravenosa, si es necesario. Para posibilitar una acción inmediata en situaciones de emergencia, deben estar inmediatamente disponibles los medicamentos y equipos necesarios, como tubo endotraqueal y respirador. Advertencias relacionadas con los excipientes: Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, está esencialmente libre de sodio. Las precauciones con respecto al riesgo medioambiental están en la sección Interacción con otros medicamentos y otras formas de interacción Carbidopa, inhibidores de la enzima catecol-o-metiltransferasa (COMT) tales como entacapona o nitecapona: la biodisponibilidad de la fluorodopa en el cerebro puede incrementarse por el tratamiento previo con inhibidores de la enzima aminoácido aromático descarboxilasa (AAAD), como carbidopa, que bloquean la conversión periférica de fluorodopa a fluorodopamina, o con inhibidores de la enzima catecol-o-metiltransferasa (COMT), como entacapona y nitecapona, que disminuyen la degradación periférica de fluorodopa a 3-O-metil-6-fluorodopa. Carbidopa: se informó sobre un caso de hiperinsulinismo congénito en el que la captación de fluorodopa en el páncreas no era detectable tras la administración de carbidopa. Glucagón: la captación de fluorodopa ( 18 F) en el páncreas se ve afectada por el glucagón por su interacción con la función de las células beta pancreáticas. 4 de 10
5 Haloperidol: un aumento de la dopamina intracerebral causado por el haloperidol puede aumentar la acumulación de fluorodopa ( 18 F) en el cerebro. Reserpina: la reserpina puede vaciar el contenido de las vesículas intraneuronales e impedir de este modo la retención de fluorodopa ( 18 F) en el cerebro. Inhibidores MAO (Monoamine Oxidasa): el uso concomitante de inhibidores MAO puede aumentar la captación de fluorodopa ( 18 F) en el cerebro. 4.6 Fertilidad, embarazo y lactancia Mujeres en edad fértil Cuando es necesario administrar radiofármacos a mujeres en edad fértil, es importante determinar un posible embarazo. Toda mujer con pérdida de un periodo debe considerarse embarazada hasta que se demuestre lo contrario. De existir dudas sobre un probable embarazo (pérdida de un periodo, periodo muy irregular, etc.), deben considerarse las técnicas alternativas (si existen) que no impliquen radiación ionizante. Embarazo Dopacis está contraindicado en el embarazo (ver sección 4.3). No existen datos suficientes para tratar los efectos del producto durante el embarazo. No se han realizado estudios reproductivos en animales. Lactancia La fluorodopa ( 18 F) será excretada en la leche materna. Antes de administrar un radiofármaco a una madre en período de lactancia, debe considerarse la posibilidad de retrasar la administración del radionucleido hasta que la madre haya dejado de amamantar a su hijo, y si se ha hecho la elección más adecuada del radiofármaco, teniendo en cuenta la secreción de actividad en la leche materna. Si la administración del medicamento se considera necesaria, debe interrumpirse la lactancia durante 12 horas y debe desecharse la leche extraída. Debe evitarse el contacto directo de la madre con niños durante las primeras 12 horas posteriores a la inyección. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas La influencia de Dopacis sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. 5 de 10
6 4.8 Reacciones adversas Las reacciones adversas informadas se presentan a continuación mediante el Sistema de Clasificación de Organos y con una frecuencia no conocida (no puede estimarse a partir de los datos disponibles) : Clasificación de órganos del sistema MedDRA Reacciones adversas (Término preferido) Frecuencia Trastornos del sistema nervioso Sensación de ardor No conocida Trastornos generales y alteraciones en el lugar de administración Dolor de la zona de No conocida aplicación, dolor, calor en la zona de aplicación Se informó que el dolor en el lugar de la inyección desapareció a los pocos minutos, sin tratamiento. En la bibliografía se ha informado sobre un caso de crisis carcinoide relacionada con una administración demasiado rápida. La exposición a la radiación ionizante está vinculada a la inducción de cáncer y a la posibilidad de desarrollar defectos hereditarios. Dado que la dosis efectiva resultante de la administración de la máxima actividad recomendada de 280 MBq (para un individuo de 70 kg) es de 7 msv, la probabilidad de aparición de estos efectos adversos es baja. 4.9 Sobredosis Si se ha administrado una sobredosis de radiación con fluorodopa ( 18 F), debe reducirse la dosis absorbida por el paciente aumentando la eliminación del radionucleido del cuerpo por medio de diuresis forzada y micciones frecuentes. Podría resultar útil calcular la dosis efectiva aplicada. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: Otros radiofármacos para diagnóstico, código ATC: V09IX05 A las concentraciones químicas y actividades recomendadas para las exploraciones de diagnóstico, no parece que la fluorodopa ( 18 F) tenga actividad farmacodinámica. 5.2 Propiedades farmacocinéticas Distribución Estudios en sujetos sanos después de la administración de fluorodopa ( 18 F) mostraron una distribución generalizada de la actividad en todos los tejidos corporales. 6 de 10
7 Captación en órganos La fluorodopa ( 18 F) es un análogo de un aminoácido aromático que se acumula rápidamente en los órganos diana, especialmente en el cuerpo estriado del cerebro humano, y se convierte en dopamina, que es un neurotransmisor de la familia de las catecolaminas. Eliminación La fluorodopa ( 18 F) se elimina por vía renal, el 50% se elimina después de 0,7 horas y el 50% restante después de 12 horas. Vida media La fluorodopa ( 18 F) se elimina por una cinética biexponencial con una semivida biológica de 12 horas (67-94%) y una semivida física de 1,7 a 3,9 horas (6-33%). Estas dos semividas parece que dependen de la edad. 5.3 Datos preclínicos sobre seguridad Estudios toxicológicos con ratas han demostrado que una sola inyección I.V. de una preparación de fluorodopa inactiva en una concentración de 5 ml/kg, que contiene más de 100 veces la cantidad de principio activo y de impurezas contenidos en Dopacis, no produjo ninguna muerte. No se presentó ninguna actividad mutagénica con la misma preparación en la prueba de Ames. No se han realizado estudios de toxicidad crónica, estudios de potencial carcinogénico a largo plazo ni estudios sobre la toxicidad en la reproducción. Este producto no está destinado para administración regular o continua. 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Ácido acético Acetato de sodio Ácido ascórbico Agua para preparaciones inyectables 6.2 Incompatibilidades En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros. 6.4 Precauciones especiales de conservación Conservar en el envase original. Después de la primera extracción, conservar en nevera (2-8 C). Los radiofármacos deben conservarse conforme a la normativa nacional sobre materiales radiactivos. 6.5 Naturaleza y contenido del envase Vial de vidrio incoloro, tipo I, multidosis de 15 ml, cerrado con un tapón de goma recubierto de teflón y sellado con una cápsula de aluminio. Presentación: un vial multidosis que contiene de 1 a 10 ml de solución, que corresponden a 90 a 900 MBq en la fecha de calibración. 7 de 10
8 6.6 Precauciones especiales de eliminación La administración de radiofármacos supone un riesgo para otras personas por la radiación externa o la contaminación por derrames de orina, vómitos, etc. Por consiguiente, deben adoptarse las medidas de protección radiológica conforme a la legislación nacional. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN CIS bio international RN 306-Saclay B.P. 32 F Gif-sur-Yvette Cedex 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN Abril FECHA DE LA REVISIÓN DEL TEXTO Abril 2013 DOSIMETRÍA La siguiente tabla muestra la dosimetría interna de la radiación calculada de acuerdo con la publicación nº 106 de la ICRP (International Commission on Radiological Protection Radiation).y se han calculado de acuerdo con los siguientes supuestos: el 100% de la actividad del flúor-18 se distribuye de manera homogénea en el cuerpo y se elimina por vía renal con una semivida biológica de 1 hora (50%) y 12 horas (50%), independientemente de la edad. Órgano Dosis absorbida por unidad de actividad administrada (mgy/mbq) Adulto 15 años 10 años 5 años 1 año 8 de 10
9 Glándulas adrenales 0,0099 0,0130 0,0190 0,0310 0,0550 Vejiga 0,3000 0,3800 0,5700 0,7800 1,0000 Superficies óseas 0,0096 0,0120 0,0180 0,0280 0,0510 Cerebro 0,0071 0,0088 0,0150 0,0240 0,0440 Mamas 0,0067 0,0085 0,0130 0,0210 0,0390 Vesícula biliar 0,0100 0,0130 0,0200 0,0290 0,0500 Tracto gastrointestinal Estómago 0,0095 0,0120 0,0180 0,0280 0,0500 Intestino delgado 0,0130 0,0170 0,0260 0,0390 0,0650 Colon 0,0150 0,0180 0,0270 0,0410 0,0630 (Intestino grueso ascendente) (Intestino grueso descendente) 0,0120 0,0150 0,0230 0,0360 0,0590) 0,0180 0,0220 0,0330 0,0470 0,0690) Corazón 0,0089 0,0110 0,0180 0,0280 0,0500 Riñones 0,0310 0,0370 0,0520 0,0780 0,1400 Hígado 0,0091 0,0120 0,0180 0,0290 0,0520 Pulmones 0,0079 0,0100 0,0160 0,0250 0,0460 Músculos 0,0099 0,0120 0,0190 0,0300 0,0510 Esófago 0,0082 0,0100 0,0160 0,0250 0,0470 Ovarios 0,0170 0,0220 0,0330 0,0470 0,0740 Páncreas 0,0100 0,0130 0,0200 0,0310 0,0560 Médula ósea roja 0,0098 0,0120 0,0190 0,0270 0,0470 Piel 0,0070 0,0085 0,0140 0,0220 0,0400 Bazo 0,0095 0,0120 0,0180 0,0290 0,0530 Testículos 0,0130 0,0180 0,0300 0,0450 0, de 10
10 Timo 0,0082 0,0100 0,0160 0,0250 0,0470 Tiroides 0,0081 0,0100 0,0170 0,0270 0,0500 Útero 0,0280 0,0330 0,0530 0,0750 0,1100 Resto del organismo 0,0100 0,0130 0,0190 0,0300 0,0520 Dosis efectiva (msv/mbq) 0,0250 0,0320 0,0490 0,0700 0,1000 La dosis efectiva resultante de la administración de una actividad de 280 MBq, para un adulto con un peso corporal de 70 kg, es de aproximadamente 7 msv. Para esta actividad administrada de 280 MBq la dosis de radiación absorbida por los órganos diana son: suprarrenales 2,8 mgy, cerebro 2,0 mgy, páncreas 2,8 mgy y tiroides 2,3 mgy, y la dosis de radiación absorbida por los órganos críticos son: vejiga 84 mgy, útero 7,8 mgy, riñones 8,7 mgy. INSTRUCCIONES PARA LA PREPARACIÓN DE RADIOFÁRMACOS Como con cualquier medicamento, si durante la preparación de este producto se ve comprometida la integridad del vial, éste no debe utilizarse. Previamente a su uso, debe verificarse el acondicionamiento y medirse la actividad utilizando un activímetro. La solución debe inspeccionarse visualmente antes de su uso, y sólo debe utilizarse si es una solución límpida y libre de partículas visibles. El vial debe mantenerse dentro de su envase original y no debe abrirse. Tras desinfectar el tapón, la solución debe extraerse a través del tapón utilizando una jeringa estéril de un solo uso con blindaje protector adecuado y una aguja estéril de un solo uso. La información detallada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios ( ). 10 de 10
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Citrato de galio ( 67 Ga) Mallinckrodt 37 MBq/ml solución inyectable
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Citrato de galio ( 67 Ga) Mallinckrodt 37 MBq/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución inyectable contiene 37 MBq de citrato
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Citrato de galio ( 67 Ga) Mallinckrodt 37 MBq/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución inyectable contiene 37 MBq de citrato
FICHA TÉCNICA. Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
FICHA TÉCNICA. Carbocisteína 50 mg
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. 20 g/100 ml
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: CLORURO DE SODIO 20 % Forma farmacéutica: Solución concentrada para infusión IV Fortaleza: Presentación: Titular del Registro Sanitario,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: CLORURO DE SODIO 20 % Forma farmacéutica: Solución concentrada para infusión IV Fortaleza: Presentación: Titular del Registro Sanitario,
Equino: Alivio de la inflamación y el dolor en trastornos músculo-esqueléticos agudos y crónicos. Alivio del dolor asociado al cólico equino.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
FICHA TÉCNICA. Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125 g Lisozima hidrocloruro...0,100 g Neomicina (sulfato)...
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH)
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
Se recomienda beber un vaso de agua después de cada dosis y abundante líquido durante el día.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Plasimine está indicado para el tratamiento de las siguientes infecciones cutáneas causadas por microorganismos sensibles (ver sección 5.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
4.2 Posología y forma de administración
 1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
FICHA TÉCNICA. Cantidad: Los ingredientes activos en 1 ml de VITALIPID INFANTIL corresponden a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID INFANTIL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID INFANTIL contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 69
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID INFANTIL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID INFANTIL contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 69
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
FICHA TÉCNICA. Líquido oral. Líquido oleoso homogéneo, transparente, de color amarillo pálido
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
Lactofilus polvo oral
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
FICHA TÉCNIA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNIA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1.NOMBRE DEL MEDICAMENTO. URSOBILANE 150 mg cápsulas. URSOBILANE 300 mg cápsulas. URSOBILANE 500 mg cápsulas. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNIA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1.NOMBRE DEL MEDICAMENTO. URSOBILANE 150 mg cápsulas. URSOBILANE 300 mg cápsulas. URSOBILANE 500 mg cápsulas. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Prospecto: información para el usuario. INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína
 Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO. 25 μg
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
INFORMACIÓN DE PRESCRIPCIÓN COMPLETA: CONTENIDO* 1 INDICACIONES Y USO 2 DOSIFICACIÓN Y ADMINISTRACIÓN
 202-1269601 VERSIÓN MAESTRA EN ESPAÑOL Revisado: 06/2013 (Leuprolide acetate para suspensión depot) Lupron Depot-PED 7.5 mg Lupron Depot-PED 11.25 mg Uno y tres meses Lupron Depot-PED 15 mg Lupron Depot-PED
202-1269601 VERSIÓN MAESTRA EN ESPAÑOL Revisado: 06/2013 (Leuprolide acetate para suspensión depot) Lupron Depot-PED 7.5 mg Lupron Depot-PED 11.25 mg Uno y tres meses Lupron Depot-PED 15 mg Lupron Depot-PED
Gel/Crema para uso cutáneo Gel homogéneo incoloro o de color amarillo pálido o ligeramente marrón. Crema blanca, brillante.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ROZEX 7,5 mg/g Gel tópico ROZEX 7,5 mg/g Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 gramo de gel/crema contiene 7,5 mg de metronidazol Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ROZEX 7,5 mg/g Gel tópico ROZEX 7,5 mg/g Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 gramo de gel/crema contiene 7,5 mg de metronidazol Para consultar la lista
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO GLUSCAN 500 MBq/ml solución inyectable, Fludesoxiglucosa ( 18 F)
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO GLUSCAN 500 MBq/ml solución inyectable, Fludesoxiglucosa ( 18 F) 1 NOMBRE DEL MEDICAMENTO GLUSCAN 500 MBq/ml solución inyectable 2 COMPOSICIÓN CUALITATIVA Y
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO GLUSCAN 500 MBq/ml solución inyectable, Fludesoxiglucosa ( 18 F) 1 NOMBRE DEL MEDICAMENTO GLUSCAN 500 MBq/ml solución inyectable 2 COMPOSICIÓN CUALITATIVA Y
FICHA TECNICA. Adultos y niños: Aplicar cinco veces al día aproximadamente cada cuatro horas omitiendo la aplicación de la noche.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
Cada sobre de MOVICOL Pediátrico contiene los siguientes principios activos:
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. SPASMOBRONCHAL 0,03 mg/ml SOLUCIÓN INYECTABLE PARA EQUINO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SPASMOBRONCHAL 0,03 mg/ml SOLUCIÓN INYECTABLE PARA EQUINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SPASMOBRONCHAL 0,03 mg/ml SOLUCIÓN INYECTABLE PARA EQUINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento ESTRUMATE 2. Composición cualitativa y cuantitativa Cloprostenol (sódico)...0,0250 g (principio activo)* Ácido cítrico anhidro...0,056
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento ESTRUMATE 2. Composición cualitativa y cuantitativa Cloprostenol (sódico)...0,0250 g (principio activo)* Ácido cítrico anhidro...0,056
FICHA TÉCNICA. Glucosamina Teva 1.500 mg polvo para solución oral EFG
 1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
Guía para pacientes bajo tratamiento con yodo radiactivo. Servicios de Farmacia Nuclear
 Guía para pacientes bajo tratamiento con yodo radiactivo Servicios de Farmacia Nuclear Guía para pacientes bajo tratamiento con yodo radiactivo Este folleto es para usted, paciente que recibirá tratamiento
Guía para pacientes bajo tratamiento con yodo radiactivo Servicios de Farmacia Nuclear Guía para pacientes bajo tratamiento con yodo radiactivo Este folleto es para usted, paciente que recibirá tratamiento
LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
Menalgil B 6 Comprimidos
 agencia española de medicamentos y productos sanitarios Menalgil B 6 Comprimidos 1. NOMBRE DEL MEDICAMENTO MENALGIL B 6 Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA MENALGIL B 6 Comprimidos Cada
agencia española de medicamentos y productos sanitarios Menalgil B 6 Comprimidos 1. NOMBRE DEL MEDICAMENTO MENALGIL B 6 Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA MENALGIL B 6 Comprimidos Cada
Un comprimido masticable contiene: 680 mg de carbonato cálcico y 80 mg de carbonato de magnesio.
 agencia española de medicamentos y productos sanitarios Rennie comprimidos masticables con sacarina 1. NOMBRE DEL MEDICAMENTO Rennie comprimidos masticables con sacarina 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
agencia española de medicamentos y productos sanitarios Rennie comprimidos masticables con sacarina 1. NOMBRE DEL MEDICAMENTO Rennie comprimidos masticables con sacarina 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Este medicamento debe ser usado exclusivamente bajo prescripción y vigilancia médica y no puede repetirse sin nueva receta médica.
 DORMID 15mg/3ml MIDAZOLAM5mg/ml Solucióninyectable IndustriaHolandesa Ventabajorecetaarchivada Estemedicamentodebeserusadoexclusivamentebajoprescripciónyvigilanciamédicaynopuederepetirsesin nuevarecetamédica.
DORMID 15mg/3ml MIDAZOLAM5mg/ml Solucióninyectable IndustriaHolandesa Ventabajorecetaarchivada Estemedicamentodebeserusadoexclusivamentebajoprescripciónyvigilanciamédicaynopuederepetirsesin nuevarecetamédica.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
Prospecto: Información para el usuario
 Prospecto: Información para el usuario Gaviscon suspensión oral sabor menta Alginato de sodio, bicarbonato (hidrógenocarbonato) de sodio y carbonato de calcio Lea todo el prospecto detenidamente antes
Prospecto: Información para el usuario Gaviscon suspensión oral sabor menta Alginato de sodio, bicarbonato (hidrógenocarbonato) de sodio y carbonato de calcio Lea todo el prospecto detenidamente antes
FICHA TECNICA. Alivio local de los síntomas ocasionados por el herpes labial, tales como: picor, escozor u hormigueo.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FOSFOEVAC 10,8g / 24,4g solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada frasco contiene: Fosfato disódico
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FOSFOEVAC 10,8g / 24,4g solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada frasco contiene: Fosfato disódico
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ciclopirox olamina ISDIN 15 mg/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de champú contiene 15
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ciclopirox olamina ISDIN 15 mg/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de champú contiene 15
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ZACTRAN 150 mg/ml solución inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene:
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ZACTRAN 150 mg/ml solución inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene:
Prospecto: información para el usuario. Sorbenor 1g solución oral Aspartato de Arginina
 Prospecto: información para el usuario Sorbenor 1g solución oral Aspartato de Arginina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario Sorbenor 1g solución oral Aspartato de Arginina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Recuerde que su médico ha prescrito SINEMET solamente para usted. Nunca se lo dé a nadie más.
 INFORMACIÓN PARA EL PACIENTE SOBRE SINEMET Por favor lea cuidadosamente este panfleto antes de que empiece a tomar su medicamento, inclusive si usted está iniciando una nueva prescripción. Alguna de la
INFORMACIÓN PARA EL PACIENTE SOBRE SINEMET Por favor lea cuidadosamente este panfleto antes de que empiece a tomar su medicamento, inclusive si usted está iniciando una nueva prescripción. Alguna de la
Prospecto: información para el usuario. Cebión 500 mg granulado para solución oral. Ácido ascórbico (Vitamina C)
 Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
Prospecto: información para el usuario. Cardi-Braun Mantenimiento solución para perfusión
 Prospecto: información para el usuario Cardi-Braun Mantenimiento solución para perfusión Lea todo el prospecto detenidamente antes de empezar a usar este medicamento. - Conserve este prospecto, ya que
Prospecto: información para el usuario Cardi-Braun Mantenimiento solución para perfusión Lea todo el prospecto detenidamente antes de empezar a usar este medicamento. - Conserve este prospecto, ya que
La osmolaridad calculada de la solución es de 832 mosm/l y el ph de 3,5-5,5. El aporte teórico de calorías es de 600 kcal/l.
 1. NOMBRE DEL MEDICAMENTO Glucosada Grifols al 15% Solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Glucosa (D.C.I.) (como monohidrato), 15 g La osmolaridad
1. NOMBRE DEL MEDICAMENTO Glucosada Grifols al 15% Solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Glucosa (D.C.I.) (como monohidrato), 15 g La osmolaridad
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA ALOXIDIL 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA ALOXIDIL 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA. 2. ANTES DE USAR Minoxidil Viñas 5% solución cutánea
 1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
en tratamiento con Toctino ... Nombre de la paciente (alitretinoína) Para el médico Soluciones pensando en ti
 (alitretinoína) Tarjeta Restaura de seguimiento desde el interiorde la Paciente en con Toctino... Nombre de la paciente Para el médico Soluciones pensando en ti www.almirall.es www.solucionesalmirall.com
(alitretinoína) Tarjeta Restaura de seguimiento desde el interiorde la Paciente en con Toctino... Nombre de la paciente Para el médico Soluciones pensando en ti www.almirall.es www.solucionesalmirall.com
VITRIFICACIÓN DE ÓVULOS (OVOCITOS)
 VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 1 VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 2 Es una técnica que se considera un procedimiento experimental, destinada a conservar gametos femeninos con fines reproductivos,
VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 1 VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 2 Es una técnica que se considera un procedimiento experimental, destinada a conservar gametos femeninos con fines reproductivos,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. DURAMUNE CACHORROS DP + C Liofilizado y disolvente para suspensión inyectable para perros
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
FICHA TÉCNICA. Metamizol (D.C.I.) magnésico... 500 mg
 ALGI-MABO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ALGI-MABO Cápsulas ALGI-MABO Ampollas ALGI-MABO Supositorios adultos ALGI-MABO Supositorios infantil 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición
ALGI-MABO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ALGI-MABO Cápsulas ALGI-MABO Ampollas ALGI-MABO Supositorios adultos ALGI-MABO Supositorios infantil 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición
FICHA TÉCNICA. Glucosa
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
ETOPOSIDO 100mg/5mL. 1. Identificación del Medicamento. Nombre Comercial. Etoposido 100mg/5mL Solución Inyectable. Nombre Genérico.
 ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
Terapia de reposición en adultos y niños en síndromes de inmunodeficiencia primaria tales como:
 1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
Prospecto: información para el usuario. Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro
 Prospecto: información para el usuario Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
FICHA TÉCNICA. No hay ninguna advertencia o precaución en su empleo que merezca la pena destacar.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Foli-doce 400/2 microgramos comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: Acido fólico: 400 microgramos, Cianocobalamina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Foli-doce 400/2 microgramos comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: Acido fólico: 400 microgramos, Cianocobalamina
Prospecto: información para el usuario. DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral)
 Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A AMEFIN
 INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. NOMBRE COMERCIAL: 2. NOMBRE GENÉRICO: 3. FORMA FARMACÉUTICA Y FORMULACIÓN: Tabletas Cada tableta contiene: Excipiente cbp 100 mg y 300 mg 1 tableta 4. INDICACIONES
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. NOMBRE COMERCIAL: 2. NOMBRE GENÉRICO: 3. FORMA FARMACÉUTICA Y FORMULACIÓN: Tabletas Cada tableta contiene: Excipiente cbp 100 mg y 300 mg 1 tableta 4. INDICACIONES
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
PROSPECTO. 3. Cómo tomar PLANTASOR 3,5 g Polvo efervescente
 PROSPECTO PLANTASOR 3,5 g Polvo efervescente Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted. Conserve este prospecto. Puede
PROSPECTO PLANTASOR 3,5 g Polvo efervescente Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted. Conserve este prospecto. Puede
Prospecto: información para el usuario. NovoThirteen 2.500 UI polvo y disolvente para solución inyectable
 Prospecto: información para el usuario NovoThirteen 2.500 UI polvo y disolvente para solución inyectable catridecacog (factor XIII de coagulación recombinante) Este medicamento está sujeto a seguimiento
Prospecto: información para el usuario NovoThirteen 2.500 UI polvo y disolvente para solución inyectable catridecacog (factor XIII de coagulación recombinante) Este medicamento está sujeto a seguimiento
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Granisetrón NORMON 1 mg/1 ml solución inyectable EFG Granisetrón
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Granisetrón NORMON 1 mg/1 ml solución inyectable EFG Granisetrón Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Granisetrón NORMON 1 mg/1 ml solución inyectable EFG Granisetrón Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto,
Prospecto: Información para el usuario. Levelina 10 mg/g crema Bifonazol
 Prospecto: Información para el usuario Levelina 10 mg/g crema Bifonazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Prospecto: Información para el usuario Levelina 10 mg/g crema Bifonazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
X-Plain Diverticulitis Sumario
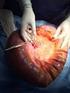 X-Plain Diverticulitis Sumario La diverticulosis es una condición común, pero con el potencial de causar complicaciones que pueden amenazar su vida. A veces los médicos recomiendan la extracción quirúrgica
X-Plain Diverticulitis Sumario La diverticulosis es una condición común, pero con el potencial de causar complicaciones que pueden amenazar su vida. A veces los médicos recomiendan la extracción quirúrgica
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Hirudoid 3 mg/g gel Condroitina sulfato de sodio
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Hirudoid 3 mg/g gel Condroitina sulfato de sodio Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante
PROSPECTO: INFORMACIÓN PARA EL USUARIO Hirudoid 3 mg/g gel Condroitina sulfato de sodio Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ácido Fusídico Isdin 20 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo contiene 20 mg de ácido fusídico.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ácido Fusídico Isdin 20 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo contiene 20 mg de ácido fusídico.
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 IBUPROFENO 100 mg/5 ml SUSPENSIÓN ANTIPIRÉTICO-ANTIINFLAMATORIO Página 1 IBUPROFENO 100 mg/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 IBUPROFENO 100 mg/5 ml SUSPENSIÓN ANTIPIRÉTICO-ANTIINFLAMATORIO Página 1 IBUPROFENO 100 mg/5 ml Suspensión Principio
La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares.
 Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
X-Plain La pancreatitis Sumario
 X-Plain La pancreatitis Sumario La pancreatitis es una enfermedad poco común que provoca la inflamación del páncreas. A pesar de ser una enfermedad poco común, casi 80,000 norteamericanos padecen de pancreatitis
X-Plain La pancreatitis Sumario La pancreatitis es una enfermedad poco común que provoca la inflamación del páncreas. A pesar de ser una enfermedad poco común, casi 80,000 norteamericanos padecen de pancreatitis
X-Plain Glaucoma Sumario
 X-Plain Glaucoma Sumario El glaucoma es un grupo de enfermedades que afectan al ojo y que pueden llevar a la ceguera si no se recibe tratamiento adecuado. El glaucoma de ángulo abierto, la forma de glaucoma
X-Plain Glaucoma Sumario El glaucoma es un grupo de enfermedades que afectan al ojo y que pueden llevar a la ceguera si no se recibe tratamiento adecuado. El glaucoma de ángulo abierto, la forma de glaucoma
MUNTEL 5 mg comprimidos recubiertos con película Levocetirizina dihidrocloruro
 Prospecto: Información para el paciente MUNTEL 5 mg comprimidos recubiertos con película Levocetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
Prospecto: Información para el paciente MUNTEL 5 mg comprimidos recubiertos con película Levocetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
Prospecto: información para el usuario. FUNGAREST 20 mg/g crema ketoconazol
 Prospecto: información para el usuario FUNGAREST 20 mg/g crema ketoconazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Prospecto: información para el usuario FUNGAREST 20 mg/g crema ketoconazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
EchinaMed Junior, comprimidos
 EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO GLUSCAN 500 MBq/ml solución inyectable, Fludesoxiglucosa ( 18 F)
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO GLUSCAN 500 MBq/ml solución inyectable, Fludesoxiglucosa ( 18 F) 1 NOMBRE DEL MEDICAMENTO GLUSCAN 500 MBq/ml solución inyectable 2 COMPOSICIÓN CUALITATIVA Y
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO GLUSCAN 500 MBq/ml solución inyectable, Fludesoxiglucosa ( 18 F) 1 NOMBRE DEL MEDICAMENTO GLUSCAN 500 MBq/ml solución inyectable 2 COMPOSICIÓN CUALITATIVA Y
Exposición de trabajadores a sustancias químicas
 Exposición de trabajadores a sustancias químicas La exposición laboral a estas sustancias se define como aquella situación en la que un trabajador puede recibir la acción de un agente químico, así como
Exposición de trabajadores a sustancias químicas La exposición laboral a estas sustancias se define como aquella situación en la que un trabajador puede recibir la acción de un agente químico, así como
Agencia Española de Medicamentos y Productos Sanitarios AEMPS TRIMETAZIDINA (IDAPTAN, TRIMETAZIDINA EFG): RESTRICCIÓN DE INDICACIONES
 Nota informativa Productos Sanitarios AEMPS TRIMETAZIDINA (IDAPTAN, TRIMETAZIDINA EFG): RESTRICCIÓN DE INDICACIONES Fecha de publicación: 25 de junio de 2012 Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.
Nota informativa Productos Sanitarios AEMPS TRIMETAZIDINA (IDAPTAN, TRIMETAZIDINA EFG): RESTRICCIÓN DE INDICACIONES Fecha de publicación: 25 de junio de 2012 Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.
OPTISPRING 0,5 mg/ml colirio en solución en envases unidosis
 1. NOMBRE DEL MEDICAMENTO OPTISPRING 0,5 mg/ml colirio en solución en envases unidosis 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada envase de 0,5 ml de colirio en solución contiene: Tetrizolina hidrocloruro.250
1. NOMBRE DEL MEDICAMENTO OPTISPRING 0,5 mg/ml colirio en solución en envases unidosis 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada envase de 0,5 ml de colirio en solución contiene: Tetrizolina hidrocloruro.250
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. PRID DELTA 1,55 g SISTEMA DE LIBERACIÓN VAGINAL PARA BOVINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PRID DELTA 1,55 g SISTEMA DE LIBERACIÓN VAGINAL PARA BOVINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sistema
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PRID DELTA 1,55 g SISTEMA DE LIBERACIÓN VAGINAL PARA BOVINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sistema
Prospecto: información para el usuario. Benzac 100 mg/g gel Peróxido de benzoilo
 Prospecto: información para el usuario Benzac 100 mg/g gel Peróxido de benzoilo Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
Prospecto: información para el usuario Benzac 100 mg/g gel Peróxido de benzoilo Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERITROMICINA 125 mg/5 ml POLVO PARA SUSPENSION ANTIHISTAMINICO Página 1 ERITROMICINA 125 mg/5 ml Polvo Para Suspensión
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERITROMICINA 125 mg/5 ml POLVO PARA SUSPENSION ANTIHISTAMINICO Página 1 ERITROMICINA 125 mg/5 ml Polvo Para Suspensión
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. OCTACILLIN 800 mg/g POLVO PARA ADMINISTRACIÓN EN AGUA DE BEBIDA PARA PORCINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO OCTACILLIN 800 mg/g POLVO PARA ADMINISTRACIÓN EN AGUA DE BEBIDA PARA PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO OCTACILLIN 800 mg/g POLVO PARA ADMINISTRACIÓN EN AGUA DE BEBIDA PARA PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Prospecto: información para el usuario
 Prospecto: información para el usuario HIBITANE 5mg/5mg Comprimidos para chupar sabor mentol Clorhexidina dihidrocloruro/benzocaína Lea todo el prospecto detenidamente porque contiene información importante
Prospecto: información para el usuario HIBITANE 5mg/5mg Comprimidos para chupar sabor mentol Clorhexidina dihidrocloruro/benzocaína Lea todo el prospecto detenidamente porque contiene información importante
Ficha Técnica. Nueva Fórmula. 1. Nombre del medicamento. 2. Composición cualitativa y cuantitativa. Primene 10%
 Nueva Fórmula 1. Nombre del medicamento Primene 10% 2. Composición cualitativa y cuantitativa Aminoácidos esenciales: L-Isoleucina.....0,670 g L-Leucina......1,00 g L-Valina.....0,760 g L-Lisina.....1,100
Nueva Fórmula 1. Nombre del medicamento Primene 10% 2. Composición cualitativa y cuantitativa Aminoácidos esenciales: L-Isoleucina.....0,670 g L-Leucina......1,00 g L-Valina.....0,760 g L-Lisina.....1,100
AGENCIA NACIONAL DE MEDICAMENTOS INSTRUCTIVO SOBRE CONTENIDOS Y FORMATO DE FOLLETO DE INFORMACIÓN AL PACIENTE
 AGENCIA NACIONAL DE MEDICAMENTOS INSTRUCTIVO SOBRE CONTENIDOS Y FORMATO DE FOLLETO DE INFORMACIÓN AL PACIENTE 1.-ASPECTOS LEGALES El folleto de información al paciente debe cumplir con lo señalado en los
AGENCIA NACIONAL DE MEDICAMENTOS INSTRUCTIVO SOBRE CONTENIDOS Y FORMATO DE FOLLETO DE INFORMACIÓN AL PACIENTE 1.-ASPECTOS LEGALES El folleto de información al paciente debe cumplir con lo señalado en los
POR QUÉ YA NO SE RECOMIENDA ESPERAR 3 MESES PARA HACERSE LA PRUEBA DEL VIH?
 QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
SUNITINIB CÁPSULAS DURAS DE 12,5-25 y 50 mg
 SUNITINIB CÁPSULAS DURAS DE 12,5-25 y 50 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier
SUNITINIB CÁPSULAS DURAS DE 12,5-25 y 50 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO PILKA NIÑOS 140 mg/140 mg supositorios 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Supositorios
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO PILKA NIÑOS 140 mg/140 mg supositorios 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Supositorios
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Bicarbonato Sódico 1M Grifols Solución inyectable Hidrogenocarbonato de sodio
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Bicarbonato Sódico 1M Grifols Solución inyectable Hidrogenocarbonato de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Bicarbonato Sódico 1M Grifols Solución inyectable Hidrogenocarbonato de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
Prospecto: información par el usuario. SEBUMSELEN champú Sulfuro de selenio / Benzalconio cloruro
 Prospecto: información par el usuario SEBUMSELEN champú Sulfuro de selenio / Benzalconio cloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Prospecto: información par el usuario SEBUMSELEN champú Sulfuro de selenio / Benzalconio cloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
