Unidad 5 (Parte 7) Análisis y Síntesis de Péptidos y Proteínas.
|
|
|
- Julio Cruz Benítez
- hace 7 años
- Vistas:
Transcripción
1 Unidad 5 (Parte 7) Análisis y Síntesis de Péptidos y Proteínas. La determinación de la estructura de un péptido requiere contestar tres preguntas: Cuáles aminoácidos están presentes? Cuántos hay de cada uno? Cuál es la secuencia de los aminoácidos en la cadena peptídica? Para el análisis de los aminoácidos presentes y la cantidad de los mismos en un péptido se utiliza un analizador de aminoácidos Este equipo es un instrumento automatizado desarrollado en la década de los cincuenta por William Stein y Stanford Moore en el Instituto Rockefeller (ahora Universidad Rockefeller). Lic. Walter de la Roca 1
2 En la preparación para el análisis, el péptido se rompe en sus aminoácidos constituyentes reduciendo todos los enlaces disulfuro, restringiendo los grupos SH de los residuos de cisteína por la reacción SN 2 con ácido yodoacético. Por último hidrolizando los enlaces amida calentándolo con HCl 6 M acuoso a 110 C por 24 horas. Se analiza la mezcla resultante de aminoácidos, por cromatografía de líquidos de alta resolución (HPLC), o por una técnica relacionada llamada cromatografía de intercambio iónico. Lic. Walter de la Roca 2
3 En la técnica de intercambio iónico, los aminoácidos separados salen (eluyen) del extremo de la columna cromatográfica mezclados con una disolución de ninhidrina y experimentan una reacción rápida que produce un color púrpura intenso. El color es detectado por un espectrómetro, y se obtiene una gráfica de tiempo de elución contra la absorbancia en el espectrómetro. Debido a que es reproducible la cantidad de tiempo requerido para que un aminoácido dado eluya de una columna estándar, pueden determinarse las identidades de los aminoácidos en un péptido. Lic. Walter de la Roca 3
4 La cantidad de cada aminoácido en la muestra se determina midiendo la intensidad del color púrpura que resulta de su reacción con ninhidrina. Secuenciación de péptidos: Degradación de Edman Si ya se conocen la identidad y la cantidad de aminoácidos, se determina la secuencia del péptido para conocer en qué orden están unidos los aminoácidos. En la actualidad, la mayor parte de la secuenciación de péptidos se hace por medio de la espectrometría de masas, utilizando la ionización por electroaspersión (ESI) o ionización por desorción láser asistida por patrón (MALDI) unido a un analizador de masas de tiempo de recorrido (TOF) Lic. Walter de la Roca 4
5 También es de uso común un método químico de secuenciación de péptidos llamado degradación de Edman. La idea general de la secuenciación de péptidos por la degradación de Edman es romper un aminoácido a la vez desde un extremo de la cadena peptídica. El aminoácido terminal se separa e identifica, y se repiten las reacciones de ruptura en el péptido de cadena acortada hasta que se conoce por completo la secuencia del péptido. Están disponibles secuenciadores de proteínas automatizados que permiten que se realicen hasta 50 ciclos repetitivos de secuenciación antes de que una acumulación de subproductos no deseados interfiera con los resultados. Son tan eficientes estos instrumentos que la información de la secuencia puede obtenerse a partir de muestras de sólo 1 a 5 picomoles-menos de 0.1 μg. Lic. Walter de la Roca 5
6 Lic. Walter de la Roca 6
7 Lic. Walter de la Roca 7
8 El rearreglo posterior catalizado por un ácido del derivado de ATZ con ácido acuoso lo convierte en una feniltiohidantoína (PTH), la cual se identifica por cromatografia al comparar su tiempo de elusión con los tiempos de elusión conocidos de los derivados de PTH de los 20 aminoácidos comunes. No es práctica la secuenciación completa de proteínas largas por la degradación de Edman debido a la acumulación de subproductos no deseados. Para evitar este problema, primero una cadena grande de un péptido se rompe por hidrólisis parcial en un número de fragmentos más pequeños. Y luego se determina la secuencia de cada fragmento, y los fragmentos individuales se ajustan entre sí al emparejar los extremos que se traslapan. De esta forma, se han secuenciado cadenas de proteínas con más de 400 aminoácidos. Lic. Walter de la Roca 8
9 La hidrólisis parcial de un péptido puede realizarse enzimática o químicamente con ácido acuoso. La hidrólisis ácida no es selectiva y conduce a una mezcla más o menos aleatoria de fragmentos pequeños, pero la hidrólisis enzimática es absolutamente específica. Por ejemplo, la enzima tripsina sólo cataliza la hidrólisis de péptidos en el lado carboxilo de los aminoácidos básicos arginina y lisina; la quimotripsina sólo rompe en el lado carboxilo de los aminoácidos arilsustituidos fenilalanina, tirosina y triptófano. Lic. Walter de la Roca 9
10 Lic. Walter de la Roca 10
11 Tripsina Rompe selectivamente la unión peptídica en el carbonilo de lisina o arginina Quimotripsina Rompe selectivamente la unión peptídica en el grupo carbonilo de aminoácidos con cadena lateral aromática Lic. Walter de la Roca 11
12 Carboxipeptidasa Selectiva, rompe la unión peptídica que libera el aminoácido C-terminal Bromuro de cianógeno No es una enzima, pero es específico para romper el enlace carboxilo de metionina Lic. Walter de la Roca 12
13 Ejercicios El octapéptido angiotensina II tiene la secuencia Asp-Arg-Val- Tir-Ile-His-Pro-Fen. Qué fragmentos resultarían si se rompiera la angiotensina con tripsina? Con quimotripsina? Dibuje la estructura del derivado de PTH que se formaría en la degradación de Edmande la angiotensina II Formaría el compuesto con el ácido aspartíco Lic. Walter de la Roca 13
14 Qué aminoácido es el residuo N-terminal en un péptido que da el derivado de PTH siguiente en la degradación de Edman? De la secuencia de aminoácidos de los hexapéptidos que producen los conjuntos defragmentos siguientes en la hidrólisis parcial ácida: (a) Arg, Gli, Ile, Leu, Pro, Val da Pro-Leu-Gli, Arg-Pro, Gli-Ile-Val (b) N, L, M, W, V da V-L, V-M-W, W-N-V Lic. Walter de la Roca 14
15 Un polipéptido de 5 aminoácidos de longitud se rompe en varios fragmentos más pequeños y se determinan las secuencias de aminoácidos de algunos de esos fragmentos. Tres de los fragmentos identificados son: His-Gly-Ser, Ala-His, y Ala- Ala. Cuál es la secuencia del polipéptido original? A. His-Gly-Ser-Ala-Ala B. Ala-His-Gly-Ser-Ala C. Ala-Ala-His-Gly-Ser D. His-Ser-Gly-Ala-Ala E. Se necesita más información para determinarla. Un polipéptido de 10 aminoácidos de longitud se fragmenta en polipéptidos más pequeños y se determina la secuencia de varios de ellos. Entre los fragmentos identificados se encuentran los siguientes: Ala-Gly-Ser-Gln, Lys-Trp-Arg-Pro, Gln-His-Lys, Asp-Ala-Gly. Cuál es la secuencia del polipéptido original? A. Ala-Gly-Ser-Gln-Lys-Trp-Arg-Pro-Gln-His B. Asp-Ala-Gly-Ser-Gln-His-Lys-Trp-Arg-Pro C. Ala-Gly-Ser-Gln-His-Lys-Trp-Arg-Pro-Asp D. Lys-Trp-Arg-Pro-Gln-His-Lys-Asp-Ala-Gly E. Ninguna de las anteriores Lic. Walter de la Roca 15
16 Síntesis de Péptidos Al conocer su estructura, ya puede emprenderse la síntesis de un péptido, quizá para obtener una gran cantidad para una evaluación biológica. La síntesis de péptidos es un problema más difícil debido que deben formarse en un orden específico varios enlaces amida distintos en lugar de formarlos aleatoriamente La solución al problema de especificidad consiste en proteger aquellos grupos funcionales que queremos hacer no reactivos mientras dejamos expuestos sólo aquellos grupos funcionales que queremos que reaccionen. Lic. Walter de la Roca 16
17 Si quisiéramos acoplar alanina con leucina para sintetizar Ala-Leu, podemos proteger el grupo NH 2 de la alanina y el grupo CO 2 H de la leucina para volverlos no reactivos, después formar el enlace amida deseado y eliminar posteriormente los grupos protectores. Se han diseñado varios grupos protectores de amino y carboxilo diferentes, pero sólo unos cuantos se utilizan ampliamente. Con frecuencia los grupos carboxilo se protegen sencillamente convirtiéndolos en ésteres metílicos o bencílicos. Lic. Walter de la Roca 17
18 Ambos grupos son introducidos fácilmente por los métodos estándares de formación de ésteres y son eliminados con facilidad por la hidrólisis suave con NaOH acuoso. Los ésteres bencílicos también pueden romperse por una hidrogenólisis catalítica del enlace bencílico débil C-O (RCO 2 -CH 2 Ph + H 2 RCO 2 H + PhCH 3 ). Lic. Walter de la Roca 18
19 Los grupos amino con frecuencia se protegen como sus derivados ter-butoxicarbonilamida, o Boc. Se introduce el grupo protector Boc por la reacción del aminoácido con dicarbonato de di-ter-butilo en una reacción de sustitución nucleofílica en el grupo acilo y se elimina por el tratamiento breve con un ácido orgánico fuerte como el ácido trifluoroacético, CF 3 CO 2 H Lic. Walter de la Roca 19
20 Reacción de activación del COOH (C-terminal, protegido) y posterior ataqué de NH 2 (N-terminal, protegido) Lic. Walter de la Roca 20
21 Por lo tanto, se necesitan cinco etapas para sintetizar un dipéptido como el Ala-Leu: Lic. Walter de la Roca 21
22 Estas etapas pueden repetirse para adicionar un aminoácido a la vez a fin de aumentar la cadena o unir dos cadenas de péptido. Se han reportado varios logros notables en la síntesis de péptidos, que incluyen una síntesis completa de la insulina humana. La insulina se compone de dos cadenas que suman un total de 51 aminoácidos unidos por puentes disulfuro. Su estructura fue determinada por Frederick Sanger, quién en 1958 recibió el Premio Nobel de Química por su trabajo. Lic. Walter de la Roca 22
23 Síntesis automatizada de péptidos: El método en fase sólida de Merrifield La síntesis de cadenas de péptidos largas por la adición secuencial de un aminoácido a la vez es extensa y ardua, pero es posible una gran simplificación utilizando el método en fase sólida introducido por R. Bruce Merrifield de la Universidad Rockefeller. En el método de Merrifield, la síntesis de péptidos se realiza con la cadena en crecimiento de aminoácido unida covalentemente a cuentas pequeñas de una resina de polímero en lugar de en una disolución. Lic. Walter de la Roca 23
24 En el procedimiento estándar de Merrifield, se utiliza la resina de poliestireno, y es preparada de tal manera que aproximadamente uno de cada 100 anillos de benceno contenga un grupo clorometilo (CH 2 Cl), y el aminoácido C- terminal protegido por Boc se une a la resina a través de un enlace éster el cual es formado por una reacción SN 2. Lic. Walter de la Roca 24
25 Lic. Walter de la Roca 25
26 A través de los años se han mejorado sustancialmente los detalles de la técnica en fase sólida, pero la idea fundamental sigue siendo la misma. Las resinas más comúnmente utilizadas actualmente son la resina de Wang o la resina de PAM (fenilacetamidometilo), y el grupo N-protector más comúnmente utilizado es el fluorenilmetiloxicarbonilo, o grupo Fmoc, en lugar de Boc. Lic. Walter de la Roca 26
27 Actualmente se utilizan sintetizadores de péptidos robóticos para repetir las etapas de acoplamiento, lavado y desprotección con aminoácidos diferentes. Cada etapa ocurre con rendimiento alto, de manera automática se minimiza la pérdida mecánica debido a que los péptidos intermediarios nunca se eliminan del polímero insoluble hasta la etapa final. Utilizando este procedimiento, pueden prepararse rutinariamente hasta 25 a 30 mg de un péptido con 20 aminoácidos. Biosíntesis de péptidos ADN codifica la formación de ARN. ARN mensajero determina la secuencia de aminoácidos y ARN de transferencia con un aa específico unido como éster. Lic. Walter de la Roca 27
28 Lic. Walter de la Roca 28
29 Estructura de las proteínas Las proteínas se clasifican usualmente como fibrosas o globulares, de acuerdo con su forma tridimensional. Las proteínas fibrosas, como el colágeno en los tendones y el tejido conectivo y la miosina en el tejido muscular, consisten en cadenas de polipéptidos arregladas lado a lado en filamentos largos. Debido a que estas proteínas son resistentes e insolubles en agua, se utilizan en la naturaleza para formar materiales estructurales. En cambio, las proteínas globulares usualmente se enrollan en formas compactas casi esféricas; por lo general, estas proteínas son solubles en agua y se mueven dentro de las células. La mayor parte de las aproximadamente enzimas que se han caracterizado hasta la fecha son proteínas globulares. Lic. Walter de la Roca 29
30 Las proteínas son tan grandes que la palabra estructura toma un significado más amplio que el que tiene cuando se refiere a los compuestos orgánicos más simples. De hecho, los químicos hablan de cuatro niveles diferentes de estructuras cuando describen a las proteínas. La estructura primaria de una proteína simplemente es la secuencia de aminoácidos. La estructura secundaria de una proteína describe cómo los segmentos del esqueleto del péptido se orientan en un patrón regular. La estructura terciaria describe cómo toda la molécula de proteína se enrolla en una forma tridimensional global. La estructura cuaternaria describe cómo las moléculas de proteínas diferentes se integran para producir estructuras agregadas grandes. Lic. Walter de la Roca 30
31 Lic. Walter de la Roca 31
32 La estructura primaria se determina, como hemos visto, secuenciando la proteína. Las estructuras secundarias, terciarias y cuaternarias se determinan por cristalografía de rayos X, debido a que aún no es posible predecir por computación cómo se pliega una secuencia de una proteína dada. Las estructuras secundarias más comunes son la hélice α y la lámina β-plegada. Una hélice α es un enrollamiento a la derecha del esqueleto de la proteína, muy parecido al enrollamiento de un cordón telefónico (figura a). Cada vuelta de la hélice contiene 3.6 residuos de aminoácido, con una distancia entre vueltas de 540 pm, o 5.4 Å. La estructura se estabiliza por puentes de hidrógeno entre grupos amida NH y grupos CO a cuatro residuos de distancia, con una distancia NH O de 2.8 Å. Lic. Walter de la Roca 32
33 La hélice α es una estructura secundaria extremadamente común, y casi todas las proteínas globulares contienen varios segmentos helicoidales. La mioglobina, una proteína globular pequeña que contiene 153 residuos de aminoácido en una sola cadena, es un ejemplo (figura b). Lic. Walter de la Roca 33
34 Una lámina β-plegada difiere de una hélice en que se extiende la cadena de péptido en vez enrollarse y los puentes de hidrógeno ocurren entre los residuos de las cadenas adyacentes (figura a). Las cadenas vecinas pueden correr en la misma dirección (paralela) o en direcciones opuestas (antiparalela), aunque el arreglo antiparalelo es más común y un poco más favorecido desde el punto de vista energético. Por ejemplo, la concanavalina A consiste en dos cadenas idénticas de 237 residuos, cada una con regiones extensas de láminas antiparalelas. Lic. Walter de la Roca 34
35 Estructura terciaria Es la forma tridimensional en que la proteína se dobla sobre sí misma como resultado de sus estructuras primaria y secundaria. En las proteínas globulares, la mayor cantidad de los grupos polares están expuestos hacia el medio acuoso, haciéndolas solubles. Las estructuras terciarias están estabilizadas por puentes de hidrógeno, puentes disulfuro, fuerzas de van der Waals e interacciones iónicas. Lic. Walter de la Roca 35
36 Fuerzas que determinan la estructura terciaria Lic. Walter de la Roca 36
37 Desnaturalización de proteínas Debido a que la estructura terciaria de una proteína globular es sostenida delicadamente por atracciones intramoleculares débiles, con frecuencia es suficiente un cambio ligero en la temperatura o el ph para desestabilizar la estructura y ocasionar que la proteína se desnaturalice. La solubilidad disminuye drásticamente. Las Enzimas también pierden su actividad catalítica por desnaturalización. Aunque la mayor parte de las desnaturalizaciones son irreversibles, se conocen algunos casos donde ocurre la renaturalización espontánea de una proteína desdoblada a su estructura terciaria estable. La renaturalización se acompaña por una recuperación total de la actividad biológica. Lic. Walter de la Roca 37
38 Estructura cuaternaria de las proteínas Es la estructura total de una proteína que está conformada por varias subunidades. No todas las proteínas tienen estructura cuaternaria. Lic. Walter de la Roca 38
Unidad 5 (Parte 8) Análisis y Síntesis de Péptidos y Proteínas.
 Unidad 5 (Parte 8) Análisis y Síntesis de Péptidos y Proteínas. La determinación de la estructura de un péptido requiere contestar tres preguntas: Cuáles aminoácidos están presentes? Cuántos hay de cada
Unidad 5 (Parte 8) Análisis y Síntesis de Péptidos y Proteínas. La determinación de la estructura de un péptido requiere contestar tres preguntas: Cuáles aminoácidos están presentes? Cuántos hay de cada
PRÓTIDOS. 2.27 En el esquema se representa la fórmula general de un aminoácido. Indica qué es lo tapado con los recuadros del 1 al 4.
 PRÓTIDOS 2.27 En el esquema se representa la fórmula general de un aminoácido. Indica qué es lo tapado con los recuadros del 1 al 4. 2.28 - Se podrían separar los distintos aminoácidos de una mezcla en
PRÓTIDOS 2.27 En el esquema se representa la fórmula general de un aminoácido. Indica qué es lo tapado con los recuadros del 1 al 4. 2.28 - Se podrían separar los distintos aminoácidos de una mezcla en
PREGUNTAS PAU PROTEÍNAS
 PREGUNTAS PAU PROTEÍNAS EJERCICIO 1 a) Cuáles son las unidades estructurales de las proteínas? [0 2] b) Escriba su fórmula general [0 2]. c) Atendiendo a la variedad de radicales cite cuatro tipos de dichas
PREGUNTAS PAU PROTEÍNAS EJERCICIO 1 a) Cuáles son las unidades estructurales de las proteínas? [0 2] b) Escriba su fórmula general [0 2]. c) Atendiendo a la variedad de radicales cite cuatro tipos de dichas
Tema 12. Química de los aminoácidos y péptidos
 Tema 12 Química de los aminoácidos y péptidos Estructura Átomo de carbono α Grupo amino α Un α-aminoácido Enlaces peptídicos Cadena lateral Una parte de un péptido Alanina Serina Glicina Cisteina Valina
Tema 12 Química de los aminoácidos y péptidos Estructura Átomo de carbono α Grupo amino α Un α-aminoácido Enlaces peptídicos Cadena lateral Una parte de un péptido Alanina Serina Glicina Cisteina Valina
Aminoácidos y Proteínas. Bioquímica Kinesiología UNLAM 2014
 Aminoácidos y Proteínas Bioquímica Kinesiología UNLAM 2014 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
Aminoácidos y Proteínas Bioquímica Kinesiología UNLAM 2014 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
Biomoléculas Orgánicas II
 Biomoléculas Orgánicas II INTRODUCCIÓN Tal como se vio en la clase anterior, los elementos químicos se organizan de tal forma que aumentan su complejidad y desarrollan funciones que son específicas. En
Biomoléculas Orgánicas II INTRODUCCIÓN Tal como se vio en la clase anterior, los elementos químicos se organizan de tal forma que aumentan su complejidad y desarrollan funciones que son específicas. En
CLASIFICACIÓN SEGÚN SU POLARIDAD NO POLARES POLARES NEUTROS ACIDOS BASICOS
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2015 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2015 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
PÉPTIDOS Y PROTEÍNAS
 PÉPTID Y PTEÍA 2 2 ' 2 ' n 2 -terminal (izquierda) 2 ' n2 -terminal (derecha) n
PÉPTID Y PTEÍA 2 2 ' 2 ' n 2 -terminal (izquierda) 2 ' n2 -terminal (derecha) n
Aminoácidos. 7. Sobre la actividad óptica de los aminoácidos es cierto que:
 Aminoácidos 1. La valoración de valina con hidróxido sódico, conduce a la obtención de dos pks. La reacción de valoración que se produce al pk2 de 9,62 es: a) COOH + OH- --> -COO- + H2O. b) COOH + -NH2
Aminoácidos 1. La valoración de valina con hidróxido sódico, conduce a la obtención de dos pks. La reacción de valoración que se produce al pk2 de 9,62 es: a) COOH + OH- --> -COO- + H2O. b) COOH + -NH2
Lehninger Principles of Biochemistry Fourth Edition
 David L. Nelson and Michael M. Cox Lehninger Principles of Biochemistry Fourth Edition Capítulo 3: Amino Acidos, Péptidos, y Proteínas Copyright 2004 by W. H. Freeman & Company Estereoquímica de Aminoácidos
David L. Nelson and Michael M. Cox Lehninger Principles of Biochemistry Fourth Edition Capítulo 3: Amino Acidos, Péptidos, y Proteínas Copyright 2004 by W. H. Freeman & Company Estereoquímica de Aminoácidos
Carbocationes. sp 3. Formación de Carbocationes
 arbocationes Los carbocationes son intermediarios orgánicos en los que el carbono está cargado positivamente. Una gran cantidad de reacciones orgánicas proceden a través de la formación de carbocationes.
arbocationes Los carbocationes son intermediarios orgánicos en los que el carbono está cargado positivamente. Una gran cantidad de reacciones orgánicas proceden a través de la formación de carbocationes.
ESTRUCTURA 4ª. áá ESENCIAL
 PROTEINAS COMPOSICIÓN AMINOÁCIDOS ENLACE PEPTÍDICO ESTRUCTURA CLASIFICACIÓN áá ESENCIAL PROPIEDADES NO POLARES POLARES S/CARGA POLARES C/CARGA OPTICAS ACIDO-BASE (Anfóteras) SOLUBILIDAD PUNTO DE FUSIÓN
PROTEINAS COMPOSICIÓN AMINOÁCIDOS ENLACE PEPTÍDICO ESTRUCTURA CLASIFICACIÓN áá ESENCIAL PROPIEDADES NO POLARES POLARES S/CARGA POLARES C/CARGA OPTICAS ACIDO-BASE (Anfóteras) SOLUBILIDAD PUNTO DE FUSIÓN
Se encuentra separado del citoplasma por la envoltura nuclear, que está formada por varias cisternas del retículo endoplasmático, que se mantienen uni
 Se encuentra separado del citoplasma por la envoltura nuclear, que está formada por varias cisternas del retículo endoplasmático, que se mantienen unidas gracias a una red de filamentos intermedios que
Se encuentra separado del citoplasma por la envoltura nuclear, que está formada por varias cisternas del retículo endoplasmático, que se mantienen unidas gracias a una red de filamentos intermedios que
BLOQUE I.- CUÁL ES LA COMPOSICIÓN DE LOS SERES VIVOS? LAS MOLÉCULAS DE LA VIDA
 BLOQUE I.- CUÁL ES LA COMPOSICIÓN DE LOS SERES VIVOS? LAS MOLÉCULAS DE LA VIDA UNIDAD DIDÁCTICA 1. Bioelementos y biomoléculas. Agua y sales minerales. Describir qué es la biología. Conocer las características
BLOQUE I.- CUÁL ES LA COMPOSICIÓN DE LOS SERES VIVOS? LAS MOLÉCULAS DE LA VIDA UNIDAD DIDÁCTICA 1. Bioelementos y biomoléculas. Agua y sales minerales. Describir qué es la biología. Conocer las características
REACCIONES EN QUÍMICA ORGÁNICA (II)
 (II) ALCOHOLES Y FENOLES Propiedades físicas de los alcoholes y fenoles El oxígeno es mucho más electronegativo que el carbono y que el hidrógeno por lo tanto, los alcoholes son compuestos polares. Cuando
(II) ALCOHOLES Y FENOLES Propiedades físicas de los alcoholes y fenoles El oxígeno es mucho más electronegativo que el carbono y que el hidrógeno por lo tanto, los alcoholes son compuestos polares. Cuando
EXPERIMENTO 3. CURVAS DE TITULACION DE AMINOACIDOS. DETERMINACION DE VALORES DE pk
 EXPERIMENTO 3 CURVAS DE TITULACION DE AMINOACIDOS. DETERMINACION DE VALORES DE pk REQUISITOS Repasar los conceptos sobre las propiedades de los aminoácidos (AA), reacciones ácido base, ph, pk, soluciones
EXPERIMENTO 3 CURVAS DE TITULACION DE AMINOACIDOS. DETERMINACION DE VALORES DE pk REQUISITOS Repasar los conceptos sobre las propiedades de los aminoácidos (AA), reacciones ácido base, ph, pk, soluciones
PROTEÍNAS. Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas:
 PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
SÍNTESIS DE PROTEINAS DEL ADN A LAS PROTEÍNAS
 SÍNTESIS DE PROTEINAS DEL ADN A LAS PROTEÍNAS La molécula de ADN contiene toda la información hereditaria de los seres vivos es decir en ella se encuentran los genes que determinan las características
SÍNTESIS DE PROTEINAS DEL ADN A LAS PROTEÍNAS La molécula de ADN contiene toda la información hereditaria de los seres vivos es decir en ella se encuentran los genes que determinan las características
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PRÁCTICA 3A. AMINOÁCIDOS Y PÉPTIDOS. REACCIÓN DE PSEUDO SANGER/ IDENTIFICACIÓN DE AMINOÁCIDOS.
 PRÁCTICA 3A. AMINOÁCIDOS Y PÉPTIDOS. REACCIÓN DE PSEUDO SANGER/ IDENTIFICACIÓN DE AMINOÁCIDOS. Presentan: Cruz Rodríguez Meyli Joanna Garrido Santos Monserrat Yesenia 15. Marzo.2018 OBJETIVOS: Ejemplificar
PRÁCTICA 3A. AMINOÁCIDOS Y PÉPTIDOS. REACCIÓN DE PSEUDO SANGER/ IDENTIFICACIÓN DE AMINOÁCIDOS. Presentan: Cruz Rodríguez Meyli Joanna Garrido Santos Monserrat Yesenia 15. Marzo.2018 OBJETIVOS: Ejemplificar
CÁTEDRA DE QUÍMICA ORGÁNICA- 2012. Trabajo Práctico N 5: Aminoácidos y Proteínas. Carreras: Zootecnia y Medicina Veterinaria
 bjetivo del Trabajo Práctico: ÁTEDRA DE QUÍMA RGÁNA- 2012 Trabajo Práctico N 5: Aminoácidos y Proteínas arreras: Zootecnia y Medicina Veterinaria ) Realizar reacciones de caracterización de proteínas:
bjetivo del Trabajo Práctico: ÁTEDRA DE QUÍMA RGÁNA- 2012 Trabajo Práctico N 5: Aminoácidos y Proteínas arreras: Zootecnia y Medicina Veterinaria ) Realizar reacciones de caracterización de proteínas:
Proteínas y su Papel Biológico
 Proteínas Proteínas y su Papel Biológico Las proteínas son macromoléculas de gran diversidad de formas y versatilidad de funciones. Pueden servir como componentes estructurales de células y tejidos (pelo,
Proteínas Proteínas y su Papel Biológico Las proteínas son macromoléculas de gran diversidad de formas y versatilidad de funciones. Pueden servir como componentes estructurales de células y tejidos (pelo,
TEMA 5. LAS PROTEÍNAS.
 TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
TEMA IV: PROTEÍNAS. ENZIMAS Y VITAMINAS
 TEMA IV: PROTEÍNAS. ENZIMAS Y VITAMINAS Proteínas. Los aminoácidos. Los péptidos Niveles de organización estructural de las proteínas Propiedades de las proteínas Clasificación Funciones de las proteínas
TEMA IV: PROTEÍNAS. ENZIMAS Y VITAMINAS Proteínas. Los aminoácidos. Los péptidos Niveles de organización estructural de las proteínas Propiedades de las proteínas Clasificación Funciones de las proteínas
Tema 3C. Estructura primaria de las proteínas
 Tema 3C. Estructura primaria de las proteínas Estructura primaria. Información a partir de la secuencia de aminoácidos. Determinación de la secuencia de aminoácidos de una proteína: secuenciación. Estructura
Tema 3C. Estructura primaria de las proteínas Estructura primaria. Información a partir de la secuencia de aminoácidos. Determinación de la secuencia de aminoácidos de una proteína: secuenciación. Estructura
Compuestos orgánicos II Lípidos y Proteínas
 Compuestos orgánicos II Lípidos y Proteínas Sesión 7 Introducción a la Biología Dr. Nelson A. Lagos Los Lípidos (grasas, triglicéridos) Una molécula de grasa esta formada por: 1) Carbono (C),hidrógeno
Compuestos orgánicos II Lípidos y Proteínas Sesión 7 Introducción a la Biología Dr. Nelson A. Lagos Los Lípidos (grasas, triglicéridos) Una molécula de grasa esta formada por: 1) Carbono (C),hidrógeno
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería.
 Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA PROTEÍNAS.- FUNCIONES BIOLÓGICAS a) Enzimas.- Actividad catalítica b) Hormonas c) Anticuerpos d) Receptores en membranas Reconocimiento
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA PROTEÍNAS.- FUNCIONES BIOLÓGICAS a) Enzimas.- Actividad catalítica b) Hormonas c) Anticuerpos d) Receptores en membranas Reconocimiento
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA ESCUELA DE CIENCIAS BASICAS TECNOLOGIA E INGENIERIA
 ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA - ECBTI UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA ESCUELA DE CIENCIAS BASICAS TECNOLOGIA E INGENIERIA TEXTO OVA UNIDAD 1 201103 BIOQUÍMICA ALBERTO
ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA - ECBTI UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA ESCUELA DE CIENCIAS BASICAS TECNOLOGIA E INGENIERIA TEXTO OVA UNIDAD 1 201103 BIOQUÍMICA ALBERTO
Aminoácidos y péptidos
 Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
AMINOÁCIDOS. Funciones:
 AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
Proteínas y Enzimas. 1ª Parte: Proteínas. Tema 10 de Biología NS Diploma BI Curso 2011-2013. Proteínas y Enzimas 1/50
 Proteínas y Enzimas 1ª Parte: Proteínas Tema 10 de Biología NS Diploma BI Curso 2011-2013 Proteínas y Enzimas 1/50 Proteínas Grupo de moléculas orgánicas más abundantes de los seres vivos (50% del peso
Proteínas y Enzimas 1ª Parte: Proteínas Tema 10 de Biología NS Diploma BI Curso 2011-2013 Proteínas y Enzimas 1/50 Proteínas Grupo de moléculas orgánicas más abundantes de los seres vivos (50% del peso
LABORATORIO DE QUÍMICA ORGANICA 502502. GUÍA No 9: ENSAYOS PARA RECONOCIMIENTO DE AMINOACIDOS
 LABORATORIO DE QUÍMICA ORGANICA 502502 GUÍA No 9: ENSAYOS PARA RECONOCIMIENTO DE AMINOACIDOS I. EL PROBLEMA El carácter único de cada α aminoácido se debe a la estructura del grupo R. En los polipéptidos
LABORATORIO DE QUÍMICA ORGANICA 502502 GUÍA No 9: ENSAYOS PARA RECONOCIMIENTO DE AMINOACIDOS I. EL PROBLEMA El carácter único de cada α aminoácido se debe a la estructura del grupo R. En los polipéptidos
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
Tema 7.- Genética Molecular. Biología y Geología 4º ESO: Genética Molecular
 Tema 7.- Genética Molecular 1 El ADN, la molécula de la herencia El ADN (ácido desoxirribonucléico), es el portador de la información genética y es el responsable de las características biológicas de un
Tema 7.- Genética Molecular 1 El ADN, la molécula de la herencia El ADN (ácido desoxirribonucléico), es el portador de la información genética y es el responsable de las características biológicas de un
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupo: 07 Semestre: 17-I Este material es exclusivamente para uso educativo
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupo: 07 Semestre: 17-I Este material es exclusivamente para uso educativo
ESTRUCTURA DE PROTEÍNAS
 ESTRUCTURA DE PROTEÍNAS PROTEINAS Polipéptidos cuya secuencia aminoacídica está determinada genéticamente. Poseen entre 50 y mas de 20,000 residuos aa. (PM entre 5,500 y 220,000). Macromoléculas mas versátiles
ESTRUCTURA DE PROTEÍNAS PROTEINAS Polipéptidos cuya secuencia aminoacídica está determinada genéticamente. Poseen entre 50 y mas de 20,000 residuos aa. (PM entre 5,500 y 220,000). Macromoléculas mas versátiles
Capítulo- 14 ácidos carboxílicos, esteres, aminas y amidas 14.4 Aminas
 Capítulo- 14 ácidos carboxílicos, esteres, aminas y amidas 1 14.4 Aminas Aminas 2 Aminas Son compuestos derivados orgánicos del amoniaco, NH 3 contiene un atomo de N unido a uno o más grupos alquilo o
Capítulo- 14 ácidos carboxílicos, esteres, aminas y amidas 1 14.4 Aminas Aminas 2 Aminas Son compuestos derivados orgánicos del amoniaco, NH 3 contiene un atomo de N unido a uno o más grupos alquilo o
Acidos nucleícos. Kinesiologia. Professor: Verónica Pantoja. Lic. MSP.
 Acidos nucleícos Professor: Verónica Pantoja. Lic. MSP. Kinesiologia Objetivo: Identificar los ácidos nucleicos como biomolecula y reconocer su importancia biológica. Descubrimiento El descubrimiento de
Acidos nucleícos Professor: Verónica Pantoja. Lic. MSP. Kinesiologia Objetivo: Identificar los ácidos nucleicos como biomolecula y reconocer su importancia biológica. Descubrimiento El descubrimiento de
QUÍMICA DEL CARBONO Principales Tipos de Reacciones Orgánicas
 1/5 DEL ARBN Para realizar un estudio completo de los compuestos de carbono, es necesario también conocer las propiedades químicas de los mismos, es decir, su reactividad. Una parte muy importante de la
1/5 DEL ARBN Para realizar un estudio completo de los compuestos de carbono, es necesario también conocer las propiedades químicas de los mismos, es decir, su reactividad. Una parte muy importante de la
PROTEINAS AMINOÁCIDOS FUNCIONES DE LOS AMINOÁCIDOS
 PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
Biotecnología de células procarióticas. Profesor: Javier Cabello Schomburg, MS
 Biotecnología de células procarióticas Profesor: Javier Cabello Schomburg, MS Reflexión Cuando amamos una persona conocemos sus defectos, igual o mejor que los nuestros, y la amamos con ellos. Si yo quiero
Biotecnología de células procarióticas Profesor: Javier Cabello Schomburg, MS Reflexión Cuando amamos una persona conocemos sus defectos, igual o mejor que los nuestros, y la amamos con ellos. Si yo quiero
Fuerzas Intermoleculares
 Fuerzas Intermoleculares Mapa conceptual Primer video http://www.youtube.com/watch?v=flxa79uiu5g Que son las fuerzas intermoleculares? Las fuerzas intermoleculares se definen como el conjunto de fuerzas
Fuerzas Intermoleculares Mapa conceptual Primer video http://www.youtube.com/watch?v=flxa79uiu5g Que son las fuerzas intermoleculares? Las fuerzas intermoleculares se definen como el conjunto de fuerzas
AMINOACIDOS. Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 12/04/2012
 AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
1. Cómo prepararías los siguientes aminoácidos empleando la síntesis de Strecker? a) Glicina, b) Valina, c) Leucina.
 1521 Química rgánica III TAEA 2 1. Cómo prepararías los siguientes aminoácidos empleando la síntesis de Strecker? a) Glicina, b) Valina, c) Leucina. 2. Cómo prepararías los siguientes aminoácidos empleando
1521 Química rgánica III TAEA 2 1. Cómo prepararías los siguientes aminoácidos empleando la síntesis de Strecker? a) Glicina, b) Valina, c) Leucina. 2. Cómo prepararías los siguientes aminoácidos empleando
Definición Bronsted-Lowry
 TEMA 4.- Acidos y bases. Propiedades ácido-base de los compuestos orgánicos. Grupos funcionales con carácter ácido. Grupos funcionales con carácter básico. Fuerza de los ácidos. Fuerza de las bases. Acidez
TEMA 4.- Acidos y bases. Propiedades ácido-base de los compuestos orgánicos. Grupos funcionales con carácter ácido. Grupos funcionales con carácter básico. Fuerza de los ácidos. Fuerza de las bases. Acidez
Metabolismo. Biología y Vida
 Metabolismo Biología y Vida Las principales moléculas biológicas Ácidos nucleicos (ADN, ARN, material genético de las células Proteínas (queratina, hemoglobina, enzimas) Carbohidratos o azúcares (glucosa,
Metabolismo Biología y Vida Las principales moléculas biológicas Ácidos nucleicos (ADN, ARN, material genético de las células Proteínas (queratina, hemoglobina, enzimas) Carbohidratos o azúcares (glucosa,
Aminoácidos. Enlace peptídico. Los aminoácidos se unen uno a continuación de otro formando una cadena, mediante un enlace característico llamado...
 Aminoácidos Enlace peptídico Los aminoácidos se unen uno a continuación de otro formando una cadena, mediante un enlace característico llamado... ENLACE PEPTÍDICO Aminoácidos Enlace peptídico H R2 NH 3
Aminoácidos Enlace peptídico Los aminoácidos se unen uno a continuación de otro formando una cadena, mediante un enlace característico llamado... ENLACE PEPTÍDICO Aminoácidos Enlace peptídico H R2 NH 3
CÁTEDRA DE QUÍMICA II BIOINGENIERÍA
 Departamento de Electrónica y Automática Facultad de Ingeniería CÁTEDRA DE QUÍMICA II BIOINGENIERÍA GUÍA DE TRABAJOS PRÁCTICOS DE LABORAORIO Nº 3 LIPIDOS Apellido y Nombre Registro SOLUBILIDAD DE LAS GRASAS
Departamento de Electrónica y Automática Facultad de Ingeniería CÁTEDRA DE QUÍMICA II BIOINGENIERÍA GUÍA DE TRABAJOS PRÁCTICOS DE LABORAORIO Nº 3 LIPIDOS Apellido y Nombre Registro SOLUBILIDAD DE LAS GRASAS
Repaso Química: Compuestos
 Repaso Química: Compuestos Covalentes, formación, fórmulas I. Selección Múltiple. Escoge la mejor contestación para cada aseveración. 1 1. Los elementos en un compuesto covalente A. donan electrones. B.
Repaso Química: Compuestos Covalentes, formación, fórmulas I. Selección Múltiple. Escoge la mejor contestación para cada aseveración. 1 1. Los elementos en un compuesto covalente A. donan electrones. B.
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
El agua. El agua es extraordinariamente abundante en la tierra y es indispensable para la vida.
 Sumario Las moléculas de los seres vivos: 1. El agua 2. El papel central del carbono 3. Moléculas orgánicas. Control de la actividad celular Fuente de energía para las células Proceso de fotosíntesis El
Sumario Las moléculas de los seres vivos: 1. El agua 2. El papel central del carbono 3. Moléculas orgánicas. Control de la actividad celular Fuente de energía para las células Proceso de fotosíntesis El
Proteínas y Ácidos Nucleicos
 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
PROTEÍNAS Y AMINOÁCIDOS
 PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
Clasificación de las proteinas según su conformación
 lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
Revisión de opción múltiple- Genes
 Revisión de opción múltiple- Genes 1. Los nucleótidos del ácido desoxirribonucleico están compuestos de: a. Azúcar ribosa, un grupo fosfato y uno de cuatro bases (adenina, citosina, timina y guanina) b.
Revisión de opción múltiple- Genes 1. Los nucleótidos del ácido desoxirribonucleico están compuestos de: a. Azúcar ribosa, un grupo fosfato y uno de cuatro bases (adenina, citosina, timina y guanina) b.
BIOQUÍMICA ESTRUCTURAL Y BIOLÓGICA José Carlos Rodríguez Rey, Javier León Serrano, Mª Dolores Delgado Villar y Jesús Navas Méndez
 PRÁCTICA 1 ESTRUCTURA Y PROPIEDADES ÁCIDO-BASE DE LOS AMINOÁCIDOS Objetivos - Aprender a medir el ph de una disolución. - Preparación de tampones. Cálculo teórico y preparación práctica. - Conocer la estructura
PRÁCTICA 1 ESTRUCTURA Y PROPIEDADES ÁCIDO-BASE DE LOS AMINOÁCIDOS Objetivos - Aprender a medir el ph de una disolución. - Preparación de tampones. Cálculo teórico y preparación práctica. - Conocer la estructura
ESTRUCTURA DE LAS PROTEÍNAS. La conformación de las proteínas viene definida por cuatro estructuras: Enlaces sencillos de rotación libre
 ESTRUCTURA DE LAS PROTEÍNAS La existencia de enlaces en la cadena polipeptídica que permiten la libre rotación de sus átomos, posibilita que (en teoría ) cualquier proteína puede adoptar un elevado número
ESTRUCTURA DE LAS PROTEÍNAS La existencia de enlaces en la cadena polipeptídica que permiten la libre rotación de sus átomos, posibilita que (en teoría ) cualquier proteína puede adoptar un elevado número
AMINOÁCIDOS, PÉPTIDOS & PROTEÍNAS
 APUNTES DE BIOQUÍMICA 2 AMINOÁCIDOS, PÉPTIDOS & PROTEÍNAS Julián A. Chamucero Millares 1 1 L as proteínas son polímeros de aminoácidos; es decir, son macromoléculas que se forman por la unión de moléculas
APUNTES DE BIOQUÍMICA 2 AMINOÁCIDOS, PÉPTIDOS & PROTEÍNAS Julián A. Chamucero Millares 1 1 L as proteínas son polímeros de aminoácidos; es decir, son macromoléculas que se forman por la unión de moléculas
ACIDOS CARBOXILICOS Y DERIVADOS
 TEMA 20.- Acidos carboxílicos, derivados de ácido y nitrilos. Naturaleza del grupo carboxilo. Clasificación y propiedades generales. Carácter ácido. Reacciones de sustitución nucleofílica. Reacciones de
TEMA 20.- Acidos carboxílicos, derivados de ácido y nitrilos. Naturaleza del grupo carboxilo. Clasificación y propiedades generales. Carácter ácido. Reacciones de sustitución nucleofílica. Reacciones de
Atraviesan completamente la membrana. Insertadas en la membrana, pero no la atraviesan del todo
 Estructura de membranas II. Proteínas de membrana Javier Corzo Periféricas Se pueden separar sin alterar la estructura de la membrana Dominio transmembrana formado por hélices alfa Atraviesan completamente
Estructura de membranas II. Proteínas de membrana Javier Corzo Periféricas Se pueden separar sin alterar la estructura de la membrana Dominio transmembrana formado por hélices alfa Atraviesan completamente
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS PRUEBA ESPECÍFICA QUÍMICA
 PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
AMINOÁCIDOS Y PROTEÍNAS
 4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
Tecnologías basadas en las proteínas. Nociones básicas sobre las proteínas
 Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Análisis de proteínas
 Análisis de proteínas Qué determina su estructura? Composición de las proteínas Las proteínas son polímeros de aminoácidos que se unen mediante una unión peptídica Todos los aminoácidos tienen un grupo
Análisis de proteínas Qué determina su estructura? Composición de las proteínas Las proteínas son polímeros de aminoácidos que se unen mediante una unión peptídica Todos los aminoácidos tienen un grupo
La velocidad de una reacción describe qué tan rápido se consumen los reactivos y se forman los productos. CH 4. (g) + 2 O 2.
 Cinética Química 1. Velocidad de reacción. 2. Factores que afectan la velocidad de reacción. 3. Expresión de la ley de velocidad. 4. Teoría de las colisiones moleculares 5. Estado de transición. 6. Catalizadores.
Cinética Química 1. Velocidad de reacción. 2. Factores que afectan la velocidad de reacción. 3. Expresión de la ley de velocidad. 4. Teoría de las colisiones moleculares 5. Estado de transición. 6. Catalizadores.
TEMA 1. QUÍMICA ORGÁNICA.
 TEMA 1. QUÍMICA ORGÁNICA. I. TIPOS DE REACTIVOS ORGÁNICOS: En las reacciones químicas se distingue entre dos tipos de reactivos: I.1. Sustrato. Es la molécula reaccionante más grande. En el transcurso
TEMA 1. QUÍMICA ORGÁNICA. I. TIPOS DE REACTIVOS ORGÁNICOS: En las reacciones químicas se distingue entre dos tipos de reactivos: I.1. Sustrato. Es la molécula reaccionante más grande. En el transcurso
Aminoácidos, péptidos y proteinas
 Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
puentes de hidrogeno enlaces covalentes Interacciones no-covalentes PUENTE DE HIDROGENO fuerte puente de hidrogeno menos fuerte puente de hidrogeno
 PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
Los aldehídos y cetonas son compuestos que contienen el grupo carbonilo
 cmapspublic.ihmc.us Los aldehídos y cetonas son compuestos que contienen el grupo carbonilo Los aldehídos y cetonas se diferencian entre sí porque en los aldehídos, el grupo carbonilo va unido a un átomo
cmapspublic.ihmc.us Los aldehídos y cetonas son compuestos que contienen el grupo carbonilo Los aldehídos y cetonas se diferencian entre sí porque en los aldehídos, el grupo carbonilo va unido a un átomo
AMINOACIDOS. Figura 1. L-alanina y D-alanina
 AMINOACIDOS ESTEREOQUIMICA Debido a que los carbones α de 19 de los 20 aminoácidos estándar están unidos a cuatro grupos diferentes, se les denominan carbones asimétricos o quirales. La glicina es una
AMINOACIDOS ESTEREOQUIMICA Debido a que los carbones α de 19 de los 20 aminoácidos estándar están unidos a cuatro grupos diferentes, se les denominan carbones asimétricos o quirales. La glicina es una
Traducción en Procariotas. en los procariotas la traducción se produce junto con la transcripción
 Traducción Traducción en Procariotas en los procariotas la traducción se produce junto con la transcripción Traducción en Eucariotas en los eucariotas la traducción se produce en el citoplasma Iniciación
Traducción Traducción en Procariotas en los procariotas la traducción se produce junto con la transcripción Traducción en Eucariotas en los eucariotas la traducción se produce en el citoplasma Iniciación
METABOLISMO DE LIPIDOS
 METABOLISMO DE LIPIDOS LIPIDOS Extenso grupo de biomoléculas químicamente distintas. Su característica principal es su insolubilidad en agua y solubilidad en solventes orgánicos (Apolares e hidrofóbicos).
METABOLISMO DE LIPIDOS LIPIDOS Extenso grupo de biomoléculas químicamente distintas. Su característica principal es su insolubilidad en agua y solubilidad en solventes orgánicos (Apolares e hidrofóbicos).
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS.
 Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS. 1. Formular los siguientes aminoácidos: alanina, fenilalanina, lisina, histidina, isoleucina, treonina. Indicar para cada
Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS. 1. Formular los siguientes aminoácidos: alanina, fenilalanina, lisina, histidina, isoleucina, treonina. Indicar para cada
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
Las reacciones químicas
 Las reacciones químicas La materia se caracteriza porque puede transformarse y experimentar cambios estructurales. Estos cambios, muy frecuentes y constantes en la naturaleza, pueden ir desde una alteración
Las reacciones químicas La materia se caracteriza porque puede transformarse y experimentar cambios estructurales. Estos cambios, muy frecuentes y constantes en la naturaleza, pueden ir desde una alteración
Ácidos nucleicos. 3ª y 4ª Parte: Transcripción y traducción I & II. Tema 12 de Biología NS Diploma BI Curso 2012-2014
 Ácidos nucleicos 3ª y 4ª Parte: Transcripción y traducción I & II Tema 12 de Biología NS Diploma BI Curso 2012-2014 Expresión de la información genética Ya se ha visto cómo la información genética se conserva
Ácidos nucleicos 3ª y 4ª Parte: Transcripción y traducción I & II Tema 12 de Biología NS Diploma BI Curso 2012-2014 Expresión de la información genética Ya se ha visto cómo la información genética se conserva
El enlace iónico. Los cationes y los aniones están unidos por la fuerza electroestática.
 El enlace iónico Los elementos con bajas energías de ionización tienden a formar cationes, en cambio los elementos con alta afinidad electrónicas tienden a formar aniones. Los metales alcalinos (IA) y
El enlace iónico Los elementos con bajas energías de ionización tienden a formar cationes, en cambio los elementos con alta afinidad electrónicas tienden a formar aniones. Los metales alcalinos (IA) y
Determinación de proteínas
 Determinación de proteínas Curso EMA 2013 Ing. Agr. Marta del Puerto Métodos para determinar proteínas Se basan en: a. Propiedad de las proteínas de absorber luz en el UV absorción A=280nm a. Capacidad
Determinación de proteínas Curso EMA 2013 Ing. Agr. Marta del Puerto Métodos para determinar proteínas Se basan en: a. Propiedad de las proteínas de absorber luz en el UV absorción A=280nm a. Capacidad
Tema 1: Breve Lección de biología (2)
 Tema 1: Breve Lección de biología (2) Genes y Proteínas Dr. Oswaldo Trelles Universidad de Málaga La función primordial de los genes es proporcionar la información necesaria para la síntesis de proteínas.
Tema 1: Breve Lección de biología (2) Genes y Proteínas Dr. Oswaldo Trelles Universidad de Málaga La función primordial de los genes es proporcionar la información necesaria para la síntesis de proteínas.
L/O/G/O BIOQUÍMICA II
 L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
Tema 7. Cinética Enzimática
 Tema 7 Cinética Enzimática 1 TEMA 7 CINÉTICA ENZIMÁTICA 1. DEFINICIONES CÓMO ACTÚAN LOS ENZIMAS? 2. CINÉTICA ENZIMÁTICA MODELO DE MICHAELIS-MENTEN REPRESENTACIONES 3. INHIBICIONES EN REACCIONES ENZIMÁTICAS
Tema 7 Cinética Enzimática 1 TEMA 7 CINÉTICA ENZIMÁTICA 1. DEFINICIONES CÓMO ACTÚAN LOS ENZIMAS? 2. CINÉTICA ENZIMÁTICA MODELO DE MICHAELIS-MENTEN REPRESENTACIONES 3. INHIBICIONES EN REACCIONES ENZIMÁTICAS
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas IDENTIFICACION CUALITATIVA DE COMPUESTOS ORGANICOS
 UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas IDENTIFICACION CUALITATIVA DE COMPUESTOS ORGANICOS Experimento No. 1 QUIM 2222 A. Introducción El químico
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas IDENTIFICACION CUALITATIVA DE COMPUESTOS ORGANICOS Experimento No. 1 QUIM 2222 A. Introducción El químico
Problema 1.- Escriba la estructura de la (L)-leucina: a) A ph bajo. b) En el ph isoeléctrico. c) A ph alto. Solución: Zwitterión CH 3 H 3 C H O H 3 N
 Problema 1.- Escriba la estructura de la (L)-leucina: a) A ph bajo. b) En el ph isoeléctrico. c) A ph alto. CH 3 CH 3 CH 3 H 3 C H 3 N H H 3 C H 3 N H 3 C H 2 N ph bajo ph = 6 ph alto Zwitterión Problema
Problema 1.- Escriba la estructura de la (L)-leucina: a) A ph bajo. b) En el ph isoeléctrico. c) A ph alto. CH 3 CH 3 CH 3 H 3 C H 3 N H H 3 C H 3 N H 3 C H 2 N ph bajo ph = 6 ph alto Zwitterión Problema
PROTEINAS AMINOACIDOS
 PROTEINAS AMINOACIDOS 1 2 PROTEINAS Las proteínas son las moléculas constituyentes de los seres vivos que, además de ocupar el 50% del peso seco de los tejidos, tienen la máxima importancia por las funciones
PROTEINAS AMINOACIDOS 1 2 PROTEINAS Las proteínas son las moléculas constituyentes de los seres vivos que, además de ocupar el 50% del peso seco de los tejidos, tienen la máxima importancia por las funciones
FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUIMICA BIORGÁNICA
 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUIMICA BIORGÁNICA PRÁCTICA 6: PRUEBAS GENERALES PARA LÍPIDOS 1. INTRODUCCION Los lípidos son compuestos insolubles en el agua pero
FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUIMICA BIORGÁNICA PRÁCTICA 6: PRUEBAS GENERALES PARA LÍPIDOS 1. INTRODUCCION Los lípidos son compuestos insolubles en el agua pero
Cinética química. Cinética Química Química 2º. Velocidad de reacción
 Cinética química Velocidad de reacción La velocidad de una reacción es la derivada de la concentración de un reactivo o producto con respecto al tiempo tomada siempre como valor positivo. Expresión de
Cinética química Velocidad de reacción La velocidad de una reacción es la derivada de la concentración de un reactivo o producto con respecto al tiempo tomada siempre como valor positivo. Expresión de
CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS.
 MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
Introducción a la Química Orgánica 28/06/2012
 Qro. 1 Presentación Instructor, guía, facilitador: M. En C. Ma. Consuelo Arellano (cvalenzu@itesm.mx) o M. en C. Araceli Florido Segoviano (aflorido@itesm.mx) Qro. 2 Vamos a integrar equipos de 2-3 personas
Qro. 1 Presentación Instructor, guía, facilitador: M. En C. Ma. Consuelo Arellano (cvalenzu@itesm.mx) o M. en C. Araceli Florido Segoviano (aflorido@itesm.mx) Qro. 2 Vamos a integrar equipos de 2-3 personas
Area Química Biológica Curso: Bioquímica. Tema 6: PROTEINAS. Dra. Silvia M. Varas
 Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
FUERZAS INTERMOLECULARES
 DEPARTAMENTO DE CIENCIAS QUÍMICA - IB FUERZAS INTERMOLECULARES Existen fuerzas de atracción entre las moléculas (fuerzas intermoleculares). Ellas son las responsables de que los gases condensen (pasar
DEPARTAMENTO DE CIENCIAS QUÍMICA - IB FUERZAS INTERMOLECULARES Existen fuerzas de atracción entre las moléculas (fuerzas intermoleculares). Ellas son las responsables de que los gases condensen (pasar
Estructura tridimensional de las proteínas
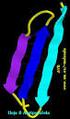 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Trabajo Práctico de Laboratorio 5
 Trabajo Práctico de Laboratorio 5 Tema: Aminoácidos y proteínas Fundamentación teórica AMIÁCIDS Propiedades químicas Los aminoácidos poseen en su estructura un grupo ácido y un grupo básico, por lo cual
Trabajo Práctico de Laboratorio 5 Tema: Aminoácidos y proteínas Fundamentación teórica AMIÁCIDS Propiedades químicas Los aminoácidos poseen en su estructura un grupo ácido y un grupo básico, por lo cual
Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las siguientes preguntas.
 DRAFT EXPERIMENTO 1 Propiedades de los Compuestos Orgánicos Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el
DRAFT EXPERIMENTO 1 Propiedades de los Compuestos Orgánicos Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el
