Práctica No. 3 SISTEMAS DISPERSOS NOMBRE DEL ALUMNO: PROFESOR: GRUPO:
|
|
|
- Miguel Ángel Juárez Olivera
- hace 7 años
- Vistas:
Transcripción
1 SISTEMAS DISPERSOS NOMBRE DEL ALUMNO: PROFESOR: GRUPO: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeño y habilidades: 1. Fundamenta opiniones sobre los impactos de la ciencia y la tecnología en su vida cotidiana, asumiendo consideraciones éticas. (2) 2. Contrasta los resultados obtenidos en una investigación o experimento con hipótesis previas y comunica sus conclusiones. (5) 3. Explicita las nociones científicas que sustentan los procesos para la solución de problemas cotidianos. (7) 4. Identifica problemas, formula preguntas de carácter científico y plantea las hipótesis necesarias para responderlas. (3) 5. Obtiene, registra y sistematiza la información para responder a preguntas de carácter científico, consultando fuentes relevantes y realizando experimentos pertinentes. (4) 6. Contrasta los resultados obtenidos en una investigación o experimento con hipótesis previas y comunica sus conclusiones. (5) 7. Aplica normas de seguridad en el manejo de sustancias, instrumentos y equipo en la realización de actividades de su vida cotidiana. (14) 8. Identifica las características distintivas de los sistemas dispersos (disoluciones, coloides y suspensiones). 9. Comprende la utilidad de los sistemas dispersos en los sistemas biológicos y en su entorno. 4. Marco Teórico: Cuando una sustancia finamente dividida está distribuida como partículas indivisibles en el seno de otra, forma lo que se llama una dispersión. Si colocamos por separado trozos de diferentes sustancias sólidas en contacto con una cantidad relativamente grande de agua, se observa que algunas permanecen prácticamente intactas, mientras que otras desaparecen. En el primer caso hablamos de sustancias insolubles en agua y en el segundo de sustancias solubles en agua. Página 18
2 Esto se puede visualizar con el siguiente ejemplo: si tenemos en principio un sistema heterogéneo formado por agua y una pequeña cantidad de sustancia sólida, CuSO4, de color azul celeste, se observa que poco a poco la sustancia sólida desaparece, el color se va difundiendo en todo el líquido hasta hacerse uniforme. Nuestro sistema se hizo homogéneo sin intervención de fuerzas externas. Este fenómeno se llama difusión y permite lograr una dispersión. Podemos definir una dispersión como la difusión de una sustancia en el seno de otra. En las dispersiones aparecen dos componentes perfectamente diferenciados: a) fase dispersa b) fase dispersante. La fase dispersa la constituyen las partículas de una sustancia que por la fuerza de difusión se introducen en el seno de la otra, que es la fase dispersante. El tamaño de las partículas de la fase dispersa puede variar desde el nivel molecular hasta conglomerados visibles a simple vista. Las propiedades de las dispersiones varían de acuerdo al tamaño de las partículas. Desde este punto de vista las dispersiones se pueden clasificar en: Soluciones Verdaderas Son sistemas homogéneos formados por 2 o más componentes, donde la cantidad del o los componentes dispersos puede variar entre ciertos límites en forma continua. Poseen las siguientes propiedades: ausencia de sedimentación o separación y homogeneidad. La fase dispersa toma el nombre de soluto y sus partículas no pueden observarse a simple vista, al microscopio ni al ultramicroscopio. El soluto no puede separarse por filtración, solamente por destilación o cristalización. Página 19
3 En la fase dispersa puede haber más de un soluto. La fase dispersante se llama disolvente o solvente. Dispersiones Coloidales o coloides Las partículas de la fase dispersa son muy pequeñas, no son retenidas por los filtros corrientes, no sedimentan aún al cabo de un prolongado reposo y resultan invisibles al microscopio, pero se ven al ultramicroscopio. Las dispersiones coloidales son transparentes como las soluciones verdaderas, pero a diferencia de ellas no son ópticamente vacías. Si se hace incidir un rayo de luz sobre una dispersión coloidal, éste es reflejado y refractado por las partículas coloidales, lo que permite observar la trayectoria del haz de luz. Este fenómeno se denomina efecto Tyndall. Son ejemplos de dispersiones coloidales la gelatina, cloruro férrico en agua, etc.. Efecto Tyndall Página 20
4 Dispersiones finas: Suspensiones y emulsiones Debido a su mayor tamaño, las partículas de la fase dispersa se hallan simplemente en suspensión en el líquido que es la fase dispersante y acaban por sedimentar luego de cierto reposo. Por ejemplo: arena agitada con agua; harina en agua (sedimenta más lentamente). Por filtración las partículas dispersas se separan fácilmente y generalmente son visibles a simple vista. Cuando las dispersiones finas se hallan formadas por dos líquidos toman el nombre de emulsiones, por ejemplo aceite y agua: agitando adquiere aspecto blanquecino lechoso porque las partículas líquidas de la fase dispersa reflejan la luz. Si a las emulsiones se las deja en reposo un tiempo prolongado, se separan los componentes de acuerdo a sus densidades. Las propiedades de las dispersiones dependen del tamaño de las partículas de la fase dispersa Cuestionario. 1. Qué es una mezcla? 2. De acuerdo a sus propiedades cómo se clasifican las mezclas? 3. Menciona tres características de una suspensión Página 21
5 4. La floculación es una propiedad de las mezclas, A cuál de los tres tipos corresponde? 5. Con qué otro nombre se conoce a las disoluciones? 6. Qué es el efecto Tyndall? 5. Procedimiento. Material y equipo. CANTIDAD MATERIAL CANTIDAD SUSTANCIA 1 Mortero con pistilo 1ltro Agua Destilada 2 *Servilletas de papel 2g *Esencia de menta 1 Embudo chico de plástico o 1 *Cucharada de detergente vidrio líquido o en polvo 4 Vasos precipitados 300ml 1 *Cucharada de sal 1 *Linterna de haz fino y potente 9g *Talco sin perfume 1 *Caja de cartón de fondo negro 4 *Tabletas antiácidas donde quepan los 3 vasos 3 *Cucharas 200 ml Agua 1 *Cepillo Dental 100g Carbonato de Calcio(CaCO3) 1 Alcohol etílico 70ml Glicerina 1 *Frasco *Material proporcionado por el alumno EXPERIMENTO 1 Demostrar la diferencia entre una disolución y un coloide por medio del efecto Tyndall Página 22
6 Instrucciones: 1. Vierte en un vaso agua destilada, en otro prepara una mezcla de agua destilada con detergente y en el tercero, mezcla agua destilada con la sal. Agita con una cuchara diferente el contenido de cada uno de los vasos 2. Coloca los vasos dentro de la caja de cartón e ilumínalos lateralmente. Escribe tus observaciones y Realiza tus dibujos. Agua destilada Agua destilada Agua destilada + + Detergente sal Responde a las siguientes preguntas: 1. Cuál mezcla es una disolución? 2. Cuál es un coloide? 3. Por qué puedes distinguir una disolución de un coloide? Página 23
7 EXPERIMENTO 2 Demostrar las propiedades de una suspensión 1. Tritura las tabletas en el mortero hasta convertirlas en un polvo fino 2. Vierte el polvo en medio vaso de agua. Agita muy bien 3. Espera de 15 a 20 minutos. Escribe tus observaciones y Realiza tus dibujos. Contesta las siguientes preguntas: 1. Cómo se ve la mezcla después de agitarla? 2. Qué tipo de mezcla formaste? Página 24
8 3. Se puede filtrar? 4. Dobla la servilleta de papel hasta formar un cono, colócala en el embudo y comprueba si se pueden separar por filtración los componentes de la mezcla. Explica qué ocurre EXPERIMENTO 3 Elaboración de un coloide de uso común Elaboración de una pasta de dientes 1. Mezcla todos los ingredientes(carbonato de calcio, esencia de menta, talco sin perfume, agua destilada, alcohol y glicerina al final para dar consistencia) en el mortero y muélelos hasta obtener una pasta homogénea. Llena el frasco con la pasta. 2. Coloca un poco de pasta sobre tu cepillo de dientes y prueba la efectividad de ésta. 3. Describe el tipo de coloide que se formó y sus características. Señala en que se parece a las pastas comerciales y en qué se diferencia de ellas. Conclusiones: Escribe las diferencias que pudiste apreciar en los tres tipos de mezclas. Página 25
9 6. Resultados y Observaciones. 7. Conclusiones: Página 26
CONCENTRACIÓN DE LAS DISOLUCIONES
 CONCENTRACIÓN DE LAS DISOLUCIONES NOMBRE DEL ALUMNO: PROFESOR: GRUPO: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeño y habilidades: 4. Marco Teórico: 1. Obtiene, registra y sistematiza
CONCENTRACIÓN DE LAS DISOLUCIONES NOMBRE DEL ALUMNO: PROFESOR: GRUPO: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeño y habilidades: 4. Marco Teórico: 1. Obtiene, registra y sistematiza
NOMENCLATURA QUIMICA INORGÁNICA LAS CARACTERISTICAS DE DIVERSAS SUSTANCIAS
 NOMENCLATURA QUIMICA INORGÁNICA LAS CARACTERISTICAS DE DIVERSAS SUSTANCIAS Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades. 1. Identifica
NOMENCLATURA QUIMICA INORGÁNICA LAS CARACTERISTICAS DE DIVERSAS SUSTANCIAS Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades. 1. Identifica
MEZCLAS Y DISOLUCIONES
 Unidades Didácticas Adaptadas 1 MEZCLAS Y DISOLUCIONES Qué vamos a estudiar en este tema?. Aquí tienes el esquema. 1. Las sustancias puras y las mezclas. 2. Observamos las mezclas a nuestro alrededor!
Unidades Didácticas Adaptadas 1 MEZCLAS Y DISOLUCIONES Qué vamos a estudiar en este tema?. Aquí tienes el esquema. 1. Las sustancias puras y las mezclas. 2. Observamos las mezclas a nuestro alrededor!
CONOCIMIENTO E IDENTIFICACIÓN DEL MATERIAL Y EQUIPO DE LABORATORIO. Nombre del Alumno: Profesor: Grupo:
 CONOCIMIENTO E IDENTIFICACIÓN DEL MATERIAL Y EQUIPO DE LABORATORIO. Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades. 1.Obtiene, registra
CONOCIMIENTO E IDENTIFICACIÓN DEL MATERIAL Y EQUIPO DE LABORATORIO. Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades. 1.Obtiene, registra
SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación.
 PRÁCTICA Nº 2 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de una muestra problema. Realizar la destilación
PRÁCTICA Nº 2 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de una muestra problema. Realizar la destilación
Fecha 2.- Representaciones gráficas. Marco teórico. Objetivo. Material. Método. Experiencia 1
 Fecha 2.- Representaciones gráficas Marco teórico En el caso de la Física, la comprobación de las hipótesis se realiza generalmente de manera experimental, por medio de la elaboración de un diseño experimental
Fecha 2.- Representaciones gráficas Marco teórico En el caso de la Física, la comprobación de las hipótesis se realiza generalmente de manera experimental, por medio de la elaboración de un diseño experimental
TEMA 3. CLASIFICACIÓN DE LA MATERIA.
 TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3º ESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. - Elemento. Es una sustancia
TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3º ESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. - Elemento. Es una sustancia
ENLACES QUÍMICOS Y SUS PROPIEDADES. Nombre del Alumno: Profesor: Grupo:
 ENLACES QUÍMICOS Y SUS PROPIEDADES Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades. 1. Identifica problemas, formula preguntas de carácter
ENLACES QUÍMICOS Y SUS PROPIEDADES Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades. 1. Identifica problemas, formula preguntas de carácter
UNIDAD DIDÁCTICA: MEZCLAS Y DISOLUCIONES
 Unidades Didácticas Adaptadas: MEZCLAS Y DISOLUCIONES 1 UNIDAD DIDÁCTICA: MEZCLAS Y DISOLUCIONES Qué vamos a estudiar en este tema?. Aquí tienes el esquema. 1. Las sustancias puras y las mezclas. 2. Observamos
Unidades Didácticas Adaptadas: MEZCLAS Y DISOLUCIONES 1 UNIDAD DIDÁCTICA: MEZCLAS Y DISOLUCIONES Qué vamos a estudiar en este tema?. Aquí tienes el esquema. 1. Las sustancias puras y las mezclas. 2. Observamos
CURSO INTRODUCTORIO DE QUÍMICA
 CURSO INTRODUCTORIO DE QUÍMICA UNIDAD II. S MATERIALES INTRODUCCIÓN Se llama sistema material a una porción limitada de materia, dentro del universo, que se separa real o imaginariamente, para su estudio.
CURSO INTRODUCTORIO DE QUÍMICA UNIDAD II. S MATERIALES INTRODUCCIÓN Se llama sistema material a una porción limitada de materia, dentro del universo, que se separa real o imaginariamente, para su estudio.
PROPIEDADES DE LA MATERIA. Nombre del Alumno: Profesor: Grupo:
 PROPIEDADES DE LA MATERIA Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades. 1. Identifica problemas, formula preguntas de carácter científico
PROPIEDADES DE LA MATERIA Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades. 1. Identifica problemas, formula preguntas de carácter científico
FÍSICA Y QUÍMICA 3ºESO
 TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3ºESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. Por ejemplo siempre tienen
TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3ºESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. Por ejemplo siempre tienen
MEZCLAS Y METODOS http://biologiaudes.wordpress.com/periodo-4/mezclas-y-metodos-deseparacion/de SEPARACION
 MEZCLAS Y METODOS http://biologiaudes.wordpress.com/periodo-4/mezclas-y-metodos-deseparacion/de SEPARACION Las Mezclas Son materiales que contienen dos o más sustancias simple, que pueden ser separadas
MEZCLAS Y METODOS http://biologiaudes.wordpress.com/periodo-4/mezclas-y-metodos-deseparacion/de SEPARACION Las Mezclas Son materiales que contienen dos o más sustancias simple, que pueden ser separadas
CÓMO SE SEPARAN LOS COMPONENTES DE UNA MEZCLA? 2. TÉCNICAS DE SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA.
 1. INTRODUCCIÓN. CÓMO SE SEPARAN LOS COMPONENTES DE UNA MEZCLA? Cuando una sustancia cualquiera contiene a otra distribuida en su seno como partículas muy pequeñas, se habla de un sistema disperso o de
1. INTRODUCCIÓN. CÓMO SE SEPARAN LOS COMPONENTES DE UNA MEZCLA? Cuando una sustancia cualquiera contiene a otra distribuida en su seno como partículas muy pequeñas, se habla de un sistema disperso o de
COLEGIO DE BACHILLERES PLANTEL 5 SATÉLITE PRÁCTICAS DE LABORATORIO QUÍMICA I SEGUNDO SEMESTRE
 COLEGIO DE BACHILLERES PLANTEL 5 SATÉLITE PRÁCTICAS DE LABORATORIO QUÍMICA I PRACTICA # 1 MATERIA, ENERGIA Y CAMBIOS OBJETIVO DE LA PRACTICA: Identificar el objeto del estudio de la química, mediante experimentos
COLEGIO DE BACHILLERES PLANTEL 5 SATÉLITE PRÁCTICAS DE LABORATORIO QUÍMICA I PRACTICA # 1 MATERIA, ENERGIA Y CAMBIOS OBJETIVO DE LA PRACTICA: Identificar el objeto del estudio de la química, mediante experimentos
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez DEYMER GÓMEZ CORREA:
 UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez Práctica: SOLUCIONES 1 Fecha: 9/Marzo/2010 DEYMER GÓMEZ CORREA: 1 042 091 432 OBJETIVOS
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez Práctica: SOLUCIONES 1 Fecha: 9/Marzo/2010 DEYMER GÓMEZ CORREA: 1 042 091 432 OBJETIVOS
DISOLUCIONES QUÍMICAS
 DISOLUCIONES QUÍMICAS Las disoluciones son mezclas homogéneas de dos o más sustancias, es decir, cuyos componentes no se pueden distinguir a simple vista. Siempre que se esta en presencia de una mezcla
DISOLUCIONES QUÍMICAS Las disoluciones son mezclas homogéneas de dos o más sustancias, es decir, cuyos componentes no se pueden distinguir a simple vista. Siempre que se esta en presencia de una mezcla
1. MATERIA Y SU ASPECTO
 1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
Experimental Intercolegial. Mezclas
 Prueba experimental intercolegial 25 de junio de 2010 Experimental Intercolegial Mezclas Introducción En nuestra vida, diariamente tenemos contacto con algún tipo de mezcla, como por ejemplo, el aire que
Prueba experimental intercolegial 25 de junio de 2010 Experimental Intercolegial Mezclas Introducción En nuestra vida, diariamente tenemos contacto con algún tipo de mezcla, como por ejemplo, el aire que
Solubilidad. Material de apoyo, Segundo Medio monica.ibanez@lbvm. onica.ibanez@lbvm.clcl 15:21
 Solubilidad Material de apoyo, Segundo Medio monica.ibanez@lbvm. onica.ibanez@lbvm.clcl Obj. de hoy: Señalar que es Solubilidad y los factores que la afectan. Qué es algo SOLUBLE? La Solubilidad corresponde
Solubilidad Material de apoyo, Segundo Medio monica.ibanez@lbvm. onica.ibanez@lbvm.clcl Obj. de hoy: Señalar que es Solubilidad y los factores que la afectan. Qué es algo SOLUBLE? La Solubilidad corresponde
AÑO 2002 http://centros5.pntic.mec.es/ies.victoria.kent/rincon- C/Practica/PR-25/PR-25.htm ISBN TEXTO.
 ASIGNATURA Ciencias Naturales CURSO 4º ESO CENTRO IESO Azagra FUENTE AUTOR Mª Luisa Tato TÍTULO EDITORIAL Internet AÑO 2002 PÁGINA http://centros5.pntic.mec.es/ies.victoria.kent/rincon- C/Practica/PR-25/PR-25.htm
ASIGNATURA Ciencias Naturales CURSO 4º ESO CENTRO IESO Azagra FUENTE AUTOR Mª Luisa Tato TÍTULO EDITORIAL Internet AÑO 2002 PÁGINA http://centros5.pntic.mec.es/ies.victoria.kent/rincon- C/Practica/PR-25/PR-25.htm
PCPI Ámbito Científico-Tecnológico LA MATERIA
 LA MATERIA La materia es todo aquello que ocupa lugar en el espacio y tiene masa. Un sistema material es una porción de materia que, para su estudio, aislamos del resto. La materia está formada por partículas
LA MATERIA La materia es todo aquello que ocupa lugar en el espacio y tiene masa. Un sistema material es una porción de materia que, para su estudio, aislamos del resto. La materia está formada por partículas
Clasificación de la materia
 Clasificación de la materia Sustancias Puras Son caracterizados por su composición y propiedades definidas y constantes bajo condiciones determinadas. Sustancias puras: Elementos Son sustancias puras formadas
Clasificación de la materia Sustancias Puras Son caracterizados por su composición y propiedades definidas y constantes bajo condiciones determinadas. Sustancias puras: Elementos Son sustancias puras formadas
Tema 13: La materia Ciencias Naturales 1º ESO página 1. Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
 Tema 13: La materia Ciencias Naturales 1º ESO página 1 TEMA 13: LA MATERIA, BASE DEL UNIVERSO 1. Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
Tema 13: La materia Ciencias Naturales 1º ESO página 1 TEMA 13: LA MATERIA, BASE DEL UNIVERSO 1. Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
Escuela del Petróleo - Química
 Escuela del Petróleo - Química 2012 1 Unidad 2 1) Sistema Materiales 2) Materiales Homogéneos y Heterogéneos. a. Separación de las fases b. Sustancia Pura 3) extensivas e intensivas 4) Sistemas dispersos
Escuela del Petróleo - Química 2012 1 Unidad 2 1) Sistema Materiales 2) Materiales Homogéneos y Heterogéneos. a. Separación de las fases b. Sustancia Pura 3) extensivas e intensivas 4) Sistemas dispersos
GUÍA DE LOS MAESTROS ACTIVIDAD: PREPARANDO SOLUCIONES COMO CIENTÍFICOS
 GUÍA DE LOS MAESTROS ACTIVIDAD: PREPARANDO SOLUCIONES COMO CIENTÍFICOS Tiempo Sugerido : 100 minutos (dos Técnica De Enseñanza: laboratorio períodos de 50 min) Materiales: Objetivos Generales: Para cada
GUÍA DE LOS MAESTROS ACTIVIDAD: PREPARANDO SOLUCIONES COMO CIENTÍFICOS Tiempo Sugerido : 100 minutos (dos Técnica De Enseñanza: laboratorio períodos de 50 min) Materiales: Objetivos Generales: Para cada
Alianza para el Aprendizaje de Ciencias y Matemáticas
 Alianza para el Aprendizaje de Ciencias y Matemáticas Actividad I: Cuáles materiales desaparecen en el agua? Guía del maestro Tiempo sugerido: 100 minutos Objetivos específicos: 1. Identificar propiedades
Alianza para el Aprendizaje de Ciencias y Matemáticas Actividad I: Cuáles materiales desaparecen en el agua? Guía del maestro Tiempo sugerido: 100 minutos Objetivos específicos: 1. Identificar propiedades
Guía de Laboratorio 3. Asignatura: Química General Básica. Práctica 6: Estudio de las Soluciones
 Guía de Laboratorio 3 Asignatura: Química General Básica Práctica 6: Estudio de las Soluciones I. Objetivos 1. Valorar la importancia de las soluciones. 2. Interpretar los factores que afectan la solubilidad
Guía de Laboratorio 3 Asignatura: Química General Básica Práctica 6: Estudio de las Soluciones I. Objetivos 1. Valorar la importancia de las soluciones. 2. Interpretar los factores que afectan la solubilidad
Laboratorio De Química TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES
 TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES - Materia Es todo lo que posee masa, y ocupa un lugar en el espacio. - Sistema Materi al Porción de materia que se aisla para su estudio. - Sistema Homogéneo Es
TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES - Materia Es todo lo que posee masa, y ocupa un lugar en el espacio. - Sistema Materi al Porción de materia que se aisla para su estudio. - Sistema Homogéneo Es
Bachillerato. todos los derechos reservados, Macmillan Profesional. QUIMI
 QUIMI A2 Los sistemas dispersos 3 Estas sustancias son materiales que resultan de la combinación de una o más sustancias puras dispersas entre sí. Mezcla heterogénea Mezcla homogénea Coloide Granito Agua
QUIMI A2 Los sistemas dispersos 3 Estas sustancias son materiales que resultan de la combinación de una o más sustancias puras dispersas entre sí. Mezcla heterogénea Mezcla homogénea Coloide Granito Agua
El primer caso es un ejemplo de mezcla heterogénea porque aprecias los componentes que la forman.
 Otras disoluciones por Cristina Andrade Guevara Figura 1. Glass of water Figura 3. Glass of water Supón que tienes un vaso con agua y le agregas aserrín. Durante algún tiempo, las partículas de aserrín
Otras disoluciones por Cristina Andrade Guevara Figura 1. Glass of water Figura 3. Glass of water Supón que tienes un vaso con agua y le agregas aserrín. Durante algún tiempo, las partículas de aserrín
filosofiatotal.blogspot.com depcienat1.blogspot.com
 www.alambiques.info filosofiatotal.blogspot.com depcienat1.blogspot.com www.panreac.es Ahhhh! Un vaso de limonada helada es muy refrescante en un día caluroso. La limonada es una combinación de jugo de
www.alambiques.info filosofiatotal.blogspot.com depcienat1.blogspot.com www.panreac.es Ahhhh! Un vaso de limonada helada es muy refrescante en un día caluroso. La limonada es una combinación de jugo de
ESCUELA SECUNDARIA GENERAL No. 3 NIÑOS HÉROES C.C.T 15DES0003P SECTOR EDUCATIVO No. II ZONA ESCOLAR 6 ANEXOS ACTIVIDADES DE CIENCIAS 3 QUÍMICA
 ESCUELA SECUNDARIA GENERAL No. 3 NIÑOS HÉROES C.C.T 15DES0003P SECTOR EDUCATIVO No. II ZONA ESCOLAR 6 ANEXOS ACTIVIDADES DE CIENCIAS 3 QUÍMICA PROFR. JORGE ALBERTO REYES MARTÍNEZ CORREO ELECTRONICO DONDE
ESCUELA SECUNDARIA GENERAL No. 3 NIÑOS HÉROES C.C.T 15DES0003P SECTOR EDUCATIVO No. II ZONA ESCOLAR 6 ANEXOS ACTIVIDADES DE CIENCIAS 3 QUÍMICA PROFR. JORGE ALBERTO REYES MARTÍNEZ CORREO ELECTRONICO DONDE
Cálculo del rendimiento de una reacción química
 COLEGIO INTERNACIONAL SEK-CATALUNYA Curso 2011/12 Práctica Química 1 4º ESO Cálculo del rendimiento de una reacción química Introducción Para interpretar una reacción de manera cuantitativa, es necesario
COLEGIO INTERNACIONAL SEK-CATALUNYA Curso 2011/12 Práctica Química 1 4º ESO Cálculo del rendimiento de una reacción química Introducción Para interpretar una reacción de manera cuantitativa, es necesario
Estados de la materia y cambios de fase
 3 Año de Química: Sistemas Materiales Prof. Javier Ponce Qué es Ciencia? Ciencia (en latíns cientia, de scire, conocer ), término que en su sentido más amplio se emplea para referirse al conocimiento sistematizado
3 Año de Química: Sistemas Materiales Prof. Javier Ponce Qué es Ciencia? Ciencia (en latíns cientia, de scire, conocer ), término que en su sentido más amplio se emplea para referirse al conocimiento sistematizado
14/08/2017. Mezcla Es la unión física de 2 o más sustancias
 Compilado por: Ing. Nelson Velásquez MATERIA Sustancias Formadas por el mismo tipo de átomos o moléculas. Responden a una sola fórmula definida. Mezclas Formadas por distintos tipos de átomos y moléculas,
Compilado por: Ing. Nelson Velásquez MATERIA Sustancias Formadas por el mismo tipo de átomos o moléculas. Responden a una sola fórmula definida. Mezclas Formadas por distintos tipos de átomos y moléculas,
Materia. Definición, propiedades, cambios de la materia y energía, clasificación de la materia.
 TEMA 02 Materia. Definición, propiedades, cambios de la materia y energía, clasificación de la materia. -.-.-.-.-.-.-.-.-..-..-..-..-..-..-.-..-..-..-..-..-.-..-.-..-.-.-.-..-.-...-..-.-..-.-..-.-..-.-..-.-..-.-..-.-..-.-
TEMA 02 Materia. Definición, propiedades, cambios de la materia y energía, clasificación de la materia. -.-.-.-.-.-.-.-.-..-..-..-..-..-..-.-..-..-..-..-..-.-..-.-..-.-.-.-..-.-...-..-.-..-.-..-.-..-.-..-.-..-.-..-.-..-.-
Disoluciones Químicas
 Disoluciones Químicas Las disoluciones son mezclas homogéneas de dos o más sustancias, es decir, cuyos componentes no se pueden distinguir a simple vista. Siempre que se esta en presencia de una mezcla
Disoluciones Químicas Las disoluciones son mezclas homogéneas de dos o más sustancias, es decir, cuyos componentes no se pueden distinguir a simple vista. Siempre que se esta en presencia de una mezcla
MATERIAL DE LABORATORIO
 MATERIAL DE LABORATORIO Vasos de precipitado. Pueden ser de dos formas: altos o bajos. Sin graduar o graduados y nos dan un volumen aproximado (los vasos al tener mucha anchura nunca dan volúmenes precisos).
MATERIAL DE LABORATORIO Vasos de precipitado. Pueden ser de dos formas: altos o bajos. Sin graduar o graduados y nos dan un volumen aproximado (los vasos al tener mucha anchura nunca dan volúmenes precisos).
SUSTANCIAS PURAS Y MEZCLAS
 Práctica nº 6 ESTUDIO DE TRES MEZCLAS Por J.A. Bertomeu R. Un poco de teoría... SUSTANCIAS PURAS Y MEZCLAS En la Naturaleza encontramos las sustancias agregadas una a otras formando una inmensa mezcla.
Práctica nº 6 ESTUDIO DE TRES MEZCLAS Por J.A. Bertomeu R. Un poco de teoría... SUSTANCIAS PURAS Y MEZCLAS En la Naturaleza encontramos las sustancias agregadas una a otras formando una inmensa mezcla.
PRÁCTICAS TÉCNICAS DE SEPARACIÓN Y PREPARACIÓN DE DISOLUCIONES FÍSICA Y QUÍMICA 2º
 PRÁCTICAS TÉCNICAS DE SEPARACIÓN Y PREPARACIÓN DE DISOLUCIONES FÍSICA Y QUÍMICA 2º CURSO: NOMBRE: COMPAÑEROS QUE FORMAN TU GRUPO: 1 FILTRACIÓN DE AGUA Y ARENA La filtración es la separación de las partículas
PRÁCTICAS TÉCNICAS DE SEPARACIÓN Y PREPARACIÓN DE DISOLUCIONES FÍSICA Y QUÍMICA 2º CURSO: NOMBRE: COMPAÑEROS QUE FORMAN TU GRUPO: 1 FILTRACIÓN DE AGUA Y ARENA La filtración es la separación de las partículas
Clasificación de la materia
 Clasificación de la materia La materia puede estar en forma de sustancias puras o mezclas. Materia Sustancias Puras Mezclas Elemento Compuesto Homogéneas Heterogéneas Disoluciones Coloides Suspensiones
Clasificación de la materia La materia puede estar en forma de sustancias puras o mezclas. Materia Sustancias Puras Mezclas Elemento Compuesto Homogéneas Heterogéneas Disoluciones Coloides Suspensiones
8.- Disoluciones, coloides y suspensiones
 Fecha 8.- Disoluciones, coloides y suspensiones Marco teórico La materia la podemos encontrar en la naturaleza en forma de sustancias puras y de mezclas. Las sustancias puras son aquéllas cuya naturaleza
Fecha 8.- Disoluciones, coloides y suspensiones Marco teórico La materia la podemos encontrar en la naturaleza en forma de sustancias puras y de mezclas. Las sustancias puras son aquéllas cuya naturaleza
PRÁCTICA No 7 CINÉTICA QUÍMICA. Nombre del Alumno: Profesor: Grupo:
 CINÉTICA QUÍMICA Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades.. Identifica problemas, formula preguntas de carácter científico y plantea
CINÉTICA QUÍMICA Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades.. Identifica problemas, formula preguntas de carácter científico y plantea
2. Ordena las letras para obtener los nombres de los cambios de estado que se definen en cada casilla.
 1. Observa las figuras, lee los textos y responde: Un trozo de mármol no varía su forma si lo cambiamos de posición. Su volumen tampoco cambia aunque lo apretemos con la mano. Podemos cambiar la forma
1. Observa las figuras, lee los textos y responde: Un trozo de mármol no varía su forma si lo cambiamos de posición. Su volumen tampoco cambia aunque lo apretemos con la mano. Podemos cambiar la forma
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
Coloides y Suspensiones Osmosis y Diálisis. SEMANA 10 Licda. Lilian Judith Guzmán Melgar
 Coloides y Suspensiones Osmosis y Diálisis SEMANA 10 Licda. Lilian Judith Guzmán Melgar SUSPENSIONES Las suspensiones son mezclas heterogéneas formadas por una fase sólida (polvo o pequeñas partículas
Coloides y Suspensiones Osmosis y Diálisis SEMANA 10 Licda. Lilian Judith Guzmán Melgar SUSPENSIONES Las suspensiones son mezclas heterogéneas formadas por una fase sólida (polvo o pequeñas partículas
Departamento Ciencias. Física y Química MATERIA. se clasifica en. SUSTANCIAS PURAS pueden ser. por métodos. físicos originan. Compuestos.
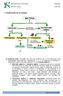 1. Clasificación de la materia MATERIA se clasifica en MEZCLAS pueden ser por métodos físicos originan SUSTANCIAS PURAS pueden ser Heterogéneas Homogéneas Compuestos como las Disoluciones formados por
1. Clasificación de la materia MATERIA se clasifica en MEZCLAS pueden ser por métodos físicos originan SUSTANCIAS PURAS pueden ser Heterogéneas Homogéneas Compuestos como las Disoluciones formados por
SOLUCIONES, COLOIDES Y SUSPENSIONES OSMOSIS Y DIALISIS Elaborado por: Lic. Raúl Hernández Mazariegos
 UNIVERSIDAD SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA DE QUIMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2016 SEMANA 10 SOLUCIONES, COLOIDES Y SUSPENSIONES OSMOSIS Y DIALISIS Elaborado
UNIVERSIDAD SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA DE QUIMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2016 SEMANA 10 SOLUCIONES, COLOIDES Y SUSPENSIONES OSMOSIS Y DIALISIS Elaborado
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas. Química General para Ingenieros: QUIM 2115
 UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas Química General para Ingenieros: QUIM 115 Experimento No. : ESTEQUIOMETRIA DE UNA REACCION EN MEDIO ACUOSO
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas Química General para Ingenieros: QUIM 115 Experimento No. : ESTEQUIOMETRIA DE UNA REACCION EN MEDIO ACUOSO
1.- Como se presenta la materia a) Sistemas homogéneos: b) Sistemas heterogéneos: 2.- Las mezclas: a) Mezclas heterogéneas:
 T3: Diversidad de la materia. 1.- Como se presenta la materia. a) Sistemas homogéneos: Son sistemas materiales que tienen el mismo aspecto en cualquiera de sus partes. Ejm: agua, aluminio, agua de mar
T3: Diversidad de la materia. 1.- Como se presenta la materia. a) Sistemas homogéneos: Son sistemas materiales que tienen el mismo aspecto en cualquiera de sus partes. Ejm: agua, aluminio, agua de mar
Dirección de Desarrollo Curricular Secretaría Académica
 PLAN DE ESTUDIOS DE EDUCACIÓN MEDIA SUPERIOR CAMPO DISCIPLINAR Ciencias Experimentales PROGRAMA DE ASIGNATURA (UNIDADES DE APRENDIZAJE CURRICULAR) Métodos de Investigación PERIODO II CLAVE BCCE.09.03-06
PLAN DE ESTUDIOS DE EDUCACIÓN MEDIA SUPERIOR CAMPO DISCIPLINAR Ciencias Experimentales PROGRAMA DE ASIGNATURA (UNIDADES DE APRENDIZAJE CURRICULAR) Métodos de Investigación PERIODO II CLAVE BCCE.09.03-06
2 Sustancias puras y mezclas
 2 Sustancias puras y mezclas Sustancias puras Llamamos sustancia pura a cualquier material que tiene unas propiedades características que la distinguen claramente de otras. Algunas de estas propiedades
2 Sustancias puras y mezclas Sustancias puras Llamamos sustancia pura a cualquier material que tiene unas propiedades características que la distinguen claramente de otras. Algunas de estas propiedades
DIVISIÓN DE INGENIERÍA EN GESTION EMPRESARIAL
 DIRECCIÓN ACADÉMICA DIVISIÓN DE INGENIERÍA EN GESTION EMPRESARIAL FUNDAMENTOS DE QUIMICA PRACTICA NO. NOMBRE DE LA RÁCTICA. GRUPO: EQUIPO: ALUMNOS: COMPETENCIA ESPECÍFICA: Diferenciar una mezcla de un
DIRECCIÓN ACADÉMICA DIVISIÓN DE INGENIERÍA EN GESTION EMPRESARIAL FUNDAMENTOS DE QUIMICA PRACTICA NO. NOMBRE DE LA RÁCTICA. GRUPO: EQUIPO: ALUMNOS: COMPETENCIA ESPECÍFICA: Diferenciar una mezcla de un
 TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES - Materia Es todo lo que posee masa, y ocupa un lugar en el espacio. - Sistema Material Porción de materia que se aisla para su estudio. - Sustancia Pura - Sistema
TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES - Materia Es todo lo que posee masa, y ocupa un lugar en el espacio. - Sistema Material Porción de materia que se aisla para su estudio. - Sustancia Pura - Sistema
Actividad: Mezcla homogénea o heterogénea?
 Mezcla homogénea o heterogénea? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Mezcla homogénea o heterogénea? Cuál es la diferencia entre una mezcla homogénea y una heterogénea?
Mezcla homogénea o heterogénea? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Mezcla homogénea o heterogénea? Cuál es la diferencia entre una mezcla homogénea y una heterogénea?
TEMA 3: MEZCLAS REFLEXIÓN INICIAL
 TEMA 3: MEZCLAS REFLEXIÓN INICIAL El aire que respiramos es una mezcla de muchos gases: nitrógeno, oxígeno, dióxido de carbono Casi todos los materiales naturales o artificiales de nuestro entorno son
TEMA 3: MEZCLAS REFLEXIÓN INICIAL El aire que respiramos es una mezcla de muchos gases: nitrógeno, oxígeno, dióxido de carbono Casi todos los materiales naturales o artificiales de nuestro entorno son
III. D ISOLU L CIONES E
 III. DISOLUCIONES III. DISOLUCIONES Índice 1. Disoluciones 2. Solubilidad 3. Factores que favorecen la disolución de las sustancias 4. Propiedades coligativas de las disoluciones 5. Suspensiones y disoluciones
III. DISOLUCIONES III. DISOLUCIONES Índice 1. Disoluciones 2. Solubilidad 3. Factores que favorecen la disolución de las sustancias 4. Propiedades coligativas de las disoluciones 5. Suspensiones y disoluciones
COMPUESTOS ORGÁNICOS
 COMPUESTOS ORGÁNICOS NOMBRE DEL ALUMNO: PROFESOR: GRUPO: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeño y habilidades: 4. Marco Teórico: 1. Obtiene, registra y sistematiza la información
COMPUESTOS ORGÁNICOS NOMBRE DEL ALUMNO: PROFESOR: GRUPO: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeño y habilidades: 4. Marco Teórico: 1. Obtiene, registra y sistematiza la información
PROBLEMAS MEZCLAS Y DISOLUCIONES
 PROBLEMAS MEZCLAS Y DISOLUCIONES 1. Clasifica como homogéneos o heterogéneos los siguientes sistemas materiales: un trozo de cobre, agua salada, hierro oxidado, una ensalada. 2. Al mezclar dos sistemas
PROBLEMAS MEZCLAS Y DISOLUCIONES 1. Clasifica como homogéneos o heterogéneos los siguientes sistemas materiales: un trozo de cobre, agua salada, hierro oxidado, una ensalada. 2. Al mezclar dos sistemas
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRACTICA DE LABORATORIO 2014. SEMANA 10 SOLUCIONES, COLOIDES Y SUSPENSIONES OSMOSIS Y DIALISIS Elaborado por: Licda. Isabel Fratti de Del Cid
 UNIVERSIDAD SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA DE QUIMICA, PRIMER AÑO I- INTRODUCCION PRACTICA DE LABORATORIO 2014 SEMANA 10 SOLUCIONES, COLOIDES Y SUSPENSIONES OSMOSIS
UNIVERSIDAD SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA DE QUIMICA, PRIMER AÑO I- INTRODUCCION PRACTICA DE LABORATORIO 2014 SEMANA 10 SOLUCIONES, COLOIDES Y SUSPENSIONES OSMOSIS
TEORÍA CINÉTICA. CAMBIOS DE ESTADO 3ºESO
 1. ESTADOS DE AGREGACIÓN DE LA MATERIA La materia se puede encontrar en la naturaleza en tres estados de agregación o estados físicos: sólido, líquido y gaseoso. Estos estados poseen unas propiedades que
1. ESTADOS DE AGREGACIÓN DE LA MATERIA La materia se puede encontrar en la naturaleza en tres estados de agregación o estados físicos: sólido, líquido y gaseoso. Estos estados poseen unas propiedades que
QUÍMICA ANALÍTICA EXPERIMENTAL I ANÁLISIS CUANTITATIVO DE ANALITOS PREVIA SEPARACIÓN POR PRECIPITACIÓN INTRODUCCIÓN
 ANÁLISIS CUANTITATIVO DE ANALITOS PREVIA SEPARACIÓN POR PRECIPITACIÓN INTRODUCCIÓN Las operaciones utilizadas en análisis químico cuantitativo para separar los diferentes componentes de una mezcla se basan
ANÁLISIS CUANTITATIVO DE ANALITOS PREVIA SEPARACIÓN POR PRECIPITACIÓN INTRODUCCIÓN Las operaciones utilizadas en análisis químico cuantitativo para separar los diferentes componentes de una mezcla se basan
ENSAYO DE COAGULACIÓN FLOCULACIÓN (JAR-TEST)
 Página 1 ENSAYO DE COAGULACIÓN FLOCULACIÓN (JAR-TEST) 1.- OBJETIVO 2.- TEORÍA 3.- MÉTODOS 4.- MATERIALES Y EQUIPOS 5.- PRODUCTOS QUÍMICOS 6.- PROCEDIMIENTO 7.- RESULTADOS 8.- CONCLUSIONES 1.- OBJETIVOS
Página 1 ENSAYO DE COAGULACIÓN FLOCULACIÓN (JAR-TEST) 1.- OBJETIVO 2.- TEORÍA 3.- MÉTODOS 4.- MATERIALES Y EQUIPOS 5.- PRODUCTOS QUÍMICOS 6.- PROCEDIMIENTO 7.- RESULTADOS 8.- CONCLUSIONES 1.- OBJETIVOS
Para la solución de algunos de los ejercicios propuestos, se adjunta una parte del sistema periódico hasta el elemento Nº 20.
 Programa Estándar Anual Nº Guía práctica Disoluciones I: mezclas, disoluciones y unidades porcentuales de concentración Ejercicios PSU Para la solución de algunos de los ejercicios propuestos, se adjunta
Programa Estándar Anual Nº Guía práctica Disoluciones I: mezclas, disoluciones y unidades porcentuales de concentración Ejercicios PSU Para la solución de algunos de los ejercicios propuestos, se adjunta
Coloides en la vida diaria
 COLOIDES 2017 Por qué la leche es blanca? Por qué se corta si la dejamos fuera de la heladera? Por qué para preparar mayonesa hay que batir? Por qué la receta lleva huevo? Por qué la clara de huevo es
COLOIDES 2017 Por qué la leche es blanca? Por qué se corta si la dejamos fuera de la heladera? Por qué para preparar mayonesa hay que batir? Por qué la receta lleva huevo? Por qué la clara de huevo es
LAS MEZCLAS. disoluciones
 LAS MEZCLAS Y disoluciones Qué es mezclar? Mezclar es juntar dos o más sustancias Los componentes son las sustancias que echamos en la mezcla A los componentes de una mezcla también se les llama ingredientes
LAS MEZCLAS Y disoluciones Qué es mezclar? Mezclar es juntar dos o más sustancias Los componentes son las sustancias que echamos en la mezcla A los componentes de una mezcla también se les llama ingredientes
OBJETIVO Aprender a preparar disoluciones de concentración dada, ya que la mayor parte de las reacciones químicas tienen lugar en forma de disolución.
 OBJETIVO Aprender a preparar disoluciones de concentración dada, ya que la mayor parte de las reacciones químicas tienen lugar en forma de disolución. FUNDAMENTO TEÓRICO Una disolución es una mezcla homogénea
OBJETIVO Aprender a preparar disoluciones de concentración dada, ya que la mayor parte de las reacciones químicas tienen lugar en forma de disolución. FUNDAMENTO TEÓRICO Una disolución es una mezcla homogénea
CARACTERISTICAS DE LAS DISOLUCIONES Mezcla: unión de dos o mas sustancias, que no se combinan químicamente
 CARACTERISTICAS DE LAS DISOLUCIONES Mezcla: unión de dos o mas sustancias, que no se combinan químicamente Las mezclas están formadas por una sustancia que se encuentra en mayor proporción llamada fase
CARACTERISTICAS DE LAS DISOLUCIONES Mezcla: unión de dos o mas sustancias, que no se combinan químicamente Las mezclas están formadas por una sustancia que se encuentra en mayor proporción llamada fase
COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS ACTIVIDAD EXPERIMENTAL 6 DE: QUÍMICA III
 COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS ACTIVIDAD EXPERIMENTAL 6 DE: QUÍMICA III 1.- IDENTIFICANDO LAS PROPIEDADES EN LAS DISOLUCIONES,
COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS ACTIVIDAD EXPERIMENTAL 6 DE: QUÍMICA III 1.- IDENTIFICANDO LAS PROPIEDADES EN LAS DISOLUCIONES,
FÍSICA Y QUÍMICA 2º ESO Tema 2: LA MATERIA Mezclas y Soluciones. Sustancias puras y mezclas
 Sustancias puras y mezclas La materia que nos rodea es, en la mayoría de los casos, una mezcla de sustancias. Los científicos han intentado clasificar las sustancias desde el principio de los tiempos.
Sustancias puras y mezclas La materia que nos rodea es, en la mayoría de los casos, una mezcla de sustancias. Los científicos han intentado clasificar las sustancias desde el principio de los tiempos.
Coloides y Suspensiones Osmosis y Diálisis. SEMANA 10 Licda. Lilian Judith Guzmán Melgar
 Coloides y Suspensiones Osmosis y Diálisis SEMANA 10 Licda. Lilian Judith Guzmán Melgar SUSPENSIONES Las suspensiones son mezclas heterogéneas formadas por una fase sólida (polvo o pequeñas partículas
Coloides y Suspensiones Osmosis y Diálisis SEMANA 10 Licda. Lilian Judith Guzmán Melgar SUSPENSIONES Las suspensiones son mezclas heterogéneas formadas por una fase sólida (polvo o pequeñas partículas
SOLUCIONES QUIMICAS. Introducción.
 SOLUCIONES QUIMICAS Introducción. Esta guía abarca los conceptos y tipos de ejercicios fundamentales que constituyen las Soluciones Química. Incluye un ejemplo sencillo que puede ser complementado con
SOLUCIONES QUIMICAS Introducción. Esta guía abarca los conceptos y tipos de ejercicios fundamentales que constituyen las Soluciones Química. Incluye un ejemplo sencillo que puede ser complementado con
----------SOLUCIÓN ---------- 1. (b) 8. (a) 2. (a) 29. (b) 30. (c) 22. (d) 23. (b) 24. (a) 25. (b) 26. (d) 27. (c) 28. (a)
 29. Si la presión externa del ambiente que rodea a un líquido aumenta, qué le pasa a la temperatura a la que hierve? a) disminuye b) aumenta c) no cambia d) no se puede saber 30. Las gotas de agua que
29. Si la presión externa del ambiente que rodea a un líquido aumenta, qué le pasa a la temperatura a la que hierve? a) disminuye b) aumenta c) no cambia d) no se puede saber 30. Las gotas de agua que
DIVERSIDAD DE LA MATERIA TEMA 3
 DIVERSIDAD DE LA MATERIA TEMA 3 Cómo se presenta la materia Sistema homogéneos Sistemas materiales que tienen el mismo aspecto en cualquiera de sus partes. Ejemplo: agua, leche, gelatina Sistemas heterogéneos
DIVERSIDAD DE LA MATERIA TEMA 3 Cómo se presenta la materia Sistema homogéneos Sistemas materiales que tienen el mismo aspecto en cualquiera de sus partes. Ejemplo: agua, leche, gelatina Sistemas heterogéneos
Cuáles de ellas son una disolución? Por qué dices que son disoluciones? Puedes identificar alguna sustancia que las forma?
 : MATERIAL PARA EL ALUMNADO Sustancias solubles y no solubles en agua Actividad 1. Qué sabemos sobre las sustancias solubles? Identificar bebidas que utilizamos en nuestra vida cotidiana. En nuestra vida
: MATERIAL PARA EL ALUMNADO Sustancias solubles y no solubles en agua Actividad 1. Qué sabemos sobre las sustancias solubles? Identificar bebidas que utilizamos en nuestra vida cotidiana. En nuestra vida
El principio de las técnicas de separación física de la materia. Diferencia entre cambios físicos y químicos de las mezclas.
 UNIVERSIDAD DE SANTANDER PROGRAMA DE INGENIERIA AMBIENTAL UDES GUIA DE LABORATORIO 0 TERMODINAMICA SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA DE ÁCIDO BENZOICO, ARENA Y SAL. NOMBRE: CÓDIGO: NOMBRE: CÓDIGO:
UNIVERSIDAD DE SANTANDER PROGRAMA DE INGENIERIA AMBIENTAL UDES GUIA DE LABORATORIO 0 TERMODINAMICA SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA DE ÁCIDO BENZOICO, ARENA Y SAL. NOMBRE: CÓDIGO: NOMBRE: CÓDIGO:
PRACTICA o. 8 SOLUBILIDAD E I SOLUBILIDAD FACTORES QUE LAS AFECTA
 1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA o. 8 SOLUBILIDAD E I SOLUBILIDAD FACTORES
1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA o. 8 SOLUBILIDAD E I SOLUBILIDAD FACTORES
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq
 qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq ACTIVIDADES DE RECUPERACIÓN DE FÍSICA Y QUÍMICA 3º ESO 2º TRIMESTRE
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq ACTIVIDADES DE RECUPERACIÓN DE FÍSICA Y QUÍMICA 3º ESO 2º TRIMESTRE
ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD
 Práctico 2 Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 2: ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten;
Práctico 2 Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 2: ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten;
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas
 UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas Experimento No. 5: ESTEQUIOMETRIA DE UNA REACCION EN MEDIO ACUOSO Laboratorio QUIM 1111 Objetivos experimentales
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas Experimento No. 5: ESTEQUIOMETRIA DE UNA REACCION EN MEDIO ACUOSO Laboratorio QUIM 1111 Objetivos experimentales
UNIDAD II. Transformaciones de la materia. Tema 2: Clasificación de la materia.
 UNIDAD II. Transformaciones de la materia. Tema 2: Clasificación de la materia. Qué es materia? Es todo lo que tiene masa y volumen. CLASIFICACIÓN DE LA MATERIA: Según: A. Estado de agregación. B. Composición.
UNIDAD II. Transformaciones de la materia. Tema 2: Clasificación de la materia. Qué es materia? Es todo lo que tiene masa y volumen. CLASIFICACIÓN DE LA MATERIA: Según: A. Estado de agregación. B. Composición.
LABORATORIO N 2 PREPARACIÓN DE SOLUCIONES
 LABORATORIO N 2 PREPARACIÓN DE SOLUCIONES I.- INTRODUCCIÓN A) Soluciones La materia puede presentarse en forma de mezclas o sustancias puras. Cuando una mezcla tiene una composición uniforme, en cualquier
LABORATORIO N 2 PREPARACIÓN DE SOLUCIONES I.- INTRODUCCIÓN A) Soluciones La materia puede presentarse en forma de mezclas o sustancias puras. Cuando una mezcla tiene una composición uniforme, en cualquier
FILTRACIÓN Y DECANTACIÓN
 Universidad Tecnológica de Pereira Facultad de Tecnología Programa de Química Química I FILTRACIÓN Y DECANTACIÓN Objetivos Aplicar adecuadamente las técnicas de filtración por gravedad y al vacío. Separar
Universidad Tecnológica de Pereira Facultad de Tecnología Programa de Química Química I FILTRACIÓN Y DECANTACIÓN Objetivos Aplicar adecuadamente las técnicas de filtración por gravedad y al vacío. Separar
Problemas de Óptica II. Óptica geométrica 2º de bachillerato. Física
 1 Problemas de Óptica II. Óptica geométrica 2º de bachillerato. Física 1. Los índices de refracción de un dioptrio esférico cóncavo, de 20,0 cm de radio, son 1,33 y 1,54 para el primero y el segundo medios.
1 Problemas de Óptica II. Óptica geométrica 2º de bachillerato. Física 1. Los índices de refracción de un dioptrio esférico cóncavo, de 20,0 cm de radio, son 1,33 y 1,54 para el primero y el segundo medios.
PR-SSI ACTIVIDAD 9: JUNTOS Y SEPARADOS GUÍA DEL MAESTRO(A) 1. Usarán las técnicas de decantación y filtración para separar una mezcla de agua y arena.
 Tiempo sugerido: 100 minutos Objetivos específicos: PR-SSI ACTIVIDAD 9: JUNTOS Y SEPARADOS GUÍA DEL MAESTRO(A) 1. Usarán las técnicas de decantación y filtración para separar una mezcla de agua y arena.
Tiempo sugerido: 100 minutos Objetivos específicos: PR-SSI ACTIVIDAD 9: JUNTOS Y SEPARADOS GUÍA DEL MAESTRO(A) 1. Usarán las técnicas de decantación y filtración para separar una mezcla de agua y arena.
Práctica 1: Magnesio, aluminio y boro
 Práctica 1: Magnesio, aluminio y boro Reacciones del magnesio y del aluminio. Síntesis del acido bórico. Objetivos: Se examinaran algunas reacciones de los elementos metálicos magnesio y aluminio y además,
Práctica 1: Magnesio, aluminio y boro Reacciones del magnesio y del aluminio. Síntesis del acido bórico. Objetivos: Se examinaran algunas reacciones de los elementos metálicos magnesio y aluminio y además,
Alianza para el Aprendizaje de Ciencias y Matemáticas
 Alianza para el Aprendizaje de Ciencias y Matemáticas Actividad: III Preparando soluciones como lo hacen los científicos Guía del maestro Tiempo sugerido: 100 minutos Objetivos específicos: 1. Distinguir
Alianza para el Aprendizaje de Ciencias y Matemáticas Actividad: III Preparando soluciones como lo hacen los científicos Guía del maestro Tiempo sugerido: 100 minutos Objetivos específicos: 1. Distinguir
Sustancias puras y mezclas: Qué es una sustancia? Qué es una sustancia pura?: Clasificación de las sustancias puras: elementos y compuestos;
 SEXTO Sustancias puras y mezclas: Qué es una sustancia?: Es cualquier variedad de materia que tiene composición definida y reconocible. Las sustancias se clasifican en sustancias puras y mezclas. Qué es
SEXTO Sustancias puras y mezclas: Qué es una sustancia?: Es cualquier variedad de materia que tiene composición definida y reconocible. Las sustancias se clasifican en sustancias puras y mezclas. Qué es
ACTIVIDADES DE RECUPERACIÓN 1º ESO 2015
 LA MATERIA ACTIVIDADES DE RECUPERACIÓN 1º ESO 2015 1.- Indica si cada una de éstas palabras es una magnitud o no. Velocidad Ternura Longitud Masa simpatía belleza superficie temperatura 2.- Realiza las
LA MATERIA ACTIVIDADES DE RECUPERACIÓN 1º ESO 2015 1.- Indica si cada una de éstas palabras es una magnitud o no. Velocidad Ternura Longitud Masa simpatía belleza superficie temperatura 2.- Realiza las
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Disoluciones I: mezclas, disoluciones y unidades porcentuales de concentración SGUICES010CB33-A16V1 Ítem Alternativa Habilidad 1 D Reconocimiento 2 A Reconocimiento 3 C
SOLUCIONARIO Guía Estándar Anual Disoluciones I: mezclas, disoluciones y unidades porcentuales de concentración SGUICES010CB33-A16V1 Ítem Alternativa Habilidad 1 D Reconocimiento 2 A Reconocimiento 3 C
CRISTALIZACIÓN Es una operación unitaria de gran importancia en la Industria Química, como método de purificación y de obtención de materiales cristal
 CRISTALIZACIÓN CRISTALIZACIÓN Es una operación unitaria de gran importancia en la Industria Química, como método de purificación y de obtención de materiales cristalinos que tienen múltiples aplicaciones.
CRISTALIZACIÓN CRISTALIZACIÓN Es una operación unitaria de gran importancia en la Industria Química, como método de purificación y de obtención de materiales cristalinos que tienen múltiples aplicaciones.
CUESTIONARIO 4 GRADO III BIMESTRE CIENCIAS NATURALES DOCENTE: YULIS FONTALVO MEJÍA COLEGIO ROSARIO DE SANTO DOMINGO
 CUESTIONARIO 4 GRADO III BIMESTRE CIENCIAS NATURALES DOCENTE: YULIS FONTALVO MEJÍA COLEGIO ROSARIO DE SANTO DOMINGO 1. La materia es aquello que constituye los objetos y ocupa un lugar en el espacio, las
CUESTIONARIO 4 GRADO III BIMESTRE CIENCIAS NATURALES DOCENTE: YULIS FONTALVO MEJÍA COLEGIO ROSARIO DE SANTO DOMINGO 1. La materia es aquello que constituye los objetos y ocupa un lugar en el espacio, las
SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA
 PRÁCTICA Nº 3 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de diversas muestras problema. I. FUNDAMENTOS
PRÁCTICA Nº 3 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de diversas muestras problema. I. FUNDAMENTOS
VII Semana de la Ciencia y la Tecnología. 12-16 de noviembre de 2007
 VII Semana de la Ciencia y la Tecnología 12-16 de noviembre de 2007 Reacción reloj Una reacción reloj es una reacción química en la que un cambio de color súbito marca el final de la transformación de
VII Semana de la Ciencia y la Tecnología 12-16 de noviembre de 2007 Reacción reloj Una reacción reloj es una reacción química en la que un cambio de color súbito marca el final de la transformación de
