TEMA 1: LA BASE QUÍMICA DE LA VIDA: BIOELEMENTOS Y BIOMOLÉCULAS. EL AGUA Y LAS SALES MINERALES.
|
|
|
- Francisco Javier Maidana Ortiz de Zárate
- hace 8 años
- Vistas:
Transcripción
1 TEMA 1: LA BASE QUÍMICA DE LA VIDA: BIOELEMENTOS Y BIOMOLÉCULAS. EL AGUA Y LAS SALES MINERALES. Los componentes materiales del Universo se combinan entre sí formando ordenaciones y complejos de grado superior entre los que destacan unos sistemas, especialísimos porque compiten por adquirir sustancias de sus alrededores, porque son capaces de formar sistemas semejantes a sí mismos, y porque en condiciones de carencia de alimento externo, llegan al equilibrio químico y pierden sus funciones elementales. Son las unidades de la vida: los seres vivos. 1. La base química de la vida: componentes orgánicos e inorgánicos Elementos biogénicos o bioelementos Los bioelementos o elementos biogénicos son aquellos elementos químicos que forman parte de la materia viva, que intervienen en la composición de los seres vivos. Los bioelementos no son exclusivos de los seres vivos, sin embargo, los mayoritarios, a excepción del oxígeno, no coinciden con los elementos químicos más abundantes en la corteza terrestre. Hay unos 70 bioelementos descritos, pero de todos ellos, sólo unos 25 son relativamente abundantes y comunes en todos ellos. Estos bioelementos se clasifican en: a. Bioelementos mayoritarios: 11 bioelementos constituyen casi el 99 % del peso de la materia viva. Podemos dividirlos en: Bioelementos primarios: C, H, O, N, P, S; imprescindibles para la formación de la materia viva. Son las unidades básicas que constituyen los diferentes tipos de moléculas biológicas. Representan más del 96 % de la materia viva y son comunes a todos los seres vivos. Bioelementos secundarios: Mg, Ca, Na, K, Cl; menos del 3 % en peso. Desempeñan funciones vitales en fisiología celular, estando, por tanto, presentes en todos los seres vivos. b. Oligoelementos: cumplen diferentes funciones celulares y se encuentran en cantidad inferior al 1 %. En conjunto, representan menos del 1 % del total. Podemos dividir en: Oligoelementos esenciales: 14 elementos que aparecen en cantidades mínimas pero que realizan funciones imprescindibles; son Fe, Sn, Mn, Mo, Cu, Zn, F, I, B, Si, V, Cr, Co, Se. Oligoelementos no esenciales: son el resto de elementos químicos hasta 70; pueden faltar en algunos organismos Por qué los bioelementos primarios son los mayoritarios Los elementos mayoritarios (C, H, O, N, P, S) son los más adecuados para formar parte de la materia viva debido a las propiedades que presentan: Capas electrónicas externas incompletas: favorece la formación de enlaces covalentes de gran estabilidad. Tema 1 1
2 Número atómico bajo: los electrones compartidos son cercanos al núcleo, por tanto, están más fuertemente atraídos y las moléculas originadas son más estables. Polaridad: oxígeno y nitrógeno son muy electronegativos, por lo que muchas moléculas biológicas son polares y, por tanto, solubles en agua (requisito imprescindible para que tengan lugar las reacciones químicas fundamentales de la actividad vital). Fácil incorporación desde la Biosfera: los bioelementos mayoritarios se puede incorporar fácilmente desde el medio externo al encontrarse en moléculas que pueden ser captadas de manera sencilla como el dióxido de carbono, el agua o los nitratos. La configuración electrónica del carbono le permite unirse a otros átomos para formar cadenas lineales, ramificadas o circulares de cierta estabilidad, pero que se rompen sin demasiada dificultad si el metabolismo lo requiere; igualmente, el carbono puede unirse a otros elementos químicos, generando diferentes grupos funcionales (conjunto de átomos unidos de una forma determinada que proporciona a las moléculas en que se encuentra unas propiedades características) que dan lugar a muy diversos componentes orgánicos y que confieren una gran variabilidad al metabolismo. El oxígeno tiende a quitar electrones a los átomos, debido a su alta electronegatividad (los oxida). Este proceso libera mucha energía, fundamental para el mantenimiento de la vida. El nitrógeno puede formar compuestos reducidos u oxidados y libera energía al pasar de una forma a otra Funciones de los bioelementos mayoritarios El carbono, hidrógeno, oxígeno y nitrógeno son los cuatro elementos fundamentales en la constitución de las principales biomoléculas orgánicas. Además: El carbono puede encontrarse también en moléculas inorgánicas de interés biológico como el dióxido de carbono, y sus derivados, los carbonatos, contribuyen, entre otras cosas al equilibrio del ph de la sangre. El oxígeno en su forma molecular es el aceptor final de la cadena de electrones (cadena respiratoria de las células con metabolismo aerobio); además forma parte del agua y del dióxido de carbono. El hidrógeno forma parte del agua y condiciona el ph de los medios biológicos; asimismo, muchos procesos redox suelen tener la forma de hidrogenaciones/deshidrogenaciones. El nitrógeno en su forma de NO funciona en los vertebrados como señal inductora de vasodilatación; también es empleado como aceptor de electrones en las cadenas respiratorias de algunas cianobacterias. Por otro lado: El azufre forma parte de ciertos aminoácidos, permitiendo la unión de los mismos por puentes disulfuro; en la forma de SH 2 y SO 2 es un producto residual del metabolismo de algunas bacterias. El fósforo está presente en los ácidos nucleicos, en nucleótidos señalizadores (AMPc) o portadores de energía (ATP) y en la cabeza polar de fosfolípidos de membrana. Además forma parte de los grupos fosfato, tan empleados en los mecanismos de regulación enzimática dirigidos por kinasas y fosforilasas. Estos grupos fosfato también constituyen un sistema muy empleado en la regulación de la acidez sanguínea. Tema 1 2
3 El sodio, el potasio y el cloro participan en el mantenimiento del grado de salinidad en las células. Además, sodio y potasio son fundamentales en la transmisión del impulso nervioso. El calcio forma estructuras esqueléticas y participa en muchas funciones como la contracción muscular, la coagulación sanguínea, El magnesio es un componente de muchas enzimas y de la clorofila Funciones de los oligoelementos Entre todos ellos destacaremos: Hierro: forma parte de la hemoglobina y la mioglobina, transportadora del oxígeno. También forma parte de los citocromos, que intervienen en la respiración celular. Cobre: forma parte de la hemocianina (pigmento respiratorio de artrópodos y moluscos) y también de muchas enzimas oxidativas. Cobalto: necesario para sintetizar la vitamina B 12 y otras enzimas. Yodo: forma parte de las hormonas tiroideas. Flúor: se encuentra en el esmalte de huesos y dientes. Zinc: clave para la acción de algunas proteínas Biomoléculas o principios inmediatos Los bioelementos se combinan entre sí para formar las moléculas constituyentes de la materia viva, que reciben el nombre de biomoléculas o principios inmediatos. Éstos los podemos dividir en: a. Simples: formados por la unión del mismo elemento (O 2, N 2, ). b. Compuestos: formados por la unión de átomos diferentes. Estas biomoléculas compuestas pueden dividirse en inorgánicas (agua y sales minerales) y orgánicas (glúcidos, lípidos, proteínas y ácidos nucleicos). 2. El agua Es el compuesto químico más importante de la materia viva. En general, la cantidad de agua en un ser vivo oscila en torno al 75 % en peso, pero esta cifra varía notablemente de unas especies a otras, y dentro de la misma especie varía en relación con la edad (mayor en individuos jóvenes) y en función del órgano que se considere (cerebro>pulmón>tejido óseo). El agua se encuentra en los seres vivos como agua circulante (sangre, savia, ), como agua intersticial (entre las células) y como agua intracelular (en el citosol y orgánulos celulares) Estructura de la molécula de agua El agua, a temperatura ambiente es líquida. Esto se debe a que la molécula de agua está formada por un átomo de oxígeno y dos átomos de hidrógeno, unidos por enlaces covalentes, y como la electronegatividad del oxígeno es mayor que la del hidrógeno, los pares de electrones compartidos se ven atraídos con más fuerza por el núcleo del oxígeno que por el del hidrógeno. Por otro lado, el hecho de que el oxígeno posea cuatro electrones más sin compartir produce la presencia de una carga negativa débil en la zona donde se sitúan los electrones no compartidos y que la molécula presente una geometría triangular, de tal manera que los átomos Tema 1 3
4 de hidrógeno forman respecto al oxígeno un ángulo de 104,5º. Esto provoca la aparición de cargas eléctricas opuestas, lo que confiere a la molécula un carácter dipolar. La polaridad favorece la interacción de las moléculas de agua, estableciéndose entre ellas un tipo de enlace denominado de hidrógeno que confiere al agua una gran cohesión, ya que cada molécula puede establecer cuatro enlaces de hidrógeno con otras moléculas de agua u otro tipo de moléculas polares como alcoholes, aminas, La estructura de la molécula de agua explica que sea líquida a temperatura ambiente y también explica sus propiedades físico-químicas y sus funciones biológicas Propiedades físico-químicas del agua a. Gran fuerza de cohesión. Se debe a la existencia de puentes de hidrógeno que unen entre sí las moléculas de agua. Ello provoca que el agua sea un líquido prácticamente incompresible, ideal para dar volumen a las células, provocar turgencia en las plantas y servir de esqueleto hidrostático en ciertos invertebrados como anélidos y celentéreos. El agua tiene también una elevada tensión superficial, es decir, su superficie opone una gran resistencia a romperse. b. Elevada fuerza de adhesión. La adherencia es la fuerza de atracción entre la superficie de cuerpos diferentes. Así, las moléculas de agua tienden a adherirse a las moléculas cargadas situadas en la superficie de un tubo; esto unido a la elevada fuerza de cohesión de la molécula de agua, permite los fenómenos de capilaridad, es decir, el ascenso de la savia bruta por los vasos leñosos del xilema. c. Elevado calor específico. Esto significa que aportando una gran cantidad de calor, la temperatura del agua sólo asciende ligeramente, debido a que buena parte de esta energía se utiliza para romper enlaces de hidrógeno. Así, el agua se convierte en un estabilizador térmico que impide cambios bruscos de temperatura. d. Elevado calor de vaporización. Es el calor necesario para que una sustancia pase a estado gaseoso. En el caso del agua, este calor es muy elevado ya que hay que romper enlaces de hidrógeno. Esta propiedad permite la refrigeración del organismo, ya que para evaporar el sudor (o para la transcripción en vegetales) hay que extraer calor del cuerpo. Por otro lado, el agua tiene alta conductividad, evitando la acumulación de calor en un determinado punto del cuerpo. e. Elevada constante dieléctrica. El agua está formada por moléculas bipolares capaces de disolver componentes iónicos, como las sales minerales, que se disocian en cationes y aniones, quedando éstos rodeados de moléculas de agua (solvatación). También disuelve compuestos covalentes polares, que contienen grupos ionizantes (alcoholes, aldehídos, cetonas, amino o carboxilo) que se rodean de moléculas de agua. No disuelve, pero sí dispersa, compuestos anfipáticos que contienen grupos hidrófobos e hidrófilos. Es el caso de los ácidos grasos con los que forman micelas. Esta propiedad del agua la convierte en un excelente vehículo de transporte de sustancias en los seres vivos y en el medio donde ocurren las reacciones bioquímicas. f. Baja densidad en estado sólido. La densidad del hielo es menor que la del agua líquida y por tanto flota sobre ella. Esto permite la vida en zonas frías ya que la costra de hielo que se forma sobre ríos y lagos permite que el agua bajo ella se mantenga en estado líquido, permitiendo la supervivencia de las especies. Tema 1 4
5 2. 3. Funciones biológicas del agua Las propiedades anteriores explican las funciones biológicas que desempeña el agua: a. Función de disolvente. El agua es el disolvente por excelencia. Todas las reacciones biológicas se producen en medio acuoso. b. Función bioquímica. El agua interviene en muchas reacciones químicas tales como la hidrólisis o el aporte de hidrógeno en la fotosíntesis. c. Función de transporte. El agua es el vehículo de transporte de sustancias de un lugar a otro del organismo. d. Función estructural. El agua da forma y volumen a las células, permite cambios y deformaciones en el citoplasma y el ascenso de la savia por los vasos conductores. e. Función mecánica. El agua da lugar a líquidos con la viscosidad adecuada para actuar de lubricantes y evitar movimientos bruscos en articulaciones. f. Función termorreguladora. El agua impide variaciones bruscas de temperatura que afecten a los organismos Ionización del agua: escala de ph. El agua pura se comporta como un electrolito débil y se encuentra en parte disociada en iones H + y OH - según la siguiente ecuación: H 2O H + + OH - En el agua la disociación es muy débil, esto significa que la mayor parte del agua se encuentra como H 2O sin disociar y solo una pequeña parte está disociada. El producto de las concentraciones de los iones H + y OH - es constante y se denomina producto iónico, en el agua a 25ºC es: [H + ].[OH - ] = En el agua pura por cada H+ que se forma, se forma un OH- lo que hace que la concentración de ambos iones sea la misma. [H + ] = [OH - ] = 10-7 Si aumenta la concentración de uno de los iones disminuye la del otro para mantener constante el producto. Hay sustancias que al disolverse en el agua, aumentan la concentración de hidrogeniones, se denominan ácidos. Otras por el contrario disminuyen la concentración de hidrogeniones se denominan bases. La acidez de una disolución viene determinada por la [H + ]. Sorensen ideo la escala de ph para expresar la concentración de hidrogeniones de una disolución y por lo tanto la acidez. El ph = - log [H + ]. El valor oscila 1 y 14. Si el ph de una disolución es 7, dicha disolución es neutra. H + = OH -. Si el ph es < 7,la disolución es ácida. H + > OH -. Si el ph es > 7, la disolución es básica. H + < OH -. Tema 1 5
6 La escala de ph es logarítmica, es decir que si aumenta o disminuye en una unidad significa que la concentración de H + se hará 10 veces menor o mayor Dispersiones acuosas. Los líquidos que están presentes en el interior del organismo constituyen el medio interno, en ellos tienen lugar las reacciones características de los procesos vitales. Estos líquidos son dispersiones. Las dispersiones son mezclas homogéneas de moléculas distintas. En ellas se diferencian dos partes: Fase dispersante o disolvente que es el componente que se encuentra en mayor cantidad, suele ser el agua (dispersiones acuosas) Fase dispersa o soluto es el componente que se encuentra en menor cantidad, pueden ser moléculas de diferentes tamaños, con distintos pesos moleculares. Las dispersiones atendiendo a como sean las moléculas de la fase dispersa pueden ser de dos tipos: Dispersiones moleculares o disoluciones verdaderas: cuando las moléculas de la fase dispersa tienen diámetros inferiores a 10-7 cm, son de pequeño peso molecular como sales, compuestos orgánicos sencillos como aminoácidos, monosacáridos etc. Son transparentes y no sedimentan. Dispersiones coloidales o coloides: cuando las moléculas de la fase dispersa tienen un diámetro que oscila entre 10-7 y 2x10-5 cm, tienen pesos moleculares elevados ( uma) como por ejemplo proteínas, ácidos nucleicos, polisacáridos etc. Son transparentes aunque al trasluz presentan turbidez (efecto Tyndall), no sedimentan pero las partículas precipitan por ultracentrifugación. Las dispersiones coloidales pueden presentarse en dos estados físicos: sol cuando tienen aspecto fluido y gel cuando tienen aspecto semisólido. El paso de sol a gel (gelificación) siempre es posible por variaciones de Tª, ph, etc no así el paso inverso. Esta particularidad es de gran valor biológico para que los líquidos orgánicos puedan adquirir determinadas cualidades en cuanto a viscosidad, elasticidad, resistencia,etc. Según el estado de la fase dispersa, existen 2 tipos de dispersiones coloidales: Suspensiones: cuando las partículas de la fase dispersa son son sólidas. Emulsiones: cuando las partículas de la fase dispersa son líquidas. Según la afinidad entre el agua (fase dispersante) y las partículas de la fase dispersa se diferencian dos tipos de dispersiones coloidales: Coloides hidrófilos: cuando las moléculas de la fase dispersa tienen afinidad por el agua. Son muy estables debido a que las moléculas de la fase dispersa se rodean de moléculas de agua, esto impide que puedan reaccionar unas con otras. Si se rompe esta capa de agua por alguna razón entonces las moléculas de la fase dispersa se unen entre si y precipitan. Si la precipitación es en forma de copos se denomina coagulación. Coloides hidrófobos: cuando las moléculas de la fase dispersa repelen el agua. Son inestables, las moléculas de la fase dispersa tienden a juntarse. Se pueden estabilizar Tema 1 6
7 cuando actúan sustancias que impiden esta unión. Ej. aceite en el agua forma emulsión inestable, se estabiliza por los jabones. 3. Las sales minerales Las sales minerales se encuentran en los seres vivos en tres formas: precipitadas, disueltas o asociadas a compuestos orgánicos Sales precipitadas Constituyen sustancias sólidas, insolubles, de función esquelética. Forman el endoesqueleto de vertebrados (fosfatos y carbonatos), de conchas de moluscos y de dientes (carbonatos), de espículas de esponjas (sílice y carbonatos), de caparazones de radiolarios y diatomeas, de estructuras de sostén de gramíneas y equisetos, Sales disueltas Aportan aniones (Cl -, SO 4 2-, PO 4 3-, CO 3 2-, HCO 3 - y NO 3- ) y cationes (Na +, K +, Mg 2+, Ca 2+ ). Las sales disueltas desempeñan, especialmente, tres funciones: regulación de procesos osmóticos, regulación del ph y acción específica de los cationes. En cuanto a la regulación de fenómenos osmóticos, las sales minerales mantienen el grado de salinidad del medio interno impidiendo que por ósmosis las células puedan verse en peligro. Así, los líquidos internos que rodean las células deber ser isotónicos respecto al contenido de sales del interior para evitar fenómenos de plasmólisis y turgencia. Por lo que respecta al ph, la adición de ácidos o bases a los líquidos biológicos produce alteraciones del ph debido a que estos líquidos contienen sales minerales que ionizan en mayor o menor medida dando H 3O + o OH - que contrarrestan el efecto de los ácidos o bases añadidos. Este fenómeno se llama efecto tampón. En el medio extracelular actúa el tampón bicarbonato y en el interno el tampón fosfato. Por lo que se refiere a la acción de los cationes, diremos que éstos son específicos y, a veces, antagónicos. A destacar en este sentido, la actuación del sodio, potasio y calcio. Cada uno de ellos paraliza el corazón, pero el sodio y el potasio lo hacen en diástole y el calcio en sístole. Por otro lado, el potasio aumenta la turgencia de la célula ya que favorece la captación de moléculas de agua, mientras que el calcio disminuye la turgencia de la célula porque dificulta esta captación. Además, sodio, potasio, cloro y calcio participan en la generación de gradientes electroquímicos imprescindibles para el mantenimiento del potencial de membrana y del potencial de acción en los procesos de sinapsis neuronal Sales minerales asociadas a sustancias orgánicas Es el caso de las fosfoproteínas, fosfolípidos, agar-agar, moléculas orgánicas que se verán más adelante Ósmosis y difusión. Cuando dos disoluciones acuosas de diferente concentración entran en contacto, las partículas de soluto tienden a dispersarse por el disolvente produciéndose lo que llamamos difusión y que podemos definir como el fenómeno físico por el que las partículas de soluto Tema 1 7
8 tienden a dispersarse de modo uniforme por el disolvente, hasta formar una disolución homogénea. Cuando entre las dos disoluciones de diferente concentración hay una membrana semipermeable, se produce la ósmosis que podemos definir como el paso del agua a través de una membrana semipermeable, desde la disolución más diluida a la más concentrada, para igualar las concentraciones. El agua ha de atravesar la membrana hacia la disolución más concentrada. La membrana semipermeable deja pasar el agua (disolvente) pero no el soluto. Las dos disoluciones ejercen sobre la membrana diferente presión. La diferencia entre las dos presiones es lo que llamamos presión osmótica (π) y sería la presión que habría que hacer para detener el flujo de agua a través de la membrana semipermeable debido a la ósmosis. A la disolución que tiene mayor concentración se la denomina hipertónica o hiperosmótica, mientras que a la más diluida se la llama hipotónica o hipoosmótica, si ambas tienen la misma concentración se denominan isotónicas o isoosmóticas. Las membranas celulares funcionan como membranas semipermeables, por ello es importante que las células estén en equilibrio osmótico con los líquidos extracelulares que las bañan. Si la célula se encuentra en un medio hipertónico respecto al medio intracelular, entonces pierde agua. Las células animales disminuyen su volumen, se arrugan y se deshidratan pudiendo llegar a morir. En las células vegetales la membrana se desprende de la pared lo que puede provocar la rotura de la célula. A este fenómeno se le llama plasmólisis. Si la célula se encuentra en un medio hipotónico respecto al medio intracelular, entonces entrara agua dentro de la misma, como consecuencia se hinchan aumentando el volumen y la presión interior, a este fenómeno se le denomina turgencia. En el caso de las células animales pueden llegar a estallar al no disponer de pared celular, a este hecho se le denomina hemólisis. En el caso de las células vegetales y bacterias no estallan debido a la pared celular. Si la célula se encuentra en un medio isotónico respecto al interior de la célula el agua entra y sale en igual cantidad. Una variante de la ósmosis es la diálisis, fenómeno físico en el que los poros de la membrana semipermeable tienen un tamaño bastante grande como para que la atraviesen además del agua pequeñas moléculas de soluto, desde la solución más concentrada hasta la más diluida Sistemas tampón o amortiguadores de ph. Los líquidos que forman el medio interno tienen un ph constante próximo a la neutralidad. Para que los procesos biológicos que tienen lugar en este medio interno se desarrollen con normalidad, es necesario que no se produzcan variaciones bruscas del ph. Tema 1 8
9 En los procesos metabólicos se están desprendiendo continuamente productos ácidos y básicos que varían el ph. Para evitar esto los seres vivos han desarrollado unos mecanismos químicos que tienen como función mantener constante el ph del medio interno. Estos mecanismos son las disoluciones amortiguadoras, reguladoras, tampón o buffer Estas soluciones están formadas por una mezcla de dos sustancias que actúan una como ácido y la otra como base y que se mantienen en equilibrio. Por lo general suelen ser un ácido débil y la sal de dicho ácido. El funcionamiento en esencia consiste en lo siguiente: AH A - + H + ácido base Si hay un aumento de H + en el medio disminuye el ph, el equilibrio se desplaza hacia la izquierda, actúa el componente básico de la reguladora que reacciona con ellos y se rebaja la concentración de H + y el ph aumenta. Si hay una disminución de H + aumenta el ph, el equilibrio se desplaza hacia la derecha, actúa el componente ácido de la reguladora y se liberan H + aumentando su concentración y disminuye el ph. Los amortiguadores más importantes en los seres vivos son: Sistema carbónico-ión bicarbonato: está presente en los líquidos extracelulares. Está formado por el par ión bicarbonato- ácido carbónico, que a su vez se disocia en dióxido de carbono y agua. H 2CO - 3 HCO 3 + H + ácido base o Si hay un exceso de H +, la reacción se desplaza hacia la izquierda, tiene lugar la siguiente reacción: HCO H + H 2CO 3 CO 2 + H 2O o Si hay un déficit de H +, la reacción se desplaza hacia la derecha, tiene lugar la siguiente reacción: H 2CO 3 H CO H + Sistema de los iones fosfato: está presente en los líquidos intracelulares. Está formado por los iones monohidrogenofosfato (base) y el ión dihidrogenofosfato (ácido). H 2PO HPO 4 + H + ácido base o Si hay un exceso de H +, tiene lugar la siguiente reacción: HPO H + H 2PO 4 - o Si hay un defecto de H + tiene lugar la siguiente reacción: H 2PO 4 - HPO H + Tema 1 9
10 EJERCICIOS Y CUESTIONES 1. Es correcto afirmar que la cantidad en la que se encuentra un elemento biogénico en el organismo refeja su importancia biológica? Pon un ejemplo que justifique la respuesta. 2. Cita cuatro peculiaridades del C y N que justifiquen por qué se encuentran entre os bioelementos cuantitativamente máis importantes de la materia viva. 3. De qué manera se poden encontrar las sales minerales en los seres vivos? Cuales son las funciones biológicas de las sales minerales en los organismos? 4. Importancia biológica de las sales minerales. Función específica de los iones: HCO 3 -, Ca +2, Na + y Fe Pon un ejemplo de una sal mineral disuelta y otra precipitada indicando la función de cada una de ellas. 6. Qué pasaría si colocamos en agua marina glóbulos rojos?: 7. Define el proceso de ósmosis. Por qué el agua de mar no calma la sed? Cuando se produce plasmolisis y turgencia? 8. Por qué una célula animal muere en un medio hipotónico y sin embargo una vegetal no? Da una explicación razonada 9. Define sistema tampón. Que pasaría si el medio interno de los seres vivos no fuera un sistema tampón? Como actúa el tampón bicarbonato frente a la bajada de ph? y frente a una subida? 10. Indica tres propiedades físico-químicas del agua y relaciónalas con su función biológica. 11. Por qué el agua es un dipolo? Señala alguna propiedad físico-química e indica las funciones biológicas que le permite realizar. 12. A qué se debe la polaridad de la molécula de agua? Qué tipo de enlace se establece entre estas moléculas? Qué propiedad del agua posibilita la vida en aguas heladas? 13. A auga atópase en estado líquido a temperatura ambiente e, sen embargo o metano (CH 4), coa mesma masa molecular (18), é un gas. A qué cres que é debido? 14. Algúns animais coma os zapateiros ou as chinches de río son capaces de moverse por riba da auga sen afundirse. Por qué é posible isto? 15. Pola elevada tensión superficial. A superficie opón unha gran resistencia a romperse. 16. Por qué as inxeccións intravenosas deben ter a mesma concentración salina co plasma sanguíneo? Qué pasaría se fosen máis diluídas?. 17. Por qué se utiliza o sal para conservar os alimentos? 18. Por qué cando se aliña a ensalada engádeselle o sal ó final? 19. Por qué un náufrago pode morrer deshidratado se está rodeado de auga? 20. Por qué a auga salgada non sacia a sede? 21. Cal é máis tenra: a carne de tenreira ou a de vaca? Por qué? 22. Por que o osíxeno permite obter tanta enerxía a partir da materia orgánica? 23. Por que hai bioelementos que son indispensables pese a haber so trazas deles? 24. Que pasaría si o medio interno dos organismos non fora unha disolución tampón? Como actúa o tampón bicarbonato fronte a unha subida e a unha baixada de ph? 25. Diferencias entre osmose e diálise. 26. Por que as follas de leituga se poñen turxentes cando se deixan en auga e logo ao aliñar a ensalada enrúganse? Tema 1 10
Los bioelementos se encuentran en los seres vivos formando parte de las moléculas, que pueden ser inorgánicas u orgánicas.
 BIOELEMENTOS: BIOMOLÉCULAS INORGÁNICAS: AGUA Y SALES MINERALES Los bioelementos se encuentran en los seres vivos formando parte de las moléculas, que pueden ser inorgánicas u orgánicas. Biomoléculas orgánicas:
BIOELEMENTOS: BIOMOLÉCULAS INORGÁNICAS: AGUA Y SALES MINERALES Los bioelementos se encuentran en los seres vivos formando parte de las moléculas, que pueden ser inorgánicas u orgánicas. Biomoléculas orgánicas:
COMUNIDAD VALENCIANA (VALENCIA) / JUNIO 99. COU / BIOLOGÍA / BIOMOLÉCULAS / OPCIÓN A / EJERCICIO 1
 COMUNIDAD VALENCIANA (VALENCIA) / JUNIO 99. COU / BIOLOGÍA / BIOMOLÉCULAS / OPCIÓN A / EJERCICIO 1 1.- Propiedades del agua e importancia biológica. El agua es un componente esencial de todo ser vivo,
COMUNIDAD VALENCIANA (VALENCIA) / JUNIO 99. COU / BIOLOGÍA / BIOMOLÉCULAS / OPCIÓN A / EJERCICIO 1 1.- Propiedades del agua e importancia biológica. El agua es un componente esencial de todo ser vivo,
EL AGUA Y LAS SALES MINERALES.
 EL AGUA Y LAS SALES MINERALES. 1. El agua de la materia viva El agua es un biomolécula inorgánica imprescindible para la vida. La cantidad de agua en los seres vivos oscila entre el 20 % (tejidos óseos)
EL AGUA Y LAS SALES MINERALES. 1. El agua de la materia viva El agua es un biomolécula inorgánica imprescindible para la vida. La cantidad de agua en los seres vivos oscila entre el 20 % (tejidos óseos)
Composición química de la materia viva. Biomoléculas inorgánicas
 Composición química de la materia viva. Biomoléculas inorgánicas Tema 1 Componentes inorgánicos. Agua: propiedades químicas y funciones biológicas. Sales minerales. Componentes orgánicos: Glúcidos, Lípidos,
Composición química de la materia viva. Biomoléculas inorgánicas Tema 1 Componentes inorgánicos. Agua: propiedades químicas y funciones biológicas. Sales minerales. Componentes orgánicos: Glúcidos, Lípidos,
BIOELEMENTOS Y BIOMOLÉCULAS
 BIOELEMENTOS Y BIOMOLÉCULAS 1. COMPOSICIÓN QUIMICA DE LOS SERES VIVOS La composición química de los seres vivos es diferente de la composición de la corteza terrestre. Después del oxígeno el elemento más
BIOELEMENTOS Y BIOMOLÉCULAS 1. COMPOSICIÓN QUIMICA DE LOS SERES VIVOS La composición química de los seres vivos es diferente de la composición de la corteza terrestre. Después del oxígeno el elemento más
BIOELEMENTOS AGUA Y SALES MINERALES
 BIOELEMENTOS AGUA Y SALES MINERALES BIOELEMENTOS PROPIEDADES Capas electrónicas externas incompletas ENLACES COVALENTES Nº atómico bajo ENLACES ESTABLES Oxígeno y Nitrógeno electronegativos BIOMOLÉCULAS
BIOELEMENTOS AGUA Y SALES MINERALES BIOELEMENTOS PROPIEDADES Capas electrónicas externas incompletas ENLACES COVALENTES Nº atómico bajo ENLACES ESTABLES Oxígeno y Nitrógeno electronegativos BIOMOLÉCULAS
BIOELEMENTOS AGUA Y SALES MINERALES
 BIOELEMENTOS AGUA Y SALES MINERALES BIOELEMENTOS PROPIEDADES Capas electrónicas externas incompletas ENLACES COVALENTES Nº atómico bajo ENLACES ESTABLES Oxígeno y Nitrógeno electronegativos BIOMOLÉCULAS
BIOELEMENTOS AGUA Y SALES MINERALES BIOELEMENTOS PROPIEDADES Capas electrónicas externas incompletas ENLACES COVALENTES Nº atómico bajo ENLACES ESTABLES Oxígeno y Nitrógeno electronegativos BIOMOLÉCULAS
I) Biomoléculas 3) El agua I-3 EL AGUA
 I-3 EL AGUA IMPORTANCIA DEL AGUA PARA LOS SERES VIVOS El agua es el líquido más abundante de la corteza y uno de los pocos líquidos naturales. No es de extrañar entonces que el agua sea una sustancia esencial
I-3 EL AGUA IMPORTANCIA DEL AGUA PARA LOS SERES VIVOS El agua es el líquido más abundante de la corteza y uno de los pocos líquidos naturales. No es de extrañar entonces que el agua sea una sustancia esencial
1.1. BIOLEMENTOS: Concepto: Son los elementos químicos que constituyen los seres vivos. Clasificación: * Primarios (~ 96%): C, H, O, N, P, S.
 1.1. BIOLEMENTOS: Concepto: Son los elementos químicos que constituyen los seres vivos. Clasificación: Biogénicos * Primarios (~ 96%): C, H, O, N, P, S. * Secundarios (~ 3,9%) :Na +, K +, Ca ++, Mg ++,
1.1. BIOLEMENTOS: Concepto: Son los elementos químicos que constituyen los seres vivos. Clasificación: Biogénicos * Primarios (~ 96%): C, H, O, N, P, S. * Secundarios (~ 3,9%) :Na +, K +, Ca ++, Mg ++,
COMPOSICIÓN QUÍMICA DE LA MATERIA VIVA
 COMPOSICIÓN QUÍMICA DE LA MATERIA VIVA ELEMENTOS QUÍMICOS: 110 BIOELEMENTOS ( Elementos biogénicos): 25-30 Forman parte de la materia viva, aunque no son exclusivos de ella No son los más abundantes, pero
COMPOSICIÓN QUÍMICA DE LA MATERIA VIVA ELEMENTOS QUÍMICOS: 110 BIOELEMENTOS ( Elementos biogénicos): 25-30 Forman parte de la materia viva, aunque no son exclusivos de ella No son los más abundantes, pero
La Bioquímica y los Bioelementos. 1.Los elementos de la vida 2.Las biomoléculas 3.El agua 4.Las sales minerales
 La Bioquímica y los Bioelementos 1.Los elementos de la vida 2.Las biomoléculas 3.El agua 4.Las sales minerales LOS ELEMENTOS DE LA VIDA Los ss.vv. (seres vivos) están constituidos por materia y, por
La Bioquímica y los Bioelementos 1.Los elementos de la vida 2.Las biomoléculas 3.El agua 4.Las sales minerales LOS ELEMENTOS DE LA VIDA Los ss.vv. (seres vivos) están constituidos por materia y, por
Base molecular de la vida. TEMA 6 LIBRO (Pág. 131)
 Base molecular de la vida TEMA 6 LIBRO (Pág. 131) GUIÓN TEMA Bioelementos Biomoléculas inorgánicas Agua Sales minerales Ósmosis Biomoléculas orgánicas Glúcidos Lípidos Proteínas Ácidos nucleicos Bioelementos
Base molecular de la vida TEMA 6 LIBRO (Pág. 131) GUIÓN TEMA Bioelementos Biomoléculas inorgánicas Agua Sales minerales Ósmosis Biomoléculas orgánicas Glúcidos Lípidos Proteínas Ácidos nucleicos Bioelementos
El agua y las sales minerales
 El agua y las sales minerales El agua El agua es la molécula más abundante de la materia viva La cantidad de agua en los seres vivos es variable Según el tipo de tejido: más agua cuanto más actividad metabólica
El agua y las sales minerales El agua El agua es la molécula más abundante de la materia viva La cantidad de agua en los seres vivos es variable Según el tipo de tejido: más agua cuanto más actividad metabólica
Importancia del Agua
 Tema El Agua Importancia del Agua El agua es la biomolécula más abundante en el ser humano. Constituye un 65-70% del peso del cuerpo, debiendose mantener alrededor de estos valores. De lo contrario, el
Tema El Agua Importancia del Agua El agua es la biomolécula más abundante en el ser humano. Constituye un 65-70% del peso del cuerpo, debiendose mantener alrededor de estos valores. De lo contrario, el
TEMA 1: LA NATURALEZA BÁSICA DE LA MATERIA QUÉ ELEMENTOS INTEGRAN LA MATERIA VIVA?
 TEMA 1: LA NATURALEZA BÁSICA DE LA MATERIA QUÉ ELEMENTOS INTEGRAN LA MATERIA VIVA? Concepto de Bioquímica Concepto de Bioelemento Los bioelementos, también conocidos como elementos biogénicos, son los
TEMA 1: LA NATURALEZA BÁSICA DE LA MATERIA QUÉ ELEMENTOS INTEGRAN LA MATERIA VIVA? Concepto de Bioquímica Concepto de Bioelemento Los bioelementos, también conocidos como elementos biogénicos, son los
BLOQUE I.- CUÁL ES LA COMPOSICIÓN DE LOS SERES VIVOS? LAS MOLÉCULAS DE LA VIDA
 BLOQUE I.- CUÁL ES LA COMPOSICIÓN DE LOS SERES VIVOS? LAS MOLÉCULAS DE LA VIDA UNIDAD DIDÁCTICA 1. Bioelementos y biomoléculas. Agua y sales minerales. Describir qué es la biología. Conocer las características
BLOQUE I.- CUÁL ES LA COMPOSICIÓN DE LOS SERES VIVOS? LAS MOLÉCULAS DE LA VIDA UNIDAD DIDÁCTICA 1. Bioelementos y biomoléculas. Agua y sales minerales. Describir qué es la biología. Conocer las características
EL AGUA Y LAS SALES MINERALES
 EL AGUA Y LAS SALES MINERALES 1. EL AGUA DE LA MATERIA VIVA El agua es la molécula más abundante de la materia viva La cantidad de agua en los seres vivos es variable Según el tipo de tejido: más agua
EL AGUA Y LAS SALES MINERALES 1. EL AGUA DE LA MATERIA VIVA El agua es la molécula más abundante de la materia viva La cantidad de agua en los seres vivos es variable Según el tipo de tejido: más agua
Tema 1. Base molecular de la vida. TEMA 6 LIBRO (Pág. 131)
 Tema 1. Base molecular de la vida TEMA 6 LIBRO (Pág. 131) GUIÓN TEMA Bioelementos Biomoléculas inorgánicas Agua Sales minerales Ósmosis Biomoléculas orgánicas Glúcidos Lípidos Proteínas Ácidos nucleicos
Tema 1. Base molecular de la vida TEMA 6 LIBRO (Pág. 131) GUIÓN TEMA Bioelementos Biomoléculas inorgánicas Agua Sales minerales Ósmosis Biomoléculas orgánicas Glúcidos Lípidos Proteínas Ácidos nucleicos
El agua. El agua es extraordinariamente abundante en la tierra y es indispensable para la vida.
 Sumario Las moléculas de los seres vivos: 1. El agua 2. El papel central del carbono 3. Moléculas orgánicas. Control de la actividad celular Fuente de energía para las células Proceso de fotosíntesis El
Sumario Las moléculas de los seres vivos: 1. El agua 2. El papel central del carbono 3. Moléculas orgánicas. Control de la actividad celular Fuente de energía para las células Proceso de fotosíntesis El
EL MANTENIMIENTO DE LA VIDA TEMA 1
 EL MANTENIMIENTO DE LA VIDA TEMA 1 INDICE 1. Seres vivos y funciones vitales 2. La composición química de los seres vivos 3. Las células 3.1 Conocimiento histórico de la célula 3.2 Cómo son las células?
EL MANTENIMIENTO DE LA VIDA TEMA 1 INDICE 1. Seres vivos y funciones vitales 2. La composición química de los seres vivos 3. Las células 3.1 Conocimiento histórico de la célula 3.2 Cómo son las células?
NUTRICIÓN Y ALIMENTACIÓN
 NUTRICIÓN Y ALIMENTACIÓN Los nutrientes son los diferentes compuestos químicos que contienen los alimentos y coinciden básicamente con nuestros componentes corporales INORGÁNICOS Y ORGÁNICOS COMPONENTES
NUTRICIÓN Y ALIMENTACIÓN Los nutrientes son los diferentes compuestos químicos que contienen los alimentos y coinciden básicamente con nuestros componentes corporales INORGÁNICOS Y ORGÁNICOS COMPONENTES
Tema 1. Introducción. Bioelementos y Biomoléculas Inorgánicas
 Tema 1. Introducción. Bioelementos y Biomoléculas Inorgánicas 1. Concepto de Biología: Es la ciencia que estudia todos los fenómenos y procesos relacionados con los seres vivos. 2. Características de los
Tema 1. Introducción. Bioelementos y Biomoléculas Inorgánicas 1. Concepto de Biología: Es la ciencia que estudia todos los fenómenos y procesos relacionados con los seres vivos. 2. Características de los
6.1. LAS CARACTERÍSTICAS DE LOS SERES VIVOS. Átomos y estructura atómica
 6.1. LAS CARACTERÍSTICAS DE LOS SERES VIVOS En este epígrafe se desarrollan las características que diferencian a los seres vivos. Una de ellas es la complejidad molecular, que se debe a la inmensa variedad
6.1. LAS CARACTERÍSTICAS DE LOS SERES VIVOS En este epígrafe se desarrollan las características que diferencian a los seres vivos. Una de ellas es la complejidad molecular, que se debe a la inmensa variedad
Tema 5: Propiedades de las sustancias en función n del tipo de enlace que poseen.
 Tema 5: Propiedades de las sustancias en función n del tipo de enlace que poseen. Relacionar las propiedades de las sustancias, con el tipo de enlace que tiene lugar entre los átomos que la constituyen,
Tema 5: Propiedades de las sustancias en función n del tipo de enlace que poseen. Relacionar las propiedades de las sustancias, con el tipo de enlace que tiene lugar entre los átomos que la constituyen,
UNIDAD 2_2 BIOELEMENTOS Y BIOMOLÉCULAS INORGÁNICAS: SALES MINERALES
 UNIDAD 2_2 BIOELEMENTOS Y BIOMOLÉCULAS INORGÁNICAS: SALES MINERALES Bloque 1. La base molecular y fisicoquímica de la vida. Contenidos Contenidos y criterios de evaluación Biología. 2.º Bachillerato 1.
UNIDAD 2_2 BIOELEMENTOS Y BIOMOLÉCULAS INORGÁNICAS: SALES MINERALES Bloque 1. La base molecular y fisicoquímica de la vida. Contenidos Contenidos y criterios de evaluación Biología. 2.º Bachillerato 1.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Septiembre,
Consecuencias de la disminución de la presión de vapor de una solución Disminuye la presión de vapor 2. Aumento del punto de ebullición de la solución
 Algunas propiedades físicas de las soluciones dependen de la cantidad de soluto no volátil disuelto, aunque no de su naturaleza A atm de presión, el agua pura congela a C y ebulle a C pero una disolución
Algunas propiedades físicas de las soluciones dependen de la cantidad de soluto no volátil disuelto, aunque no de su naturaleza A atm de presión, el agua pura congela a C y ebulle a C pero una disolución
PUNTO 1º - SERES VIVOS Y FUNCIONES VITALES
 PUNTO 1º - SERES VIVOS Y FUNCIONES VITALES Los seres vivos se diferencian de la materia inerte por: LAS FUNCIONES VITALES Nutrición, Relación y Reproducción. La nutrición incluye la alimentación, respiración
PUNTO 1º - SERES VIVOS Y FUNCIONES VITALES Los seres vivos se diferencian de la materia inerte por: LAS FUNCIONES VITALES Nutrición, Relación y Reproducción. La nutrición incluye la alimentación, respiración
Biomoléculas Orgánicas II
 Biomoléculas Orgánicas II INTRODUCCIÓN Tal como se vio en la clase anterior, los elementos químicos se organizan de tal forma que aumentan su complejidad y desarrollan funciones que son específicas. En
Biomoléculas Orgánicas II INTRODUCCIÓN Tal como se vio en la clase anterior, los elementos químicos se organizan de tal forma que aumentan su complejidad y desarrollan funciones que son específicas. En
TEMA 2: BIOELEMENTOS Y BIOMOLÉCULAS ORGÁNICAS.
 TEMA 2: BIOELEMENTOS Y BIOMOLÉCULAS ORGÁNICAS. 1.-BIOELEMENTOS. Los bioelementos son aquellos elementos químicos que constituyen la materia viva. No son de los más abundantes en la naturaleza (si exceptuamos
TEMA 2: BIOELEMENTOS Y BIOMOLÉCULAS ORGÁNICAS. 1.-BIOELEMENTOS. Los bioelementos son aquellos elementos químicos que constituyen la materia viva. No son de los más abundantes en la naturaleza (si exceptuamos
TEMA 1. LA MATERIA VIVA
 TEMA 1. LA MATERIA VIVA BIOELEMENTOS: Aquellos que forman las moléculas indispensables para la vida, también llamadas biomoléculas BIOELEMENTOS PRIMARIOS 96% de la materia viva Carbono (C) Hidrógeno (H)
TEMA 1. LA MATERIA VIVA BIOELEMENTOS: Aquellos que forman las moléculas indispensables para la vida, también llamadas biomoléculas BIOELEMENTOS PRIMARIOS 96% de la materia viva Carbono (C) Hidrógeno (H)
LOS NUTRIENTES MOLÉCULAS QUÍMICAS SENCILLAS QUE EL ORGANISMO EXTRAE DE LOS ALIMENTOS Y QUE UTILIZA PARA LLEVAR A CABO SUS FUNCIONES METABÓLICAS
 LOS NUTRIENTES MOLÉCULAS QUÍMICAS SENCILLAS QUE EL ORGANISMO EXTRAE DE LOS ALIMENTOS Y QUE UTILIZA PARA LLEVAR A CABO SUS FUNCIONES METABÓLICAS GLÚCIDOS TAMBIEN DENOMINADOS AZÚCARES E HIDRATOS DE CARBONO
LOS NUTRIENTES MOLÉCULAS QUÍMICAS SENCILLAS QUE EL ORGANISMO EXTRAE DE LOS ALIMENTOS Y QUE UTILIZA PARA LLEVAR A CABO SUS FUNCIONES METABÓLICAS GLÚCIDOS TAMBIEN DENOMINADOS AZÚCARES E HIDRATOS DE CARBONO
UD 1. LA MATERIA VIVA: BIOELEMENTOS Y BIOMOLÉCULAS. ANEXO: Tipos de enlaces y formas de representar las moléculas
 UD 1. LA MATERIA VIVA: BIOELEMENTOS Y BIOMOLÉCULAS. ANEXO: Tipos de enlaces y formas de representar las moléculas 1. BIOELEMENTOS O ELEMENTOS BIOGÉNICOS Son los elementos químicos que se encuentran en
UD 1. LA MATERIA VIVA: BIOELEMENTOS Y BIOMOLÉCULAS. ANEXO: Tipos de enlaces y formas de representar las moléculas 1. BIOELEMENTOS O ELEMENTOS BIOGÉNICOS Son los elementos químicos que se encuentran en
EL ENLACE QUÍMICO. La unión consiste en que uno o más electrones de valencia de algunos de los átomos se introduce en la esfera electrónica del otro.
 EL ENLACE QUÍMICO Electrones de valencia La unión entre los átomos se realiza mediante los electrones de la última capa exterior, que reciben el nombre de electrones de valencia. La unión consiste en que
EL ENLACE QUÍMICO Electrones de valencia La unión entre los átomos se realiza mediante los electrones de la última capa exterior, que reciben el nombre de electrones de valencia. La unión consiste en que
Cuando la sustancia que se difunde es el agua, y cuando la difusión se lleva a cabo a través de una membrana semi-permeable el proceso se llama
 OSMOSIS Cuando la sustancia que se difunde es el agua, y cuando la difusión se lleva a cabo a través de una membrana semi-permeable el proceso se llama ósmosis. También el movimiento del agua hacia abajo
OSMOSIS Cuando la sustancia que se difunde es el agua, y cuando la difusión se lleva a cabo a través de una membrana semi-permeable el proceso se llama ósmosis. También el movimiento del agua hacia abajo
Biología. 2º Bachillerato LAS MOLÉCULAS DE LA VIDA. Bioelementos y biomoléculas inorgánicas
 Biología 2º Bachillerato I. LAS MOLÉCULAS DE LA VIDA 1 Bioelementos y biomoléculas inorgánicas 1. Los elementos de la vida 2. Las biomoléculas 4. Las sales minerales 1. Los elementos de la vida Se denominan
Biología 2º Bachillerato I. LAS MOLÉCULAS DE LA VIDA 1 Bioelementos y biomoléculas inorgánicas 1. Los elementos de la vida 2. Las biomoléculas 4. Las sales minerales 1. Los elementos de la vida Se denominan
ejercicios propuestos
 INGRESO ESCUELA NAVAL MILITAR QUÍMICA ejercicios propuestos 1. El átomo está constituido principalmente por: a) Fotones, neutrones y protones. b) Protones, neutrones y electrones. c) Electrones, aniones
INGRESO ESCUELA NAVAL MILITAR QUÍMICA ejercicios propuestos 1. El átomo está constituido principalmente por: a) Fotones, neutrones y protones. b) Protones, neutrones y electrones. c) Electrones, aniones
BIOELEMENTOS Y BIOMOLÉCULAS BIOMOLÉCULAS INORGÁNICAS
 BIOELEMENTOS Y BIOMOLÉCULAS BIOMOLÉCULAS INORGÁNICAS 1. Bioelementos a. Bioelementos primarios b. Bioelementos secundarios c. Oligoelementos 2. Biomoléculas inorgánicas a. Agua i. Propiedades físicas y
BIOELEMENTOS Y BIOMOLÉCULAS BIOMOLÉCULAS INORGÁNICAS 1. Bioelementos a. Bioelementos primarios b. Bioelementos secundarios c. Oligoelementos 2. Biomoléculas inorgánicas a. Agua i. Propiedades físicas y
GLOSARIO Ácidos grasos Ácidos grasos esenciales Agua Aminoácidos Aminoácidos proteicos Azúcares simples
 GLOSARIO Ácidos grasos: Son la base estructural de las grasas. Existen dos tipos: Saturados: Son los sólidos a temperatura ambiente, como la carne animal. Insaturados: Son líquidos a temperatura ambiente,
GLOSARIO Ácidos grasos: Son la base estructural de las grasas. Existen dos tipos: Saturados: Son los sólidos a temperatura ambiente, como la carne animal. Insaturados: Son líquidos a temperatura ambiente,
Bioelementos y biomoléculas 1-Moleculas inorganicas Sales minerales. Verónica Pantoja. Lic. MSP.
 Bioelementos y biomoléculas 1-Moleculas inorganicas Sales minerales Professor: Kinesiologia Verónica Pantoja. Lic. MSP. 1.Precipitadas Formando estructuras sólidas, insolubles, con función esquelética.
Bioelementos y biomoléculas 1-Moleculas inorganicas Sales minerales Professor: Kinesiologia Verónica Pantoja. Lic. MSP. 1.Precipitadas Formando estructuras sólidas, insolubles, con función esquelética.
Prof. Jorge Luis Colmenares 2011-II
 Prof. Jorge Luis Colmenares 2011-II Ciclos BIOGEOQUIMICOS SON LOS MOVIMIENTOS DE CANTIDADES MASIVAS O NO, DE ELEMENTOS INORGÁNICOS ENTRE LOS COMPONENTES VIVIENTES Y NO VIVIENTES DEL AMBIENTE (ATMÓSFERA
Prof. Jorge Luis Colmenares 2011-II Ciclos BIOGEOQUIMICOS SON LOS MOVIMIENTOS DE CANTIDADES MASIVAS O NO, DE ELEMENTOS INORGÁNICOS ENTRE LOS COMPONENTES VIVIENTES Y NO VIVIENTES DEL AMBIENTE (ATMÓSFERA
Tema 3: Ecuaciones químicas y concentraciones
 Tema 3: Ecuaciones químicas y concentraciones Definición de disolución. Clases de disoluciones. Formas de expresar la concentración de una disolución. Proceso de dilución. Solubilidad. Diagramas de fases
Tema 3: Ecuaciones químicas y concentraciones Definición de disolución. Clases de disoluciones. Formas de expresar la concentración de una disolución. Proceso de dilución. Solubilidad. Diagramas de fases
FUERZAS INTERMOLECULARES
 DEPARTAMENTO DE CIENCIAS QUÍMICA - IB FUERZAS INTERMOLECULARES Existen fuerzas de atracción entre las moléculas (fuerzas intermoleculares). Ellas son las responsables de que los gases condensen (pasar
DEPARTAMENTO DE CIENCIAS QUÍMICA - IB FUERZAS INTERMOLECULARES Existen fuerzas de atracción entre las moléculas (fuerzas intermoleculares). Ellas son las responsables de que los gases condensen (pasar
PROPIEDADES PERIÓDICAS
 PROPIEDADES PERIÓDICAS Propiedades que influyen en el comportamiento químico 1) RADIO ATÓMICO : distancia media entre 2 núcleos de un elemento unidos por un enlace simple. X X r = ½ d Medidas atómicas
PROPIEDADES PERIÓDICAS Propiedades que influyen en el comportamiento químico 1) RADIO ATÓMICO : distancia media entre 2 núcleos de un elemento unidos por un enlace simple. X X r = ½ d Medidas atómicas
TEMA 1 LA COMPOSICIÓN DE LA MATERIA VIVA EL AGUA Y LAS SALES MINERALES
 TEMA 1 LA COMPOSICIÓN DE LA MATERIA VIVA EL AGUA Y LAS SALES MINERALES 1. LA BASE QUÍMICA DE LA VIDA: COMPONENTES ORGÁNICOS E INORGÁNICOS 1.1. Bioelementos: 1.1.1. Clasificación de los bioelementos 1.1.2.
TEMA 1 LA COMPOSICIÓN DE LA MATERIA VIVA EL AGUA Y LAS SALES MINERALES 1. LA BASE QUÍMICA DE LA VIDA: COMPONENTES ORGÁNICOS E INORGÁNICOS 1.1. Bioelementos: 1.1.1. Clasificación de los bioelementos 1.1.2.
BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA. Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas
 BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas A.- Los
BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas A.- Los
El enlace iónico. Los cationes y los aniones están unidos por la fuerza electroestática.
 El enlace iónico Los elementos con bajas energías de ionización tienden a formar cationes, en cambio los elementos con alta afinidad electrónicas tienden a formar aniones. Los metales alcalinos (IA) y
El enlace iónico Los elementos con bajas energías de ionización tienden a formar cationes, en cambio los elementos con alta afinidad electrónicas tienden a formar aniones. Los metales alcalinos (IA) y
LOS LÍMITES DE LA CÉLULA: LA MEMBRANA CELULAR
 LOS LÍMITES DE LA CÉLULA: LA MEMBRANA CELULAR La membrana celular o plasmática de fine los límites de la célula y mantiene las diferencias entre el exterior y el interior de la misma. A través de ella
LOS LÍMITES DE LA CÉLULA: LA MEMBRANA CELULAR La membrana celular o plasmática de fine los límites de la célula y mantiene las diferencias entre el exterior y el interior de la misma. A través de ella
Tema 1. Introducción
 Tema 1. Introducción - Bioquímica: concepto, y objetivos - Importancia de la Bioquímica en la Lic. De Farmacia - Composición química del cuerpo humano: Bioelementos Bioelementos primarios o principales
Tema 1. Introducción - Bioquímica: concepto, y objetivos - Importancia de la Bioquímica en la Lic. De Farmacia - Composición química del cuerpo humano: Bioelementos Bioelementos primarios o principales
GUÍA DE ESTUDIO EL AGUA. Área Biología
 GUÍA DE ESTUDIO EL AGUA Área Biología Resultados de aprendizaje Conocer las características y bases moleculares de los seres vivos. Conocer y determinar las principales características del agua y sus propiedades.
GUÍA DE ESTUDIO EL AGUA Área Biología Resultados de aprendizaje Conocer las características y bases moleculares de los seres vivos. Conocer y determinar las principales características del agua y sus propiedades.
TRANSPORTE EN MEMBRANA CELULAR
 TRANSPORTE EN MEMBRANA CELULAR TRANSPORTE MICROMOLECULAR Dos Tipos Difusión pasiva Transporte activo DIFUSIÓN PASIVA La difusión simple se puede realizar directamente con la doble capa de fosfolípidos
TRANSPORTE EN MEMBRANA CELULAR TRANSPORTE MICROMOLECULAR Dos Tipos Difusión pasiva Transporte activo DIFUSIÓN PASIVA La difusión simple se puede realizar directamente con la doble capa de fosfolípidos
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS
 UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
El agua posee una serie de propiedades características, derivadas de su estructura:
 1.2.- El Agua Es la sustancia más abundante en los seres vivos, ya que supone un 70% de su masa, ya sea en forma de agua intracelular o extracelular: espacios intersticiales, sangre o savia vegetal. La
1.2.- El Agua Es la sustancia más abundante en los seres vivos, ya que supone un 70% de su masa, ya sea en forma de agua intracelular o extracelular: espacios intersticiales, sangre o savia vegetal. La
Propiedades de las disoluciones
 Tema 1: Disoluciones Propiedades de las disoluciones Factor de van t Hoff (i) El factor de van t Hoff (i) indica la medida del grado de disociación o de ionización de un soluto en agua. El factor de van
Tema 1: Disoluciones Propiedades de las disoluciones Factor de van t Hoff (i) El factor de van t Hoff (i) indica la medida del grado de disociación o de ionización de un soluto en agua. El factor de van
Ejercicios de Enlace Químico
 Ejercicios de Enlace Químico 1) Utilizando la tabla periódica, indique cuál de los siguientes compuestos tiene mayor carácter iónico. a) LiF b) KF c) CsF d) CaF 2 e) BaF 2 2) Indique cuál(es) de la(s)
Ejercicios de Enlace Químico 1) Utilizando la tabla periódica, indique cuál de los siguientes compuestos tiene mayor carácter iónico. a) LiF b) KF c) CsF d) CaF 2 e) BaF 2 2) Indique cuál(es) de la(s)
Profesora: María Antonia Rojas Serrano
 Profesora: María Antonia Rojas Serrano Todo el Universo está formado por los mismos elementos químicos. Se denominan bioelementos a aquellos elementos que forman parte de los seres vivos. Atendiendo a
Profesora: María Antonia Rojas Serrano Todo el Universo está formado por los mismos elementos químicos. Se denominan bioelementos a aquellos elementos que forman parte de los seres vivos. Atendiendo a
Tendencias Periódicas- Problemas de Revisión
 Tendencias Periódicas- Problemas de Revisión PSI Química Nombre Tamaño atómico 1. Ordena los siguientes elementos según su tamaño atómico creciente: P, Cs, Sn, F, Sr, Tl 2. Ordena los siguientes elementos
Tendencias Periódicas- Problemas de Revisión PSI Química Nombre Tamaño atómico 1. Ordena los siguientes elementos según su tamaño atómico creciente: P, Cs, Sn, F, Sr, Tl 2. Ordena los siguientes elementos
REACCIONES EN QUÍMICA ORGÁNICA (II)
 (II) ALCOHOLES Y FENOLES Propiedades físicas de los alcoholes y fenoles El oxígeno es mucho más electronegativo que el carbono y que el hidrógeno por lo tanto, los alcoholes son compuestos polares. Cuando
(II) ALCOHOLES Y FENOLES Propiedades físicas de los alcoholes y fenoles El oxígeno es mucho más electronegativo que el carbono y que el hidrógeno por lo tanto, los alcoholes son compuestos polares. Cuando
Estructura atómica: tipos de enlaces
 Estructura atómica: tipos de enlaces Estructura de los átomos Modelo atómico de Bohr Masa (g) Carga (C) Protón 1.673 x 10-24 1.602 x 10-19 Neutrón 1.675 x 10-24 0 Electrón 9.109 x 10-28 1.602 x 10-19 Los
Estructura atómica: tipos de enlaces Estructura de los átomos Modelo atómico de Bohr Masa (g) Carga (C) Protón 1.673 x 10-24 1.602 x 10-19 Neutrón 1.675 x 10-24 0 Electrón 9.109 x 10-28 1.602 x 10-19 Los
PH y SISTEMAS TAMPÓN
 PH y SISTEMAS TAMPÓN DISOCIACIÓN DEL AGUA.- El agua se disocia de la manera siguiente: HOH H+ OH- El valor de Kéq. a 25ºC es muy pequeña, siendo del orden de 1 8 x 10(-16). Esto significa
PH y SISTEMAS TAMPÓN DISOCIACIÓN DEL AGUA.- El agua se disocia de la manera siguiente: HOH H+ OH- El valor de Kéq. a 25ºC es muy pequeña, siendo del orden de 1 8 x 10(-16). Esto significa
PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS
 PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS 1. De acuerdo a la posición de los elementos en la tabla periódica, cuál de los siguientes compuestos será el más iónico? a) NaCl b)
PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS 1. De acuerdo a la posición de los elementos en la tabla periódica, cuál de los siguientes compuestos será el más iónico? a) NaCl b)
Bioelementos, agua, sales minerales y biomoléculas (general)
 Año 2001 Cuando cogemos trozos de hojas de lechuga, los cubrimos con un paño húmedo y los guardamos en un frigorífico a 4ºC, permanecen turgentes durante mucho tiempo. Sin embargo, cuando aliñamos, con
Año 2001 Cuando cogemos trozos de hojas de lechuga, los cubrimos con un paño húmedo y los guardamos en un frigorífico a 4ºC, permanecen turgentes durante mucho tiempo. Sin embargo, cuando aliñamos, con
Definición Bronsted-Lowry
 TEMA 4.- Acidos y bases. Propiedades ácido-base de los compuestos orgánicos. Grupos funcionales con carácter ácido. Grupos funcionales con carácter básico. Fuerza de los ácidos. Fuerza de las bases. Acidez
TEMA 4.- Acidos y bases. Propiedades ácido-base de los compuestos orgánicos. Grupos funcionales con carácter ácido. Grupos funcionales con carácter básico. Fuerza de los ácidos. Fuerza de las bases. Acidez
COMPOSICIÓN DE LOS SERES VIVOS
 COMPOSICIÓN DE LOS SERES VIVOS SERES VIVOS: Un ser vivo es un organismo que nace, crece, se reproduce y muere. CONSTITUIDOS POR BIOELEMENTOS BIOMOLECULAS PRIMARIOS SECUNDARIOS ORGANICOS INORGANICOS CARBONO
COMPOSICIÓN DE LOS SERES VIVOS SERES VIVOS: Un ser vivo es un organismo que nace, crece, se reproduce y muere. CONSTITUIDOS POR BIOELEMENTOS BIOMOLECULAS PRIMARIOS SECUNDARIOS ORGANICOS INORGANICOS CARBONO
jueves, 18 de septiembre de 14
 BIOELEMENTOS Y BIOMOLÉCULAS BIOELEMENTO Elemento químico que constituye las moléculas de los seres vivos. Se dividen en : PRIMARIOS: C,H,O,N,P y S. Son los más abundantes (96,2%) SECUNDARIOS: Na+, K+,
BIOELEMENTOS Y BIOMOLÉCULAS BIOELEMENTO Elemento químico que constituye las moléculas de los seres vivos. Se dividen en : PRIMARIOS: C,H,O,N,P y S. Son los más abundantes (96,2%) SECUNDARIOS: Na+, K+,
TEMA 1: DEL ÁTOMO AL SER HUMANO
 TEMA 1: DEL ÁTOMO AL SER HUMANO Niveles de organización. Del átomo al organismo Los niveles de organización son los sucesivos grados de complejidad estructural en que se organiza la materia viva. Niveles
TEMA 1: DEL ÁTOMO AL SER HUMANO Niveles de organización. Del átomo al organismo Los niveles de organización son los sucesivos grados de complejidad estructural en que se organiza la materia viva. Niveles
Química general Primera Unidad: LA QUÍMICA UNA CIENCIA BÁSICA
 Química general Primera Unidad: LA QUÍMICA UNA CIENCIA BÁSICA Describe los fundamentos de la formación de enlace iónicos y covalentes y su relación con la polaridad de las moléculas resultantes. Mg. Emilio
Química general Primera Unidad: LA QUÍMICA UNA CIENCIA BÁSICA Describe los fundamentos de la formación de enlace iónicos y covalentes y su relación con la polaridad de las moléculas resultantes. Mg. Emilio
EQUILIBRIO ÁCIDO-BASE.
 EQUILIBRIO ÁCIDOBASE. 1. PROPIEDADES DE ÁCIDOS Y BASES. 2. TEORÍA DE ARRHENIUS. 3. TEORÍA DE BRONSTED Y LOWRY. 4. TEORÍA DE LEWIS. 5. FUERZAS DE ÁCIDOS Y BASES. CONSTANTES DE DISOCIACIÓN. 6. EQUILIBRIO
EQUILIBRIO ÁCIDOBASE. 1. PROPIEDADES DE ÁCIDOS Y BASES. 2. TEORÍA DE ARRHENIUS. 3. TEORÍA DE BRONSTED Y LOWRY. 4. TEORÍA DE LEWIS. 5. FUERZAS DE ÁCIDOS Y BASES. CONSTANTES DE DISOCIACIÓN. 6. EQUILIBRIO
NUTRICIÓN DE LAS PLANTAS
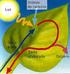 NUTRICIÓN DE LAS PLANTAS ABSORCIÓN EN LAS PLANTAS FOTOSÍNTESIS, generalidades Existen dos fases, en función de su dependencia de la luz: FASE LUMINOSA o dependiente de la luz: Ocurre en los tilacoides.
NUTRICIÓN DE LAS PLANTAS ABSORCIÓN EN LAS PLANTAS FOTOSÍNTESIS, generalidades Existen dos fases, en función de su dependencia de la luz: FASE LUMINOSA o dependiente de la luz: Ocurre en los tilacoides.
1. Importancia de la posición astronómica de la Tierra en la vida
 1. Importancia de la posición astronómica de la Tierra en la vida La coexistencia de las fases sólidas, líquidas y gaseosas del agua en la Tierra es tal vez vital para el origen y la evolución de la vida
1. Importancia de la posición astronómica de la Tierra en la vida La coexistencia de las fases sólidas, líquidas y gaseosas del agua en la Tierra es tal vez vital para el origen y la evolución de la vida
Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre. La hemoglobina aumenta la capacidad de la sangre para transportar oxígeno.
 Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre La sangre transporta los gases respiratorios por todo el organismo. El O2 se transporta desde los pulmones hasta todos los tejidos del
Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre La sangre transporta los gases respiratorios por todo el organismo. El O2 se transporta desde los pulmones hasta todos los tejidos del
Biología 2º Bachillerato
 II. ESTRUCTURA Y FUNCIÓN CELULAR 7 La envoltura celular 1. La membrana plasmática 2. Especializaciones de la membrana plasmática: uniones intercelulares 3. Transporte de pequeñas moléculas a través de
II. ESTRUCTURA Y FUNCIÓN CELULAR 7 La envoltura celular 1. La membrana plasmática 2. Especializaciones de la membrana plasmática: uniones intercelulares 3. Transporte de pequeñas moléculas a través de
EJERCICIOS DE SELECTIVIDAD 99/00
 EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
TEMA 1. BIOELEMENTOS Y BIOMOLÉCULAS
 TEMA 1. BIOELEMENTOS Y BIOMOLÉCULAS 1. EL ENLACE QUÍMICO EN LA MATERIA VIVA 2. LOS BIOELEMENTOS 3. LAS BIOMOLÉCULAS. BIOMOLÉCULAS INORGÁNICAS: 3.1. EL AGUA 3.2. LAS SALES MINERALES 4. LAS DISOLUCIONES
TEMA 1. BIOELEMENTOS Y BIOMOLÉCULAS 1. EL ENLACE QUÍMICO EN LA MATERIA VIVA 2. LOS BIOELEMENTOS 3. LAS BIOMOLÉCULAS. BIOMOLÉCULAS INORGÁNICAS: 3.1. EL AGUA 3.2. LAS SALES MINERALES 4. LAS DISOLUCIONES
LA NUTRICIÓN: OBTENCIÓN Y USO DE MATERIA Y ENERGÍA POR LOS SERES VIVOS
 LA NUTRICIÓN: OBTENCIÓN Y USO DE MATERIA Y ENERGÍA POR LOS SERES VIVOS Todos los seres vivos necesitan nutrientes para mantener sus funciones vitales y por lo tanto mantenerse con vida. Las células tienen
LA NUTRICIÓN: OBTENCIÓN Y USO DE MATERIA Y ENERGÍA POR LOS SERES VIVOS Todos los seres vivos necesitan nutrientes para mantener sus funciones vitales y por lo tanto mantenerse con vida. Las células tienen
Ácido: Especie que tiene tendencia a ceder un H + Base: Especie que tiene tendencia a aceptar un H +
 Reacciones ácido-base 1 Brønsted-Lowry (1923) Ácido: Especie que tiene tendencia a ceder un H + Base: Especie que tiene tendencia a aceptar un H + CH 3 COOH (aq) + H 2 O (l) H 3 O + (aq) + CH 3 COO (aq)
Reacciones ácido-base 1 Brønsted-Lowry (1923) Ácido: Especie que tiene tendencia a ceder un H + Base: Especie que tiene tendencia a aceptar un H + CH 3 COOH (aq) + H 2 O (l) H 3 O + (aq) + CH 3 COO (aq)
TEMA 6. La función de nutrición
 TEMA 6. La función de nutrición 1. El ser humano como animal pluricelular Los seres humanos, al igual que el resto de seres vivos, estamos formados por células. Las personas, al igual que los animales
TEMA 6. La función de nutrición 1. El ser humano como animal pluricelular Los seres humanos, al igual que el resto de seres vivos, estamos formados por células. Las personas, al igual que los animales
ÁCIDO-BASE. ÁCIDO: Sustancia que en disolución acuosa disocia cationes H +. BASE: Sustancia que en disolución acuosa disocia aniones OH.
 ÁCIDO-BASE Ácidos: 1. CARACTERÍSTICAS DE ÁCIDOS Y BASES. Tienen sabor agrio, son corrosivos para la piel, enrojecen ciertos colorantes, vegetales. Disuelven sustancias, atacan a los metales desprendiendo
ÁCIDO-BASE Ácidos: 1. CARACTERÍSTICAS DE ÁCIDOS Y BASES. Tienen sabor agrio, son corrosivos para la piel, enrojecen ciertos colorantes, vegetales. Disuelven sustancias, atacan a los metales desprendiendo
LOS CIMIENTOS DE LA VIDA: BIOELEMENTOS Y PRINCIPIOS QUÍMICOS BÁSICOS
 LOS CIMIENTOS DE LA VIDA: BIOELEMENTOS Y PRINCIPIOS QUÍMICOS BÁSICOS BIOELEMENTOS PRIMARIOS Y SECUNDARIOS. La materia viva está constituida por alrededor de setenta elementos químicos. Estos elementos
LOS CIMIENTOS DE LA VIDA: BIOELEMENTOS Y PRINCIPIOS QUÍMICOS BÁSICOS BIOELEMENTOS PRIMARIOS Y SECUNDARIOS. La materia viva está constituida por alrededor de setenta elementos químicos. Estos elementos
EL AGUA Y LAS SALES MINERALES.
 EL AGUA Y LAS SALES MINERALES. 1. La tabla periódica y los bioelementos: La vida es una forma de organización molecular propia de la naturaleza, capaz de establecer un soporte material de transferencia
EL AGUA Y LAS SALES MINERALES. 1. La tabla periódica y los bioelementos: La vida es una forma de organización molecular propia de la naturaleza, capaz de establecer un soporte material de transferencia
QUIMICA 1. Comisión B. Comisión B Lunes 10 am 1 pm Miércoles 12 am 2 pm
 Departamento de Ciencia y Tecnología Departamento de Ciencia y Tecnología QUIMICA 1 Comisión B QUIMICA 1 Comisión B Lunes 10 am 1 pm Miércoles 12 am 2 pm Dra. Silvia Alonso (salonso@unq.edu.ar) Lic. Evelina
Departamento de Ciencia y Tecnología Departamento de Ciencia y Tecnología QUIMICA 1 Comisión B QUIMICA 1 Comisión B Lunes 10 am 1 pm Miércoles 12 am 2 pm Dra. Silvia Alonso (salonso@unq.edu.ar) Lic. Evelina
Fuerzas Intermoleculares
 Fuerzas Intermoleculares Mapa conceptual Primer video http://www.youtube.com/watch?v=flxa79uiu5g Que son las fuerzas intermoleculares? Las fuerzas intermoleculares se definen como el conjunto de fuerzas
Fuerzas Intermoleculares Mapa conceptual Primer video http://www.youtube.com/watch?v=flxa79uiu5g Que son las fuerzas intermoleculares? Las fuerzas intermoleculares se definen como el conjunto de fuerzas
Estándar Anual. Ejercicios PSU. Ciencias Básicas Química. Guía práctica: El enlace químico GUICES004CB33-A16V1. Programa
 Programa Estándar Anual Nº Guía práctica: El enlace químico Ejercicios PSU 1. Con respecto al enlace químico, se afirma que A) el enlace iónico se establece entre elementos de electronegatividad similar.
Programa Estándar Anual Nº Guía práctica: El enlace químico Ejercicios PSU 1. Con respecto al enlace químico, se afirma que A) el enlace iónico se establece entre elementos de electronegatividad similar.
2.3.- Célula eucariótica. Componentes estructurales y funciones.
 2.3.- Célula eucariótica. Componentes estructurales y funciones. 2.3.1.- La Membrana Plasmática. La membrana plasmática es una estructura que rodea y limita completamente a la célula y constituye una barrera
2.3.- Célula eucariótica. Componentes estructurales y funciones. 2.3.1.- La Membrana Plasmática. La membrana plasmática es una estructura que rodea y limita completamente a la célula y constituye una barrera
LOS ALIMENTOS compuestos orgánicos Química Orgánica Química del Carbono Química Orgánica Química del Carbono alimentación
 LOS ALIMENTOS Los seres vivos están formados principalmente por C carbono, H hidrógeno, O oxígeno y N nitrógeno, y, en menor medida, contienen también S azufre y P fósforo junto con algunos halógenos y
LOS ALIMENTOS Los seres vivos están formados principalmente por C carbono, H hidrógeno, O oxígeno y N nitrógeno, y, en menor medida, contienen también S azufre y P fósforo junto con algunos halógenos y
TEMA Nº 1.- COMPONENTES DE LA MATERIA VIVA. AGUA Y SALES MINERALES
 Componentes de la materia viva. Agua y sales minerales 5 TEMA Nº 1.- COMPONENTES DE LA MATERIA VIVA. AGUA Y SALES MINERALES INTRODUCCIÓN Etimológicamente, el término biología proviene del griego (bios=vida,
Componentes de la materia viva. Agua y sales minerales 5 TEMA Nº 1.- COMPONENTES DE LA MATERIA VIVA. AGUA Y SALES MINERALES INTRODUCCIÓN Etimológicamente, el término biología proviene del griego (bios=vida,
FISIOLOGÍA LICENCIATURA EN ENFERMERÍA
 UNIDAD TEMÁTICA N 1: FISIOLOGÍA DE LOS LÍQUIDOS CORPORALES. MEDIO INTERNO. OBJETIVOS ESPECÍFICOS: Conocer y cuantifica la distribución del agua en el organismo y las concentraciones de los aniones, cationes,
UNIDAD TEMÁTICA N 1: FISIOLOGÍA DE LOS LÍQUIDOS CORPORALES. MEDIO INTERNO. OBJETIVOS ESPECÍFICOS: Conocer y cuantifica la distribución del agua en el organismo y las concentraciones de los aniones, cationes,
EL AGUA Y LAS SALES MINERALES
 EL AGUA Y LAS SALES MINERALES El agua es el componente molecular más abundante en los seres vivos. La cantidad varía con la edad de los animales: Por ejemplo en el embrión el porcentaje aproximado es del
EL AGUA Y LAS SALES MINERALES El agua es el componente molecular más abundante en los seres vivos. La cantidad varía con la edad de los animales: Por ejemplo en el embrión el porcentaje aproximado es del
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2013 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción B Reserva
Unidad 1: Nutrición y Salud. Para qué nos alimentamos? Profesora: Karen Cabrera
 Liceo Bicentenario Teresa Prats Departamento de química Unidad 1: Nutrición y Salud. Para qué nos alimentamos? Profesora: Karen Cabrera Qué sabemos de nuestra alimentación? Si tu cuerpo no recibe alguno
Liceo Bicentenario Teresa Prats Departamento de química Unidad 1: Nutrición y Salud. Para qué nos alimentamos? Profesora: Karen Cabrera Qué sabemos de nuestra alimentación? Si tu cuerpo no recibe alguno
INTRODUCCIÓN BLOQUE I: LAS FUNCIONES DE LOS SERES VIVOS
 Introducción bloque 1: Las funciones de los seres vivos página 1 INTRODUCCIÓN BLOQUE I: LAS FUNCIONES DE LOS SERES VIVOS I. QUÉ ES UN SER VIVO? Las características que comparten los seres vivos y que los
Introducción bloque 1: Las funciones de los seres vivos página 1 INTRODUCCIÓN BLOQUE I: LAS FUNCIONES DE LOS SERES VIVOS I. QUÉ ES UN SER VIVO? Las características que comparten los seres vivos y que los
Química de la Vida. Br. Ángel E. Hernández C.
 Química de la Vida Br. Ángel E. Hernández C. Conceptos básicos Bioquímica Biología Molecular Átomo Partículas subatómicas Molécula Polaridad Solubilidad Compuesto Orgánico Inorgánico Solución Mezcla Carga
Química de la Vida Br. Ángel E. Hernández C. Conceptos básicos Bioquímica Biología Molecular Átomo Partículas subatómicas Molécula Polaridad Solubilidad Compuesto Orgánico Inorgánico Solución Mezcla Carga
Reacciones en disolución acuosa
 Reacciones en disolución acuosa (no redox) Ramón L. Hernández-Castillo, Ph.D. Química 106 (laboratorio) Objetivos Reglas de Solubilidad en medio acuoso Reacciones típicas en medio acuoso (precipitación,
Reacciones en disolución acuosa (no redox) Ramón L. Hernández-Castillo, Ph.D. Química 106 (laboratorio) Objetivos Reglas de Solubilidad en medio acuoso Reacciones típicas en medio acuoso (precipitación,
ENLACE QUÍMICO. Química 2º bachillerato Enlace químico 1
 ENLACE QUÍMICO 1. El enlace químico. 2. El enlace covalente. 3. Geometría de las moléculas covalentes. 4. Polaridad de enlaces. 5. Teoría del enlace de valencia. 6. El orbital molecular. 7. Moléculas y
ENLACE QUÍMICO 1. El enlace químico. 2. El enlace covalente. 3. Geometría de las moléculas covalentes. 4. Polaridad de enlaces. 5. Teoría del enlace de valencia. 6. El orbital molecular. 7. Moléculas y
Tema 1 Introducción a la Ciencia de los Materiales.
 Tema 1 Introducción a la Ciencia de los Materiales. La Ciencia de los Materiales es la disciplina que se encarga de estudiar cómo están formados los materiales y cuáles son sus propiedades. El objetivo
Tema 1 Introducción a la Ciencia de los Materiales. La Ciencia de los Materiales es la disciplina que se encarga de estudiar cómo están formados los materiales y cuáles son sus propiedades. El objetivo
LA TABLA PERIÓDICA. 2ºbachillerato QUÍMICA
 LA TABLA PERIÓDICA 2ºbachillerato QUÍMICA 1 A lo lo largo de la la historia, los químicos han intentado ordenar los elementos de forma agrupada, de tal manera que aquellos que posean propiedades similares
LA TABLA PERIÓDICA 2ºbachillerato QUÍMICA 1 A lo lo largo de la la historia, los químicos han intentado ordenar los elementos de forma agrupada, de tal manera que aquellos que posean propiedades similares
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2010. Fase general OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
