EL AGUA EN LAS PLANTAS
|
|
|
- María Nieves Torres Camacho
- hace 7 años
- Vistas:
Transcripción
1 EL AGUA EN LAS PLANTAS Preparado por: José Régulo Cartagena V. Profesor Asociado La Fisiología Vegetal es en buena parte el estudio del agua. El agua es una de las más comunes y más importantes sustancias sobre la superficie de la tierra. Ella es esencial para la existencia de la vida, muchos organismos entre ellos los vegetales dependen para sobrevivir, más del agua disponible que de cualquier otro factor ambiental. El agua es la forma en la cual el átomo de H, elemento esencial de todas las moléculas orgánicas, es absorbido y, posteriormente, asimilado durante la fotosíntesis. Por lo tanto, ha de considerarse como un nutriente para la planta, de la misma manera que lo son el CO 2 o el NO 3 -. No obstante, la cantidad de agua que se requiere para el proceso fotosintético es pequeña y, sólo constituye, aproximadamente, un 0.01 por 100 de la cantidad total utilizada por la planta. La razón de esta baja utilización es que la mayoría de las funciones en las cuales participa son de naturaleza física. IMPORTANCIA ECOLÓGICA DEL AGUA La distribución de las plantas sobre la superficie de la tierra es principalmente controlada por el agua y la temperatura, y donde esta última lo permite, las plantas crecen dependiendo de la cantidad y distribución de la precipitación. Así, donde las lluvias son abundantes y constantes se aprecia una vegetación exuberante como en el Chocó; lugares con variaciones fuertes, similares al clima Mediterráneo, caracterizado por días calientes y noches frías, resultan ser adecuados para el cultivo de la caña de azúcar y frutales; por ejemplo, el Valle del Cauca; aquello sitios dónde las épocas de verano son muy largas, se aprecia un notable desarrollo de los, pastos y praderas como sucede en los llanos orientales y el Tolima, finalmente donde no llueve, son comunes los paisajes desérticos, como se aprecian en la Guajira y el Norte del Huila. En contraste donde el suelo tiene mal drenaje, lo que provoca una más o menos permanente saturación del suelo, se aprecia la vegetación propia de los pantanos, esto es corriente en los humedales existentes en la Sabana de Bogotá.
2 IMPORTANCIA FISIOLÓGICA DEL AGUA La importancia ecológica del agua es el resultado de su importancia fisiológica. La única manera en la cual un factor ambiental, como el agua, puede afectar el crecimiento de las plantas, es a través de su influencia sobre los procesos fisiológicos. Casi todos los procesos en la planta son afectados directa o indirectamente por el suministro de agua. Por ejemplo, la respiración de las semillas en formación, es inicialmente muy alta, pero esta se reduce rápidamente durante la maduración. En semillas secas al aire, la respiración es muy baja, pero esta se incrementa lentamente en la medida que se aumenta el contenido del agua, hasta un punto crítico, en el cual hay un rápido incremento en la respiración, como respuesta a un aumento adicional del contenido del agua. El crecimiento de las planta es controlado por la velocidad en la división y elongación celular y por el suministro de compuestos: orgánicos e inorgánicos requeridos para la síntesis de nuevo protoplasma y pared celular. El crecimiento de la célula es particularmente dependiente de al menos un mínimo grado del turgor de la célula, la elongación del tallo y las hojas son rápidamente reducidas o detenidas por déficit de agua. Una reducción en el contenido de agua inhibe la fotosíntesis y generalmente disminuye la velocidad de respiración y otros procesos donde hay la intervención de las enzimas. En resumen, la reducción en el contenido de agua es acompañado por la pérdida de turgencia y marchitamiento, cesación del ensanchamiento celular, cierre de los estomas, reducción de la fotosíntesis, y la interferencia con muchos otros procesos metabólicos. Eventualmente, una continúa deshidratación causa desorganización en el protoplasma y la muerte de la planta. FUNCIONES DEL AGUA EN LA PLANTA La importancia del agua en muchas actividades fisiológicas puede resumirse en cuatro funciones principales. 1. CONSTITUYENTE. El agua es importante cuantitativamente ella constituye el % del peso fresco de muchas plantas herbáceas y más del 50% del peso fresco de las plantas leñosas. El agua es parte importante del protoplasma, como también de las proteínas y moléculas de lípidos; una reducción en el contenido de agua en estos componentes de la célula, por debajo de un nivel crítico causa cambios en la estructura celular y finalmente la muerte.
3 Unas pocas plantas y órganos de plantas pueden ser deshidratadas en condiciones de temperatura ambiental o aún en estufa, como es el caso de algunas semillas, sin perder su viabilidad, pero tienen una marcada reducción en su actividad fisiológica, siempre acompañada por una disminución en el contenido en los tejidos. 2. SOLVENTE El agua es un solvente en el cual gases, minerales y otros solutos entran a las células de las plantas y se mueven de célula a célula y de órgano a órgano. La relativa alta permeabilidad de la pared celular y las membranas del protoplasma permiten la formación de una fase líquida, que se extiende a través de la planta, sirviendo de medio para que ocurra la translocación de los elementos disueltos. 3. REACTANTE El agua es un reactante o sustrato para muchos procesos importantes, como la fotosíntesis y otros hídricos como la hidrólisis del almidón a azúcar en la germinación de semillas. 4. MANTENIMIENTO DE LA TURGENCIA La turgencia es esencial para el crecimiento y alargamiento de la célula, para el crecimiento y mantenimiento de la forma en las plantas herbáceas. La turgencia también es importante para la apertura de los estomas, el, movimiento de las hojas, de los pétalos y otras estructuras especializadas. La incapacidad para mantener la turgencia resulta en una inmediata reducción en el crecimiento. PROPIEDADES DEL AGUA La importancia del agua en los organismos vivos resulta de sus exclusivas propiedades físicas y químicas. Una sustancia con el peso molecular del agua debería existir a temperatura de salón en forma de gas y tener un punto de congelación a -100 C. Sin embargo el agua a temperatura de salón es líquida y su punto de congelación es O C. Tiene el más alto calor específico de cualquier sustancia conocida, excepto el amonio líquido, el cual es un 13% más alto. (La cantidad de energía necesaria para elevar en 1 C la temperatura de una sustancia equivalente a 1 gramo es su calor específico). Para el agua es casi 1 caloría, equivalente a joules. El alto calor específico del agua sirve para estabilizar la temperatura, esto se aprecia en la temperatura relativamente uniforme de islas y tierras cercanas a grandes cuerpos de agua. Esto es importante para las plantas.
4 El calor latente de vapor es el más alto conocido, 540 cal /g a 100 C. el calor de fusión, 80 cal/g, es también inusualmente alto. Debido a esto, la evaporación del agua tiene un pronunciado efecto refrigerante y la condensación un efecto calentador. También tiene un alto calor de fusión, para fundir un gramo de hielo a 0 C, deben aplicarse 335 j (80 cal/g). El agua es extremadamente buen conductor de calor comparado con otros líquidos y sólidos no metálicos, aunque es pobre comparado con los metales. El agua es transparente a la radiación visible ( nm). Esto le permite a la luz penetrar cuerpos de agua y hace posible que las algas hagan fotosíntesis y crezcan a profundidades considerables. El agua tiene una más alta tensión superficial que otros líquidos, debido a las altas fuerzas cohesivas entre las moléculas. (Cohesión, es la atracción entre moléculas semejantes - Adhesión, atracción entre moléculas distintas). Esto hace que pueda soportar hasta 1000 atmósferas de tensión, sin que las moléculas se rompan. Propiedad que sirve para respaldar la teoría de la cohesión que explica el ascenso del agua en los árboles de gran altura. El agua también es de alta densidad y es destacable que su máxima densidad es a 4 C en vez de ser a 0 C. Pero es más sobresaliente el hecho de que el agua se expanda al congelarse, de manera que el hielo tiene un volumen 9% mayor que la forma líquida de donde se formó. Las moléculas se empacan mejor sólidas. Esto explica por que el hielo flota y las latas de cerveza estallan cuando se dejan en el congelador. El agua tiene una de las constantes dieléctricas más altas que se conocen (78.54). Una sustancia no polar tiene una constante dieléctrica de Este parámetro es una medida de la capacidad de neutralizar la atracción entre cargas eléctricas. Debido a esto el agua se comporta como casi un solvente universal, especialmente para electrolitos y moléculas polares, como los azucares. La porción (+) de la molécula es atraída hacia la superficie (-) y viceversa, lo cual resulta en que cada ión es rodeado por un escudo de moléculas de agua, que mantienen los iones de carga opuesta separados. También es un buen solvente para muchos no electrolitos, por que puede formar uniones de H con el N en grupos amino y O en grupos de carbono. Esto le permite ser absorbida o unida fuertemente a la superficie de las micelas de arcilla, celulosa, proteínas y muchas otras sustancias. Esta característica es de mucha importancia para la relación entre agua suelo y planta. Posee además un coeficiente de viscosidad (resistencia a fluir) muy bajo, a 20 C es de centipoises, mientras que a 19 C en el aceite industrial es de 120 centipoises. La viscosidad del agua decrece de manera notable al aumentar la temperatura, pero esto no tiene mucha importancia en la fisiología de la planta.
5 EXPLICACIÓN A LAS PROPIEDADES EXCLUSIVAS DEL AGUA Gran parte de las propiedades del agua se deben a que los segmentos lineales que conectan los centros de los átomos de hidrógeno con el centro del átomo de oxigeno, no están en línea recta, sino que forman un ángulo de 104,5. Los electrones que forman cada enlace covalente entre los átomos de hidrógeno y el de oxigeno, están más cerca del núcleo del oxigeno, dejando a los dos núcleos de hidrógeno (protones) con sus cargas positivas sobre la superficie del átomo de oxigeno que tiene carga negativa. Una molécula así dispuesta es polar. El resultado es que el lado positivo de la molécula de agua es atraída por el lado negativo de la otra, formado un enlace entre las dos moléculas. A este enlace se le conoce como puente de hidrógeno. La energía de estos enlaces varia entre 8 y 42 kilojoules/mol (kj mol -1 ). Cada molécula de agua es donante de dos H otras dos moléculas de agua y a la vez es receptora de otros dos H Esto quiere decir que cada molécula de agua es capaz de hacer cuatro puentes de hidrógeno. Los puentes de hidrógeno juegan un papel muy importante en propiedades del agua, como el calor latente de vaporización, el calor latente de fusión y la viscosidad. Otro factor que contribuye a la atracción entre las moléculas son las llamadas fuerzas de van der Waals, que se caracterizan por ser muy débiles. Su energía no es mayor a 4,2 kj mol -1. En moléculas neutras no polares, estas fuerzas resultan del hecho de que los electrones (-), están en continúo movimiento de manera que el centro de la molécula para las cargas negativas no siempre corresponde al centro para las cargas positivas. De esta manera cuando dos moléculas semejantes se aproximan lo suficiente entre sí pueden inducirse mutuamente ligeras polarizaciones, por lo que las regiones con cargas distintas se atraen. Estas fuerzas mantienen juntas a las moléculas en los hidrocarburos, pero también se dan en membranas y partes internas de proteínas. Hecha esta discusión sobre agua, sus funciones y propiedades, ahora se tratará de entender como el agua y otras sustancias entran y salen de la célula. FLUJO MASIVO Y DIFUSIÓN Los fluidos son sustancias líquidas o gaseosas que fluyen o se ajustan a la forma del recipiente que los contiene. Cuando el flujo ocurre en respuesta a diferencias en la presión e implica átomos o moléculas que se mueven simultáneamente, se le llama flujo masivo. Las diferencias de presión se pueden deber a la gravedad, o a fuerzas mecánicas. En los vegetales los fluidos se desplazan por los tejidos vasculares por flujo masivo, en respuesta a diferencias en presión que se crean por difusión.
6 Difusión es el movimiento de las moléculas entre dos puntos en respuesta a las diferencias de concentración en las sustancias. La velocidad de difusión es proporcional a la energía cinética de las moléculas (su temperatura), su tamaño (la velocidad de difusión es proporcional a la raíz cuadrada del peso molecular), la densidad del medio que atraviesan y el gradiente de concentración sobre el cual se difunden. Cuando ocurre la distribución uniforme de las moléculas, se establece un equilibrio dinámico y cesa su movimiento neto (aunque existe continuo movimiento o difusión de moléculas dentro del sistema en equilibrio). La difusión ocurre en respuesta a un gradiente de concentración. La concentración es la cantidad de sustancia o número de partículas por unidad de volumen. Se produce un gradiente cuando la concentración cambia de manera gradual de un volumen de espacio a otro. Visto así es muy sencillo. Pero para entenderlo mejor, es necesario revisar los conceptos de TERMODINÁMICA. Los principios de termodinámica, inicialmente desarrollados para entender el calor y las máquinas, son ahora aplicados a todas las formas de energía. Primera ley de la termodinámica. En todos los cambios físicos (la difusión es un proceso físico) y químicos, la energía no se crea ni se destruye, solo se transforma. En un proceso como la difusión, la transformación ocurrirá de manera espontánea, si el estado final tiene menor nivel de energía que el inicial. La termodinámica del equilibrio informa sobre el nivel de energía en un estado inicial (antes) y el nivel de energía en un estado final (después). Una medida de energía asociada a un estado en particular (inicial, antes de o final, después de ocurrido el proceso), se conoce como entalpía (H). Donde: E = energía interna P = presión V = volumen H=E+PV La energía interna existe en dos formas potencial y cinética. La organización de estas formas de energía puede conducir a producir trabajo. Las diferencias en entalpía ( H) pueden cuantificarse, si se mide el calor liberado o ganado por el sistema al moverse de un estado a otro. Los procesos que liberan calor son exotérmicos y tienen un (- H), pero si obtienen calor se llaman endotérmicos ( H).
7 Los procesos con (- H) son espontáneos ya que van de un estado energético mayor a uno menor. Como no es posible cuantificar la energía interna total o absoluta de un sistema, debe haber algo más que contribuya al estado energético total del sistema, esto es la entropía Segunda ley de la Termodinámica. Cualquier sistema más sus alrededores, tiende en forma espontánea a un mayor desorden. La medida de ese desorden se llama entropía (S). La entropía aplica muy bien en el proceso de difusión y se considera que un sistema alcanza su equilibrio, cuando logra su máximo desorden. Gibbs tomó los dos elementos que se derivan de las leyes de termodinámica (entalpía y entropía), y desarrolló el concepto de energía libre que se expresa con la fórmula: Donde: G = energía libre H = entalpía S = entropía T = temperatura en Kelvin G = H-TS La energía libre se define como la energía disponible (sin cambio de temperatura) para producir trabajo. A partir de esa apreciación se establece que el potencial químico de una sustancia bajo cualquier condición (esto es, pura, en solución o como integrante de un sistema complejo), es la energía libre por mol de esa sustancia. A mayor energía libre/mol, mayor potencial químico. Para el agua por ser la sustancia más común e importante sobre la tierra, se ha establecido que su potencial equivale a su potencial químico y es una medida de la energía disponible para reaccionar con otras sustancias o para moverse: El agua circula entre dos puntos siempre que su potencial termodinámico no sea idéntico entre dichos puntos. El potencial hídrico, ψ, utilizado en fisiología se deriva de esta magnitud. Constituye la resultante de fuerzas de origenes diversos (osmótica, capilar, de imbibición, turgencia, etc.) que liga el agua al suelo o a diferentes tejidos del vegetal. El potencial hídrico corresponde desde el punto de vista energético al trabajo que habría que suministrar a una unidad de masa de agua ligada al suelo, o a los tejidos de una planta para llevarla de este estado de unión a un estado de referencia, correspondiente al del agua pura (a menudo denominada libre por oposición a la ligada) a la misma temperatura y a la presión atmosférica. El potencial hídrico para el agua pura o libre es 0, todos los ψ que caracterizan el agua ligada son negativos, puesto que sería necesario suministrar trabajo para llevar esta agua a un ψ = 0.
8 El agua como todas las sustancias, se mueve a favor de un gradiente de energía, cediéndola a medida que se mueve. Mientras que la energía pueda perderse, como resultado del movimiento del agua, este continuará. El equilibrio se alcanzará solo cuando ya no ocurran circunstancias que propicien pérdida de energía. En un sistema particular, el potencial hídrico total es la suma algebraica de varios componentes: ψ = ψ p + ψ s + ψ m + ψ g siendo ψ p, ψ s, ψ m, ψ g respectivamente, componentes debidos a fuerzas de presión, osmótica, mátrica y gravitacional. El componente de presión (ψ p ) representa la diferencia en presión hidrostática con la referencia y puede ser positivo o negativo. El componente osmótico (ψ s ) es consecuencia de los solutos disueltos, disminuye la energía libre del agua y es siempre negativo. El potencial mátrico (ψ m ) es similar al ψ s excepto que la reducción en la actividad del agua es consecuencia de fuerzas en las superficies de los sólidos. La distinción entre ψ p y el ψ m es, hasta cierto punto, arbitraria puesto que, frecuentemente es difícil decidir si las partículas son solutos o sólidos. El componente gravitacional (ψ g ) es consecuencia de diferencias en energía potencial debidas a diferencia de altura con el nivel de referencia, siendo positivo si es superior al de referencia y negativo cuando es inferior. El potencial hídrico de un sistema expresa esta capacidad de realizar trabajo. Este puede ser negativo, cero o positivo, debido a que la presión puede ser positiva y muy elevada, en tanto que el ψ s puede ser cero o negativo. A medida que aumenta la presión sobre la solución, también aumenta la capacidad del solvente par realizar trabajo y por lo tanto el potencial de agua de la solución. El potencial hídrico se expresa en atmósferas, bars, pascales (Pa) o megapascales (MPA). 1 bar l0 MPa. BIBLIOGRAFIA AZCON J. y M. TALON Fisiología y bioquímica vegetal, interamericana - MacGrawilill. Madrid. 581 p. BIDWELL, R.G.S Fisiología vegetal. AGT Editor. México, D. F. p63. KRAMER, P.J. and J. S. BOOYER Water relations of plants and soils. Academic press. NewYork,N. Y. 482p.
9 SALISBURY, E. y C. ROSS Fisiología vegetal. Grupo Editorial Iberoamérica. México, D. F. p
RELACIONES HÍDRICAS. ECONOMÍA DEL AGUA.
 Relaciones hídricas RELACIONES HÍDRICAS. ECONOMÍA DEL AGUA. Generalidades. Energía Libre. Potencial Químico. Potencial agua. Factores que lo afectan. El agua en la célula. Componentes. Relación suelo-planta-atmósfera.
Relaciones hídricas RELACIONES HÍDRICAS. ECONOMÍA DEL AGUA. Generalidades. Energía Libre. Potencial Químico. Potencial agua. Factores que lo afectan. El agua en la célula. Componentes. Relación suelo-planta-atmósfera.
4/7/2011. Relación Suelo Planta Atmosfera Capitulo 5. Agua en el sistema suelo-planta. Importancia del agua para las plantas
 Relación Suelo Planta Atmosfera Capitulo 5 Agua en el sistema suelo-planta Importancia del agua para las plantas Por cada gramo de materia seca, las raíces absorben aprox. 500 g de agua. El agua es transportada
Relación Suelo Planta Atmosfera Capitulo 5 Agua en el sistema suelo-planta Importancia del agua para las plantas Por cada gramo de materia seca, las raíces absorben aprox. 500 g de agua. El agua es transportada
RELACIONES HIDRICAS. Sistema radicular y absorción de agua Transpiración y ascenso de agua Movimientos estomáticos
 RELACIONES HIDRICAS Importancia del agua Propiedades del agua Procesos del transporte Relaciones hídricas celulares Relaciones hídricas en planta Sistema radicular y absorción de agua Transpiración y ascenso
RELACIONES HIDRICAS Importancia del agua Propiedades del agua Procesos del transporte Relaciones hídricas celulares Relaciones hídricas en planta Sistema radicular y absorción de agua Transpiración y ascenso
Estructura del agua y sus propiedades La estructura molecular del agua está formada por un átomo de oxígeno y dos átomos de hidrógeno, enlazados
 Estructura del agua y sus propiedades La estructura molecular del agua está formada por un átomo de oxígeno y dos átomos de hidrógeno, enlazados químicamente mediante enlaces polares covalentes. Los ángulos
Estructura del agua y sus propiedades La estructura molecular del agua está formada por un átomo de oxígeno y dos átomos de hidrógeno, enlazados químicamente mediante enlaces polares covalentes. Los ángulos
Nombre Periodo Fecha. CONCEPTO CLAVE Todos los seres vivos tienen como base los átomos y sus interacciones.
 Sección 1: Los átomos, los iones y las moléculas CONCEPTO CLAVE Todos los seres vivos tienen como base los átomos y sus interacciones. VOCABULARIO átomo ión molécula elemento compuesto enlace iónico enlace
Sección 1: Los átomos, los iones y las moléculas CONCEPTO CLAVE Todos los seres vivos tienen como base los átomos y sus interacciones. VOCABULARIO átomo ión molécula elemento compuesto enlace iónico enlace
El agua y las sales minerales
 El agua y las sales minerales El agua El agua es la molécula más abundante de la materia viva La cantidad de agua en los seres vivos es variable Según el tipo de tejido: más agua cuanto más actividad metabólica
El agua y las sales minerales El agua El agua es la molécula más abundante de la materia viva La cantidad de agua en los seres vivos es variable Según el tipo de tejido: más agua cuanto más actividad metabólica
LA NUTRICIÓN EN LAS PLANTAS
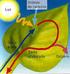 LA NUTRICIÓN EN LAS PLANTAS LOS SERES VIVOS COMO SISTEMAS LA NUTRICIÓN COMO INTERCAMBIO DE MATERIA Y ENERGÍA LOS ORGANISMOS SEGÚN LA FORMA DE OBTENER LA ENERGÍA PROCESOS EN LA NUTRICIÓN EN LAS PLANTAS
LA NUTRICIÓN EN LAS PLANTAS LOS SERES VIVOS COMO SISTEMAS LA NUTRICIÓN COMO INTERCAMBIO DE MATERIA Y ENERGÍA LOS ORGANISMOS SEGÚN LA FORMA DE OBTENER LA ENERGÍA PROCESOS EN LA NUTRICIÓN EN LAS PLANTAS
Página 1 de Período en el cual ocurre la mayor actividad enzimática: a) Profase b) Metafase c) Anafase d) Interfase Respuesta correcta : (d)
 1. De acuerdo a la Teoría Bioquímica o Evolutiva sobre el origen y evolución de la vida, la atmósfera primitiva carecía de: a) Oxígeno b) Agua c) Hidrógeno d) Nitrógeno 2. La Ciencia se caracteriza por
1. De acuerdo a la Teoría Bioquímica o Evolutiva sobre el origen y evolución de la vida, la atmósfera primitiva carecía de: a) Oxígeno b) Agua c) Hidrógeno d) Nitrógeno 2. La Ciencia se caracteriza por
CONTENIDO Y ESTADO ENERGÉTICO DEL AGUA EN LA PLANTA. -Propiedades del agua y concepto de potencial hídrico. - Métodos de medición
 CONTENIDO Y ESTADO ENERGÉTICO DEL AGUA EN LA PLANTA -Propiedades del agua y concepto de potencial hídrico. - Métodos de medición Herman Silva Robledo Laboratorio Relación Suelo- Agua Planta Facultad de
CONTENIDO Y ESTADO ENERGÉTICO DEL AGUA EN LA PLANTA -Propiedades del agua y concepto de potencial hídrico. - Métodos de medición Herman Silva Robledo Laboratorio Relación Suelo- Agua Planta Facultad de
Fuerzas intermoleculares y líquidos y sólidos
 Fuerzas intermoleculares y líquidos y sólidos Capítulo 11 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Una fase es la parte homógenea de un sistema en contacto
Fuerzas intermoleculares y líquidos y sólidos Capítulo 11 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Una fase es la parte homógenea de un sistema en contacto
La nutrición como intercambio de materia y energía
 La nutrición como intercambio de materia y energía Se denomina nutrición al conjunto de procesos mediante los cuales un organismo intercambia materia y energía con el medio que le rodea. Los organismos
La nutrición como intercambio de materia y energía Se denomina nutrición al conjunto de procesos mediante los cuales un organismo intercambia materia y energía con el medio que le rodea. Los organismos
Unidad 4 Termoquímica
 Unidad 4 Termoquímica Termoquímica Ciencia que estudia la relación existente, entre la energía en sus diversas formas, y los procesos químicos. Parte de la Termodinámica, ciencia más amplia que se ocupa
Unidad 4 Termoquímica Termoquímica Ciencia que estudia la relación existente, entre la energía en sus diversas formas, y los procesos químicos. Parte de la Termodinámica, ciencia más amplia que se ocupa
ESTADOS DE AGREGACIÓN DE LA MATERIA FLUIDOS
 FLUIDOS LÍQUIDOS ESTADOS DE AGREGACIÓN DE LA MATERIA FLUIDOS CONCEPTO DE FLUIDO Los líquidos y los gases son fluidos porque las partículas están dispuestas de forma más desordenada que en los sólidos,
FLUIDOS LÍQUIDOS ESTADOS DE AGREGACIÓN DE LA MATERIA FLUIDOS CONCEPTO DE FLUIDO Los líquidos y los gases son fluidos porque las partículas están dispuestas de forma más desordenada que en los sólidos,
LAS MOLÉCULAS DE LOS SERES VIVOS LA QUÍMICA CELULAR
 LAS MOLÉCULAS DE LOS SERES VIVOS LA QUÍMICA CELULAR La molécula de agua libre y aislada, formada por un átomo de Oxigeno unido a otros dos átomos de Hidrogeno, es triangular. El ángulo de los dos enlaces
LAS MOLÉCULAS DE LOS SERES VIVOS LA QUÍMICA CELULAR La molécula de agua libre y aislada, formada por un átomo de Oxigeno unido a otros dos átomos de Hidrogeno, es triangular. El ángulo de los dos enlaces
Tema 12. Gases. Química General e Inorgánica A ESTADOS DE AGREGACION DE LA MATERIA
 Tema 12 Gases Química General e Inorgánica A ESTADOS DE AGREGACION DE LA MATERIA 2.1 2.1 Variables que determinan el estado de agregación Tipo de material o materia Temperatura Presión 2.2 Elementos que
Tema 12 Gases Química General e Inorgánica A ESTADOS DE AGREGACION DE LA MATERIA 2.1 2.1 Variables que determinan el estado de agregación Tipo de material o materia Temperatura Presión 2.2 Elementos que
Tema 2: Fuerzas intermoleculares
 Tema 2: Fuerzas intermoleculares Fuerzas intermoleculares: ion dipolo, dipolo dipolo, dispersión de London y puentes de hidrógeno. Gases ideales y reales. Propiedades de los ĺıquidos. Presión de vapor.
Tema 2: Fuerzas intermoleculares Fuerzas intermoleculares: ion dipolo, dipolo dipolo, dispersión de London y puentes de hidrógeno. Gases ideales y reales. Propiedades de los ĺıquidos. Presión de vapor.
Contenidos clase calor 1
 Contenidos clase calor 1 Concepto de temperatura Escalas termométricas Conversión de unidades termométricas Concepto de calor Transmisión de calor Dilatación y contracción de la materia Estados de la materia
Contenidos clase calor 1 Concepto de temperatura Escalas termométricas Conversión de unidades termométricas Concepto de calor Transmisión de calor Dilatación y contracción de la materia Estados de la materia
BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA. Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas
 BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas A.- Los
BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas A.- Los
GUÍA DE ESTUDIO EL AGUA. Área Biología
 GUÍA DE ESTUDIO EL AGUA Área Biología Resultados de aprendizaje Conocer las características y bases moleculares de los seres vivos. Conocer y determinar las principales características del agua y sus propiedades.
GUÍA DE ESTUDIO EL AGUA Área Biología Resultados de aprendizaje Conocer las características y bases moleculares de los seres vivos. Conocer y determinar las principales características del agua y sus propiedades.
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES La molécula de agua La molécula de agua Líquido, sólido o gaseoso: existen los tres en la tierra Solvente Universal: por lo que es casi imposible
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES La molécula de agua La molécula de agua Líquido, sólido o gaseoso: existen los tres en la tierra Solvente Universal: por lo que es casi imposible
Propiedades de la materia. Características de sólidos, líquidos y gases
 Propiedades de la materia Características de sólidos, líquidos y gases Fluidos Líquidos Ej: H 2 O Estados de la materia Gases Ej: O 2 Amorfos Ej: caucho Cristalinos Ej: sal, azúcar Sólidos Metálicos Enlace
Propiedades de la materia Características de sólidos, líquidos y gases Fluidos Líquidos Ej: H 2 O Estados de la materia Gases Ej: O 2 Amorfos Ej: caucho Cristalinos Ej: sal, azúcar Sólidos Metálicos Enlace
COMPOSICIÓN QUÍMICA DE LA MATERIA VIVA
 COMPOSICIÓN QUÍMICA DE LA MATERIA VIVA ELEMENTOS QUÍMICOS: 110 BIOELEMENTOS ( Elementos biogénicos): 25-30 Forman parte de la materia viva, aunque no son exclusivos de ella No son los más abundantes, pero
COMPOSICIÓN QUÍMICA DE LA MATERIA VIVA ELEMENTOS QUÍMICOS: 110 BIOELEMENTOS ( Elementos biogénicos): 25-30 Forman parte de la materia viva, aunque no son exclusivos de ella No son los más abundantes, pero
Principios de Bioquímica Esquema general:
 Principios de Bioquímica Esquema general: Principios de la termodinámica Interacciones a nivel atómico Moléculas básicas: características Macroestructuras subcelulares Principios de la Termodinámica Definición
Principios de Bioquímica Esquema general: Principios de la termodinámica Interacciones a nivel atómico Moléculas básicas: características Macroestructuras subcelulares Principios de la Termodinámica Definición
Membranas biológicas y transporte
 Membranas biológicas y transporte Todas las células están rodeadas de una membrana que sirve de borde externo y separa el citoplasma del ambiente que le rodea Las membranas permite a la célula tomar retener,
Membranas biológicas y transporte Todas las células están rodeadas de una membrana que sirve de borde externo y separa el citoplasma del ambiente que le rodea Las membranas permite a la célula tomar retener,
La Bioquímica y los Bioelementos. 1.Los elementos de la vida 2.Las biomoléculas 3.El agua 4.Las sales minerales
 La Bioquímica y los Bioelementos 1.Los elementos de la vida 2.Las biomoléculas 3.El agua 4.Las sales minerales LOS ELEMENTOS DE LA VIDA Los ss.vv. (seres vivos) están constituidos por materia y, por
La Bioquímica y los Bioelementos 1.Los elementos de la vida 2.Las biomoléculas 3.El agua 4.Las sales minerales LOS ELEMENTOS DE LA VIDA Los ss.vv. (seres vivos) están constituidos por materia y, por
II. ESTADOS DE AGREGACIÓN. TEORÍA CINÉTICO-MOLECULAR
 II. ESTADOS DE AGREGACIÓN. TEORÍA CINÉTICO-MOLECULAR 1 Índice 1. Los estados de agregación de la materia 2. Los gases y la teoría cinética 3. Las leyes de los gases 4. La teoría cinético-molecular 2 1
II. ESTADOS DE AGREGACIÓN. TEORÍA CINÉTICO-MOLECULAR 1 Índice 1. Los estados de agregación de la materia 2. Los gases y la teoría cinética 3. Las leyes de los gases 4. La teoría cinético-molecular 2 1
Teoría Cinético-Molecular. Fuerzas Intermoleculares y Líquidos y Sólidos. Fase. Fuerzas 18/08/2011
 Fuerzas Intermoleculares y Líquidos y Sólidos Teoría Cinético-Molecular Gases (moleculas bien separadas) Líquidos y Sólidos (moléculas bien cercanas) Qué es una fase? Basado en Capítulo 11 de Química (Chang,
Fuerzas Intermoleculares y Líquidos y Sólidos Teoría Cinético-Molecular Gases (moleculas bien separadas) Líquidos y Sólidos (moléculas bien cercanas) Qué es una fase? Basado en Capítulo 11 de Química (Chang,
EL AGUA Y LAS SALES MINERALES
 EL AGUA Y LAS SALES MINERALES 1. EL AGUA DE LA MATERIA VIVA El agua es la molécula más abundante de la materia viva La cantidad de agua en los seres vivos es variable Según el tipo de tejido: más agua
EL AGUA Y LAS SALES MINERALES 1. EL AGUA DE LA MATERIA VIVA El agua es la molécula más abundante de la materia viva La cantidad de agua en los seres vivos es variable Según el tipo de tejido: más agua
1. Introducción: la leyes de la Termodinámica (Gianc. 17.1)
 Tema 2: Termodinámica 1. Introducción: las leyes de la termodinámica. 2. Equilibrio y temperatura. 3. Gases y temperatura absoluta 4. Gases ideales y disoluciones. 5. Energía interna y velocidades moleculares.
Tema 2: Termodinámica 1. Introducción: las leyes de la termodinámica. 2. Equilibrio y temperatura. 3. Gases y temperatura absoluta 4. Gases ideales y disoluciones. 5. Energía interna y velocidades moleculares.
FUERZAS INTERMOLECULARES
 FUERZAS INTERMOLECULARES Diariamente se usan el agua y otros líquidos para beber, asearse, lavar y cocinar, y también se manejan, se usan para sentarse en ellos y para vestirse los solidos. El movimiento
FUERZAS INTERMOLECULARES Diariamente se usan el agua y otros líquidos para beber, asearse, lavar y cocinar, y también se manejan, se usan para sentarse en ellos y para vestirse los solidos. El movimiento
BIOLOGÍA. Prof. Ma. Florencia Benimeli
 BIOLOGÍA Profesorado de educación secundaria de la modalidad técnico profesional en concurrencia con título de base Escuela Normal Superior Florentino Ameghino Prof. Ma. Florencia Benimeli OBJETO DE ESTUDIO
BIOLOGÍA Profesorado de educación secundaria de la modalidad técnico profesional en concurrencia con título de base Escuela Normal Superior Florentino Ameghino Prof. Ma. Florencia Benimeli OBJETO DE ESTUDIO
El agua posee una serie de propiedades características, derivadas de su estructura:
 1.2.- El Agua Es la sustancia más abundante en los seres vivos, ya que supone un 70% de su masa, ya sea en forma de agua intracelular o extracelular: espacios intersticiales, sangre o savia vegetal. La
1.2.- El Agua Es la sustancia más abundante en los seres vivos, ya que supone un 70% de su masa, ya sea en forma de agua intracelular o extracelular: espacios intersticiales, sangre o savia vegetal. La
Termoquímica. Termoquímica Es la parte de la Química que estudia el intercambio energético de un sistema químico con el exterior.
 ermoquímica ermoquímica Es la parte de la Química que estudia el intercambio energético de un sistema químico con el exterior. Sistemas materiales Un SISEMA es la parte del universo que se aísla para su
ermoquímica ermoquímica Es la parte de la Química que estudia el intercambio energético de un sistema químico con el exterior. Sistemas materiales Un SISEMA es la parte del universo que se aísla para su
Calor y temperatura. Cap. 13, 14 y 15 Giancoli 6ta ed.
 Calor y temperatura Cap. 13, 14 y 15 Giancoli 6ta ed. Contenido Definiciones Clasificación Leyes, principios Procedimientos Definiciones Termodinámica: es el estudio de los procesos en los que la energía
Calor y temperatura Cap. 13, 14 y 15 Giancoli 6ta ed. Contenido Definiciones Clasificación Leyes, principios Procedimientos Definiciones Termodinámica: es el estudio de los procesos en los que la energía
Termoquímica. Introducción
 Termoquímica Introducción La termodinámica es la ciencia dedicada al estudio de los cambios energéticos que tienen lugar en procesos físicos y químicos. La termoquímica es la parte de la química que estudia
Termoquímica Introducción La termodinámica es la ciencia dedicada al estudio de los cambios energéticos que tienen lugar en procesos físicos y químicos. La termoquímica es la parte de la química que estudia
BIOELEMENTOS AGUA Y SALES MINERALES
 BIOELEMENTOS AGUA Y SALES MINERALES BIOELEMENTOS PROPIEDADES Capas electrónicas externas incompletas ENLACES COVALENTES Nº atómico bajo ENLACES ESTABLES Oxígeno y Nitrógeno electronegativos BIOMOLÉCULAS
BIOELEMENTOS AGUA Y SALES MINERALES BIOELEMENTOS PROPIEDADES Capas electrónicas externas incompletas ENLACES COVALENTES Nº atómico bajo ENLACES ESTABLES Oxígeno y Nitrógeno electronegativos BIOMOLÉCULAS
IMPORTANCIA DEL AGUA EN EL MUNDO BIOLOGICO
 IMPORTANCIA DEL AGUA EN EL MUNDO BIOLOGICO Facilita las reacciones metabólicas Amortigua cambios de temperatura Interviene en el transporte de sustancias Lubrica y amortigua el roce entre órganos Favorece
IMPORTANCIA DEL AGUA EN EL MUNDO BIOLOGICO Facilita las reacciones metabólicas Amortigua cambios de temperatura Interviene en el transporte de sustancias Lubrica y amortigua el roce entre órganos Favorece
Por qué es importante conocer. componentes de una disolución química?
 Por qué es importante conocer la proporción de los componentes de una disolución química? Qué será más conveniente cuando calentamos agua para cocinar algún alimento: agregar sal antes o después que hierva
Por qué es importante conocer la proporción de los componentes de una disolución química? Qué será más conveniente cuando calentamos agua para cocinar algún alimento: agregar sal antes o después que hierva
COMISION Nº 5 QUIMICA ORGANICA. Seminario 4. Lic. Gisela Guerberoff
 QUIMICA ORGANICA COMISION Nº 5 Seminario 4 Lic. Gisela Guerberoff REACCIÓN QUÍMICA Ejercicios en guía: pág. 23 a 26. Capítulo 4 de Wade. Punto 4.1, 4.4,4.5, 4.6, 4.8, 4.9,4.10. Por qué ocurren las reacciones
QUIMICA ORGANICA COMISION Nº 5 Seminario 4 Lic. Gisela Guerberoff REACCIÓN QUÍMICA Ejercicios en guía: pág. 23 a 26. Capítulo 4 de Wade. Punto 4.1, 4.4,4.5, 4.6, 4.8, 4.9,4.10. Por qué ocurren las reacciones
Sistemas Termodinámicos
 Termodinámica. Sistemas Termodinámicos Un sistema termodinámico se define como la parte del universo objeto de estudio. Un sistema termodinámico puede ser una célula, una persona, el vapor de una máquina,
Termodinámica. Sistemas Termodinámicos Un sistema termodinámico se define como la parte del universo objeto de estudio. Un sistema termodinámico puede ser una célula, una persona, el vapor de una máquina,
Guía de Apoyo Prueba Coeficiente 2 FOTOSINTESIS
 Complejo Educacional Joaquín Edwards Bello Dpto. de Biología Prof. Cristian Astudillo M Nivel 1 Medio Guía de Apoyo Prueba Coeficiente 2 FOTOSINTESIS La fotosíntesis es un proceso mediante el cual las
Complejo Educacional Joaquín Edwards Bello Dpto. de Biología Prof. Cristian Astudillo M Nivel 1 Medio Guía de Apoyo Prueba Coeficiente 2 FOTOSINTESIS La fotosíntesis es un proceso mediante el cual las
Estado líquido y las Fuerzas intermoleculares
 Estado líquido y las Fuerzas intermoleculares Propiedades de los líquidos La tensión superficial es la cantidad de energía requerida para dilatar o aumentar la superficie de un líquido por unidad de área.
Estado líquido y las Fuerzas intermoleculares Propiedades de los líquidos La tensión superficial es la cantidad de energía requerida para dilatar o aumentar la superficie de un líquido por unidad de área.
Breve introducción a los principales. compuestos. de la química de la Vida
 Breve introducción a los principales compuestos de la química de la Vida AGUA DIOXIDO DE CARBONO MACROMOLÉCULAS ORGÁNICAS La molécula de agua libre y aislada, formada por un átomo de Oxigeno unido a otros
Breve introducción a los principales compuestos de la química de la Vida AGUA DIOXIDO DE CARBONO MACROMOLÉCULAS ORGÁNICAS La molécula de agua libre y aislada, formada por un átomo de Oxigeno unido a otros
Biología. 2º Bachillerato LAS MOLÉCULAS DE LA VIDA. Bioelementos y biomoléculas inorgánicas
 Biología 2º Bachillerato I. LAS MOLÉCULAS DE LA VIDA 1 Bioelementos y biomoléculas inorgánicas 1. Los elementos de la vida 2. Las biomoléculas 4. Las sales minerales 1. Los elementos de la vida Se denominan
Biología 2º Bachillerato I. LAS MOLÉCULAS DE LA VIDA 1 Bioelementos y biomoléculas inorgánicas 1. Los elementos de la vida 2. Las biomoléculas 4. Las sales minerales 1. Los elementos de la vida Se denominan
SOLUCIONES. Coordinadora de Enseñanza de Bioquímica y Biología Molecular. Fac. de Medicina. UNAM
 SOLUCIONES M. en C. Alicia Cea Bonilla Coordinadora de Enseñanza de Bioquímica y Biología Molecular. Fac. de Medicina. UNAM 1 Qué es una solución? Es una mezcla homogénea de dos o más sustancias. La sustancia
SOLUCIONES M. en C. Alicia Cea Bonilla Coordinadora de Enseñanza de Bioquímica y Biología Molecular. Fac. de Medicina. UNAM 1 Qué es una solución? Es una mezcla homogénea de dos o más sustancias. La sustancia
Niveles de Organización Conceptos, átomos y enlaces
 Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Escrito por Administrador Jueves, 05 de Febrero de :47 - Actualizado Sábado, 15 de Mayo de :55
 TRANSLOCACION Y TRANSPORTE DE SUSTANCIAS Procesos de transporte en las plantas Una planta necesita mucha más agua que un animal de peso comparable. Esto se debe a que la casi totalidad del agua que entra
TRANSLOCACION Y TRANSPORTE DE SUSTANCIAS Procesos de transporte en las plantas Una planta necesita mucha más agua que un animal de peso comparable. Esto se debe a que la casi totalidad del agua que entra
EL CALOR Y LA TEMPERATURA - Teoría
 EL CALOR Y LA TEMPERATURA - Teoría Prof.- Juan Sanmartín 4º Curso de E.S.O. 1 INTERCAMBIO DEL CALOR COMO FORMA DE TRANSFERENCIA DE ENERGÍA Pese a que los cambios que pueden producirse en los sistemas son
EL CALOR Y LA TEMPERATURA - Teoría Prof.- Juan Sanmartín 4º Curso de E.S.O. 1 INTERCAMBIO DEL CALOR COMO FORMA DE TRANSFERENCIA DE ENERGÍA Pese a que los cambios que pueden producirse en los sistemas son
De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos.
 ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
FUERZAS INTERMOLECULARES
 FUERZAS INTERMOLECULARES Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben
FUERZAS INTERMOLECULARES Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben
Sales minerales (2-3%) Ciertos gases (CO 2, O 2, N 2, etc) Moléculas orgánicas: Carbohidratos Lípidos Proteínas Ácidos nucleicos (12-23%)
 AGUA y SALES MINERALES Dra. Sandra Orellana Verdejo Clase 5 Clasificación de moléculas inorgánicas y orgánicas Moléculas inorgánicas: Agua (75-85%) Sales minerales (2-3%) Ciertos gases (CO 2, O 2, N 2,
AGUA y SALES MINERALES Dra. Sandra Orellana Verdejo Clase 5 Clasificación de moléculas inorgánicas y orgánicas Moléculas inorgánicas: Agua (75-85%) Sales minerales (2-3%) Ciertos gases (CO 2, O 2, N 2,
FUERZAS INTERMOLECULARES
 FUERZAS INTERMOLECULARES FUERZAS INTRAMOLECULARES: Fuerzas que se dan en el interior de las moléculas :Enlace Químico. FUERZAS INTERMOLECULARES: Interacciones entre moléculas. Mantienen unidas las moléculas
FUERZAS INTERMOLECULARES FUERZAS INTRAMOLECULARES: Fuerzas que se dan en el interior de las moléculas :Enlace Químico. FUERZAS INTERMOLECULARES: Interacciones entre moléculas. Mantienen unidas las moléculas
Agua y Soluciones SEMANA 07. Licda. Lilian Judith Guzmán M.
 Agua y Soluciones SEMANA 07 Licda. Lilian Judith Guzmán M. AGUA El agua es el compuesto químico más abundante en los seres vivos y en nuestro planeta, lo cual lo hace ser uno de los compuestos más extraordinarios.
Agua y Soluciones SEMANA 07 Licda. Lilian Judith Guzmán M. AGUA El agua es el compuesto químico más abundante en los seres vivos y en nuestro planeta, lo cual lo hace ser uno de los compuestos más extraordinarios.
Unidad I Sub-Unidad 1.1. MATERIA Y ENERGÍA
 DEFINICIONES: Materia es todo lo que tiene masa y ocupa un lugar en el espacio; Masa es la cantidad de materia que tiene un cuerpo; Volumen es el espacio ocupado por la masa Estados de la materia en relación
DEFINICIONES: Materia es todo lo que tiene masa y ocupa un lugar en el espacio; Masa es la cantidad de materia que tiene un cuerpo; Volumen es el espacio ocupado por la masa Estados de la materia en relación
BIOELEMENTOS AGUA Y SALES MINERALES
 BIOELEMENTOS AGUA Y SALES MINERALES BIOELEMENTOS PROPIEDADES Capas electrónicas externas incompletas ENLACES COVALENTES Nº atómico bajo ENLACES ESTABLES Oxígeno y Nitrógeno electronegativos BIOMOLÉCULAS
BIOELEMENTOS AGUA Y SALES MINERALES BIOELEMENTOS PROPIEDADES Capas electrónicas externas incompletas ENLACES COVALENTES Nº atómico bajo ENLACES ESTABLES Oxígeno y Nitrógeno electronegativos BIOMOLÉCULAS
La materia y sus estados
 La materia y sus estados Física y Química La materia Oxford University Press España, S. A. Física y Química 3º ESO 2 Todo lo que existe en el universo está constituido por materia. La materia se presenta
La materia y sus estados Física y Química La materia Oxford University Press España, S. A. Física y Química 3º ESO 2 Todo lo que existe en el universo está constituido por materia. La materia se presenta
La materia y sus estados
 La materia y sus estados Física y Química La materia Oxford University Press España, S. A. Física y Química 3º ESO 2 Todo lo que existe en el universo está constituido por materia. La materia se presenta
La materia y sus estados Física y Química La materia Oxford University Press España, S. A. Física y Química 3º ESO 2 Todo lo que existe en el universo está constituido por materia. La materia se presenta
TERMODINÁMICA QUÍMICA
 TERMODINÁMICA QUÍMICA CONCEPTOS BÁSICOS: Estado estándar de una sustancia es su forma pura más estable a la presión de 1 atmosfera y 25º C de temperatura. Importantes: O 2 (g), C (grafito), H 2 (g), Br
TERMODINÁMICA QUÍMICA CONCEPTOS BÁSICOS: Estado estándar de una sustancia es su forma pura más estable a la presión de 1 atmosfera y 25º C de temperatura. Importantes: O 2 (g), C (grafito), H 2 (g), Br
Escuela del Petróleo - Química U N I DA D 1 FUNDAMENTOS DE LA QUÍMICA
 Escuela del Petróleo - Química 2012 1 U N I DA D 1 1. La materia y sus cambios 2. Materia y Energía. 3. Propiedades de la Materia a. Estados de la Materia b. Cambios de estado FUNDAMENTOS DE LA QUÍMICA
Escuela del Petróleo - Química 2012 1 U N I DA D 1 1. La materia y sus cambios 2. Materia y Energía. 3. Propiedades de la Materia a. Estados de la Materia b. Cambios de estado FUNDAMENTOS DE LA QUÍMICA
PSU MÓDULO COMÚN QUÍMICA PROPIEDADES COLIGATIVAS
 DEPARTAMENTO DE CIENCIAS PSU_MÓDULO COMÚN DE QUÍMICA PSU MÓDULO COMÚN QUÍMICA PROPIEDADES COLIGATIVAS Corresponden a las nuevas propiedades del solvente, debido que el soluto altera al solvente puro en
DEPARTAMENTO DE CIENCIAS PSU_MÓDULO COMÚN DE QUÍMICA PSU MÓDULO COMÚN QUÍMICA PROPIEDADES COLIGATIVAS Corresponden a las nuevas propiedades del solvente, debido que el soluto altera al solvente puro en
Energía y metabolismo
 Energía y metabolismo Sesión 17 Introducción a la Biología Prof. Nelson A. Lagos Los sistemas vivos son abiertos y requieren energía para mantenerse La energía es la capacidad de hacer trabajo. Cinético
Energía y metabolismo Sesión 17 Introducción a la Biología Prof. Nelson A. Lagos Los sistemas vivos son abiertos y requieren energía para mantenerse La energía es la capacidad de hacer trabajo. Cinético
TEMA 1: LA NATURALEZA BÁSICA DE LA MATERIA QUÉ ELEMENTOS INTEGRAN LA MATERIA VIVA?
 TEMA 1: LA NATURALEZA BÁSICA DE LA MATERIA QUÉ ELEMENTOS INTEGRAN LA MATERIA VIVA? Concepto de Bioquímica Concepto de Bioelemento Los bioelementos, también conocidos como elementos biogénicos, son los
TEMA 1: LA NATURALEZA BÁSICA DE LA MATERIA QUÉ ELEMENTOS INTEGRAN LA MATERIA VIVA? Concepto de Bioquímica Concepto de Bioelemento Los bioelementos, también conocidos como elementos biogénicos, son los
BALANCE DE ENERGÍA. Diseño de Plantas Industriales Programa de Ingeniería Ambiental Facultad de Ciencias Ambientales
 BALANCE DE ENERGÍA Diseño de Plantas Industriales Programa de Ingeniería Ambiental Facultad de Ciencias Ambientales Los objetivos del balance de Energía son: Determinar la cantidad energía necesaria para
BALANCE DE ENERGÍA Diseño de Plantas Industriales Programa de Ingeniería Ambiental Facultad de Ciencias Ambientales Los objetivos del balance de Energía son: Determinar la cantidad energía necesaria para
I. Propiedades del agua II. Ácidos, Bases y Buffers III. Problemas y aplicaciones
 CAPÍTULO I EL AGUA Y SOLUCIONES ACUOSAS I. Propiedades del agua II. Ácidos, Bases y Buffers III. Problemas y aplicaciones I. Propiedades del agua A. Estructura e interacciones 1. Geometría 2. Enlaces Hidrógeno
CAPÍTULO I EL AGUA Y SOLUCIONES ACUOSAS I. Propiedades del agua II. Ácidos, Bases y Buffers III. Problemas y aplicaciones I. Propiedades del agua A. Estructura e interacciones 1. Geometría 2. Enlaces Hidrógeno
ESTADOS DE AGREGACIÓN DE LA MATERIA Y SUS PROPIEDADES
 ESTADOS DE AGREGACIÓN DE LA MATERIA Y SUS PROPIEDADES ESTADO GASEOSO: F atrac.e/molec. > E cinética
ESTADOS DE AGREGACIÓN DE LA MATERIA Y SUS PROPIEDADES ESTADO GASEOSO: F atrac.e/molec. > E cinética
Los compuestos químicos
 Los compuestos químicos Física y Química Compuestos formados por moléculas Oxford University Press España, S. A. Física y Química 3º ESO 2 Un compuesto químico es una sustancia pura formada por dos o más
Los compuestos químicos Física y Química Compuestos formados por moléculas Oxford University Press España, S. A. Física y Química 3º ESO 2 Un compuesto químico es una sustancia pura formada por dos o más
file:///documentos hechos/clases - Docencia/ PLAN BOL... Están mas separados que la suma de sus radios de van der Waals
 1 Dos átomos unidos por un enlace covalente: 10 Están mas separados que la suma de sus radios de van der Waals Están mas próximos que la suma de los radios de van der Waals Están exactamente a la distancia
1 Dos átomos unidos por un enlace covalente: 10 Están mas separados que la suma de sus radios de van der Waals Están mas próximos que la suma de los radios de van der Waals Están exactamente a la distancia
Física para Ciencias: Termodinámica
 Física para Ciencias: Termodinámica Dictado por: Profesor Aldo Valcarce 1 er semestre 2014 La Termodinámica Trata de: Calor (energía térmica) Temperatura Dilatación Comportamiento de gases (tratamiento
Física para Ciencias: Termodinámica Dictado por: Profesor Aldo Valcarce 1 er semestre 2014 La Termodinámica Trata de: Calor (energía térmica) Temperatura Dilatación Comportamiento de gases (tratamiento
Nutrición vegetal. Nutrición vegetal. Biología y Geología
 Nutrición vegetal Biología y Geología Las funciones de nutrición La obtención y el transporte de los nutrientes El transporte de la savia bruta La incorporación de los gases La fotosíntesis El transporte
Nutrición vegetal Biología y Geología Las funciones de nutrición La obtención y el transporte de los nutrientes El transporte de la savia bruta La incorporación de los gases La fotosíntesis El transporte
SOLUCIONES BLOQUE 3. TEORÍA CINÉTICO-MOLECULAR.
 SOLUCIONES BLOQUE 3. TEORÍA CINÉTICO-MOLECULAR. Cuestiones. 1. Solución: En los líquidos las partículas tienen más libertad para moverse, debido a que las fuerzas intermoleculares presentes en ellos son
SOLUCIONES BLOQUE 3. TEORÍA CINÉTICO-MOLECULAR. Cuestiones. 1. Solución: En los líquidos las partículas tienen más libertad para moverse, debido a que las fuerzas intermoleculares presentes en ellos son
FOTOSINTESISY RELACIONES ALIMENTARIAS Durante la primavera, la mayoría de las plantas crecen con mayor rapidez y florecen. Asimismo, suele aumentar
 FOTOSINTESISY RELACIONES ALIMENTARIAS Durante la primavera, la mayoría de las plantas crecen con mayor rapidez y florecen. Asimismo, suele aumentar la cantidad de insectos y de aves en el ambiente. Lo
FOTOSINTESISY RELACIONES ALIMENTARIAS Durante la primavera, la mayoría de las plantas crecen con mayor rapidez y florecen. Asimismo, suele aumentar la cantidad de insectos y de aves en el ambiente. Lo
BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA. Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas
 BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas A.- Los
BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas A.- Los
FOTOSÍNTESIS : «El proceso fotosintético y sus etapas»
 FOTOSÍNTESIS : «El proceso fotosintético y sus etapas» Biología I medio Cómo ingresan el agua (H2O) y el dióxido de carbono (CO2) a la planta? Agua raíces (luego es transportada hacia las hojas por conductos
FOTOSÍNTESIS : «El proceso fotosintético y sus etapas» Biología I medio Cómo ingresan el agua (H2O) y el dióxido de carbono (CO2) a la planta? Agua raíces (luego es transportada hacia las hojas por conductos
POTENCIAL QUIMICO Y POTENCIAL AGUA A NIVEL CELULAR
 Espacio curricular FISIOLOGIA VEGETAL POTENCIAL QUIMICO Y POTENCIAL AGUA A NIVEL CELULAR UNIDAD TEMATICA 4 Absorción y movimiento del agua en la planta: Potencial químico y potencial agua. Componentes
Espacio curricular FISIOLOGIA VEGETAL POTENCIAL QUIMICO Y POTENCIAL AGUA A NIVEL CELULAR UNIDAD TEMATICA 4 Absorción y movimiento del agua en la planta: Potencial químico y potencial agua. Componentes
BIOENERGÉTICA ELEMENTOS DE TERMODINÁMICA CINÉTICA BIOQUÍMICA
 BIOENERGÉTICA ELEMENTOS DE TERMODINÁMICA CINÉTICA BIOQUÍMICA Los capítulos precedentes describieron la lógica molecular creciente de la vida, desde moléculas inorgánica simples, pasando por moléculas orgánicas
BIOENERGÉTICA ELEMENTOS DE TERMODINÁMICA CINÉTICA BIOQUÍMICA Los capítulos precedentes describieron la lógica molecular creciente de la vida, desde moléculas inorgánica simples, pasando por moléculas orgánicas
Bioelementos y Biomoléculas 1-Moléculas inorganicas : Agua
 Bioelementos y Biomoléculas 1-Moléculas inorganicas : Agua Técnico Professor: Verónica en masoterapia Pantoja. Lic. MSP. Objetivos Reconocer los bioelementos en los seres vivos Reconocer el agua como biomolécula
Bioelementos y Biomoléculas 1-Moléculas inorganicas : Agua Técnico Professor: Verónica en masoterapia Pantoja. Lic. MSP. Objetivos Reconocer los bioelementos en los seres vivos Reconocer el agua como biomolécula
El ascenso del agua en las plantas
 El ascenso del agua en las plantas Los árboles más grandes del mundo: Harry Cole (California): Secoya 113.1 m de altura. Ferguson (Australia): Eucalipto Australiano: mide 132.6 m y 6 m de diámetro Eucaliptis
El ascenso del agua en las plantas Los árboles más grandes del mundo: Harry Cole (California): Secoya 113.1 m de altura. Ferguson (Australia): Eucalipto Australiano: mide 132.6 m y 6 m de diámetro Eucaliptis
Fundación Barceló Facultad de Medicina Licenciatura en Nutrición. El AGUA. La vida se apoya en su comportamiento anormal
 El AGUA La vida se apoya en su comportamiento anormal El agua, una molécula simple y extraña, puede ser considerada como el líquido de la vida. Es la sustancia más abundante en la biosfera, dónde la encontramos
El AGUA La vida se apoya en su comportamiento anormal El agua, una molécula simple y extraña, puede ser considerada como el líquido de la vida. Es la sustancia más abundante en la biosfera, dónde la encontramos
ESTADOS DE LA MATERIA
 ESTADOS DE LA MATERIA M en C Alicia Cea Bonilla 1 Existen tres estados de la materia: sólido, líquido y gaseoso, dependiendo de la distancia entre sus partículas, de las fuerzas de atracción entre éstas
ESTADOS DE LA MATERIA M en C Alicia Cea Bonilla 1 Existen tres estados de la materia: sólido, líquido y gaseoso, dependiendo de la distancia entre sus partículas, de las fuerzas de atracción entre éstas
LA NUTRICIÓN DE LAS PLANTAS
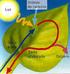 LA NUTRICIÓN DE LAS PLANTAS CIENCIAS NATURALES 2º DE E.S.O. Francisco Javier Barba Regidor EL ALIMENTO DE LAS PLANTAS Las plantas, como todos los seres vivos, toman del medio las sustancias que constituyen
LA NUTRICIÓN DE LAS PLANTAS CIENCIAS NATURALES 2º DE E.S.O. Francisco Javier Barba Regidor EL ALIMENTO DE LAS PLANTAS Las plantas, como todos los seres vivos, toman del medio las sustancias que constituyen
Energía. Introducción a la Termodinámica. Tipos de energía química. Tipos de energía: Energía cinética. Energía solar.
 Altura, h Química General e Inorgánica Clases 5 y 6 21 y 23 de marzo de 2016 Prof. Dr. Pablo Evelson Introducción a la Termodinámica Tipos de energía: potencial Ep= mgh cinética solar térmica Masa, m potencial
Altura, h Química General e Inorgánica Clases 5 y 6 21 y 23 de marzo de 2016 Prof. Dr. Pablo Evelson Introducción a la Termodinámica Tipos de energía: potencial Ep= mgh cinética solar térmica Masa, m potencial
Introducción al metabolismo
 Introducción al metabolismo Patricio Muñoz Torres patricio.munozt@gmail.com Metabolismo n Las células llevan a cabo reacciones químicas (metabolismo) y organizan sus moléculas en estructuras específicas.
Introducción al metabolismo Patricio Muñoz Torres patricio.munozt@gmail.com Metabolismo n Las células llevan a cabo reacciones químicas (metabolismo) y organizan sus moléculas en estructuras específicas.
Tema 1. Fuerzas intermoleculares
 . Geometría molecular. Momentos dipolares. Fuerzas de van de Waals y radios de van de Waals. El enlace de hidrógeno. El estado líquido. Estructura y propiedades del agua. Estructura de los sólidos. Tipos
. Geometría molecular. Momentos dipolares. Fuerzas de van de Waals y radios de van de Waals. El enlace de hidrógeno. El estado líquido. Estructura y propiedades del agua. Estructura de los sólidos. Tipos
Física y Química. 2º ESO. LA MATERIA Y SUS PROPIEDADES La materia. La materia es todo aquello que tiene masa y ocupa un espacio.
 La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
ESTO NO ES UN EXAMEN, ES UNA HOJA DEL CUADERNILLO DE EJERCICIOS. Heroica Escuela Naval
 CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
PROPIEDADES DE LA MATERIA. Departamento de Física y Química 2º ESO
 PROPIEDADES DE LA MATERIA Departamento de Física y Química 2º ESO 0. Mapa conceptual Estados de agregación Sólido Líquido Gaseoso Propiedades MATERIA Teoría cinética Generales Específicas Leyes de los
PROPIEDADES DE LA MATERIA Departamento de Física y Química 2º ESO 0. Mapa conceptual Estados de agregación Sólido Líquido Gaseoso Propiedades MATERIA Teoría cinética Generales Específicas Leyes de los
Contenidos mínimos Física y Química Curso Contenidos mínimos Física y Química 2º ESO
 Contenidos mínimos Física y Química 2º ESO Magnitudes y unidades. Longitud, masa, superficie y volumen. Cambio de unidades. Estados de la materia. Cambios de estado. Mezclas (heterogéneas y homogéneas).
Contenidos mínimos Física y Química 2º ESO Magnitudes y unidades. Longitud, masa, superficie y volumen. Cambio de unidades. Estados de la materia. Cambios de estado. Mezclas (heterogéneas y homogéneas).
EL POTENCIAL HIDRICO
 EL POTENCIAL HIDRICO Por E.G. García Material para uso exclusivo del curso Introdución a la Fisiología Vegetal. Escuela de Biología, Universidad de Costa Rica. IMPORTANCIA DEL AGUA 80-95% del PF en tejidos
EL POTENCIAL HIDRICO Por E.G. García Material para uso exclusivo del curso Introdución a la Fisiología Vegetal. Escuela de Biología, Universidad de Costa Rica. IMPORTANCIA DEL AGUA 80-95% del PF en tejidos
Numero másico (A). Suma del numero de protones y el numero de neutrones de un átomo.
 PROPIEDADES DE LOS MATERIALES. UNIDAD El Estado Solido. Estructura Atómica. Protón- partícula con carga positiva. Neutro-partícula con carga neutra. Electron-particula con carga negativa. Numero atómico
PROPIEDADES DE LOS MATERIALES. UNIDAD El Estado Solido. Estructura Atómica. Protón- partícula con carga positiva. Neutro-partícula con carga neutra. Electron-particula con carga negativa. Numero atómico
Universidad Técnica Federico Santa María Departamento de Química
 Universidad Técnica Federico Santa María Departamento de Química Química y Sociedad QUI - 010 Certamen 2 Casa Central (05 Noviembre año 2008) Nombre:...Rol USM... Profesor:...Paralelo... Tabla con valores
Universidad Técnica Federico Santa María Departamento de Química Química y Sociedad QUI - 010 Certamen 2 Casa Central (05 Noviembre año 2008) Nombre:...Rol USM... Profesor:...Paralelo... Tabla con valores
La unidad de temperatura en el Sistema Internacional es el Kelvin (K) Elaboración Propia
 La energía y su transferencia: En este tema se estudia qué se entiende por sistema en termodinámica y los principios generales que rigen la evolución de los mismos. Se verá como el intercambio de energía
La energía y su transferencia: En este tema se estudia qué se entiende por sistema en termodinámica y los principios generales que rigen la evolución de los mismos. Se verá como el intercambio de energía
Bencenito.com, Física y Química, Glosario ( )
 1 Glosario de Química Afinidad electrónica: energía liberada cuando un átomo gaseoso en su estado fundamental capta un electrón libre y se convierte en un ión mononegativo. Formula: F + e F. +ε Anión:
1 Glosario de Química Afinidad electrónica: energía liberada cuando un átomo gaseoso en su estado fundamental capta un electrón libre y se convierte en un ión mononegativo. Formula: F + e F. +ε Anión:
Labranza y temperatura del suelo. Francisco Rojo
 Labranza y temperatura del suelo Francisco Rojo Temperatura y Flujo de Calor en el suelo, en cero labranza Francisco Rojo Rübke 2005 Procesos influenciados por el aumento de la Temperatura Actividad Microbiológica
Labranza y temperatura del suelo Francisco Rojo Temperatura y Flujo de Calor en el suelo, en cero labranza Francisco Rojo Rübke 2005 Procesos influenciados por el aumento de la Temperatura Actividad Microbiológica
Tema 5: Disoluciones. (Químic General) Disoluciones 6 de noviembre de / 38
 Tema 5: Disoluciones Tipos de disoluciones. Concentración. Solubilidad de gases. Diagramas de fases de dos componentes. Propiedades coligativas: presión osmótica, disminución del punto de fusión y aumento
Tema 5: Disoluciones Tipos de disoluciones. Concentración. Solubilidad de gases. Diagramas de fases de dos componentes. Propiedades coligativas: presión osmótica, disminución del punto de fusión y aumento
Selección Múltiple: Encierre en un círculo la alternativa que consideres correcta
 REFUERZO SIMCE 2013 N 1 Este refuerzo entra en las pruebas parciales y globales. Se aplicara el reglamento de evaluación en caso de no entrega en la fecha oportuna. Selección Múltiple: Encierre en un círculo
REFUERZO SIMCE 2013 N 1 Este refuerzo entra en las pruebas parciales y globales. Se aplicara el reglamento de evaluación en caso de no entrega en la fecha oportuna. Selección Múltiple: Encierre en un círculo
COMPORTAMIENTO DE GASES (TRATAMIENTO MACROSCÓPICO) VARIABLES DE ESTADO PRESIÓN, TEMPERATURA Y DENSIDAD.
 LA TRATA DE: CALOR (ENERGÍA TÉRMICA) TEMPERATURA DILATACIÓN COMPORTAMIENTO DE GASES (TRATAMIENTO MACROSCÓPICO) VARIABLES DE ESTADO PRESIÓN, TEMPERATURA Y DENSIDAD. EL GAS IDEAL LA TEMPERATURA ESTÁ ASOCIADA
LA TRATA DE: CALOR (ENERGÍA TÉRMICA) TEMPERATURA DILATACIÓN COMPORTAMIENTO DE GASES (TRATAMIENTO MACROSCÓPICO) VARIABLES DE ESTADO PRESIÓN, TEMPERATURA Y DENSIDAD. EL GAS IDEAL LA TEMPERATURA ESTÁ ASOCIADA
1.1. BIOLEMENTOS: Concepto: Son los elementos químicos que constituyen los seres vivos. Clasificación: * Primarios (~ 96%): C, H, O, N, P, S.
 1.1. BIOLEMENTOS: Concepto: Son los elementos químicos que constituyen los seres vivos. Clasificación: Biogénicos * Primarios (~ 96%): C, H, O, N, P, S. * Secundarios (~ 3,9%) :Na +, K +, Ca ++, Mg ++,
1.1. BIOLEMENTOS: Concepto: Son los elementos químicos que constituyen los seres vivos. Clasificación: Biogénicos * Primarios (~ 96%): C, H, O, N, P, S. * Secundarios (~ 3,9%) :Na +, K +, Ca ++, Mg ++,
Polaridad de una molécula
 Polaridad de una molécula Una molécula se considera polar si existe un momento dipolar neto debido a sus enlaces Depende de su geometría Una molécula formada por enlaces polares no necesariamente debe
Polaridad de una molécula Una molécula se considera polar si existe un momento dipolar neto debido a sus enlaces Depende de su geometría Una molécula formada por enlaces polares no necesariamente debe
