PROGRAMA PROVINCIAL DE FARMACOVIGILANCIA BOLETÍN INFORMATIVO: Nº 03/2016 NOVEDADES NACIONALES E INTERNACIONALES EN SEGURIDAD
|
|
|
- María Luisa Escobar Duarte
- hace 7 años
- Vistas:
Transcripción
1 PROGRAMA PROVINCIAL DE FARMACOVIGILANCIA BOLETÍN INFORMATIVO: Nº 03/2016 NOVEDADES NACIONALES E INTERNACIONALES EN SEGURIDAD DE MEDICAMENTOS NOVEDADES INTERNACIONALES DE AGENCIAS REGULADORAS CLOZAPINA Antipsicótico - La FDA modifica el monitoreo de neutropenia y se aprueba un nuevo REMS compartido (FDA, EEUU) La FDA realizó cambios en los requisitos para el monitoreo, prescripción, dispensación y recepción de Clozapina. Aprobó una nueva estrategia de evaluación y minimización de riesgos (REMS) compartida, llamada Programa REMS Clozapina. Entre otras cosas, explica cómo monitorear a los pacientes que presentan neutropenia durante el tratamiento con Clozapina. Se espera que el nuevo programa compartido reduzca la posible confusión de tener registros separados a cargo de cada TARC de este IFA. Se sustituirá el registro de pacientes en tratamiento que tiene cada laboratorio comercializador de clozapina por un único registro informatizado. Los pacientes que están tratados actualmente con clozapina se transferirán automáticamente al Programa REMS Clozapina. Con el fin de prescribir y dispensar clozapina a los prescriptores y farmacias se les requerirá estar certificados en el Programa REMS Clozapina. En nuestro país la clozapina se encuentra en un programa especial de Farmacovigilancia Intensiva por Disposición ANMAT Nº 935/2000. MODIFICACIONES DE SEGURIDAD EN PROSPECTOS DE LA FDA (FDA, EEUU) La FDA realizó modificaciones en la información de seguridad de los prospectos de varios productos, una tabla de vista rápida proporciona el nombre del medicamento y las secciones modificadas. Haciendo click en el nombre del medicamento se puede acceder a la vista detallada, que incluye las secciones y subsecciones modificadas, una descripción de la información nueva o modificada de seguridad y un enlace a la información de prescripción revisada. MICOFENOLATO MOFETIL (CELLCEPT ), similares Y MICOFENOLATO SÓDICO (MYFORTIC ) Inmunosupresores Serio riesgo de teratogenicidad (HPRA, Irlanda)(ANSM, Francia)(AEMPS, España) El micofenolato es un poderoso teratógeno humano, que aumenta el riesgo de aborto espontáneo y anomalías congénitas en caso de exposición durante el embarazo. Las siguientes nuevas contraindicaciones han sido agregadas al resumen de las características del producto de Micofenolato mofetil (CellCept ): El Micofenolato no debe ser usado durante el embarazo a menos que no haya otro tratamiento alternativo adecuado para prevenir el rechazo de transplante; El Micofenolato no debe ser indicado a mujeres en edad fértil que no estén usando anticoncepción altamente efectiva; El tratamiento con Micofenolato no debe ser iniciado en mujeres en edad fértil sin tener un resultado de test de embarazo para descartar el uso no intencionado durante el embarazo.
2 Debido al potencial genotóxico del Micofenolato y al riesgo de pasaje al líquido seminal, se recomienda que los hombres sexualmente activos (incluyendo hombres vasectomizados) usen preservativos durante el tratamiento y durante al menos 90 días después de cesar el tratamiento. Además, se recomienda que las parejas femeninas de pacientes masculinos tratados con Micofenolato usen anticoncepción altamente efectiva durante el tratamiento y durante un total de 90 días luego de la última dosis de Micofenolato. Los pacientes no deben donar sangre durante la terapia o por al menos 6 semanas luego de la discontinuación de Micofenolato. Los hombres no deben donar semen durante la terapia o por 90 días luego de la discontinuación de Micofenolato. En los últimos tres años se han recibido 141 notificaciones de sospechas de reacciones adversas con micofenolato, micofenolato mofetil y ácido micofenólico, incluyendo 7 reportes de defectos congénitos. Ver Boletín Informativo Nº 01/15. DIMETILFUMARATO Inmunomodulador Nuevas medidas para minimizar el riesgo de leucoencefalopatía multifocal progresiva (HPRA, Irlanda) (ANSM, Francia) (AEMPS, España) Medidas para minimizar el riesgo de LMP: Antes de iniciar el tratamiento con dimetilfumarato (Tecfidera ): Realizar un recuento sanguíneo completo (incluyendo linfocitos); Una resonancia magnética basal de referencia (por lo general dentro de los 3 meses); Asesorar a los pacientes y cuidadores sobre el riesgo de LMP, los posibles síntomas clínicos a tener en cuenta y las acciones a tomar si surge alguno de estos síntomas. Después de iniciar el tratamiento: Monitorear recuentos sanguíneos completos cada 3 meses; Debido a un posible riesgo aumentado de LMP, considerar interrumpir el dimetilfumarato (Tecfidera ) en pacientes con recuento de linfocitos por debajo de 500/mm 3 persistente durante más de 6 meses (es decir, linfopenia severa prolongada); Si el tratamiento se detiene debido a linfopenia, monitorear a los pacientes hasta que los niveles de linfocitos vuelvan a lo normal. Otras consideraciones: Tener en cuenta que la LMP sólo puede ocurrir en presencia de una infección con el virus John- Cunningham (JCV). Un test de anticuerpos anti-jcv negativos (en presencia de recuentos de linfocitos normales) no excluye la posibilidad de infección posterior con JCV. Si se continúa el tratamiento en pacientes con linfopenia severa prolongada, se recomienda la vigilancia aumentada para LMP. Si se sospecha LMP, se debe interrumpir el tratamiento inmediatamente e investigar. En los últimos tres años se han recibido 3 notificaciones de sospechas de reacciones adversas con dimetilfumarato, no relacionadas al tema mencionado. INHIBIDORES DEL COTRANSPORTADOR SODIO-GLUCOSA TIPO 2 (SGLT2) Antidiabéticos Revisión del riesgo de cetoacidosis diabética (EMA, Unión Europea)(TGA, Australia) y Riesgo potencial de daño renal agudo (Health Canada, Canadá) Se realizó una revisión de seguridad para evaluar el riesgo potencial de lesión renal aguda con el uso de dos inhibidores SGLT2, Canaglifloniza (Invokana ) o Dapagliflozina (Forxiga ). La revisión de Health Canada concluyó que la evidencia apoyó la existencia de un vínculo entre el uso de inhibidores SGLT2 y el riesgo de lesión renal aguda. El PRAC de la EMA, realizó una revisión del riesgo de cetoacidosis diabética con inhibidores SGLT2, utilizados para el tratamiento de la diabetes tipo 2. Todos los casos fueron serios y algunos requirieron hospitalización. Aunque la cetoacidosis diabética suele ir acompañada de hiperglucemia, en varios de estos
3 reportes los niveles de glucemia estaban sólo moderadamente aumentados. Estos niveles sanguíneos no característicos podrían retrasar el diagnóstico y el tratamiento. La EMA ahora revisará todos los datos disponibles sobre el riesgo de cetoacidosis diabética con inhibidores SGLT2 y considerará si se necesita alguna modificación en la forma en que estos medicamentos se utilizan en la Unión Europea. La Therapeutic Goods Administration (TGA), a su vez, también informó sobre este tema. Información para profesionales de la salud: Los pacientes tratados con estos medicamentos deben ser evaluados cuando presenten signos o síntomas de acidosis metabólica con el fin de evitar retrasos en el diagnóstico y el tratamiento. Si se sospecha cetoacidosis diabética, el tratamiento con inhibidores SGLT2 debe interrumpirse. Si se confirma la cetoacidosis diabética, se deben tomar las medidas adecuadas para corregirla y para monitorear la glucemia. El mecanismo subyacente para la cetoacidosis diabética asociada a inhibidores SGLT2 no se ha establecido. Algunos de los casos reportados involucraron el uso off-label en pacientes con diabetes tipo 1. Se recuerda que los inhibidores SGLT2 se deben utilizar de acuerdo con su respectiva información de producto. La diabetes tipo 1 no es una indicación aprobada para estos medicamentos. Ver Boletín Informativo Nº 07/ PRODUCTOS CON ESTRONCIO Antiosteoporóticos - Nuevas restricciones para enfrentar posibles riesgos cardíacos y circulatorios (Health Canada, Canadá) Una revisión de seguridad de la EMA encontró que la dosis de 680mg por día fue beneficiosa para la osteoporosis severa, pero que no debe utilizarse en pacientes que tienen problemas cardíacos o circulatorios preexistentes. El análisis demostró que el aumento del riesgo de efectos cardíacos y circulatorios sólo fue significativo en pacientes con antecedentes actuales o pasados de problemas cardíacos y circulatorios. Health Canada no encontró información disponible sobre el riesgo cardiovascular con ranelato de estroncio en dosis menores a 680mg por día, o con otras formas de estroncio no-ranelato a cualquier dosis. Mientras permanece la incertidumbre, Health Canada está adoptando un enfoque precautorio y recomendando actualizaciones en los prospectos de productos que contienen estroncio, incluyendo informar a los consumidores acerca de no utilizar estos productos si tienen problemas cardíacos o circulatorios preexistentes, como infarto de miocardio, accidente cerebrovascular o coágulos sanguíneos, y considera que el estroncio, independientemente de la forma, puede tener un riesgo potencial de efectos adversos cardiovasculares en personas que ya se encuentran en riesgo. Aunque la evidencia disponible para efectos adversos cardíacos y circulatorios involucró sólo a ranelato de estroncio a dosis de 680mg por día, el riesgo con dosis más bajas y con otras combinaciones de sales no se puede descartar. Ver Boletín Informativo Nº 06/14 y 4/14. CRIZOTINIB (XALKORI ) Antineoplásico - Nueva advertencia sobre insuficiencia cardíaca (HPRA, Irlanda)(ANSM, Francia) (AEMPS, España) Está indicado para el tratamiento de adultos con cáncer de pulmón de células no-pequeñas (NSCLC) avanzado previamente tratado positivo para la kinasa del linfoma anaplásico (ALK). El laboratorio Pfizer, en acuerdo con las agencias reguladoras, informó a los profesionales de la salud a través de una carta, lo siguiente: Se han reportado casos severos, algunos fatales, de insuficiencia cardíaca en pacientes con NSCLC ALK-positivo tratados con crizotinib. La insuficiencia cardíaca ocurrió en pacientes con o sin trastornos cardíacos preexistentes. Los pacientes deben ser monitoreados para detectar signos y síntomas de insuficiencia cardíaca (disnea, edema, rápido aumento de peso).
4 Si se observan síntomas de insuficiencia cardíaca, deben considerarse medidas apropiadas tales como interrupción, reducción de la dosis, o discontinuación. Recomendaciones para profesionales de la salud: Monitorear a todos los pacientes para detectar signos y síntomas de insuficiencia cardíaca (incluyendo disnea, edema o aumento rápido de peso por retención de líquidos). Considerar reducir la dosis o interrumpir el tratamiento si se presentan síntomas de insuficiencia cardíaca. En los últimos tres años se han recibido 30 notificaciones de sospechas de reacciones adversas con crizotinib, no relacionadas al tema mencionado. Ver Boletín Informativo Nº 05/15. GALANTAMINA (REMINYL Y SIMILARES) Anticolinesterásico Advertencia sobre reacciones cutáneas graves (ANSM, Francia) (HPRA, Irlanda) La galantamina está indicada para el tratamiento sintomático de la enfermedad de Alzheimer de leve a moderadamente severa. A raíz de la aparición de Síndrome de Stevens-Johnson (SSJ) y pustulosis exantemática aguda generalizada (PEAG), la información del producto se ha actualizado. Resumen: Se han observado reacciones cutáneas graves (SSJ y PEAG) en pacientes tratados con galantamina. Los pacientes deben ser informados del riesgo de aparición de estas reacciones cutáneas graves y los signos clínicos asociados a ellas. Ellos deben ser informados de la necesidad de detener el tratamiento con galantamina a partir de la aparición de los primeros signos de erupción cutánea. El resumen de las características del producto de estas especialidades y la información para pacientes serán modificados para incluir a el SSJ y la PEAG como nuevos efectos adversos. Ver Boletín Informativo Nº 1/15 y 14/14. MEDIOS DE CONTRASTE IODADO PARA ESPECTROSCOPÍA MÉDICA Casos raros de hipotiroidismo en bebés (FDA, EEUU) La FDA advierte que se han reportado casos raros de hipotiroidismo en bebés luego del uso de medios de contraste que contienen iodo (MCI) para radiografías y otros procedimientos de espectroscopía médica. En todos los casos reportados, los bebés eran prematuros o tenían otras condiciones médicas subyacentes serias. La evidencia disponible conduce a la FDA a creer que esta ocurrencia rara suele ser temporal y se resuelve sin tratamiento o efectos duraderos. La FDA aprobó cambios en los prospectos de todos los productos de MCI para incluir información sobre estos casos. No se recomiendan cambios en la actual prescripción, administración o prácticas de monitoreo. Recomendación: Los padres y cuidadores de los bebes que reciben un MCI deben contactarse con un profesional de salud en caso de requerir información adicional. Los bebés generalmente no muestran signos visibles de hipotiroidismo. Los profesionales de la salud deben continuar siguiendo las recomendaciones del prospecto de productos de MCI y utilizar el juicio clínico para determinar si es necesario realizar tests en busca de hipotiroidismo. CLOPIDOGREL (PLAVIX ) Antiagregante plaquetario - El tratamiento a largo plazo NO modifica el riesgo de muerte (FDA, EEUU) Una revisión de la FDA ha determinado que el uso a largo plazo de clopidogrel (Plavix ) NO aumenta o disminuye el riesgo general de muerte en pacientes con, o en riesgo de, enfermedades cardíacas. La evaluación del ensayo Dual Antiplatelet Therapy (DAPT) y otros varios ensayos clínicos además, no sugirieron que el clopidogrel aumente el riesgo de cáncer o de muerte por cáncer. La FDA examinó los resultados del ensayo DAPT y de otros ensayos clínicos grandes y a largo plazo de clopidogrel con los datos disponibles sobre las tasas de muerte, muerte por cáncer, o cáncer reportado
5 como un evento adverso. Además, realizó un meta-análisis de otros ensayos clínicos a largo plazo para evaluar los efectos de clopidogrel en las tasas de mortalidad por cualquier causa. Los resultados indican que la terapia antiagregante dual con clopidogrel y Aspirina a largo plazo (12 meses o más) no parece cambiar el riesgo general de muerte en comparación con el tratamiento a corto plazo (6 meses o menos) con Clopidogrel y Aspirina, o Aspirina sola. Además, no hubo un aumento en los riesgos de muerte relacionados con cáncer o eventos adversos relacionados con cáncer con el tratamiento a largo plazo. Recomendación: Los pacientes no deben dejar de tomar Clopidogrel u otros medicamentos antiplaquetarios, ya que hacerlo puede resultar en un aumento del riesgo de ataques cardíacos y de coágulos sanguíneos. Ver Boletín Informativo Nº 08/15, 4/15 y 9/13. ARIPIPRAZOL Antipsicótico - Riesgo de juego patológico e hipersexualidad (Health Canada) Health Canada encontró un riesgo aumentado de juego patológico e hipersexualidad asociado con aripiprazol. La revisión identificó 18 casos internacionales de juego patológico y 6 casos internacionales de hipersexualidad en la literatura científica publicada. En la mayoría de los casos, los comportamientos cesaron o mejoraron cuando se interrumpió el tratamiento o cuando la dosis se redujo. Los reportes involucraron a pacientes masculinos y femeninos de 19 a 64 años de edad. En los últimos tres años se han recibido 15 notificaciones de sospechas de reacciones adversas con aripiprazol, no relacionadas al tema mencionado. TALIDOMIDA Inmunosupresor Reducción de la dosis de inicio al combinarse con melfalan en mayores de 75 años (HPRA, Irlanda) (ANSM, Francia) El laboratorio Celgene Ltd. ha enviado una carta a los profesionales de la salud informando que la dosis inicial de talidomida, al combinarse con melfalan y prednisona, debe reducirse en pacientes mayores de 75 años con mieloma múltiple no tratado: Se recomienda una dosis inicial de 100mg/día de talidomida en pacientes >75 años de edad. Cuando se combina con talidomida, se debe usar una dosis inicial reducida de melfalán en pacientes >75 años de edad. El perfil de reacciones adversas en general reportado en pacientes >75 años de edad tratados con talidomida 100mg una vez al día fue similar al perfil de reacciones adversas observado en pacientes 75 años de edad tratados con talidomida 200mg una vez al día. Sin embargo, los pacientes >75 años tienen un mayor riesgo de reacciones adversas serias. Ver Boletín Informativo Nº 06/13 y 05/13. NOVEDADES EN VACUNAS VACUNAS ANTIGRIPALES Composición recomendada para las vacunas antigripales de uso en la temporada de influenza 2016 en el hemisferio sur (WHO, 24/09/2015) Las recomendaciones para la composición de la vacuna antigripal trivalente que será utilizada en la temporada gripal 2016 en el hemisferio sur incluyen los siguientes componentes: Un virus A/California/7/2009 (H1N1)pdm09-like; Un virus A/Hong Kong/4801/2014 (H3N2)-like; Un virus B/Brisbane/60/2008-like. Se recomienda que las vacunas tetravalentes que contienen dos virus influenza B contengan los tres virus anteriores y un virus B/Phuket/3073/2013-like. n Vacunas VACUNACIÓN CONTRA EL VIRUS DEL PAPILOMA HUMANO (HPV) Riesgo de enfermedades autoinmunes: Un estudio Cnamts/ANSM tranquilizador (ANSM, Francia)
6 Los resultados de un estudio conjunto de la ANSM y l Assurance Maladie, sobre una cohorte de 2,2 millones de niñas de años, muestran que la vacunación el virus del papiloma humano (HPV) con Gardasil o Cervarix NO aumenta el riesgo global de desarrollar enfermedades autoinmunes para 14 patologías de interés evaluadas (enfermedad desmielinizante del sistema nervioso central incluyendo esclerosis múltiple, síndrome de Guillain-Barré, lupus, esclerodermia, vasculitis, artritis reumatoide/artritis juvenil, miositis, síndrome de Sjögren, enfermedad intestinal inflamatoria crónica, enfermedad celíaca, púrpura trombocitopénica autoinmune, diabetes tipo 1, tiroiditis y pancreatitis). La exposición a la vacunación contra el HPV no se asoció con la aparición de las 14 patologías de interés tomadas en conjunto, ni con 12 de ellas estudiadas por separado. Sin embargo, se encontró una asociación estadísticamente significativa entre la vacunación y dos de esas enfermedades (enfermedad intestinal inflamatoria crónica y síndrome de Guillain-Barré). Dado el bajo riesgo de enfermedad intestinal inflamatoria crónica, los responsables del estudio y el Comité Científico estiman que su asociación estadística muy baja no permite concluir un exceso de riesgo para esta enfermedad. Por otra parte, la literatura no sugiere que la vacunación en general sea un factor de riesgo para enfermedad intestinal inflamatoria crónica. En cambio, parece probable un mayor riesgo de síndrome de Guillain-Barré después de la vacunación contra el HPV, en vista de la fortaleza y solidez de la asociación a través de diferentes análisis de sensibilidad realizados. Este síndrome es un riesgo conocido y figura en la autorización de comercialización de Gardasil. Los resultados del estudio permiten precisar el riesgo de aparición de este síndrome que, teniendo en cuenta la rareza de la enfermedad, es limitado (del orden de 1-2 casos adicionales de síndrome de Guillain-Barré por cada niñas vacunadas). En general, los resultados del estudio son tranquilizadores y consistentes con la literatura internacional. Los beneficios esperados de la vacunación en términos de salud pública son mucho mayores que los riesgos a los que se puede exponer a las niñas. La vacunación contra el HPV, además de la prueba de Papanicolaou, debe ser continuada como una medida preventiva contra el cáncer de cuello uterino. En los últimos tres años se han recibido 243 notificaciones de sospechas de reacciones adversas con vacunas contra el virus del papiloma humano (HPV), ninguna de ellas reportada con enfermedad intestinal inflamatoria crónica o síndrome de Guillain-Barré. Ver Boletín Informativo Nº Nº 04/15 y 01/15. Novedades en Vacunas VACUNAS CONTRA EL HPV La EMA confirma que NO existe evidencia en la relación de estas vacunas con los síndromes de dolor regional complejo o taquicardia postural ortostática (EMA, Unión Europea) (HPRA, Irlanda) (ANSM, Francia) (AEMPS, España) El Comité de Productos Medicinales para Uso Humano de la EMA ha completado la revisión de la evidencia entorno a los reportes de dos síndromes, el síndrome de dolor regional complejo (DRC) y el síndrome de taquicardia postural ortostática (TPO) en mujeres jóvenes que recibieron la vacuna contra el virus del papiloma humano (HPV). Después de la debida consideración, el Comité confirmó la recomendación reciente del Comité de Evaluación de Riesgos en Farmacovigilancia de la EMA que la evidencia disponible no apoya una relación causal entre las vacunas y el desarrollo de estos síndromes. Desde el Departamento de Farmacovigilancia se informa que no se han recibido notificaciones de síndrome de dolor regional complejo y el síndrome de taquicardia postural ortostática asociados a la vacunación por HPV en los periodos Fuente: Novedades Internacionales y Nacionales en Seguridad de Medicamentos noviembre de Departamento de Farmacovigilancia. Dirección de Evaluación y Registro de Medicamentos. ANMAT. SE RECUERDA LA IMPORTANCIA DE NOTIFICAR LAS SOSPECHAS DE EVENTOS ADVERSOS RELACIONADOS CON EL USO DE UN MEDICAMENTO PUEDE HACERLO ON LINE, EN LA SIGUIENTE DIRECCIÓN:
7 Y PARA EL CASO DE REPORTES DE EVENTOS ASOCIADOS A VACUNAS:
Comunicación dirigida a profesionales sanitarios
 Comunicación dirigida a profesionales sanitarios Tecfidera (dimetilfumarato): Nuevas recomendaciones para minimizar el riesgo de leucoencefalopatía multifocal progresiva. Intensificación de las medidas
Comunicación dirigida a profesionales sanitarios Tecfidera (dimetilfumarato): Nuevas recomendaciones para minimizar el riesgo de leucoencefalopatía multifocal progresiva. Intensificación de las medidas
NOVEDADES INTERNACIONALES Y NACIONALES EN SEGURIDAD DE MEDICAMENTOS MAYO 2013
 NOVEDADES INTERNACIONALES Y NACIONALES EN SEGURIDAD DE MEDICAMENTOS MAYO 2013 INTERNACIONALES DE AGENCIAS REGULATORIAS BEVACIZUMAB Anticuerpo monoclonal Riesgo de fascitis necrotizante. (Health Canada,
NOVEDADES INTERNACIONALES Y NACIONALES EN SEGURIDAD DE MEDICAMENTOS MAYO 2013 INTERNACIONALES DE AGENCIAS REGULATORIAS BEVACIZUMAB Anticuerpo monoclonal Riesgo de fascitis necrotizante. (Health Canada,
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
 ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
El reservorio es humano y el modo de transmisión es por vía aérea a través de las secreciones nasofaríngeas de la persona infectada.
 Información general Rubéola La rubéola es una infección vírica que es leve en los niños, pero tiene consecuencias graves en las embarazadas porque puede causar muerte fetal o defectos congénitos en el
Información general Rubéola La rubéola es una infección vírica que es leve en los niños, pero tiene consecuencias graves en las embarazadas porque puede causar muerte fetal o defectos congénitos en el
PROGRAMA PROVINCIAL DE FARMACOVIGILANCIA
 PROGRAMA PROVINCIAL DE FARMACOVIGILANCIA BOLETÍN INFORMATIVO: Nº 09/2016 NOVEDADES NACIONALES E INTERNACIONALES EN SEGURIDAD DE MEDICAMENTOS NOVEDADES INTERNACIONALES DE AGENCIAS REGULADORAS INHIBIDORES
PROGRAMA PROVINCIAL DE FARMACOVIGILANCIA BOLETÍN INFORMATIVO: Nº 09/2016 NOVEDADES NACIONALES E INTERNACIONALES EN SEGURIDAD DE MEDICAMENTOS NOVEDADES INTERNACIONALES DE AGENCIAS REGULADORAS INHIBIDORES
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
Kylend Presentación: Acción terapéutica: Indicaciones: Posología y administración: Contraindicaciones: Embarazo:
 Kylend Lenalidomida Cápsulas duras. Venta bajo receta archivada. Nota importante: Antes de proceder a la prescripción, consulta toda la información respectiva. Presentación: Cápsulas duras de 5, 10, 15
Kylend Lenalidomida Cápsulas duras. Venta bajo receta archivada. Nota importante: Antes de proceder a la prescripción, consulta toda la información respectiva. Presentación: Cápsulas duras de 5, 10, 15
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA Comunicación sobre cambios en la información de seguridad de Sibutramina para profesionales sanitarios Mayo de 2010 NOTA INFORMATIVA
DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA Comunicación sobre cambios en la información de seguridad de Sibutramina para profesionales sanitarios Mayo de 2010 NOTA INFORMATIVA
Qué es la gripe? La gripe es una enfermedad transmisible producida por un virus, con mayor incidencia en los meses de invierno y sus complicaciones pu
 Qué es la gripe? La gripe es una enfermedad transmisible producida por un virus, con mayor incidencia en los meses de invierno y sus complicaciones pueden dar lugar a problemas de salud importantes, especialmente
Qué es la gripe? La gripe es una enfermedad transmisible producida por un virus, con mayor incidencia en los meses de invierno y sus complicaciones pueden dar lugar a problemas de salud importantes, especialmente
MANEJO DE RAM JOSÉ CORNEJO GARCÍA NEUMÓLOGO HOSPITAL NACIONAL ARZOBISPO LOAYZA
 MANEJO DE RAM JOSÉ CORNEJO GARCÍA NEUMÓLOGO HOSPITAL NACIONAL ARZOBISPO LOAYZA QUE ES UNA RAM? Es una reacción adversa, no deseada ni intencionada, de un paciente a un fármaco adecuadamente administrado,
MANEJO DE RAM JOSÉ CORNEJO GARCÍA NEUMÓLOGO HOSPITAL NACIONAL ARZOBISPO LOAYZA QUE ES UNA RAM? Es una reacción adversa, no deseada ni intencionada, de un paciente a un fármaco adecuadamente administrado,
La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos.
 Pág. 1 de 5 La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad y eficacia de los medicamentos basados
Pág. 1 de 5 La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad y eficacia de los medicamentos basados
MICOFENOLATO DE MOFETILO O ÁCIDO MICOFENÓLICO
 DEPARTAMENTO DE MEDICAMENTOS DE USO HUMANO División de Farmacoepidemiología y Farmacovigilancia Modificaciones de la información de los medicamentos autorizados por procedimiento puramente nacional que
DEPARTAMENTO DE MEDICAMENTOS DE USO HUMANO División de Farmacoepidemiología y Farmacovigilancia Modificaciones de la información de los medicamentos autorizados por procedimiento puramente nacional que
Keytruda es un medicamento biológico
 KEYTRUDA (pembrolizumab) Información importante para Profesionales Sanitarios sobre reacciones adversas inmunorelacionadas Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada
KEYTRUDA (pembrolizumab) Información importante para Profesionales Sanitarios sobre reacciones adversas inmunorelacionadas Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada
Anexo IV. Conclusiones científicas
 Anexo IV Conclusiones científicas 1 Conclusiones científicas Se han notificado cuatro casos de lesión hepática grave que condujo a un trasplante hepático desde la autorización de comercialización de Esmya.
Anexo IV Conclusiones científicas 1 Conclusiones científicas Se han notificado cuatro casos de lesión hepática grave que condujo a un trasplante hepático desde la autorización de comercialización de Esmya.
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS. Esther Salgueiro 10, 17 de Marzo de 2015
 FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
Valdoxan /Thymanax (agomelatina)
 Valdoxan /Thymanax (agomelatina) Información de seguridad para profesionales sanitarios Recomendaciones sobre cómo realizar el control de la función hepática del paciente Información sobre prevención de
Valdoxan /Thymanax (agomelatina) Información de seguridad para profesionales sanitarios Recomendaciones sobre cómo realizar el control de la función hepática del paciente Información sobre prevención de
FDA modifica el monitoreo de la neutropenia asociada con clozapina; nuevo programa REMS para todos los medicamentos con clozapina
 FDA modifica el monitoreo de la neutropenia asociada con clozapina; nuevo programa REMS para todos los medicamentos con clozapina FDA, 15 de septiembre de 2015 La Administración de Alimentos y Medicamentos
FDA modifica el monitoreo de la neutropenia asociada con clozapina; nuevo programa REMS para todos los medicamentos con clozapina FDA, 15 de septiembre de 2015 La Administración de Alimentos y Medicamentos
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Preguntas para responder
 Preguntas para responder DIAGNÓSTICO DEL LUPUS ERITEMATOSO SISTÉMICO Detección precoz 1. La detección precoz y el tratamiento temprano mejoran el pronóstico y la supervivencia de las personas con lupus
Preguntas para responder DIAGNÓSTICO DEL LUPUS ERITEMATOSO SISTÉMICO Detección precoz 1. La detección precoz y el tratamiento temprano mejoran el pronóstico y la supervivencia de las personas con lupus
Domperidona: pequeño aumento del riesgo de arritmias ventriculares graves o muerte cardiaca súbita.
 Pág. 1 de 5 Domperidona: pequeño aumento del riesgo de arritmias ventriculares graves o muerte cardiaca súbita. El objetivo de esta alerta internacional es difundir información sobre la seguridad y eficacia
Pág. 1 de 5 Domperidona: pequeño aumento del riesgo de arritmias ventriculares graves o muerte cardiaca súbita. El objetivo de esta alerta internacional es difundir información sobre la seguridad y eficacia
Nota mensual. Medicamentos. Marzo. sobre. de Uso Humano y Productos Sanitarios. Medicamentos
 Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Conclusiones científicas
 Anexo II Conclusiones científicas y motivos para la revocación o modificación de los términos de las autorizaciones de comercialización y explicación detallada de las diferencias de la recomendación del
Anexo II Conclusiones científicas y motivos para la revocación o modificación de los términos de las autorizaciones de comercialización y explicación detallada de las diferencias de la recomendación del
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL
 MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL v.1 actualización: 17 de mayo de 2013 Fecha de publicación: 17 de mayo de 2013 CORREO ELECTRÓNICO smhaem@aemps.es Página 1 de 6 C/ CAMPEZO, 1 EDIFICIO 8 28022
MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL v.1 actualización: 17 de mayo de 2013 Fecha de publicación: 17 de mayo de 2013 CORREO ELECTRÓNICO smhaem@aemps.es Página 1 de 6 C/ CAMPEZO, 1 EDIFICIO 8 28022
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
Información importante para el profesional sanitario sobre el tratamiento con LADEVINA
 Información importante para el profesional sanitario sobre el tratamiento con LADEVINA INTRODUCCION LADEVINA es un fármaco inmunomodulador. Estudios clínicos fase III, mostraron que en pacientes pretratados
Información importante para el profesional sanitario sobre el tratamiento con LADEVINA INTRODUCCION LADEVINA es un fármaco inmunomodulador. Estudios clínicos fase III, mostraron que en pacientes pretratados
sistema inmunitario está diseñado para combatir las substancias ajenas o extrañas al cuerpo. En las personas con lupus, el sistema inmunitario se
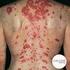 LUPUS El sistema inmunitario está diseñado para combatir las substancias ajenas o extrañas al cuerpo. En las personas con lupus, el sistema inmunitario se afecta y ataca a las células y tejidos sanos.
LUPUS El sistema inmunitario está diseñado para combatir las substancias ajenas o extrañas al cuerpo. En las personas con lupus, el sistema inmunitario se afecta y ataca a las células y tejidos sanos.
OPS/OMS UNICEF UNFPA
 OPS/OMS UNICEF UNFPA Razón de Mortalidad Materna por Departamentos Bolivia 2000-2011 Causas de Muerte Materna (directas e indirectas) en Bolivia - 2011 1% Parto prolongado 12% Hipertensión 8% Aborto 1%VIH
OPS/OMS UNICEF UNFPA Razón de Mortalidad Materna por Departamentos Bolivia 2000-2011 Causas de Muerte Materna (directas e indirectas) en Bolivia - 2011 1% Parto prolongado 12% Hipertensión 8% Aborto 1%VIH
FINGOLIMOD ( GILENYA): NUEVAS CONTRAINDICACIONES DE USO EN PACIENTES CON PATOLOGÍA CARDIACA SUBYACENTE Y RECOMENDACIONES DE REVISIONES DERMATOLÓGICAS
 FINGOLIMOD ( GILENYA): NUEVAS CONTRAINDICACIONES DE USO EN PACIENTES CON PATOLOGÍA CARDIACA SUBYACENTE Y RECOMENDACIONES DE REVISIONES DERMATOLÓGICAS La Agencia Española de Medicamentos y Productos Sanitarios
FINGOLIMOD ( GILENYA): NUEVAS CONTRAINDICACIONES DE USO EN PACIENTES CON PATOLOGÍA CARDIACA SUBYACENTE Y RECOMENDACIONES DE REVISIONES DERMATOLÓGICAS La Agencia Española de Medicamentos y Productos Sanitarios
Anexo III. Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto
 Anexo III Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto Nota: Este resumen de las características del producto y prospecto son el resultado del
Anexo III Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto Nota: Este resumen de las características del producto y prospecto son el resultado del
Ministerio de Salud Secretaría de Política, Regulación y Relaciones Sanitarias A.N.M.A.T.
 BUENOS AIRES, 07 Sep 2007 VISTO la Resolución del ex Ministerio de Salud y Acción Social N 706/93, la Disposición N 5904/96, el Expediente N 1-0047-0000-014095-07-9 del registro de esta Administración
BUENOS AIRES, 07 Sep 2007 VISTO la Resolución del ex Ministerio de Salud y Acción Social N 706/93, la Disposición N 5904/96, el Expediente N 1-0047-0000-014095-07-9 del registro de esta Administración
USO COMPASIVO DEL ACIDO MICOFENOLICO EN EL LUPUS
 PANADERO ESTEBAN MI, BECARES FJ, CASTILLO E, BONILLA M, TOLEDANO G, TORTAJADA E. USO COMPASIVO DEL ACIDO MICOFENOLICO EN EL LUPUS ERITEMATOSO SISTÉMICO 54 CONGRESO SEFH MARIBEL PANADERO ESTEBAN SERVICIO
PANADERO ESTEBAN MI, BECARES FJ, CASTILLO E, BONILLA M, TOLEDANO G, TORTAJADA E. USO COMPASIVO DEL ACIDO MICOFENOLICO EN EL LUPUS ERITEMATOSO SISTÉMICO 54 CONGRESO SEFH MARIBEL PANADERO ESTEBAN SERVICIO
B. Gálvez piso /15
 Santa Fe, 16 de Junio de 2017 El Ministerio de Salud a través de la y Prevención de la Salud de Santa Fe informa que en el ámbito de la Provincia de Santa Fe desde el mes de abril en que fue detectado
Santa Fe, 16 de Junio de 2017 El Ministerio de Salud a través de la y Prevención de la Salud de Santa Fe informa que en el ámbito de la Provincia de Santa Fe desde el mes de abril en que fue detectado
Resumen general de la evaluación científica de los medicamentos que contienen nimesulida para uso sistémico (Ver Anexo I)
 Anexo II Conclusiones científicas y motivos de la modificación de los resúmenes de las características del producto y los prospectos presentados por la EMA 41 Conclusiones científicas Resumen general de
Anexo II Conclusiones científicas y motivos de la modificación de los resúmenes de las características del producto y los prospectos presentados por la EMA 41 Conclusiones científicas Resumen general de
este año SIN EXCUSAS me Vacuno contra la gripe Recomendaciones de la sociedad Española de geriatría y gerontología para PROfEsIONALEs sanitarios
 este año SIN S me Vacuno contra la gripe Recomendaciones de la sociedad Española de geriatría y gerontología para PROfEsIONALEs sanitarios S Y EVIDENCIAS SOBRE N.º 1 La gripe es una infección banal PRIMERA
este año SIN S me Vacuno contra la gripe Recomendaciones de la sociedad Española de geriatría y gerontología para PROfEsIONALEs sanitarios S Y EVIDENCIAS SOBRE N.º 1 La gripe es una infección banal PRIMERA
FARMACOVIGILANCIA Información destinada a los profesionales de la salud
 FARMACOVIGILANCIA Información destinada a los profesionales de la salud 02/05/12 Finasteride. Riesgo de disfunción sexual y cáncer de mama. ANMAT. Desde la comercialización de finasteride en la Unión Europea
FARMACOVIGILANCIA Información destinada a los profesionales de la salud 02/05/12 Finasteride. Riesgo de disfunción sexual y cáncer de mama. ANMAT. Desde la comercialización de finasteride en la Unión Europea
Comunicación dirigida a profesionales sanitarios
 Comunicación dirigida a profesionales sanitarios Bendamustina (Levact, Bendamustina Accord, Bendamustina Dr. Reddys, Bendamustina Intas): aumento de la mortalidad observado en estudios clínicos recientes
Comunicación dirigida a profesionales sanitarios Bendamustina (Levact, Bendamustina Accord, Bendamustina Dr. Reddys, Bendamustina Intas): aumento de la mortalidad observado en estudios clínicos recientes
PROGRAMA PROVINCIAL DE FARMACOVIGILANCIA BOLETÍN INFORMATIVO: Nº 09/2013 NOVEDADES NACIONALES E INTERNACIONALES EN SEGURIDAD
 PROGRAMA PROVINCIAL DE FARMACOVIGILANCIA BOLETÍN INFORMATIVO: Nº 09/2013 NOVEDADES NACIONALES E INTERNACIONALES EN SEGURIDAD DE MEDICAMENTOS -AGOSTO 2013- NOVEDADES INTERNACIONALES DE AGENCIAS REGULADORAS
PROGRAMA PROVINCIAL DE FARMACOVIGILANCIA BOLETÍN INFORMATIVO: Nº 09/2013 NOVEDADES NACIONALES E INTERNACIONALES EN SEGURIDAD DE MEDICAMENTOS -AGOSTO 2013- NOVEDADES INTERNACIONALES DE AGENCIAS REGULADORAS
PROGRAMA INSTITUCIONAL DE FARMACOVIGILANCIA COLOMBIANA DE SALUD
 Página 1 de 6 CDS-IDM 2.6.5-01 PROGRAMA INSTITUCIONAL DE COLOMBIANA DE SALUD FEBRERO 2013 Página 2 de 6 CDS-IDM 2.6.5-01 JUSTIFICACION: Debido a que la información sobre un fármaco reunida durante la fase
Página 1 de 6 CDS-IDM 2.6.5-01 PROGRAMA INSTITUCIONAL DE COLOMBIANA DE SALUD FEBRERO 2013 Página 2 de 6 CDS-IDM 2.6.5-01 JUSTIFICACION: Debido a que la información sobre un fármaco reunida durante la fase
Mtra. María Elena Pajarito Melchor Coordinadora Estatal del Programa de Atención a la Salud de la Infancia y Adolescencia.
 Guadalajara Jal, 05 de Octubre de 2016 Mtra. María Elena Pajarito Melchor Coordinadora Estatal del Programa de Atención a la Salud de la Infancia y Adolescencia. Influenza Enfermedad infecciosa de origen
Guadalajara Jal, 05 de Octubre de 2016 Mtra. María Elena Pajarito Melchor Coordinadora Estatal del Programa de Atención a la Salud de la Infancia y Adolescencia. Influenza Enfermedad infecciosa de origen
B. Gálvez piso /15
 Santa Fe, 24 de septiembre de 2018 El Ministerio de Salud a través de la y Prevención de la Salud de Santa Fe informa que en el ámbito de la Provincia de Santa Fe desde la Semana Epidemiológica 30 que
Santa Fe, 24 de septiembre de 2018 El Ministerio de Salud a través de la y Prevención de la Salud de Santa Fe informa que en el ámbito de la Provincia de Santa Fe desde la Semana Epidemiológica 30 que
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
LEFLUNOMIDA. Información sobre seguridad para los profesionales sanitarios
 LEFLUNOMIDA Información sobre seguridad para los profesionales sanitarios Leflunomida es un fármaco antirreumático modificador de la enfermedad" (FARME) indicado para el tratamiento de pacientes adultos
LEFLUNOMIDA Información sobre seguridad para los profesionales sanitarios Leflunomida es un fármaco antirreumático modificador de la enfermedad" (FARME) indicado para el tratamiento de pacientes adultos
Anexo III. Modificaciones a las secciones relevantes de ficha técnica y prospecto
 Anexo III Modificaciones a las secciones relevantes de ficha técnica y prospecto Nota: La ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados posteriormente
Anexo III Modificaciones a las secciones relevantes de ficha técnica y prospecto Nota: La ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados posteriormente
Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias A.N.M.A.T.
 BUENOS AIRES, 24 Oct 2007 VISTO la Resolución del ex y Acción Social Nº 706/93, la Disposición Nº 5904/96, la Disposición Nº 3855/98, el Expediente Nº 1-0047- 0000-016483-07-1 del registro de esta Administración
BUENOS AIRES, 24 Oct 2007 VISTO la Resolución del ex y Acción Social Nº 706/93, la Disposición Nº 5904/96, la Disposición Nº 3855/98, el Expediente Nº 1-0047- 0000-016483-07-1 del registro de esta Administración
JORNADA PARA PROFESIONALES SOBRE USO MEDICINAL DE CANNABIS
 JORNADA PARA PROFESIONALES SOBRE USO MEDICINAL DE CANNABIS Acceso actual a la utilización de Cannabis en la Provincia de Santa Fe. Comisión Provincial de Medicamentos Valeria Palchik Rosario, 10 de Noviembre
JORNADA PARA PROFESIONALES SOBRE USO MEDICINAL DE CANNABIS Acceso actual a la utilización de Cannabis en la Provincia de Santa Fe. Comisión Provincial de Medicamentos Valeria Palchik Rosario, 10 de Noviembre
Tratamiento de EPOC y oxigenoterapia
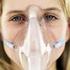 Tratamiento de EPOC y oxigenoterapia Dr. Chih Hao Chen Ku Farmacología Clínica Hospital San Juan de Dios Universidad de Costa Rica Componentes del manejo 1. Valorar y monitorizar la enfermedad 2. Reducir
Tratamiento de EPOC y oxigenoterapia Dr. Chih Hao Chen Ku Farmacología Clínica Hospital San Juan de Dios Universidad de Costa Rica Componentes del manejo 1. Valorar y monitorizar la enfermedad 2. Reducir
Posible asociación. Introducción y objetivos
 Posible asociación La demencia supone una carga social significativa y creciente y las opciones para el tratamiento de los pacientes que presentan esta enfermedad son limitadas; por lo tanto, la identificación
Posible asociación La demencia supone una carga social significativa y creciente y las opciones para el tratamiento de los pacientes que presentan esta enfermedad son limitadas; por lo tanto, la identificación
Historia de modificaciones del documento
 Páginas 1 de 5 Formularios del ISCO3 para el Reporte de Eventos Adversos Este documento proporciona orientación y plantillas para obtener los registros de Eventos Adversos durante la práctica de la terapia
Páginas 1 de 5 Formularios del ISCO3 para el Reporte de Eventos Adversos Este documento proporciona orientación y plantillas para obtener los registros de Eventos Adversos durante la práctica de la terapia
FÓRMULA CUALI CUANTITATIVA:
 VACUNAANTIGRIPAL VENTABAJORECETA FORMAFARMACÉUTICA: Suspensióninyectableporvíaintramuscular(jeringaprellenadade0,5ml) FÓRMULACUALI CUANTITATIVA: Cadajeringaprellenadade0,5mlcontiene: Antigenosdehemoaglutininayneuraminidasasdelassiguientescepasdevirusinfluenza:
VACUNAANTIGRIPAL VENTABAJORECETA FORMAFARMACÉUTICA: Suspensióninyectableporvíaintramuscular(jeringaprellenadade0,5ml) FÓRMULACUALI CUANTITATIVA: Cadajeringaprellenadade0,5mlcontiene: Antigenosdehemoaglutininayneuraminidasasdelassiguientescepasdevirusinfluenza:
Anexo IV. Conclusiones científicas
 Anexo IV Conclusiones científicas 38 Conclusiones científicas Las pruebas científicas sobre la leucoencefalopatía multifocal progresiva (LMP) en pacientes tratados con Tysabri son cada vez más numerosas.
Anexo IV Conclusiones científicas 38 Conclusiones científicas Las pruebas científicas sobre la leucoencefalopatía multifocal progresiva (LMP) en pacientes tratados con Tysabri son cada vez más numerosas.
PROGRAMA DE PREVENCIÓN Y VIGILANCIA DE LA GRIPE EN LA COMUNIDAD VALENCIANA.
 PROGRAMA DE PREVENCIÓN Y VIGILANCIA DE LA GRIPE EN LA COMUNIDAD VALENCIANA. OBJETIVOS. 1. Prevenir las complicaciones y la mortalidad secundarias a la gripe en los grupos de riesgo especialmente susceptibles
PROGRAMA DE PREVENCIÓN Y VIGILANCIA DE LA GRIPE EN LA COMUNIDAD VALENCIANA. OBJETIVOS. 1. Prevenir las complicaciones y la mortalidad secundarias a la gripe en los grupos de riesgo especialmente susceptibles
ALERTA RÁPIDA EUROPEA DEL MEDICAMENTO VETERINARIO VELACTIS
 Sanitarios AEMPS ALERTA RÁPIDA EUROPEA DEL MEDICAMENTO VETERINARIO VELACTIS Fecha de publicación: 1 de julio de 2016 Categoría: MEDICAMENTOS VETERINARIOS, SEGURIDAD. Referencia: MVET, 5/2016 Suspensión
Sanitarios AEMPS ALERTA RÁPIDA EUROPEA DEL MEDICAMENTO VETERINARIO VELACTIS Fecha de publicación: 1 de julio de 2016 Categoría: MEDICAMENTOS VETERINARIOS, SEGURIDAD. Referencia: MVET, 5/2016 Suspensión
Medicamentos biológicos y biosimilares
 Medicamentos biológicos y biosimilares Guía breve para el paciente Qué son los medicamentos biológicos? Los medicamentos biológicos son moléculas grandes y complejas, que se obtienen a partir de organismos
Medicamentos biológicos y biosimilares Guía breve para el paciente Qué son los medicamentos biológicos? Los medicamentos biológicos son moléculas grandes y complejas, que se obtienen a partir de organismos
Control prenatal. Parto. Post parto
 Control prenatal Parto Post parto INE 9 SEDES OPS/OMS UNICEF ESTUDIO DE MUERTE MATERNA Metodología RAMOS modificada RAMOS = Reproductive Age MOrtality Survey UNFPA JICA BM BID OTROS Principales elementos
Control prenatal Parto Post parto INE 9 SEDES OPS/OMS UNICEF ESTUDIO DE MUERTE MATERNA Metodología RAMOS modificada RAMOS = Reproductive Age MOrtality Survey UNFPA JICA BM BID OTROS Principales elementos
CAMPAÑA DE VACUNACIÓN ANTIGRIPAL
 CAMPAÑA DE VACUNACIÓN ANTIGRIPAL 2016-2017 I. JUSTIFICACIÓN La gripe es un importante problema de salud pública, tanto por la mortalidad que puede provocar directa o indirectamente (en pacientes con patologías
CAMPAÑA DE VACUNACIÓN ANTIGRIPAL 2016-2017 I. JUSTIFICACIÓN La gripe es un importante problema de salud pública, tanto por la mortalidad que puede provocar directa o indirectamente (en pacientes con patologías
Farmacovigilancia en la República Dominicana. Dr. Lucas ML Lanfranco Encargado de la Unidad de farmacovigilancia La Antigua, Guatemala Octubre 2013
 Farmacovigilancia en la República Dominicana Dr. Lucas ML Lanfranco Encargado de la Unidad de farmacovigilancia La Antigua, Guatemala Octubre 2013 Marco Legal La Ley General de Salud (No. 42-01) regula
Farmacovigilancia en la República Dominicana Dr. Lucas ML Lanfranco Encargado de la Unidad de farmacovigilancia La Antigua, Guatemala Octubre 2013 Marco Legal La Ley General de Salud (No. 42-01) regula
TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO
 TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO Estimado profesional sanitario, Febrero 2014 Teofarma S.r.l,
TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO Estimado profesional sanitario, Febrero 2014 Teofarma S.r.l,
La EMA confirma las recomendaciones para minimizar el riesgo de LMP, una infección cerebral, con Tysabri
 25/04/2016 EMA/266665/2016 La EMA confirma las recomendaciones para minimizar el riesgo de LMP, una infección Se deberá considerar la realización de resonancias magnéticas más frecuentes en los pacientes
25/04/2016 EMA/266665/2016 La EMA confirma las recomendaciones para minimizar el riesgo de LMP, una infección Se deberá considerar la realización de resonancias magnéticas más frecuentes en los pacientes
Anexo III. Enmiendas a las secciones relevantes de la información del producto
 Nota: Anexo III Enmiendas a las secciones relevantes de la información del producto Estas enmiendas a las secciones relevantes de la información del producto son el resultado de un procedimiento de arbitraje.
Nota: Anexo III Enmiendas a las secciones relevantes de la información del producto Estas enmiendas a las secciones relevantes de la información del producto son el resultado de un procedimiento de arbitraje.
DIRECCIÓN DE REGULACIÓN DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCIÓN DE REGULACIÓN DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I SEMESTRE DEL 2014 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer semestre de 2014 (enero de 2014 hasta
DIRECCIÓN DE REGULACIÓN DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I SEMESTRE DEL 2014 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer semestre de 2014 (enero de 2014 hasta
Anexo- IV-Sistema GRADE de evaluación de la evidencia y formulación de recomendaciones
 Anexo- IV-Sistema GRADE de evaluación de la evidencia y formulación de recomendaciones El sistema GRADE se basa en una serie de juicios secuenciales que comienzan con la clasificación de la importancia
Anexo- IV-Sistema GRADE de evaluación de la evidencia y formulación de recomendaciones El sistema GRADE se basa en una serie de juicios secuenciales que comienzan con la clasificación de la importancia
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS INZITAN (DEXAMETASONA, TIAMINA, CIANOCOBALAMINA, LIDOCAÍNA): SUSPENSIÓN DE COMERCIALIZACIÓN Fecha de publicación: 30 de noviembre
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS INZITAN (DEXAMETASONA, TIAMINA, CIANOCOBALAMINA, LIDOCAÍNA): SUSPENSIÓN DE COMERCIALIZACIÓN Fecha de publicación: 30 de noviembre
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada película bucodispersable contiene 16 mg de extracto (como extracto seco) de hoja
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada película bucodispersable contiene 16 mg de extracto (como extracto seco) de hoja
Comparación de las vacunas profilácticas aprobadas contra el virus del papiloma humano
 Comparación de las vacunas profilácticas aprobadas contra el virus del papiloma humano La infección por serotipos oncogénicos del virus del papiloma humano (VPH) puede progresar hacia cáncer de cuello
Comparación de las vacunas profilácticas aprobadas contra el virus del papiloma humano La infección por serotipos oncogénicos del virus del papiloma humano (VPH) puede progresar hacia cáncer de cuello
DIRECCIÓN DE REGULACIÓN DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCIÓN DE REGULACIÓN DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME II SEMESTRE DEL 2014 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el segundo semestre de 2014 (julio de 2014 hasta
DIRECCIÓN DE REGULACIÓN DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME II SEMESTRE DEL 2014 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el segundo semestre de 2014 (julio de 2014 hasta
Comunicación dirigida a Profesionales Sanitarios
 Comunicación dirigida a Profesionales Sanitarios Julio de 2015 XGEVA (denosumab): medidas establecidas para minimizar el riesgo de osteonecrosis mandibular Estimado Profesional Sanitario, Amgen S.A. de
Comunicación dirigida a Profesionales Sanitarios Julio de 2015 XGEVA (denosumab): medidas establecidas para minimizar el riesgo de osteonecrosis mandibular Estimado Profesional Sanitario, Amgen S.A. de
Pautas clínicas KDIGO Glomeruloesclerosis focal y segmentaria idiopática (GFS idiopática) en adultos - recomendaciones Thais Foster
 Pautas clínicas KDIGO Glomeruloesclerosis focal y segmentaria idiopática (GFS idiopática) en adultos - recomendaciones Thais Foster recomendada por el equipo docente de las pautas clínicas KDIGO KDIGO
Pautas clínicas KDIGO Glomeruloesclerosis focal y segmentaria idiopática (GFS idiopática) en adultos - recomendaciones Thais Foster recomendada por el equipo docente de las pautas clínicas KDIGO KDIGO
CAMPAÑA DE VACUNACIÓN ANTIGRIPAL EN ADULTOS
 CAMPAÑA DE VACUNACIÓN ANTIGRIPAL EN ADULTOS 2008-2009 I. JUSTIFICACIÓN La gripe es un importante problema de salud pública, tanto por la mortalidad que puede provocar directa o indirectamente (en pacientes
CAMPAÑA DE VACUNACIÓN ANTIGRIPAL EN ADULTOS 2008-2009 I. JUSTIFICACIÓN La gripe es un importante problema de salud pública, tanto por la mortalidad que puede provocar directa o indirectamente (en pacientes
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Regender 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 120 mg de extracto
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Regender 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 120 mg de extracto
ACTUALIZACIÓN EN VACUNACIÓN FRENTE AL NEUMOCOCO
 Vara de Rey, 8. Planta 1ª 26071 Logroño. La Rioja. Teléfono: 941 291 100 Fax: 941 272418 Salud Salud Pública y Consumo ACTUALIZACIÓN EN VACUNACIÓN FRENTE AL NEUMOCOCO La administración de la vacuna antineumocócica
Vara de Rey, 8. Planta 1ª 26071 Logroño. La Rioja. Teléfono: 941 291 100 Fax: 941 272418 Salud Salud Pública y Consumo ACTUALIZACIÓN EN VACUNACIÓN FRENTE AL NEUMOCOCO La administración de la vacuna antineumocócica
Anexo II. Conclusiones científicas
 Anexo II Conclusiones científicas 7 Conclusiones científicas Solu-Medrol 40 mg polvo y disolvente para solución inyectable (en adelante, «Solu-Medrol») contiene metilprednisolona y, como excipiente, lactosa
Anexo II Conclusiones científicas 7 Conclusiones científicas Solu-Medrol 40 mg polvo y disolvente para solución inyectable (en adelante, «Solu-Medrol») contiene metilprednisolona y, como excipiente, lactosa
PROGRAMA PERMANENTE DE FARMACOVIGILANCIA
 PROGRAMA PERMANENTE DE FARMACOVIGILANCIA MAYO, 2014 Farmacovigilancia Ciencia que trata de recoger, vigilar, investigar y evaluar la información sobre los efectos de los medicamentos, productos biológicos,
PROGRAMA PERMANENTE DE FARMACOVIGILANCIA MAYO, 2014 Farmacovigilancia Ciencia que trata de recoger, vigilar, investigar y evaluar la información sobre los efectos de los medicamentos, productos biológicos,
Novedades Internacionales y Nacionales en Seguridad de Medicamentos Octubre de 2015
 Novedades Internacionales y Nacionales en Seguridad de Medicamentos Octubre de 2015 Departamento de Farmacovigilancia Administración Nacional de Medicamentos, Alimentos y Tecnología Médica 1 Índice Novedades
Novedades Internacionales y Nacionales en Seguridad de Medicamentos Octubre de 2015 Departamento de Farmacovigilancia Administración Nacional de Medicamentos, Alimentos y Tecnología Médica 1 Índice Novedades
Capacitación Equipo regional Dengue Miércoles 22 enero 2014
 Capacitación Equipo regional Dengue Miércoles 22 enero 2014 Enfermedad predominantemente sintomática (3-28% de asintomáticos), Hay enfermedad aguda, subaguda y crónica. No existe una vacuna ni tratamiento
Capacitación Equipo regional Dengue Miércoles 22 enero 2014 Enfermedad predominantemente sintomática (3-28% de asintomáticos), Hay enfermedad aguda, subaguda y crónica. No existe una vacuna ni tratamiento
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Estudios acerca de la prevalencia de trastorno depresivo mayor en pacientes clínicamente enfermos.
 Los pacientes con depresión y tienen mayor morbilidad y menor desempeño que los individuos con depresión, sin comorbilidades; además, las tasas de recuperación son menores y tienen más recaídas.. Dr. Iosifescu
Los pacientes con depresión y tienen mayor morbilidad y menor desempeño que los individuos con depresión, sin comorbilidades; además, las tasas de recuperación son menores y tienen más recaídas.. Dr. Iosifescu
"RECOMENDACIONES DE TRATAMIENTO ANTIVIRAL EN INFECCIONES RESPIRATORIAS BAJAS 2012"
 "RECOMENDACIONES DE TRATAMIENTO ANTIVIRAL EN INFECCIONES RESPIRATORIAS BAJAS 2012" Comité de Infectología Los informes semanales de la Vigilancia de Infecciones Respiratorias Agudas en Argentina que publica
"RECOMENDACIONES DE TRATAMIENTO ANTIVIRAL EN INFECCIONES RESPIRATORIAS BAJAS 2012" Comité de Infectología Los informes semanales de la Vigilancia de Infecciones Respiratorias Agudas en Argentina que publica
DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I SEMESTRE DEL 2015 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer semestre del 2015
DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I SEMESTRE DEL 2015 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer semestre del 2015
Preguntas para responder
 reguntas para responder TRATAMIENTO FARMACOLÓGICO 1. En los pacientes mayores de 65 años con insuficiencia cardiaca crónica y fracción de eyección del ventrículo izquierdo menor al 50 %, se recomienda
reguntas para responder TRATAMIENTO FARMACOLÓGICO 1. En los pacientes mayores de 65 años con insuficiencia cardiaca crónica y fracción de eyección del ventrículo izquierdo menor al 50 %, se recomienda
Informe Sistema Notificación de Efectos adversos supuestamente atribuibles a la vacunación o inmunización. Año 2015.
 Informe Sistema Notificación de Efectos adversos supuestamente atribuibles a la vacunación o inmunización. Año 2015. Unidad de Inmunizaciones, División Epidemiología - Unidad de Farmacovigilancia, Departamento
Informe Sistema Notificación de Efectos adversos supuestamente atribuibles a la vacunación o inmunización. Año 2015. Unidad de Inmunizaciones, División Epidemiología - Unidad de Farmacovigilancia, Departamento
Guía para profesionales sanitarios LEMTRADA. Información importante de seguridad. (alemtuzumab)
 LEMTRADA (alemtuzumab) Guía para profesionales sanitarios Información importante de seguridad Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de reacciones adversas
LEMTRADA (alemtuzumab) Guía para profesionales sanitarios Información importante de seguridad Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de reacciones adversas
Comunicación dirigida a los profesionales sanitarios
 Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Enfermedades raras y Medicamentos huérfanos
 Marzo 2012 Volumen 2, número 3 Enfermedades raras y Medicamentos huérfanos Caja Costarricense de Seguro Social Servicio de Farmacia Centro de Información de Medicamentos y Farmacoterapéutica El concepto
Marzo 2012 Volumen 2, número 3 Enfermedades raras y Medicamentos huérfanos Caja Costarricense de Seguro Social Servicio de Farmacia Centro de Información de Medicamentos y Farmacoterapéutica El concepto
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Suero Fisiológico Braun 0,9% Disolvente para uso parenteral Cloruro de sodio
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Suero Fisiológico Braun 0,9% Disolvente para uso parenteral Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
PROSPECTO: INFORMACIÓN PARA EL USUARIO Suero Fisiológico Braun 0,9% Disolvente para uso parenteral Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I SEMESTRE DEL 2016 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer semestre del 2016
DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I SEMESTRE DEL 2016 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer semestre del 2016
REMEDIAR + REDES. Hipertensión arterial
 REMEDIAR + REDES Hipertensión arterial Tratamiento farmacológico Dra. Laura Antonietti Tratamiento farmacológico A quiénes tratar con fármacos? Quéfármaco indicar? Tratamiento farmacológico A quiénes tratar
REMEDIAR + REDES Hipertensión arterial Tratamiento farmacológico Dra. Laura Antonietti Tratamiento farmacológico A quiénes tratar con fármacos? Quéfármaco indicar? Tratamiento farmacológico A quiénes tratar
18 mayo / actualización
 18 mayo / 2016 actualización Vacunación contra la gripe en el año 2016: los virus circulantes son concordantes con las cepas incluidas en la vacuna trivalente en el 91% de los casos Dra. GRACIELA PÉREZ
18 mayo / 2016 actualización Vacunación contra la gripe en el año 2016: los virus circulantes son concordantes con las cepas incluidas en la vacuna trivalente en el 91% de los casos Dra. GRACIELA PÉREZ
7. Tratamiento farmacológico en ancianos
 7. Tratamiento farmacológico en ancianos Preguntas a responder: Está indicado el tratamiento con estatinas en prevención primaria de enfermedad cardiovascular en pacientes ancianos (mayores de 74 años)?
7. Tratamiento farmacológico en ancianos Preguntas a responder: Está indicado el tratamiento con estatinas en prevención primaria de enfermedad cardiovascular en pacientes ancianos (mayores de 74 años)?
Denominación (de fantasía) Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé
 Anexo I Lista de las denominaciones (de fantasía), forma farmacéutica, dosis de los medicamentos, forma de administración, solicitantes/titulares de la autorización de comercialización en los Estados Miembros
Anexo I Lista de las denominaciones (de fantasía), forma farmacéutica, dosis de los medicamentos, forma de administración, solicitantes/titulares de la autorización de comercialización en los Estados Miembros
Restricciones de dispensación para isotretinoína
 Introducción La isotretinoína tiene una elevada capacidad teratógena, pudiendo causar malformaciones congénitas potencialmente fatales. Por este motivo el embarazo representa una contraindicación absoluta
Introducción La isotretinoína tiene una elevada capacidad teratógena, pudiendo causar malformaciones congénitas potencialmente fatales. Por este motivo el embarazo representa una contraindicación absoluta
INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS
 Stelara (ustekinumab) INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS Por favor, además de la ficha técnica del producto (FT) lea detenidamente esta guía. Por favor, informe a sus pacientes sobre
Stelara (ustekinumab) INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS Por favor, además de la ficha técnica del producto (FT) lea detenidamente esta guía. Por favor, informe a sus pacientes sobre
Comunicación dirigida a profesionales sanitarios
 Julio 2013 Comunicación dirigida a profesionales sanitarios Diclofenaco nuevas contraindicaciones y advertencias tras la revisión europea de su seguridad cardiovascular Estimado profesional sanitario,
Julio 2013 Comunicación dirigida a profesionales sanitarios Diclofenaco nuevas contraindicaciones y advertencias tras la revisión europea de su seguridad cardiovascular Estimado profesional sanitario,
El sarampión puede producir epidemias que causan muchas muertes y meningoencefalitis, que puede dejar secuelas de retraso mental.
 Información general El sarampión El sarampión es una enfermedad muy contagiosa y grave causada por un virus. El único reservorio del mismo es humano, por lo que reúne todas las condiciones para ser eliminado
Información general El sarampión El sarampión es una enfermedad muy contagiosa y grave causada por un virus. El único reservorio del mismo es humano, por lo que reúne todas las condiciones para ser eliminado
PROTOCOLO DE VIGILANCIA EPIDEMIOLÓGICA DE GRIPE (A/H1N1) EN HUMANOS (Versión 8 de 13 de Julio de 2009).
 PROTOCOLO DE VIGILANCIA EPIDEMIOLÓGICA DE GRIPE (A/H1N1) EN HUMANOS (Versión 8 de 13 de Julio de 2009). PRESCRIPCIÓN DE OSELTAMIVIR: El médico que atienda al paciente realizará la prescripción en receta
PROTOCOLO DE VIGILANCIA EPIDEMIOLÓGICA DE GRIPE (A/H1N1) EN HUMANOS (Versión 8 de 13 de Julio de 2009). PRESCRIPCIÓN DE OSELTAMIVIR: El médico que atienda al paciente realizará la prescripción en receta
SUPERINTENDENCIA DE SERVICIOS DE SALUD GRIPE Y VIRUS RESPIRATORIOS 2016
 SUPERINTENDENCIA DE SERVICIOS DE SALUD GRIPE Y VIRUS RESPIRATORIOS 2016 SUPERINTENDENCIA DE SERVICIOS DE SALUD INFORME DE LA CIRCULACIÓN DE GRIPE Y OTROS VIRUS RESPIRATORIOS EN ARGENTINA BOLETIN I - AÑO
SUPERINTENDENCIA DE SERVICIOS DE SALUD GRIPE Y VIRUS RESPIRATORIOS 2016 SUPERINTENDENCIA DE SERVICIOS DE SALUD INFORME DE LA CIRCULACIÓN DE GRIPE Y OTROS VIRUS RESPIRATORIOS EN ARGENTINA BOLETIN I - AÑO
Revisión Bibliográfica
 MIOCARDITIS EN LA PRACTICA CLINICA Revisión Bibliográfica Dr. Agustín Cordero Unidad Cardiovascular Sanatorio Allende Introducción Enfermedad inflamatoria del miocardio Heterogénea (Presentación clínica
MIOCARDITIS EN LA PRACTICA CLINICA Revisión Bibliográfica Dr. Agustín Cordero Unidad Cardiovascular Sanatorio Allende Introducción Enfermedad inflamatoria del miocardio Heterogénea (Presentación clínica
