Cátedra de Geoquímica
|
|
|
- María Rosario Botella Chávez
- hace 7 años
- Vistas:
Transcripción
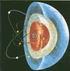
1 Regla de Fases Geología Isotópica Cátedra de Geoquímica 1 EL ÁTOMO Los átomos están constituidos por un núcleo masivo, rodeado de electrones que se mueven en órbitas con distintos niveles de energía Núcleo (diámetro de cm, veces < que el átomo): Protones (p + ) u Neutrones (n 0 ) u Eletrosfera: Eletrones orbitales (e - ) 1/18 masa de H = u Partículas Subatómicas Carga Masa relativa Protones Neutrones 0 +1 Electrones -1 0 Eléctricamente neutro 2 1
2 NÚCLIDIO: agrupación de p+ y n0 detectable. A Z E (N) Del griego ISÓTOPOS ἴσος, isos = mismo; τόπος, tópos = lugar ISÓBAROS ἴσος, isos = mismo; βαρύς, barýs = peso Z: Número Atómico [p+] =Z Z A:Número Másico (p+ +n0) A (Z+N) = A (Z+N) Ejemplos Características Químicas Ej: 12 C, 13 C y 14 C (todos 6 protones) iguales (definen elementos químicos) Ej: 14 C y 14 N (6 protones) (7 protones) diferentes Propiedades Físicas Diferentes ( masa) Similares (= masa) Dos núclidios son ISÓTONOS si tienen el mismo número de neutrones (N). Por ejemplo, 12 B y 13 C, (7 neutrones) 3 ISÓTOPOS 4 2
3 PESO ATÓMICO Ejercicio 1: Calcular PA del Cl El peso atómico de un elemento es la suma ponderada de los distintos isótopos que lo constituyen. Por ejemplo: el K está formado por 39 K (abundancia: 93,1%) K (abundancia: 0,0119%) 41 K (abundancia: 6,9%) El peso atómico del K será: Isótopo [masa x abundancia] (PA) K 39 K (39 x 0,931) = 36,309 + K ( x 0,000119)= 0, K (41 x 0,069) = 2,829 Σ (PA) K = 39,143 Medición masa de isótopos: Espectrómetro de masa Abundancia en la naturaleza de los isótopos: Handbook of Chemistry and Physics (Lide and Frederikse, 1995) PA elemento: Σ (PA isótopo x Abundancia isótopo) 5 Espectrómetro de masas 2.ELECTROIMÁN Separación de masas 3.COLECTOR Detectores 1. FUENTE Ionizacìón 6 3
4 No. atómico (Z) 04/09/2012 TABLA DE NÚCLIDIOS (Chart of Nuclides) isótopos isóbaros isótonos No. de neutrones (N) 7 Tabla parcial de núclidios. Isótpos estables (campos sombreados) Cinturón de estabilidad Isótopos inestables (campos blancos) 8 4
5 Estabilidad Nuclear: es el equilibrio entre las fuerzas de repulsión eléctrica de los protones y la fuerza atractiva nuclear de corto alcance, que experimentan los protones y neutrones del núcleo. Reglas de la estabilidad nuclear Son más estables los nuclídios con: Número par de protones o de neutrones (más estables que los que son nones). Números mágicos de protones o de neutrones (más estables que los que no tienen estos números).[ ] Número Atómico menor que 83 (con Z mayor 83 NO hay nuclídios estables, ejemplo Po Z=84). Ciertos valores de relación neutrón /protón (N/Z). Éstos valores son los que dan balance de fuerzas favorable a la estabilidad. Ejemplos de isóbaros 9 Gráfica de neutrones vs protones Para los núcleos ligeros N es aproximadamente igual a Z, es decir la relación entre N y Z es 1 (N / Z =1), por lo que son estables. Para los núcleos pesados la estabilidad se consigue con mayor número de neutrones y la relación entre N y Z puede llegar a ser de hasta 1.56 (N / Z=1.56) 10 5
6 No. atómico (Z) 04/09/2012 TIPOS DE DECAIMIENTO RADIACTIVO Radiación alfa: (α ) Expulsión de un núcleo de helio. A Z N A-4 Z-2 D + 4 2He Radiación beta (β ): Son electrones de alta velocidad emitidos por un núcleo inestable. 1 0 n 1 1 p + 0-1e (radiación β) Captura electrónica (Є): Un electrón interno (orbital de la capa K) es atrapado por un p+ del núcleo 1 1 p + 0-1e 1 0n Radiación gamma (γ): Rayos γ (fotones), radiación electromagnética Sin efecto isotópico. NZ* NZ + γ 11 ISOBÁRICAS Ejercicio 2 Radiación alfa: (α ) Radiación beta (β ): Captura electrónica (Є): Hijo Z-2 N-2 Padre Z N Hijo Z+1 N-1 Padre Z N Padre Z N Hijo Z-1 N+1 A-4 A = cte A=cte No. de neutrones (N) 12 6
7 235 U ===> 231 Th + 4 He Rb ===> e - + K + e - ===> Ar 13 Química Geología Física Nuclear Geoquímica de Isótopos Geoquímica de Isótopos Radiogénicos (decaimento radioativo) K Ar Rb 147 Sm 143 Nd 238 U 206 Pb Se mide el acumulación del isótopo radigénico Geoquímica de Isótopos Cosmogénicos 14 C Se mide el decaimiento de la actividad radiactiva en el t. Geoquímica de Isótopos Estables No radiogénicos (fraccionamento isotópico) 1 H, 2 H 12 C, 13 C 14 N, 15 N 16 O, 17 O, 18 O 32 S, 33 S, 34 S, 36 S Geocronología (determinación de edades) Evolución manto y de la corteza Génesis de minerales y rocas Geocronología del Cuaternario Hidrogeología, Determinación de paleotemperaturas, Procesos de mineralización 14 7
8 ISÓTOPOS INESTABLES La radiactividad es un proceso de desintegración espontánea exclusiva del núcleo. Durante el decaimiento se desprende energía en forma de radiación y/o partículas.. El isótopo radiactivo inicial se llama padre radiactivo (N) en tanto que el producto se conoce como hijo radigénico (D). N D Los productos formados también pueden ser inestables y por lo tanto sufrirán desintegración posterior hasta que forme un isótopo estable. La secuencia de desintegración se conoce como Serie de decaimiento. 15 Cinética de la desintegración radiactiva El decaimiento radiactivo es, una reacción de primer orden: depende del número de átomos radiactivos que decaen en la unidad de tiempo, no depende de factores externos como P, T, catalizador, etc. dn N dt dn = - λ N dt Variación del número de átomos radiactivos en el tiempo es proporcional al número inicial de los mismos (N) λ, o constante del decaimiento radiactivo, probabilidad de un átomo de desintegrarse en un intervalo de tiempo dado característica de cada sistema expresada en unidades de tiempo (segundos, minutos, horas, años) El signo (-) se debe a que N va disminuyendo a medida que el tiempo transcurre 16 8
9 dn = - λ N dt Reagrupamos Integramos y resolvemos dn = - λ dt N N t N dn/ N = - λ dt = ln = - λ (t - t 0 ) N 0 t 0 N 0 Ejercicio 3 Fracción de átomos Remanentes. N = e -λ.t N 0 N 0 el número inicial de átomos radiactivos. N el número de átomos radiactivos que queda al cabo de un tiempo t. (t - t 0 ) el tiempo total transcurrido. Como t 0 = 0 ==> (t - t 0 ) = t N = N 0 e -λ.t N 0 = N e λ.t Ecuación Básica del Decaimiento Radiactivo Ejercicio 4 (N: actividad hoy) 17 Se define al tiempo de vida media (t ½ ) como el tiempo necesario para que la mitad de los átomos del elemento radioactivo se desintegren. N = N 0 e -λ.t N = N 0 e -λ.t½ 2 t= t1/2 N = N 0 /2 N = e -λ.t½ N 0 2 ln = -λ.t ½ 2 ln 2 = λ.t ½ ln 2 t ½ = λ ln 2 λ = t ½ Ejercicios 3 y
10 Decaimiento radiactivo en el tiempo- Curva hipotética N o 1/2 Siempre lleva el mismo intervalo de tiempo para que la mitad de los átomos desaparezca! 1/4 1/8 N N 0 e t t1 t2 t3 19 D* es el número de hijos producidos a partir de un padre radiogénico N 0 D* = N 0 - N [N 0 = N e λ.t ] N 0 :número de átomos del elemento padre existentes al tiempo de cierre del sistema (t = 0) N: número de átomos padre remanentes al cabo de un tiempo t D* = N e λ.t - N D* = N (e λ.t - 1) D átomo de igual especie que el hijo radiactivo D = D 0 + D* D 0 los isótopos del elemento hijo que no son producto del decaimiento radiactivo. D = D 0 + N (e λ.t - 1) Ecuación general del decaimiento radiactivo 20 10
11 D = D 0 + N (e λ.t - 1) D - D 0 = N (e λ.t - 1) D - D = (e λ.t 1) N D - D 0 ln ( ) = λ.t N 1 D - D 0 t = --- ln ( ) λ N Condiciones para obtener t 1- Sistema cerrado no debe haber pérdida ni ganancia elemento de N y/o D* después de su formación. 2- D 0 (hijos de origen no radiogénico), debe poder calcularse con exactitud y D* >> D λ debe ser constante, por lo que se conoce, recién a temperaturas en el orden de los 6000 a 7000 C habría alteraciones en el valor de la constante de decaimiento. 4- D y N deben poder medirse con exactitud y precisión relativamente altas. Se miden con espectrómetro de masas. 21 Curva de decaimiento de un isótopo padre y curva de crecimento de isótopo hijo D * N N 1 e 0 N 0 e t t Radiactividad: proceso EXPONENCIAL NEGATIVO 22 11
12 RUBIDIO Traza (vestigio) Metal alcalino (grupo IA) No forma minerales propios; Sustitución K Rb Radios iónicos: Rb + = 1.48 Å; K + = 1.33 Å Isótopos Rb 85 Rb72% Rb, 28%, decaimiento β Rb ===> e - + λ = 1,42 x años -1 Sistema Rb- ESTRONCIO Traza Alcalino térreo (grupo IIA) Forma algunos minerales propios: Estroncianita (CO 3, hidrotermal), Celestina (SO 4 ). Sustitución Ca Radios iónicos: +2 = 1.13Å; Ca +2 = 0.99Å. 84 (0,5%) (10%) ( 7%) 88 (82,5) Las determinaciones se pueden efectuar sobre roca total o sobre concentrados de minerales. Dada la magnitud de la vida media de este sistema, es útil para datar desde materiales precámbricos hasta pre-terciarios Este método no es aplicable a rocas ultrabásicas, dado que su contenido en K es muy bajo y por ende no contienen Rb. 23 m = 0 + Rb (e λ.t - 1) m = el isótopo hijo medido (total). 0 = el isótopo inicial (no radigénico). Rb = el isótopo padre. ( ) m ( ) 0 Rb = (e λ.t - 1) y = b + x m Ordenada al origen (b) relación ( / ) 0 cuando t = 0 (cierre del sistema) b = ( / ) 0, no puede ser medido por espectrometría de masas. permite inferir la procedencia del material analizado * b < 0,704 se asume un origen profundo (manto o rocas derivas de él) * b > 0,710, el origen de la rocas es cortical o producto de la asimilación de rocas corticales. Recta isocrona (igual tiempo) Errorcrona: los puntos no están alineados debido a pérdidas o ganancias del isótopo padre y/o del isótopo hijo, posteriores a la cristalización, causadas por metamorfismo, aguas circulantes, etc.). Pendiente m = (e λt - 1) Permite conocer la edad de la roca m + 1 = e λt ln (m + 1) = λt 1 t = ln (m + 1) λ Ejercicio
13 Evolución de la relación / : Al inicio: 3 muestras (a,b,c) con diferentes relaciones Rb/ al tiempo t o Minerales y rocas: Las micas poseen mayor relación Rb/ que las plagioclasas. ( ) o a b c Plagioclasa Roca Total Biotita t o Rb 25 Evolución de la relación / : Al inicio: 3 muestras (a,b,c) con diferentes relaciones Rb/ al tiempo t o Rocas: Progresa diferenciación magmática (Comagmáticas) ( ) o a b c Tonalita Granodiorita Granito t o Rb 26 13
14 Después de un tiempo (t 0 t 1 ): cada muestra gana una cantidad de, dependiendo de su concentración de Rb ( Rb> ) A medida que pasa el tiempo la relación ( Rb/ ) decrece en tanto que se va incrementando la relación ( / ), desplazando los puntos de la recta (hacia arriba y hacia la izquierda simultáneamente) y aumentando la pendiente t 1 c 1 ( ) o a 1 b 1 a b c t o Rb 27 Al tiempo t 2 (hoy): cada roca tiene un aumento en proporcional a la concentración de Rb original. Principio de la isócrona (Nicolaysen, 1961) t 2 c 2 t 1 b 2 c 1 a 2 b 1 ( ) o a 1 a b c t o Rb La intersección de la isócrona con el eje Y da el valor / inicial 28 14
15 Sistema Sm_Nd Son elementos de las Tierras Raras (grupo IIIB) Radio iónico Nd 3+ : 1.08 A Sm 3+ : 1.04 A Sm > Nd + 4 2He El 147 Sm decae en 143 Nd por decaimiento α, Son geoquímicamente inmóviles en rocas ígneas, por lo tanto no se ven afectados por el metamorfismo, la meteorización, etc. Rocas ultrabásicas y sus minerales Las rocas típicas corticales tienen proporciones Sm/Nd menores que las rocas derivadas del manto superior, (toleitas y gabros). Rocas lunares y condritas ( 143 Nd) m ( 143 Nd) 0 ( 147 Sm) = (e λt - 1) ( 144 Nd) ( 144 Nd) ( 144 Nd) y = b + x m Constante de decaimiento λ = 6,54 x a -1. Debido a que el valor de su vida media (t 1/2 ) es de 1,06 x años es adecuado para ello, este método se emplea únicamente en rocas arcaicas, más antiguas que Ma. 29 Sistema K-Ar POTASIO Metal alcalino (grupo IA) K es el octavo elemento mas abundante en la corteza continental. En minerales como las micas, feldespatos K, hornblenda, etc. Radio iónico K + = 1.33 Å K tiene 3 isótopos naturales: 39 K ( %) K ( %) 41 K (6.7302%). Peso atómico: uma ARGÓN Gas noble Ar es el tercer gas mas abundante en la atmósfera (0.934 vol.%). Después del He, Ar es el gas noble mas abundante en rocas y minerales. Radio iónico Ar = 1.9 Å Isótopos naturales: Ar (99.60%); 38 Ar (0.063%) y 36 Ar (0.337%). Peso atómico: amu Ar/ 36 Ar atm =
16 K Ca + β (89 %) + K + Ar (11 %) Ca + Ar = K (e λt - 1) λ β = 4,962 x años -1 + λ Є = 0,581 x años -1 λ t = 5,543 x años -1 El método K-Ca no se puede usar debido a que el Ca es el isótopo más D* = K (e λt -1) abundante del Ca y por lo tanto no se cumple con la condición D* >> D 0. El Ar es un gas noble, y por lo tanto el que se encuentra en la muestra provendrá únicamente del decaimiento radiactivo del K Ar = Ar o + Ar* ( Ar) m ( Ar) 0 K λ Є = (e λt - 1) ( 36 Ar) ( 36 Ar) ( 36 Ar) λ t Para tener la proporción de K que decae en Ar, se introduce relación λ Є / λ t. Se data el tiempo transcurrido desde que el mineral inició la retención de Ar. (Temperatura de bloqueo o cierre es en la cual queda retenido isótopo hijo). Mineral T Bloqueo ( Ar) m ( 36 Ar) λ t x x = (e λt.t - 1) ( 36 Ar) ( K) λ Є Anfibol 500 C Muscovita 350 C Biotita 250 C T 1/2 = x 10 9 a Feldespato C 31 ( Ar) m λ t ( Ar) m λ t x = e λt.t ln [ x ] = λ t.t ( K) λ Є ( K) λ Є 1 ( Ar) m λ t t = --- ln [ x ] λ t ( K) λ Є Problema 6 Unidades: moles del isótopo correspondiente ( K ó Ar)/ 1g de muestra K es un elemento mayoritario resultado analítico Recalcular concentraciones Ar es ser un gas, resultado analítico Se divide por 100 %K 2 O o en %K cm 3 /g de muestra (en CNPT) (ml) 22.4 litros 1 mol se multiplica abundancia K * se divide por el PA = (39,098302) K en moles/g 32 16
17 Ventajas: Rango de Edad. Se lo puede aplicar en materiales cuyas edades correspondan a los comienzos de los tiempos geológicos hasta muestras de 5000 ó 6000 años. Tipo de Rocas Rocas Plutónicas: tiempo transcurrido desde que mineral inició retención de Ar. El K se encuentra en muchos minerales (anf, msv, bt, feld.). Rocas Volcánicas: podemos datar pasta afanítica en basaltos. Rocas Metamórficas. minerales neoformados. Rocas sedimentarias minerales autìgenos (generados en una cuenca) Illita y Glauconita : [K 2 (Mg,Fe) 2 Al 2 (Si 4 O 10 ) 2 (OH) 4. No requiere corrección inicial D 0. No es aplicable a rocas ultrabásicas Desventajas: Se ve muy afectado por procesos metamórficos que hayan tenido lugar en el área, pues el Ar difunde con el aumento de T.l0ºC (Edad rejuvenecida) 33 Isótopos Cosmogénicos: Método 14C 14 7 N + 1 0n > 14 6C + 1 1H Se origina en la atmósfera por bombardeo de neutrones ( 1 0n) sobre el isótopo 14 N, Todos los organismos están en equilibrio con el 14 C atmosférico, mientras realicen sus procesos metabólicos. Al morir, cesa el intercambio que mantiene el contenido de 14 C constante en el organismo, 14 C comienza a decaer (β). ) 14 6 C > 14 7 N + 0-1e Esta actividad remanente (N) es una medida de la concentración del 14 C en el tiempo transcurrido a partir de su muerte. N = N 0 e -λt N la actividad actual de 14 C en la muestra N 0 la actividad de 14 C en la atmósfera = 16 des/min x g Ejercicio
18 1 N t = ln λ N 0 Ese 14 C es radiactivo y decae nuevamente a 14 N con un t 1/2 de 5730 años. ln 2 ln 2 t 1/2 = 5730 a = <===> λ = 1,21x10-4 a -1 λ 5730 Materiales: carbones vegetales o animales, maderas, turba, conchilla, huesos, papel, ropas, cabellos, hidrocarburos y suelos con contenido de materia orgánica. cualquier material que tenga C puede ser datado por esta método. 35 El 14C también se puede absorber en el agua de mar. En organismos que forman conchillas calcáreas. En aguas superficiales que se mezclan por acción de las olas mares de poca profundidad. CO 2 + CO H 2 O ===> 2HCO 3 - Es el método radimétrico más utilizado en: Arqueología, antropología Paleontología (Holoceno) Vulcanismo reciente con restos orgánicos incluidos Ingresiones marinas (miles de años) Geociencias e investigaciones de medio ambiente. Se determinan edades absolutas de los últimos.000 años
19 Materia viva acutal no puede ser usada por el método de 14 C Efecto revolución industrial (1850) o Quema combustibles fósiles (carecen de 14 C) o CO 2 inactivo disminuye efecto de 14 C Efecto de la bomba atómica (1945) o Explosiones nucleares liberaron neutrones o Producción de 14C artificial. 37 Padre (N) Modo Decaimiento λ T 1/2 Hijo (D) Relación Rb β 1.42 x a x a / K β 5.543x10-10 a x 10 9 a Ar, Ca Ar/ 36 Ar 147 Sm α 6.54 x y x a 143 Nd 143 Nd/ 144 Nd 232 Th 235 U 238 U α α α x y x y x y x a 7.07 x 10 8 a 4.47 x 10 9 a 208 Pb 207 Pb 206 Pb 208 Pb/ 204 Pb 207 Pb/ 204 Pb 206 Pb/ 204 Pb ISÓTOPOS RADIOGENICOS D = D 0 + N (e λ.t - 1) 1 D - D 0 t = --- ln ( ) λ N ISÓTOPOS COSMOGÉNICOS N = N 0 e -λt 1 N t = ln λ N 0 Padre (N) Modo Decaimiento λ T 1/2 Hijo (D) 14 C β 1,21x10-4 a a 14 N 38 19
20 Relación entre escala de tiempo período de semidesintegración 1.06 x a 1.25 x 10 9 a 4.8 x a T 1/ a 39 RADIACTIVOS ISÓTOPOS ESTABLES Se desintegran emitiendo partículas α y β. Se mide el acumulación del isótopo radigénico (hijo) K Ar Rb Radigénicos Se mide el decaimiento de la actividad radiactiva en el t (padre) 14 C Cosmogénicos Geocronómetros No se desintegran de forma espontánea. Fraccionamento isotópico 1 H, 2 H 12 C, 13 C 14 N, 15 N 16 O, 17 O, 18 O 32 S, 33 S, 34 S, 36 S Trazadores del origen y de procesos 20
21 Geoquímica deisótopos Estables No radiogénicos (fraccionamento isotópico) O, N, C, S 41 Geoquímica deisótopos Estables No radiogénicos Se miden las relaciones isotópicas entre el isótopo pesado (raro) y el ligero (más abundante): D/H, 13 C/ 12 C, 15 N/ 14 N, 18 O/ 16 O, 34 S/ 32 S Forman parte de la mayoría de rocas y fluidos de la corteza Condiciones de un elemento para mostrar fraccionamiento isotópico: Número atómico bajo Z < 16. Elementos livianos. Diferencia de masa entre los isótopos, debe ser apreciable. Abundancia del elemento y del isótopo raro, suficientemente elevada para permitir determinaciones precisas de las relaciones isotópicas mediante espectrometría de masas. (No puede ser inferior a décimas de %) Existen en más de un estado de oxidación.(c y S) o forman una gran variedad de compuestos (O). Es conveniente que el elemento tenga distintos tipos de unión química, desde iónica hasta covalente (por ejemplo C y S). Fraccionamiento mayor cuando enlaces son. Ej. Al y Mg forman enlaces parecidos a la mayoría de los compuestos naturales (no se fraccionan) 42 21
22 Fraccionamiento Isotópico: separación de los distintos isótopos estables de un elemento durante reacciones químicas, procesos físicos o biológicas Depende de las masas relativas y de la fuerza de enlace de los isótopos. Isótopos Diferencia de masa H, D 99.8% 12 C, 13 C 8.36% Fraccionan 14 N, 15 N 7.12% 16 O, 18 O 12.5% 32 S, 34 S 6.24% 235 U,,238 U 1.3% No fraccionan 206 Pb, 207 P b 0.49% La diferencia de masa entre isótopos da lugar a comportamientos distintos durante procesos físicos y químicos. SEPARACIÓN DE LAS MOLÉCULAS = FRACCIONAMIENTO ISOTÓPICO (base de la geoquímica de los isótopos estables) 43 SEPARACIÓN DE LAS MOLÉCULAS = FRACCIONAMIENTO ISOTÓPICO Isótopos pesados prefieren fases líquida y sólida Isótpos livianos prefieren la fase gaseosa. Cuando se enriquece una fase se empobrece la otra Por ejemplo, la molécula 2 H 2 18 O es más pesada que la 1 H 2 16 O por lo que durante la evaporación la más liviana, de mayor energía vibracional, tiende a pasar más fácilmente a la fase vapor, en tanto que la molécula pesada se concentra en líquido
23 FRACCIONAMIENTO ISOTÓPICO A) Efectos cinéticos asociados a reacciones químicas o procesos físicos Evaporación, difusión, fusión, cristalización. dependen de la masa de las moléculas B) Reacciones de intercambio isotópico en el equilibrio: Redistribución de isótopos de un elemento entre diferentes moléculas que lo contienen 1/2C 16 O 2 + H 2 18 O <=> 1/2C 18 O 2 + H 2 16 O dependen de la fuerza del enlace (leyes de la termodinámica y mecánica cuántica) Tiene lugar durante: Es un proceso fuertemente dependiente de la temperatura, por lo que se A) Efectos cinéticos asociados a han calibrado una gran cantidad de geotermómetros. reacciones químicas o procesos físicos Las diferencias en las energías vibracionales de partículas de masas diferentes se tornan menores a muy altas temperaturas (menor fraccionamiento) La relación de isótopos de uno de los elementos livianos en un mineral, La distribución de isótopos entre dos fases minerales (que se han formado al mismo tiempo) Indicadores temperaturas geológicas. ambiente geológico procesos geológicos (fuentes de minerales y fluidos) 45 FRACCIONAMIENTO ISOTÓPICO R = ISÓTOPO PESADO ISÓTOPO LIGERO ( ISÓTOPO RARO / ISÓTOPO ABUNDANTE) Se expresa como diferencias en las RELACIONES ISOTÓPICAS, R Ej. D/H, 13 C/ 12 C, 15 N/ 14 N, 18 O/ 16 O, 34 S/ 32 S FACTOR DE FRACCIONAMIENTO ISOTÓPICO COEFICIENTE DE PARTICIÓN (α) Determina como se distribuyen los isótopos entre dos fases (ej. carbonato y agua; vapor de agua y agua etc.) RA = relación entre el isótopo pesado α AB respecto al ligero en la fase A; = R A /R B RB = relación entre el isótopo pesado respecto al ligero en la fase B. α H2O/CO3= = R H2O /R CO3 = = ( 18 O/ 16 O) H2O / ( 18 O/ 16 O) CO3 = Se usan concentraciones, no actividades α es próximo a 1 debido a que las relaciones difieren en ; α tiende a 1 al aumentar la T 46 23
24 VALOR DELTA (δ ) En Geoquímica más frecuentemente que α se usa la relación con respecto a un estándar, que se denomina δ. δ = R muestra R estándar x 1000 R estándar d 18 O = ( 18 O/ 16 O) muestra - ( 18 O/ 16 O) smow ( 18 O/ 16 O) smow dd = (D/H) muestra - (D/H) smow (D/H) smow x1000 Los estándares usados son: Para 18 O/ 16 O y D/H: SMOW (Standard Mean Ocean Water) Para 18 O/ 16 O sólo en climatología: PDB: (Pee Dee Belemnite), Cretácico de Carolina del Sur. Para 13 C/ 12 C PDB: (Pee Dee Belemnite), Cretácico de Carolina del Sur. Para 34 S/ 32 S: CD (Troilita del meteorito de Canyon Diablo, Arizona). x1000 Ejercicio 8 Aplicaciones de isótopos de Oxígeno e Hidrogéno Estratigrafía de hielo y nieve Composición isotópica de agua en océanos Paleotermometría en océanos Paleoclimatología en los continentes Agua geotermal y salmueras 47 δ = R muestra R estándar x 1000 R estándar Si δ > 0, la muestra está enriquecida en el isótopo pesado, en relación al estándar muestra isotópicamente pesada. Si δ < 0, la muestra está empobrecida en el isótopo pesado, en relación al estándar. muestra isotópicamente liviana Si δ = 0, la muestra tiene la misma relación isotópica que el estándar.. Diagrama esquemático del proceso de fraccionamiento isotópico a través de la evaporación, la condensación, y la evapotranspiración (combinación de evaporación y transpiración). Se observa que las aguas son más ligeras cuando se evaporan y son relativamente más pesadas cuando se condensan en forma de precipitación
25 Relación entre α y δ : α AB = R A / R B = δ 18 O A δ 18 O B VALOR DELTA (Δ ) Δ es la diferencia entre los δ de un isótopo en dos fases diferentes. Δ AB = δ A - δ B Relación entre α y Δ Δ AB = (α AB - 1) x 1000 (α AB 1) (ln α). Δ AB = δ A - δ B 1000 x ln α = f (T) 49 Ejercicio 7 Relación lineal entre 10 3 (ln α) y la inversa de la temperatura (en Kelvin) (Urey) 1000 x ln α = B + A (1 x 10 6 ) T 2 Ecuación termométrica 1000 x ln α = B + A (1 x 10 6 ) T 2 y = b + m x 50 25
26 Fórmulas Fraccionamiento isotópico Ejemplo: elemento oxígeno Fases: agua y carbonato RELACIONES ISOTÓPICAS (R) R = isótopo pesado isótopo ligero R = 18 O 16 O COEFICIENTE DE PARTICIÓN (α) α AB = R A = R H2O R B R = CO3 α H2O/CO3= = ( 18 O/ 16 O) H2O ( 18 O/ 16 O) CO3 = VALOR DELTA (δ ) δ =[ R muestra R estándar ] x 1000 R estándar d 18 O = [ ( 18 O/ 16 O) m - ( 18 O/ 16 O) smow ] x10 3 ( 18 O/ 16 O) smow VALOR DELTA (Δ ) Δ AB = δ A - δ B 1000 x ln α AB SMOW:(Standard Mean Ocean Water) Δ H2O/CO3= = 18 δ O H2O - 18 δ O CO3= 10 3 x ln α H2O/CO3 51 Ejemplo. Un filón hidrotermal está formado por cuarzo (qz) y clorita (chl), los cuales fueron depositados contemporáneamente y en equilibrio isotópico. Calcular la temperatura de formación de dicho cuerpo intrusivo. Datos: δ O 18 cuarzo = 5,1 ; δo 18 chl = -1.5 Conociendo las ecuaciones de geotermometría para los pares qz-w y chl-w 10 3 ln α qz w = 3,38x10 6 3, Δ qz w = 18 δ O qz - 18 δ O w = 5,1%o - T ln α chl w = 1,56x10 6 4,70 Δ chl w = 18 δ O chl - 18 δ O w = -1.5%o T 2 1,82x ,3 = Δ qz chl = 18 δ O qz - 18 δ O chl = 6,6 %o T 2 Deducimos ecuación Geotermométrica entre el cuarzo y la clorita
27 Δ qz chl= 1,82x ,3 = 6,6 %o T 2 1,82x10 6 = 6,6-1,3 T 2 1,82x10 6 = 5,3 T 2 T 2 = 5,3/ 1.82x10 6 T = [ 5,3/ 1.82x10 6 ] 1/2 = 5,0 K 313 C 53 27
Cátedra Geoquímica TP N 11 Geología isotópica
 Los átomos están constituidos por un núcleo masivo, rodeado de electrones que se mueven en órbitas con distintos niveles de energía. Las principales partículas componentes del núcleo (nucleones) son: el
Los átomos están constituidos por un núcleo masivo, rodeado de electrones que se mueven en órbitas con distintos niveles de energía. Las principales partículas componentes del núcleo (nucleones) son: el
GEOLOGÍA ISOTÓPICA. TP N 12 Geoquímica. Lic. Florencia Mari Facultad de Ciencias Naturales y Museo. UNLP
 GEOLOGÍA ISOTÓPICA TP N 12 Geoquímica 2011 Lic. Florencia Mari Facultad de Ciencias Naturales y Museo. UNLP Temario 1- Conceptos previos 2- Estructura del átomo- Isótopos 3- Consideraciones 4- Cinética
GEOLOGÍA ISOTÓPICA TP N 12 Geoquímica 2011 Lic. Florencia Mari Facultad de Ciencias Naturales y Museo. UNLP Temario 1- Conceptos previos 2- Estructura del átomo- Isótopos 3- Consideraciones 4- Cinética
Métodos de Fechamientos radio-isotópicos de rocas y otros materiales. Cecilia Caballero Miranda
 Métodos de Fechamientos radio- de rocas y otros materiales Cecilia Caballero Miranda Base física: f Decaimiento radiactivo Antecedentes Bequerel, 1895 = radiactividad Bottwood, 1870-1921 = aplicación como
Métodos de Fechamientos radio- de rocas y otros materiales Cecilia Caballero Miranda Base física: f Decaimiento radiactivo Antecedentes Bequerel, 1895 = radiactividad Bottwood, 1870-1921 = aplicación como
PPTCEL001QM11-A16V1 Clase. Fenómenos nucleares I: partículas radiactivas
 PPTCEL001QM11-A16V1 Clase Fenómenos nucleares I: partículas radiactivas Aprendizajes esperados Conocer las partículas radiactivas. Conocer el concepto de isótopos. Aplicar el concepto de masa atómica promedio.
PPTCEL001QM11-A16V1 Clase Fenómenos nucleares I: partículas radiactivas Aprendizajes esperados Conocer las partículas radiactivas. Conocer el concepto de isótopos. Aplicar el concepto de masa atómica promedio.
Átomo. Posee protones y neutrones. Estos se llaman Nucleones. Alrededor giran los electrones en. forma de nube. Son eléctricamente neutro
 Átomo Posee protones y neutrones Estos se llaman Nucleones Alrededor giran los electrones en forma de nube Son eléctricamente neutro Por eso Z(número de Protones)=Ne(Número de Electrones) Átomo Su dimensión
Átomo Posee protones y neutrones Estos se llaman Nucleones Alrededor giran los electrones en forma de nube Son eléctricamente neutro Por eso Z(número de Protones)=Ne(Número de Electrones) Átomo Su dimensión
Curso Hidrogeoquímica para Dummies
 Curso Hidrogeoquímica para Dummies Sesión 13 Isotopos Radiactivos www.gidahatari.com Isótopos Radiactivos Teniendo en cuenta que en los núcleos de los isótopos puede haber un desbalance de las partículas
Curso Hidrogeoquímica para Dummies Sesión 13 Isotopos Radiactivos www.gidahatari.com Isótopos Radiactivos Teniendo en cuenta que en los núcleos de los isótopos puede haber un desbalance de las partículas
Descubrimiento del Núcleo
 Física Nuclear Descubrimiento del Núcleo Componentes del núcleo: protones y neutrones Propiedades de la fuerza nuclear fuerte Debe ser de atracción y suficientemente grande para vencer la repulsión culombiana
Física Nuclear Descubrimiento del Núcleo Componentes del núcleo: protones y neutrones Propiedades de la fuerza nuclear fuerte Debe ser de atracción y suficientemente grande para vencer la repulsión culombiana
RADIOACTIVIDAD - (2015)
 RADIOACTIVIDAD - (2015) A- CONCEPTOS GENERALES SOBRE RADIACTIVIDAD B- ISÓTOPOS C- TIPOS Y PROPIEDADES DE LAS RADIACCIONES D- REACCIONES NUCLEARES E- VIDA MEDIA A- CONCEPTOS GENERALES SOBRE RADIACTIVIDAD
RADIOACTIVIDAD - (2015) A- CONCEPTOS GENERALES SOBRE RADIACTIVIDAD B- ISÓTOPOS C- TIPOS Y PROPIEDADES DE LAS RADIACCIONES D- REACCIONES NUCLEARES E- VIDA MEDIA A- CONCEPTOS GENERALES SOBRE RADIACTIVIDAD
TIEMPO GEOLÓGICO Y SIGNIFICADO DE LOS FÓSILES
 TIEMPO GEOLÓGICO Y SIGNIFICADO DE LOS FÓSILES PROFESOR Ing. JORGE HUAYHUA ROJAS Revis. PEDRO H. TUMIALAN TIEMPO GEOLOGICO Y SIGNIFICADO DE LOS FOSILES Tiempo geológico es la sucesión de intervalos ocurridos
TIEMPO GEOLÓGICO Y SIGNIFICADO DE LOS FÓSILES PROFESOR Ing. JORGE HUAYHUA ROJAS Revis. PEDRO H. TUMIALAN TIEMPO GEOLOGICO Y SIGNIFICADO DE LOS FOSILES Tiempo geológico es la sucesión de intervalos ocurridos
Temas X y XI: Radiactividad
 Física Médica Grupo 1B Temas X y XI: Radiactividad Dpto. de Radiología (Física Médica) Facultad de Medicina Transiciones nucleares 1. Desex. gamma: A Z X * A Z X+γ 1. Emisión alfa: A Z X A 4 Z 2 Y+α 2.
Física Médica Grupo 1B Temas X y XI: Radiactividad Dpto. de Radiología (Física Médica) Facultad de Medicina Transiciones nucleares 1. Desex. gamma: A Z X * A Z X+γ 1. Emisión alfa: A Z X A 4 Z 2 Y+α 2.
1. Con respecto a la radiación gamma, cuál(es) de las siguientes afirmaciones es(son) correcta(s)?
 Nº GUÍA PRÁCTICA Fenómenos nucleares I: partículas radiactivas Ejercicios PSU 1. Con respecto a la radiación gamma, cuál(es) de las siguientes afirmaciones es(son) correcta(s)? I) Puede penetrar a través
Nº GUÍA PRÁCTICA Fenómenos nucleares I: partículas radiactivas Ejercicios PSU 1. Con respecto a la radiación gamma, cuál(es) de las siguientes afirmaciones es(son) correcta(s)? I) Puede penetrar a través
Z, ( a veces se suprime Z),donde X es el símbolo químico del elemento. Así por ejemplo tenemos los isótopos del carbono:
 RADIACTIVIDAD El núcleo atómico está constituido por nucleones: Z protones y N neutrones, ( en total A ). Como sabemos los nucleones son partículas elementales y están constituidos por la agrupación de
RADIACTIVIDAD El núcleo atómico está constituido por nucleones: Z protones y N neutrones, ( en total A ). Como sabemos los nucleones son partículas elementales y están constituidos por la agrupación de
J.M.L.C. IES Aguilar y Cano ALGUNOS DERECHOS RESERVADOS
 La radiactividad o radioactividad es un fenómeno físico natural, por el cual algunas sustancias o elementos químicos llamados radiactivos, emiten radiaciones que tienen la propiedad de impresionar placas
La radiactividad o radioactividad es un fenómeno físico natural, por el cual algunas sustancias o elementos químicos llamados radiactivos, emiten radiaciones que tienen la propiedad de impresionar placas
A. Lavoisier (mediciones de masas reaccionantes): la materia no se crea ni se destruye
 Características esenciales de las reacciones químicas A. Lavoisier (mediciones de masas reaccionantes): la materia no se crea ni se destruye Joseph Louis Proust (formación de CuCO 3 ): los elementos que
Características esenciales de las reacciones químicas A. Lavoisier (mediciones de masas reaccionantes): la materia no se crea ni se destruye Joseph Louis Proust (formación de CuCO 3 ): los elementos que
Física Nuclear Preguntas de Opción Múltiple
 Física Nuclear Preguntas de Opción Múltiple PSI Física Nombre: 1. Un elemento químico desconocido se representa como: Z X. Cuál es el nombre de Z? A. Número de masa atómica B. Número atómico C. Número
Física Nuclear Preguntas de Opción Múltiple PSI Física Nombre: 1. Un elemento químico desconocido se representa como: Z X. Cuál es el nombre de Z? A. Número de masa atómica B. Número atómico C. Número
La estructura atómica: el núcleo
 Tema 1 La estructura atómica: el núcleo Introducción. Modelos atómicos Composición del átomo. Partículas fundamentales Estructura del núcleo Estabilidad nuclear y energía de enlace nuclear Aplicaciones
Tema 1 La estructura atómica: el núcleo Introducción. Modelos atómicos Composición del átomo. Partículas fundamentales Estructura del núcleo Estabilidad nuclear y energía de enlace nuclear Aplicaciones
FÍSICA NUCLEAR. I WANT TO KNOW GOD S THOUGHTS; THE REST ARE DETAILS (Albert Einstein )
 FÍSICA NUCLEAR I WANT TO KNOW GOD S THOUGHTS; THE REST ARE DETAILS (Albert Einstein. 879 955) . INTRODUCCIÓN. RESEÑA HISTÓRICA Radiactividad propiedad de los núcleos atómicos de ciertos isótopos de modificar
FÍSICA NUCLEAR I WANT TO KNOW GOD S THOUGHTS; THE REST ARE DETAILS (Albert Einstein. 879 955) . INTRODUCCIÓN. RESEÑA HISTÓRICA Radiactividad propiedad de los núcleos atómicos de ciertos isótopos de modificar
TEMA 6.- EL NÚCLEO 1.- LA NATURALEZA DE LAS REACCIONES NUCLEARES 2.- ESTABILIDAD NUCLEAR. Energía de enlace nuclear 3.- RADIACTIVIDAD NATURAL
 TEMA 6.- EL NÚCLEO.- LA NATURALEZA DE LAS REACCIONES NUCLEARES 2.- ESTABILIDAD NUCLEAR Energía de enlace nuclear 3.- RADIACTIVIDAD NATURAL 4.- RADIACTIVIDAD ARTIFICIAL 5.- FISIÓN NUCLEAR 6.- FUSIÓN NUCLEAR
TEMA 6.- EL NÚCLEO.- LA NATURALEZA DE LAS REACCIONES NUCLEARES 2.- ESTABILIDAD NUCLEAR Energía de enlace nuclear 3.- RADIACTIVIDAD NATURAL 4.- RADIACTIVIDAD ARTIFICIAL 5.- FISIÓN NUCLEAR 6.- FUSIÓN NUCLEAR
ME4010: Introducción a la Ingeniería Nuclear
 : Introducción a la Ingeniería Nuclear Sergio Courtin V. Marzo 2016 Departamento de Ingeniería Mecánica FCFM - Universidad de Chile Estabilidad Nuclear Los nucleidos que se encuentran en la naturaleza
: Introducción a la Ingeniería Nuclear Sergio Courtin V. Marzo 2016 Departamento de Ingeniería Mecánica FCFM - Universidad de Chile Estabilidad Nuclear Los nucleidos que se encuentran en la naturaleza
Núcleo Atómico. El núcleo es una masa muy compacta formada por protones y neutrones.
 Núcleo Atómico Profesor: Robinson Pino H. 1 COMPONENTES DEL NÚCLEO ATÓMICO El núcleo es una masa muy compacta formada por protones y neutrones. PROTÓN PROTÓN(p + ) Es una partícula elemental con carga
Núcleo Atómico Profesor: Robinson Pino H. 1 COMPONENTES DEL NÚCLEO ATÓMICO El núcleo es una masa muy compacta formada por protones y neutrones. PROTÓN PROTÓN(p + ) Es una partícula elemental con carga
Esta parte de la Física estudia el comportamiento de los núcleos atómicos. Física nuclear
 Esta parte de la Física estudia el comportamiento de los núcleos atómicos Física nuclear CORTEZA Electrones NÚCLEO Protones Neutrones PARTÍCULA CARGA MASA Electrón (e - ) -1,6.10-19 C 9,1.10-31 kg Protón
Esta parte de la Física estudia el comportamiento de los núcleos atómicos Física nuclear CORTEZA Electrones NÚCLEO Protones Neutrones PARTÍCULA CARGA MASA Electrón (e - ) -1,6.10-19 C 9,1.10-31 kg Protón
Actividad y Leyes del Decaimiento Radiactivo
 ctividad y Leyes del Decaimiento Radiactivo Características del Fenómeno de la Transformación Radiactiva Se denomina radiactividad al proceso de transformación espontánea nea de núcleos atómicos mediante
ctividad y Leyes del Decaimiento Radiactivo Características del Fenómeno de la Transformación Radiactiva Se denomina radiactividad al proceso de transformación espontánea nea de núcleos atómicos mediante
Unidad N 11 QUIMICA NUCLEAR
 Unidad N 11 QUIMICA NUCLEAR Estructura básica del átomo Electrones: CAMBIOS: generan las propiedades Químicas y Físicas más o menos comunes de un dado átomo. Núcleo: CAMBIOS: modifican en forma sustancial
Unidad N 11 QUIMICA NUCLEAR Estructura básica del átomo Electrones: CAMBIOS: generan las propiedades Químicas y Físicas más o menos comunes de un dado átomo. Núcleo: CAMBIOS: modifican en forma sustancial
Fundamentos de Química Inorgánica. Estructura Atómica
 Fundamentos de Química Inorgánica Estructura Atómica A 1 2 3 X H H Z 1 1 1 A:? Z:? N:? H Origen de los elementos Inicio: las primeras partículas elementales se formaron hace unos 15.000 millones de años
Fundamentos de Química Inorgánica Estructura Atómica A 1 2 3 X H H Z 1 1 1 A:? Z:? N:? H Origen de los elementos Inicio: las primeras partículas elementales se formaron hace unos 15.000 millones de años
Preguntas de Física Nuclear. 1. Qué partículas forman el núcleo? Cuál es el término general para nombrarlas? De qué están compuestas esas partículas?
 Preguntas de Física Nuclear 1. Qué partículas forman el núcleo? Cuál es el término general para nombrarlas? De qué están compuestas esas partículas? 2. Cuál es la definición de número atómico? Cuál es
Preguntas de Física Nuclear 1. Qué partículas forman el núcleo? Cuál es el término general para nombrarlas? De qué están compuestas esas partículas? 2. Cuál es la definición de número atómico? Cuál es
QUÍMICA COMÚN Y ELECTIVO
 QUÍMICA COMÚN Y ELECTIVO GENERALIDADES 1. MODELOS ATÓMICOS 2. EL AGUA, EL AIRE Y EL PETRÓLEO COMÚN 3. QUÍMICA ORGÁNICA 4. DISOLUCIONES QUÍMICAS 1. EQUILIBRIO QUÍMICO 2. CINÉTICA 3. ACTIVIDAD NUCLEAR ELECTIVO
QUÍMICA COMÚN Y ELECTIVO GENERALIDADES 1. MODELOS ATÓMICOS 2. EL AGUA, EL AIRE Y EL PETRÓLEO COMÚN 3. QUÍMICA ORGÁNICA 4. DISOLUCIONES QUÍMICAS 1. EQUILIBRIO QUÍMICO 2. CINÉTICA 3. ACTIVIDAD NUCLEAR ELECTIVO
Resolución PRÁCTICO 9
 Resolución PRÁCTICO 9 1- Complete las siguientes ecuaciones nucleares, remplazando las X por los símbolos o números correspondientes (Nota: X toma diferentes números y símbolos en cada una de las situaciones):
Resolución PRÁCTICO 9 1- Complete las siguientes ecuaciones nucleares, remplazando las X por los símbolos o números correspondientes (Nota: X toma diferentes números y símbolos en cada una de las situaciones):
RADIACTIVIDAD. Alejandra Pardo Martínez 1º ESO
 RADIACTIVIDAD Alejandra Pardo Martínez 1º ESO 1. ESTRUCTURA ATÓMICA El átomo es la parte más pequeña de materia que conserva sus propiedades químicas. De forma simplificada, puede considerarse que está
RADIACTIVIDAD Alejandra Pardo Martínez 1º ESO 1. ESTRUCTURA ATÓMICA El átomo es la parte más pequeña de materia que conserva sus propiedades químicas. De forma simplificada, puede considerarse que está
Radiaciones, ser humano y medio ambiente. María Eugenia Pérez
 Radiaciones, ser humano y medio ambiente María Eugenia Pérez 1- Núcleo atómico 2- Radiactividad 3- Modos de decaimiento 4- Cinética de decaimiento radioactivo 5-Tabla de nucleidos Núcleo atómico Fue descubierto
Radiaciones, ser humano y medio ambiente María Eugenia Pérez 1- Núcleo atómico 2- Radiactividad 3- Modos de decaimiento 4- Cinética de decaimiento radioactivo 5-Tabla de nucleidos Núcleo atómico Fue descubierto
Slide 1 / 33. Slide 2 / 33. Slide 3 / El número atómico es equivalente a cuál de los siguientes? A El número de neutrones del átomo.
 Slide 1 / 33 Slide 2 / 33 3 El número atómico es equivalente a cuál de los siguientes? Slide 3 / 33 A El número de neutrones del átomo. B El número de protones del átomo C El número de nucleones del átomo.
Slide 1 / 33 Slide 2 / 33 3 El número atómico es equivalente a cuál de los siguientes? Slide 3 / 33 A El número de neutrones del átomo. B El número de protones del átomo C El número de nucleones del átomo.
producción de energía en las estrellas interiores estelares
 producción de energía en las estrellas interiores estelares porqué brillan las estrellas? la energía emitida por las estrellas tiene su origen en reacciones termonucleares que tienen lugar en su interior
producción de energía en las estrellas interiores estelares porqué brillan las estrellas? la energía emitida por las estrellas tiene su origen en reacciones termonucleares que tienen lugar en su interior
La radioactividad es una propiedad intrínseca de los núcleos de los átomos.
 Radiactividad y Reacciones Nucleares Tema 3-1/23 1. DESCUBRIIMIIENTO DE LA RADIIACTIIVIIDAD Descubrimiento: Henri Becquerel (1896) La radioactividad es una propiedad intrínseca de los núcleos de los átomos.
Radiactividad y Reacciones Nucleares Tema 3-1/23 1. DESCUBRIIMIIENTO DE LA RADIIACTIIVIIDAD Descubrimiento: Henri Becquerel (1896) La radioactividad es una propiedad intrínseca de los núcleos de los átomos.
Universidad Técnica Nacional
 Universidad Técnica Nacional Química I-CB005 Unidad II Átomos Moléculas e Iones Teoría atómica de Dalton Postulados de la teoría atómica de Dalton: Los elementos están formados por partículas extremadamente
Universidad Técnica Nacional Química I-CB005 Unidad II Átomos Moléculas e Iones Teoría atómica de Dalton Postulados de la teoría atómica de Dalton: Los elementos están formados por partículas extremadamente
Unidad 3. Átomos y moléculas
 Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
Física P.A.U. FÍSICA MODERNA 1 FÍSICA MODERNA
 Física P.A.U. FÍSICA MODERNA FÍSICA MODERNA PROBLEMAS MECÁNICA CUÁNTICA.. En una célula fotoeléctrica, el cátodo metálico se ilumina con una radiación de λ = 5 nm, el potencial de frenado para los electrones
Física P.A.U. FÍSICA MODERNA FÍSICA MODERNA PROBLEMAS MECÁNICA CUÁNTICA.. En una célula fotoeléctrica, el cátodo metálico se ilumina con una radiación de λ = 5 nm, el potencial de frenado para los electrones
Ponte en forma 1.- Realiza las actividades que se te solicitan a continuación: a) Completa el siguiente cuadro:
 RESPUESTAS BLOQUE III Ponte en forma 1.- Realiza las actividades que se te solicitan a continuación: a) Completa el siguiente cuadro: Tipo de raciación Partículas Carga eléctrica Masa(uma) Alfa α +2 4
RESPUESTAS BLOQUE III Ponte en forma 1.- Realiza las actividades que se te solicitan a continuación: a) Completa el siguiente cuadro: Tipo de raciación Partículas Carga eléctrica Masa(uma) Alfa α +2 4
Radiaciones Ionizantes FUNDAMENTOS FÍSICOS DE IMÁGENES DIAGNÓSTICAS - PILAR INFANTE L - FIACIBI
 Radiaciones Ionizantes FUNDAMENTOS FÍSICOS DE IMÁGENES DIAGNÓSTICAS - PILAR INFANTE L - FIACIBI FUNDAMENTOS FÍSICOS DE IMÁGENES DIAGNÓSTICAS - PILAR INFANTE L - FIACIBI LAS RADIACIONES IONIZANTES Transferencia
Radiaciones Ionizantes FUNDAMENTOS FÍSICOS DE IMÁGENES DIAGNÓSTICAS - PILAR INFANTE L - FIACIBI FUNDAMENTOS FÍSICOS DE IMÁGENES DIAGNÓSTICAS - PILAR INFANTE L - FIACIBI LAS RADIACIONES IONIZANTES Transferencia
Química General III. Tema 13. Química Nuclear. Sulfato doble de K y U, emite radiación fuente de rayos radiactivos.
 Química General III. Tema 3. Química Nuclear Introducción. Reacción Química Wilhelm Röntgen Henri Becquerel solo 896 895 participan electrones. Rayos X Sulfato doble de K y U, emite radiación fuente de
Química General III. Tema 3. Química Nuclear Introducción. Reacción Química Wilhelm Röntgen Henri Becquerel solo 896 895 participan electrones. Rayos X Sulfato doble de K y U, emite radiación fuente de
Radiactividad Medicina Nuclear (1993) Radioterapia y Radiodiagnóstico (2008) Facultad de Ingeniería, UNER
 Radiactividad Medicina Nuclear (1993) Radioterapia y Radiodiagnóstico (008) Facultad de Ingeniería, UNER 1. Ley de decaimiento En la naturaleza hay isótopos inestables y metaestables que pueden emitir
Radiactividad Medicina Nuclear (1993) Radioterapia y Radiodiagnóstico (008) Facultad de Ingeniería, UNER 1. Ley de decaimiento En la naturaleza hay isótopos inestables y metaestables que pueden emitir
Determina el número de protones que hay en el núcleo de los átomos correspondientes a los siguientes elementos químicos:
 II EL ÁTOMO EJERCICIOS II Determina el número de protones que hay en el núcleo de los átomos correspondientes a los siguientes elementos químicos: a) b) 5. Determina la estructura atómica de los átomos
II EL ÁTOMO EJERCICIOS II Determina el número de protones que hay en el núcleo de los átomos correspondientes a los siguientes elementos químicos: a) b) 5. Determina la estructura atómica de los átomos
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA 1. Atomos y partículas subatómicas La materia, sea el estado en el que se encuentre (sólido líquido gas) está constituida por partículas diminutas llamadas átomos. Actualmente,
ESTRUCTURA DE LA MATERIA 1. Atomos y partículas subatómicas La materia, sea el estado en el que se encuentre (sólido líquido gas) está constituida por partículas diminutas llamadas átomos. Actualmente,
---- Debe indicarse claramente nombres y números de lista de los alumnos integrantes del grupo.
 LICEO Confederación Suiza SECTOR: Química GUÍA DE APRENDIZAJE NIVEL: 4 Medio PROFESOR(A): Genny Astudillo Castillo UNIDAD TEMÁTICA: Química Nuclear CONTENIDO: Fisión y fusión nuclear OBJETIVO DE APRENDIZAJE:
LICEO Confederación Suiza SECTOR: Química GUÍA DE APRENDIZAJE NIVEL: 4 Medio PROFESOR(A): Genny Astudillo Castillo UNIDAD TEMÁTICA: Química Nuclear CONTENIDO: Fisión y fusión nuclear OBJETIVO DE APRENDIZAJE:
Interacción nuclear 1
 Interacción nuclear Cuestiones. Comente cada una de las frases siguientes: a) Isótopos son aquellos núclidos de igual número atómico pero distinto número másico. b) Si un núclido emite una partícula alfa,
Interacción nuclear Cuestiones. Comente cada una de las frases siguientes: a) Isótopos son aquellos núclidos de igual número atómico pero distinto número másico. b) Si un núclido emite una partícula alfa,
Tema 1 Átomos y Tabla Periódica
 Tema Átomos y Tabla Periódica Tres partículas subatómicas: el protón (carga +), el neutrón (carga = ) y el electrón (carga -) : son las partículas principales que afectan el comportamiento químico de los
Tema Átomos y Tabla Periódica Tres partículas subatómicas: el protón (carga +), el neutrón (carga = ) y el electrón (carga -) : son las partículas principales que afectan el comportamiento químico de los
Tema 1: Tarea para resolver en clase Química General
 Tema 1: Tarea para resolver en clase Química General 1. Para los elementos 28 24 14 Si y 12 Mg de: a) número de protones contenidos en el núcleo b) número de neutrones contenidos en el núcleo c) número
Tema 1: Tarea para resolver en clase Química General 1. Para los elementos 28 24 14 Si y 12 Mg de: a) número de protones contenidos en el núcleo b) número de neutrones contenidos en el núcleo c) número
Física nuclear. Núcleo atómico
 Física nuclear La configuración de los electrones de un átomo determina si este puede unirse a otros para formar compuestos y la manera para hacerlo. Además, los electrones causan efectos tales como la
Física nuclear La configuración de los electrones de un átomo determina si este puede unirse a otros para formar compuestos y la manera para hacerlo. Además, los electrones causan efectos tales como la
ESTRUCTURA DE LA MATERIA VICENTE PUCHADES PUCHADES. SERVICIO DE RADIOFÍSICA Y PROTECCIÓN RADIOLÓGICA DEL HGU SANTA LUCÍA. CARTAGENA.
 ESTRUCTURA DE LA MATERIA VICENTE PUCHADES PUCHADES. SERVICIO DE RADIOFÍSICA Y PROTECCIÓN RADIOLÓGICA DEL HGU SANTA LUCÍA. CARTAGENA. INDICE Qué es la materia? Modelos de la materia Fuerzas Fundamentales
ESTRUCTURA DE LA MATERIA VICENTE PUCHADES PUCHADES. SERVICIO DE RADIOFÍSICA Y PROTECCIÓN RADIOLÓGICA DEL HGU SANTA LUCÍA. CARTAGENA. INDICE Qué es la materia? Modelos de la materia Fuerzas Fundamentales
EL ÁTOMO. Departamento de Física y Química 3º ESO
 EL ÁTOMO Departamento de Física y Química 3º ESO 0. Mapa conceptual Metales No metales Tabla periódica Elementos Cationes Isótopos ÁTOMO Iones Aniones Protones Núcleo Neutrones Electrones Número atómico
EL ÁTOMO Departamento de Física y Química 3º ESO 0. Mapa conceptual Metales No metales Tabla periódica Elementos Cationes Isótopos ÁTOMO Iones Aniones Protones Núcleo Neutrones Electrones Número atómico
FÍSICA MODERNA FÍSICA NUCLEAR Y DE PARTÍCULAS. José Luis Rodríguez Blanco
 FÍSICA MODERNA FÍSICA NUCLEAR Y DE PARTÍCULAS José Luis Rodríguez Blanco Fenómenos radiactivos H. Becquerel (1896): Sales de uranio emiten una radiación sumamente penetrante independiente del estado de
FÍSICA MODERNA FÍSICA NUCLEAR Y DE PARTÍCULAS José Luis Rodríguez Blanco Fenómenos radiactivos H. Becquerel (1896): Sales de uranio emiten una radiación sumamente penetrante independiente del estado de
1. El modelo moderno del átomo se basa en el trabajo de
 Química de diagnóstico Nombre: Período: Fecha: Instrucciones: Por favor, conteste las siguientes preguntas en la medida de su capacidad. Asegúrese de mostrar todo su trabajo y circule su respuesta. Usted
Química de diagnóstico Nombre: Período: Fecha: Instrucciones: Por favor, conteste las siguientes preguntas en la medida de su capacidad. Asegúrese de mostrar todo su trabajo y circule su respuesta. Usted
Elementos radiactivos
 1 Elementos radiactivos I. El núcleo atómico 1. Componentes del núcleo, nucleones, protón y neutrón. Carga masa Símbolo (u.m.a.) Protón 1+ 1,007825 1 1 P ( 1 1 H + ) Neutrón 0 1,008665 0 1 n Masa del electrón
1 Elementos radiactivos I. El núcleo atómico 1. Componentes del núcleo, nucleones, protón y neutrón. Carga masa Símbolo (u.m.a.) Protón 1+ 1,007825 1 1 P ( 1 1 H + ) Neutrón 0 1,008665 0 1 n Masa del electrón
T.2 EL TIEMPO EN GEOLOGÍA
 T.2 EL TIEMPO EN GEOLOGÍA MÉTODOS DE DATACIÓN Cronología absoluta: intenta ordenar los hechos ocurridos en el tiempo según cuando ocurrió (años). Cronología relativa: ordena los hechos ocurridos en el
T.2 EL TIEMPO EN GEOLOGÍA MÉTODOS DE DATACIÓN Cronología absoluta: intenta ordenar los hechos ocurridos en el tiempo según cuando ocurrió (años). Cronología relativa: ordena los hechos ocurridos en el
31/03/2015 FÍSICA DE LA RADIACIÓN CONCEPTOS FUNDAMENTALES ESTRUCTURA ATÓMICA Y MOLECULAR. Materia
 FÍSICA DE LA RADIACIÓN 1ra Parte CONCEPTOS FUNDAMENTALES ESTRUCTURA ATÓMICA Y MOLECULAR Materia Materia: es cualquier cosa que ocupe espacio y que tenga masa, cuando se altera, produce energía. La unidad
FÍSICA DE LA RADIACIÓN 1ra Parte CONCEPTOS FUNDAMENTALES ESTRUCTURA ATÓMICA Y MOLECULAR Materia Materia: es cualquier cosa que ocupe espacio y que tenga masa, cuando se altera, produce energía. La unidad
4. Identificar un isótopo radiactivo del carbono e indicar su uso. 5. Cuál es la configuración electrónica del vanadio?
 ESTRUCTURA ATÓMICA 1. Qué afirmación sobre el número de electrones, protones y neutrones del átomo es correcta? A El número de neutrones menos el número de electrones es cero. B. El número de protones
ESTRUCTURA ATÓMICA 1. Qué afirmación sobre el número de electrones, protones y neutrones del átomo es correcta? A El número de neutrones menos el número de electrones es cero. B. El número de protones
N está formado por 7 protones y 8 neutrones, luego su masa teórica debería ser:
 1. Calcular la energía de enlace por nucleón del isótopo 15 N sabiendo que su masa es 15,189 u. Datos: 1 u = 1,6 1-2 g ; m p = 1,26 u; m n = 1,8665 u El núcleo 15 N está formado por protones y 8 neutrones,
1. Calcular la energía de enlace por nucleón del isótopo 15 N sabiendo que su masa es 15,189 u. Datos: 1 u = 1,6 1-2 g ; m p = 1,26 u; m n = 1,8665 u El núcleo 15 N está formado por protones y 8 neutrones,
Los átomos constituyen la unidad básica de todos los materiales de ingeniería. La estructura de los átomos Están constituidos por las siguientes partí
 Capítulo 2: Estructura atómica Los átomos constituyen la unidad básica de todos los materiales de ingeniería. La estructura de los átomos Están constituidos por las siguientes partículas subatómicas: Protones
Capítulo 2: Estructura atómica Los átomos constituyen la unidad básica de todos los materiales de ingeniería. La estructura de los átomos Están constituidos por las siguientes partículas subatómicas: Protones
El átomo MODELOS ATÓMICOS
 El átomo Es la porción más pequeña de la materia. Los primeros en utilizar este término fueron Leucipo y Demócrito (los atomistas), quienes creían que la materia estaba formados por pequeñas partículas
El átomo Es la porción más pequeña de la materia. Los primeros en utilizar este término fueron Leucipo y Demócrito (los atomistas), quienes creían que la materia estaba formados por pequeñas partículas
LA MATERIA. Características de los átomos
 LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
H Deuterio (1p+1n); ,02310 = = = 1uma = 1u = = 1,6610 kg
 El átomo Física uclear Es la parte más pequeña de un elemento químico que mantiene sus propiedades. Está formado por protones y neutrones, que forman el núcleo, y por electrones que giran en la corteza.
El átomo Física uclear Es la parte más pequeña de un elemento químico que mantiene sus propiedades. Está formado por protones y neutrones, que forman el núcleo, y por electrones que giran en la corteza.
Demócrito y Leucipo. Bohr. Dalton
 Demócrito y Leucipo Bohr Dalton Rutherford Thomson ÁTOMO (del griego a= sin y tomo= división), Átomo estacionario núcleo central modelo matemático probabilístico "orbital". Demócrito (siglo V a.c): Concepto
Demócrito y Leucipo Bohr Dalton Rutherford Thomson ÁTOMO (del griego a= sin y tomo= división), Átomo estacionario núcleo central modelo matemático probabilístico "orbital". Demócrito (siglo V a.c): Concepto
Tema 1: Núcleo atómico y Desintegración
 Tema 1: Núcleo atómico y Desintegración Núcleo atómico. Radiactividad. Modos de Decaimiento N ú c l e o t ó m i c o El núcleo atómico es la parte del átomo que contiene toda la carga positiva y la mayoría
Tema 1: Núcleo atómico y Desintegración Núcleo atómico. Radiactividad. Modos de Decaimiento N ú c l e o t ó m i c o El núcleo atómico es la parte del átomo que contiene toda la carga positiva y la mayoría
Identificación de suelos
 Nacional-Sede Manizales Identificación de suelos Cristhian C. Mendoza B. 1 Mecánica de suelos Clasificación. Caracterización física. Comportamiento hidráulico. Consolidación Comportamiento mecánico. Mecánica
Nacional-Sede Manizales Identificación de suelos Cristhian C. Mendoza B. 1 Mecánica de suelos Clasificación. Caracterización física. Comportamiento hidráulico. Consolidación Comportamiento mecánico. Mecánica
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: El átomo y sus enlaces
 1(9) Ejercicio nº 1 Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes aniones: 35 1 80 1 1 31 3 17 Cl ; Br ; O ; P 35 8 15 Ejercicio
1(9) Ejercicio nº 1 Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes aniones: 35 1 80 1 1 31 3 17 Cl ; Br ; O ; P 35 8 15 Ejercicio
25 12 Mg. 1. En la especie el numero atómico corresponde a: A) 22 B) 12 C) 25 D) 13 E) ninguna de las anteriores.
 MINIPRUEBA CLASE 02 25 12 Mg 1. En la especie el numero atómico corresponde a: A) 22 B) 12 C) 25 D) 13 E) ninguna de las anteriores. 25 12 Mg Z 2. Se puede afirmar que: I) La masa del electrón es aproximadamente
MINIPRUEBA CLASE 02 25 12 Mg 1. En la especie el numero atómico corresponde a: A) 22 B) 12 C) 25 D) 13 E) ninguna de las anteriores. 25 12 Mg Z 2. Se puede afirmar que: I) La masa del electrón es aproximadamente
Tema 2. El Tiempo Geológico
 Tema 2 El Tiempo Geológico Datación Relativa Ley (axioma) de la Superposición Enunciada por Nicolás Steno en 1669 Base de la estratigrafía y la arqueología 2 Ley de la Superposición Las capas sedimentarias
Tema 2 El Tiempo Geológico Datación Relativa Ley (axioma) de la Superposición Enunciada por Nicolás Steno en 1669 Base de la estratigrafía y la arqueología 2 Ley de la Superposición Las capas sedimentarias
Qué es la energía nuclear? Tema1
 Toda la materia del universo está formada por moléculas que a su vez están constituidas por átomos, pequeñísimas unidades que durante mucho tiempo se consideraron invisibles. En la actualidad sabemos que
Toda la materia del universo está formada por moléculas que a su vez están constituidas por átomos, pequeñísimas unidades que durante mucho tiempo se consideraron invisibles. En la actualidad sabemos que
EL NÚCLEO ATÓMICO. (8p, pn) y O 8. (8p, 8n), O 8. Los núcleidos O 8
 EL NÚCLEO ATÓMICO Los núcleos retienen sus identidades en los procesos químico, y las propiedades nucleares, con excepción de la carga, influyen en el comportamiento químico de modos tan sólo indirectos
EL NÚCLEO ATÓMICO Los núcleos retienen sus identidades en los procesos químico, y las propiedades nucleares, con excepción de la carga, influyen en el comportamiento químico de modos tan sólo indirectos
Elementos ordenados según su número atómico (Z, número de p + ) Hay 18 PERÍODOS
 TABLA PERIÓDICA Elementos ordenados según su número atómico (Z, número de p + ) Columnas Filas GRUPOS PERÍODOS Familias de elementos con propiedades comunes Hay 18 División principal Elementos representativos
TABLA PERIÓDICA Elementos ordenados según su número atómico (Z, número de p + ) Columnas Filas GRUPOS PERÍODOS Familias de elementos con propiedades comunes Hay 18 División principal Elementos representativos
Física P.A.U. FÍSICA MODERNA 1 FÍSICA MODERNA
 Física P.A.U. FÍSICA MODERNA 1 FÍSICA MODERNA PROBLEMAS EFECTO FOTOELÉCTRICO 1. En una célula fotoeléctrica, el cátodo metálico se ilumina con una radiación de λ = 175 nm, el potencial de frenado para
Física P.A.U. FÍSICA MODERNA 1 FÍSICA MODERNA PROBLEMAS EFECTO FOTOELÉCTRICO 1. En una célula fotoeléctrica, el cátodo metálico se ilumina con una radiación de λ = 175 nm, el potencial de frenado para
Técnico Profesional QUÍMICA
 Convenio Programa Técnico Profesional QUÍMICA Modelos atómicos, estructura atómica y tipos de átomos Nº Ejercicios PSU 1. Rutherford, luego de realizar pruebas con una lámina de oro bombardeada por partículas
Convenio Programa Técnico Profesional QUÍMICA Modelos atómicos, estructura atómica y tipos de átomos Nº Ejercicios PSU 1. Rutherford, luego de realizar pruebas con una lámina de oro bombardeada por partículas
N está formado por 7 protones y 8 neutrones, luego su masa teórica debería ser:
 01. Calcular la energía de enlace por nucleón del isótopo 15 N sabiendo que su masa es 15,0001089 u. Datos: 1 u = 1, 10-2 g ; m p = 1,002 u; m n = 1,0085 u El núcleo 15 N está formado por protones y 8
01. Calcular la energía de enlace por nucleón del isótopo 15 N sabiendo que su masa es 15,0001089 u. Datos: 1 u = 1, 10-2 g ; m p = 1,002 u; m n = 1,0085 u El núcleo 15 N está formado por protones y 8
Tema 1. Conceptos Básicos en Química
 Tema 1. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas empíricas y moleculares Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que estudia la composición
Tema 1. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas empíricas y moleculares Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que estudia la composición
FÍSICA NUCLEAR. El núcleo atómico
 1. El núcleo atómico. 2. Energía de enlace nuclear. 3. La radiactividad nuclear. 4. Leyes de la desintegración radiactiva. 5. Reacciones nucleares: su aspecto energético. 6. Fisión nuclear: reactores nucleares.
1. El núcleo atómico. 2. Energía de enlace nuclear. 3. La radiactividad nuclear. 4. Leyes de la desintegración radiactiva. 5. Reacciones nucleares: su aspecto energético. 6. Fisión nuclear: reactores nucleares.
* Ozono estratosférico: Máxima concentración: km
 * Ozono estratosférico: Máxima concentración: 20 50 km A. Formación 1) Sobre los 90 km O 2 + [UV(A): λ < 0.24 μm] O + O O es estable por baja probabilidad de colisión entre moléculas ( ρ 2 ) 2) Bajo los
* Ozono estratosférico: Máxima concentración: 20 50 km A. Formación 1) Sobre los 90 km O 2 + [UV(A): λ < 0.24 μm] O + O O es estable por baja probabilidad de colisión entre moléculas ( ρ 2 ) 2) Bajo los
PPTCEL002QM11-A16V1 Clase. Fenómenos nucleares II: fisión y fusión nuclear
 PPTCEL002QM11-A16V1 Clase Fenómenos nucleares II: fisión y fusión nuclear Resumen de la clase anterior Átomos ISÓTOPOS INESTABLES Elementos buscan generar estabilidad RADIACTIVIDAD Emisiones Alfa Beta
PPTCEL002QM11-A16V1 Clase Fenómenos nucleares II: fisión y fusión nuclear Resumen de la clase anterior Átomos ISÓTOPOS INESTABLES Elementos buscan generar estabilidad RADIACTIVIDAD Emisiones Alfa Beta
6 ECUACIONES DE DESINTEGRACIÓN Y ACUMULACIÓN
 Isótopos Ambientales en el Ciclo Hidrológico IGME. Temas: Guías y manuales. ISBN: 84-7840-465-1 6 ECUACIONES DE DESINTEGRACIÓN Y ACUMULACIÓN RADIOACTIVA Las expresiones matemáticas que se presentan en
Isótopos Ambientales en el Ciclo Hidrológico IGME. Temas: Guías y manuales. ISBN: 84-7840-465-1 6 ECUACIONES DE DESINTEGRACIÓN Y ACUMULACIÓN RADIOACTIVA Las expresiones matemáticas que se presentan en
Isótopos de oxígeno y el Sistema Solar. Isótopos
 Isótopos de oxígeno y el Sistema Solar Isótopos Átomos de un mismo elemento (igual número atómico) pero diferente número de neutrones y por tanto masa atómica diferente Predisposición a las condiciones
Isótopos de oxígeno y el Sistema Solar Isótopos Átomos de un mismo elemento (igual número atómico) pero diferente número de neutrones y por tanto masa atómica diferente Predisposición a las condiciones
Teoría atómica de Dalton (1803)
 EL ÁTOMO DIVISIBLE El átomo Desde los tiempos de la antigua Grecia,los pensadores se preguntaban cómo estaba constituida la materia en su interior? Demócrito (S.V a.c.) introduce el término de átomo como
EL ÁTOMO DIVISIBLE El átomo Desde los tiempos de la antigua Grecia,los pensadores se preguntaban cómo estaba constituida la materia en su interior? Demócrito (S.V a.c.) introduce el término de átomo como
Los átomos se relacionan por medio de enlaces químicos (fuerzas intramoleculares). Ejemplo: Los hidrógenos y oxígeno del H2O.
 QUIMICA COMUN RECAPITULACIÓN RECAPITULACIÓN Los átomos se relacionan por medio de enlaces químicos (fuerzas intramoleculares). Ejemplo: Los hidrógenos y oxígeno del H2O. Las moléculas y compuestos se relacionan
QUIMICA COMUN RECAPITULACIÓN RECAPITULACIÓN Los átomos se relacionan por medio de enlaces químicos (fuerzas intramoleculares). Ejemplo: Los hidrógenos y oxígeno del H2O. Las moléculas y compuestos se relacionan
Prefacio... ix COMO UTILIZAR ESTE LIBRO... 1 QUE ES LA QUIMICA... 2 EL METODO CIENTIFICO... 3 LAS RAMAS DE LA QUIMICA... 3
 ÍNDICE Prefacio... ix 1 introducción a la química... 1 COMO UTILIZAR ESTE LIBRO... 1 QUE ES LA QUIMICA... 2 EL METODO CIENTIFICO... 3 LAS RAMAS DE LA QUIMICA... 3 2 el sistema métrico y la medición científica...
ÍNDICE Prefacio... ix 1 introducción a la química... 1 COMO UTILIZAR ESTE LIBRO... 1 QUE ES LA QUIMICA... 2 EL METODO CIENTIFICO... 3 LAS RAMAS DE LA QUIMICA... 3 2 el sistema métrico y la medición científica...
GUIA DE REPASO 1º MEDIO PREPARACION EXAMEN. Subsector: QUÍMICA Docente: Liduvina Campos A. Nombre alumno: Curso: Fecha:
 Liceo Polivalente Juan Antonio Ríos Quinta Normal GUIA DE REPASO 1º MEDIO PREPARACION EXAMEN Unidad temática: Ejercicios de contenidos Guías 0 a 6 Objetivo General: Repaso de contenidos guías 0 a 6 Contenidos:
Liceo Polivalente Juan Antonio Ríos Quinta Normal GUIA DE REPASO 1º MEDIO PREPARACION EXAMEN Unidad temática: Ejercicios de contenidos Guías 0 a 6 Objetivo General: Repaso de contenidos guías 0 a 6 Contenidos:
Tema 3: Reacciones Nucleares
 Tema 3: Reacciones Nucleares I n t r o d u c c i ó n El descubrimiento de la radiactividad representó un avance muy importante para la ciencia, ya que cambió radicalmente la visión existente sobre la estructura
Tema 3: Reacciones Nucleares I n t r o d u c c i ó n El descubrimiento de la radiactividad representó un avance muy importante para la ciencia, ya que cambió radicalmente la visión existente sobre la estructura
BIOLOGÍA. Prof. Ma. Florencia Benimeli
 BIOLOGÍA Profesorado de educación secundaria de la modalidad técnico profesional en concurrencia con título de base Escuela Normal Superior Florentino Ameghino Prof. Ma. Florencia Benimeli OBJETO DE ESTUDIO
BIOLOGÍA Profesorado de educación secundaria de la modalidad técnico profesional en concurrencia con título de base Escuela Normal Superior Florentino Ameghino Prof. Ma. Florencia Benimeli OBJETO DE ESTUDIO
Física Nuclear y Reacciones Nucleares
 Slide 1 / 34 Física Nuclear y Reacciones Nucleares El Núcleo Slide 2 / 34 Protón: La carga de un protón es 1,6 x10-19 C. La masa de un protón es 1,6726x10-27 kg. Neutrones: El neutrón es neutro. La masa
Slide 1 / 34 Física Nuclear y Reacciones Nucleares El Núcleo Slide 2 / 34 Protón: La carga de un protón es 1,6 x10-19 C. La masa de un protón es 1,6726x10-27 kg. Neutrones: El neutrón es neutro. La masa
Slide 1 / 34. Física Nuclear y Reacciones Nucleares
 Slide 1 / 34 Física Nuclear y Reacciones Nucleares Slide 2 / 34 El Núcleo Protón: La carga de un protón es 1,6 x10-19 C. La masa de un protón es 1,6726x10-27 kg. Neutrones: El neutrón es neutro. La masa
Slide 1 / 34 Física Nuclear y Reacciones Nucleares Slide 2 / 34 El Núcleo Protón: La carga de un protón es 1,6 x10-19 C. La masa de un protón es 1,6726x10-27 kg. Neutrones: El neutrón es neutro. La masa
QUIMICA GENERAL. Docente : Raquel Villafrades Torres
 Universidad Pontificia Bolivariana QUIMICA GENERAL Docente : Raquel Villafrades Torres TEORIA ATOMICA DE DALTON (1808) BASES Ley de conservación de la masa: La masa total de las sustancias presentes después
Universidad Pontificia Bolivariana QUIMICA GENERAL Docente : Raquel Villafrades Torres TEORIA ATOMICA DE DALTON (1808) BASES Ley de conservación de la masa: La masa total de las sustancias presentes después
1. Estructura atómica y clasificación periódica
 Química 1. Estructura atómica y clasificación periódica Para comenzar. Para afianzar los contenidos teóricos correspondientes a este capítulo, les proponemos una serie de actividades que es conveniente
Química 1. Estructura atómica y clasificación periódica Para comenzar. Para afianzar los contenidos teóricos correspondientes a este capítulo, les proponemos una serie de actividades que es conveniente
SEGUNDO DE BACHILLERATO QUÍMICA. a A + b B c C + d D
 TEMA 5. CINÉTICA QUÍMICA a A + b B c C + d D 1 d[a] 1 d[b] 1 d[c] 1 d[d] mol v = = = + = + a dt b dt c dt d dt L s El signo negativo en la expresión de velocidad es debido a que los reactivos desaparecen,
TEMA 5. CINÉTICA QUÍMICA a A + b B c C + d D 1 d[a] 1 d[b] 1 d[c] 1 d[d] mol v = = = + = + a dt b dt c dt d dt L s El signo negativo en la expresión de velocidad es debido a que los reactivos desaparecen,
Estructura de la materia y Sistema Periódico
 Estructura de la materia y Sistema Periódico 1 - Respecto el número cuántico «n» que aparece en el modelo atómico de Bohr indicar de manera razonada cuáles de las siguientes frases son correctas y cuáles
Estructura de la materia y Sistema Periódico 1 - Respecto el número cuántico «n» que aparece en el modelo atómico de Bohr indicar de manera razonada cuáles de las siguientes frases son correctas y cuáles
Modelo atómico de Thomson
 Modelo atómico de Dalton. Ésta es la primera teoría científica que considera que la materia está dividida en átomos Modelo atómico de Thomson Introduce la idea de que el átomo puede dividirse en las llamadas
Modelo atómico de Dalton. Ésta es la primera teoría científica que considera que la materia está dividida en átomos Modelo atómico de Thomson Introduce la idea de que el átomo puede dividirse en las llamadas
Tiempo y Geología. Geología General I 2015
 Tiempo y Geología Geología General I 2015 A qué nos referimos cuando hablamos del tiempo geológico? Tiempo Geológico Todo el tiempo que transcurrió desde la formación de la Tierra hasta el presente Qué
Tiempo y Geología Geología General I 2015 A qué nos referimos cuando hablamos del tiempo geológico? Tiempo Geológico Todo el tiempo que transcurrió desde la formación de la Tierra hasta el presente Qué
CINÉTICA QUÍMICA. También deberemos tener en cuenta los coeficientes estequiométricos.
 CINETICA CINÉTICA QUÍMICA Estudia la velocidad con la que tienen lugar las reacciones, los factores que influyen en ella y el mecanismo mediante el que se lleva a cabo. VELOCIDAD DE REACCIÓN Cuando se
CINETICA CINÉTICA QUÍMICA Estudia la velocidad con la que tienen lugar las reacciones, los factores que influyen en ella y el mecanismo mediante el que se lleva a cabo. VELOCIDAD DE REACCIÓN Cuando se
Fenómenos nucleares II: fisión y fusión nuclear SGUICEL002QM11-A16V1
 Fenómenos nucleares II: fisión y fusión nuclear SGUICEL002QM11-A16V1 Ítem Alternativa Habilidad 1 E Comprensión 2 B Aplicación 3 D Aplicación 4 E ASE 5 B Aplicación 6 C Aplicación 7 A Reconocimiento 8
Fenómenos nucleares II: fisión y fusión nuclear SGUICEL002QM11-A16V1 Ítem Alternativa Habilidad 1 E Comprensión 2 B Aplicación 3 D Aplicación 4 E ASE 5 B Aplicación 6 C Aplicación 7 A Reconocimiento 8
EL ÁTOMO ( I ). Conceptos fundamentales
 EL ÁTOMO ( I ). onceptos fundamentales Núcleo del átomo Dimensiones muy reducidas comparadas con el tamaño del átomo En el núcleo radica la masa del átomo Partículas: protones y neutrones (nucleones).
EL ÁTOMO ( I ). onceptos fundamentales Núcleo del átomo Dimensiones muy reducidas comparadas con el tamaño del átomo En el núcleo radica la masa del átomo Partículas: protones y neutrones (nucleones).
PPTCCO007CB33-A17V1 Clase. Leyes y conceptos de la estequiometría
 PPTCCO007CB33-A17V1 Clase Leyes y conceptos de la estequiometría Resumen de la clase anterior El átomo Representado por Divisible en Participan en Protón Neutrón Electrón Caracterizados por Modelos atómicos
PPTCCO007CB33-A17V1 Clase Leyes y conceptos de la estequiometría Resumen de la clase anterior El átomo Representado por Divisible en Participan en Protón Neutrón Electrón Caracterizados por Modelos atómicos
Radiación. Tipos de radiación
 Radiación Las radiaciones son ondas electromagnéticas o partículas que se propagan con una velocidad dada. Contienen energía, carga eléctrica y magnética. Pueden ser generadas por fuentes naturales o instrumentos
Radiación Las radiaciones son ondas electromagnéticas o partículas que se propagan con una velocidad dada. Contienen energía, carga eléctrica y magnética. Pueden ser generadas por fuentes naturales o instrumentos
Protones. Neutrones e Isótopos. 4) Cuál átomo tiene el menor número de neutrones? A) carbono-14 B) nitrógeno-14 C) oxígeno-16 D) fluor-19 E) argón 18
 Protones 1) y están ubicados en el núcleo atómico. A) Protones, electrones B) Electrones, neutrones C) Protones, neutrones D) Ninguno de los anteriores E) Neutrones, sólo neutrones 2) El número atómico
Protones 1) y están ubicados en el núcleo atómico. A) Protones, electrones B) Electrones, neutrones C) Protones, neutrones D) Ninguno de los anteriores E) Neutrones, sólo neutrones 2) El número atómico
Tema 5: El átomo y sus uniones.
 Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
