Conocimiento y comprensión de la ciencia. Aprendizaje Esperado _ Interpreta gráficos y tablas de datos
|
|
|
- Vicente Pereyra Quintana
- hace 7 años
- Vistas:
Transcripción
1 DEPARTAMENTO DE CIENCIAS QUÍMICA - MYP Séptimo Básico GUÍA # 4: GRÁFICAS Y TABLAS Pregunta guía: Cómo los científicos han investigado el mundo que nos rodea? Área de interacción: Ingenio Humano Criterio C: Conocimiento y comprensión de la ciencia. Aprendizaje Esperado _ Interpreta gráficos y tablas de datos Pega la guía en tu cuaderno y luego responde 1_Dado los siguientes gráficos responde: A_ Cuál elemento es el de mayor porcentaje en el cuerpo humano? Oxígeno B_ Cuál es el segundo elemento en abundancia en el cuerpo humano? Carbono C_ Qué elementos están presentes en el cuerpo humano? Oxígeno, carbono, hidrógeno, nitrógeno, sodio, calcio, etc. 2_La gráfica representa la abundancia de elementos en la corteza terrestre A_ Cuál es el elemento más abundante en la corteza terrestre? Oxígeno B_ Cuáles son los cuatro elementos más abundantes en la corteza terrestre? Oxígeno, Silicio, Aluminio y Hierro. C_ El Silicio en qué parte de la corteza terrestre se encuentra presente? En la arena
2 3_ Realice la gráfica en papel milimetrado y en Excel para la obtención de dióxido de carbono (CO 2 ) en un experimento Tiempo / min Masa de CO 2 /g 2,0 1,5 4,0 2,5 6,0 3,1 8,0 3,4 10,0 3,6 16,0 3,8 4_ La solubilidad de una sustancia se define como la cantidad de gramos que se pueden disolver en 100 gramos de agua. La gráfica muestra la solubilidad del nitrato de potasio (KNO 3 ) entre los 0 C y los 60 C A_ Qué cantidad de nitrato de potasio se disuelven en 100 gramos de agua a los 40 C? 62 g B_ Qué cantidad de nitrato de potasio se disuelven en 100 gramos de agua a los 20 C? 31 g C_ Cómo afecta la temperatura la solubilidad del nitrato de potasio? A mayor temperatura mayor solubilidad E_ Cuáles son las variables dependiente e independientes en este experimento? Variable dependiente: Solubilidad Variable independiente: Temperatura
3 5_ Dada la siguiente gráfica responda A_ Qué significan las dos líneas paralelas en el eje Y? Un corte en la escala B_ Qué sucede con el volumen de dióxido de carbono a través de los años? Aumenta 6_ Dada la secuencia de imágenes. Coloque el número que corresponde de la columna A con la explicación en la columna B COLUMNA A COLUMNA B 1 2_ A medida que la Tierra se enfrió, la mayor parte del vapor de agua condensaba en agua líquida, formándose así los océanos 2 5_ Poco a poco, la concentración de oxígeno en la atmósfera aumentó, y disminuyo la concentración del dióxido de carbono. Finalmente, llegaron a las concentraciones que tienen actualmente. 3 1_ Hace más de 3000 millones de años, la atmósfera de la Tierra consistía principalmente de dióxido de carbono (CO 2 ) y vapor de agua (H 2 O (g)). Había pequeñas cantidades de otros gases, incluyendo el nitrógeno (N 2 ).
4 4 3_ La mayor parte del dióxido de carbono fue disuelto en los océanos. Allí, se combina con compuestos de calcio para formar carbonato de calcio, que se deposita en forma de roca caliza en el lecho del océano. 5 4_ Había dióxido de carbono en la atmósfera, y esto hizo posible que las primeras plantas que se desarrollaron en los océanos, hace unos 1500 millones de años atrás, lo utilizaran para fabricar su alimento mediante la fotosíntesis., en cuyo proceso se libera oxígeno a la atmósfera. Qué intenta explicar la secuencia de imágenes? Intenta explicar como se formó el oxígeno presente en la atmosfera terrestre 7_ Se realizó un experimento y se obtuvieron datos que se muestran graficados A_ Cuál pudo ser el problema planteado para esta investigación? Cómo afecta la temperatura a la solubilidad del azúcar en agua? B_ Qué cantidad de azúcar se disuelven en 100 gramos de agua a 0 C? Se disuelven 180 g de azúcar
5 C_ Qué cantidad de azúcar se disuelven en 100 gramos de agua a 80 C? Se disuelven 420 g de azúcar D_ A temperatura ambiente cuál será la solubilidad del azúcar? A temperatura ambiente aproximadamente 20 C se disuelven 200 g de azúcar II_ Selección múltiple: Encierra en un círculo la letra de la alternativa que consideras correcta 1. Cuál de los siguientes gráficos representa de mejor manera a los datos contenidos en la siguiente tabla de datos. tiempo (h) distancia (m) A) B) C) D) E) 2. Cuál es la conclusión correcta que se obtiene después de observar el siguiente gráfico A) Sólo llueve 3 meses al año B) En agosto llovió el doble de julio C) En julio llovió menos que en septiembre D) Ninguna de las anteriores 3. Según los datos observados en el gráfico, es correcto afirmar que:
6 A) el periodo más lluvioso fue entre los meses mayo y agosto. B) todos los meses llovió lo mismo. C) la cantidad de lluvia caída disminuyó a partir de enero. D) en todos los meses, la cantidad de lluvia caída fue mayor a 80 milímetros. 4. Los escarabajos de la harina son unos insectos que comen alimentos guardados como harina y maíz, causando grandes daños. Unos científicos querían saber más sobre estos escarabajos y pusieron 4 frascos tapados con género, con harina y 10 escarabajos en cada uno. Durante dos meses, dejaron cada frasco a una temperatura distinta. Después contaron los escarabajos que había en cada frasco. Los resultados del experimento se muestran en la tabla. Temperatura/ ºC Cantidad de escarabajos después de dos meses Según la información del texto y de la tabla a cuál de las siguientes temperaturas conviene guardar la harina para que sea menos dañada por los escarabajos? A) 27 ºC B) 22 ºC C) 32 ºC D) 38 ºC 5. Lucía se interesa por los fenómenos que ocurren todos los días. Ahora está investigando las sombras. Para eso, mide el largo de una sombra a distintas horas del día y anota sus resultados en la siguiente tabla. Hora Largo de la sombra en centímetros 10 de la mañana del día 91 2 de la tarde 98 4 de la tarde 190 Qué conclusión puede sacar Lucía de su investigación? A) El largo de la sombra cambia durante el día. B) La sombra más larga que puede haber en un día es de 190 cm. C) En la mañana pueden distinguirse detalles dentro de la sombra. D) El color de la sombra depende del día en que se mida.
ACTIVIDADES: GRÁFICAS Y TABLAS
 1_Dado los siguientes gráficos responde: ACTIVIDADES: GRÁFICAS Y TABLAS A_ Cuál elemento es el de mayor porcentaje en el cuerpo humano? B_ Cuál es el segundo elemento en abundancia en el cuerpo humano?
1_Dado los siguientes gráficos responde: ACTIVIDADES: GRÁFICAS Y TABLAS A_ Cuál elemento es el de mayor porcentaje en el cuerpo humano? B_ Cuál es el segundo elemento en abundancia en el cuerpo humano?
ENSAYO SIMCE OFICIAL 4º básico Comprensión del Medio Natural Nombre:
 ENSAYO SIMCE OFICIAL 4º básico Comprensión del Medio Natural Nombre: Origen: Ministerio de Educación Colegio: Fecha: 1 Lucía compró una planta de regalo para su mamá y la guardó dentro de un closet durante
ENSAYO SIMCE OFICIAL 4º básico Comprensión del Medio Natural Nombre: Origen: Ministerio de Educación Colegio: Fecha: 1 Lucía compró una planta de regalo para su mamá y la guardó dentro de un closet durante
SOLUCIONES SOLIDA LIQUIDA GASEOSA. mezclas homogéneas de dos sustancias: SEGÚN EL ESTADO FISICO DEL SOLVENTE
 Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
IES ALONSO QUESADA Física y Química 3º ESO Trabajo Científico. Estados de la materia. Clasificación de la materia.
 IES ALONSO QUESADA Física y Química 3º ESO Trabajo Científico. Estados de la materia. Clasificación de la materia. 1) Contesta las siguientes preguntas: a - Cuáles son los pasos del método científico?.
IES ALONSO QUESADA Física y Química 3º ESO Trabajo Científico. Estados de la materia. Clasificación de la materia. 1) Contesta las siguientes preguntas: a - Cuáles son los pasos del método científico?.
Tiempo (minutos) Temperatura (ºC)
 EXAMEN FINAL 3º ESO. FÍSICA Y QUÍMICA. 1.- Al calentar un cierto sólido se ha obtenido la siguiente tabla de datos: Tiempo (minutos) 0 2 4 6 10 12 16 18 20 Temperatura (ºC) -5 0 5 10 20 20 20 25 30 Representa
EXAMEN FINAL 3º ESO. FÍSICA Y QUÍMICA. 1.- Al calentar un cierto sólido se ha obtenido la siguiente tabla de datos: Tiempo (minutos) 0 2 4 6 10 12 16 18 20 Temperatura (ºC) -5 0 5 10 20 20 20 25 30 Representa
CuO (s) + H 2 SO 4(aq) CuSO 4(aq) +H 2 O (aq)
 Relación de problemas Química 4º ESO CDP. NTRA. SRA. DE LORETO 1. El trióxido de azufre se sintetiza a partir de dióxido de azufre y oxígeno molecular. Calcula la masa y el volumen de los reactivos que
Relación de problemas Química 4º ESO CDP. NTRA. SRA. DE LORETO 1. El trióxido de azufre se sintetiza a partir de dióxido de azufre y oxígeno molecular. Calcula la masa y el volumen de los reactivos que
Disoluciones. Química General II 2011
 Disoluciones Química General II 2011 Disolución Es una mezcla homogénea de dos o mas sustancias. Componentes: Soluto: Sustancia (s) presente (s) en menor cantidad en una disolución, son las sustancias
Disoluciones Química General II 2011 Disolución Es una mezcla homogénea de dos o mas sustancias. Componentes: Soluto: Sustancia (s) presente (s) en menor cantidad en una disolución, son las sustancias
Materia: es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos. Es diversa y discontinua.
 Sistemas materiales Materia: es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos. Es diversa y discontinua. Mezcla Heterogénea: unión de dos o más sustancias de
Sistemas materiales Materia: es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos. Es diversa y discontinua. Mezcla Heterogénea: unión de dos o más sustancias de
3, Masa (g) Número de átomos de hidrógeno. (g/mol) moléculas. cloruro de hidrógeno. amoniaco 5. metano
 Ejercicios de moles y reacciones químicas 1. Se tienen 300 g de diyodo. a) Cuántos moles de diyodo tengo? b) Cuántas de diyodo tengo? Cuántos átomos de yodo tengo? Dato: MA(I)=127 u. 2. Se tienen 7,892
Ejercicios de moles y reacciones químicas 1. Se tienen 300 g de diyodo. a) Cuántos moles de diyodo tengo? b) Cuántas de diyodo tengo? Cuántos átomos de yodo tengo? Dato: MA(I)=127 u. 2. Se tienen 7,892
CLASIFICACIÓN DE LA MATERIA
 Separación de sustancias Elementos y compuestos Fernández Monroy, Mª Ernestina; Gutiérrez Múzquiz, Félix A. y Marco Viñes, José Manuel Física y Química: guía interactiva para la resolución de ejercicios
Separación de sustancias Elementos y compuestos Fernández Monroy, Mª Ernestina; Gutiérrez Múzquiz, Félix A. y Marco Viñes, José Manuel Física y Química: guía interactiva para la resolución de ejercicios
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO
 PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
INSTITUCIÓN EDUCATIVA FE Y ALEGRÍA NUEVA GENERACIÓN
 INSTITUCIÓN EDUCATIVA FE Y ALEGRÍA NUEVA GENERACIÓN Formando para el amor y la vida - AREA CIENCIAS NATURALES: QUIMICA - FISICA Tema: La Materia, Energía y Sonido Tiempo: 2 periodos académicos Grado: Quinto
INSTITUCIÓN EDUCATIVA FE Y ALEGRÍA NUEVA GENERACIÓN Formando para el amor y la vida - AREA CIENCIAS NATURALES: QUIMICA - FISICA Tema: La Materia, Energía y Sonido Tiempo: 2 periodos académicos Grado: Quinto
E.E.T. Nº9. Físico-Química de 2do año. Guía Nº3. Profesor: Alumno: Curso:
 E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F. 4 - Expresa en moles: 4,5 g de agua; 0,3 g de hidrógeno; 440 g de dióxido de carbono
 ÁTOMOS, MOLÉCULAS Y MOLES 1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F 2- Calcula la masa de las siguientes moléculas: HNO 3 ; PH 3 ; Cl 2 O; N 2 O 5 y CCl 4 3 - Cuantos moles de oxígeno
ÁTOMOS, MOLÉCULAS Y MOLES 1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F 2- Calcula la masa de las siguientes moléculas: HNO 3 ; PH 3 ; Cl 2 O; N 2 O 5 y CCl 4 3 - Cuantos moles de oxígeno
EJEMPLOS DE PREGUNTA. Prueba de QUÍMICA. febrero 2010
 EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
LAS CAPAS FLUIDAS DE LA TIERRA
 LAS CAPAS FLUIDAS DE LA TIERRA LA ATMÓSFERA La atmósfera es la capa gaseosa que rodea la Tierra. Es fundamental para la vida porque contiene los gases que respiramos y porque nos protege de algunas radiaciones
LAS CAPAS FLUIDAS DE LA TIERRA LA ATMÓSFERA La atmósfera es la capa gaseosa que rodea la Tierra. Es fundamental para la vida porque contiene los gases que respiramos y porque nos protege de algunas radiaciones
Equilibrio Químico. CI4102 Ingeniería Ambiental Profesor Marcelo Olivares A.
 Equilibrio Químico CI4102 Ingeniería Ambiental Profesor Marcelo Olivares A. Introducción Las reacciones químicas que se ha considerado hasta este punto se denominan irreversibles debido a que ellas proceden
Equilibrio Químico CI4102 Ingeniería Ambiental Profesor Marcelo Olivares A. Introducción Las reacciones químicas que se ha considerado hasta este punto se denominan irreversibles debido a que ellas proceden
PROBLEMAS DE ESTEQUIOMETRÍA SEPTIEMBRE 2012
 PROBLEMAS DE ESTEQUIOMETRÍA SEPTIEMBRE 2012 1- Una muestra de 15 g de calcita, que contiene un 98 % en peso de carbonato de calcio puro, se hace reaccionar con ácido sulfúrico del 96% y densidad 1,84 g.cm
PROBLEMAS DE ESTEQUIOMETRÍA SEPTIEMBRE 2012 1- Una muestra de 15 g de calcita, que contiene un 98 % en peso de carbonato de calcio puro, se hace reaccionar con ácido sulfúrico del 96% y densidad 1,84 g.cm
MOL. Nº AVOGADRO DISOLUCIONES. TEMA 4 Pág. 198 libro (Unidad 10)
 MOL. Nº AVOGADRO DISOLUCIONES TEMA 4 Pág. 198 libro (Unidad 10) CONCEPTOS PREVIOS Supuestos de Dalton Teoría atómica de Dalton Elementos consitudios por átomos, partícuals separads e indivisibles Átomos
MOL. Nº AVOGADRO DISOLUCIONES TEMA 4 Pág. 198 libro (Unidad 10) CONCEPTOS PREVIOS Supuestos de Dalton Teoría atómica de Dalton Elementos consitudios por átomos, partícuals separads e indivisibles Átomos
INSTITUCIÒN EDUCATIVA JUAN MARIA CESPEDES. DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 11º
 INSTITUCIÒN EDUCATIVA Código: F-GA-024 EDUCACIÒN CON CALIDAD JUAN MARIA CESPEDES Versión: 02 Fecha: 2011-07-05 DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 11º PREGUNTAS DE SELECCIÓN
INSTITUCIÒN EDUCATIVA Código: F-GA-024 EDUCACIÒN CON CALIDAD JUAN MARIA CESPEDES Versión: 02 Fecha: 2011-07-05 DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 11º PREGUNTAS DE SELECCIÓN
Física y Química 1ºBachillerato Ejemplo Examen. Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Ioduro de Calcio:
 Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
REACCIONES DE QUÍMICA INORGÁNICA. RENDIMIENTO Y RIQUEZA.
 PROBLEMAS ESTEQUIOMETRÍA 1º BACH. REACCIONES DE QUÍMICA INORGÁNICA. RENDIMIENTO Y RIQUEZA. 1. El cloruro amónico con hidróxido de calcio produce al reaccionar cloruro de calcio, amoníaco y agua. Si el
PROBLEMAS ESTEQUIOMETRÍA 1º BACH. REACCIONES DE QUÍMICA INORGÁNICA. RENDIMIENTO Y RIQUEZA. 1. El cloruro amónico con hidróxido de calcio produce al reaccionar cloruro de calcio, amoníaco y agua. Si el
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Sistemas Físicos y Químicos (II)
 Autor: anuel Díaz Escalera (http://www.fqdiazescalera.com) 1(6) Ejercicio nº 1 Determina la composición centesimal de los siguientes compuestos: a) NH 3 ; b) H 2 SO 4 y c) CaCO 3 Ejercicio nº 2 Calcula
Autor: anuel Díaz Escalera (http://www.fqdiazescalera.com) 1(6) Ejercicio nº 1 Determina la composición centesimal de los siguientes compuestos: a) NH 3 ; b) H 2 SO 4 y c) CaCO 3 Ejercicio nº 2 Calcula
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
MOL. Nº AVOGADRO GASES. TEMA 4 Pág. 198 libro (Unidad 10)
 MOL. Nº AVOGADRO GASES TEMA 4 Pág. 198 libro (Unidad 10) CONCEPTOS PREVIOS Supuestos de Dalton Teoría atómica de Dalton Elementos constituidos por átomos, partículas separadas e indivisibles Átomos de
MOL. Nº AVOGADRO GASES TEMA 4 Pág. 198 libro (Unidad 10) CONCEPTOS PREVIOS Supuestos de Dalton Teoría atómica de Dalton Elementos constituidos por átomos, partículas separadas e indivisibles Átomos de
Materia: FÍSICA Y QUÍMICA 3º E.S.O Curso
 ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REPASO FÍSICA Y QUÍMICA
 ACTIVIDADES DE REPASO FÍSICA Y QUÍMICA 1. Esquema del método científico. 2. Cuáles son las magnitudes que forman el Sistema Internacional (S.I.)? Cuáles son sus unidades? 3. Realiza los siguientes cambios
ACTIVIDADES DE REPASO FÍSICA Y QUÍMICA 1. Esquema del método científico. 2. Cuáles son las magnitudes que forman el Sistema Internacional (S.I.)? Cuáles son sus unidades? 3. Realiza los siguientes cambios
IES SIERRA DEL AGUA ACTIVIDADES DE FÍSICA Y QUÍMICA DE ALUMNOS PENDIENTES DE 3º DE ESO
 IES SIERRA DEL AGUA ACTIVIDADES DE FÍSICA Y QUÍMICA DE ALUMNOS PENDIENTES DE 3º DE ESO Tema 1: Medida y método científico. 1. Transforme las siguientes magnitudes al S.I de unidades: a) 228 Gm b) 436 ns
IES SIERRA DEL AGUA ACTIVIDADES DE FÍSICA Y QUÍMICA DE ALUMNOS PENDIENTES DE 3º DE ESO Tema 1: Medida y método científico. 1. Transforme las siguientes magnitudes al S.I de unidades: a) 228 Gm b) 436 ns
5) En 20 g de Ni 2 (CO 3 ) 3 : a) Cuántos moles hay de dicha sal? b) Cuántos átomos hay de oxígeno? c) Cuántos moles hay de iones carbonato?
 QUÍMICA 2º BACH. SELECTIVIDAD: MOL-N A 1) Para un mol de agua, justifique la veracidad o falsedad de las siguientes afirmaciones: a) En condiciones normales de presión y temperatura, ocupa un volumen de
QUÍMICA 2º BACH. SELECTIVIDAD: MOL-N A 1) Para un mol de agua, justifique la veracidad o falsedad de las siguientes afirmaciones: a) En condiciones normales de presión y temperatura, ocupa un volumen de
La materia se puede definir como todo aquello que tiene masa y ocupa un volumen.
 Tema 2: LA MATERIA Que es la materia? La materia se puede definir como todo aquello que tiene masa y ocupa un volumen. Clasificación de la materia (criterio: separación) Mezclas Sustancias puras Composición
Tema 2: LA MATERIA Que es la materia? La materia se puede definir como todo aquello que tiene masa y ocupa un volumen. Clasificación de la materia (criterio: separación) Mezclas Sustancias puras Composición
Liceo Bauzá Repartido de ejercicios y problemas:
 TORIO DE QUÍMICA Liceo Bauzá Repartido de ejercicios y problemas: ESTEQUIOMÉTRICOS LABORA CÁLCULOS 1- El peróxido de hidrógeno (H 2 O 2 ), conocido como agua oxigenada, es un compuesto que es utilizado
TORIO DE QUÍMICA Liceo Bauzá Repartido de ejercicios y problemas: ESTEQUIOMÉTRICOS LABORA CÁLCULOS 1- El peróxido de hidrógeno (H 2 O 2 ), conocido como agua oxigenada, es un compuesto que es utilizado
Evaluación del Período Nº 5 Tierra y Universo Ciencias Naturales TERCER AÑO BÁSICO
 Evaluación del Período Nº 5 Tierra y Universo Ciencias Naturales TERCER AÑO BÁSICO Mi nombre Mi curso Nombre de mi escuela Fecha Selección múltiple: A continuación se presentan una serie de preguntas
Evaluación del Período Nº 5 Tierra y Universo Ciencias Naturales TERCER AÑO BÁSICO Mi nombre Mi curso Nombre de mi escuela Fecha Selección múltiple: A continuación se presentan una serie de preguntas
1. Explica qué se entiende por magnitud, medida y unidad. Pon un ejemplo de cada una para ilustrar tus explicaciones
 IES CARMEN CONDE ACTIVIDAES DE REPASO. SEPTIEMBRE 2014 Unidad 1. La ciencia: la materia y su medida 1. Explica qué se entiende por magnitud, medida y unidad. Pon un ejemplo de cada una para ilustrar tus
IES CARMEN CONDE ACTIVIDAES DE REPASO. SEPTIEMBRE 2014 Unidad 1. La ciencia: la materia y su medida 1. Explica qué se entiende por magnitud, medida y unidad. Pon un ejemplo de cada una para ilustrar tus
5. Transformar los moles de la sustancia problema a las unidades que pida el problema.
 REACCIONES QUÍMICAS ESTEQUIOMETRÍA Es la parte de la química que estudia las cantidades de las sustancias que reaccionan y que se forman en una reacción química. Para realizar cálculos estequiométricos,
REACCIONES QUÍMICAS ESTEQUIOMETRÍA Es la parte de la química que estudia las cantidades de las sustancias que reaccionan y que se forman en una reacción química. Para realizar cálculos estequiométricos,
INSTITUCIÒN EDUCATIVA JUAN MARIA CESPEDES. DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 11º
 INSTITUCIÒN EDUCATIVA Código: F-GA-024 EDUCACIÒN CON CALIDAD JUAN MARIA CESPEDES Versión: 02 Fecha: 2011-07-05 DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 11º PREGUNTAS DE SELECCIÓN
INSTITUCIÒN EDUCATIVA Código: F-GA-024 EDUCACIÒN CON CALIDAD JUAN MARIA CESPEDES Versión: 02 Fecha: 2011-07-05 DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 11º PREGUNTAS DE SELECCIÓN
REFUERZO SIMCE 2013 N 4
 REFUERZO SIMCE 2013 N 4 Este refuerzo entra en las pruebas parciales y globales. Se aplicara el reglamento de evaluación en caso de no entrega en la fecha oportuna. Selección Múltiple: Encierre en un círculo
REFUERZO SIMCE 2013 N 4 Este refuerzo entra en las pruebas parciales y globales. Se aplicara el reglamento de evaluación en caso de no entrega en la fecha oportuna. Selección Múltiple: Encierre en un círculo
LEYES FUNDAMENTALES DE LA QUÍMICA
 LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
ÍNDICE REACCIONES QUÍMICAS QUÍMICAS
 REACCIONES QUÍMICAS ES QUÍMICAS REACCIONES QUÍMICAS Transformaciones físicas y químicas Reacción química Ecuación química Teoría de las reacciones químicas Velocidad de las reacciones químicas Energía
REACCIONES QUÍMICAS ES QUÍMICAS REACCIONES QUÍMICAS Transformaciones físicas y químicas Reacción química Ecuación química Teoría de las reacciones químicas Velocidad de las reacciones químicas Energía
PRÁCTICA DE REFORZAMIENTO I (BÁSICO)
 1. MÉTODO DE OSTWALD 5 PUNTOS El método de Ostwald es un proceso químico que permite obtener un ácido fuerte que puede ocasionar graves quemaduras en los seres vivos;presenta 22,23% de nitrógeno, 76,17%
1. MÉTODO DE OSTWALD 5 PUNTOS El método de Ostwald es un proceso químico que permite obtener un ácido fuerte que puede ocasionar graves quemaduras en los seres vivos;presenta 22,23% de nitrógeno, 76,17%
Elemento Neutrones Protones Electrones
 PROBLEMAS DE ÁTOMOS 1. Argumenta cómo se explica la ley de conservación de la masa en las reacciones químicas mediante su teoría atómica de Dalton. Calcula cuánto carbono se necesita para reaccionar exactamente
PROBLEMAS DE ÁTOMOS 1. Argumenta cómo se explica la ley de conservación de la masa en las reacciones químicas mediante su teoría atómica de Dalton. Calcula cuánto carbono se necesita para reaccionar exactamente
El uso de fertilizantes sintéticos, los cultivos agrícolas y la quema de carbón y petróleo han duplicado el ritmo al cual el
 ( ) La diferencia de temperatura de las distintas fracciones ( ) La diferencia de densidad de los distintos hidrocarburos que forman las fracciones ( ) La solubilidad de cada una de las fracciones 5 El
( ) La diferencia de temperatura de las distintas fracciones ( ) La diferencia de densidad de los distintos hidrocarburos que forman las fracciones ( ) La solubilidad de cada una de las fracciones 5 El
todoesquimica.bligoo.cl
 todoesquimica.bligoo.cl Ley de conservación de la masa (Lavoisier) Ley de proporciones definidas (Proust) Ley de proporciones múltiples (Dalton). Ley de proporciones recíprocas (Ritcher) Ley de volúmenes
todoesquimica.bligoo.cl Ley de conservación de la masa (Lavoisier) Ley de proporciones definidas (Proust) Ley de proporciones múltiples (Dalton). Ley de proporciones recíprocas (Ritcher) Ley de volúmenes
03 DISOLUCIONES. 2 Observando la curva de solubilidad del clorato potásico, responder:
 03 DISOLUCIONES 1 Sabemos que cierta disolución tiene una concentración de c = 512 g/l. Si su densidad es1,43 g/l, expresa el valor de su concentración en tanto por ciento. 2 Observando la curva de solubilidad
03 DISOLUCIONES 1 Sabemos que cierta disolución tiene una concentración de c = 512 g/l. Si su densidad es1,43 g/l, expresa el valor de su concentración en tanto por ciento. 2 Observando la curva de solubilidad
UNIDAD EDUCATIVA COLEGIO SAN ANTONIO DEL TUY OCUMARE DEL TUY, ESTADO MIRANDA
 UNIDAD EDUCATIVA COLEGIO SAN ANTONIO DEL TUY OCUMARE DEL TUY, ESTADO MIRANDA CURSO: 4 TO AÑO PROFESOR: CARLOS M. LANDAETA H. GUÍA N 2: SOLUCIONES. UNIDADES DE CONCENTRACIÓN. LEY DE RAOULT Y PROPIEDADES
UNIDAD EDUCATIVA COLEGIO SAN ANTONIO DEL TUY OCUMARE DEL TUY, ESTADO MIRANDA CURSO: 4 TO AÑO PROFESOR: CARLOS M. LANDAETA H. GUÍA N 2: SOLUCIONES. UNIDADES DE CONCENTRACIÓN. LEY DE RAOULT Y PROPIEDADES
MEZCLAS Y DISOLUCIONES - CUESTIONES Y EJERCICIOS
 MEZCLAS Y DISOLUCIONES - CUESTIONES Y EJERCICIOS Concentración de una disolución 1º.- Calcula la masa de nitrato de hierro (II), Fe(NO 3 ) 2, existente en 100 ml de disolución acuosa al 6 % en masa. Dato:
MEZCLAS Y DISOLUCIONES - CUESTIONES Y EJERCICIOS Concentración de una disolución 1º.- Calcula la masa de nitrato de hierro (II), Fe(NO 3 ) 2, existente en 100 ml de disolución acuosa al 6 % en masa. Dato:
EJERCICIOS TEMA 2. LA MATERIA Y SUS PROPIEDADES.
 EJERCICIOS TEMA 2. LA MATERIA Y SUS PROPIEDADES. 1. La materia puede presentarse en tres estados de agregación. Cuáles son? 2. Cómo son la forma y el volumen de un sólido? Y de un líquido? Y de un gas?
EJERCICIOS TEMA 2. LA MATERIA Y SUS PROPIEDADES. 1. La materia puede presentarse en tres estados de agregación. Cuáles son? 2. Cómo son la forma y el volumen de un sólido? Y de un líquido? Y de un gas?
Clasificación de la materia
 Clasificación de la materia Sustancias Puras Son caracterizados por su composición y propiedades definidas y constantes bajo condiciones determinadas. Sustancias puras: Elementos Son sustancias puras formadas
Clasificación de la materia Sustancias Puras Son caracterizados por su composición y propiedades definidas y constantes bajo condiciones determinadas. Sustancias puras: Elementos Son sustancias puras formadas
2. Cómo dividen la Tierra los paralelos y los meridianos? Cómo se llama el paralelo cero? Y el meridiano cero?
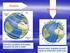 9. Reparte de la manera más equitativa posible esta cantidad de caramelos entre 3 amigos: 1 25057kgdefresa,0 57892kgdementay0 8999kgdecafé.Redondeaalamilésima. 1 25057kg+0 57892kg+0 8999kg=2 72939kg 2
9. Reparte de la manera más equitativa posible esta cantidad de caramelos entre 3 amigos: 1 25057kgdefresa,0 57892kgdementay0 8999kgdecafé.Redondeaalamilésima. 1 25057kg+0 57892kg+0 8999kg=2 72939kg 2
Estados de la materia y cambios de fase
 3 Año de Química: Sistemas Materiales Prof. Javier Ponce Qué es Ciencia? Ciencia (en latíns cientia, de scire, conocer ), término que en su sentido más amplio se emplea para referirse al conocimiento sistematizado
3 Año de Química: Sistemas Materiales Prof. Javier Ponce Qué es Ciencia? Ciencia (en latíns cientia, de scire, conocer ), término que en su sentido más amplio se emplea para referirse al conocimiento sistematizado
Determina el número de protones que hay en el núcleo de los átomos correspondientes a los siguientes elementos químicos:
 II EL ÁTOMO EJERCICIOS II Determina el número de protones que hay en el núcleo de los átomos correspondientes a los siguientes elementos químicos: a) b) 5. Determina la estructura atómica de los átomos
II EL ÁTOMO EJERCICIOS II Determina el número de protones que hay en el núcleo de los átomos correspondientes a los siguientes elementos químicos: a) b) 5. Determina la estructura atómica de los átomos
De acuerdo a lo explicado podemos resolver problemas como los siguientes:
 Estequiometría de reacciones II Pureza de los reactivos Hasta aquí hemos considerado que las reacciones son completas y que los reactivos son puros. Pero en la práctica, muchas veces esto último no ocurre,
Estequiometría de reacciones II Pureza de los reactivos Hasta aquí hemos considerado que las reacciones son completas y que los reactivos son puros. Pero en la práctica, muchas veces esto último no ocurre,
LOS GASES Y LAS DISOLUCIONES. Departamento de Física y Química 3º ESO
 LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
Apuntes Disoluciones
 Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la propia disolución
Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la propia disolución
MAGNITUDES MOLARES COMPOSICIÓN DE LAS DISOLUCIONES. Actividad 7. Actividad 1. Actividad 8. Actividad 2. Actividad 9. Actividad 3.
 MAGNITUDES MOLARES {Respuesta: [a] 0, mol; [b] 0,82 mol; [c] 0,56 mol} Actividad [a] En qué se parecen y en qué se diferencian las siguientes magnitudes: masa molecular relativa y masa molar? [b] Calcula
MAGNITUDES MOLARES {Respuesta: [a] 0, mol; [b] 0,82 mol; [c] 0,56 mol} Actividad [a] En qué se parecen y en qué se diferencian las siguientes magnitudes: masa molecular relativa y masa molar? [b] Calcula
LA TIERRA, UN PLANETA DIFERENTE
 LA TIERRA, UN PLANETA DIFERENTE Qué es la atmósfera? La atmósfera es la capa de aire que rodea a la Tierra. 1. La parte alta está compuesta por muchas capas y tiene poco aire. 2. La parte baja contiene
LA TIERRA, UN PLANETA DIFERENTE Qué es la atmósfera? La atmósfera es la capa de aire que rodea a la Tierra. 1. La parte alta está compuesta por muchas capas y tiene poco aire. 2. La parte baja contiene
Guía del estudiante Grado Séptimo Bimestre II Semana 3 Número de clases 7-9
 L ibertad y Ord en CIENCIAS Grado Séptimo Bimestre II Semana 3 Número de clases 7-9 Clase 7 Tema: Ciclos biogeoquímicos Ciclo del carbono Actividad 1 Observe el video y escriba algunas ideas sobre el tema
L ibertad y Ord en CIENCIAS Grado Séptimo Bimestre II Semana 3 Número de clases 7-9 Clase 7 Tema: Ciclos biogeoquímicos Ciclo del carbono Actividad 1 Observe el video y escriba algunas ideas sobre el tema
ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) TALLER N 2: CONCEPTO DE MOL Y NUMERO DE AVOGADRO
 I. Presentación de la guía: ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) TALLER N 2: CONCEPTO DE MOL Y NUMERO DE AVOGADRO Competencia: El alumno será capaz de reconocer y aplicar el concepto de mol y número
I. Presentación de la guía: ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) TALLER N 2: CONCEPTO DE MOL Y NUMERO DE AVOGADRO Competencia: El alumno será capaz de reconocer y aplicar el concepto de mol y número
1. MATERIA Y SU ASPECTO
 1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
3. Física del Buceo. Séptima Compañía de Bomberos Acción y Disciplina Tome Dichato Fundada el 24 de Octubre de 1975 GERSA
 3. Física del Buceo Séptima Compañía de Bomberos Acción y Disciplina Tome Dichato Fundada el 24 de Octubre de 1975 GERSA 1. Conceptos básicos y unidades de medida 1.1 Materia y sus estados Es todo aquello
3. Física del Buceo Séptima Compañía de Bomberos Acción y Disciplina Tome Dichato Fundada el 24 de Octubre de 1975 GERSA 1. Conceptos básicos y unidades de medida 1.1 Materia y sus estados Es todo aquello
Unidad 3. Átomos y moléculas
 Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
ACTIVIDADES PARA LOS ALUMNOS CON LA ASIGNATURA DE FÍSICA Y QUÍMICA DE 3º PENDIENTE
 ACTIVIDADES PARA LOS ALUMNOS CON LA ASIGNATURA DE FÍSICA Y QUÍMICA DE 3º PENDIENTE Los alumnos que hallan suspendido la asignatura de Física y Química de 3º deberán entregar, el día del examen de la asignatura,
ACTIVIDADES PARA LOS ALUMNOS CON LA ASIGNATURA DE FÍSICA Y QUÍMICA DE 3º PENDIENTE Los alumnos que hallan suspendido la asignatura de Física y Química de 3º deberán entregar, el día del examen de la asignatura,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 2, Opción B Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 2, Opción B Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio
CANTIDAD DE MATERIA. La masa total será: 12 0, ,0034 0, ,011uma. 15,9949 0, ,9991 0, ,9991 0, ,999 uma
 CANTIDAD DE MATERIA 1. Dada una muestra de carbono en la que la abundancia relativa de los isótopos es 98,892% de 12 C (12 uma) y 1,108% de 13 C (13,0034 uma), cuál es la masa media de estos átomos cuando
CANTIDAD DE MATERIA 1. Dada una muestra de carbono en la que la abundancia relativa de los isótopos es 98,892% de 12 C (12 uma) y 1,108% de 13 C (13,0034 uma), cuál es la masa media de estos átomos cuando
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2
 FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
CLASE Nº 2 ESTEQUIOMETRÍA
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
Estequiometría II. Química General I Lic. Oswaldo Martínez
 Estequiometría II Química General I 2012 Lic. Oswaldo Martínez Reactivo limitante Cuando se efectúa una reacción, los reactivos no están presentes en cantidades estequiométricas necesariamente, es decir,
Estequiometría II Química General I 2012 Lic. Oswaldo Martínez Reactivo limitante Cuando se efectúa una reacción, los reactivos no están presentes en cantidades estequiométricas necesariamente, es decir,
Acuerdo 286. Química. Disoluciones. Recopiló: M.C. Macaria Hernández Chávez
 Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
EVALUACIÓN DE LABORATORIO DE QUIMICA GENERAL I Resolución y Rúbrica
 ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL FACULTAD DE CIENCIAS NATURALES Y MATEMÁTICAS DEPARTAMENTO DE CIENCIAS QUÍMICAS Y AMBIENTALES EVALUACIÓN DE LABORATORIO DE QUIMICA GENERAL I Resolución y 1 (10 puntos).
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL FACULTAD DE CIENCIAS NATURALES Y MATEMÁTICAS DEPARTAMENTO DE CIENCIAS QUÍMICAS Y AMBIENTALES EVALUACIÓN DE LABORATORIO DE QUIMICA GENERAL I Resolución y 1 (10 puntos).
FÍSICA Y QUÍMICA Solucionario ÁCIDOS Y BASES
 FÍSICA Y QUÍMICA Solucionario ÁCIDOS Y BASES 1.* Calculad la molaridad de las siguientes disoluciones. a) Añadimos 3,6 moles de NaCl a 0,5 l de agua. 7 M b) Añadimos 2,5 moles de NaCl a 0,4 l de agua.
FÍSICA Y QUÍMICA Solucionario ÁCIDOS Y BASES 1.* Calculad la molaridad de las siguientes disoluciones. a) Añadimos 3,6 moles de NaCl a 0,5 l de agua. 7 M b) Añadimos 2,5 moles de NaCl a 0,4 l de agua.
Soluciones y unidades de concentración
 MATERIA Soluciones y unidades de concentración MEZCLAS SISTEMAS HETEROGÉNEOS Leche Arena Sal y azúcar SISTEMAS HOMOGÉNEOS Sal en agua Aire Acero COMPUESTOS Agua Etanol Benceno SUSTANCIAS PURAS ELEMENTOS
MATERIA Soluciones y unidades de concentración MEZCLAS SISTEMAS HETEROGÉNEOS Leche Arena Sal y azúcar SISTEMAS HOMOGÉNEOS Sal en agua Aire Acero COMPUESTOS Agua Etanol Benceno SUSTANCIAS PURAS ELEMENTOS
Soluciones y unidades de concentración
 Soluciones y unidades de concentración Dra. Dra. Patricia Patricia Satti, Satti, UNRN UNRN MATERIA MEZCLAS SUSTANCIAS PURAS SISTEMAS HETEROGÉNEOS Leche Arena Sal y azúcar SISTEMAS HOMOGÉNEOS Sal en agua
Soluciones y unidades de concentración Dra. Dra. Patricia Patricia Satti, Satti, UNRN UNRN MATERIA MEZCLAS SUSTANCIAS PURAS SISTEMAS HETEROGÉNEOS Leche Arena Sal y azúcar SISTEMAS HOMOGÉNEOS Sal en agua
TEMA 13: LA MATERIA, BASE DEL UNIVERSO
 TEMA 13: LA MATERIA, BASE DEL UNIVERSO Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy pequeñas llamadas átomos. La masa y el volumen se consideran
TEMA 13: LA MATERIA, BASE DEL UNIVERSO Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy pequeñas llamadas átomos. La masa y el volumen se consideran
TEMA 2: LA MATERIA: CÓMO SE PRESENTA?
 TEMA 2: LA MATERIA: CÓMO SE PRESENTA? 1.- La materia: sustancias puras y mezclas. 1.1.- Recordatorio. 1.2.- Sustancias puras. 1.3.- Mezclas. 1.4.- Cómo distinguir un coloide de una mezcla homogénea. 2.-
TEMA 2: LA MATERIA: CÓMO SE PRESENTA? 1.- La materia: sustancias puras y mezclas. 1.1.- Recordatorio. 1.2.- Sustancias puras. 1.3.- Mezclas. 1.4.- Cómo distinguir un coloide de una mezcla homogénea. 2.-
Este es un modelo de examen, en el examen real usted debe identificar los datos que necesita para resolver el problema, por lo tanto usted debe en
 Este es un modelo de examen, en el examen real usted debe identificar los datos que necesita para resolver el problema, por lo tanto usted debe en algunos problemas inventarse datos para poder resolver
Este es un modelo de examen, en el examen real usted debe identificar los datos que necesita para resolver el problema, por lo tanto usted debe en algunos problemas inventarse datos para poder resolver
Expresar la concentración de la disolución resultante en: a) % m/m, b) % m/v, c) g soluto/dm 3 disolvente.
 PROBLEMAS DE DISOLUCIONES PARTE I: Formas Físicas de Expresar las Concentraciones. 1. Se disuelven 35 g de cloruro de magnesio (MgCl 2 ) en 150 g de agua dando una disolución cuya densidad es de 1,12 g/cm
PROBLEMAS DE DISOLUCIONES PARTE I: Formas Físicas de Expresar las Concentraciones. 1. Se disuelven 35 g de cloruro de magnesio (MgCl 2 ) en 150 g de agua dando una disolución cuya densidad es de 1,12 g/cm
Tema 7. Las mezclas. Introducción
 Tema 7. Las mezclas Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las sustancias puras son los elementos y los compuestos que
Tema 7. Las mezclas Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las sustancias puras son los elementos y los compuestos que
Universidad Técnica Nacional
 Universidad Técnica Nacional Química I-CB005 Unidad III Estequiometría: Cálculos con fórmulas y ecuaciones químicas Masa atómica Promedio ponderado de la masa y abundancia de los isótopos naturales del
Universidad Técnica Nacional Química I-CB005 Unidad III Estequiometría: Cálculos con fórmulas y ecuaciones químicas Masa atómica Promedio ponderado de la masa y abundancia de los isótopos naturales del
Fuerzas de cohesión Sólido 1 Definido Pequeña 4 Líquido Variable Definido 3 Grande Gaseoso Variable 2 Grande Débil
 Comprensión de la naturaleza 8 básico Eje temático: Materia y energía 1. En la tabla se muestran las características de los estados sólidos, líquidos y gaseosos. Cuál de las siguientes opciones está referida
Comprensión de la naturaleza 8 básico Eje temático: Materia y energía 1. En la tabla se muestran las características de los estados sólidos, líquidos y gaseosos. Cuál de las siguientes opciones está referida
MEZCLAS Y DISOLUCIONES. Física y Química 3º de E.S.O. IES Isidra de Guzmán
 MEZCLAS Y DISOLUCIONES Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las
MEZCLAS Y DISOLUCIONES Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las
EJERCICIOS DE DISOLUCIONES Y ESTEQUIOMETRÍA
 EJERCICIOS DE DISOLUCIONES Y ESTEQUIOMETRÍA REACCIONES: 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono, medido
EJERCICIOS DE DISOLUCIONES Y ESTEQUIOMETRÍA REACCIONES: 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono, medido
Ejercicios de reacciones químicas 1. En la reacción de combustión del propano (C 3 H 8 ), éste reacciona con oxígeno para dar dióxido de carbono y
 Ejercicios de reacciones químicas 1. En la reacción de combustión del propano (C 3 H 8 ), éste reacciona con oxígeno para dar dióxido de carbono y agua: b) Si 140 g de propano reaccionan con un exceso
Ejercicios de reacciones químicas 1. En la reacción de combustión del propano (C 3 H 8 ), éste reacciona con oxígeno para dar dióxido de carbono y agua: b) Si 140 g de propano reaccionan con un exceso
Qué es la Hidrogeología?
 Qué es la Hidrogeología? La hidrogeología trata del estudio integral del agua subterránea, su distribución y evolución en tiempo y espacio en el marco de la geología regional. La geohidrología se encarga
Qué es la Hidrogeología? La hidrogeología trata del estudio integral del agua subterránea, su distribución y evolución en tiempo y espacio en el marco de la geología regional. La geohidrología se encarga
CAPITULO 6 : Soluciones
 CAPITULO 6 : Soluciones Gran parte de los líquidos que conocemos o que manejamos habitualmente son soluciones o disoluciones. El agua de mar, la saliva, la orina, la lavandina, el vinagre y al agua que
CAPITULO 6 : Soluciones Gran parte de los líquidos que conocemos o que manejamos habitualmente son soluciones o disoluciones. El agua de mar, la saliva, la orina, la lavandina, el vinagre y al agua que
Ejercicios Equilibrio Químico
 Ejercicios Equilibrio Químico 1. En un recipiente de 10,0 L a 800K, se encierran 1,00 mol de CO(g) y 1,00 mol de H 2 O(g). Cuando se alcanza el equilibrio: CO(g) + H 2 O(g) CO 2 (g) + H 2 (g) se hallan
Ejercicios Equilibrio Químico 1. En un recipiente de 10,0 L a 800K, se encierran 1,00 mol de CO(g) y 1,00 mol de H 2 O(g). Cuando se alcanza el equilibrio: CO(g) + H 2 O(g) CO 2 (g) + H 2 (g) se hallan
QUÍMICA. Tema 4. Estados de Agregación de la Materia
 Tema 4. Estados de Agregación de la Materia Índice - Características de sólidos, líquidos y gases - Volumen molar de los gases - Ecuación de estado de los gases - Disoluciones Objetivos específicos - Que
Tema 4. Estados de Agregación de la Materia Índice - Características de sólidos, líquidos y gases - Volumen molar de los gases - Ecuación de estado de los gases - Disoluciones Objetivos específicos - Que
ESTABLECIMIENTO DEL MODELO ATÓMICO- MOLECULAR PARA TODA LA MATERIA
 ESTABLECIMIENTO DEL MODELO ATÓMICO- MOLECULAR PARA TODA LA MATERIA Observaciones experimentales Propiedades comunes de los gases Propiedades de los sólidos y de los líquidos Cambios de estado Enorme variedad
ESTABLECIMIENTO DEL MODELO ATÓMICO- MOLECULAR PARA TODA LA MATERIA Observaciones experimentales Propiedades comunes de los gases Propiedades de los sólidos y de los líquidos Cambios de estado Enorme variedad
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
LAS REACCIONES QUÍMICAS.
 1 Ajustes de reacciones químicas. LAS REACCIONES QUÍMICAS. Ejercicios de la unidad 8 1.- Ajusta por tanteo las siguientes reacciones químicas: a) C 3 H 8 + O CO + H O; b) Na + H O NaOH + H ; c) KOH + H
1 Ajustes de reacciones químicas. LAS REACCIONES QUÍMICAS. Ejercicios de la unidad 8 1.- Ajusta por tanteo las siguientes reacciones químicas: a) C 3 H 8 + O CO + H O; b) Na + H O NaOH + H ; c) KOH + H
Guía del estudiante. Clase 16 Tema: Transformaciones de la materia. Qué son los cambios químicos y físicos? Actividad 1 (para socializar)
 CIENCIAS Grado Séptimo Bimestre IV Semana 6 Número de clases 16-18 Clase 16 Tema: Transformaciones de la materia Qué son los cambios químicos físicos? Actividad 1 (para socializar) Con la información contenida
CIENCIAS Grado Séptimo Bimestre IV Semana 6 Número de clases 16-18 Clase 16 Tema: Transformaciones de la materia Qué son los cambios químicos físicos? Actividad 1 (para socializar) Con la información contenida
Concepto de mol. Concepto de mol. Número de Avogadro
 Concepto de mol Concepto de mol. Número de Avogadro La masa de los átomos es muy pequeña. Si se toma como ejemplo el átomo de calcio, cuyo radio es de 2.10-8 cm, para completar una distancia de un centímetro
Concepto de mol Concepto de mol. Número de Avogadro La masa de los átomos es muy pequeña. Si se toma como ejemplo el átomo de calcio, cuyo radio es de 2.10-8 cm, para completar una distancia de un centímetro
So S l o u l c u i c o i n o e n s e
 Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol
 COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol de ácido metanoico (ácido fórmico)? Si tenemos en cuenta las fórmulas
COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol de ácido metanoico (ácido fórmico)? Si tenemos en cuenta las fórmulas
2 o Bach. QUÍMICA - Seminario ESTEQUIOMETRÍA. 2. La composición centesimal de un compuesto de Criptón es de 68,80 % de Kr y 31,20 % de F.
 ESTEQUIOMETRÍA 1. Calcula la densidad del butano (C 4 H 10 ) a una temperatura de 10 o C y una presión de 700 mmhg. 2. La composición centesimal de un compuesto de Criptón es de 68,80 % de Kr y 31,20 %
ESTEQUIOMETRÍA 1. Calcula la densidad del butano (C 4 H 10 ) a una temperatura de 10 o C y una presión de 700 mmhg. 2. La composición centesimal de un compuesto de Criptón es de 68,80 % de Kr y 31,20 %
La Materia y sus Cambios
 La Materia y sus Cambios 1. Química 2. Concepto de Materia y Energía 3. Estados de la Materia 4. Propiedades de la Materia 5. Composición de la Materia 6. Métodos de Separación de Mezclas 1. Química Química:
La Materia y sus Cambios 1. Química 2. Concepto de Materia y Energía 3. Estados de la Materia 4. Propiedades de la Materia 5. Composición de la Materia 6. Métodos de Separación de Mezclas 1. Química Química:
Semana 8 Bimestre: I Número de clase: 22
 Semana 8 Bimestre: I Número de clase: 22 Tema: Enlaces químicos Evidencias de aprendizaje: 1. Explica la formación de nuevos compuestos utilizando el diagrama de Lewis. Representa los tipos de enlaces
Semana 8 Bimestre: I Número de clase: 22 Tema: Enlaces químicos Evidencias de aprendizaje: 1. Explica la formación de nuevos compuestos utilizando el diagrama de Lewis. Representa los tipos de enlaces
EJERCICIOS DE LOS ESTADOS DE LA MATERIA
 EJERCICIOS DE LOS ESTADOS DE LA MATERIA Ejercicio nº 1 1- Observa la imagen y contesta las preguntas. La piedra aparece en el interior de un vaso graduado y luego se ha introducido en una Probeta sin quitar
EJERCICIOS DE LOS ESTADOS DE LA MATERIA Ejercicio nº 1 1- Observa la imagen y contesta las preguntas. La piedra aparece en el interior de un vaso graduado y luego se ha introducido en una Probeta sin quitar
Ciencias de la Tierra FS001
 1 Ciencias de la Tierra FS001 001_02_01 - Rocas Ígneas UNIVERSIDAD NACIONAL AUTÓNOMA DE HONDURAS FACULTAD DE CIENCIAS ESCUELA DE FÍSICA LUIS VARGAS & HEYDI MARTÍNEZ Ciclo de la Roca 2 Clasificación de
1 Ciencias de la Tierra FS001 001_02_01 - Rocas Ígneas UNIVERSIDAD NACIONAL AUTÓNOMA DE HONDURAS FACULTAD DE CIENCIAS ESCUELA DE FÍSICA LUIS VARGAS & HEYDI MARTÍNEZ Ciclo de la Roca 2 Clasificación de
