FICHA TÉCNICA. Los comprimidos son redondos, biconvexos, lisos por ambas caras y de color azul claro.
|
|
|
- Andrés Pereyra Prado
- hace 6 años
- Vistas:
Transcripción
1 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida Apotex 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida Excipientes: Lactosa monohidrato 91,45 mg. Para la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Comprimido recubierto con película (comprimido). Los comprimidos son redondos, biconvexos, lisos por ambas caras y de color azul claro. 4. DATOS CLÍNICOS 4.1. Indicaciones terapéuticas Finasterida está indicada en el tratamiento de la hiperplasia benigna de próstata (HBP) sintomática en varones con aumento de tamaño de la próstata con objeto de: o Mejorar los síntomas o Reducir el riesgo de retención urinaria aguda o Reducir la necesidad de cirugía, incluidas la resección transuretral de la próstata (RTUP) y la prostatectomía. Finasterida produce regresión del crecimiento prostático, mejora el flujo urinario y mejora los síntomas relacionados con la HBP Posología y forma de administración La posología recomendada es un comprimido diario de 5 mg, con o sin alimentos. Finasteridapuede administrarse sola o en combinación con el alfa-bloqueante doxazosina (ver sección 5.1). INSUFICIENCIA RENAL No es necesario ajustar la dosis de los pacientes con grados variables de insuficiencia renal (aclaramientos de creatinina de hasta sólo 9 ml/min), dado que los estudios farmacocinéticos no indicaron ningún cambio de la eliminación de finasterida. Pacientes de edad avanzada No es necesario ajustar la dosis, aunque los estudios farmacocinéticos indicaron una ligera disminución en la eliminación de finasterida en los pacientes mayores de 70 años. Uso en niños Finasteridano está recomendado para uso en niños debido a la ausencia de datos sobre seguridad y eficacia en este grupo de población. 1 de 13
2 4.3. Contraindicaciones El uso de finasterida no está indicado en las mujeres ni en los niños. Finasterida está contraindicado en las siguientes situaciones: Hipersensibilidad a cualquier componente de este producto. Embarazo - Utilización en las mujeres que están o pueden estar embarazadas (véase sección 4.6 Embarazo y lactancia, Exposición a finasterida riesgo para el feto varón) Advertencias y precauciones especiales de empleo Generales Los pacientes con un gran volumen de residuo urinario y/o una disminución intensa del flujo urinario deben ser controlados cuidadosamente para evitar complicaciones obstructivas. La posibilidad de cirugía debe ser una opción. Efectos sobre el APE y la detección del cáncer de próstata No se ha demostrado un efecto clínico beneficioso en los pacientes con cáncer de próstata tratados con finasterida. Se vigiló a pacientes con HBP y niveles séricos de antígeno prostático específico (APE) elevados en estudios clínicos controlados con determinación seriada de APE y biopsias prostáticas repetidas. En estos estudios de HBP, no parecía que finasteridaalterase la tasa de detección del cáncer de próstata, y la incidencia global de cáncer de próstata no varió significativamente en los pacientes tratados con finasterida y con un placebo. Antes de comenzar el tratamiento con finasterida, y periódicamente durante su administración, se recomienda realizar un tacto rectal y otras evaluaciones dirigidas al diagnóstico del cáncer de próstata. También se utilizan los niveles séricos APE para detectar el cáncer de próstata. Generalmente, un nivel basal de APE > 10 ng/ml (Hybritech) exige realizar una nueva evaluación y considerar la biopsia; si existen niveles de APE comprendidos entre 4 y 10 ng/ml, se recomienda efectuar una nueva evaluación. Existe un solapamiento notable en los niveles de APE entre los varones con y sin cáncer de próstata. Por consiguiente, los valores de APE dentro de los límites de referencia normales en varones con HBP no descartan el cáncer de próstata, independientemente del tratamiento con finasterida. Un valor basal de APE < 4 ng/ml no excluye la existencia de cáncer de próstata. Finasterida produce un descenso aproximado del 50% de las concentraciones séricas de APE en los pacientes con HBP, incluso con cáncer de próstata. Al evaluar los datos de los niveles séricos de APE en los pacientes con HBP tratados con finasterida es preciso tener en cuenta este descenso, que no descarta la presencia concomitante de un cáncer de próstata. Dicho descenso es previsible independientemente de los valores de APE, aunque puede variar en cada paciente. En el análisis de los datos del APE de más de pacientes incluidos en el Estudio sobre la eficacia y la seguridad a largo plazo de finasterida (PLESS), realizado durante 4 años según un diseño doble ciego y controlado con placebo, se confirmó que, en los pacientes típicos tratados con finasterida durante al menos seis meses, los valores de APE deben multiplicarse por dos para su comparación con los límites normales de los varones no tratados. Este ajuste permite mantener la sensibilidad y especificidad de la determinación del APE y su capacidad para detectar el cáncer de próstata. 2 de 13
3 Es preciso evaluar cuidadosamente todo aumento sostenido de los niveles del APE en los pacientes tratados con finasterida, sin olvidar el posible incumplimiento del tratamiento con finasterida. El porcentaje de APE libre (relación de APE libre y total) no desciende significativamente con finasterida. La relación de APE libre y total permanece constante incluso bajo la influencia de finasterida. Cuando el porcentaje de APE libre se utiliza como ayuda en la detección del cáncer de próstata, no es necesario ajustar su valor. 3 de 13
4 Interacciones entre el fármaco y las pruebas analíticas Efecto sobre los niveles del APE La concentración sérica de APE guarda relación con la edad y el volumen de la próstata del paciente, y el volumen prostático guarda relación con la edad del paciente. Al evaluar las determinaciones analíticas del APE es preciso considerar que los niveles del APE descienden en los pacientes tratados con finasterida. En la mayoría de los pacientes se observa un descenso rápido del APE en los primeros meses de tratamiento, y a partir de este momento los niveles de APE se estabilizan en un nuevo nivel basal. Este nivel basal postratamiento es aproximadamente la mitad del valor previo al tratamiento. Por consiguiente, como norma general, en los pacientes tratados con finasterida durante al menos seis meses los valores de APE deben multiplicarse por dos a efectos de comparación con los límites normales en varones no tratados. Para una interpretación clínica, véase 4.4 Advertencias y precauciones especiales de empleo, Efectos sobre el APE y la detección del cáncer de próstata. Cáncer de mama en varones Se ha notificado cáncer de mama en varones que toman finasterida 5 mg durante los ensayos clínicos y durante el período de uso después de la comercialización. Los médicos deben advertir a sus pacientes de la necesidad de informar inmediatamente de cualquier cambio que observen en el tejido de la mama, como bultos, dolor, ginecomastia o secreción del pezón. Uso en niños No está indicada la utilización de finasterida en los niños. No se han establecido la seguridad y la eficacia en los niños. Alteraciones del estado de ánimo y depresión Se han notificado alteraciones del estado de ánimo, incluido estado de animo deprimido, depresión y con menor frecuencia, ideación suicida en pacientes tratados con finasterida 5mg. Se debe supervisar a los pacientes en relación a síntomas psiquiátricos y si estos ocurren, se debe indicar al paciente que busque consejo médico. Advertencias sobre excipientes Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, de insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o problemas de absorción de glucosa o galactosa no deben tomar este medicamento. Este medicamento no contiene gluten Interacción con otros medicamentos y otras formas de interacción No han sido identificadas interacciones farmacológicas de importancia clínica. Finasterida se metaboliza principalmente a través del sistema enzimático 3A4 del citocromo P450, pero no parece afectarle de forma significativa. Aunque se estima que el riesgo de que finasterida afecte a la farmacocinética de otros fármacos es pequeño, es probable que inhibidores e inductores de la isoenzima P450 3A4 afecten a la concentración plasmática de finasterida. Sin embargo, y en base al margen de seguridad establecido para este fármaco, es poco probable que cualquier incremento de la concentración plasmática como consecuencia del uso concomitante de tales inhibidores tenga importancia clínica. Se han realizado pruebas en seres humanos con propranolol, digoxina, glibenclamida, warfarina, teofilina y fenazona, sin encontrar interacciones de importancia clínica. Otros tratamientos concomitantes 4 de 13
5 Aunque no se han realizado estudios específicos sobre interacciones, en los estudios clínicos en los que se ha utilizado finasterida junto con inhibidores de la ECA, paracetamol, ácido acetilsalicílico, alfa-bloqueantes, beta-bloqueantes, bloqueadores de los canales del calcio, nitratos cardiacos, diuréticos, antagonistas H2, inhibidores de la HMG-CoA reductasa, antiinflamatorios no esteroideos (AINEs), quinolonas y benzodiazepinas no se han detectado indicios de interacciones adversas de importancia clínica Fertilidad, embarazo y lactancia Embarazo Finasterida está contraindicado en las mujeres que estén o puedan estar embarazadas (ver sección 4.3 Contraindicaciones). Dada la capacidad que poseen los inhibidores de la 5α-reductasa de tipo II para inhibir la conversión de la testosterona en dihidrotestosterona, estos fármacos, incluida finasterida, pueden producir malformaciones de los genitales externos en los fetos varones cuando se administran a la mujer embarazada. Exposición a finasterida - riesgo para el feto varón Las mujeres que estén o puedan estar embarazadas no deben manipular comprimidos machacados o partidos de finasterida, dada la posible absorción de finasterida y el consiguiente riesgo potencial para el feto varón (véase 4.6 Embarazo y lactancia). Los comprimidos de finasterida tienen un recubrimiento que evita el contacto con el producto activo cuando se manipula normalmente, siempre que los comprimidos no se partan ni se machaquen. Se han recuperado pequeñas cantidades de finasterida del semen de sujetos que reciben finasterida 5 mg/día. Se desconoce si el feto masculino puede verse gravemente afectado si su madre está expuesta al semen de un paciente que está siendo tratado con finasterida. Cuando la pareja sexual del paciente está o pudiera estar embarazada, se recomienda que el paciente minimice la exposición de su pareja al semen. Lactancia No está indicada la utilización de finasterida en las mujeres. Se desconoce si finasterida se excreta en la leche humana Efectos sobre la capacidad para conducir y utilizar máquinas No hay datos conocidos que sugieran que finasterida pueda afectar la capacidad de conducir o manejar máquinaria Reacciones adversas Las reacciones adversas más frecuentes son impotencia y disminución de la libido. Estas reacciones adversas se producen en las primeras fases del tratamiento y en la mayoría de los pacientes se resuelven al continuar con el tratamiento. En la siguiente tabla se presentan las reacciones adversas comunicadas durante los ensayos clínicos y/o en el uso después de la comercialización: La frecuencia de reacciones adversas se determina de la siguiente manera: Muy frecuentes ( 1/10), Frecuentes (de 1/100 a <1/10)>, Poco frecuentes (de 1/1.000 a <1/100), Raras (de 1/10,000 a <1/1,000)>, Muy raras (<1/10.000), Frecuencia no conocida (no se puede estimar a partir de los datos disponibles). 5 de 13
6 No se puede determinar la frecuencia de reacciones adversas notificadas durante el uso posterior a la comercialización, ya que proceden de notificaciones espontáneas. Clasificación de órganos del sistema Trastornos del sistema inmunológico Trastornos psiquiátricos Trastornos cardíacos Trastornos hepatobiliares Trastornos de la piel y del tejido subcutáneo Trastornos del aparato reproductor y de la mama Exploraciones complementarias Frecuencia: reacción adversa Frecuencia no conocida: reacciones de hipersensibilidad, incluida hinchazón de los labios y cara Frecuente: disminución de la libido Frecuencia no conocida: palpitaciones Frecuencia no conocida: elevación de las enzimas hepáticas Poco frecuente: erupción cutánea Frecuencia no conocida: prurito, urticaria Frecuente: impotencia Poco frecuente: trastornos de la eyaculación, hipersensibilidad mamaria, crecimiento mamario Frecuencia no conocida: dolor testicular Frecuente: disminución del volumen de eyaculación Además, en los ensayos clínicos y durante el uso posterior a la comercialización se ha notificado cáncer de mama en varón (véase 4.4 Advertencias y precauciones especiales de empleo). Tratamiento médico de los síntomas prostáticos (MTOPS) El estudio MTOPS comparó finasterida 5 mg/día (n=768), doxazosina 4 u 8 mg/día (n=756), el tratamiento combinado de finasterida 5 mg/día y doxazosina 4 u 8 mg/día (n=786) y placebo (n=737). En este estudio, el perfil de seguridad y tolerabilidad del tratamiento combinado fue normalmente consecuente con los perfiles de los componentes individuales. La incidencia del trastorno de eyaculación en pacientes recibiendo tratamiento combinado fue comparable a la suma de las incidencias de esta reacción adversa para las dos monoterapias. Otros datos a largo plazo En un ensayo controlado con placebo de 7 años de duración en el que se incluyeron varones sanos, de los cuales tenían datos de biopsia prostática por punción disponibles para análisis, se detectó cáncer de próstata en 803 varones (18,4%) que recibían finasterida de 5 mg y varones (24,4%) que recibían placebo. En el grupo de finasterida de 5 mg, 280 varones (6,4%) tenían cáncer de próstata con puntuaciones de Gleason de 7-10 detectados en biopsia por punción frente a 237 varones (5,1%) en el grupo placebo. Análisis adicionales sugieren que el aumento en la prevalencia de cáncer de próstata de alto grado observado en el grupo de finasterida de 5 mg puede explicarse por un sesgo de la detección debido al efecto de finasterida de 5 mg sobre el volumen prostático. Del total de los casos de cáncer de próstata diagnosticados en este estudio, aproximadamente el 98% fueron clasificados como intracapsulares (estadío clínico T1 o T2) en el diagnóstico. Se desconoce la importancia clínica de la puntuación de Gleason de Resultados de las pruebas analíticas Al evaluar las determinaciones analíticas del APE es preciso considerar que los niveles del APE descienden en los pacientes tratados con finasterida (véase el apartado 4.4 Advertencias y precauciones especiales de empleo). 6 de 13
7 4.9. Sobredosis Los pacientes han recibido dosis únicas de hasta 400 mg de finasterida y dosis múltiples de hasta 80 mg/día durante tres meses sin que se observaran efectos adversos. No se recomienda ningún tratamiento específico de la sobredosis de finasterida. 5. PROPIEDADES FARMACOLÓGICAS 5.1. Propiedades farmacodinámicas Grupo farmacoterapéutico: Inhibidores de la testosterona-5-alfa reductasa. Código ATC: G04CB01. Finasterida es un compuesto 4-azasteroideo sintético, inhibidor específico de la 5α-reductasa de tipo II, una enzima intracelular que metaboliza la testosterona para convertirla en un andrógeno más potente, la dihidrotestosterona (DHT). En la hiperplasia benigna de próstata (HBP), el aumento de tamaño de la próstata depende de la conversión de la testosterona en DHT dentro de la próstata. Finasterida es muy eficaz para reducir la DHT circulante e intraprostática. finasterida no posee afinidad por los receptores androgénicos. En el Estudio sobre la eficacia y la seguridad a largo plazo de finasterida (PLESS) se valoró el efecto del tratamiento con finasterida sobre los episodios urológicos relacionados con la HBP (intervención quirúrgica [p. ej., resección transuretral de la próstata y prostatectomía] o retención urinaria aguda que exigiera sondaje durante un período de 4 años en pacientes con síntomas moderados o graves de HBP. En este estudio multicéntrico aleatorizado, doble ciego y controlado con placebo, el tratamiento con finasterida redujo el riesgo de todos los episodios urológicos en un 51% y también se acompañó de una regresión importante y sostenida del volumen de la próstata, y de un aumento sostenido del flujo urinario máximo y una mejoría de los síntomas. La hiperplasia benigna de próstata (HBP) se produce en la mayoría de los varones a partir de los 50 años de edad, y su prevalencia aumenta con la edad. Los estudios epidemiológicos indican que el aumento de tamaño de la próstata triplica el riesgo de padecer retención urinaria aguda o tener que someterse a cirugía prostática. Asimismo, la probabilidad de que aparezcan síntomas urinarios moderados o graves o una disminución del flujo urinario es 3 veces mayor en los varones con próstata agrandada que en los que tienen próstatas más pequeñas. El desarrollo y crecimiento de la próstata y el desarrollo posterior de HBP dependen de un andrógeno potente, la dihidrotestosterona (DHT). La testosterona, secretada por los testículos y las glándulas suprarrenales, es convertida rápidamente en DHT por la 5α-reductasa de tipo II, sobre todo en la próstata, el hígado y la piel, en donde más tarde se une de forma preferente a los núcleos celulares de esos tejidos. Se ha demostrado in vitro e in vivo que finasterida es un inhibidor específico de la 5 -reductasa de tipo II y que no posee afinidad por los receptores de los andrógenos. Finasterida es un inhibidor competitivo de la 5αreductasa de tipo II humana, con la que forma lentamente un complejo enzimático estable con la 5 reductasa de tipo II humana. El recambio de este complejo es sumamente lento (t 1/2 ~ 30 días). Se ha observado que una única dosis de 5 mg de finasterida causa una reducción rápida de la concentración sérica de DHT, observándose un efecto máximo después de 8 horas. Aunque los niveles plasmáticos de finasterida variaron a lo largo de 24 horas, los niveles séricos de DHT permanecieron constantes durante este período, lo que indica que las concentraciones plasmáticas del fármaco no se relacionan directamente con las concentraciones plasmáticas de DHT. 7 de 13
8 Los datos obtenidos en los estudios descritos a continuación, que demuestran una reducción del riesgo de retención urinaria aguda y de cirugía, mejoría de los síntomas relacionados con la HBP, aumento del flujo urinario máximo y disminución del volumen de la próstata, muestran que finasterida invierte la progresión de la HBP en los varones con aumento del tamaño de la próstata. En un principio se evaluó la administración de 5 mg/día de finasterida en pacientes con síntoma de HBP y aumento de tamaño prostático demostrado por tacto rectal en dos estudios de fase III aleatorizados, doble ciego y controlados con placebo de un año de duración, y en sus extensiones en régimen abierto durante 5 años. De los 536 pacientes aleatorizados inicialmente para recibir 5 mg/día de finasterida, 234 completaron los 5 años adicionales de tratamiento y estaban disponibles para el análisis. Los parámetros de eficacia fueron la puntuación de síntomas, el flujo urinario máximo y el volumen de la próstata. Asimismo, se evaluó finasterida en el PLESS, un estudio multicéntrico aleatorizado, doble ciego y controlado con placebo, de 4 años de duración. En este estudio se valoró el efecto del tratamiento con 5 mg/día de finasterida sobre los síntomas de HBP y los episodios urológicos relacionados con la HBP (intervención quirúrgica [p. ej., resección transuretral de próstata y prostatectomía] o retención urinaria aguda que exigiera sondaje). Se distribuyó aleatoriamente en el estudio a pacientes (1.524 a finasterida, al placebo) de edades comprendidas entre 45 y 78 años con síntomas moderados o graves de HBP y con un crecimiento de la próstata demostrado mediante tacto rectal, de los que pacientes fueron evaluables con respecto a la eficacia. Completaron los 4 años del estudio sujetos (1.000 en el grupo de finasterida y 883 en el de placebo). También se evaluaron el flujo urinario máximo y el volumen de la próstata. Efecto sobre la retención urinaria aguda y la necesidad de cirugía En el estudio PLESS de 4 años se requirió cirugía o se produjo retención urinaria aguda que precisó sondaje en el 13,2% de los pacientes que tomaron placebo, en comparación con el 6,6% de los que recibieron 5 mg de finasterida, lo que representa una reducción del 51 % del riesgo de cirugía o retención urinaria aguda a lo largo de 4 años. Con 5 mg de finasterida se redujo el riesgo de cirugía en un 55% (10,1% con placebo frente al 4,6% con finasterida), y el de retención urinaria aguda en un 57% (6,6% con placebo frente al 2,8% con finasterida). La reducción del riesgo era evidente entre los grupos de tratamiento en la primera evaluación (4 meses), y se mantuvo a lo largo de los 4 años del estudio. En la tabla 1 siguiente se muestran la frecuencia de aparición y la reducción del riesgo de los episodios urológicos durante el estudio. Tabla 1 TASAS DE EPISODIOS UROLÓGICOS Y REDUCCIÓN DEL RIESGO CON FINASTERIDA A LO LARGO DE 4 AÑOS Porcentaje de Pacientes Episodios urológicos Placebo (n = 1503) 8 de 13 Finasterida 5 mg (n = 1513) Reducción del riesgo Cirugía o retención urinaria aguda 13,2% 6,6% 51%* Cirugía TURP 10,1% 8,3% 4,6% 4,2% 55%* 49%* Retención urinaria aguda 6,6% 2,8% 57%* Cirugía relacionada con la HBP * p<0,001 Efecto sobre la puntuación de síntomas En los dos estudios de fase III de un año de duración, las puntuaciones medias totales de síntomas descendieron ya en la segunda semana en relación con la situación basal. En estos estudios se observó una mejoría importante de los síntomas a los 7 y a los 10 meses en comparación con placebo. Aunque en algunos pacientes se observó una mejoría precoz de los síntomas urinarios, generalmente era necesario un ensayo terapéutico de al menos 6 meses para valorar si se había logrado una respuesta beneficiosa en el alivio de los síntomas. La mejoría de los síntomas de HBP se mantuvo durante el primer año y a lo largo de los 5 años adicionales de los estudios de extensión.
9 En el estudio PLESS de 4 años de duración los pacientes tenían síntomas moderados o graves en la situación basal (media aproximada de 15 puntos en una escala de 0 a 34 puntos). En los pacientes que siguieron en tratamiento durante los 4 años del estudio finasterida mejoró la puntuación de los síntomas en 3,3 puntos, frente a 1,3 puntos en el grupo de placebo (p <0,001). En los pacientes tratados con finasterida se demostró una mejoría de la puntuación de los síntomas al año, que se mantenía a los 4 años. Las puntuaciones de los síntomas mejoraron en los pacientes tratados con placebo en el primer año, pero empeoraron posteriormente. Los pacientes con síntomas moderados o graves en la situación basal solían experimentar la mayor mejoría de la puntuación de los síntomas. Efecto sobre el flujo urinario máximo En los dos estudios de fase III de un año de duración, el flujo urinario máximo aumentó notablemente a las 2 semanas en comparación con el basal. En estos estudios se observó un aumento importante del flujo urinario máximo a los 4 y a los 7 meses en comparación con placebo. Este efecto se mantuvo durante el primer año y a lo largo de los 5 años adicionales de los estudios de extensión. En el estudio PLESS de 4 años de duración se produjo una clara separación entre los grupos de tratamiento con respecto al flujo urinario máximo en favor de finasterida a los 4 meses, y se mantuvo durante la totalidad del estudio. El flujo urinario máximo medio en la situación basal fue de 11 ml/seg., aproximadamente, en los dos grupos de tratamiento. En los pacientes que permanecieron en tratamiento durante todo el estudio y que tenían datos del flujo urinario evaluables, finasterida aumentó el flujo urinario máximo en 1,9 ml/seg., frente a 0,2 ml/seg. en el grupo de placebo. Efecto sobre el volumen de la próstata En los dos estudios de fase III de un año de duración, el volumen medio de la próstata en la situación basal osciló entre 40 y 50 cc. En ambos estudios se produjo una reducción importante del volumen prostático en comparación con la situación basal y con placebo en la primera evaluación (3 meses). Este efecto se mantuvo durante el primer año y a lo largo de los 5 años adicionales de los estudios de extensión. En el estudio PLESS de 4 años de duración se valoró anualmente el volumen de la próstata en un subgrupo de pacientes (n = 284) mediante resonancia magnética (RM). En los pacientes tratados con finasterida se redujo el volumen de la próstata en comparación con el basal y con placebo a lo largo de los 4 años del estudio. Dentro del subgrupo de pacientes sometidos a RM que permanecieron en tratamiento durante la totalidad del estudio, finasterida disminuyó en un 17,9% el volumen de la próstata (desde 55,9 cc en la situación basal a 45,8 cc a los 4 años), en comparación con el aumento del 14,1% (desde 51,3 a 58,5 cc) observado en el grupo de placebo (p <0,001). El volumen de la próstata como factor predictivo de la respuesta terapéutica En un metaanálisis en el que se combinaron datos de 1 año procedentes de siete estudios al doble ciego controlados con placebo de diseño similar, en los que se incluyeron pacientes con HBP sintomática, se demostró que en los pacientes tratados con Finasterida la magnitud de la respuesta de los síntomas y el grado de mejoría del flujo urinario máximo fueron mayores en los pacientes con aumento del tamaño prostático (alrededor de 40 cc o mayor) en la situación basal. Tratamiento médico de los síntomas prostáticos (MTOPS) El estudio MTOPS (Medical Therapy Of Prostatic Symptoms) fue un estudio de 4 a 6 años de duración, en hombres con HBP sintomática que fueron aleatorizados para recibir finasterida 5 mg/día, doxazosina 4 u 8 mg/día***, la combinación de finasterida 5 mg/día y doxazosina 4 u 8 mg/día*** o placebo. El criterio de valoración principal fue el tiempo hasta la evolución clínica de la HBP, definida como un aumento confirmado de > 4 puntos desde el valor inicial en la puntuación de síntomas, retención urinaria aguda, insuficiencia renal relacionada con la HBP, infecciones urinarias recurrentes o urosepsis o incontinencia. En comparación con placebo, el tratamiento con finasterida, doxazosina o el tratamiento combinado produjeron una reducción significativa en el riesgo de la evolución clínica de la HBP del 34, 39 *** Dosis ajustada de 1 mg a 4 u 8 mg en un periodo de 3 semanas. 9 de 13
10 y 66% respectivamente. La mayoría de los acontecimientos (274 de 351) que constituyeron la evolución de la HBP fueron aumentos confirmados de > 4 puntos en la puntuación de síntomas; se redujo el riesgo de la evolución de la puntuación de los síntomas en un 30, 45 y 64% en los grupos de finasterida, doxazosina y la combinación, respectivamente, en comparación con placebo. La retención urinaria aguda puede explicar 41 de los 351 acontecimientos de la evolución de HBP; el riesgo de desarrollar retención urinaria aguda se redujo en un 68, 35 y 81% en los grupos de finasterida, doxazosina y la combinación, respectivamente, en comparación con placebo. Sólo los grupos de finasterida y el de tratamiento combinado fueron significativamente diferentes del placebo. Otros estudios clínicos Se realizó un estudio doble ciego y controlado con placebo de 24 semanas de duración en el que se incluyeron 36 pacientes con síntomas moderados o graves de obstrucción urinaria y un flujo máximo inferior a 15 ml/seg. en el que se valoraron los efectos urodinámicos de finasterida en el tratamiento de la obstrucción vesical por HBP mediante técnicas invasivas. En los pacientes tratados con 5 mg de finasterida se demostró un alivio de la obstrucción en comparación con placebo, puesto de manifiesto por una mejoría importante de la presión del detrusor y un aumento del flujo medio. Se evaluó mediante RM el efecto de finasterida sobre el volumen de las zonas periféricas y periuretral de la próstata en un estudio doble ciego y controlado con placebo de un año de duración en el que se incluyeron 20 varones con HBP. Los pacientes tratados con finasterida, pero no los tratados con el placebo, experimentaron una disminución importante del tamaño total de la glándula prostática [11,5 ± 3,2 cc (EE)], que se debió fundamentalmente a una reducción [6,2 ± 3 cc] del tamaño de la zona periuretral. Dado que ésta es responsable de la obstrucción del flujo, su reducción puede explicar la respuesta clínica beneficiosa observada en estos pacientes. Otros datos a largo plazo En el estudio controlado con placebo de 7 años de duración en el que se incluyeron varones sanos, de los cuales tenían datos disponibles para análisis de biopsia prostática por punción, se detectó cáncer de próstata en 803 (18,4%) varones que recibían finasterida y (24,4%) varones que recibían placebo. En el grupo de finasterida, 280 (6,4%) varones tenían cáncer de próstata con puntuaciones de Gleason de 7-10 detectados en la biopsia por punción frente a 237 (5,1%) varones en el grupo placebo. Del total de los casos de cáncer de próstata diagnosticados en este estudio, aproximadamente el 98% fueron clasificados como intracapsulares (fase T1 o T2). Se desconoce la relación entre el uso a largo plazo de finasterida y los tumores con puntuación de Gleason de Propiedades farmacocinéticas Después de la administración de una dosis oral de 14C-Finasterida, el 39% de la dosis total fue excretada con la orina en forma de metabolitos (prácticamente no existía medicamento intacto en la orina), y el 57% de la dosis total fue excretada con las heces. En este estudio se identificaron dos metabolitos de finasterida que poseen sólo una pequeña fracción de su actividad inhibidora de la 5 -reductasa. En comparación con una dosis intravenosa de referencia, la biodisponibilidad de finasterida administrada por vía oral es de 80% aproximadamente, y no es afectada por la presencia de alimentos. La finasterida alcanza concentraciones plasmáticas máximas aproximadamente dos horas después de la administración, y su absorción es completa en seis a ocho horas. Tiene una semivida de eliminación plasmática de seis horas, y su unión a las proteínas plasmáticas es de 93% aproximadamente. El aclaramiento plasmático de finasterida es de 165 ml/min, y su volumen de distribución es de 76 litros. Un estudio utilizando dosis múltiples demostró una lenta acumulación de pequeñas cantidades de finasterida. Después de administrar dosis de 5 mg diarios, las concentraciones plasmáticas mínimas de finasterida en estado de equilibrio fueron 8 a 10 ng/ml y se mantuvieron estables a lo largo del tiempo. 10 de 13
11 No hay datos disponibles en pacientes con insuficiencia hepática. Finasterida es extensivamente metabolizada por el hígado, principalmente por el citocromo P450 3A4. El índice de eliminación de finasterida está algo disminuido en los hombres de edad avanzada. A medida que aumenta la edad, su semivida se prolonga de aproximadamente seis horas en hombres de 18 a 60 años a ocho horas en los mayores de 70 años. Esta diferencia no tiene ninguna importancia clínica y, por lo tanto, no es necesario reducir la dosificación. En pacientes con insuficiencia renal crónica y aclaramiento de creatinina de 9 a 55 ml/min, la eliminación de una dosis única de 14 C-Finasterida no fue diferente a la observada en voluntarios sanos, y tampoco varió su unión a las proteínas plasmáticas. En los pacientes con disfunción renal, una porción de los metabolitos que normalmente se excretan por vía renal fue excretada con las heces. Parece ser, por lo tanto, que la excreción de metabolitos por vía fecal aumenta en proporción con la disminución de su excreción urinaria. No es necesario hacer ningún ajuste de la dosificación en pacientes con disfunción renal que no estén sometidos a diálisis. Se ha hallado finasterida en el líquido cefalorraquídeo (LCR) de pacientes tratados con el mismo durante siete a diez días, pero el medicamento no parece concentrarse preferentemente con el LCR. También se ha recuperado finasterida del semen de sujetos que estaban recibiendo 5 mg diarios de finasterida. La cantidad de finasterida en el semen fue 50 a 100 veces menor que la dosis de finasterida (5 microgramos) y no tuvo ningún efecto sobre las concentraciones circulantes de DHT en hombres adultos Datos preclínicos sobre seguridad Los resultados de los estudios de toxicidad, genotoxicidad y carcinogenicidad no mostraron riesgos adicionales particular para los humanos. Estudios toxicológicos de reproducción en ratas macho mostraron disminución del peso vesicular seminal y prostático, disminución de la secreción de las glándulas genitales accesorias y disminución del índice de fertilidad (causado por el efecto farmacológico de la finasterida). Se desconoce la relevancia clínica de estos hallazgos. Al igual que con otros inhibidores de la 5-α-reductasa, se ha observado feminización de los fetos machos nacidos de ratas a las que se administró finasterida durante el periodo de gestación. La administración intravenosa de finasterida a monas Rhesus preñadas de dosis >800 ng/día durante la totalidad del periodo de desarrollo embrionario y fetal, no originó ninguna anomalía en los fetos machos. Esta dosis es al menos 60 a 120 veces mayor que la exposición a finasterida más alta estimada en mujeres embarazadas a partir del semen de varones tratados con 5 mg/día. Para confirmar la relevancia del modelo Rhesus aplicado al desarrollo fetal de los seres humanos, se administró una dosis oral de finasterida de 2 mg/kg/día [la exposición (AUC) de los monos fue ligeramente mayor (3x) a la de varones tratados con 5 mg de finasterida, o aproximadamente 1-2 millones de veces la cantidad estimada de finasterida en el semen] a monas preñadas, lo que originó anomalías en los genitales externos de los fetos machos. No se observó ninguna otra anomalía en los fetos machos ni anomalías relacionadas con finasterida en los fetos hembras con ninguna dosis. Carcinogénesis y Mutagénesis No se observó ningún indicio de efecto tumorígeno en un estudio en ratas que recibieron hasta 320 mg/kg/día de finasterida durante 24 meses (3.200 veces más que la dosis recomendada en seres humanos). En un estudio de carcinogenicidad de 19 meses en ratones se observó un aumento estadísticamente significativo (p 0,05) en la frecuencia de adenomas testiculares de las células de Leydig con una dosificación de 250 mg/kg/día (2.500 veces mayor que la dosis recomendada en seres humanos); no se observaron adenomas en los ratones que recibieron 2,5 ó 25 mg/kg/día (25 y 250 veces más que la dosis recomendada en seres humanos, respectivamente). No se observó ningún indicio de mutagenicidad en ensayos de mutagénesis bacteriana in vitro, de mutagénesis en células de mamífero, ni de elución alcalina in vitro. En un ensayo de aberración 11 de 13
12 cromosómica in vitro, cuando se trataron células de ovario de hámster chino con concentraciones altas ( micromol) de finasterida hubo un ligero aumento de las aberraciones cromosómicas. Esas concentraciones son veces mayores que las concentraciones plasmáticas máximas obtenidas en el hombre con una dosis total de 5 mg. Además, las concentraciones empleadas en los estudios in vitro ( micromol) no se pueden alcanzar en un sistema biológico. En un ensayo de aberración cromosómica in vivo en ratones, no se observó ningún aumento de las aberraciones cromosómicas relacionado con el tratamiento, administrando finasterida a la dosis máxima tolerada (250 mg/kg/día, veces mayor que la dosis recomendada en seres humanos). 6. DATOS FARMACÉUTICOS 6.1. Lista de excipientes Excipientes del núcleo: Lactosa monohidrato. Carboximetilalmidón sódico. Almidón de maíz sin gluten. Sílice coloidal anhidra. Docusato de sodio benzoato. Estearato de magnesio. Excipientes de recubrimiento: Opadry azul 04F50702 [Hipromelosa, Dióxido de titanio (E-171), Macrogol 6000, Indigotina (E-132)] Incompatibilidades No procede Periodo de validez 3años Precauciones especiales de conservación No se precisan condiciones especiales de conservación Naturaleza y contenido del envase Finasterida se presenta en blíster de PVC/PVDC/Aluminio con 28 y 500 comprimidos Precauciones especiales de eliminación y otras manipulaciones Ninguna especial La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con las normativas locales. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Apotex Europe B.V. Darwinweg CR Leiden Países Bajos 12 de 13
13 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN Septiembre de FECHA DE LA REVISIÓN DEL TEXTO Julio de 13
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Finasterida Alter 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Finasterida Alter 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA. finasterida cinfa 5 mg comprimidos recubiertos con película EFG
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO finasterida cinfa 5 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida Para
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO finasterida cinfa 5 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida Para
FICHA TÉCNICA. FINASTERIDA BENEL 5 mg comprimidos recubiertos con película EFG
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO FINASTERIDA BENEL 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida Para
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO FINASTERIDA BENEL 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida Para
FICHA TÉCNICA. Cada comprimido recubierto con película contiene 5 mg de finasterida.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida TecniGen 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 5 mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida TecniGen 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 5 mg
Finastar. FINASTAR (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Esta especialidad se presenta como:
 Finastar FINASTAR (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Esta especialidad se presenta como: FINASTAR 5 mg cuya composición es: - Principio activo: Finasterida 5 mg - Excipientes (ver
Finastar FINASTAR (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Esta especialidad se presenta como: FINASTAR 5 mg cuya composición es: - Principio activo: Finasterida 5 mg - Excipientes (ver
PROSCAR (finasterida) PROSCAR 5 mg cuya composición es: - Principio activo: Finasterida... 5 mg - Excipientes (ver 6.1), c.s.p...
 FICHA TÉCNICA IPC - 0199 Tracer No. PSC-E-20030237 01/03 PROSCAR (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Esta especialidad se presenta como: PROSCAR 5 mg cuya composición es: - Principio
FICHA TÉCNICA IPC - 0199 Tracer No. PSC-E-20030237 01/03 PROSCAR (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Esta especialidad se presenta como: PROSCAR 5 mg cuya composición es: - Principio
La posología recomendada es un comprimido diario de 5 mg, con o sin alimentos.
 1. NOMBRE DEL MEDICAMENTO PROSCAR 5 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida. Excipientes con efecto conocido: 106,40
1. NOMBRE DEL MEDICAMENTO PROSCAR 5 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida. Excipientes con efecto conocido: 106,40
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Finasterida RANBAXY 5mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida RANBAXY 5mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida. Excipientes:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida RANBAXY 5mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida. Excipientes:
EUCOPROST (finasterida)
 FICHA TÉCNICA para Médicos IPC 0997a Tracer No. PSC-E-14800 07/99 EUCOPROST (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Esta especialidad se presenta como: EUCOPROST 5 mg cuya composición es:
FICHA TÉCNICA para Médicos IPC 0997a Tracer No. PSC-E-14800 07/99 EUCOPROST (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Esta especialidad se presenta como: EUCOPROST 5 mg cuya composición es:
Hipersensibilidad a cualquiera de los componentes de este producto.
 PROSCAR 5 mg TABLETAS RECUBIERTAS (Finasteride) PROSCAR (Finasteride) un compuesto sintético 4 azasteroide, es un inhibidor específico de la 5α - reductasa Tipo II, una enzima intracelular que metaboliza
PROSCAR 5 mg TABLETAS RECUBIERTAS (Finasteride) PROSCAR (Finasteride) un compuesto sintético 4 azasteroide, es un inhibidor específico de la 5α - reductasa Tipo II, una enzima intracelular que metaboliza
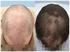
Finasterida está indicada para el tratamiento de las primeras fases de la alopecia androgenética en varones.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida Actavis 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida Actavis 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg
INFORMACION PARA PRESCRIBIR AMPLIA
 INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre Comercial: TEALEP 2. Nombre Genérico: FINASTERIDA 3. Forma Farmacéutica y Formulación: Comprimidos. Cada comprimido contiene: Finasterida... 5 mg Excipiente
INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre Comercial: TEALEP 2. Nombre Genérico: FINASTERIDA 3. Forma Farmacéutica y Formulación: Comprimidos. Cada comprimido contiene: Finasterida... 5 mg Excipiente
No existen pruebas de que la elevación de la dosis aumente la eficacia. No es necesario ajustar la posología en pacientes con insuficiencia renal.
 Propecia RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA PROPECIA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de finasterida. 3. FORMA FARMACÉUTICA
Propecia RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA PROPECIA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de finasterida. 3. FORMA FARMACÉUTICA
FICHA TÉCNICA. Comprimidos redondos, biconvexos, de color marrón rojizo, de 7 mm de diámetro y con la marca "F1" en una de las caras.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ALOCARE 1 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Finasterida Cada comprimido recubierto con película
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ALOCARE 1 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Finasterida Cada comprimido recubierto con película
Finasterida Biorga 1 mg comprimidos recubiertos con película EFG. Cada comprimido recubierto con película contiene 1 mg de finasterida.
 1. NOMBRE DEL MEDICAMENTO Finasterida Biorga 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg de finasterida.
1. NOMBRE DEL MEDICAMENTO Finasterida Biorga 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg de finasterida.
Finasterida está indicada para el tratamiento de las primeras fases de la alopecia androgenética en varones.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida Actavis 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida Actavis 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg
FICHAS TÉCNICAS. Finasterida NORMON 1 mg comprimidos recubiertos con película EFG Finasterida NORMON 5 mg comprimidos recubiertos con película EFG
 FICHAS TÉCNICAS Finasterida NORMON 1 mg comprimidos recubiertos con película EFG Finasterida NORMON 5 mg comprimidos recubiertos con película EFG RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL
FICHAS TÉCNICAS Finasterida NORMON 1 mg comprimidos recubiertos con película EFG Finasterida NORMON 5 mg comprimidos recubiertos con película EFG RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL
FICHA TÉCNICA. No hay evidencia de que un aumento en la dosis se traduzca en un aumento en la eficacia.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Predser 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto contiene 1 mg de finasterida. Excipiente(s)
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Predser 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto contiene 1 mg de finasterida. Excipiente(s)
FICHA TÉCNICA. Excipientes con efecto conocido 1,38 g de sacarosa y 1,10 g glucosa. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor menta 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor menta 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
FICHA TÉCNICA. Comprimidos recubiertos blancos, redondos y marcados con F y 5 en una de las caras.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida ratiopharm 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 5
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida ratiopharm 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 5
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
FICHA TÉCNICA. LORATADINA KERN PHARMA está indicado para el tratamiento sintomático de rinitis alérgica y urticaria idiopática crónica.
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO LORATADINA KERN PHARMA 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Lista de excipientes,
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO LORATADINA KERN PHARMA 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Lista de excipientes,
FICHA TÉCNICA 4. DATOS CLÍNICOS
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO EBASTINA ALPROFARMA 10 mg Comprimidos recubiertos con película EFG. EBASTINA ALPROFARMA 20 mg Comprimidos recubiertos con película EFG. 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO EBASTINA ALPROFARMA 10 mg Comprimidos recubiertos con película EFG. EBASTINA ALPROFARMA 20 mg Comprimidos recubiertos con película EFG. 2. COMPOSICIÓN CUALITATIVA
FICHA TECNICA. Acamprosato 333 mg Para consultar la lista completa de excipientes, ver sección 6.1
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ZULEX 333 mg, Comprimidos recubiertos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Acamprosato 333 mg Para consultar la lista completa de excipientes, ver sección 6.1
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ZULEX 333 mg, Comprimidos recubiertos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Acamprosato 333 mg Para consultar la lista completa de excipientes, ver sección 6.1
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
Prospecto: Información para el usuario Finasterida Kern Pharma 5 mg comprimidos recubiertos con película EFG
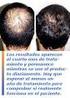 Prospecto: Información para el usuario Finasterida Kern Pharma 5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: Información para el usuario Finasterida Kern Pharma 5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Ultra Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Ultra Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO. FAMVIR comprimidos 125 mg FAMVIR comprimidos 250 mg FAMVIR comprimidos 750 mg
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO FAMVIR comprimidos 125 mg FAMVIR comprimidos 250 mg FAMVIR comprimidos 750 mg 2. COMPOSICION CUALITATIVA Y CUANTITATIVA FAMVIR comprimidos 125 mg: Principio activo
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO FAMVIR comprimidos 125 mg FAMVIR comprimidos 250 mg FAMVIR comprimidos 750 mg 2. COMPOSICION CUALITATIVA Y CUANTITATIVA FAMVIR comprimidos 125 mg: Principio activo
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. LORATADINA RANBAXY 10 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO LORATADINA RANBAXY 10 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO LORATADINA RANBAXY 10 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Excipientes con efecto conocido:
FICHA TÉCNICA. Adultos y niños mayores de 12 años: máximo 10 mg al día en una única toma
 1. NOMBRE DEL MEDICAMENTO REACTINE 10 mg Comprimidos FICHA TÉCNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de cetirizina (DOE) dihidrocloruro Lista de excipientes, en 6.1
1. NOMBRE DEL MEDICAMENTO REACTINE 10 mg Comprimidos FICHA TÉCNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de cetirizina (DOE) dihidrocloruro Lista de excipientes, en 6.1
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ambroxol Apotex 3 mg/ ml jarabe EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ambroxol Apotex 3 mg/ ml jarabe EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contienen 3 mg de ambroxol hidrocloruro. Excipiente(s) con efecto
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ambroxol Apotex 3 mg/ ml jarabe EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contienen 3 mg de ambroxol hidrocloruro. Excipiente(s) con efecto
FICHA TÉCNICA. Cada comprimido recubierto con película contiene 1 mg de finasterida como componente activo.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida Actavis 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida Actavis 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA. La duración estimada del tratamiento será de dos semanas.
 FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea
 FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO bucomax pastillas para chupar sabor menta bucomax pastillas para chupar sabor fresa bucomax pastillas para chupar sabor miel y limón 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
1. NOMBRE DEL MEDICAMENTO bucomax pastillas para chupar sabor menta bucomax pastillas para chupar sabor fresa bucomax pastillas para chupar sabor miel y limón 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
I. Denominación distintiva PROPESHIA. II. Denominación genérica. Finasterida. III. Forma Farmacéutica y Formulación PROPESHIA.
 I. Denominación distintiva PROPESHIA II. Denominación genérica Finasterida III. Forma Farmacéutica y Formulación PROPESHIA Tabletas Cada tableta de PROPESHIA contiene finasterida... 1 mg Excipiente c.b.p....
I. Denominación distintiva PROPESHIA II. Denominación genérica Finasterida III. Forma Farmacéutica y Formulación PROPESHIA Tabletas Cada tableta de PROPESHIA contiene finasterida... 1 mg Excipiente c.b.p....
Prospecto: información para el usuario
 Prospecto: información para el usuario Finasterida Apotex 1 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porque contiene información
Prospecto: información para el usuario Finasterida Apotex 1 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porque contiene información
FICHA TÉCNICA. Supositorios incoloros semitransparentes envasados en blíster de aluminio-polietileno.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SUPOSITORIOS DE GLICERINA MICRALAX ADULTOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Supositorios incoloros semitransparentes envasados en
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SUPOSITORIOS DE GLICERINA MICRALAX ADULTOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Supositorios incoloros semitransparentes envasados en
No hay evidencia de que un aumento de la dosis resulte en un aumento de la eficacia.
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lambdaxel 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto contiene
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lambdaxel 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto contiene
ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg. COMPOSICIÓN Cada comprimido recubierto contiene: Excipientes: Según lo aprobado en Registro
 ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg COMPOSICIÓN Cada comprimido recubierto contiene: Anastrozol 1 mg Excipientes: Según lo aprobado en Registro CLASIFICACION TERAPEUTICA Antineoplásico INDICACIONES
ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg COMPOSICIÓN Cada comprimido recubierto contiene: Anastrozol 1 mg Excipientes: Según lo aprobado en Registro CLASIFICACION TERAPEUTICA Antineoplásico INDICACIONES
FICHA TÉCNICA. Sorbitol líquido (no cristalizante); 1 ml de jarabe contiene 495,6 mg de sorbitol (E 420).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
Prospecto: información para el usuario. Finasterida pensa 5 mg comprimidos recubiertos con película EFG
 Prospecto: información para el usuario Finasterida pensa 5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario Finasterida pensa 5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Posología Adultos y adolescentes mayores de 12 años: administrar 30 ml (195 mg) cada 4 horas. La dosis máxima mg / 24 h.
 1. NOMBRE DEL MEDICAMENTO Frispec 6,5 mg/ ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Guaifenesina 6,5 mg Excipientes con efecto conocido: Parahidroxibenzoato de metilo
1. NOMBRE DEL MEDICAMENTO Frispec 6,5 mg/ ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Guaifenesina 6,5 mg Excipientes con efecto conocido: Parahidroxibenzoato de metilo
PROPUESTA DE FICHA TÉCNICA
 PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
Prospecto: información para el usuario
 Prospecto: información para el usuario FINASTERIDA QUALIGEN 5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario FINASTERIDA QUALIGEN 5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario. Lambdaxel 1 mg comprimidos recubiertos con película EFG Finasterida
 Prospecto: información para el usuario Lambdaxel 1 mg comprimidos recubiertos con película EFG Finasterida Lea todo el prospecto detenidamente antes de tomar el medicamento. Conserve este prospecto ya
Prospecto: información para el usuario Lambdaxel 1 mg comprimidos recubiertos con película EFG Finasterida Lea todo el prospecto detenidamente antes de tomar el medicamento. Conserve este prospecto ya
FICHA TÉCNICA. FAMOTIDINA STADA 20 mg comprimidos recubiertos con película EFG Cada comprimido recubierto contiene:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FAMOTIDINA STADA 20 mg comprimidos recubiertos con película EFG FAMOTIDINA STADA 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FAMOTIDINA STADA 20 mg comprimidos recubiertos con película EFG FAMOTIDINA STADA 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. Cetirizina ANGENERICO 10 mg/ml gotas orales en solución EFG
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO Cetirizina ANGENERICO 10 mg/ml gotas orales en solución EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cetirizina ANGENERICO gotas orales en solución: cada
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO Cetirizina ANGENERICO 10 mg/ml gotas orales en solución EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cetirizina ANGENERICO gotas orales en solución: cada
FICHA TÉCNICA. Comprimidos ovalados, blancos, con una ranura en un lado y planos en el otro lado, marcados L y 10 a cada lado de la ranura.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Loratadina Teva 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Excipiente(s) con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Loratadina Teva 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Excipiente(s) con efecto conocido:
500 mg: Comprimido oblongo, biconvexo, blanco a amarillento, ranurado por ambos lados.
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO KEFAVET 250 mg comprimidos recubiertos con película KEFAVET
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO KEFAVET 250 mg comprimidos recubiertos con película KEFAVET
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Finasterida KERN PHARMA 1 mg comprimidos recubiertos con película EFG
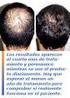 PROSPECTO: INFORMACIÓN PARA EL USUARIO Finasterida KERN PHARMA 1 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este
PROSPECTO: INFORMACIÓN PARA EL USUARIO Finasterida KERN PHARMA 1 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este
Prospecto: información para el usuario. PROSCAR 5 mg comprimidos recubiertos con película. finasterida
 Prospecto: información para el usuario PROSCAR 5 mg comprimidos recubiertos con película finasterida Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario PROSCAR 5 mg comprimidos recubiertos con película finasterida Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO INCURIN 1 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancia activa: estriol
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO INCURIN 1 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancia activa: estriol
FICHA TECNICA. Comprimido recubierto con película redondo, de color rosa anaranjado, grabado con el logo 'F1' en una de las caras.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO CELGANOL 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg de finasterida.
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO CELGANOL 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg de finasterida.
FICHA TÉCNICA. Loratadina STADA 10 mg comprimidos recubiertos con película EFG Loratadina STADA 1mg/ml jarabe EFG
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Loratadina STADA 10 mg comprimidos recubiertos con película EFG Loratadina STADA 1mg/ml jarabe EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Loratadina STADA 10 mg comprimidos recubiertos con película EFG Loratadina STADA 1mg/ml jarabe EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TÉCNICA. Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
Finasterida NORMON 1 mg comprimidos recubiertos con película EFG. Un comprimido recubierto contiene 1 mg de finasterida.
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Finasterida NORMON 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Finasterida NORMON 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto
SKELID 200 mg comprimidos
 SKELID 200 mg comprimidos 1. DENOMINACIÓN DEL MEDICAMENTO SKELID 200 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Acido tiludrónico (D.C.I.) sal disódica cantidad correspondiente a ácido
SKELID 200 mg comprimidos 1. DENOMINACIÓN DEL MEDICAMENTO SKELID 200 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Acido tiludrónico (D.C.I.) sal disódica cantidad correspondiente a ácido
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
Prospecto: Información para el usuario. Finasteridaratiopharm 5 mg comprimidos recubiertos con película EFG
 Prospecto: Información para el usuario Finasteridaratiopharm 5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información
Prospecto: Información para el usuario Finasteridaratiopharm 5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información
FICHA TÉCNICA. Comprimidos recubiertos con película, de color anaranjado, oblongos y ranurados por una cara.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Flebikern 500 mg comprimidos recubiertos con película. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene: Fracción flavonoica
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Flebikern 500 mg comprimidos recubiertos con película. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene: Fracción flavonoica
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Para la lista completa de excipientes, véase la sección 6.1.
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL COMPRIMIDOS 50 mg. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Sustancia activa Carprofeno
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL COMPRIMIDOS 50 mg. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Sustancia activa Carprofeno
FICHA TÉCNICA. Azelastina hidrocloruro al 0,05% (0,5 mg/ml). Cada gota contiene 0,015 mg de azelastina hidrocloruro
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA. Cada comprimido recubierto con película contiene 1 mg de finasterida.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ALOCARE 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg de finasterida.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ALOCARE 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg de finasterida.
Finasterida STADA 1 mg comprimidos recubiertos con película EFG
 1. NOMBRE DEL MEDICAMENTO Finasterida STADA 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: finasterida. Cada comprimido recubierto con película
1. NOMBRE DEL MEDICAMENTO Finasterida STADA 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: finasterida. Cada comprimido recubierto con película
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA EUSPC-PPC-T-102003/Final for Renewal N01 Tracer No. PPC-E-20033409 10/03 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DE LA ESPECIALIDAD
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA EUSPC-PPC-T-102003/Final for Renewal N01 Tracer No. PPC-E-20033409 10/03 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DE LA ESPECIALIDAD
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TÉCNICA. Alivio a corto plazo (durante dos-tres meses) del edema y síntomas relacionados con la insuficiencia venosa crónica.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA troxerutina cinfa 1000 mg granulado para solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Para consultar la lista
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA troxerutina cinfa 1000 mg granulado para solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Para consultar la lista
Adultos y niños mayores de 12 años 10 mg una vez al día (una cápsula). Las cápsulas se pueden tomar con independencia de las comidas.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Loratadina Farmalider 10 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula blanda de Loratadina Farmalider 10 mg contiene: Loratadina...10
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Loratadina Farmalider 10 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula blanda de Loratadina Farmalider 10 mg contiene: Loratadina...10
PROYECTO DE PROSPECTO PROSCAR FINASTERIDE 5 mg Comprimidos Recubiertos
 INDUSTRIA NORTEAMERICANA PROYECTO DE PROSPECTO PROSCAR FINASTERIDE 5 mg Comprimidos Recubiertos VENTA BAJO RECETA FÓRMULA: Cada comprimido recubierto contiene: Finasteride... 5,0 mg Lactosa... 106,4 mg
INDUSTRIA NORTEAMERICANA PROYECTO DE PROSPECTO PROSCAR FINASTERIDE 5 mg Comprimidos Recubiertos VENTA BAJO RECETA FÓRMULA: Cada comprimido recubierto contiene: Finasteride... 5,0 mg Lactosa... 106,4 mg
FICHA TÉCNICA. La posología media recomendada para la acetilcisteína en estos casos es la siguiente:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Acetilcisteína Pensa 200 mg polvo para solución oral EFG Acetilcisteína Pensa 600 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Acetilcisteína Pensa 200 mg polvo para solución oral EFG Acetilcisteína Pensa 600 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FORMA FARMACÉUTICA Y FORMULACIÓN:
 Profidox * Tabletas (Finasteride/alfuzosina) FORMA FARMACÉUTICA Y FORMULACIÓN: Cada TABLETA contiene: Finasteride 5 mg Clorhidrato de alfuzosina 5 mg Excipiente, c.b.p. 1 tableta. INDICACIONES TERAPÉUTICAS:
Profidox * Tabletas (Finasteride/alfuzosina) FORMA FARMACÉUTICA Y FORMULACIÓN: Cada TABLETA contiene: Finasteride 5 mg Clorhidrato de alfuzosina 5 mg Excipiente, c.b.p. 1 tableta. INDICACIONES TERAPÉUTICAS:
FICHA TÉCNICA. Población pediátrica Tebarat no se debe utilizar en niños menores de 4 años debido a la ausencia de datos de seguridad y eficacia.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tebarat 0,5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 0,5 mg de hidrocloruro de azelastina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tebarat 0,5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 0,5 mg de hidrocloruro de azelastina
FICHA TECNICA. Cada unidad de administración contiene: Comprimido Sobre Jarabe
 FICHA TECNICA 1. DENOMINACION DEL MEDICAMENTO Motosol comprimidos Motosol jarabe Motosol granulado sobres 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada unidad de administración contiene: Comprimido Sobre
FICHA TECNICA 1. DENOMINACION DEL MEDICAMENTO Motosol comprimidos Motosol jarabe Motosol granulado sobres 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada unidad de administración contiene: Comprimido Sobre
FICHA TÉCNICA. Finasterida SwanPond Investments 1 mg comprimidos recubiertos con película EFG
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida SwanPond Investments 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de finasterida.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida SwanPond Investments 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de finasterida.
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Auxina E-50, Auxina E-200, Auxina E-400 Vitamina E (Acetato de dl-? -tocoferol)
 1. NOMBRE DEL MEDICAMENTO Auxina E-50, Auxina E-200, Auxina E-400 Vitamina E (Acetato de dl-? -tocoferol) FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por cápsula: Principio Activo:?? Auxina
1. NOMBRE DEL MEDICAMENTO Auxina E-50, Auxina E-200, Auxina E-400 Vitamina E (Acetato de dl-? -tocoferol) FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por cápsula: Principio Activo:?? Auxina
Prospecto: Información para el usuario Finasterida Bluefish 1 mg comprimidos recubiertos con película EFG
 Prospecto: Información para el usuario Finasterida Bluefish 1 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porque contiene información
Prospecto: Información para el usuario Finasterida Bluefish 1 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porque contiene información
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DAIVONEX Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DAIVONEX Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Calcipotriol 50 microgramos/g (como hidrato). Para la lista completa de excipientes, ver sección 6.1. 3.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DAIVONEX Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Calcipotriol 50 microgramos/g (como hidrato). Para la lista completa de excipientes, ver sección 6.1. 3.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Cellufresh 5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Cellufresh 5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
1. NOMBRE DE LA ESPECIALIDAD. PRODERMA 50 mg PRODERMA 100 mg PRODERMA 200 mg 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DE LA ESPECIALIDAD PRODERMA 50 mg PRODERMA 100 mg PRODERMA 200 mg 2. COMPOSICION CUALITATIVA Y CUANTITATIVA PRODERMA 50 mg Doxiciclina (hiclato) 50 mg PRODERMA 100 mg Doxiciclina (hiclato) 100
1. NOMBRE DE LA ESPECIALIDAD PRODERMA 50 mg PRODERMA 100 mg PRODERMA 200 mg 2. COMPOSICION CUALITATIVA Y CUANTITATIVA PRODERMA 50 mg Doxiciclina (hiclato) 50 mg PRODERMA 100 mg Doxiciclina (hiclato) 100
FICHA TECNICA. ANASTROZOL NORMON 1 mg comprimidos recubiertos con película EFG
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ANASTROZOL NORMON 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de anastrozol. Excipientes:
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ANASTROZOL NORMON 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de anastrozol. Excipientes:
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. COPINAL 300 mg cápsulas COPINAL 300 mg suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO COPINAL 300 mg cápsulas COPINAL 300 mg suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene 300 mg de acexamato de zinc. Cada sobre de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO COPINAL 300 mg cápsulas COPINAL 300 mg suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene 300 mg de acexamato de zinc. Cada sobre de
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
1 comprimido de mg contiene los siguientes principios activos:
 1. NOMBRE DEL MEDICAMENTO Rennie Refluxine Comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 comprimido de 3.486 mg contiene los siguientes principios activos: Carbonato cálcico 1.250
1. NOMBRE DEL MEDICAMENTO Rennie Refluxine Comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 comprimido de 3.486 mg contiene los siguientes principios activos: Carbonato cálcico 1.250
FICHA TÉCNICA. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 100 mg de simeticona. Excipientes con efecto conocido:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 100 mg/ml gotas orales en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 100 mg de simeticona. Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 100 mg/ml gotas orales en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 100 mg de simeticona. Excipientes con efecto conocido:
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Finasterida Germed 5 mg comprimidos recubiertos con película EFG Finasterida
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Finasterida Germed 5 mg comprimidos recubiertos con película EFG Finasterida Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Finasterida Germed 5 mg comprimidos recubiertos con película EFG Finasterida Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve
FICHA TÉCNICA. Alivio a corto plazo (de dos o tres meses) del edema y síntomas relacionados con la insuficiencia venosa crónica.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Troxerutina NORMON 1000 mg granulado para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Excipientes: Isomaltosa,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Troxerutina NORMON 1000 mg granulado para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Excipientes: Isomaltosa,
AutorSPCosteoporVar.FT.doc FICHA TÉCNICA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO OSTEOPOR 830 mg comprimidos recubiertos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Complejo de oseína-hidroxiapatita (COH) 830 mg, compuesto por: 75 mg de péptidos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO OSTEOPOR 830 mg comprimidos recubiertos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Complejo de oseína-hidroxiapatita (COH) 830 mg, compuesto por: 75 mg de péptidos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Tavonin 120 mg comprimidos recubiertos con película Extracto de Ginkgo biloba EGb761
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tavonin 120 mg comprimidos recubiertos con película Extracto de Ginkgo biloba EGb761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.2 Composición cualitativa y cuantitativa
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tavonin 120 mg comprimidos recubiertos con película Extracto de Ginkgo biloba EGb761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.2 Composición cualitativa y cuantitativa
Potenciator 5 g solución oral está indicado en adultos y adolescentes mayores de 12 años.
 POTENCIATOR 1. NOMBRE DEL MEDICAMENTO. Potenciator 5 g solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla de 10 ml contiene 5 g de Aspartato de arginina Excipientes con efecto conocido:
POTENCIATOR 1. NOMBRE DEL MEDICAMENTO. Potenciator 5 g solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla de 10 ml contiene 5 g de Aspartato de arginina Excipientes con efecto conocido:
FICHA TÉCNICA. (fitomenadiona, DCI) en 0,2 ml (volumen de llenado: 0,3 ml). Solución contenida en ampollas para administración oral o parenteral.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Konakion 2 mg pediátrico 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 2 mg de vitamina K 1 (fitomenadiona, DCI) en 0,2 ml (volumen de llenado:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Konakion 2 mg pediátrico 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 2 mg de vitamina K 1 (fitomenadiona, DCI) en 0,2 ml (volumen de llenado:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Comprimido recubierto con película convexo, octogonal, color canela, grabado con el logo P en una cara y PROPECIA en la otra.
 1. NOMBRE DEL MEDICAMENTO Propecia 1 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de finasterida. Excipientes con efecto conocido: Cada
1. NOMBRE DEL MEDICAMENTO Propecia 1 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de finasterida. Excipientes con efecto conocido: Cada
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ancesol 10 mg/ml solución inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene: Sustancia
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ancesol 10 mg/ml solución inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene: Sustancia
