Efecto De La Temperatura Sobre Las Propiedades Viscosimétricas Y Volumétricas De Soluciones Acuosas De Pentanol
|
|
|
- Emilio Olivares Velázquez
- hace 6 años
- Vistas:
Transcripción
1 Revista Colombiana de Física, Vol. 43, No. 2 de Efecto De La Temperatura Sobre Las Propiedades Viscosimétricas Y Volumétricas De Soluciones Acuosas De Pentanol Effect Of Temperature On The Viscometric And Volumetric Properties Of Aqueous Solutions Of Pentanol A. Portacio L *.a, M. Paéz M.b, J. Lafont M b a Departamento de Física y Electrónica, Universidad de Córdoba, Montería, Colombia. b Departamento de Química, Universidad de Córdoba, Montería, Colombia. Recibido ; Aceptado ; Publicado en línea Resumen Las densidades y viscosidades de mezcla binarias de pentanol + agua fueron medidas sobre un rango de fracción molar 0,0005 0,0045 para las temperaturas 293,15; 298,15; 303,15; 308,15 y 313,15K para las mezclas binarias Pentanol + agua a diferentes temperaturas usando picnómetros tipo Wood-Brusie y viscosímetros de Ubbelohde respectivamente. A partir de los datos de densidad se obtuvieron volúmenes molares y volúmenes molares parciales a fin de obtener información acerca de las interacciones presentes en las soluciones y analizar el efecto que causa la temperatura sobre ellas. Las interacciones termodinámicas de Pentanol en agua se estudiaron usando los resultados experimentales de densidad y viscosidad a diferentes temperaturas, a través del cálculo de la desviación de viscosidad y la correlación del coeficiente B de viscosidad. Palabras Clave: Pentanol; Viscosidad; Soluciones Acuosas. Abstract The densities and viscosities of binary mixtures of pentanol + water were measured over a range of molar Fractions 0,0005 0,0045 for the temperatures 293,15; 298,15; 303,15; 308,15 y 313,15K for pentanol + water binary mixtures at different temperatures using pycnometers Wood-Brusie and of Ubbelohde viscometers respectively. From density data we obtained molar volumes and partial molar volumes to get information about the interactions present in solutions and analyze the effect that the temperature causes on them. Pentanol thermodynamic interactions in water were studied using the experimental results of density and viscosity at different temperatures, by calculating the deviation of viscosity and the correlation coefficient B of viscosity. Keywords: Pentanol; Viscosity; Aqueous Solutions PACS: Jn., s Revista Colombiana de Física. Todos los derechos reservados. 1. Introducción Los alcanodioles constituyen los modelos estructurales más simples de polioles. Se ha encontrado [1,2] que la adición de polioles previene la desnaturalización de proteínas en medios acuosos, disminuye la temperatura de congelación del agua en soluciones acuosas y conducen a la reorganización de las estructuras tridimensionales (3D) del agua. El mecanismo implicado en estos procesos no se conoce. La posibilidad de formar enlace de hidrógeno intramolecular en moléculas de alcanodioles y su tendencia a formar enlace de hidrógeno con otras moléculas, es un comportamiento interesante en soluciones acuosas. Los estudios sobre la viscosidad de soluciones acuosas de alca- * alfonsoportacio@gmail.com
2 A. Portacio L., M. Paéz M, J. Lafont M.: Efecto De La Temperatura Sobre Las Propiedades Viscosimétricas Y Volumétricas De Soluciones Acuosas De Pentanol nodioles son limitados. Varios trabajos han sido realizados con dioles de cadena corta a 298,15K. Sin embargo muy pocos datos han sido registrados en la literatura para alcanodioles de cadena larga y a otras temperaturas [2]. De ahí que el interés de los autores de este trabajo, consistió en realizar un estudio del efecto que la temperatura ejerce sobre la viscosidad de las soluciones acuosas de Pentanol, con el propósito de obtener información relevante de las interacciones que ocurren en la solución. Para lograr este objetivo, los datos de viscosidad relativa fueron correlacionados a través de la ecuación de Tsangaris Martín [3]; mientras que los datos de viscosidad absoluta fueron analizados con base en la teoría de Eyring. La desviación de viscosidad fue evaluada y analizada de acuerdo con la ecuación sugerida por Parsa y Haghro (2008). 2. Materiales y métodos Como reactivo se utilizó el Pentanol de 99% de pureza, Aldrich. El agua empleada para la calibración de los equipos y la preparación de las soluciones fue doblemente destilada, con una conductividad menor que 2 µl cm 1. Todas las soluciones fueron preparadas por el método de pesada por triplicado usando una balanza OHAUS con una sensibilidad de ±10 5 g en el rango más bajo. La densidad de las soluciones fue medida usando picnómetros de cuello capilar, tipo Wood y Brusie con una incertidumbre de ±10 5 gcm 3. La capacidad de estos picnómetros es de aproximadamente 80 cm 3 los cuales fueron calibrados con agua a las temperaturas de trabajo. La viscosidad fue determinada usando un viscosímetro de Ubbelohde de nivel suspendido, con tiempos de flujo próximos a 300 s para el agua. Los tiempos de flujo son resultado del promedio de quince medidas independientes. La reproducibilidad fue en todos los casos mejor que 0,05% y la incertidumbre en la determinación de la viscosidad fue de ±0,001mPa s. Todas las medidas se realizaron en un baño a temperatura constante controlada y las variaciones de temperatura en el mismo se registraron con un termómetro Fluke Hart Scientific de alta precisión con una incertidumbre de ±0,005K. Los volúmenes molares y los volúmenes molares parciales del soluto de las soluciones acuosas diluidas de Pentanol fueron calculados usando las ecuaciones (1) y (2) respectivamente. Las tendencias de estas cantidades en función de la concentración se muestran en la figura (1). = + = +,, (1), (2) donde es el volumen molar, es el volumen molar parcial del soluto, y son las fracciones molares del solvente y el soluto respectivamente y y son los pesos moleculares del solvente y el soluto respectivamente. Tabla No. 1: Densidades de las soluciones acuosas de Pentanol para las temperaturas ; ; ; y K. x 2 ρ(g/cm 3 ) Análisis y discusión Los resultados experimentales de las densidades de las soluciones acuosas de Pentanol para las temperaturas: 293,15; 298,15; 303,15; 308,15 y 313,15K son reportadas en la tabla 1, donde se puede notar cómo la densidad de las soluciones acuosas diluidas de Pentanol disminuye con el aumento de la temperatura. Ahora, sabiendo que la densidad da información sobre el grado de compactamiento de las moléculas mostrando éstas un menor compactamiento, además es claro que al aumentar la concentración de las moléculas aumenta la densidad de las soluciones. Fig. 1: Volumen molar parcial de las soluciones acuosas diluidas de Pentanol en función de la concentración para diferentes temperaturas. 623
3 Rev.Col.Fís., Vol. 43, No. 2 de Los volúmenes molares parciales del soluto a dilución infinita y las pendientes límites para cada una de las temperaturas, fueron obtenidos por la correlación de los valores mostrados en la figura 1, para lo cual se ajustaron los parámetros de la ecuación lineal (3), donde representa la pendiente límite y el volumen molar parcial a dilución infinita. Los resultados de y y se encuentran en la tabla 2, con sus respectivas incertidumbres. = + (3) Tabla No. 2: Volúmenes molares parciales a dilución infinita y pendientes límites de las soluciones acuosas diluidas de Pentanol para las temperaturas K; K; K; K y K T (K) ± 0,2 ±0, A partir de los datos de la tabla 2, se ajustó la dependencia funcional del volumen molar parcial a dilución infinita con la temperatura mediante la ecuación cuadrática (4), = + +. (4) Los resultados del ajuste de la ecuación (4) se presentan en la tabla 3, donde se puede notar que el signo de la segunda derivada del volumen molar parcial a dilución infinita con respecto a la temperatura es positivo. De acuerdo con la interpretación del signo de esta derivada, podemos decir que en la región diluida el Pentanol tiene un efecto formador sobre la estructura del agua, es decir un comportamiento hidrofóbico, lo cual está de acuerdo con lo obtenido por la pendiente límite. Tabla No. 3: Constantes de ajuste para la dependencia cuadrática del volumen molar parcial a dilución infinita con temperatura. c 1 x 10-5 ± c 1 x 10-5 c 2 ± c 2 c 3 x 10 3 ± c 3 x La segunda derivada del volumen molar parcial a dilución infinita con respecto a la temperatura, refleja el efecto de los solutos sobre la estructura del agua e indica el comportamiento hidrofílico del soluto. El signo negativo se atribuye a que el soluto tiene un efecto disruptor sobre la estructura del agua y el signo positivo a que el soluto tiene un efecto formador [4,5]. Con base a lo anterior al Pentanol se le atribuye un efecto formador sobre la estructura del agua. La viscosidad del sistema Pentanol + agua a las temperaturas de trabajo fueron calculadas desde las medidas de densidad y tiempos de flujo de cada mezcla. Los datos de viscosidad fueron obtenidos a partir de la ecuación (5) [2]; los resultados se muestran en la tabla 4. =, (5) donde y son las constantes del viscosímetro, ρ es la densidad y t es el tiempo de flujo. Tabla No. 4: Viscosidad de soluciones acuosas de Pentanol en función de la molalidad y de la temperatura. mol kg La viscosidad relativa fue determinada como la razón de la viscosidad de la solución y del solvente respectivamente; los resultados se muestran en la Tabla 5. Estas viscosidades a su vez se ajustaron a partir de la ecuación Tsangaris Martín (Hua, 2006) la cual se escribe como sigue: η r = +, (6) donde m es la molalidad, es la viscosidad relativa, B es un coeficiente que relaciona el tamaño y la forma del soluto en la molécula y los efectos de solvatación, mientras D según Hua (2006), representa un parámetro cuantitativo de interacción soluto-soluto y soluto-solvente a altas concentraciones. Experimentalmente se ha encontrado que el signo de refleja el efecto de los solutos sobre la estructura 624
4 A. Portacio L., M. Paéz M, J. Lafont M.: Efecto De La Temperatura Sobre Las Propiedades Viscosimétricas Y Volumétricas De Soluciones Acuosas De Pentanol del agua e indica el comportamiento hidrofóbico del soluto. El signo negativo se atribuye a que el soluto tiene un efecto formador sobre la estructura del agua y el signo positivo a que el soluto tiene un efecto disruptor [3]. Los resultados para los coeficientes B con sus respectivas desviaciones estándar y la variación de B respecto a la temperatura, se muestran en la tabla 6. Tabla No. 5: Viscosidad relativa de soluciones acuosas de Pentanol en función de la molalidad para K, K, K, K y K. (mol Kg -1 ) η r(mpas) , Tabla No. 6: Coeficientes B, D y db dt para soluciones acuosas de Pentanol en función de la temperatura. T (K) B ± B D ± D db/dt En este trabajo no se analiza el parámetro D, dado que las soluciones de este trabajo son a bajas concentraciones. Es evidente de los resultados presentados en la tabla 6, que este soluto se comporta hidrofóbicamente y en consecuencia puede ser catalogado como un soluto formador de la estructura del agua. La desviación de viscosidad fue calculada por la ecuación (7) (Parsa y Haghro, 2008) = +, (7) donde,, son respectivamente la viscosidad de la mezcla, la viscosidad del agua, la viscosidad del Pentanol, la fracción molar del agua en la mezcla y la fracción molar del Pentanol en la mezcla. En la tabla 7 se correlacionan las desviaciones de viscosidad en función de la fracción molar para cada una de las temperaturas de trabajo. Experimentalmente se ha encontrado [2] que valores negativos de la desviación de viscosidad pueden ser interpretados considerando las fuerzas de los enlaces hidrógeno intermoleculares, el tamaño y la forma molecular de los componentes, de tal manera que grandes valores negativos de la desviación de viscosidad podrían indicar la formación de estructuras cíclicas de multímeros de especies Pentanol agua. Además el efecto de la temperatura sobre una mezcla Pentanol-agua puede ser analizado de la siguiente manera: si al aumentar la temperatura los valores la desviación de viscosidad decrecen en valor absoluto entonces existe un debilitamiento de las interacciones Pentanol agua, si aumentan en valor absoluto las interacciones Pentanol agua se fortalecen. Puede verse de los resultados de la tabla 7, que las desviaciones de viscosidad de las mezclas acuosas de Pentanol son en la mayoría positivas y sus valores disminuyen con la temperatura, lo cual indica que las interacciones Pentanol agua se debilitan al aumentar la temperatura. Tabla No. 7: Desviaciones de viscosidad en función de la fracción molar para cada una de las temperaturas de trabajo. x 2 4. Conclusiones η (mpas) ,, La densidad de las soluciones acuosas de Pentanol disminuye al aumentar la concentración de soluto y al aumentar la temperatura. 625
5 Rev.Col.Fís., Vol. 43, No. 2 de El Pentanol se comporta hidrofóbicamente y en consecuencia puede ser catalogado como un soluto formador de la estructura del agua, esto fue verificado con la pendiente límite, y la segunda derivada del volumen molar parcial a dilución infinita con respecto a la temperatura. Finalmente se puede concluir que en las soluciones acuosas diluidas de Pentanol predomina el efecto hidrofóbico sobre el hidrofílico. Para las soluciones acuosas de Pentanol la viscosidad disminuye con el aumento de la temperatura y aumenta con la concentración del soluto. El coeficiente B disminuye sensiblemente con el aumento de la temperatura. La pendiente es pequeña y negativa para las temperaturas estudiadas, lo cual podría indicar que el Pentanol tiene un efecto formador sobre la estructura del agua, debido a que el efecto de la cadena apolar sobrepasa la contribución de la hidratación hidrofílica. El Pentanol se puede catalogar como un soluto que estabiliza la estructura nativa de la proteínas en las temperaturas , , , y K, porque el coeficiente B de viscosidad es positivo en estas condiciones. Referencias [1] Portacio, A. et al, Medidas de Viscosidad de Mezclas Acuosas Binarias a K Revista Colombiana de Física: 41 (2) , (2009). [2] Paéz, M., J. Lafont, y A. Portacio, Efecto de la Temperatura sobre la Viscosidad de Soluciones Acuosas Diluidas de 1,2-Pentanodiol. Información Tecnológica: 20 (2) 55-60, (2009). [3] Hua, Z; Viscosity B coefficients and standard partial molar volumes of amino acids, and their roles in interpreting the protein (enzyme) stabilization. Biophysical Chemistry: 122(3) (2006). [4] Romero, C.M, A. Suárez y E. Jiménez, Efecto de la temperatura sobre las propiedades volumétricas de alcoholes alifáticos en soluciones acuosas diluidas. Revista Colombiana de Química: 36 (3) , (2007). [5] Banipal, P., A. Chahal, y T. Banipal, Studies on volumetric properties of some saccharides in aqueous potassium chloride solutions over temperature range ( to ) K. J. Chem. Thermodynamics: 41(4) (2009). [6] Romero, C.M., Páez, M. Volumetric properties of aqueous binary mixtures of 1- butanol, butanediols, 1, 2, 4 butanetrioland butanetretol at K. Journal of Solution Chemistry: 36 (2) , (2007). [7] Romero, C.M et al, Effect of temperature on the volumetric properties of dilute aqueous solutions of 1,2 hexanediol. 1,5-hexanediol; 1,6-hexanediol and 2,5 - hexanediol. Journal of Chemical Thermodynamics: 39 (1) , (2007). 626
Comportamiento Superficial e Interfacial de Soluciones Acuosas Diluidas de Isómeros de Pentanodiol a 288.15K
 Comportamiento Información Tecnológica Superficial e Interfacial de Soluciones Acuosas Diluidas de Isómeros Vol. 22(1), 65-70 (2011) doi: 10.4067/S0718-07642011000100009 Comportamiento Superficial e Interfacial
Comportamiento Información Tecnológica Superficial e Interfacial de Soluciones Acuosas Diluidas de Isómeros Vol. 22(1), 65-70 (2011) doi: 10.4067/S0718-07642011000100009 Comportamiento Superficial e Interfacial
TRAZABILIDAD DE LAS MEDICIONES DE VISCOSIDAD
 TRAZABILIDAD DE LAS MEDICIONES DE VISCOSIDAD Sonia Trujillo Juárez, Raul Molina Mercado Centro Nacional de Metrología km 4,5 carr. a los Cués, Mpio del Marqués, Qro (44) -05-00, sonia.trujillo@cenam.mx,
TRAZABILIDAD DE LAS MEDICIONES DE VISCOSIDAD Sonia Trujillo Juárez, Raul Molina Mercado Centro Nacional de Metrología km 4,5 carr. a los Cués, Mpio del Marqués, Qro (44) -05-00, sonia.trujillo@cenam.mx,
DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4
 Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
Fundamentos de Química. Horario de Tutorías
 Fundamentos de Química Segundo Cuatrimestre Horario de Tutorías Martes 12:00-14:00 16:00-19:00 Edificio 24B.Tercera Planta 14/02/2006 Tema 11: Propiedades de las disoluciones 11.1 Definición de disolución
Fundamentos de Química Segundo Cuatrimestre Horario de Tutorías Martes 12:00-14:00 16:00-19:00 Edificio 24B.Tercera Planta 14/02/2006 Tema 11: Propiedades de las disoluciones 11.1 Definición de disolución
VOLUMEN MOLAR PARCIAL DE UNA MEZCLA BINARIA
 Práctica VOLUMEN MOLAR PARCIAL DE UNA MEZCLA BINARIA. INTRODUCCIÓN Las magnitudes termodinámicas como la entropía S, energía interna E, volumen V ó entalpía H son magnitudes extensivas, que dependen de
Práctica VOLUMEN MOLAR PARCIAL DE UNA MEZCLA BINARIA. INTRODUCCIÓN Las magnitudes termodinámicas como la entropía S, energía interna E, volumen V ó entalpía H son magnitudes extensivas, que dependen de
APÉNDICE I. Calibración de la señal cromatográfica como función de la concentración: Sistema Ternario
 APÉNDICE I Calibración de la señal cromatográfica como función de la concentración: Sistema Ternario En este apéndice se muestra la información correspondiente a la elaboración de las diferentes curvas
APÉNDICE I Calibración de la señal cromatográfica como función de la concentración: Sistema Ternario En este apéndice se muestra la información correspondiente a la elaboración de las diferentes curvas
6 APENDICE. A. Curvas de Calibración
 6 APENDICE A. Curvas de Calibración Las muestras colectadas en las hidrólisis contenían básicamente carbohidratos como, glucosa, xilosa y arabinosa, entre otros. Se realizaron curvas de calibración para
6 APENDICE A. Curvas de Calibración Las muestras colectadas en las hidrólisis contenían básicamente carbohidratos como, glucosa, xilosa y arabinosa, entre otros. Se realizaron curvas de calibración para
Determinación de constantes de ionización
 Capítulo 5. Determinación de constantes de ionización Se determinaron las constantes de ionización de diversos compuestos mediante curvas de titulación ácido-base empleando métodos espectrofotométricos
Capítulo 5. Determinación de constantes de ionización Se determinaron las constantes de ionización de diversos compuestos mediante curvas de titulación ácido-base empleando métodos espectrofotométricos
DISOLUCIONES UNIDAD IV. Licda. Miriam Marroquín Leiva
 DISOLUCIONES UNIDAD IV 1 DISOLUCIÓN Es una mezcla homogénea de dos o más sustancias; el soluto y el disolvente. Es un término utilizado para describir un sistema en el cual una o más sustancias están mezcladas
DISOLUCIONES UNIDAD IV 1 DISOLUCIÓN Es una mezcla homogénea de dos o más sustancias; el soluto y el disolvente. Es un término utilizado para describir un sistema en el cual una o más sustancias están mezcladas
Disoluciones. Química General II 2011
 Disoluciones Química General II 2011 Disolución Es una mezcla homogénea de dos o mas sustancias. Componentes: Soluto: Sustancia (s) presente (s) en menor cantidad en una disolución, son las sustancias
Disoluciones Química General II 2011 Disolución Es una mezcla homogénea de dos o mas sustancias. Componentes: Soluto: Sustancia (s) presente (s) en menor cantidad en una disolución, son las sustancias
Modelado de Disolvente
 Seminario Fuerzas Intermoleculares Modelado de Disolvente Presentado por: David Ignacio Ramírez Palma Instituto de Química, Universidad Nacional Autónoma de México Noviembre 2014. 1 Contenido - Concepto
Seminario Fuerzas Intermoleculares Modelado de Disolvente Presentado por: David Ignacio Ramírez Palma Instituto de Química, Universidad Nacional Autónoma de México Noviembre 2014. 1 Contenido - Concepto
EJEMPLOS DE PREGUNTA. Prueba de QUÍMICA. febrero 2010
 EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez
 UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez Práctica: Determinación de Densidades. Fecha: 24 de noviembre de 2009 DEYMER GÓMEZ CORREA:
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez Práctica: Determinación de Densidades. Fecha: 24 de noviembre de 2009 DEYMER GÓMEZ CORREA:
EJERCICIOS RESUELTOS DISOLUCIONES
 EJERIIOS RESUELTOS DISOLUIONES 1.- Se disuelven 20 g de NaOH en 560 g de agua. alcula a) la concentración de la en % en masa y b) su molalidad. Ar(Na) 2. Ar(O)16. Ar(H)1. NaOH 20 a) % NaOH.100 % NaOH.100
EJERIIOS RESUELTOS DISOLUIONES 1.- Se disuelven 20 g de NaOH en 560 g de agua. alcula a) la concentración de la en % en masa y b) su molalidad. Ar(Na) 2. Ar(O)16. Ar(H)1. NaOH 20 a) % NaOH.100 % NaOH.100
DISOLUCIONES DILUIDAS IDEALES. LEY DE HENRY. MODELO DE LA DISOLUCIÓN DILUIDA IDEAL
 DISOLUCIONES DILUIDAS IDEALES. LEY DE HENRY. Muchas disoluciones se desvían bastante del modelo de disolución ideal. or ello resulta útil definir otro modelo: MODELO DE LA DISOLUCIÓN DILUIDA IDEAL 1) Descripción
DISOLUCIONES DILUIDAS IDEALES. LEY DE HENRY. Muchas disoluciones se desvían bastante del modelo de disolución ideal. or ello resulta útil definir otro modelo: MODELO DE LA DISOLUCIÓN DILUIDA IDEAL 1) Descripción
PREPARACIÓN DE SOLUCIONES
 PRÁCTICA 4 PREPARACIÓN DE SOLUCIONES OBJETIVOS: Determinar las concentraciones físicas y químicas de las soluciones Preparar soluciones a partir de reactivos sólidos y líquidos I. FUNDAMENTO TEÓRICO. Las
PRÁCTICA 4 PREPARACIÓN DE SOLUCIONES OBJETIVOS: Determinar las concentraciones físicas y químicas de las soluciones Preparar soluciones a partir de reactivos sólidos y líquidos I. FUNDAMENTO TEÓRICO. Las
PREPARACIÓN DE SOLUCIONES
 1. INTRODUCCION Las soluciones se definen como mezclas homogéneas de dos o más especies moleculares o iónicas. Las soluciones gaseosas son por lo general mezclas moleculares. Sin embargo las soluciones
1. INTRODUCCION Las soluciones se definen como mezclas homogéneas de dos o más especies moleculares o iónicas. Las soluciones gaseosas son por lo general mezclas moleculares. Sin embargo las soluciones
DETERMINACIÓN DE LA CONSTANTE UNIVERSAL DE LOS GASES
 DETERMINACIÓN DE LA CONSTANTE UNIERSAL DE LOS GASES La ley general de los gases relaciona la presión P, el volumen, la temperatura T, el número de moles n, y la constante universal de los gases R, como
DETERMINACIÓN DE LA CONSTANTE UNIERSAL DE LOS GASES La ley general de los gases relaciona la presión P, el volumen, la temperatura T, el número de moles n, y la constante universal de los gases R, como
PROBLEMARIO DE QUÍMICA ANALÍTICA II. Espectrometría UV-Visible
 UNIVERSIDAD DEL ZULIA FACULTAD EXPERIMENTAL DE CIENCIAS DEPARTAMENT DE QUIMICA UNIDAD ACADÉMICA DE QUÍMICA ANALÍTICA MATERIA: QUÍMICA ANALÍTICA II PRBLEMARI DE QUÍMICA ANALÍTICA II Espectrometría UV-Visible
UNIVERSIDAD DEL ZULIA FACULTAD EXPERIMENTAL DE CIENCIAS DEPARTAMENT DE QUIMICA UNIDAD ACADÉMICA DE QUÍMICA ANALÍTICA MATERIA: QUÍMICA ANALÍTICA II PRBLEMARI DE QUÍMICA ANALÍTICA II Espectrometría UV-Visible
Operaciones Básicas de Transferencia de Materia Problemas Tema 6
 1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
CONTENIDO DE HIERRO EN LAS LECHES DE FORMULA EMPLEADAS EN LA ALIMENTACIÓN INFANTIL: DISTRIBUCION EN EL SUERO LACTEO Y EN LA GRASA
 CONTENIDO DE HIERRO EN LAS LECHES DE FORMULA EMPLEADAS EN LA ALIMENTACIÓN INFANTIL: DISTRIBUCION EN EL SUERO LACTEO Y EN LA GRASA R. Domínguez 3,1, J.M. Fraga 1,2, J.A. Cocho 1,2, P. Bermejo 3, A. Bermejo
CONTENIDO DE HIERRO EN LAS LECHES DE FORMULA EMPLEADAS EN LA ALIMENTACIÓN INFANTIL: DISTRIBUCION EN EL SUERO LACTEO Y EN LA GRASA R. Domínguez 3,1, J.M. Fraga 1,2, J.A. Cocho 1,2, P. Bermejo 3, A. Bermejo
HOJA DE PROBLEMAS 1: ENUNCIADOS
 Tema: DISOLUCIONES HOJA DE PROBLEMAS 1: ENUNCIADOS 1. ( ) Una disolución acuosa de AgNO 3 con una composición del 12 % en peso tiene una densidad de 1.1080 g/cm 3 a 20 C y 1 atm. Calcule la fracción molar,
Tema: DISOLUCIONES HOJA DE PROBLEMAS 1: ENUNCIADOS 1. ( ) Una disolución acuosa de AgNO 3 con una composición del 12 % en peso tiene una densidad de 1.1080 g/cm 3 a 20 C y 1 atm. Calcule la fracción molar,
UNIVERSIDAD AUTONOMA DE ZACATECAS Francisco García Salinas UNIDAD ACADÉMICA DE CIENCIAS QUÍMICAS Químico Farmacéutico Biólogo
 UNIVERSIDAD AUTONOMA DE ZACATECAS Francisco García Salinas UNIDAD ACADÉMICA DE CIENCIAS QUÍMICAS Químico Farmacéutico Biólogo PROGRAMA: ACADEMIA DE FISICOQUÍMICA JUNIO 2010 PROPUESTA ELABORADA POR: ACADEMIA
UNIVERSIDAD AUTONOMA DE ZACATECAS Francisco García Salinas UNIDAD ACADÉMICA DE CIENCIAS QUÍMICAS Químico Farmacéutico Biólogo PROGRAMA: ACADEMIA DE FISICOQUÍMICA JUNIO 2010 PROPUESTA ELABORADA POR: ACADEMIA
QUÍMICA.SEPTIEMBRE (FE). OPCIÓN A
 1. (2,5 puntos) QUÍMICA.SEPTIEMBRE (FE). OPCIÓN A Las entalpías estándar de combustión del C(s), H 2 (g) y propano gas, C 3 H 8 (g), son -394, -286 y -2220 kj/mol, respectivamente: i. Calcule la entalpía
1. (2,5 puntos) QUÍMICA.SEPTIEMBRE (FE). OPCIÓN A Las entalpías estándar de combustión del C(s), H 2 (g) y propano gas, C 3 H 8 (g), son -394, -286 y -2220 kj/mol, respectivamente: i. Calcule la entalpía
XXI Congreso Interamericano de Ingeniería Química
 PRESIÓN DE VAPOR DE SOLUCIONES ACUOSAS DE ALCANOLAMINAS Blanca Estela García-Flores, Arturo Trejo Instituto Mexicano del Petróleo, Programa de Ingeniería Molecular, Area de Investigación en Termofísica,
PRESIÓN DE VAPOR DE SOLUCIONES ACUOSAS DE ALCANOLAMINAS Blanca Estela García-Flores, Arturo Trejo Instituto Mexicano del Petróleo, Programa de Ingeniería Molecular, Area de Investigación en Termofísica,
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas.
 La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES
 Preuniversitario Liceo de Aplicación Química 4º 2010 Profesora Paola Lizama V. GUÍA 4: DISOLUCIONES EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES 01.- Calcular la cantidad de sosa cáustica (NaOH) y de agua que
Preuniversitario Liceo de Aplicación Química 4º 2010 Profesora Paola Lizama V. GUÍA 4: DISOLUCIONES EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES 01.- Calcular la cantidad de sosa cáustica (NaOH) y de agua que
QUÍMICA FÍSICA II Grupo A. Tercer control, 10 de mayo de Escoged 2 de las 3 preguntas que os propongo, cada una de las preguntas vale 5 puntos.
 QUÍMICA FÍSICA II Grupo A. Tercer control, 10 de mayo de 2011 Escoged 2 de las 3 preguntas que os propongo, cada una de las preguntas vale 5 puntos. 1. Qué significado tienen los parámetros termodinámicos
QUÍMICA FÍSICA II Grupo A. Tercer control, 10 de mayo de 2011 Escoged 2 de las 3 preguntas que os propongo, cada una de las preguntas vale 5 puntos. 1. Qué significado tienen los parámetros termodinámicos
Predicción de volúmenes de exceso molar de mezclas binarias alcohol-solvente desde índices de refracción
 Predicción de volúmenes de exceso molar de mezclas binarias alcohol-solvente desde índices de refracción Prediction of excess molar volumes of binary mixture alcohol-solvent from refractive index Marlon
Predicción de volúmenes de exceso molar de mezclas binarias alcohol-solvente desde índices de refracción Prediction of excess molar volumes of binary mixture alcohol-solvent from refractive index Marlon
ANALISIS EXPERIMENTAL PARA DETERMINAR LA CONDUCTIVIDAD TÉRMICA EN LA TIERRA VERTIDA
 ANALISIS EXPERIMENTAL PARA DETERMINAR LA CONDUCTIVIDAD TÉRMICA EN LA TIERRA VERTIDA Dra. Yolanda G. Aranda Jimenez Arq. Quim Edgardo J. Suárez Dominguez MI 14 SIACOT SAN SALVADOR, EL SALVADOR Vista exterior,
ANALISIS EXPERIMENTAL PARA DETERMINAR LA CONDUCTIVIDAD TÉRMICA EN LA TIERRA VERTIDA Dra. Yolanda G. Aranda Jimenez Arq. Quim Edgardo J. Suárez Dominguez MI 14 SIACOT SAN SALVADOR, EL SALVADOR Vista exterior,
PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERMINACIÓN DE LA MASA MOLECULAR DE UN SOLUTO PROBLEMA POR CRIOSCOPIA
 PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERINACIÓN DE LA ASA OLECULAR DE UN SOLUTO PROBLEA POR CRIOSCOPIA OBJETIVOS: El objetivo de la práctica es el estudio del efecto que produce la adición de un soluto
PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERINACIÓN DE LA ASA OLECULAR DE UN SOLUTO PROBLEA POR CRIOSCOPIA OBJETIVOS: El objetivo de la práctica es el estudio del efecto que produce la adición de un soluto
Evaluación de propiedades físicas de mezclas etanol-agua (II) Evaluation of physical properties of ethanolwater mixtures (II)
 Rev. Fac. Ing. Univ. Antioquia N. 52 pp. 62-74. Marzo, 2010 Evaluación de propiedades físicas de mezclas etanol-agua (II) Evaluation of physical properties of ethanolwater mixtures (II) Osney Ones *, Jorge
Rev. Fac. Ing. Univ. Antioquia N. 52 pp. 62-74. Marzo, 2010 Evaluación de propiedades físicas de mezclas etanol-agua (II) Evaluation of physical properties of ethanolwater mixtures (II) Osney Ones *, Jorge
FOURIER Y NEWTON). LEY DE FICK PARA DIFUSIÓN
 INTRODUCCIÓN. SEMEJANZA ENTRE TRANSFERENCIA DE MASA, CALOR Y MOMENTO (LEYES DE FICK, FOURIER Y NEWTON). LEY DE FICK PARA DIFUSIÓN MOLECULAR. E-mail: williamsscm@hotmail.com TRANSFERENCIA DE MASAS El transporte
INTRODUCCIÓN. SEMEJANZA ENTRE TRANSFERENCIA DE MASA, CALOR Y MOMENTO (LEYES DE FICK, FOURIER Y NEWTON). LEY DE FICK PARA DIFUSIÓN MOLECULAR. E-mail: williamsscm@hotmail.com TRANSFERENCIA DE MASAS El transporte
Conductividad en disoluciones electrolíticas.
 Conductividad en disoluciones electrolíticas. 1.- Introducción 2.- Conductores 3.- Definición de magnitudes 3.1- Conductividad específica 3.2 Conductividad molar " 4. Variación de la conductividad (, ")
Conductividad en disoluciones electrolíticas. 1.- Introducción 2.- Conductores 3.- Definición de magnitudes 3.1- Conductividad específica 3.2 Conductividad molar " 4. Variación de la conductividad (, ")
UNIVERSIDAD TECNOLÓGICA METROPOLITANA INGENIERIA EN QUIMICA LABORATORIO ANALISIS INSTRUMENTAL. INFORME N 1: ESPECTROFOTOMETRÍA UV VISIBLE INTRODUCCION
 UNIVERSIDAD TECNOLÓGICA METROPOLITANA INGENIERIA EN QUIMICA LABORATORIO ANALISIS INSTRUMENTAL. INFORME N 1: ESPECTROFOTOMETRÍA UV VISIBLE INTRODUCCION En este laboratorio utilizaremos el método de la espectrofotometría
UNIVERSIDAD TECNOLÓGICA METROPOLITANA INGENIERIA EN QUIMICA LABORATORIO ANALISIS INSTRUMENTAL. INFORME N 1: ESPECTROFOTOMETRÍA UV VISIBLE INTRODUCCION En este laboratorio utilizaremos el método de la espectrofotometría
ESTADO LÍQUIDO 26/05/2011. Características. Dependen de la naturaleza y fuerza de las partículas que los constituyen
 ESTADO LÍQUIDO Dependen de la naturaleza y fuerza de las partículas que los constituyen Características Tienen densidades mayores que los gases Volumen definido sin forma propia Son poco compresibles Fluyen
ESTADO LÍQUIDO Dependen de la naturaleza y fuerza de las partículas que los constituyen Características Tienen densidades mayores que los gases Volumen definido sin forma propia Son poco compresibles Fluyen
SEGUNDO DE BACHILLERATO QUÍMICA. a A + b B c C + d D
 TEMA 5. CINÉTICA QUÍMICA a A + b B c C + d D 1 d[a] 1 d[b] 1 d[c] 1 d[d] mol v = = = + = + a dt b dt c dt d dt L s El signo negativo en la expresión de velocidad es debido a que los reactivos desaparecen,
TEMA 5. CINÉTICA QUÍMICA a A + b B c C + d D 1 d[a] 1 d[b] 1 d[c] 1 d[d] mol v = = = + = + a dt b dt c dt d dt L s El signo negativo en la expresión de velocidad es debido a que los reactivos desaparecen,
Bioquímica Tema 2: Soluciones. Unidades Año: 2013
 TEMA 2: SOLUCIONES Al estudio de las soluciones se le asigna gran importancia, teniendo en cuenta que la mayoría de las reacciones químicas ocurren entre soluciones, particularmente en medios acuosos.
TEMA 2: SOLUCIONES Al estudio de las soluciones se le asigna gran importancia, teniendo en cuenta que la mayoría de las reacciones químicas ocurren entre soluciones, particularmente en medios acuosos.
3. REQUERIMIENTOS. El estudiante debe tener conocimientos básicos de: - Química General - Laboratorio de Química General 4. OBJETIVOS.
 1. IDENTIFICACIÓN Materia: LABORATORIO DE QUIMICA ANALITICA Códigos: SIRE: 6102 EIQ: IQ-5064 Prelación: IQ-5023 - IQ-5032 Ubicación: Cuarto Semestre TPLU: 0-0-3-1 Condición: Obligatoria Departamento: Química
1. IDENTIFICACIÓN Materia: LABORATORIO DE QUIMICA ANALITICA Códigos: SIRE: 6102 EIQ: IQ-5064 Prelación: IQ-5023 - IQ-5032 Ubicación: Cuarto Semestre TPLU: 0-0-3-1 Condición: Obligatoria Departamento: Química
QUIMICA UNIVERSIDAD DE BURGOS QUÍMICA GUÍA DOCENTE Denominación de la asignatura: QUIMICA. Titulación
 GUÍA DOCENTE 2012-2013 QUIMICA 1. Denominación de la asignatura: QUIMICA Titulación Ingeniería Electrónica Industrial y Automática Código 6400 2. Materia o módulo a la que pertenece la asignatura: Química
GUÍA DOCENTE 2012-2013 QUIMICA 1. Denominación de la asignatura: QUIMICA Titulación Ingeniería Electrónica Industrial y Automática Código 6400 2. Materia o módulo a la que pertenece la asignatura: Química
EJERCICIOS RESUELTOS DISOLUCIONES
 EJERCICIOS RESUELTOS DISOLUCIONES 1- Se disuelven 20 g de NaOH en 560 g de agua Calcula a) la concentración de la en % en masa b) su molalidad Ar(Na) 2 Ar(O)16 Ar(H)1 NaOH 20 a) % NaOH % NaOH % NaOH,45
EJERCICIOS RESUELTOS DISOLUCIONES 1- Se disuelven 20 g de NaOH en 560 g de agua Calcula a) la concentración de la en % en masa b) su molalidad Ar(Na) 2 Ar(O)16 Ar(H)1 NaOH 20 a) % NaOH % NaOH % NaOH,45
TESIS DOCTORAL REOLOGÍA DE ESPESANTES CELULÓSICOS PARA PINTURAS AL AGUA: MODELIZACIÓN Y MECANISMO DE ESPESAMIENTO ASOCIATIVO
 FACULTAT DE QUÍMICA DEPARTAMENT D'ENGINYERIA QUÍMICA I METAL LÚRGIA TESIS DOCTORAL REOLOGÍA DE ESPESANTES CELULÓSICOS PARA PINTURAS AL AGUA: MODELIZACIÓN Y MECANISMO DE ESPESAMIENTO ASOCIATIVO Alicia Maestro
FACULTAT DE QUÍMICA DEPARTAMENT D'ENGINYERIA QUÍMICA I METAL LÚRGIA TESIS DOCTORAL REOLOGÍA DE ESPESANTES CELULÓSICOS PARA PINTURAS AL AGUA: MODELIZACIÓN Y MECANISMO DE ESPESAMIENTO ASOCIATIVO Alicia Maestro
DEPARTAMENTO DE QUÍMICA ANALÍTICA Y TECNOLOGÍA DE ALIMENTOS ANALISIS INSTRUMENTAl I
 PRIMERA RELACIÓN DE PROBLEMAS. CALIBRACIÓN EN QUÍMICA ANALÍTICA 1.- En la determinación de una especie X por un método instrumental en el que la señal analítica se define como P = kc x, se obtuvieron los
PRIMERA RELACIÓN DE PROBLEMAS. CALIBRACIÓN EN QUÍMICA ANALÍTICA 1.- En la determinación de una especie X por un método instrumental en el que la señal analítica se define como P = kc x, se obtuvieron los
INFORME DE LABORATORIO N 11 CONCENTRACIÓN Y ph
 UNIVERSIDAD DE CIENCIAS E INFORMATICA FACULTAD DE CIENCIAS DE LA SALUD ESCUELA DE KINESIOLOGIA INFORME DE LABORATORIO N 11 CONCENTRACIÓN Y ph Asignatura :Química general Profesor : José Gabriel Martínez
UNIVERSIDAD DE CIENCIAS E INFORMATICA FACULTAD DE CIENCIAS DE LA SALUD ESCUELA DE KINESIOLOGIA INFORME DE LABORATORIO N 11 CONCENTRACIÓN Y ph Asignatura :Química general Profesor : José Gabriel Martínez
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD
 TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
DISOLUCIONES 1.- QUÉ ES UNA DISOLUCIÓN?
 DISOLUCIONES 1.- QUÉ ES UNA DISOLUCIÓN? Disoluciones, en química, mezclas homogéneas de dos o más sustancias. El soluto es el componente que se encuentra en distinto estado físico que la disolución; y
DISOLUCIONES 1.- QUÉ ES UNA DISOLUCIÓN? Disoluciones, en química, mezclas homogéneas de dos o más sustancias. El soluto es el componente que se encuentra en distinto estado físico que la disolución; y
Unidad 0 CÁLCULOS QUÍMICOS. Unidad 0. Cálculos químicos
 Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
Práctica No 12. Determinación experimental de la Presión de vapor de un líquido puro
 Práctica No 12 Determinación experimental de la Presión de vapor de un líquido puro 1. Objetivo general: Evaluar la entalpía de vaporización mediante el modelo de Clausius y Clapeyron. 2. Marco teórico:
Práctica No 12 Determinación experimental de la Presión de vapor de un líquido puro 1. Objetivo general: Evaluar la entalpía de vaporización mediante el modelo de Clausius y Clapeyron. 2. Marco teórico:
2. MECANISMO DE DISOLUCIÓN Y DE HIDRATACIÓN DE IONES.
 1. QUÉ ES UNA DISOLUCIÓN? Disoluciones, en química, mezclas homogéneas de dos o más sustancias. El soluto es el componente que se encuentra en distinto estado físico que la disolución; y el disolvente
1. QUÉ ES UNA DISOLUCIÓN? Disoluciones, en química, mezclas homogéneas de dos o más sustancias. El soluto es el componente que se encuentra en distinto estado físico que la disolución; y el disolvente
QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g)
![QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g) QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g)](/thumbs/49/25837773.jpg) OPCIÓN A QUÍMICA. 1. (2,5 puntos) Construya el ciclo de Born-aber y calcule la energía de red (Δ red ) del KCl(s) a partir de los siguientes datos: Entalpía estándar de formación del KCl(s) [Δ f (KCl)]
OPCIÓN A QUÍMICA. 1. (2,5 puntos) Construya el ciclo de Born-aber y calcule la energía de red (Δ red ) del KCl(s) a partir de los siguientes datos: Entalpía estándar de formación del KCl(s) [Δ f (KCl)]
Determinar de forma cuantitativa el calor que se absorbe o desprende en una reacción de neutralización en medio acuoso -NaOH+HCl- que evoluciona a
 Determinar de forma cuantitativa el calor que se absorbe o desprende en una reacción de neutralización en medio acuoso -NaOH+HCl- que evoluciona a presión constante, interpretando los resultados obtenidos
Determinar de forma cuantitativa el calor que se absorbe o desprende en una reacción de neutralización en medio acuoso -NaOH+HCl- que evoluciona a presión constante, interpretando los resultados obtenidos
TRBAJO PRÁCTICO N 5: ph. Objetivo: Determinar el ph de soluciones ácidas y básicas de concentraciones diferentes.
 QUÍMICA GENERAL Y TECNOLÓGICA 2010 TRBAJO PRÁCTICO N 5: ph Objetivo: Determinar el ph de soluciones ácidas y básicas de concentraciones diferentes. Fundamentos Teóricos: La mayoría de las reacciones químicas
QUÍMICA GENERAL Y TECNOLÓGICA 2010 TRBAJO PRÁCTICO N 5: ph Objetivo: Determinar el ph de soluciones ácidas y básicas de concentraciones diferentes. Fundamentos Teóricos: La mayoría de las reacciones químicas
ANÁLISIS CUANTITATIVO POR WDFRX
 ANÁLISIS CUANTITATIVO POR WDFRX El análisis cuantitativo se obtiene mediante la medida de las intensidades de las energías emitidas por la muestra. Siendo la intensidad de la emisión (número de fotones)
ANÁLISIS CUANTITATIVO POR WDFRX El análisis cuantitativo se obtiene mediante la medida de las intensidades de las energías emitidas por la muestra. Siendo la intensidad de la emisión (número de fotones)
Ciencia e Ingeniería Neogranadina ISSN: Universidad Militar Nueva Granada Colombia
 Ciencia e Ingeniería Neogranadina ISSN: 14-817 revistaing@unimilitar.edu.co Universidad Militar Nueva Granada Colombia Rodríguez Chaparro, Tatiana; Pinzón, Luz Helena; Arámbula, Carlos Alberto Estudio
Ciencia e Ingeniería Neogranadina ISSN: 14-817 revistaing@unimilitar.edu.co Universidad Militar Nueva Granada Colombia Rodríguez Chaparro, Tatiana; Pinzón, Luz Helena; Arámbula, Carlos Alberto Estudio
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº6
 CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº6 TEMA: PROPIEDADES COLIGATIVAS OBJETIVOS: Aplicar las propiedades coligativas para el cálculo de masas molares de solutos y de las propiedades físicas de las soluciones.
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº6 TEMA: PROPIEDADES COLIGATIVAS OBJETIVOS: Aplicar las propiedades coligativas para el cálculo de masas molares de solutos y de las propiedades físicas de las soluciones.
HISTORIA DE SU DESCUBRIMIENTO
 1 HISTORIA DE SU DESCUBRIMIENTO La primera referencia histórica escrita acerca del hidrógeno procede de Paracelso, célebre alquimista, quien en el s. XVI observó un aire (que se desprendía al hacer reaccionar
1 HISTORIA DE SU DESCUBRIMIENTO La primera referencia histórica escrita acerca del hidrógeno procede de Paracelso, célebre alquimista, quien en el s. XVI observó un aire (que se desprendía al hacer reaccionar
Problemas resueltos de disoluciones y sus diferentes medidas de concentración.
 UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE CIENCIAS ESCUELA DE QUÍMICA Problemas resueltos de disoluciones y sus diferentes medidas de concentración. 1. Qué es una disolución? Una disolución consiste
UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE CIENCIAS ESCUELA DE QUÍMICA Problemas resueltos de disoluciones y sus diferentes medidas de concentración. 1. Qué es una disolución? Una disolución consiste
SECCIÓN A4 VISCOSIDAD DE SALMUERAS DE FORMIATO
 MANUAL TÉCNICO DEL FORMIATO C A B O T PROPIEDADES QUÍMICAS Y FÍSICAS SECCIÓN A4 VISCOSIDAD DE SALMUERAS DE FORMIATO A4.1 Introducción...2 A4.2 Viscosidad de salmueras de formiato de sal única en función
MANUAL TÉCNICO DEL FORMIATO C A B O T PROPIEDADES QUÍMICAS Y FÍSICAS SECCIÓN A4 VISCOSIDAD DE SALMUERAS DE FORMIATO A4.1 Introducción...2 A4.2 Viscosidad de salmueras de formiato de sal única en función
DEPARTAMENTO DE FÍSICA Y QUÍMICA curso RECUPERACIÓN DE LA ASIGNATURA "FÍSICA Y QUÍMICA" DE 1º DE BACHILLERATO
 DEPARTAMENTO DE FÍSICA Y QUÍMICA curso 2016-17 RECUPERACIÓN DE LA ASIGNATURA "FÍSICA Y QUÍMICA" DE 1º DE BACHILLERATO Durante el mes de octubre se entregará un documento con orientaciones sobre los contenidos
DEPARTAMENTO DE FÍSICA Y QUÍMICA curso 2016-17 RECUPERACIÓN DE LA ASIGNATURA "FÍSICA Y QUÍMICA" DE 1º DE BACHILLERATO Durante el mes de octubre se entregará un documento con orientaciones sobre los contenidos
INTRODUCCIÔN A LA METROLOGÎA QUÎMICA
 INTRODUCCIÔN A LA METROLOGÎA QUÎMICA CURVAS DE CALIBRACIÓN EN LOS MÉTODOS ANALÍTICOS María Antonia Dosal Marcos Villanueva Marzo 2008 Un procedimiento analítico muy utilizado en análisis cuantitativo es
INTRODUCCIÔN A LA METROLOGÎA QUÎMICA CURVAS DE CALIBRACIÓN EN LOS MÉTODOS ANALÍTICOS María Antonia Dosal Marcos Villanueva Marzo 2008 Un procedimiento analítico muy utilizado en análisis cuantitativo es
QUIMICA UNIVERSIDAD DE BURGOS QUÍMICA GUÍA DOCENTE Denominación de la asignatura: QUIMICA. Titulación
 GUÍA DOCENTE 2010-2011 QUIMICA 1. Denominación de la asignatura: QUIMICA Titulación Ingeniería Electrónica Industrial y Automática Código 6400 2. Materia o módulo a la que pertenece la asignatura: Química
GUÍA DOCENTE 2010-2011 QUIMICA 1. Denominación de la asignatura: QUIMICA Titulación Ingeniería Electrónica Industrial y Automática Código 6400 2. Materia o módulo a la que pertenece la asignatura: Química
Determinación Experimental de los Indices de Refracción de las Mezclas Binarias Benceno-Ciclohexano y Tetracloruro de Carbono-Benceno
 Acta Farm. Bonaerense 15 (3): 177-81 (1996) Recibido el 20 de mayo de 19% Aceptado el 2 de septiembre de 1996 Metodología Analítica Determinación Experimental de los Indices de Refracción de las Mezclas
Acta Farm. Bonaerense 15 (3): 177-81 (1996) Recibido el 20 de mayo de 19% Aceptado el 2 de septiembre de 1996 Metodología Analítica Determinación Experimental de los Indices de Refracción de las Mezclas
Conceptos básicos de metrología
 Conceptos básicos de metrología Definiciones, características y estimación de incertidumbres. Lic. Francisco Sequeira Castro 05 de Noviembre, 2014 Qué es la metrología? La metrología es la ciencia de las
Conceptos básicos de metrología Definiciones, características y estimación de incertidumbres. Lic. Francisco Sequeira Castro 05 de Noviembre, 2014 Qué es la metrología? La metrología es la ciencia de las
5. Equilibrio químico
 5. Equilibrio químico Química (1S, Grado Biología) UAM 5. Equilibrio químico Contenidos Equilibrio químico Concepto Condición de uilibro químico Energía libre de Gibbs de reacción Cociente de reacción
5. Equilibrio químico Química (1S, Grado Biología) UAM 5. Equilibrio químico Contenidos Equilibrio químico Concepto Condición de uilibro químico Energía libre de Gibbs de reacción Cociente de reacción
índice ~
 - ---------------- índice ~ Página CAPíTULO 1 CONCEPTOS FUNDAMENTALES 23 1. MATERIA 2. MASA Y PESO 3. VOLUMEN 4. MEDICIÓN 4.1 Unidades fundamentales o patrones de medición unidades SI 5. OPERACIONES MATEMÁTICAS
- ---------------- índice ~ Página CAPíTULO 1 CONCEPTOS FUNDAMENTALES 23 1. MATERIA 2. MASA Y PESO 3. VOLUMEN 4. MEDICIÓN 4.1 Unidades fundamentales o patrones de medición unidades SI 5. OPERACIONES MATEMÁTICAS
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Modelo 2005/2006 PRIMERA PARTE
 1 PAU Química. Modelo 2005/2006 PRIMERA PARTE Cuestión 1. Para el elemento alcalino del tercer periodo y para el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones electrónicas.
1 PAU Química. Modelo 2005/2006 PRIMERA PARTE Cuestión 1. Para el elemento alcalino del tercer periodo y para el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones electrónicas.
DISOLUCIONES. Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables.
 DISOLUCIONES Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables. Soluto es la sustancia que se encuentra en menor proporción. Disolvente es la sustancia
DISOLUCIONES Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables. Soluto es la sustancia que se encuentra en menor proporción. Disolvente es la sustancia
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS.
 PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
PRUEBA ESPECÍFICA PRUEBA 201
 PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 201 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada ejercicio
PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 201 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada ejercicio
Propiedades físicas y químicas del cuero para calzado de seguridad
 Silva Trejos, Paulina Propiedades físicas y químicas del cuero para calzado de seguridad Tecnología en Marcha. Vol. 18 N. 1. Propiedades físicas y químicas del cuero para calzado de seguridad Paulina Silva
Silva Trejos, Paulina Propiedades físicas y químicas del cuero para calzado de seguridad Tecnología en Marcha. Vol. 18 N. 1. Propiedades físicas y químicas del cuero para calzado de seguridad Paulina Silva
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico.
 FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
Tema 6: Disoluciones. Propiedades coligativas
 Tema 6: Disoluciones. Propiedades coligativas 1-Una solución saturada A) Contiene más soluto que solvente. B) Contiene más solvente que soluto. C) Contiene el mismo número de moles de soluto que de solvente.
Tema 6: Disoluciones. Propiedades coligativas 1-Una solución saturada A) Contiene más soluto que solvente. B) Contiene más solvente que soluto. C) Contiene el mismo número de moles de soluto que de solvente.
Curva de calibracion Calcio (Perkin Elmer 370)
 Absorbancia UNIVERSIDAD INDSUTRIAL DE SANTANDER ESCUELA DE QUIMICA Laboratorio de Instrumentación Química I Grupo 2 (Jueves) Silvia Juliana Vesga Cód.: 2090143 Brandon Álvarez Sánchez Cód.: 2091650 Práctica
Absorbancia UNIVERSIDAD INDSUTRIAL DE SANTANDER ESCUELA DE QUIMICA Laboratorio de Instrumentación Química I Grupo 2 (Jueves) Silvia Juliana Vesga Cód.: 2090143 Brandon Álvarez Sánchez Cód.: 2091650 Práctica
GUIA DE ESTUDIO Nº 7: Equilibrio Químico
 Página26 GUIA DE ESTUDIO Nº 7: Equilibrio Químico I.- Conceptos básicos: Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio
Página26 GUIA DE ESTUDIO Nº 7: Equilibrio Químico I.- Conceptos básicos: Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio
Maestría en Ciencia y Tecnología Ambiental
 Maestría en Ciencia y Tecnología Ambiental Temario: Química Propósito general: Proporcionar y estandarizar el conocimiento básico de química a los candidatos para ingresar al programa de Maestría en Ciencia
Maestría en Ciencia y Tecnología Ambiental Temario: Química Propósito general: Proporcionar y estandarizar el conocimiento básico de química a los candidatos para ingresar al programa de Maestría en Ciencia
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
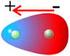 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
ISOTERMA DE ADSORCIÓN DE ÁCIDO OXÁLICO SOBRE CARBÓN ACTIVO. Eva Mª Talavera Rodríguez y Francisco A. Ocaña Lara
 ISOTERMA DE ADSORCIÓN DE ÁCIDO OXÁLICO SOBRE CARBÓN ACTIVO Eva Mª Talavera Rodríguez y Francisco A. Ocaña Lara 1. Objetivos 1.- Verificar la adsorción de las moléculas de un soluto en una disolución líquida
ISOTERMA DE ADSORCIÓN DE ÁCIDO OXÁLICO SOBRE CARBÓN ACTIVO Eva Mª Talavera Rodríguez y Francisco A. Ocaña Lara 1. Objetivos 1.- Verificar la adsorción de las moléculas de un soluto en una disolución líquida
Teoría Disoluciones Fórmula empírica y molecular Física y Química. 1º bachiller DISOLUCIONES
 Teoría Disoluciones Fórmula empírica y molecular Física y Química. 1º bachiller 18-1-2015 CONCEPTO DE DISOLUCIÓN DISOLUCIONES Una disolución es una mezcla homogénea de sustancias en igual o distintos estados
Teoría Disoluciones Fórmula empírica y molecular Física y Química. 1º bachiller 18-1-2015 CONCEPTO DE DISOLUCIÓN DISOLUCIONES Una disolución es una mezcla homogénea de sustancias en igual o distintos estados
[ A ], [ B ]...: concentraciones molares de los reactivos en un momento dado.
![[ A ], [ B ]...: concentraciones molares de los reactivos en un momento dado. [ A ], [ B ]...: concentraciones molares de los reactivos en un momento dado.](/thumbs/49/25484895.jpg) VELOCIDAD MEDIA DE UNA REACCIÓN aa + b B c C + d D [ A] [ B] [ C] [ D] Vmedia = = = = a b c d A Velocidad de disminución de los reactivos: a Velocidad de aumento de los productos: ECUACIÓN DE VELOCIDAD
VELOCIDAD MEDIA DE UNA REACCIÓN aa + b B c C + d D [ A] [ B] [ C] [ D] Vmedia = = = = a b c d A Velocidad de disminución de los reactivos: a Velocidad de aumento de los productos: ECUACIÓN DE VELOCIDAD
Biopolímero s (4831)
 Biopolímero s (4831) 5.4. Factores que determinan la estructura de los ácidos nucleicos. 5.4.4 Apilamiento de bases Cuando se examinan los cristales de ácidos nucleicos helicoidales se observa que los
Biopolímero s (4831) 5.4. Factores que determinan la estructura de los ácidos nucleicos. 5.4.4 Apilamiento de bases Cuando se examinan los cristales de ácidos nucleicos helicoidales se observa que los
Análisis Gravimétrico
 Análisis Gravimétrico Noviembre, 2012 Clasificación del Análisis Químico Análisis Químico Análisis químico cualitativo Análisis químico cuantitativo Qué hay? Cuánto hay? Identificar los componentes Cuantificar
Análisis Gravimétrico Noviembre, 2012 Clasificación del Análisis Químico Análisis Químico Análisis químico cualitativo Análisis químico cuantitativo Qué hay? Cuánto hay? Identificar los componentes Cuantificar
So S l o u l c u i c o i n o e n s e
 Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
Titulaciones en Química Analítica. Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D.
 Titulaciones en Química Analítica Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D. Introducción En el análisis volumétrico, la concentración se determina midiendo su capacidad de reaccionar con un reactivo
Titulaciones en Química Analítica Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D. Introducción En el análisis volumétrico, la concentración se determina midiendo su capacidad de reaccionar con un reactivo
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
UNIDAD 2. CINÉTICA QUÍMICA
 UNIDAD 2. CINÉTICA QUÍMICA Introducción. Velocidad de reacción Cómo se producen las reacciones químicas Ecuación de la velocidad de reacción Factores que afectan a la velocidad de reacción Mecanismo de
UNIDAD 2. CINÉTICA QUÍMICA Introducción. Velocidad de reacción Cómo se producen las reacciones químicas Ecuación de la velocidad de reacción Factores que afectan a la velocidad de reacción Mecanismo de
TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos
 TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos ÍNDICE 1. Ecuaciones (reacciones) químicas 2. Cálculos estequiométricos. Reactivo limitante y reacciones consecutivas 3. Pureza de un reactivo 4. Rendimiento
TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos ÍNDICE 1. Ecuaciones (reacciones) químicas 2. Cálculos estequiométricos. Reactivo limitante y reacciones consecutivas 3. Pureza de un reactivo 4. Rendimiento
Purificación de proteínas
 Purificación de proteínas Purificación Proceso que cuenta con varias etapas cuyo objetivo es lograr la concentración diferencial de la proteína o molécula de interés Condiciones generales a evaluar Calidad
Purificación de proteínas Purificación Proceso que cuenta con varias etapas cuyo objetivo es lograr la concentración diferencial de la proteína o molécula de interés Condiciones generales a evaluar Calidad
Disoluciones. Contenidos. Identificar en una disolución el soluto y el disolvente.
 Disoluciones Contenidos Identificar en una disolución el soluto y el disolvente. Clasificar los tipos de disoluciones según el estado físico del soluto y el disolvente. Efectuar cálculos de determinación
Disoluciones Contenidos Identificar en una disolución el soluto y el disolvente. Clasificar los tipos de disoluciones según el estado físico del soluto y el disolvente. Efectuar cálculos de determinación
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
Carlos Martínez B. Ley de Boyle. Carlos Javier Bernal Avila. Viernes, 29 de enero de 2010
 ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS LABORATORIO DE FISICA B Profesor: Carlos Martínez B. Título de la práctica: Ley de Boyle Nombre: Carlos Javier Bernal Avila Grupo
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS LABORATORIO DE FISICA B Profesor: Carlos Martínez B. Título de la práctica: Ley de Boyle Nombre: Carlos Javier Bernal Avila Grupo
TRABAJO PRÁCTICO N 5 TERMOQUÍMICA
 TRABAJO PRÁCTICO N 5 TERMOQUÍMICA Calores de reacción Todas las reacciones químicas están acompañadas ya sea por una absorción o una liberación de energía, que en general se manifiesta como calor. La Termoquímica
TRABAJO PRÁCTICO N 5 TERMOQUÍMICA Calores de reacción Todas las reacciones químicas están acompañadas ya sea por una absorción o una liberación de energía, que en general se manifiesta como calor. La Termoquímica
Ecuación para la correlación de la viscosidad de mezclas: crudo pesado + diluyente
 Ecuación para la correlación de la viscosidad de mezclas: crudo pesado + diluyente Ascención Romero Martínez a y Rafael Eustaquio Rincón b Instituto Mexicano del Petróleo, Dirección de Investigación y
Ecuación para la correlación de la viscosidad de mezclas: crudo pesado + diluyente Ascención Romero Martínez a y Rafael Eustaquio Rincón b Instituto Mexicano del Petróleo, Dirección de Investigación y
Química 2º Bach. Recuperación 1ª Evaluación 13/01/05
 Química º Bach. Recuperación 1ª Evaluación 13/1/5 DEPARTAMENT DE FÍSIA E QUÍMIA Nombre: 1. alcula a partir de qué temperatura será espontánea la reacción de descomposición del tetraóxido de dinitrógeno
Química º Bach. Recuperación 1ª Evaluación 13/1/5 DEPARTAMENT DE FÍSIA E QUÍMIA Nombre: 1. alcula a partir de qué temperatura será espontánea la reacción de descomposición del tetraóxido de dinitrógeno
TERMOQUÍMICA PAU ASTURIAS
 TERMOQUÍMICA PAU ASTURIAS 1. (PAU 08) La observación experimental de H con respecto al producto T S, para una reacción simple, A B, permite la representación gráfica de la figura: Observando, la misma,
TERMOQUÍMICA PAU ASTURIAS 1. (PAU 08) La observación experimental de H con respecto al producto T S, para una reacción simple, A B, permite la representación gráfica de la figura: Observando, la misma,
Trabajo Práctico Nº 4 SACAROSA
 FUNDAMENTOS TEÓRICOS Trabajo Práctico Nº 4 SACAROSA PARTE A: PROPIEDADES COLIGATIVAS Si se disuelve un soluto en un líquido, hay ciertas propiedades de la solución que se irán modificando de acuerdo con
FUNDAMENTOS TEÓRICOS Trabajo Práctico Nº 4 SACAROSA PARTE A: PROPIEDADES COLIGATIVAS Si se disuelve un soluto en un líquido, hay ciertas propiedades de la solución que se irán modificando de acuerdo con
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
Los enlaces C F son polares pero la geometría tetraédrica
 1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
Molaridad y molalidad
 Molaridad y molalidad Apellidos, nombre Atarés Huerta, Lorena (loathue@tal.upv.es) Departamento Centro Departamento de Tecnología de Alimentos ETSIAMN (Universidad Politécnica de Valencia) 1 Resumen de
Molaridad y molalidad Apellidos, nombre Atarés Huerta, Lorena (loathue@tal.upv.es) Departamento Centro Departamento de Tecnología de Alimentos ETSIAMN (Universidad Politécnica de Valencia) 1 Resumen de
