Instituto de Investigación e Ingeniería Ambiental. Triquinelosis: transmisión experimental en ratas bajo condiciones de cautiverio.
|
|
|
- María del Rosario García Tebar
- hace 6 años
- Vistas:
Transcripción
1 Instituto de Investigación e Ingeniería Ambiental Triquinelosis: transmisión experimental en ratas bajo condiciones de cautiverio. Autor: Jorge L. Caracostantogolo M.V. Director: Pedro Steffan MSc PhD Lugar de trabajo: Instituto de Patobiología CICVyA INTA Castelar, Argentina. Tesis presentada para obtener el título de Magister en Control de Plagas y su Impacto Ambiental Marzo 2009
2 2 Agradecimientos Deseo expresar mi más sincero agradecimiento: A mi Director de tesis, el Dr. Pedro Steffan quien por su guía y sus consejos fue de fundamental ayuda para que pudiera desarrollar este trabajo. A la Universidad Nacional de San Martín, en la persona del Dr. Eduardo Zerba y a todo el personal del Centro de Investigaciones de Plagas e Insecticidas (CIPEIN) que pusieron toda su capacidad docente y su buena disposición para brindar los excelentes cursos de la Maestría en Control de Plagas y su Impacto Ambiental. A mi amigo el Dr. Carlos Eddi quien con su amistad y su ejemplo me formó profesionalmente a lo largo de 20 años, en que integramos el Area de Parasitología de INTA Castelar y que hizo la primera lectura crítica del borrador de esta tesis. Al personal del Area de Parasitología del Instituto de Patobiología del INTA de Castelar, sin cuyo apoyo no habría sido posible obtener los resultados de experimentación de esta tesis. Al Instituto Nacional de Tecnología Agropecuaria en la persona del Director del Instituto de Patobiología, Dr. Luis Samartino MSc PhD, por darme la posibilidad desde el punto de vista económico y edilicio para llevar a cabo los ensayos con animales de laboratorio y por dar el soporte a todas las condiciones necesarias para tener siempre un buen ambiente de trabajo.
3 Dedicación: A Betty, Griselda y Jorge que le dan sentido a todos mis esfuerzos. 3
4 4 Tabla de contenidos Agradecimientos.. 2 Dedicación. 3 Tabla de contenidos 4 Resumen 6 1. Introducción Posición taxonómica de Trichinella spiralis Hospedadores Morfología Ciclo Biológico Fase Gastroentérica Fase Parenteral Epidemiología El cerdo como fuente de infección El caballo y la forma en que se infecta El papel de la rata en la transmisión El ciclo silvestre Signos clínicos en las personas Hallazgos de laboratorio Signos Clínicos en los cerdos Patología Diagnóstico en Medicina Veterinaria Técnica de compresión (triquinoscopía) Técnica de digestión artificial o enzimática Toma de muestras para diagnóstico Faenas de rutina Faenas compulsivas de animales provenientes 28 de un foco Métodos indirectos Inmunofluorescencia indirecta (IFI) ELISA Indirecto Inmunoelectrotransferencia o Western Blot (WB) Control de la triquinelosis Control de las ratas en criaderos de cerdos TRABAJO EXPERIMENTAL Experimento I: Presencia e infectividad de larvas de T. spiralis en materia fecal de ratas inoculadas experimentalmente Introducción Objetivo general Objetivos específicos Materiales y métodos Unidades experimentales Grupos experimentales Alojamiento de los animales Inoculación experimental Obtención de la materia fecal de ratas inoculadas Procesamiento de la materia fecal de ratas inoculadas Examen clínico de las ratas inoculadas 39
5 Digestión enzimática de los ratones receptores Serología de los ratones receptores Cronograma de actividades Diseño experimental Análisis estadístico Resultados Discusión Experimento II: Infección congénita y transmamaria por larvas de T. spiralis en las crías de ratas infectadas experimentalmente Introducción Objetivos Materiales y métodos Unidades experimentales Grupos experimentales Alojamiento de los animales Apareamiento Inoculación experimental Digestión enzimática de los músculos de las madres Digestión enzimática de los músculos de las crías Diagnóstico serológico por la técnica de ELISA Diseño experimental Cronograma del ensayo Análisis estadístico Resultados Discusión Conclusiones.. 59 Referencias Bibliográficas. 62 APENDICE I : Resultados de Análisis Estadisticos.. 74 APENDICE II : Fotos 92
6 Resumen Los ensayos llevados a cabo en esta tesis tuvieron por objetivo mejorar el conocimiento sobre las formas de transmisión de la triquinelosis en ratas infectadas experimentalmente con Trichinella spiralis. Se realizaron dos experimentos. En el primero se determinó la presencia y la infectividad de larvas en materia fecal de ratas Wistar de gramos de peso corporal luego de infectarlas experimentalmente con larvas enquistadas en carne, utilizando diferentes fuentes de infección, dosis de larvas y tipos de dieta. Se registraron los signos clínicos presentados por las ratas infectadas y además, en un ensayo accesorio, se estudió la transmisión por consumo del intestino en el día 5 p.i. La presencia de larvas se estudió por métodos parasitológicos, utilizando tamices seriados de porosidad decreciente y microscopía estereoscópica. La infectividad se estudió administrando por vía oral a ratones Balb C, las larvas aisladas de la materia fecal de las ratas. A los 60 días de la inoculación, fueron sacrificados, se sometieron sus músculos a digestión enzimática y sus sueros sanguíneos a diagnóstico de anticuerpos por la técnica de ELISA. En el segundo experimento se estudiaron las vías de transmisión transplacentaria y transmamaria. Se infectó a ratas Wistar hembras con 2000 larvas de T. spiralis en el primer tercio de la preñez o en el día del parto. En el día 90 post parto, se estudió la presencia de larvas musculares y de anticuerpos en ellas y en sus crías, empleando la misma metodología que se utilizó para los ratones receptores en el primer experimento. Se pudo demostrar que las larvas de T. spiralis que salen en la materia fecal de las ratas infectadas experimentalmente no son infectantes. No se hallaron larvas musculares ni anticuerpos contra el parásito en los ratones receptores. La infección con dosis altas de larvas, produjo signos clínicos de enfermedad en las ratas, coincidiendo la ocurrencia de falta de reacción por afección de la musculatura, con el momento en que las larvas que invaden los músculos se tornan infectantes. La ingestión de intestino en el día 5 p.i., que contiene hembras en larvipostura, da lugar a bajos niveles de infección en los animales que lo consumen. No se pudo demostrar que la infección por vía transplacentaria o transmamaria fueran posibles. Las ratas madres infectadas tuvieron larvas en sus músculos y anticuerpos anti-trichinella, pero no sus crías. Se concluye que en ratas, la triquinelosis no se transmite por coprofagia y que la infección de ratas con una cantidad de larvas similar a la que podría ocurrir en condiciones naturales, no transmite la enfermedad a las crías por las vías transplacentaria ni transmamaria. 6
7 7 Triquinelosis: transmisión experimental en ratas bajo condiciones de cautiverio. 1. Introducción La triquinelosis es una enfermedad parasitaria transmisible por los alimentos. El agente causal es un nematodo filiforme perteneciente al género Trichinella y la única especie hallada hasta el momento en Argentina es Trichinella spiralis. El ciclo de vida de este nematodo es de tipo autoheteroxeno lo que significa que el mismo hospedador alberga a las formas adultas, a las larvales iniciales y a las larvales infectantes para un nuevo hospedador. Las larvas infectantes habitan en las fibras de músculo estriado de los animales afectados. Cuando la carne de estos animales es consumida por otros, la digestión libera las larvas permitiéndoles evolucionar hasta parásitos adultos en el intestino delgado. Los nematodos adultos copulan y las hembras depositan nuevas larvas en la mucosa intestinal. Estas se distribuyen por todo el cuerpo mediante la circulación linfática y sanguínea, pero solamente aquellas que llegan al músculo estriado pueden continuar su evolución para alcanzar capacidad infectante. La triquinelosis afecta al hombre cuando come carne cruda o insuficientemente cocida de cerdo o presas de caza infectadas o salazones crudas preparadas con estas materias primas. Desde el punto de vista epidemiológico, se reconocen tres ciclos de infección: el doméstico, que involucra a cerdos, caballos, roedores y al hombre, el sinantrópico, que incluye a las mascotas y a la fauna que utiliza el ambiente modificado por el hombre, y el salvaje, que incluye solamente a animales silvestres. El modo de transmisión entre animales de especies diferentes es por ingestión de músculos infectados, lo que puede ocurrir por predación o por consumo de carroña. Entre animales de la misma especie la transmisión puede ocurrir por canibalismo. La transmisión por coprofagia es teóricamente posible si una digestión incompleta de la carne ingerida permitiera la presencia de fibras musculares infectadas en materia fecal. 1.1 Posición taxonómica de Trichinella spiralis El género Trichinella pertenece al phylum Nemathelminthes, clase Nematoda, orden Trichocephalida y superfamilia trichinelloidea La Superfamilia Trichinelloidea se caracteriza por tener faringe seguida por un esófago moniliforme; los machos y las hembras tienen una sola gónada. Comprende a la Familia Trichuridae y a la Familia Trichinellidae, ambas con intestino normal con un solo esticosoma y a la Familia Cystoopsidae, con intestino modificado y con dos esticosomas. Las hembras de la Familia Trichuridae son ovíparas y los machos tienen espícula. Las hembras de la Familia Trichinellidae son vivíparas y los machos no tienen espícula. (Martínez Fernández, 2002) La Familia Trichinellidae tiene un solo género, Trichinella Raillet 1895 Los parásitos de este género, presentan un esófago filiforme formado por una célula tubular rodeada por una capa de células llamadas esticocitos que vierten sus productos de excreción-secreción en la luz del esófago. Otra
8 característica distintiva es la presencia de células bacilares relacionadas con la cutícula. (Smyth, 1994) Hoy se reconocen ocho especies y tres genotipos en el genero Trichinella (Murrell y col., 2000; Pozio y col., 2002a; Pozio y Zarlenga, 2005). Se las llama especies crípticas, simpátricas o gemelas porque son poblaciones aisladas desde el punto de vista reproductivo pero que todavía no se diferencian morfológicamente. Por la característica de formar por fuera de la célula muscular parasitada una cápsula de colágeno visible con microscopio óptico, se reconocen en el género dos ramas: encapsulantes y no encapsulantes (Pozio, 2005) Los primeros métodos utilizados para clasificar los aislamientos de diferentes áreas geográficas o hospedadores se basaron en características biológicas mensurables: El Índice de Capacidad Reproductiva (RCI) definido como el cociente entre el número de larvas musculares obtenidas y el número de larvas infectantes administradas a animales de laboratorio. La capacidad de reproducirse entre los sexos opuestos de diferentes aislamientos. En base a estos métodos se describieron dos nuevas especies que diferían de T. spiralis: T. nativa (Britov & Boev, 1972) con bajo RCI en roedores y cerdos comparado con el de T. spiralis T. nelsoni (Britov & Boev, 1972) con RCI intermedio entre T. spiralis y T. nativa En 1972 fue descripta una cuarta especie, T. pseudospiralis que se diferenciaba por la falta de una cápsula de colágeno alrededor de la célula muscular infectada y por el menor tamaño de la larva muscular. Los primeros intentos para investigar la variación genética entre aislamientos de Trichinella spp. utilizando métodos bioquímicos, revelaron que existían diferencias consistentes entre las alozimas de aislamientos provenientes de diferentes hospedadores u orígenes geográficos (Flockhart y col., 1982). La Rosa y col. en 1992, publicaron un estudio sobre 152 aislamientos de diferentes hospedadores y regiones geográficas. Utilizaron 27 patrones de alozima, lo que les permitió identificar ocho genotipos distintos que nombraron T1 a T8. Cuatro de estos genotipos representaban a las cuatro especies propuestas hasta el momento: T. spiralis, T. nativa, T. nelsoni y T. pseudospiralis. Un meta-análisis de los datos publicados hasta 1992, que reunía características de 300 aislamientos, permitió llevar a cabo la revisión taxonómica del género, con el reconocimiento de cinco especies: T. spiralis, T. nativa, T. nelsoni, T. pseudospiralis y T. britovi; y tres genotipos a los que se denominó Trichinella T5, T6 y T8 (Pozio y col., 1992b) Este esquema taxonómico se mantiene hasta el presente con modificaciones para el agregado de nuevas especies y genotipos: T. murrelli, antes denominada como T5, T. papuae la segunda no encapsulante, (Murrell y col., 2000); T9 aislado de carnívoros selváticos en Japón (Nagano y col., 1999) y T. zimbabwensis, la tercera no encapsulante (Pozio y col., 2002a) 8
9 9 Phylum Nemathelminthes, Rudolphi, 1808 Clase Nematoda Orden Tricocephallida Superfamilia trichuroidea Familia Trichinellidae, Ward, 1907 Trichinella spiralis, (Owen, 1835) Railliet, 1895 (T1) T. nativa, (Britov & Boev, 1972), (T2) T. britovi, (Pozio y col., 1992b) (T3) T. pseudospiralis, Garkavi, 1972, (T4) T. murrelli, (Pozio & Larosa, 2000) (T5) T. nelsoni, (Britov & Boev, 1972; Pozio y col, 1992b) (T7) T. papuae, (Pozio y col., 1999) (T10) T. zimbabwensis, (Pozio y col., 2002a) (T11) T6 (Pozio y col., 1992b) T8 (Pozio y col., 1992b) T9 (Nagano y col., 1999) La introducción de pruebas derivadas de la reacción en cadena de la polimerasa (PCR) simplificó la identificación de los aislamientos provenientes de diferentes hospedadores y regiones geográficas y confirmó la taxonomía actual del Género. Su alta sensibilidad permite analizar larvas individualmente, lo que ha permitido demostrar que pueden existir infecciones mixtas en un mismo hospedador (Pozio & Zarlenga, 2005; Pozio & Murrell, 2006). En Sudamérica, hasta 2007, sólo se habían detectado infecciones por T. spiralis (Venturiello, 2002; Molina, 2002; Pozio, 2005). En 2008, Krivokapich y col. reportaron un aislamiento hallado en un puma en la Patagonia, cuyo ADN, en las tres regiones útiles para identificación, no coincide con ninguno de los 11 genotipos reconocidos. Este aislamiento es del tipo encapsulado y son necesarios más estudios para establecer si se trata de un nuevo genotipo. 1.2 Hospedadores Las aves, los mamíferos y los reptiles pueden ser hospedadores de Trichinella spp. Se han hallado vertebrados infectados en todos los continentes con excepción de la Antártida (Pozio, 2005) Los mamíferos son los hospedadores mas importantes para el género, habiéndose descripto infecciones naturales en 150 especies pertenecientes a 12 Ordenes (Marsupialia, Insectivora, Edentata, Chiroptera, Lagomorpha, Rodentia, Cetacea, Carnivora, Perissodactyla, Artiodactyla, Tylopoda y Primates) (Pozio, 2005) El hombre es la única especie de primate que puede hallarse infectado en condiciones naturales por cualquiera de las especies del género Trichinella, excepto por T. zimbabwensis. En condiciones experimentales se han encontrado 15 especies de primates no humanos altamente susceptibles a especies de Trichinella encapsuladas y no encapsuladas, pero nunca se han detectado en condiciones de vida salvaje (Pozio, 2001)
10 10 Los mamíferos son susceptibles a todas las especies de Trichinella, los reptiles, solamente a T. papuae y T. zimbabwensis; en tanto que las aves son susceptibles únicamente a T. pseudospiralis (Pozio, 2001). En las muestras recibidas por el Centro Internacional para la Investigación de Triquinelosis, T. spiralis se halló en el 87% de las provenientes de cerdos domésticos, 67% de jabalíes, 88% de equinos, 79% de las ratas sinantrópicas y el 100% de los armadillos sinantrópicos (Pozio & Murrell, 2005) T. spiralis expandió su área de difusión a través de la importación pasiva en cerdos y ratas sinantrópicas (Pozio, 2001) En muchas regiones del mundo, fue trasmitida a los animales salvajes por exposición a depósitos de basura donde se desechaban restos provenientes de cerdos faenados (Pozio & Murrell, 2005) Es la especie que causa la mayoría de los casos humanos de triquinelosis en todo el mundo. Su patogenicidad es mayor que la del resto de las especies del género debido a que las hembras producen el número más alto de larvas recién nacidas (Pozio y col., 1992a) 1.3 Morfología La morfología de T. spiralis cambia a lo largo del ciclo biológico, de modo que en la fase gastroentérica se pueden describir: las larvas musculares que se liberan por la digestión de los quistes musculares, los preadultos, los adultos y las larvas recién nacidas; y en la fase parenteral: las larvas circulantes recién nacidas que al llegar al músculo del hospedador se transformarán en larvas musculares. Las larvas musculares (L1) contenidas en el tejido muscular ingerido, son liberadas por el proceso digestivo en el estómago. Miden alrededor de 1 mm de largo por µm de diámetro. Están típicamente enrolladas en espiral y cuando quedan liberadas del quiste muscular, presentan movimientos de extensión y enrollamiento continuos. La LI es una fase avanzada de larva de primer estado en la que se diferencian el esticosoma, que ocupa los dos tercios anteriores, y el primordio genital y el intestino que ocupan el tercio posterior. Ya en este estadío es posible diferenciar los sexos por la disposición que toman el primordio genital y el intestino: en los futuros machos, se cruzan, en tanto que en las futuras hembras corren paralelos. (Villela, 1966); (Martínez Fernandez, 2002; Despommier, 1983) Cada estadio larval puede ser reconocido en los machos por el grosor de la cutícula desprendida y por la presencia o ausencia de apéndices copulatorios, papilas tuberculadas y esperma. En las hembras, por el estado de desarrollo de la vagina y el útero y por el grosor de la cutícula y la presencia de estriaciones en la misma (Kozek, 1971). En las L1 futuros machos, la cutícula es gruesa y estriada transversalmente. No existen apéndices copulatorios (Kozek, 1971) En las larvas futuras hembras, la vaina que queda liberada en la primera muda es gruesa y estriada como la descripta en los machos. Las subsiguientes vainas son muy tenues y no permiten diferenciar los estadios
11 11 resultantes. Por esta razón, en las larvas futuras hembras se diferencian los estadios basándose en el desarrollo de los organos reproductivos. (Kozek, 1971) En las L1 futuras hembras el primordio de vagina consiste en unas pocas células hipodérmicas situadas cerca de la porción anterior del esticosoma. El primordio uterino aparece como una estructura sinuosa en el espacio que queda entre el ovario y el esticosoma. Está limitada por una célula grande (12 µm) denominada célula de conexión genital. En el esticosoma se pueden diferenciar células de tres tipos distintos que elaboran excreciones antigénicas. El esticosoma consiste en una fila única de 37 a 52 células llamadas esticocitos. Cada una tiene un diámetro de 25 µm, posee un solo núcleo y está comunicada con la luz del esófago. El citoplasma contiene mitocondrias, aparato de Golgi, retículo endoplásmico granular y gránulos de 5 tipos: a0, a1, a2, ß y?. Estos gránulos contienen material antigénico que induce la formación de anticuerpos por parte del hospedador (Despommier & Muller, 1976; Takahashi y col., 1989). En los especímenes futuros machos, el número de esticocitos varia de 47 a 52 con un promedio de 49. En las larvas futuras hembras, el número es de 37 a 45 con una media de 43 (Villela, 1966) Larvas de segundo estadío (L2): A partir de las larvas de segundo estadio, a lo largo del esticosoma pueden verse cuatro bandas bacilares que corresponden a los poros de las glándulas hipodérmicas, dispuestos en forma paralela. Cada célula glandular comunica con el exterior del verme, a través de poros de 1.5 a 2 µm que contienen un material denso. Estos poros son un punto débil de Trichinella spp. ya que pueden ser atacados por la respuesta inmune humoral del hospedador y por las enzimas digestivas. La aparición de los poros, coincide con el momento del ciclo en que ocurre la expulsión temprana de los vermes del intestino mediada por la inmunidad desarrollada en el hospedador, sugiriendo que las células mencionadas son la fuente de irritantes antigénicos que inician o contribuyen a los mecanismos de expulsión (Kozek, 2005) Las larvas L2 machos, que empiezan a observarse después de la primera muda que ocurre a las 8 horas p.i. tienen cutícula gruesa con estriaciones. A menudo aparece como formada por dos capas, siendo la más interna delicada y granular. En este estadío se hacen visibles los apéndices copulatorios como dos saliencias cerca del orificio rectal (Kozek, 1971). Las L2 futuras hembras muestran los primordios vaginal y uterino conectados. Puede verse una banda hialina en el centro del primordio vaginal que puede interpretarse como la futura cavidad (Kozek, 1971). Larvas de tercer estadío (L3): Las L3 futuros machos abandonan una vaina más fina que la de la primera muda y sin estriaciones trasversales. Los apéndices copulatorios son de mayor tamaño, llegando a los 12 µm. Hacia medial de los apéndices copulatorios se ven dos papilas tuberculadas. El primordio de vesícula seminal se extiende hacia el recto y ambas estructuras se unen a través de una célula genital de conexión (Kozek, 1971).
12 12 Las L3 futuras hembras tienen vagina totalmente desarrollada aunque no evidente. Larvas de cuarto estadio (L4): La tercera vaina abandonada por los futuros machos es también fina y a diferencia de la segunda, muestra el contorno de los apéndices copulatorios. Las L4 muestran las papilas tuberculadas con mayor tamaño (2 µm) pero los primordios de vesícula seminal y recto todavía no se unen (Kozek, 1971). Las L4 futuras hembras tienen un orificio genital bien visible y la vagina forma un tubo corto que se dirige hacia atrás hasta la célula de conexión genital del primordio uterino (Kozek, 1971). La vaina abandonada por las L4 tiene el contorno de los apéndices copulatorios y de las papilas tuberculadas de mayor tamaño que la vaina anterior (Kozek, 1971). Los futuros machos muestran un par de papilas cónicas por dentro de los apéndices copulatorios y en medial y ventral de las papilas tuberculadas. Los apéndices copulatorios primero se vacuolan y finalmente aparecen vacíos. Se observa la unión de la vesícula seminal con el recto, posibilitando la salida de los espermatozoides (Kozek, 1971). Las futuras hembras muestran una disminución en el diámetro de la vagina. La cutícula aparece abultada alrededor del orificio genital que está cerrado. La célula de conexión genital desaparece y en su lugar, se ve una abertura que conecta la vagina con el útero (Kozek, 1971). El macho tiene de 1.4 a 1.6 mm de longitud, y un diámetro de 40 a 60 µm. El testículo tiene un tramo ascendente, luego desciende y forma el conducto deferente, una vesícula seminal y un conducto eyaculador que desemboca en un tubo copulatorio dentro de la cloaca. La protrusión del tubo copulatorio a través de la abertura cloacal situada entre los apéndices copulatorios, forma la campana copulatoria. Los apéndices mencionados actuarían fijando a la hembra durante la cópula. Entre los apéndices hay dos pares de papilas con función sensorial. (Wu, 1955; Martínez Fernandez, 2002; Despommier y Campbell, 1983; Burnham & Despommier, 1984) La hembra mide 3 mm de largo y 36 µm de diámetro. El esticosoma ocupa el tercio anterior. El sistema reproductor consiste en un solo ovario, oviducto, receptáculo seminal, útero y vagina. Es voluminoso, llenando la casi totalidad de la cavidad corporal por detrás del esticosoma. La vulva desemboca a la altura de la mitad del esticosoma. Los huevos evolucionan a larvas en el interior del útero. Así, la parte posterior del útero, está ocupada por huevos de 30 µm de diámetro en tanto que la parte anterior contiene embriones. (Wu, 1955; Martínez Fernández, 2002; Despommier y Campbell, 1983). A diferencia de las larvas musculares liberadas del quiste por digestión enzimática, los adultos de T. spiralis puestos en solución salina isotónica presentan movimientos serpenteantes y responden a gradientes de temperatura. Se desconoce si esta capacidad de responder a estímulos térmicos es importante para el cumplimiento del ciclo biológico (Despommier, 1973) Las larvas recién nacidas tienen un largo promedio de 111 µm, el diámetro es de 7 µm en su extremo anterior y se va afinando hasta los 3 µm,
13 13 en el extremo posterior. El extremo anterior es redondeado con una indentación terminal que representa la boca. Tiene una estructura de estilete bucal con movimientos de protrusión y retracción. Detrás de la boca hay un bulbo esofágico pobremente diferenciado que se afina hacia posterior y se une a una columna de núcleos correspondientes a células no diferenciadas (Ali Khan, 1966). Con ayuda de microscopía electrónica, microscopía de rayos X y confocal, se pudo determinar que existe un primordio de esticosoma en el que se diferencian los esticocitos con sus gránulos típicos. No se detecta el intestino pero sí un primordio genital marcado. (Kozek y col., 1998) 1.4 Ciclo Biológico Nomenclatura de los estadíos de T. spiralis (Adaptado de Kozek (1971) y Despommier (1983) Estadío Larva I Infectiva del intestino Localización en el hospedador Presencia durante el ciclo biológico Sinónimos Entérica 0 a 9 horas p.i. Larva muscular, larva infectiva, juvenil Larva II Entérica hs. p.i. No tiene Larva III Entérica hs. p.i. No tiene Larva IV Entérica hs. p.i. No tiene Adulto Entérica 31 hs. hasta días, semanas o meses p.i. según las características del hospedador. Larva I Recién nacida infectiva del músculo Larva I Migratoria infectiva del músculo Larva I Preinfectiva del intestino Larva I Infectiva del intestino Entérica Parenteral Muscular Muscular Desde el día 5-6 p.i. y mientras duren las hembras adultas en el hospedador. Desconocida. Probablemente No mayor de 1 día. 0 a 15 días luego de entrar a la célula muscular Desde los 16 días posteriores a su entrada en la célula muscular hasta 30 años. No tiene Prelarva, embrión Larva migratoria Larva muscular inmadura, juvenil Larva muscular, larva infectiva, juvenil
14 14 Todos los estadios del ciclo biológico de T. spiralis se encuentran en un mismo hospedador. El ciclo puede dividirse en dos fases: una que ocurre en el músculo, en la que el nivel de diferenciación sexual alcanzado es comparable al de una larva de quinto estadio de otros nematodos o preadulto; la otra en el intestino, donde hay cinco estadíos separados por 4 mudas sucesivas. La generalidad de las larvas de nematodos atraviesa cuatro mudas para llegar al estadío adulto. En un principio, debido a los cambios de tamaño observados en la larva de T. spiralis en el músculo del hospedador, se pensó que los mismos implicaban mudas, de modo que no se tenía seguridad acerca de qué estadio del ciclo era el que correspondía a la larva infectiva que queda libre de su cápsula por la digestión. Los trabajos de Ali Khan en 1966 y Kozek en 1971a y b determinaron que las cuatro mudas ocurrían en el intestino del hospedador; en tanto que la evolución de la larva en el músculo no incluía mudas, no obstante poderse reconocer un estadio temprano y un estadio tardío en el que ya existen vestigios de diferenciación sexual, que inducían al error de comparar este estadio con la larva de quinto estadio (o preadulto) de otros nematodos Fase Gastroentérica: Cuando se infecta experimentalmente a ratas con larvas de T. spiralis, en el término de una hora las larvas penetran en la mucosa del intestino (Gursch, 1949). Las larvas liberadas por la digestión estomacal, penetran en la capa de células epiteliales columnares que cubren las vellosidades intestinales, ocupando aproximadamente 100 células contiguas sin destruirlas (Wright, 1979) Los machos comienzan sus mudas y completan su desarrollo antes que las hembras. La última muda ocurre a las 25 hs. post inoculación en los machos y a las 28 hs. p.i. en las hembras. Las primeras hembras fecundadas se observan a las 30 hs. p.i. (Kozek, 1971 a; Gardiner, 1976) Las hembras pueden ser fecundadas en más de una oportunidad y cada macho puede inseminar al menos a cuatro hembras (Gardiner, 1976) El crecimiento se da en longitud pero no en diámetro debido a que el incremento en este sentido destruiría el nicho intramulticelular que protege al parásito. Los estadios inmaduros y los adultos se mueven a través de la capa de células epiteliales, pueden salir al lumen del intestino y volver a entrar en el epitelio. Por esta razón puede considerarse que tanto en el músculo como en el intestino, Trichinella spp. es un parásito tisular (Wright, 1979). El número de larvas que cada hembra deposita depende de su permanencia en el intestino y esta característica varia con la especie del hospedador. En el cerdo infectado experimentalmente la postura de larvas se inicia hacia el día sexto post infección y dura hasta el día 20 (Martínez Fernandez, 2002; Despommier y Campbell, 1983). Entre la 3 y las 5 semanas post inoculación se produce una remoción de los vermes adultos del intestino.
15 15 Esta expulsión va acompañada de una reversión en la relación hembra: macho de la población que pasa de 2 : 1 a 0 : 1 (Campbell y Cuckler, 1966). En los múridos de experimentación, el período de postura de larvas es más corto pues ocurre un proceso inflamatorio que produce la expulsión de las hembras adultas. Así, en las ratas, la mayor proporción de la postura (75%) ocurre entre el 6to. y el 7mo. día p.i. A partir del noveno día los vermes adultos empiezan a desaparecer del intestino y esta desaparición se completa hacia el día 16 post infección (Gursch, 1949) (Love y col, 1976). El pico de producción de larvas recién nacidas ocurre en el día 7 p.i. cuando la fecundidad de las hembras es máxima. Después del día 8 p.i. la fecundidad disminuye, lo que se refleja en una caída brusca en el número de larvas circulantes en sangre y linfa (Wang, 1987). En ratas jóvenes, inoculadas a los 21 días de edad, el período de expulsión total ocurre entre los días 21 y 28 post inoculación. En ratas en lactación, Love y col., 1976 hallaron que un 65% de los vermes no habían sido expulsados aún en el día 21, mientras que ratas similares que no amamantaban, se habían desprendido de todos los vermes en el día 15 post inoculación. Diversos autores, inoculando ratas con una larva de cada sexo o implantando una hembra grávida en el intestino, midieron la cantidad de larvas producidas por cada hembra, esperando su desarrollo en los músculos y recuperándolas por digestión enzimática. Mediante estos procedimientos, establecieron que cada hembra puede poner entre 200 (Gursch, 1949) y 1100 larvas (Nolf, 1937). En cobayos, la presencia de adultos en el intestino se mantiene por 4 a 5 semanas, obteniéndose entre 1000 y 2500 larvas por cada hembra. (Roth 1938) Fase Parenteral: Las larvas recién nacidas son puestas en el interior de la vellosidad intestinal, penetran en los capilares linfáticos y portales y son arrastrados por la circulación hacia toda la economía corporal. (Martínez Fernandez, 2002; Despommier y Campbell, 1983). Es importante que las larvas recién nacidas sean puestas en el interior de la vellosidad. Si experimentalmente se implantan larvas recién nacidas en la luz del duodeno, ninguna llega al tejido muscular. La infectividad es máxima cuando se inoculan por vía intravenosa (73%) y es mucho menor (9%) cuando se inoculan por vía intraperitoneal (Dennis y col., 1970). En ratones infectados experimentalmente, las primeras larvas recién nacidas pueden recuperarse del torrente sanguíneo a las 120 horas post infección (Ali Khan, 1966). El 97% de las larvas penetran en los capilares sanguíneos directamente en el intestino siendo cuantitativamente más importante esta vía que la linfática. Inyectando un número conocido de larvas en la circulación y muestreando la sangre a intervalos, se determinó que el 75% de las larvas migra fuera del torrente sanguíneo dentro de las primeras tres horas (Wang, 1997).
16 Hasta un 40 % de las larvas que llegan por primera vez al tejido muscular puede volver a la circulación y entrar en otros tejidos y en los músculos nuevamente (Despommier y col., 1975). Las larvas que pasan desde el intestino a la cavidad peritoneal, tienen menos posibilidades de entrar en la circulación sanguínea. Solamente el 0.5% de las larvas que llegan al músculo, provienen de la cavidad peritoneal (Wang, 1997) (Dennis y col, 1970). Las larvas que llegan al músculo estriado, invaden las miofibrillas y cada célula invadida se transforma en una célula nodriza donde la larva desarrolla hasta su estadío infectivo y puede permanecer viable durante años. La larva que penetra en un tejido distinto al músculo estriado, no puede inducir la formación de su célula nodriza y no continúa su desarrollo. (Despommier, 1983) Esta transformación de la célula hospedador, inducida por la larva de T. spiralis mediante la secreción y excreción de las sustancias producidas por las células componentes de su esticosoma, es la razón por la que este parásito es considerado como uno de los más exitosos simbiontes intracelulares que se conocen. Los cambios, le permiten perdurar viable por años, en un microambiente que él mismo ha modificado, sin provocar la muerte de la célula hospedador. Esto, sumado a la posibilidad de sobrevivir en anaerobiosis una vez producida la muerte del animal parasitado, asegura que la larva permanezca infectiva en la carroña durante varias semanas, a pesar de la putrefacción, manteniendo la enfermedad dondequiera que haya animales omnívoros de la fauna silvestre o animales domésticos criados sin restricciones alimentarias (Despommier, 1998). Los cambios que se han descripto en la célula muscular durante su transformación en célula nodriza son los siguientes: Durante los 4 o 5 primeros días de la invasión, se produce la división nuclear y la replicación del ADN resultando en una cantidad de ADN 4 veces mayor a la normal y en aproximadamente 40 a 60 núcleos por célula. (Despommier, 1991). A partir del 5nto día de la invasión y extendiéndose durante todo el período de infección, se observa daño mitocondrial expresado como vacuolización de la matriz más interna. Ocho días después de la invasión, la célula ha perdido todas sus proteínas contráctiles. No se detecta actina, miosina ni creatina kinasa. (Despommier, 1998). A partir del día 7 de la invasión, se inicia la síntesis del ARNm para síntesis de colágeno tipo IV que va a aparecer en el día 11 y va a cesar de sintetizarse en el día 26. La síntesis de ARNm para la formación de colágeno tipo VI se inicia en el día 7 y continúa a bajo nivel durante todo el período de infección. (Polvere y col., 1997) La síntesis de ARNm para la producción del factor de crecimiento del endotelio vascular se inicia en el día 7-8 y eso lleva a la formación de una red vascular que rodea a la célula nodriza iniciando su formación a partir del día 12 y completándose en el día 26 (Despommier, 1998). 16
17 Epidemiología La triquinelosis por T. spiralis es una enfermedad endémica en Argentina. Entre 1990 y 2006 se registraron oficialmente 8806 casos clínicos en personas, en tanto que en porcinos se han detectado en el periodo 1999/2006, 767 focos (Caracostantogolo y col., 2007) A los fines de explicar el flujo de la infección por Trichinella spp. en la naturaleza se han diferenciado tres ciclos biológicos: el doméstico, el sinantrópico y el silvestre (Pozio, 2000). En el ciclo doméstico, los hospedadores son especies animales omnívoras criadas como fuentes de alimento para el hombre: el cerdo y el caballo El cerdo como fuente de infección: En el ciclo doméstico, la infección se mantiene mediante el consumo de carroña, la alimentación con residuos crudos de faena y el canibalismo. Hanbury y col, 1986 estudiaron la prevalencia de triquinelosis en un criadero de cerdos durante 12 años, encontrando que la permanencia de la transmisión se debía a canibalismo. Expusieron cerdos libres de triquinelosis a contacto con roedores y con fauna silvestre durante un año sin lograr que se infectaran. Una forma de transmisión reportada experimentalmente en cerdos, pero cuya frecuencia se desconoce en condiciones naturales es el consumo de materia fecal de animales recientemente infectados (Spindler, 1953; Schurrenberger y col., 1964) Se ha descripto la presencia de larvas en la cola de cerdos con triquinelosis y se ha propuesto que el canibalismo de la cola, un hecho frecuente entre los cerdos, podría ser una vía de diseminación de la enfermedad (Smith, 1975) pero aún no se ha evaluado la importancia de esta fuente de infección en la epidemiología general de la enfermedad (Handbury y col., 1986). Los cerdos criados en explotaciones familiares y de subsistencia o en criaderos comerciales con manejo rudimentario, frecuentemente alimentados con residuos sin cocción previa, con acceso a restos de faena o a cadáveres de cerdos que no se eliminan adecuadamente, son los hospedadores que mantienen el ciclo doméstico (Pozio, 2000; Bolpe y col., 2001) La alimentación de los cerdos con residuos recolectados en domicilios y en comercios o industrias carneas, es una práctica corriente entre los tenedores de cerdos para subsistencia en Argentina. (Verdier, 2007) Si la prevalencia de la enfermedad en cerdos es alta, el problema no tarda en hacerse visible; ya sea porque los cerdos positivos son detectados en frigoríficos que efectúan el diagnostico por digestión enzimática o porque, luego de la faena domiciliaria, la carne es utilizada para preparar chacinados salados sin cocción que dan lugar a brotes de triquinelosis en las personas que los consumen. (Caracostantogolo y col., 2007) La característica de sobrevivencia por años de las larvas musculares sumada a la imposibilidad de detectar signos clínicos en los cerdos tornan dificultoso el control de la enfermedad y la explicación de la causa de los focos. En ocasiones, los animales afectados son padrillos o hembras destinadas a la reproducción durante varios años y se descubre su condición cuando son llevados a faena en frigoríficos que hacen el diagnóstico post
18 mortem por digestión enzimática. Cuando esto ocurre, para las normas sanitarias, la situación constituye un foco y hay que proceder a hacer una faena controlada del resto de animales que componen el criadero hasta despoblarlo. Las condiciones ambientales y de manejo sanitario en ese momento pueden ser distintas de las que existían en el momento en que se produjo la infección (Steffan, 2006). En repetidas ocasiones, cuando se ha llevado a cabo la faena compulsiva de todos los cerdos de un criadero en que se produjo un foco, el diagnóstico por digestión enzimática realizado post mortem en el laboratorio de la planta de faena da resultados negativos para todos los cerdos (Dela Sota, 2005). Hoy, con la utilización de las técnicas serológicas, más sensibles que la digestión enzimática, podemos explicar esta situación diciendo que esos resultados no indican que el establecimiento no está infectado sino que el nivel de infección no es detectable por la técnica de digestión enzimática y la carne puede librarse cruda al mercado sin peligro para los consumidores. (Ruiz y Morici, 2008). En municipios pequeños, la disposición de los residuos domiciliarios recolectados se lleva a cabo en basurales no cercados. Las condiciones sociales desfavorables llevan a que los tenedores de cerdos cercanos a esos basurales, alimenten sus animales dejándolos libres en el lugar sin oposición eficiente de las autoridades municipales (Dela Sota, 2005). En estas condiciones, los animales comen todo cuanto pueden y es difícil controlar el número de cabezas y el estado sanitario de las mismas. Si alguno de los cerdos muere, sirve de alimento para el resto. Si el cerdo muerto alberga larvas de T. spiralis en sus músculos, será fuente de infección para todos los que lo consuman y para los roedores y otros carroñeros del lugar. (Steffan, 2006) En las zonas con baja temperatura, en un intento por conservar alimentos a bajo costo para asegurar la subsistencia familiar o por mantenimiento de tradiciones familiares, se preparan salazones de carne de cerdo (jamón, bondiola) o embutidos con una mezcla de carne de cerdos y de bovinos (chorizos secos, salame). El proceso posterior a la elaboración, consiste en dejar que los embutidos maduren por efecto de la sal y los condimentos, colocándolos en un ambiente fresco y seco durante varios meses (Ribicich, 2002). Si la carne de cerdo utilizada tiene larvas de T. spiralis, este proceso no elimina su infectividad (Gamble, 2000). En muchos casos, los embutidos infectados que pueden enfermar a las personas, son consumidos solamente por el propietario y su familia originando un brote reducido. En situaciones más graves, los embutidos se consumen en un festejo con muchos invitados o se comparten con familiares o amigos que pueden o no vivir en la misma zona, produciendo un brote más amplio y difícil de manejar, con enfermos que pueden no llegar a enterarse a tiempo sobre la causa de su malestar. Cualquiera sea el caso, el consumo ocurre varios meses después de la elaboración y en ocasiones los animales utilizados no son originarios del lugar donde se los terminó de criar, de modo que no se puede tener la seguridad sobre cuál fue el lugar en que los cerdos se infectaron. Cuando aparecen personas enfermas, las autoridades de salud tratan de establecer la fuente de la infección siguiendo el rastro, en sentido inverso, de los productos consumidos por los enfermos. Es frecuente que cuando se 18
19 19 llega al presunto lugar de origen de los animales utilizados en la elaboración, ya no haya cerdos o que los cerdos hallados no tengan propietario (Steffan, 2006). Los cerdos criados en forma comercial, en ambientes aislados del medio exterior y alimentados con granos o alimento balanceado presentan muy baja incidencia de la enfermedad. En Argentina, menos del 0,1% de los cerdos criados en estas condiciones dan resultado positivo a la técnica de digestión artificial post faena que se lleva a cabo en los frigoríficos con habilitación nacional (SENASA, 2006). Recientemente, un relevamiento serológico llevado a cabo por el SENASA y el INTA (Ruiz y col., 2008) utilizando las técnicas de ELISA y Western Blot con antígeno de ES elaborado por el Área de Enfermedades parasitarias del Instituto de Patobiología del CICVyA INTA Castelar, permitió estudiar la infección por T. spiralis en 2254 sueros provenientes de criaderos de tipo familiar y para subsistencia en las provincias de Buenos Aires, La Pampa, San Luis, Córdoba, Santiago del Estero, Entre Ríos y Santa Fe. La edad de los animales muestreados fue de 6-12 meses y los niveles de positividad variaron del 1.1 al 5% según las localidades. Este tipo de relevamientos permite detectar zonas donde T. spiralis está presente y es importante para promover la mejora de las condiciones de cría y sanidad de los cerdos y para intensificar la aplicación de los controles post faena de la carne por digestión enzimática con el objeto de evitar la enfermedad en la población humana El caballo y la forma en que se infecta: En los países en que se crían para consumo humano, en la etapa previa a su comercialización, los caballos reciben un suplemento alimentario basado en carne y grasa de cerdo. Esta es una de las formas en que los caballos adquieren la infección y pueden transformarse en fuente de contagio si su carne se utiliza para la preparación de comidas que se consumen sin cocción. (Murrell, 2006) En Argentina fue reportado un brote de triquinelosis presuntamente debido a consumo de carne de caballo (Troncoso y col., 2002). Los tres afectados habían robado y sacrificado un caballo y comieron su carne luego de una cocción que la dejó jugosa. El suero de uno de ellos dio resultado positivo a las técnicas de ELISA y Western Blot. No pudo ser demostrada la existencia de larvas de T. spiralis en la carne porque el resto no consumido fue vendido por los afectados a otras personas como carne de bovino. El trabajo no describe adecuadamente la metodología empleada ni provee datos que permitan asociar el malestar de los afectados al consumo de carne de caballo infectada con Trichinella spp. mas allá de una presunción El papel de la rata en la transmisión: Las ratas pardas ( Rattus norvegicus) forman parte del ciclo doméstico y del sinantrópico de la enfermedad y se infectan a partir de las mismas fuentes que los cerdos (Stojcevic y col., 2004). En las décadas de 1940 y 1950, en Estados Unidos de Norteamérica y Canadá se llevaron a cabo numerosos estudios para conocer la prevalencia en cerdos y en ratas (Anónimo, 1940; Wright 1943; Moynihan, 1949; Frank, 1951; Poole, 1952). Se encontró que la incidencia en cerdos era mayor en los
20 criaderos que alimentaban con desechos de faena o con residuos crudos. La prevalencia en ratas fue mayor en los criaderos que tenían cerdos infectados que en los que no tenían. También fue alta en ratas capturadas en plantas de faenas de cerdos en las que los restos de vísceras quedaban al alcance de los roedores. De esta manera se llegó a la conclusión que la triquinelosis en las ratas era dependiente de la enfermedad en los cerdos y que la incidencia en ratas podría ser considerada como una indicación de la prevalencia en los cerdos que se criaban vecinos al lugar donde las ratas eran capturadas (Poole 1952; Leiby y col.,1990). Los hallazgos en fauna sinantrópica siguen este mismo patrón. Se estudió la prevalencia de triquinelosis en ratas y en comadrejas capturadas en una zona de granjas avícolas de la provincia de Buenos Aires, en la que no existían cerdos enfermos y se encontró que ninguna de las poblaciones estaba infectada (Gómez Villafañe y col., 2004). Un estudio llevado a cabo sobre la población de ratas de un criadero de cerdos permitió determinar que sobre una muestra de 440 ratas tomada a lo largo de 25 meses, el 42.4% se hallaba infectado por T. spiralis (Leiby y col., 1990). Aún en ausencia de una fuente conocida de carne infectada (basura con restos de carne o animales muertos infectados), la infección se mantenía en la población de ratas, probablemente por canibalismo. La reducción de la población de ratas, por aplicación de medidas de control, produjo una disminución de la prevalencia. Por esta razón es aconsejable llevar a cabo un control de roedores en criaderos donde existe la enfermedad en los cerdos o en aquellos que se repueblan con cerdos sanos después de haberse producido un foco (Leiby y col., 1990) Por otra parte, una investigación de la epidemiología de la enfermedad en ratas pardas y en cerdos llevada a cabo en Croacia estableció que las ratas no eran un reservorio en las granjas. Se estudiaron 2287 ratas en 60 granjas hallándose que sólo había ratas infectadas donde había cerdos infectados y el manejo sanitario era deficiente. Este hallazgo sugiere que en las condiciones del área estudiada, la rata era una víctima del manejo inapropiado de los restos de faena o de la deficiente eliminación de los cadáveres de los cerdos más que un reservorio de la enfermedad (Stojcevic y col., 2004) Existen reportes sobre la posibilidad de transmisión congénita experimental de T. spiralis en roedores (Cui y col., 2004). Este podría ser un modo más en que la infección podría mantenerse en la población de ratas, lo que se sumaría al canibalismo de individuos infectados que mueren por cualquier causa (Leiby y col., 1990). En las colonias de ratas, son frecuentes las luchas por jerarquía o por territorio. Si bien estas se detienen mucho antes de la muerte de alguno de los contendientes, los sucesivos encuentros, sumados a las enfermedades, reducen la longevidad de los individuos (Coto, 1997). Generalmente la muerte de los individuos ocurre dentro de los túneles de la madriguera. Los cadáveres son comidos por el resto de las ratas, como se puede inferir del hecho que contraen algunas parasitosis (capilariosis) que sólo se transmiten por ingestión de músculos o de vísceras (Leiby y col., 1990). La enfermedad en los roedores puede afectar su capacidad reproductiva. Los ratones machos infectados con T. spiralis tienen menor actividad y pueden perder la conducta dominante en encuentros agresivos 20
21 21 con machos no infectados (Rau, 1983; Rau, 1984). Las crías de ratón provenientes de madres infectadas, no obstante no haber sido infectadas en el útero ni por amamantamiento, en el momento del destete son significativamente más livianas y de conducta más susceptible a la predación que las camadas provenientes de madres sanas (Rau, 1985). Esto se debe a que las madres afectadas, reducen su actividad física y por consiguiente el cuidado de las crías. En regiones productoras de cereal donde además exista una alta prevalencia de triquinelosis en los cerdos, los cadáveres de roedores infectados podrían contaminar los cereales, causando focos de triquinelosis en criaderos bien manejados y situados a mucha distancia del lugar en que se encuentren los roedores infectados (Oivanen y col, 2002) El ciclo silvestre: Los animales predadores o carroñeros como los zorros, comadrejas, vison, mapaches, zorrinos y armadillos, participan en el ciclo silvestre de la enfermedad. Este ciclo varía en cuanto a las condiciones ambientales en que se desarrolla la vida de los hospedadores y a las que se han adaptado algunas especies de Trichinella spp. para persistir. Así, hay un ciclo silvestre selvático, polar, marino, etc. donde diversas especies de Trichinella spp. se han adaptado a mamíferos, reptiles y aves, así como a resistir bajas temperaturas y temperaturas altas en que la putrefacción de los músculos ocurre rápidamente (Pozio 2000) En los países en que el ciclo doméstico ha disminuido su importancia debido a medidas de manejo que proveen carne segura para el consumo humano, el hombre enferma a partir de la ingestión de carne de animales silvestres obtenidos como presas de caza (Murrell, 2006) Entre los hospedadores que componen el ciclo silvestre, la infección se mantiene por predación o por consumo de carroña. En los sitios aislados de los centros poblados, las especies de Trichinella spp. que afectan a los animales silvestres han evolucionado, adaptándose a los mismos hasta convertirse en especies diferenciables. Cuando los animales silvestres se acercan a los poblados, se infectan con las especies de Trichinella spp. propias del ciclo doméstico (T. spiralis, T. britovi) y esto ocurre porque predan a animales sinantrópicos (perros, gatos, comadrejas, ratas). De esta manera, los hospedadores que componen el ciclo sinantrópico, actúan como nexo para la infección de los hospedadores del ciclo silvestre (Pozio, 2000; Pozio 2005; Steffan, 2006; Murrell, 2006) Otra fuente de infección para los animales silvestres son los desechos de carne cruda eliminados como residuos domiciliarios, de actividades de campamento o de industrias alimentarias. (Murrell y col, 1987; Murrell, 2006; Pozio y Murrell, 2006). Un estudio llevado a cabo en Pennsylvania, muestreando 6 especies de animales utilizados en peletería, permitió determinar que todas ellas podían estar infectadas por larvas de T. spiralis. Se hallaron prevalencias de 2.6% en mapaches, 2.9% en comadrejas, 6.7% en zorros grises, 15% en
22 22 zorros colorados, 3.9% en zorrinos y 5.9% en visones (Schad y col., 1984). Las carcazas de los animales de peletería, frecuentemente quedan en el terreno y pueden ser fuentes de infección para otros carroñeros silvestres o domésticos. Cuando la carne de los animales de peletería se emplea como alimento humano, en general, las preparaciones son sometidas a cocción prolongada, por lo que no constituyen riesgo (Schad y col., 1984). En un muestreo llevado a cabo en la provincia de Buenos Aires para detectar la presencia de larvas de Trichinella spp. en músculos de animales autóctonos, se halló una prevalencia de 46.6% en peludos (Chaetophractus villosus) en tanto que no se hallaron larvas en zorros ni en comadrejas (Huici y col., 1999). 1.6 Signos clínicos en las personas En los casos leves, el diagnóstico en base a los síntomas clínicos en las personas es muchas veces erróneo, debido a la presencia de síntomas similares a los de otras enfermedades que ocurren con mayor frecuencia. Así, el edema palpebral se diagnostica como conjuntivitis; los trastornos intestinales como una indigestión y los dolores musculares se relacionan a una gripe. En Canadá, pacientes que con posterioridad resultaron enfermos de triquinelosis, fueron admitidos en hospitales con diagnósticos iniciales de: apendicitis, úlcera gástrica, encefalitis, peritonitis, erisipela, tétanos, conjuntivitis, fiebre escarlata, hipotensión, paperas, envenenamiento con plomo, miocarditis, bronconeumonía, sarcoma, alcoholismo, reumatismo, fiebre tifoidea, gastroenteritis, colitis, influenza, fiebre ondulante, infección respiratoria alta, asma, poliomielitis, meningitis, nefritis, enfermedad inflamatoria pélvica, edema angioneurótico, neuritis periférica, sífilis, artritis, cólera, malaria, sinusitis, endocarditis (Cameron,1937) Cuando aparecen pacientes con síntomas agudos, se encuentra eosinofilia marcada en pruebas de laboratorio y se hace el diagnóstico serológico que permite confirmar anticuerpos contra T. spiralis, los sistemas sanitarios dan por sentado que existe un brote y comienzan a relacionar los cuadros de sintomatología similar, ocurridos en la zona. Es de gran importancia el diagnóstico certero de los primeros casos del brote pues son los activan un estado de alarma en los servicios de salud (Teixeira, 2006). La primera semana de la fase entérica, con infecciones moderadas a severas, está asociada con dolor en la zona superior del abdomen, diarrea o constipación, vómitos, malestar y elevación leve de la temperatura. Todos estos síntomas pueden variar en intensidad y duran unos pocos días. El cuadro clínico es similar al de cualquier desorden intestinal y puede ser fácilmente confundido. Cuando los síntomas se tornan más preocupantes, al comienzo de la fase parenteral, los afectados acuden al médico (Capó y Despommier, 1996) Todos los signos y síntomas de la fase parenteral, están relacionados con la penetración indiscriminada de los tejidos, por las larvas recién nacidas. En las infecciones moderadas ocurren: mialgia difusa, un estado similar a la parálisis, edema periorbital o facial, conjuntivitis, fiebre, cefalea, erupción dérmica, dificultad para deglutir o para abrir la boca, insomnio, pérdida de peso, parestesias, acaloramiento, secreción nasal, disfonía, bronquitis,
23 23 hemorragias en línea en la matriz de las uñas o en la retina, disturbios visuales y parálisis de los músculos oculares. Los pacientes con infección severa pueden desarrollar manifestaciones neurológicas hacia el fin de la segunda semana: cefaleas, vértigos, acufenos, afasia, convulsiones y parestesias. Generalmente, los pacientes están alertas pero apáticos y el insomnio prolongado los torna irritables. El daño difuso del tejido cerebral por oclusión de las arterias o por inflamación granulomatosa puede dar síntomas de meningitis, encefalitis o hemiplejía (Capó y Despommier, 1996). Los porcentajes de presentación de síntomas en la fase aguda de la enfermedad, son: fiebre (87-94% de los pacientes), dolor abdominal (32%), nauseas (26%), diarrea (40-52%), eosinofilia (90%), mialgias (85-95%), cefalea (42-81%), edema facial (54-95%), debilidad y malestar (73%), hemorragia subconjuntival (65%), Erupción dérmica (21%), Tos (17%), Vómitos (10%), Dolor pectoral (5%), Disfagia (3%), Acortamiento de movimientos respiratorios (2%), Hemoptisis (2%) y anticuerpos anti- Trichinella (64%) (Calcagno y col., 2005; Lazarevic y col, 1999). Durante la fase crónica a 3 años de la infección, se observaron: mialgia (72%), alteraciones visuales (22%), desórdenes gastrointestinales (31%) y la persistencia de anticuerpos (77%) (Calcagno y col., 2005). La muerte puede ocurrir entre la tercera y la quinta semana postinfección, debido a fallo cardíaco o fallo en el sistema nervioso central (Pawlowski, 1983). Las infecciones por bajo número de larvas en humanos, frecuentemente pasan inadvertidas, convirtiéndose en hallazgo de autopsias que pueden utilizarse como un dato más de la presencia de la enfermedad en la población (Sawitz, 1937; Butt y Lapeyre,1939; Wright,1939; Cristea y col., 2004) 1.7 Hallazgos de laboratorio: En la fase temprana de la enfermedad, es común una leucocitosis de a células por mm 3 con un predominio de eosinofilos circulantes entre 1400 y 8700 por mm 3 (Brown, 1898). La eosinofilia es el hallazgo de laboratorio más temprano y característico de la triquinelosis y está relacionado con la intensidad de la infección. Aún en los casos asintomáticos, la eosinofilia alcanza niveles de 5 a 15% de los leucocitos, pudiendo llegar al 62 % en casos graves (Teixeira, 2006) Una caída brusca en el porcentaje de eosinófilos circulantes a 1% o 0 puede ser indicación de una infección severa e incluso, señalar el comienzo de la muerte del paciente (Capó y Despommier, 1996) Solamente el estadio adulto de Trichinella spp. promueve la eosinofilia. El nivel de este parámetro es máximo durante las tercera y cuarta semana post infección y se estabiliza en ese momento (Brown, 1898). Estas células infiltran la porción infectada de tejido intestinal y se localizan en las adyacencias de los vermes adultos y entran en el tejido muscular dañado luego que las larvas recién nacidas penetran en él. No se conoce que rol juegan estas células en la infección de los humanos con este parásito (Capó y Despommier, 1996).
24 24 Otro hallazgo de laboratorio positivo es una elevación en los niveles circulantes de enzimas musculares (ej. Creatinina fosfokinasa, 1,6- difosfofructoaldolasa, lactato dehidrogenasa, aldolasas y aminotransferasas (Teixeira, 2006). Pueden estar elevadas en 35 a 100% de los individuos infectados y están presentes en el suero debido a la destrucción del tejido muscular por las larvas migratorias recién nacidas (Capó y Despommier, 1996) 1.8 Signos Clínicos en los cerdos Campbell y Suckler (1966) no hallaron signos clínicos en cerdos inoculados con larvas por kg de peso vivo. No hubo aumento de la temperatura, ni disminucion en la ganancia de peso comparada con la de un grupo control no inoculado. Solamente hallaron una moderada eosinofilia a partir del día 6 post inoculación que alcanzó picos de 18 a 41% entre los días 14 y 28 p.i. Ribicich y col (2007) inocularon grupos de 3 cerdos con dosis infectivas de 100, 500 y 5000 larvas de T. spiralis. Solamente en 2 de 9 animales infectados se observaron signos clínicos relacionables con la enfermedad: edema periorbitario, dificultades para caminar y problemas respiratorios. No se observaron alteraciones en la temperatura corporal ni en la frecuencia cardíaca. El experimento tuvo una duración de 100 días a partir de la inoculación. Desde el día 20 post inoculación (p.i.), la ganancia de peso en los grupos inoculados con 500 y 5000 larvas fue significativamente menor (P<0.05) que la de los animales del grupo control no inoculados. Entre el día 40 p.i. y el día 100 p.i., los animales inoculados tuvieron una ganancia de peso 10 a 15% menor que la del grupo control. 1.9 Patología T. spiralis produce lesiones en la mucosa intestinal, en la célula muscular estriada y en varios organos como corazón, hígado, bazo, ojos y sistema nervioso central que son afectados por las larvas invasivas. Las larvas que desarrollan hasta adultos en el intestino delgado producen lesiones en la mucosa, cuya gravedad aumenta con el número de larvas: desde pequeñas úlceras y ligeras hemorragias hasta edema, infiltración celular marcada y hemorragias profusas (Weatherly, 1983). El pico de la respuesta aguda del hospedador, ocurre 8 a 10 días post infección y dura hasta el día 14 p.i. con una intensa infiltración celular, con muchas células granulocíticas (hasta 50% de eosinófilos) así como células plasmáticas y linfocitos. Hacia el día 38 p.i., la estructura de los tejidos intestinales vuelve a la normalidad. Según Larsh y Race, 1975, existen asociaciones directas entre: El grado de sensibilidad del hospedador al desafio y la evolución en el tiempo, la intensidad de la inflamación y la expulsión de vermes. El tamaño del desafío y el grado de inflamación resultante La persistencia de los vermes en el intestino y la ausencia de la inflamación aguda característica. La inflamación resultante de la infección se debe no sólo al daño mecánico de las células y tejidos causado por los parásitos, sino también a la respuesta celular inmune específica del tipo de hipersensibilidad tardía. Esta respuesta inflamatoria, genera un ambiente desfavorable que provoca el paso
25 25 de los vermes desde los tejidos intestinales al lumen y su salida del organismo con la materia fecal (Larsh y Race, 1975). En el hombre infectado, los grupos de músculos donde se encuentran con mayor frecuencia las larvas enquistadas de T. spiralis, son: los músculos externos del ojo, los maseteros, músculos de la lengua y laringe, el diafragma, los músculos del cuello, los intercostales y los deltoides (Gould, 1970). En cerdos experimentalmente infectados, el músculo con mayor cantidad de larvas es el diafragma, seguido por la lengua, maseteros, musculos del cuello, deltoides, pectorales, abdominales, glúteo mayor y músculos del miembro posterior (Olsen y col., 1964) (Ruiz y col., 2005) Los músculos esqueléticos de los seres humanos infectados, comparados con los de los animales, manifiestan una degeneración grasa más severa, degeneración hialina, degeneración hidrópica, inflamación intersticial y una destrucción más frecuente de las larvas no encapsuladas (Gould, 1970) Diagnóstico en Medicina Veterinaria Existen métodos de diagnóstico directos e indirectos. Los resultados positivos de los primeros dependen del hallazgo de larvas musculares y su identificación por caracteres morfológicos en tanto que los métodos indirectos, sugieren la presencia de esas larvas en el hospedador a través de la detección de anticuerpos específicos mediante técnicas de serología (OIE, 2004) Los métodos de diagnóstico directo consisten en demostrar la presencia de larvas de primer estadío (L1) de Trichinella spp. en tejido muscular de hospedadores susceptibles o en alimentos crudos preparados con esa materia prima. Los análisis que se realizan en muestras de tejido muscular se limitan a la inspección post faena de las carnes utilizando las siguientes técnicas: Compresión o Triquinoscopía Digestión Artificial o Enzimática Los métodos directos pueden detectar larvas de Trichinella spp. en cerdos, equinos y otros animales susceptibles, tan temprano como a los 17 días post infestación. Este período coincide con el momento en que la larva muscular se hace infectiva para un nuevo hospedador ( Gamble y col., 2000) Técnica de compresión (triquinoscopía): Es un método antiguo que aún es utilizado en zonas donde no existen laboratorios con capacidad para practicar técnicas de digestión enzimática. El procedimiento consiste en la inspección óptica de muestras de tejido muscular (preferentemente diafragma) que se cortan en pequeños trozos en la dirección de las fibras y se colocan entre 2 vidrios gruesos que se comprimen desde los extremos mediante dos tornillos con tuerca mariposa, hasta quedar transparentes. Este compresor, se coloca en un microscopio de proyección denominado triquinoscopio o en un microscopio convencional que tenga un aumento de 40X, y se recorre cada uno de los trocitos comprimidos en busca de L1. Esta larva, aparece enrollada dentro de la fibra muscular y rodeada de una cápsula ovalada de aproximadamente 400 µm a la altura de su eje. Cuando el material examinado corresponde a un animal con nivel alto
26 26 de infección, se puede observar más de una larva dentro de un mismo quiste muscular. El Manual de estándares para las pruebas diagnósticas y vacunas de la OIE (OIE 2004) indica que para cada animal, se deben tomar 28 muestras de 2 x 10 mm, totalizando un peso de 0,5 g de los sitios de predilección, que en el cerdo son: diafragma, lengua y maseteros. Desventajas: Baja sensibilidad: el nivel de infección mínimo detectable es de 3 larvas por gramo de tejido analizado. Se necesita mayor tiempo para inspeccionar un número importante de muestras de cada carcasa, razón por la cual demoraría los resultados en establecimientos de faena. Pueden obtenerse resultados falsos negativos debido a la distribución irregular de los quistes en los tejidos y también por la posibilidad de encontrarse el animal muestreado en un estado inicial de la infestación, con quistes cuya cápsula es poco evidente. En las regiones del mundo en que se ha diagnosticado la presencia de T. pseudospiralis, T. papuae, y T. zimbabwensis, cuyos quistes no están rodeados de la cápsula de colágeno que facilita la detección de las larvas del resto de las especies de Trichinella spp., la práctica de la triquinoscopía es aún menos recomendable. La triquinoscopía y otros métodos similares de compresión no, son recomendados como exámenes de rutina en los alimentos de origen animal que van a ser destinados a consumo humano (Gamble y col., 2000); no obstante, la posibilidad de llevarla a cabo en zonas donde no existen laboratorios que hagan el diagnóstico por digestión enzimática, es mucho mejor que no realizar ningún diagnóstico (Murrel, 2006) Técnica de digestión artificial o enzimática: Es un método directo que permite el aislamiento, visualización y cuantificación de larvas de Trichinella spp. en trozos de músculo o en fiambres crudos elaborados con carne de animales susceptibles de padecer la enfermedad (Montali y col. 1997). La digestión enzimática trata de reproducir in vitro la digestión estomacal, con el objeto de liberar las larvas que pudieran hallarse dentro de quistes en el tejido muscular muestreado. La carne a diagnosticar, previamente molida, se sumerge en líquido de digestión compuesto por ácido clorhídrico y pepsina (ambos al 1%) en agua destilada. Luego de 30 a 45 minutos a 44 a 46 ºC con agitación continua, la cápsula es destruida y las larvas quedan libres. Éstas L1, son recuperadas mediante procesos de filtración y sedimentación y se observan al microscopio o triquinoscopio para su cuantificación, expresando el resultado como número de larvas encontradas por gramo de muestra (L/g) (Ruiz y col., 2007) Las larvas de Trichinella spp. miden aproximadamente 1 mm de longitud y 0.03 mm de ancho. La característica morfológica más distintiva es la presencia del esticosoma, una serie de células discoidales dispuestas alrededor del esófago, que ocupan la mitad anterior de la larva. Pueden tener diferentes apariencias:
27 27 enrolladas sin motilidad: cuando el medio líquido en el que se encuentran está frío. enrolladas con motilidad: cuando el medio líquido se lleva a 40 grados centígrados. en forma de C sin motilidad: se consideran larvas muertas. En caso de duda, los parásitos deben observarse a un mayor aumento y deberían examinarse mayor cantidad de tejidos (Gamble y col., 2000). La frecuencia con que las larvas están presentes en los músculos del cerdo naturalmente infectado, determinada por digestión enzimática (Cristea y col., 2004b), es la siguiente: músculos externos de la lengua (98%), diafragma (90%), intercostales (78%), miembro anterior (69%), músculos dorsales(45%), músculos del flanco (40%), músculos de las orejas (23%), musculos de la cola (17%). La cantidad de larvas por gramo (intensidad de infección) según la especie del hospedador, fue mayor en los siguientes músculos: Cerdos: músculos externos de la lengua y diafragma Jabalí: músculos externos de la lengua y diafragma Oso marrón: musculos de la lengua y masetero Rata: musculos de la lengua y masetero Ratón: músculos del flanco y masetero Zorro: músculos del ojo y del miembro anterior Perro: músculos profundos del cuello y miembro anterior (Cristea y col, 2004b) La sensibilidad de los métodos de diagnóstico directos depende de la cantidad de muestra de tejido examinado y del músculo del que fueron obtenidos. Para determinaciones de rutina por digestión artificial en áreas no endémicas, es recomendable utilizar 1 g de muestra por animal, pero es preferible utilizar 5 g por animal, sobre todo en áreas endémicas: con 1 g se obtiene una sensibilidad de 3 l/g de tejido, en cambio, procesando 5 gramos, la sensibilidad se incrementa a 1 L/g de tejido (Gamble, 1996; Gamble y col., 2000) La ingestión de carne con niveles de infección menores a 1 L/g no constituiría un peligro para los consumidores (Zimmermann, 1983) Toma de muestras para diagnóstico El tamaño de muestra puede variar. Se pueden tomar muestras individuales de hasta 100 g por animal. Las muestras, deben tomarse a partir de los músculos más frecuentemente infectados, según la especie animal. Los músculos recomendados por la Comisión Internacional de Trichinellosis (ICT) (Gamble y col., 2000) son los siguientes: Cerdos: pilares del diafragma (zona de transición entre la parte muscular y la tendinosa) o lengua. Caballos: lengua o músculos maseteros. Jabalí: músculos del antebrazo o del diafragma. Zorros: diafragma, lengua, músculos flexores y extensores de los miembros anteriores. Los animales a muestrear deben estar identificados con medios confiables (Caravanas numeradas, tatuaje, chips). Las muestras no deben congelarse. Deben enviarse al laboratorio de diagnóstico, en bolsas plásticas individuales, identificadas con marcador
28 28 indeleble y acondicionadas en una caja de térmica con refrigerantes. Es muy importante que estén acompañadas de un protocolo con los siguientes datos: Nombre de la persona que las remite Nombre y ubicación del establecimiento de origen de las muestras. Cantidad de animales muestreados, y número de muestras de cada animal. Para la toma de muestras en frigoríficos, es importante considerar aspectos diferenciales según se trate de faenas de rutina o faenas compulsivas originadas en un foco Faenas de rutina: Se toman como mínimo 50 g de los músculos recomendados. Esto permite realizar nuevos análisis en caso de resultar alguna muestra positiva. En el cerdo, se extraen de los pilares del diafragma. Si no hubiere o no alcanzare el pilar del diafragma, se deberá tomar parte del diafragma situada cerca de las costillas o del esternón, de la musculatura de la base de la lengua, de los músculos masticadores o de los intercostales (Montali y col., 1997). Las muestras se colocan en bandejas con cuadrantes numerados correlativamente, de acuerdo al orden que tengan las carcasas en la noria. Para carnes porcinas destinadas al consumo, se deben tomar submuestras de 5 g por animal y agrupar en lotes de 20 animales cada uno. Es conveniente que las muestras agrupadas no superen los 100 g ya que no resulta adecuado trabajar con mayor cantidad de muestra, pues se requerirá material de vidrio de una capacidad superior, lo que provoca un manejo dificultoso. Si en las muestras agrupadas se encuentran larvas, se repite la técnica con submuestras de 20 g por animal en grupos de 5 animales. Si uno de estos grupos vuelve a dar resultado positivo, se repite la técnica en forma individual con 20 g de carne por animal para identificar el o los animales positivos Faenas compulsivas de animales provenientes de un foco: Si los animales provienen de focos de triquinelosis se toman como mínimo submuestras de 10 g y muestras agrupadas de hasta 10 animales para realizar la técnica de DA. Se sugiere esta cantidad para aumentar la posibilidad de detección de larvas. Ventajas con respecto a la Triquinoscopía: Se pueden analizar muestras agrupadas en forma simultánea acortando el tiempo de diagnóstico (rutina de frigoríficos). Posee mayor sensibilidad ya que se analiza una mayor cantidad de muestra. La técnica de digestión artificial nos permite también confirmar la presencia del parásito en los chacinados que provocaron brotes. Hay que tener en cuenta que si la muestra no se encuentra altamente parasitada, se deberá llegar al agotamiento total de la pieza para emitir un resultado certero. Un diagnóstico de ausencia de larvas en una determinada cantidad de muestra de chacinado relacionada con un brote, no certifica la ausencia del parásito en el resto de la misma ni habilita su comercialización (Montali y col. 1997) Para jamón, bondiola y panceta, que están elaborados solo con carne porcina, se analizan 50 g de muestra. En el caso de jamón crudo, la
29 29 experiencia demuestra que la zona en donde se encuentra mayor cantidad de larvas es en la zona próxima al garrón ( Montali y col. 1997) Métodos indirectos Las técnicas más utilizadas para detectar la presencia de anticuerpos anti -Trichinella son: Inmunofluorescencia indirecta (IFI), Inmunoabsorción enzimática indirecta (ELISA indirecto) Inmunoelectrotransferencia o Western Blot (WB). Estas pruebas serológicas poseen la capacidad de detectar mínimas cantidades de anticuerpos presentes en los sueros (sensibilidad) y en una muy alta proporción de ensayos, solamente reaccionan ante anticuerpos inducidos por Trichinella spp. (especificidad). El inmunodiagnóstico actual de triquinelosis en los porcinos, se realiza mediante la utilización de dos técnicas de manera complementaria que aportan su sensibilidad y especificidad: ELISA y WB respectivamente. El suero con resultado positivo por ambas técnicas sugiere que el animal está infectado. (Gamble y col.,1983; Murrell y col., 1986; Guarnera y col., 2007). El inmunodiagnóstico se utiliza para detectar animales reactores positivos en las piaras. La detección de IgG anti-trichinella en sueros de cerdos puede considerarse como una herramienta estratégica en los programas de vigilancia epidemiológica. Su aplicación continuada puede ser de utilidad para establecer áreas de riesgo en las que se deberían intensificar las medidas de control. (Ruiz y Martínez, 2007) Inmunofluorescencia indirecta (IFI): Es una técnica capaz de detectar complejos antígeno-anticuerpo usando anticuerpos anti-inmunoglobulina porcina marcados con colorantes fluorescentes como el Isotiocianato de fluoresceína. Estas sustancias al ser excitadas con luz de longitud de onda del rango ultravioleta nm, emite luz visible que se observa como fluorescente en un microscopio de fluorescencia El proceso consta de dos etapas: en la primera se fijan sobre un portaobjetos los antígenos que constituyen el substrato conocido específico. Puede realizarse a partir de un corte de tejido muscular infectado o bien a partir de larvas musculares de T. spiralis fijadas sobre un portaobjetos con acetona a 20Cº, sobre el cual se coloca el suero del animal a analizar. Si la reacción es positiva, se producirá la formación del complejo antígenoanticuerpo. En la segunda etapa se enfrenta una anti-inmunoglobulina porcina marcada, con el complejo citado y se produce una reacción fluorescente visible en el microscopio de fluorescencia. (Venturiello y col., 1998) Se considera : suero reactivo ( positivo) cuando hay presencia de fluorescencia y suero no reactivo o negativo cuando hay ausencia de fluorescencia. (OIE, 2004b) Ventajas: Es sensible y rápida. Es económica si se posee el microscopio de fluorescencia.
30 30 La inmunofluorescencia indirecta se visualiza en forma más brillante que la detección directa debido a que varias anti-inmunoglobulinas fluorescentes se pueden unir a cada una de las moléculas de antígeno-anticuerpo formadas en la primera etapa. Desventajas: Se necesita un microscopio de fluorescencia. Tiene menor especificidad que el ELISA y el WB ELISA Indirecto: El ensayo inmunoenzimático ELISA indirecto se basa en el uso de: Antígeno de T. spiralis inmovilizado sobre una fase sólida (placa de 96 pocillos) Sueros con anticuerpos provenientes de animales infectados que se utilizan como controles positivos Sueros controles negativos de animales no infectados Sueros problema Un suero anti-especie marcado con una enzima, de forma que los conjugados resultantes tengan actividad tanto inmunológica como enzimática pudiendo ser revelada mediante la adición de un substrato específico que en acción con la enzima producirá un color observable a simple vista y/o cuantificable por un lector de ELISA. Inicialmente se utilizaban antígenos de extractos somáticos de las larvas musculares lo que resultaba en un ELISA de baja especificidad (Ruitenberg y col., 1974). Durante la década del 80 se desarrolló la metodología para la obtención de antígenos de excreción secreción (ES) obtenidos a partir de metabolitos de las larvas musculares de Trichinella spp. en cultivos in vitro. Estos antígenos corresponden a un grupo de glicoproteínas relacionadas con un peso molecular aproximado kda (Gamble y col., 1983). Se ha determinado que el uso de antígenos ES de larvas musculares aumenta la especificidad de los resultados obtenidos respecto a los antígenos de adultos o de los antígenos somáticos (Murrell y col.,1986; Nowakowski, 2004). Varios autores han reportado la utilización con éxito del test indirecto de ELISA con antígeno ES para el diagnóstico en varias especies animales (Murrell y col. 1986; Gamble y col.,1997; Pozio y col 2002b) La prueba de ELISA utilizando antígeno ES de T. spiralis inicia la detección de anticuerpos anti-trichinella en cerdos inoculados experimentalmente entre los 21 y 56 días post-inoculación. (Van Knapen y col., 1980; Gamble y col., 1983; Gamble, 1996; Ribicich, y col. 2000) Ventajas: La prueba de ELISA se caracteriza por presentar alta sensibilidad, especificidad, rapidez y economía. Es versátil, robusta, de simple realización. Permite realizar numerosas muestras a la vez. Se puede realizar sin necesidad de faenar al animal. La muestra de elección es el suero sanguíneo, pero también hay reportes sobre la utilización de líquido muscular con resultados equivalentes a los obtenidos con sueros sanguíneos (Beck y col., 2005)
31 31 La sensibilidad del ELISA indirecto es del orden de 0,01 l/g. Esto significa que es capaz de detectar los anticuerpos inducidos por un nivel de infección de una larva en 100 g de carne. Desventajas: Puede presentar resultados falsos negativos. Puede presentar resultados falsos positivos. Se pueden mencionar distintas causas que explicarían la aparición de resultados falsos negativos o falsos positivos: El período ventana : es un lapso durante el período temprano de la infección con Trichinella, en el cual los anticuerpos específicos no pueden ser detectados en el animal infectado. Este período se extiende durante los 17 días post infección (tiempo en que la larva se hace infectiva) y dependiendo de la dosis infectante, puede llegar hasta el día 40 p.i. (Nöckler y col., 2005) La respuesta tardía es una aparición demorada de los anticuerpos debida a bajos niveles de infección o a factores del hospedador asociados con un mal estado nutricional, edad, o simple variabilidad individual (Nöckler y col., 2005). La inmunidad cruzada es causa de la aparición de resultados falsos positivos y se debe a la presencia de anticuerpos generados contra nematodes del tubo digestivo, especialmente Ascaris suum y Trichuris suis. El empleo del antígeno de ES, en reemplazo de los antígenos somáticos totales originalmente utilizados redujo la proporción de falsos positivos por inmunidad cruzada (Gamble y col., 1983) Inmunoelectrotransferencia o Western Blot (WB): Esta técnica se basa en la detección de la unión de: anticuerpos anti T. spiralis presentes en el suero de cerdos positivos con bandas polipeptídicas específicas obtenidas por electroforesis del antígeno ES En un primer paso se obtiene el fraccionamiento del antígeno ES en bandas de distinto peso molecular mediante su siembra en un gel de poliacrilamida que se somete a electroforesis ( SDS PAGE ) Las proteínas inmunogénicas específicas de T. spiralis se ubican en un triplete de bandas localizadas de 42 a 60 KDa. La totalidad de las bandas obtenidas en el gel, se transfieren a una membrana de nitrocelulosa y esta, luego de un bloqueo para evitar reacciones inespecíficas, se pone en contacto con sueros porcinos. La unión antígeno anticuerpo se visualiza mediante el uso de anticuerpo anti cerdo unido a peroxidasa y la posterior incubación con substrato para obtener un compuesto coloreado en el lugar ocupado por el complejo. Si el lugar ocupado por los anticuerpos en la membrana coincide con el triplete de bandas específicas, el suero problema se considera positivo (OIE, 2004) El resultado positivo obtenido por un suero en esta prueba, es imprescindible para confirmar el resultado positivo obtenido por el mismo suero en la prueba de ELISA. Ventajas: Presenta alta especificidad.
32 32 Desventajas: Es laboriosa Es costosa Control de la triquinelosis: Las normas para control de la triquinelosis, establecen que cuando en un predio que cría o tiene cerdos se detecta un animal positivo en el diagnóstico post faena llevado a cabo mediante la técnica de digestion enzimática, el resto de los cerdos debe faenarse compulsivamente en un lapso determinado hasta despoblar el predio. (SENASA, 2006). La técnica dignostica de digestion enzimática ha sido declarada oficial por el SENASA por Resolución Nº 740/99. Además es la técnica exigida por los miembros de la Comunidad Económica Europea (CEE) para el comercio de porcinos y sus subproductos entre los países de la CEE o con países del tercer mundo. La Comisión Internacional de Trichinellosis (ICT) provee lineamientos generales para los métodos de digestión artificial. Estos métodos son recomendados para inspección individual de carcasas de cerdos, equinos o de presas de caza cuyas carnes sean destinadas a consumo humano (Gamble y col. 2000). Los laboratorios que diagnostican triquinelosis por el método de digestión artificial, deben mantener un adecuado sistema de calidad para garantizar la sensibilidad del ensayo. Deben ser validados antes de autorizar su funcionamiento, empleando muestras conocidas positivas y negativas y posteriormente monitorear periódicamente su eficacia utilizando paneles de muestras en ensayos ciegos (pruebas de proficiencia) (Forbes & Gajadhar, 1999; Gajadhar & Forbes, 2001) En la Argentina, la triquinelosis es una enfermedad de denuncia obligatoria. Los laboratorios de control bromatológico municipal, de plantas faenadoras oficiales o privados, y los veterinarios privados deben comunicar al representante de la Dirección de Bromatología de su respectivo municipio la detección de un resultado positivo. El municipio es responsable de la comunicación a los organismos provinciales y nacionales Control de las ratas en criaderos de cerdos. Por su proximidad al ambiente ocupado por el hombre y las especies animales que explota, la rata parda, Rattus norvegicus, es la que juega el rol más importante en el ciclo doméstico de la triquinelosis (Leiby y col., 1990; Stojcevic y col., 2004) La alimentación de los cerdos con residuos de faena o con restos crudos de domicilios o de industrias alimentarias, uno de los factores de riesgo de transmisión de T. spiralis más frecuentes para la población de cerdos en los criaderos familiares y para subsistencia, lo es también para la población de roedores que habitan el area (Wright, 1943; Poole 1952; Leiby y col.,1990). Es improbable que la colonia de ratas de un criadero de cerdos se infecte a partir de consumir restos de faena o carroña en un basural o en otro criadero situados a más de un kilómetro del territorio de la colonia. De hecho, la extensión territorial de las colonias de la rata parda no tiene un radio superior a los 50 metros (FUNASA, 2002). Por esta razón, tanto en el estudio
33 de los focos de triquinelosis como en la decisión de las medidas de control posteriores, todas las operaciones para mejorar las condiciones sanitarias, sanear el ambiente y controlar los roedores deben iniciarse por el predio en que ocurrió el foco, para luego, si fuere necesario, extenderse en forma concéntrica. En los criaderos comerciales tecnificados que mantienen a los cerdos en confinamiento, el control permanente de roedores se lleva a cabo por medidas de saneamiento ambiental (Elias, 1984; Timm, 1994) y de aplicación de rodenticidas. Las medidas de saneamiento ambiental que tienden a disminuir el número de roedores que puede soportar el ambiente, consisten en: Mantener el pasto cortado alrededor de los galpones de cría No dejar recipientes ni enseres que puedan servir como refugio No dejar disponibles a los roedores fuentes de agua ni de alimento Reparar los caños de desagüe rotos que puedan servir de entrada a los locales de cría o de almacenamiento de alimentos Mantener todas las aberturas con alambre tejido anti-roedores Construir alrededor de cada local una vereda de concreto de un metro de ancho para evitar la excavación de túneles que puedan conducir al interior. Desde el punto de vista de su modo de acción, los rodenticidas se clasifican en anticoagulantes y no anticoagulantes. Los rodenticidas anticoagulantes se comenzaron a usar en Los primeros fueron warfarina, pindona, difacinona y clorofacinona. Se los conoce como anticoagulantes de primera generación o rodenticidas de tomas múltiples porque solo producen la muerte luego de varias tomas repetidas (Whisson, 1996). Provocan una inhibición de la activación de la vitamina K1 necesaria para la activación de los factores de coagulación II, VII, IX y X (Thacker, 2001). Como resultado, las ratas mueren por hemorragias internas. La acción lenta de estos rodenticidas tiene dos ventajas importantes: 1) a diferencia de lo que ocurre con los tóxicos rápidos, las ratas son incapaces de asociar su malestar a la ingestión del cebo envenenado y por esa razón no abandonan el consumo; 2) dan tiempo para administrar el antídoto (vitamina K) en caso que una mascota, el ganado o una persona hubieren ingerido el cebo. La aparición de resistencia a estos anticoagulantes llevó al desarrollo de los anticoagulantes de segunda generación: bromadiolona y brodifacoum. Estos son más potentes que los anteriores y pueden producir la muerte después de varios días de haber ingerido el rodenticida una sola vez. Todos los rodenticidas anticoagulantes tienen la misma indicación de uso: deben ser administrados durante 15 días o hasta que cesa el consumo. Esto asegura que la población total tenga oportunidad para ingerir una dosis letal del rodenticida (Whisson, 1996) Para usar rodenticidas no anticoagulantes es necesaria la aplicación previa de cebos sin veneno durante varios días para que los roedores pierdan la aversión a lo que no conocen y los consuman sin recelo (Elias, 1984). La elección del lugar donde se ponen los cebos con veneno requiere conocimiento de las caracteristicas de los roedores involucrados. Para evitar la intoxicacion accidental de mascotas o niños, se pueden disponer los 33
34 rodenticidas dentro de cajas de madera con entradas para los roedores (estaciones de cebado) en las que estos se hallarán más seguros y no interrumpirán la ingestión del veneno por ruidos que podrían ahuyentarlos (Timm,1994). Una forma alternativa de disminuir la población de roedores sin utilizar venenos y evitar que los cadaveres queden a disposición de los cerdos es mediante la utilización de trampas. Las más comunes son las tipo guillotina, que por liberación de un poderoso resorte, activado cuando la rata toca el cebo, aprisionan su cuerpo entre un arco de alambre y la base de madera. Frecuentemente la rata muere porque la trampa destruye un órgano vital. Hay otros tipos de trampa diseñadas para atrapar vivos a los roedores. Algunas de ellas, como las Tipo Shermann, por la seguridad que proveen al operador, son utilizadas en las capturas para relevamiento de población o para estudiar la prevalencia de enfermedades en la misma (Coto, 1997). Otras, por la cualidad de permitir la captura de varios animales por día, son empleadas en algunos paises de Africa y de Asia donde las ratas consumen entre el 17 y el 50% de los cereales antes de las cosechas. En estos paises, existe deficiencia marcada de proteinas, de modo que las ratas que se cazan, son consumidas por la población humana (Fiedler, 1990). La eficacia para reducir la población, depende del tipo de trampa empleado, de la adecuada ubicación, de la cantidad y de la atención diaria de las mismas para que estén siempre activadas (Belmain, 2008). Se ha intentado el control biológico de roedores mediante el uso de predadores y de agentes patógenos. La introducción de predadores para disminuir la población de roedores frecuentemente ha creado más inconvenientes que soluciones pues al crecer su población se transforman en plaga (Elias, 1984) Tampoco es conveniente la utilización de rodenticidas basados en microorganismos patógenos que afectarían a los roedores, pues también pueden afectar a los humanos. Es el caso de los basados en Salmonella enteritidis, cuya participación en brotes de salmonellosis en humanos ha sido motivo de numerosos reportes (Painter y col.; 2004) Es importante que el control por rodenticidas no se emplee en criaderos donde los cerdos no están continuamente confinados, dado que si las ratas que mueren están infectadas con larvas de T. spiralis, estas pueden mantenerse con capacidad infectante hasta durante 90 días (Jovic y col., 2001) y servir de fuente de infección a los cerdos. Por otra parte, estos son muy susceptibles a la intoxicación por anticoagulantes y la misma podría ocurrir a partir del consumo de los roedores muertos. El control de roedores en este tipo de explotaciones deberá basarse en reducir las fuentes de alimentación, agua y refugio, lo que dará por resultado una disminución en el tamaño de la colonia. (Elias, 1984; Coto 1997) Según las normas vigentes en sanidad animal, cuando se sabe que en un criadero hay animales infectados con T. spiralis, corresponde hacer un despoblamiento del mismo y todos los cerdos deben faenarse en frigoríficos habilitados que cuenten con laboratorio para diagnóstico por digestión enzimática. En el predio donde funcionaba el criadero, corresponde implantar medidas para disminuir la población de roedores y en este caso, teniendo en cuenta que el repoblamiento con cerdos no debería hacerse antes de los seis meses, podrían utilizarse rodenticidas anticoagulantes y no anticoagulantes, 34
35 35 incluidos los fumigantes, si se cuenta con el servicio de un especialista en control de plagas (Timm, 1994). La realidad en los criaderos para subsistencia respecto a la posibilidad de controlar los roedores es muy distinta de la expresada para los criaderos comerciales de cerdos. En ellos es frecuente que los roedores cuenten con un ambiente muy adecuado para sostener poblaciones grandes, debido a que el alimento consiste en residuos comestibles de comercios o de domicilios que se vuelcan en la intemperie, los corrales están construidos con trozos de madera, chapas y alambres y cuando el agua no escasea, las cañerías y los bebederos tienen fugas. En sintesis, los roedores tienen comida, refugio y agua disponibles. A esto se suma que los propietarios de los cerdos no tienen posibilidades económicas, ni conocimientos, ni apoyo, ni presión de los organismos municipales para llevar a cabo el control de roedores o mejorar las condiciones de cría de los animales (Caracostantogolo, 2006) Características de los activos rodenticidas más empleados en la actualidad Clase Activo Presentación Modo de Acción Anticoagulantes 1era generación Anticoagulantes 2nda generación No anticoagulantes Dosis repetida Necesidad de Precebado Warfarina Cebo y líquido Si No Pindona Cebo y líquido Si No Clorofacinona Cebo y polvo Anti vit. No No Difacinona Cebo y polvo K No No Brodifacoum Cebo No No Bromadiolona Cebo No No Fosfuro de zinc Cebo o polvo para hacer cebo Daño hepático y cardíaco Colecalciferol Cebo Hipercalcemia Indistinto No Brometalina Cebo Depresión del Indistinto no SNC y parálisis Si Si
36 36 2. TRABAJO EXPERIMENTAL 2.1 Experimento I: Presencia e infectividad de larvas de Trichinella spiralis en materia fecal de ratas inoculadas experimentalmente Introducción: La coprofagia es una conducta frecuente en muchas especies animales. Entre sus causas se han enumerado: la corrección de deficiencias en la dieta, el aprendizaje de los alimentos que consumen los progenitores, la imposibilidad de absorber un determinado nutriente (Mendes y col., 2000; Beerda y col., 1999; Marinier y Alexander, 1995). Algunos autores dieron mucha importancia a la transmisión de la triquinelosis por coprofagia, al punto de explicar la permanencia de la enfermedad, no obstante los controles estrictos que existían en sus países, por el apetito general de los perros y los cerdos en comer las heces de otros animales (Jacob, 1941) Existen varios reportes sobre la posibilidad de infectar animales de laboratorio y cerdos administrándoles como alimento la materia fecal (M.F.) de otros animales infectados experimentalmente con larvas musculares de T. spiralis (Spindler, 1953; Schnurrenberger y col.; 1964). Los artículos publicados no son claros en cuanto a la metodología aplicada para demostrar la presencia de larvas en la materia fecal, hacer el conteo y para administrar las larvas o la materia fecal a los animales receptores. Este experimento se hizo para determinar con técnicas parasitológicas y serológicas si la materia fecal de ratas que consumen carne infectada con larvas de T. spiralis podría servir de fuente de infección para otros individuos en la colonia de ratas, sumándose al modo de transmisión más frecuente que es el canibalismo o el consumo de carroña (Poole 1952; Leiby y col.,1990) Objetivo general: Determinar si la materia fecal de ratas que han ingerido larvas de T. spiralis puede ser una fuente de infección Objetivos específicos: Determinar si el número de larvas infectantes influye sobre la proporción de larvas presentes en materia fecal. Determinar si las larvas de T. spiralis presentes en la materia fecal de ratas infectadas experimentalmente son infectivas y si mantienen su infectividad después de 3 y de 7 días de permanencia de la boñiga en el ambiente. Registrar los signos clínicos presentados por ratas inoculadas con distintas dosis de larvas de T. spiralis
37 Materiales y métodos Unidades experimentales: Se utilizaron ratas Wistar hembras de gramos para determinar la presencia de larvas de T. spiralis en su materia fecal luego de infectarlas experimentalmente. Todos los animales fueron desparasitados 30 días antes de iniciar el experimento con un antiparasitario formulado en base a fenbendazol, pamoato de pyrantel y praziquantel dado que se había diagnosticado la infección por Himenolepis spp. y por Syphacia spp. Para determinar la infectividad de las larvas recuperadas de materia fecal de las ratas se emplearon ratones Balb C hembras de 60 días de edad con un peso aproximado de 30 g Grupos experimentales: Grupos para determinar presencia de larvas en M.F.: Se utilizaron 7 grupos compuestos cada uno por 6 Ratas Wistar: Grupo 1: alimentado con una dieta natural compuesta por carne cocida, vegetales verdes y pan (DN), infección experimental con 2000 larvas enquistadas en carne Grupo 2: recibió alimento balanceado para roedores y fue infectado con 2000 larvas enquistadas en carne. Grupo 3: DN e infección experimental con larvas enquistadas en carne Grupo 4: DN e infección experimental con larvas en suspensión obtenidas por digestión enzimática. Grupo 5: DN e infección experimental con 2000 larvas enquistadas en carne Grupo 6: DN e infección experimental con 5000 larvas enquistadas en carne Grupo 7: DN e infección experimental con larvas enquistadas en carne. Grupos para determinar la infectividad de las larvas recuperadas de materia fecal: Se utilizaron 4 grupos compuestos cada uno por 6 ratones BALB C hembras de 30 gramos de peso corporal alimentados con alimento balanceado para roedores y agua ad libitum. Grupo 1M: infectado experimentalmente con 40 larvas/ratón obtenidas por digestión enzimática de carne de ratón y sometidas al paso por tamices al igual que las obtenidas de materia fecal. Grupo 2M: infectado experimentalmente con 40 larvas/ratón recuperadas de la materia fecal de ratas depositada a las 24 horas post infección Grupo 3 M: infectado experimentalmente con 40 larvas/ratón recuperadas de la materia fecal de ratas depositada a las 24 horas post infección y conservada a 18ºC y 70% de humedad relativa (H.R.) durante 3 días Grupo 4 M: infectado experimentalmente con 40 larvas/ratón recuperadas de la materia fecal de ratas depositada a las 24 horas post infección y conservada a 18ºC y 70% H.R. durante 7 días Alojamiento de los animales: Durante las primeras 72 horas post inoculación, las ratas se alojaron en forma individual en jaulas de alambre tejido con piso enrejado que permitía recolectar la materia fecal en bandejas. Al iniciarse el cuarto día post
38 38 inoculación, las ratas que componían los Grupos 5, 6 y 7 se alojaron en lotes de 3 animales por jaula, para su observación clínica. La dimensión de las jaulas era de 40 X 50 X 40 cm (Foto 1). La administración de agua fue mediante frascos de vidrio invertidos con pico metálico. La alimentación fue ad libitum con una dieta compuesta por pan, carne cocida y vegetales. La temperatura del ambiente se mantuvo en grados centígrados mediante aire acondicionado y calefacción. El aire fue renovado durante 15 minutos cada hora. Los ratones receptores se alojaron en grupos de 6 por jaula de 29X15X14 cm con agua y alimentación ad libitum (Foto 2). Todos los grupos recibieron alimento balanceado para roedores. Las condiciones ambientales se mantuvieron en los mismos niveles del local que alojó a las ratas Inoculación experimental: Para la inoculación de las ratas, según los grupos se utilizaron larvas musculares de T. spiralis obtenidas por digestión enzimática o carne de ratón con una cantidad conocida de larvas por gramo. El material infectante fue obtenido por inoculación de ratones Balb C con 800 larvas musculares de T. spiralis cada uno. Estos fueron sacrificados 45 días post-inoculación y sus músculos fueron procesados para ser utilizados como inóculo. Los procedimientos para obtención de larvas y cuantificación se tomaron de OIE, (Fotos 9 a 12) Las larvas obtenidas por digestión enzimática fueron cuantificadas en larvas por gramo de carne digerida para determinar el peso de carne a administrar en los animales que recibirían carne infectada. Una vez, cuantificadas las larvas se prepararon las dosis de larvas en agua a utilizar como inóculo en las ratas que recibirían larvas en suspensión. A cada animal alojado individualmente, la carne infectada se le administró en una placa de Petri y se observó que la misma fuera consumida. Las larvas en suspensión fueron administradas directamente en la boca de las ratas y de los ratones, mediante micropipeta automática, en volúmenes de microlitros Obtención de la materia fecal de ratas inoculadas: La materia fecal de cada rata infectada fue recogida a las 24, 48 y 72 horas post inoculación, colocada en recipientes individuales identificados con el número del animal y jaula y procesada el mismo día de la recolección para determinar la presencia de larvas de T. spiralis, cuantificarlas y componer con ellas el inóculo para los ratones receptores. El 20% de las boñigas depositadas por cada rata en el día 1 post inoculación, se reunió en un lote para estudiar la infectividad de las larvas contenidas en las mismas luego de 3 y de 7 días de conservación a temperatura ambiente Procesamiento de la materia fecal de ratas inoculadas: Cada muestra de materia fecal fue disuelta en agua corriente a 40 grados centígrados mediante mortereado en una placa de Petri de 150 mm de diámetro con un mango cilíndrico de extremo plano de 50 mm de diámetro. Una vez obtenida una disolución adecuada, la muestra fue filtrada por tamices en serie de 60, 80 y 250 mallas por pulgada cuadrada con ayuda de agua a presión para mover las partículas retenidas por cada uno. El
39 39 material sólido retenido por el último tamiz, fue resuspendido en 100 ml de agua a la misma temperatura. Este volumen repartido en alícuotas de 20 ml cada una, volcadas en una placa de Petri, fue examinado bajo lupa estereoscópica a X para cuantificar el número de larvas. Las larvas halladas se transfirieron a tubos Eppendorf mediante micropipeta automática de microlitros para luego ser inoculadas en los ratones receptores a razón de 40 larvas/ratón Examen clínico de las ratas inoculadas: Diariamente se examinaron las ratas de los Grupos 5, 6 y 7, inoculadas con 2000, 5000 y larvas respectivamente, para registrar la presencia de signos clínicos tales como edemas palpebrales (Foto 5), actividad disminuida, pérdida de reacción, heces blandas o diarrea. Se registró la actividad como normal cuando en el momento de proveerle los cuidados diarios el animal despertaba, observaba al operador, caminaba, trepaba por la jaula para husmear (Foto 3); y como actividad disminuida cuando en la misma situación continuaba durmiendo. Se registró como estado febril positivo el aspecto de pelo erizado sumado a una posición corporal típica, con la espina dorsal encorvada (Foto 4). Se registró la reacción como normal cuando en el momento de depositar la rata de lado en el piso de la jaula, la misma se incorporaba rápidamente y caminaba; y como reacción disminuida cuando se quedaba de lado sin incorporarse y caminar (Foto 6). Las heces se registraron como blandas cuando conservaban la forma de la boñiga normal pero tenían menor consistencia y como diarrea cuando no tenían forma de boñiga y eran de consistencia líquida Digestión enzimática de los ratones receptores: Los ratones inoculados con las larvas recuperadas de la materia fecal de las ratas, fueron sacrificados 60 días post inoculación, por dislocación cervical bajo anestesia general obtenida por inyección intra peritoneal de ketamina combinada con xilazina. La musculatura de cada animal fue sometida a digestión enzimática para cuantificar la infección en número de larvas de T. spiralis por gramo de carne digerida (Fotos 9 a 12) Serología de los ratones receptores: En el momento del sacrificio de los ratones receptores, se obtuvo sangre de cada uno de los animales para utilizar el suero en el diagnóstico de T. spiralis por la técnica de ELISA según Ruiz y col, La presencia de anticuerpos detectables en base al nivel de Densidad Óptica (D.O.) de los sueros medido luego de la reacción antígeno-anticuerpo indicó que las larvas inoculadas tenían capacidad infectante habiendo desarrollado en el intestino hasta adultos y la descendencia de estos hasta larva I infectante en los músculos esqueléticos. Estos son los dos puntos del organismo del hospedador en que las T. spiralis infectivas liberan sustancias antigénicas.
40 Cronograma de actividades: Tarea Adaptación Coproexamen Conteo y recuperación de larvas día -7 X X inoculación de ratas Inoculación de ratones Mat. fecal día 1 PI inoculación de ratones Mat. fecal conservada 3 días inoculación de ratones Mat. fecal conservada 7 días Necropsia de ratones receptores y muestreo de sangre Digestión Enzimática Días - 6 a -1 X Día 0 X Día 1 X X Día 2 X Día 3 Día 4 día 5 Día 6 Día 7 Día 8 Día 60 X X X X X Diseño experimental: Unidades experimentales Ratas Wistar Ratones Balb C Grupo N Infección experimental Alimentación larvas enquistadas Natural larvas enquistadas Balanceado larvas enquistadas Natural larvas en suspensión Natural larvas enquistadas Natural larvas enquistadas Natural larvas enquistadas Natural 1M 6 40 larvas de digestión Balanceado enzimática 2M 6 40 larvas de materia fecal día 1 Balanceado post infección (p.i.) 3M 6 40 larvas de MF conservada Balanceado por 3 días 4M 6 40 larvas de MF conservada Balanceado por 7 días
41 Análisis estadístico: Las cantidades de larvas recuperadas de la materia fecal de las ratas infectadas experimentalmente fueron transformadas al log10 de (n+1) para normalizar y homogeneizar la variancia. Se utilizó el programa SAS (Statistical Analysis System) para efectuar el procedimiento de análisis de variancia (ANOVA) y la comparación de medias mediante el test de Tukey con un nivel de significación inferior al 5%. Se procedió de igual forma con los datos de larvas recuperadas de la digestión enzimática de los ratones inoculados con larvas recuperadas de la materia fecal de ratas. La hipótesis nula para los grupos 1 y 2 era que no había diferencia en la cantidad de larvas hallada en materia fecal de grupos infectados con larvas en carne si se las alimentaba con dietas distintas. La hipótesis alternativa era que el tipo de dieta podía acelerar o retardar la salida de larvas de T. spiralis en materia fecal. Para los grupos 3 y 4 diferenciados por la infección experimental con larvas en carne o con larvas en suspensión obtenidas por digestión enzimática, la hipótesis nula era que no habría diferencias en la cantidad de larvas presentes en materia fecal; en tanto que la hipótesis alternativa era que la cantidad de larvas en materia fecal iba a diferir en ambos grupos. Para los grupos 5, 6 y 7 inoculados con 2000, 5000 y larvas en carne, la hipótesis nula era que las cantidades de larvas en materia fecal de las ratas inoculadas experimentalmente no iban a ser diferentes, en tanto que la hipótesis alternativa era que la cantidad de larvas en materia fecal dependía de las cantidades de larvas con que se infectaba a cada grupo Para los grupos 1M, 2M, 3M y 4M, inoculados con larvas frescas obtenidas por digestión enzimática de carne, larvas de materia fecal del día 1 p.i., larvas de materia fecal del día 1 conservada durante 3 días y larvas de materia fecal del día 1 conservada durante 7 días respectivamente, la hipótesis nula era que todos los grupos iban a estar infectados con larvas musculares y todos iban a tener anticuerpos contra T. spiralis. La hipótesis alternativa era que tanto la infección por larvas musculares como los niveles de anticuerpos iban a ser diferentes en los distintos grupos Resultados: En la tabla 1 se presentan los resultados de distinto tipo de dieta sobre la cantidad de larvas de T. spiralis que salen en materia fecal 24, 48 y 72 horas. Las ratas alimentadas con una dieta natural compuesta por carne cocida, y vegetales expulsaron a las 24 horas post infección un número significativamente mayor (P<0.05) de larvas en materia fecal que el grupo de ratas que recibió alimento balanceado para roedores. A su vez, las ratas alimentadas con alimento balanceado, a las 48 horas post infección expulsaron un número significativamente mayor (P<0.05) que las que recibieron la dieta natural. Este grupo a las 48 horas post infección expulsó un número de larvas similar (P>0.05) al expulsado por el grupo alimentado con balanceado a las 24 horas post infección. Ninguno de los grupos expulsó larvas 72 horas post infección.
42 42 En la tabla 2 pueden verse los resultados del efecto de distintos tipos de fuente de infección sobre el número de larvas que se expulsan en materia fecal a las 24, 48 y 72 horas post infección. Las ratas infectadas con larvas en suspensión, obtenidas por digestión enzimática de carne infectada de ratón expulsaron, tanto a las 24 como a las 48 horas post infección, una cantidad significativamente mayor (P<0.05) de larvas en materia fecal que las ratas infectadas con la misma cantidad de larvas enquistadas en carne. A las 72 horas post infección, no se hallaron larvas en materia fecal de ninguna de las ratas infectadas. Tabla 1: Cantidades de larvas de T. spiralis recuperadas a las 24, 48 y 72 horas post inoculación, de la materia fecal de ratas que recibieron distinto tipo de dieta y fueron infectadas con 2000 larvas en carne. Grupo 1 Dieta natural Larvas halladas en materia fecal Rata Nro. 24 horas Log10(n+1) 48 horas Log10(n+1) 72 horas Log10(n+1) 1 6 0, , , , , , , , , , , , , , , , , ,000 Medias 5,127a 0,787 0,348b 0,180 0b 0,000 Grupo 2 Alimento Balanceado para roedores Larvas halladas en materia fecal Rata Nro. 24 horas Log10(n+1) 48 horas Log10(n+1) 72 horas Log10(n+1) 7 0 0, , , , , , , , , , , , , , , , , ,000 Medias 0,513b 0,130 4,459a 0,737 0b 0,000 a=valores con letras diferentes son significativamente diferentes P<0.05
43 43 Tabla 2. Cantidades de larvas de T. spiralis recuperadas a las 24, 48 y 72 horas post inoculación, de la materia fecal de ratas inoculadas con larvas en carne y en suspensión. Grupo 3 Larvas enquistadas en carne Larvas halladas en materia fecal Rata Nro. 24 horas Log10(n+1) 48 horas Log10(n+1) 72 horas Log10(n+1) , , , , , , , , , , , , , , , , , ,000 Medias 10,412b 1,057 2,203c 0,506 0d 0,000 Grupo 4 larvas en suspensión Larvas halladas en materia fecal Rata Nro. 24 horas Log10(n+1) 48 horas Log10(n+1) 72 horas Log10(n+1) , , , , , , , , , , , , , , , , , ,000 Medias 83,165a 1,925 16,489b 1,243 0d 0,000 a=valores con letras diferentes son significativamente diferentes P<0.05 En la tabla 3, se presentan los resultados del efecto de 2000, 5000 o larvas enquistadas en carne sobre la cantidad de larvas de T. spiralis expulsadas en materia fecal de las ratas infectadas. No hubo diferencias significativas (P>0.05) entre las cantidades de larvas halladas a las 24 horas post infección en la materia fecal de los tres grupos infectados. Tampoco hubo diferencias significativas (P>0.05) entre las cantidades de larvas halladas a las 48 horas post infección. Todos los grupos expulsaron a las 24 horas post infección, cantidades de larvas significativamente mayores (P<0.05) que a las 48 y a las 72 horas p.i. A las 72 horas p.i., no se hallaron larvas en la materia fecal de ninguno de los grupos infectados. En el día 1 p.i., en el momento de obtener las larvas de la materia fecal depositada por las ratas inoculadas para ser inoculadas a los ratones de los grupos receptores, en las boñigas se hallaron larvas con diferentes grados de enrollamiento, con movimiento e inmóviles. Las larvas bien enrolladas y las móviles eran de aspecto similar a las obtenidas de la digestión enzimática de carne, con las que se infectó al Grupo 1M. Las larvas obtenidas de las boñigas conservadas durante 3 y 7 días, tenían un grado de enrollamiento menor que las de las boñigas frescas y no presentaban motilidad.
44 44 Tabla 3. Cantidades de larvas de T. spiralis recuperadas a las 24 y 48 horas post inoculación, de la materia fecal de ratas infectadas con 2000, 5000 y larvas enquistadas. Grupo 5: 2000 larvas en carne Larvas halladas en materia fecal Rata Nro. 24 horas Log10(n+1) 48 horas Log10(n+1) 72 horas Log10(n+1) , , , , , , , , , , , , , , , , , ,000 MG 10,588 a 0,348b 0,000b Grupo 6: 5000 larvas en carne Larvas halladas en materia fecal Rata Nro. 24 horas Log10(n+1) 48 horas Log10(n+1) 72 horas Log10(n+1) , , , , , , , , , , , , , , , , , ,000 MG 12,612 a 0,348b 0,000b Grupo 7: larvas en carne Larvas halladas en materia fecal Rata Nro. 24 horas Log10(n+1) 48 horas Log10(n+1) 72 horas Log10(n+1) , , , , , , , , , , , , , , , , , ,000 MG 11,381 a 0,414b 0,000b a=valores con letras diferentes son significativamente diferentes P<0.05 En la tabla 4 se presentan los resultados de Digestión enzimática de las pruebas de infectividad de las larvas recuperadas de la materia fecal de ratas cuando fueron inoculadas en ratones Balb C. indicativa de la falta de infectividad de las larvas presentes en la materia fecal. Las densidades ópticas obtenidas en el grupo 1, inoculado con larvas musculares obtenidas por digestión enzimática fueron significativamente mayores (P<0.05) que las del resto de los grupos.
45 45 Tabla 4: Cantidades de larvas de T. spiralis (larvas/gramo) recuperadas de los ratones receptores 60 días post inoculación. Grupo /origen de Las larvas 1M Digestión artificial 2M M.F. día 1 p.i. 3M M.F. conservada 3 días 4M M.F. conservada 7 días Ratón Nro. Larvas / gramo Media Geométrica 41.2 a 0 b 0 b 0 b M.F.: materia fecal a,b: Valores con letras diferentes son significativamente diferentes (P<0.05) En la tabla 5 se expresan los niveles de anticuerpos medidos como densidad óptica mediante la técnica de ELISA en los sueros de los ratones receptores en el día 60 post inoculación. Solamente fueron positivos los ratones que recibieron larvas obtenidas por digestión enzimática de músculos de ratones dadores. Ninguno de los grupos que recibieron larvas de T. spiralis obtenidas de la materia fecal de ratas inoculadas experimentalmente, formó anticuerpos contra el antígeno ES utilizado en la técnica de ELISA. Para que esto ocurra es necesario que las larvas tengan capacidad infectante para desarrollar en el intestino del hospedador hasta parásitos adultos y que su descendencia pueda migrar a los músculos esqueléticos y establecerse en células nodrizas, liberando en cada uno de estos sitios los componentes granulares antigénicos contenidos en sus esticocitos. La ausencia de anticuerpos es
46 46 Tabla 5: Densidades ópticas (D.O.) obtenidas mediante la técnica de ELISA en los sueros extraídos de los ratones receptores en el día 60 post inoculación. Los valores >0.143 son positivos. Grupo /origen de las larvas 1M Digestión artificial 2M M.F. día 1 p.i. 3M M.F. conservada 3 días 4M M.F. conservada 7 días Ratón Nro. Densidad Óptica Media Geométrica a b b b M.F.: materia fecal D.O. Densidad óptica Punto de corte: D.O.= a,b: Valores con letras diferentes son significativamente diferentes (P<0.05) En la Tabla 6 se expresan los resultados de la observación clínica de las ratas de los Grupos 5, 6 y 7, alimentadas con carne que contenía 2000, 5000 y larvas por animal respectivamente. El Grupo 5, solo mostró actividad disminuida en un animal y ningún otro signo clínico. En el grupo 6, todos los animales tuvieron heces blandas y tres tuvieron actividad disminuida. El grupo inoculado con larvas por animal fue el que mostró más signos clínicos de enfermedad: heces blandas a partir del día 2 p.i. con evolución a diarrea a partir del día 3 p.i.; actividad disminuida temprana (a partir del día 3-4 p.i.); reacción disminuida a partir del día 23 p.i.
47 47 Tabla 6: Resultados de la observación clínica de ratas inoculadas con 2000, 5000 y larvas de T. spiralis en carne Grupo/ Infección Grupo Larvas Grupo Larvas Grupo Larvas Rata Edema Estado Actividad Reacción Heces Diarrea Muerte Nro. Párpado Febril blandas 25 Neg Neg Normal Normal Neg Neg No 26 Neg Neg Normal Normal Neg Neg No 27 Neg Neg Normal Normal Neg Neg No 28 Neg Neg Normal Normal Neg Neg No 29 Neg Neg Disminuida Día 30 Normal Neg Neg No 30 Neg Neg Normal Normal Neg Neg No 31 Neg Neg Disminuida Normal (+) Neg No día 28 Día 2 a10 32 Neg Neg Normal Normal (+) Neg No Día 2 a12 33 Neg (+) Día 4 y 5 34 (+) día 22 (+) Día 4 y 5 Normal Disminuida Día Neg Neg Disminuida Día Neg (+) Día 4 y 5 Normal Día 1 a 5 37 Neg Neg Disminuida Desde Día 4 38 (+) Día 24 (+) Día 4 a 7 39 Neg (+) Día 4 a 8 40 Neg (+) Día 5 a 7 41 Neg (+) Día 5 a 8 42 (+) día 22 (+) Día 6 y 7 Disminuida Desde día 4 Disminuida Desde Día 3 Disminuida Desde Día 4 Disminuida Desde Día 4 Disminuida Desde Día 3 Disminuida Desde Día 24 Disminuida Desde Día 26 (+) Día 2 a12 (+) Día 2 a 9 Normal (+) Día 2 a 8 Normal Día 1 a 5 Normal Hasta Día 4 Disminuida Desde día 23 Disminuida Desde Día 26 Disminuida Desde Día 24 Disminuida Desde Día 25 Disminuida Desde Día 24 (+) Día 2 a 5 (+) Día 2 (+) Día 2 (+) Día 2 (+) Día 2 (+) Día 2 (+) Día 2 Neg Neg Neg Neg (+) Día 3 a 5 (+) Día 3 a 12 (+) Día 3 a 10 (+) Día 3 a 11 (+) Día 3 a 12 (+) Día 3 a 14 No No No Sacrificio Día 5 SI Día 5 Natural No No No No No Neg = Negativo En el curso de la observación clínica ocurrió la muerte de una de las ratas del grupo 7, que fue hallada 12 horas después del control anterior en que estaban todos los animales vivos. Esto dio origen a un ensayo accesorio para determinar si en el día 5 p.i., el intestino contiene formas infectantes para los animales que pudieran comerlo. En el quinto día p.i., en el intestino ya no hay larvas musculares pues todas han evolucionado hasta adultos en las primeras 30 horas p.i.
48 48 Si los animales que comían el intestino del animal muerto desarrollaban larvas en sus músculos, las mismas debían provenir de las hembras adultas fecundadas que se hallaban en el intestino ingerido. Estas hembras, para transmitir la enfermedad en este modo, debían tener la capacidad de resistir a la digestión en el estómago del animal receptor, entrar en la capa de células de la mucosa intestinal y depositar larvas recién nacidas dentro de las vellosidades intestinales (Denis y col., 1970). Para conocer si estas hembras adultas perdían su capacidad de infectar con el paso de las horas post mortem, se sacrificó un animal del Grupo 6 y la mitad craneal del intestino de este animal y del animal hallado muerto se dieron a comer a 2 grupos de 4 ratas cada uno (Grupo intestino fresco y Grupo Intestino 12 horas post mortem). Las ratas de estos dos grupos fueron sacrificadas 45 días p.i. y sus músculos se sometieron a digestión enzimática. Sólo se hallaron larvas musculares en las ratas que consumieron el intestino fresco del animal sacrificado (Tabla 7). Se puede inferir que en el intestino del animal hallado muerto las hembras adultas de T. spiralis estaban muertas o sin capacidad para entrar en la mucosa o depositar larvas recién nacidas. Tabla 7: Resultados de digestión enzimática de ratas alimentadas con intestino obtenido de ratas inoculadas 5 días p.i. Grupo Intestino Fresco Intestino 12 horas Post mortem Digestión Rata Enzimática Nro. Total Larvas/ gramo IN IN IN IN IN IN IN IN Discusión: En las condiciones del presente ensayo, fue posible demostrar la presencia de larvas en la materia fecal de ratas inoculadas experimentalmente con larvas de T. spiralis. Las larvas aparecían más precozmente (1 día antes) en materia fecal cuando las ratas se alimentaban con una dieta natural que cuando consumían alimento balanceado (P<0.05). Aparecía un mayor número de larvas en materia fecal (P<0.05) cuando se utilizaban larvas en suspensión provenientes de digestión enzimática de carne infectada que cuando se proveía carne conteniendo larvas enquistadas como fuente de infección. La causa de este hallazgo puede interpretarse
49 49 como una pérdida de capacidad de las larvas provenientes de digestión enzimática para permanecer en el intestino. La cantidad de larvas que aparecieron en materia fecal no estuvo ligada a la dosis de larvas infectantes utilizadas, no hallándose diferencias significativas entre grupos de ratas infectados con 2000, 5000 o larvas enquistadas en carne (P>0.05). En el caso que las larvas halladas en materia fecal hubieran sido infectivas, esta invariabilidad no ligada a la dosis infectante tornaría igualmente peligrosa a una rata que consumiera pocas larvas como a una que hubiere comido una gran cantidad. Pero en este experimento también se demostró que las larvas de T. spiralis presentes en materia fecal en los días siguientes a su inoculación experimental, no son infectivas para los hospedadores que las consuman. A diferencia de lo informado en los reportes publicados sobre el tema (Robinson & Olsen, 1960; Schnurrenberger y col.; 1964) en el presente ensayo no se hallaron en materia fecal quistes intactos ni restos de carne sin digerir. Todas las larvas se hallaron libres, con diferentes grados de enrollamiento y movilidad, pero cuando fueron inoculadas a ratones susceptibles, no desarrollaron el ciclo biológico en los mismos ni liberaron sustancias antigénicas capaces de desencadenar una respuesta de anticuerpos en los hospedadores. En este ensayo, se demostró que un modo posible de transmisión de la enfermedad es por la ingestión del intestino de ratas recientemente infectadas que contenga hembras de T. spiralis en postura de larvas recién nacidas. Este modo de transmisión da lugar a niveles de infección bajos que, de ocurrir en cerdos por predación de ratas, no se podrían detectar por la técnica diagnóstica de digestión enzimática, en las condiciones en que se realiza para liberar la carne al consumo. Existen reportes de trasplante de individuos adultos de hasta 72 horas p.i. con resultados positivos en cuanto a la producción de larvas musculares en ratones (Katz, 1960). Según Carr y col., 1979, las ratas muestran aversión a ingerir carne de individuos de la misma especie, pero tal conducta se disiparía varias horas post mortem, por modificación de las sustancias que actuarían como estímulos quimioreceptibles. A lo largo de los ensayos realizados, se ha podido observar esta conducta en ratas machos pero no en hembras, las cuales aceptan y comen inmediatamente la carne fresca de ratas recién sacrificadas. Serían necesarios nuevos estudios para determinar la frecuencia de este modo de transmisión en la colonia de ratas. Los signos clínicos de triquinelosis que podrían poner a la rata infectada en inferioridad de condiciones ante un oponente (Rau, 1984) o un predador (disminución de la actividad, capacidad de reacción disminuida, diarrea) se observaron en los grupos inoculados con 5000 y con larvas. Estos niveles de dosis individual son poco frecuentes en condiciones naturales, pero podrían ocurrir en ratas machos dominantes, que consumen cantidades de alimento mayores que el resto de la colonia (Coto, 1997).
50 Experimento II: Infección congénita y transmamaria por larvas de T. spiralis en las crías de ratas infectadas experimentalmente Introducción: Las ratas que habitan lugares donde se crían cerdos, se infectan con T. spiralis cuando consumen cadáveres o restos de faena de cerdos infectados que quedan a su disposición (Poole 1952; Leiby y col.,1990). La trasmisión al resto de la colonia ocurre por canibalismo o por consumo de cadáveres de ratas que resultan de luchas por jerarquía o por territorio o a consecuencia de enfermedades (Leiby y col., 1990). Existen además reportes sobre la posibilidad de la transmisión transplacentaria y por vía galactógena en roedores (Cosoroaba y Orjanu, 2001; Wang-ZhongQuan y col., 2005; Boulos y col., 2005). Algunos de estos reportes no hacen mención al número de larvas empleado en la infección experimental de las ratas madres o mencionan la utilización de material infectante con un muy alto numero de larvas por gramo (10000 l/g) que es poco frecuente en condiciones naturales. Por otra parte, hay trabajos que indican que en la infección por vía oral con larvas recién nacidas, como ocurriría por vía transmamaria, estas larvas tienen pocas probabilidades de producir una infección exitosa de los músculos. En este sentido, Dennis y col., 1970 inoculando larvas recién nacidas en la luz del duodeno de ratones, hallaron que ninguno de los ratones sacrificados 14 días después de la infección albergaba larvas en su musculatura. También hallaron que cuando las larvas recién nacidas eran inoculadas por vía intravenosa, el 73% se encontraban parasitando los músculos, por lo que se concluyó que era necesario que las larvas recién nacidas fueran puestas dentro de la vellosidad intestinal para que alcanzaran con éxito el torrente sanguíneo. A esto se agregaría un efecto de la leche descripto por Riedel en Este investigador demostró que la inclusión de leche en la dieta de ratones infectados experimentalmente con 100 larvas de T. spiralis, si bien no impedía el desarrollo de las larvas hasta adultos, afectaba a las larvas recién nacidas de modo que 28 días después, los ratones albergaban en sus músculos un número de larvas muy reducido con respecto al grupo al que se le administraba agua en lugar de leche. El presente experimento se llevó a cabo para determinar la posibilidad de la transmisión vertical en la colonia de ratas, empleando dosis infectivas menores, más próximas a las que pueden hallarse naturalmente y utilizando métodos parasitológicos y serológicos Objetivo: Determinar si las crías de ratas infectadas experimentalmente con T. spiralis pueden infectarse por vía transplacentaria o transmamaria Materiales y métodos Unidades experimentales: Se utilizaron ratas Wistar hembras de gramos para infectarlas con T. spiralis durante el apareamiento o el puerperio y determinar la presencia de larvas de T. spiralis en ellas y sus crías por digestión enzimática 90 días después del alumbramiento.
51 Grupos experimentales Se formaron 3 grupos de 9 ratas hembras cada uno que fueron infectados de la siguiente manera: Grupo 1: infectado 7 días después de iniciado el apareamiento Grupo 2: infectado el día del alumbramiento Grupo 3: no infectado Alojamiento de los animales: Previo y durante el apareamiento, las ratas hembras se alojaron en jaulas de alambre tejido con una bandeja inferior que permitía el uso de viruta de madera como cama. La dimensión de las jaulas era de 40 X 50 X 40 cm (Foto 1). En cada jaula se alojaron 3 ratas hembras con un macho. La administración de agua fue mediante frascos de vidrio invertidos con pico metálico. La alimentación fue ad libitum con alimento balanceado para roedores de laboratorio. La temperatura del ambiente se mantuvo en grados centígrados mediante aire acondicionado. El aire fue renovado durante 15 minutos cada hora mediante un extractor de aire Apareamiento: Tres días antes del apareamiento se agregó viruta de la cama de ratas machos a la cama de las ratas de cada grupo para promover el celo. En cada jaula de tres ratas hembras se colocó un macho durante 15 días. Al finalizar el período de apareamiento, se retiraron los machos y las hembras se alojaron en forma individual en jaulas similares a las utilizadas para el apareamiento con el agregado de una caja de acero inoxidable con viruta de madera para usar como nido (Fotos 7 y 8) Inoculación experimental: Para la inoculación de las ratas, se utilizaron larvas musculares de T. spiralis obtenidas por digestión enzimática en dosis individuales de 2000 larvas. El material infectante fue obtenido por inoculación de ratones Balb C con 800 larvas musculares de T. spiralis cada uno. Estos fueron sacrificados 45 días post-inoculación y sus músculos fueron procesados para ser utilizados como inóculo. Los procedimientos para obtención de larvas y cuantificación se tomaron de OIE, Una vez, cuantificadas las larvas se prepararon las dosis de larvas en agua a utilizar como inóculo. Las larvas en suspensión fueron administradas directamente en la boca de las ratas mediante micropipeta automática, en volúmenes de microlitros Digestión enzimática de los músculos de las madres: Luego de 90 días del alumbramiento, las ratas que parieron fueron sacrificadas por dislocación cervical bajo anestesia general obtenida por inyección intraperitoneal de ketamina combinada con xilazina. y su musculatura fue sometida a digestión enzimática para determinar el nivel de infección por larvas musculares de T. spiralis (Fotos 9 a 12)
52 Digestión enzimática de los músculos de las crías: A los 90 días de edad, las crías de las ratas infectadas y no infectadas fueron sacrificadas del mismo modo que las ratas adultas y la musculatura de cada animal fue sometida a digestión enzimática para determinar la presencia de larvas de T. spiralis y cuantificar la infección en número de larvas por gramo de carne digerida Diagnóstico serológico de triquinelosis por la técnica de ELISA: En el día 90 post parto, se obtuvieron muestras de sangre de cada una de las crías y de sus madres para someterlas al diagnóstico serológico por el test de ELISA con antígeno de excreción-secreción siguiendo los procedimientos descriptos por Gamble y col., Para la obtención del punto de corte se utilizaron sueros de ratas Wistar inoculadas experimentalmente con 500 larvas de T. spiralis y sueros de ratas no inoculadas nacidas y criadas en el bioterio del Instituto de Patobiología del CICVyA, INTA. El punto de corte se estableció como el promedio de D.O. de los sueros negativos + 3 desvíos estándar Diseño experimental: Unidades Experimentales Ratas Wistar Grupo N Infección experimental larvas en suspensión 7 días después de iniciado el apareamiento larvas en suspensión el día Sangrado de madres y crías Día 90 post parto Día 90 post parto del alumbramiento 3 9 No infectadas Día 90 post parto Necropsia de ratas paridas y/o crías Día 90 post parto/nacimiento Día 90 post parto/nacimiento 90 días de edad
53 Cronograma del ensayo: Tarea Momento de realización Formación de grupos en base al peso Día -7 Alojamiento en jaulas de apareamiento Día -7 Inducción del celo Día -3 a 0 Inicio del apareamiento Día 0 Infección experimental del grupo 1 Día 7 Observación clínica en Grupo 1 y 3 Día 7 en adelante Retirada de los machos Día 15 Alojamiento en jaulas individuales Día 16 Infección experimental del grupo 2 Día del alumbramiento Observación clínica en Grupos 2 y 3 Día del alumbramiento en adelante Destete de las crías y alojamiento en jaulas Día 35 post parto por camadas Muestreo de sangre Día 90 post parto Sacrificio y digestión enzimática Día 90 post parto Análisis estadístico: Los resultados obtenidos de las madres y los de las crías se analizaron por separado. Las cantidades de larvas recuperadas de la musculatura de las ratas madres y el nivel de infección de las camadas fueron transformados al log10 de (n+1) para normalizar y homogeneizar la variancia. Se utilizó el programa SAS (Statistical Analysis System) para efectuar el procedimiento de análisis de variancia (ANOVA) y la comparación de medias mediante el test de Tukey con un nivel de significación inferior al 5%. La hipótesis nula para los grupos 1, 2 y 3 en el caso de las madres era que las larvas recién nacidas de T. spiralis no infectarían los músculos de modo que no existirían diferencias en cuanto al número de larvas recuperadas en la digestión enzimática en los tres grupos experimentales. La hipótesis alternativa era que las larvas recién nacidas de T. spiralis tenían capacidad para infectar los músculos de las ratas madres produciendo en los grupos 1 y 2 cantidades de larvas musculares diferentes a las del grupo 3. Para las crías se asignaría el valor 1 a las camadas que tuvieran al menos 1 animal infectado con larvas musculares de T. spiralis y el valor 0 para las camadas en que no se hallara ninguna larva en ninguno de los animales que la componían. La hipótesis nula para las camadas de los 3 grupos experimentales sería que no habría diferencia en cuanto al número de camadas no infectadas respecto al Grupo 3 control no infectado. La hipótesis alternativa era que las camadas de ratas infectadas experimentalmente serían diferentes en cuanto a su nivel de infección respecto a las camadas del grupo control no infectado, verificando que la infección trasplacentaria (Grupo 1) o transmamaria (Grupo 2) era posible.
54 54 Los valores de D.O. de los sueros de las ratas madres infectadas y no infectadas se analizaron de la misma manera que las cantidades de larvas en musculatura. La hipótesis nula se confirmaría si no existían diferencias en los niveles de D.O. en los tres grupos experimentales lo que confirmaría que las larvas empleadas en la infección experimental carecían de infectividad. La hipótesis alternativa se confirmaría si existía diferencia entre los niveles de D.O. de los grupos infectados con respecto al grupo control no infectado. Respecto al análisis de la D.O. en las camadas, si en alguna de ellas existía al menos un animal con D.O. por encima del punto de corte a esa camada se le asignaría el valor 1. A las camadas en que ninguna de las crías tuviera valores de D.O. por encima del punto de corte se le asignaría el valor Resultados: En la tabla 1 se sintetizan los resultados obtenidos en todo el ensayo respecto a la digestión enzimática y al nivel de anticuerpos contra T. spiralis medidos por la técnica de ELISA tanto en las ratas madres como en sus camadas. Para ambos parámetros, los resultados obtenidos tanto en las ratas madres infectadas en el día 7 del apareamiento como en aquellas infectadas en el día del parto, fueron significativamente mayores (P<0.05) que los obtenidos en el grupo no infectado, indicando que las larvas utilizadas para la inoculación, tenían capacidad infectante normal. En ninguna de las camadas de ninguno de los grupos experimentales, hubo crías con resultados positivos a digestión enzimática ni a la técnica de ELISA, indicando que, no obstante existir en las madres el estadío infectivo de larvas recién nacidas, este no infectó a las crías por vía transplacentaria ni por vía transmamaria. En la tabla 2 se expresan los resultados de digestión enzimática (larvas /gramo) y de la técnica de ELISA (D.O.) de las ratas madres de los tres grupos experimentales. Ambos grupos infectados fueron similares entre sí y presentaron valores de cantidad de larvas/gramo y Densidad Óptica significativamente mayores (P<0.05) que el grupo de madres no infectadas.
55 55 Tabla 1: Síntesis de resultados de Digestión enzimática y de ELISA de las ratas madres y sus camadas. Grupo 1 Infectado 7 días después de iniciado el apareado Grupo 2 Infectado el día del parto Grupo 3 No infectado Madres Camadas Rata Nro. Digestión ELISA Nro. de crías Digestión +/total ELISA +/total 1 Positivo Positivo 8 0/8 0/8 2 Positivo Positivo 7 0/7 0/7 3 Positivo Positivo 9 0/9 0/9 4 Excluida Excluida Positivo Positivo 5 0/5 0/5 6 Positivo Positivo 7 0/7 0/7 7 Excluida Excluida Positivo Positivo 8 0/8 0/8 9 Positivo Positivo 8 0/8 0/8 Madres Camadas Rata Nro. Digestión ELISA Nro. de crías Digestión +/total ELISA +/total 10 Positivo Positivo 7 0/7 0/7 11 Positivo Positivo 9 0/9 0/9 12 Positivo Positivo 6 0/6 0/6 13 Positivo Positivo 10 0/10 0/10 14 Excluida Excluida Positivo Positivo 7 0/7 0/7 16 Positivo Positivo 7 0/7 0/7 17 Positivo Positivo 10 0/10 0/10 18 Positivo Positivo 7 0/7 0/7 Madres Camadas Rata Nro. Digestión ELISA Nro. de crías Digestión +/total ELISA +/total 19 Negativo Negativo 8 0/8 0/8 20 Negativo Negativo 7 0/7 0/7 21 Excluida Excluida Negativo Negativo 8 0/8 0/8 23 Negativo Negativo 7 0/7 0/7 24 Negativo Negativo 8 0/8 0/8 25 Negativo Negativo 6 0/6 0/6 26 Excluida Excluida Negativo Negativo 7 0/7 0/7 *Excluida: Las ratas que no parieron se excluyeron del grupo ELISA +: valores de Densidad Óptica (D.O.) >0.107 Digestión +: presencia de larvas de T. spiralis en sedimento de la digestión enzimática de musculatura esquelética.
56 56 Tabla 2 : Resultados individuales de Digestión enzimática (larvas/gramo) y de D.O. obtenidas por la técnica de ELISA en las ratas madres de los tres grupos experimentales en el día 90 post parto. D.O. positiva = Grupo Nro. 1 Infectado 7 días después de iniciado el apareamiento 2 Infectado el día del parto 3 No infectado Rata Nro. Larvas/ Gramo MG l/g D.O ª ª b MG D.O ª 0.944ª 0.026b a: letras diferentes en la misma columna corresponden a valores significativamente diferentes (P<0.05) En la Tabla 3 se ven los resultados de Digestión enzimática (larvas/gramo) de cada uno de los componentes de las diferentes camadas. En ninguno de los animales se hallaron larvas musculares de T. spiralis.
57 57 Tabla 3: Resultados individuales de Digestión enzimática (larvas/gramo) obtenidos de los componentes de cada una de la camadas de los tres grupos experimentales en el día 90 post parto. Grupo Nro Camada Larvas/gramo de cada componente de la camada Nro En la Tabla 4 se expresan los resultados de nivel de anticuerpos contra T. spiralis medidos por la técnica de ELISA en cada uno de los componentes de cada camada. El punto de corte, a partir del cual el resultado se consideró positivo fue la D.O , y todos los sueros dieron resultados inferiores al mismo.
58 58 Tabla 4: Valores de D.O. obtenidos del suero de cada uno de los componentes de cada camada por la Técnica de ELISA con antígeno de ES. Los valores = se consideran positivos. Grupo Camada D.O. de cada componente de la camada Nro Discusión: En las condiciones de este experimento, no fue posible transmitir la infección por T. spiralis por vía transplacentaria ni por vía transmamaria. A pesar que las ratas madres infectadas albergaron L1 de T. spiralis en su musculatura y formaron anticuerpos específicos, sus camadas no fueron infectadas por larvas recién nacidas circulantes (L1 invasoras del tejido muscular) a través de los vasos placentarios ni por ingestión de leche a través de la lactación y por ende sus músculos no albergaron L1 ni formaron anticuerpos específicos. Los resultados positivos publicados sobre transmisión transplacentaria, fueron obtenidos utilizando altas dosis infectivas. Si bien en teoría este modo de transmisión es posible, dado que la placenta de los roedores es del tipo hemocorial, los niveles de infección obtenidos en las crías por los diferentes autores (Cosoroaba y Orjanu, 2001; Wang-ZhongQuan y col., 2005; Boulos y col., 2005) son muy bajos (2-3 larvas musculares por animal) y de distribución despareja dentro de una misma camada (uno o dos animales positivos por camada).
59 59 En los experimentos en los que se obtuvieron estos resultados, las madres eran inoculadas en el primer tercio de la preñez al igual que se hizo en el presente ensayo. Recientemente Matenga y col, 2006, refirieron que era posible obtener camadas infectadas de ratas infectando a las madres con larvas de T. zimbabwensis 40 días antes del apareamiento. En este esquema de infección, para el momento en que se hace el apareamiento y transcurre el período de preñez, no existen larvas recién nacidas que puedan migrar por vía galactófora, de modo que los resultados obtenidos por estos autores podrían deberse a una migración de larvas musculares que todavía no se habrían establecido en las miofibrillas. Dadas las bajas cantidades de larvas que se hallaron parasitando las crías de ratas inoculadas experimentalmente en los ensayos mencionados y la imposibilidad de lograrlo en el presente ensayo empleando menores dosis infectantes y utilizando técnicas parasitológicas y serológicas, se puede inferir que la infección por las vías transplacentaria y/o transmamaria no es de ocurrencia frecuente en condiciones naturales y que el modo de transmisión por el que puede persistir la infección en la colonia de ratas, es el canibalismo o el consumo de carroña (Leiby y col., 1990). 2.3 Conclusiones: De los resultados de los ensayos realizados durante el desarrollo de la presente tesis se puede concluir que: 1. Ratas alimentadas con carne conteniendo larvas enquistadas de T. spiralis y que consumen una dieta natural, eliminan larvas en materia fecal en las primeras 24 hs. de haberse alimentado. Las larvas se hallan en diferentes estados de enrollamiento, con morfología similar a las L1 musculares, con movimiento o inmóviles. 2. Las presencia de larvas en materia fecal de ratas infectadas es significativamente mayor (P<0.05) cuando el material infectante utilizado son larvas en suspensión obtenidas por digestión enzimática que cuando son larvas enquistadas en carne. La digestión enzimática puede disminuir la vitalidad de una proporción de larvas y a ello se suma el efecto de la digestión en el estómago del hospedador. El resultado es la pérdida de la capacidad de las larvas para adaptarse al medio intestinal y su aparición en materia fecal. Podría inferirse que un escaso número de larvas enquistadas también es afectado por la digestión estomacal y no podría establecerse en el intestino para desarrollar hasta parásitos adultos. 3. Cuando se infecta experimentalmente a ratas, por ingestión de carne conteniendo larvas enquistadas de T. spiralis, el nivel de infección de la carne, no influye en la cantidad de larvas que salen en la materia fecal de los animales que la consumen. No hubo diferencias significativas (P>0.05) en la cantidad de larvas aisladas de materia fecal en el día 1 p.i. en grupos de ratas que consumieron carne conteniendo 2000, 5000 o larvas enquistadas.
60 60 Las cantidad de larvas presentes en materia fecal, disminuyó en el día 2 p.i. en todos los grupos, siendo significativamente menor (P<0.05) que en el día 1 p.i.; pero tampoco hubo diferencias entre los tres grupos (P>0.05) para el parámetro estudiado. En el caso que las larvas que salen en materia fecal fueren infectantes, el hallazgo de la similaridad de los tres grupos transformaría a las ratas en igualmente peligrosas desde el punto de vista de la transmisión, independiente del número de larvas consumidas. 4. La técnica de ELISA con antígeno de E.S. permite diferenciar luego de la reacción antígeno-anticuerpo, el suero de ratas infectadas y no infectadas por medición de la Densidad óptica. La misma podría llevarse a cabo con líquido tisular en lugar de suero, permitiendo el estudio de la enfermedad en animales capturados muertos, sin necesidad de someter los tejidos a digestión enzimática. Muestreando un miembro y sometiendo a congelamientodescongelamiento el tejido muscular es posible obtener una cantidad de líquido tisular suficiente para hacer el diagnóstico. 5. La combinación de métodos parasitológicos y serológicos en ensayos sobre infectividad, permite obtener datos no sólo sobre la presencia del parásito sino también sobre la relación hospedador-parásito, a través de la detección de anticuerpos, que sirven para confirmar si los parásitos utilizados tienen algún nivel de infectividad. 6. El aislamiento de larvas de la materia fecal en las ratas de los ensayos, fue posible gracias a la utilización de tamices seriados de porosidad decreciente. La eficiencia de los mismos permite aconsejar su utilización para aislar larvas de T. spiralis luego de la digestión enzimática de alimentos con alto contenido en almidones u otras sustancias, que pueden dificultar la visualización de las larvas, como es el caso de los embutidos de preparación industrial. 7. La materia fecal de ratas infectadas con larvas de T. spiralis, no constituye una fuente de infección para otros animales que tengan conducta de coprofagia. Las larvas aisladas de materia fecal en el día 1 p.i. inoculadas en ratones susceptibles, no tuvieron capacidad para desarrollar hasta adultos en el intestino y por ende no hubo larvas recién nacidas ni larvas enquistadas en los músculos. Las larvas aisladas de las boñigas conservadas por 3 y por 7 días tenían características morfológicas y funcionales de menor vitalidad que las larvas aisladas de las boñigas frescas en el día 1 p.i. El grado de enrollamiento era menor y no tenían motilidad. Dado que no se hallaron anticuerpos por la técnica de ELISA en ninguno de los ratones receptores, es posible concluir en que no hubo desarrollo de las larvas en el intestino. Los anticuerpos anti- trichinella se forman en respuesta a la liberación de sustancias antigénicas contenidas en los gránulos del esticosoma de las formas que componen el ciclo entérico y
61 61 de las mismas estructuras en las larvas musculares a partir del día de la invasión a las miofibrillas. La coprofagia no es un medio para el mantenimiento de la infección por T. spiralis en la colonia de ratas. La presencia de materia fecal de ratas infectadas en el alimento de otros animales no es un factor de riesgo de triquinelosis. 8. La ingestión de intestino de ratas infectadas recientemente, que contenga hembras de T. spiralis en postura de larvas recién nacidas, produce bajos niveles de infección en los músculos de los animales que lo ingieren. Dado que los procesos post mortem anulan este modo de transmisión, el mismo sería más importante fuera de la colonia de ratas, que dentro de ella, ya que existiría aversión de las ratas a consumir los cuerpos de otras ratas inmediatamente después de la muerte. Fuera de la colonia, si la rata cuyo intestino contiene hembras adultas en larvipostura es objeto de predación, este modo de transmisión es posible y los niveles de infección serían suficientemente bajos para no ser detectados por la técnica de digestión enzimática que se utiliza como diagnóstico post mortem para liberar la carne sin cocción a consumo. La aplicación de la técnica de ELISA para diagnosticar la enfermedad en animales provenientes de focos de triquinelosis que se someten a faena sanitaria, frecuentemente detecta un número mayor de animales positivos que los detectados por la digestión enzimática. Los niveles bajos de infección permiten explicar estos resultados. Son necesarios más estudios para determinar la existencia de otros factores que produzcan niveles bajos de infección. 9. En ratas, la infección por altas dosis de T. spiralis produce enfermedad con signos clínicos de afección, que puede disminuir la capacidad para enfrentar a un oponente o escapar de un predador. El consumo de carne infectada necesario para alcanzar dosis tan altas, podría ocurrir en ratas machos dominantes. La pérdida de reacción, que se observa desde el día 23 p.i., se debe a la inflamación del tejido muscular que produce dolor y pérdida de función. Esta condición puede favorecer la predación de la rata que, en ese momento del ciclo, ya tendría larvas de T. spiralis con capacidad infectante en sus fibras musculares (7 días p.i. para la llegada de las larvas recién nacidas al músculo días para que la larva alcance capacidad infectante) 10. La infección de ratas con una cantidad de larvas similar a la que podría ocurrir en condiciones naturales, no transmite la enfermedad a las crías por las vías transplacentaria ni transmamaria. No obstante existir en las madres el estadío infectivo de larvas recién nacidas, este no infectó a las crías por las vías mencionadas. Incluso en los reportes sobre la posibilidad de este modo de transmisión, utilizando dosis infectantes muy altas, los niveles de infección obtenidos en las crías fueron muy bajos, pudiéndose concluir en que no sería suficiente para mantener la infección en la colonia de ratas en caso que no ocurriere canibalismo.
62 62 Referencias Bibliográficas Ali Khan, Z. (1966). The post-embryonic development of Trichinella spiralis with special reference to ecdysis. J. Parasitol. 52: Anónimo (1940) Editorial en American Journal Of Public Health Vol 30, Oct Beck, R., Gaspar, A., Mihaljevic, Ž., Marinculic, A., Stojcevic, D. and Brstilo, M. (2005). Evaluation of ELISA for detection of Trichinella antibodies in muscle juice samples of naturally infected pigs. Veterinary Parasitology 132, Beerda, B., Schilder, M.B.H, Van Hooff, J., De Vries, H.J and Mol, J.A (1999). Chronic Stress in Dogs Subjected to Social and Spatial Restriction. I. Behavioral Responses. Physiology & Behavior, Vol. 66, (2), Belmain, S. (2008) Eficacia de trampas para el manejo de plaga de roedores basado en ecologia. Comunicación personal Bolpe, J., Montali, G., Caminoa, R. y Pouzo, M. (2001). Epidemiological surveillance and control of trichinellosis in Buenos Aires province. Xth ICT Conference, Aug Parasite, 8 (2), S236-S239. Boulos, L.M., Ibrahim, I.R., Said, D.E. and El-Zawawy, L.A. (2005). Congenital trichinellosis in experimentally infected mice. Journal of the Egyptian Society of Parasitology, 35(2), Britov,V.A. and Boev,S.N. (1972).Taxonomic rank of various strains of Trichinella and their circulation in nature.vestnik Akademii Nauk KSSR 28, Citado por Pozio & Murrell, 2005 Brown, T.R (1898) Studies on trichinosis, with especial reference to the increase of the eosinophilic cells in the blood and muscle, the origin of these cells and their diagnostic importance. The Journal of Experimental Medicine, Vol III, Burnham, J.C. and Despommier, D.D. (1984). Development of the male genitalia of Trichinella spiralis during the enteral phase of infection in the mouse: An SEM study. J.Parasit., 70, Butt, E. M. and Lapeyre, J. L. (1939). Trichina spiralis: Its Incidence in Necropsy Material. California and Western Medicine, 50 (5), Calcagno, M.A., Teixeira, C., Forastiero, M.A., Costantino, S.N., Venturiello, S.M. (2005) Aspectos clinicos, serologicos y parasitologicos de un brote de triquinelosis humana en Villa Mercedes, San Luis, Argentina. Las fases aguda y cronica de la infección. Medicina (Buenos Aires) 65,
63 63 Cameron, T.W.M. (1937) Trichinosis. Canadian Journal of Comparative Medicine 1(2), 5-14 Campbell, W.C. y Cuckler, A.C. (1966). Further studies on the effect of thiabendazole on trichinosis in swine, with notes on the biology of the infection. J. Parasitol. 52, Capó V. y Despommier DD. (1996) Clinical aspects of infection with Trichinella spp. Clin Microbiol. Rev, 9, Caracostantogolo, J. (2006) Mejoramiento del control de la trichinellosis en Argentina. Seminario final del Proyecto TCP ARG Instituto de Patobiología, CICVyA INTA Castelar, 05 de octubre de Caracostantogolo, J., Steffan, P., Dillon, J., De La Sota, M., Belgrano, D., Veneroni, R., Ruiz, M., Schapiro, J., Castaño, R., Martinez, M., Morici, G., Balbiani, G.,Castro, M. y Eddi, C. (2007). Mejoramiento del control de la trichinellosis en Argentina: Proyecto TCP ARG 3003 entre la FAO y el Gobierno Argentino. En Mejoramiento del control de la trichinellosis. (pp. 5-23) FAO América Latina y el Caribe. Organización de las Naciones Unidas para la Agricultura y la Alimentación, Roma. ISBN Carr, W.J., Landauer, M.R., Wiese, R.E., Marasco, E. and Thor, D.H. (1979) A natural food aversion in Norway rats. Journal of Comparative and Physiological Psychology 93, Citado por Leiby y col., Cosoroaba, I, Orjanu, N (1998). Congenital trichinellosis in the rat. Veterinary Parasitology, 77(2/3), Coto, H. Biología y Control de Ratas Sinantrópicas. Editorial Abierta. Argentina, ISBN Cristea, D., Cristea, E. and Cristea, Gh. (2004)a. The evolution of Trichinosis in men studied on necroptical data. XIth International Conference on Trichinellosis, ICT 11. August 8-12, 2004, San Diego, California. Cristea, Gh., Cristea, D., and Cristea, E. (2004)b. Intensity of Trichinella sp. infection in the pig. XIth International Conference on Trichinellosis, ICT 11. August 8-12, San Diego, California. Cui, J., Wang, Z.Q., Hang, H.M. (2004) Congenital transmission of trichinellosis in the mice. XIth International Conference on Trichinellosis, ICT 11. August 8-12, San Diego, California. Dela Sota, M. (2005) Programa de Control de la trichinellosis. Taller de Trichinellosis organizado por la FAO y el Gobierno Argentino. 28 septiembre, UNICEN, Tandil Dennis, D. T., Despommier, D. D. & Davis, N. (1970) Infectivity of the newborn larva of Trichinella spiralis in the rat. J Parasitol., 56,
64 64 Despommier, D.D.D. (1973) A circular thermal migration device for the rapid collection of large numbers of intestinal helminths. J. Parasitol., 59, Despommier, D. D., Aron, L. & Turgeon, L. (1975) Trichinella spiralis: Growth of intracellular(muscle)larva. Exp parasitol., 37, Despommier, D.D & Muller, M. (1976) The Stichosome and Its Secretion Granules in the Mature Muscle Larva of Trichinella spiralis. J. Parasitol., 62, Despommier, D.D.D. (1983) Cap. 3: Biology. En Campbell, W.C. (Ed.), Trichinella and trichinosis (pp ). Plenum Press, New York. Despommier, D.D.D. y Campbell, W.C. (1983) Synopsis of Morphology. En Campbell, W.C. (Ed.), Trichinella and trichinosis (pp ). Plenum Press, New York.. Despommier, D., Symmans, W.F., and Dellt, R. (1991). Changes in nurse cell nuclei during synchronous infection with Trichinella spiralis. J. Parasitol., 77(2), Despommier, D.D.D. (1998). How Does Trichinella spiralis Make Itself at Home? Parasitology Today, 14 (8), Elias, D.J. (1984) Roedores como plagas de productos almacenados, control y manejo. Serie Tecnología Poscosecha. Oficina Regional de la FAO para América Latina y el Caribe. Santiago, Chile Fiedler, L.A. (1990) Rodents as food source. Proceedings of the Fourteenth Vertebrate Pest Conference University of Nebraska, Lincoln pp Frank, J.F.(1951) A study on the incidence of trichinosis in wild rats in the maritime provinces. Canadian Journal of Comparative Medicine,. XV (12), Flockhart, H.A., Harrison, S.E., Dobinson, A.R. and James, E.R.(1982). Enzyme polymorphism in Trichinella. Transactions of the Royal Society of Tropical Medicine and Hygiene, 76, citado por Pozio 2005 Forbes L.B. & Gajadhar A.A. (1999). A validated Trichinella digestion assay and an associated sampling and quality assurance system for use in testing pork and horse meat. J. Food Prot., 62, FUNASA Manual de controle de roedores. Ministerio da saúde, Brazilia, dezembro de 2002) Assessoria de Comunicação e Educação em Saúde/Ascom/FUNASA
65 65 Gajadhar A.A. & Forbes L.B. (2001). An internationally recognized quality assurance system for diagnostic parasitology in animal health and food safety with example data on trichinellosis. Vet. Parasitol., 103, Gamble H.R. (1996). Detection of trichinellosis in pigs by artificial digestion and enzyme immunoassay. J. Food Prot., 59, Gamble, H.R., Anderson, W.R., Graham, C.E., Murrell, K.D., (1983). Diagnosis of swine trichinosis by enzyme-linked immunosorbent asssay (ELISA) using an excretory/secretory antigen. Vet. Parasitol. 13, Gamble, H.R., Wisnewski, N., Wasson, D.L., Diagnosis of trichinellosis in swine by enzyme immunoassay, using a synthetic glycan antigen. Am. J. Vet. Res., 58, Gamble, H.R., Bessonov, A.S., Cuperlovic, K., Gajadhar, A.A., van Knapen, F., Noeckler, K., Schenone, H. and Zhu, X. (2000) International Commission on Trichinellosis: Recommendations on methods for the control of Trichinella in domestic and wild animals intended for human consumption. Veterinary Parasitology, 93, Gardiner, Ch.H. (1976) Habitat and reproductive behavior of Trichinella spiralis. Jour. Parasitol., 62, Garkavi, B.L. (1972). Species of Trichinella isolated from wild animals. Veterinariya, 10, Citado por Murrel y col, 2000) Gómez Villafañe, I.E., Miñarro, F., Ribicich, M., Rossetti, C.A., Rossotti, D., Busch, M. (2004). Assessment of the risks of rats (Rattus norvegicus) and opossums (Didelphis albiventris) in different poultry-rearing areas in Argentina. Brazilian Journal of Microbiology, 35, Gould, S.E. (ed.), (1970). Trichinosis in Man and Animals Charles C. Thomas, Springfield, Illinois. Citado por Weatherly,1983 Guarnera, E.A., Molina, V.E. y Krivokapich, S.J. (2007) Vigilancia Epidemiológica in vivo de la Trichinellosis porcina en cerdos expuestos naturalmente a la enfermedad. En Mejoramiento del control de la trichinellosis (pp ). FAO América Latina y el Caribe. Organización de las Naciones Unidas para la Agricultura y la Alimentación, Roma. ISBN Gursch, O.F. (1949) Intestinal phase of Trichinella spiralis (Owen, 1835) Raillet, J. Parasitol, 35, Hanbury RD, Doby PB, Miller HO, Murrell KD. (1986) Trichinosis in a herd of swine: cannibalism as a major mode of transmission. J Am Vet Med Assoc., 188(10), Huici, N.C. Tesón, M., Macazaga, A. y Loverde, V. (1999). Triquinelosis en algunos animales autóctonos argentinos. Veterinaria Argentina, 155,
66 66 Jacob, E. (1941) Das Kotfressen der Caniden als eine mogliche Ursache ihrer Trichinose. Tierärztl. Wschr., 34, Citado por Robinson & Olsen, Jovic S, Djordjevic M, Kulisic Z, Pavlovic S, Radenkovic B. (2001). Infectivity of Trichinella spiralis larvae in pork buried in the ground. Parasite, 8(2 Suppl), S Katz, F.F. (1960) The oral transplantation of intestinal stages of Trichinella spiralis. The Journal of Parasitology, 46, Kozek, W.J. (1971 a) The molting pattern in Trichinella spiralis. I. A light microscopy study. J. Parasitol. 57, Kozek, W.J. (1971 b) The molting pattern in Trichinella spiralis. II. An electron microscopy study. J. Parasitol., 57, Kozek, W., Brown, J., Mayer, W., Larabell, C. and Moronne, M. (1998) Structure of Trichinella spiralis newborn larva elucidated by soft X-ray, confocal and electronic microscopy. Parasitology International, 47 (suppl.), 294. Kozek, W.J Are bacillary bands responsible for expulsion of Trichinella spiralis?. Veterinary Parasitology, 132, Krivokapich, S.J., Gonzalez Prous, C.L., Gatti, G.M., Confalonieri, V., Molina, V., Matarasso, H., Guarnera, E. (2008) Molecular evidence for a novel encapsulated genotype of Trichinella from Patagonia, Argentina. Veterinary Parasitology, 156, La Rosa, G.,Pozio, E., Rossi, P. and Murrell, K.D.(1992). Allozyme analysis of Trichinella isolates from various host species and geographic regions. Journal of Parasitology, 78, Larsh, J.E. and Race, G.J. (1975). Allergic inflammation as a hypothesis for the expulsion of worms from tissues: A review. Exp. Parasitol., 37, Citado por Weatherly, (1983) Lazarevic, A.M., Neskovic, A., Goronja, M., Golubovic, S., Komic, J., Bojic, M., Popovic, A.D. (1999) Low Incidence of Cardiac Abnormalities in Treated Trichinosis: A Prospective Study of 62 Patients from a Single-source Outbreak. The American Journal of Medicine, 107, Leiby, D.A., Duffy, C.H., Murrell, K.D. and Schad, G.A. (1990). Trichinella spiralis in an agricultural ecosystem: transmission in the rat population. J Parasitol., 76 (3), Love, R. J., Ogilvie, B. M. & McLaren, D.J. (1976) The immune mechanism which expels the intestinal stage of Trichinella spiralis from rats. Immunology, 30, 7-15
67 67 Marinier, S.L. and Alexander, A.J. (1995). Coprophagy as an Avenue for Foals of the Domestic Horse to Learn Preferences from their Dams. J theor Biol, 173, Martínez Fernández, A.R Triquinelosis. En Cordero del Campillo, M. y Rojo Vazquez, F.A. (Eds) Parasitología Veterinaria (pp ). Mc Graw Hill Interamericana de España. Matenga, E., Mukaratirwa, S., Bhebhe, E. and Willingham, A.E. (2006). Evidence of Congenital and Transmammary Transmission of Trichinella zimbabwensis in Rats. (Rattus norvegicus) and its Epidemiological Implications. Intern J Appl Res Vet Med, 4 (4), Mendes, A., Nogueira, S.S.C., Lavorenti, A. and Nogueira-Filho, S.L.G. (2000). A note on the cecotrophy behavior in capybara Hydrochaeris hydrochaeris. Applied Animal Behaviour Science, 66, Molina, V. (2002) Actualización en trichinellosis. Red de Helmintología de FAO para América Latina y el Caribe. Editada por Caracostantogolo, J.L. Montali, G., Cabral, M. y Plaza, H., (1997). Diagnóstico de Trichinella spiralis por el Método de Digestión Artificial. Dirección de Desarrollo Agropecuario y Sanidad Animal. Ministerio de Asuntos Agrarios de la provincia de Buenos Aires. Moynihan, I.W. and Musfeldt I.W (1949) A Study of the Incidence of Trichinosis in Rats in British Columbia. Canadian Journal of Comparative Medicine, XIII (6) Murrell, K.D., Anderson, W.R., Schad, G.A., Hanbury, B.S., Kazacos, D.V.M., Gamble, H.R. and Brown, D.V.M. (1986). Field evaluation of the enzymelinked immunosorbent assay for swine trichinosis: Efficacy of the excretorysecretory antigen. American Journal of Veterinary Research, 47(5), Murrell, K.D., Stringfellow, E, Dame, J.B., Leiby, D.A., Duffy, C. and Schad, G.A., (1987). Trichinella spiralis in an agricultural ecosystem. II. Evidence for natural transmission of Trichinella spiralis spiralis from domestic swine to wildlife. J. Parasitol., 73, Murrell, K.D., Lichtenfels, J.R., Zarlenga, D.S. and Pozio, E. (2000). The systematics of Trichinella with a key to species. Vet. Parasitol. 93, Murrell, K.D. (2006) The Global Situation and Prospects for Complete Control. Seminario final del proyecto TCP 3003 Mejoramiento del Control de la Trichinellosis. 5 de octubre, Instituto de Patobiología, INTA Castelar, ARGENTINA.
68 68 Nagano, I., Wu, Z., Matsuo, A., Pozio, E. and Takahashi, Y. (1999). Identification of Trichinella isolates by polymerase chain reaction-restriction fragment length polymorphism of the mitochondrial cytochrome c oxidase subunit I gene. Int. J. Parasitol., 29, Nöckler, K., Serrano, F.J., Boireau, P., Kapel, C.M.O. and Pozio, E. (2005). Experimental studies in pigs on Trichinella detection in different diagnostic matrices. Veterinary Parasitology, 132, Nolf, L.O. (1937) The transplantation of gravid Trichinella spiralis. J. Parasitol. 23, 574. Citado por Gursch, Nowakowski, Z. (2004). Intensity of Trichinella spiralis invasion in the muscles of infected sheep. Medycyna Weterynaryjna, 60(6), OIE (2004) Oficina Internacional de Epizootias Trichinellosis Manual of diagnostic tests and vaccines for terrestrial animals chapter Oivanen, L., Mikkonen, T., Haltia, L., Karhula, H., Saloniemi, H. and Sukura, A. (2002). Persistence of Trichinella spiralis in Rat Carcasses Experimentally Mixed in Different Feed. Acta vet. scand., 43, Olsen, B.S., Villella, J.B. and Gould, S.E. (1964) Distribution of Trichinella spiralis in muscles of experimentally infected swine. J. Parasitol., 50, Painter, J.A., Mølbak, K., Sonne-Hansen, J., Barrett, J., Wells, J.G. and Tauxe, R.V. (2004). Salmonella-based Rodenticides and Public Health. Emerging Infectious Diseases, 10 (6), Pawlowski, Z. S. (1983). Clinical aspects in man. En Campbell, W.C. (Ed.), Trichinella and trichinosis (pp ). Plenum Press, New York. Polvere, R.I., Kabbash, C.A., Capó, V.A., Kadan, I. and Despommier, D.D. (1997). Trichinella spiralis: Synthesis of Type IV and Type VI Collagen during Nurse Cell Formation. Exper. Parasitol. 86, Poole, J.B.(1952) A survey of the incidence of trichinosis in rats in British Columbia.Canadian Journal of Comparative Medicine, XVI (8), Pozio, E., La Rosa, G., Rossi, P. and Murrell, K.D., (1992a). Biological characterizations of Trichinella isolates from various host species and geographic regions. J. Parasitol. 78, Pozio, E., La Rosa, G., Murrell, K.D. and Lichtenfels, J.R. (1992b).Taxonomic revision of the genus Trichinella. Journal of Parasitology, 78, Pozio, E. (2000). Factors affecting the flow among domestic, synanthropic and sylvatic cycles of Trichinella. Veterinary Parasitology, 93,
69 69 Pozio, E., (2001). New patterns of Trichinella infections. Vet. Parasitol. 98: Pozio, E., Foggin, C.M., Marucci, G., La Rosa, G., Sacchi, L., Corona, S., Rossi, P. and Mukaratirwa, S. (2002a). Trichinella zimbabwensis n.sp. (Nematoda), a new non encapsulated species from crocodiles (Crocodylus niloticus) in Zimbabwe also infecting mammals. Int. J. Parasitol., 32, Pozio, E., Sofronic Milosavljevic, L.J., Gomez Morales, M.A., Boireau, P. and Nockler, K. (2002b). Evaluation of ELISA and Western blot analysis using three antigens to detect anti-trichinella IgG in horses. Vet. Parasitol. 108, Pozio, E. (2005) The broad spectrum of Trichinella hosts: From cold to warmblooded animals. Veterinary Parasitology, 132, 3 11 Pozio, E. and Zarlenga, D.S. (2005) Recent advances on the taxonomy, systematics and epidemiology of Trichinella. International Journal for Parasitology, 35, Pozio, E. and Murrell, K.D. (2006) Systematics and Epidemiology of Trichinella. Advances in Parasitology, 63, Rau, M.E. (1983) Establishment and maintenance of behavioural dominance in male mice infected with Trichinella spiralis. Parasitology, 86, Rau, M.E. (1984) Loss of behavioural dominance in male mice infected with Trichinella spiralis. Parasitology, 88, Rau, M.E. (1985) The effect of Trichinella spiralis infection of pregnant mice on the future behavior of their offspring. J. Parasit., 71, Ribicich, M, Gamble, H.R, Santillan, G, Miguez, M, Molina, V, Guarnera, E, Basso, N. and Franco, A. (2000). Evaluation of ELISA test for the diagnosis of porcine trichinellosis. The Pig Journal, 46, Ribicich, M. (2002) Actualización en Trichinellosis Red de Helmintología de FAO para América Latina y el Caribe. Ribicich, M., Gamble, H.R., Rosa, A., Sommerfelt, I., Marquez, A., Mira, G., Cardillo, N., Cattaneo, M.L., Falzoni, E. and Franco, A. (2007) Clinical, haematological, biochemical and economic impacts of Trichinella spiralis infection in pigs. Veterinary Parasitology, 147, Riedel, B. (1949) Milk as source of some protection against the acquisition of Trichinella spiralis in mice. The Journal of Parasitology, 35(1), 27-30
70 70 Robinson, H.A & Olsen, O.W. (1960) The role of rats and mice in the transmission of the porkworm Trichinella spiralis (Owens 1835) Raillet The Journal of Parasitology, 46(5), Roth, H. (1938) Experimental studies on the course of trichina infection in guinea pigs. I. The minimum dose of trichina larvae required to produce infestation of the muscles, with an account of the potential productiveness of the female trichina. Amer. Jour. Hyg., 28, Citado por Gursch, Ruitenberg E.J., Steerenberg P.A., Brosi B.J. and Buys J.(1974) Serodiagnosis of Trichinella spiralis infections in pigs by enzyme-linked immunosorbent assays. Bull World Health Organ., 51, Ruiz, M., Schapiro, J., Martinez, M., Castaño, R., Morici, G., Cutullé, Ch., Balbiani, G., Castro, M. y Caracostantogolo, J. (2005) Distribución de larvas de Trichinella spiralis en músculos de porcinos infectados experimentalmente y detección de infectividad posterior a la congelación. XVII Congreso Latinoamericano de Parasitología, 23 al 26 de Noviembre, Mar del Plata, Argentina Ruiz,M, Castaño Zubieta R, Martinez M, Schapiro,J. Cutullé, Morici G, Castro M, Balbiani G y Caracostantogolo J. (2007) Guia de procedimientos para el diagnóstico de Trichinellosis en Medicina Veterinaria. En Mejoramiento del control de la trichinellosis (pp ). FAO América Latina y el Caribe. Organización de las Naciones Unidas para la Agricultura y la Alimentación, Roma. ISBN Ruiz M. y Martinez, M.L. (2007) Trichinellosis: Técnica Inmunoenzimatica de diagnostico (ELISA). En Mejoramiento del control de la trichinellosis (pp.84-87). FAO América Latina y el Caribe. Organización de las Naciones Unidas para la Agricultura y la Alimentación, Roma. ISBN Ruiz, M., Martinez, M., Morici, G., Castaño Zubieta, R., Soprano, L., Balbiani, G., Schapiro, J., Castro, M., Belgrano, D., Veneroni, R., Medicina,V., Caracostantogolo, J.L. y Eddi, C.S. (2008). Serología de Triquinelosis en Cerdos de Producciones Familiares. VIII Congreso Argentino de Protozoología y Enfermedades Parasitarias. 2 al 5 de Noviembre. Rosario, Santa Fe, Argentina. Ruiz, ML. y Morici, G.(2008) Importancia de las técnicas de diagnóstico serológicas en Trichinellosis porcina: Técnica Inmunoenzimática de diagnóstico (ELISA) En Cacchione, R.A., Durlach, R., Martino, P. (Eds.).Temas de Zoonosis IV. Asociación Argentina de Zoonosis. Buenos Aires. Sawitz, W. (1937). Are Post-Mortem Statistics on Trichinosis Valid for the Living Population? American Journal Of Public Health, 27,
71 71 Schad, G.A., Leiby, D.A. and Murrell, K.D. (1984) Distribution, prevalence and intensity of Trichinella spiralis infection in furbearing mammals of Pennsylvania. J.Parasit., 70, Schad, G.A., Duffy, C.H., Leiby, D.A., Murrell, K.D. and Zirkle, E.W. (1987) Trichinella spiralis in an agricultural ecosystem: transmission under natural and experimentally modified on-farm conditions. J Parasitol., 73(1), Schnurrenberger, P.R, Masterson, R.A, Suessenguth, H., and Bashe, W.J. (1964). Swine trichinosis. I. Fecal transmission under simulated field conditions. Am. J. Vet. Res., 25, SENASA (2006) Resolución 555/2006 Programa de Control y Erradicación de la Triquinosis Porcina en la República Argentina. Smith, H. J. (1975) Trichinae in Tail Musculature of Swine. Can. J. comp. Med., 39, Smyth, J.D. (1994) Introduction to Animal Parasitology. Third edition Cambridge University Press. Spindler, L.A. (1953) Transmission of Trichinae to Swine Through Feces. The Journal of Parasitology, 39(4) (Supplement), 34. Steffan, P. (2006) Trichinella y trichinellosis: Biología, Epidemiología y enfermedad en el hombre. Taller de Trichinellosis organizado por la FAO y el Gobierno Argentino. 29 de marzo, Comodoro Rivadavia, Argentina. Stojcevic, D., Zivicnjak, T., Marinculic, A., Marucci, G., Andelko, G., Brstilo, M., Pavo, L. and Pozio, E.( 2004) The epidemiological investigation of Trichinella infection in brown rats (Rattus norvegicus) and domestic pigs in Croatia suggests that rats are not a reservoir at the farm level. J Parasitol. 90(3), Takahashi, Y., Mizuno, N., Suzuki, H., Aisaka, A. and Araki, T. (1989). Morphological study of the stichocyte granules of Trichinella spiralis muscle larvae. Japanese Journal of Parasitology, 38,77-85 citado por Takahashi y col., Teixeira, C. (2006) Sintomatología de la Trichinellosis. Taller Teórico Práctico sobre Trichinellosis organizado por la FAO y el Gobierno Argentino. 4 de agosto, Villa Mercedes, San Luis, Argentina. Thacker, J.L. (2001) Long- Acting Anticoagulant Rodenticides, Minnesota Poison Control System, Hennepin County Medical Center. Iowa Statewide Poison Control Center.
72 72 Timm, R.M. (1994) Norway rats. In Scott E. Hygnstrom, Robert M. Timm, Gary E. Larson (Eds.) Prevention and Control of Wildlife Damage. University of Nebraska-Lincoln. 2 vols. mhandbook Troncoso, A., Gulotta, H., Carranza, C., Errobidart, C., Espinosa, G. y Bava, J. (2002) Trinquinosis (sic) asociada al consumo de carne de caballo. Primer caso en Argentina. Pren. Med. Argent., 89, Van Knapen, F., Franchimont, J.H., Ruitenberg, E.J., Baldelli, J., Bradley, J., Gibson,T.E., Gottal,C.,Henriksen, S.A., Kohler,G., Skovgaard, N., Soule, C. and Taylor, S.M. (1980). Comparison of the enzyme-linked immunosorbent assay (ELISA) with three other methods for the detection of Trichinella spiralis infections in pigs. Vet. Parasitol., 7, Venturiello, S.M., Ben, G.J.M, Costantino, S.N., Malmassari, S.L, Nuñez, G.G., Veneroni, R.L. and Traversa, M.J.(1998). Diagnosis of porcine trichinellosis: parasitological and immunoserological tests in pigs from endemic areas of Argentina. Veterinary Parasitology, 74, Venturiello, S.M. (2002) Actualización en trichinellosis. Red de Helmintología de FAO para América Latina y el Caribe. Editada por Caracostantogolo, J.L. Verdier, M. (2007) Trichinellosis porcina: Estudios realizados en el Partido de Rauch (Buenos Aires). En Mejoramiento del control de la trichinellosis (pp ). FAO América Latina y el Caribe. Organización de las Naciones Unidas para la Agricultura y la Alimentación, Roma. ISBN Villela, J.B. (1966) Morphologic criteria for distinguishing the sex of Trichinella spiralis larvae from muscle. J. Parasitol., 52, Wang, Ch. (1997) Study of biological properties of Trichinella spiralis newborn larvae and the antiparasitic mucosal immunity of the host Frontiers in Bioscience, 2, Wang-ZhongQuan, Han-HuaMin, Cui-Jing (2005) Preliminary study on congenital transmission of Trichinella spiralis in mice. Chinese-Journal-of- Parasitology-and-Parasitic-Diseases, 23(3), Weatherly, N.F. (1983) Anatomical Pathology. En Campbell, W.C. (Ed.), Trichinella and trichinosis (pp ). Plenum Press, New York.. Whisson, D. (1996) Rodenticides for Control of Norway Rats, Roof Rats and House Mice. Poultry Fact Sheet No. 23. Cooperative Extension University of California
73 73 Wright, W.H (1939) Studies on Trichinosis: XI. The Epidemiology of Trichinella spiralis. Infestation and Measures Indicated for the Control of Trichinosis. American Journal of Public Health, 29, Wright, W.H. (1943) Public Health Problems Concerned in the Disposal of Garbage by Feeding It to Swine. American Journal Of Public Health, 33, Wright K. (1979) Trichinella spiralis: an intracelular parasite in the intestinal phase. J. Parasitol., 65, Wu, L. (1955) Studies on Trichinella spiralis I. Male an female reproductive systems. J. Parasitol., 41, Zimmermann, W.J. (1983). Surveillance in swine and other animals by muscle examination. En Campbell, W.C. (Ed.), Trichinella and trichinosis (pp ). Plenum Press. New York.
74 74 APENDICE I: RESULTADOS DE ANALISIS ESTADISTICOS
75 75 Resultados del Análisis estadístico para determinar el efecto de la dieta sobre el número de larvas de T. spiralis presente en materia fecal. OBS GROUP WORMS
76 76 ANALISIS DE VARIANZA Larvas T. spiralis en MF 2000 LARVAS EN CARNE Grupo 1 Dieta natural 24H ; Grupo 2 Al. balanceado 24H Grupo 3 Dieta natural 48H ; Grupo 4 Al. balanceado 48H Grupo 5 Dieta natural 72H ; Grupo 6 Al. Balanceado 72H Analysis of Variance Procedure Class Level Information Class Levels Values GROUP Number of observations in data set = 36 Dependent Variable: WORMS Sum of Mean Source DF Squares Square F Value Pr > F Model Error Corrected Total Dependent Variable: WORMS R-Square C.V. Root MSE WORMS Mean Source DF Anova SS Mean Square F Value Pr > F GROUP Ryan-Einot-Gabriel-Welsch Multiple Range Test for variable: WORMS NOTE: This test controls the type I experimentwise error rate. Alpha= 0.05 df= 30 MSE= Number of Means Critical Range Means with the same letter are not significantly different. REGWQ Grouping Mean N GROUP A A B B B B
77 77 Tukey's Studentized Range (HSD) Test for variable: WORMS NOTE: This test controls the type I experimentwise error rate, but generally has a higher type II error rate than REGWQ. Alpha= 0.05 df= 30 MSE= Critical Value of Studentized Range= Minimum Significant Difference= Means with the same letter are not significantly different. Tukey Grouping Mean N GROUP A A B B B B Bonferroni (Dunn) T tests for variable: WORMS NOTE: This test controls the type I experimentwise error rate, but generally has a higher type II error rate than REGWQ. Alpha= 0.05 df= 30 MSE= Critical Value of T= 3.19 Minimum Significant Difference= Means with the same letter are not significantly different. Bon Grouping Mean N GROUP A A B B B B
78 78 Resultados del Análisis estadístico para determinar el efecto del tipo de material infectivo sobre el número de larvas de T. spiralis presente en materia fecal. OBS GROUP WORMS
79 79 ANALISIS DE VARIANZA Larvas T. spiralis en MF Grupo 1 Larvas en carne 24H ; Grupo 2 Larvas en suspension 24H Grupo 3 Larvas en carne 48H ; Grupo 4 Larvas en suspension 48H Grupo 5 Larvas en carne 72H ; Grupo 6 Larvas en suspension 72H Analysis of Variance Procedure Class Level Information Class Levels Values GROUP Number of observations in data set = 36 Dependent Variable: WORMS Sum of Mean Source DF Squares Square F Value Pr > F Model Error Corrected Total R-Square C.V. Root MSE WORMS Mean Dependent Variable: WORMS Source DF Anova SS Mean Square F Value Pr > F GROUP Ryan-Einot-Gabriel-Welsch Multiple Range Test for variable: WORMS NOTE: This test controls the type I experimentwise error rate. Alpha= 0.05 df= 30 MSE= Number of Means Critical Range Means with the same letter are not significantly different. REGWQ Grouping Mean N GROUP A B B C D D
80 80 Bonferroni (Dunn) T tests for variable: WORMS NOTE: This test controls the type I experimentwise error rate, but generally has a higher type II error rate than REGWQ. Alpha= 0.05 df= 30 MSE= Critical Value of T= 3.19 Minimum Significant Difference= Means with the same letter are not significantly different. Bon Grouping Mean N GROUP A B B C D D Tukey's Studentized Range (HSD) Test for variable: WORMS NOTE: This test controls the type I experimentwise error rate, but generally has a higher type II error rate than REGWQ. Alpha= 0.05 df= 30 MSE= Critical Value of Studentized Range= Minimum Significant Difference= Means with the same letter are not significantly different. Tukey Grouping Mean N GROUP A B B C D D
81 81 Resultados del Análisis estadístico para determinar el efecto de la dosis infectiva sobre el número de larvas de T. spiralis presente en materia fecal. OBS GROUP WORMS
82 82 ANALISIS DE VARIANZA Larvas T. spiralis en MF Grupo 1 Carne 2000 lar. 24H ; Grupo 2 Carne 5000 lar. 24H Grupo 3 Carne lar. 24H ; Grupo 4 Carne 2000 lar. 48H Grupo 5 Carne 5000 lar. 48H; Grupo 6 Carne lar. 48H Grupo 7 Carne 2000 lar. 72H; Grupo 8 Carne 5000 lar. 72H Grupo 9 Carne lar. 72H Analysis of Variance Procedure Class Level Information Class Levels Values GROUP Number of observations in data set = 54 Dependent Variable: WORMS Sum of Mean Source DF Squares Square F Value Pr > F Model Error Corrected Total Dependent Variable: WORMS R-Square C.V. Root MSE WORMS Mean Source DF Anova SS Mean Square F Value Pr > F GROUP Ryan-Einot-Gabriel-Welsch Multiple Range Test for variable: WORMS NOTE: This test controls the type I experimentwise error rate. Alpha= 0.05 df= 45 MSE= Number of Means Critical Range Number of Means Critical Range Means with the same letter are not significantly different. REGWQ Grouping Mean N GROUP A A A B B B B B B
83 83 Bonferroni (Dunn) T tests for variable: WORMS NOTE: This test controls the type I experimentwise error rate, but generally has a higher type II error rate than REGWQ. Alpha= 0.05 df= 45 MSE= Critical Value of T= 3.41 Minimum Significant Difference= Means with the same letter are not significantly different. Bon Grouping Mean N GROUP A A A B B B B B B Tukey's Studentized Range (HSD) Test for variable: WORMS NOTE: This test controls the type I experimentwise error rate, but generally has a higher type II error rate than REGWQ. Alpha= 0.05 df= 45 MSE= Critical Value of Studentized Range= Minimum Significant Difference= Means with the same letter are not significantly different. Tukey Grouping Mean N GROUP A A A B B B B B B
84 84 Anális is estadístico de los datos de digestión enzimática de los ratones receptores. ANALISIS DE VARIANZA Infectividad de Larvas T. spiralis en MF Grupo 1 Larvas de Digestion ; Grupo 2 Larvas de MF 24H PI Grupo 3 Larvas de MF conservadas 3 dias ; Grupo 4 Larvas MF conservadas 7 dias Resultados de Digestion enzimatica OBS GROUP WORMS
85 85 Analysis of Variance Procedure Class Level Information Class Levels Values GROUP Number of observations in data set = 24 Dependent Variable: WORMS Sum of Mean Source DF Squares Square F Value Pr > F Model Error Corrected Total Dependent Variable: WORMS R-Square C.V. Root MSE WORMS Mean Source DF Anova SS Mean Square F Value Pr > F GROUP Ryan-Einot-Gabriel-Welsch Multiple Range Test for variable: WORMS NOTE: This test controls the type I experimentwise error rate. Alpha= 0.05 df= 20 MSE= Number of Means Critical Range Means with the same letter are not significantly different. REGWQ Grouping Mean N GROUP A B B
86 86 Análisis estadístico de los datos de densidad óptica de los ratones receptores. ANALISIS DE VARIANZA Infectividad de Larvas T. spiralis en MF Grupo 1 Larvas de Digestion ; Grupo 2 Larvas de MF 24H PI Grupo 3 Larvas de MF conservadas 3 dias ; Grupo 4 Larvas MF conservadas 7 dias OBS GROUP WORMS
87 87 Analysis of Variance Procedure Class Level Information Class Levels Values GROUP Number of observations in data set = 24 Dependent Variable: WORMS Sum of Mean Source DF Squares Square F Value Pr > F Model Error Corrected Total R-Square C.V. Root MSE WORMS Mean Dependent Variable: WORMS Source DF Anova SS Mean Square F Value Pr > F GROUP Ryan-Einot-Gabriel-Welsch Multiple Range Test for variable: WORMS NOTE: This test controls the type I experimentwise error rate. Alpha= 0.05 df= 20 MSE= Number of Means Critical Range Means with the same letter are not significantly different. Analysis of Variance Procedure REGWQ Grouping Mean N GROUP A B B B
88 88 ANALISIS DE VARIANZA Transmision congenita y transmamaria. Grupo 1 inoculacion dia 7 de apareamiento; Grupo 2 inoculacion dia del parto; Grupo 3 no inoculadas DIGESTION ENZIMATICA DE LAS RATAS MADRES OBS GROUP DE
89 89 General Linear Models Procedure Class Level Information Class Levels Values GROUP Number of observations in data set = 22 Dependent Variable: DE Sum of Mean Source DF Squares Square F Value Pr > F Model Error Corrected Total R-Square C.V. Root MSE DE Mean Dependent Variable: DE Source DF Type I SS Mean Square F Value Pr > F GROUP Source DF Type III SS Mean Square F Value Pr > F GROUP Ryan-Einot-Gabriel-Welsch Multiple Range Test for variable: DE NOTE: This test controls the type I experimentwise error rate. Alpha= 0.05 df= 19 MSE= WARNING: Cell sizes are not equal. Harmonic Mean of cell sizes= Number of Means 2 3 Critical Range Means with the same letter are not significantly different. REGWQ Grouping Mean N GROUP A A B
90 90 ANALISIS DE VARIANZA Transmision congenita y transmamaria. Grupo 1 inoculacion dia 7 de apareamiento; Grupo 2 inoculacion dia del parto; Grupo 3 no inoculadas DENSIDAD OPTICA DE LAS RATAS MADRES OBS GROUP DO
91 91 General Linear Models Procedure Class Level Information Class Levels Values GROUP Number of observations in data set = 22 Dependent Variable: DO Sum of Mean Source DF Squares Square F Value Pr > F Model Error Corrected Total Dependent Variable: DO R-Square C.V. Root MSE DO Mean General Linear Models Procedure Source DF Type I SS Mean Square F Value Pr > F GROUP Source DF Type III SS Mean Square F Value Pr > F GROUP General Linear Models Procedure Ryan-Einot-Gabriel-Welsch Multiple Range Test for variable: DO NOTE: This test controls the type I experimentwise error rate. Alpha= 0.05 df= 19 MSE= WARNING: Cell sizes are not equal. Harmonic Mean of cell sizes= Number of Means 2 3 Critical Range Means with the same letter are not significantly different. REGWQ Grouping Mean N GROUP A A B
92 APENDICE II: FOTOS 92
93 93 Foto 1: Jaula para ratas de 40X50X40 cm con piso enrejado Foto 2: Jaulas para ratones
94 94 Foto 3: Actividad normal: las ratas prestan atención al ambiente en el momento de la observación de los signos clínicos. Foto 4: Estado febril: La rata permanece echada, con el pelo erizado, ojos entrecerrados, ajena al ambiente
95 95 Foto 5: Edema palpebral: Observado en algunas ratas inoculadas con 5000 y con larvas de T. spiralis Foto 6: Reacción disminuida: cuando la rata es depositada de lado en el piso de la jaula, no se incorpora rápidamente.
96 96 Foto 7: Caja de acero inoxidable con viruta dentro de la jaula de piso enrejado Durante los primeros 10 días la rata solamente deja el nido para alimentarse y no lleva comida al mismo. Foto 8. Cuando las crías crecen, la rata pasa más tiempo fuera del nido y lleva comida al mismo para que las crías se familiaricen con sus caracteres. Podría llevar carne?
97 97 Foto 9: Digestión enzimática de los músculos sobre agitadores magnéticos calefaccionados. Foto 10: Sedimentación en ampollas Squibb luego de la digestión enzimática.
98 98 Foto 11. Sedimentación en tubos cónicos previa a la visualización microscópica. Pueden verse las cámaras acrílicas para conteo. Foto 12. Larvas musculares de T. spiralis obtenidas por digestión enzimática.
Género Trichinella. Jorge Caracostantogolo MV MSc Instituto de Patobiología CICVyA INTA Castelar, ARGENTINA
 Género Trichinella Jorge Caracostantogolo MV MSc Instituto de Patobiología CICVyA INTA Castelar, ARGENTINA Phylum Nemathelminthes, Rudolphi, 1808 Clase Nematoda Orden Tricocephallida Superfamilia trichuroidea
Género Trichinella Jorge Caracostantogolo MV MSc Instituto de Patobiología CICVyA INTA Castelar, ARGENTINA Phylum Nemathelminthes, Rudolphi, 1808 Clase Nematoda Orden Tricocephallida Superfamilia trichuroidea
Triquinelosis. Jorge Caracostantogolo MV MSc Instituto de Patobiología CICVyA INTA Castelar, ARGENTINA
 Triquinelosis Jorge Caracostantogolo MV MSc Instituto de Patobiología CICVyA INTA Castelar, ARGENTINA La triquinelosis es una enfermedad parasitaria zoonótica trasmitida por alimentos. 1 Los alimentos
Triquinelosis Jorge Caracostantogolo MV MSc Instituto de Patobiología CICVyA INTA Castelar, ARGENTINA La triquinelosis es una enfermedad parasitaria zoonótica trasmitida por alimentos. 1 Los alimentos
TRIQUINOSIS. Claves para trabajar con los alumnos
 TRIQUINOSIS. Claves para trabajar con los alumnos Qué es? La triquinosis es una enfermedad parasitaria. Las personas se enferman al consumir carne insuficientemente cocida o productos elaborados con carne
TRIQUINOSIS. Claves para trabajar con los alumnos Qué es? La triquinosis es una enfermedad parasitaria. Las personas se enferman al consumir carne insuficientemente cocida o productos elaborados con carne
LABORATORIO No. 2 HELMINTOS INTESTINALES
 LABORATORIO No. 2 HELMINTOS INTESTINALES GENERALIDADES: Los helmintos, comúnmente llamados gusanos, están ampliamente distribuidos en la naturaleza. Muchos de ellos son de vida libre y otros se han adaptado
LABORATORIO No. 2 HELMINTOS INTESTINALES GENERALIDADES: Los helmintos, comúnmente llamados gusanos, están ampliamente distribuidos en la naturaleza. Muchos de ellos son de vida libre y otros se han adaptado
PHYLUM: Pentastomida
 PHYLUM: Pentastomida Endoparásitos obligados de las vías respiratorias de aves, mamíferos, reptiles y peces. Morfología externa Cuerpo alargado, aplanado o cilíndrico, con simetría bilateral y dividido
PHYLUM: Pentastomida Endoparásitos obligados de las vías respiratorias de aves, mamíferos, reptiles y peces. Morfología externa Cuerpo alargado, aplanado o cilíndrico, con simetría bilateral y dividido
Conferencia No. 5 Ciencias Biológicas del nivel I
 Conferencia No. 5 Ciencias Biológicas del nivel I SUMARIO 1 2 Sistema Digestivo. Sistema Urogenital. 3 4 Sistema Digestivo ESTRUCTURA Está constituido por los siguientes órganos: cavidad bucal, faringe,
Conferencia No. 5 Ciencias Biológicas del nivel I SUMARIO 1 2 Sistema Digestivo. Sistema Urogenital. 3 4 Sistema Digestivo ESTRUCTURA Está constituido por los siguientes órganos: cavidad bucal, faringe,
NEMATODOS Enterobius vermicularis Trichinella spiralis
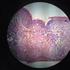 NEMATODOS Miles de especies son parásitos de plantas, invertebrados y vertebrados. Algunos son exclusivamente parásitos del hombre como Enterobius vermicularis, otros tienen varios huéspedes mamíferos
NEMATODOS Miles de especies son parásitos de plantas, invertebrados y vertebrados. Algunos son exclusivamente parásitos del hombre como Enterobius vermicularis, otros tienen varios huéspedes mamíferos
La reproducción humana:
 5º EPO La reproducción humana: El aparato reproductor masculino: El aparato reproductor masculino es el encargado de producir los espermatozoides. La siguiente imagen muestra las partes de las que consta
5º EPO La reproducción humana: El aparato reproductor masculino: El aparato reproductor masculino es el encargado de producir los espermatozoides. La siguiente imagen muestra las partes de las que consta
Triquinosis Trichinella
 Triquinosis CIE - 9 124: CIE -10 B75 infección parasitaria endémica producida por nematodos del género Trichinella transmitida por carnivorismo y caracterizada por un síndrome febril, signos oculopalpebrales,
Triquinosis CIE - 9 124: CIE -10 B75 infección parasitaria endémica producida por nematodos del género Trichinella transmitida por carnivorismo y caracterizada por un síndrome febril, signos oculopalpebrales,
Conferencia No. 1 Ciencias Biológicas del nivel II
 Conferencia No. 1 Ciencias Biológicas del nivel II SUMARIO 1 2 3 4 Sistema Respiratorio. Sistema Circulatorio. Sistema Digestivo. Sistema Urogenital Sistema Respiratorio El sistema respiratorio asegura
Conferencia No. 1 Ciencias Biológicas del nivel II SUMARIO 1 2 3 4 Sistema Respiratorio. Sistema Circulatorio. Sistema Digestivo. Sistema Urogenital Sistema Respiratorio El sistema respiratorio asegura
LABORATORIO No. 3 HELMINTOS INTESTINALES
 LABORATORIO No. 3 HELMINTOS INTESTINALES PARTE I: NEMÁTODOS (Cont...) Uncinarias: Se conoce con este nombre principalmente dos parásitos: Necator americanus y Ancylostoma duodenale entre estos adultos
LABORATORIO No. 3 HELMINTOS INTESTINALES PARTE I: NEMÁTODOS (Cont...) Uncinarias: Se conoce con este nombre principalmente dos parásitos: Necator americanus y Ancylostoma duodenale entre estos adultos
Cómo se llega a INTA???
 Cómo se llega a INTA??? http://helminto.inta.gob.ar/patobiologia/contactos Cátedra de Parasitología Veterinaria USAL Prof. Titular: Jorge Caracostantogolo MV MSc Profesor Adjunto: Javier Schapiro MV DrMV
Cómo se llega a INTA??? http://helminto.inta.gob.ar/patobiologia/contactos Cátedra de Parasitología Veterinaria USAL Prof. Titular: Jorge Caracostantogolo MV MSc Profesor Adjunto: Javier Schapiro MV DrMV
Brotes de triquinosis/trichinellosis en distintas jurisdicciones del país
 COMUNICACIÓN Brotes de triquinosis/trichinellosis en distintas jurisdicciones del país 9 de septiembre de 2016 SE 36 Ante la ocurrencia de distintos brotes de triquinosis en las provincias de Argentina
COMUNICACIÓN Brotes de triquinosis/trichinellosis en distintas jurisdicciones del país 9 de septiembre de 2016 SE 36 Ante la ocurrencia de distintos brotes de triquinosis en las provincias de Argentina
E S P E C I A L I D A D E N S A L U D P Ú B L I C A V E T E R I N A R I A
 F A C U L T A D D E C I E N C I A S V E T E R I N A R I A S U N L P A M E S P E C I A L I D A D E N S A L U D P Ú B L I C A V E T E R I N A R I A E V A L U A C I Ó N D E U N P R O G R A M A D E C O N T
F A C U L T A D D E C I E N C I A S V E T E R I N A R I A S U N L P A M E S P E C I A L I D A D E N S A L U D P Ú B L I C A V E T E R I N A R I A E V A L U A C I Ó N D E U N P R O G R A M A D E C O N T
HACIA UN CONTROL PARASITARIO EFICIENTE
 CICLO DE VIDA EPIDEMIOLOGIA RESISTENCIA METODOS DE CONTROL HACIA UN CONTROL PARASITARIO EFICIENTE Para que las medidas de control parasitario tengan éxito, se debe comprender el ciclo de vida y la epidemiología
CICLO DE VIDA EPIDEMIOLOGIA RESISTENCIA METODOS DE CONTROL HACIA UN CONTROL PARASITARIO EFICIENTE Para que las medidas de control parasitario tengan éxito, se debe comprender el ciclo de vida y la epidemiología
UNIVERSIDAD ESTATAL A DISTANCIA COLEGIO NACIONAL DE EDUCACIÓN A DISTANCIA
 UNIVERSIDAD ESTATAL A DISTANCIA COLEGIO NACIONAL DE EDUCACIÓN A DISTANCIA Extraclase de Ciencias Código: 80014 9 año Responsable: Coordinación Académica 221 29 95 / 2223 72 21 PRIMER SEMESTRE 2017 Extraclase
UNIVERSIDAD ESTATAL A DISTANCIA COLEGIO NACIONAL DE EDUCACIÓN A DISTANCIA Extraclase de Ciencias Código: 80014 9 año Responsable: Coordinación Académica 221 29 95 / 2223 72 21 PRIMER SEMESTRE 2017 Extraclase
8. REPRODUCCIÓN SEXUAL DE LOS ANIMALES
 8. REPRODUCCIÓN SEXUAL DE LOS ANIMALES La mayoría de los animales se reproducen sexualmente. Proceso en tres etapas: Formación de gametos. Fecundación. Desarrollo embrionario. 8. REPRODUCCIÓN SEXUAL DE
8. REPRODUCCIÓN SEXUAL DE LOS ANIMALES La mayoría de los animales se reproducen sexualmente. Proceso en tres etapas: Formación de gametos. Fecundación. Desarrollo embrionario. 8. REPRODUCCIÓN SEXUAL DE
En un organismo unicelular, como una bacteria o un protista, la célula única debe realizar todas las funciones necesarias para la vida.
 HISTOLOGIA HUMANA OBJETIVOS: Conocer los diferentes tipos de tejido que posee el cuerpo humano. Aprender a diferenciar los 4 tipos de tejidos fundamentales y conocer sus funciones. Conocer superficialmente
HISTOLOGIA HUMANA OBJETIVOS: Conocer los diferentes tipos de tejido que posee el cuerpo humano. Aprender a diferenciar los 4 tipos de tejidos fundamentales y conocer sus funciones. Conocer superficialmente
En un organismo unicelular, como una bacteria o un protista, la célula única debe realizar todas las funciones necesarias para la vida.
 HISTOLOGIA ANIMAL En un organismo unicelular, como una bacteria o un protista, la célula única debe realizar todas las funciones necesarias para la vida. Tejidos Los animales pueden alcanzar grandes tallas
HISTOLOGIA ANIMAL En un organismo unicelular, como una bacteria o un protista, la célula única debe realizar todas las funciones necesarias para la vida. Tejidos Los animales pueden alcanzar grandes tallas
LAS FUNCIONES DE REPRODUCCIÓN EN LOS ANIMALES
 16 LAS FUNCIONES DE REPRODUCCIÓN EN LOS ANIMALES 16.1. LA REPRODUCCIÓN ASEXUAL Y SEXUAL EN LOS ANIMALES Al igual que has estudiado los distintos tipos de aparatos digestivos y circulatorios en los animales,
16 LAS FUNCIONES DE REPRODUCCIÓN EN LOS ANIMALES 16.1. LA REPRODUCCIÓN ASEXUAL Y SEXUAL EN LOS ANIMALES Al igual que has estudiado los distintos tipos de aparatos digestivos y circulatorios en los animales,
Órganos que intervienen en las funciones vitales
 Órganos que intervienen en las funciones vitales Función de nutrición. Boca. Es la abertura corporal por la que se ingieren alimentos. Está ubicada en la cara y constituye en su mayor parte el aparato
Órganos que intervienen en las funciones vitales Función de nutrición. Boca. Es la abertura corporal por la que se ingieren alimentos. Está ubicada en la cara y constituye en su mayor parte el aparato
DISECCIÓN DE DECÁPODO (CRUSTACEA) Anatomía externa e interna.
 DISECCIÓN DE DECÁPODO (CRUSTACEA) Anatomía externa e interna. Antes de comenzar la disección se levanta la pared del cuerpo en el cefalotórax y abdomen; se observan los órganos situados dentro de la cavidad
DISECCIÓN DE DECÁPODO (CRUSTACEA) Anatomía externa e interna. Antes de comenzar la disección se levanta la pared del cuerpo en el cefalotórax y abdomen; se observan los órganos situados dentro de la cavidad
4. TEJIDOS ANIMALES. Se pueden diferenciar dos grandes grupos: Tejidos conectivos. Tejido epitelial Tejido muscular Tejido nervioso.
 4. TEJIDOS ANIMALES Se pueden diferenciar dos grandes grupos: Tejidos poco especializados Tejidos muy especializados Tejidos conectivos Tejido epitelial Tejido muscular Tejido nervioso Conjuntivo Adiposo
4. TEJIDOS ANIMALES Se pueden diferenciar dos grandes grupos: Tejidos poco especializados Tejidos muy especializados Tejidos conectivos Tejido epitelial Tejido muscular Tejido nervioso Conjuntivo Adiposo
LABORATORIO No. 4 HELMINTOS INTESTINALES
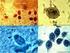 LABORATORIO No. 4 HELMINTOS INTESTINALES PARTE I: NEMÁTODOS (Cont...) Enterobius vermicularis: Gusano de color blanco amarillento, en el extremo anterior se encuentra la boca provista de tres labios y
LABORATORIO No. 4 HELMINTOS INTESTINALES PARTE I: NEMÁTODOS (Cont...) Enterobius vermicularis: Gusano de color blanco amarillento, en el extremo anterior se encuentra la boca provista de tres labios y
REPRODUCCIÓN HUMANA. La ovogénesis
 REPRODUCCIÓN HUMANA A pesar que nuestra forma de reproducción es muy similar a la de los demás mamíferos, en los seres humanos se presentan particularidades morfológicas, fisiológicas y comportamentales
REPRODUCCIÓN HUMANA A pesar que nuestra forma de reproducción es muy similar a la de los demás mamíferos, en los seres humanos se presentan particularidades morfológicas, fisiológicas y comportamentales
NEMATODIASIS I Ascariasis Tricocefalosis
 II Año Enfermería 14 Marzo 2011 NEMATODIASIS I Ascariasis Tricocefalosis DraQF Patricia Salinas T. Unidad Docente de Parasitología Facultad de Medicina Universidad de Chile HELMINTOS clasificación METAZOOS
II Año Enfermería 14 Marzo 2011 NEMATODIASIS I Ascariasis Tricocefalosis DraQF Patricia Salinas T. Unidad Docente de Parasitología Facultad de Medicina Universidad de Chile HELMINTOS clasificación METAZOOS
LABORATORIO No. 6 HELMINTOS/PLATELMINTOS
 LABORATORIO No. 6 HELMINTOS/PLATELMINTOS PARTE II: PLATELMINTOS B. CESTODOS O TENIAS: Son gusanos planos de forma acintada, constituídos por escólex, cuello y estróbilo el cual esta constituído por segmentos
LABORATORIO No. 6 HELMINTOS/PLATELMINTOS PARTE II: PLATELMINTOS B. CESTODOS O TENIAS: Son gusanos planos de forma acintada, constituídos por escólex, cuello y estróbilo el cual esta constituído por segmentos
La supervivencia de las especies requiere que sus individuos se multipliquen para reemplazar a los que mueren.
 1. LA REPRODUCCIÓN Y EL CICLO VITAL La supervivencia de las especies requiere que sus individuos se multipliquen para reemplazar a los que mueren. La reproducción es la función por la cual los seres vivos
1. LA REPRODUCCIÓN Y EL CICLO VITAL La supervivencia de las especies requiere que sus individuos se multipliquen para reemplazar a los que mueren. La reproducción es la función por la cual los seres vivos
Manejo de las enfermedades porcinas. Manejo sanitario y tratamiento de las enfermedades del cerdo
 Manejo de las enfermedades porcinas Autor: Dr. Michael Muirhead y Thomas Alexander. Fuente: Extraído de El sitio porcino ( www.elsitioporcino.com ). Manejo sanitario y tratamiento de las enfermedades del
Manejo de las enfermedades porcinas Autor: Dr. Michael Muirhead y Thomas Alexander. Fuente: Extraído de El sitio porcino ( www.elsitioporcino.com ). Manejo sanitario y tratamiento de las enfermedades del
Generalidades de los Parásitos
 Generalidades de los Parásitos Autor: Bióloga Natalia Ocampo Fernández Enero 2014 http://www.uaeh.edu.mx/virtual TEMA 54.- GENERALIDADES DE LOS PARÁSITOS Introducción. Parásito y parasitismo. Parásito:
Generalidades de los Parásitos Autor: Bióloga Natalia Ocampo Fernández Enero 2014 http://www.uaeh.edu.mx/virtual TEMA 54.- GENERALIDADES DE LOS PARÁSITOS Introducción. Parásito y parasitismo. Parásito:
Tema III Parasitología Médica. Nematodos II 2da Parte
 Tema III Parasitología Médica Nematodos II 2da Parte Ascariosis Ascaris lumbricoides Es la infección más frecuente y cosmopolita de todas las helmintiosis. Constituye el nematodo intestinal de mayor tamaño.
Tema III Parasitología Médica Nematodos II 2da Parte Ascariosis Ascaris lumbricoides Es la infección más frecuente y cosmopolita de todas las helmintiosis. Constituye el nematodo intestinal de mayor tamaño.
ALERTA Brotes de triquinosis en tres provincias de Argentina. 27 de julio de 2018 SE 30
 ALERTA Brotes de triquinosis en tres provincias de Argentina. 27 de julio de 2018 SE 30 Ante el reporte, a la semana epidemiológica (SE) 30 de 2018, de 310 casos de triquinosis en las localidades de Pehuajó,
ALERTA Brotes de triquinosis en tres provincias de Argentina. 27 de julio de 2018 SE 30 Ante el reporte, a la semana epidemiológica (SE) 30 de 2018, de 310 casos de triquinosis en las localidades de Pehuajó,
8. Generalidades de los céstodes
 8. Generalidades de los céstodes I.Introducción: Los cestodes son helmintos exclusivamente parásitos, aplanados dorsoventralmente, de modo que semejan cintas y por ello su nombre, son de tamaño variable
8. Generalidades de los céstodes I.Introducción: Los cestodes son helmintos exclusivamente parásitos, aplanados dorsoventralmente, de modo que semejan cintas y por ello su nombre, son de tamaño variable
Anatomía Humana. Definición. La Anatomía es la ciencia que estudia la estructura del cuerpo humano, junto con todos los sistemas que lo forman.
 Anatomía Humana Definición La Anatomía es la ciencia que estudia la estructura del cuerpo humano, junto con todos los sistemas que lo forman. 1 Cómo se organiza la anatomía? 1. Nivel químico 2. Nivel celular
Anatomía Humana Definición La Anatomía es la ciencia que estudia la estructura del cuerpo humano, junto con todos los sistemas que lo forman. 1 Cómo se organiza la anatomía? 1. Nivel químico 2. Nivel celular
1. CONCLUSIONES GENERALES.
 1. CONCLUSIONES GENERALES. La jaula tendrá que tener todo lo necesario para que el roedor este cómodo. Para los hámsters chinos y roborowskys es aconsejable ponerlos en un terrario. La finalidad de estos
1. CONCLUSIONES GENERALES. La jaula tendrá que tener todo lo necesario para que el roedor este cómodo. Para los hámsters chinos y roborowskys es aconsejable ponerlos en un terrario. La finalidad de estos
Anatomía del aparato digestivo
 Anatomía del aparato digestivo En el aparato digestivo se identifican dos partes bien diferenciadas: el tubo digestivo y las glándulas anejas que participan en el proceso de digestión y absorción de los
Anatomía del aparato digestivo En el aparato digestivo se identifican dos partes bien diferenciadas: el tubo digestivo y las glándulas anejas que participan en el proceso de digestión y absorción de los
Diagnóstico. de Trichinella. en porcinos. Jenny Jovana Chaparro Gutiérrez. Facultad de Ciencias Agrarias
 Diagnóstico de Trichinella en porcinos Jenny Jovana Chaparro Gutiérrez Facultad de Ciencias Agrarias Diagnóstico de Trichinella en Porcinos Jenny Jovana Chaparro Gutiérrez MV MSc DrSc Docente de parasitología
Diagnóstico de Trichinella en porcinos Jenny Jovana Chaparro Gutiérrez Facultad de Ciencias Agrarias Diagnóstico de Trichinella en Porcinos Jenny Jovana Chaparro Gutiérrez MV MSc DrSc Docente de parasitología
Digestión: es la transformación de los alimentos en sustancias más simples que el organismo puede asimilar.
 SISTEMA DIGESTIVO Objetivo: - Motivar la comprensión acerca de la ubicación y estructura de los órganos del Aparato Digestivo. - Documentarse acerca del proceso digestivo humano y sus implicaciones con
SISTEMA DIGESTIVO Objetivo: - Motivar la comprensión acerca de la ubicación y estructura de los órganos del Aparato Digestivo. - Documentarse acerca del proceso digestivo humano y sus implicaciones con
Las etapas de la vida.
 TEMA 3. LA REPRODUCCIÓN. Las etapas de la vida y las características sexuales. Características sexuales: son las diferencias que podemos ver entre el cuerpo del hombre y la mujer y que van cambiando a
TEMA 3. LA REPRODUCCIÓN. Las etapas de la vida y las características sexuales. Características sexuales: son las diferencias que podemos ver entre el cuerpo del hombre y la mujer y que van cambiando a
SANIDAD EN LA PRODUCCION PORCINA. M. V. Pablo Agustinho
 SANIDAD EN LA PRODUCCION PORCINA M. V. Pablo Agustinho 05 de agosto de 2016 PATOLOGÍAS MÁS COMUNES DE ENCONTRAR. BREVE DESCRIPCIÓN DE CADA UNA. COMO DIFERENCIARLAS. CRITERIOS A TENER EN CUENTA AL MOMENTO
SANIDAD EN LA PRODUCCION PORCINA M. V. Pablo Agustinho 05 de agosto de 2016 PATOLOGÍAS MÁS COMUNES DE ENCONTRAR. BREVE DESCRIPCIÓN DE CADA UNA. COMO DIFERENCIARLAS. CRITERIOS A TENER EN CUENTA AL MOMENTO
CAPÍTULO IV INGENIERÍA CELULAR
 CAPÍTULO IV INGENIERÍA CELULAR MITOSIS Y MEIOSIS Sumario Mitosis y meiosis: 1. Qué es la mitosis? 2.División de las células 3.La interfase 4.Las fases de la mitosis 5.Significado de la mitosis 6. Qué es
CAPÍTULO IV INGENIERÍA CELULAR MITOSIS Y MEIOSIS Sumario Mitosis y meiosis: 1. Qué es la mitosis? 2.División de las células 3.La interfase 4.Las fases de la mitosis 5.Significado de la mitosis 6. Qué es
Dr. MARGARITA MARIA MAZO CARDONA M.V.Z Esp Sanidad Animal Docente utp
 Dr. MARGARITA MARIA MAZO CARDONA M.V.Z Esp Sanidad Animal Docente utp POSICIÓN ANIMAL POBLACIÓN MUNDIAL EN MILLONES POBLACIÓN EN USA MILL PAIS CON MAYOR POBLACIÓN 1 GATO 202 86.4 ESTADOS UNIDOS 2 PERRO
Dr. MARGARITA MARIA MAZO CARDONA M.V.Z Esp Sanidad Animal Docente utp POSICIÓN ANIMAL POBLACIÓN MUNDIAL EN MILLONES POBLACIÓN EN USA MILL PAIS CON MAYOR POBLACIÓN 1 GATO 202 86.4 ESTADOS UNIDOS 2 PERRO
Universidad Nacional del Nordeste Facultad de Medicina Cátedra II de Histología y Embriología
 Universidad Nacional del Nordeste Facultad de Medicina Cátedra II de Histología y Embriología ACTIVIDAD N 9 Aparato digestivo I APARATO DIGESTIVO I Consta de: a) tubo digestivo: compuesto por la boca,
Universidad Nacional del Nordeste Facultad de Medicina Cátedra II de Histología y Embriología ACTIVIDAD N 9 Aparato digestivo I APARATO DIGESTIVO I Consta de: a) tubo digestivo: compuesto por la boca,
FICHA PROGRAMA NACIONAL DE BRUCELOSIS BOVINA
 FICHA PROGRAMA NACIONAL DE BRUCELOSIS BOVINA DR. JULIO CÉSAR JIMÉNEZ ARIAS COORDINADOR DE PROGRAMA SETIEMBRE 2009 1 1. BASES FUNDAMENTALES 1.1 PREMISAS La brucelosis bovina es una enfermedad infectocontagiosa
FICHA PROGRAMA NACIONAL DE BRUCELOSIS BOVINA DR. JULIO CÉSAR JIMÉNEZ ARIAS COORDINADOR DE PROGRAMA SETIEMBRE 2009 1 1. BASES FUNDAMENTALES 1.1 PREMISAS La brucelosis bovina es una enfermedad infectocontagiosa
EL PALUDISMO O MALARIA
 EL PALUDISMO O MALARIA PALUDISMO El paludismo o malaria es una enfermedad muy frecuente, a escala mundial. En 2016, se estima que hubo 216 millones de casos de paludismo en todo el mundo. La mayoría de
EL PALUDISMO O MALARIA PALUDISMO El paludismo o malaria es una enfermedad muy frecuente, a escala mundial. En 2016, se estima que hubo 216 millones de casos de paludismo en todo el mundo. La mayoría de
Biología y Geología 3º ESO
 1/ Reproducción y sexualidad. Biología y Geología 3º ESO TEMA 8: SEXUALIDAD Y REPRODUCCIÓN a) Para qué sirve la función de reproducción? b) Características de la reproducción sexual. c) Diferencias entre
1/ Reproducción y sexualidad. Biología y Geología 3º ESO TEMA 8: SEXUALIDAD Y REPRODUCCIÓN a) Para qué sirve la función de reproducción? b) Características de la reproducción sexual. c) Diferencias entre
LA DIGESTIÓN LA NUTRICIÓN
 LA DIGESTIÓN LA NUTRICIÓN Las personas necesitamos energía para desarrollar nuestras actividades y materiales de construcción para crecer o reparar nuestro cuerpo. La función de nutrición comprende todos
LA DIGESTIÓN LA NUTRICIÓN Las personas necesitamos energía para desarrollar nuestras actividades y materiales de construcción para crecer o reparar nuestro cuerpo. La función de nutrición comprende todos
2006 Avances en la Investigación Científica en el CUCBA
 771 ISBN 970-27-1045-6 DETERMINACIÓN DE LA PRESENCIA DE ANTICUERPOS ANTI- Trichinella spiralis EN CERDOS POR LA PRUEBA DE ELISA Medina Lerena, Miriam Susana; Agustín Ramírez Álvarez, Moisés Ochoa Sánchez,
771 ISBN 970-27-1045-6 DETERMINACIÓN DE LA PRESENCIA DE ANTICUERPOS ANTI- Trichinella spiralis EN CERDOS POR LA PRUEBA DE ELISA Medina Lerena, Miriam Susana; Agustín Ramírez Álvarez, Moisés Ochoa Sánchez,
Qué es la ANATOMIA? Qué es la FISIOLOGIA? FUNCIONES VITALES
 Qué es la ANATOMIA? La ANATOMIA se define como la ciencia biológica que describe la forma y estructura de los organismos en general HISTOLOGIA CITOLOGIA EMBRIOLOGIA Qué es la FISIOLOGIA? La FISIOLOGIA
Qué es la ANATOMIA? La ANATOMIA se define como la ciencia biológica que describe la forma y estructura de los organismos en general HISTOLOGIA CITOLOGIA EMBRIOLOGIA Qué es la FISIOLOGIA? La FISIOLOGIA
2 GRADO 5. A. La digestión es el proceso de transformación de los alimentos para que puedan ser absorbidos y utilizados por las células del organismo
 PRUEBA DE CIENCIAS NATURALES PERIODO 2 GRADO 5 1 El sistema digestivo es el conjunto de órganos (boca, faringe, esófago, estómago, intestino delgado e intestino grueso) encargados del proceso de la digestión.
PRUEBA DE CIENCIAS NATURALES PERIODO 2 GRADO 5 1 El sistema digestivo es el conjunto de órganos (boca, faringe, esófago, estómago, intestino delgado e intestino grueso) encargados del proceso de la digestión.
Órganos del cuerpo humano
 Órganos del cuerpo humano Los órganos del cuerpo humano se forman por la agrupación de tejidos (epitelial, conectivo, muscular y nervioso), que se forman mediante la agrupación de células. Ellos tienen
Órganos del cuerpo humano Los órganos del cuerpo humano se forman por la agrupación de tejidos (epitelial, conectivo, muscular y nervioso), que se forman mediante la agrupación de células. Ellos tienen
Diagnóstico Diferencial del Aborto Bovino
 Diagnóstico Diferencial del Aborto Bovino Neosporosis en Bovinos Méd. Vet. Enrique M. TRABATTONI (FCV UNL 1982) Director Técnico - Centro Veterinario Laboratorio de Análisis Veterinarios Belgrano 1865
Diagnóstico Diferencial del Aborto Bovino Neosporosis en Bovinos Méd. Vet. Enrique M. TRABATTONI (FCV UNL 1982) Director Técnico - Centro Veterinario Laboratorio de Análisis Veterinarios Belgrano 1865
2006 Avances en la Investigación Científica en el CUCBA 776
 2006 Avances en la Investigación Científica en el CUCBA 776 ISBN 970-27-1045-6 DETERMINACIÓN CUANTITATIVA DE Trichinella spiralis EN MÚSCULOS DE RATAS WISTAR Y RATONES CD Medina Lerena, Miriam Susana;
2006 Avances en la Investigación Científica en el CUCBA 776 ISBN 970-27-1045-6 DETERMINACIÓN CUANTITATIVA DE Trichinella spiralis EN MÚSCULOS DE RATAS WISTAR Y RATONES CD Medina Lerena, Miriam Susana;
Trabajo realizado por: Alba Higuera María Borrega Elena Higuera María Cantalejo Beatriz Rozas
 Trabajo realizado por: Alba Higuera María Borrega Elena Higuera María Cantalejo Beatriz Rozas Proceso digestivo: transformación de los alimentos en el aparato digestivo para ser asimilados. Etapas: Ingestión:
Trabajo realizado por: Alba Higuera María Borrega Elena Higuera María Cantalejo Beatriz Rozas Proceso digestivo: transformación de los alimentos en el aparato digestivo para ser asimilados. Etapas: Ingestión:
cia de las técnicas de diagnóstico serológicas en trichinellosis porcina: técnica inmunoenzimática de dia
 Page 1 of 5 cia de las técnicas de diagnóstico serológicas en trichinellosis porcina: técnica inmunoenzimática de dia Marcela L. Ruiz, Gabriel Morici. Del Libro Temas de Zoonosis IV, Editorial Asociación
Page 1 of 5 cia de las técnicas de diagnóstico serológicas en trichinellosis porcina: técnica inmunoenzimática de dia Marcela L. Ruiz, Gabriel Morici. Del Libro Temas de Zoonosis IV, Editorial Asociación
ADH1 ADH4 MM SM. Resultados
 A R ADH4 ADH1 MM SM B R FG SM MM Figura 27. Localización del mrna de ADH1 y de ADH4 en estómago (cuerpo) de rata adulta mediante ISH. A, Detección de ADH1 en la zona media de la mucosa gástrica. B, Detección
A R ADH4 ADH1 MM SM B R FG SM MM Figura 27. Localización del mrna de ADH1 y de ADH4 en estómago (cuerpo) de rata adulta mediante ISH. A, Detección de ADH1 en la zona media de la mucosa gástrica. B, Detección
NUTRICIÓN EN ANIMALES INVERTEBRADOS Y VERTEBRADOS CLASE DE BIOLOGÍA- GRADO 6 - COLEGIO JUVENTUDES UNIDAS
 NUTRICIÓN EN ANIMALES INVERTEBRADOS Y VERTEBRADOS CLASE DE BIOLOGÍA- GRADO 6 - COLEGIO JUVENTUDES UNIDAS ANIMALES INVERTEBRADOS Poríferos Cnidarios Equinodermos Artrópodos Anélidos Moluscos ANIMALES VERTEBRADOS
NUTRICIÓN EN ANIMALES INVERTEBRADOS Y VERTEBRADOS CLASE DE BIOLOGÍA- GRADO 6 - COLEGIO JUVENTUDES UNIDAS ANIMALES INVERTEBRADOS Poríferos Cnidarios Equinodermos Artrópodos Anélidos Moluscos ANIMALES VERTEBRADOS
LOS SERES VIVOS. Los seres vivos son los que tienen vida, como las personas, los animales y las plantas.
 LOS SERES VIVOS Los seres vivos: Los seres vivos son los que tienen vida, como las personas, los animales y las plantas. Los seres inertes son los que no tienen vida, como las rocas, el suelo o el aire.
LOS SERES VIVOS Los seres vivos: Los seres vivos son los que tienen vida, como las personas, los animales y las plantas. Los seres inertes son los que no tienen vida, como las rocas, el suelo o el aire.
Población de roedores en zonas aledañas a granjas porcícolas como fuente potencial de enfermedades Zoonóticas. Diego Piedrahita MVZ MSc - PhD
 Población de roedores en zonas aledañas a granjas porcícolas como fuente potencial de enfermedades Zoonóticas Diego Piedrahita MVZ MSc - PhD Población de roedores en zonas aledañas a granjas porcícolas
Población de roedores en zonas aledañas a granjas porcícolas como fuente potencial de enfermedades Zoonóticas Diego Piedrahita MVZ MSc - PhD Población de roedores en zonas aledañas a granjas porcícolas
TALLER Epidemiología de las Enfermedades Transmisibles
 Epidemiología de las Enfermedades Transmisibles Realice la lectura del Módulo 2 del MOPECE, desde la página 22 y responda las siguientes preguntas: Pregunta 1 Cuáles de los siguientes factores condicionan
Epidemiología de las Enfermedades Transmisibles Realice la lectura del Módulo 2 del MOPECE, desde la página 22 y responda las siguientes preguntas: Pregunta 1 Cuáles de los siguientes factores condicionan
REPRODUCCIÓN DETERMINACIÓN DEL SEXO
 Espermatozoides REPRODUCCIÓN DETERMINACIÓN DEL SEXO Las gónadas masculinas son los testículos que producen espermatozoides. Las gónadas femeninas son los ovarios que producen los óvulos. Cada célula nucleada
Espermatozoides REPRODUCCIÓN DETERMINACIÓN DEL SEXO Las gónadas masculinas son los testículos que producen espermatozoides. Las gónadas femeninas son los ovarios que producen los óvulos. Cada célula nucleada
Aparato digestivo: tubo digestivo y estructuras anexas principales: lengua dientes glándulas salivales páncreas hígado vesícula biliar.
 Aparato digestivo I Aparato digestivo: tubo digestivo y estructuras anexas principales: lengua dientes glándulas salivales páncreas hígado vesícula biliar. La mucosa digestiva cumple muchas funciones:
Aparato digestivo I Aparato digestivo: tubo digestivo y estructuras anexas principales: lengua dientes glándulas salivales páncreas hígado vesícula biliar. La mucosa digestiva cumple muchas funciones:
El aparato digestivo está formado por los siguientes órganos: boca, faringe, esófago, estómago, intestino delgado, intestino grueso, recto y ano.
 INSTITUCION EDUCATIVA LA PRESENTACION NOMBRE LUMNA: AREA : CIENCIAS NATURALES Y EDUCACION AMBIENTAL ASIGNATURA: CIENCIAS NATURALES DOCENTE: MARA CELINA MAZO TAPIAS TIPO DE GUIA: CONCEPTUAL y DE EJECUCION
INSTITUCION EDUCATIVA LA PRESENTACION NOMBRE LUMNA: AREA : CIENCIAS NATURALES Y EDUCACION AMBIENTAL ASIGNATURA: CIENCIAS NATURALES DOCENTE: MARA CELINA MAZO TAPIAS TIPO DE GUIA: CONCEPTUAL y DE EJECUCION
Tema 1. Epidemiología y control de las enfermedades transmisibles
 Tema 1 Epidemiología y control de las enfermedades transmisibles Definición de enfermedad transmisible Enfermedad transmisible es aquella que precisa la existencia de un agente causal infeccioso que desencadena
Tema 1 Epidemiología y control de las enfermedades transmisibles Definición de enfermedad transmisible Enfermedad transmisible es aquella que precisa la existencia de un agente causal infeccioso que desencadena
TEMA 4 LA REPRODUCCIÓN
 TEMA 4 LA REPRODUCCIÓN 1. La reproducción La capacidad de reproducción es la cualidad fundamental de los seres vivos. Tipos de reproducción Asexual Reproducción elemental. Se generan copias idénticas Sexual
TEMA 4 LA REPRODUCCIÓN 1. La reproducción La capacidad de reproducción es la cualidad fundamental de los seres vivos. Tipos de reproducción Asexual Reproducción elemental. Se generan copias idénticas Sexual
Función de nutrición en los animales
 Función de nutrición en los animales Biología y Geología La digestión en los animales El aparato digestivo en los invertebrados El aparato digestivo en los vertebrados Digestión intestinal Absorción intestinal
Función de nutrición en los animales Biología y Geología La digestión en los animales El aparato digestivo en los invertebrados El aparato digestivo en los vertebrados Digestión intestinal Absorción intestinal
Platelmintos Nematoda. Protozoos Poríferos
 PLATELMINTOS Echinodermata Chordata Arthropoda Uniramia Chelicerata Crustacea Annelida Mollusca Platelmintos Nematoda Cnidarios Protozoos Poríferos Tienen simetría bilateral EJE DE POLARIDAD: antero-posterior
PLATELMINTOS Echinodermata Chordata Arthropoda Uniramia Chelicerata Crustacea Annelida Mollusca Platelmintos Nematoda Cnidarios Protozoos Poríferos Tienen simetría bilateral EJE DE POLARIDAD: antero-posterior
H. SCHAPIRO, MV., DCV.
 Dr. Javier H. SCHAPIRO, MV., DCV. Cátedras de Parasitología y de Enfermedades Parasitarias Escuela de Veterinaria, Universidad del Salvador 4621-0443 (interno 128-133) schapiro.javier@inta.gob.ar schapirojavier@yahoo.com.ar
Dr. Javier H. SCHAPIRO, MV., DCV. Cátedras de Parasitología y de Enfermedades Parasitarias Escuela de Veterinaria, Universidad del Salvador 4621-0443 (interno 128-133) schapiro.javier@inta.gob.ar schapirojavier@yahoo.com.ar
Funciones de los sistemas del cuerpo humano
 Funciones de los sistemas del cuerpo humano Sistema cardiovascular se encarga del transporte de nutrientes y gases por el cuerpo a través de la sangre. Sistema respiratorio realiza el intercambio de gases
Funciones de los sistemas del cuerpo humano Sistema cardiovascular se encarga del transporte de nutrientes y gases por el cuerpo a través de la sangre. Sistema respiratorio realiza el intercambio de gases
PROGRAMA ANATOMIA-FISIOLOGIA HUMANA I
 PROGRAMA ANATOMIA-FISIOLOGIA HUMANA I 1 curso 102 horas lectivas 1. Anatomía y fisiología. Introducción a la estructura y la función del cuerpo. 1.1 Niveles de la organización estructural 1.2 Posición
PROGRAMA ANATOMIA-FISIOLOGIA HUMANA I 1 curso 102 horas lectivas 1. Anatomía y fisiología. Introducción a la estructura y la función del cuerpo. 1.1 Niveles de la organización estructural 1.2 Posición
COLEGIO NACIONES UNIDAS I.E.D TALLER DE APOYO GRADO QUINTO CIENCIAS NATURALES
 COLEGIO NACIONES UNIDAS I.E.D TALLER DE APOYO GRADO QUINTO CIENCIAS NATURALES OBJETIVO: Repasar los temas desarrollados durante el primer trimestre como preparación para las pruebas trimestrales. NOMBRE:
COLEGIO NACIONES UNIDAS I.E.D TALLER DE APOYO GRADO QUINTO CIENCIAS NATURALES OBJETIVO: Repasar los temas desarrollados durante el primer trimestre como preparación para las pruebas trimestrales. NOMBRE:
TIPOS DE HOSPEDEROS: DEFINITIVOS E INTERMEDIOS. Dr. José Fabio Fernández Alemán-UIA MQC- Especialista
 TIPOS DE HOSPEDEROS: DEFINITIVOS E INTERMEDIOS Dr. José Fabio Fernández Alemán-UIA MQC- Especialista Cómo se define hospedero? Es la forma correcta en español de referirnos al ser humano que sufre de una
TIPOS DE HOSPEDEROS: DEFINITIVOS E INTERMEDIOS Dr. José Fabio Fernández Alemán-UIA MQC- Especialista Cómo se define hospedero? Es la forma correcta en español de referirnos al ser humano que sufre de una
FUNDAMENTOS E IMPORTANCIA DE LA UTILIZACIÓN DEL TEST DE ELISA PARA EL DIAGNÓSTICO DE TRICHINELLOSIS EN CERDOS DE ARGENTINA
 FUNDAMENTOS E IMPORTANCIA DE LA UTILIZACIÓN DEL TEST DE ELISA PARA EL DIAGNÓSTICO DE TRICHINELLOSIS EN CERDOS DE ARGENTINA Mabel Ribicich Med Vet. M Sc Parasitología y Enfermedades Parasitarias Facultad
FUNDAMENTOS E IMPORTANCIA DE LA UTILIZACIÓN DEL TEST DE ELISA PARA EL DIAGNÓSTICO DE TRICHINELLOSIS EN CERDOS DE ARGENTINA Mabel Ribicich Med Vet. M Sc Parasitología y Enfermedades Parasitarias Facultad
Aparato circulatorio: Transporta el oxígeno y los nutrientes a todas las células, y recoge el CO 2 y los desechos. ~ 1 ~
 PUNTO 1º - APARATOS IMPLICADOS EN LA NUTRICIÓN Los aparatos implicados en la nutrición son : Aparato digestivo: Digiere los alimentos y los transforma en nutrientes. Aparato respiratorio: Se ocupa del
PUNTO 1º - APARATOS IMPLICADOS EN LA NUTRICIÓN Los aparatos implicados en la nutrición son : Aparato digestivo: Digiere los alimentos y los transforma en nutrientes. Aparato respiratorio: Se ocupa del
PULGAS Son insectos picadores. No tienen alas. Color amarillo a marrón oscuro. Miden de 1 a 8 mm de largo. Parasitan a mamíferos y aves.
 PULGAS Son insectos picadores. No tienen alas. Color amarillo a marrón oscuro. Miden de 1 a 8 mm de largo. Parasitan a mamíferos y aves. PULGAS Clase Insecta Orden Siphonaptera Familia Pullicidae Familia
PULGAS Son insectos picadores. No tienen alas. Color amarillo a marrón oscuro. Miden de 1 a 8 mm de largo. Parasitan a mamíferos y aves. PULGAS Clase Insecta Orden Siphonaptera Familia Pullicidae Familia
Los órganos hematopoyéticos y linfoides. Los ganglios linfáticos. Distribución de los elementos. Los órganos hematopoyéticos y. linfoides.
 Los órganos hematopoyéticos y Dos funciones principales: Defensiva (estructuras linfoides). Hematopoyética (médula ósea). Estructuras linfoides: Los ganglios linfáticos. El bazo. Las formaciones linfoides
Los órganos hematopoyéticos y Dos funciones principales: Defensiva (estructuras linfoides). Hematopoyética (médula ósea). Estructuras linfoides: Los ganglios linfáticos. El bazo. Las formaciones linfoides
Uso de inmunoglobulinas de origen aviar para contrarrestar los efectos del virus de la diarrea epidémica porcina
 Uso de inmunoglobulinas de origen aviar para contrarrestar los efectos del virus de la diarrea epidémica porcina Fuente: Autor/es: Ph.D. Ioannis Mavromichalis, Editor de Pig International (Traducción Departamento
Uso de inmunoglobulinas de origen aviar para contrarrestar los efectos del virus de la diarrea epidémica porcina Fuente: Autor/es: Ph.D. Ioannis Mavromichalis, Editor de Pig International (Traducción Departamento
PUNTO 1º - LA FUNCIÓN DE NUTRICIÓN
 PUNTO 1º - LA FUNCIÓN DE NUTRICIÓN Definición Nutrición: Conjunto de procesos mediante los cuales los seres vivos toman materia y energía del exterior y la transforman en materia propia y en energía. Definición
PUNTO 1º - LA FUNCIÓN DE NUTRICIÓN Definición Nutrición: Conjunto de procesos mediante los cuales los seres vivos toman materia y energía del exterior y la transforman en materia propia y en energía. Definición
ESPECIALIDAD EN AVICULTURAA
 ESPECIALIDAD EN AVICULTURAA Perfil El médico veterinario peruano especialista en avicultura es un profesional que está capacidad de ejercer su profesión de contribuir al desarrollo del Perú ejerciendo
ESPECIALIDAD EN AVICULTURAA Perfil El médico veterinario peruano especialista en avicultura es un profesional que está capacidad de ejercer su profesión de contribuir al desarrollo del Perú ejerciendo
Tejido epitelial. Compuesto por células muy juntas con escasa o nula sustancia intercelular.
 Tejido epitelial Compuesto por células muy juntas con escasa o nula sustancia intercelular. Forman membranas que tapizan la superficie corporal y revisten cavidades dentro del organismo: EPITELIOS DE REVESTIMIENTO
Tejido epitelial Compuesto por células muy juntas con escasa o nula sustancia intercelular. Forman membranas que tapizan la superficie corporal y revisten cavidades dentro del organismo: EPITELIOS DE REVESTIMIENTO
Manejo de cerdito destetado precoz y ultraprecoz: 1
 Manejo de cerdito destetado precoz y ultraprecoz: 1 Fuente: Ing. Joaquin A. Paulino, nutricionista, NTECRD S.A. Nutricion y Tecnología, República Dominicana. 30 julio 2014. Extraído de El Sitio Porcino
Manejo de cerdito destetado precoz y ultraprecoz: 1 Fuente: Ing. Joaquin A. Paulino, nutricionista, NTECRD S.A. Nutricion y Tecnología, República Dominicana. 30 julio 2014. Extraído de El Sitio Porcino
El cuerpo humano desarrolla diariamente una serie de funciones que sólo son posibles cuando se cuenta con un adecuado suministro energético
 El cuerpo humano desarrolla diariamente una serie de funciones que sólo son posibles cuando se cuenta con un adecuado suministro energético proveniente de los alimentos. Los alimentos recorren un largo
El cuerpo humano desarrolla diariamente una serie de funciones que sólo son posibles cuando se cuenta con un adecuado suministro energético proveniente de los alimentos. Los alimentos recorren un largo
Leptospirosis: un problema o una verdad incómoda? por Dra. Blanca Herrera Medico Veterinario
 Leptospirosis: un problema o una verdad incómoda? por Dra. Blanca Herrera Medico Veterinario blan@adinet.com.uy La leptospirosis es una enfermedad producida por una bacteria llamada leptospira spp. Esta
Leptospirosis: un problema o una verdad incómoda? por Dra. Blanca Herrera Medico Veterinario blan@adinet.com.uy La leptospirosis es una enfermedad producida por una bacteria llamada leptospira spp. Esta
LEPTOSPIROSIS PORCINA
 LEPTOSPIROSIS PORCINA Conociendo su transmisión para mejorar su control Laura Pérez & Albert Finestra Uriol Veterinarios de porcino en TSC La leptospirosis porcina es una antigua conocida de técnicos y
LEPTOSPIROSIS PORCINA Conociendo su transmisión para mejorar su control Laura Pérez & Albert Finestra Uriol Veterinarios de porcino en TSC La leptospirosis porcina es una antigua conocida de técnicos y
Se produce al consumir carne o productos cárnicos crudos o insuficientemente cocinados de animales infestados por la Triquina.
 LA TRIQUINOSIS QUÉ ES LA TRIQUINOSIS? Es una enfermedad causada por las larvas enquistadas de un gusano del género Trichinella del que existen varias especies. En Aragón se encuentran la Trichinella spiralis
LA TRIQUINOSIS QUÉ ES LA TRIQUINOSIS? Es una enfermedad causada por las larvas enquistadas de un gusano del género Trichinella del que existen varias especies. En Aragón se encuentran la Trichinella spiralis
Enfermedades Parasitarias Transmitidas por Alimentos
 1 de 6 03/06/2009 06:24 p.m. Enfermedades Parasitarias Transmitidas por Alimentos Material para docencia preparado por Prof. Dr. Carlos S. Eddi MSc PhD**, Prof. Jorge Caracostantogolo** MV, Prof. Roberto
1 de 6 03/06/2009 06:24 p.m. Enfermedades Parasitarias Transmitidas por Alimentos Material para docencia preparado por Prof. Dr. Carlos S. Eddi MSc PhD**, Prof. Jorge Caracostantogolo** MV, Prof. Roberto
Phylum Acanthocephala
 Phylum Acanthocephala Características generales Constituyen un phylum pequeño, pero sumamente interesante e importante, dentro de los helmintos parásitos. En estado adulto parasitan el intestino de vertebrados
Phylum Acanthocephala Características generales Constituyen un phylum pequeño, pero sumamente interesante e importante, dentro de los helmintos parásitos. En estado adulto parasitan el intestino de vertebrados
Histológicamente se caracterizaron las siguientes regiones:
 INTRODUCCIÓN La comunidad de peces de la cuenca del río Ameca ubicado en el Edo. de Jalisco a sufrido cambios drásticos por alteraciones ecológicas en la última década. Estos cambios implican una pérdida
INTRODUCCIÓN La comunidad de peces de la cuenca del río Ameca ubicado en el Edo. de Jalisco a sufrido cambios drásticos por alteraciones ecológicas en la última década. Estos cambios implican una pérdida
APARATOS REPRODUCTORES FEMENINO Y MASCULINO
 APARATOS REPRODUCTORES FEMENINO Y MASCULINO Aparato Reproductor Femenino Cambios Sexuales Secundarios Desarrollo Femenino Genitales Externos Conjunto de estos órganos se denomina vulva: Se compone de los
APARATOS REPRODUCTORES FEMENINO Y MASCULINO Aparato Reproductor Femenino Cambios Sexuales Secundarios Desarrollo Femenino Genitales Externos Conjunto de estos órganos se denomina vulva: Se compone de los
EL APARATO REPRODUCTOR FEMENINO En la mujer, el sistema reproductor está formado por los ovarios, las trompas de falopio, el útero y la vulva.
 Sabías que la reproducción humana es un proceso? En la primera etapa se forman los gametos. Y sabes dónde se forman los gametos? Pues en el sistema reproductor. En una segunda etapa, los gametos deben
Sabías que la reproducción humana es un proceso? En la primera etapa se forman los gametos. Y sabes dónde se forman los gametos? Pues en el sistema reproductor. En una segunda etapa, los gametos deben
a. INTA Castelar. Hidatidosis / Echinococcosis
 Instituto de Patobiología. Área de Parasitología. a. INTA Castelar. Hidatidosis / Echinococcosis Qué es la hidatidosis? Es una enfermedad parasitaria que consiste en la presencia de quistes (bolsas) con
Instituto de Patobiología. Área de Parasitología. a. INTA Castelar. Hidatidosis / Echinococcosis Qué es la hidatidosis? Es una enfermedad parasitaria que consiste en la presencia de quistes (bolsas) con
Guía de Trabajos Prácticos Diversidad Animal I Trabajo Práctico Nº 6 Parte II Nematoda 1 PARTE II
 Guía de Trabajos Prácticos Diversidad Animal I Trabajo Práctico Nº 6 Parte II Nematoda 1 PARTE II Phyla NEMATODA, NEMATOMORPHA Objetivos: - Identificar las características de la morfología externa de los
Guía de Trabajos Prácticos Diversidad Animal I Trabajo Práctico Nº 6 Parte II Nematoda 1 PARTE II Phyla NEMATODA, NEMATOMORPHA Objetivos: - Identificar las características de la morfología externa de los
El estudio de Trichinella spiralis en modelos experimentales
 REDVET - Revista electrónica de Veterinaria - ISSN 1695-7504 El estudio de Trichinella spiralis en modelos experimentales Alejandra Moreno G*., Claudia Maldonado T*., Isabel Chávez Ruvalcaba*., Rosa G
REDVET - Revista electrónica de Veterinaria - ISSN 1695-7504 El estudio de Trichinella spiralis en modelos experimentales Alejandra Moreno G*., Claudia Maldonado T*., Isabel Chávez Ruvalcaba*., Rosa G
PMD: CARLOS ANDRES SAMBONI
 PMD: CARLOS ANDRES SAMBONI La respiración es un proceso involuntario y automático, mediante la cual las células del cuerpo toman oxígeno (O2) y eliminan el dióxido de carbono (CO2). Es un intercambio gaseoso
PMD: CARLOS ANDRES SAMBONI La respiración es un proceso involuntario y automático, mediante la cual las células del cuerpo toman oxígeno (O2) y eliminan el dióxido de carbono (CO2). Es un intercambio gaseoso
PESTE PORCINA AFRICANA
 CAPÍTULO 15.1. PESTE PORCINA AFRICANA Artículo 15.1.1. Disposiciones generales El cerdo y las especies de suidos de su misma familia son los únicos huéspedes naturales del virus de la peste porcina africana.
CAPÍTULO 15.1. PESTE PORCINA AFRICANA Artículo 15.1.1. Disposiciones generales El cerdo y las especies de suidos de su misma familia son los únicos huéspedes naturales del virus de la peste porcina africana.
