CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Especialización CEBI_E1b Técnicas de análisis en biotecnología
|
|
|
- Lorena Velázquez Santos
- hace 5 años
- Vistas:
Transcripción
1 CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Especialización CEBI_E1b Técnicas de análisis en biotecnología Macromoléculas Docente a cargo: SANTAGAPITA, Patricio CEBI_E1b_2 :
2 La electroforesis es una técnica para separar o resolver moléculas en una mezcla, bajo la influencia de un campo eléctrico (también llamada movilidad electroforética) Las moléculas en solución, bajo la influencia de un campo eléctrico, migran a una velocidad determinada por la relación carga:masa
3 PAGE: polyacrilamide gel electrophoresis 2 condiciones: nativa y desnaturalizante SDS-PAGE: método para separar proteínas sólo por tamaño SDS: sodium dodecyl sulphate El detergente linealiza las proteínas. Así, poseen la misma carga por masa INDEPENDENCIA CONFORMACIÓN ESPACIAL
4 SDS: estructura y función - Detergente aniónico desnaturalizante - Rompe interacciones hidrofóbicas y cubre la superficie de la proteína - Enmascara las cargas positivas con sus cargas negativas - No rompe puentes disulfuro inter o intra- catenarios Se agrega aprox. 1,5 g / g de proteína
5 Tratamiento de la muestra a sembrar: Además del agregado del SDS, la muestra puede ser calentada a 9598 C durante 3-4 minutos, en presencia de DTT (ditiotreitol) o 2mercaptoetanol, que contribuyen a desnaturalizar las proteínas reduciendo enlaces disulfuro y rompiendo estructuras terciarias (plegamientos) y cuaternarias (asociaciones de subunidades). Recordatorio: este método no se utiliza cuando es necesario mantener la estructura nativa de la proteína para otros análisis, o para sacar algún tipo de conclusión comparativa.
6 Por lo tanto, las proteínas en la muestra: Sólo presentan estructura primaria (linealizadas). Serán más largas cuanto mayor sea su masa. Tienen carga neta negativa, por lo que migrarán al polo positivo cuando se las someta a un campo eléctrico. Las proteínas no presentan diferencias en cargas (todas tienen la misma tendencia a acercarse al polo positivo con la misma fuerza) y no presentan diferencias espaciales en su conformación. Resta poner las proteínas en un ambiente que las separe por tamaño, una estructura tridimensional en forma de red o esponja con un determinado tamaño de poro.
7 Entonces, un esquema de lo que sucederá... s-s SDS, calor Proteínas con SDS +
8 Pasos: 1) Preparación del gel y de la muestra (en paralelo) 2) Corrida del gel Requiere conocimiento previo 3) Revelado de las proteínas en el gel, mediante el método de tinción Dependerá del uso
9 Técnica: enlaces interesantes: Como preparar un gel (How to Make an SDS-PAGE gel) Como correr un gel (How to Run an SDS-PAGE gel) Como realizar la tinción (How to Stain an SDS-PAGE gel)
10 Poliacrilamida: polímero de acrilamida. Se produce un gel cuyo tamaño de poro puede regularse cambiando las proporciones de acrilamida y bisacrilamida utilizadas en el momento de la preparación de la mezcla y la polimerización. El gel no es sólido, sino que presenta túneles, poros y una forma de red tridimensional de fibras.
11 Estructuras involucradas en la polimerización: t
12 La polimerización de la acrilamida inicia con la adición del persulfato de amonio (PSA), que forma radicales libres al ser disuelto en agua: El TEMED funciona como agente catalítico adicional para la polimerización. Además, acelera la formación de radicales sulfato.
13 El radical inicia al polimerización de la acrilamida. Sólo se forma un gel rígido cuando se adiciona la bisacrilamida a la mezcla, uniendose así cadenas de poliacrilamida adyacentes.
14 La cantidad de bisacrilamida adicionada es la que controla el grado de entrecruzamiento, y por lo tanto, el tamaño de poro. IMPORTANTE: el efecto del tamaño de poro es OPUESTO al que normalmente se verifica en cromatografía. Si bien en ambos casos las proteínas grandes presentan dificultad para entrar por los poros, en cromatografía eluyen rápidamente. En electroforesis, eluyen lentamente ya que al no entrar facilmente en el gel, el transporte producido por la corriente eléctrica es dificultoso. El tamaño de poro no es simple de controlar como suele serlo en las resinas utilizadas en cromatografía.
15 Las proteínas desnaturalizadas por SDS ingresarán todas al mismo tiempo, y al ser sometidas a un campo eléctrico migrarán al polo positivo. Las moléculas más chicas avanzarán más rápido dentro de la red tridimensional. Por lo tanto, se obtiene un método para separar proteínas por tamaño (masa), independientemente de su conformación tridimensional.
16 Resultado de la corrida: líneas o bandas? En una muestra que contiene sólo una proteína de una secuencia y tamaño determinados, tendremos miles de copias de la misma molécula. Cada una de estas copias recorrerá el gel por diferentes caminos, siendo algunas retenidas durante un poco más de tiempo. Esto genera una banda (y no una línea definida) en el gel.
17 Resultado de la corrida: líneas o bandas? De la misma manera, la técnica SDS-PAGE sólo separa proteínas del mismo tamaño. Por lo tanto, proteínas con diferente secuencia de aminoácidos pero de la misma longitud, correrán juntas en la misma banda, sin poder ser identificadas. Como regla general, esta técnica permite separar moléculas cuyos tamaños difieren hasta en un 10 %, y se utilizan markers o ladders con bandas de peso molecular conocidas como referencia en los geles.
18 Los geles de acrilamida se preparan entre dos placas de vidrio transparente. BIORAD
19 Técnica: Requiere preparar los vidrios en posición vertical, utilizando un spacer standard (1 mm por ej). Esto minimiza el contacto del gel con el aire, ya que el O2 inhibe la polimerización por reacción con los sulfatos. Preparar las mezclas de ambos geles (stack y de corrida o resolutivo), sin agregar PSA ni TEMED. BIORAD
20 Técnica (cont.) Agregar TEMED y PSA, en ese orden, sólo al gel de corrida, mezclar por inversión varias veces y volcar entre los vidrios. Antes de que termine de polimerizar el gel de corrida, agregar TEMED y PSA al gel stacking, y también volcarlo entre los vidrios, sobre el gel de corrida. Poner el peine y dejar polimerizar. Antes de cargar las muestras, sacar los peines con cuidado y lavar los wells con buffer de corrida.
21 La resolución de los geles depende de las cantidades agregadas para la preparación de la mezcla, y se expresa en % de acrilamida (geles de 10, 12, 15%, etc). Para geles de 10% o menos, se usa un gel de stacking de 4%, mientras que para geles mayores al 10%, es recomendable un stacking de 6%. Los geles stacking son laxos para permitir que todas las proteínas corran libremente, hasta encontrarse con el gel de corrida, que es mucho más denso. Esto hace que todas las proteínas de la muestra se encuentren en la misma línea de partida cuando comienzan a correr por el gel de corrida o resolutivo.
22 Se presentan mezclas standard para geles de corrida o resolutivos. El ph del buffer es 8, % 17.5 % 13.5 %
23 Mezcla standard para gel de Solución para la muestra (5X): tiene stacking de 4,5%. El ph del buffer azul de bromofenol para indicar el es 6,8 frente de la corrida y como indicador de ph, y glicerol para darle mayor densidad que el buffer al momento de la siembra en la calle. El azul de bromofenol tiene carga positiva en ph > 4,6, por lo que corre delante de todas las proteínas.
24 Buffer de corrida: es el buffer con el que se llena la cuba y en el que se sumerge el gel. Para una cuba standard de Bio Rad (Protean II) son necesarios 500 ml de una solución del buffer anterior 1X, por lo que deberán diluirse 50 ml del Buffer 10X en agua destilada o milliq. Se corren los geles a 200 volts constantes, hasta que el azul del frente de corrida llegue al borde inferior del gel. Son unos minutos. La progresión de la corrida puede monitorearse también utilizando markers coloreados.
25 Luego de la electroforesis, el gel debe ser teñido para detectar las proteínas separadas, o las proteínas transferidas a una membrana para su detección específica posterior (Western blot). Las tinciones mas comunes son Coomassie Blue, PageBlu, o tinción Argéntica (con plata). Recordar que las proteínas se observan como bandas diferentes en el gel, y se utiliza un marcador con proteínas de peso molecular conocido como referencia en una de las calles del gel. La electroforesis en gel es el primer método utilizado para la determinación de pureza en proteínas. Como todo método, puede tener falsos positivos y negativos.
26 El colorante Coomassie Blue es cuantitativo. Puede utilizarse para cuantificar especies diferentes en un gel. Sin embargo, se adhiere con menor afinidad a las proteínas con alto grado de glicosilación. Límite de detección: 100 ng. Se une a las histidinas y aminoácidos aromáticos de las proteínas a detectar. Colorantes comúnmente utilizados: Coomassie Blue R250 (se obtiene mejor resolución), Coomassie Blue G250 (es más sensible), Coomassie Violet R150.
27 Existe también una tinción coloidal de Coomassie Blue, en la cual se usa Coomassie Blue G250 (en lugar de R250) en una solución que también contiene acido fosfórico, sulfato de amonio, y metanol al 20%. Esta tinción es mucho más sensible, aunque no tan cuantitativa como la que utiliza R250. Se recomienda el uso con proteínas de bajo peso molecular, o cuando es necesaria la detección de especies en muy baja concentración. En estos casos también es recomendable aumentar el porcentaje de metanol de los buffers, incluyendo el buffer de transferencia en los Western Blots.
28 La tinción argéntica es muy sensible (detecta impurezas que no se ven por otros métodos) pero no es cuantitativa (tiene diferente afinidad por las distintas proteínas). Límite de detección: 1 ng. El mecanismo químico de la tinción argéntica todavía no se conoce. Es un método muy sensible a suciedad en los vidrios, materiales e impurezas en los reactivos. Hay que trabajar con mucho cuidado, evitar el contacto con el gel y utilizar buffers recién preparados y fríos.
29 PageBlu: solución teñidora de proteínas. Protocolo mucho más simple Más sensible que Coomasie Blue R-250 Única solución. No contiene ác. Acético o metanol Más rápido que CB de Thermo Scientific Útil para Western Blot
30 Tinción PAS específica para glicoproteínas tinción del ácido periódico-schiff-pas para glicoproteínas (Glicoprotein Detection Kit, Sigma) Concentraciones de proteínas entre 1 y 6 mg/ml
31 Tinción PAS Las bandas de proteínas se fijaron al gel de poliacrilamida con ácido tricloroacético al 12,5% (p/v) durante 30 minutos, el exceso de ácido se eliminó por lavado con agua y a continuación los glicanos unidos a la estructura de las glicoproteínas se hicieron reaccionar con ácido periódico al 1% (p/v) en ácido acético al 3% (v/v). El exceso de los iones periodato e iodato se eliminaron lavando con agua (6 veces durante 10 minutos) y a continuación se desarrolló el color por inmersión del gel en el reactivo de Schiff durante 1 h en oscuridad. El gel se decoloró con una solución de Na2S2O5 al 0,5% (p/v) y lavado con agua bidestilada. Benavent, 2007, Tesis Facultad de Ciencias de Madrid
32 Marcadores: muchas opciones en el mercado. Debe cubrir todo el rango de interés. Puede poseer doble utilidad: PAGE y Western blot. de Invitrogen
33 de Thermo Scientific
34 Los geles finalmente son secados, para extraerles la mayor parte de su contenido acuoso. El secado puede hacerse en estufas cerradas, o en secadoras con planchas calientes (80C) y la aplicación de vacío. El secado por aire caliente se realiza en geles contenidos entre dos planchas de celofan, y es ideal para densitometría, escaneado y almacenamiento. La tendencia al quebrado es mucho menor. BIORAD
35 Algunos ejemplos de tinciones...
36 Mas ejemplos...
37 SDS PAGE Gel with MW standards
38 Existen sistemas automatizados para hacer electroforesis de proteínas y ácidos nucleicos, con circuitos capilares microvolumétricos conteniendo una matriz similar a la poliacrilamida. Estos sistemas son automáticos, rápidos, y generan un perfil de absorbancia versus tiempo de cada muestra, similar los picos del HPLC analítico. Luego estos picos son transformados en bandas con la densidad apropiada en un gel virtual emitido por el equipo.
39 Recomendaciones: Utilizar geles SDS-PAGE para determinar pureza en muestras, cuando sea necesaria una cuantificación. Optar por métodos coloidales cuando se busque una proteína de bajo PM. Aumentar el porcentaje de metanol en los buffers de tinción cuando haya que detectar proteínas de bajo PM, para fijarlas mejor. Tricina: su uso es necesario con proteínas pequeñas o péptidos. Muy alta resolución. Más complejos de preparar. Geles mas duros y difíciles de almacenar. Ver protocolo adjunto (Schägger, Nat. Protocols, 2006,1:16)
40 Recomendaciones: Utilizar geles de plata para detectar impurezas en mínima concentración. Se recomienda utilizarlos para el seguimiento y desarrollo de métodos de purificación. No analizar muestras con alta concentración de proteínas. Las cantidades que mejor se observan en geles de Coomassie Blue están entre 200 y 2000 ng. Para geles de plata, entre 25 y 200 ng. No comparar cuantitativamente proteínas con diferente grado de glicosilación.
41 Por lo tanto, el paso n 1 antes de realizar el gel: No analizar muestras con alta concentración de proteínas Determinación de concentración de proteínas Existen varios métodos (Bradford, Lowry, Biuret, etc). Se entrará en detalle más adelante en el curso Conocer el tipo de proteínas para realizar tinciones diferenciales
42 Geles de agarosa Uso más general: separar ADN, o ARN por tamaño Migran hacia el polo positivo porque ya cargadas eléctricamente Proteínas: sii alto peso molecular Aplicaciones: - luego de digestión con enzimas específicas - análisis de productos de PCR De esta forma, separo fragmento linealizados, y la conformación de doble hélice no es un problema
43 Preparación: 0,7 y 2% agarosa. 3% si fragmentos pequeños. Más simple que PAGE
44 Buffers de corrida: - TAE (Tris/ acetate/ EDTA) - TBE (Tris/ borate/ EDTA) - SB (Sodim borate) Tinción: bromuro de etidio (se intercala entre las bases), SYBR Green (Sigma), plata. Revelado: al UV. Comparando intensidad y posición respecto al marcador, puedo cuantificar y conocer el PM, respectivamente
45 Geles de agarosa Protocolo útil: gel: desarrollo de la técnica
46 en geles de agarosa. Esquema
47 Fragmentos de DNA separados en gel de agarosa Ladders (en kb), a) por Enz. Restricc, b) marcadores
48 Geles de agarosa Desarrollos específicos: Sistema de electroforesis por microchip para análisis de ADN/ARN MCE-202 MultiNA (Shimadzu, Biotech- Jenck S.A.) Alta reproducibilidad, detecciones de hasta 6 pb, automatización
49 P St res an tai da ne rd d Sh s ar k Sa lm on Tr ou t Ca tfi sh St ur ge Ac on tin & M yo si n & M yo si n Ac tin St ur ge on Sa lm on Tr ou t Ca tfi sh P St res an tai da ne rd d s Sh ar k Se pueden separar proteínas en geles de agarosa? Myosin Heavy Chain Actin Tropomyosin Myosin Light Chains Myosin Heavy Chain Actin Tropomyosin Myosin Light Chains 10 Poliacrilamida BIORAD Agarosa
50 Estimación del peso molecular (12 mm) 25 (17 mm) 20 (22 mm) 15 (27.5 mm) 10 (36 mm) Size (kd) Distance migrated (mm) BIORAD
51 Analisis del peso molecular con papel semi-log
52 Algunas empresas que comercializan equipos: BIO RAD, Labnet International Inc., Scie-Plas (UK), Cole-parmer instrument company,
53
54
55 Ready Gel Precast Gel Assembly Step 1 BIORAD Step 3 Step 2 Step 4
ELECTROFORESIS Q U Í M I C A B I O L Ó G I C A. D E P A R T A M E N T O D E B Q C A. F C N Y C S. U N P S J B
 ELECTROFORESIS Q U Í M I C A B I O L Ó G I C A. D E P A R T A M E N T O D E B Q C A. F C N Y C S. U N P S J B 2 0 1 7 Que es la electroforesis? Qué permite analizar? Que factores influyen? Separar y analizar
ELECTROFORESIS Q U Í M I C A B I O L Ó G I C A. D E P A R T A M E N T O D E B Q C A. F C N Y C S. U N P S J B 2 0 1 7 Que es la electroforesis? Qué permite analizar? Que factores influyen? Separar y analizar
MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS. Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa
 MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa Qué es la electroforesis? Es la técnica que permite la separación
MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa Qué es la electroforesis? Es la técnica que permite la separación
MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS. Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa.
 MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa. Qué es la electroforesis? Es la técnica que permite la
MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa. Qué es la electroforesis? Es la técnica que permite la
Monitoreo de un proceso de purificación de proteínas. Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa
 Monitoreo de un proceso de purificación de proteínas Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa Qué es la electroforesis? Es la técnica que permite la separación
Monitoreo de un proceso de purificación de proteínas Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa Qué es la electroforesis? Es la técnica que permite la separación
Electroforesis de proteínas en geles de poliacrilamida
 Electroforesis de proteínas en geles de poliacrilamida Electroforesis de proteínas en geles de poliacrilamida: Introducción y técnica básica La electroforesis de proteínas en geles con una matriz de poliacrilamida,
Electroforesis de proteínas en geles de poliacrilamida Electroforesis de proteínas en geles de poliacrilamida: Introducción y técnica básica La electroforesis de proteínas en geles con una matriz de poliacrilamida,
Introducción. Electroforesis zonal Campo aplicado a un soporte estabilizante Muestra dispuesta sobre una zona reducida del soporte
 Introducción Técnica analítica separativa: Transporte de moléculas cargadas bajo la acción de un campo eléctrico Movilidad electroforética depende de: La carga de la molécula Depende del medio ph Fuerza
Introducción Técnica analítica separativa: Transporte de moléculas cargadas bajo la acción de un campo eléctrico Movilidad electroforética depende de: La carga de la molécula Depende del medio ph Fuerza
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 Virología y Micología Veterinaria Trabajo Práctico No. 4 ELECTROFORESIS La electroforesis es una técnica utilizada para separar grandes moléculas por tamaño a través de la aplicación de un campo eléctrico
1 Virología y Micología Veterinaria Trabajo Práctico No. 4 ELECTROFORESIS La electroforesis es una técnica utilizada para separar grandes moléculas por tamaño a través de la aplicación de un campo eléctrico
ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE
 Departamento de Biología de Sistemas Unidad Docente de Bioquímica y Biología Molecular ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE 1. FUNDAMENTO TEÓRICO La electroforesis es una técnica de
Departamento de Biología de Sistemas Unidad Docente de Bioquímica y Biología Molecular ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE 1. FUNDAMENTO TEÓRICO La electroforesis es una técnica de
Práctica: Electroforesis de DNA y transferencia a membranas de celulosa o nylon.
 Biología Celular y Molecular para Medicina Jorge Contreras Pineda Práctica: Electroforesis de DNA y transferencia a membranas de celulosa o nylon. GENERALIDADES La electroforesis es una técnica de laboratorio
Biología Celular y Molecular para Medicina Jorge Contreras Pineda Práctica: Electroforesis de DNA y transferencia a membranas de celulosa o nylon. GENERALIDADES La electroforesis es una técnica de laboratorio
ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE
 1. FUNDAMENTO TEÓRICO ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE Departamento de Bioquímica La electroforesis es una técnica de separación de moléculas cargadas por migración en un campo
1. FUNDAMENTO TEÓRICO ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE Departamento de Bioquímica La electroforesis es una técnica de separación de moléculas cargadas por migración en un campo
Trabajo Práctico 5: Electroforesis de proteínas Electroforesis de proteínas en Acetato de celulosa
 Trabajo Práctico 5: Electroforesis de proteínas Electroforesis de proteínas en Acetato de celulosa OBJETIVO: -Realizar electroforesis de las proteínas presentes en suero utilizando acetato de celulosa
Trabajo Práctico 5: Electroforesis de proteínas Electroforesis de proteínas en Acetato de celulosa OBJETIVO: -Realizar electroforesis de las proteínas presentes en suero utilizando acetato de celulosa
PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA
 INTRODUCCIÓN PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA La electroforesis es una técnica que permite separar moléculas cargadas eléctricamente, entre las cuales se encuentran los ácidos nucleicos (DNA
INTRODUCCIÓN PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA La electroforesis es una técnica que permite separar moléculas cargadas eléctricamente, entre las cuales se encuentran los ácidos nucleicos (DNA
BIOLOGIA CELULAR Y MOLECULAR. LABORATORIO No 9: ELECTROFORESIS EN GELES DE POLIACRILAMIDA (SDS-PAGE)
 BIOLOGIA CELULAR Y MOLECULAR LABORATORIO No 9: ELECTROFORESIS EN GELES DE POLIACRILAMIDA (SDS-PAGE) 1. INTRODUCCIÓN Uno de los métodos que permite la purificación y separación de proteínas de un organismo
BIOLOGIA CELULAR Y MOLECULAR LABORATORIO No 9: ELECTROFORESIS EN GELES DE POLIACRILAMIDA (SDS-PAGE) 1. INTRODUCCIÓN Uno de los métodos que permite la purificación y separación de proteínas de un organismo
Electroforesis de proteínas
 Electroforesis de proteínas Introducción general La electroforesis es un método de separación basado en la tasa diferencial de migración de especies cargadas al estar en un campo eléctrico de DC La electroforesis
Electroforesis de proteínas Introducción general La electroforesis es un método de separación basado en la tasa diferencial de migración de especies cargadas al estar en un campo eléctrico de DC La electroforesis
ELECTROFORESIS. Objetivo de la clase. *fundamentos *procedimientos *algunas aplicaciones. Conocer los métodos electroforéticos
 ELECTROFORESIS Objetivo de la clase Conocer los métodos electroforéticos *fundamentos *procedimientos *algunas aplicaciones Definición de electroforesis Proceso de separación que se basa en la diferente
ELECTROFORESIS Objetivo de la clase Conocer los métodos electroforéticos *fundamentos *procedimientos *algunas aplicaciones Definición de electroforesis Proceso de separación que se basa en la diferente
TP3: Electroforesis en gel de poliacrilamida
 Objetivos TP3: Electroforesis en gel de poliacrilamida Comparar los perfiles proteicos obtenidos mediante SDS-PAGE. Calcular la movilidad electroforética de diferentes bandas proteicas. Introducción La
Objetivos TP3: Electroforesis en gel de poliacrilamida Comparar los perfiles proteicos obtenidos mediante SDS-PAGE. Calcular la movilidad electroforética de diferentes bandas proteicas. Introducción La
GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS. Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo (+)
 GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS Electroforésis Separación de especies cargadas (anión (-) y catión (+) ) Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo
GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS Electroforésis Separación de especies cargadas (anión (-) y catión (+) ) Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo
ANEXOS A: Procedimientos experimentales
 ANEXOS 1 ANEXOS A: Procedimientos experimentales SDS-TRIS-GLICINA-PAGE Procedimiento A.1. Descripción del método de preparación de geles de poliacrilamida. Se trata de un sistema vertical de electroforesis,
ANEXOS 1 ANEXOS A: Procedimientos experimentales SDS-TRIS-GLICINA-PAGE Procedimiento A.1. Descripción del método de preparación de geles de poliacrilamida. Se trata de un sistema vertical de electroforesis,
ELECTROFORESIS GENERALIDADES Y APLICACIONES CLINICAS
 ELECTROFORESIS GENERALIDADES Y APLICACIONES CLINICAS Marcelo Castillo Navarrrete, T.M. MsCs (C) Facultad de Medicina Carrera Tecnología Médica 18 de Noviembre de 2004 Fundamentos de Electroforesis Alta
ELECTROFORESIS GENERALIDADES Y APLICACIONES CLINICAS Marcelo Castillo Navarrrete, T.M. MsCs (C) Facultad de Medicina Carrera Tecnología Médica 18 de Noviembre de 2004 Fundamentos de Electroforesis Alta
ELECTROFORESIS EN GELES DE POLIACRILAMIDA SDS-PAGE. Presencia de Sodio Dodecil Sulfato bajo condiciones reductoras (SDSPAGE)
 ELECTROFORESIS EN GELES DE POLIACRILAMIDA SDSPAGE Presencia de Sodio Dodecil Sulfato bajo condiciones reductoras (SDSPAGE) Método rápido, reproducible y de bajo costo Utilizado para cuantificar, comparar
ELECTROFORESIS EN GELES DE POLIACRILAMIDA SDSPAGE Presencia de Sodio Dodecil Sulfato bajo condiciones reductoras (SDSPAGE) Método rápido, reproducible y de bajo costo Utilizado para cuantificar, comparar
MÉTODOS DE ESTUDIO DE PROTEÍNAS
 MÉTODOS DE ESTUDIO DE PROTEÍNAS ANÁLISIS DE EXPRESIÓN DE PROTEÍNAS Al estudiar la expresión de un gen puede analizarse el ARN (Northern blot, PCR a tiempo real, etc), y también la expresión de la proteína,
MÉTODOS DE ESTUDIO DE PROTEÍNAS ANÁLISIS DE EXPRESIÓN DE PROTEÍNAS Al estudiar la expresión de un gen puede analizarse el ARN (Northern blot, PCR a tiempo real, etc), y también la expresión de la proteína,
PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS. Es un ácido capaz de formar sales con iones cargados
 Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
TP3: Electroforesis en gel de poliacrilamida
 TP3: Electroforesis en gel de poliacrilamida Objetivos Comparar las fracciones de proteínas obtenidas en el TP Nº2 mediante SDS-PAGE. Calcular la movilidad electroforética de diferentes bandas proteicas.
TP3: Electroforesis en gel de poliacrilamida Objetivos Comparar las fracciones de proteínas obtenidas en el TP Nº2 mediante SDS-PAGE. Calcular la movilidad electroforética de diferentes bandas proteicas.
 TRABAJO PRACTICO Nº 3. PROTEINAS Y ENZIMAS. www.fcn.unp.edu.ar/sitio/farmacognosia/ Objetivo - Utilizar reacciones generales y técnicas de extracción y separación adecuadas para el análisis de proteínas
TRABAJO PRACTICO Nº 3. PROTEINAS Y ENZIMAS. www.fcn.unp.edu.ar/sitio/farmacognosia/ Objetivo - Utilizar reacciones generales y técnicas de extracción y separación adecuadas para el análisis de proteínas
TÉCNICAS DE ANÁLISIS GENÉTICO: Extracción de ADN.
 Trabajo Práctico 2.2 TÉCNICAS DE ANÁLISIS GENÉTICO: Extracción de ADN. Desde el reconocimiento del ADN como "la molécula de la vida", se conoce que en ella se encuentran cifradas las instrucciones que
Trabajo Práctico 2.2 TÉCNICAS DE ANÁLISIS GENÉTICO: Extracción de ADN. Desde el reconocimiento del ADN como "la molécula de la vida", se conoce que en ella se encuentran cifradas las instrucciones que
ELABORACIÓN N DE MEZCLA PARA PCR. Raquel Asunción Lima Cordón
 ELABORACIÓN N DE MEZCLA PARA PCR Raquel Asunción Lima Cordón PCR Polymerase Chain reaction (reacción en cadena de la polimerasa) Sintetizar muchas veces un fragmento de ADN PCR: simulación de lo que sucede
ELABORACIÓN N DE MEZCLA PARA PCR Raquel Asunción Lima Cordón PCR Polymerase Chain reaction (reacción en cadena de la polimerasa) Sintetizar muchas veces un fragmento de ADN PCR: simulación de lo que sucede
3. Materiales y Métodos
 3. Materiales y Métodos El análisis de haplotipos se realizó mediante la caracterización de variaciones alélicas reportadas con anterioridad. En total de analizaron cinco marcadores polimórficos: tres
3. Materiales y Métodos El análisis de haplotipos se realizó mediante la caracterización de variaciones alélicas reportadas con anterioridad. En total de analizaron cinco marcadores polimórficos: tres
Tema 6 Cuantificación de proteínas
 Tema 6 Cuantificación de proteínas Procedimiento de estudio de proteínas Selección de fuente Fraccionamiento de células Centrifugación Cromatografía Cromatografía en capa fina Cromatografía en columna
Tema 6 Cuantificación de proteínas Procedimiento de estudio de proteínas Selección de fuente Fraccionamiento de células Centrifugación Cromatografía Cromatografía en capa fina Cromatografía en columna
Guía de TP Nro. 5 Actividad Proteolítica Celular
 Biología Celular y Molecular Guía de TP Nro. 5 Actividad Proteolítica Celular Introducción La actividad proteolítica secretada por las células es un elemento indispensable para la proliferación y migración
Biología Celular y Molecular Guía de TP Nro. 5 Actividad Proteolítica Celular Introducción La actividad proteolítica secretada por las células es un elemento indispensable para la proliferación y migración
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo
 Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
Diagnóstico Avanzado en Enfermedades Tropicales
 Diagnóstico Avanzado en Enfermedades Tropicales Máster universitario en Enfermedades Tropicales Código 302731 (3 créditos ECTS) Área de Parasitología Departamento de Biología Animal, Parasitología, Ecología,
Diagnóstico Avanzado en Enfermedades Tropicales Máster universitario en Enfermedades Tropicales Código 302731 (3 créditos ECTS) Área de Parasitología Departamento de Biología Animal, Parasitología, Ecología,
Separación de biomoléculas
 Separación de biomoléculas Cromatografía. Aspectos generales, técnicas involucradas. FPLC, HPLC. Electroforesis. Conceptos generales y aplicaciones. Geles de poliacrilamida y agarosa. Isoelectroenfoque.
Separación de biomoléculas Cromatografía. Aspectos generales, técnicas involucradas. FPLC, HPLC. Electroforesis. Conceptos generales y aplicaciones. Geles de poliacrilamida y agarosa. Isoelectroenfoque.
PRACTICA CROMATOGRAFIA EN GEL Y CUANTIFICACIÓN DE PROTEÍNAS J.A. REIG. 1 de 20 2 de 10 1 moneda de 1 10 monedas monedas monedas de 0.
 PRACTICA CROMATOGRAFIA EN GEL Y CUANTIFICACIÓN DE PROTEÍNAS J.A. REIG Para saber lo que tengo debo separar las partes y cuantificar 1 de 20 2 de 10 1 moneda de 1 10 monedas 0.20 4 monedas 0.10 3 monedas
PRACTICA CROMATOGRAFIA EN GEL Y CUANTIFICACIÓN DE PROTEÍNAS J.A. REIG Para saber lo que tengo debo separar las partes y cuantificar 1 de 20 2 de 10 1 moneda de 1 10 monedas 0.20 4 monedas 0.10 3 monedas
Universidad de la República Oriental del Uruguay Facultad de Ingeniería Instituto de Ingeniería Eléctrica MANUAL DE USUARIO ELECTROFORESIS
 Universidad de la República Oriental del Uruguay Facultad de Ingeniería Instituto de Ingeniería Eléctrica MANUAL DE USUARIO ELECTROFORESIS DICIEMBRE 2006 Tratamiento de Imágenes por Computadora Proyecto
Universidad de la República Oriental del Uruguay Facultad de Ingeniería Instituto de Ingeniería Eléctrica MANUAL DE USUARIO ELECTROFORESIS DICIEMBRE 2006 Tratamiento de Imágenes por Computadora Proyecto
Proyecto de Fin de Cursos
 Universidad de la República Oriental del Uruguay Proyecto de Fin de Cursos ELECTROFORESIS EN GEL DE MOLÉCULAS DE ADN Noviembre de 2006 Carolina Etchart C.I. 3.757.708-8 Marcelo Lavagna C.I. 3.508.715-8
Universidad de la República Oriental del Uruguay Proyecto de Fin de Cursos ELECTROFORESIS EN GEL DE MOLÉCULAS DE ADN Noviembre de 2006 Carolina Etchart C.I. 3.757.708-8 Marcelo Lavagna C.I. 3.508.715-8
EXTRACCIÓN Y PURIFICACIÓN DE ÁCIDOS NUCLEICOS
 EXTRACCIÓN Y PURIFICACIÓN DE ÁCIDOS NUCLEICOS Consideraciones iniciales - Condiciones de limpieza y esterilidad - Peligrosidad de algunos reactivos usados en la purificación Fases - Rotura-homogeneización:
EXTRACCIÓN Y PURIFICACIÓN DE ÁCIDOS NUCLEICOS Consideraciones iniciales - Condiciones de limpieza y esterilidad - Peligrosidad de algunos reactivos usados en la purificación Fases - Rotura-homogeneización:
Bqca.. Esp. Marcela Alejandra Guastavino Dra. María a Mercedes Tiscornia
 Bqca.. Esp. Marcela Alejandra Guastavino Dra. María a Mercedes Tiscornia Cátedra de Biología Molecular y Genética - 2015 OBJETIVOS Comprender el fundamento teórico de las técnicas t básicas de aislamiento
Bqca.. Esp. Marcela Alejandra Guastavino Dra. María a Mercedes Tiscornia Cátedra de Biología Molecular y Genética - 2015 OBJETIVOS Comprender el fundamento teórico de las técnicas t básicas de aislamiento
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL
 CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
Técnicas de Caracterización y purificación
 Técnicas de Caracterización y purificación hidrofobicidad carga Propiedades de las proteínas utilizadas para caracterizar y purificar Carga Tamaño Forma Actividad biologica Hidrofobicidad PM Estabilidad
Técnicas de Caracterización y purificación hidrofobicidad carga Propiedades de las proteínas utilizadas para caracterizar y purificar Carga Tamaño Forma Actividad biologica Hidrofobicidad PM Estabilidad
4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar
 4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar - Agarosa de grado molecular - Agarosa de bajo punto de fusión
4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar - Agarosa de grado molecular - Agarosa de bajo punto de fusión
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas.
 Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
BIOLOGIA MOLECULAR. Dra. Ma. Laura Tondo
 TÉCNICAS BASADAS EN HIBRIDACIÓN MOLECULAR BIOLOGIA MOLECULAR 2016 Dra. Ma. Laura Tondo DESNATURALIZACION Y RENATURALIZACION DEL DNA Cómo se mantienen unidas las dos hebras del DNA? - Puentes de hidrógeno
TÉCNICAS BASADAS EN HIBRIDACIÓN MOLECULAR BIOLOGIA MOLECULAR 2016 Dra. Ma. Laura Tondo DESNATURALIZACION Y RENATURALIZACION DEL DNA Cómo se mantienen unidas las dos hebras del DNA? - Puentes de hidrógeno
Técnicas de Estudio de las células
 Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
ELECTROFORESIS AVANZADA
 Ref. ELECAVANZADA (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Ref. ELECAVANZADA (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Módulo 2 Biología Molecular Genética Molecular II Módulo 2. Clonación y Selección de moléculas recombinantes
 Módulo 2 Clonación y Selección de moléculas recombinantes El fragmento de ADN amplificado por PCR en el módulo anterior se introdujo en un vector pgem T Easy (Ver Anexo 2) utilizando una ligasa. En la
Módulo 2 Clonación y Selección de moléculas recombinantes El fragmento de ADN amplificado por PCR en el módulo anterior se introdujo en un vector pgem T Easy (Ver Anexo 2) utilizando una ligasa. En la
Código: IDK-003 Ver: 1. Factor V Leiden
 Sistema para detección de la alteración G1691A en el gene que codifica para el Factor V de la coagulación humana Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71
Sistema para detección de la alteración G1691A en el gene que codifica para el Factor V de la coagulación humana Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71
Código: KIT-005 Ver: 1 MTHFR C677T
 Sistema para detección de la alteración C677T en el gene que codifica para la Metilen-tetrahidrofolato reductasa humana 1 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598)
Sistema para detección de la alteración C677T en el gene que codifica para la Metilen-tetrahidrofolato reductasa humana 1 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598)
Código: IDK-006 Ver: 1 MTHFR A1298C. Sistema para detección de la alteración A1298C en el gene de la Mutilen Tetrahidrofolato Reductasa
 Sistema para detección de la alteración A1298C en el gene de la Mutilen Tetrahidrofolato Reductasa Reg. MSP 21199 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336
Sistema para detección de la alteración A1298C en el gene de la Mutilen Tetrahidrofolato Reductasa Reg. MSP 21199 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336
Transferencia de material genético II. 1) Aislamiento de plásmidos Lisis alcalina
 Transferencia de material genético II 1) Aislamiento de plásmidos Lisis alcalina ESQUEMA GENERAL SESIÓN I: TRANSFORMAR cepas de E. coli con un plásmido. Verificar que hay células transformantes de acuerdo
Transferencia de material genético II 1) Aislamiento de plásmidos Lisis alcalina ESQUEMA GENERAL SESIÓN I: TRANSFORMAR cepas de E. coli con un plásmido. Verificar que hay células transformantes de acuerdo
Técnicas de Biología Molecular. Biol 3051L
 Técnicas de Biología Molecular Biol 3051L Objetivos El cortar el DNA con enzimas de restricción y hacer corridas de geles usando electroforesis es muchas veces el primer paso para estudiar un gen. En este
Técnicas de Biología Molecular Biol 3051L Objetivos El cortar el DNA con enzimas de restricción y hacer corridas de geles usando electroforesis es muchas veces el primer paso para estudiar un gen. En este
Ensayos southwestern y northwestern
 Búsqueda de proteínas que se unen a DNA (secuencia conocida, promotor) Ensayo southwestern encontrar proteínas ligantes de DNA que reconozcan en éste una determinada secuencia de nucleótidos Ensayo northwestern
Búsqueda de proteínas que se unen a DNA (secuencia conocida, promotor) Ensayo southwestern encontrar proteínas ligantes de DNA que reconozcan en éste una determinada secuencia de nucleótidos Ensayo northwestern
PROTEÓMICA DIFERENCIAL:
 PROTEÓMICA DIFERENCIAL: Técnicas, aplicaciones y dificultades Proteómica: Qué es? Para qué sirve? Conocer el proteoma de un organismo es tener una imagen dinámica de todas las proteínas expresadas por
PROTEÓMICA DIFERENCIAL: Técnicas, aplicaciones y dificultades Proteómica: Qué es? Para qué sirve? Conocer el proteoma de un organismo es tener una imagen dinámica de todas las proteínas expresadas por
Transferencia de material genético II. Ensayos de restricción (digestión) del plásmido Electroforesis en geles de agarosa
 Transferencia de material genético II Ensayos de restricción (digestión) del plásmido Electroforesis en geles de agarosa ESQUEMA GENERAL SESIÓN I: TRANSFORMAR cepas de E. coli con un plásmido. Verificar
Transferencia de material genético II Ensayos de restricción (digestión) del plásmido Electroforesis en geles de agarosa ESQUEMA GENERAL SESIÓN I: TRANSFORMAR cepas de E. coli con un plásmido. Verificar
Biología Celular y Molecular. Guía de TP Nro. 5. Actividad proteolítica celular.
 Biología Celular y Molecular. Guía de TP Nro. 5 Actividad proteolítica celular. Introducción La actividad proteolítica secretada por las células es un elemento indispensable para la proliferación y migración
Biología Celular y Molecular. Guía de TP Nro. 5 Actividad proteolítica celular. Introducción La actividad proteolítica secretada por las células es un elemento indispensable para la proliferación y migración
RESULTADOS Y DISCUSIÓN. Aislamiento de Inmunoglobulina de Conejo Anti-Ferritina
 RESULTADOS Y DISCUSIÓN Aislamiento de Inmunoglobulina de Conejo Anti-Ferritina El aislamiento de inmunoglobulinas provenientes del suero de conejo inmunizado con ferritina de bazo de caballo, se realizó
RESULTADOS Y DISCUSIÓN Aislamiento de Inmunoglobulina de Conejo Anti-Ferritina El aislamiento de inmunoglobulinas provenientes del suero de conejo inmunizado con ferritina de bazo de caballo, se realizó
Ensayos de restricción
 Ensayos de restricción Vector con inserto= Vector recombinante 6500pb Objetivos de ensayos de restricción de plásmidos Conocer el principio de separación y detección de ácidos nucleicos en geles de agarosa.
Ensayos de restricción Vector con inserto= Vector recombinante 6500pb Objetivos de ensayos de restricción de plásmidos Conocer el principio de separación y detección de ácidos nucleicos en geles de agarosa.
DESARROLLO COGNOSCITIVO Y APRENDIZAJE
 Prof. Jhonis Valbuena Cátedra: Análisis Instrumental La Electrofóresis es un método de la Química Analítica que utiliza corriente eléctrica controlada con la finalidad de separar biomolèculas según su
Prof. Jhonis Valbuena Cátedra: Análisis Instrumental La Electrofóresis es un método de la Química Analítica que utiliza corriente eléctrica controlada con la finalidad de separar biomolèculas según su
EL EMPLEO DE ANÁLISIS BIOQUÍMICOS Y MOLECULARES EN EL EXAMEN DHE MOLECULARES EN EL EXAMEN DHE
 X Curso de Formación sobre la Protección de las Obtenciones Vegetales para Países Iberoamericanos Montevideo (URUGUAY) 12 al 16 de Diciembre de 2011 EL EMPLEO DE ANÁLISIS BIOQUÍMICOS Y MOLECULARES EN EL
X Curso de Formación sobre la Protección de las Obtenciones Vegetales para Países Iberoamericanos Montevideo (URUGUAY) 12 al 16 de Diciembre de 2011 EL EMPLEO DE ANÁLISIS BIOQUÍMICOS Y MOLECULARES EN EL
ESTRUCTURA, PROPIEDADES Y FUNCIÓN DE ÁCIDOS NUCLÉICOS. Aislamiento de plásmido
 ESTRUCTURA, PROPIEDADES Y FUNCIÓN DE ÁCIDOS NUCLÉICOS Aislamiento de plásmido Transferencia de material genético intercelular Transformación Conjugación Transformación Transducción Existe algún mecanismo
ESTRUCTURA, PROPIEDADES Y FUNCIÓN DE ÁCIDOS NUCLÉICOS Aislamiento de plásmido Transferencia de material genético intercelular Transformación Conjugación Transformación Transducción Existe algún mecanismo
DETERMINACIÓN DEL PESO MOLECULAR DE PROTEÍNAS
 DETERMINACIÓN DEL PESO MOLECULAR DE PROTEÍNAS 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es desarrollar el conocimiento de la estructura de las proteínas y determinar
DETERMINACIÓN DEL PESO MOLECULAR DE PROTEÍNAS 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es desarrollar el conocimiento de la estructura de las proteínas y determinar
MATERIALES Y METODOS. El presente trabajo se desarrolló en el Laboratorio de. Investigación del Departamento de Ciencias Químico Biológicas de
 19 MATERIALES Y METODOS El presente trabajo se desarrolló en el Laboratorio de Investigación del Departamento de Ciencias Químico Biológicas de la Universidad de Sonora Unidad Regional Norte campus Caborca.
19 MATERIALES Y METODOS El presente trabajo se desarrolló en el Laboratorio de Investigación del Departamento de Ciencias Químico Biológicas de la Universidad de Sonora Unidad Regional Norte campus Caborca.
Electroforesis. Dr. Héctor L. Ayala del Río AMGEN Bruce Wallace Program Departamento de Biología UPR-Humacao VER VIDEO CARGADO GEL
 Electroforesis Dr. Héctor L. Ayala del Río AMGEN Bruce Wallace Program Departamento de Biología UPR-Humacao VER VIDEO CARGADO GEL 1 Electroforesis l Método utilizado para separar y purificar macromoléculas:
Electroforesis Dr. Héctor L. Ayala del Río AMGEN Bruce Wallace Program Departamento de Biología UPR-Humacao VER VIDEO CARGADO GEL 1 Electroforesis l Método utilizado para separar y purificar macromoléculas:
PRÁCTICO Nº 6. ACIDOS NUCLEICOS II Espectrofotometría, Electroforesis, Mapas de Restricción
 PRÁCTICO Nº 6. ACIDOS NUCLEICOS II Espectrofotometría, Electroforesis, Mapas de Restricción Espectrofotometría de ácidos nucleicos Los dobles enlaces conjugados de las bases nitrogenadas hacen que los
PRÁCTICO Nº 6. ACIDOS NUCLEICOS II Espectrofotometría, Electroforesis, Mapas de Restricción Espectrofotometría de ácidos nucleicos Los dobles enlaces conjugados de las bases nitrogenadas hacen que los
PURIFICACIÓN DE PROTEÍNAS
 PURIFICACIÓN DE PROTEÍNAS ESQUEMA DE PURIFICACIÓN DE UNA PROTEÍNA tejido vegetal animal homogeneizar cultivo celular bacterias levaduras células mamíferos PREPARACIÓN EXTRACTO crudo fraccionamiento subcelular
PURIFICACIÓN DE PROTEÍNAS ESQUEMA DE PURIFICACIÓN DE UNA PROTEÍNA tejido vegetal animal homogeneizar cultivo celular bacterias levaduras células mamíferos PREPARACIÓN EXTRACTO crudo fraccionamiento subcelular
Proteínas: Métodos para su Estudio
 Proteínas: Métodos para su Estudio Propiedades Espectroscópicas Todos los aminoácidos absorben luz en la región infraroja Sólo Phe, Tyr, & Trp absorben UV Absorbancia a 280 nm es un buen diagnóstico para
Proteínas: Métodos para su Estudio Propiedades Espectroscópicas Todos los aminoácidos absorben luz en la región infraroja Sólo Phe, Tyr, & Trp absorben UV Absorbancia a 280 nm es un buen diagnóstico para
TRABAJO PRÁCTICO Nº 2 CUANTIFICACIÓN DE PROTEÍNAS POR EL MÉTODO DE BRADFORD.
 AÑO 2010 PRIMER SEMESTRE LABORATORIO ASIGNATURA DE BIOQUÍMICA. PLAN COMÚN AGRONOMÍA E INGENIERÍA FORESTAL FACULTAD CIENCIAS SILVOAGROPECUARIAS TRABAJO PRÁCTICO Nº 2 CUANTIFICACIÓN DE PROTEÍNAS POR EL MÉTODO
AÑO 2010 PRIMER SEMESTRE LABORATORIO ASIGNATURA DE BIOQUÍMICA. PLAN COMÚN AGRONOMÍA E INGENIERÍA FORESTAL FACULTAD CIENCIAS SILVOAGROPECUARIAS TRABAJO PRÁCTICO Nº 2 CUANTIFICACIÓN DE PROTEÍNAS POR EL MÉTODO
Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular
 Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular Aislamiento, análisis y manipulación de ácidos nucleicos Generación de moléculas de DNA recombinante Ingeniería Genética AISLAMIENTO
Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular Aislamiento, análisis y manipulación de ácidos nucleicos Generación de moléculas de DNA recombinante Ingeniería Genética AISLAMIENTO
Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular
 Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular Aislamiento, análisis y manipulación de ácidos nucleicos Generación de moléculas de DNA recombinante Ingeniería Genética AISLAMIENTO
Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular Aislamiento, análisis y manipulación de ácidos nucleicos Generación de moléculas de DNA recombinante Ingeniería Genética AISLAMIENTO
ELECTROFORESIS Fundamento.
 ELECTROFORESIS La electroforesis es un método de laboratorio en el que se utiliza una corriente eléctrica controlada con la finalidad de separar biomoleculas según su tamaño y carga eléctrica a través
ELECTROFORESIS La electroforesis es un método de laboratorio en el que se utiliza una corriente eléctrica controlada con la finalidad de separar biomoleculas según su tamaño y carga eléctrica a través
AMINOACIDOS. Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 12/04/2012
 AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
Módulo 1 Biología Molecular Genética Molecular II 2009. Módulo 1. Amplificación de un fragmento de ADN genómico por PCR
 Módulo 1 Amplificación de un fragmento de ADN genómico por PCR En este primer módulo se amplificará por PCR, mediante el uso de oligonucleótidos específicos, un fragmento de ADN genómico de Aspergillus
Módulo 1 Amplificación de un fragmento de ADN genómico por PCR En este primer módulo se amplificará por PCR, mediante el uso de oligonucleótidos específicos, un fragmento de ADN genómico de Aspergillus
IBCM 1 GUIA DE PROBLEMAS DE PROTEINAS
 IBCM 1 1-Complete los esquemas II y III. Además señale: extremo NH2 terminal, extremo 5 del mrna, extremo 3 del trna, sitio P, sitio A, codones y anticodones (complételos con las bases correspondientes)
IBCM 1 1-Complete los esquemas II y III. Además señale: extremo NH2 terminal, extremo 5 del mrna, extremo 3 del trna, sitio P, sitio A, codones y anticodones (complételos con las bases correspondientes)
EXTRACCIÓN DE ADN (Doyle & Doyle, 1987)
 EXTRACCIÓN DE ADN (Doyle & Doyle, 1987) MATERIALES Y REACTIVOS (Grado biología molecular a analítico) Cloroformo Alcohol Isoamilico Isopropanol. Etanol al 70%. Bloques de Hielo Microcentrifuga Bloque de
EXTRACCIÓN DE ADN (Doyle & Doyle, 1987) MATERIALES Y REACTIVOS (Grado biología molecular a analítico) Cloroformo Alcohol Isoamilico Isopropanol. Etanol al 70%. Bloques de Hielo Microcentrifuga Bloque de
Vidrafoc Life Science
 Estamos muy satisfechos de poder presentarle nuestra nueva línea de Vidrafoc Life Science Desde sus inicios, en 1968, con la fabricación de vidrio científi co y posteriormente con la distribución de material
Estamos muy satisfechos de poder presentarle nuestra nueva línea de Vidrafoc Life Science Desde sus inicios, en 1968, con la fabricación de vidrio científi co y posteriormente con la distribución de material
CROMATOGRAFÍA DE AMINOÁCIDOS
 CROMATOGRAFÍA DE AMINOÁCIDOS Electroforesis.- Es un método de laboratorio en el que se utiliza una corriente eléctrica controlada con la finalidad de separar aminoácidos (y otras biomoléculas) según su
CROMATOGRAFÍA DE AMINOÁCIDOS Electroforesis.- Es un método de laboratorio en el que se utiliza una corriente eléctrica controlada con la finalidad de separar aminoácidos (y otras biomoléculas) según su
Los principales mecanismos que intervienen en la separación cromatográfica son:
 TP 8 CROMATOGRAFIA EN PAPEL, Introducción Los métodos cromatográficos son un conjunto de técnicas empleadas para separar compuestos químicos de una mezcla. Su nombre significa escribir con color ya que
TP 8 CROMATOGRAFIA EN PAPEL, Introducción Los métodos cromatográficos son un conjunto de técnicas empleadas para separar compuestos químicos de una mezcla. Su nombre significa escribir con color ya que
ELECTROFORESIS EN GELES DE AGAROSA. Agustín Garrido. agugarrido@hotmail.com
 1 ELECTROFORESIS EN GELES DE AGAROSA Agustín Garrido agugarrido@hotmail.com Introducción En este trabajo práctico se utilizó la técnica de electroforesis. Este proceso se basa en la migración de las moléculas
1 ELECTROFORESIS EN GELES DE AGAROSA Agustín Garrido agugarrido@hotmail.com Introducción En este trabajo práctico se utilizó la técnica de electroforesis. Este proceso se basa en la migración de las moléculas
Electroforesis capilar
 Electroforesis capilar LUIS ENRIQUE MENDOZA POSTGRADO EN INGENIERÍA A BIOMÉDICA UNIVERSIDAD DE LOS ANDES MÉRIDA VENEZUELA NOVIEMBRE 2006 Electroforesis capilar AGENDA RESUMEN TIPOS DE ELECTROFORESIS EQUIPO
Electroforesis capilar LUIS ENRIQUE MENDOZA POSTGRADO EN INGENIERÍA A BIOMÉDICA UNIVERSIDAD DE LOS ANDES MÉRIDA VENEZUELA NOVIEMBRE 2006 Electroforesis capilar AGENDA RESUMEN TIPOS DE ELECTROFORESIS EQUIPO
Tópicos en Biofísica Molecular 2do Cuatrimestre de 2015 Docentes: Lía Pietrasanta y Alan Bush
 Tópicos en Biofísica Molecular 2do Cuatrimestre de 2015 Docentes: Lía Pietrasanta y Alan Bush Guía 4: Electroforesis Northern, Southern y Western blots. Problema 1 Una proteína en su estado nativo tiene
Tópicos en Biofísica Molecular 2do Cuatrimestre de 2015 Docentes: Lía Pietrasanta y Alan Bush Guía 4: Electroforesis Northern, Southern y Western blots. Problema 1 Una proteína en su estado nativo tiene
Cuantificación y análisis químico de proteínas
 Cuantificación y análisis químico de proteínas Enlace peptídico R 1 R 2 Secuencia: AlaGluGlyLys o AEGK Puentes disulfuro COO- COO- COO- NH 2 NH 2 NH 2 Modificaciones Post-traduccionales I Análisis químico
Cuantificación y análisis químico de proteínas Enlace peptídico R 1 R 2 Secuencia: AlaGluGlyLys o AEGK Puentes disulfuro COO- COO- COO- NH 2 NH 2 NH 2 Modificaciones Post-traduccionales I Análisis químico
TRABAJO PRACTICO Nº 3. PROTEINAS Y ENZIMAS.
 UNIVERSIDAD NACIONAL DE LA PATAGONIA SAN JUAN BOSCO FACULTAD DE CIENCIAS NATURALES DEPARTAMENTO DE FARMACIA CATEDRA DE FARMACOGNOSIA TRABAJO PRACTICO Nº 3. PROTEINAS Y ENZIMAS. Objetivo - Utilizar reacciones
UNIVERSIDAD NACIONAL DE LA PATAGONIA SAN JUAN BOSCO FACULTAD DE CIENCIAS NATURALES DEPARTAMENTO DE FARMACIA CATEDRA DE FARMACOGNOSIA TRABAJO PRACTICO Nº 3. PROTEINAS Y ENZIMAS. Objetivo - Utilizar reacciones
TP2: Extracción y cuantificación de proteínas
 Objetivo TP2: Extracción y cuantificación de proteínas Comparar métodos de extracción de proteínas a partir de distintos organismos. Cuantificar las proteínas resultantes de cada extracto. Introducción
Objetivo TP2: Extracción y cuantificación de proteínas Comparar métodos de extracción de proteínas a partir de distintos organismos. Cuantificar las proteínas resultantes de cada extracto. Introducción
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO
 LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
CYP 2C9 A1075C CYP2C9*3
 CYP 2C9 A1075C Sistema para la detección de la mutación A1075C en el gene del citocromo P450 2C9. Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. Info@atgen.com.uy
CYP 2C9 A1075C Sistema para la detección de la mutación A1075C en el gene del citocromo P450 2C9. Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. Info@atgen.com.uy
Metodos de purificación
 Metodos de purificación Basado en las siguientes propiedades proteicas: Tamaño Solubilidad Carga Adsorción Afinidad CAROLINA VITA Característica Tamaño Solubidad Polaridad Carga Procedimientos Dialisis
Metodos de purificación Basado en las siguientes propiedades proteicas: Tamaño Solubilidad Carga Adsorción Afinidad CAROLINA VITA Característica Tamaño Solubidad Polaridad Carga Procedimientos Dialisis
INSTITUTO NACIONAL DE MEDICAMENTOS (INAME) FARMACOPEA ARGENTINA
 INSTITUTO NACIONAL DE MEDICAMENTOS (INAME) FARMACOPEA ARGENTINA AV. CASEROS 2161 1264 BUENOS AIRES FAX 5411-4340-0853 R E P U B L I C A A R G E N T I N A LORATADINA Sustancia de Referencia para Ensayos
INSTITUTO NACIONAL DE MEDICAMENTOS (INAME) FARMACOPEA ARGENTINA AV. CASEROS 2161 1264 BUENOS AIRES FAX 5411-4340-0853 R E P U B L I C A A R G E N T I N A LORATADINA Sustancia de Referencia para Ensayos
qprotein (BCA) Kit para cuantificar proteinas totales PB-L Productos Bio-Lógicos
 qprotein () Kit para cuantificar proteinas totales PB-L http://www.pb-l.com.ar qprotein () Cat. no. RA03 CONTENIDO Componentes RA0301 RA0302 Buffer A 250 ml 500 ml Buffer B 5 ml 10 ml Proteína Patrón 5
qprotein () Kit para cuantificar proteinas totales PB-L http://www.pb-l.com.ar qprotein () Cat. no. RA03 CONTENIDO Componentes RA0301 RA0302 Buffer A 250 ml 500 ml Buffer B 5 ml 10 ml Proteína Patrón 5
Electroforesis CAPÍTULO. Elementos necesarios para una electroforesis. Gel. Cámara de electroforesis. Introducción.
 Electroforesis David Alejandro López de la Mora Ana Soledad Sandoval Rodríguez CAPÍTULO 13 Introducción En biología molecular, una gran cantidad de técnicas que se realizan comúnmente requiere el uso de
Electroforesis David Alejandro López de la Mora Ana Soledad Sandoval Rodríguez CAPÍTULO 13 Introducción En biología molecular, una gran cantidad de técnicas que se realizan comúnmente requiere el uso de
PARTE II REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDTAR DE PROTEÍNA
 PARTE II REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDTAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo
PARTE II REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDTAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo
RESULTADOS Y DISCUSIONES. El análisis por medio de electroforesis a demostrado ser uno de los
 39 RESULTADOS Y DISCUSIONES El análisis por medio de electroforesis a demostrado ser uno de los mejores métodos de separación para complejos proteicos, además de necesitar cantidades muy pequeñas de muestra.
39 RESULTADOS Y DISCUSIONES El análisis por medio de electroforesis a demostrado ser uno de los mejores métodos de separación para complejos proteicos, además de necesitar cantidades muy pequeñas de muestra.
PRÁCTICAS AMPLIACIÓN DE MICROBIOLOGÍA
 PRÁCTICAS AMPLIACIÓN DE MICROBIOLOGÍA Día 1º.- EXPLICACIÓN GENERAL. TRANSFORMACIONES: E. coli, Streptomyces Día 2º.- INOCULAR MINIPREPS (8:45 de la mañana). OBTENCIÓN DE PLÁSMIDO ( MINIPREPS, Lisis alcalina)
PRÁCTICAS AMPLIACIÓN DE MICROBIOLOGÍA Día 1º.- EXPLICACIÓN GENERAL. TRANSFORMACIONES: E. coli, Streptomyces Día 2º.- INOCULAR MINIPREPS (8:45 de la mañana). OBTENCIÓN DE PLÁSMIDO ( MINIPREPS, Lisis alcalina)
ADN y RNA caracterización y métodos de estudio
 ADN y RNA caracterización y métodos de estudio Separación por centrifugación de equilibrio en gradiente de densidad de en CsCl Separación por centrifugación de equilibrio en gradiente de densidad de en
ADN y RNA caracterización y métodos de estudio Separación por centrifugación de equilibrio en gradiente de densidad de en CsCl Separación por centrifugación de equilibrio en gradiente de densidad de en
Purificación de Proteínas Parte II
 Purificación de Proteínas Parte II Fase I. Obtención del extracto crudo Lisis celular. Válido para células sin pared celular como las células de tejidos animales, pero no es suficiente para células vegetales
Purificación de Proteínas Parte II Fase I. Obtención del extracto crudo Lisis celular. Válido para células sin pared celular como las células de tejidos animales, pero no es suficiente para células vegetales
Purificaciónde Inmunoglobulina A, a partir deleche materna para su posible estabilización in vitro
 4 Encuentro de Jóvenes Investigadores CONACYT 11 Coloquio de Jóvenes Talentos en la Investigación Acapulco, Guerrero 21, 21 y 23 de septiembre 2016 Memorias Purificaciónde Inmunoglobulina A, a partir deleche
4 Encuentro de Jóvenes Investigadores CONACYT 11 Coloquio de Jóvenes Talentos en la Investigación Acapulco, Guerrero 21, 21 y 23 de septiembre 2016 Memorias Purificaciónde Inmunoglobulina A, a partir deleche
Taller Ciencia para Jóvenes CIMAT 2012 Bachillerato julio 8 14 Cinvestav Campus Guanajuato
 Introducción Taller Ciencia para Jóvenes CIMAT 2012 Bachillerato julio 8 14 Cinvestav Campus Guanajuato Visita al CINVESTAV - Irapuato. 19 julio, 2012. Las bacterias son los organismos más abundantes que
Introducción Taller Ciencia para Jóvenes CIMAT 2012 Bachillerato julio 8 14 Cinvestav Campus Guanajuato Visita al CINVESTAV - Irapuato. 19 julio, 2012. Las bacterias son los organismos más abundantes que
TECNICAS DE BIOLOGIA MOLECULAR
 Química Biológica Patológica TECNICAS DE BIOLOGIA MOLECULAR IV- Parte Aplicadas al diagnóstico de Enfermedades Genéticas Tema:1 (1) Dra. Silvia Varas qbpatologica.unsl@gmail.com TIPO DE MUTACION DEFINE
Química Biológica Patológica TECNICAS DE BIOLOGIA MOLECULAR IV- Parte Aplicadas al diagnóstico de Enfermedades Genéticas Tema:1 (1) Dra. Silvia Varas qbpatologica.unsl@gmail.com TIPO DE MUTACION DEFINE
Métodos de secuenciación de ADN
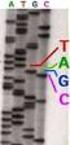 Métodos de secuenciación de ADN Valeria Tekiel Breve historia. 1871 Descubrimiento de los ácidos nucleicos 1903 Los cromosomas son unidades hereditarias 1910 Los genes están en los cromosomas 1944 El ADN
Métodos de secuenciación de ADN Valeria Tekiel Breve historia. 1871 Descubrimiento de los ácidos nucleicos 1903 Los cromosomas son unidades hereditarias 1910 Los genes están en los cromosomas 1944 El ADN
REACCIÓN EN CADENA DE LA POLIMERASA (PCR)
 REACCIÓN EN CADENA DE LA POLIMERASA (PCR) Microbiología General Microbiología M de los Alimentos Licenciatura en Bioquímica i Ingeniería en alimentos c Microbiología r 2015 Licenciatura en Biotecnología
REACCIÓN EN CADENA DE LA POLIMERASA (PCR) Microbiología General Microbiología M de los Alimentos Licenciatura en Bioquímica i Ingeniería en alimentos c Microbiología r 2015 Licenciatura en Biotecnología
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA
 REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas
LAS PROTEINASAS COMO UN PROBLEMA EN PURIFICACION DE PROTEÍNAS. SINTOMAS QUE SUGIEREN UN PROBLEMA PROTEOLITICO:
 LAS PROTEINASAS COMO UN PROBLEMA EN PURIFICACION DE PROTEÍNAS. SINTOMAS QUE SUGIEREN UN PROBLEMA PROTEOLITICO: 1) Ausencia de una proteína específica (por actividad o inmunorreactividad). 2) Bajos rendimientos
LAS PROTEINASAS COMO UN PROBLEMA EN PURIFICACION DE PROTEÍNAS. SINTOMAS QUE SUGIEREN UN PROBLEMA PROTEOLITICO: 1) Ausencia de una proteína específica (por actividad o inmunorreactividad). 2) Bajos rendimientos
