Ejercicios de moles, moléculas, átomos y masa paso a paso
|
|
|
- Vicente Rodríguez Salinas
- hace 7 años
- Vistas:
Transcripción
1 Ejercicios de moles,, átomos y masa paso a paso 1º ponemos las equivalencias entre mol, o átomos, masa y volumen en caso de gases: M(g) Mol 6,02 10 o átomos Gases en C.N 22,4 l Según esto tendremos varias equivalencias: 1 mol6,02 10 o átomos M molecular o atómica epresada en gramos M molecular o atómica epresada en gramos 6,02 10 o átomos ( para gases en C.N))22,4 l 22,4 l (para gases en C.N) 6, ,4 l (para gases en C.N)M molecular epresada en gramos 1º Ejercicio. Paso de moles a : Cuántas de metano hay en 10 moles de dicho compuesto? En este caso nos piden relacionar los moles con las : 1 mol6,02 10 o átomos Podemos hacerlo por proporciones 10moles 6,02 10 moléc 6, moles 6, º ejercicio. Paso de gramos a moles: Cuántos moles de aluminio hay en 135 g de dicho metal? En este caso nos piden relacionar los moles con la masa, para ello necesitamos la M Al 27 1
2 M molecular o atómica epresada en gramo En nuestro caso 1 mol27 g de Al 27g 135g 135 g 5moles 27g 3º ejercicio. Paso de gramos a : Cuántas de propano, C 3 H 8, hay en 100 g de dicho gas? En este caso nos piden relacionar con g: M molecular o atómica epresada en gramos 6,02 10 o átomos Antes debemos hacer antes la M(C 3 H 8 ) g En nuestro caso sería: 44 g6, g 6, , g 1,3 10 4º ejercicio. Cálculo de los gramos de un átomo de un elemento o de una molécula de un compuesto: Cuál es la masa en gramos de un átomo de plata? Este caso es como el anterior, nos piden relacionar los átomos o las con g: M molecular o atómica epresada en gramos 6,02 10 o átomos Antes debemos hacer la M (Ag)108 En nuestro caso sería: 108 g6,02 10 átomos 108g 6,02 10 átomos 1átomo 108g 1átomo 1,79 6,02 10 átomos g 5ºejercicio. Paso de volumen a masa en gases: Cuántos gramos de amoniaco gaseoso hay en 1litro de amoniaco medidos en condiciones normales de presión y temperatura? En este caso tenemos que relacionar el Volumen con la masa, para ello tenemos que hacer antes la M(NH 3 )
3 22,4 l (para gases en C.N)M molecular epresada en gramos En nuestro caso sería 22,4 litros (C.N)17 g 22,4litro 1litro 17g 17g 1 litro 0, 76g Ahora vamos a hacer un ejercicio más completo. Un recipiente contiene 200 gramos de dióido de carbono. Calcula: a) el número de moles. b) número de c) número de átomos totales d) número de átomos de Carbono e) número de átomos de Oígeno f) volumen en condiciones normales que ocupan esos 200 g a) Número de moles. Nos piden relacionar número de moles con la masa: M molecular o atómica epresada en gramo Para ello tenemos que calcular la Masa molecular M(CO 2 ) g 200g 200 g 4, 54moles b) Número de. Aquí podemos hacerlo de dos maneras: La primera relacionando nº de gramos con M molecular (g)6,02 10, en nuestro caso 44 g 6, , g 6, g 2,
4 La segunda sería, como conocemos los moles que son 200 g pues lo hemos calculado en el primer apartado, 4,54 moles ahora relacionaríamos los moles con las, 6, , 54moles 6, , ,54moles 2,73 10 c) Número de átomos totales: En una molécula de CO 2 hay 1 átomo de Carbono y 2 átomos de Oígeno en total 3 átomos y por otra parte tenemos 200 g de CO 2 que hemos calculado que son 2,73 10, luego: écula 3átomos 2,73 10 d) Número de átomos de carbono. 3átomos 2, ,19 10 écula átomos En una molécula de CO 2 hay 1 átomo de Carbono y por otra parte tenemos 200 g de CO 2 que hemos calculado que son 2,73 10, luego: écula 1átomo 2, átomo 2, ,73 10 écula átomosdec e) Número de átomos de oígeno. En una molécula de CO 2 hay 2 átomos de Carbono y por otra parte tenemos 200 g de CO 2 que hemos calculado que son 2,73 10, luego: écula 2átomosdeO 2,73 10 f) Volumen en C.N que ocupan esos 200g. 2átomos 2,73 10 écula 5,46 10 átomosdeoíg. En este caso podríamos actuar de dos maneras: Relacionando la Masa con el volumen de un gas en C.N. 22,4 l (para gases en C.N)M molecular epresada en gramos, en nuestro caso sería: 44 g22,4 l (C.N) 4
5 200g 200 g 101, 8litros Como hemos calculado en el primer apartado que 200g son 4,54 moles, entonces tendríamos que relacionar los moles con el volumen epresado en litros. 4, 54moles 4,54moles 101, 7litros La diferencia que eiste entre datos es debido a las aproimaciones el los cálculos 5
Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1]
![Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1]](/thumbs/40/20756584.jpg) Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] [1]. Calcula: (a) La masa de un átomo de potasio. (b) El número de átomos de fósforo que hay en 2 g de este elemento. (c)
Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] [1]. Calcula: (a) La masa de un átomo de potasio. (b) El número de átomos de fósforo que hay en 2 g de este elemento. (c)
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
CONCEPTOS BÁSICOS EN QUÍMICA
 CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
QUÍMICA 2º Bachillerato Ejercicios: Cálculos en Química
 1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Sistemas Físicos y Químicos
 1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
EL MOL. MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas
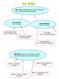 EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
si con 24 g de magnesio reaccionan 6 g de oxígeno pues con 6 g reaccionarán x
 Hoja número 1. 1) Si 24 g de magnesio se combinan exactamente con 16 g de oxígeno para formar óxido de magnesio, a) cuántos gramos de óxido se habrán formado?; b) a partir de 6 g de magnesio cuántos gramos
Hoja número 1. 1) Si 24 g de magnesio se combinan exactamente con 16 g de oxígeno para formar óxido de magnesio, a) cuántos gramos de óxido se habrán formado?; b) a partir de 6 g de magnesio cuántos gramos
Ejercicios de repaso
 Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
FÓRMULAS EMPÍRICA Y MOLECULAR
 FÓRMULAS EMPÍRICA Y MOLECULAR 1.- Un cierto compuesto X está formado por un 33,3% del elemento A y un 66,7% del elemento B. Cuántos gramos de X se formarán cuando se mezclan 3,98 gramos de A con 6,23 gramos
FÓRMULAS EMPÍRICA Y MOLECULAR 1.- Un cierto compuesto X está formado por un 33,3% del elemento A y un 66,7% del elemento B. Cuántos gramos de X se formarán cuando se mezclan 3,98 gramos de A con 6,23 gramos
Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la
 Prof.- Juan Sanmartín 4º E.S.O ESO 1 3 Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la reacción, es decir,
Prof.- Juan Sanmartín 4º E.S.O ESO 1 3 Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la reacción, es decir,
5) En 20 g de Ni 2 (CO 3 ) 3 : a) Cuántos moles hay de dicha sal? b) Cuántos átomos hay de oxígeno? c) Cuántos moles hay de iones carbonato?
 QUÍMICA 2º BACH. SELECTIVIDAD: MOL-N A 1) Para un mol de agua, justifique la veracidad o falsedad de las siguientes afirmaciones: a) En condiciones normales de presión y temperatura, ocupa un volumen de
QUÍMICA 2º BACH. SELECTIVIDAD: MOL-N A 1) Para un mol de agua, justifique la veracidad o falsedad de las siguientes afirmaciones: a) En condiciones normales de presión y temperatura, ocupa un volumen de
GUÍA N 1: Unidades de medida y Leyes Ponderales. 1.- Convierta las siguientes unidades de temperatura en C, F y K según corresponda:
 1 PRIMERA PARTE: Ejercicios de desarrollo. GUÍA N 1: Unidades de medida y Leyes Ponderales. Considerando las siguientes tablas de conversión de unidades del SISTEMA INTERNACIONAL DE UNIDADES (S.I.), desarrolla
1 PRIMERA PARTE: Ejercicios de desarrollo. GUÍA N 1: Unidades de medida y Leyes Ponderales. Considerando las siguientes tablas de conversión de unidades del SISTEMA INTERNACIONAL DE UNIDADES (S.I.), desarrolla
El mol. Chema Martín, 3º ESO. 2016
 El mol Chema Martín, 3º ESO. 2016 El mol Es el concepto fundamental de la química. Todos los cálculos que haremos a partir de ahora se basarán en él, por eso es muy importante entenderlo correctamente
El mol Chema Martín, 3º ESO. 2016 El mol Es el concepto fundamental de la química. Todos los cálculos que haremos a partir de ahora se basarán en él, por eso es muy importante entenderlo correctamente
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción
UNIDAD 1: ATOMOS Y MOLÉCULAS
 UNIDAD 1: ATOMOS Y MOLÉCULAS 1 Se define átomo como la menor porción de un elemento que se puede intercambiar por medio de una reacción química. Se define molécula como la menor porción de materia que
UNIDAD 1: ATOMOS Y MOLÉCULAS 1 Se define átomo como la menor porción de un elemento que se puede intercambiar por medio de una reacción química. Se define molécula como la menor porción de materia que
Las ecuaciones químicas
 Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar:
 1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
Resolución de Cuestiones
 La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
MASA ATÓMICA MASA MOLECULAR. Física y Química 4º E.S.O. MASA ATÓMICA, MASA MOLECULAR Y MOLES Pág. 1
 Física y Química 4º E.S.O. MASA ATÓMICA, MASA MOLECULAR Y MOLES Pág. 1 MASA ATÓMICA Al igual que ocurre en la materia ordinaria (piensa en las distintas variedades de panes en tamaño, composición y peso,
Física y Química 4º E.S.O. MASA ATÓMICA, MASA MOLECULAR Y MOLES Pág. 1 MASA ATÓMICA Al igual que ocurre en la materia ordinaria (piensa en las distintas variedades de panes en tamaño, composición y peso,
Cantidad de sustancia. Gases. Disoluciones.
 1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
Tema 2. Estequiometría
 Tema 2. Estequiometría Masas Atómicas Escala del carbono 12 Masas atómicas relativas Concepto de mol Relaciones de masa de las fórmulas químicas Composición centesimal Fórmula empírica. Fórmula molecular
Tema 2. Estequiometría Masas Atómicas Escala del carbono 12 Masas atómicas relativas Concepto de mol Relaciones de masa de las fórmulas químicas Composición centesimal Fórmula empírica. Fórmula molecular
, que no está formado por moléculas, sino por una red cristalina en la que hay una proporción de dos átomos de flúor por cada átomo de calcio.
 7 El mol y las reacciones químicas Contenidos Índice 1 2 3 4 Masa molecular y composición centesimal El mol y el número de Avogadro Las reacciones químicas Tipos de reacciones químicas 5 Estequiometría
7 El mol y las reacciones químicas Contenidos Índice 1 2 3 4 Masa molecular y composición centesimal El mol y el número de Avogadro Las reacciones químicas Tipos de reacciones químicas 5 Estequiometría
Boletín 1 La naturaleza de la materia Moles moléculas y átomos
 Boletín La naturaleza de la materia Moles éculas y átomos Cuántas éculas de metano hay en 0 es de dicho compuesto? En este caso nos piden relacionar los es con las éculas: 6,0 0 éculas o átomos Podemos
Boletín La naturaleza de la materia Moles éculas y átomos Cuántas éculas de metano hay en 0 es de dicho compuesto? En este caso nos piden relacionar los es con las éculas: 6,0 0 éculas o átomos Podemos
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Estequiometría
 1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
TEÓRICO-PRÁCTICO N 2: ESTEQUIOMETRÍA DE LA MOLÉCULA
 TEÓRICO-PRÁCTICO N 2: ESTEQUIOMETRÍA DE LA MOLÉCULA FUNDAMENTO TEÓRICO La estequiometría es el área de la química que estudia las cantidades de reactivos y productos que intervienen en una reacción química,
TEÓRICO-PRÁCTICO N 2: ESTEQUIOMETRÍA DE LA MOLÉCULA FUNDAMENTO TEÓRICO La estequiometría es el área de la química que estudia las cantidades de reactivos y productos que intervienen en una reacción química,
UNIDAD: 7 ESTEQUIOMETRÍA
 UNIDAD: 7 ESTEQUIOMETRÍA CONCEPTOS BÁSICOS DE ESTEQUIOMETRÍA RECOPILÓ: QUIM. GABRIEL JIMENEZ ZERON TOMADO DEL TEMA ESTEQUIOMETRIA www.wikipedia.org Estequiometría El termino estequiometría proviene del
UNIDAD: 7 ESTEQUIOMETRÍA CONCEPTOS BÁSICOS DE ESTEQUIOMETRÍA RECOPILÓ: QUIM. GABRIEL JIMENEZ ZERON TOMADO DEL TEMA ESTEQUIOMETRIA www.wikipedia.org Estequiometría El termino estequiometría proviene del
TIPOS DE REACCIONES QUIMICAS
 Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Disoluciones Químicas. GUÍA DE APRENDIZAJE Nº 6 2º MEDIO SOLUCIONES 2ª parte Objetivo General:Conocer conceptos de las disoluciones en
Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Disoluciones Químicas. GUÍA DE APRENDIZAJE Nº 6 2º MEDIO SOLUCIONES 2ª parte Objetivo General:Conocer conceptos de las disoluciones en
Física y Química - 3º ESO
 C O L L E G I S A N A N T O N I O D E P A D U A F R A N C I S C A N S L C A R C A I X E N T C U R S 2 0 1 1 / 2 0 1 2 Física y Química - 3º ESO Tema 1 La ciencia y su método. Medida de magnitudes. Anexo
C O L L E G I S A N A N T O N I O D E P A D U A F R A N C I S C A N S L C A R C A I X E N T C U R S 2 0 1 1 / 2 0 1 2 Física y Química - 3º ESO Tema 1 La ciencia y su método. Medida de magnitudes. Anexo
1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F. 4 - Expresa en moles: 4,5 g de agua; 0,3 g de hidrógeno; 440 g de dióxido de carbono
 ÁTOMOS, MOLÉCULAS Y MOLES 1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F 2- Calcula la masa de las siguientes moléculas: HNO 3 ; PH 3 ; Cl 2 O; N 2 O 5 y CCl 4 3 - Cuantos moles de oxígeno
ÁTOMOS, MOLÉCULAS Y MOLES 1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F 2- Calcula la masa de las siguientes moléculas: HNO 3 ; PH 3 ; Cl 2 O; N 2 O 5 y CCl 4 3 - Cuantos moles de oxígeno
La uma, por ser una unidad de masa, tiene su equivalencia en gramos:
 UNIDAD 2 Magnitudes atómico-moleculares Introducción Teórica La masa de un átomo depende del átomo en cuestión, es decir del número de protones y neutrones que contenga su núcleo. Dicha magnitud es muy
UNIDAD 2 Magnitudes atómico-moleculares Introducción Teórica La masa de un átomo depende del átomo en cuestión, es decir del número de protones y neutrones que contenga su núcleo. Dicha magnitud es muy
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS PRUEBA ESPECÍFICA QUÍMICA
 PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES
 TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
La riqueza en peso nos dice que en 100 gramos de disolución hay 37 gramos de soluto, de modo que en 1180 gramos de disolución habrá:
 40.- Calcula la concentración en g/l de un ácido clorhídrico comercial de 37 % de riqueza en peso y densidad 1,18 g/ml. En primer lugar expresamos la densidad en g/l : 1180 g/l La riqueza en peso nos dice
40.- Calcula la concentración en g/l de un ácido clorhídrico comercial de 37 % de riqueza en peso y densidad 1,18 g/ml. En primer lugar expresamos la densidad en g/l : 1180 g/l La riqueza en peso nos dice
GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA. 1. Igualar las siguientes ecuaciones mediante el método algebraico.
 1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
TRANSFORMACIONES QUÍMICAS 1.- SUSTANCIAS PURAS, ELEMENTOS Y COMPUESTOS
 TRANSFORMACIONES QUÍMICAS - Sustancias puras, elementos y compuestos. - Leyes ponderales de la Química. - Teoría atómica de Dalton. - Hipótesis de Avogadro. - Masas atómica y molecular. Mol. - Leyes de
TRANSFORMACIONES QUÍMICAS - Sustancias puras, elementos y compuestos. - Leyes ponderales de la Química. - Teoría atómica de Dalton. - Hipótesis de Avogadro. - Masas atómica y molecular. Mol. - Leyes de
4. TEORÍA ATÓMICO-MOLECULAR
 4. TEORÍA ATÓMICO-MOLECULAR Sustancias que reaccionan 1. Explica qué son los procesos o cambios físicos y pon ejemplos de ellos. Los procesos o cambios físicos no producen modificaciones en la naturaleza
4. TEORÍA ATÓMICO-MOLECULAR Sustancias que reaccionan 1. Explica qué son los procesos o cambios físicos y pon ejemplos de ellos. Los procesos o cambios físicos no producen modificaciones en la naturaleza
B. Cuál es su número atómico y másico? Di cuántos protones y neutrones hay en el núcleo y electrones en la corteza.
 Problema nº 0 Los isótopos del boro se representan así: B 5 5 B. Cuál es su número atómico másico? Di cuántos protones neutrones ha en el núcleo electrones en la corteza. El número atómico es Z = 5, el
Problema nº 0 Los isótopos del boro se representan así: B 5 5 B. Cuál es su número atómico másico? Di cuántos protones neutrones ha en el núcleo electrones en la corteza. El número atómico es Z = 5, el
Problemas de Química (1ero Grado de Química). Tema 1.
 Problemas de Química (1ero Grado de Química). Tema 1. CÁLCULOS BÁSICOS 1. Expresa en notación científica, indicando en cada caso el número de cifras significativas: a) 258292 b) 1804, 5289 c) 0, 48 d)
Problemas de Química (1ero Grado de Química). Tema 1. CÁLCULOS BÁSICOS 1. Expresa en notación científica, indicando en cada caso el número de cifras significativas: a) 258292 b) 1804, 5289 c) 0, 48 d)
SESIÓN 1 CÁLCULOS QUÍMICOS
 SESIÓN 1 CÁLCULOS QUÍMICOS I. CONTENIDOS: 1. Nomenclatura química. 2. atómica. 3. molecular. 4. Concepto mol. 5. El número de Avogadro. II. OBJETIVOS: Al término de la Sesión, el alumno: Recordará las
SESIÓN 1 CÁLCULOS QUÍMICOS I. CONTENIDOS: 1. Nomenclatura química. 2. atómica. 3. molecular. 4. Concepto mol. 5. El número de Avogadro. II. OBJETIVOS: Al término de la Sesión, el alumno: Recordará las
GASES - PREGUNTAS DE TEST
 GASES - PREGUNTAS DE TEST A - CONCEPTOS GENERALES B - LEYES GENERALES DE LOS GASES IDEALES: C- LEY DE GRAHAM DE LA DIFUSIÓN D- TEORÍA CINÉTICA A - CONCEPTO DE GAS-VAPOR A-1 - Un vapor es A - Cualquier
GASES - PREGUNTAS DE TEST A - CONCEPTOS GENERALES B - LEYES GENERALES DE LOS GASES IDEALES: C- LEY DE GRAHAM DE LA DIFUSIÓN D- TEORÍA CINÉTICA A - CONCEPTO DE GAS-VAPOR A-1 - Un vapor es A - Cualquier
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2012 Se disponen de tres recipientes que contienen en estado gaseoso 1 L de metano, 2 L de nitrógeno
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2012 Se disponen de tres recipientes que contienen en estado gaseoso 1 L de metano, 2 L de nitrógeno
Tema 0. Conceptos Básicos en Química. Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones
 Tema 0. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que trata de la composición y propiedades de
Tema 0. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que trata de la composición y propiedades de
2,21 g de magnesio 7 g magnesio+ 4,59 g oxígeno=
 Compuesto Tetróxido de dinitrógeno Alcohol etílico Glucosa Propano Dióxido de carbono Fórmula molecular Fórmula empírica N O 4 C H 6 O C 6 H 1 O 6 C H 8 CO NO C H 6 O CH O C H 8 CO 1. Justifica si un compuesto
Compuesto Tetróxido de dinitrógeno Alcohol etílico Glucosa Propano Dióxido de carbono Fórmula molecular Fórmula empírica N O 4 C H 6 O C 6 H 1 O 6 C H 8 CO NO C H 6 O CH O C H 8 CO 1. Justifica si un compuesto
Guía de repaso 5: Gases-Transformación isotérmica
 Guía de repaso 5: Gases-Transformación isotérmica 1- a) Cuáles son las cantidades que determinan el estado de un gas? b) Qué significa decir que un gas sufrió una transformación? 2- a) Qué son los gases
Guía de repaso 5: Gases-Transformación isotérmica 1- a) Cuáles son las cantidades que determinan el estado de un gas? b) Qué significa decir que un gas sufrió una transformación? 2- a) Qué son los gases
Unidades de masa atómica
 Unidades de masa atómica La estructura química y las fórmulas químicas sirven para estudiar las relaciones de masa de átomos y moléculas. Estas relaciones ayudan a explicar la composición de los compuestos
Unidades de masa atómica La estructura química y las fórmulas químicas sirven para estudiar las relaciones de masa de átomos y moléculas. Estas relaciones ayudan a explicar la composición de los compuestos
PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS
 PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS 1. De acuerdo a la posición de los elementos en la tabla periódica, cuál de los siguientes compuestos será el más iónico? a) NaCl b)
PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS 1. De acuerdo a la posición de los elementos en la tabla periódica, cuál de los siguientes compuestos será el más iónico? a) NaCl b)
GUÍA DE APRENDIZAJE Nº 6 para 1º MEDIO TEMA: ESTEQUIOMETRIA 2ª parte. Subsector: QUÍMICA Docente: Liduvina Campos A. Nombre alumno: Curso: Fecha:
 Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Estequiometría. GUÍA DE APRENDIZAJE Nº 6 para 1º MEDIO TEMA: ESTEQUIOMETRIA 2ª parte Objetivo General: Aplicación de cálculos estequiométricos
Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Estequiometría. GUÍA DE APRENDIZAJE Nº 6 para 1º MEDIO TEMA: ESTEQUIOMETRIA 2ª parte Objetivo General: Aplicación de cálculos estequiométricos
1º. Se hace reaccionar 100 gramos de Calcio con ácido clorhídrico para dar cloruro
 1º. Se hace reaccionar 100 gramos de Calcio con ácido clorhídrico para dar cloruro de calcio e hidrógeno gaseoso. Se pide: b) Hallar la masa de ácido clorhídrico necesario para que reaccione totalmente
1º. Se hace reaccionar 100 gramos de Calcio con ácido clorhídrico para dar cloruro de calcio e hidrógeno gaseoso. Se pide: b) Hallar la masa de ácido clorhídrico necesario para que reaccione totalmente
EJERCICIOS RESUELTOS DE EQUILIBRIO QUIMICO
 EJERIIOS RESUELTOS DE EQUILIBRIO QUIMIO 1. uando el cloruro amónico se calienta a 75º en un recipiente cerrado de 1,0 litro, se descompone dando lugar a cloruro de hidrógeno gaseoso y amoniaco gaseoso
EJERIIOS RESUELTOS DE EQUILIBRIO QUIMIO 1. uando el cloruro amónico se calienta a 75º en un recipiente cerrado de 1,0 litro, se descompone dando lugar a cloruro de hidrógeno gaseoso y amoniaco gaseoso
CONCEPTOS BÁSICOS DE QUÍMICA
 CONCEPTOS BÁSICOS DE QUÍMICA IES La Magdalena. Avilés. Asturias Los átomos de distintos elementos pueden unirse mediante un enlace (iónico o covalente) formando un compuesto. Cuando se forma un compuesto
CONCEPTOS BÁSICOS DE QUÍMICA IES La Magdalena. Avilés. Asturias Los átomos de distintos elementos pueden unirse mediante un enlace (iónico o covalente) formando un compuesto. Cuando se forma un compuesto
Principios y conceptos básicos de Química
 Principios y conceptos básicos de Química Se estudiarán durante las dos primeras quincenas, estos contenidos están en el tema 2 del libro de texto. Quincena 1ª - Repaso de conceptos estudiados en ESO (Densidad,
Principios y conceptos básicos de Química Se estudiarán durante las dos primeras quincenas, estos contenidos están en el tema 2 del libro de texto. Quincena 1ª - Repaso de conceptos estudiados en ESO (Densidad,
H2SO4 (aq)+ NaOH (aq) Na2SO4 (aq)+ H2O (líq)
 1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
CANTIDAD DE SUSTANCIA Y NUMERO DE PARTÍCULAS
 CANTIDAD DE SUSTANCIA Y NUMERO DE PARTÍCULAS Las moléculas están formadas por átomos 1 molécula de CO 2 está formada por: 1 átomo de C y 2 átomos de O 1 molécula de O 2 está formada por: 2 átomos de O
CANTIDAD DE SUSTANCIA Y NUMERO DE PARTÍCULAS Las moléculas están formadas por átomos 1 molécula de CO 2 está formada por: 1 átomo de C y 2 átomos de O 1 molécula de O 2 está formada por: 2 átomos de O
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS
 UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
Departamento de Física y Química Adaptaciones 3º E.S.O.
 Los elementos químicos se ordenan en la Tabla de los elementos (Tabla periódica) siguiendo el criterio de número atómico creciente, es decir, según el número de protones que tienen en el núcleo. El primer
Los elementos químicos se ordenan en la Tabla de los elementos (Tabla periódica) siguiendo el criterio de número atómico creciente, es decir, según el número de protones que tienen en el núcleo. El primer
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio,
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
PROBLEMA 1. Se hace reaccionar 50 gramos de calcio con ácido clorhídrico 2 M para dar hidrógeno gaseoso y cloruro de calcio.
 PROBLEMA. Se hace reaccionar 50 gramos de calcio con ácido clorhídrico 2 M para dar hidrógeno gaseoso y cloruro de calcio. a) Calcular el volumen de disolución de ácido clorhídrico necesario para que reaccione
PROBLEMA. Se hace reaccionar 50 gramos de calcio con ácido clorhídrico 2 M para dar hidrógeno gaseoso y cloruro de calcio. a) Calcular el volumen de disolución de ácido clorhídrico necesario para que reaccione
UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 8
 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 8 NOMBRE DE LA ASIGNATURA TÍTULO DURACIÓN BIBLIOGRAFÍA SUGERIDA DOCENTES Química General UNIDADES QUÍMICAS Y ESTEQUIOMETRÍA
UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 8 NOMBRE DE LA ASIGNATURA TÍTULO DURACIÓN BIBLIOGRAFÍA SUGERIDA DOCENTES Química General UNIDADES QUÍMICAS Y ESTEQUIOMETRÍA
1. Una cierta cantidad de gas ocupa 500 ml a 1.5 atm y 20 C Qué volumen ocupará a 720 mmhg y 80 C?
 Tema: GASES 1. Una cierta cantidad de gas ocupa 500 ml a 1.5 atm y 20 C Qué volumen ocupará a 720 mmhg y 80 C? 2. A cuántas atmosferas deben someterse 40 L de H 2 que están a 40 C y 0.5 atm para que el
Tema: GASES 1. Una cierta cantidad de gas ocupa 500 ml a 1.5 atm y 20 C Qué volumen ocupará a 720 mmhg y 80 C? 2. A cuántas atmosferas deben someterse 40 L de H 2 que están a 40 C y 0.5 atm para que el
RESOLUCIÓN DE PROBLEMAS DE ESTEQUIOMETRÍA (I)
 RESOLUCIÓN DE PROBLEMAS DE ESTEQUIOMETRÍA (I) 1. Es un problema de estequiometría básico. Sustancia dato: CO 2. Sustancia problema: C 2 H 2 Reacción ajustada: C 2 H 2 + 1/2O 2 2CO 2 + H 2 O a) Calculo
RESOLUCIÓN DE PROBLEMAS DE ESTEQUIOMETRÍA (I) 1. Es un problema de estequiometría básico. Sustancia dato: CO 2. Sustancia problema: C 2 H 2 Reacción ajustada: C 2 H 2 + 1/2O 2 2CO 2 + H 2 O a) Calculo
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2010. Fase general OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
UNIDADES DE CONCENTRACIÓN
 Colegio San Esteban Diácono Departamento de Ciencias Química IIº Medio Prof. Juan Pastrián / Sofía Ponce de León UNIDADES DE CONCENTRACIÓN 1. Porcentaje masa/masa (%m/m) Cantidad en masa (g) de un componente
Colegio San Esteban Diácono Departamento de Ciencias Química IIº Medio Prof. Juan Pastrián / Sofía Ponce de León UNIDADES DE CONCENTRACIÓN 1. Porcentaje masa/masa (%m/m) Cantidad en masa (g) de un componente
Se entiende por disolución toda mezcla homogénea de dos o más componentes en proporción variable.
 6. DISOLUCIONES 6.1. Generalidades Se entiende por disolución toda mezcla homogénea de dos o más componentes en proporción variable. Las disoluciones objeto de nuestro estudio serán binarias, en las que
6. DISOLUCIONES 6.1. Generalidades Se entiende por disolución toda mezcla homogénea de dos o más componentes en proporción variable. Las disoluciones objeto de nuestro estudio serán binarias, en las que
CuO (s) + H 2 SO 4(aq) CuSO 4(aq) +H 2 O (aq)
 Relación de problemas Química 4º ESO CDP. NTRA. SRA. DE LORETO 1. El trióxido de azufre se sintetiza a partir de dióxido de azufre y oxígeno molecular. Calcula la masa y el volumen de los reactivos que
Relación de problemas Química 4º ESO CDP. NTRA. SRA. DE LORETO 1. El trióxido de azufre se sintetiza a partir de dióxido de azufre y oxígeno molecular. Calcula la masa y el volumen de los reactivos que
Estequiometría: ejercicios resueltos
 Estequiometría: ejercicios resueltos Ejercicio 1: Tienes en un laboratorio un frasco con 10 gramos de bromuro de litio en polvo y otro con 500 ml de agua destilada cómo prepararías una disolución de bromuro
Estequiometría: ejercicios resueltos Ejercicio 1: Tienes en un laboratorio un frasco con 10 gramos de bromuro de litio en polvo y otro con 500 ml de agua destilada cómo prepararías una disolución de bromuro
QUÍMICA 2º BACHILLERATO
 CONCEPTO DE. ISÓTOPOS. 1.-/ Cuántas moléculas de agua hay en un matraz que contiene 250 ml, si la densidad del agua es 1,00 g/ml? 2.-/ Cuántos átomos de oxígeno hay en medio litro de oxígeno medidos a
CONCEPTO DE. ISÓTOPOS. 1.-/ Cuántas moléculas de agua hay en un matraz que contiene 250 ml, si la densidad del agua es 1,00 g/ml? 2.-/ Cuántos átomos de oxígeno hay en medio litro de oxígeno medidos a
UNIDAD 4. ESTRUCTURA DE LA MATERIA.
 UNIDAD 4. ESTRUCTURA DE LA MATERIA. 1.- Resume las características principales de los distintos modelos atómicos que has estudiado y ordénalos cronológicamente. (Pág. 74 a 78) 2.- Indica si las siguientes
UNIDAD 4. ESTRUCTURA DE LA MATERIA. 1.- Resume las características principales de los distintos modelos atómicos que has estudiado y ordénalos cronológicamente. (Pág. 74 a 78) 2.- Indica si las siguientes
1010 DEPARTAMENTO DE FÍSICA Y QUÍMICA 2º Bachillerato QUÍMICA
 1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
UNIDAD I. ESTEQUIOMETRÍA Tema: Cálculos estequiométricos. (PENDIENTE 1 MEDIO)
 UNIDAD I. ESTEQUIOMETRÍA Tema: Cálculos estequiométricos. (PENDIENTE 1 MEDIO) 1. Composición Centesimal Indica el porcentaje en masa, de cada elemento que forma parte de 100 gramos de un compuesto. Se
UNIDAD I. ESTEQUIOMETRÍA Tema: Cálculos estequiométricos. (PENDIENTE 1 MEDIO) 1. Composición Centesimal Indica el porcentaje en masa, de cada elemento que forma parte de 100 gramos de un compuesto. Se
CANTIDAD DE SUSTANCIA
 CANTIDAD DE SUSTANCIA 1. Una gota de ácido sulfúrico ocupa 0,025 ml. Si la densidad del mismo es 1,981 g/cm 3 a) calcula el número de moléculas de dicho ácido que hay en la gota y b) el número de átomos
CANTIDAD DE SUSTANCIA 1. Una gota de ácido sulfúrico ocupa 0,025 ml. Si la densidad del mismo es 1,981 g/cm 3 a) calcula el número de moléculas de dicho ácido que hay en la gota y b) el número de átomos
Estequiometría. En química, la estequiometría (del griego "στοιχειον"
 Estequiometría En química, la estequiometría (del griego "στοιχειον" = stoicheion (elemento) y "μετρον"=métron, (medida) es el cálculo de las relaciones cuantitativas entre reactivos y productos en el
Estequiometría En química, la estequiometría (del griego "στοιχειον" = stoicheion (elemento) y "μετρον"=métron, (medida) es el cálculo de las relaciones cuantitativas entre reactivos y productos en el
Estequiometría. 1. MASA ATÓMICA DE UN ELEMENTO. UNIDAD DE MASA ATÓMICA (u.m.a).
 Estequiometría 1 Estequiometría 1. MASA ATÓMICA DE UN ELEMENTO. UNIDAD DE MASA ATÓMICA (u.m.a). Dalton afirmó que cada átomo tiene una masa propia y diferente de la de cualquier otro átomo. Por otra parte,
Estequiometría 1 Estequiometría 1. MASA ATÓMICA DE UN ELEMENTO. UNIDAD DE MASA ATÓMICA (u.m.a). Dalton afirmó que cada átomo tiene una masa propia y diferente de la de cualquier otro átomo. Por otra parte,
(g) CO 2. (g) + 2 H 2. Procediendo en la misma forma con la segunda ecuación, obtenemos: (g) 3 CO 2. (g) + 4 H 2
 Para ajustar el oxígeno, escribiremos otro dos delante de la molécula de oxígeno gaseoso en los reactivos. De este modo, la ecuación ajustada del primer proceso es: CH (g) + 2 O 2 (g) CO 2 (g) + 2 H 2
Para ajustar el oxígeno, escribiremos otro dos delante de la molécula de oxígeno gaseoso en los reactivos. De este modo, la ecuación ajustada del primer proceso es: CH (g) + 2 O 2 (g) CO 2 (g) + 2 H 2
EJERCICIOS DE SELECTIVIDAD 99/00
 EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
DIVERTIDISIMOS EJERCICIOS PARA NAVIDAD (I)
 COLEGIO HISPANO-INGLÉS DIVERTIDISIMOS EJERCICIOS PARA NAVIDAD (I) NOMBRE: DPTO.FÍSICA-QUÍMICA CURSO:1º DE BACH A y B 1.- Un hidrocarburo gaseoso contenido en un matraz de 500 ml en condiciones normales
COLEGIO HISPANO-INGLÉS DIVERTIDISIMOS EJERCICIOS PARA NAVIDAD (I) NOMBRE: DPTO.FÍSICA-QUÍMICA CURSO:1º DE BACH A y B 1.- Un hidrocarburo gaseoso contenido en un matraz de 500 ml en condiciones normales
Ejercicios y respuestas del apartado: Cálculos estequiométricos
 Ejercicios y respuestas del apartado: Cálculos estequiométricos 2 de 9 Cálculos estequiométricos: Consideraciones previas. El ejercicio se basa en la siguiente reacción: N 2 + 3 H 2 2 NH 3 1. Si tenemos
Ejercicios y respuestas del apartado: Cálculos estequiométricos 2 de 9 Cálculos estequiométricos: Consideraciones previas. El ejercicio se basa en la siguiente reacción: N 2 + 3 H 2 2 NH 3 1. Si tenemos
REACCIONES QUÍMICAS MASA MOLES MOLÉCULAS ÁTOMOS ÁTOMOS. Factor de conversión N A = 6, partículas/mol
 REACCIONES QUÍMICAS CANTIDAD DE MATERIA La cantidad de sustancia se puede expresar en gramos (masa), en moles, moléculas o átomos. Podemos pasar de unas unidades a otras utilizando el siguiente esquema:
REACCIONES QUÍMICAS CANTIDAD DE MATERIA La cantidad de sustancia se puede expresar en gramos (masa), en moles, moléculas o átomos. Podemos pasar de unas unidades a otras utilizando el siguiente esquema:
PENDIENTES 3ºE.S.O. FÍSICA Y QUÍMICA ACTIVIDADES DE RECUPERACIÓN
 PENDIENTES 3ºE.S.O. FÍSICA Y QUÍMICA ACTIVIDADES DE RECUPERACIÓN 1) Razona si los procesos siguientes son físicos o químicos: a. La fermentación del azúcar. b. Formación de hielo. c. Destrucción de la
PENDIENTES 3ºE.S.O. FÍSICA Y QUÍMICA ACTIVIDADES DE RECUPERACIÓN 1) Razona si los procesos siguientes son físicos o químicos: a. La fermentación del azúcar. b. Formación de hielo. c. Destrucción de la
EJERCICIOS DE TERMODINÁMICA
 EJERCICIOS DE TERMODINÁMICA. La descomposición del tetraóxido de nitrógeno ( N O 4 NO4( NO( ocurre espontáneamente a temperaturas altas. Los datos termodinámicos a 98ºK se incluyen en la tabla adjunta.
EJERCICIOS DE TERMODINÁMICA. La descomposición del tetraóxido de nitrógeno ( N O 4 NO4( NO( ocurre espontáneamente a temperaturas altas. Los datos termodinámicos a 98ºK se incluyen en la tabla adjunta.
ESTEQUIOMETRÍA I. ÁTOMO Mínima porción de materia que posee aún las propiedades del elemento.
 ESTEQUIOMETRÍA I Preparado por: José del c. Mondragón C. El término estequiometría deriva del griego steicheion, que significa primer principio o elemento y de metron, que significa medida. La estequiometría
ESTEQUIOMETRÍA I Preparado por: José del c. Mondragón C. El término estequiometría deriva del griego steicheion, que significa primer principio o elemento y de metron, que significa medida. La estequiometría
Tema 13: La materia Ciencias Naturales 1º ESO página 1. Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
 Tema 13: La materia Ciencias Naturales 1º ESO página 1 TEMA 13: LA MATERIA, BASE DEL UNIVERSO 1. Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
Tema 13: La materia Ciencias Naturales 1º ESO página 1 TEMA 13: LA MATERIA, BASE DEL UNIVERSO 1. Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA
 ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA Problemas 1. El calor de combustión del ácido acético(l) es 874 kj/mol. Sabiendo que las entalpías de formación estándar del CO 2 (g), H 2 O(l) son respectivamente:
ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA Problemas 1. El calor de combustión del ácido acético(l) es 874 kj/mol. Sabiendo que las entalpías de formación estándar del CO 2 (g), H 2 O(l) son respectivamente:
GUIA DE ESTUDIO PARA EXAMEN EXTRAORDINARIO DE QUÍMICA TERCER GRADO DE SECUNDARIA 2013-2014
 GUIA DE ESTUDIO PARA EXAMEN EXTRAORDINARIO DE QUÍMICA TERCER GRADO DE SECUNDARIA 2013-2014 - Qué es química orgánica? - Escribe la formula y nombre de dos compuestos orgánicos. - Qué función realiza el
GUIA DE ESTUDIO PARA EXAMEN EXTRAORDINARIO DE QUÍMICA TERCER GRADO DE SECUNDARIA 2013-2014 - Qué es química orgánica? - Escribe la formula y nombre de dos compuestos orgánicos. - Qué función realiza el
Materia: FÍSICA Y QUÍMICA 3º E.S.O Curso
 ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
Pegatina del Estudiante
 Examen 2015-16 Plan: [G25] ACCESO A GRADO PARA MAYORES DE 25 Asignatura: [558] Química Profesor: Lucas Castro Martínez Fecha: 28/04/2016 Horario peninsular 9:00-10:30 Pegatina del Estudiante Espacio para
Examen 2015-16 Plan: [G25] ACCESO A GRADO PARA MAYORES DE 25 Asignatura: [558] Química Profesor: Lucas Castro Martínez Fecha: 28/04/2016 Horario peninsular 9:00-10:30 Pegatina del Estudiante Espacio para
EJERCICIOS DE EQUILIBRIO QUÍMICO.
 EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
Reactivos limitantes UNIDAD 3: ESTEQUIOMETRÍA
 Reactivos limitantes En muchos procesos industriales la cantidad de productos que se obtenga dependerá de la cantidad de materias iniciales con las que se cuente. Por ejemplo, si deseas fabricar bicicletas,
Reactivos limitantes En muchos procesos industriales la cantidad de productos que se obtenga dependerá de la cantidad de materias iniciales con las que se cuente. Por ejemplo, si deseas fabricar bicicletas,
CONCENTRACIÓN MOLAR Y NORMAL
 PROBLEMAS INICIALES DE PRÁCTICA CONCENTRACIÓN MOLAR Y NORMAL Pregunta 1 Qué significa una disolución con una concentración 0.3 M? Respuesta: 0.3 moles de una sustancia en 1 litro de disolución. Pregunta
PROBLEMAS INICIALES DE PRÁCTICA CONCENTRACIÓN MOLAR Y NORMAL Pregunta 1 Qué significa una disolución con una concentración 0.3 M? Respuesta: 0.3 moles de una sustancia en 1 litro de disolución. Pregunta
LEYES FUNDAMENTALES DE LA QUÍMICA
 CONTENIDOS LEYES FUNDAMENTALES DE LA QUÍMICA 1.- La Química en la antigüedad. La Alquimia. 2.- Sustancias homogéneas y heterogéneas. Elementos y compuestos. (Repaso)..- Leyes fundamentales de la Química..1.
CONTENIDOS LEYES FUNDAMENTALES DE LA QUÍMICA 1.- La Química en la antigüedad. La Alquimia. 2.- Sustancias homogéneas y heterogéneas. Elementos y compuestos. (Repaso)..- Leyes fundamentales de la Química..1.
Física y Química 1º Bachillerato LOMCE
 Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 201 2016 Unidad Didáctica 1 Rev 01 Las Leyes Ponderales y Las Leyes de los Gases Ideales 1.1 Las
Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 201 2016 Unidad Didáctica 1 Rev 01 Las Leyes Ponderales y Las Leyes de los Gases Ideales 1.1 Las
Problemas resueltos = =
 Química General. Curso º Problemas resueltos. Sabiendo que la constante de equilibrio para la reacción entre el ácido acético y el etanol es 4, calcular las composiciones del equilibrio cuando se parte
Química General. Curso º Problemas resueltos. Sabiendo que la constante de equilibrio para la reacción entre el ácido acético y el etanol es 4, calcular las composiciones del equilibrio cuando se parte
La unidad de masa atómica se define como la doceava parte de la masa de un átomo del isótopo carbono-12.
 Conceptos básicos La masa de los átomos se mide en unidades de masa atómica (u) La unidad de masa atómica se define como la doceava parte de la masa de un átomo del isótopo carbono-12. 12 g de carbono-12
Conceptos básicos La masa de los átomos se mide en unidades de masa atómica (u) La unidad de masa atómica se define como la doceava parte de la masa de un átomo del isótopo carbono-12. 12 g de carbono-12
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
Licenciatura en Nutrición. Curso Introductorio. Introducción a la Bioquímica Módulo 1 Leccion 2
 Licenciatura en Nutrición Curso Introductorio Introducción a la Bioquímica Módulo 1 Leccion 2 1 MOLÉCULAS Y COMPUESTOS Objetivos Describir los dos tipos fundamentales de enlaces químicos. Describir las
Licenciatura en Nutrición Curso Introductorio Introducción a la Bioquímica Módulo 1 Leccion 2 1 MOLÉCULAS Y COMPUESTOS Objetivos Describir los dos tipos fundamentales de enlaces químicos. Describir las
Departamento de Física y Química Adaptaciones para 3º E.S.O.
 El átomo está formado por tres clases de partículas fundamentales: los protones, p +, que se encuentran en el núcleo o zona central del átomo y que tienen carga positiva y una masa apreciable. Los neutrones,
El átomo está formado por tres clases de partículas fundamentales: los protones, p +, que se encuentran en el núcleo o zona central del átomo y que tienen carga positiva y una masa apreciable. Los neutrones,
