Introducción a la Hematología
|
|
|
- Luis Miguel Salvador Márquez Roldán
- hace 7 años
- Vistas:
Transcripción
1 Introducción a la Hematología Manual de Prácticas Nombre del alumno: Nombre del laboratorista: Nombre del profesor: Grado & Grupo:
2 DIRECCION GENERAL DE EDUCACIÓN MEDIA SUPERIOR ACADEMIA ESTATAL DE CLÍNICOS MANUAL DE PRÁCTICAS DE INTRODUCCIÓN A LA HEMATOLOGÍA Mi laboratorio, obtenido el 27 de julio de 2016 en: Revisado por: QFB. Acevedo Zambrano Carlos De Jesús
3 Índice pág. Introducción General... 1 Reglamento General de Laboratorio... 2 Práctica 1. Material Básico del Laboratorio de Clínicos... 4 Práctica 2. Flebotomía (Toma de Muestra de Sangre Venosa Periférica) Práctica 3. Punción Capilar Práctica 4. Preparación y Tinción de Frotis Sanguíneo Práctica 5. Montaje y Conteo de Leucocitos Práctica 6. Conteo de Plaquetas Práctica 7. Determinación de Hemoglobina Práctica 8. Determinación de Hematocrito Práctica 9. Reticulocitos Práctica 10. Determinación de VSG Práctica 11. Grupo Sanguíneo Práctica 12. Tiempos de coagulación TP y TTP Práctica 13. Pruebas Cruzadas Práctica 14. Coombs Directo Práctica 15. Coombs Indirecto Anexo Anexo
4 Introducción general Siglos atrás la sangre fue considerada como el líquido esencial para la vida y se le atribuía ser la fuente que mantenía el equilibrio en el organismo, sin embargo la composición celular de la sangre no se reconoció hasta la invención del microscopio, siendo Leeuwenhoek el primero en observar los glóbulos rojos, no fue hasta años después cuando se logró realizar exploraciones de los elementos que constituyen a la sangre, definiéndose ésta como un órgano polisistemático constituido por eritrocitos, leucocitos, plaquetas y plasma. La complicada composición de la sangre provocó el interés para realizar estudios sobre las células que la constituían, siendo K. Vierordt quién realizó los primeros análisis cuantitativos de éstas, pero fue hasta los años treinta que se intentó relacionar el número de células sanguíneas con algunas patologías, métodos cada vez mejores y conocimientos más profundos sobre la fisiología sanguínea permitió una relación estrecha con el cuadro clínico presentado por diferentes pacientes. En la actualidad se han desarrollado técnicas cualitativas y cuantitativas de los componentes celulares, que en conjunto constituyen la CITOMETRÍA HEMÁTICA: Determinación de hemoglobina y hematocrito, cuenta de eritrocitos, leucocitos, plaquetas, observación del frotis sanguíneo y cálculos de los índices eritrocitarios. La Citometría hemática es sin lugar a dudas el primer paso para el diagnóstico, dado que numerosos trastornos se acompañan de alteraciones en las células por lo cual es importante hacer la diferenciación. Las células pueden sufrir alteraciones no sólo en su forma sino también en su cantidad y su función, que pueden ser secundarias a algunas alteraciones fisiopatológicas, enfermedades crónicas, terapias con medicamentos, déficit de algún componente, neoplasias, etc., lo cual lleva a alterar las funciones que desempeñan como es: defensa contra infecciones, aporte de oxígeno. etc. Actualmente se cuenta con aparatos automatizados para la determinación de la Citometría hemática, día a día han sustituido a la forma manual, ya que los valores son más precisos; sin embargo, el Químico Farmacobiólogo debe estar preparado para realizar esta prueba por ambos métodos. El manual de prácticas de Introducción a la hematología ayuda a los alumnos de quinto semestre del área técnica de Analista químico, a comprender los procesos químicos que se manifiestan por la alteración de los elementos de la sangre y evaluarlos en el laboratorio, mediante análisis apegados a la normatividad vigente; de esta manera desarrolla competencias profesionales esenciales para el área clínica. El manual está desarrollado desde un enfoque de búsqueda que requiere que el estudiante realice investigaciones documentales previas al desarrollo de cada práctica, elabore diagramas de flujo que muestren el desarrollo previsto de la misma, dibuje esquemas para representar lo que sucede al realizarla y responda preguntas de cierre a manera de evidencia de aprendizaje, para finalmente redactar conclusiones de aprendizaje personales, donde relacione contenidos teóricos con la experiencia vivida en el laboratorio. Antes de empezar, es necesario conocer el reglamento general de laboratorio, los procedimientos que se realizan de manera general en ese ambiente y las precauciones que es necesario tener cuando se trabaja en un laboratorio clínico. 1
5 Reglamento General de Laboratorio 1. Hay que seguir cuidadosamente las reglas establecidas para el trabajo correcto del laboratorio. 2. Todos los alumnos deben usar permanentemente una bata de laboratorio limpia y abotonada durante el tiempo que esté en el interior del laboratorio. 3. Está absolutamente prohibido: fumar, ingerir líquidos (agua, refresco, etc.) o comer dentro del laboratorio, así como ponerse cosméticos ni tocarse la cara con las manos o algún otro objeto. 4. No deberá sacar del laboratorio equipo, cepas o medios de cultivo contaminados, sangre de ningún tipo de líquido corporal considerado como RPBI. 5. No poner ropa o libros sobre la mesa de trabajo, ni guardar material de laboratorio (cultivos) en las bolsas de las batas. 6. Los membretes o etiquetas deben ser humedecidos con agua y no con la lengua. 7. Al inicio y al final de la práctica limpiar y descontaminar las mesas de trabajo y el equipo que vaya a estar o haya estado en contacto con el material infectado. Colocar todo el equipo en su sitio. 8. Lavarse de manera meticulosa las manos con jabón germicida y abundante agua una vez terminada la práctica, incluso si sale antes de la terminación de la misma por breves momentos. 9. No se permite la visita personal de personas ajenas a la práctica ya que puede ocasionar distracción del estudiante poniendo en riesgo la seguridad en el trabajo que se realiza. Procedimientos del laboratorio 1. Comprobar que las llaves del gas y del agua estén cerradas antes de salir del laboratorio. 2. En caso de cualquier accidente personal (herida personal o incendio) o del material de trabajo, notifíquese inmediatamente al maestro o al instructor. 3. Todo el personal debe lavarse las manos profusamente con un desinfectante después de trabajar con muestras clínicas, material contaminado y animales infectados. 4. Todo el material sucio debe ser manejado con guantes. 5. Hay que separar las pipetas, portaobjetos y cubreobjetos contaminados del resto de material sucio y colocarlos en un contenedor punzocortante. 6. A todo el material contaminado de desecho se le deben quitar etiquetas y cintas adhesivas; se colocan en bolsas se colocan en un carro para su transporte al área de esterilización. 7. Las pipetas contaminadas se sumergen en una solución de hipoclorito de sodio durante 30 minutos. Precauciones generales en el laboratorio clínico La sangre y los líquidos corporales de los pacientes o estudiantes deben considerarse infecciosos. 1. Todas las muestras de sangre y líquidos corporales deben guardarse en un recipiente adecuado con tapón para evitar su derrame durante el transporte. Hay que tener precaución cuando se recoja cada muestra para evitar la contaminación del exterior del recipiente y de la etiqueta que acompaña la muestra. 2. Todas las personas que analicen sangre y muestras de líquidos corporales deben llevar guantes. Ante la posibilidad de un posible contacto de la mucosa con sangre o líquidos corporales del paciente, es necesario el uso de mascarilla y gafas protectoras. Hay que cambiarse de guantes y lavarse las manos después de tomar la muestra. 3. En análisis rutinarios, como estudios histológicos y anatomopatológicos o cultivos microbiológicos, no es necesario utilizar una cabina de seguridad. Sin embargo, estas cabinas deben emplearse cuando realicen análisis de muestras con una posibilidad importante de generar aerosoles, por ejemplo, en una agitación intensa. 4. Hay que utilizar pipetas automáticas para manipular todos los líquidos en el laboratorio. No se debe pipetear con la boca. 5. Hay que limitar el uso de las jeringas y agujas a situaciones en las que no haya otra alternativa, y siempre hay que seguir las recomendaciones generales para evitar lesiones con agujas. 2
6 6. Hay que descontaminar todas las superficies de trabajo con un germicida químico apropiado después de un derrame de sangre y otros líquidos corporales y cuando se haya finalizado el trabajo. 7. Los materiales contaminados empleados en las pruebas de laboratorio deben limpiarse y descontaminarse antes de ser reprocesados, o bien, guardarlos en bolsas y eliminarlos de acuerdo con la norma para residuos infecciosos. 8. El equipo de laboratorio que se haya contaminado con sangre u otros líquidos corporales deben descontaminarse y limpiarse. 9. Todas las personas deben lavarse las manos después de finalizar las actividades de laboratorio y quitarse la bata antes de dejar el laboratorio. 10. No se debe comer, beber ni fumar en el área de trabajo. Fuente: Morbidity and mortality weekly report, 36 5S-10S, 1987, Center for Disease Control and prevention Guidelines. Material indispensable que deberá traer el estudiante por sesión. 1. Bata blanca de laboratorio. 2. La práctica a realizarse. 3. Franela limpia. 4. Tijeras. 5. Cinta maskin tape. 6. Encendedor. 7. Marcador para cristal (Sharpie). 3
7 PRACTICA 1 Material Básico del Laboratorio de Clínicos Investigación Previa: investiga el material básico que debe existir en un Laboratorio clínico, reporta tus hallazgos en el siguiente espacio. Referencias Bibliográficas
8 Elabora un diagrama de flujo que indique de manera general los pasos a seguir durante el desarrollo de esta práctica. Competencias Genéricas a desarrollar en la asignatura 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. Competencias profesionales a desarrollar en la asignatura 1. Realiza operaciones básicas en el laboratorio que le permitan realizar experimentos controlados. 2. Maneja material y equipos básicos de laboratorio para realizar análisis cualitativos y cuantitativos de muestras considerando normas de calidad internos y externos que garanticen la calidad y confiabilidad de los resultados. Propósito: El alumno conoce el material del laboratorio necesario para el desarrollo de las prácticas del manual de Introducción a la Hematología, para su correcto uso y aplicación. Introducción Es importante conocer el material que se utilizará en la materia de introducción a la hematología ya que esto ayudará a realizar los procedimientos más rápido al momento de llevar a cabo las prácticas, de no ser así el procedimiento de rutina tardará más de lo normal, debido a la falta de conocimientos previos por parte de los integrantes de cada equipo. Para conocer los materiales utilizados en el laboratorio de Análisis Clínicos y familiarizarse con ellos, se propone la siguiente practica: 5
9 Realización de un grupo sanguíneo, para esta prueba el alumno debe saber la técnica de Flebotomía y la utilización de materiales como: torundas, guantes, placa de porcelana, reactivos para grupos, pipetas, aplicadores, sistema vacutainer, o la implementación de aguja con jeringa, látex (torniquete), también debe saber interpretar el grupo sanguíneo. Material y equipo Tubos vacutainer Sistema Vacutainer Latex Boquillas Pipetas pasteur Pipetas piston o automáticas Cámara de Neubauer Capilares Jeringas Torundas Recipiente RPBI Agujas Tubo de Wintrobe Guantes de latex Cubre bocas Parafilm Placas serológicas Pianos Placa de toque Tubo con baquelita Desarrollo Tubos Vacutainer: Dentro de los tubos más utilizados en la actualidad en los laboratorios Clínicos tanto privados como particulares son los de la marca BD Vacutainer. Y de estos se pueden encontrar una gran variedad de tubos de diferentes colores. Entre los más utilizados se encuentran el rojo, amarillo, lila y azul. Dependiendo del tipo de estudio que requiera el paciente es el tuvo a utilizar y las condiciones de él, oncológicos, pediátricos, geriátricos, obsesos entre otros. 6
10 También es muy importante saber el orden recomendado para realizar las tomas de muestra con aguja en toma múltiple (sistema Vacutainer) para reducir la fuente de errores preanalíticos. A continuación, se muestra el orden de los tubos. Tubos Microtainer: En pacientes en los que la cantidad de muestra requerida para el análisis es mínima, debido a que su condición no favorece una toma de muestra con un volumen mayor, ya sea por condiciones como quemaduras, fracturas múltiples, deshidratación, pacientes pediátricos o porque las técnicas de laboratorio permiten trabajar con microtécnicas, podemos determinar que la punción capilar es la mejor opción. Para garantizar buenos resultados, un factor clave en la obtención de la muestra es la correcta preparación del paciente y seguir un orden adecuado de la toma. Sistema Vacutainer: El sistema Vacutainer está compuesto de dos elementos por un Holder (soporte Vacutainer, camiseta) y su aguja con broche de seguridad. Estoy nos ayuda a realizar tomas de sangre multiples cambiando 7
11 solamente los tubos colectores con una sola punción y garantizar la calidad de las muestras. A continuacion se muestran imágenes del sistema Vacutainer. Torundas: Son bolitas de algodón contenidas en un recipiente preferentemente de cristal empapadas en alcohol etílico al 96 %, que se utiliza principalmente para limpiar el área de punción. Recipientes RPBI: Material de Residuo Peligroso Biológico Infeccioso (RPBI) que se utiliza en la toma de muestra sanguínea es un recipiente hermético con ciertas características de color rojo para recolectar las agujas utilizadas y bolsas de color rojo. Se recomienda leer norma RPBI, NOM-087-ECOL-SSA Agujas: Las agujas tienen diferentes códigos de colores y de ello depende del grosor ejemplo: Agujas color Negro (delgada), Verde (Termino medio) y Amarillo (toma única). Otras marcas comerciales manejan agujas con los mismos códigos de colores de grosor, pero con mayor seguridad para el flebotomista, ya que cuentan con broches de seguridad. 8
12 Látex: Se usa como torniquete y para poder localizar las venas al igual se usa para las boquillas (succión de células). Los torniquetes facilitan la localización de la vena y, por lo tanto, la punción sin dañar la piel del paciente. Otro dispositivo que no requiere contacto directo con el paciente para una rápida visualización de las venas es el Accuvein. Ha sido diseñado pensando en los profesionales médicos, pues incluso para un profesional experimentado la canalización intravenosa o la extracción de sangre puede representar todo un reto. Boquillas: Este material se utiliza para succionar pipetas de blancos, de sahli o plaquetas. Pipetas de Plaquetas: Tiene una dilatación más grande y sirve para montar plaquetas, su dilución es 1:200. Pipetas de Blanco: Tiene una dilatación con una partícula solida que permite la agitación de la muestra de sangre con el diluyente, su dilución es 1:20. Sahli: Sirve para montaje de Hemoglobina tiene una marca de 20 microlitros es de 0.02 ml. Pipetas Pasteur: Son de tallo largo y corto, se usan para transferencias de muestras pequeñas o bien en hematología nos permite introducir la muestra al tubo de Wintrobe para realizar el montaje para sedimentación globular, tomar suero de tubo primario y verterlo a copillas o plasma. Pipetas pistón o automáticas: Estas son de diferentes volúmenes de 10, 100 o 1000 microlitros y pueden ser de colchón de aire o de flujo positivo, esto dependerá el uso del mismo, normalmente este tipo de pipetas nos permiten medir 9
13 con precisión volúmenes pequeños de suero, plasma, sangre, plaquetas, o fluidos muy viscosos como espermatozoides u orinas mucolientas. Cámara de Neubauer: Con recubrimiento o hematocímetro. Se utiliza para el montaje y conteo de células sanguíneas. Se coloca el cubrehematocímetro sobre la cámara y luego se pone la muestra (una gota ó 50 microlitros) en la orilla, solo debe de estar la parte lisa, se lleva al microscopio y se realiza el conteo. Posee nueve cuadrantes en el interior. La cámara no se lava con escobillón, se lava con los dedos o con una gasa con detergente esto se hace antes y después de usarlo. Cámara de Neubauer, obtenido en julio de 2016 en: Capilares: Capilares de color rojo y azul. Capilar rojo: se usan en hematología para tomar muestras sanguíneas obtenidas por punción capilar, tiene anticoagulante llamado heparina. Los capilares azules, no tiene anticoagulante y se usa para determinar el hematocrito. tubos capilares, obtenido en julio de 2016 en: Tubo de Wintrobe: Se usa para eritrosedimentación globular o velocidad de sedimentación globular (VSG). Es un tubo graduado en mm que va de 0 a 10. Guantes de látex: Se usan como protección personal o del paciente y también evitar cualquier contacto directo con las muestras. Cubre bocas: Es utilizado para la protección tanto del paciente como del personal de salud de posibles aerosoles de patógenos infecciosos que puedan comprometer la salud del paciente o del operario. Parafilm: Plástico flexible y delgado que se usa como sustituto de tapón o para recipientes de boca angosta. 10
14 Placas serológicas: Se emplean para pruebas de aglutinación en placa, como factor reumatoide, proteína C reactiva, Streptolisinas entre otras. Pianos: Los pianos vienen en presentación de dos teclas o de ocho, ambas sirven para contar células la primera es manual y la segunda se encuentran en presentaciones digitales y de teclas, nos ayuda a diferenciar las células blancas en un total de 100 células. Placa de toque: Placa de porcelana con excavaciones que se usa para la identificar el grupo sanguíneo y el RH. Actividad: Investiga por lo menos 3 materiales más diferentes a los anteriores y dibújalos a continuación. Figura 1 Figura 2 Figura 3 Cuestionario de cierre: 1.- En una toma de muestra múltiple, Cuál es el orden de los tubos que se debe seguir? 2.- Cuántas veces debe de ser agitado el tubo lila y el tubo azul? 3.- Él tubo rojo y amarillo también se deben agitar? Sí? No? Por qué? 4.- Qué es Flebotomista? Conclusión Personal: Con respecto al propósito de la practica. Nombre del alumno(a) Nombre del Laboratorista Nombre y firma del titular 11
15 PRACTICA 2 Flebotomía Toma de muestra de sangre venosa periférica Investigación Previa: investiga el procedimiento para la toma de muestras de sangre venosa periférica, reporta tus hallazgos en el siguiente espacio. Referencia Bibliográfica
16 Elabora un diagrama de flujo que indique de manera general los pasos a seguir durante el desarrollo de esta práctica. Competencias Genéricas a desarrollar en la asignatura 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. Competencias profesionales a desarrollar en la asignatura 1. Realiza operaciones básicas en el laboratorio que le permitan realizar experimentos controlados. 2. Maneja material y equipos básicos de laboratorio para realizar análisis cualitativos y cuantitativos de muestras considerando normas de calidad internos y externos que garanticen la calidad y confiabilidad de los resultados. Propósito: El alumno aprenderá a realizar una punción venosa para obtener muestra de sangre. Conocimientos previos que el alumno debe tener antes de realizar esta práctica. Anatomía de miembro superior (músculos, inervación, irrigación y drenaje venoso). NOM-087-ECOL-SSA1-2002, Protección ambiental. Salud ambiental. Residuos peligrosos Biológico Infecciosos. Clasificación y especificaciones de manejo. Técnica de lavado de manos clínico. Técnica abierta de colocación de guantes. 13
17 Introducción La flebotomía constituye una de las etapas más importantes en el trabajo del laboratorio clínico. Por una parte, representa el primer contacto entre el laboratorio y sus pacientes y desde el punto de vista de la muestra sanguínea, la enorme importancia que conlleva una muestra apropiadamente colectada, la seguridad de su origen y el correcto envasado y transporte, constituyen factores fundamentales en la evaluación e informe de los exámenes a realizar. El personal que ha de realizar la colección de la muestra sanguínea, debe tener presente que, en el trato correcto del paciente, su orientación y la habilidad para realizar su trabajo, está la Cara del Laboratorio Clínico ante la comunidad que ha de servir. El presente protocolo pretende ser una guía para el personal encargado de la colección de las muestras sanguíneas, tal que ésta función sea estandarizada en sus aspectos técnicos y estableciendo las pautas necesarias en bioseguridad y de aquellos factores que pueden afectar la calidad de la muestra. Las venas de un paciente constituyen la principal fuente de especímenes para análisis de laboratorio, como punto de entrada de medicamentos, así como el sitio ideal para transfusiones sanguíneas y/o procedimientos intravenosos. El proceso mediante el cual la sangre es removida de la vena es conocido como venopuntura o flebotomía. La importancia de la flebotomía reside en que es el primer contacto entre el laboratorio y sus pacientes, mientras que, desde el punto de vista de la muestra, un proceso cuidadoso conlleva una muestra apropiadamente colectada, así como la garantía de la seguridad de su origen y el correcto envasado y transporte, factores necesarios para la correcta evaluación e informe de los exámenes a realizar. La toma de muestra de sangre para análisis de laboratorio se puede realizar mediante las siguientes técnicas: venosa o periférica y capilar. Para la mayoría de los exámenes clínicos, incluyendo hemogramas y dosificación de hemoglobina, se recomienda utilizar sangre venosa, mientras que para las fórmulas leucocitarias o frotes periféricos puede extraerse sangre en el lóbulo de la oreja o de la yema de un dedo. En los casos de niños, se recomienda utilizar la yema del dedo gordo del pie o del talón. FACTORES PREANALÍTICOS QUE AFECTAN LAS PRUEBAS Es importante tener presente que existen muchos factores que pueden afectar las pruebas de laboratorio, algunos de los cuales pueden ser evitados con una adecuada orientación al paciente y una correcta técnica de extracción sanguínea. A continuación, enumeraremos algunos de estos factores y recomendaciones al respecto. 1. La ansiedad y la tensión mental o física puede afectar los niveles de muchos componentes sanguíneos. Tal es el caso de las concentraciones de Prolactina, Cortisol, Catecolamina, Aldosteronas y Renina. También puede elevar la cuenta de leucocitos. 2. Se recomienda evitar ejercicios físicos vigorosos durante 3 días previos a la toma de muestra, ya que pueden alterar los niveles de CPK, LDH, AST potasio, glucosa, lactato, prolactina y cortisol. 3. El ritmo diurno de algunos fluidos corporales muestran fluctuaciones durante el día. Por ejemplo, los niveles de cortisol son altos en la mañana, pero decrecen en la tarde. Los niveles de hierro tienden a caer durante el día. 4. La situación dietética del paciente puede ser importante para ciertas pruebas. Tal es el caso de las variaciones en la concentración de lípidos después de una comida grasosa. El suero sanguíneo muestra una apariencia lechosa debido a la presencia de triglicéridos y quilomicrones. Estos sueros hiperlipidémicos influyen en las mediciones, por lo que se recomienda tomar muestra después de un periodo de ayuno, usualmente de toda la noche. 5. La ingestión de etanol induce cambios en la composición de los lípidos corporales. De particular interés son las enzimas hepáticas, como la fosfatasa alcalina, transaminasas, gama glutamil transferasa y otros componentes como la glucosa, triglicéridos, uratos y lactato. 14
18 6. El fumar puede producir variaciones en los resultados de algunos componentes como la lipasa, amilasa, colesterol, glucosa e igualmente afecta la absorción gástrica en la prueba de tolerancia a la glucosa. 7. La cirugía y la inyección intramuscular provoca un aumento en la concentración de creatincinasa. 8. La exploración rectal o la manipulación prostática, puede causar un aumento en la concentración del antígeno prostático específico. 9. Los anticonceptivos orales afectan profundamente la actividad estrogénica y conducen al aumento de muchas proteínas como la tiroxina, cortisol y las hormonas sexuales. 10. Medicamentos como barbitúrico y fenitoina, inducen enzimas hepáticas con valores elevados. 11. Evite extraer sangre arriba de una inyección intravenosa previa, ya que las concentraciones de muchos compuestos pueden resultar erróneamente altos o bajos. 12. Evite provocar hemólisis durante el proceso de extracción o llenado de los tubos, lo cual afectará algunas pruebas relevantes. La hemólisis puede ocurrir también por exceso de residuos del alcohol utilizado durante la desinfección del sitio a puncionar. También puede ser debido a un incremento en la fragilidad capilar y alto volumen de células empacadas, especialmente en recién nacidos. 13. Evite agitar con fuerza los capilares para microcolección de muestra, ya que puede provocar su hemólisis. 14. Evite puncionar en un área con hematoma, fístulas, quemaduras, escoriaciones de la piel, cicatrices o del costado en que se ha realizado mastectomía reciente. 15. Verifique condiciones de ayuno para las pruebas que lo requieran. 16. Las pruebas seriadas como curvas de tolerancia, postprandial, post-ejercicios, etc deben monitorearse en el tiempo adecuado, por lo que tienen prioridad. 17. En el caso de las pruebas seriadas, deben rotularse los tubos con la hora de toma de la muestra. Conocer la información anterior permite iniciar la práctica de manera correcta. Material y equipo 1 Torniquete por equipo 1 Frasco con torundas con alcohol etílico al 70 %, como antiséptico. 2 Tubos de ensayo de 13x75 mm con tapón de color lila. 2 Jeringas: De 3, 5, 10 y 20 Adaptador para tubos-vacutainer: Se utilizan para tubos al vacío. (holder, agujas). 1 par de Guantes estériles. 1 Bolsa de desechos 1 contenedor punzo cortante. Jabón desinfectante. Toallas de papel Lavamanos Desarrollo PUNCIÓN VENOSA Fundamento teórico La punción venosa permite extraer una mayor cantidad de sangre para las pruebas necesarias en hematología. Las venas de elección suelen ser las de la cara anterior del antebrazo (vena cubital, vena cefálica y la vena basílica) porque resulta fácil acceder a ellas. Las cifras hemáticas permanecen constantes no obstante el sitio seleccionado para obtener la punción venosa. 15
19 La muestra debe tomarse correctamente y bajo las condiciones más favorables para evitar errores. Esto incluye la absoluta identificación del paciente, el sitio a puncionar y el volumen a colectar. El paciente debe estar en posición cómoda, de preferencia en una silla especial para venopunción con descanso para los brazos y si está en cama, preferiblemente acostado. Procedimiento: 1.- Selección del sitio a puncionar: Al proceder a seleccionar el sitio a puncionar, evite áreas con hematoma, fístulas, quemaduras, escoriaciones de la piel o cicatrices. Si se trata de un paciente hospitalizado evite tomar muestra de un brazo que se esté utilizando con venoclisis o del costado en que se ha realizado una mastectomía reciente. 2.- La palpación: Antes de proceder a puncionar, se debe escoger la vena. La mejor manera es realizando una palpación de las mismas para esa decisión. Para ello coloque el torniquete 3 a 4 pulgadas por arriba del sitio seleccionado, para visualizarlas mejor. Debe tener presente en no mantener el torniquete por más de 3 minutos, para evitar la hemoconcentración. Las venas más utilizadas para la venopunción, están localizadas en el área antecubital. Entre éstas tenemos: a) Vena Cubital: Es la más larga y gruesa de todas y es la preferida por bordear la musculatura del brazo. b) Vena Cefálica: Tiene iguales características de la anterior, pero es un poco menos gruesa. c) Vena Basílica: Es más pequeña que las anteriores. Esta vena está cerca de la arteria braquial, por lo que su punción es riesgosa y su área es más sensible y dolorosa para el paciente. Al palpar hágalo con la punta de sus dedos, tratando de seguir el rastro de las venas. Aquí también son útiles sus conocimientos en la anatomía de las venas de las extremidades superiores. En ocasiones si no visualiza la vena, puede forzar la sangre dentro de la vena a través de un suave masaje de abajo hacia arriba. 3.- La descontaminación: Una vez que se ha decidido por la vena a puncionar, debe proceder a descontaminar el área con alcohol etílico o isopropílico al 70% utilizando algodón y con movimientos 16
20 circulares del interior al exterior. Debe tener presente que una vez realizada la descontaminación, no debe volver a tocar el área venosa. 4.- La punción venosa: Ahora está preparado para realizar la extracción sanguínea. El brazo debe estar preferiblemente en posición cómoda horizontalmente. Con el torniquete en posición, haga que el paciente cierre y abra el puño de 3 a 5 veces para bombear mejor la sangre, y luego que mantenga el puño cerrado. Si se trata de un niño, es recomendable colocar 2 dedos de la mano, debajo del codo del paciente, para evitar que doble el brazo durante la extracción. 5.- Extracción con jeringa: Cuando vaya a proceder a realizar la extracción con jeringuilla, usted debe tener presente el calibre a utilizar y el tamaño de la jeringuilla según el volumen a extraer. a) Coloque la punta de la aguja en un ángulo de 15 a 30 grados sobre la superficie de la vena escogida y atraviese la piel con un movimiento firme y seguro, hasta el lumen de la vena. b) Apretando firmemente la jeringuilla, debe jalar el émbolo con movimiento continuo para extraer la sangre hasta el volumen requerido. Evite presionar fuertemente la aguja durante la extracción. c) Afloje el torniquete para que la sangre fluya mejor y remueva la aguja del brazo con movimiento suave al terminar de colectar, sin apretar el área de la punción con el algodón. d) Presione el algodón sobre el sitio de la punción aplicando una presión adecuada y no excesiva para evitar la formación de hematoma. e) Llenar los tubos en su orden. f) Descarte la jeringuilla y aguja en un contenedor apropiado. 6.- problemas durante la extracción venosa: Diversos problemas pueden surgir durante la colección de sangre venosa y pudiera no obtenerse sangre o su colección sea incompleta. a) Colocación correcta de la aguja: Coloque la aguja con el bisel hacia arriba b) Cambio en la posición de la aguja. Movimiento de retroceso que la saca del lumen venoso. c) Movimiento hacia delante que atraviesa la vena. Movimiento de la aguja, tal que el bisel de la aguja quede contra la pared de la vena, afectando la entrada de la sangre. d) Colapso de la vena: En estos casos, afloje el torniquete para incrementar el flujo sanguíneo, remueva la aguja ligeramente y vuelva a redireccionarla. d) Formación de hematoma: Si se forma un hematoma bajo la piel adyacente al sitio de la punción, afloje el torniquete y retire la aguja. Aplique presión firmemente sobre el hematoma. e) Sangre arterial: Pudiera suceder que se atraviese una arteria, en estos casos la sangre se observa de un color rojo brillante. Retire la aguja y aplique presión por 5 minutos. a) b) c) c) 17
21 d) d) e) 7.- como prevenir Hematomas: Puncione solamente la pared superior de la vena. Remueva el torniquete antes de remover la aguja. Escoja las venas superficiales mayores. Aplique presión sobre el sitio de la punción. 8.- Como prevenir la Hemólisis. La hemólisis de una muestra sanguínea puede ocurrir por diversas razones entre las que se pueden enumerar: a) Trauma con una aguja de calibre muy pequeño. b) Por contaminación con agentes antisépticos. c) Agitación violenta o excesiva de los tubos. d) Demasiado tiempo en ser analizadas las muestras o en ser separado el coágulo de sangre. e) Incremento en la fragilidad capilar de los eritrocitos o alto volumen de células empacadas, especialmente en neonatos. f) Presión excesiva para mejorar el flujo sanguíneo. g) En tubos no llenados al vacío, puede ocurrir hemólisis al llenarlos haciendo una fuerte presión sobre el émbolo provocando un chorro de sangre muy fuerte. 9.- Extracción con Vacutainer: En ocasiones, especialmente cuando se requiere colectar muchos tubos para diversas pruebas en secciones distintas, es sumamente útil el uso del adaptador vacutainer o similar, el cual nos permite llenar cuantos tubos sean necesarios. En estos casos, una vez hecha la punción, sostenga firmemente el vacutainer con una mano y con la otra inserte, llene y retire cuantos tubos requiera. 18
22 Dibujos y Observaciones: Cuestionario de cierre: Resuelve el siguiente caso problema: Paciente femenino de 75 años de edad, la cual acude al servicio de urgencias debido a deposiciones de características melenicas de 5 días de evolución, a la exploración física la paciente se encuentra desorientada, hipoactiva, piel y mucosas pálidas, al tacto rectal se observa la presencia de melena franca, resto sin alteraciones aparentes, además se reportan los siguientes signos vitales: FC 125x, FR: 24 x, TA: 90/60, Temp: 37.8 C. 1.-En este caso se solicitan los siguientes estudios de laboratorio: Citometría hemática (biometría hemática), química sanguínea y tiempos de coagulación. Si usted realiza la toma con vacutainer cuál sería el orden adecuado para llenado de los tubos contenedores de acuerdo al color del tapón? a) Rojo, morado y azul b) Azul, rojo, morado c) Rojo, azul y morado d) Morado, azul y rojo 2.-Son medidas para evitar la hemolisis de la muestra, EXCEPTO: a) Remover el torniquete antes de remover la aguja. b) Escoger las venas superficiales mayores. c) Mezclar vigorosamente la muestra con el anticoagulante del tubo. d) Asegúrese de que el sitio de la punción esté seco del antiséptico. Conclusión Personal: Con respecto al propósito de la práctica. Nombre y firma del alumno(a) Nombre y firma del Laboratorista. Nombre y firma del Titular. 19
23 PRACTICA 3 Punción capilar Investigación Previa: investiga los pasos que conforman la técnica de punción capilar, reporta tus hallazgos en el siguiente espacio. Referencia Bibliográfica
24 Elabora un diagrama de flujo que indique de manera general los pasos a seguir durante el desarrollo de esta práctica. Competencias Genéricas a desarrollar en la asignatura 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. Competencias profesionales a desarrollar en la asignatura 1. Realiza operaciones básicas en el laboratorio que le permitan realizar experimentos controlados. 2. Maneja material y equipos básicos de laboratorio para realizar análisis cualitativos y cuantitativos de muestras considerando normas de calidad internos y externos que garanticen la calidad y confiabilidad de los resultados. Propósito: El alumno aprenderá la técnica de punción capilar para obtener muestras de sangre. Conocimientos previos que el alumno debe tener antes de realizar esta práctica. Anatomía de miembro superior (músculos, inervación, irrigación y drenaje venoso). NOM-087-ECOL-SSA1-2002, Protección ambiental. Salud ambiental. Residuos peligrosos Biológico Infecciosos. Clasificación y especificaciones de manejo. Técnica de lavado de manos clínico. Técnica abierta de colocación de guantes. 21
25 Introducción La sangre capilar es una mezcla de sangre de arteriolas, vénulas y capilares, así como fluidos intersticiales e intracelulares. La sangre capilar se extrae frecuentemente en pediatría y geriatría, pero es también un método generalmente utilizado en pacientes adultos, por ejemplo: para analíticas de gas en sangre y determinación de Glucosa y Lactato. Debido a que la extracción de sangre apilar produce volúmenes de sangre muy pequeños, este método no es adecuado para análisis que requieran volúmenes superiores a 1 ml. Entonces estos casos por ejemplo hemocultivos la sangre se debe de extraer por venopunción. Asimismo, la sangre capilar no es adecuada para análisis de coagulación. Otro criterio que excluye la extracción de sangre capilar son inflamaciones o interrupción de la circulación local en el punto de punción que puede darse en pacientes que padezcan shock. La obtención de sangre por punción capilar es particularmente útil en las siguientes circunstancias: Si la punción venosa es peligrosa para el paciente, No se puede accesar las venas recomendadas, Las venas se están utilizando para administrar medicamentos, El volumen de sangre requerido no justifica una extracción venosa. Estas circunstancias se aplican a: Neonatos, Lactantes, Niños, Adultos con quemaduras severas, En pacientes muy obesos, En caso de terapias intravenosas. La punción cutánea se puede llevar a cabo en: La superficie más lateral o más medial de la planta del pie, La superficie medial plantar del dedo gordo del pie, La superficie lateral del dedo medio o anular, preferiblemente, El lóbulo de la oreja, evitando la mejilla. En pacientes en los cuales la cantidad de muestra requerida para el análisis es mínima, ya sea porque su condición no favorece una toma de muestra con un volumen mayor o porque las técnicas de laboratorio permiten trabajar con microtécnicas, podemos determinar que la punción capilar es la mejor opción. Para garantizar buenos resultados, un factor clave en la obtención de la muestra es la correcta preparación del paciente y seguir un orden adecuado de la toma. Material y equipo Guantes de latex Torundas Lancetas desechables semiautomáticas Tubos de muestras Recipiente de RPBI Desarrollo Selección del punto de punción. En la práctica d rutina, los punto de punción estándar para la extracción de sangre capilar son: los laterales de los dedos corazón, anular y meñique, la sección más 22
26 baja del lóbulo de la oreja y en niños, las áreas laterales del talón. En la mayoría de los casos, la punción en el dedo es muy molesta por lo que muchos pacientes prefieren la extracción de sangre del lóbulo de la oreja dado que es menos doloroso. La punción del dedo índice y pulgar es incomoda ya que estas dos falanges se usan frecuentemente para tocar y sostener objetos de modo que el punto de punción puede ser muy incomodo. Por la misma razón, la punción se debe restringir a los dedos de la mano no dominante del paciente. Antes de la punción, se debe comprobar si se ha realizado una extracción de sangre capilar recientemente a este paciente. Para obtener una buena circulación de sangre, presionar ligeramente el punto de punción anterior una vez y será suficiente para estimular el flujo sanguíneo desde este mismo punto, evitando así una nueva punción. Procedimiento 1.- Una vez escogido el sitio de la punción, puede dar un ligero masaje al área para concentrar la sangre. 2.- Limpie el sitio con alcohol etílico o isopropílico al 70%. 3.- Con una mano sostenga el dedo o área a puncionar y con la otra sostenga la lanceta. 4.- Haga la punción con la lanceta, realizando un movimiento rápido, firme y profundo. 5.- Después de puncionar, descartar la primera gota de sangre, que contiene líquido tisular, limpiándolo con el algodón. 6.- Presione el dedo para hacer salir la sangre, procurando sea de manera ininterrumpida. 7.- Una vez tomada la muestra, sellar los tubos capilares con sellador o los microtubos con su tapa. 8.- Los microtubos y capilares con anticoagulantes deben ser invertidos suavemente por lo menos 10 veces para evitar su coagulación. 9.- Coloque el algodón sobre el sitio puncionado haciendo presión para parar el sangramiento Después de la extracción de sangre. a).- Presionar un algodón en el punto de punción o dejar al paciente sostenerlo. En caso necesario, eliminar los residuos de la pomada vasodilatadora aplicada antes de la punción usando un algodón con vaselina. b).- Si el paciente lo solicita, cubrir el punto de punción con un apósito. c).- desechar los materiales contaminados de acuerdo a la legislación vigente (RPBI). d) Desinfectarse las manos. e).- Proceder con el análisis de las muestras de sangre. f).- Registrar la extracción de sangre y los resultados. 23
27 Dibujos y Observaciones Cuestionario de cierre: 1.- En qué casos se aplica la técnica de punción capilar? 2.- Menciona las ventajas y desventajas que presenta esta técnica con respecto a la punción venosa. 3.- Cuáles son los sitios de punción capilar? Conclusión Personal: Con respecto al propósito de la práctica. Nombre y Firma del alumno Nombre y firma del Laboratorista Nombre y firma del Titular 24
28 PRACTICA 4 Preparación y tinción de frotis sanguíneo Investigación Previa: investiga los pasos para la preparación y tinción de frotis sanguíneo, reporta tus hallazgos en el siguiente espacio. Referencia Bibliográfica
29 Elabora un diagrama de flujo que indique de manera general los pasos a seguir durante el desarrollo de esta práctica. Competencias Genéricas a desarrollar en la asignatura 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. Competencias profesionales a desarrollar en la asignatura 1. Realiza operaciones básicas en el laboratorio que le permitan realizar experimentos controlados. 2. Maneja material y equipos básicos de laboratorio para realizar análisis cualitativos y cuantitativos de muestras considerando normas de calidad internos y externos que garanticen la calidad y confiabilidad de los resultados. Propósito: El alumno aprenderá la técnica habitual para la preparar frotis sanguíneos y realizará la tinción del mismo con la técnica de Wright. Conocimientos previos que el alumno debe tener antes de realizar esta práctica: Serie roja, serie blanca, y serie trombocitica, para su adecuada identificación en el microscopio. Introducción Con el fin de estudiar satisfactoriamente los frotis sanguíneos, es necesario colorearlos. En la mayoría de los laboratorios los colorantes más empleados para la tinción hematológica se basan en el de Romanowsky constituido fundamentalmente con la mezcla de eosina (ácido) y azul de metileno 26
30 (básico). Además, se han incorporado el empleo de derivados por oxidación del azul de metileno que se conoce con el nombre de azures (A, B, C). Son los azures los responsables de la coloración púrpura o roja de ciertas estructuras. Tanto la eosina como el azul de metileno son muy sensibles a las variaciones de ph de las diferentes estructuras celulares, de forma que las que tienen carácter básico fijan la eosina mientras que las que poseen propiedades ácidas fijan principalmente el azul de metileno. Esto explica que las estructuras basófilas se tiñan de color azul mientras que los competente acidófilas adquieren un color rosado. La diferente afinidad de ciertas granulaciones citoplasmáticas por dichos colorantes permite clasificar a los leucocitos polimorfonucleares en 3 grupos: a). - Granulocitos eosinófilos, en los que la granulación específica contiene sustancias de carácter básicos que fijan los colorantes ácidos y se tiñen de color rojo-naranja. b). - Granulocitos basófilos, en los que la granulación específica posee sustancias de carácter ácido que fijan los colorantes básicos y se tiñen de color azul oscuro. c). - Granulocitos neutrófilos, en los que la granulación específica posee compuestos de carácter neutro por lo que fijan ambos colorantes simultáneamente, de ahí que se tiñen de color pardo. Dentro del grupo de colorante tipo Romanowsky los más utilizados son el de Wright, Giemsa y May- Grünwald-Giemsa, entre otras. Tinción de Wright Esta coloración es conocida como policromática debido a que produce varios colores. Es una solución de alcohol metílico de un colorante ácido (eosina) y otro básico (azul de metileno). El alcohol sirve como un fijador del frotis sanguíneo al portaobjetos. El amortiguador, que consiste en una solución tamponada, mantiene el ph del colorante y favorece la mejor absorción por los diferentes componentes celulares. El típico color de los núcleos celulares, mayoritariamente rojo purpura, se basa en la interacción molecular entre eosina y un complejo azur B-ADN. Ambos colorantes forman el complejo. La intensidad de la coloración depende del contenido de azur B y de la relación entre azur B y eosina amarilla. El resultado de tinción puede ser influido por diferentes factores como el valor del ph de la solución y de la solución tampón, las substancias tampón (amortiguadoras), el tiempo de tinción y la fijación. Fortis sanguíneo: Se define como frote, frotis o extendido, a la preparación microscópica delgada y transparente, extendida entre dos cristales (porta o cubreobjetos), obtenida de un líquido orgánico espeso o tejido semilíquido o pastoso (sangre, aspirados, secreciones, exudados, etc.) El frote periférico se utiliza para el estudio de las características citológicas de las células de la sangre, lo cual permite valorar el funcionamiento general de la médula ósea a través de sus componentes celulares, lo cual implica la evaluación de las líneas eritrocíticas, leucocitaria y megacariocítica, determinando anormalidades en forma, tamaño, color e inclusiones citoplasmáticas, dando una medida cuantitativa y cualitativa de los elementos que lo conforman. La preparación y tinción de un extendido de sangre periférica o de médula ósea es una técnica fundamental en hematología, ya que la información obtenida puede conllevar a: 1) El diagnóstico correcto de una enfermedad; 2) Orientar al clínico para brindar la terapéutica adecuada y 3) Monitorear el proceso de recuperación del paciente. 27
31 Material y equipo Microscopio 2 Porta objetos Cubeta de tinción Aceite de inmersión Torundas Tubo de ensayo Lanceta Sistema vacutainer (aguja y holder) Puente Frasco lavador (pizeta) Agua Cronometro Colorante de Wrigth Tampón (amortiguador) Buffer Guantes Recipiente RPB Desarrollo Procedimiento Obtención del frotis sanguíneo 1. Obtención de la muestra (sangre capilar). Con la lanceta realizar un pequeño corte en la yema del dedo índice o corazón previamente desinfectado con alcohol de 70º. 2. Desechar la primera gota. 3. Depositar una gota en el extremo de un portaobjetos y colocarlo encima de la mesa. 4. Proceder a tapar el dedo pinchado y desechar la lanceta en un contenedor de residuos. 5. Realizar la extensión de la muestra. Colocar el segundo portaobjetos por delante de la muestra (que se encuentra en el primer portaobjetos colocado encima de la mesa), con una inclinación de 45º respecto al que contiene la muestra. Primero se procederá a un deslizamiento hacia el extremo donde se encuentra la gota de sangre. De esta forma se consigue que por capilaridad, la sangre ocupe todo el borde del segundo portaobjetos. Seguidamente se procederá a la extensión en sentido contrario de forma rápida y uniforme. 6. Dejar secar al aire. 7. Etiquetar el portaobjetos. Si el frotis está bien realizado deberemos observar tres partes: la cabeza, el cuerpo y la cola (forma de pluma). Es en el cuerpo realizaremos la observación y el estudio. 28
32 Técnica en cuña para realizar el frotis de sangre periférica. A. Ángulo correcto al sostener el frotis extensor. B. La sangre se extiende en toda la superficie de contacto entre los portaobjetos. C. Frotis en cuña completado. (De Rodak BF, Fritsma GA, Keohane EM: Hematology: clinical principles and applications, ed 4, St. Louis, 2012, Saunders.) Procedimiento para la tinción 1. Realizar en una placa un extendido de la muestra con el borde de otra placa. Dejar secar. 2. colocar los frotis de sangre completamente secos, en la gradilla de tinción adecuada. 3. cubrir el porta-objetos con 1-2 ml de R1 colorante de Wright solución. 4. tras 1 minuto, añadir un volumen igual de BUFFER GIORDANO Ph: 7.0 PARA WRIGTH, soplar para homogenizar hasta permitir que la mezcla adquiera un brillo verde metálico. 5. se deja actuar de 3 a 6 minutos. 6. lavar con agua corriente, dejar secar a temperatura ambiente. 7. leer al microscopio con objetivo de 40X o 100X y aceite de inmersión. 29
33 Resultado Tipo de Células Linfocitos Monocitos Neutrófilos Eosinófilos Basófilas Trombocitos(plaquetas) Eritrocito Resultado Núcleo azul violeta Núcleo (lobulado) azul violeta citoplasma azul claro Núcleo azul oscuro citoplasma rosa pálido gránulos tono rosado a azul claro Núcleo azul citoplasma rosa palidogranulos rojo ladrillo Núcleo purpura a azul oscuro gránulos azul oscuro-negro Azul Rojizo Eritrocito Linfocito Monocito Neutrófilos segmentado Eosinófilos Basofilos Dibujos y observaciones 30
34 Cuestionario de cierre 1. Indique cuáles son los componentes del colorante de Wright y cómo se prepara. 2. Qué soluciones pueden utilizarse como amortiguador para la tinción de Wright y cuál es el ph que debe tener? 3. Qué sucede cuando se evapora el colorante? 4. En qué consiste la tinción de Wright-modificado? Conclusión Personal: Con respecto al propósito de la práctica. Nombre y Firma del alumno Nombre y firma del Laboratorista Nombre y firma del Titular 31
35 PRACTICA 5 Montaje y conteo de Leucocitos Investigación previa: investiga los pasos para el montaje y conteo de Leucocitos, reporta tus hallazgos en el siguiente espacio. Referencia Bibliográfica
36 Elabora un diagrama de flujo que indique de manera general los pasos a seguir durante el desarrollo de esta práctica. Competencias Genéricas a desarrollar en la asignatura 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. Competencias profesionales a desarrollar en la asignatura 1. Realiza operaciones básicas en el laboratorio que le permitan realizar experimentos controlados. 2. Maneja material y equipos básicos de laboratorio para realizar análisis cualitativos y cuantitativos de muestras considerando normas de calidad internos y externos que garanticen la calidad y confiabilidad de los resultados. Propósito: El alumno realizará el montaje y conteo de leucocitos de una muestra de sangre. Introducción El valor que se considera normal en un individuo es de 5,000-10,000 leucocitos por mm3 de sangre. Sin embargo, estos valores pueden variar por varias razones. Leucocitosis: Es un aumento del número de leucocitos respecto a las cifras normales. Habitualmente se habla de leucocitosis, frente a valores superiores a 10,000 o 12,000. La leucocitosis puede obedecer a muchos factores, además de los patológicos. Por ejemplo, se produce leucocitosis en caso 33
37 de ejercicio violento, inyecciones de adrenalina, reacciones emocionales de ansiedad, dolor y anoxia. Normalmente hay una ligera leucocitosis durante el embarazo. Leucopenia: este término designa una disminución del número de leucocitos respecto a los valores normales. Las cifras inferiores a 5,000 se consideran leucopenia. Existen muchas causas de leucopenias: Infecciones: la leucopenia es característica de ciertas enfermedades: fiebre tifoidea, enfermedades virales como hepatitis, rubeola y rikettsias. Destrucción de la médula por agentes físicos y químicos: radiación ionizante y gran numero de fármacos. Algunos de ellos son los que emplean específicamente para reducir la actividad celular en la leucemia o en el cáncer. Para el conteo de leucocitos, se usan métodos sistemáticos que son más rápidos y precisos, y los métodos manuales. Todo método manual de recuento celular incluye 3 fases: Dilución de la sangre, Muestreo de la sangre diluida en un volumen, Recuento de células en ese volumen, Para el recuento de leucos se cuentan los 4 cuadrados de las esquinas, que corresponden a los campos 1, 3,7 y 9. Para su dilución, se hace lo mismo que para los hematíes pero empleando la pipeta de blancos, de modo que la solución que obtenemos es de 1/20. Se utiliza como diluyente el líquido de Turk. El líquido de Turk es hipotónico de modo que se destruyen los hematíes y así no entorpecen en el recuento. El líquido de Turk consta de ácido acético glaciar 2ml, violeta de genciana disolución de 1% 1ml y agua destilada en cantidad suficiente para 1000ml. Deberá filtrarse a menudo para evitar levaduras y hongos. En un principio es un poco difícil distinguir los leucocitos de los restos de membranas de los hematíes hemolizados. Se debe tener en cuenta que los leucocitos son más refringentes (más brillantes) al moverlo con el microscopio que los restos de hematíes. Se debe observar la presencia de la membrana citoplasmática y de la membrana nuclear (a veces más) como líneas finas y brillantes. Esto se observa fácilmente moviendo el microscopio hacia delante y hacia atrás. El recuento de leucocitos es uno de los métodos de rutina. La condición previa de todos los métodos de recuento es la dilución y preparación programadas de una muestra de sangre. El acido acético contenido en la solución de Turk hemoliza los eritrocitos. Se recuenta el tipo de célula deseado en un volumen definido y se calcula el número de células en un microlitro de sangre. Material y equipo Pipeta de Thoma para glóbulos blancos (perla blanca). Torundas Torniquete Sistema vacutainer Equipo para venopuncion (Tubo lila) Boquilla blanca Tubo de goma Tubos de ensayo Papel parafilm Cámara de Neubauer Cubrehematimetro Microscopio Gasas Alcohol al 70% Sangre venosa Liquido de Turk 34
38 Desarrollo Procedimiento de montaje 1. Usando la pipeta para glóbulos blancos, aspirar sangre venosa o capilar hasta la marca 0,5 (dilución 1:20). Limpie bien la punta de la pipeta. 2. Llenar con la solución para blancos (solución Turk) hasta la marca 11 por encima del bulbo. 3. Coloque la pipeta en el agitador mezclando por 2 minutos. 4. Descartar las primeras 6 gotas de la suspensión celular. 5. Usando la cámara de recuento de neubauer, con la laminilla de cuarzo debidamente instalada, deposite la muestra en el punto indicado de la cámara hasta notar que se llena. Deje reposar 3 minutos antes de pasar al microscopio y efectuar el recuento. Alternativa para la Dilución: Usando un tubo de ensayo de 12x75 mm, dispense en el 380 microlitros de la solución para blancos (solución de Turk). Luego con pipeta automática de 20 microlitros tome la muestra y dilúyala en la solución, mezcle bien, monte en la cámara de recuento de neubauer y proceda a efectuar el conteo. Obtenido en julio de 2016 en: Obtenido el julio de 2016 en: scatado: a). La cámara de Neubauer o hemocitómetro es una lámina portaobjeto gruesa, en cuyo centro se hayan dos superficies cuadriculadas iguales, separadas del resto de la lámina por surcos y dos barras transversales algo más elevadas. Una laminilla cubreobjetos ópticamente plan, que al colocarse sobre las barras elevadas de la lámina forma una cámara entre el cubreobjetos y la superficie cuadriculada, teniendo una altura de 0.1mm Obtenido en julio de 2016 en: b) En la cámara de Neubauer las áreas de recuento de eritrocitos y leucocitos son diferentes, como se muestra en la imagen. 35
39 6. Colocar en la platina del microscopio y enfocar la cuadricula a 10x. Y contar en los 4 cuadrados angulares grandes de 1 mm de lado cada uno. 7. En el recuento se incluyen las células que cubren o tocan por dentro o por fuera las líneas limitantes superior e izquierda en el cuadro pequeño de recuento y no se consideran los que estén en los límites inferior y derecho. 8. Se recomienda hacer siempre determinaciones dobles cuyos resultados no deben diferir más del 15%. Resultado L x 20 x 10 Numero de Leucocitos = 4 Donde: L = Suma de las células contadas en los 4 cuatro grandes cuadros exteriores. 20 = Factor de Dilución. 10 Valores = Corrección normales Profundidad de Leucocitos. de la cámara para llevar a mm3 Adultos Niños Infantes Neonatos mm mm mm mm3 Dibujos y Observaciones 36
40 Cuestionario de cierre: 1. Qué función tiene el reactivo de Turk en la Dilución? 2. Qué dilución preparaste para poderlo montar en la cámara de neubauer? 3. Cuántos cuadrantes se deben de leer en la cámara de neubauer para el conteo de leucocitos? 4. Con cuál es el objetivo del microscopio se tiene que observar la muestra? Conclusión Personal: Con respecto al propósito de la práctica. Nombre y Firma del alumno Nombre y firma del Laboratorista Nombre y firma del Titular 37
41 PRACTICA 6 Conteo de Plaquetas Investigación Previa investiga acerca de los pasos para el montaje y conteo de Plaquetas, reporta tus hallazgos en el siguiente espacio. Referencia Bibliográfica
42 Elabora un diagrama de flujo que indique de manera general los pasos a seguir durante el desarrollo de esta práctica. Competencias Genéricas a desarrollar en la asignatura 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. Competencias profesionales a desarrollar en la asignatura 1. Realiza operaciones básicas en el laboratorio que le permitan realizar experimentos controlados. 2. Maneja material y equipos básicos de laboratorio para realizar análisis cualitativos y cuantitativos de muestras considerando normas de calidad internos y externos que garanticen la calidad y confiabilidad de los resultados. Propósito: El alumno realizará el montaje y conteo de Plaquetas de una muestra de sangre. Introducción La megacariopoyesis es el proceso por medio del cual los megacariocitos, que se derivan de células madre hematopoyéticas pluripotentes, cuya función principal es la producción de plaquetas (trombopoyesis), las cuales son críticas para una adecuada hemostasia en la vasculatura sanguínea periférica. Un adulto normal, de 70 kilogramos de peso, produce alrededor de millones de plaquetas por día y este número puede elevarse hasta 20 veces en caso de necesidad. 39
43 El megacariocito, se deriva de las células madre hematopoyéticas primitivas, con un diámetro de 50 a 100 µm, constituyéndose en la célula más grande del organismo, es multilobulada y su núcleo es poliploide. A diferencia de los otros precursores hematopoyéticos, como los proeritroblastos, los promegacariocitos (megacarioblastos), los precursores de los megacariocitos, se diferencian por sucesivas replicaciones del ADN sin dividirse en células hijas, con lo cual el número de cromosomas presentes en el núcleo se duplica en cada ciclo. Este fenómeno se llama endomitosis, y origina células con 2, 4, 8, 16, 32 y excepcionalmente 64 veces más ADN que una célula somática (llamadas 2N, 4N, 8N). Al mismo tiempo que aumenta el tamaño del núcleo, se incrementa la cantidad de citoplasma y la capacidad de producir plaquetas. Por su gran núcleo, estas células se conocen como megacariocitos. Los megacariocitos 8N y mayores se diferencian, adquiriendo un gran número de gránulos azurófilos, y son los que originan las plaquetas. Durante la vida, un megacariocito maduro puede producir hasta plaquetas. En la siguiente figura se esquematiza el proceso de la trombopoyesis. Figura obtenida en julio de 2016 en: Schulze H, Shivdasani RA. Mechanisms of thrombopoiesis. J Thromb Haemost 2005; 3: Las plaquetas son fragmentos citoplasmáticos anucleados, no células como erróneamente se hace referencia a ellas con frecuencia, que se producen como consecuencia de la ruptura y liberación del citoplasma de los megacariocitos de la médula ósea. Las plaquetas circulan en la sangre en forma de disco biconvexo (discocitos) de aproximadamente 3 μm de diámetro, un volumen (volumen medio plaquetario) de 8,3 a 11,6 fl y 10 pg de peso. Tienen una vida media en la sangre de 7 a 10 días y su concentración oscila entre y por μl. En un estado fisiológico normal, las plaquetas circulan sin adherirse al endotelio vascular sano. Cuando hay alteraciones en la integridad del endotelio vascular o en la fuerza de cizallamiento del flujo sanguíneo, las plaquetas se activan. La activación de las plaquetas desempeña un papel esencial en las respuestas tanto benignas como patológicas a lesiones vasculares y formación de trombos. El proceso de transformación de plaquetas inactivas en un tapón plaquetario bien formado ocurre a lo largo de su proceso, pero puede dividirse en tres etapas: adhesión, agregación y secreción. 40
44 El recuento de plaquetas se efectúa en sangre obtenida de punción venosa anticoagulada con EDTA- Na 2, y sometida a hemólisis por acción de una solución hipotónica de oxalato de amonio en agua destilada. El recuento de plaquetas es uno de los métodos de rutina. La condición previa de todos los métodos de recuento es la dilución programada y preparación de una muestra de sangre. La dilución de reacción hemolizada la sangre se cuenta el tipo de célula deseado en un volumen definido y se calcula el número de células en un microlitro de sangre. En el método directo la sangre se diluye 1:100 con un solvente que liza los hematíes; las plaquetas se encuentran en un volumen conocido de la dilución en una cámara de Newbauwer empleado en un proceso para contrastar visualmente (colorante, o iluminación de contraste de fases). Material y equipo Microscopio Pipetas Glóbulos Blancos Cronometro Torniquete Torunda Sistema vacutainer (Horlder, agujas) Cámara de Neubauer Cubrehematimetro Tubo lila para sistema vacutainer Gasas Aplicador de madera Porta objetos y aceite de inmersión Agitador de pipetas Papel parafilm Boquilla Guantes de latex. Cámara humeda. Sustancias Diluyente Plaxan (Oxalato de amonio) Muestra de Sangre anticoagulada con EDTA Colorantes para tinción de Wright Desarrollo Método Directo 1. Preparar el diluyente Plaxan, con oxalato de amonio al 1 % en un matraz aforado. 2. Mezclar varias veces la muestra para homogenizar y con ayuda de la boquilla aspirar sangre en la pipeta para blancos arriba de la marca (0.5). Limpiar la pipeta por fuera y llevar la sangre hasta la marca 0.5 exactamente con la ayuda de una gasa. 3. Ahora, sin que se tire ni una gota de sangre, aspira diluyente plaxan (oxalato de amonio 1%) hasta la marca 11 sin que se forme ninguna burbuja. Cuando aspires el diluyente coloca la pipeta en posición vertical dentro del tubo de diluyente para que no se te formen burbujas. 4. Limpia la punta de la pipeta, cuida que no baje el volumen de tu pipeta de la marca 11 con ayuda de una gasa. 5. Tapa la punta con un dedo y retira la boquilla. 6. Tapa ahora la punta de la pipeta con papel parafilm y agítala en el agitador de pipetas. Darle dos veces el tiempo de 45 segundos. 7. Elimina de 3 a 4 gotas y montar con cuidado la cámara de Neubauer con el cubre hematimetro. 8. Ponerla en la cámara húmeda por 20 minutos. 41
45 9. Llevarla al microscopio y contar en los recuadros del centro de la cámara, 4 cuadros pequeños de la esquina y 1 del centro. Al terminar multiplica el resultado por Esto te dará el total de plaquetas de la muestra por mm El maestro o el Laboratorista te deberá auxiliar para ubicar el área de conteo para plaquetas en la cámara de Neubauer y te indicara cuales son las plaquetas para que cuentes. Imagen obtenida en julio de 2016 en: Cálculo: Nº de plaquetas x mm3 = plaquetas contadas en 5 cuadrados pequeños Altura x dilución x área Reemplazando = 1/10 x 1/20 x 1/5 plaquetas contadas en 5 cuadrados pequeños = plaquetas contadas x 1000 Procedimiento en conteo de plaquetas en frotis sanguíneo. Técnica 1. Observar el frotis sanguíneo con el objetivo de inmersión del microscopio. 2. Elegir, para su examen, una zona de la preparación sanguínea en la que las células no están superpuestas y en la que se observa la morfología de las mismas. 3. Contar el número de plaquetas presentes en 10 campos microscópicos. Para cambiar de campo correctamente y evitar contar los mismos trombocitos, se fija la vista en un punto de uno de los bordes del campo microscópico que se está estudiando (por ejemplo, el borde derecho) y se desliza el portaobjetos hasta que ese punto está en el borde opuesto de un nuevo campo microscópico (en este caso, en el borde izquierdo). 4. Calcular la cifra media del número de plaquetas contadas en los 10 campos microscópicos. 42
46 Dibujos y Observaciones Cuestionario de cierre: 1. Cuáles son los valores de referencia normales de trombocitos? 2. Cuál es el reactivo que se utiliza en la técnica de conteo con el método directo? 3. Cuál es el tamaño aproximado de un trombocito? Conclusión personal: Con respecto al propósito de la práctica Nombre y Firma del alumno Nombre y firma del Laboratorista Nombre y firma del Titular 43
47 PRACTICA 7 Determinación de Hemoglobina Investigación Previa: investiga acerca del proceso de la determinación de Hemoglobina, reporta tus hallazgos en el siguiente espacio. Referencia Bibliográfica
48 Elabora un diagrama de flujo que indique de manera general los pasos a seguir durante el desarrollo de esta práctica. Competencias Genéricas a desarrollar en la asignatura 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. Competencias profesionales a desarrollar en la asignatura 1. Realiza operaciones básicas en el laboratorio que le permitan realizar experimentos controlados. 2. Maneja material y equipos básicos de laboratorio para realizar análisis cualitativos y cuantitativos de muestras considerando normas de calidad internos y externos que garanticen la calidad y confiabilidad de los resultados. Propósito: El alumno llevará a cabo el montaje y determinación de la concentración de hemoglobina de una muestra de sangre. Introducción La hemoglobina es una proteína conjugada de sirve para el transporte de O 2 y CO 2. Cuando está totalmente saturada, cada gramo contiene alrededor de 1,4 ml de O 2. La masa total de eritrocitos de un adulto contiene unos 600 g de hemoglobina capaces de transportar 800 ml de O 2. 45
49 Una molécula de hemoglobina consta de 2 pares de cadenas polipeptidicas (unión de aminoácidos) (globina) y 4 grupos proteicos HEM que contienen casa uno un átomo de Fe en estado ferroso. Las cadenas peptidicas que son iguales 2 a 2 adoptan una posición helicoidal; lo que da a la molécula de hemoglobina una estructura esteroide. Cada punto HEM se localiza en una zona determinada de una de las cadenas de polipeptidos. Localizado cerca de la superficie de la molécula, el HEM se combina de forma reversible con una molécula de O 2 de CO 2. Este grupo HEM es el responsable del color rojo de la hemoglobina. La parte proteica o globina tiene 4 cadenas polipeptidicas que se denominan con las letras α, β, γ y δ. Existe una cadena más, la ε que está presente durante los primeros 3 meses de vida. Se diferencian unas de otras en el número de posición de aminoácidos de los que están compuestas. Por lo tanto, existen varios tipos de hemoglobinas. En el ser humano se puede encontrar las siguientes hemoglobinas normales: HEMOGLOBINA A: consta de 2 cadenas α y 2 cadenas β. En un adulto normal corresponde a más del 95% del total. HEMOGLOBINA A 2: consta de 2 cadenas α y dos cadenas δ. En un adulto sano esta en proporción menor al 3%. HEMOGLOBINA F o fetal: consta de 2 cadenas α y 2 cadenas γ. Es una hemoglobina principal en el feto desde el 4 mes de embarazo hasta aproximadamente 6 meses de edad. La Hb F tiene mayor afinidad por el O 2. HEMOGLOBINA GOWER: consta de 2 cadenas α y 2 cadenas ε. Desaparece casi por completo en el tercer mes de embarazo y empieza a aparecer la Hb F. La función principal de la hemoglobina es el transporte de O 2 de los pulmones a donde la tensión es elevada hacia los tejidos donde es baja. A una tensión de O 2 de 100 mmhg en los capilares pulmonares del 98% de hemoglobina se combina con el O 2. En los tejidos donde la tensión de O 2 puede descender hasta 20 mmhg el O 2 se disocia fácilmente de la hemoglobina; en este caso menos de un 30% del O 2 puede permanecer combinado con la hemoglobina. La hemoglobina reducida es hemoglobina con su hierro no asociado a no ir unido al O 2. Cuando cada grupo HEM se asocia con una molécula de O 2, la hemoglobina corresponde a la oxihemoglobina. Tanto en la hemoglobina como la oxihemoglobina el hierro pertenece en estado ferroso Fe 2+. Con el hierro oxidado al estado férrico Fe 3+ la molécula pierde la capacidad de transportar el O 2 y/o CO 2. La anemia que es una disociación de la concentración de hemoglobina por debajo de lo normal y casi siempre del número de eritrocitos o del hematocrito, constituye una alteración muy corriente y una frecuencia complicación de otras enfermedades. El diagnóstico clínico de la anemia basado en la estimación del color de la piel y de las mucosas visibles es de poca garantía. Para complicar más de la anemia suele estar enmascarando en muchos procesos por otras manifestaciones. Por otras razones la estimación correcta de la hemoglobina es importante y una de las pruebas habituales que debe llevarse a cabo en casi todos los pacientes. La anemia no constituye una enfermedad en sí misma, sino que debe ser considerada como un síndrome derivado de algún trastorno en algún sistema. Quiere esto decir que siempre que aparezca una anemia debe buscarse otra enfermedad o trastorno primario que la motive. No obstante, todas las 46
50 anemias coinciden en la aparición de unos síntomas y signos clínicos que la caracterizan y que se presenta en todo caso. A una concentración de hemoglobina de 16g por 100 ml se ha convertido en darle el valor arbitrario de 100%, los valores normales en u adulto varón son de 13-18g por ml y en una mujer adulta 11-16g por ml. Si la concentración de hemoglobina es inferior a estos valores nos encontramos en un proceso anémico. La determinación de la concentración de hemoglobina total es indicativa de la capacidad de transporte de oxígeno y anhídrido carbónico de la sangre entre los pulmones y otros tejidos, siendo también importante como paso inicial en la detección de la anemia y la eritrocitosis. La tasa de hemoglobina puede hallarse disminuida como consecuencia de una hemorragia, hemólisis o como resultado de un daño en la médula ósea que afecte la formación de hematíes. Por el contrario, la concentración de hemoglobina en sangre puede verse aumentada cuando el intercambio de gases a través de los pulmones se halla alterado, así como en otros diversos trastornos. El ión ferroso de la hemoglobina se oxida a ión férrico por acción del ferrocianuro potásico formándose hemoglobina (metahemoglobina). La hemoglobina reacciona con el cianuro para formar cianhemiglobina (cianmetahemoglobina) que se puede medir por espectrofotometría. Material y equipo Torundas Sistema vacutainer Tubo lila de EDTA Látex Fotómetro o colorímetro para mediciones a 540 ± 20 nm. Reactivo de diluyente Drabkin Sangre capilar o venosa EDTA. Hemoglobina en sangre es estable 6 días a 2-8º C. Obtenida en julio de 2016 en: Desarrollo Método colorimétrico de punto Final Preparación de reactivos Reactivo Drabkin (50x). Modificado2. Ferricianuro potásico 30 mmol/l, cianuro potásico 38 mmol/l, fosfato monopotásico 50 mmol/l, tensioactivo 2,5% (p/v). Xn 47
51 Patrón de Hemoglobina. Hemoglobina 12 g/dl (7,5 mmol/l). Origen bovino. El valor de concentración es trazable al Material de Referencia Certificado CRM 522. Mediante una pipeta automática aspirar 5 ml de R1 y dispensarlos en un matraz aforado de 250 ml dirigiendo el flujo contra el cuello para minimizar la formación de espuma. Enrasar con agua destilada, tapar y mezclar por inversión. Estable como mínimo 6 meses a 15-25ºC en frasco topacio de borosilicato. Desechar el reactivo cuando presente signos de obscurecimiento o decoloración. Patrón de hemoglobina. Una vez abierto conserver a -20ºC. Mezclar bien antes de su uso. Técnica 1. Pipetear en tubos rotulados 2. Mezclar y reposar los tubos 3 minutos a temperatura ambiente. 3. Leer la absorbencia (A) de la muestra y el patrón a 540 nm frente al blanco de reactivo. El color es estable varias horas. Para períodos superiores a las 6 horas mantener los tubos refrigerados a 2-8ºC. Cálculos Dibujos y Observaciones 48
52 Describe a continuación lo antes observado y dibujado en la parte de arriba. Cuestionario de cierre: 1. Qué importancia tiene el determinar la hemoglobina a un paciente? 2. Qué es la anemia, y cómo es que ésta puede producirse? 3. Qué pasa con la relación Hb-O 2, cuando una persona está sometida e una gran cantidad de CO 2, por ejemplo, en el caso de un incendio. Conclusión personal: Con respecto al propósito de la práctica Nombre y Firma del alumno Nombre y firma del Laboratorista Nombre y firma del Titular 49
53 PRACTICA 8 Determinación de Hematocrito Investigación Previa: investiga acerca del proceso para la determinación de Hematocrito, reporta tus hallazgos en el siguiente espacio. Referencia Bibliográfica
54 Elabora un diagrama de flujo que indique de manera general los pasos a seguir durante el desarrollo de esta práctica. Competencias Genéricas a desarrollar en la asignatura 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. Competencias profesionales a desarrollar en la asignatura 1. Realiza operaciones básicas en el laboratorio que le permitan realizar experimentos controlados. 2. Maneja material y equipos básicos de laboratorio para realizar análisis cualitativos y cuantitativos de muestras considerando normas de calidad internos y externos que garanticen la calidad y confiabilidad de los resultados. Propósito: El alumno llevará a cabo el proceso para la determinación de Hematocrito con el objetivo de comprender y valorar sus aplicaciones. Introducción El método de referencia para la determinación del Hto es la centrifugación de sangre total en tubo capilar (micrométodo), es una técnica sencilla, barata y accesible a laboratorios de baja complejidad. En la actualidad, todos los autoanalizadores hematológicos suministran, dentro del contexto del hemograma automatizado, un valor de Hto que resulta de un cálculo electrónico a partir del Volumen Corpuscular Medio (obtenido por conductividad o campo oscuro) y la concentración de eritrocitos. 51
55 Obviamente este valor obtenido electrónicamente difiere del obtenido por centrifugación en que no considera el efecto del plasma atrapado entre los eritrocitos ni el efecto de las restantes células sanguíneas, por lo que es siempre algo inferior (1-3 %). Tanto el Hto. Obtenido por microcentrifugación o por métodos automatizados, son un buen parámetro del estado de la serie eritroide. El Hto refleja la concentración y no la masa total de glóbulos rojos. Por ejemplo., un paciente en estado de shock acompañado de hemoconcentración, el Hto. Puede ser normal o alto, aun cuando la masa eritrocitaria total disminuye por la pérdida de sangre. Por lo tanto, no es confiable como indicador de anemia poco después de una hemorragia o una transfusión. El Hematocrito es el volumen de eritrocitos expresados como un porcentaje de volumen de sangre total existente en una muestra. Se recomienda para la determinación del hematocrito utilizar sangre venosa con anticoagulante, esta determinación es importante para poder calcular los índices de Wintrobe. El Hematocrito es una medición de la proporción del volumen que ocupan los eritrocitos en el volumen total de sangre entera en una muestra de sangre. Mide la fracción que comprende a los glóbulos rojos (masa globular), respecto al volumen total de la muestra de sangre venosa o capilar. Puede expresarse en porcentaje o como valor decimal. Hto = altura de la columna de glóbulos rojos / altura de la columna de sangre total (glóbulos rojos más plasma) El porcentaje de una muestra centrifugada de sangre que corresponde a los eritrocitos es el hematocrito. Valores bajos de hematocrito, la disminución de glóbulos rojos en la sangre es una anemia. Se puede relacionar con diferentes condiciones, como hemorragia o leucemia. 52
56 Hay numerosos factores que pueden contribuir a desarrollar una anemia, como la baja en la ingesta de hierro, o pacientes con enfermedad renal crónica, que no generan suficiente eritropoyetina para estimular la producción de glóbulos rojos en la médula ósea. Aun así, solo se utilizan los valores de Hb para detectar si el paciente es o no anémico. Valores altos de hematocrito, se pueden asociar a deshidratación o hipoxia. Patologías como la policitemia vera consisten en una desmedida producción de glóbulos rojos. En casos de enfermedad pulmonar obstructiva crónica, la hipoxia genera un aumento en la producción de eritropoyetina por el riñón, lo que puede resultar en un hematocrito alto. Material y equipo -Tubo de Wintrobe graduado de mm. -Pipetas Pasteur con bulbo de hule -Centrífuga -Sistema Vacutainer -plastilina -encendedor o cerillos -centrifuga -microcentrifuga -torundas -latex -tubo lila con EDTA -capilar azules o rojos. - sangre venosa. Obtenido en julio de 2016 en: Desarrollo Método de microhematocrito Es una técnica muy utilizada, por necesitar muy poca cantidad de sangre, muy sencilla y poderse realizar en gran número de muestras a la vez y en muy poco tiempo. Se utilizan tubos capilares de vidrio de 7 a 7,5 cm. de longitud por 1mm. De diámetro interno. Heparinizados o no, dependiendo del tipo de muestra (sangre entera anticoagulada o sangre capilar). Si se utiliza sangre capilar, se desechará la primera gota después de la punción. Procedimiento. 1. Extracción de sangre venosa siguiendo la misma metodología que en la primera práctica de flebotomía. 2. La aguja de extracción va acoplada a un tubo estéril con EDTA o citrato sódico para permitir la obtención de sangre no coagulada. 3. Introducimos un tubo de capilaridad en el tubo con la muestra de sangre y dejaremos que se llene por capilaridad. 53
57 4. Sellar uno de los extremos del tubo de capilaridad para evitar la salida de sangre durante la centrifugación. 5. Colocar el tubo de capilaridad en la centrífuga, asegurándose de que el peso esté equilibrado. Esto significa que siempre que pongamos un tubo, deberá haber otro en el lado opuesto. Si las muestras no son pares, rellenaremos con tubos vacíos. 6. Centrifugar durante 6 minutos a rpm 7. Tras la centrifugación, observaremos que la muestra ha quedado dividida en dos fracciones; el plasma por un lado y la fracción celular por el otro. Ahora ya se puede calcular el hematocrito. Calculo del hematocrito A: longitud total de la sangre en el tubo B: Longitud de la fracción celular X: Hematocrito en % Ejemplo: Cálculo utilizando una regla de tres A= 7.5cm B=2.8cm X 7.5 X = (280) X = 37.3% (hematocrito) Otra técnica el por el método de Wintrobe Técnica: 1.-Llenar la sangre extraída con anticoagulante con una pipeta Pasteur, comenzando desde el fondo hasta la marca superior de 100 mm, teniendo cuidado de no provocar espuma. 2.-Centrifugar a 3000 rpm por 30 minutos. Resultados (lectura): El tubo Wintrobe está previsto ya de una graduación que nos permite leer con facilidad los resultados, en este caso la muestra de sangre pertenecía a un hombre, con lo cual al haber obtenido un porcentaje de 48%, podemos decir que su porcentaje eritrocitaria se encuentra dentro del rango establecido. Valores de referencia Hombres: 47.0 ±5.0% Mujeres: 42.0 ±5.0% Niños (5 años) 38%-44% 54
58 Lactantes (3 meses): 37-42% Recién nacidos: 50-58% Dibujos y Observaciones Fundamenta tus dibujos. Cuestionario de cierre: 1. Qué método es el recomendado para realizar la prueba de hematocrito? 2. Cuáles son los valores normales de hematocrito de una persona adulta? 3. Cómo se determina el porcentaje de hematocrito por el método de microhematocrito? Conclusión personal: Con respecto al propósito de la práctica Nombre y Firma del alumno Nombre y firma del Laboratorista Nombre y firma del Titular 55
59 PRACTICA 9 Reticulocitos Investigación Previa: investiga acerca del proceso para la tinción y conteo de Reticulocitos, reporta tus hallazgos en el siguiente espacio. Referencia Bibliográfica
60 Elabora un diagrama de flujo que indique de manera general los pasos a seguir durante el desarrollo de esta práctica. Competencias Genéricas a desarrollar en la asignatura 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. Competencias profesionales a desarrollar en la asignatura 1. Realiza operaciones básicas en el laboratorio que le permitan realizar experimentos controlados. 2. Maneja material y equipos básicos de laboratorio para realizar análisis cualitativos y cuantitativos de muestras considerando normas de calidad internos y externos que garanticen la calidad y confiabilidad de los resultados. Propósito: El alumno realizará la determinación de Reticulocitos, como medio para valorar la hematopoyesis en un paciente. Introducción Los reticulocitos son células rojas en el penúltimo estadio de maduración resultantes del proceso de diferenciación del eritroblasto ortocromático, luego de la eyección del núcleo por este último. Conservan restos de material retículofilamentoso constituido principalmente por ribonucleoproteínas (ARN y proteínas) presentes en cantidad considerable en las células nucleadas que le preceden. El proceso de maduración a eritrocito ocurre en la médula ósea, durante tres días aproximadamente y 57
61 durante un día en sangre periférica e implica la eliminación paulatina del material reticular intracitoplasmático. Reticulocitos. Es el precursor inmediato del eritrocito y su concentración permite conocer de manera indirecta el grado de eritropoyesis en la médula ósea (MO). Se le conoce como reticulocito, por tener un fino retículo basófilo que se hace evidente con tinciones supravitales (para células vivas), sin embargo, en las tinciones habituales se infiere su presencia por eritrocitos de aspecto mayor a lo normal (falsa macrocitosis) y se informa como basofilia difusa, ya que las células se tiñen de color azul claro o gris. La cifra normal de reticulocitos en la sangre periférica (SP) es de 1 a 2.5%. En este procedimiento se mezclan e incuban iguales volúmenes de sangre total, capilar o venosa, y colorante; luego se realiza un extendido de la mezcla y se cuentan los reticulocitos en el microscopio óptico. Material y equipo Microscopio óptico Tubos de lila EDTA Pipetas Pasteur Baño de María (incubadora) Porta objetos Aplicador de madera Azul cresil brillante Gradilla Papel parafilm Aceite de inmersión Desarrollo Técnica 1. Colocar en un tubo dos gotas de sangre (aproximadamente 50µl por cada gota) y dos gotas de colorante y tapar con papel parafilm. 2. Agitar la mezcla sangre-colorante e incubar 15 minutos a 37 C. 3. Hacer una extensión en un portaobjetos con una gota de la mezcla. 4. Dejar secar y observar en objetivo de inmersión 100x. 5. Observar 10 campos y contar los eritrocitos en los 10 campos observados y anotando el número de reticulocitos observados dentro de ese conteo. % reticulocitos = Nº de reticulocitos contados/ Nº de hematíes contados x 100 % reticulocitos = 25/2000 x 100 % reticulocitos = 1,25% Nota: Los resultados de reticulocitos en pacientes anémicos deberán corregirse debido a que se presenta en una anemia una falsa impresión del número nuevo de eritrocitos que son producidos por el paciente anémico. % reticulocitos observados x hematocrito del paciente % reticulocitos corregidos = 45 (Hto normal) 58
62 Dibujos y Observaciones Fundamenta cada uno de tus dibujos. Cuestionario de cierre: 1. Qué son los reticulocitos? 2. Qué tipo de tinción estamos utilizando? 3. Por qué hacemos la corrección del porcentaje de los reticulocitos? Conclusión personal: Con respecto al propósito de la práctica Nombre y Firma del alumno Nombre y firma del Laboratorista Nombre y firma del Titular 59
63 PRACTICA 10 Determinación de VSG Investigación Previa: investiga el procedimiento para la determinación de VSG en sangre venosa, registra tus hallazgos en el siguiente espacio. Referencia Bibliográfica
64 Elabora un diagrama de flujo que indique de manera general los pasos a seguir durante el desarrollo de esta práctica. Competencias Genéricas a desarrollar en la asignatura 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. Competencias profesionales a desarrollar en la asignatura 1. Realiza operaciones básicas en el laboratorio que le permitan realizar experimentos controlados. 2. Maneja material y equipos básicos de laboratorio para realizar análisis cualitativos y cuantitativos de muestras considerando normas de calidad internos y externos que garanticen la calidad y confiabilidad de los resultados. Propósito: El alumno realizará la técnica de VSG y llevará a cabo su lectura. Introducción La medición de la velocidad de sedimentación globular (VSG) es una prueba para evaluar la respuesta inflamatoria durante la fase aguda de diversos padecimientos infecciosos y no infecciosos. Su historia se remonta a la observación de Fahraeus en 1918, de una rápida sedimentación de los eritrocitos en el plasma de una mujer gestante que no ocurría en otra mujer no embarazada. 61
65 Sin embargo, fue hasta 1941 cuando MacLeod describió la VSG como reactante de fase aguda. El fenómeno se debe a la tendencia de los eritrocitos de agregarse en forma de columnas de monedas (fenómeno de Rouleaux) como resultado de un proceso electroquímico reversible. En la sangre normal, los eritrocitos tienen una carga negativa (potencial zeta) en su superficie, que hace que se repelan entre sí, lo cual da por resultado una velocidad de sedimentación de menos de 10 milímetros (mm) por hora. Por el contrario, todas las condiciones asociadas con procesos inflamatorios que cambian el potencial zeta favorecen el fenómeno de Rouleaux e incrementan la VSG. La VSG se incrementa en infecciones agudas y crónicas, necrosis tisular, lesiones malignas, enfermedades de la colágena y reumáticas, niveles séricos anormales de proteínas y embarazo, así como en pacientes con falla renal crónica en hemodiálisis y pacientes con insuficiencia cardiaca congestiva, entre otras. Para medir la VSG hay diversos procedimientos; en 1974, Wintrobe describió el método que es aún la regla de oro y requiere 1 ml de sangre venosa anticoagulada con EDTA. La sangre se coloca en el tubo de Wintrobe (tubo de vidrio con un diámetro de 3 mm y graduado en mm en una escala de 0 a 10 cm) y se deja reposar a temperatura ambiente durante una hora en un soporte para mantener la posición vertical; al término, se cuantifica la sedimentación en milímetros desde el borde superior del plasma hasta la base de las células. Otra técnica es la de Westergreen, validada y aceptada por el Comité Internacional de Estandarización en Hematología y descrita en Ésta consiste en extraer sangre venosa y mezclarla con citrato trisódico al 3.8% como anticoagulante. Luego se vierte en un tubo de cristal de 300 ± 1.5 mm de longitud y 2.55 ± 0.15 mm de diámetro, con una escala graduada en mm de 0 a 200, y se coloca en posición vertical durante 24 horas. Las lecturas en milímetros (a partir del borde superior del plasma y hasta las células) se realizan después de una, dos y 24 horas. La técnica en capilares llamada velocidad de microeritrosedimentación se utiliza de manera empírica desde la década de 1930 hasta nuestros días, como un procedimiento sencillo y útil para apoyar el diagnóstico de sepsis. Consiste en tomar una pequeña muestra sanguínea por punción venosa o en el talón y colectada en un capilar heparinizado para microhematocrito de 75 mm de largo y 1.1 mm de diámetro interno; posteriormente, se coloca en posición vertical durante una hora. La lectura se realiza de la misma manera que las dos técnicas anteriores y el resultado se reporta en mm/hora. Aunque los métodos de Wintrobe y Westergreen están validados y tienen un alto grado de confiabilidad, en ocasiones presentan algunas desventajas: 1) Requieren la toma de un poco más de un mililitro de sangre del paciente, lo cual es un problema en algunos recién nacidos pretérmino; 2) se requieren tubos diseñados específicamente para tal propósito (se carece de ellos en muchos países en vías de desarrollo) y el resultado con frecuencia demora varias horas; y 3) es una prueba no disponible las 24 horas del día en muchos hospitales de países en vías de desarrollo. La determinación de la VSG mediante capilares con heparina es un método simple, económico y rápido que puede realizarse en la cabecera del paciente pediátrico a cualquier hora. Sin embargo, se 62
66 necesita la punción del paciente sólo para ese propósito, se utiliza un anticoagulante distinto (heparina) al de la técnica de Wintrobe (EDTA) y aún no se valida. Hasta donde sabemos, la VSG no ha sido evaluada por microtécnica con capilares sin anticoagulante a partir de la misma muestra que se emplea tanto para la biometría hemática, como para la técnica estándar de Wintrobe (ambas con EDTA). Material y equipo Torundas Sistema vacutainer Tubo capilar color rojo Plastilina Mechero Cerillos Tubo lila con EDTA Látex Pipeta de Westergreen longitud 300 mm y calibre 2,5 Soporte que inmovilice la pipeta en posición vertical. Cronómetro Desarrollo Método de Wintrobe Se transfiriere un mililitro (ml) de la muestra anticoagulada a un tubo de Wintrobe y se mantiene en posición vertical a 90 durante una hora. La cuantificación de la VSG se efectúa de manera visual y el resultado se corrige de acuerdo con el hematocrito del paciente mediante el nomograma. Método de micro-eritrosedimentación con capilar De manera simultánea a la colocación de cada muestra en los tubos de Wintrobe, se toma una pequeña muestra de la misma sangre con capilares de 75 mm de longitud y diámetro interno de 1.1 mm sin heparina. Se sella el tubo en su borde inferior con plastilina o mechero y se coloca en posición 63
67 vertical a 90 sobre un soporte, pared o cualquier objeto plano con ayuda de cinta canela. La medición del micro- eritrosedimentación se lleva a cabo con una regla milimétrica desde el borde superior del plasma hasta el inicio de la columna de eritrocitos. Los resultados se expresan como mm/hora y no se corrigen de acuerdo con el hematocrito. Adultos (Método de Westergreen): Hombres menores de 50 años: menos de 10 mm/h Hombres mayores de 50 años: menos de 13 mm/h Mujeres menores de 50 años: menos de 13 mm/h Mujeres mayores de 50 años: menos de 20 mm/h VSG Corregida = VSG del paciente x Hto del paciente / Hto ideal Método de Westergreen. Para ello se realiza una extracción de sangre venosa del brazo del paciente. 1. Una vez obtenida la sangre se le añade el anticoagulante, y se deja en la pipeta de Westergreen. 2. La dejamos reposar durante una hora a temperatura ambiente. 3. Teniendo en cuenta que el plasma es de menor densidad, ésta se quedara arriba del tubo mientras que los eritrocitos se sedimentarán al fondo, como pilas de monedas. 4. Para calcular la velocidad en la que ha ocurrido esto, hay que medir la distancia entre la superficie del menisco correspondiente a la columna eritrocitaria y la parte superior de la columna de sangre situada a nivel de la marca 0. 64
68 Obtenido en julio de 2016 en: Dibujos y Observaciones Obtenido en julio de 2016 en: Describe cada uno de los dibujos que plasmaste. Cuestionario de cierre: 1. Qué es la VSG? 2. Para que utiliza la prueba de VSG? 3. Cuáles son los valores de referencia de la prueba? 65
69 Conclusiones personales Nombre y Firma del alumno Nombre y firma del Laboratorista Nombre y firma del Titular 66
70 PRACTICA 11 Grupo Sanguíneo Investigación Previa: investiga acerca de las técnicas para la determinación del Grupo Sanguíneo, registra tus hallazgos en el siguiente espacio. Referencia Bibliográfica
71 Elabora un diagrama de flujo que indique de manera general los pasos a seguir durante el desarrollo de esta práctica. Competencias Genéricas a desarrollar en la asignatura 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. Competencias profesionales a desarrollar en la asignatura 1. Realiza operaciones básicas en el laboratorio que le permitan realizar experimentos controlados. 2. Maneja material y equipos básicos de laboratorio para realizar análisis cualitativos y cuantitativos de muestras considerando normas de calidad internos y externos que garanticen la calidad y confiabilidad de los resultados. Propósito: El alumno determinará el grupo ABO y Rh, y conocerá las técnicas directa e inversa para la determinación del mismo, además de su importancia en la terapia transfuncional. Conocimientos previos que debe de tener el alumno NOM-017-SSA1-93, de los reactivos hemoclasificadores para determinar grupos del sistema ABO. NOM-018-SSA1-93, del reactivo anti Rh para identificar el antígeno D. NOM-019-SSA1-93, del reactivo antiglobulina humana para la prueba de Coombs. Técnica de lavado de manos clínico. Técnica abierta de colocación de guantes. 68
72 Introducción El grupo sanguíneo es una forma de clasificar la sangre de los humanos en función de la presencia o no de determinados glucolípidos de la membrana de los glóbulos rojos y de glucoproteínas presentes en el plasma sanguíneo y a veces en otras secreciones. Concretamente, la porción de estas moléculas responsable del grupo sanguíneo son los glúcidos que se encuentran unidos a ellas. Se conocen muchos tipos de antígenos que determinan el grupo sanguíneo y se agrupan en los llamados sistemas de grupos sanguíneos. En la actualidad se agrupan en 26 sistemas diferentes. De estos, el sistema ABO y el Rh son los que nosotros estudiaremos. El conocimiento del grupo sanguíneo es muy importante para comprobar la compatibilidad de las transfusiones sanguíneas, y en los casos de incompatibilidad entre la madre y el feto. También se utiliza como prueba de apoyo en los casos de comprobación de paternidad o maternidad. En algunos de ellos se obtienen conclusiones inequívocas. El sistema ABO fue el primero que se descubrió. En el año 1901, Karl Landsteiner y sus colaboradores publicaron un trabajo con los resultados obtenidos al estudiar la sangre de sus cinco ayudantes y la suya. Separó el suero (plasma sin fibrinógeno, la proteína que interviene en la coagulación sanguínea) de los eritrocitos y mezcló cada uno de los sueros con cada una de las muestras de eritrocitos. Observó que en algunas de estas mezclas se producía una reacción llamada de aglutinación (aparecían una especie de grumos en las muestras mezcladas) y en otras no. Según Landsteiner, las reacciones de aglutinación se producían entre antígenos presentes en los eritrocitos y anticuerpos presentes en el suero. Determinó que existían dos tipos de antígenos diferentes que denominó A y B. Con este pequeño grupo de estudio, definió tres tipos diferentes de grupos sanguíneos, el A, el B y el O; el O procede del alemán ohne, que significa sin o ausente de. Cuando se ampliaron los estudios a poblaciones de mayor tamaño, en 1902, se agregó también el grupo AB. Una persona del grupo A tiene en sus glóbulos rojos al antígeno A y en su suero, los anticuerpos contra el antígeno B. La persona que tenga el grupo B tendrá en sus eritrocitos el antígeno B y en su suero anticuerpos contra el antígeno A. Si la persona es del grupo O, no tendrá ninguno de los antígenos en los eritrocitos, pero tendrá anticuerpos contra el antígeno A y contra el B. Si una persona es del grupo AB, tiene ambos tipos de antígenos en sus eritrocitos y no tiene anticuerpos contra ninguno de ellos en el suero. Además de los antígenos del sistema AB0, existen otros innumerables aglutinógenos en los eritrocitos. Los del sistema Rh tienen importancia clínica En este sistema los individuos se clasifican como Rh positivos o Rh negativos, perteneciendo el 85% de la población española al primer tipo. A diferencia del sistema de grupos anterior su distribución en las células y secreciones orgánicas está menos extendida, lo que significa que para que en el plasma de una persona Rh negativa existan anticuerpos Rh se hace necesario un primer contacto, que active el sistema inmunitario. En realidad, el sistema Rh está determinado genéticamente por tres pares de alelos (C, c, D, d, E y e), los cuales determinan la expresión en la membrana de los hematíes de los antígenos correspondientes (C, D y E). El más importante es, con mucho, el aglutinógeno D. Cuando se inyectan glóbulos rojos que contienen el factor Rh, en una persona Rh negativa, las aglutininas anti-rh se desarrollan lentamente alcanzando su máxima concentración de 2 a 4 meses después. 69
73 La respuesta inmune es mucho más potente en unas personas que en otras. Si se producen más exposiciones al antígeno la persona puede quedar sensibilizada al factor Rh. En una transfusión de células Rh positivo a un individuo Rh negativo puede no observarse una reacción inmediata, sin embargo, al cabo de unas 2-4 semanas se ha sintetizado suficiente cantidad de aglutininas para eliminar la totalidad de las células Rh positivas que se encontraban circulantes. Se produce, por tanto, una reacción retardada, aunque habitualmente débil. En subsiguientes transfusiones, cuando la persona está inmunizada, la reacción puede ser inmediata y potente, del mismo tipo que las provocadas por el sistema AB0. Material y equipo Torundas Sistema vacutainer Tubo lila y rojo Agujas Guantes de látex Látex (torniquete) Placa de toque (porcelana) Tubos de ensayo 13 x 100 Centrifuga Peseta Lanceta Agua (grifo o destilada) Aplicadores Gasas Reactivos Suero Anti- (A, B, AB, RH, Control, A 1, A H ) Células Sensibilizadas (A,A 1,A 2,B,O) Desarrollo Para realizar ambas pruebas deberás obtener muestra de sangre con o sin anticoagulante de tu paciente. Método Directo en Placa 1. Realiza la toma de muestra con el tubo capilar que te proporciono tu maestro, y una vez tomada, homogeniza de unas 5 o 6 veces, con ayuda de una pipeta pasteur y chupón toma muestra del tubo y coloca una gota de sangre en las 5 primeras de las excavaciones en la placa de toque. 2. A una de las muestras de la placa agrega una gota del suero hemoclasificador Anti-A, a la siguiente Anti-B, posteriormente Anti-AB, Anti- D y por último Control Rh. 3. Con ayuda de aplicadores de madera (fracciónalo en 3 partes iguales), mezcla las diferentes muestras con sus reactivos a homogenizar (una fracción de aplicador para cada muestra) y colocar la placa en el rotor durante dos minutos o agitarlo manual mente. 4. Transcurridos los dos minutos interprete el grupo y Rh. 5. Es importante que no interpretes antes el grupo, pues el Rh en tarda más en reaccionar que los grupos y esto te puede ocasionar reportar un Rh negativo, cuando no lo es. 6. Este mismo procedimiento lo puedes repetir, pero ahora en tubos de ensayo de 13X100 para rectificar el grupo si tienes dudas en tu resultado de la placa de toque nada más que en lugar del rotor necesitaras centrifugar por 2 minutos a 2500 rpm. 70
74 Método Inverso en tubo. Obtenido en julio de 2016 en: 1. Separar por Centrifugación a 3500 rpm de la muestra sin anticoagulante el suero del paciente. 2. Colocar dos gotas del suero problema a cuatro tubos de ensayo e identifícalos como: A 1, A 2, B, O. 3. Agregar una gota de lavado de eritrocitos de los grupos conocidos como A 1, A 2, B, O en los tubos correspondientes. 4. Agitar suavemente y centrifugar a 2500 rpm durante 1 minuto. 5. Leer la aglutinación en el sobre nadante agitando suavemente. 71
75 6. Realiza la interpretación del grupo. Obtenido en julio de 2016 en: Preparación de Células Sensibilizadas A 1, A 2, B, AB y O. 1. Para esta parte, se requiere que ya cuentes con muestras sanguíneas con EDTA, de los grupos correspondientes. (A 1, A 2, B y O). 2. Una vez que tengas dichas muestras en 4 o 5 tubos de ensayo de 13X100 deberás rotular con un marcador cada uno con el título correspondiente como: A 1, A 2, B, AB y O. 3. Con ayuda de una pipeta pasteur y un chupón agregar a cada tubo de ensayo con de cada grupo correspondientes 8 gotas de sangre ejemplo: tubo A1 ocho gotas de sangre del tubo con EDTA (anticoagulante), del grupo A1 y así sucesivamente a los demás. 4. Una vez que tienes todos los tubos con sus muestras respectivas hacer 3 lavados con solución salina fisiológica a una concentración de 0.98 de NaCl a 2500 rpm cada lavado por 3 minutos cada tubo se llena con solución fisiológica sus ¾ partes y se centrifuga. 5. Después del primer lavado decante el sobrenadante, resuspende el botoncito y llene nuevamente cada tubo hasta su ¾ partes del tubo. 6. Una vez terminado sus tres lavados resuspende el botón y vierte nuevamente solución fisiológica poco menos de las ¾ partes. 7. Listo tendrá sus células sensibilizadas para poder realizar su grupo inverso. Dibujos y Observaciones 72
76 Cuestionario de cierre: 1. Cuál es el grupo sanguíneo si los antisueros A, B, AB, Rh no aglutinan? 2. Cómo debe de aglutinar el grupo inverso si el grupo directo del paciente es AB positivo? 3. Si en el grupo inverso aglutino A, B, AB, Cuál será su grupo Directo? Conclusión personal: Con respecto al propósito de la práctica Nombre y Firma del alumno Nombre y firma del Laboratorista Nombre y firma del Titular 73
77 PRACTICA 12 Tiempos de Coagulación TP y TPT Investigación Previa: investiga acerca de los Tiempos de Coagulación TP y TPT, registra tus hallazgos en el siguiente espacio. Referencia Bibliográfica
78 Elabora un diagrama de flujo que indique de manera general los pasos a seguir durante el desarrollo de esta práctica. Competencias Genéricas a desarrollar en la asignatura 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. Competencias profesionales a desarrollar en la asignatura 1. Realiza operaciones básicas en el laboratorio que le permitan realizar experimentos controlados. 2. Maneja material y equipos básicos de laboratorio para realizar análisis cualitativos y cuantitativos de muestras considerando normas de calidad internos y externos que garanticen la calidad y confiabilidad de los resultados. Propósito: El alumno determinará el tiempo de sangrado y coagulación para verificar los valores normales y la importancia de su determinación en la eficiencia global del mecanismo de coagulación. Conocimientos previos que debe de tener el alumno NOM-017-SSA1-93, de los reactivos hemoclasificadores para determinar grupos del sistema ABO. NOM-018-SSA1-93, del reactivo anti Rh para identificar el antígeno D. NOM-019-SSA1-93, del reactivo antiglobulina humana para la prueba de Coombs. Técnica de lavado de manos clínico. Técnica abierta de colocación de guantes. 75
79 Introducción Cuando una lesión afecta la integridad de las paredes de los vasos sanguíneos, se ponen en marcha una serie de mecanismos que tienden a limitar la pérdida de sangre. Estos mecanismos llamados de "hemostasia" comprenden la vasoconstricción local del vaso, el depósito y agregación de plaquetas y la coagulación de la sangre. Se denomina coagulación al proceso por el cual la sangre pierde su liquidez, tornándose similar a un gel en primera instancia y luego sólida, sin experimentar un verdadero cambio de estado. Este proceso es debido, en última instancia, a que una proteína soluble que normalmente se encuentra en la sangre, el fibrinógeno, experimenta un cambio químico que la convierte en insoluble y con la capacidad de entrelazarse con otras moléculas iguales, para formar enormes agregados macromoleculares en forma de una red tridimensional. El fibrinógeno, una vez transformado, recibe el nombre de fibrina. La coagulación es, por lo tanto, el proceso enzimático por el cual el fibrinógeno soluble se convierte en fibrina insoluble, capaz de polimerizar y entrecruzarse. Un coágulo es, por lo tanto, una red tridimensional de fibrina que eventualmente ha atrapado entre sus fibras a otras proteínas, agua, sales y hasta células sanguíneas. Por una convención se denomina trombo a un coagulo formado en el interior de un vaso sanguíneo. Hasta hoy en día conocemos poco la influencia de la edad en los trastornos de la coagulación, ya que no tenemos una clara evidencia del papel que juega la edad como factor de riesgo independiente en la trombosis o la hemorragia. En el contexto del diagnóstico, la edad es una variable intermedia para otros factores de riesgo (neoplasias o arterioesclerosis, por ejemplo). Aunque es cierto que con la edad aumentan diferentes enzimas de coagulación (factor VII, VIII, trombina, antitrombina), y del D-dímero, también es verdad que hay personas centenarias que están sanas, por lo que factores de coagulación elevados pueden no ser marcadores de riesgo aumentado de trombosis. Como respuesta inicial a la lesión vascular, por acción del propio vaso y de la plaqueta, se inicia la hemostasia primaria, que finaliza con la activación del factor X y la activación del sistema de coagulación. La hemostasia secundaria (coagulación propiamente dicha) tiene como objetivo la formación de un coágulo estable de fibrina. Concomitantemente y con motivo de que este «tapón hemostático» no perdure más tiempo del necesario, poniendo en peligro la circulación del vaso, se pone en marcha la fibrinolisis. 76
80 Ante una hemorragia, el primer paso para llegar a un buen diagnóstico es la exploración física. Una hemorragia de piel y mucosas, con petequias y equimosis, simétrica y difusa, tipo gingivorragia, hemoptisis, hemorragia digestiva, o bien un sangrado inmediato a un traumatismo o a la cirugía, indicará una alteración de la hemostasia primaria. Por otra parte, hematomas subcutáneos o musculares, con grandes equimosis, hemartros, hemorragias retroperitoneales o viscerales, o bien un sangrado horas o días posterior al traumatismo o a la cirugía, nos ha de hacer pensar en una alteración de la hemostasia secundaria. El estudio de cualquier trastorno de la coagulación, se inicia con un hemograma y fórmula completos, plaquetas, tiempo de protrombina (PT) y tiempo de tromboplastina (PTT). A medida que avancemos en el diagnóstico diferencial, serán necesarias nuevas exploraciones complementarias. Las alteraciones de la hemostasia primaria se deben a una alteración vascular o plaquetar. Los exámenes de coagulación, conocidos como Pruebas de Coagulación contemplan una serie de análisis destinados a entregar información acerca del proceso de la coagulación en el ser humano. Estos resultados son extremadamente útiles para cualquier área de la medicina, ya que entregan una visión al médico del estado del paciente respecto a estos procesos, fundamentales al momento de programar por ejemplo una cirugía, o un parto normal. Además, en pacientes con diversas patologías, estos exámenes le permiten al clínico realizar un seguimiento de los tratamientos aplicados. Material y equipo Tubo de ensayo 13x 100 Tubo azul citratado Cronometro Centrifuga Baño maría Sistema vacutainer Aguja Torunda Látex (torniquete) Guantes de látex Gasas Termómetro R1 Activador Ácido elágico Tampón y conservantes. R 2 Iniciador Cloruro cálcico (CaCl2) 0.02M Desarrollo Principio del método Los factores intrínsecos de la coagulación se activan en presencia de un complejo fosfolipídico y un activador soluble en plasma citratado; se mide el tiempo transcurrido después de la adición del cloruro cálcico (CaCl2) hasta la formación del coágulo de fibrina. La medida del tiempo de APTT, es la determinación más común junto con la PT, sirve para determinar trastornos de la coagulación y es particularmente sensible a los defectos de la coagulación intrínseca (Factores VIII, IX, XI, XII). Se usa normalmente para la monitorización de las terapias anticoagulantes 77
81 con heparina. El diagnóstico clínico debe realizarse teniendo en cuenta todos los datos clínicos y de laboratorio. PROCEDIMIENTO 1. Plasma obtenido por punción venosa diluido 1/10 en solución de citrato trisódico 3.8%. 2. Mezclar inmediatamente la sangre con el anticoagulante. Evitar la formación de espuma. 3. Centrifugar la muestra a 2500 x g 15 min y transferir el plasma. 4. Usar solo contenedores de vidrio siliconado o plástico. 5. Los plasmas turbios, ictéricos, lipémicos o hemolizados pueden dar resultados erróneos. 6. La muestra es estable 2 horas a temperatura ambiente (15-25ºC) o 28 días si se congela inmediatamente a 20ºC. Técnica Manual 1. Calentar a 37ºC los reactivos y la muestra. 2. Mezclar bien los reactivos sin agitarlos. 3. Pipetear en un tubo de ensayo limpio y seco: Plasma citratado (µl) 100 R1 (µl) Mezclar bien e incubar exactamente 5 min. a 37ºC (tiempo de activación). 5. Pipetear: R 2 (µl) Mezclar 7. Poner en marcha el cronómetro o el controlador de tiempo del coagulómetro y medir el tiempo de formación del coágulo, a partir de la adición del R2 Iniciador. CÁLCULOS Los valores se pueden expresar en segundos o en tasa de APTT, dividiendo el resultado de la muestra (sec) por el tiempo de reacción del plasma Control (sec). VALORES DE REFERENCIA Se ha realizado un estudio exhaustivo con 250 muestras de una población sana y como resultado se han establecido los valores de referencia siguientes: APTT (segundos) sec. Estos valores son orientativos. Es recomendable que cada laboratorio establezca sus propios valores de referencia. Dibujos y Observaciones 78
82 Cuestionario de cierre: 1. Cuál es el factor de coagulación para tiempo de protrombina? 2. Cuál es el factor de coagulación de tiempo parcial de tromboplastina? 3. Cuáles son sus valores de referencia normas? 4. Qué es el fibrinógeno y que valor diagnostico tiene en el área clínica? Conclusiones personales Nombre y Firma del alumno Nombre y firma del Laboratorista Nombre y firma del titular 79
83 PRACTICA 13 Pruebas Cruzadas Investigación Previa: investiga acerca del procedimiento para realizar pruebas cruzadas, registra tus hallazgos en el siguiente espacio. Referencia Bibliográfica
84 Elabora un diagrama de flujo que indique de manera general los pasos a seguir durante el desarrollo de esta práctica. Competencias Genéricas a desarrollar en la asignatura 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.1 Sigue instrucciones y procedimientos de manera reflexiva, comprendiendo como cada uno de sus pasos contribuye al alcance de un objetivo 5.5 Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. 8. Participa y colabora de manera efectiva en equipos diversos. 8.1 Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con pasos específicos. 8.3 Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos equipos de trabajo. Competencias profesionales a desarrollar en la asignatura 1. Realiza operaciones básicas en el laboratorio que le permitan realizar experimentos controlados. 2. Maneja material y equipos básicos de laboratorio para realizar análisis cualitativos y cuantitativos de muestras considerando normas de calidad internos y externos que garanticen la calidad y confiabilidad de los resultados. Propósito: El alumno realizará las pruebas de compatibilidad sanguínea, como uno de los requisitos para poder transfundir una unidad de sangre o de sus componentes. Introducción Según el diccionario de la Lengua Española, Compatibilidad: proviene del latín compatibilis - compadecerse. Que puede unirse o existir armónicamente con otra cosa o persona en un mismo lugar o tiempo. Definición acorde con la finalidad de las pruebas de compatibilidad sanguínea en donde buscamos una coexistencia armónica entre el producto sanguíneo transfundido y su receptor. 81
85 Historia: el primer reporte escrito de la transfusión sanguínea fue realizado en animales, por J. Denis en Francia en junio de J. Blundell realiza los primeros intentos de transfusión en humanos en En 1901 Landsteiner descubre el Sistema AB0. En 1914 Hustin empieza a utilizar el Citrato como anticoagulante. Moreschi en 1908 experimenta con animales inyectándoles IgG humana, trabajo que más tarde Coombs continúa y realiza su publicación en 1945 poniendo las bases de la prueba más generalizada y valiosa de nuestro tiempo que conocemos como Prueba de Coombs. Dacie en 1957 publica su trabajo sobre IgG contra el complemento humano. En el transcurso de los últimos 70 años se ha trabajado con diferentes sustancias que aceleran y modifican la reacción antígeno anticuerpo: albúmina humana, bovina, bovina polimerizada a 19%, 22%, 30%. Enzimas como la bromelina, fisina, papaína y tripsina, L.I.S.S. (Low ionic strength saline/solución salina de baja fuerza iónica), columnas de gel, polietileno glicol (PEG), polibreno. La prueba de compatibilidad sanguínea es un ensayo in vitro de lo que puede suceder en el paciente al recibir la transfusión de un componente sanguíneo. De acuerdo a lo establecido internacionalmente la secuencia de actividades es: solicitud del producto y datos relevantes del receptor. Identificación y colección de las muestras sanguíneas del receptor. Estudios y pruebas del donador. Determinación del grupo AB0 y Rho (D) del receptor. Detección de anticuerpos irregulares. Selección de componentes AB0 y Rho (D) apropiados para el receptor. Comparación entre resultados actuales y el historial de las pruebas pretransfusionales previas. Prueba mayor: 2 volúmenes del suero del paciente frente a un volumen de eritrocitos lavados del donador. Prueba menor: 2 volúmenes de plasma del donante frente a un volumen de eritrocitos lavados del receptor. Auto testigo: Eritrocitos más suero del paciente. Algunos de los factores más importantes que afectan la sobrevida de los eritrocitos son: la clase y subclase de inmunoglobulinas que se producen frente a sangre incompatible; la capacidad del anticuerpo para activar el complemento; la cantidad de anticuerpos presentes en el plasma del paciente y la avidez por su correspondiente antígeno eritrocitario; el número de sitios antigénicos que tenga la sangre incompatible circulando en el organismo del paciente transfundido, el margen térmico de acción del anticuerpo implicado, la cantidad de eritrocitos transfundidos, la presencia de substancias solubles de grupo en el receptor secretor y la actividad del sistema fagocítico mononuclear del paciente transfundido. El objeto de las pruebas cruzadas de compatibilidad, es investigar anticuerpos específicos activos a 37 C en el suero del paciente contra los eritrocitos del donador y viceversa. La Prueba Cruzada se divide en tres partes: 1. Prueba mayor.- Que contiene el suero del paciente y eritrocitos del donador (D), 2. Prueba menor.- Que contiene el suero del donador y los eritrocitos del paciente (R), 3. El autotestigo.- Que contiene el suero y eritrocitos del paciente (AT). Material y equipo Baños de María 37ºC Termómetro Algodón estéril Alcohol 70 % Agujas Látex (torniquete) Unidades de sangre y/o componentes (CE, CP, PFC) Solución salina fisiológica al 0,9 % Albúmina bovina 25 % Suero de Coombs Sueros Hemoclasificadores (Anti B, Anti A y AB, Anti D, Control) Gradillas 82
86 Tubos de 13x100 mm Tubos de 10x75 mm Centrífuga de mesa Tubo rojo con activador de coagulación Tubo lila con Anticoagulante (heparina o EDTA) Desarrollo Sangre del Receptor: De 5 a 10 ml de sangre fresca con y sin anticoagulante en un tubo rotulado con nombre completo del enfermo, expediente, fecha, edad, cama y hora de extracción. Técnica 1. Centrifugar el tubo del receptor 5 minutos a 3500 rpm., para separar completamente el suero de los eritrocitos del coagulo. 2. Deben de anotarse los datos completos del paciente en la hoja de reporte y anotar sus resultados como se indicará más adelante y separar el suero en un tubo rotulado con los datos del paciente como se indicó anteriormente. 3. Cortar un segmento del tubo piloto de la bolsa de sangre, pasar todo el contenido de 12x75 mm. Y centrifugarlo a 3500 rpm durante tres minutos, este tubo contiene plasma y eritrocitos del donador. 4. Colocar las 2 o 3 gotas de sangre remanente del tubo piloto en otro tubo de 12x75 mm. Y adicionar la solución salina. 5. Realizar tres lavados por un tiempo de tres minutos a 3000 rpm. Decantando y volviendo a centrifugar. 6. Después de los lavados, hacer una solución de eritrocitos al 5% con solución salina. (Este tubo contiene eritrocitos lavados de la sangre del donador) 7. Colocar en una gradilla 3 tubos de 10x75 mm previamente rotulados como se indica a continuación. Bolsa de Sangre CE Paciente enfermo ER SR ED SD M m C Blanco o Calibrador 83
Extracción de Sangre Venosa Periférica
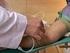 Extracción de Sangre Venosa Periférica Introducción La extracción venosa de sangre es un proceso muy acequiado en el análisis biológico dado que es posible detectar diversas enfermedades o condiciones
Extracción de Sangre Venosa Periférica Introducción La extracción venosa de sangre es un proceso muy acequiado en el análisis biológico dado que es posible detectar diversas enfermedades o condiciones
GenPE: estudio Internacional de Genética en Preeclampsia
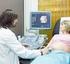 GenPE: estudio Internacional de Genética en Preeclampsia INSTRUCTIVO Toma de muestra proyecto GenPE PAQUETE PARA CAPTACIÓN DE PACIENTE Y TOMA DE MUESTRA. Cuando llegue a su institución la caja del proyecto
GenPE: estudio Internacional de Genética en Preeclampsia INSTRUCTIVO Toma de muestra proyecto GenPE PAQUETE PARA CAPTACIÓN DE PACIENTE Y TOMA DE MUESTRA. Cuando llegue a su institución la caja del proyecto
CONTROL DE CALIDAD PREANALITICO
 CONTROL DE CALIDAD PREANALITICO TOMA DE MUESTRA LAS FASES DE CONTROL DE CALIDAD SON; PREANALITICO ANALITICO POST ANALITICO CONTROL PREANALITICO *SON TODAS LAS ESPECIFICACIONES QUE SE DEBEN CONSIDERAR,
CONTROL DE CALIDAD PREANALITICO TOMA DE MUESTRA LAS FASES DE CONTROL DE CALIDAD SON; PREANALITICO ANALITICO POST ANALITICO CONTROL PREANALITICO *SON TODAS LAS ESPECIFICACIONES QUE SE DEBEN CONSIDERAR,
VENIPUNCIÓN Y MANEJO DE ESPECIMENES HEMATOLÓGICOS
 VENIPUNCIÓN Y MANEJO DE ESPECIMENES HEMATOLÓGICOS Práctica 2 1. Introducción Las venas de un paciente constituyen la principal fuente de especímenes para análisis de laboratorio, como punto de entrada
VENIPUNCIÓN Y MANEJO DE ESPECIMENES HEMATOLÓGICOS Práctica 2 1. Introducción Las venas de un paciente constituyen la principal fuente de especímenes para análisis de laboratorio, como punto de entrada
UNIVERSIDAD JUÁREZ DEL ESTADO DE DURANGO FACULTAD DE MEDICINA Y NUTRICIÓN Unidad Médica de Simulación Clínica "Dr. José Jorge Talamas Márquez"
 LICENCIATURA EN NUTRICIÓN Practica #10 TOMA DE MUESTRA DE GLUCOSA CAPILAR OBJETIVOS: Al concluir la práctica el alumno será capaz de: 1. Definir y conocer la técnica de toma de muestra de glucosa capilar
LICENCIATURA EN NUTRICIÓN Practica #10 TOMA DE MUESTRA DE GLUCOSA CAPILAR OBJETIVOS: Al concluir la práctica el alumno será capaz de: 1. Definir y conocer la técnica de toma de muestra de glucosa capilar
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
Protocolo de toma de muestra arterial MANUAL DE CALIDAD LABORATORIO CLÍNICO. PRO 08 D Ed 01 Protocolo extracción arterial
 MANUAL DE CALIDAD LABORATORIO CLÍNICO Protocolo de toma de muestra arterial Código Fecha emisión/última revisión Revisado Aprobado PRO 08 D Ed 01 18/11/09 Spsor. Rafael Infantes Viano Dr. Vidal Pérez Valero.
MANUAL DE CALIDAD LABORATORIO CLÍNICO Protocolo de toma de muestra arterial Código Fecha emisión/última revisión Revisado Aprobado PRO 08 D Ed 01 18/11/09 Spsor. Rafael Infantes Viano Dr. Vidal Pérez Valero.
LIMPIEZA Y DESINFECCION
 PAGINA: 1 de 7 1. DEFINICION: Es el procedimiento, mediante el cual son eliminados los diferentes desechos generados en los procesos de recolección y procesamiento de muestras; y además se describe el
PAGINA: 1 de 7 1. DEFINICION: Es el procedimiento, mediante el cual son eliminados los diferentes desechos generados en los procesos de recolección y procesamiento de muestras; y además se describe el
Mat. Natalia Torres D.Educadora Roche Diabetes Care
 Mat. Natalia Torres D.Educadora Roche Diabetes Care Objetivos Definir Glicemia capilar Identificar los objetivos del control de glicemia capilar Conocer la historia toma de muestra de glicemia capilar
Mat. Natalia Torres D.Educadora Roche Diabetes Care Objetivos Definir Glicemia capilar Identificar los objetivos del control de glicemia capilar Conocer la historia toma de muestra de glicemia capilar
EXTRACCIÓN DE SANGRE DE VENA PERIFÉRICA
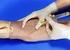 Página 1 de 7 EXTRACCIÓN DE SANGRE DE VENA PERIFÉRICA 1.-OBJETIVO Proporcionar los conocimientos necesarios para obtener muestras de sangre venosa del paciente para determinaciones diagnósticas. 2.-DEFINICIÓN
Página 1 de 7 EXTRACCIÓN DE SANGRE DE VENA PERIFÉRICA 1.-OBJETIVO Proporcionar los conocimientos necesarios para obtener muestras de sangre venosa del paciente para determinaciones diagnósticas. 2.-DEFINICIÓN
MANUAL DE PROCEDIMIENTOS PUNCION ARTERIAL EN PACIENTES AULA DE SIMULACION USAL
 MANUAL DE PROCEDIMIENTOS PUNCION ARTERIAL EN PACIENTES AULA DE SIMULACION USAL aulasimulacion@usal.edu.ar JUSTIFICACIÓN Los instructores del Laboratorio de Simulación de la USAL hemos elaborado el presente
MANUAL DE PROCEDIMIENTOS PUNCION ARTERIAL EN PACIENTES AULA DE SIMULACION USAL aulasimulacion@usal.edu.ar JUSTIFICACIÓN Los instructores del Laboratorio de Simulación de la USAL hemos elaborado el presente
MANUAL DE FLEBOTOMIA
 ÍNDICE MANUAL DE FLEBOTOMIA Página 1. INTRODUCCIÓN... 2 2. La Seguridad Primero:... 2 2.1. Requisitos generales para la seguridad personal... 2 2.2. Medidas específicas durante la flebotomía... 3 3. Factores
ÍNDICE MANUAL DE FLEBOTOMIA Página 1. INTRODUCCIÓN... 2 2. La Seguridad Primero:... 2 2.1. Requisitos generales para la seguridad personal... 2 2.2. Medidas específicas durante la flebotomía... 3 3. Factores
TRATAMIENTO Y RECOGIDA DE MUESTRAS EN EL LABORATORIO
 TRATAMIENTO Y RECOGIDA DE MUESTRAS EN EL LABORATORIO GEMA GÓMEZ LAJARA TEL TEL SERVICIO SERVICIO DE DE LABORATORIO LABORATORIO HOSPITAL SANTA BARBARA. PUERTOLLANO. HOSPITAL SANTA BARBARA. PUERTOLLANO.
TRATAMIENTO Y RECOGIDA DE MUESTRAS EN EL LABORATORIO GEMA GÓMEZ LAJARA TEL TEL SERVICIO SERVICIO DE DE LABORATORIO LABORATORIO HOSPITAL SANTA BARBARA. PUERTOLLANO. HOSPITAL SANTA BARBARA. PUERTOLLANO.
MANEJO DE SOLUCIONES DESINFECTANTES
 PAGINA: 1 de 8 REVISADO: ELABORADO: COORDINADOR DE CALIDAD 1. DEFINICION ENFERMERO JEFE COORDINADOR CIRUGIA Las soluciones desinfectantes son sustancias que actúan sobre los microorganismos inactivándolos
PAGINA: 1 de 8 REVISADO: ELABORADO: COORDINADOR DE CALIDAD 1. DEFINICION ENFERMERO JEFE COORDINADOR CIRUGIA Las soluciones desinfectantes son sustancias que actúan sobre los microorganismos inactivándolos
La preparación de su hogar
 INTRODUCCIÓN Cómo guardar y manipular sus suministros Cuando se autoadministra una infusión IV de medicamentos, las infecciones son una preocupación importante. Los gérmenes están en todos lados, tanto
INTRODUCCIÓN Cómo guardar y manipular sus suministros Cuando se autoadministra una infusión IV de medicamentos, las infecciones son una preocupación importante. Los gérmenes están en todos lados, tanto
Toma de Muestras Microbiológicas
 Toma de Muestras Microbiológicas MICROBIOLOGÍA CLÍNICA DIAGNÓSTICO DE ENFERMEDADES INFECCIOSAS MUESTRA AISLAMIENTO IDENTIFICACIÓN SENSIBILIDAD A ANTIMICROBIANOS Detección de anticuerpos, antígenos y ácidos
Toma de Muestras Microbiológicas MICROBIOLOGÍA CLÍNICA DIAGNÓSTICO DE ENFERMEDADES INFECCIOSAS MUESTRA AISLAMIENTO IDENTIFICACIÓN SENSIBILIDAD A ANTIMICROBIANOS Detección de anticuerpos, antígenos y ácidos
SÍLABO. Este formato se basa en el anterior y que fuera aprobado por el Consejo de Planificación Académica.
 SÍLABO De acuerdo con el Modelo General para la Evaluación de Carreras con Fines de Acreditación (CEAACES 2011), cada asignatura de la carrera debe contar con un sílabo estandarizado que especifica los
SÍLABO De acuerdo con el Modelo General para la Evaluación de Carreras con Fines de Acreditación (CEAACES 2011), cada asignatura de la carrera debe contar con un sílabo estandarizado que especifica los
Manual de laboratorio
 UNIVERSIDAD NACIONAL DE INGENIERIA UNI-Norte Sede regional en Estelí Manual de laboratorio 2008 Química de Alimentos Objetivos Generales 1. Proporcionar a los estudiantes de Ingeniería Agroindustrial las
UNIVERSIDAD NACIONAL DE INGENIERIA UNI-Norte Sede regional en Estelí Manual de laboratorio 2008 Química de Alimentos Objetivos Generales 1. Proporcionar a los estudiantes de Ingeniería Agroindustrial las
EL KIT CONTIENE: EL KIT CONTIENE: Jeringa de diluyente precargada. Adaptador del vial en su envase. Vial con el fármaco en polvo. Vástago del émbolo
 ALPROLIX Factor IX de coagulación (recombinante), proteína de fusión a Fc INSTRUCCIONES DE USO Lea las Instrucciones de uso antes de comenzar a usar el ALPROLIX y cada vez que obtenga un suministro nuevo
ALPROLIX Factor IX de coagulación (recombinante), proteína de fusión a Fc INSTRUCCIONES DE USO Lea las Instrucciones de uso antes de comenzar a usar el ALPROLIX y cada vez que obtenga un suministro nuevo
Clasificación y cuidados de la ropa
 Clasificación y cuidados de la ropa Lavado y secado de ropa Para darle los cuidados necesarios a cada prenda debes leer su etiqueta e interpretar las indicaciones. Toma en cuenta los siguientes cuidados
Clasificación y cuidados de la ropa Lavado y secado de ropa Para darle los cuidados necesarios a cada prenda debes leer su etiqueta e interpretar las indicaciones. Toma en cuenta los siguientes cuidados
COMITÉ CIENTIFICO 23 de marzo VALOR DEL EXAMEN 47 PUNTOS, puntaje mínimo para certificados de aprovechamiento 33 puntos o más.
 Nombre del participante: Unidad Ejecutora: Fecha: Nombre de la actividad: SEMINARIO DE INTERPRETACION DE EXAMENES DE LABORATORIO I Y II Calificación: Correo electrónico: C.I. COD. COMITÉ CIENTIFICO 23
Nombre del participante: Unidad Ejecutora: Fecha: Nombre de la actividad: SEMINARIO DE INTERPRETACION DE EXAMENES DE LABORATORIO I Y II Calificación: Correo electrónico: C.I. COD. COMITÉ CIENTIFICO 23
TOMA DE SIGNOS VITALES
 REVISADO: ELABORADO: PAGINA: 1 de 6 COORDINADOR DE CALIDAD ENFERMERO JEFE COORDINADOR CIRUGIA 1. DEFINICION Procedimientos a través de los cuales se determinan los valores del funcionamiento de los mecanismos
REVISADO: ELABORADO: PAGINA: 1 de 6 COORDINADOR DE CALIDAD ENFERMERO JEFE COORDINADOR CIRUGIA 1. DEFINICION Procedimientos a través de los cuales se determinan los valores del funcionamiento de los mecanismos
LISTA DE CHEQUEO INFRAESTRUCTURA E INSUMOS
 LISTA DE CHEQUEO INFRAESTRUCTURA E INSUMOS 1 FECHA HORA: NOMBRE DE LA INSTITUCION: SERVICIO: APLICADO POR: OBSERVACIÓN SI NO Insumos e infraestructura Está disponible en el servicio el Protocolo de lavado
LISTA DE CHEQUEO INFRAESTRUCTURA E INSUMOS 1 FECHA HORA: NOMBRE DE LA INSTITUCION: SERVICIO: APLICADO POR: OBSERVACIÓN SI NO Insumos e infraestructura Está disponible en el servicio el Protocolo de lavado
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR
 ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
Fase preanalítica. Porcentaje de participacion de cada una de las fases en el flujo de trabajo
 Fase preanalítica Porcentaje de participacion de cada una de las fases en el flujo de trabajo Variaciones preanalíticas Cualquier factor fisiológico, técnico o de procedimiento que puede afectar la concentración
Fase preanalítica Porcentaje de participacion de cada una de las fases en el flujo de trabajo Variaciones preanalíticas Cualquier factor fisiológico, técnico o de procedimiento que puede afectar la concentración
2. Precauciones de Rutina para el Control de Infecciones de Enfermedades Respiratorias
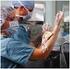 2. PRECAUCIONES DE RUTINA PARA EL CONTROL DE INFECCIONES DE ENFERMEDADES RESPIRATORIAS 2. Precauciones de Rutina para el Control de Infecciones de Enfermedades Respiratorias Precauciones estándar Las precauciones
2. PRECAUCIONES DE RUTINA PARA EL CONTROL DE INFECCIONES DE ENFERMEDADES RESPIRATORIAS 2. Precauciones de Rutina para el Control de Infecciones de Enfermedades Respiratorias Precauciones estándar Las precauciones
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL
 UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
UNIVERSIDAD JUÁREZ DEL ESTADO DE DURANGO
 UNIVERSIDAD JUÁREZ DEL ESTADO DE DURANGO FACULTAD DE MEDICINA Y NUTRICIÓN Unidad Médica de Simulación Clínica "Dr. José Jorge Talamas Márquez" HABILIDADES BÁSICAS I Práctica # 1: LAVADO DE MANOS CLINICO
UNIVERSIDAD JUÁREZ DEL ESTADO DE DURANGO FACULTAD DE MEDICINA Y NUTRICIÓN Unidad Médica de Simulación Clínica "Dr. José Jorge Talamas Márquez" HABILIDADES BÁSICAS I Práctica # 1: LAVADO DE MANOS CLINICO
BIOSEGURIDAD. Dirección de Vigilancia y Análisis del Riesgo en Salud Pública
 BIOSEGURIDAD Dirección de Vigilancia y Análisis del Riesgo en Salud Pública Bioseguridad Conjunto de medidas universales destinadas a proteger al personal, la comunidad y el medio ambiente de riesgos a
BIOSEGURIDAD Dirección de Vigilancia y Análisis del Riesgo en Salud Pública Bioseguridad Conjunto de medidas universales destinadas a proteger al personal, la comunidad y el medio ambiente de riesgos a
ADECUACIÓN DE MEDICAMENTOS Y TÉCNICA ASÉPTICA
 ADECUACIÓN DE MEDICAMENTOS Y TÉCNICA ASÉPTICA III Encuentro de Egresados Instituto de Educación Pablo Tobón Uribe Sección de Farmacia Clínica Departamento de Servicios Farmacéuticos QF Sergio Andrés Aguirre
ADECUACIÓN DE MEDICAMENTOS Y TÉCNICA ASÉPTICA III Encuentro de Egresados Instituto de Educación Pablo Tobón Uribe Sección de Farmacia Clínica Departamento de Servicios Farmacéuticos QF Sergio Andrés Aguirre
La muestra idónea es la primera orina de la mañana, ya que permite la multiplicación de bacterias durante la noche.
 INSTRUCCCIONES PARA LA TOMA DE MUESTRA DE ORINAS Y HECES ORINA 1. ORINA PARCIAL Y UROCULTIVO La muestra idónea es la primera orina de la mañana, ya que permite la multiplicación de bacterias durante la
INSTRUCCCIONES PARA LA TOMA DE MUESTRA DE ORINAS Y HECES ORINA 1. ORINA PARCIAL Y UROCULTIVO La muestra idónea es la primera orina de la mañana, ya que permite la multiplicación de bacterias durante la
6.6. Precauciones especiales de eliminación y otras manipulaciones Instrucciones para el Sistema de Tres Agujas
 6.6. Precauciones especiales de eliminación y otras manipulaciones Instrucciones para el Sistema de Tres Agujas RISPERDAL CONSTA microesferas de liberación prolongada contenido en el vial sólo se debe
6.6. Precauciones especiales de eliminación y otras manipulaciones Instrucciones para el Sistema de Tres Agujas RISPERDAL CONSTA microesferas de liberación prolongada contenido en el vial sólo se debe
3.- Higiene de manos y Antisepsia cutánea
 Higiene de manos La medida más sencilla y eficaz para reducir la infección asociada a la asistencia sanitaria Transmisión cruzada de microorganismos a través de las manos: Las manos de los profesionales
Higiene de manos La medida más sencilla y eficaz para reducir la infección asociada a la asistencia sanitaria Transmisión cruzada de microorganismos a través de las manos: Las manos de los profesionales
SERVICIO DE PREVENCIÓN DE RIESGOS LABORALES DEL PERSONAL PROPIO
 DE RIESGOS PÁGINA: 1 de 7 Fecha: Elaborado por: María Amparo García Layunta. Jefa del Sector de Medicina del Trabajo. SPRL_INVASSAT Mª Cruz Benlloch López. Técnico de Prevención de Riesgos Laborales. SPRL_INVASSAT
DE RIESGOS PÁGINA: 1 de 7 Fecha: Elaborado por: María Amparo García Layunta. Jefa del Sector de Medicina del Trabajo. SPRL_INVASSAT Mª Cruz Benlloch López. Técnico de Prevención de Riesgos Laborales. SPRL_INVASSAT
Manual para la disposición final de desechos o material bio-infeccioso. Servicios Médicos
 Manual para la disposición final de desechos o material bio-infeccioso Servicios Médicos Los desechos peligrosos generados en centros de salud requieren de un manejo especial para evitar la transmisión
Manual para la disposición final de desechos o material bio-infeccioso Servicios Médicos Los desechos peligrosos generados en centros de salud requieren de un manejo especial para evitar la transmisión
GUIA Nº2: POSTURA DE GUANTES DE PROCEDIMIENTO Y ESTERILES
 FACULTAD DE ENFERMERÍA ASIGNATURA: CUIDADOS DE ENFERMERÍA EN EL CICLO VITAL I (ENFE-6013) CREADO EQUIPO DOCENTE PAE 1 (2010) ACTUALIZADO EQUIPO DOCENTE CICLO VITAL I (2012-1) TALLER Nº 1 GUIA Nº2: POSTURA
FACULTAD DE ENFERMERÍA ASIGNATURA: CUIDADOS DE ENFERMERÍA EN EL CICLO VITAL I (ENFE-6013) CREADO EQUIPO DOCENTE PAE 1 (2010) ACTUALIZADO EQUIPO DOCENTE CICLO VITAL I (2012-1) TALLER Nº 1 GUIA Nº2: POSTURA
Mª Luisa Maroto - DUE Farmacia
 Mª Luisa Maroto - DUE Farmacia CITOSTÁTICOS Sustancias de distinta naturaleza química utilizadas en el tratamiento farmacológico de enfermedades neoplásicas CITOTÓXICOS Medicamentos que pueden ocasionar
Mª Luisa Maroto - DUE Farmacia CITOSTÁTICOS Sustancias de distinta naturaleza química utilizadas en el tratamiento farmacológico de enfermedades neoplásicas CITOTÓXICOS Medicamentos que pueden ocasionar
Unidad de Endoscopias Servicio de Digestivo RECOMENDACIONES DE ENFERMERÍA DESPUÉS DE LA GASTROSTOMÍA PERCUTÁNEA
 Unidad de Endoscopias Servicio de Digestivo RECOMENDACIONES DE ENFERMERÍA DESPUÉS DE LA GASTROSTOMÍA PERCUTÁNEA La colocación de una sonda por gastrostomía endoscópica percutánea (PEG) está indicada para
Unidad de Endoscopias Servicio de Digestivo RECOMENDACIONES DE ENFERMERÍA DESPUÉS DE LA GASTROSTOMÍA PERCUTÁNEA La colocación de una sonda por gastrostomía endoscópica percutánea (PEG) está indicada para
Microscopio y observación de células
 I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
Olanzapina en polvo y disolvente para suspensión inyectable de liberación prolongada
 ZYPADHERA Olanzapina en polvo y disolvente para suspensión inyectable de liberación prolongada Instrucciones para la reconstitución y administración dirigido a Profesionales Sanitarios Información sobre
ZYPADHERA Olanzapina en polvo y disolvente para suspensión inyectable de liberación prolongada Instrucciones para la reconstitución y administración dirigido a Profesionales Sanitarios Información sobre
Residuos Peligrosos Generados en el consultorio médico del TESCHI se utilizará la clasificación RPBI s siguiente:
 Página 1 de 6 1. Propósito Establecer los conocimientos necesarios para establecer los lineamientos acerca del manejo de los residuos peligrosos biológicos infecciosos en el consultorio médico, con el
Página 1 de 6 1. Propósito Establecer los conocimientos necesarios para establecer los lineamientos acerca del manejo de los residuos peligrosos biológicos infecciosos en el consultorio médico, con el
INSTRUCTIVO DETERMINACIÓN DE GRUPOS A,B,O Y RH-D
 1. OBJETIVO: Desarrollar la clasificación de Grupo y Rh a los usuarios del Hospital Regional de Arica Dr. Juan Noé Crevani, de acuerdo con los antígenos y anticuerpos presentes en la sangre, esto con el
1. OBJETIVO: Desarrollar la clasificación de Grupo y Rh a los usuarios del Hospital Regional de Arica Dr. Juan Noé Crevani, de acuerdo con los antígenos y anticuerpos presentes en la sangre, esto con el
Trabajo Práctico N 3. Reconocimiento de sustancias ácidas, básicas y neutras. mediante el empleo de indicadores químicos.
 Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Obtener una muestra biológica en condiciones óptimas para su proceso analítico de acuerdo al examén solicitado.
 Código: I-CIRB-AADC-02 Revisión: 03 Página: 1 de 7 1.- OBJETIVO Obtener una muestra biológica en condiciones óptimas para su proceso analítico de acuerdo al examén solicitado. 2.- ALCANCE Aplica para la
Código: I-CIRB-AADC-02 Revisión: 03 Página: 1 de 7 1.- OBJETIVO Obtener una muestra biológica en condiciones óptimas para su proceso analítico de acuerdo al examén solicitado. 2.- ALCANCE Aplica para la
PROCEDIMIENTO DE TOMA Y PRESERVACION DE MUESTRAS DE AGUA POTABLE
 Nit. 900041159-2 PROCEDIMIENTO DE TOMA Y PRESERVACION DE MUESTRAS DE AGUA POTABLE La metodología utilizada para colectar las muestras, provenientes de un sistema de distribución de agua para consumo humano,
Nit. 900041159-2 PROCEDIMIENTO DE TOMA Y PRESERVACION DE MUESTRAS DE AGUA POTABLE La metodología utilizada para colectar las muestras, provenientes de un sistema de distribución de agua para consumo humano,
INDICACIONES PARA LA HIGIENE DE MANOS
 Medicina Preventiva y Salud Pública H.C.U.V. Actualizado 2010 INDICACIONES PARA LA HIGIENE DE MANOS Debe realizarse higiene de las manos por parte del personal sanitario en las siguientes situaciones A.
Medicina Preventiva y Salud Pública H.C.U.V. Actualizado 2010 INDICACIONES PARA LA HIGIENE DE MANOS Debe realizarse higiene de las manos por parte del personal sanitario en las siguientes situaciones A.
INTRODUCCION INDICACIONES CONTRAINDICACIONES EQUIPO NECESARIO. Anestesia local.
 Toracocentesis INTRODUCCION El volumen y la complicación de las grandes operaciones toracoabdominales hacen cada vez más frecuente la existencia de derrames pleurales, que interfieren con el buen curso
Toracocentesis INTRODUCCION El volumen y la complicación de las grandes operaciones toracoabdominales hacen cada vez más frecuente la existencia de derrames pleurales, que interfieren con el buen curso
1. Manejo integral de Recolección y Manejo de Residuos Peligrosos (RP)
 1. Manejo integral de Recolección y Manejo de Residuos Peligrosos (RP) Aceite Usado: Aceite usado es cualquier aceite que haya sido refinado del petróleo crudo o cualquier aceite sintético que haya sido
1. Manejo integral de Recolección y Manejo de Residuos Peligrosos (RP) Aceite Usado: Aceite usado es cualquier aceite que haya sido refinado del petróleo crudo o cualquier aceite sintético que haya sido
Instituto de Banca y Comercio de Puerto Rico Programa de Salud Curso de Emergencias Médicas-Paramédico
 Instituto de Banca y Comercio de Puerto Rico Programa de Salud Curso de Emergencias Médicas-Paramédico Venopunción y Cálculo de Dosis 1 Objetivos Al finalizar la charla educativa el TEM-P podrá: Definir
Instituto de Banca y Comercio de Puerto Rico Programa de Salud Curso de Emergencias Médicas-Paramédico Venopunción y Cálculo de Dosis 1 Objetivos Al finalizar la charla educativa el TEM-P podrá: Definir
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico.
 FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
AISLAMIENTO UNIVERSAL
 AISLAMIENTO UNIVERSAL OBJETIVO: Llevar a cabo las medidas de protección que deben observarse de forma sistemática y generalizada en el ámbito hospitalario. 1 EQUIPAMIENTO NECESARIO: Jabón antiséptico y
AISLAMIENTO UNIVERSAL OBJETIVO: Llevar a cabo las medidas de protección que deben observarse de forma sistemática y generalizada en el ámbito hospitalario. 1 EQUIPAMIENTO NECESARIO: Jabón antiséptico y
Revisado en enero de 2010 (Revised 01/10)
 A los medicamentos que se aplican dentro de un músculo se les llama inyecciones intramusculares, IM por sus siglas en inglés. Estas inyecciones se aplican en zonas del cuerpo llamadas zonas de la inyección.
A los medicamentos que se aplican dentro de un músculo se les llama inyecciones intramusculares, IM por sus siglas en inglés. Estas inyecciones se aplican en zonas del cuerpo llamadas zonas de la inyección.
HIGIENE EN EL MEDIO HOSPITALARIO
 HIGIENE EN EL MEDIO HOSPITALARIO Código Nombre Categoría SN_0079 HIGIENE EN EL MEDIO HOSPITALARIO SANIDAD Duración 30 HORAS Modalidad ONLINE Audio SI Vídeo SI Objetivos OFRECER AL PERSONAL DEL CENTRO SANITARIO
HIGIENE EN EL MEDIO HOSPITALARIO Código Nombre Categoría SN_0079 HIGIENE EN EL MEDIO HOSPITALARIO SANIDAD Duración 30 HORAS Modalidad ONLINE Audio SI Vídeo SI Objetivos OFRECER AL PERSONAL DEL CENTRO SANITARIO
Manual para. Manipuladores de Alimentos. Módulo 3: Condiciones del personal que manipula alimentos
 Manual para Manipuladores de Alimentos Módulo 3: Condiciones del personal que manipula alimentos Indice Capítulo 1. Introducción 1 Capítulo 2. Estado de salud 1 Capítulo 3. Higiene personal 2 Capítulo
Manual para Manipuladores de Alimentos Módulo 3: Condiciones del personal que manipula alimentos Indice Capítulo 1. Introducción 1 Capítulo 2. Estado de salud 1 Capítulo 3. Higiene personal 2 Capítulo
Anemias en Pediatría Diagnóstico, interpretación del hemograma
 Anemias en Pediatría Diagnóstico, interpretación del hemograma Dra. Marcela Gutiérrez Médica Pediatra Hematóloga Hospital de Niños Ricardo Gutiérrez Buenos Aires Técnica de recolección: recursos para su
Anemias en Pediatría Diagnóstico, interpretación del hemograma Dra. Marcela Gutiérrez Médica Pediatra Hematóloga Hospital de Niños Ricardo Gutiérrez Buenos Aires Técnica de recolección: recursos para su
CATETERISMO VESICAL ELABORADO: CATETERISMO VESICAL
 PAGINA: 1 de 6 REVISADO: COORDINADOR DE CALIDAD ELABORADO: ENFERMERO JEFE COORDINADOR URGENCIAS CATETERISMO VESICAL 1. DEFINICION: Es la introducción de una sonda o catéter a la vejiga por el orificio
PAGINA: 1 de 6 REVISADO: COORDINADOR DE CALIDAD ELABORADO: ENFERMERO JEFE COORDINADOR URGENCIAS CATETERISMO VESICAL 1. DEFINICION: Es la introducción de una sonda o catéter a la vejiga por el orificio
NORMAS DE SEGURIDAD EN EL LABORATORIO DE MICROBIOLOGÍA
 Introducción Principios de Bioseguridad NORMAS DE SEGURIDAD EN EL LABORATORIO DE MICROBIOLOGÍA Normas de seguridad en el Laboratorio de Microbiología Medidas en caso de emergencia Bibliografía INTRODUCCIÓN
Introducción Principios de Bioseguridad NORMAS DE SEGURIDAD EN EL LABORATORIO DE MICROBIOLOGÍA Normas de seguridad en el Laboratorio de Microbiología Medidas en caso de emergencia Bibliografía INTRODUCCIÓN
Toma de Muestras Orofaríngeas para la Vigilancia de la Influenza Aviar de Alta Patogenecidad (IAAP) 2010
 Toma de Muestras Orofaríngeas para la Vigilancia de la Influenza Aviar de Alta Patogenecidad (IAAP) 2010 Paso 1: Reunir los materiales necesarios Equipo de protección personal apropiado - además de vestir
Toma de Muestras Orofaríngeas para la Vigilancia de la Influenza Aviar de Alta Patogenecidad (IAAP) 2010 Paso 1: Reunir los materiales necesarios Equipo de protección personal apropiado - además de vestir
Lista de precios 2008 BD Sistemas Vacutainer
 Lista de precios 2008 BD Sistemas Vacutainer Porque en BD Vacutainer su seguridad trabajamos pensando en usted Innovando productos de seguridad los cuales astán enfocados a los cuatro ideales más importantes:
Lista de precios 2008 BD Sistemas Vacutainer Porque en BD Vacutainer su seguridad trabajamos pensando en usted Innovando productos de seguridad los cuales astán enfocados a los cuatro ideales más importantes:
CUIDADOS DE HERIDAS QUIRÚRGICAS
 DIRECCION DE CUIDADOS DE HERIDAS QUIRÚRGICAS AUTORES Ultima actualización Alba Mª Álvarez González Enero 2011 REVISORES Comisión Cuidados Enfermería Mayo 2012 AUTORIZADO Dirección de Enfermería Mayo 2012
DIRECCION DE CUIDADOS DE HERIDAS QUIRÚRGICAS AUTORES Ultima actualización Alba Mª Álvarez González Enero 2011 REVISORES Comisión Cuidados Enfermería Mayo 2012 AUTORIZADO Dirección de Enfermería Mayo 2012
Valoración del estado nutricional. [9.1] Cómo estudiar este tema? [9.2] Qué es la valoración del estado nutricional
![Valoración del estado nutricional. [9.1] Cómo estudiar este tema? [9.2] Qué es la valoración del estado nutricional Valoración del estado nutricional. [9.1] Cómo estudiar este tema? [9.2] Qué es la valoración del estado nutricional](/thumbs/53/31653362.jpg) Valoración del estado nutricional [9.1] Cómo estudiar este tema? [9.2] Qué es la valoración del estado nutricional [9.3] Medidas para calcular el valor del estado nutricional TEMA Esquema TEMA 9 Esquema
Valoración del estado nutricional [9.1] Cómo estudiar este tema? [9.2] Qué es la valoración del estado nutricional [9.3] Medidas para calcular el valor del estado nutricional TEMA Esquema TEMA 9 Esquema
A: Protocolo de Actuación para trabajos con Bromuro de Etidio.
 TRABAJOS CON BROMURO DE ETIDIO Y ACRILAMIDA. 1 A: Protocolo de Actuación para trabajos con Bromuro de Etidio. Objeto: Dar instrucciones de seguridad para todos los procedimientos que utilicen Bromuro de
TRABAJOS CON BROMURO DE ETIDIO Y ACRILAMIDA. 1 A: Protocolo de Actuación para trabajos con Bromuro de Etidio. Objeto: Dar instrucciones de seguridad para todos los procedimientos que utilicen Bromuro de
Explicación del desbridamiento de llagas
 Explicación del desbridamiento de llagas Introducción Algunas llagas presentan dificultades para cicatrizar por sí solas. Las llagas que no cicatrizan también se conocen como heridas o heridas crónicas.
Explicación del desbridamiento de llagas Introducción Algunas llagas presentan dificultades para cicatrizar por sí solas. Las llagas que no cicatrizan también se conocen como heridas o heridas crónicas.
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
3.9 Imprime los resultados obtenidos y los entrega al personal del área de recepción.
 Código: I-FMED-LAC-10 Revisión: 02 Página: 1 de 5 1.- OBJETIVO Proporcionar información para realizar la Citometría Hemática (BH) 2.- ALCANCE Aplica para todas las muestras referenciadas al laboratorio
Código: I-FMED-LAC-10 Revisión: 02 Página: 1 de 5 1.- OBJETIVO Proporcionar información para realizar la Citometría Hemática (BH) 2.- ALCANCE Aplica para todas las muestras referenciadas al laboratorio
PMD: CARLOS ANDRES SAMBONI PMD: CARLOS ANDRES SAMBONI
 PMD: CARLOS ANDRES SAMBONI PMD: CARLOS ANDRES SAMBONI PRINCIPIO UNIVERSAL DE BIOSEGURIDAD TODOS LOS PACIENTES Y SUS FLUIDOS CORPORALES INDEPENDIENTEMENTE DEL DIAGNOSTICO O MOTIVO DE INGRESO, DEBERAN SER
PMD: CARLOS ANDRES SAMBONI PMD: CARLOS ANDRES SAMBONI PRINCIPIO UNIVERSAL DE BIOSEGURIDAD TODOS LOS PACIENTES Y SUS FLUIDOS CORPORALES INDEPENDIENTEMENTE DEL DIAGNOSTICO O MOTIVO DE INGRESO, DEBERAN SER
Prácticas: Configuración de los seres vivos. Curso académico Práctica 2. Preparación de extensiones celulares.
 Prácticas: Configuración de los seres vivos. Curso académico 2009-2010 16 Práctica 2. Preparación de extensiones celulares Introducción Se entiende por extensión o frotis celular, a la formación de una
Prácticas: Configuración de los seres vivos. Curso académico 2009-2010 16 Práctica 2. Preparación de extensiones celulares Introducción Se entiende por extensión o frotis celular, a la formación de una
PANDEMIA DE INFLUENZA. Lo que la gente debe de saber
 PANDEMIA DE INFLUENZA Lo que la gente debe de saber SINTOMAS DE LA PANDEMIA DE INFLUENZA Usted podría tener Pandemia de Influenza si presenta: Tos Fiebre Dolor de Cabeza o dolor muscular Fatiga Vomito
PANDEMIA DE INFLUENZA Lo que la gente debe de saber SINTOMAS DE LA PANDEMIA DE INFLUENZA Usted podría tener Pandemia de Influenza si presenta: Tos Fiebre Dolor de Cabeza o dolor muscular Fatiga Vomito
50 kits de recolección de muestras con torunda multitest Aptima (N.º de catálogo PRD-03546) Cada kit contiene:
 Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
CONTROL DE CAMBIOS Y MEJORAS
 Página: 1 de 8 CONTROL DE CAMBIOS Y MEJORAS NIVEL DE REVISIÓN SECCIÓN Y/O PÁGINA DESCRIPCIÓN DE LA MODIFICACIÓN Y MEJORA FECHA DE MODIFICACIÓN 01 02 03 04 Elaboró Revisó Aprobó M. en C. María F. Cárdenas
Página: 1 de 8 CONTROL DE CAMBIOS Y MEJORAS NIVEL DE REVISIÓN SECCIÓN Y/O PÁGINA DESCRIPCIÓN DE LA MODIFICACIÓN Y MEJORA FECHA DE MODIFICACIÓN 01 02 03 04 Elaboró Revisó Aprobó M. en C. María F. Cárdenas
EQUIPAMIENTO DE APOYO, ASISTENCIA Y EMERGENCIA AERONAVES DE INSTRUCCIÓN AEROCLUB DE COLOMBIA ESCUELA DE AVIACION AEROCLUB DE COLOMBIA
 EQUIPAMIENTO DE APOYO, ASISTENCIA Y EMERGENCIA AERONAVES DE INSTRUCCIÓN AEROCLUB DE COLOMBIA ESCUELA DE AVIACION AEROCLUB DE COLOMBIA 2015 BOTIQUIN DE PRIMEROS AUXILIOS Los Botiquines de Primeros Auxilios
EQUIPAMIENTO DE APOYO, ASISTENCIA Y EMERGENCIA AERONAVES DE INSTRUCCIÓN AEROCLUB DE COLOMBIA ESCUELA DE AVIACION AEROCLUB DE COLOMBIA 2015 BOTIQUIN DE PRIMEROS AUXILIOS Los Botiquines de Primeros Auxilios
INSTRUCCIONES PARA AISLAMIENTO DE LEUCOCITOS A PARTIR DE SANGRE TOTAL
 INSTRUCCIONES PARA AISLAMIENTO DE LEUCOCITOS A PARTIR DE SANGRE TOTAL EL PRIMER PASO, ES LEER PRIMERO Y LUEGO SEGUIR TODAS LAS INSTRUCCIONES!!!!! ALFREDO URIBE ARDILA M.SC. REACTIVOS SOLUCION DEXTRAN-HEPARINA
INSTRUCCIONES PARA AISLAMIENTO DE LEUCOCITOS A PARTIR DE SANGRE TOTAL EL PRIMER PASO, ES LEER PRIMERO Y LUEGO SEGUIR TODAS LAS INSTRUCCIONES!!!!! ALFREDO URIBE ARDILA M.SC. REACTIVOS SOLUCION DEXTRAN-HEPARINA
Hoy estoy: Nuestro cuerpo
 Nombre: Fecha: Hoy estoy: Grado: Grupo: Nuestro cuerpo INTRODUCCIÓN Nuestro cuerpo nos permite hacer muchas cosas como caminar, jugar, respirar, comer y pensar. Lo podemos dividir en tres partes principales:
Nombre: Fecha: Hoy estoy: Grado: Grupo: Nuestro cuerpo INTRODUCCIÓN Nuestro cuerpo nos permite hacer muchas cosas como caminar, jugar, respirar, comer y pensar. Lo podemos dividir en tres partes principales:
APLICACIÓN DE HERBICIDAS CON PULVERIZADORA PARA EL CONTROL DE MALEZAS HERBACEAS Y ARBUSTIVAS
 PÁG: 1 de 6 1.- Alcance La presente instrucción de trabajo describe el modo de aplicación de herbicidas para el control de malezas herbáceas y arbustivas, mediante el uso de mochila pulverizadora manual.
PÁG: 1 de 6 1.- Alcance La presente instrucción de trabajo describe el modo de aplicación de herbicidas para el control de malezas herbáceas y arbustivas, mediante el uso de mochila pulverizadora manual.
GUIA DE INFORMACIÓN BASICA PARA EL CIUDADANO EN RELACION A LOS LABORATORIOS CLÍNICOS
 GUIA DE INFORMACIÓN BASICA PARA EL CIUDADANO EN RELACION A LOS LABORATORIOS CLÍNICOS los laboratorios del Área de Gestión Clínica de Biotecnología de la Empresa Pública Sanitaria Bajo Guadalquivir cubren
GUIA DE INFORMACIÓN BASICA PARA EL CIUDADANO EN RELACION A LOS LABORATORIOS CLÍNICOS los laboratorios del Área de Gestión Clínica de Biotecnología de la Empresa Pública Sanitaria Bajo Guadalquivir cubren
1. Lea las instrucciones en la etiqueta de la deferoxamina y verifique la fecha de vencimiento. 2. Vuelva a lavarse las manos.
 El médico ha decidido darle un medicamento llamado deferoxamina (Desferal ) para eliminar parte del exceso de hierro que se ha acumulado en el cuerpo de su hijo. La deferoxamina se une con el hierro y
El médico ha decidido darle un medicamento llamado deferoxamina (Desferal ) para eliminar parte del exceso de hierro que se ha acumulado en el cuerpo de su hijo. La deferoxamina se une con el hierro y
Gestión de Laboratorio Universidad Nacional del Nordeste Facultad de Ciencias Exactas y Naturales y Agrimensura Año:2014 Bioquímica: Hilda Salerno
 Gestión de Laboratorio Universidad Nacional del Nordeste Facultad de Ciencias Exactas y Naturales y Agrimensura Año:2014 Bioquímica: Hilda Salerno QUÉ ES UN RESIDUO PATOLÓGICO? Un residuo patológico es
Gestión de Laboratorio Universidad Nacional del Nordeste Facultad de Ciencias Exactas y Naturales y Agrimensura Año:2014 Bioquímica: Hilda Salerno QUÉ ES UN RESIDUO PATOLÓGICO? Un residuo patológico es
PRACTICA 2 TINCION DE GRAM
 PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
Prevención, Diagnóstico y Tratamiento de la Infección de Vías Urinarias No Complicada en Menores de 18 años en el Primero y Segundo Nivel de Atención
 Guía de Referencia Rápida Prevención, Diagnóstico y Tratamiento de la Infección de Vías Urinarias No Complicada en Menores de 18 años en el Primero y Segundo Nivel de Atención Guía de Referencia Rápida
Guía de Referencia Rápida Prevención, Diagnóstico y Tratamiento de la Infección de Vías Urinarias No Complicada en Menores de 18 años en el Primero y Segundo Nivel de Atención Guía de Referencia Rápida
Pauta de corrección guía IV medio Homeostasis
 Pauta de corrección guía IV medio Homeostasis Actividad 1.- Registra la temperatura ambiental en un día cada una hora. Así mismo registra la temperatura corporal que tu cuerpo tiene en cada hora. Grafica
Pauta de corrección guía IV medio Homeostasis Actividad 1.- Registra la temperatura ambiental en un día cada una hora. Así mismo registra la temperatura corporal que tu cuerpo tiene en cada hora. Grafica
Instrucciones de uso. TRULICITY (Tru-li-si-ti) (dulaglutide) inyección, para uso subcutáneo. Pluma de dosis única de 0.75 mg/0.
 Instrucciones de uso 1 TRULICITY (Tru-li-si-ti) (dulaglutide) inyección, para uso subcutáneo Pluma de dosis única de 0.75 mg/0.5 ml una vez por semana RETIRAR EL SELLO RETIRAR EL SELLO Abrir y aplanar
Instrucciones de uso 1 TRULICITY (Tru-li-si-ti) (dulaglutide) inyección, para uso subcutáneo Pluma de dosis única de 0.75 mg/0.5 ml una vez por semana RETIRAR EL SELLO RETIRAR EL SELLO Abrir y aplanar
DUCHA LAVA OJOS INOX AUTÓNOMA B-TEMP MODELO BD-570A
 DUCHA LAVA OJOS INOX AUTÓNOMA B-TEMP MODELO BD-570A Manual de procedimiento para carga de duchas autónomas de emergencia Steelpro INOX Para contar con el equipo autónomo listo para su operación es fundamental
DUCHA LAVA OJOS INOX AUTÓNOMA B-TEMP MODELO BD-570A Manual de procedimiento para carga de duchas autónomas de emergencia Steelpro INOX Para contar con el equipo autónomo listo para su operación es fundamental
-9 Ampolletas Colilert - Franelas - Bata
 El día jueves 24 de mayo del año en curso se realizaron las pruebas de calidad del agua, utilizando el Método de Quanty Tray. Materiales: Elaborado por: Bitelio Daniel Ordoñez González, Prestado de Servicio
El día jueves 24 de mayo del año en curso se realizaron las pruebas de calidad del agua, utilizando el Método de Quanty Tray. Materiales: Elaborado por: Bitelio Daniel Ordoñez González, Prestado de Servicio
PROTOCOLO DE ACTUACIÓN EN PRIMEROS AUXILIOS
 PROTOCOLO DE ACTUACIÓN EN PRIMEROS AUXILIOS 1 INTRODUCCIÓN Se entiende por Primeros Auxilios, los cuidados inmediatos, adecuados y provisionales prestados a las personas accidentadas. 2 ACTIVACIÓN DE UN
PROTOCOLO DE ACTUACIÓN EN PRIMEROS AUXILIOS 1 INTRODUCCIÓN Se entiende por Primeros Auxilios, los cuidados inmediatos, adecuados y provisionales prestados a las personas accidentadas. 2 ACTIVACIÓN DE UN
MATERIAL PARA LA TOMA DE MUESTRAS EN PAPEL FILTRO PARA ENFERMEDADES LISOSOMALES
 MATERIAL PARA LA TOMA DE MUESTRAS EN PAPEL FILTRO PARA ENFERMEDADES LISOSOMALES La toma de muestras de sangre en papel filtro es una técnica útil para el tamizaje de enfermedades lisosomales como: Enfermedad
MATERIAL PARA LA TOMA DE MUESTRAS EN PAPEL FILTRO PARA ENFERMEDADES LISOSOMALES La toma de muestras de sangre en papel filtro es una técnica útil para el tamizaje de enfermedades lisosomales como: Enfermedad
PRÁCTICO EXTRACCIÓN DE SANGRE (contenidos temáticos correspondientes al año lectivo 2016)
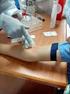 PRÁCTICO EXTRACCIÓN DE SANGRE (contenidos temáticos correspondientes al año lectivo 2016) DESCRIPCION DE LA ASIGNATURA En esta asignatura el estudiante adquiere conocimientos y procedimientos para la realización
PRÁCTICO EXTRACCIÓN DE SANGRE (contenidos temáticos correspondientes al año lectivo 2016) DESCRIPCION DE LA ASIGNATURA En esta asignatura el estudiante adquiere conocimientos y procedimientos para la realización
MANUAL DE INSTRUCCIONES PLANCHA A VAPOR ED-4583T
 MANUAL DE INSTRUCCIONES PLANCHA A VAPOR ED-4583T ESTIMADO CLIENTE Con el fin de que obtenga el mayor desempeño de su producto, por favor lea este manual de instrucciones cuidadosamente antes de comenzar
MANUAL DE INSTRUCCIONES PLANCHA A VAPOR ED-4583T ESTIMADO CLIENTE Con el fin de que obtenga el mayor desempeño de su producto, por favor lea este manual de instrucciones cuidadosamente antes de comenzar
LA HIGIENE DE MANOS NO ES UN CONCEPTO NUEVO
 Lic. Roxana Carranza Coronel DICIEMBRE 2014 LA HIGIENE DE MANOS NO ES UN CONCEPTO NUEVO 1861, Iganz Phillip Semmelweis impuso como practica sanitaria el lavado de manos antes y después de la atención de
Lic. Roxana Carranza Coronel DICIEMBRE 2014 LA HIGIENE DE MANOS NO ES UN CONCEPTO NUEVO 1861, Iganz Phillip Semmelweis impuso como practica sanitaria el lavado de manos antes y después de la atención de
TALLER VIA SUBCUTÁNEA. Equipos de Soporte de Atención Domiciliaria (ESAD) SERVICIO MURCIANO DE SALUD
 TALLER VIA SUBCUTÁNEA Equipos de Soporte de Atención Domiciliaria (ESAD) SERVICIO MURCIANO DE SALUD Elección de la vía de adm: Que permita autonomía al enfermo Fácil utilización Lo menos agresiva posible
TALLER VIA SUBCUTÁNEA Equipos de Soporte de Atención Domiciliaria (ESAD) SERVICIO MURCIANO DE SALUD Elección de la vía de adm: Que permita autonomía al enfermo Fácil utilización Lo menos agresiva posible
PROCEDIMIENTO PARA MANEJO Y ELIMINACIÓN DE RESIDUOS BIOLÓGICOS Facultad de Ciencias Biológicas
 Página 1 de 7 I. PROPÓSITO Este procedimiento establece los aspectos técnicos y administrativos relacionados al manejo y eliminación de los residuos biológicos con el fin de disminuir el riesgo para el
Página 1 de 7 I. PROPÓSITO Este procedimiento establece los aspectos técnicos y administrativos relacionados al manejo y eliminación de los residuos biológicos con el fin de disminuir el riesgo para el
Anexo V. Guías de Bioseguridad para el Manejo de Muestras en el. Síndrome Respiratorio Agudo y Grave (SRAS)
 nexo V Guías de Bioseguridad para el Manejo de Muestras en el Síndrome Respiratorio gudo y Grave (SRS) Traducido de WHO: Biosafety guidelines for handling of SRS specimens. http://www.who.int/csr/srs/biosafety2003_04_25/en/)
nexo V Guías de Bioseguridad para el Manejo de Muestras en el Síndrome Respiratorio gudo y Grave (SRS) Traducido de WHO: Biosafety guidelines for handling of SRS specimens. http://www.who.int/csr/srs/biosafety2003_04_25/en/)
La Sangre. Universidad Autónoma del Estado de Morelos Escuela de Técnicos Laboratoristas Anatomía y Fisiología
 La Sangre Universidad Autónoma del Estado de Morelos Escuela de Técnicos Laboratoristas Anatomía y Fisiología Alumna: Carpinteiro Morales Alexa Karina Semestre y grupo: 5to A2 Cuestionario 1.- Qué es la
La Sangre Universidad Autónoma del Estado de Morelos Escuela de Técnicos Laboratoristas Anatomía y Fisiología Alumna: Carpinteiro Morales Alexa Karina Semestre y grupo: 5to A2 Cuestionario 1.- Qué es la
Protocolo para el registro de la solicitud de. Colonoscopia diagnóstica
 Subdirección de Gestión Clínica y de Calidad Protocolo para el registro de la solicitud de Colonoscopia diagnóstica Elaborado por Área de Calidad Subdirección de Gestión Clínica y Calidad SESPA Página
Subdirección de Gestión Clínica y de Calidad Protocolo para el registro de la solicitud de Colonoscopia diagnóstica Elaborado por Área de Calidad Subdirección de Gestión Clínica y Calidad SESPA Página
Insumos y Medicamentos para Hospitalización y UCI
 PARA HOSPITALES EN EPIDEMIA DE INFLUENZA A H/N ATENCIÓN A PACIENTES EN TERAPIA INTENSIVA Ventiladores Monitores Bombas para infusión de soluciones parenterales Cascadas para los ventiladores Sistemas cerrados
PARA HOSPITALES EN EPIDEMIA DE INFLUENZA A H/N ATENCIÓN A PACIENTES EN TERAPIA INTENSIVA Ventiladores Monitores Bombas para infusión de soluciones parenterales Cascadas para los ventiladores Sistemas cerrados
TOMA DE MUESTRAS SANGUÍNEAS PARA EL LABORATORIO CLÍNICO Y VARIABILIDAD DE VALORES ANALÍTICOS MUESTRAS. Isabel Ramos Sevillano (Laboratorio)
 TOMA DE MUESTRAS SANGUÍNEAS PARA EL LABORATORIO CLÍNICO Y VARIABILIDAD DE VALORES ANALÍTICOS MUESTRAS Isabel Ramos Sevillano (Laboratorio) . INTRODUCCIÓN El laboratorio se utiliza como un medio de ayuda
TOMA DE MUESTRAS SANGUÍNEAS PARA EL LABORATORIO CLÍNICO Y VARIABILIDAD DE VALORES ANALÍTICOS MUESTRAS Isabel Ramos Sevillano (Laboratorio) . INTRODUCCIÓN El laboratorio se utiliza como un medio de ayuda
Fortel PROSTATE (PSA)
 Fortel PROSTATE (PSA) Test para Screening Simple, realizable y confidencial [Seleccione la fecha] Un test visual fácil, para detectar niveles anormales del Antígeno Prostático Específico (PSA), sobre rango
Fortel PROSTATE (PSA) Test para Screening Simple, realizable y confidencial [Seleccione la fecha] Un test visual fácil, para detectar niveles anormales del Antígeno Prostático Específico (PSA), sobre rango
PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN DE LAS COMPETENCIAS PROFESIONALES CUESTIONARIO DE AUTOEVALUACIÓN PARA LAS TRABAJADORAS Y TRABAJADORES
 MINISTERIO DE EDUCACIÓN SECRETARÍA DE ESTADO DE EDUCACIÓN Y FORMACIÓN PROFESIONAL DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN
MINISTERIO DE EDUCACIÓN SECRETARÍA DE ESTADO DE EDUCACIÓN Y FORMACIÓN PROFESIONAL DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN
Obsevación y recuento de células sanguíneas. Semestre B-2010
 1 Práctica 2 Obsevación y recuento de células sanguíneas Semestre B-2010 Introducción En la sangre se encuentran los leucocitos o glóbulos blancos que son las células móviles del sistema inmunitario. Todos
1 Práctica 2 Obsevación y recuento de células sanguíneas Semestre B-2010 Introducción En la sangre se encuentran los leucocitos o glóbulos blancos que son las células móviles del sistema inmunitario. Todos
HOSPITAL GENERAL REGIONAL IZTAPALAPA CLÍNICA DE CATÉTERES
 HOSPITAL GENERAL REGIONAL IZTAPALAPA CLÍNICA DE CATÉTERES El Gobierno del Distrito Federal a través de la Secretaria de Salud DF pone en marcha simultáneamente el 21 de Septiembre del 2011, las Clínicas
HOSPITAL GENERAL REGIONAL IZTAPALAPA CLÍNICA DE CATÉTERES El Gobierno del Distrito Federal a través de la Secretaria de Salud DF pone en marcha simultáneamente el 21 de Septiembre del 2011, las Clínicas
