ALGUNOS PROBLEMAS FUNDAMENTALES SOBRE LA COMBUSTIÓN DE OXIDANTES LÍQUIDOS EN HIDROGENO
|
|
|
- Carolina Navarro Aguilar
- hace 7 años
- Vistas:
Transcripción
1 ALGUNOS PROBLEMAS FUNDAMENTALES SOBRE LA COMBUSTIÓN DE OXIDANTES LÍQUIDOS EN HIDROGENO Por Carlos SÁNCHEZ TARIFA y Pedro PÉREZ DEL NOTARIO Dres. Ingenieros Aeronáuticos Este trabajo fue presentado en el XVII Internacional Astronauttcs Federar ion Congress. La investigación presentada en este trabajo ha sido desarrollada en < Instituto Nacional de Técnica Aeroespacial. patrocinada por la Air Forcé Office of Scientific Research bajo el contrato AF-EOAR a través de la European Office of Aerospace Research (OAR) de la Fuerza Aérea de los Estados Unidos, 1. Introducción. El hidrógeno es e! combustible de alta energía más importante en la tecnología ce os motores cohete. Motores cohete hidrógeno/oxigeno ya están siendo empleados y otro's sistemas de propulsantes líquidos que utilizan e! hidrógeno con diversos oxidantes, se encuentran en avanzado estado de desarrollo. El hidrógeno posee unas características físico-químicas muy particulares. Su presión crítica es desusadamente baja, del orden de la's 12 atmósferas, con el resultado de que es inyectado en las cámaras de combustión de los motores cohete en condiciones supercríticas. Con presiones superiores al valor crítico la tensión superficial se anula y. por consiguiente, no se pueden f:rmar gotas en el interior de la cámara de combustión, comportándose el hidrógeno como un fluido homogéneo, Por otra parte, la mayoría de los oxidantes tienen presiones críticas superiores a las n;rma!es de trabajo de! propulsante líquido de los motore'j cohets. Por consiguiente, el proceso básico en la cámara de combustión de un motor cohete es la combustión de un chorro de gotas de oxidante en atmósfera de hidrógeno. El objeto de este trabajo es el estudio del proceso de la combustión básica de gotas aislada's de un oxidante en atmósfera de hidrógen; en reposo. Existe abundante literatura sobre la combustión de gotas (por ejemplo, las ref, 1, 2. 3 y 4). La mayor parte de los estudios se refieren al caso de gotas de combustibles ardiendo en aire. Algunos de ellos consideran combustibles más exóticos de alta energía y hay sólo unos pocos trabajos sobre gotas de monopropulsantes. Por otra parte, no se han desarrollado estudios teóricos ni experimentales sobre la combustión de gotas de oxidantes en hidrógeno. La pequeña densidad y reducido peso molecular del hidrógeno, producen unas condiciones de difusión especialmente críticas y la suposición de utilizar valores medios para los coe-
2 ficientes de transporte despreciando la composición de la mezcla, lo cual se admite normalmente en los estudios de combustión, puede introducir errores importantes para el caso de hidrógeno según se demuestra en este trabajo, Alguno's resultados sobre la combustión de ácido nítrico y bromo fueron presentados por nosotros en las referencias 4 y 5. Estos estudios han sido completados y se ha incluido también la combustión de gotas de oxígeno. El bromo se seleccionó perqué la cinética química de la reacción 1HL-B,.;; es conocida, lo que permite una excelente oportunidad para el estudio de la influencia de la cinética química sobre la combustión de gotas. Se seleccionó el ácido nítrico por ser este oxidante líquido particularmente apropiado para llevar a cabo estudios experimentales, y, finalmente, se seleccionó el oxígeno a causa de su elevado interés técnico. Este último estudio es la aplicación de un estudio general 'sobre la llama de difusión hidrógeno-oxígeno con simetría esférica, mostrada en las referencias 6 y Modelo del proceso. Se estudia la combustión de gotas de oxidante en atmósfera de hidrógeno bajo las siguientes hipótesis. 1." Simetría esférica. Por consiguiente, se desprecian lo's efectos de convención natural, siempre pequeños en una atmósfera de hidrógeno. 2." Régimen estacionario. Se despreciará la velocidad de recesión de la superficie de la gota, comparada con las velocidades de difusión de las especies químicas, así como también se prescinde dei calor y tiempo requeridos para elevar la temperatura de la gota hasta la de 'su temperatura de ebullición. 3." Presión constante, puesto que prácticamente no varía en este tipo de procesos. 4." Se considerarán únicamente tres especies químicas: hidrógeno, oxidante y productos de reacción. La influencia de los radicales solamente aparecerá en la cinética química del proceso. 5." Se considerará una velocidad de reacción global para tener en cuenta la cinética química del proceso. Esta velocidad de reacción puede obtenerse del modelo completo de reacción química del proceso de combustión. 6." Se supondrá una variación lineal de la densidad y conductividad térmica del gas en función de la composición de la mezcla. 3. Ecuaciones fundamentales. Las ecuaciones fundamentales del proceso se expresarán en función de las variables adimensionales: C P 1 ffl e = -^-ít-t fl)l [2] ir y'se supondrá una reacción de combustión global de la forma: v, M, + v, M 2 = v 3 M 3, 3 ] Bajo dichas hipótesis y en función de x y í) las ecuaciones fundamentales se expresan en la forma: a) Continuidad que expresa la conservación de la masa de cada especie química i. dx MlJ * l U
3 b) Energía. (e, - 1) " s +«1 + í*i-l) X rffl 7 rf x í) = O. [5] Esta ecuación expresa que la suma de los flujos de calor y entalpia es constante. Esta constante se ha obtenido expresando que en la superficie de la gota el calor recibido por la misma se utiliza en la evaporación del líquido. En dicha ecuación el parámetro Ou es: < i*] El calor de reacción normalizado q a f viene dado por; ra d) Difusión. Suponiendo que solamente exista difusión por concentración resulta Y; j m 9li. Ii dy rfy t í i Í/Y M Y ; rf x V X = 0, [8! en la que L es el número de Lewis-Semenov, expresado en la forma: L u = c r ftí Q U Pí e) Condiciones de contorno. Las condiciones de contorno son las siguientes: En la superficie de la gota: X =x. 0=0, s = 1» h s = B^ = Q [10] En el infinito: x = 0 8 = Y, = K <s> Y; = V 0» «6 1 a = 0» Y 8 = Y 3 «["] 4. Solución del sistema. Se resolverá el problema, en primer lugar, admitiendo una velocidad de reacción infinita, lo cual es equivalente a suponer una zona de reacción de espesor cero. Esta es la ya conocida hipótesis de Burke y Schuman para el estudio de las llamas de difusión comprobándose que proporciona una buena aproximación en los procesos de combustión de gotas siempre que éstas no sean excesivamente pequeñas o la presión demasiado' baja. En este caso en que el hidrógeno es la atmósfera reactante con un peso molecular mucho menor que el de la gota oxidante, se consideró que la influencia de la composición de la mezcla sobre el valor de la
4 densidad y conductividad térmica podría ser de una gran importancia. Por consiguiente, se tomaron variaciones lineales de la densidad y conductividad térmica en función de la fracción másica de los productos de combustión, en la forma: PtJ *Í3 Y 3 [12] l Con la hipótesis de Burke-Schuman el problema tiene una solución analítica exacta: La fracción másica y la temperatura vienen dadas por: Zona o ^ x ^ x x :^i^e4 L»'*-^< Y - V»M ; [14].r'" s- "* = r % B -y» c a +g M Y i OH + í>js 5 > B u = (f " +í23»> r c +g»v,?,, 0, _ /,, _.,, \ fl >»i/''a ''i r - V r L o - V 1 L» ( f!i +?23 E 3 m) í~ / J_ y* V "twási L 5J v» v l "0 l v J v l) " I c l» '3 c 23 T^ 23 3 a> I c i3 ^ ^211 ' 3 1 L 3=»--Y3K, Csj + g'ssys J L C 23 + S S V, J [15] Zona x ^ x* í x s!3( A '-- Y S)^ el3( Y 3 S- V 3) [16] o s + o» [ Y «V " x c,,4-g V, á,ll ' a CuL " ri7].v 3, e + ír»y t, La velocidad adímensional de combustión x s ; M, 4 TC /. r 4 se obtiene expresando en las ecuaciones anteriores que para x = x s es, J =Q S. La posición del frente de llama x = x* y temperatura máxima 0* se obtienen mediante la condición de que para x = x* es Y :í = i. Del valor de x s se obtiene la constante de evaporación k, igual a la pendiente de la curva r- ; = f (t), por medio de la expresión d r l m k= =. [19] di 4 T j %.. Resultados teóricos para vina velocidad de reacción infinita. Los resultados teóricos de la velocidad de combustión adimensíonal x s, constante de evaporación h y relación del radio de la gota/radío de la llama r*/ r s se obtuvieron para gotas de ácido nítrico, bromo y oxígeno admitiendo una velocidad de reacción infinita. Les resultados se muestran en la Tabla núm. i, en la cual se incluyen también a título comparativo resultados correspondientes a la combustión de gotas de hidrocarburos en aire, así como algunas ctras combinaciones propulsantes representativas. Como puede verse, la combustión en hidrógeno es considerablemente más rápida y la llama se halla mucho más próxima a la superficie de la gota que en otras combinaciones propulsantes Se representa también en la Tabla la influencia, verdaderamente importante para el cas: de combus-
5 tión de gotas de oxígeno en hidrógeno, de considerar constantes o variables los valores de la densidad del gas y coeficientes de transporte en función de la composición de la mezcla. TABLA N." i. Velocidad de combustión, constantes de evaporación y relación del radio de la llama al de la gota. Velocidad de combustión adimensional Constantes de evaporación drt rit, cm.! /seg. Relación radio >ota.'radio llama r x r s Gotas de oxigeno en hidrógeno (coeficientes de transporte constantes) 4.00 i.27 x 10 -» 2,10 Gotas de oxígeno en hidrógeno (coeficientes de transporte variables) 2,80 5,79 X Gotas de ácido nítrico en hidrógeno (teórico) 1, X 10- ;i 1.53 Gotas de ácido nítrico en hidrógeno (experimental) 6.5 X 10- A 1.30 (promedio) Gotas de bromo en hidrógeno (teórico") X 10- ;í N-hepta.no en aire (experimental) 2.7 X 10- ;i * 3.10 Benceno en aire (experimenta!) 2,50 X 10-* * 3,0 Alcohol etílico en aire (experimental) 1,98 X 10-3* 3.5 Hidracfria en hidrógeno (experimental T, = 920" C.)... 1,70 X 10-8 * % 5,0* Hidracina en nitrógeno (experimental, TM = 700" C.)... 2,70 X H)- ;l * == 6,0* Datos tomados de resultados experimentales realizados ei> el INTA. 6. Velocidad de reacción finita. Los sistemas de ecuaciones diferenciales [4, 5 y 8] se revolvieron para el caso velocidad de reacción finita utilizando el método analítico aproximado descrito en las ref. 4 y 5. Para la aplicación de este método se precisa una velocidad de reacción global, no pudíendo, por consiguiente, utilizarse en los cas:s de ácido nítrico y oxígeno para los cuales no se disponía de tal velocidad de reacción. Para la reacción bromo-hidrógeno se adoptó el modelo de reacción de Campbell y Hirschtelder, del cual se obtiene la velocidad de reacción global (ver ref. 5). Los resultados '-e obtuvieron en función del prcducto adimensional de la presión multiplicada por el radio de la gota, en la forma: [20] = -^=4(Q'V<r,). [21] en la que el parámetro íl viene dado por H = X1C'M,(M I /M 1 ) (RT y ) - 3/2 - i [22]
6 Los valores de A s y r V. se representan en las figuras i y 2, en las cuales también se incluyen los de las gotas de acido nítrico y oxigeno paia el caso de una ve'ocidad de reacción infinita Los resu tados muestran que para el caso del bromo, la combustión de gotas no existe por debajo de un valor mínimo de la presión o del radio de la gota ( ) Asimismo se puede observar que los lesultados por encima de este valor tienden rápidamente hacia los que e han obtenido, suponiendo una velocidad de reacción infinita X\ / \ ;\ \BR 0M0 g 6 / Y VELOC ;idad D i REACCIÓN Fl vllta 1 OXIGENO ACIDO NÍTRICO 1 - Fig 1 Velocidad de combustión en hidrogeno del bromo oxígeno y ácido nítrico RADIO DE LAS GOTAS (ADIMENSIONAL) p OXIGENO -, i I 2 3 yo Q< 1fi y \ \ / VELC CIDAD _BR 0M0 ACIDO NÍTRICO - DE REA CCION -INITA Fig 2. Relación del radio de la llama al radio de la gofa para el oxígeno, el bromo y ácido nítrico QÍ pl r s RADIO DE LAS GOTAS (ADIMENSIONAL) (*) Esta conclusión se estableció en la ict 4 de un mojo geneial paia combustión de gotas considerando cmet ca química Imita
7 Fig. 3. Datos experimentales de la combustión de gotas de ácido nítrico en Iq atmósfera de hidrógeno 85 V. ACIDO NÍTRICO 98 V. ACIDO NÍTRICO A.N.(TEORICO) 5- K-S.aKKT'cmVfeeg K=6.5»10" 3 cmvseg k= 4.4*10^ cmvseg 7. Resultados experimentales. Los resultados experimentales se obtuvieron observando la combustión de gotas suspendidas de una delgada fibra de cuarzo en una cámara llena de hidrógeno. Se tomaron datos fotográficos del diámetro de 'ias gotas y de la llama en función del tiempo para diferentes valores de la presión. Estos estudios experimentales, únicamente fueron realizados para las gotas de ácido nítrico y bromo, a causa de que no fue posible realizar este trabajo experimental con gotas de oxígeno. Los resultados experimentales para las gotas de ácido nítrico se representan en las figuras 3, y los 1.50 " , TIEMPO (SESJ RADIO DE LAS GOTAS r mm. s 0.75 Ignición, f = 0 Combustión explosiva f = 1/50 seg Fig. 4. Gota de bromo ardiendo en atmósfera de hidrógeno, p = 5,5 atm. resultadcs teóricos en ía tabla núm 1, en la que puede comprobarse que ambos resultados concuerdan razonablemente. Según se muestra en la fotografía de la figura 4, obtenida con una máquina cinematográfica de alta velocidad, la combustión de gotas de bromo en el hidrógeno es de tipo explosivo. Un tipo de combustión similar se ha observado alguna's veces en partículas de metal, no existiendo hasta el momento una explicación clara de este fenómeno. En nuestro caso, y debido a este tipo de combustión explosiva, la ccmparación entre los resultados teórico's y experimentales no pudo llevarse a efecto.
8 8. Conclusiones. a) El proceso de la combustión de oxidantes líquidos con hidrógeno acontece como la combustión de un chorro de gotas de oxidante en una atmósfera homogénea de hidrógeno. b) La combustión de gotas oxidantes en hidrógeno es mucho más rápida que la combj.s-ión ce gotas de la mayor parte de las combinaciones usuales de propulsantes. c) La llama de hidrógeno-oxigeno se sitúa muy próxima a la superficie de la gota oxidante. d) Cuando se calcula la combustión de oxidantes líquidos en hidrógeno es importante tener en cuenta la variación de la densidad del gas y coeficientes de transporte en función de la composición de la mezcla. Lista de los principales símbolos D calor molar a presión constante (constante). coeficiente de difusión. i x = velocidad de reacción. = coordenada adimensioual. : gasto inásico. y, = fracción de masa de ia especie /. peso molecular, = fracción del flujo de la especie I. presión. valor medio de ia conductividad térmica. calor molar de evaporación del oxidante coeficientes estoquioniétricos. calor molar de reacción, = valor medio de densidad de las especies t i. radio. temperatura adimensioual. SUBÍNDICES ] 2 3 = oxidante, hidrógeno y productos de reacción, respectivamente. s en la superficie de la gota, REFERENCIAS GODSAVE, G. A. E.: Studies of llic Combustión of Drops in a Fuel Spray. Fourth Symposium (International) on Combustión, LORELL, J: WISE, H., and CARI;, R. S.: Steady State Biiniing of a Liquid Droplet mth Fiuite Reaction Kiuetics. Proceeding of the Gas Dynamic Symposium on Aerothermochemistry, Evaston III, 1956, SÁNCHEZ TARIFA, C. and PÉREZ DEL NOTARIO, P.: A Tlieoretical Investiyatiou on the Combustión of Liquid Bipropeüaut Droplcts, Instituto Nacional de Técnica Aeronáutica, Madrid, Spain, ARDC Contract No. AF 61 (052)-221 AFOSR TN SÁNCHEZ TARIFA, C,; PÉREZ DEL NOTARIO, P., and GARCÍA MORENO, F.: Combustión of Liquid Monopropellants und Bipropellants in Droplets, Eight. Symposium (International) on Combustión, Combustión of Btomine and Nitric Acid Droplets in a liydrogen Atmospliere. Instituto Nacional de Técnica Aeroespacial. Madrid. Spain, EOAR Contract AF ól (052) 221, AFOSR TN PÉREZ DEL NOTARIO, P. and SÁNCHEZ TARIFA, C.: On the Slrneture of Premixcd and Diffusiou Laminar Splierico-Symmctrical Fiamos, Ninth Symposium (International) on Combustión, SÁNCHEZ TARIFA, C.: Hybrid Combustión and Fíame Structurcs. Instituto Nacional de Técnica Aeroespacial, Madrid, Spain, 1966, EOAR Contrate 61-70, Report final.
INGENIERO. JOSMERY SÁNCHEZ
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA
 PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA OBJETIVO GENERAL: Familiarizar al alumno con los sistemas de torres de refrigeración para evacuar el calor excedente del agua. OBJETIVOS ESPECÍFICOS: Investigar
PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA OBJETIVO GENERAL: Familiarizar al alumno con los sistemas de torres de refrigeración para evacuar el calor excedente del agua. OBJETIVOS ESPECÍFICOS: Investigar
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
Universidad Nacional de Córdoba. Facultad de Ciencias Exactas Físicas y Naturales. Cátedra de Mecánica de los Fluidos. Carrea de Ingeniería Civil
 Universidad Nacional de Córdoba Facultad de Ciencias Exactas Físicas y Naturales Cátedra de Mecánica de los Fluidos Carrea de Ingeniería Civil FLUJO COMPRESIBLE DR. ING. CARLOS MARCELO GARCÍA 2011 A modo
Universidad Nacional de Córdoba Facultad de Ciencias Exactas Físicas y Naturales Cátedra de Mecánica de los Fluidos Carrea de Ingeniería Civil FLUJO COMPRESIBLE DR. ING. CARLOS MARCELO GARCÍA 2011 A modo
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor. Webpage: Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
C: GASES Y PRESIÓN DE VAPOR DEL AGUA
 hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
Unidad 0 CÁLCULOS QUÍMICOS. Unidad 0. Cálculos químicos
 Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
Capítulo 10. Efectos de superficie. Sistema respiratorio
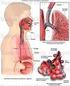 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
EJEMPLOS DE PREGUNTA. Prueba de QUÍMICA. febrero 2010
 EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
APÉNDICE I. Calibración de la señal cromatográfica como función de la concentración: Sistema Ternario
 APÉNDICE I Calibración de la señal cromatográfica como función de la concentración: Sistema Ternario En este apéndice se muestra la información correspondiente a la elaboración de las diferentes curvas
APÉNDICE I Calibración de la señal cromatográfica como función de la concentración: Sistema Ternario En este apéndice se muestra la información correspondiente a la elaboración de las diferentes curvas
TEMA 1: SISTEMAS MODELADOS POR ECUACIONES DIFERENCIALES EN INGENIERÍA QUÍMICA. CLASIFICACIÓN. GENERALIDADES.
 TEMA 1: SISTEMAS MODELADOS POR ECUACIONES DIFERENCIALES EN INGENIERÍA QUÍMICA. CLASIFICACIÓN. GENERALIDADES. 1. INTRODUCCIÓN. PLANTEAMIENTO DE PROBLEMAS EN INGENIERÍA QUÍMICA 2. PROBLEMAS EXPRESADOS MEDIANTE
TEMA 1: SISTEMAS MODELADOS POR ECUACIONES DIFERENCIALES EN INGENIERÍA QUÍMICA. CLASIFICACIÓN. GENERALIDADES. 1. INTRODUCCIÓN. PLANTEAMIENTO DE PROBLEMAS EN INGENIERÍA QUÍMICA 2. PROBLEMAS EXPRESADOS MEDIANTE
BALANCES DE MASA Y ENERGÍA CAPITULO 1: BALANCES DE MATERIALES
 BALANCES DE MASA Y ENERGÍA CAPITULO 1: BALANCES DE MATERIALES 1.1 INTRODUCCION Proceso: Cualquier operación o serie de operaciones que produce un cambio físico o químico en una sustancia o en una mezcla
BALANCES DE MASA Y ENERGÍA CAPITULO 1: BALANCES DE MATERIALES 1.1 INTRODUCCION Proceso: Cualquier operación o serie de operaciones que produce un cambio físico o químico en una sustancia o en una mezcla
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
de aire. Determinar la composicion de la mezcla resultante. Cuál es el porcentaje en exceso de aire, suponiendo conversion completa?
 C A P Í T U L O 2 Dada la importancia que tienen los procesos de combustión en la generación de contaminantes, en este capítulo se han incluido algunos ejercicios relacionados con la combustión estequiométrica.
C A P Í T U L O 2 Dada la importancia que tienen los procesos de combustión en la generación de contaminantes, en este capítulo se han incluido algunos ejercicios relacionados con la combustión estequiométrica.
TUTORIAL BÁSICO DE MECÁNICA FLUIDOS
 TUTORIAL BÁSICO DE MECÁNICA FLUIDOS El tutorial es básico pues como habréis visto en muchos de ellos es haceros entender no sólo la aplicación práctica de cada teoría sino su propia existencia y justificación.
TUTORIAL BÁSICO DE MECÁNICA FLUIDOS El tutorial es básico pues como habréis visto en muchos de ellos es haceros entender no sólo la aplicación práctica de cada teoría sino su propia existencia y justificación.
TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR
 TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR El calor: Es una forma de energía en tránsito. La Termodinámica y La Transferencia de calor. Diferencias. TERMODINAMICA 1er. Principio.Permite determinar
TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR El calor: Es una forma de energía en tránsito. La Termodinámica y La Transferencia de calor. Diferencias. TERMODINAMICA 1er. Principio.Permite determinar
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea.
 Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMA 3: CINÉTICA HOMOGÉNEA. REACCIONES SIMPLES CQA-3/1
 TEMA 3: CINÉTICA HOMOGÉNEA. REACCIONES SIMPLES CQA-3/1 CARACTERÍSTICAS DE LAS REACCIONES HOMOGÉNEAS Todas las sustancias reaccionantes se encuentran en una sola fase Velocidad de reacción: Objetivo principal
TEMA 3: CINÉTICA HOMOGÉNEA. REACCIONES SIMPLES CQA-3/1 CARACTERÍSTICAS DE LAS REACCIONES HOMOGÉNEAS Todas las sustancias reaccionantes se encuentran en una sola fase Velocidad de reacción: Objetivo principal
DEPARTAMENTO DE INGENIERÍA QUÍMICA. Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESTADO NO ESTACIONARIO
 DEPARAMENO DE INGENIERÍA QUÍMICA Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESADO NO ESACIONARIO 1. INRODUCCIÓN El sistema al que se va a plantear el balance de energía calorífica consiste
DEPARAMENO DE INGENIERÍA QUÍMICA Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESADO NO ESACIONARIO 1. INRODUCCIÓN El sistema al que se va a plantear el balance de energía calorífica consiste
Anejo 1. Teoría de Airy. Solución lineal de la ecuación de ondas.
 Anejo 1. Teoría de Airy. Solución lineal de la ecuación de ondas. Introducción y ecuaciones que rigen la propagación del oleaje. La propagación de oleaje en un fluido es un proceso no lineal. Podemos tratar
Anejo 1. Teoría de Airy. Solución lineal de la ecuación de ondas. Introducción y ecuaciones que rigen la propagación del oleaje. La propagación de oleaje en un fluido es un proceso no lineal. Podemos tratar
TEMA 5. MAGNITUDES FISICAS Y UNIDADES DE MEDIDA. 4ª. PARTE
 1 TEMA 5. MAGNITUDES FISICAS Y UNIDADES DE MEDIDA. 4ª. PARTE Mario Melo Araya Ex Profesor Universidad de Chile melomarioqca@gmail.com 11. EQUIVALENCIAS Y CONVERSION DE UNIDADES DE MEDIDA. Para toda magnitud
1 TEMA 5. MAGNITUDES FISICAS Y UNIDADES DE MEDIDA. 4ª. PARTE Mario Melo Araya Ex Profesor Universidad de Chile melomarioqca@gmail.com 11. EQUIVALENCIAS Y CONVERSION DE UNIDADES DE MEDIDA. Para toda magnitud
Contenidos mínimos Física y Química 3º ESO
 Contenidos mínimos Física y Química 3º ESO EL TRABAJO CIENTÍFICO Etapas del método científico. Magnitudes y unidades. Cambio de unidades. Sistema Internacional de Unidades (SI). Representación de gráficas
Contenidos mínimos Física y Química 3º ESO EL TRABAJO CIENTÍFICO Etapas del método científico. Magnitudes y unidades. Cambio de unidades. Sistema Internacional de Unidades (SI). Representación de gráficas
T 1 T 2. x L. Con frecuencia es importante el valor de la resistencia térmica multiplicado por el área de flujo de calor, en este caso sera
 1. ey de Fourier ué flujo de calor es necesario hacer pasar a través de una barra circular de madera de 5 cm de diámetro y 10 cm de longitud, cuya temperatura en los extremos es de 50 C y 10 C en sus extremos?
1. ey de Fourier ué flujo de calor es necesario hacer pasar a través de una barra circular de madera de 5 cm de diámetro y 10 cm de longitud, cuya temperatura en los extremos es de 50 C y 10 C en sus extremos?
Problemas de Potencial Eléctrico. Boletín 2 Tema 2
 1/22 Problemas de Potencial Eléctrico Boletín 2 Tema 2 Fátima Masot Conde Ing. Industrial 21/11 Problema 1 Ocho partículas con una carga de 2 nc cada una están uniformemente distribuidas sobre el perímetro
1/22 Problemas de Potencial Eléctrico Boletín 2 Tema 2 Fátima Masot Conde Ing. Industrial 21/11 Problema 1 Ocho partículas con una carga de 2 nc cada una están uniformemente distribuidas sobre el perímetro
GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES
 GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES Área Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento lógico y
GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES Área Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento lógico y
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
Existen tres formas de transferencia metálica: 1. Transferencia Spray o de Rocío. 2. Transferencia Globular. 3. Transferencia por Corto-Circuito.
 SISTEMA MIG SÓLIDO Descripción del proceso El sistema MIG fue introducido a fines del año 1940. El proceso es definido por la AWS como un proceso de soldadura al arco, donde la fusión se produce por calentamiento
SISTEMA MIG SÓLIDO Descripción del proceso El sistema MIG fue introducido a fines del año 1940. El proceso es definido por la AWS como un proceso de soldadura al arco, donde la fusión se produce por calentamiento
AHORRO DE ENERGÍA EN UNA CALDERA UTILIZANDO
 AHORRO DE ENERÍA EN UNA CALDERA UTILIZANDO ECONOMIZADORES Javier Armijo C., ilberto Salas C. Facultad de Química e Ingeniería Química, Universidad Nacional Mayor de San Marcos Resumen En el presente trabajo
AHORRO DE ENERÍA EN UNA CALDERA UTILIZANDO ECONOMIZADORES Javier Armijo C., ilberto Salas C. Facultad de Química e Ingeniería Química, Universidad Nacional Mayor de San Marcos Resumen En el presente trabajo
LABORATORIO 6. TITULO : Propiedades de los Gases
 37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
REGIMENES DE CORRIENTES O FLUJOS
 LINEAS DE CORRIENTE Ø Las líneas de corriente son líneas imaginarias dibujadas a través de un fluido en movimiento y que indican la dirección de éste en los diversos puntos del flujo de fluidos. Ø Una
LINEAS DE CORRIENTE Ø Las líneas de corriente son líneas imaginarias dibujadas a través de un fluido en movimiento y que indican la dirección de éste en los diversos puntos del flujo de fluidos. Ø Una
Ejercicios relacionados con líquidos y sólidos
 Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
INDICE 1.- CÁLCULO DE CHIMENEA DE EVACUACIÓN DE HUMOS SEGÚN LA NORMA EN DATOS DE PARTIDA... 2
 INDICE 1.- CÁLCULO DE CHIMENEA DE EVACUACIÓN DE HUMOS SEGÚN LA NORMA EN 13384-1.... 2 1.1.- DATOS DE PARTIDA.... 2 1.2.- CAUDAL DE LOS PRODUCTOS DE COMBUSTIÓN.... 2 1.3.- DENSIDAD MEDIA DE LOS HUMOS...
INDICE 1.- CÁLCULO DE CHIMENEA DE EVACUACIÓN DE HUMOS SEGÚN LA NORMA EN 13384-1.... 2 1.1.- DATOS DE PARTIDA.... 2 1.2.- CAUDAL DE LOS PRODUCTOS DE COMBUSTIÓN.... 2 1.3.- DENSIDAD MEDIA DE LOS HUMOS...
FOURIER Y NEWTON). LEY DE FICK PARA DIFUSIÓN
 INTRODUCCIÓN. SEMEJANZA ENTRE TRANSFERENCIA DE MASA, CALOR Y MOMENTO (LEYES DE FICK, FOURIER Y NEWTON). LEY DE FICK PARA DIFUSIÓN MOLECULAR. E-mail: williamsscm@hotmail.com TRANSFERENCIA DE MASAS El transporte
INTRODUCCIÓN. SEMEJANZA ENTRE TRANSFERENCIA DE MASA, CALOR Y MOMENTO (LEYES DE FICK, FOURIER Y NEWTON). LEY DE FICK PARA DIFUSIÓN MOLECULAR. E-mail: williamsscm@hotmail.com TRANSFERENCIA DE MASAS El transporte
Destilación - Método del polo de operación II. Problemas. Problemas de Operaciones Unitarias II Ingeniería Química 1
 Destilación - Método del polo de operación II Problemas PROBLEMA 1. A una columna de agotamiento como la indicada en la figura, ingresa una mezcla etanol/agua en su punto de burbuja, de composición 50
Destilación - Método del polo de operación II Problemas PROBLEMA 1. A una columna de agotamiento como la indicada en la figura, ingresa una mezcla etanol/agua en su punto de burbuja, de composición 50
Prácticas de Laboratorio de Hidráulica
 Universidad Politécnica de Madrid E.T.S. Ingenieros de Caminos, Canales y Puertos Prácticas de Laboratorio de Hidráulica Jaime García Palacios Francisco V. Laguna Peñuelas 2010 Índice general 3. Venturi
Universidad Politécnica de Madrid E.T.S. Ingenieros de Caminos, Canales y Puertos Prácticas de Laboratorio de Hidráulica Jaime García Palacios Francisco V. Laguna Peñuelas 2010 Índice general 3. Venturi
EFECTO DEL CALOR SOBRE LA MATERIA
 EFECTO DEL CALOR SOBRE LA MATERIA MATERIA: es todo aquello que ocupa un lugar en el espacio y tiene masa LOS EFECTOS QUE PRODUCE EL CALOR SOBRE LA MATERIA SE PUEDEN CLASIFICAR EN: * CAMBIOS FÍSICOS. *
EFECTO DEL CALOR SOBRE LA MATERIA MATERIA: es todo aquello que ocupa un lugar en el espacio y tiene masa LOS EFECTOS QUE PRODUCE EL CALOR SOBRE LA MATERIA SE PUEDEN CLASIFICAR EN: * CAMBIOS FÍSICOS. *
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1)
 PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO.
 LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
Formatos para prácticas de laboratorio
 CARRERA PLAN DE ESTUDIO CLAVE DE UNIDAD DE APRENDIZAJE NOMBRE DE LA UNIDAD DE APRENDIZAJE ING. MECÁNICO 2009-2 12198 MECÁNICA DE FLUIDOS PRÁCTICA No. MF-04 LABORATORIO DE NOMBRE DE LA PRÁCTICA MECÁNICA
CARRERA PLAN DE ESTUDIO CLAVE DE UNIDAD DE APRENDIZAJE NOMBRE DE LA UNIDAD DE APRENDIZAJE ING. MECÁNICO 2009-2 12198 MECÁNICA DE FLUIDOS PRÁCTICA No. MF-04 LABORATORIO DE NOMBRE DE LA PRÁCTICA MECÁNICA
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
Datos ELV, Fracciones molares de n-c 6 H 14, 1 atm x (líquido) 0,0 0,1 0,3 0,5 0,55 0,7 1,0 y (vapor) 0,0 0,36 0,70 0,85 0,90 0,95 1,0 Sigue
 Método del polo de operación (I) - Destilación Problemas PROBLEMA 1*. Cierta cantidad de una mezcla de vapor de alcohol etílico y agua, 50 % molar, a una temperatura de 190 ºF, se enfría hasta su punto
Método del polo de operación (I) - Destilación Problemas PROBLEMA 1*. Cierta cantidad de una mezcla de vapor de alcohol etílico y agua, 50 % molar, a una temperatura de 190 ºF, se enfría hasta su punto
Conceptos de combustión y combustibles
 Jornada sobre CALDERAS EFICIENTES EN PROCESOS INDUSTRIALES Conceptos de combustión y combustibles José M. Domínguez Cerdeira Prescripción - Promoción del Gas Gas Natural Distribución SDG, S.A. Madrid,
Jornada sobre CALDERAS EFICIENTES EN PROCESOS INDUSTRIALES Conceptos de combustión y combustibles José M. Domínguez Cerdeira Prescripción - Promoción del Gas Gas Natural Distribución SDG, S.A. Madrid,
Las sustancias reaccionan entre sí. REACCIÓN QUÍMICA: proceso en el cual una o varias sustancias cambian para formar sustancias nuevas
 Las sustancias reaccionan entre sí. REACCIÓN QUÍMICA: proceso en el cual una o varias sustancias cambian para formar sustancias nuevas LEY DE LAVOISIER: Los átomos no se crean ni se destruyen durante cualquier
Las sustancias reaccionan entre sí. REACCIÓN QUÍMICA: proceso en el cual una o varias sustancias cambian para formar sustancias nuevas LEY DE LAVOISIER: Los átomos no se crean ni se destruyen durante cualquier
5. Datos de las inspecciones
 5. Datos de las inspecciones Inspección 1: Fecha: 14 de febrero de 2014 Hora: 8:00h Características de los elementos a analizar: 1. Puerta metálica de uno de los almacenes - Material: Chapa metálica pintada.
5. Datos de las inspecciones Inspección 1: Fecha: 14 de febrero de 2014 Hora: 8:00h Características de los elementos a analizar: 1. Puerta metálica de uno de los almacenes - Material: Chapa metálica pintada.
FÍSICA Y QUÍMICA 4º ESO. MCU. Características. Magnitudes angulares. Ley del movimiento.
 FÍSICA Y QUÍMICA 4º ESO Unidad 1. El movimiento Sistema de referencia. o Carácter relativo del movimiento. Conceptos básicos para describir el movimiento. o Trayectoria, posición, desplazamiento. o Clasificación
FÍSICA Y QUÍMICA 4º ESO Unidad 1. El movimiento Sistema de referencia. o Carácter relativo del movimiento. Conceptos básicos para describir el movimiento. o Trayectoria, posición, desplazamiento. o Clasificación
Sustancias puras, procesos de cambios de fase, diagramas de fase. Estado 3 Estado 4 Estado 5. P =1 atm T= 100 o C. Estado 3 Estado 4.
 TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
CAPITULO 5 PROCESO DE SECADO. Se entiende por secado de alimentos la extracción deliberada del agua que contienen,
 CAPITULO 5 PROCESO DE SECADO 5.1 SECADO DE ALIMENTOS Se entiende por secado de alimentos la extracción deliberada del agua que contienen, operación que se lleva a cabo en la mayoría de los casos evaporando
CAPITULO 5 PROCESO DE SECADO 5.1 SECADO DE ALIMENTOS Se entiende por secado de alimentos la extracción deliberada del agua que contienen, operación que se lleva a cabo en la mayoría de los casos evaporando
El tubo De Vénturi. Introducción
 El tubo De Vénturi Recopilado a partir de http://www.monografias.com/trabajos6/tube/tube.shtml por: Jose Carlos Suarez Barbuzano. Técnico Superior Química Ambiental. Técnico del Centro Canario del Agua
El tubo De Vénturi Recopilado a partir de http://www.monografias.com/trabajos6/tube/tube.shtml por: Jose Carlos Suarez Barbuzano. Técnico Superior Química Ambiental. Técnico del Centro Canario del Agua
Apuntes de Electroquímica
 Voltametría La ecuación de Butler Volmer, j = j 0 [e (1 )f e f ], relaciona la densidad de corriente, j, que fluye a través de un electrodo con el sobrepotencial,. Se trata de una expresión que surge al
Voltametría La ecuación de Butler Volmer, j = j 0 [e (1 )f e f ], relaciona la densidad de corriente, j, que fluye a través de un electrodo con el sobrepotencial,. Se trata de una expresión que surge al
Flujo en canales abiertos
 cnicas y algoritmos empleados en estudios hidrológicos e hidráulicos Montevideo - Agosto 010 PROGRAMA DE FORMACIÓN IBEROAMERICANO EN MATERIA DE AGUAS Flujo en canales abiertos Luis Teixeira Profesor Titular,
cnicas y algoritmos empleados en estudios hidrológicos e hidráulicos Montevideo - Agosto 010 PROGRAMA DE FORMACIÓN IBEROAMERICANO EN MATERIA DE AGUAS Flujo en canales abiertos Luis Teixeira Profesor Titular,
BARCO A VAPOR TERMODINÁMICO. INTEGRANTES: Bibiana Rodríguez Laura Liliana Triana Carlos Alberto Chinome
 BARCO A VAPOR TERMODINÁMICO INTEGRANTES: Bibiana Rodríguez Laura Liliana Triana Carlos Alberto Chinome PLANTEAMIENTO DEL PROBLEMA Continuando con la promoción y desarrollo de la cátedra de termodinámica
BARCO A VAPOR TERMODINÁMICO INTEGRANTES: Bibiana Rodríguez Laura Liliana Triana Carlos Alberto Chinome PLANTEAMIENTO DEL PROBLEMA Continuando con la promoción y desarrollo de la cátedra de termodinámica
E.E.T. Nº9. Físico-Química de 2do año. Guía Nº3. Profesor: Alumno: Curso:
 E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
GUIA DE PROBLEMAS. Velocidad de aproximación al equilibrio = kr(c-ceq)
 GUIA DE PROBLEMAS 1. La conversión de hidrógeno molecular de la forma orto a la forma para es catalizada por NiO. Se dipone de un catalizador soportado con un área específica de 305 m 2 /g y un volumen
GUIA DE PROBLEMAS 1. La conversión de hidrógeno molecular de la forma orto a la forma para es catalizada por NiO. Se dipone de un catalizador soportado con un área específica de 305 m 2 /g y un volumen
QUÍMICA. La MATERIA REPRESENTACIÓN. Observación Datos Ley Hipótesis Teoría DEFINICIONES BÁSICAS. Propiedades
 QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
El ejemplo que a continuación se detalla no pertenece a ninguna empresa en particular, pretende ser una aclaración a lo detallado en esta guía.
 CAPÍTULO 1 Introducción 1.1 INTRODUCCIÓN Se recomienda la lectura de este capítulo una vez leído el correspondiente a su instalación afectada en el anexo I de la Directiva 2003/87 y que a su vez ha sido
CAPÍTULO 1 Introducción 1.1 INTRODUCCIÓN Se recomienda la lectura de este capítulo una vez leído el correspondiente a su instalación afectada en el anexo I de la Directiva 2003/87 y que a su vez ha sido
UNIDAD 1 La materia y sus cambios
 UNIDAD 1 La materia y sus cambios Tema 1.3 Propiedades características de las sustancias: físicas, organolépticas, químicas; intensivas y extensivas. NMLV 1 Propiedades de las sustancias Organolépticas
UNIDAD 1 La materia y sus cambios Tema 1.3 Propiedades características de las sustancias: físicas, organolépticas, químicas; intensivas y extensivas. NMLV 1 Propiedades de las sustancias Organolépticas
ANEXO 7: ANÁLISIS FÍSICO-QUÍMICO DE LA BIOMASA UTILIZADA
 ANEXO 7: ANÁLISIS FÍSICO-QUÍMICO DE LA BIOMASA UTILIZADA 93 1.7. ANÁLISIS FÍSICO-QUÍMICO DE LA BIOMASA UTILIZADA. SARMIENTO DE VID. 1.7.1 Análisis Químico: Ensayos experimentales - Celulosa---------------------
ANEXO 7: ANÁLISIS FÍSICO-QUÍMICO DE LA BIOMASA UTILIZADA 93 1.7. ANÁLISIS FÍSICO-QUÍMICO DE LA BIOMASA UTILIZADA. SARMIENTO DE VID. 1.7.1 Análisis Químico: Ensayos experimentales - Celulosa---------------------
Índice Matemáticas 11
 5 Índice Índice Matemáticas 11 I. Símbolos, operaciones aritméticas, leyes 12 1. Símbolos generales 12 2. Símbolos de la teoría de conjuntos 12 3. Símbolos de lógica 12 4. Operaciones artiméticas 13 5.
5 Índice Índice Matemáticas 11 I. Símbolos, operaciones aritméticas, leyes 12 1. Símbolos generales 12 2. Símbolos de la teoría de conjuntos 12 3. Símbolos de lógica 12 4. Operaciones artiméticas 13 5.
Revista de actualidad de Higiene y Seguridad Laboral editada por la Cámara Argentina de Seguridad
 Revista de actualidad de Higiene y Seguridad Laboral editada por la Cámara Argentina de Seguridad www.cas-seguridad.org.ar/revista_ahora.htm Explosiones la importancia de conocer sus características principales
Revista de actualidad de Higiene y Seguridad Laboral editada por la Cámara Argentina de Seguridad www.cas-seguridad.org.ar/revista_ahora.htm Explosiones la importancia de conocer sus características principales
Para la solución de algunos de los ejercicios propuestos, se adjunta una parte del sistema periódico hasta el elemento Nº 20.
 Programa Estándar Anual Nº Guía práctica Estequiometría I: leyes y conceptos de la estequiometría Ejercicios PSU Para la solución de algunos de los ejercicios propuestos, se adjunta una parte del sistema
Programa Estándar Anual Nº Guía práctica Estequiometría I: leyes y conceptos de la estequiometría Ejercicios PSU Para la solución de algunos de los ejercicios propuestos, se adjunta una parte del sistema
CAPITULO 6. Análisis Dimensional y Semejanza Dinámica
 CAPITULO 6. Análisis Dimensional y Semejanza Dinámica Debido a que son pocos los flujos reales que pueden ser resueltos con exactitud sólo mediante métodos analíticos, el desarrollo de la mecánica de fluidos
CAPITULO 6. Análisis Dimensional y Semejanza Dinámica Debido a que son pocos los flujos reales que pueden ser resueltos con exactitud sólo mediante métodos analíticos, el desarrollo de la mecánica de fluidos
Conceptos básicos en estequiometría
 Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
LABORATORIO DE FENÓMENOS COLECTIVOS
 LABORATORIO DE FENÓMENOS COLECTIVOS LA VISCOSIDAD DE LOS LÍQUIDOS CRUZ DE SAN PEDRO JULIO CÉSAR RESUMEN La finalidad de esta práctica es la determinación de la viscosidad de diferentes sustancias (agua,
LABORATORIO DE FENÓMENOS COLECTIVOS LA VISCOSIDAD DE LOS LÍQUIDOS CRUZ DE SAN PEDRO JULIO CÉSAR RESUMEN La finalidad de esta práctica es la determinación de la viscosidad de diferentes sustancias (agua,
M A R I A N O B A Q U E R O DPTO. DE FÍSICA Y QUÍMICA EJERCICIOS RESUELTOS
 I E S M A R I A N O B A Q U E R O DPTO. DE FÍSICA Y QUÍMICA EJERCICIOS RESUELTOS Índice general 1. El átomo y el enlace 6 2. Leyes básicas de la Química 9 b1fq-res-atomo.tex 1. El átomo y el enlace Unidad
I E S M A R I A N O B A Q U E R O DPTO. DE FÍSICA Y QUÍMICA EJERCICIOS RESUELTOS Índice general 1. El átomo y el enlace 6 2. Leyes básicas de la Química 9 b1fq-res-atomo.tex 1. El átomo y el enlace Unidad
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES. Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile
 Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
Solución: Según Avogadro, 1 mol de cualquier gas, medido en condiciones normales ocupa 22,4 L. Así pues, manteniendo la relación: =1,34 mol CH 4
 Ejercicios Física y Química Primer Trimestre 1. Calcula los moles de gas metano CH 4 que habrá en 30 litros del mismo, medidos en condiciones normales. Según Avogadro, 1 mol de cualquier gas, medido en
Ejercicios Física y Química Primer Trimestre 1. Calcula los moles de gas metano CH 4 que habrá en 30 litros del mismo, medidos en condiciones normales. Según Avogadro, 1 mol de cualquier gas, medido en
TEMA 2: LEYES Y CONCEPTOS BÁSICOS EN QUÍMICA
 1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo.
 Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo. N 2 g 3 H 2 g 2 NH 3 g 2 NH 3 g N 2 g 3 H 2 g concentración H 2 N 2 NH 3 concentración NH 3 H 2
Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo. N 2 g 3 H 2 g 2 NH 3 g 2 NH 3 g N 2 g 3 H 2 g concentración H 2 N 2 NH 3 concentración NH 3 H 2
Operaciones Básicas de Transferencia de Materia Problemas Tema 6
 1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
4. DIFUSION EN SÓLIDO
 4. DIFUSION EN SÓLIDO MATERIALES 13/14 ÍNDICE 1. Conceptos generales. Mecanismos de difusión. 3. Leyes de Fick. 1. Estado estacionario.. Estado no estacionario. 4. Factores de difusión. 5. Aplicaciones
4. DIFUSION EN SÓLIDO MATERIALES 13/14 ÍNDICE 1. Conceptos generales. Mecanismos de difusión. 3. Leyes de Fick. 1. Estado estacionario.. Estado no estacionario. 4. Factores de difusión. 5. Aplicaciones
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
DIVISIÓN DE INGENIERIAS DEPARTAMENTO DE INGENIERÍA QUÍMICA PROGRAMA DE ASIGNATURA
 CENTRO UNIVERSITARIO DE CIENCIAS EXACTAS E INGENIERIAS DIVISIÓN DE INGENIERIAS DEPARTAMENTO DE INGENIERÍA QUÍMICA PROGRAMA DE ASIGNATURA NOMBRE DE MATERIA TERMODINÁMICA QUÍMICA CLAVE DE MATERIA DEPARTAMENTO
CENTRO UNIVERSITARIO DE CIENCIAS EXACTAS E INGENIERIAS DIVISIÓN DE INGENIERIAS DEPARTAMENTO DE INGENIERÍA QUÍMICA PROGRAMA DE ASIGNATURA NOMBRE DE MATERIA TERMODINÁMICA QUÍMICA CLAVE DE MATERIA DEPARTAMENTO
Física y Química 1ºBachillerato Ejemplo Examen. Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Ioduro de Calcio:
 Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13
 CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
Relaciones de masa en las reacciones químicas
 Relaciones de masa en las reacciones químicas Capítulo 3 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Micro-mundo Átomos y moléculas Macro-mundo gramos La
Relaciones de masa en las reacciones químicas Capítulo 3 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Micro-mundo Átomos y moléculas Macro-mundo gramos La
Mecánica de Fluidos. Análisis Diferencial
 Mecánica de Fluidos Análisis Diferencial Análisis Diferencial: Descripción y caracterización del flujo en función de la descripción de una partícula genérica del flujo. 1. Introducción 2. Movimiento de
Mecánica de Fluidos Análisis Diferencial Análisis Diferencial: Descripción y caracterización del flujo en función de la descripción de una partícula genérica del flujo. 1. Introducción 2. Movimiento de
1.- La materia y clasificación. La materia es cualquier cosa que ocupa un espacio y tiene masas Estados: sólido, líquido, gaseoso
 La Química La Química se encarga del estudio de las propiedades de la materia y de los cambios que en ella se producen. La Química es una ciencia cuantitativa y requiere el uso de mediciones. Las cantidades
La Química La Química se encarga del estudio de las propiedades de la materia y de los cambios que en ella se producen. La Química es una ciencia cuantitativa y requiere el uso de mediciones. Las cantidades
Estequiometría y Leyes Ponderales
 Estequiometría y Leyes Ponderales Equipo de Educación en Química Verde Centro Interdisciplinario de Líquidos Iónicos Programa de Educación Continua para el Magisterio Introducción Leyes fundamentales de
Estequiometría y Leyes Ponderales Equipo de Educación en Química Verde Centro Interdisciplinario de Líquidos Iónicos Programa de Educación Continua para el Magisterio Introducción Leyes fundamentales de
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 8 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 5, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 8 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 5, Opción B Reserva 3, Ejercicio
UNIVERSIDAD NACIONAL DEL SUR 1
 UNIVERSIDAD NACIONAL DEL SUR 1 PROGRAMA DE: Termodinámica Química para Ingeniería CODIGO: 6479 H O R A S D E C L A S E P R O F E S O R R E S P O N S A B L E T E O R I C A S P R A C T I C A S Dra. Susana
UNIVERSIDAD NACIONAL DEL SUR 1 PROGRAMA DE: Termodinámica Química para Ingeniería CODIGO: 6479 H O R A S D E C L A S E P R O F E S O R R E S P O N S A B L E T E O R I C A S P R A C T I C A S Dra. Susana
Ventajas de las puertas de madera maciza.
 Ventajas de las puertas de madera maciza. POR ANDRÉS CÁCERES G. Las puertas macizas tienen muchas ventajas respecto a las puertas huecas, es por esto que está justificado su mayor precio. Su densidad tiene
Ventajas de las puertas de madera maciza. POR ANDRÉS CÁCERES G. Las puertas macizas tienen muchas ventajas respecto a las puertas huecas, es por esto que está justificado su mayor precio. Su densidad tiene
Física para Ciencias: Principio de Arquímedes, Ecuaciones de Continuidad y Bernoulli.
 Física para Ciencias: Principio de Arquímedes, Ecuaciones de Continuidad y Bernoulli. Dictado por: Profesor Aldo Valcarce 1 er semestre 2014 Presión de un fluido Presión depende de la profundidad P = ρ
Física para Ciencias: Principio de Arquímedes, Ecuaciones de Continuidad y Bernoulli. Dictado por: Profesor Aldo Valcarce 1 er semestre 2014 Presión de un fluido Presión depende de la profundidad P = ρ
LA DINAMO TACOMETRICA: COMO ESCOGER EL SENSOR DE VELOCIDAD
 1 Introducción LA DINAMO TACOMETRICA: COMO ESCOGER EL SENSOR DE VELOCIDAD Desde hace unos años, el proceso de control de las máquinas rotativas eléctricas ha experimentado un gran número de cambios, a
1 Introducción LA DINAMO TACOMETRICA: COMO ESCOGER EL SENSOR DE VELOCIDAD Desde hace unos años, el proceso de control de las máquinas rotativas eléctricas ha experimentado un gran número de cambios, a
Shell Térmico Oil B. Aceite para transferencia térmica
 Shell Térmico B es un aceite mineral puro de baja viscosidad, baja tensión de vapor y alta resistencia a la oxidación desarrollado para transferencia de calor ya sea en sistemas de calefacción cerrados
Shell Térmico B es un aceite mineral puro de baja viscosidad, baja tensión de vapor y alta resistencia a la oxidación desarrollado para transferencia de calor ya sea en sistemas de calefacción cerrados
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
2003, Ernesto de Jesús Alcañiz
 2003, Ernesto de Jesús Alcañiz 5 Gases y líquidos 5.1 La teoría cinético-molecular de los gases 5.2 Predicciones de la teoría cinético-molecular 5.3 Los gases reales: ecuación de Van der Waals 5.4 Propiedades
2003, Ernesto de Jesús Alcañiz 5 Gases y líquidos 5.1 La teoría cinético-molecular de los gases 5.2 Predicciones de la teoría cinético-molecular 5.3 Los gases reales: ecuación de Van der Waals 5.4 Propiedades
Otros métodos de separación de componentes de una solución:
 Industrias II Destilación Filmina 1 DESTILACION Definición Método para separar componentes de una solución líquida (binaria, ternaria, etc.) Vaporización parcial Distribución de sustancias en una fase
Industrias II Destilación Filmina 1 DESTILACION Definición Método para separar componentes de una solución líquida (binaria, ternaria, etc.) Vaporización parcial Distribución de sustancias en una fase
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2009 PRIMERA PARTE
 1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN ÍNDICE
 CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
ANEXO 1. DEPARTAMENTO DE: Química. ASIGNATURA: Química Tecnológica. CARRERAS - PLAN: Licenciatura en Química - Plan 1997.
 1 Corresponde al Anexo I de la Resolución N 93/02 ANEXO 1 DEPARTAMENTO DE: Química ASIGNATURA: Química Tecnológica. CARRERAS - PLAN: Licenciatura en Química - Plan 1997 CURSO: Cuarto REGIMEN: Cuatrimestral
1 Corresponde al Anexo I de la Resolución N 93/02 ANEXO 1 DEPARTAMENTO DE: Química ASIGNATURA: Química Tecnológica. CARRERAS - PLAN: Licenciatura en Química - Plan 1997 CURSO: Cuarto REGIMEN: Cuatrimestral
Soluciones. DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I)
 Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
Estudio de la combustión en motores diesel
 Estudio de la combustión en motores diesel 1. EL PROCESO DE COMBUSTIÓN La Combustión es una reacción termoquímica muy rápida entre el oxígeno del aire y el combustible, para formar teóricamente CO 2 y
Estudio de la combustión en motores diesel 1. EL PROCESO DE COMBUSTIÓN La Combustión es una reacción termoquímica muy rápida entre el oxígeno del aire y el combustible, para formar teóricamente CO 2 y
GF750: Guía Experimental. Colapso de un cilindro sujeto a gravedad y rotación.
 GF750: Guía Experimental. Colapso de un cilindro sujeto a gravedad y rotación. 21 de abril de 2010 1. Introducción En este experimento haremos uso de la mesa rotatoria (con capacidad de girar en el rango
GF750: Guía Experimental. Colapso de un cilindro sujeto a gravedad y rotación. 21 de abril de 2010 1. Introducción En este experimento haremos uso de la mesa rotatoria (con capacidad de girar en el rango
LEYES FUNDAMENTALES DE LA QUÍMICA
 LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
