RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. 1. NOMBRE DEL MEDICAMENTO INNOHEP UI anti-xa/ml solución inyectable en jeringas
|
|
|
- Purificación Rosa Villalobos de la Fuente
- hace 6 años
- Vistas:
Transcripción
1 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO INNOHEP UI anti-xa/ml solución inyectable en jeringas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una jeringa contiene UI anti Xa/ml de tinzaparina sódica. Para consultar la lista completa de excipientes ver sección FORMA FARMACÉUTICA Solución inyectable. Jeringa de 0,5 ml que contiene un líquido incoloro o de color pajizo, carente de turbidez y de material que deposita al dejar la jeringa en reposo. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas - Prevención de la enfermedad tromboembólica en pacientes sometidos a cirugía general u ortopédica. - Prevención de la enfermedad tromboembólica en pacientes no quirúrgicos con riesgo elevado o moderado. - Prevención de la coagulación en el sistema extracorpóreo en los circuitos de hemodiálisis, en pacientes sin riesgo hemorrágico conocido. 4.2 Posología y forma de administración Las diferentes heparinas de bajo peso molecular, no son necesariamente equivalentes. En consecuencia, se debe respetar la dosificación y el modo de empleo específico de cada una de ellas. Prevención de la enfermedad tromboembólica en pacientes quirúrgicos: Cirugía general en pacientes con riesgo moderado de tromboembolismo venoso: En el día de la intervención, UI anti-xa, subcutáneamente, dos horas antes de la operación y a continuación, UI una vez al día durante 7-10 días. Cirugía ortopédica en pacientes con riesgo elevado de tromboembolismo venoso: En pacientes con un peso comprendido entre 60 y 90 kg, se administrará por vía subcutánea UI anti-xa, 12 horas antes de la intervención y a continuación UI anti-xa diariamente, durante el post-operatorio. En pacientes con un peso superior a 90 kg o inferior a 60 kg, o si la profilaxis comienza dos horas antes de la intervención, se administrarán 50 UI anti-xa por kg de peso corporal como dosis inicial, seguidas de 50 UI anti-xa por kg de peso corporal una vez al día. En ambos casos la duración del tratamiento será de 7 a 10 días. Prevención de la enfermedad tromboembólica en pacientes no quirúrgicos: La posología recomendada es de UI anti-xa/día en pacientes con riesgo moderado o UI anti-xa/día en pacientes con riesgo elevado, por vía subcutánea. La duración del tratamiento coincidirá con la duración del riesgo tromboembólico, siempre según criterio médico. Prevención de la coagulación en el sistema extracorpóreo en los circuitos de hemodiálisis, en pacientes sin riesgo hemorrágico conocido: CORREO ELECTRÓNICO Sugerencias_ft@aemps.es C/ CAMPEZO, 1 EDIFICIO MADRID
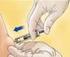
2 INNOHEP se administra en bolo en la línea arterial del dializador (o intravenosamente) al inicio de la diálisis. La dosis debe ajustarse individualmente teniendo en cuenta las características del paciente, así como las condiciones técnicas en las que se realiza la diálisis. Dosis inicial recomendada en hemodiálisis UI anti-xa en bolo. Ajuste de la dosis Si se produce un efecto anticoagulante insuficiente (formación de coágulos en los captadores de burbujas) la dosis en bolo puede aumentarse, en las sucesivas sesiones de diálisis, en intervalos de 500 UI anti-xa hasta alcanzar la dosis satisfactoria. Si se produce un sangrado prolongado a nivel de la cánula, la dosis en bolo puede reducirse, en las sucesivas sesiones de diálisis, en intervalos de 500 UI anti-xa hasta alcanzar la dosis satisfactoria. La experiencia clínica que se posee con tinzaparina ha demostrado que se obtienen resultados satisfactorios en el 90% de los pacientes con dosis comprendidas entre UI anti-xa y UI anti-xa. Cuando se utiliza la pauta posológica anterior, no es necesario añadir un anticoagulante a la solución salina utilizada para cebar el dializador. Niños: No existe experiencia de su uso en niños. Forma de administración de la inyección subcutánea: Coger un pliegue de piel, sin presionar, entre los dedos pulgar e índice de una mano. Manteniendo este pliegue, insertar la aguja perpendicularmente al pliegue de la piel con la otra mano, es decir, en ángulo recto con la piel. Introducir cuidadosamente la aguja e inyectar lentamente la dosis necesaria en el tejido graso de la piel. Retirar la aguja después de la inyección y soltar la piel. 4.3 Contraindicaciones - Hipersensibilidad al principio activo, heparinas o a alguno de los excipientes. - Presencia o historia de trombocitopenia (tipo II) asociada a heparina. - Hipertensión grave no controlada. - Endocarditis séptica. - Insuficiencia hepática grave. - Procesos hemorrágicos activos (úlcera gastroduodenal, hemorragias intracraneales o intraoculares u otros). - Infarto cerebral hemorrágico. - Diátesis hemorrágica (congénita o adquirida), deficiencia de factores de la coagulación y trombocitopenia grave. - Cirugía que afecte al cerebro, médula espinal u ojos. - Aborto inminente (ver sección 4.6). 4.4 Advertencias y precauciones especiales de empleo INNOHEP debe administrarse con precaución a pacientes con:
3 - Insuficiencia renal o hepática. Deben monitorizarse los niveles de actividad anti-xa en pacientes con insuficiencia renal grave. - Hipertensión arterial no controlada. - Historia de úlcera péptica u otras lesiones susceptibles de sangrar. - Retinopatía o hemorragia vítrea. En pacientes sometidos a anestesia epidural o espinal o a punción lumbar, la administración de heparinas con fines profilácticos se ha asociado muy raramente a la aparición de hematomas epidurales o espinales, con el resultado final de parálisis prolongada o permanente. Este riesgo se incrementa por el uso de catéteres epidurales o espinales para anestesia, la administración concomitante de medicamentos con efecto sobre la coagulación como antiinflamatorios no esteroídicos (AINEs), antiagregantes plaquetarios o anticoagulantes, y por las punciones traumáticas o repetidas. A la hora de decidir el intervalo de tiempo que debe transcurrir entre la administración de una heparina a dosis profilácticas y la inserción o retirada de un catéter espinal o epidural, deben tenerse en cuenta las características del paciente y del producto, debiendo de transcurrir al menos doce horas. Una vez insertado o retirado el catéter, deberán transcurrir al menos cuatro horas hasta la administración de una nueva dosis de heparina. La siguiente dosis deberá retrasarse hasta que la intervención quirúrgica haya finalizado. Si bajo criterio médico se decide administrar tratamiento anticoagulante durante un procedimiento anestésico espinal o epidural, debe extremarse la vigilancia del paciente para detectar precozmente cualquier signo o síntoma de deterioro neurológico, como dolor lumbar, déficit sensorial y motor (entumecimiento y debilidad de extremidades inferiores) y trastornos funcionales del intestino o vejiga. El personal de enfermería debe ser entrenado para detectar tales signos y síntomas. Asimismo, se advertirá a los pacientes que informen inmediatamente al médico o personal de enfermería si experimentan cualquiera de los síntomas antes descritos. Si se sospecha la aparición de algún signo o síntoma sugestivo de hematoma espinal o epidural, deben realizarse las pruebas diagnósticas con carácter de urgencia e instaurar el tratamiento adecuado, incluyendo la descompresión medular. Como precaución, se recomienda un recuento de plaquetas antes de iniciar el tratamiento y a continuación, dos veces a la semana durante el tratamiento. Se debe emplear con precaución en ancianos. No debe administrarse por inyección intramuscular. Debido al mayor riesgo de sangrado, la administración intramuscular de otros fármacos debe evitarse siempre que sea posible. 4.5 Interacción con otros otras formas de interacción La administración simultánea de medicamentos que actúan sobre la hemostasia, como por ejemplo, AINE s, ácido acetilsalicílico, salicilatos, antagonistas de la vitamina K, dipiridamol y dextranos, debe realizarse con precaución en pacientes tratados con INNOHEP.
4 La interacción de la heparina con la nitroglicerina administrada intravenosamente (que puede disminuir la eficacia de la heparina), no debe descartarse para la tinzaparina. Los medicamentos que aumentan la concentración sérica de potasio solo deben ser administrados bajo estricto control médico. 4.6 Embarazo y lactancia El tratamiento con anticoagulantes de mujeres embarazadas debe realizarse bajo la supervisión de un especialista. En un número limitado de mujeres embarazadas tratadas con tinzaparina (637), los datos obtenidos no mostraron un riesgo adicional durante el embarazo, o sobre la salud del feto o del recién-nacido. Hasta la fecha, no se dispone de otros datos epidemiológicos relevantes. En dos estudios clínicos, no se observó el paso de tinzaparina a través de la placenta. Los datos en animales no indican efectos nocivos directos o indirectos sobre el embarazo, el desarrollo embriofetal, el parto o el desarrollo postnatal (ver Sección 5.3). Debe tenerse precaución a la hora de prescribir tinzaparina a mujeres embarazadas. No existen datos disponibles relativos al periodo de lactancia. Mujeres embarazadas con válvulas cardiacas implantadas: Se han comunicado fallos terapéuticos en mujeres embarazadas con válvulas cardiacas implantadas tratadas con dosis anticoagulantes completas de tinzaparina y otras heparinas de bajo peso molecular. No se recomienda la utilización de tinzaparina en mujeres embarazadas con válvulas cardiacas implantadas. Al no existir información clara sobre la dosificación, eficacia y seguridad en estas circunstancias, cualquier tentativa de anticoagular a estas pacientes deberá ser llevada a cabo solo por médicos con los debidos conocimientos y experiencia en esta área clínica, y únicamente si no se dispone de una alternativa más segura. Esta contraindicado el tratamiento con INNOHEP en mujeres con riesgo de aborto inminente (ver sección 4.3). La anestesia epidural durante el parto en mujeres embarazadas tratadas con dosis profilácticas de heparinas de bajo peso molecular debe ser monitorizada por especialistas (ver sección 4.4). 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas La influencia de INNOHEP sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. 4.8 Reacciones adversas Se ha empleado la terminología siguiente con el fin de clasificar las frecuencias de las reacciones adversas: Muy frecuente >1/10 Frecuente > 1/100 a <1/10 Poco frecuente >1/1,000 a <1/100 Rara >1/10,000 a <1/1,000 Muy rara <1/10,000 Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
5 Las reacciones adversas comunicadas más frecuentemente son episodios de sangrado, aumento reversible de los niveles de enzimas hepáticas, trombocitopenia reversible y diversos tipos de reacciones cutáneas. Basándose en el conjunto de los resultados de estudios, de un programa de ensayos clínicos, que incluían a aproximadamente pacientes, las reacciones locales tras la administración subcutánea, tales como irritación, hematomas y equimosis, se identificaron en aproximadamente un 16% de los pacientes. El riesgo de sangrado total fue de aproximadamente un 10%, mientras que el riesgo de sangrados mayores fue de aproximadamente un 0,8%. En aproximadamente un 8% de los pacientes se identificó un aumento reversible en los niveles de enzimas hepáticos y una trombocitopenia reversible en aproximadamente un 1% de los pacientes, siendo la incidencia de trombocitopenia grave del 0,13%. Trastornos vasculares Frecuente: Hemorragias (piel, mucosas, heridas, gastro-intestinal, urogenital). Pueden producirse complicaciones hemorrágicas, que pueden afectar a cualquier órgano, en particular cuando se administran altas dosis. Se han comunicado casos raros de reacciones adversas graves a INNOHEP tales como hematoma epidural o subdural o hemorragia intracraneal. Estos hematomas han tenido como resultado final diferentes grados de deterioro neurológico, incluyendo parálisis prolongada o permanente (ver Sección 4.4: Advertencias y precauciones especiales de empleo). Se han comunicado casos raros de hemorragia retroperitoneal y metrorragias. Trastornos de la sangre y del sistema linfático Frecuente: Trombocitopenia (tipo I) Raro: Trombocitopenia inducida por heparina (THI), probablemente de naturaleza inmuno-alérgica (tipo II). Trastornos hepatobiliares Frecuente: Niveles elevados de transaminasas, gamma-gt, LDH y lipasas. Estos aumentos son reversibles una vez se suspende la administración del fármaco. Trastornos generales y alteraciones en el lugar de administración Muy frecuente: Reacciones en el lugar de inyección. Puede producirse irritación local en el lugar de inyección. Trastornos del sistema inmunológico Raro: Reacciones alérgicas. Raro: Angioedema. Se han comunicado casos raros de reacciones anafilactoideas. Trastornos de la piel y del tejido subcutáneo Frecuente: Rash. Raro: Urticaria. Raro: Prurito.
6 Raro: Necrosis cutánea. Se han notificado diversos tipos de rash, tales como rash eritematoso y maculopapular. Se han notificado casos raros de necrólisis epidérmica y síndrome de Stevens-Johnson. Trastornos del metabolismo y la nutrición Muy raro: Puede producirse hipoaldosteronismo, asociado a hiperkalemia y acidosis metabólica (especialmente en pacientes con insuficiencia renal y diabetes mellitus). Trastornos del aparato reproductor y de la mama Muy raro: Priapismo. Efectos de clase, aceptados como atribuibles a todos los compuestos de la clase: Se han notificado casos de pérdida transitoria de cabello y osteoporosis, relacionados con el tratamiento con heparina no fraccionada. 4.9 Sobredosis Hemorragia es el signo y síntoma principal de sobredosis con tinzaparina. Si se produce hemorragia debe suspenderse el tratamiento con INNOHEP, dependiendo de la gravedad de la hemorragia y del riesgo de trombosis. En casos de hemorragia grave, la tinzaparina puede ser neutralizada con protamina. Después de la administración subcutánea de diferentes dosis de tinzaparina, la actividad anti-iia se neutraliza hasta un 85% y la actividad anti-xa hasta un 60% (47-74%), con la administración intravenosa de sulfato de protamina (1 mg por 100 UI anti-xa de tinzaparina). Pueden ser necesarias dosis repetidas de protamina o una infusión continua. Debe señalarse que la sobredosificación con protamina tiene un efecto anticoagulante por si mismo y que la protamina puede causar reacciones anafilácticas. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: Tinzaparina Código ATC: B 01 AB 10 La tinzaparina sódica es una heparina de bajo peso molecular de origen porcino con una relación anti-xa/anti-iia entre 1,5 y 2,5. La tinzaparina sódica se obtiene mediante despolimerización enzimática de la heparina convencional no fraccionada. Como la heparina convencional, tinzaparina sódica actúa como anticoagulante potenciando la inhibición de la antitrombina III sobre los factores de la coagulación activados, principalmente el factor Xa. La actividad biológica de tinzaparina sódica está estandarizada frente al primer Estándar Internacional para Heparinas de Bajo Peso Molecular y se expresa en unidades internacionales (UI) anti-xa. La actividad anti-xa de la tinzaparina sódica no es inferior a 70 y no superior a 120 UI/mg. La actividad anti-iia de la tinzaparina sódica es de aproximadamente 55 UI/mg. El peso molecular medio de la tinzaparina sódica es de El porcentaje de cadenas de peso molecular inferior a es menor al 10%. El porcentaje de cadenas entre y oscila entre el 60,0 y el 72,0 % (media 66%). El porcentaje de cadenas de peso molecular por encima de oscila entre el 22,0 y el 36,0 %.
7 En pacientes sometidos a hemodiálisis crónica intermitente, tratados con las dosis recomendadas, el valor medio de la actividad anti-xa plasmática fue de 0,61 UI/ml, a las dos horas de la administración. 5.2 Propiedades farmacocinéticas La actividad anti-xa máxima se alcanza 4-6 horas después de la inyección subcutánea. La vida media de eliminación de la actividad anti-xa tras inyección intravenosa es de aproximadamente 90 minutos. La biodisponibilidad de la actividad anti-xa es del 90%. Debido a la prolongada semivida biológica de INNOHEP, es suficiente administrarlo una vez al día. Tinzaparina sufre un metabolismo menor en el hígado mediante despolimerización y se excreta a través de los riñones en forma inalterada o casi inalterada. Se ha estudiado la farmacocinética de innohep durante el embarazo. Los datos de la monitorización farmacocinética secuencial de 55 gestaciones sugieren que las propiedades farmacocinéticas no difieren en relación a pacientes no gestantes. Se observó una leve, aunque no estadísticamente significativa, disminución de los niveles anti-xa a medida que avanzaba la gestación. Se recomienda la monitorización de los niveles máximos anti-xa durante las 4 horas siguientes a la administración de tinzaparina. En particular, durante las primeras semanas de tratamiento y en las últimas etapas del embarazo. 5.3 Datos preclínicos sobre seguridad En general la heparina y las heparinas de bajo peso molecular son sólo ligeramente tóxicas y ello es aplicable también a la tinzaparina sódica. El efecto más importante observado en los estudios de toxicidad aguda, subaguda y crónica, toxicidad sobre la reproducción y mutagenicidad, es la hemorragia causada por la administración de dosis muy elevadas. Después de la administración intramuscular de heparinas de bajo peso molecular en animales, se observó un hematoma necrosante. En un estudio de 12 meses de duración en ratas se observaron efectos de osteoporosis. Estudios en ratas y conejos no han detectado un potencial teratógeno para la heparina de bajo peso molecular a dosis de hasta 25 mg/kg de peso. Los fetos que fueron expuestos prenatalmente a 10 mg/kg de peso presentaban un peso corporal más bajo que los controles. 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Acetato de sodio y agua para preparaciones inyectables. Ajustador de ph: hidróxido de sodio. 6.2 Incompatibilidades INNOHEP no debe mezclarse con otras soluciones inyectables. 6.3 Período de validez 2 años. 6.4 Precauciones especiales de conservación No conservar a temperatura superior a 25 ºC. 6.5 Naturaleza y contenido del envase
8 Jeringas precargadas de 0,5 ml de capacidad conteniendo 0,25 ml (2.500 UI anti-xa), 0,35 ml (3.500 UI anti-xa) o 0,45 ml (4.500 UI anti-xa) de la solución inyectable, provistas de un capuchón protector para las agujas y de un dispositivo de seguridad. Envases conteniendo 2, 10 y 50 jeringas precargadas. En España únicamente se comercializarán los envases conteniendo 2 y 10 jeringas. 6.6 Precauciones especiales de eliminación y manipulación La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. Los productos para administración parenteral deben inspeccionarse visualmente antes de su administración. No utilizar si se observa turbidez o un precipitado. La solución puede presentar una coloración amarillenta durante el almacenamiento, siendo adecuada todavía para su utilización. Para la inyección subcutánea, ver Sección TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN LEO Pharmaceutical Products Ltd. A/S Industriparken 55 DK Ballerup Dinamarca 8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN Primera autorización: 17 de Agosto de 1999 Última renovación: Agosto FECHA DE LA REVISIÓN DEL TEXTO
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO innohep 2.500 UI anti-xa/0,25 ml solución inyectable en jeringas precargadas innohep 3.500 UI anti-xa/0,35 ml solución
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO innohep 2.500 UI anti-xa/0,25 ml solución inyectable en jeringas precargadas innohep 3.500 UI anti-xa/0,35 ml solución
FICHA TÉCNICA CONJUNTA INNOHEP
 FICHA TÉCNICA CONJUNTA INNOHEP NOMBRE DEL MEDICAMENTO innohep 8.000 UI anti-xa/0,4 ml solución inyectable en jeringas precargadas innohep 10.000 UI anti-xa/0,5 ml solución inyectable en jeringas precargadas
FICHA TÉCNICA CONJUNTA INNOHEP NOMBRE DEL MEDICAMENTO innohep 8.000 UI anti-xa/0,4 ml solución inyectable en jeringas precargadas innohep 10.000 UI anti-xa/0,5 ml solución inyectable en jeringas precargadas
1. NOMBRE DEL MEDICAMENTO INNOHEP 20.000 UI anti-xa/ml, solución inyectable en jeringas
 1. NOMBRE DEL MEDICAMENTO INNOHEP 20.000 UI anti-xa/ml, solución inyectable en jeringas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una jeringa contiene 20.000 UI anti-xa/ml de tinzaparina sódica. Para excipientes,
1. NOMBRE DEL MEDICAMENTO INNOHEP 20.000 UI anti-xa/ml, solución inyectable en jeringas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una jeringa contiene 20.000 UI anti-xa/ml de tinzaparina sódica. Para excipientes,
Tratamiento de la trombosis venosa profunda establecida, con o sin embolismo pulmonar.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO: HIBOR 5.000 UI. HIBOR 7.500 UI. HIBOR 10.000 UI. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Presentación HIBOR 5.000 UI / 0,2 ml jeringas precargadas Principio
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO: HIBOR 5.000 UI. HIBOR 7.500 UI. HIBOR 10.000 UI. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Presentación HIBOR 5.000 UI / 0,2 ml jeringas precargadas Principio
FICHA TÉCNICA. 1. NOMBRE DEL MEDICAMENTO HEPARINA LEO PHARMA UI/ml solución inyectable
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HEPARINA LEO PHARMA 5.000 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución inyectable contiene 5.000 UI de heparina sódica.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HEPARINA LEO PHARMA 5.000 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución inyectable contiene 5.000 UI de heparina sódica.
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
FICHA TÉCNICA. Debe evitarse la administración por vía intramuscular debido al riesgo de formación de hematomas en el lugar de inyección.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HEPARINA LEO PHARMA 1.000 UI/ml, solución inyectable HEPARINA LEO PHARMA 5.000 UI/ml, solución inyectable
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HEPARINA LEO PHARMA 1.000 UI/ml, solución inyectable HEPARINA LEO PHARMA 5.000 UI/ml, solución inyectable
FICHA TÉCNICA NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA NOMBRE DEL MEDICAMENTO innohep 8.000 UI anti-xa/0,4 ml solución inyectable en jeringas precargadas innohep 10.000 UI anti-xa/0,5 ml solución inyectable en jeringas precargadas innohep 12.000
FICHA TÉCNICA NOMBRE DEL MEDICAMENTO innohep 8.000 UI anti-xa/0,4 ml solución inyectable en jeringas precargadas innohep 10.000 UI anti-xa/0,5 ml solución inyectable en jeringas precargadas innohep 12.000
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea
 FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA. Polisacárido Vi de Salmonella typhi (cepa Ty2)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
FICHA TÉCNICA. 1. NOMBRE DEL MEDICAMENTO HEPARINA SÓDICA CHIESI UI/ml HEPARINA SÓDICA CHIESI UI/ml
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HEPARINA SÓDICA CHIESI 1.000 UI/ml HEPARINA SÓDICA CHIESI 5.000 UI/ml 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Heparina sódica Chiesi 1.000 UI/ml: vial conteniendo
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HEPARINA SÓDICA CHIESI 1.000 UI/ml HEPARINA SÓDICA CHIESI 5.000 UI/ml 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Heparina sódica Chiesi 1.000 UI/ml: vial conteniendo
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO INNOHEP 2.500 UI anti-xa/0,25 ml solución inyectable en jeringas INNOHEP 3.500 UI anti-xa/0,35 ml solución inyectable en jeringas INNOHEP
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO INNOHEP 2.500 UI anti-xa/0,25 ml solución inyectable en jeringas INNOHEP 3.500 UI anti-xa/0,35 ml solución inyectable en jeringas INNOHEP
Excipientes: Ácido Clorhidrico o Hidróxido de sodio para ajustar ph, Agua para inyección Basado en una potencia de 100 UI/mg
 Nurox Solución Inyectable Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier duda o no está seguro
Nurox Solución Inyectable Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier duda o no está seguro
PROSPECTO: INFORMACIÓN PARA EL USUARIO. HEPARINA SÓDICA CHIESI UI/ml
 PROSPECTO: INFORMACIÓN PARA EL USUARIO HEPARINA SÓDICA CHIESI 1.000 UI/ml Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto ya que puede tener que volver
PROSPECTO: INFORMACIÓN PARA EL USUARIO HEPARINA SÓDICA CHIESI 1.000 UI/ml Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto ya que puede tener que volver
FICHA TÉCNICA. Posología Administrar cuando sea necesario, o según criterio médico. Como norma general administrar:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MICRALAX Citrato/Lauril sulfoacetato 450 mg/ 45 mg solución rectal Citrato de sodio / Lauril sulfoacetato de sodio 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MICRALAX Citrato/Lauril sulfoacetato 450 mg/ 45 mg solución rectal Citrato de sodio / Lauril sulfoacetato de sodio 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por
FICHA TÉCNICA. Adultos y adolescentes mayores de 12 años: de 250 a 500 mg al día distribuidos en dos tomas (mañana y noche)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TÉCNICA. - Fraxiparina 0,8 ml solución inyectable, cada jeringa precargada contiene UI anti Xa de nadroparina cálcica.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fraxiparina 0,3 ml solución inyectable Fraxiparina 0,4 ml solución inyectable Fraxiparina 0,6 ml solución inyectable Fraxiparina 0,8 ml solución inyectable 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fraxiparina 0,3 ml solución inyectable Fraxiparina 0,4 ml solución inyectable Fraxiparina 0,6 ml solución inyectable Fraxiparina 0,8 ml solución inyectable 2. COMPOSICIÓN
FICHA TÉCNICA. - Fraxiparina 0,8 ml solución inyectable, cada jeringa precargada contiene UI anti Xa de nadroparina cálcica.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fraxiparina 0,3 ml solución inyectable Fraxiparina 0,4 ml solución inyectable Fraxiparina 0,6 ml solución inyectable Fraxiparina 0,8 ml solución inyectable 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fraxiparina 0,3 ml solución inyectable Fraxiparina 0,4 ml solución inyectable Fraxiparina 0,6 ml solución inyectable Fraxiparina 0,8 ml solución inyectable 2. COMPOSICIÓN
FICHA TÉCNICA. No exceder la dosis máxima de 480 mg de simeticona (4 comprimidos masticables) al día.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. HEPARINA HOSPIRA 1%, solución inyectable HEPARINA HOSPIRA 5%, solución inyectable
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HEPARINA HOSPIRA 1%, solución inyectable HEPARINA HOSPIRA 5%, solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial de 5 ml de contiene: HEPARINA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HEPARINA HOSPIRA 1%, solución inyectable HEPARINA HOSPIRA 5%, solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial de 5 ml de contiene: HEPARINA
Solución inyectable Solución incolora o ligeramente amarillenta, transparente, exenta de partículas visibles.
 1. NOMBRE DEL MEDICAMENTO Heparina sódica ROVI 1000 UI/ml solución inyectable. Heparina sódica ROVI 5000 UI/ml solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Heparina sódica ROVI 1000 UI/ml
1. NOMBRE DEL MEDICAMENTO Heparina sódica ROVI 1000 UI/ml solución inyectable. Heparina sódica ROVI 5000 UI/ml solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Heparina sódica ROVI 1000 UI/ml
Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol.
 1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. 2.1 Descripción general
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Las cápsulas son ovales, con el cuerpo y la tapa de color blanco.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Las cápsulas son ovales, con el cuerpo y la tapa de color blanco.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Saccharomyces boulardii 250 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Saccharomyces boulardii 250 mg Excipientes con efecto conocido:
FICHA TÉCNICA. Excipientes con efecto conocido: 0,458 g de maltitol líquido (E965) y 1,830 g de isomalta (E953).
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
Prospecto: Información para el usuario. FRAGMIN UI/ml solución inyectable en ampollas Dalteparina sódica
 Prospecto: Información para el usuario FRAGMIN 10.000 UI/ml solución inyectable en ampollas Dalteparina sódica Lea todo el prospecto detenidamente antes de empezar a utilizar el medicamento porque contiene
Prospecto: Información para el usuario FRAGMIN 10.000 UI/ml solución inyectable en ampollas Dalteparina sódica Lea todo el prospecto detenidamente antes de empezar a utilizar el medicamento porque contiene
FICHA TÉCNICA. Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO TOLFEDINE 4% 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. INGREDIENTES ACTIVOS: Ácido tolfenámico... 4,00 g EXCIPIENTES:
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO TOLFEDINE 4% 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. INGREDIENTES ACTIVOS: Ácido tolfenámico... 4,00 g EXCIPIENTES:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MICRALAX Macrogol 5,9 g polvo para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MICRALAX Macrogol 5,9 g polvo para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 5,9 gramos de Macrogol 3350. Excipientes con efecto
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MICRALAX Macrogol 5,9 g polvo para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 5,9 gramos de Macrogol 3350. Excipientes con efecto
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DAIVONEX Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DAIVONEX Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Calcipotriol 50 microgramos/g (como hidrato). Para la lista completa de excipientes, ver sección 6.1. 3.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DAIVONEX Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Calcipotriol 50 microgramos/g (como hidrato). Para la lista completa de excipientes, ver sección 6.1. 3.
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Ultra Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Ultra Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TÉCNICA. (fitomenadiona, DCI) en 0,2 ml (volumen de llenado: 0,3 ml). Solución contenida en ampollas para administración oral o parenteral.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Konakion 2 mg pediátrico 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 2 mg de vitamina K 1 (fitomenadiona, DCI) en 0,2 ml (volumen de llenado:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Konakion 2 mg pediátrico 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 2 mg de vitamina K 1 (fitomenadiona, DCI) en 0,2 ml (volumen de llenado:
PROSPECTO HEPARINA HOSPIRA 1%
 PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento Conserve este prospecto. Puede tener que volver a leerlo. Si tiene alguna duda, consulte a su médico o farmacéutico.
PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento Conserve este prospecto. Puede tener que volver a leerlo. Si tiene alguna duda, consulte a su médico o farmacéutico.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ambroxol Apotex 3 mg/ ml jarabe EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ambroxol Apotex 3 mg/ ml jarabe EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contienen 3 mg de ambroxol hidrocloruro. Excipiente(s) con efecto
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ambroxol Apotex 3 mg/ ml jarabe EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contienen 3 mg de ambroxol hidrocloruro. Excipiente(s) con efecto
FICHA TECNICA. Acamprosato 333 mg Para consultar la lista completa de excipientes, ver sección 6.1
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ZULEX 333 mg, Comprimidos recubiertos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Acamprosato 333 mg Para consultar la lista completa de excipientes, ver sección 6.1
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ZULEX 333 mg, Comprimidos recubiertos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Acamprosato 333 mg Para consultar la lista completa de excipientes, ver sección 6.1
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Cellufresh 5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Cellufresh 5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
FICHA TÉCNICA. Supositorios incoloros semitransparentes envasados en blíster de aluminio-polietileno.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SUPOSITORIOS DE GLICERINA MICRALAX ADULTOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Supositorios incoloros semitransparentes envasados en
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SUPOSITORIOS DE GLICERINA MICRALAX ADULTOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Supositorios incoloros semitransparentes envasados en
- Enoxaparina (D.C.I.) sódica: 90 mg (equivalente a UI)* - Agua para preparaciones inyectables c.s.p. 0,6 ml
 1. NOMBRE DEL MEDICAMENTO Clexane Forte 90 mg (9.000 UI)/0,6 ml jeringas Clexane Forte 120 mg (12.000 UI)/0,8 ml jeringas Clexane Forte150 mg (15.000 UI)/1ml jeringas 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
1. NOMBRE DEL MEDICAMENTO Clexane Forte 90 mg (9.000 UI)/0,6 ml jeringas Clexane Forte 120 mg (12.000 UI)/0,8 ml jeringas Clexane Forte150 mg (15.000 UI)/1ml jeringas 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. solución Bemiparina sódica (DCI) UI (anti-xa) Bemiparina sódica (DCI) UI (anti-xa)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HIBOR 5.000 UI anti Xa/0,2 ml solución inyectable en jeringas precargadas HIBOR 7.500 UI anti Xa/0,3 ml solución inyectable en jeringas precargadas HIBOR 10.000
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HIBOR 5.000 UI anti Xa/0,2 ml solución inyectable en jeringas precargadas HIBOR 7.500 UI anti Xa/0,3 ml solución inyectable en jeringas precargadas HIBOR 10.000
FICHA TÉCNICA. Excipientes con efecto conocido 1,38 g de sacarosa y 1,10 g glucosa. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor menta 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor menta 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. SANODIN 20 mg/g pomada bucal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada gramo de pomada bucal contiene:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SANODIN 20 mg/g pomada bucal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada bucal contiene: Carbenoxolona disódica. 20 mg Excipientes: Para consultar
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SANODIN 20 mg/g pomada bucal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada bucal contiene: Carbenoxolona disódica. 20 mg Excipientes: Para consultar
FICHA TÉCNICA HEPARINA VEDIM
 FICHA TÉCNICA HEPARINA VEDIM 1. DENOMINACIÓN DE LA ESPECIALIDAD Heparina Vedim 1% Heparina Vedim 5% 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Heparina Vedim 1% : Heparina de sodio (D.C.I.) 5.000 U.I.;
FICHA TÉCNICA HEPARINA VEDIM 1. DENOMINACIÓN DE LA ESPECIALIDAD Heparina Vedim 1% Heparina Vedim 5% 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Heparina Vedim 1% : Heparina de sodio (D.C.I.) 5.000 U.I.;
Prospecto: Información para el usuario. FRAGMIN UI/0,2 ml solución inyectable en jeringas precargadas Dalteparina sódica
 Prospecto: Información para el usuario FRAGMIN 5.000 UI/0,2 ml solución inyectable en jeringas precargadas Dalteparina sódica Lea todo el prospecto detenidamente antes de empezar a utilizar el medicamento
Prospecto: Información para el usuario FRAGMIN 5.000 UI/0,2 ml solución inyectable en jeringas precargadas Dalteparina sódica Lea todo el prospecto detenidamente antes de empezar a utilizar el medicamento
Prospecto: Información para el usuario. FRAGMIN UI/0,2 ml solución inyectable en jeringas precargadas Dalteparina sódica
 Prospecto: Información para el usuario FRAGMIN 2.500 UI/0,2 ml solución inyectable en jeringas precargadas Dalteparina sódica Lea todo el prospecto detenidamente antes de empezar a utilizar el medicamento
Prospecto: Información para el usuario FRAGMIN 2.500 UI/0,2 ml solución inyectable en jeringas precargadas Dalteparina sódica Lea todo el prospecto detenidamente antes de empezar a utilizar el medicamento
100 g de champú contienen 1,5 g de Ciclopirox Olamina (15 mg/g) Véase la lista de excipientes en la sección 6.1.
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO CICLOPIROX OLAMINA CAPITEC 15 mg/g CHAMPÚ 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 100 g de champú contienen 1,5 g de Ciclopirox Olamina (15 mg/g) Véase la
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO CICLOPIROX OLAMINA CAPITEC 15 mg/g CHAMPÚ 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 100 g de champú contienen 1,5 g de Ciclopirox Olamina (15 mg/g) Véase la
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO, ESPECIES DE DESTINO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO, ESPECIES DE DESTINO TOLFEDINE 20 MG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA EN PRINCIPIOS ACTIVOS Y COMPONENTES DEL
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO, ESPECIES DE DESTINO TOLFEDINE 20 MG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA EN PRINCIPIOS ACTIVOS Y COMPONENTES DEL
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DICLOVET 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DICLOVET 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO, ESPECIES DE DESTINO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO, ESPECIES DE DESTINO TOLFEDINE 60 MG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA EN PRINCIPIOS ACTIVOS Y COMPONENTES DEL
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO, ESPECIES DE DESTINO TOLFEDINE 60 MG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA EN PRINCIPIOS ACTIVOS Y COMPONENTES DEL
PROSPECTO: INFORMACIÓN PARA EL USUARIO. HEPARINA SÓDICA CHIESI UI/ml
 PROSPECTO: INFORMACIÓN PARA EL USUARIO HEPARINA SÓDICA CHIESI 5.000 UI/ml Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto ya que puede tener que volver
PROSPECTO: INFORMACIÓN PARA EL USUARIO HEPARINA SÓDICA CHIESI 5.000 UI/ml Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto ya que puede tener que volver
FICHA TÉCNICA. Alivio a corto plazo (de dos o tres meses) del edema y síntomas relacionados con la insuficiencia venosa crónica.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Troxerutina NORMON 1000 mg granulado para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Excipientes: Isomaltosa,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Troxerutina NORMON 1000 mg granulado para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Excipientes: Isomaltosa,
FICHA TÉCNICA. Virus de la gripe fraccionados*, inactivados, que contienen antígenos equivalentes a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
Prospecto: información para el usuario. Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
 Prospecto: información para el usuario FRAXIPARINA FORTE 0,6 ml solución inyectable Nadroparina cálcica Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. Conserve este prospecto,
Prospecto: información para el usuario FRAXIPARINA FORTE 0,6 ml solución inyectable Nadroparina cálcica Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. Conserve este prospecto,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO MEDICAMENTOS VETERINARIOS DE FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GLEPTOVEX 200 mg/ml solución inyectable para porcino 2.
DEPARTAMENTO MEDICAMENTOS VETERINARIOS DE FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GLEPTOVEX 200 mg/ml solución inyectable para porcino 2.
FICHA TÉCNICA. MENCEVAX AC es una preparación liofilizada de polisacáridos purificados de Neisseria meningitidis (meningococo) de los grupos A y C.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ancesol 10 mg/ml solución inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene: Sustancia
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ancesol 10 mg/ml solución inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene: Sustancia
1. NOMBRE DE LA ESPECIALIDAD. PRODERMA 50 mg PRODERMA 100 mg PRODERMA 200 mg 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DE LA ESPECIALIDAD PRODERMA 50 mg PRODERMA 100 mg PRODERMA 200 mg 2. COMPOSICION CUALITATIVA Y CUANTITATIVA PRODERMA 50 mg Doxiciclina (hiclato) 50 mg PRODERMA 100 mg Doxiciclina (hiclato) 100
1. NOMBRE DE LA ESPECIALIDAD PRODERMA 50 mg PRODERMA 100 mg PRODERMA 200 mg 2. COMPOSICION CUALITATIVA Y CUANTITATIVA PRODERMA 50 mg Doxiciclina (hiclato) 50 mg PRODERMA 100 mg Doxiciclina (hiclato) 100
FICHA TÉCNICA. 1. DENOMINACIÓN DEL MEDICAMENTO: GLUCOSAMINA GINELADIUS 625 mg comprimidos recubiertos con película
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO: GLUCOSAMINA GINELADIUS 625 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido contiene 750 mg de Hidrocloruro
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO: GLUCOSAMINA GINELADIUS 625 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido contiene 750 mg de Hidrocloruro
FICHA TÉCNICA. Cada 5 ml de jarabe contienen 15 mg de clorhidrato de ambroxol (DCI)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ambroxol cinfa 15 mg/5 ml jarabe EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Cada 5 ml de jarabe contienen 15 mg de clorhidrato
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ambroxol cinfa 15 mg/5 ml jarabe EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Cada 5 ml de jarabe contienen 15 mg de clorhidrato
DALMARELIN, 25 microgramos/ml solución inyectable para bovino y conejos. Principio activo: Lecirelina acetato equivalente a lecirelina
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DALMARELIN, 25 microgramos/ml solución inyectable para bovino y conejos. 2.
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DALMARELIN, 25 microgramos/ml solución inyectable para bovino y conejos. 2.
Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO bucomax pastillas para chupar sabor menta bucomax pastillas para chupar sabor fresa bucomax pastillas para chupar sabor miel y limón 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
1. NOMBRE DEL MEDICAMENTO bucomax pastillas para chupar sabor menta bucomax pastillas para chupar sabor fresa bucomax pastillas para chupar sabor miel y limón 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
ambroxol cinfa 15 mg / 5 ml jarabe EFG
 FICHA TÉCNICA ambroxol cinfa 15 mg / 5 ml jarabe EFG 1. NOMBRE DEL MEDICAMENTO ambroxol cinfa 15 mg/5 ml jarabe EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 5 ml de jarabe contienen 15 mg de clorhidrato
FICHA TÉCNICA ambroxol cinfa 15 mg / 5 ml jarabe EFG 1. NOMBRE DEL MEDICAMENTO ambroxol cinfa 15 mg/5 ml jarabe EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 5 ml de jarabe contienen 15 mg de clorhidrato
FICHA TÉCNICA (RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO)
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA (RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO) 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PRIVAPROL 50 mg/ml suspensión inyectable para perras 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA (RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO) 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PRIVAPROL 50 mg/ml suspensión inyectable para perras 2. COMPOSICIÓN
FICHA TÉCNICA. KONAKION 10 mg 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO KONAKION 10 mg 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 10 mg de vitamina K 1 (fitomenadiona, DCI) en 1 ml. 3. FORMA FARMACÉUTICA Solución
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO KONAKION 10 mg 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 10 mg de vitamina K 1 (fitomenadiona, DCI) en 1 ml. 3. FORMA FARMACÉUTICA Solución
FICHA TÉCNICA. Normoreum 400 mg comprimidos recubiertos con película
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Normoreum 400 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: 400 mg de extracto
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Normoreum 400 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: 400 mg de extracto
Prospecto: Información para el usuario. FRAGMIN UI/0,4 ml solución inyectable en jeringas precargadas Dalteparina sódica
 Prospecto: Información para el usuario FRAGMIN 10.000 UI/0,4 ml solución inyectable en jeringas precargadas Dalteparina sódica Lea todo el prospecto detenidamente antes de empezar a utilizar el medicamento
Prospecto: Información para el usuario FRAGMIN 10.000 UI/0,4 ml solución inyectable en jeringas precargadas Dalteparina sódica Lea todo el prospecto detenidamente antes de empezar a utilizar el medicamento
FICHA TÉCNICA. Sorbitol líquido (no cristalizante); 1 ml de jarabe contiene 495,6 mg de sorbitol (E 420).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ingelvac MycoFLEX suspensión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Mycoplasma
FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ingelvac MycoFLEX suspensión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Mycoplasma
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PORCEPTAL 4 microgramos/ml Solución inyectable para porcino
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PORCEPTAL 4 microgramos/ml Solución inyectable para porcino
4.2. Indicaciones de uso, especificando las especies de destino
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO FILAVAC VHD K C+V suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO FILAVAC VHD K C+V suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento veterinario MODERIN 4 mg 2. Composición cualitativa y cuantitativa 2.1 composición cualitativa: Nombre del ingrediente Referencias
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento veterinario MODERIN 4 mg 2. Composición cualitativa y cuantitativa 2.1 composición cualitativa: Nombre del ingrediente Referencias
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TÉCNICA. Cada pastilla para chupar contiene 1,2 mg de alcohol 2,4-diclorobencílico y 0,6 mg de amilmetacresol.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Strepsils pastillas para chupar sabor miel y limón 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Cada pastilla para chupar contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Strepsils pastillas para chupar sabor miel y limón 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Cada pastilla para chupar contiene
FICHA TÉCNICA. Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Grifols Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Grifols Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. Afecciones agudas y crónicas de las vías respiratorias que requieran tratamiento secretolítico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUXIMED JARABE EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 5 ml de jarabe contiene 15 mg de ambroxol (hidrocloruro). Excipientes: ácido benzoico (E210) 10 mg,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUXIMED JARABE EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 5 ml de jarabe contiene 15 mg de ambroxol (hidrocloruro). Excipientes: ácido benzoico (E210) 10 mg,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA. GLUCOSAMINA PHARMA NORD 400 mg CÁPSULAS
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA GLUCOSAMINA PHARMA NORD 400 mg CÁPSULAS 1. NOMBRE DEL MEDICAMENTO Glucosamina Pharma Nord
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA GLUCOSAMINA PHARMA NORD 400 mg CÁPSULAS 1. NOMBRE DEL MEDICAMENTO Glucosamina Pharma Nord
FICHA TÉCNICA. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 100 mg de simeticona. Excipientes con efecto conocido:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 100 mg/ml gotas orales en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 100 mg de simeticona. Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 100 mg/ml gotas orales en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 100 mg de simeticona. Excipientes con efecto conocido:
FICHA TÉCNICA. Niños menores de 1 año: no se ha establecido la seguridad y eficacia de Thrombocid Forte en niños menores de 1 año.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Thrombocid Forte 5 mg/g pomada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene: Pentosano polisulfato sódico...5 mg Excipientes: Alcohol
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Thrombocid Forte 5 mg/g pomada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene: Pentosano polisulfato sódico...5 mg Excipientes: Alcohol
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Artific 3,20 mg/ml colirio en solución. Artific 3,20 mg/ml colirio en solución en envase unidosis. 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Artific 3,20 mg/ml colirio en solución. Artific 3,20 mg/ml colirio en solución en envase unidosis. 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Sustancia activa Ácido fenoxi-2-metil-2-propiónico (como sal sódica) mg
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LIVERFINE 100 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LIVERFINE 100 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. El tratamiento de las enfermedades de ojo seco requiere un régimen individualizado de dosificación.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lipolac 2 mg/g gel oftálmico 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 g de gel oftálmico contiene 2 mg de carbómero. Para consultar la lista completa de excipientes,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lipolac 2 mg/g gel oftálmico 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 g de gel oftálmico contiene 2 mg de carbómero. Para consultar la lista completa de excipientes,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. AMCHAFIBRIN 500 mg comprimidos, ácido tranexámico 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO AMCHAFIBRIN 500 mg comprimidos, ácido tranexámico 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Amchafibrin 500 mg contiene: Ácido tranexámico 500
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO AMCHAFIBRIN 500 mg comprimidos, ácido tranexámico 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Amchafibrin 500 mg contiene: Ácido tranexámico 500
FICHA TÉCNICA. * La vacuna cumple con la recomendación de la OMS (hemisferio Norte) y con la decisión de la Unión Europea para la campaña 2000/2001.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL PASTEUR Vacuna antigripal inactivada (virus fraccionados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe cultivados en huevos, fraccionados
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL PASTEUR Vacuna antigripal inactivada (virus fraccionados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe cultivados en huevos, fraccionados
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO CORREO ELECTRÓNICO Sugerencias_ft@aemps.es C/ CAMPEZO, 1 EDIFICIO 8 28022 MADRID 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO CORREO ELECTRÓNICO Sugerencias_ft@aemps.es C/ CAMPEZO, 1 EDIFICIO 8 28022 MADRID 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en
PROSPECTO. PROTAMINA HOSPIRA solución inyectable. El principio activo es sulfato de protamina. Cada vial contiene 50 mg de sulfato de protamina.
 PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento Conserve este prospecto. Puede tener que volver a leerlo. Si tiene alguna duda, consulte a su médico o farmacéutico.
PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento Conserve este prospecto. Puede tener que volver a leerlo. Si tiene alguna duda, consulte a su médico o farmacéutico.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO EMEPRID 5 mg/ml SOLUCIÓN INYECTABLE PARA PERROS Y GATOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO EMEPRID 5 mg/ml SOLUCIÓN INYECTABLE PARA PERROS Y GATOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene:
Para la lista completa de excipientes, véase la sección Indicaciones de uso, especificando las especies de destino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
FOLLETO DE INFORMACIÓN AL PACIENTE DOLGENAL SOLUCIÓN INYECTABLE 30mg/1mL
 FOLLETO DE INFORMACIÓN AL PACIENTE DOLGENAL SOLUCIÓN INYECTABLE 30mg/1mL DOLGENAL Ketorolaco Trometamol 30 mg/1 ml Solución inyectable Vía de Administración: I.M. - I.V. Venta bajo receta médica en establecimientos
FOLLETO DE INFORMACIÓN AL PACIENTE DOLGENAL SOLUCIÓN INYECTABLE 30mg/1mL DOLGENAL Ketorolaco Trometamol 30 mg/1 ml Solución inyectable Vía de Administración: I.M. - I.V. Venta bajo receta médica en establecimientos
HEMATICEN 200 mg/ml solución inyectable para lechones
 Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: HEMATICEN 200 mg/ml solución inyectable para lechones Reg. nº: 3506 ESP
Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: HEMATICEN 200 mg/ml solución inyectable para lechones Reg. nº: 3506 ESP
FICHA TÉCNICA. Cada ml de solución inyectable contiene 7,5 mg de ambroxol hidrocloruro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Motosol 7,5 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Descripción general Cada ml de solución inyectable contiene 7,5 mg de ambroxol hidrocloruro.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Motosol 7,5 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Descripción general Cada ml de solución inyectable contiene 7,5 mg de ambroxol hidrocloruro.
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Ficha técnica Página 1
 1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
FICHA TÉCNICA. Por envase monodosis de 5 ml: Citrato trisódico dihidratado mg Laurilsulfoacetato de sodio...45 mg
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO CLISTERAN solución rectal 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Por envase monodosis de 5 ml: Citrato trisódico dihidratado... 450 mg Laurilsulfoacetato de
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO CLISTERAN solución rectal 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Por envase monodosis de 5 ml: Citrato trisódico dihidratado... 450 mg Laurilsulfoacetato de
SODIOFOLIN 50 mg/ml solución para inyección o perfusión intravenosa
 L e a t o d o e l p r o s p e c t o d e t e n i d a m e n t e a n t e s d e e m p e z a r En este prospecto 1. Qué es Sodiofolin 50 mg/ml solución para inyección o perfusión intravenosa y para qué se utiliza
L e a t o d o e l p r o s p e c t o d e t e n i d a m e n t e a n t e s d e e m p e z a r En este prospecto 1. Qué es Sodiofolin 50 mg/ml solución para inyección o perfusión intravenosa y para qué se utiliza
