ciclohexeno (p.eb.=83ºc)
|
|
|
- Salvador Vázquez Gutiérrez
- hace 9 años
- Vistas:
Transcripción
1 Síntesis rgánica 1 Tema 7. Síntesis de alquenos por eliminación de alcoholes y derivados. La reacción de Wittig. Estereoselectividad en la reacción de Wittig. Utilización de acetilenos en la síntesis de compuestos olefínicos. La reacción de Diels-Alder. Estereoespecificidad, estereoselectividad y regioselectividad en la reacción de Diels-Alder. Síntesis de alquenos por eliminación de alcoholes y derivados. Cuando los alcoholes se calientan en presencia de cantidades catalíticas de ácidos experimentan una reacción de deshidratación que los convierte en alquenos. Esta reacción es un equilibrio entre los reactivos (el alcohol de partida) y los productos (el alqueno y el agua). C C C C 2 Para impulsar el equilibrio hacia la derecha es necesario eliminar el alqueno o el agua a medida que se van formando. Esto se consigue mediante la destilación del alqueno, más volátil que el alcohol porque no puede formar puentes de hidrógeno, o mediante la adición de un agente deshidratante que elimine el agua a medida que ésta se va generando. Por ejemplo, el ciclohexeno se obtiene a partir del ciclohexanol mediante calentamiento en presencia de 3 P 4 o de 2 S 4 en un sistema de destilación. Como el ciclohexeno es más volátil que el ciclohexanol se va eliminando de la mezcla de reacción y de este modo el equilibrio del proceso se va desplazando hacia la derecha. 3 P 4 2 ciclohexanol (p.eb.=161ºc) ciclohexeno (p.eb.=83ºc) Por lo general, si la reacción se lleva a cabo en medio ácido el proceso sigue un mecanismo E1. La protonación del grupo hidroxilo lo convierte en un buen grupo saliente. La eliminación de agua en el alcohol protonado genera un carbocatión que pierde un protón para dar lugar al alqueno:
2 Tema 7 2 Mecanismo de deshidratación de alcoholes en medio ácido P 2 P P P El paso que determina la velocidad del proceso es el de la formación del carbocatión y por tanto la facilidad de deshidratación de alcoholes en medio ácido sigue el mismo orden que el estabilidad de los carbocationes. alcohol 1º < alcohol 2º < alcohol 3º aumenta la velocidad de deshidratación Un alcohol también se puede transformar en un alqueno en medio básico. En este caso no se produce la protonación del grupo hidroxilo y para convertir a éste en un buen grupo saliente hay que transformarlo en un éster de ácido sulfónico (un tosilato (Ts) o un mesilato (Ms)). Una vez convertido el alcohol en tosilato o mesilato, la olefina se obtiene por calentamiento de estos ésteres en presencia de una base. En estos casos la reacción sigue un mecanismo E2.
3 Síntesis rgánica 3 Deshidratación de alcoholes en medio básico 1º. Formación del ester de sulfonato Cl S C 3 N S C 3 Ts cloruro de tosilo tosilato de ciclohexilo 2º. Reacción de eliminación E2 por reacción con una base Ts t-buk t-bu ciclohexeno El mecanismo de la reacción de eliminación E2 es estereoespecífico y exige que el protón que va a ser capturado por la base, y el grupo saliente se sitúen en posición trans-diaxial: Mecanismo E2 en la eliminación del tosilato Ts Ts Ts La síntesis del 1-fenilciclohexeno es un ejemplo de la preparación de olefinas mediante la deshidratación de alcoholes.
4 Tema 7 4 Retrosíntesis del 1-fenilciclohexeno Ph IGF Ph 1,1 Ph C-C La retrosíntesis se inicia con una etapa de interconversión del grupo funcional olefina en el grupo funcional alcohol. Este paso transforma al 1- fenilciclohexeno en el 1-fenilciclohexan-1-ol. Este alcohol se puede analizar mediante la estrategia de desconexión explicada en el tema 4, lo que conduce a un sintón aniónico Ph(-), cuyo equivalente sintético es un reactivo orgametálico Ph-Met, y a un sintón catiónico cuyo equivalente sintético es la ciclohexanona. sintón equivalente sintético Ph PhLi La síntesis se formularía del siguiente modo: 1º. Adición de fenil-litio a la ciclohexanona PhLi TF Li Ph 3 Ph 2º. Deshidratación ácida del 1-fenilciclohexan-1-ol Ph 3 P 4 calor Ph 1-fenilciclohexeno
5 Síntesis rgánica 5 El inconveniente de las reacciones de deshidratación es que no son muy regioselectivas y con mucha frecuencia conducen a mezclas de olefinas, con independencia del tipo de mecanismo E1 o E2 mediante el que tiene lugar la reacción de deshidratación. Por ejemplo, supongamos que se desee proponer una secuencia sintética para el 3-etil-3-hepteno. La retrosíntesis de este compuesto podría ser la siguiente: Retrosíntesis del 3-etil-3-hepteno basada en la deshidratación de un alcohol IGF 1,1 C-C sintón equivalente sintético BrMg La síntesis se podría formular del siguiente modo: 1º. Adición del bromuro de butilmagnesio a la 3-pentanona BrMg TF
6 Tema 7 6 2º. Deshidratación ácida del 3-etil-3-pentanol 3 P etil-2-hepteno 3-etil-3-hepteno Como se puede apreciar en el esquema anterior, la reacción de deshidratación del alcohol transcurre a través de un carbocatión terciario. Este intermedio presenta dos tipos diferentes de protones en los carbonos en α respecto al centro catiónico: el protón 2 y el protón 4. Si el carbocatión elimina el protón 2 se forma el 3-etil-2-hepteno, mientras que la pérdida del protón 4 conduce al 3-etil-2-hepteno. En consecuencia, la síntesis proporciona una mezcla de alquenos isoméricos y carece de interés preparativo. Sería deseable un método de síntesis de alquenos que no diera lugar a la formación de mezclas de olefinas. Este método es la reacción de Wittig, que permite un control total sobre la posición del doble enlace y un control parcial sobre la estereoquímica del mismo. El método de Wittig permite la síntesis de olefinas mediante la reacción de iluros de fósforo con aldehídos o cetonas. Los iluros de fósforo se obtienen por reacción de sales de fosfonio con bases adecuadas. La retrosíntesis del 3-etil- 3-hepteno mediante una reacción de Wittig se indica a continuación: Retrosíntesis del 3-etil-3-hepteno mediante una reacción de Wittig 3-etil-3-hepteno C-C Wittig cetona PPh 3 iluro de fósforo Ph 3 P Br Los iluros de fósforo necesarios para las reacciones de Wittig se preparan a partir de sales de fosfonio, normalmente sales de trifenil alquil fosfonio. En la síntesis del 3-etil-3-hepteno se requiere una sal de trifenil butil fosfonio que se puede preparar mediante una reacción S N 2 entre la trifenilfosfina (Ph 3 P) y el
7 Síntesis rgánica 7 bromuro de n-butilo. Las diferentes etapas del proceso de síntesis del 3-etil-3- hepteno mediante una reacción de Wittig se detallan a continuación: 1º. Síntesis de la sal de fosfonio. Ph 3 P S N 2 Ph 3 P Br Br bromuro de trifenil n-butil fosfonio 2º. Generación del iluro de fósforo. El iluro de fósforo se genera por reacción de tipo ácido-base entre la sal de fosfonio (el ácido) y una base fuerte, por ejemplo butil-litio. Ph 3 P Ph 3 P Br Li n-butil-litio Ph 3 P n-butano LiBr iluro de fósforo 3º. Reacción de Wittig. El iluro normalmente no se aísla sino que se añade, a la mezcla de reacción que lo contiene, el aldehído o la cetona para que tenga lugar el proceso de formación del doble enlace C=C. En el caso de la síntesis que nos ocupa, el compuesto carbonílico que hay que añadir a la reacción es la 3- pentanona. Ph 3 P 3-pentanona PPh 3 PPh 3 betaína oxafosfetano Ph 3 P óxido de trifenilfosfina 3-etil-3-hepteno
8 Tema 7 8 El iluro de fósforo ataca nucleofílicamente al grupo carbonilo originando una betaína (sal interna). Este intermedio reacciona intramolecularmente transformándose en un anillo de oxafosfetano, que colapsa para dar lugar a la olefina y al óxido de trifenilfosfina. La formación del fuerte enlace P-, con una energía de Kcal/mol, es la fuerza impulsora responsable de la transformación del oxafosfetano en el alqueno y en el óxido de trifenilfosfina. Estereocontrol en la reacción de Wiitig. Las reacciones de Wittig son estereoselectivas puesto que conducen, en muchas ocasiones, a la formación mayoritaria de la olefina E o de la olefina Z en función del grado de estabilidad del iluro empleado en el proceso. a) Cuando el iluro está estabilizado el doble enlace que se forma es mayoritariamente el de configuración E. Un iluro se dice que está estabilizado cuando la carga negativa se deslocaliza por resonancia con un grupo electrón-atrayente. Un ejemplo de iluro estabilizado es el metoxicarbonilmetilentrifenilfosforano (Ph 3 P=CCMe), cuyas estructuras resonantes se dan a continuación: Estructuras resonantes del metoxicarbonilmetilentrifenilfosforano: iluro estabilizado Ph 3 P I Me Ph 3 P II Me Ph 3 P III Me El Ph 3 P=CCMe presenta, además de las estructuras resonantes I y II, que contienen todos los iluros, una tercera estructura resonante adicional, la estructura III, que es la que ayuda a estabilizar el iluro por deslocalización de la carga negativa sobre el carbonilo del éster metílico. tro caso de iluro estabilizado lo constituye el bencilidentrifenilfosforano (Ph 3 P=CPh). En este caso el iluro se estabiliza por deslocalización de la carga negativa sobre el anillo aromático, como se aprecia en las estructuras resonantes II, III y IV que se indican en la siguiente figura: Estructuras resonantes del bencilidentrifenilfosforano: iluro estabilizado Ph 3 P Ph 3 P Ph 3 P Ph 3 P I II III IV
9 Síntesis rgánica 9 La reacción de estos iluros estabilizados con aldehídos proporciona mayoritariamente el compuesto olefínico con configuración E en el doble enlace. Por ejemplo, la reacción entre benzaldehído y el Ph 3 P=CCMe forma muy mayoritariamente el (E)-3-fenilpropenoato de metilo: Síntesis de alquenos E con iluros estabilizados Ph Ph 3 P Me Ph CMe (E)-3-fenilpropenoato de metilo b) Cuando el iluro no está estabilizado el doble enlace que se forma es mayoritariamente el de configuración Z. Un iluro no estabilizado es el que presenta muy poca deslocalización de la carga negativa. Un ejemplo de esta clase de iluros lo constituye el etilidentrifenilfosforano, cuyas estructuras resonantes se indican a continuación: Estructuras resonantes del etilidentrifenilfosforano: iluro no estabilizado Ph 3 P C 3 Ph 3 P C 3 Al contrario que en los dos iluros anteriores el grupo metilo del Ph 3 P=CC 3 no puede deslocalizar la carga negativa ni por efecto inductivo ni por efecto resonante. La reacción de este iluro con aldehídos proporciona mayoritariamente el compuesto olefínico con configuración Z en el doble enlace.
10 Tema 7 10 Síntesis de alquenos Z con iluros no estabilizados Ph Ph 3 P C 3 Ph C 3 (Z)-1-fenil-1-propeno Una ejemplo de aplicación de las reacciones de Wittig estereoselectivas lo constituye la síntesis del (E)-1-fenil-4-metil-1-hexeno, que se podría analizar del siguiente modo: Retrosíntesis del (E)-1-fenil-4-metil-1-hexeno Ph 3 P C-C Wittig El aldehído resultante de la desconexión, el 3-metilpentanal, se podría continuar desconectando mediante el siguiente esquema retrosintético: Retrosíntesis del 3-metilpentanal IGF 1,2 C-C Los equivalentes sintéticos de esta desconexión son los siguientes: sintón equivalente sintético BrMg
11 Síntesis rgánica 11 La síntesis del aldehído sería: 1º. Formación del reactivo de Grignard Br Mg TF BrMg 2º. Apertura nucleofílica del epóxido por reacción con el Grignard BrMg BrMg 3 3º. xidación del alcohol a aldehído PCC C 2 Cl 2 4º. Síntesis de la sal de fosfonio y generación del iluro. Por otra parte, la reacción entre el bromuro de bencilo y el Ph 3 P dará lugar a una sal de fosfonio, que por ionización proporcionará el iluro estabilizado necesario para la reacción de Wittig: Br Ph 3 P tolueno PPh 3 Br sal de fosfonio PPh 3 Br n-buli PPh 3 LiBr n-bu iluro 5º. Reacción de Wittig. Por último, la reacción de Wittig entre el iluro y el aldehído proporcionará mayoritariamente la olefina de configuración E en el doble enlace: PPh 3
12 Tema 7 12 Utilización de acetilenos en la síntesis de compuestos olefínicos. Los enlaces C- son enlaces covalentes fuertes debido a que la similtud entre las electronegatividades del carbono y del hidrógeno provoca una compartición casi igual de la densidad electrónica. Sin embargo, no todos los átomos de carbono de un compuesto orgánico tienen la misma electronegatividad. Fe hecho, un carbono que presente hibridación hibridación sp es más electronegativo que un carbono con hibridación sp 2, que a su vez es más electronegativo que un carbono con hibridación sp 3, el cual es ligeramente más electronegativo que un hidrógeno. Esta diferencia de electronegatividad en función del tipo de hibridación del átomo de carbono se explica del siguiente modo: La electronegatividad es una medida de la capacidad que tiene un átomo de mantener a los electrones cerca de su núcleo. Cuanto más cerca estén los electrones del núcleo más electronegativo es el átomo. La distancia media entre un electrón 2s y el núcleo atómico es menos que la distancia media entre un electrón 2p y el núcleo. Por tanto, los electrones en un orbital híbrido sp, que contiene un 50% de carácter s, están más cercanos, en términos medios, al núcleo que los electrones de un orbital sp 2, que contiene un 33.3% de carácter s. Por el mismo razonamiento, los electrones de un orbital sp 2 están más cerca del núcleo, como media, que los electrones de un orbital sp 3. En consecuencia, cuánto mayor sea el carácter s de los orbitales híbridos de un átomo de carbono mayor será la electronegatividad de éste, de manera que el orden de electronegatividad relativa será: sp > sp 2 > sp 3 aumento de la electronegatividad Cuanto mayor es la electronegatividad del átomo al cual está unido el hidrógeno mayor es la facilidad para liberar este hidrógeno. Cuanto mayor es la facilidad con la que se rompe el enlace con el hidrogeno mayor es la acidez del compuesto. electronegatividad N < < F fuerza ácida N 3 2 F < < pk a =36 pk a =15.7 pk a =3.2 aumento de la electronegativida y de la acidez
13 Síntesis rgánica 13 Como la electronegatividad sigue el orden sp > sp 2 > sp 3 ya se puede afirmar que el acetileno será más ácido que el etileno y éste más ácido que el etano. De hecho, el pk a estimado de estos tres hidrocarburos es: pk a de los hidrocarburos C C 2 C C 2 3 C C 3 pk a = 25 pk a = 44 pk a = 50 En el siguiente esquema se compara la acidez de los tres hidrocarburos anteriores con la de otros compuestos de la segunda fila del sistema periódico: pk a de compuestos de la segunda fila del Sistema Periódico 3 C C 3 2 C C 2 N 3 C C 2 F pk a = 50 pk a = 44 pk a = 36 pk a = 25 pk a = 15.7 pk a = 3.2 aumento de la acidez Las bases conjugadas de estos ácidos tienen el siguiente orden de basicidad: 3 C C 2 > 2 C C > 2 N > C C > > F aumento de la basicidad La consecuencia que hay que extraer de las dos tablas anteriores es que para arrancar un protón de un ácido (A-) hay que emplear una base (B - ) que sea más fuerte que la base conjugada del ácido (A - ). Por ejemplo, el acetileno CC se puede ionizar por reacción con el anión amiduro N 2 (-) porque esta base es más fuerte que el anión acetiluro CC(-), la base conjugada del acetileno.
14 Tema 7 14 RC C 2 N RC C N 3 anión amiduro anión acetiluro (base muy fuerte) Se puede hacer un cálculo estimativo de la constante de equilibrio de esta reacción que sería K a = Si en lugar del anión amiduro se emplea el anión hidróxido la reacción de ionización del acetileno no tiene lugar porque el anión hidróxido es una base demasiado débil y no consigue arrancar el protón enlazado a un carbono sp. La constante de equilibrio de este proceso sería de K a = RC C RC C 2 anión hidróxido (base débil) anión acetiluro La relativa acidez de los hidrógenos enlazados a los carbonos sp marca la química de los acetilenos terminales. Cuando se dice que esta clase de hidrógenos son ácidos se entiende que lo son en relación a los otros hidrógenos enlazados a átomos de carbono con hibridación sp 2 o sp 3.
15 Síntesis rgánica 15 Empleo de los aniones alquinuro en síntesis a) como nucleófilos en reacciones S N 2: creación de enlaces C-C por reacción con haluros de alquilo. Un anión acetiluro puede emplearse como nucleófilo en reacciones de C- alquilación con haluros de alquilo. Este tipo de reacciones transcurren mediante mecanismos S N 2. Por ejemplo, el 3-hexino se puede sintetizar a partir del 1- butino mediante la ionización de éste con amiduro sódico seguida de reacción del alquinuro sódico con bromuro de etilo. Creación de enlaces C-C mediante reacciones S N 2 entre alquinuros y haluros de alquilo 1º. Ionización del alquino terminal C 3 C 2 C C NaN 2 C 3 C 2 C C Na N 3 1-butino 2º. Reacción S N 2 del alquinuro con un haluro primario Na C 3 C 2 C C C 3 C 2 Br C 3 C 2 C CC 2 C 3 NaBr 3-hexino Este proceso de C-alquilación de alquinuros es una vía indirecta para la síntesis de olefinas. Por ejemplo, la hidrogenación del 3-hexino con el catalizador de Lindlar (Pd/BaS 4 y quinoleina) proporciona el (Z)-3-hexeno. Por otra parte, la reducción del triple enlace con sodio disuelto en amoniaco líquido conduce al (E)-3-hexeno: 2, Pd/BaS 4 C 3 C 2 C CC 2 C 3 3-hexino quinoleina Na, N 3 (l) C 3 C 2 C 2 C 3 (Z)-3-hexeno C 3 C 2 C 2 C 3 (E)-3-hexeno
16 Tema 7 16 A continuación, se pondrá de manifiesto la potencialidad sintética de los alquinos terminales mediante la discusión de la síntesis, tomada de la literatura científica, del disparlure, una feromona de atracción sexual de cierta clase de polillas. La retrosíntesis de este compuesto sería la siguiente: IGF disparlure Br IGF 1-bromo-5-metilhexano 1-dodecino acetileno Br 1-bromodecano La primera etapa retrosintética es la interconversión del grupo funcional epóxido en doble enlace Z, que se puede obtener de forma estereoespecífica por hidrogenación controlada del triple enlace del hidrocarburo acetilénico que se indica en el esquema anterior. La desconexión de uno de los enlaces Csp 3 - Csp lleva al 1-dodecino y al 1-bromo-5-metilhexano. Por último, la desconexión del enlace Csp 3 -Csp del 1-dodecino conduce al acetileno y al 1-bromodecano. De acuerdo con el anterior esquema retrosintético la síntesis del disparlure se plantearía del siguiente modo: Síntesis: 1º. C-alquilación del acetiluro sódico con 1-bromodecano: formación del primer enlace Csp 3 -Csp. C C NaN 2 C C Na N 3 acetileno C C Na Br 1-bromodecano S N 2 C C (C 2 ) 9 C 3
17 Síntesis rgánica 17 1º. Formación del segundo enlace Csp 3 -Csp. C C NaN 2 Na C C (C 2 ) 9 C 3 N 3 Br Na C C (C 2 ) 9 C 3 S N 2 (C 2 ) 9 C 3 1-bromo-5-metilhexano 3º. idrogenación cis del triple enlace. (C 2 ) 9 C 3 2, Pd/BaS 4 quinoleina 5º. Epoxidación del doble enlace. MCPBA disparlure b) como nucleófilos en adiciones a grupos carbonilo Un anión alquinuro también se puede emplear en la formación de enlaces C-C mediante la adición nucleofílica a grupos carbonilo de aldehídos y de cetonas. Creación de enlaces C-C mediante la adición de aniones alquinuro a grupos carbonilo RC C RC C 3 RC C En relación con el anterior esquema sintético, el diol acetilénico 2,5- dimetil-3-hexin-2,5-diol se podría analizar del siguiente modo:
18 Tema 7 18 Retrosíntesis del 2,5-dimetil-3-hexin-2,5-diol C C C C sintón C C equivalente sintético C C, base La desconexión de uno de los enlaces Csp 3 -Csp lleva a la acetona y a la base conjugada del 2-metil-3-butin-2-ol. A su vez, este alcohol acetilénico se desconectaría del siguiente modo: Retrosíntesis del 2-metil-3-butin-2-ol C C C C La síntesis sería: 1º. Adiciòn nucleofílica del acetiluro sódico a la acetona C C NaN 2 N 3 Na C C Na C C Na C C 3 C C 2-metil-3-butin-2-ol
19 Síntesis rgánica 19 2º. Adición nucleofílica a la acetona de la base conjugada del 2-metil-3-butin-2-ol C C 2 NaN 2 2 N 3 Na C C dianión Na Na C C Na Na C C Na 3 C C dianión La adición del anión acetiluro a la acetona generará, después de la hidrólisis ácida de la mezcla de reacción, el 2-metil-3-butin-2-ol. La reacción de este compuesto con dos equivalentes de NaN 2 dará lugar al dianión indicado en el esquema de síntesis. Este compuesto presenta dos centros con elevada densidad electrónica: el oxígeno alcoxídico y el carbono aniónico. Si se añade a la reacción 1 equivalente de un compuesto electrofílico, por ejemplo acetona, tiene lugar una reacción quimioselectiva, con preferencia de la C-alquilación sobre la -alquilación, debido a que el carbono aniónico es mucho más nucleofílico que el oxígeno alcoxídico. La hidrólisis ácida de la mezcla de reacción proporcionará el 2,5-dimetil-3-hexin-2,5-diol.
20 Tema 7 20 La reacción de Diels-Alder En 1906, el químico alemán Albrecht descubrió que la reacción entre el ciclopentadieno y la p-benzoquinona daba lugar a un complejo dimérico, que ahora se sabe que es el compuesto 1. ciclopentadieno p-benzoquinona 1 En 1928, tto Diels y Kurt Alder publicaron sus investigaciones sobre la reactividad entre una serie de dienos, entre ellos el ciclopentadieno, y determinados alquenos. Por ejemplo, la reacción entre el ciclopentadieno y el anhidrido maleico, en benceno a reflujo, daba lugar al compuesto 2, con rendimientos prácticamente cuantitativos ciclopentadieno benceno reflujo anhidrido maleico 2 (100%) De igual modo, la reacción entre el ciclopentadieno y la acroleína en éter a reflujo proporcionaba el compuesto 3 con un 95% de rendimiento. ciclopentadieno acroleína 3 (95%) Por el descubrimiento de estas reacciones, y de otras muchas relacionadas con las anteriores,. Diels y K. Alder fueron galardonados con el premio Nobel de Química en Desde entonces, la reacción entre un dieno y un alqueno para generar un anillo ciclohexénico se conoce con el nombre de reacción de Diels-Alder. Al producto de la reacción se le denomina también producto de cicloadición [42] dado un sistema de 4 electrones π (el dieno) reacciona con un sistema de dos electrones π (el dienófilo).
21 Síntesis rgánica 21 La velocidad de reacción del ciclopentadieno en los procesos Diels-Alder depende del tipo de alqueno con el que reacciona. Se acaba de comentar que el ciclopentadieno reacciona con acroleína en éter a temperatura ambiente para dar un 95% del aducto 3. Sin embargo, el ciclopentadieno sólo reacciona con el etileno en un reactor a presión a 200ºC y a 5800 psi, para dar, después de 32 horas, el aducto 4 con un 74% de rendimiento. Por otra parte, la reacción entre el ciclopentadieno y el acetato de vinilo sólo se consigue en un reactor a presión a 190ºC durante 10 horas y proporciona sólo un 25% del aducto 5. C 2 C 2 etileno 200ºC 5800 psi, 32h 4 (74%) Ac acetato de vinilo 190ºC presión, 10h 5 (25%) Ac Por lo general, los alquenos simples, como el etileno, o los alquenos elctrónicamente ricos, como el acetato de vinilo, sólo reaccionan con ciclopentadieno bajo condiciones de reacción muy vigorosas. Esta diferencia de comportamiento contrasta con la fácil reactividad del ciclopentadieno con los alquenos electrónicamente deficientes como la acroleína, la p-benzoquinona o el anhidrido maleico y se puede explicar mediante las energía relativas de los orbitales frontera del dieno y del dienófilo, como se verá un poco más adelante. Mecanismo de la reacción de Diels-Alder desde el punto de vista de los rbitales Moleculares Frontera. a) rbitales Moleculares Frontera del etileno. El enlace π del etileno se explica mediante el solapamiento de dos orbitales atómicos p. Este recubrimiento orbitálico puede ser descrito matemáticamente mediante la mecánica cuántica. El resultado de este tratamiento matemático se puede describir mediante términos no matemáticos utilizando la teoría del rbital Molecular. Los dos lóbulos que forman un orbital p son de fases opuestas. Si la aproximación de dos orbitales p permite el solapamiento de lóbulos que presentan la misma fase se establece entre los dos átomos una interacción atractiva que forma un enlace covalente.
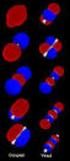
22 Tema 7 22 Si por el contrario, los dos orbitales p se aproximan de forma que se enfrenten lóbulos de fase opuesta se establecerá entre los dos átomos una interacción repulsiva. Los electrones llenan los orbitales moleculares siguiendo las mismas reglas que se emplean para el llenado de orbitales atómicos:.- los electrones van llenando los orbitales moleculares de menor energía..- un orbital molecular sólo puede contener dos electrones. La combinación de los dos orbitales atómicos p del etileno origina dos orbitales moleculares: un orbital molecular enlazante π y un orbital molecular antienlazante π*. Una forma común de obtener una imagen aproximada de un orbital molecular π es dibujar un orbital p en cada átomo, con indicación de los signos de la función de onda de cada lóbulo orbitálico. ay que tener en cuenta que los signos matemáticos o de los lóbulos orbitálicos se derivan de las ecuaciones mecano-cuánticas que los describen e indican la fase de la función de onda, no cargas eléctricas. El orbital molecular enlazante π se forma por solapamiento constructivo de los dos orbitales atómicos p que están en fase. Esto significa que el signo de la función de onda que describe a estos dos orbitales atómicos es el mismo. El orbital antienlazante π* se forma por combinación lineal de los dos orbitales atómicos p cuya función de onda tiene signos opuestos. sistema de orbitales moleculares p del etileno nodo - - LUM orbital molecularp* antienlazante - - orbitales atómicos p energía - - M orbital molecular p enlazante
23 Síntesis rgánica 23 Los orbitales moleculares tienen energías que se distribuyen simétricamente por arriba y por debajo de la energía de los orbitales p originales En el estado fundamental del etileno los dos electrones que constituyen el enlace π se encuentran en el orbital molecular de enlace y el orbital molecular antienlazante está vacío. Al orbital molecular enlazante se le denomina orbital M, del inglés ighest ccupied Molecular rbital. Al orbital vacío π* antienlazante se le denomina LUM, del inglés Lowest Unoccupied Molecular rbital. b) rbitales moleculares frontera del 1,3-butadieno. En un dieno conjugado, como el 1,3-butadieno, los orbitales atómicos p desde C1 a C4 se solapan dando un sistema extendido de cuatro orbitales moleculares π, denominados ψ 1, ψ 2, ψ 3 y ψ 4. Dos de los orbitales moleculares son enlazantes y los otros dos son antienlazantes. El orbital molecular de mínima energía ψ 1 se forma por solapamiento de las funciones de onda de los orbitales p, cuyas fases positivas se solapan constructivamente en una cara de la molécula, y cuyas fases negativas se solapan constructivamente en la otra cara de la molécula. Un orbital molecular es enlazante si el número de interacciones enlazantes es mayor que el número de interacciones antienlazantes. Como el número de interacciones antienlazantes es igual al número de nodos se puede también afirmar que un orbital molecular es enlazante si el número de interacciones enlazantes es mayor que el número de nodos. El orbital molecular ψ 1 tiene tres interacciones de enlace entre C1-C2, C2-C3 y C3-C4 y ninguna interacción antienlazante, o lo que es lo mismo: ningún nodo. Por tanto, es un orbital molecular enlazante. Sistema de orbitales moleculares del 1,3-butadieno ψ ψ 3 LUM ψ 2 M energía ψ 1 niveles de energía del estado fundamental
24 Tema 7 24 El segundo orbital molecular ψ 2 tiene un nodo en el centro de la molécula y presenta dos interacciones de enlace entre C1-C2 y C3-C4 y una interacción antienlazante entre C2-C3. Como el número de interacciones enlazantes es mayor que el número de nodos el orbital molecular ψ 2 es enlazante. El tercer orbital molecular ψ 3 tiene dos nodos y presenta una interacción de enlace entre C2-C3 y dos de antienlace entre C1-C2 y C3-C4. Globalmente es un orbital antienlazante porque el número de nodos es mayor que el número de interacciones enlazantes. El cuarto orbital molecular ψ 4 no tiene interacciones de enlace y presenta tres nodos. Es un orbital molecular antienlazante y es el de máxima energía. Cada orbital molecular del 1,3-butadieno puede dar cabida a dos electrones. Como el 1,3-butadieno tiene cuatro electrones π los orbitales moleculares que se llenan primero son los dos de menor energía. Por tanto, en el estado fundamental del 1,3-butadieno los dos orbitales moleculares ψ 1 y ψ 2 están llenos y los dos antienlazantes ψ 3 y ψ 4 están vacíos. El orbital ocupado de más alta energía (orbital M) es el ψ 2, y el orbital vacío de menor energía (orbital LUM) es el ψ 3. c) La reacción de Diels-Alder mediante el sistema de orbitales frontera. Las interacciones orbitálicas que explican la reacción de Diels-Alder son las que se producen entre los orbitales frontera del dieno y del dienólifo y por tanto la cicloadición [42] puede tener lugar mediante la interacción entre el M dieno -LUM dienófilo o mediante la interacción LUM dieno -M dienófilo. ψ 4 LUM dieno ψ 3 π* LUM dienófilo energía M dieno ψ 2 π M dienófilo ψ butadieno etileno
25 Síntesis rgánica 25 Para que se produzca la reacción de Diels-Alder, y cualquier otra reacción, los orbitales de las dos especies reactivas deben aproximarse a la distancia de enlace. En una reacción Diels-Alder el solapamiento orbitálico mas eficiente tiene lugar cuando el dieno y el dienófilo se aproximan en planos paralelos. En el siguiente esquema orbitálico se aprecia cómo la aproximación en planos paralelos permite el solapamiento en fase de los orbitales moleculares frontera del dieno y del dienófilo: M dieno (ψ 2 ) LUM dieno (ψ 3 ) LUM dienófilo (π*) M dienófilo (π) La aproximación del dieno y del dienófilo en planos paralelos y la formación concertada de enlaces explican, como se verá más adelante, la estereoselectividad y la estereoespecificidad de la reacción de Diels-Alder. Anteriormente se ha visto que la reacción ente el ciclopentadieno y el etileno sólo tiene lugar en condiciones muy drásticas de presión y temperatura. De igual modo, la reacción entre el 1.3-butadieno y el etileno proporciona tan sólo un 16% de ciclohexeno después de 17 horas de reacción a 200ºC y 4500 psi de presión. Estas condiciones de reacción tan drásticas contrastan con las de la reacción entre el 1,3-butadieno y el acrilato de etilo, que tiene lugar a temperatura ambiente y presión atmosférica, proporcionando el producto de cicloadición casi con rendimiento cuantitativo. En la siguiente figura se describen las interacciones M dieno - LUM dienófilo para la reacción del 1,3-butadieno con el etileno y con el acrilato de etilo. En el esquema sólo se representan, para mayor claridad, los dos orbitales frontera del 1,3-butadieno. Se puede apreciar que el nivel de energía de los orbitales moleculares del acrilato de etilo es menor que el de los orbitales moleculares del etileno, lo cual se explica por la conjugación del doble
26 Tema 7 26 enlace con el grupo éster. La disminución del nivel de energía de los orbitales moleculares del acrilato implica una menor diferencia de energía entre los orbitales frontera M butadieno -LUM acrilato (9.07 ev), lo que se traduce en una mayor efectividad del solapamiento orbitálico y en una mayor velocidad de la reacción. Por otra parte, el diferencia de energía entre el M butadieno - LUM etileno es de ev, lo que explica por qué los dienófilos que no contienen grupos electrón-atrayentes reaccionan con los dienos en condiciones mucho más duras que las que requieren los dienófilos como el acrilato interaciones M dieno -LUM dienófilo del butadieno con el etileno y el acrilato de etilo energía 1.5 ev π* LUM dienófilo E = ev ψ 3 LUM dieno ev π* LUM dienófilo E = ev ev π etileno M dienófilo ψ 2 M dieno ev π M dienófilo 1,3-butadieno CEt acrilato de etilo
27 Síntesis rgánica 27 Estereoespecificidad de la reacción de Diels-Alder. La reacción de Diels-Alder es estereoespecífica porque la configuración de los reactivos se transmite íntegramente al producto de la reacción. Si los sustituyentes del dienófilo son cis serán cís en el producto. Si son trans serán trans en el producto, tal y como se indica en las reacciones que se dan a continuación: CC 3 C 3 CC 3 C 3 dienófilo cis producto cis 3 C CC 3 CC 3 C 3 dienófilo trans producto trans De igual modo, la estereoquímica del dieno también se transmite con total fidelidad al producto de la reacción de Diels-Alder: C 3 C 3 NC NC CN CN C 3 C 3 CN CN CN CN C 3 C 3 NC NC CN CN C 3 C 3 CN CN CN CN La reacción de Diels-Alder es estereoespecífica porque es concertada: todos los enlaces se forman y se rompen al mismo tiempo y por tanto la estereoquímica de los reactivos se transmite íntegramente a los productos de la reacción.
28 Tema 7 28 perfil de energía de una reacción Diels-Alder estado de transición energía reactivos producto coordenada de reacción Estereoselectividad de la reacción de Diels-Alder. Cuando el dieno es un compuesto cíclico el producto de la reacción de Diels-Alder es un aducto bicíclico con puente. La reacción puede dar lugar a dos aductos diastereoisómericos denominados endo y exo. CC 3 CC 3 CC 3 endo exo Si el sustituyente del dienófilo está situado lejos del puente el aducto es el endo. Si el sustituyente está situado cerca del puente el producto de la reacción se denomina exo. Si la reacción se efectúa bajo condiciones de control cinético el isómero mayoritario de la reacción es el endo. (producto de control cinético, pcc). Este aducto se forma más rápidamente que el aducto exo (producto de control termodinámico, pct) debido a que el estado de transición que lo genera presenta interacciones orbitálicas secundarias que lo estabilizan:
29 Síntesis rgánica 29 interacción orbitálica secundaria 3 CC 3 C CC 3 estado de transición endo producto endo CC 3 CC 3 CC 3 estado de transición exo producto exo El producto endo se forma más rápidamente que el exo, pero en condiciones de control termodinámico el compuesto que se formará mayoritariamente es el exo, que es más estable que el endo porque tiene menos intereacciones estéricas. energía endo (cct) exo (pct) coodenada de reacción
30 Tema 7 30 Regioselectividad en la reacción de Diels-Alder En la reacción entre el 1-metoxi-1,3-butadieno y la acroleína se pueden formar dos productos de cicloadición: el 2-metoxi-3-ciclohexenocarbaldehído y el 5-metoxi-3-ciclohexenocarbaldehído. El primero de ellos es el producto mayoritario de la reacción: C 3 C 1-metoxi-1,3-butadieno C 3 C 2-metoxi-3-ciclohexenocarbaldehido mayoritario C 3 C 5-metoxi-3-ciclohexenocarbaldehído minoritario Por otra parte, la reacción Diels-Alder entre el 2-etoxi-1,3-butadieno y el acrilato de etilo proporciona mayoritariamente el 4-etoxi-3- ciclohexenocarboxilato de metilo. Et CC 3 2-etoxi-1,3-butadieno Et CC 3 4-etoxi-3-ciclohexenocarboxilato de metilo mayoritario Et CC 3 3-etoxi-3-ciclohexenocarboxilato de metilo minoritario Por comparación con las reacciones de Sustitución Electrofílica Aromática (S E Ar) se dice que las reacciones Diels-Alder son orto y para dirigentes. Esta preferencia de la reacción de Diels-Alder se puede explicar asumiendo que el estado de transición favorecido será el que presente una mayor interacción M-LUM, que es la que tiene lugar entre los átomos de carbono con los mayores coeficientes orbitálicos (en valor absoluto). Los coeficientes orbitálicos del orbital molecular M, en el 1-metoxi- 1,3-butadieno, son y 0561 en C1 y C4 respectivamente. Los coeficientes orbitálicos del LUM de la acroleína son y en C2 y C3 respectivamente. La orientación favorecida entre el dieno y el dienófilo es la que solapa el C4 del dieno (0.561 en valor absoluto) con el C3 del dienófilo (0.593).
31 Síntesis rgánica Me C metoxi-1,3-butadieno acroleína aproximación orto aproximación meta Me C Me mayoritario C C Me Me minoritario C
32 Tema 7 32 Desconexiones de aductos Diels-Alder. Las reacciones de Diels-Alder originan anillos ciclohexénicos. Para proponer el producto de la reacción y la posición correcta de los nuevos enlaces σ y π es aconsejable seguir el movimiento de los electrones mediante flechas. Del mismo modo se puede desconectar un anillo ciclohexénico al dieno y al dienófilo originales mediante la ayuda de flechas tal y como se describe en el siguiente esquema X D-A X retro D-A dieno dienófilo aducto ciclohexénico El compuesto tricíclico que se indica a continuación se puede desconectar, mediante la metodología anterior, al dieno y al dienófilo que se indican en el esquema: Retrosíntesis D-A dieno dienófilo (1) El problema de esta desconexión es que surge un dienófilo (compuesto 1) que es un mal dienófilo porque el doble enlace no está conjugado con un grupo electrón-atrayente. Si se emplea este compuesto en la reacción de Diels-Alder el rendimiento de la reacción será, casi con toda seguridad, muy bajo. Una alternativa podría ser la lactona 2, o bien el compuesto 3, que es el anhídrido maleico. Este último compuesto podría ser incluso superior al compuesto 2, porque al ser un dienófilo simétrico no planteará problemas de regioselectividad.
33 Síntesis rgánica 33 Equivalentes sintéticos del dienófilo 1 dienófilo 2 (g-butirolactona) dienófilo 1 dienófilo 3 (anhidrido maleico) Por otra parte, el dieno que surge de la desconexión, el 1-vinilciclohexeno, se puede analizar del modo que se indica a continuación: Retrosíntesis del 1-vinilciclohexeno IGF 1,1 1-vinilciclohexeno C-C La síntesis de este compuesto sería: BrMg TF 3 P 4 1-vinilciclohexeno La reacción de Diels-Alder entre el 1-vinilciclohexeno y el anhídrido maleico, en condiciones de control cinético, dará lugar estereoselectivamente al producto endo tal y como se describe a continuación:
34 Tema 7 34 estado de transición endo aducto endo La reacción de Diels-Alder anterior genera, de forma estereocontrolada tres nuevos centros asimétricos. Para poner de manifiesto la potencialidad sintética de esta reacción hay que tener en cuenta que en una reacción en la que se originen tres nuevos estereocentros se pueden formar un total de 8 estereoisómeros (2 3 ). La reacción anterior sólo forma dos: el que está dibujado en el esquema y su enantiómero. La formación del enantiómero es inevitable. Como el dieno y el dienófilo son aquirales el producto de la reacción es una mezcla racémica. El otro enantiómero se forma mediante la orientación alternativa: estado de transición enantiomérico endo aducto enantiomérico endo El producto final se obtendrá a partir del aducto Diles-Alder por reducción con LiAl 4, lo que proporcionará un diol, que mediante deshidratación catalizada por ácidos dará lugar al anillo de tetrahidrofuránico:
35 Síntesis rgánica 35 aducto D-A LiAl 4 TF diol - - 2
Dienos aislados. Dienos conjugados. Dienos acumulados (alenos)
 TEMA 10.- Hidrocarburos poliinsaturados. Clasificación. Dienos conjugados. Reacciones de adición. Cicloadiciones. Reacciones de Diels-Alder. Un dieno es un compuesto orgánico que tiene dos enlaces dobles.
TEMA 10.- Hidrocarburos poliinsaturados. Clasificación. Dienos conjugados. Reacciones de adición. Cicloadiciones. Reacciones de Diels-Alder. Un dieno es un compuesto orgánico que tiene dos enlaces dobles.
TEMA 8 SÍNTESIS DE ALQUENOS. Miguel Carda
 TEMA 8 SÍNTESIS DE ALQUENS Miguel arda Tema 8. Síntesis de alquenos 8.1. Síntesis de alquenos por deshidratación de alcoholes y derivados. 8.2. Síntesis de alquenos mediante la reacción de Wittig. 8.2.1.
TEMA 8 SÍNTESIS DE ALQUENS Miguel arda Tema 8. Síntesis de alquenos 8.1. Síntesis de alquenos por deshidratación de alcoholes y derivados. 8.2. Síntesis de alquenos mediante la reacción de Wittig. 8.2.1.
Tema 10. El empleo de nitrocompuestos en síntesis. Acidez. Alquilación de nitrocompuestos.
 Síntesis rgánica 1 Tema 10. El empleo de nitrocompuestos en síntesis. Acidez. Alquilación de nitrocompuestos. Los nitrocompuestos alifaticos se caracterizan por ser particularmente acidos. Por ejemplo,
Síntesis rgánica 1 Tema 10. El empleo de nitrocompuestos en síntesis. Acidez. Alquilación de nitrocompuestos. Los nitrocompuestos alifaticos se caracterizan por ser particularmente acidos. Por ejemplo,
Tema 3.- Síntesis de aminas. Aminas primarias: Quimioselectividad. Reactivos para el sintón NH 2 -.
 Síntesis rgánica 1 Tema 3.- Síntesis de aminas. Aminas primarias: Quimioselectividad. eactivos para el sintón 2 -. Una amina se puede analizar como un compuesto C-X. Una desconexión análoga ya se ha visto
Síntesis rgánica 1 Tema 3.- Síntesis de aminas. Aminas primarias: Quimioselectividad. eactivos para el sintón 2 -. Una amina se puede analizar como un compuesto C-X. Una desconexión análoga ya se ha visto
Mecanismo de las reacciones orgánicas
 TEMA 3.- Mecanismos e intermedios de reacción. Tipos de reacciones. Reacciones concertadas y reacciones por pasos. Tipos de mecanismos. Nucleófilos y electrófilos. Intermedios de reacción: iones carbonio,
TEMA 3.- Mecanismos e intermedios de reacción. Tipos de reacciones. Reacciones concertadas y reacciones por pasos. Tipos de mecanismos. Nucleófilos y electrófilos. Intermedios de reacción: iones carbonio,
ALCOHOLES. Estructura: grupo
 TEMA 16.- Alcoholes, fenoles y tioles. Clasificación y propiedades generales. Carácter ácido. Reacciones de desplazamiento y eliminación. Reacciones de oxidación. R- Ar- R-SH alcohol fenol tiol ALCOLES
TEMA 16.- Alcoholes, fenoles y tioles. Clasificación y propiedades generales. Carácter ácido. Reacciones de desplazamiento y eliminación. Reacciones de oxidación. R- Ar- R-SH alcohol fenol tiol ALCOLES
Carbocationes. sp 3. Formación de Carbocationes
 arbocationes Los carbocationes son intermediarios orgánicos en los que el carbono está cargado positivamente. Una gran cantidad de reacciones orgánicas proceden a través de la formación de carbocationes.
arbocationes Los carbocationes son intermediarios orgánicos en los que el carbono está cargado positivamente. Una gran cantidad de reacciones orgánicas proceden a través de la formación de carbocationes.
Capitulo 3 Síntesis de aminas
 Capitulo 3 Síntesis de aminas 3.1. Aspectos generales en la síntesis de aminas. 3.1.1. Quimioselectividad debida al impedimento estérico. 3.1.2. Quimioselectividad debida al efecto electrónico. 3.1.3.
Capitulo 3 Síntesis de aminas 3.1. Aspectos generales en la síntesis de aminas. 3.1.1. Quimioselectividad debida al impedimento estérico. 3.1.2. Quimioselectividad debida al efecto electrónico. 3.1.3.
TEMA 2 REACTIVIDAD QUÍMICA Y REACCIONES ORGÁNICAS
 TEMA 2 REATIVIDAD QUÍMIA Y REAIONES ORGÁNIAS 1. Introducción. 2. Tipos de reacciones orgánicas. 3. Reacciones características de los grupos funcionales. 4. aracterísticas de las reacciones orgánicas. 5.
TEMA 2 REATIVIDAD QUÍMIA Y REAIONES ORGÁNIAS 1. Introducción. 2. Tipos de reacciones orgánicas. 3. Reacciones características de los grupos funcionales. 4. aracterísticas de las reacciones orgánicas. 5.
Lección 11: HALUROS DE ALQUILO III
 Lección 11: HALUROS DE ALQUILO III 1. Reacciones de eliminación. 1.1. Mecanismos E2 y E1. 1.2. Regioselectividad y estereoquímica de las reacciones de eliminación. 2. Competencia entre sustituciones y
Lección 11: HALUROS DE ALQUILO III 1. Reacciones de eliminación. 1.1. Mecanismos E2 y E1. 1.2. Regioselectividad y estereoquímica de las reacciones de eliminación. 2. Competencia entre sustituciones y
Definición Bronsted-Lowry
 TEMA 4.- Acidos y bases. Propiedades ácido-base de los compuestos orgánicos. Grupos funcionales con carácter ácido. Grupos funcionales con carácter básico. Fuerza de los ácidos. Fuerza de las bases. Acidez
TEMA 4.- Acidos y bases. Propiedades ácido-base de los compuestos orgánicos. Grupos funcionales con carácter ácido. Grupos funcionales con carácter básico. Fuerza de los ácidos. Fuerza de las bases. Acidez
León Felipe Otálvaro Tamayo 1 REACCIONES ÁCIDO-BASE
 León Felipe tálvaro Tamayo 1 REACCINES ÁCID-BASE emos visto que en general, las reacciones en química orgánica ocurren entre nucleófilos y electrófilos, de cara a que un enlace es formado entre el centro
León Felipe tálvaro Tamayo 1 REACCINES ÁCID-BASE emos visto que en general, las reacciones en química orgánica ocurren entre nucleófilos y electrófilos, de cara a que un enlace es formado entre el centro
DIENOS. Los dienos conjugados son aquellos donde los enlaces dobles se alternan con enlaces simples. Ej: 1,3-pentadieno CH 2 =CH-CH=CH-CH 3
 Teoría de Química Orgánica I DIENOS Un hidrocarburo que contiene dos dobles enlaces se denomina dieno y la relación entre los dobles enlaces puede clasificarse como aislados, conjugados o acumulados. Los
Teoría de Química Orgánica I DIENOS Un hidrocarburo que contiene dos dobles enlaces se denomina dieno y la relación entre los dobles enlaces puede clasificarse como aislados, conjugados o acumulados. Los
Química del carbono: estudio de algunas funciones orgánicas
 Química del carbono: estudio de algunas funciones orgánicas Contenidos Estructura y enlaces en moléculas orgánicas: geometría y polaridad. Isomería geométrica. Relación entre fuerzas intermoleculares y
Química del carbono: estudio de algunas funciones orgánicas Contenidos Estructura y enlaces en moléculas orgánicas: geometría y polaridad. Isomería geométrica. Relación entre fuerzas intermoleculares y
acetileno enlace σ C sp -C sp enlace σ C sp -H 1s H C C H C C sistema de orbitales σ del acetileno sistema de orbitales π del acetileno
 Química rgánica Tema 7. Alquinos 1 Tema 7. Alquinos. Estructura. Nomenclatura de los alquinos. Acidez de los alquinos. Reacciones de los alquinos: adiciones electrofílicas al triple enlace. Adición de
Química rgánica Tema 7. Alquinos 1 Tema 7. Alquinos. Estructura. Nomenclatura de los alquinos. Acidez de los alquinos. Reacciones de los alquinos: adiciones electrofílicas al triple enlace. Adición de
QUÍMICA ORGÁNICA PARA CIENCIAS DE LA SALUD
 QUÍMICA ORGÁNICA PARA CIENCIAS DE LA SALUD PROYECTO EDITORIAL BIBLIOTECA DE QUÍMICAS Director: Carlos Seoane Prado Catedrático de Química Orgánica Universidad Complutense de Madrid Queda prohibida, salvo
QUÍMICA ORGÁNICA PARA CIENCIAS DE LA SALUD PROYECTO EDITORIAL BIBLIOTECA DE QUÍMICAS Director: Carlos Seoane Prado Catedrático de Química Orgánica Universidad Complutense de Madrid Queda prohibida, salvo
ALCOHOLES Y FENOLES: REACCIONES DE PREPARACIÓN, REACTIVIDAD Y MECANISMOS DE REACCIÓN
 Universidad Privada Antonio Guillermo Urrelo Facultad de Ciencias de la Salud Farmacia y Bioquímica ALCOHOLES Y FENOLES: REACCIONES DE PREPARACIÓN, REACTIVIDAD Y MECANISMOS DE REACCIÓN Mg. Q.F. PATRICIA
Universidad Privada Antonio Guillermo Urrelo Facultad de Ciencias de la Salud Farmacia y Bioquímica ALCOHOLES Y FENOLES: REACCIONES DE PREPARACIÓN, REACTIVIDAD Y MECANISMOS DE REACCIÓN Mg. Q.F. PATRICIA
SUSTITUCIÓN NUCLEOFÍLICA. Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de San Carlos de Guatemala
 SUSTITUCIÓN NUCLEOFÍLICA Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de San Carlos de Guatemala Polaridades de algunos grupos Observe la polaridad de los grupos
SUSTITUCIÓN NUCLEOFÍLICA Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de San Carlos de Guatemala Polaridades de algunos grupos Observe la polaridad de los grupos
TEORÍA DEL ENLACE DE VALENCIA
 Esta teoría supone que: TEORÍA DEL ENLACE DE VALENCIA Dos átomos forman un enlace covalente cuando se superponen o solapan orbitales atómicos de ambos, originando una zona común de alta densidad electrónica
Esta teoría supone que: TEORÍA DEL ENLACE DE VALENCIA Dos átomos forman un enlace covalente cuando se superponen o solapan orbitales atómicos de ambos, originando una zona común de alta densidad electrónica
REACCIÓN. Las herramientas sintéticas. ticas. Mayor reactividad Vía a externa. Reacción química
 Las herramientas sintéticas ticas 1. onceptos de química orgánica aplicables al diseño de síntesis de fármacos María Font.. Dpto. Química rgánica y Farmacéutica. Sección n de Modelización Molecular. Universidad
Las herramientas sintéticas ticas 1. onceptos de química orgánica aplicables al diseño de síntesis de fármacos María Font.. Dpto. Química rgánica y Farmacéutica. Sección n de Modelización Molecular. Universidad
Sistemas conjugados. Resonancia. Aromaticidad.
 Sistemas conjugados. Resonancia. Aromaticidad. Preparado por Licda. Nora Guzmán Basado en: Dr. Carlos A. Rius, Depto.Química Orgánica, Facultad de Química,UNAM. Lic. Mario M. Rodas, Depto. Química Orgánica,
Sistemas conjugados. Resonancia. Aromaticidad. Preparado por Licda. Nora Guzmán Basado en: Dr. Carlos A. Rius, Depto.Química Orgánica, Facultad de Química,UNAM. Lic. Mario M. Rodas, Depto. Química Orgánica,
TEMA 1: Introducción a la Química. Reacción química: leyes. Mol y Número de Avogadro. Estequiometría y disoluciones.
 TEMA 1: Introducción a la Química. Reacción química: leyes. Mol y Número de Avogadro. Estequiometría y disoluciones. 1. Introducción: sustancias puras (elementos y compuestos); transformaciones de la materia
TEMA 1: Introducción a la Química. Reacción química: leyes. Mol y Número de Avogadro. Estequiometría y disoluciones. 1. Introducción: sustancias puras (elementos y compuestos); transformaciones de la materia
EJERCICIOS DE SELECTIVIDAD 99/00
 EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
ACIDOS CARBOXILICOS Y DERIVADOS
 TEMA 20.- Acidos carboxílicos, derivados de ácido y nitrilos. Naturaleza del grupo carboxilo. Clasificación y propiedades generales. Carácter ácido. Reacciones de sustitución nucleofílica. Reacciones de
TEMA 20.- Acidos carboxílicos, derivados de ácido y nitrilos. Naturaleza del grupo carboxilo. Clasificación y propiedades generales. Carácter ácido. Reacciones de sustitución nucleofílica. Reacciones de
Tema 10 Sistemas insaturados conjugados
 Tema 10 Sistemas insaturados conjugados Sistemas alílicos. Estructura de los dienos conjugados. Calores de hidrogenación de dienos. Síntesis de dienos. Reactividad de los dienos conjugados. La reacción
Tema 10 Sistemas insaturados conjugados Sistemas alílicos. Estructura de los dienos conjugados. Calores de hidrogenación de dienos. Síntesis de dienos. Reactividad de los dienos conjugados. La reacción
Enlace químico: moléculas diatómicas
 Química General e Inorgánica A Enlace químico: moléculas diatómicas Tema 5 Los electrones de valencia son los electrones del nivel exterior de un átomo. Los electrones de valencia son los electrones que
Química General e Inorgánica A Enlace químico: moléculas diatómicas Tema 5 Los electrones de valencia son los electrones del nivel exterior de un átomo. Los electrones de valencia son los electrones que
Comparación entre los calores de hidrogenación del 1-penteno y del trans-2-penteno. 2.6 Kcal/mol. Hº = kcal/mol
 Química rgánica Tema 8. Dienos 1 Tema 8. Dienos conjugados: estructura y estabilidad. Reacciones de adición a dienos conjugados. ontrol cinético y control termodinámico en la adición de al 1,3- butadieno.
Química rgánica Tema 8. Dienos 1 Tema 8. Dienos conjugados: estructura y estabilidad. Reacciones de adición a dienos conjugados. ontrol cinético y control termodinámico en la adición de al 1,3- butadieno.
Enlace covalente: Teoría del enlace de valencia. Hibridación.
 Enlace covalente: Teoría del enlace de valencia. Hibridación. Valencia covalente o covalencia de un elemento: número de electrones que comparte con otros átomos. Un átomo puede desaparear electrones promocionándolos
Enlace covalente: Teoría del enlace de valencia. Hibridación. Valencia covalente o covalencia de un elemento: número de electrones que comparte con otros átomos. Un átomo puede desaparear electrones promocionándolos
TEMA 1. QUÍMICA ORGÁNICA.
 TEMA 1. QUÍMICA ORGÁNICA. I. TIPOS DE REACTIVOS ORGÁNICOS: En las reacciones químicas se distingue entre dos tipos de reactivos: I.1. Sustrato. Es la molécula reaccionante más grande. En el transcurso
TEMA 1. QUÍMICA ORGÁNICA. I. TIPOS DE REACTIVOS ORGÁNICOS: En las reacciones químicas se distingue entre dos tipos de reactivos: I.1. Sustrato. Es la molécula reaccionante más grande. En el transcurso
Clase 17: Reactividad de los Haluros de Alquilo y algo de estereoquímica en Reacciones
 Clase 17: Reactividad de los Haluros de Alquilo y algo de estereoquímica en Reacciones Mario Manuel Rodas Morán Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de
Clase 17: Reactividad de los Haluros de Alquilo y algo de estereoquímica en Reacciones Mario Manuel Rodas Morán Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de
TEMA 6 ESTEREOSELECTIVIDAD, ESTEREOESPECIFICIDAD Y ENANTIOSELECTIVIDAD. Miguel Carda
 TEMA 6 ESTERESELECTIVIDAD, ESTEREESPECIFICIDAD Y ENANTISELECTIVIDAD Miguel Carda Tema 6. Reacciones estereoselectivas, estereoespecíficas y enantioselectivas 6.1 Reacciones estereoselectivas. 6.2. Reacciones
TEMA 6 ESTERESELECTIVIDAD, ESTEREESPECIFICIDAD Y ENANTISELECTIVIDAD Miguel Carda Tema 6. Reacciones estereoselectivas, estereoespecíficas y enantioselectivas 6.1 Reacciones estereoselectivas. 6.2. Reacciones
TEMA 8.- TEORÍA DE ENLACE QUÍMICO Y GEOMETRÍA MOLECULAR.
 TEMA 8.- TEORÍA DE ENLACE QUÍMICO Y GEOMETRÍA MOLECULAR. 1. Geometría Molecular. Modelo de repulsión de par electrónico en la capa de valencia (VSEPR). 2. Polaridad de las especies químicas polinucleares.
TEMA 8.- TEORÍA DE ENLACE QUÍMICO Y GEOMETRÍA MOLECULAR. 1. Geometría Molecular. Modelo de repulsión de par electrónico en la capa de valencia (VSEPR). 2. Polaridad de las especies químicas polinucleares.
ejercicios propuestos
 INGRESO ESCUELA NAVAL MILITAR QUÍMICA ejercicios propuestos 1. El átomo está constituido principalmente por: a) Fotones, neutrones y protones. b) Protones, neutrones y electrones. c) Electrones, aniones
INGRESO ESCUELA NAVAL MILITAR QUÍMICA ejercicios propuestos 1. El átomo está constituido principalmente por: a) Fotones, neutrones y protones. b) Protones, neutrones y electrones. c) Electrones, aniones
PROGRAMA DE QUÍMICA ESTRUCTURA ATÓMICA Y CLASIFICACIÓN PERIÓDICA DE LOS ELEMENTOS
 PROGRAMA DE QUÍMICA La asignatura se ajustará al programa oficial (Decreto 115/2008, de 6 de junio, por el que se establece el currículo de Bachillerato en Extremadura- DOE, nº 117, de 18 de junio de 2008-).
PROGRAMA DE QUÍMICA La asignatura se ajustará al programa oficial (Decreto 115/2008, de 6 de junio, por el que se establece el currículo de Bachillerato en Extremadura- DOE, nº 117, de 18 de junio de 2008-).
Tema 6. Miguel Carda y Eva Falomir Universidad Jaume I
 Tema 6 ALCLES,, FENLES Y ÉTEES Miguel Carda y Eva Falomir Universidad Jaume I TEMA 6 ALCLES, FENLES Y ÉTEES BLQUE TEMÁTIC VI: ALCLES, FENLES Y ÉTEES Unidad temática VI.1. Alcoholes VI.1.1. Acidez de
Tema 6 ALCLES,, FENLES Y ÉTEES Miguel Carda y Eva Falomir Universidad Jaume I TEMA 6 ALCLES, FENLES Y ÉTEES BLQUE TEMÁTIC VI: ALCLES, FENLES Y ÉTEES Unidad temática VI.1. Alcoholes VI.1.1. Acidez de
Momentos dipolares de un éter y Momento dipolar general O R 114º. 1.43A o 1.43A 0.96A 0.96A O H CH 3 H CH 3 110º 104.5º 108.9º.
 Química rgánica Tema 4. Éteres y epóxidos 1 Tema 4. Éteres y epóxidos. Estructura y propiedades de los éteres. Nomenclatura de los éteres. Síntesis de Williamson de éteres. Síntesis de éteres por deshidratación
Química rgánica Tema 4. Éteres y epóxidos 1 Tema 4. Éteres y epóxidos. Estructura y propiedades de los éteres. Nomenclatura de los éteres. Síntesis de Williamson de éteres. Síntesis de éteres por deshidratación
Capitulo 11. Grupo Nitro en síntesis orgánica
 Capitulo 11. Grupo Nitro en síntesis orgánica 11.1. Introducción. 11.2. Nitración de compuestos aromáticos 11.3. El empleo de nitrocompuestos en síntesis. 11.3.1. Reacción de Henry 11.3.2. Reacción de
Capitulo 11. Grupo Nitro en síntesis orgánica 11.1. Introducción. 11.2. Nitración de compuestos aromáticos 11.3. El empleo de nitrocompuestos en síntesis. 11.3.1. Reacción de Henry 11.3.2. Reacción de
Tema 5. Estereoselectividad: reacciones estereoespecíficas. Reacciones estereoselectivas. Control en las reacciones estereoselectivas.
 Síntesis rgánica 1 Tema 5. Estereoselectividad: reacciones estereoespecíficas. Reacciones estereoselectivas. Control en las reacciones estereoselectivas. Una reacción estereoselectiva es aquella que conduce
Síntesis rgánica 1 Tema 5. Estereoselectividad: reacciones estereoespecíficas. Reacciones estereoselectivas. Control en las reacciones estereoselectivas. Una reacción estereoselectiva es aquella que conduce
Tendencias Periódicas- Problemas de Revisión
 Tendencias Periódicas- Problemas de Revisión PSI Química Nombre Tamaño atómico 1. Ordena los siguientes elementos según su tamaño atómico creciente: P, Cs, Sn, F, Sr, Tl 2. Ordena los siguientes elementos
Tendencias Periódicas- Problemas de Revisión PSI Química Nombre Tamaño atómico 1. Ordena los siguientes elementos según su tamaño atómico creciente: P, Cs, Sn, F, Sr, Tl 2. Ordena los siguientes elementos
Modelo de repulsión de pares de electrones en la capa de valencia Forma molecular y polaridad molecular. Hibridación de orbitales y enlaces múltiples
 GEOMETRÍA MOLECULAR Y TEORÍADE ENLACE Modelo de repulsión de pares de electrones en la capa de valencia Forma molecular y polaridad molecular Teoría de enlace de valencia Hibridación de orbitales y enlaces
GEOMETRÍA MOLECULAR Y TEORÍADE ENLACE Modelo de repulsión de pares de electrones en la capa de valencia Forma molecular y polaridad molecular Teoría de enlace de valencia Hibridación de orbitales y enlaces
QUÍMICA DEL CARBONO Principales Tipos de Reacciones Orgánicas
 1/5 DEL ARBN Para realizar un estudio completo de los compuestos de carbono, es necesario también conocer las propiedades químicas de los mismos, es decir, su reactividad. Una parte muy importante de la
1/5 DEL ARBN Para realizar un estudio completo de los compuestos de carbono, es necesario también conocer las propiedades químicas de los mismos, es decir, su reactividad. Una parte muy importante de la
León Felipe Otálvaro Tamayo 1 TÓPICO 3 LA LÓGICA DE LAS REACCIONES QUÍMICAS (MECANISMOS).
 León Felipe tálvaro Tamayo 1 TÓPI 3 LA LÓGIA DE LAS REAINES QUÍMIAS (MEANISMS). Un mecanismo es una descripción paso a paso de cómo las reacciones químicas ocurren. ada paso implica algún tipo de formación
León Felipe tálvaro Tamayo 1 TÓPI 3 LA LÓGIA DE LAS REAINES QUÍMIAS (MEANISMS). Un mecanismo es una descripción paso a paso de cómo las reacciones químicas ocurren. ada paso implica algún tipo de formación
UNIVERSDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA III. Integrante: Fecha de entrega: 26/06/2011 Giselle Velasco
 UNIVERSDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA III Integrante: Fecha de entrega: 6/06/011 Giselle Velasco Carrera: Quimica Pura. Trabajo # Tema: Acidez de los Acidos Carboxílicos
UNIVERSDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA III Integrante: Fecha de entrega: 6/06/011 Giselle Velasco Carrera: Quimica Pura. Trabajo # Tema: Acidez de los Acidos Carboxílicos
MODELOS ATÓMICOS Y PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. CUESTIONES.
 MODELOS ATÓMICOS Y PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. CUESTIONES. E2A.S2013 Para los siguientes elementos Na, P, S y Cl, diga razonadamente cuál es: a.- El de menor energía de ionización. b.- El
MODELOS ATÓMICOS Y PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. CUESTIONES. E2A.S2013 Para los siguientes elementos Na, P, S y Cl, diga razonadamente cuál es: a.- El de menor energía de ionización. b.- El
ACIDOS Y BASES. QUÍMICA ORGÁNICA I (Q) Facultad de CC.QQ. y Farmacia USAC Segundo Semestre 2014
 ACIDOS Y BASES QUÍMICA ORGÁNICA I (Q) Facultad de CC.QQ. y Farmacia USAC Segundo Semestre 2014 Ácidos y Bases Los términos acido y base pueden tener diferente significado, dependiendo del contexto. La
ACIDOS Y BASES QUÍMICA ORGÁNICA I (Q) Facultad de CC.QQ. y Farmacia USAC Segundo Semestre 2014 Ácidos y Bases Los términos acido y base pueden tener diferente significado, dependiendo del contexto. La
Estabilidad de Alquenos Sistemas conjugados. Resonancia. Aromaticidad.
 Estabilidad de Alquenos Sistemas conjugados. Resonancia. Aromaticidad. Preparado por Licda. Nora Guzmán Basado en: Dr. Carlos A. Rius, Depto.Química Orgánica, Facultad de Química,UNAM. Lic. Mario M. Rodas,
Estabilidad de Alquenos Sistemas conjugados. Resonancia. Aromaticidad. Preparado por Licda. Nora Guzmán Basado en: Dr. Carlos A. Rius, Depto.Química Orgánica, Facultad de Química,UNAM. Lic. Mario M. Rodas,
Reacción de Diels-Alder
 Reacción de Diels-Alder Dieno Dienófilo Ciclohexeno Biciclo[2,2,1]hept-2-eno 1 APUNTES DE QUÍMICA ORGANICA II Profesor Silvia Contreras 2 UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUÍMICA
Reacción de Diels-Alder Dieno Dienófilo Ciclohexeno Biciclo[2,2,1]hept-2-eno 1 APUNTES DE QUÍMICA ORGANICA II Profesor Silvia Contreras 2 UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUÍMICA
REACCIONES EN QUÍMICA ORGÁNICA (II)
 (II) ALCOHOLES Y FENOLES Propiedades físicas de los alcoholes y fenoles El oxígeno es mucho más electronegativo que el carbono y que el hidrógeno por lo tanto, los alcoholes son compuestos polares. Cuando
(II) ALCOHOLES Y FENOLES Propiedades físicas de los alcoholes y fenoles El oxígeno es mucho más electronegativo que el carbono y que el hidrógeno por lo tanto, los alcoholes son compuestos polares. Cuando
Química Orgánica Compuestos orgánicos y reactividad
 Química Orgánica Compuestos orgánicos y reactividad IES La Magdalena. Avilés. Asturias El hecho de que el carbono posea una electronegatividad (2,55), intermedia entre el valor máximo (3,98 para el flúor)
Química Orgánica Compuestos orgánicos y reactividad IES La Magdalena. Avilés. Asturias El hecho de que el carbono posea una electronegatividad (2,55), intermedia entre el valor máximo (3,98 para el flúor)
El equilibrio ácido-base en los compuestos orgánicos
 ESTRUCTURA-REACTIVIDAD DE LAS MOLÉCULAS ORGÁNICAS (I) El equilibrio ácido-base en los compuestos orgánicos Teoría de Arrhenius Según la teoría de Arrhenius, desarrollada a finales del siglo XIX, un ácido
ESTRUCTURA-REACTIVIDAD DE LAS MOLÉCULAS ORGÁNICAS (I) El equilibrio ácido-base en los compuestos orgánicos Teoría de Arrhenius Según la teoría de Arrhenius, desarrollada a finales del siglo XIX, un ácido
QUíMICA DEL CARBONO. 1. Consulta tu tabla periódica y completa la siguiente información acerca del carbono.
 El Carbono es un elemento que da origen a una gran variedad de compuestos. En 1807, Berzellius clasificó los productos químicos en inorgánicos: los que proceden de la materia inanimada, como el CO, CO
El Carbono es un elemento que da origen a una gran variedad de compuestos. En 1807, Berzellius clasificó los productos químicos en inorgánicos: los que proceden de la materia inanimada, como el CO, CO
Propiedades Tabla Periódica
 Propiedades Tabla Periódica Profesor Gustavo L. Propiedades Tabla Periódica 1 Un poco de historia... 2 En 1869, el químico ruso Dimitri Mendeleev propuso por primera vez que los elementos químicos exhibían
Propiedades Tabla Periódica Profesor Gustavo L. Propiedades Tabla Periódica 1 Un poco de historia... 2 En 1869, el químico ruso Dimitri Mendeleev propuso por primera vez que los elementos químicos exhibían
Enlaces químicos II: Geometría molecular e hibridación de orbitales atómicos
 Enlaces químicos II: Geometría molecular e hibridación de orbitales atómicos Capítulo 10 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Modelo de repulsión de
Enlaces químicos II: Geometría molecular e hibridación de orbitales atómicos Capítulo 10 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Modelo de repulsión de
Capitulo 5. Estereoquímica.
 Capitulo 5. Estereoquímica. 5.1. Selectividad 5.1.1. Reacciones estereoespecíficas. 5.1.2. Reacciones estereoselectivas. 5.1.3. Control en las reacciones estereoselectivas. Como se observo en el capitulo
Capitulo 5. Estereoquímica. 5.1. Selectividad 5.1.1. Reacciones estereoespecíficas. 5.1.2. Reacciones estereoselectivas. 5.1.3. Control en las reacciones estereoselectivas. Como se observo en el capitulo
Dienos conjugados y polienos.
 DIENOS Y POLIENOS Dienos conjugados y polienos. Cuando los dobles enlaces están separados por dos o más enlaces sencillos no interaccionan entre ellos y se les denomina enlaces dobles aislados, como en
DIENOS Y POLIENOS Dienos conjugados y polienos. Cuando los dobles enlaces están separados por dos o más enlaces sencillos no interaccionan entre ellos y se les denomina enlaces dobles aislados, como en
GUIA Nº 2 DE CIENCIAS PARA 7º B. Realizar los tipos de energía con 3 ejemplos ilustrarlo cada uno y explicarlo.
 GUIA Nº 2 DE CIENCIAS PARA 7º B Realizar los tipos de energía con 3 ejemplos ilustrarlo cada uno y explicarlo. Investigar la energía mecánica con sus formulas. La teoría atómica con sus enlaces, átomos,
GUIA Nº 2 DE CIENCIAS PARA 7º B Realizar los tipos de energía con 3 ejemplos ilustrarlo cada uno y explicarlo. Investigar la energía mecánica con sus formulas. La teoría atómica con sus enlaces, átomos,
Tiene electrones en 15 orbitales y tiene 2 capas llenas de electrones: la 1ª y la 2ª
 EJERCICIOS RESUELTOS DEL LIBRO 12. Fe: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 a) la combinación de (3,2,-1), será debido a: n=3, indica que el nivel energético es el 3º l=2,indica que el tipo de orbital es
EJERCICIOS RESUELTOS DEL LIBRO 12. Fe: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 a) la combinación de (3,2,-1), será debido a: n=3, indica que el nivel energético es el 3º l=2,indica que el tipo de orbital es
PRUEBA OPTATIVA DE CIENCIAS FORMA C40 MÓDULO ELECTIVO QUÍMICA
 PRUEBA OPTATIVA DE CIENCIAS FORMA C40 MÓDULO ELECTIVO QUÍMICA Para la solución de algunos de los ejercicios propuestos en esta prueba, se adjunta una parte del Sistema Periódico hasta el elemento Nº 20
PRUEBA OPTATIVA DE CIENCIAS FORMA C40 MÓDULO ELECTIVO QUÍMICA Para la solución de algunos de los ejercicios propuestos en esta prueba, se adjunta una parte del Sistema Periódico hasta el elemento Nº 20
BLOQUE TEMÁTICO VI. ALCOHOLES, FENOLES Y ÉTERES (Problemas)
 LQUE TEMÁTI VI LLES, FENLES Y ÉTERES (Problemas) Química rgánica I-www.sinorg.uji.es 3 Problema 6.1. Proponga mecanismos que expliquen las siguientes reacciones: a) b) Problema 6.2. eduzca cuáles serán
LQUE TEMÁTI VI LLES, FENLES Y ÉTERES (Problemas) Química rgánica I-www.sinorg.uji.es 3 Problema 6.1. Proponga mecanismos que expliquen las siguientes reacciones: a) b) Problema 6.2. eduzca cuáles serán
Problemas numéricos y Cuestiones. Capítulo 6
 1. Escriba las estructuras de Lewis para los siguientes compuestos iónicos: (a) cloruro de calcio; (b) sulfuro de bario; c) óxido de litio; d) fluoruro de sodio; e) nitruro de magnesio Todas estas estructuras
1. Escriba las estructuras de Lewis para los siguientes compuestos iónicos: (a) cloruro de calcio; (b) sulfuro de bario; c) óxido de litio; d) fluoruro de sodio; e) nitruro de magnesio Todas estas estructuras
LA TABLA PERIÓDICA. 2ºbachillerato QUÍMICA
 LA TABLA PERIÓDICA 2ºbachillerato QUÍMICA 1 A lo lo largo de la la historia, los químicos han intentado ordenar los elementos de forma agrupada, de tal manera que aquellos que posean propiedades similares
LA TABLA PERIÓDICA 2ºbachillerato QUÍMICA 1 A lo lo largo de la la historia, los químicos han intentado ordenar los elementos de forma agrupada, de tal manera que aquellos que posean propiedades similares
Tema 4. Propiedades generales. Propiedades generales de los elementos no metálicos. Propiedades generales de los óxidos y de los haluros a lo largo
 Tema 4. Propiedades generales. Propiedades generales de los elementos no metálicos. Propiedades generales de los óxidos y de los haluros a lo largo del sistema periódico. Variación del carácter iónicocovalente.
Tema 4. Propiedades generales. Propiedades generales de los elementos no metálicos. Propiedades generales de los óxidos y de los haluros a lo largo del sistema periódico. Variación del carácter iónicocovalente.
Comparación entre los calores de hidrogenación del 1-penteno y del trans-2-penteno. 2.6 Kcal/mol. Hº = kcal/mol
 Química rgánica 1 conjugados: estructura y estabilidad. Reacciones de adición a dienos conjugados. ontrol cinético y control termodinámico en la adición de Br al 1,3- butadieno. Reacciones de desplazamiento
Química rgánica 1 conjugados: estructura y estabilidad. Reacciones de adición a dienos conjugados. ontrol cinético y control termodinámico en la adición de Br al 1,3- butadieno. Reacciones de desplazamiento
TEMA 1(II) REACCIONES ORGÁNICAS. Consideraciones generales
 TEMA 1(II) REACCIONES ORGÁNICAS Consideraciones generales 1(II).1 REACCIÓN QUÍMICA. MECANISMOS DE REACCIÓN Una reacción química es sencillamente la transformación de uno o varios compuestos en otro u otros.
TEMA 1(II) REACCIONES ORGÁNICAS Consideraciones generales 1(II).1 REACCIÓN QUÍMICA. MECANISMOS DE REACCIÓN Una reacción química es sencillamente la transformación de uno o varios compuestos en otro u otros.
Estructuras de Lewis
 Estructuras de Lewis La forma más sencilla de simbolizar la estructura electrónica y el enlace en una molécula covalente es mediante estructuras de Lewis. ada electrón de valencia se representan mediante
Estructuras de Lewis La forma más sencilla de simbolizar la estructura electrónica y el enlace en una molécula covalente es mediante estructuras de Lewis. ada electrón de valencia se representan mediante
PROPIEDADES Y REACCIONES DE LOS HALOALCANOS (I): LA SUBSTITUCIÓN NUCLEOFÍLICA BIMOLECULAR
 PROPIEDADES Y REACCIONES DE LOS HALOALCANOS (I): LA SUBSTITUCIÓN NUCLEOFÍLICA BIMOLECULAR Propiedades Físicas de los Haloalcanos Las propiedades físicas de los haloalcanos son completamente diferentes
PROPIEDADES Y REACCIONES DE LOS HALOALCANOS (I): LA SUBSTITUCIÓN NUCLEOFÍLICA BIMOLECULAR Propiedades Físicas de los Haloalcanos Las propiedades físicas de los haloalcanos son completamente diferentes
ESTRUCTURA ATÓMICA TABLA PERIÓDICA UNIÓN QUÍMICA
 ESTRUCTURA ATÓMICA TABLA PERIÓDICA UNIÓN QUÍMICA Teoría Atómica de DALTON 1- Los elementos químicos están constituidos por partículas denominadas átomos 2- Átomos de un mismo elemento, tienen las mismas
ESTRUCTURA ATÓMICA TABLA PERIÓDICA UNIÓN QUÍMICA Teoría Atómica de DALTON 1- Los elementos químicos están constituidos por partículas denominadas átomos 2- Átomos de un mismo elemento, tienen las mismas
Qué estudiamos en Química Orgánica? ÁTOMOS Y ELECTRONES! ENLACE QUÍMICO
 Química Orgánica I Qué estudiamos en Química Orgánica? Cómo los compuestos orgánicos reaccionan: Rompimiento y formación de enlaces. Enlaces que se forman cuando átomos comparten electrones, enlaces que
Química Orgánica I Qué estudiamos en Química Orgánica? Cómo los compuestos orgánicos reaccionan: Rompimiento y formación de enlaces. Enlaces que se forman cuando átomos comparten electrones, enlaces que
Tema 3. Enlace químico
 Tema 3. Enlace químico Teoría de Lewis Enlace iónico Enlace covalente Parámetros de enlace Forma de las moléculas Polaridad de las moléculas Teoría del enlace de valencia Enlace químico Modo de combinarse
Tema 3. Enlace químico Teoría de Lewis Enlace iónico Enlace covalente Parámetros de enlace Forma de las moléculas Polaridad de las moléculas Teoría del enlace de valencia Enlace químico Modo de combinarse
GUIA DE APRENDIZAJE QUIMICA 1º MEDIO TEMA : CONFIGURACIÓN ELECTRÓNICA
 Liceo Juan Antonio Ríos Quinta Normal GUIA DE APRENDIZAJE QUIMICA 1º MEDIO TEMA : CONFIGURACIÓN ELECTRÓNICA Unidad temática: Estructura atómica Objetivo General:Comprender el comportamiento de los electrones
Liceo Juan Antonio Ríos Quinta Normal GUIA DE APRENDIZAJE QUIMICA 1º MEDIO TEMA : CONFIGURACIÓN ELECTRÓNICA Unidad temática: Estructura atómica Objetivo General:Comprender el comportamiento de los electrones
Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p
 1s Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p Diagrama de orbitales: Consiste en dibujar los orbitales como cuadrados
1s Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p Diagrama de orbitales: Consiste en dibujar los orbitales como cuadrados
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2010. Fase general OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
Estructura atómica: tipos de enlaces
 Estructura atómica: tipos de enlaces Estructura de los átomos Modelo atómico de Bohr Masa (g) Carga (C) Protón 1.673 x 10-24 1.602 x 10-19 Neutrón 1.675 x 10-24 0 Electrón 9.109 x 10-28 1.602 x 10-19 Los
Estructura atómica: tipos de enlaces Estructura de los átomos Modelo atómico de Bohr Masa (g) Carga (C) Protón 1.673 x 10-24 1.602 x 10-19 Neutrón 1.675 x 10-24 0 Electrón 9.109 x 10-28 1.602 x 10-19 Los
4.- Establezca las diferencias entre los siguientes términos: a) órbita y orbital; b) nivel y subnivel
 TEMA 3 CONFIGURACIÓN ELECTRÓNICA Y TABLA PERIÓDICA. A. Números Cuánticos. Significado y Valores Permitidos 1.- Compare los modelos atómicos de Thomson, Rufherford y Bohr. 2.- Mencione el aporte fundamental
TEMA 3 CONFIGURACIÓN ELECTRÓNICA Y TABLA PERIÓDICA. A. Números Cuánticos. Significado y Valores Permitidos 1.- Compare los modelos atómicos de Thomson, Rufherford y Bohr. 2.- Mencione el aporte fundamental
PROGRAMA QUÍMICA 2015-2016
 PROGRAMA QUÍMICA 2015-2016 1. Conceptos comunes. Transformaciones físicas y químicas. Leyes ponderales de la química. Masas atómicas y masas moleculares. Número de Avogadro. Mol. Fórmula empírica y fórmula
PROGRAMA QUÍMICA 2015-2016 1. Conceptos comunes. Transformaciones físicas y químicas. Leyes ponderales de la química. Masas atómicas y masas moleculares. Número de Avogadro. Mol. Fórmula empírica y fórmula
TEORÍA DE ORBITALES MOLECULARES DE HÜCKEL
 TEORÍA DE ORBITALES MOLECULARES DE HÜCKEL Principios básicos. El método de orbitales moleculares de Hückel (HMO) constituye la aproximación más simple de la teoría de orbitales moleculares. Su aplicación
TEORÍA DE ORBITALES MOLECULARES DE HÜCKEL Principios básicos. El método de orbitales moleculares de Hückel (HMO) constituye la aproximación más simple de la teoría de orbitales moleculares. Su aplicación
EL ENLACE QUÍMICO. La unión consiste en que uno o más electrones de valencia de algunos de los átomos se introduce en la esfera electrónica del otro.
 EL ENLACE QUÍMICO Electrones de valencia La unión entre los átomos se realiza mediante los electrones de la última capa exterior, que reciben el nombre de electrones de valencia. La unión consiste en que
EL ENLACE QUÍMICO Electrones de valencia La unión entre los átomos se realiza mediante los electrones de la última capa exterior, que reciben el nombre de electrones de valencia. La unión consiste en que
FUERZAS INTERMOLECULARES
 DEPARTAMENTO DE CIENCIAS QUÍMICA - IB FUERZAS INTERMOLECULARES Existen fuerzas de atracción entre las moléculas (fuerzas intermoleculares). Ellas son las responsables de que los gases condensen (pasar
DEPARTAMENTO DE CIENCIAS QUÍMICA - IB FUERZAS INTERMOLECULARES Existen fuerzas de atracción entre las moléculas (fuerzas intermoleculares). Ellas son las responsables de que los gases condensen (pasar
Química general Primera Unidad: LA QUÍMICA UNA CIENCIA BÁSICA
 Química general Primera Unidad: LA QUÍMICA UNA CIENCIA BÁSICA Describe los fundamentos de la formación de enlace iónicos y covalentes y su relación con la polaridad de las moléculas resultantes. Mg. Emilio
Química general Primera Unidad: LA QUÍMICA UNA CIENCIA BÁSICA Describe los fundamentos de la formación de enlace iónicos y covalentes y su relación con la polaridad de las moléculas resultantes. Mg. Emilio
TEMA 2: DISTRIBUCIÓN ELECTRÓNICA Y TABLA PERIÓDICA.
 TEMA 2: DISTRIBUCIÓN ELECTRÓNICA Y TABLA PERIÓDICA. 1.- Distribución electrónica. La distribución electrónica o configuración electrónica es el modo en que se sitúan los electrones en la corteza de los
TEMA 2: DISTRIBUCIÓN ELECTRÓNICA Y TABLA PERIÓDICA. 1.- Distribución electrónica. La distribución electrónica o configuración electrónica es el modo en que se sitúan los electrones en la corteza de los
Compuestos carbonílicos ALDEHIDOS Y CETONAS. Compuestos carbonílicos C R 2 C R 2 R 2 R 1. ácido carboxílico éster lactona (éster cíclico) C Cl C N
 ompuestos carbonílicos ALDEIDS Y ETNAS ompuestos carbonílicos aldehído 1 cetona 2 2 2 1 1 ácido carboxílico éster lactona (éster cíclico) l 1 2 cloruro de ácido anhídrido 1 N 1 N 2 1 N 2 1 N 2 3 3 amidas
ompuestos carbonílicos ALDEIDS Y ETNAS ompuestos carbonílicos aldehído 1 cetona 2 2 2 1 1 ácido carboxílico éster lactona (éster cíclico) l 1 2 cloruro de ácido anhídrido 1 N 1 N 2 1 N 2 1 N 2 3 3 amidas
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS PRUEBA ESPECÍFICA QUÍMICA
 PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
INFORME LABORATORIO, QUÍMICA GENERAL DEYMER GÓMEZ CORREA FERNEY OSORIO BARAHONA PROPIEDADES QUÍMICAS DE LOS HIDROCARBUROS
 INFORME LABORATORIO, QUÍMICA GENERAL DEYMER GÓMEZ CORREA FERNEY OSORIO BARAHONA PROPIEDADES QUÍMICAS DE LOS HIDROCARBUROS PROFESORA: SOL HELENA GIRALDO UNIVERSIDAD DE ANTIOQUIA F.Q.F. INGENIERÍA DE ALIMENTOS
INFORME LABORATORIO, QUÍMICA GENERAL DEYMER GÓMEZ CORREA FERNEY OSORIO BARAHONA PROPIEDADES QUÍMICAS DE LOS HIDROCARBUROS PROFESORA: SOL HELENA GIRALDO UNIVERSIDAD DE ANTIOQUIA F.Q.F. INGENIERÍA DE ALIMENTOS
acetileno enlace σ C sp -C sp enlace σ C sp -H 1s H C C H C C sistema de orbitales π del acetileno Química Orgánica Tema 7.
 Química rgánica Tema 7. Alquinos 1 Tema 7. Alquinos. Estructura. Nomenclatura de los alquinos. Acidez de los alquinos. eacciones de los alquinos: adiciones electrofílicas al triple enlace. Adición de hidrácidos
Química rgánica Tema 7. Alquinos 1 Tema 7. Alquinos. Estructura. Nomenclatura de los alquinos. Acidez de los alquinos. eacciones de los alquinos: adiciones electrofílicas al triple enlace. Adición de hidrácidos
Reacciones Pericíclicas
 Reacciones Pericíclicas Reacciones de compuestos orgánicos Reacción polar Reacción radicalaria Antes de 1960, la reactividad en química orgánica estaba pensada como dominada por factores que incluian:
Reacciones Pericíclicas Reacciones de compuestos orgánicos Reacción polar Reacción radicalaria Antes de 1960, la reactividad en química orgánica estaba pensada como dominada por factores que incluian:
Fundamentos de Química 1er Curso de los Grados en Ingeniería de los Recursos Energéticos y de los Recursos Mineros 1
 Departamento de Ingeniería Química y Química Inorgánica Universidad de Cantabria (SPAIN) Fundamentos de Química 1er Curso de los Grados en Ingeniería de los Recursos Energéticos y de los Recursos Mineros
Departamento de Ingeniería Química y Química Inorgánica Universidad de Cantabria (SPAIN) Fundamentos de Química 1er Curso de los Grados en Ingeniería de los Recursos Energéticos y de los Recursos Mineros
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Septiembre,
En un grupo. En un período
 Propiedades Periódicas Radio atómico Potencial de ionización Electroafinidad Electronegatividad Radio atómico (r): es la distancia desde el núcleo al último electrón del átomo Sabemos que r n Al aumentar
Propiedades Periódicas Radio atómico Potencial de ionización Electroafinidad Electronegatividad Radio atómico (r): es la distancia desde el núcleo al último electrón del átomo Sabemos que r n Al aumentar
Tema 4. Tema 4: Clasificación Periódica de los elementos químicos. 4.1 Introducción
 Tema 4: Clasificación Periódica de los elementos químicos 4.1 Introducción 4. Descripción de la Tabla Periódica 4.3 Base electrónica de la clasificación periódica 4.4 Propiedades periódicas AJ1.13-1, PHH10,
Tema 4: Clasificación Periódica de los elementos químicos 4.1 Introducción 4. Descripción de la Tabla Periódica 4.3 Base electrónica de la clasificación periódica 4.4 Propiedades periódicas AJ1.13-1, PHH10,
27/04/2011. Tabla Periódica Propiedades Periódicas Radio atómico Potencial de ionización Electroafinidad Electronegatividad.
 Propiedades Periódicas Radio atómico Potencial de ionización Electroafinidad Electronegatividad Radio atómico (r): es la distancia desde el núcleo al último electrón del átomo En un período Sabemos que
Propiedades Periódicas Radio atómico Potencial de ionización Electroafinidad Electronegatividad Radio atómico (r): es la distancia desde el núcleo al último electrón del átomo En un período Sabemos que
6.1. LAS CARACTERÍSTICAS DE LOS SERES VIVOS. Átomos y estructura atómica
 6.1. LAS CARACTERÍSTICAS DE LOS SERES VIVOS En este epígrafe se desarrollan las características que diferencian a los seres vivos. Una de ellas es la complejidad molecular, que se debe a la inmensa variedad
6.1. LAS CARACTERÍSTICAS DE LOS SERES VIVOS En este epígrafe se desarrollan las características que diferencian a los seres vivos. Una de ellas es la complejidad molecular, que se debe a la inmensa variedad
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 3, Opción B Reserva 1, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 3, Opción B Reserva 1, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva 3, Ejercicio
El enlace iónico. Los cationes y los aniones están unidos por la fuerza electroestática.
 El enlace iónico Los elementos con bajas energías de ionización tienden a formar cationes, en cambio los elementos con alta afinidad electrónicas tienden a formar aniones. Los metales alcalinos (IA) y
El enlace iónico Los elementos con bajas energías de ionización tienden a formar cationes, en cambio los elementos con alta afinidad electrónicas tienden a formar aniones. Los metales alcalinos (IA) y
Tema 9 ALQUINOS. Miguel Carda y Eva Falomir Universidad Jaume I
 Tema 9 ALQUINOS Miguel Carda y Eva Falomir Universidad Jaume I TEMA 9 ALQUINOS BLOQUE TEMÁTICO IX: ALQUINOS Unidad temática IX. Alquinos IX.1 Acidez de los alquinos IX.1. Adiciones electrófilas al triple
Tema 9 ALQUINOS Miguel Carda y Eva Falomir Universidad Jaume I TEMA 9 ALQUINOS BLOQUE TEMÁTICO IX: ALQUINOS Unidad temática IX. Alquinos IX.1 Acidez de los alquinos IX.1. Adiciones electrófilas al triple
Por qué se unen los átomos?
 Enlace Químico Por qué se unen los átomos? Los átomos se unen entre sí porque al estar unidos alcanzan una situación más estable (menos energética) que cuando estaban separados. En adelante podremos hablar
Enlace Químico Por qué se unen los átomos? Los átomos se unen entre sí porque al estar unidos alcanzan una situación más estable (menos energética) que cuando estaban separados. En adelante podremos hablar
TALLER DE RECUPERACIÓN Química Orgánica (nomenclatura básica, alcanos, alquenos y alquinos)
 COLEGO SANTA ROSA DE LMA BOGOTÁ CAMPO DE CONOCMENTO CENTÍFCO Y TECNOLÓGCO QUMCA BÓLOGO ESP JUAN ORTEGA TALLER DE RECUPERACÓN Química Orgánica (nomenclatura básica, alcanos, alquenos y alquinos) Lee el
COLEGO SANTA ROSA DE LMA BOGOTÁ CAMPO DE CONOCMENTO CENTÍFCO Y TECNOLÓGCO QUMCA BÓLOGO ESP JUAN ORTEGA TALLER DE RECUPERACÓN Química Orgánica (nomenclatura básica, alcanos, alquenos y alquinos) Lee el
Propiedades Periódicas
 Propiedades Periódicas Radio atómico Definición: La mitad de la distancia entre los centros de dos átomos vecinos. Estimar el tamaño de los átomos es un poco complicado debido a la naturaleza difusa de
Propiedades Periódicas Radio atómico Definición: La mitad de la distancia entre los centros de dos átomos vecinos. Estimar el tamaño de los átomos es un poco complicado debido a la naturaleza difusa de
ÁCIDO-BASE TEORÍA DE ARRHENIUS
 ÁCIDO-BASE TEORÍA DE ARRHENIUS Ácido es toda sustancia que en disolución acuosa se disocia con formación de iones de hidrógeno, H +, o protones. HA + H 2 O A -- + H + Base es toda sustancia que en disolución
ÁCIDO-BASE TEORÍA DE ARRHENIUS Ácido es toda sustancia que en disolución acuosa se disocia con formación de iones de hidrógeno, H +, o protones. HA + H 2 O A -- + H + Base es toda sustancia que en disolución
