U N A M. Facultad de Ingeniería. M. C. Q. Alfredo Velásquez Márquez U N A M. Facultad de Ingeniería
|
|
|
- Bernardo Valenzuela Peña
- hace 7 años
- Vistas:
Transcripción
1 U A M úmeros Cuánticos M C Q Alfredo Velásquez Márquez U A M Los números cuánticos son variables involucradas en la ecuación de onda de chrödinger Dependiendo de los valores de los números cuánticos, se obtienen diferentes soluciones para la ecuación de onda Estas soluciones permiten conocer los lugares de máxima probabilidad para ubicar a un electrón dentro de un átomo 1
2 U A M Los números cuánticos obtenidos de la ecuación de onda son tres: - El número cuántico principal - El número cuántico secundario, también llamado número cuántico azimutal o número cuántico de momento angular - El número cuántico magnético U A M úmero Cuántico Principal El número cuántico principal, se denota con un una letra n y su valor indica la órbita o nivel energético en el que se encuentra el electrón, mientras mayor sea el valor de n, más alejado está el electrón del núcleo, y mayor es su contenido energético 2
3 U A M Los valores que adquiere n, son números enteros mayores de cero; así por ejemplo: Cuando n = 1, el electrón se encuentra en la órbita 1 Cuando, el electrón se encuentra en la órbita 2 Cuando n = 3, el electrón se encuentra en la órbita 3 Cuando n = x, el electrón se encuentra en la órbita x U A M úmero Cuántico ecundario El número cuántico secundario, se denota con una letra l y su valor indica la subórbita o subnivel de energía en el que se encuentra el electrón Dicha subórbita o subnivel energético, también llamado orbital, se puede entender como la forma geométrica que describe el electrón al moverse dentro del átomo 3
4 U A M Para cada valor de n, l adquiere diferentes valores enteros, que van desde cero hasta n-1; así por ejemplo: Cuando n = 1, l adquiere un solo valor: Cuando, l adquiere dos valores: y 1 Cuando n = 3, l adquiere tres valores:, 1 y 2 U A M Como se mencionó anteriormente, los orbitales son formas geométricas que describen los electrones al moverse en el interior del átomo Estas formas geométricas son diferentes para cada valor de l, y a cada orbital se le asigna una literal 4
5 U A M s l = 1 p l = 2 d U A M Cuando l = 3, los orbitales son del tipo f; cuando l = 4, los orbitales son del tipo g y a partir de aquí, se van asignando las letras siguientes del abecedario Conforme aumenta el valor de l, aumenta la complejidad de la figura geométrica que describe el electrón; de hecho, aún no se han determinado las formas que presentan los orbitales del tipo g 5
6 U A M úmero Cuántico Magnético El número cuántico magnético, se denota con una letra m y sus valores indican las orientaciones que tienen los orbitales en el espacio U A M Para cada valor de l, m adquiere diferentes valores enteros que van desde l hasta +l, pasando por cero; así por ejemplo: Cuando, m adquiere un solo valor: Cuando l = 1, m adquiere tres valores: 1, y +1 Cuando l = 2, m adquiere cinco valores: 2, 1,, +1 y +2 6
7 U A M Con base en lo anterior, para las tres primeras órbitas de un átomo, se puede establecer la tabla siguiente: 1a Órbita 2a Órbita 3a Órbita n l () 1 (p) 1 (p) 2 (d) m U A M 1a Órbita 2a Órbita 3a Órbita n l () 1 (p) m (p) 2 (d) 1a Órbita 2a Órbita 1s 2s 2p x 2p y 2p z 3a Órbita 3s 3p 3p 3p 3d 3d 3d 3d 2-2 3d 2 7
8 U A M Al emplear los parámetros n, l y m en la ecuación de onda de onda de chrödinger, se logró conocer los lugares de máxima probabilidad (orbitales) para ubicar a un electrón dentro de un átomo, esto fue un gran avance para conocer la estructura electrónica del átomo y permitió justificar muchas características físicas y químicas de los elementos; sin embargo, fue necesario introducir un cuarto número cuántico, para tomar en cuenta los efectos relativistas y poder explicar el diamagnetismo y paramagnetismo que presentan los átomos de los elementos U A M úmero Cuántico de Espin El cuarto número cuántico se denota con una letra s y se le denomina número cuántico de espin o de giro del electrón Este número tiene dos valores por cada valor del número cuántico m; los valores son +½ y -½, y denotan los dos posibles giros del electrón alrededor de su propio eje 8
9 U A M orte magnético ur magnético ur magnético orte magnético U A M Hidrógeno: úmeros cuánticos del electrón n = 1 1s PARAMAGÉTICO 9
10 U A M Helio: 1s úmeros cuánticos de los electrones n = 1 n = 1 s = -1/2 DIAMAGÉTICO U A M Litio: es 1s 2s úmeros cuánticos de los electrones n = 1 n = 1 s = -1/2 PARAMAGÉTICO 1
11 U A M Berilio: es 1s n = 1 n = 1 2s DIAMAGÉTICO s = -1/2 s = -1/2 Boro: es 1s n = 1 n = 1 2s 2p x 2p y 2p z l = 1 m = -1 PARAMAGÉTICO s = -1/2 s = -1/2 11
2.2Evolución del modelo atómico:
 Tema 2.1.- El átomo. 2.2Evolución del modelo atómico: 2.2.- Modelo mecánico cuántico ondulatorio 2.2.1.- Números cuánticos 2.3.- Configuración electrónica 2.3.1.- normal, su desarrollo y mención de: spin.
Tema 2.1.- El átomo. 2.2Evolución del modelo atómico: 2.2.- Modelo mecánico cuántico ondulatorio 2.2.1.- Números cuánticos 2.3.- Configuración electrónica 2.3.1.- normal, su desarrollo y mención de: spin.
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I
 El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I 2012
 El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I 2012 Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I 2012 Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
GUIA TEÓRICA NÚMEROS CUÁNTICOS
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSE DE SUCRE VICE RECTORADO PUERTO ORDAZ DEPARTAMENTO DE ESTUDIOS GENERALES SECCIÓN DE QUÍMICA Asignatura: QUÍMICA I GUIA TEÓRICA NÚMEROS CUÁNTICOS
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSE DE SUCRE VICE RECTORADO PUERTO ORDAZ DEPARTAMENTO DE ESTUDIOS GENERALES SECCIÓN DE QUÍMICA Asignatura: QUÍMICA I GUIA TEÓRICA NÚMEROS CUÁNTICOS
Dónde se Ubica un Electrón?
 2do Medio > Química Números Cuánticos Dónde se Ubica un Electrón? En la naturaleza, toda la materia tiene volumen y ocupa un espacio. Por ejemplo, es bastante sencillo mirar a tu alrededor y darte cuenta
2do Medio > Química Números Cuánticos Dónde se Ubica un Electrón? En la naturaleza, toda la materia tiene volumen y ocupa un espacio. Por ejemplo, es bastante sencillo mirar a tu alrededor y darte cuenta
Universidad Nacional Experimental de las Fuerzas Armadas Extensión San Felipe Básico de Ingeniería NÚMEROS CUÁNTICOS
 LA CORTEZA ATÓMICA NÚMEROS CUÁNTICOS Órbita: Es un concepto que deriva de la teoría atómica de Bohr. Representa la trayectoria descrita por un electrón en su giro alrededor del núcleo. Orbital: Es un concepto
LA CORTEZA ATÓMICA NÚMEROS CUÁNTICOS Órbita: Es un concepto que deriva de la teoría atómica de Bohr. Representa la trayectoria descrita por un electrón en su giro alrededor del núcleo. Orbital: Es un concepto
CONFIGURACIÓN ELECTRÓNICA
 Profesor Gustavo L. CONFIGURACIÓN ELECTRÓNICA 15-04-2013 10:55 1 Introducción Definiciones: La configuración electrónica es el modo en el cual los electrones están ordenados en un átomo. Orbitales, por
Profesor Gustavo L. CONFIGURACIÓN ELECTRÓNICA 15-04-2013 10:55 1 Introducción Definiciones: La configuración electrónica es el modo en el cual los electrones están ordenados en un átomo. Orbitales, por
TEMA 1: Estructura Atómica
 TEMA 1: Estructura Atómica 1. Configuraciones electrónicas. 2. Propiedades periódicas: Energía de activación Afinidad electrónica Electronegatividad Descripción mecánico- cuántica del átomo: Orbitales
TEMA 1: Estructura Atómica 1. Configuraciones electrónicas. 2. Propiedades periódicas: Energía de activación Afinidad electrónica Electronegatividad Descripción mecánico- cuántica del átomo: Orbitales
CARACTER ONDULATORIO DE LOS ELECTRONES
 CARACTER ONDULATORIO DE LOS ELECTRONES Actualmente la idea intuitiva de Bor de que los electrones se encuentran en órbitas de energía determinada no se mantiene. Hoy se considera que no es posible conocer
CARACTER ONDULATORIO DE LOS ELECTRONES Actualmente la idea intuitiva de Bor de que los electrones se encuentran en órbitas de energía determinada no se mantiene. Hoy se considera que no es posible conocer
Clase N 1. Modelo Atómico II
 Pre-Universitario Manuel Guerrero Ceballos Clase N 1 Modelo Atómico II ICAL ATACAMA Módulo Plan Común Síntesis De La Clase Anterior Modelo atómico Átomo Divisible en Protón Neutrón Electrón Carga: +1 Masa:
Pre-Universitario Manuel Guerrero Ceballos Clase N 1 Modelo Atómico II ICAL ATACAMA Módulo Plan Común Síntesis De La Clase Anterior Modelo atómico Átomo Divisible en Protón Neutrón Electrón Carga: +1 Masa:
QUÍMICA COMÚN NÚMEROS CUÁNTICOS Y CONFIGURACIÓN ELECTRÓNICA
 QUÍMICA COMÚN QC-03 NÚMEROS CUÁNTICOS Y CONFIGURACIÓN ELECTRÓNICA 2014 REPRESENTACIÓN DE LOS ELECTRONES MEDIANTE LOS NÚMEROS CUÁNTICOS Como consecuencia del principio planteado por Heisenberg se deduce
QUÍMICA COMÚN QC-03 NÚMEROS CUÁNTICOS Y CONFIGURACIÓN ELECTRÓNICA 2014 REPRESENTACIÓN DE LOS ELECTRONES MEDIANTE LOS NÚMEROS CUÁNTICOS Como consecuencia del principio planteado por Heisenberg se deduce
PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS.
 PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS. 1. Explique que indica el número cuántico magnético y el número cuántico de espín. Número cuántico magnético:
PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS. 1. Explique que indica el número cuántico magnético y el número cuántico de espín. Número cuántico magnético:
QUÍMICA LICENCIATURA DE INGENIERÍA EN ENERGÍAS RENOVABLES
 QUÍMICA LICENCIATURA DE INGENIERÍA EN ENERGÍAS RENOVABLES 2013-1 Teoría: Dra. Karina Cuentas Gallegos Martes y jueves 10-12 hrs. Laboratorio: M.C. Mirna Guevara García Jueves 12-14 hrs. Curso de Química
QUÍMICA LICENCIATURA DE INGENIERÍA EN ENERGÍAS RENOVABLES 2013-1 Teoría: Dra. Karina Cuentas Gallegos Martes y jueves 10-12 hrs. Laboratorio: M.C. Mirna Guevara García Jueves 12-14 hrs. Curso de Química
Corteza atómica: Estructura electrónica
 Corteza atómica: Estructura electrónica Aunque los conocimientos actuales sobre la estructura electrónica de los átomos son bastante complejos, las ideas básicas son las siguientes: 1. Existen 7 niveles
Corteza atómica: Estructura electrónica Aunque los conocimientos actuales sobre la estructura electrónica de los átomos son bastante complejos, las ideas básicas son las siguientes: 1. Existen 7 niveles
Configuración Electrónica
 Configuración Electrónica La configuración electrónica de un átomo indica la forma como están distribuidos los electrones entre los distintos orbitales atómicos. Según el Principio de Exclusión de Pauli,
Configuración Electrónica La configuración electrónica de un átomo indica la forma como están distribuidos los electrones entre los distintos orbitales atómicos. Según el Principio de Exclusión de Pauli,
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO PRUEBA REFORZAMIENTO 1 MEDIO EXAMENES LIBRES
 COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO PRUEBA REFORZAMIENTO 1 MEDIO EXAMENES LIBRES ASIGNATURA: UNIDAD: OBJETIVO (S): CONTENIDO (S): QUIMICA I - II Reconocer las partículas que componen el átomo. MODELO
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO PRUEBA REFORZAMIENTO 1 MEDIO EXAMENES LIBRES ASIGNATURA: UNIDAD: OBJETIVO (S): CONTENIDO (S): QUIMICA I - II Reconocer las partículas que componen el átomo. MODELO
UNIDAD 5: ESTRUCTURA ATÓMICA CLASIFICACIÓN PERIÓDICA
 UNIDAD 5: ESTRUCTURA ATÓMICA CLASIFICACIÓN PERIÓDICA 1 Recordando la unidad 1, el átomo esta formado por un núcleo (con protones y neutrones) y una corteza de electrones. Composición del átomo: Atomo Núcleo
UNIDAD 5: ESTRUCTURA ATÓMICA CLASIFICACIÓN PERIÓDICA 1 Recordando la unidad 1, el átomo esta formado por un núcleo (con protones y neutrones) y una corteza de electrones. Composición del átomo: Atomo Núcleo
El átomo: sus partículas elementales
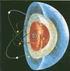 El átomo: sus partículas elementales Los rayos catódicos estaban constituidos por partículas cargadas negativamente ( a las que se llamo electrones) y que la relación carga/masa de éstas partículas era
El átomo: sus partículas elementales Los rayos catódicos estaban constituidos por partículas cargadas negativamente ( a las que se llamo electrones) y que la relación carga/masa de éstas partículas era
Línea de tiempo: Modelos Atómicos
 Línea de tiempo: Modelos Atómicos Modelo de Thomson 1904 Budín de pasas Demócrito (450 a. c) Teoría Atómica de Dalton1808 Modelo de Rutherford 1911 Modelo Atómico de Bohr1913 Fuente de energía V o Q Bohr
Línea de tiempo: Modelos Atómicos Modelo de Thomson 1904 Budín de pasas Demócrito (450 a. c) Teoría Atómica de Dalton1808 Modelo de Rutherford 1911 Modelo Atómico de Bohr1913 Fuente de energía V o Q Bohr
Surgió alrededor de 1925, como resultados de los trabajos realizados por diversos investigadores. Este modelo nos permite explicar la composición del
 Introducción al modelo mecano cuántico Surgió alrededor de 1925, como resultados de los trabajos realizados por diversos investigadores. Este modelo nos permite explicar la composición del átomo y algunos
Introducción al modelo mecano cuántico Surgió alrededor de 1925, como resultados de los trabajos realizados por diversos investigadores. Este modelo nos permite explicar la composición del átomo y algunos
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León.
 Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
Guía de trabajo Nº 4: ESTRUCTURA ATÓMICA. TABLA PERIÓDICA.
 Guía de trabajo Nº 4: ESTRUCTURA ATÓMICA. TABLA PERIÓDICA. EXPECTATIVAS DE LOGROS Reconocer los diferentes avances acerca de la estructura atómica Realizar un análisis de las limitaciones de cada modelo
Guía de trabajo Nº 4: ESTRUCTURA ATÓMICA. TABLA PERIÓDICA. EXPECTATIVAS DE LOGROS Reconocer los diferentes avances acerca de la estructura atómica Realizar un análisis de las limitaciones de cada modelo
PLAN DE NIVELACIÓN DE QUIMICA SEGUNDO PERIODO 2016 GRADO DECIMO. Nombre: Grado: 10º Fecha:
 PLAN DE NIVELACIÓN DE QUIMICA SEGUNDO PERIODO 2016 GRADO DECIMO Nombre: Grado: 10º Fecha: El trabajo de dos científicos Meyer y Mendeleiev, condujo a la organización de los elementos químicos en grupos
PLAN DE NIVELACIÓN DE QUIMICA SEGUNDO PERIODO 2016 GRADO DECIMO Nombre: Grado: 10º Fecha: El trabajo de dos científicos Meyer y Mendeleiev, condujo a la organización de los elementos químicos en grupos
CATEDRA DE QUIMICA GENERAL TSIA
 ECUACIÓN DE SCHRÖDINGER Fue Erwin Schrodinger, EN 1926quien ideó el modelo atómico actual, llamado "Ecuación de Onda", una fórmula matemática que considera los aspectos anteriores. La solución de esta
ECUACIÓN DE SCHRÖDINGER Fue Erwin Schrodinger, EN 1926quien ideó el modelo atómico actual, llamado "Ecuación de Onda", una fórmula matemática que considera los aspectos anteriores. La solución de esta
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA 1. Naturaleza de la materia (el átomo). 2. Modelos atómicos clásicos. 3. Modelo mecánico cuántico. 4. Mecánica ondulatoria de Schrödinger. 5. Números cuánticos. 6. Orbitales atómicos.
ESTRUCTURA DE LA MATERIA 1. Naturaleza de la materia (el átomo). 2. Modelos atómicos clásicos. 3. Modelo mecánico cuántico. 4. Mecánica ondulatoria de Schrödinger. 5. Números cuánticos. 6. Orbitales atómicos.
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica. Ing. Sol de María Jiménez González
 Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS. Tipos de radiaciones electromagnéticas según λ.
 RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS.
 PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS. PARTÍCULAS FUNDAMENTALES. CONCEPTOS PREVIOS De acuerdo con lo anterior, en un átomo hay tres partículas fundamentales: protones y neutrones,
PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS. PARTÍCULAS FUNDAMENTALES. CONCEPTOS PREVIOS De acuerdo con lo anterior, en un átomo hay tres partículas fundamentales: protones y neutrones,
ATOMO DE HIDROGENO. o = permitividad al vacío = 8.85 X C 2 N -1 cm -1. = metros. F = Newtons 2. Ó (3)
 ATOMO DE HIDROGENO I. Atomo de hidrógeno A. Descripción del sistema: Dos partículas que interaccionan por atracción de carga eléctrica y culómbica. 1. Ley de coulomb: a. En el sistema cgs en unidades de
ATOMO DE HIDROGENO I. Atomo de hidrógeno A. Descripción del sistema: Dos partículas que interaccionan por atracción de carga eléctrica y culómbica. 1. Ley de coulomb: a. En el sistema cgs en unidades de
EXTRUCTURA ATOMICA ACTUAL
 ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
Modelo Atómico. Thompson (1898): Esfera uniforme de materia con carga (+) en la cual se encuentran embebidos los electrones con carga (-)
 Modelo Atómico 1 Thompson (1898): Esfera uniforme de materia con carga (+) en la cual se encuentran embebidos los electrones con carga () Electrón Conceptos:» Neutralidad eléctrica» Carga elemental del
Modelo Atómico 1 Thompson (1898): Esfera uniforme de materia con carga (+) en la cual se encuentran embebidos los electrones con carga () Electrón Conceptos:» Neutralidad eléctrica» Carga elemental del
Configuraciones electrónicas. Química General I 2012
 Configuraciones electrónicas Química General I 2012 Configuración o notación electrónica Es el ordenamiento de los electrones dentro de la nube electrónica utilizando los números cuánticos. Se utiliza
Configuraciones electrónicas Química General I 2012 Configuración o notación electrónica Es el ordenamiento de los electrones dentro de la nube electrónica utilizando los números cuánticos. Se utiliza
1.2. NÚMEROS CUÁNTICOS.
 1.2. NÚMEROS CUÁNTICOS. 1.2.1. NÚMERO CUÁNTICO PRINCIPAL. En la corteza, los electrones se sitúan siguiendo caminos determinados llamados orbitales. Cada orbital está definido por tres números cuánticos,
1.2. NÚMEROS CUÁNTICOS. 1.2.1. NÚMERO CUÁNTICO PRINCIPAL. En la corteza, los electrones se sitúan siguiendo caminos determinados llamados orbitales. Cada orbital está definido por tres números cuánticos,
Tema 14 11/02/2005. Tema 8. Mecánica Cuántica. 8.1 Fundamentos de la mecánica cuántica
 Tema 14 11/0/005 Tema 8 Mecánica Cuántica 8.1 Fundamentos de la mecánica cuántica 8. La ecuación de Schrödinger 8.3 Significado físico de la función de onda 8.4 Soluciones de la ecuación de Schrödinger
Tema 14 11/0/005 Tema 8 Mecánica Cuántica 8.1 Fundamentos de la mecánica cuántica 8. La ecuación de Schrödinger 8.3 Significado físico de la función de onda 8.4 Soluciones de la ecuación de Schrödinger
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS Alexis Lema Jueves 10-12 ESPECTROSCOPIA UV-VIS. COMBINACIÓN LINEAL DE ORBITALES ATOMICOS (CLOA). ORBITALES ATOMICOS
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS Alexis Lema Jueves 10-12 ESPECTROSCOPIA UV-VIS. COMBINACIÓN LINEAL DE ORBITALES ATOMICOS (CLOA). ORBITALES ATOMICOS
QUIMICA Unidad N 3 : - ESTRUCTURA ATÓMICA
 QUIMICA Unidad N 3 : - ESTRUCTURA ATÓMICA Niels BOHR John DALTON 1 Profesora Mercedes Caratini - QUIMICA- ET 28 REPÚBLICA FRANCESA MODELO ATÓMICO ACTUAL El modelo atómico actual se construye a partir de
QUIMICA Unidad N 3 : - ESTRUCTURA ATÓMICA Niels BOHR John DALTON 1 Profesora Mercedes Caratini - QUIMICA- ET 28 REPÚBLICA FRANCESA MODELO ATÓMICO ACTUAL El modelo atómico actual se construye a partir de
ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS
 ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes.
ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes.
QM-2 GUÍA CURSOS ANUALES. Ciencias Plan Común. Química Números Cuánticos y Configuración Electrónica.
 QM-2 Ciencias Plan Común Química 2009 Números Cuánticos y Configuración Electrónica. Contenidos: La presente guía tiene por objetivo proporcionarte distintas instancias didácticas relacionadas con el proceso
QM-2 Ciencias Plan Común Química 2009 Números Cuánticos y Configuración Electrónica. Contenidos: La presente guía tiene por objetivo proporcionarte distintas instancias didácticas relacionadas con el proceso
QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA.
 Modelos atómicos QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA. Teoría atómica de Dalton: La materia está formada por átomos indivisibles. Los átomos de un elemento son distintos de los átomos de otro elemento
Modelos atómicos QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA. Teoría atómica de Dalton: La materia está formada por átomos indivisibles. Los átomos de un elemento son distintos de los átomos de otro elemento
Guía de Estudio para 1er Parcial Temas Selectos de Química
 Guía de Estudio para 1er Parcial Temas Selectos de Química 1. Menciona que científicos ordenaron los elementos conocidos en su época en triadas (grupos de tres), en octavas, por número atómico y quien
Guía de Estudio para 1er Parcial Temas Selectos de Química 1. Menciona que científicos ordenaron los elementos conocidos en su época en triadas (grupos de tres), en octavas, por número atómico y quien
Teoría atómica I: Modelos atómicos, estructura atómica y tipos de átomos. Teoría atómica II: Números cuánticos y configuración electrónica
 TEORÍA ATÓMICA Teoría atómica I: Modelos atómicos, estructura atómica y tipos de átomos Teoría atómica II: Números cuánticos y configuración electrónica Aprendizajes esperados Diferenciar los distintos
TEORÍA ATÓMICA Teoría atómica I: Modelos atómicos, estructura atómica y tipos de átomos Teoría atómica II: Números cuánticos y configuración electrónica Aprendizajes esperados Diferenciar los distintos
Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos
 Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos INTEGRANTES: * Nazate Amuy Ana * Veloz Hidalgo Polet TEMA: Combinación Lineal de Orbitales Atómicos ORBITAL ATÓMICO
Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos INTEGRANTES: * Nazate Amuy Ana * Veloz Hidalgo Polet TEMA: Combinación Lineal de Orbitales Atómicos ORBITAL ATÓMICO
Thompson (1898) Rutherford (1911) Bohr (1913) Schrödinger (1926) NUMEROS CUANTICOS
 Thompson (1898) Modelo Atómico Rutherford (1911) Bohr (1913) Propiedad corpuscular de las onda (PLANCK) Propiedad ondulatoria de las partículas (De Broglie) Schrödinger (1926) Números cuánticos 1 NUMEROS
Thompson (1898) Modelo Atómico Rutherford (1911) Bohr (1913) Propiedad corpuscular de las onda (PLANCK) Propiedad ondulatoria de las partículas (De Broglie) Schrödinger (1926) Números cuánticos 1 NUMEROS
Capítulo 3. Átomos Hidrogenoides.
 Capítulo 3. Átomos Hidrogenoides. Objetivos: Introducción del concepto de orbital atómico Descripción de los números cuánticos en los orbitales atómicos Justificación cualitativa de la cuantización de
Capítulo 3. Átomos Hidrogenoides. Objetivos: Introducción del concepto de orbital atómico Descripción de los números cuánticos en los orbitales atómicos Justificación cualitativa de la cuantización de
02/06/2014. Química Plan Común
 Química Plan Común Limitaciones del Modelo Atómico de Rutherford Según el modelo atómico de Rutherford, los electrones se mueven en órbitas circulares y tienen una aceleración normal. Pero según los principios
Química Plan Común Limitaciones del Modelo Atómico de Rutherford Según el modelo atómico de Rutherford, los electrones se mueven en órbitas circulares y tienen una aceleración normal. Pero según los principios
LOS ÁTOMOS. En una reacción química, la masa total de los reactivos es igual a la masa total de las sustancias obtenidas tras el proceso.
 LOS ÁTOMOS 1. LEYES PONDERALES. MODELO ATÓMICO DE DALTON Se denominan leyes ponderales de las reacciones químicas aquellas que establecen las proporciones de los pesos en cualquier proceso químico. Son
LOS ÁTOMOS 1. LEYES PONDERALES. MODELO ATÓMICO DE DALTON Se denominan leyes ponderales de las reacciones químicas aquellas que establecen las proporciones de los pesos en cualquier proceso químico. Son
ENLACE QUÍMICO. Hidrógeno. Carbono. Agua. Etileno. Acetileno
 ENLACE QUÍMICO Símbolos y estructuras de Lewis: Modelo más simple para describir el enlace químico (sólo en moléculas constituidas por átomos de elementos representativos). Hidrógeno Carbono Agua Etileno
ENLACE QUÍMICO Símbolos y estructuras de Lewis: Modelo más simple para describir el enlace químico (sólo en moléculas constituidas por átomos de elementos representativos). Hidrógeno Carbono Agua Etileno
Movimiento vibracional
 ESPECTROSCOPÍA Movimiento vibracional El oscilador armónico como modelo de la vibración molecular Los sistemas que vibran a nivel molecular incluyen las vibraciones internas de una molécula y las vibraciones
ESPECTROSCOPÍA Movimiento vibracional El oscilador armónico como modelo de la vibración molecular Los sistemas que vibran a nivel molecular incluyen las vibraciones internas de una molécula y las vibraciones
1º BACH Física y Química TEMA 1 Naturaleza Atómica de la Materia
 1º BACH Física y Química TEMA 1 Naturaleza Atómica de la Materia 1,- Un átomo de Hidrógeno en su estado fundamental recibe una energía de 13 056 ev. Averiguar hasta que nivel ascenderá el electrón y cuál
1º BACH Física y Química TEMA 1 Naturaleza Atómica de la Materia 1,- Un átomo de Hidrógeno en su estado fundamental recibe una energía de 13 056 ev. Averiguar hasta que nivel ascenderá el electrón y cuál
Hoja de Problemas 5. Física Atómica.
 Hoja de Problemas 5. Física Atómica. Fundamentos de Física III. Grado en Física. Curso 25/26. Grupo 56. UAM. 3-3-26 Problema En 896 el astrónomo americano Edward Charles Pickering observó unas misteriosas
Hoja de Problemas 5. Física Atómica. Fundamentos de Física III. Grado en Física. Curso 25/26. Grupo 56. UAM. 3-3-26 Problema En 896 el astrónomo americano Edward Charles Pickering observó unas misteriosas
Estructura de la materia. 2º Bachillerato
 Estructura de la materia 2º Bachillerato Indice 1. El átomo. Partículas elementales. 2. Modelo atómico de Rutherford. 3. Modelo atómico de Bohr. 4. Modelo atómico de Bohr-Sommerfeld. 5. Principios de la
Estructura de la materia 2º Bachillerato Indice 1. El átomo. Partículas elementales. 2. Modelo atómico de Rutherford. 3. Modelo atómico de Bohr. 4. Modelo atómico de Bohr-Sommerfeld. 5. Principios de la
GUÍA DE EJERCICIOS TABLA PERIÓDICA
 GUÍA DE EJERCICIOS TABLA PERIÓDICA Área Química Resultados de aprendizaje Extrae y analiza información para resolver ejercicios relacionados con configuración electrónica y propiedades periódicas, desarrollando
GUÍA DE EJERCICIOS TABLA PERIÓDICA Área Química Resultados de aprendizaje Extrae y analiza información para resolver ejercicios relacionados con configuración electrónica y propiedades periódicas, desarrollando
1.3. CONFIGURACIÓN ELECTRÓNICA.
 1.3. CONFIGURACIÓN ELECTRÓNICA. 1.3.1. PRINCIPIO DE EXCLUSIÓN DE PAULI. Los electrones se mueven en la corteza atómica siguiendo los orbitales, orbitales que vienen determinados por los números cuánticos
1.3. CONFIGURACIÓN ELECTRÓNICA. 1.3.1. PRINCIPIO DE EXCLUSIÓN DE PAULI. Los electrones se mueven en la corteza atómica siguiendo los orbitales, orbitales que vienen determinados por los números cuánticos
Con posterioridad el físico alemán Sommerfeld introdujo en el modelo la posibilidad de órbitas elípticas. Köningsberg, Munich, 1951
 4. El paso de una órbita a otra supone la absorción o emisión de radiación. El átomo sólo absorberá o emitirá la radiación justa para pasar de una órbita a otra. Las órbitas de los electrones son estables
4. El paso de una órbita a otra supone la absorción o emisión de radiación. El átomo sólo absorberá o emitirá la radiación justa para pasar de una órbita a otra. Las órbitas de los electrones son estables
PROPÓSITOS ASIGNATURA: GRADO: BLOQUE SABERES DECLARATIVOS. Química I. Primer Semestre. I. Estructura electrónica de los átomos.
 ASIGNATURA: Química I GRADO: Primer Semestre BLOQUE SABERES DECLARATIVOS PROPÓSITOS I. Estructura electrónica de los átomos. Define los conceptos de número atómico, masa atómica, número de masa e isótopo.
ASIGNATURA: Química I GRADO: Primer Semestre BLOQUE SABERES DECLARATIVOS PROPÓSITOS I. Estructura electrónica de los átomos. Define los conceptos de número atómico, masa atómica, número de masa e isótopo.
TEORIA MECANO-CUÁNTICO
 TEORIA MECANO-CUÁNTICO En los conciertos de música, aunque todos quisiéramos estar lo mas cerca posible del escenario, solo unos pocos pueden hacerlo, pues existe una distribución determinada para quienes
TEORIA MECANO-CUÁNTICO En los conciertos de música, aunque todos quisiéramos estar lo mas cerca posible del escenario, solo unos pocos pueden hacerlo, pues existe una distribución determinada para quienes
Teoría de Orbitales Moleculares (OM)
 Teoría de Orbitales Moleculares (OM) La combinación de orbitales atómicos sobre átomos diferentes forman los llamados orbitales moleculares; dentro de este modelo se señala que los electrones que pertenecen
Teoría de Orbitales Moleculares (OM) La combinación de orbitales atómicos sobre átomos diferentes forman los llamados orbitales moleculares; dentro de este modelo se señala que los electrones que pertenecen
Teoría Cuántica y la Estructura Electrónica de los Atomos
 Teoría Cuántica y la Estructura Electrónica de los Atomos Capítulo 7 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Propiedades de la ondas Largo de onda (λ)
Teoría Cuántica y la Estructura Electrónica de los Atomos Capítulo 7 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Propiedades de la ondas Largo de onda (λ)
4. Identificar un isótopo radiactivo del carbono e indicar su uso. 5. Cuál es la configuración electrónica del vanadio?
 ESTRUCTURA ATÓMICA 1. Qué afirmación sobre el número de electrones, protones y neutrones del átomo es correcta? A El número de neutrones menos el número de electrones es cero. B. El número de protones
ESTRUCTURA ATÓMICA 1. Qué afirmación sobre el número de electrones, protones y neutrones del átomo es correcta? A El número de neutrones menos el número de electrones es cero. B. El número de protones
Ordenando Electrones. De qué forma? 2do Medio > Química Configuración Electrónica. Analiza la siguiente situación:
 do Medio > Química Ordenando Electrones Analiza la siguiente situación: Uno de los mayores logros de la ciencia de la primera mitad del siglo XX se dio en el área de la física, y fue el desarrollo de la
do Medio > Química Ordenando Electrones Analiza la siguiente situación: Uno de los mayores logros de la ciencia de la primera mitad del siglo XX se dio en el área de la física, y fue el desarrollo de la
Configuración electrónica o estructuración de los átomos
 Configuración electrónica o estructuración de los átomos o principio de construcción o edificación progresiva (del alemán, aufbauprinzip) o distribución de los electrones en el átomo. Átomo significa sin
Configuración electrónica o estructuración de los átomos o principio de construcción o edificación progresiva (del alemán, aufbauprinzip) o distribución de los electrones en el átomo. Átomo significa sin
Contenidos: Atomicidad y las características de las partículas fundamentales. Configuraciones electrónicas de los átomos
 Átomos Estructuras electrónicas de los átomos Contenidos: Atomicidad y las características de las partículas fundamentales Configuraciones electrónicas de los átomos Principios de : Exclusión de Pauli
Átomos Estructuras electrónicas de los átomos Contenidos: Atomicidad y las características de las partículas fundamentales Configuraciones electrónicas de los átomos Principios de : Exclusión de Pauli
Exposición oral sobre el tema. Tabla Periódica. Presenta Q.F.B. Natalia Alarcón Vázquez
 Exposición oral sobre el tema Tabla Periódica Presenta Q.F.B. Natalia Alarcón Vázquez 20 de Junio de 2005 1 Objetivos Resaltar el valor de la tabla periódica como una herramienta útil, que posee información
Exposición oral sobre el tema Tabla Periódica Presenta Q.F.B. Natalia Alarcón Vázquez 20 de Junio de 2005 1 Objetivos Resaltar el valor de la tabla periódica como una herramienta útil, que posee información
CBTIS No. 30 Química I Materia & energía. C.4 Complete la siguiente tabla en su libreta. Use su tabla periódica, apuntes y expertise de clase
 ctividad 1 C.4 Complete la siguiente tabla en su libreta. Use su tabla periódica, apuntes y expertise de clase De elem No. De masa neutrones Periodo Grupo Bloque Distribución de según el modelo atómico
ctividad 1 C.4 Complete la siguiente tabla en su libreta. Use su tabla periódica, apuntes y expertise de clase De elem No. De masa neutrones Periodo Grupo Bloque Distribución de según el modelo atómico
El enlace químico. Alejandro Solano-Peralta Facultad de Estudios Superiores Cuautitlán, UNAM
 Alejandro Solano-Peralta Facultad de Estudios Superiores Cuautitlán, UNAM El enlace químico Las átomos pueden formar enlaces por compartición de electrones Dos electrones compartidos forman un enlace simple.
Alejandro Solano-Peralta Facultad de Estudios Superiores Cuautitlán, UNAM El enlace químico Las átomos pueden formar enlaces por compartición de electrones Dos electrones compartidos forman un enlace simple.
Tema 3 El Átomo. Modelos Atómicos y Configuraciones Electrónicas
 Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 2015 2016 Unidad Didáctica 3 Rev 01 El Átomo. Modelos Atómicos y Configuraciones Electrónicas
Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 2015 2016 Unidad Didáctica 3 Rev 01 El Átomo. Modelos Atómicos y Configuraciones Electrónicas
TEMA 7: ELEMENTOS Y COMPUESTOS
 TEMA 7: ELEMENTOS Y COMPUESTOS FÍSICA Y QUÍMICA 4º ESO IES ZOCO LAS PARTÍCULAS DEL ÁTOMO MODELO ATÓMICO DE DALTON Cada elemento químico se compone de partículas diminutas e indestructibles denominadas
TEMA 7: ELEMENTOS Y COMPUESTOS FÍSICA Y QUÍMICA 4º ESO IES ZOCO LAS PARTÍCULAS DEL ÁTOMO MODELO ATÓMICO DE DALTON Cada elemento químico se compone de partículas diminutas e indestructibles denominadas
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 3, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva 3, Ejercicio, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 3, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva 3, Ejercicio, Opción
Configuración electró Átomos polielectró
 n electró Átomos polielectró polielectrónicos Enrique Ruiz-Trejo Departamento de Fí Física y Quí Química Teó Teórica Facultad de Quí Química Universidad Nacional Autó Autónoma de Mé México Principio de
n electró Átomos polielectró polielectrónicos Enrique Ruiz-Trejo Departamento de Fí Física y Quí Química Teó Teórica Facultad de Quí Química Universidad Nacional Autó Autónoma de Mé México Principio de
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS DE LA ESPECTROSCOPIA
 Integrantes: Ipiales Gabriela Química de Alimentos Olmos Wendy Química Farmacéutica Día: Miércoles 9-11 Fecha: 05/07/2011 DEFINICIÓN DE ORBITALES ATÓMICOS Un orbital atómico representa una región del espacio
Integrantes: Ipiales Gabriela Química de Alimentos Olmos Wendy Química Farmacéutica Día: Miércoles 9-11 Fecha: 05/07/2011 DEFINICIÓN DE ORBITALES ATÓMICOS Un orbital atómico representa una región del espacio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
Apuntes del Modelo del átomo hidrogenoide.
 Apuntes del Modelo del átomo hidrogenoide. Dr. Andrés Soto Bubert Un átomo hidrogenoide es aquel que tiene un solo electrón de carga e, rodeando un núcleo de carga +Ze. Átomos que cumplen esta descripción
Apuntes del Modelo del átomo hidrogenoide. Dr. Andrés Soto Bubert Un átomo hidrogenoide es aquel que tiene un solo electrón de carga e, rodeando un núcleo de carga +Ze. Átomos que cumplen esta descripción
UNIDAD No. EL SISTEMA PERIÓDICO DE LOS ELEMENTOS QUÍMICOS (LA TABLA PERIÓDICA)
 UNIDAD No. LOGROS: Comprender los criterios de ordenación de los elementos químicos en la tabla periódica. Diferenciar e identificar las propiedades periódicas de los elementos químicos. Determinar la
UNIDAD No. LOGROS: Comprender los criterios de ordenación de los elementos químicos en la tabla periódica. Diferenciar e identificar las propiedades periódicas de los elementos químicos. Determinar la
Resoluciones de ejercicios del PRÁCTICO 8
 Resoluciones de ejercicios del PRÁCTICO 8 1- a) Modelo de Bohr: Modelo que intenta explicar el átomo de hidrogeno (H). Basado en las ideas de Planck y de Einstein, sobre la cuantización de la energía y
Resoluciones de ejercicios del PRÁCTICO 8 1- a) Modelo de Bohr: Modelo que intenta explicar el átomo de hidrogeno (H). Basado en las ideas de Planck y de Einstein, sobre la cuantización de la energía y
Modelo atómico de la materia.
 Modelo atómico de la materia. La Teoría Atómica se basa en la suposición (ratificada después por datos experimentales) de que la materia no es continua, sino que está formada por partículas distintas.
Modelo atómico de la materia. La Teoría Atómica se basa en la suposición (ratificada después por datos experimentales) de que la materia no es continua, sino que está formada por partículas distintas.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 003 QUÍMICA TEMA : LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva 3, Ejercicio, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 003 QUÍMICA TEMA : LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva 3, Ejercicio, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 2, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 2, Opción B Reserva 3, Ejercicio
EL ÁTOMO MECANO CUÁNTICO Ecuación de Schrödinger y Orbitales atómicos
 Obtención de la ecuación de Schrödinger Se parte de la ecuación de una onda ψ= Asen( ωt kx) en la cual Ψ es la elongación, A la amplitud, ω frecuencia angular, k el número de onda, y x la posición respecto
Obtención de la ecuación de Schrödinger Se parte de la ecuación de una onda ψ= Asen( ωt kx) en la cual Ψ es la elongación, A la amplitud, ω frecuencia angular, k el número de onda, y x la posición respecto
CAPITULO VIII CONFIGURACIONES ELECTRÓNICAS. n, l, m l, m s
 CAPITULO VIII CONFIGURACIONES ELECTRÓNICAS Las características del átomo de H dependen del movimiento de su electrón, el cual está determinado por un conjunto de números cuánticos: n, l, m l, m s n = 1,
CAPITULO VIII CONFIGURACIONES ELECTRÓNICAS Las características del átomo de H dependen del movimiento de su electrón, el cual está determinado por un conjunto de números cuánticos: n, l, m l, m s n = 1,
Semana 2 Bimestre I Número de clases 4 6
 Semana Bimestre I Número de clases 4 Clase 4 Tema: Configuración electrónica Los números cuánticos Actividad 1 Observe escuche con atención el video para identificar ideas que le permitan escribir un párrafo
Semana Bimestre I Número de clases 4 Clase 4 Tema: Configuración electrónica Los números cuánticos Actividad 1 Observe escuche con atención el video para identificar ideas que le permitan escribir un párrafo
UNIVERSIDAD NACIONAL DEL CALLAO
 UNIVERSIDAD NACIONAL DEL CALLAO FACULTAD DE CIENCIAS NATURALES Y MATEMÁTICA UNIDAD DE INVESTIGACIÓN DE LA FACULTAD DE CIENCIAS NATURALES Y MATEMÁTICA INFORME FINAL DEL TEXTO TEXTO: MECÁNICA CUÁNTICA II
UNIVERSIDAD NACIONAL DEL CALLAO FACULTAD DE CIENCIAS NATURALES Y MATEMÁTICA UNIDAD DE INVESTIGACIÓN DE LA FACULTAD DE CIENCIAS NATURALES Y MATEMÁTICA INFORME FINAL DEL TEXTO TEXTO: MECÁNICA CUÁNTICA II
Unidad 1 Estructura atómica de la materia. Teoría cuántica
 Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
ESTRUCTURA ATÓMICA. SISTEMA PERIÓDICO Y ENLACE QUÍMICO
 1.- Un átomo A tiene como configuración electrónica: 1s 2 2s 2 2p 6 3s 2 3p 6 5s 1. a) Cuáles son los números cuánticos de su electrón más externo? b) Justifica la veracidad o falsedad de las siguientes
1.- Un átomo A tiene como configuración electrónica: 1s 2 2s 2 2p 6 3s 2 3p 6 5s 1. a) Cuáles son los números cuánticos de su electrón más externo? b) Justifica la veracidad o falsedad de las siguientes
ESTRUCTURA ATÓMICA. Utilizando el siguiente esquema vamos a configurar los electrones de los átomos e iones del ejercicio:
 ESTRUCTURA ATÓMICA 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes. Utilizando el siguiente
ESTRUCTURA ATÓMICA 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes. Utilizando el siguiente
Los átomos constituyen la unidad básica de todos los materiales de ingeniería. La estructura de los átomos Están constituidos por las siguientes partí
 Capítulo 2: Estructura atómica Los átomos constituyen la unidad básica de todos los materiales de ingeniería. La estructura de los átomos Están constituidos por las siguientes partículas subatómicas: Protones
Capítulo 2: Estructura atómica Los átomos constituyen la unidad básica de todos los materiales de ingeniería. La estructura de los átomos Están constituidos por las siguientes partículas subatómicas: Protones
Capítulo 7 Teoría cuántica y la estructura electrónica de los átomos
 Capítulo 7 Teoría cuántica y la estructura electrónica de los átomos Este capítulo presenta al estudiante la teoría cuántica y la importancia de ésta al describir la conducta electrónica. Al terminar este
Capítulo 7 Teoría cuántica y la estructura electrónica de los átomos Este capítulo presenta al estudiante la teoría cuántica y la importancia de ésta al describir la conducta electrónica. Al terminar este
Actividad: Cómo son las configuraciones electrónicas?
 Cómo son las configuraciones electrónicas de los elementos que forman una familia? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Cómo son las configuraciones electrónicas? En
Cómo son las configuraciones electrónicas de los elementos que forman una familia? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Cómo son las configuraciones electrónicas? En
FÍSICA y QUÍMICA. Número cuántico Secundario (SUBNIVEL) l. Número cuántico Magnético (ORBITAL, como si fuera una caja) m.
 TEMA 1: ESTRUCTURA DE LA MATERIA. MODELOS ATÓMICOS 1. Modelo Atómico de RUTHERFORD a. Modelo predecesor de Thomson. b. Modelo atómico de Rutherford. c. Virtudes y defectos del Modelo de Rutherford. 2.
TEMA 1: ESTRUCTURA DE LA MATERIA. MODELOS ATÓMICOS 1. Modelo Atómico de RUTHERFORD a. Modelo predecesor de Thomson. b. Modelo atómico de Rutherford. c. Virtudes y defectos del Modelo de Rutherford. 2.
Experimento 12 LÍNEAS ESPECTRALES. Objetivos. Teoría. Postulados de Bohr. El átomo de hidrógeno, H
 Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
Átomos polielectrónicos Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas
 ESTRUCTURA ELECTRÓNICA Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas Átomos con un solo electrón: La energía depende solamente del
ESTRUCTURA ELECTRÓNICA Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas Átomos con un solo electrón: La energía depende solamente del
Unidad III. Onda: Alteración vibracional por medio de la cuál se trasmite la energía. Amplitud propagación de onda
 Unidad III TEORÍA CUÁNTICA Y ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS Mayra García PUCMM Dpto. Ciencias Básicas Propiedades de las ondas Onda: Alteración vibracional por medio de la cuál se trasmite la energía
Unidad III TEORÍA CUÁNTICA Y ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS Mayra García PUCMM Dpto. Ciencias Básicas Propiedades de las ondas Onda: Alteración vibracional por medio de la cuál se trasmite la energía
Tabla Periódica y Propiedades Periódicas
 Tabla Periódica y Propiedades Periódicas 1. Las configuraciones electrónicas de los elementos nitrógeno y vanadio son respectivamente: Lo primero que debemos hacer es buscar en la Tabla Periódica los números
Tabla Periódica y Propiedades Periódicas 1. Las configuraciones electrónicas de los elementos nitrógeno y vanadio son respectivamente: Lo primero que debemos hacer es buscar en la Tabla Periódica los números
LA ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS
 LA ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS 1.- La descripción macroscópica del Universo. El desarrollo de la Física hasta finales del siglo XIX permite una descripción de nuestro entorno cotidiano que se
LA ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS 1.- La descripción macroscópica del Universo. El desarrollo de la Física hasta finales del siglo XIX permite una descripción de nuestro entorno cotidiano que se
INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3.
 El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
Radiación térmica y el postulado de Planck
 Contenido Radiación térmica y el postulado de Planck 17 1-1 1-2 1-3 1.4 1.5 1-6 1-7 Introducción 19 Radiación térmica 19 Teoría clásica de la cavidad radiante 24 Teoría de Planck de 1a cavidad radiante
Contenido Radiación térmica y el postulado de Planck 17 1-1 1-2 1-3 1.4 1.5 1-6 1-7 Introducción 19 Radiación térmica 19 Teoría clásica de la cavidad radiante 24 Teoría de Planck de 1a cavidad radiante
Qué estudiamos en Química Orgánica? ÁTOMOS Y ELECTRONES! ENLACE QUÍMICO
 Química Orgánica I Qué estudiamos en Química Orgánica? Cómo los compuestos orgánicos reaccionan: Rompimiento y formación de enlaces. Enlaces que se forman cuando átomos comparten electrones, enlaces que
Química Orgánica I Qué estudiamos en Química Orgánica? Cómo los compuestos orgánicos reaccionan: Rompimiento y formación de enlaces. Enlaces que se forman cuando átomos comparten electrones, enlaces que
Asignaturas antecedentes y subsecuentes Electromagnetismo
 PROGRAMA DE ESTUDIOS FÍSICA ATOMICA Y MOLECULAR Área a la que pertenece: AREA SUSTANTIVA PROFESIONAL Horas teóricas: 5 Horas prácticas: 0 Créditos: 10 Clave: F0109 Asignaturas antecedentes y subsecuentes
PROGRAMA DE ESTUDIOS FÍSICA ATOMICA Y MOLECULAR Área a la que pertenece: AREA SUSTANTIVA PROFESIONAL Horas teóricas: 5 Horas prácticas: 0 Créditos: 10 Clave: F0109 Asignaturas antecedentes y subsecuentes
Materiales Y Dispositivos Electrónicos
 Materiales Y Dispositivos Electrónicos Guía De Estudio Nº 2 MODELOS ATÓMICOS DEFINICIONES GENERALES: Sugerimos repasar todos los conceptos asociados a las definiciones generales citadas a continuación:
Materiales Y Dispositivos Electrónicos Guía De Estudio Nº 2 MODELOS ATÓMICOS DEFINICIONES GENERALES: Sugerimos repasar todos los conceptos asociados a las definiciones generales citadas a continuación:
Modelo atómico de la materia. Contenidos
 Modelo atómico de la materia Antecedentes: Contenidos El átomo nuclear: Constituyentes del nucleo Antencedentes de la Mecanica Cuantica - Principio de Dualidad Onda-Partícula. - Principio de Incertidumbre
Modelo atómico de la materia Antecedentes: Contenidos El átomo nuclear: Constituyentes del nucleo Antencedentes de la Mecanica Cuantica - Principio de Dualidad Onda-Partícula. - Principio de Incertidumbre
ESTRUCTURA DE LA MATERIA Y SISTEMA PERIÓDICO. Lola Castelao
 ESTRUCTURA DE LA MATERIA Y SISTEMA PERIÓDICO DALTON: el átomo es indivisible. MODELOS ATÓMICOS THOMSON: el átomo es una especie de pudín, formado por una masa cargada positivamente, dentro del cual se
ESTRUCTURA DE LA MATERIA Y SISTEMA PERIÓDICO DALTON: el átomo es indivisible. MODELOS ATÓMICOS THOMSON: el átomo es una especie de pudín, formado por una masa cargada positivamente, dentro del cual se
