Instrumentación en Resonancia Magnética Nuclear: el espectrómetro
|
|
|
- Héctor Suárez Vidal
- hace 7 años
- Vistas:
Transcripción
1 Instrumentación en Resonancia Magnética Nuclear: el espectrómetro Un imán que genere un campo magnético fijo y estable. Generalmente se identifica cada espectrómetro por la frecuencia de resonancia del protón, así en un imán de Tesla, los núcleos de 1 H resuenan a 300 MHz, y por tanto sería un espectrómetro de 300 MHz. Por el momento el imán de mayor campo magnético del mundo lo ha instalado Bruker en la Unviersidad de ciencia y tecnología Rey Abdullah en Arabia Saudita, de 950 MHz (22.3 Tesla). Una sonda, que se sitúa dentro del imán, en la que se introduce la muestra y que consta de las bobinas responsables de emitir y recibir las radiofrecuencias (RF). El número de bobinas y su disposición determinan el tipo y las aplicaciones de cada sonda. Una consola en la que se generan los pulsos de RF y controla el resto de la parte electrónica del espectrómetro Una computadora que sirve de interfase con el espectrómetro y con el que se analiza toda la información obtenida.
2 Ventajas del método de pulsos -Los pulsos son cortos, entonces se requieren tiempos cortos de uso de equipo -Es más sensible que el método de barrido y permite una mejor resolución -Se pueden sumar FIDS. Esto es particularmente útil para estudiar núcleos poco sensibles y de baja abundancia natural (como 13 C o 15 N) Abundancia natural 1 H: 99,98 % 19 F: 100 % 31 P 100% 13 C: 1,1% (I 0, magnéticamente activo) 12 C: 98,9% (I = 0) En general, se deben sumar muchas FIDS para obtener un buen espectro de RMN 13 C Al problema de la abundancia relativa, se suma el de la SENSIBILIDAD INHERENTE del núcleo, que es proporcional a la constante magnetogírica al cubo: g C ¼ g H Sensibilidad inherente g 3 Sens. 13 C / Sens. 1 H = (g 13C / g 1H ) 3 = (1/4 g 1H / g 1H ) 3 = 1,50 x 10-2 La respuesta de un núcleo de 13 C es 150 veces menor que al de 1 H.
3 El espectro de RMN 1 H Distintos H dan señales a distinta frecuencia d : desplazamiento químico El área de cada señal es proporcional al número de H de la muestra
4
5 La técnica de RMN con transformada de Fourier (FT-NMR) es la que se utiliza en los espectrómetros actuales. Uno de los pioneros en este campo es Richard R. Ernst, que la desarrolló a partir del año 1966 y por la que fue galardonado con el Premio Nobel de Química en FT-NMR permite disminuir drásticamente el tiempo que requiere adquirir una acumulación (scan) del espectro completo de RMN. En vez de realizar un barrido lento de la frecuencia, una en cada instante, esta técnica explora simultánea e instantáneamente todo un rango de frecuencias. Dos desarrollos técnicos fueron fundamentales para poder hacer realidad la técnica FT-NMR: ordenadores capaces de llevar a cabo las operaciones matemáticas necesarias para pasar desde el dominio de tiempo al de la frecuencia, es decir, para obtener el espectro; y el conocimiento sobre cómo poder excitar simultáneamente todo un rango de frecuencias. FT-NMR funciona con la muestra (espines nucleares) sometida a un campo magnético externo constante. Se irradia la muestra con un pulso electromagnético de muy corta duración en la región de las radiofrecuencias. La forma que suele usarse para este pulso es rectangular, es decir, la intensidad de la radiofrecuencia oscila entre un máximo y un mínimo que es constante mientras dura el pulso. Un pulso de corta duración tiene una cierta incertidumbre en la frecuencia (principio de indeterminación de Heisenberg). La descomposición de fourier de una onda rectangular contiene contribuciones de una de todas las frecuencias. El pulso que se genera es por tanto policromático y cuanto más corto sea, es capaz de excitar un mayor rango de frecuencias.
6 La aplicación de un pulso policromático en una región estrecha de la banda de radiofrecuencias (MHz) afecta a aquellos espines nucleares que resuenen en esa región. Un pulso policromático con una anchura en frecuencia de unos pocos khz puede llegar a excitar simúltaneamente sólo a los espines nucleares de un mismo tipo de núcleo atómico dentro de una molécula, por ejemplo, todos los núcleos de hidrógeno (1H). Antes del pulso el vector Magnetización neta de cada uno de los espines nucleares se encuentra en situación de equilibrio alineado en la dirección del campo magnético. Durante el tiempo que se aplica el pulso, el pulso introduce un segundo campo magnético en una dirección perpendicular al campo principal del imán y el vector Magnetización realiza un determinado movimiento de precesión. Tras cesar el pulso, el vector Magnetización de todos los espines afectados puede formar un cierto ángulo con el eje del campo magnético principal. En este momento, los espines, comportándose como pequeños imanes polarizados, comienzan a precesionar con su frecuencia característica en torno al campo magnético externo, induciendo una pequeña corriente oscilante de RF en una bobina receptora situada en las inmediaciones de la muestra. A medida que los núcleos van regresando poco a poco a la situación inicial de equilibrio alineados con en el campo magnético principal, la señal detectada va disminuyendo de intensidad hasta hacerse cero. Esta caída de la señal se conoce como caída libre de la inducción (Free Induction Decay) (FID) y da lugar al espectro de RMN. La FID es una onda que contiene todas las señales del espectro en una forma que es dependiente del tiempo. Esta onda puede convertirse en un espectro de señales en función de su frecuencia. Para ello se utiliza una función matemática conocida como Transformada de Fourier. El resultado es lo que se conoce como un espectro de RMN (espectro de frecuencias).
7 DESPLAZAMIENTO QUÍMICO La frecuencia a la que ocurre la absorción de energía de un núcleo en RMN se llama frecuencia de resonancia o frecuencia de Larmor ν = γ Bo / 2π Por ejemplo 500,13 MHz para 1 H en un campo de 11,75 Tesla Ley de Lenz Pero en realidad un núcleo en un átomo o molécula no experimenta el campo magnético que aplicamos porque está rodeado de electrones que generan un campo inducido que cancela parte del campo Bo B local = B o σ σ constante de apantallamiento. Nº adimensional B ef = B o - B loc = B o (1 - σ) La frecuencia de resonancia del núcleo es en realidad: ν = γ Bo(1 - σ) / 2π La constante de apantallamiento σ depende de 3 factores principales la densidad electrónica alrededor del núcleo las corrientes (y en consecuencia los B locales) que esos electrones puedan generar los B locales generados por electrones de otros átomos Es decir influyen: electronegatividad de átomos/grupos cercanos, distribución de cargas, hibridización, efectos inductivos y de resonancia, cercanía y orientación relativa de grupos funcionales, formación de puentes de H, interacciones con el solvente, etc.
8 EL EFECTO INDUCTIVO Si la densidad electrónica entorno al núcleo disminuye por efecto inductivo, el campo inducido por la carga también disminuye y la resonancia se puede alcanzar a un campo inferior Así para el grupo metilo tendremos: CH 3 -C (δ 0.9 ppm) CH 3 -N (δ 2.3 ppm) CH 3 -O (δ 3.3 ppm) CH 3 -F (δ = 4.26 ppm) CH 3 -Cl (δ = 3.05 ppm) CH 3 -Br (δ = 2.68 ppm) CH 3 -I (δ = 2.16 ppm) Como puede observarse existe una relación, que es prácticamente lineal, entre la electronegatividad de los sustituyentes y el desplazamiento químico protónico (δ). De igual forma se podría indicar para grupos metileno (CH 2 ) y metino (CH), con la única salvedad de que los desplazamientos suelen aumentar conforme aumenta la sustitución, es decir el desplazamiento de los metinos suele ser mayor que el de los metilenos y el de estos que el de los metilos. δ = 2.05 ppm H 3 C O δ = 3.60 ppm H 3 CO O Mayor efecto inductivo
9 ν A = γ Bo(1 - σ A) / 2π δ A = v A - ν ref. X 10 6 ν ref. δ A = γ Bo(1 - σ A) - γ Bo(1 - σ ref) / 2π X 10 6 = (σ ref - σ A ) X 10 6 γ Bo / 2π Como en general σ ref σ A, los valores de son d 0, y la referencia aparece a la derecha del espectro
10
11
12 Efectos de anisotropía magnética Se debe a los campos magnéticos generados en átomos o grupos cercanos al 1 H. Los más importantes son los debidos a e - p. Estos campos son anisotrópicos, es decir que no son equivalentes en todas las direcciones del espacio. En el benceno la circulación de las nubes de e - por arriba y por debajo del plano del anillo inducen líneas de campo que tienen igual sentido que Bo en la región de los H aromáticos. Mediante cálculos se puede saber en que región el campo inducido se opone al Bo y en que región se suma.
13 El anillo de la molécula de benceno, se orienta respecto al campo magnético principal H 0, colocando su plano perpendicular a él. Esto hace que los electrones p generen una corriente diamagnética (que se resta a Bo) asociada en el centro del anillo, y que es paramagnética (se suma al Bo) en los espacios ocupados por los protones del anillo. Esa es la razón del porqué, protones, libre de elementos electronegativos vecinos aparezcan a campos tan bajos ( 7.0 ppm ).También puede observarse (aunque en menor escala) este mismo efecto en los grupos metilos, metilenos y metinos, unidos directamente al anillo aromático, aquí también las corrientes electrónicas en el anillo bencénico se hacen sentir sobre esos protones desplazándolos desde su posición normal hasta campos más bajos.
14 Multiplicidad de las señales. Acoplamiento spin-spin, escalar o indirecto 1,2-dichloroethane 1,1-dichloroethane El número de líneas que presenta la señal se llama multiplicidad y la causa es la interacción con los núcleos vecinos que poseen momento magnético. La estructura fina se debe al ACOPLAMIENTO INDIRECTO, debido a la interacción transmitida a través de los electrones de enlace (y no a través del espacio). 13 C- 1 H Si estudiamos la resonancia del 13 C, el spin del núcleo vecino puede oponerse o sumarse al campo externo Bo, haciendo que sienta dos situaciones diferentes: un estado apantallado y otro desapantallado. La información se transmite a través de los e- del enlace entre los núcleos.
15 Si los núcleos A y X tienen I = ½ existirán 4 posibles disposiciones de los spines (2I+1), y en consecuencia, 4 niveles de energía. A 1 -X 2 En ausencia de la interacción spin-spin (J=0) cada señal será un singulete, pues las 2 transiciones posibles para cada núcleo son isoenergéticas. Cada señal es un singulete. Si hay interacción ( J 0), J puede ser mayor o menor que 0. Tomemos el ej. J 0 (J 0): el acoplamiento se traduce en una disminución (aumento) de la E de los estados con spines paralelos y en un aumento (disminución), de la misma magnitud, de la energía de los estados con spines antiparalelos (deducido por cálculos mecanocuánticos). En consecuencia, las 2 transiciones posibles para cada núcleo son de distinta energía, y por lo tanto, de distinta frecuencia. Cada señal es un doblete, cuya frecuencia central coincide con la frecuencia en ausencia de acoplamiento.
16 sigue la regla del n+1 J es independiente del campo magnético aplicado (Bo), y es dependiente de la electronegatividad de los sutituyentes, de la distancia (J a 2, 3 enlaces), del tipo de enlace (simple, doble, triple) y del ángulo comprendido entre los núcleos acoplados. J A + B cos θ + C cos 2 θ Acoplamientos homonucleares H-C-C-H, acoplamientos heteronucleares H-C, C-F, etc. J brinda información estructural!!
17 Cuando en el acoplamiento intervienen dobles enlaces la situación no sigue la regla del n+1
RESONANCIA MAGNÉTICA NUCLEAR
 RESONANCIA MAGNÉTICA NUCLEAR SPIN DEL NUCLEO El nucleo de algunos átomos poseen SPIN. Estos núcleos se comportan como si estuvieran girando... no sabemos si realmente giran! Es como la propiedad de un
RESONANCIA MAGNÉTICA NUCLEAR SPIN DEL NUCLEO El nucleo de algunos átomos poseen SPIN. Estos núcleos se comportan como si estuvieran girando... no sabemos si realmente giran! Es como la propiedad de un
TEMA 2: Resonancia Magnética Nuclear RMN-1H y 13C Fundamentos
 Fundamentos La Resonancia Magnética Nuclear (RMN) es la técnica que mayor información estructural proporciona. Ello se debe a que se observan los núcleos de los átomos y se puede conocer la influencia
Fundamentos La Resonancia Magnética Nuclear (RMN) es la técnica que mayor información estructural proporciona. Ello se debe a que se observan los núcleos de los átomos y se puede conocer la influencia
J H,H pequeño. Equivalencia química y equivalencia magnética
 La magnitud de J para 1 H, 1 H varía entre -20 y 20 Hz J a 2 enlaces 2 J H,H 10-15 Hz J a 3 enlaces 3 J H,H 3-10 Hz J a larga distancia H-C-C-C-H 4 J H,H pequeño Los J heteronucleares son mas grandes,
La magnitud de J para 1 H, 1 H varía entre -20 y 20 Hz J a 2 enlaces 2 J H,H 10-15 Hz J a 3 enlaces 3 J H,H 3-10 Hz J a larga distancia H-C-C-C-H 4 J H,H pequeño Los J heteronucleares son mas grandes,
Teoría de orbitales moleculares y orden de enlace Propiedades moleculares y configuraciones
 5/30/013 GEOMETRÍA MOLECULAR Y TEORÍA DE ENLACE Teoría de orbitales moleculares y orden de enlace Propiedades moleculares y configuraciones electrónicas Geometría Molecular y Enlace Químico Especies Poliatómicas:
5/30/013 GEOMETRÍA MOLECULAR Y TEORÍA DE ENLACE Teoría de orbitales moleculares y orden de enlace Propiedades moleculares y configuraciones electrónicas Geometría Molecular y Enlace Químico Especies Poliatómicas:
1.- Fundamentos básicos
 1.- Fundamentos básicos - Algunos núcleos tienen espín: La circulación de carga genera un campo magnético a lo largo del eje de giro ( 1 H, 7 Li, 11 B, 13 C, 14 N, 19 F, 23 Na, 27 Al, 29 Si, 31 P, 33 S,
1.- Fundamentos básicos - Algunos núcleos tienen espín: La circulación de carga genera un campo magnético a lo largo del eje de giro ( 1 H, 7 Li, 11 B, 13 C, 14 N, 19 F, 23 Na, 27 Al, 29 Si, 31 P, 33 S,
Enlace químico II: geometría molecular e hibridación de orbitales atómicos
 Enlace químico II: geometría molecular e hibridación de orbitales atómicos Capítulo 10 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Teorías de cómo ocurren
Enlace químico II: geometría molecular e hibridación de orbitales atómicos Capítulo 10 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Teorías de cómo ocurren
ENLACE QUÍMICO. Hidrógeno. Carbono. Agua. Etileno. Acetileno
 ENLACE QUÍMICO Símbolos y estructuras de Lewis: Modelo más simple para describir el enlace químico (sólo en moléculas constituidas por átomos de elementos representativos). Hidrógeno Carbono Agua Etileno
ENLACE QUÍMICO Símbolos y estructuras de Lewis: Modelo más simple para describir el enlace químico (sólo en moléculas constituidas por átomos de elementos representativos). Hidrógeno Carbono Agua Etileno
Resonancia Magnética Nuclear
 Resonancia Magnética Nuclear Por qué algunas señales aparecen como señales múltiples (multipletes)? Dos átomos que se encuentren contiguos interaccionan modificándose mutuamente. La forma de la señal depende
Resonancia Magnética Nuclear Por qué algunas señales aparecen como señales múltiples (multipletes)? Dos átomos que se encuentren contiguos interaccionan modificándose mutuamente. La forma de la señal depende
Enlace químico II: geometría molecular e hibridación de orbitales atómicos
 Enlace químico II: geometría e hibridación de orbitales atómicos Capítulo 10 Modelo de la repulsión de los pares de electrones de la capa de valencia (): Predice la geometría de la molécula a partir de
Enlace químico II: geometría e hibridación de orbitales atómicos Capítulo 10 Modelo de la repulsión de los pares de electrones de la capa de valencia (): Predice la geometría de la molécula a partir de
Propiedades magnéticas
 Propiedades magnéticas Fuerzas magnéticas Las fuerzas magnéticas se generan mediante el movimiento de partículas cargadas Eléctricamente; existen junto a las fuerzas electrostáticas. Distribuciones del
Propiedades magnéticas Fuerzas magnéticas Las fuerzas magnéticas se generan mediante el movimiento de partículas cargadas Eléctricamente; existen junto a las fuerzas electrostáticas. Distribuciones del
El enlace químico. Alejandro Solano-Peralta Facultad de Estudios Superiores Cuautitlán, UNAM
 Alejandro Solano-Peralta Facultad de Estudios Superiores Cuautitlán, UNAM El enlace químico Las átomos pueden formar enlaces por compartición de electrones Dos electrones compartidos forman un enlace simple.
Alejandro Solano-Peralta Facultad de Estudios Superiores Cuautitlán, UNAM El enlace químico Las átomos pueden formar enlaces por compartición de electrones Dos electrones compartidos forman un enlace simple.
TEMA 10. ESPECTROSCOPIA DE RESONANCIA MAGNÉTICA NUCLEAR
 TEMA 10. ESPETROSOPIA DE RESONANIA MAGNÉTIA NULEAR 1. Fundamentos físicos de la espectroscopia de RMN. 2. El espectrómetro de resonancia magnética nuclear. 3. Resonancia magnética nuclear de 1. Apantallamiento
TEMA 10. ESPETROSOPIA DE RESONANIA MAGNÉTIA NULEAR 1. Fundamentos físicos de la espectroscopia de RMN. 2. El espectrómetro de resonancia magnética nuclear. 3. Resonancia magnética nuclear de 1. Apantallamiento
Resonancia Magnetica Nuclear Avanzada
 Resonancia Magnetica Nuclear Avanada Ala-Arg-Pro-Tr-Asn-Phe-Cpa-Leu-NH 2 Cpa Ala Pro Facultad De Quimica Que es la espectroscopia? Sin aprender griego o latin, la espectroscopia es el estudio de las interacciones
Resonancia Magnetica Nuclear Avanada Ala-Arg-Pro-Tr-Asn-Phe-Cpa-Leu-NH 2 Cpa Ala Pro Facultad De Quimica Que es la espectroscopia? Sin aprender griego o latin, la espectroscopia es el estudio de las interacciones
Operador de densidad y operadores producto en resonancia magnética nuclear
 Operador de densidad y operadores producto en resonancia magnética nuclear Juan Carlos Paniagua Dep. de Química Física & Institut de Química Teòrica i Computacional - Universitat de Barcelona Presentación
Operador de densidad y operadores producto en resonancia magnética nuclear Juan Carlos Paniagua Dep. de Química Física & Institut de Química Teòrica i Computacional - Universitat de Barcelona Presentación
Resonancia Magnética Nuclear
 Víctor Moreno de la Cita Jesús J. Fernández Romero 25 de mayo de 2010 1 Base teórica 2 Medicina Química y análisis no destructivo Computación cuántica 3 4 Notación que emplea Kittel: µ = Momento magnético
Víctor Moreno de la Cita Jesús J. Fernández Romero 25 de mayo de 2010 1 Base teórica 2 Medicina Química y análisis no destructivo Computación cuántica 3 4 Notación que emplea Kittel: µ = Momento magnético
TEMA 6: Enlace químico en sistemas moleculares
 TEMA 6: Enlace químico en sistemas moleculares Índice 1) Introducción 2) Enlaces en molécula a.i. a.ii. a.iii. a.iv. Teoría de orbitales moleculares Teoría del enlace de valencia Resonancia Polaridad 3)
TEMA 6: Enlace químico en sistemas moleculares Índice 1) Introducción 2) Enlaces en molécula a.i. a.ii. a.iii. a.iv. Teoría de orbitales moleculares Teoría del enlace de valencia Resonancia Polaridad 3)
+ -R + - R 3. u r. u r µ = u r µ cos θ = µ cos θ. F = q E = q k. 3(u. Campo eléctrico generado por un dipolo eléctrico a distancias grandes E
 Cargas, dipolos e interacciones moleculares Campo eléctrico generado por un dipolo eléctrico a distancias grandes E= k 3u r (ur µ) - µ E 3 µ u r - µ = Q D Producto escalar u r µ = u r µ cos θ = µ cos θ
Cargas, dipolos e interacciones moleculares Campo eléctrico generado por un dipolo eléctrico a distancias grandes E= k 3u r (ur µ) - µ E 3 µ u r - µ = Q D Producto escalar u r µ = u r µ cos θ = µ cos θ
ESPECTROSCOPÍA EJEMPLOS DE ELUCIDACION ESTRUCTURAL DE COMPUESTOS. Elucidación estructural: Ejemplo 1 Dados los siguientes espectros:
 ESPECTROSCOPÍA EJEMPLOS DE ELUCIDACION ESTRUCTURAL DE COMPUESTOS Elucidación estructural: Ejemplo 1 Dados los siguientes espectros: 1) Empezaremos por encontrar la formula molecular, pues no la tenemos.
ESPECTROSCOPÍA EJEMPLOS DE ELUCIDACION ESTRUCTURAL DE COMPUESTOS Elucidación estructural: Ejemplo 1 Dados los siguientes espectros: 1) Empezaremos por encontrar la formula molecular, pues no la tenemos.
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA 1. Naturaleza de la materia (el átomo). 2. Modelos atómicos clásicos. 3. Modelo mecánico cuántico. 4. Mecánica ondulatoria de Schrödinger. 5. Números cuánticos. 6. Orbitales atómicos.
ESTRUCTURA DE LA MATERIA 1. Naturaleza de la materia (el átomo). 2. Modelos atómicos clásicos. 3. Modelo mecánico cuántico. 4. Mecánica ondulatoria de Schrödinger. 5. Números cuánticos. 6. Orbitales atómicos.
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS Alexis Lema Jueves 10-12 ESPECTROSCOPIA UV-VIS. COMBINACIÓN LINEAL DE ORBITALES ATOMICOS (CLOA). ORBITALES ATOMICOS
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS Alexis Lema Jueves 10-12 ESPECTROSCOPIA UV-VIS. COMBINACIÓN LINEAL DE ORBITALES ATOMICOS (CLOA). ORBITALES ATOMICOS
UNIVERSIDAD NACIONAL DEL SUR 1
 UNIVERSIDAD NACIONAL DEL SUR 1 PROGRAMA DE: CODIGO: 393 H O R A S D E C L A S E P R O F E S O R R E S P O N S A B L E T E O R I C A S P R A C T I C A S Dra. Alicia B. Chopa Por semana Por cuatrimestre
UNIVERSIDAD NACIONAL DEL SUR 1 PROGRAMA DE: CODIGO: 393 H O R A S D E C L A S E P R O F E S O R R E S P O N S A B L E T E O R I C A S P R A C T I C A S Dra. Alicia B. Chopa Por semana Por cuatrimestre
Tema 3.-Espectroscopía de biomoléculas
 Tema 3.Espectroscopía de biomoléculas Tema 3.Espectroscopía de biomoléculas 3..El espectro electromagnético 3.2.Espectros de absorción y de emisión (espontánea y estimulada) 3.2..Momento dipolar de transición:
Tema 3.Espectroscopía de biomoléculas Tema 3.Espectroscopía de biomoléculas 3..El espectro electromagnético 3.2.Espectros de absorción y de emisión (espontánea y estimulada) 3.2..Momento dipolar de transición:
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
INTERACCIONES Y MATERIALES MAGNÉTICOS
 INTERACCIONES Y MATERIALES MAGNÉTICOS G U T I É R R E Z N Ú Ñ E Z D E B O R A H V A L E R I A I S L A S B A U T I S T A J O S É A L F R E D O L O E R A R U B A L C A V A J E S S I C A R I V E R O T R E
INTERACCIONES Y MATERIALES MAGNÉTICOS G U T I É R R E Z N Ú Ñ E Z D E B O R A H V A L E R I A I S L A S B A U T I S T A J O S É A L F R E D O L O E R A R U B A L C A V A J E S S I C A R I V E R O T R E
Conceptos de relajación en RMN
 Conceptos de relajación en RMN Oscar Millet Unidad de Biología Estructural CICbioGUNE Curso Avanzado de Resonancia Magnética Nuclear, Jaca 2009 Relajación: retorno de la magnetización a la situación de
Conceptos de relajación en RMN Oscar Millet Unidad de Biología Estructural CICbioGUNE Curso Avanzado de Resonancia Magnética Nuclear, Jaca 2009 Relajación: retorno de la magnetización a la situación de
ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS
 ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes.
ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes.
Modelo Atómico. Thompson (1898): Esfera uniforme de materia con carga (+) en la cual se encuentran embebidos los electrones con carga (-)
 Modelo Atómico 1 Thompson (1898): Esfera uniforme de materia con carga (+) en la cual se encuentran embebidos los electrones con carga () Electrón Conceptos:» Neutralidad eléctrica» Carga elemental del
Modelo Atómico 1 Thompson (1898): Esfera uniforme de materia con carga (+) en la cual se encuentran embebidos los electrones con carga () Electrón Conceptos:» Neutralidad eléctrica» Carga elemental del
Gradientes de Campo Magnético en experimentos de RMN
 VIII Escuela de Verano RMN Jaca 16-junio junio-2009 Gradientes de Campo Magnético en experimentos de RMN Teodor Parella SeRMN UAB Secuencia de pulsos, Espectro y Estructura Experimento RMN: Secuencia de
VIII Escuela de Verano RMN Jaca 16-junio junio-2009 Gradientes de Campo Magnético en experimentos de RMN Teodor Parella SeRMN UAB Secuencia de pulsos, Espectro y Estructura Experimento RMN: Secuencia de
DETERMINACIÓN ESTRUCTURAL (Teoría) CURSO , GRUP A 9 de febrero Apellidos... Nombre...
 DETERMINAIÓN ESTRUTURAL (Teoría) URS 2003-2004, GRUP A 9 de febrero 2004 Apellidos... Nombre... 1.- Que diferencias espera encontrar entre el 3 - y el 3 -D. a) en sus espectros de masas. El ión molecular
DETERMINAIÓN ESTRUTURAL (Teoría) URS 2003-2004, GRUP A 9 de febrero 2004 Apellidos... Nombre... 1.- Que diferencias espera encontrar entre el 3 - y el 3 -D. a) en sus espectros de masas. El ión molecular
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
Temas del Curso. Introducción a la resonancia magnética. Introducción a la fisiología de la señal BOLD. Introducción de la suite de herramientas FSL.
 Temas del Curso Introducción a la resonancia magnética. Introducción a la fisiología de la señal BOLD. Introducción de la suite de herramientas FSL. Postproceso de imágenes "crudas" de fmr. Análisis estadístico
Temas del Curso Introducción a la resonancia magnética. Introducción a la fisiología de la señal BOLD. Introducción de la suite de herramientas FSL. Postproceso de imágenes "crudas" de fmr. Análisis estadístico
La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica.
 SISTEMA PERIÓDICO DE LOS ELEMENTOS La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica. Niels Bohr Principio de exclusión
SISTEMA PERIÓDICO DE LOS ELEMENTOS La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica. Niels Bohr Principio de exclusión
Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos
 Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos INTEGRANTES: * Nazate Amuy Ana * Veloz Hidalgo Polet TEMA: Combinación Lineal de Orbitales Atómicos ORBITAL ATÓMICO
Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos INTEGRANTES: * Nazate Amuy Ana * Veloz Hidalgo Polet TEMA: Combinación Lineal de Orbitales Atómicos ORBITAL ATÓMICO
MOLÉCULAS POLAReS Y NO POLAReS
 MOLÉCULAS POLAReS Y NO POLAReS Una molécula polar presenta distribución asimétrica de las cargas eléctricas debido a la diferencia de electronegatividad de los átomos que la forman. Presenta dos zonas
MOLÉCULAS POLAReS Y NO POLAReS Una molécula polar presenta distribución asimétrica de las cargas eléctricas debido a la diferencia de electronegatividad de los átomos que la forman. Presenta dos zonas
El Modelo Moderno y resultados de nuestro interés
 CLASES 3 Y 4 ESTRUCTURA ELECTRÓNICA DE LOS ELEMENTOS AL ESTADO FUNDAMENTAL. TABLA PERIÓDICA. ELECTRONEGATIVIDAD. El Modelo Moderno y resultados de nuestro interés Así es como el Modelo Moderno (MM) reemplazó
CLASES 3 Y 4 ESTRUCTURA ELECTRÓNICA DE LOS ELEMENTOS AL ESTADO FUNDAMENTAL. TABLA PERIÓDICA. ELECTRONEGATIVIDAD. El Modelo Moderno y resultados de nuestro interés Así es como el Modelo Moderno (MM) reemplazó
Junio Pregunta 3B.- Una espira circular de 10 cm de radio, situada inicialmente en el plano r r
 Junio 2013. Pregunta 2A.- Una bobina circular de 20 cm de radio y 10 espiras se encuentra, en el instante inicial, en el interior de un campo magnético uniforme de 0,04 T, que es perpendicular al plano
Junio 2013. Pregunta 2A.- Una bobina circular de 20 cm de radio y 10 espiras se encuentra, en el instante inicial, en el interior de un campo magnético uniforme de 0,04 T, que es perpendicular al plano
Espectro Electromagnético
 1 Espectro Electromagnético La luz es radiación electromagnética y está compuesta por una parte eléctrica y otra magnética. Las particulas subatómicas, electrones y fotones, tienen propiedades de partículas
1 Espectro Electromagnético La luz es radiación electromagnética y está compuesta por una parte eléctrica y otra magnética. Las particulas subatómicas, electrones y fotones, tienen propiedades de partículas
RESONANCIA MAGNÉTICA NUCLEAR (NMR) Larraona Puy, M. Manjavacas Arévalo, A.
 Si ahora aplicamos un pulso electromagnético de radiofrecuencia a la frecuencia de resonancia, polarizado en una dirección perpendicular al plano de B, se inducirán transiciones por la absorción de fotones
Si ahora aplicamos un pulso electromagnético de radiofrecuencia a la frecuencia de resonancia, polarizado en una dirección perpendicular al plano de B, se inducirán transiciones por la absorción de fotones
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS. Tipos de radiaciones electromagnéticas según λ.
 RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
Elucidación Estructural de Biomoléculas utilizando Resonancia Magnética Nuclear
 Universidad de Los Andes Facultad de Ciencias Postgrado Interdisciplinario en Química Aplicada Mención Estudio de Materiales Elucidación Estructural de Biomoléculas utilizando Resonancia Magnética Nuclear
Universidad de Los Andes Facultad de Ciencias Postgrado Interdisciplinario en Química Aplicada Mención Estudio de Materiales Elucidación Estructural de Biomoléculas utilizando Resonancia Magnética Nuclear
PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS.
 PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS. 1. Explique que indica el número cuántico magnético y el número cuántico de espín. Número cuántico magnético:
PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS. 1. Explique que indica el número cuántico magnético y el número cuántico de espín. Número cuántico magnético:
Introducción a la Resonancia Magnética Nuclear. Química Orgánica III Primer Semestre 2014
 Introducción a la Resonancia Magnética Nuclear Química Orgánica III Primer Semestre 2014 Referencias empleadas en esta presentación: McMurry, John. Química Orgánica. 8ª. Edición. CENGAGE. Wade, L.J. Química
Introducción a la Resonancia Magnética Nuclear Química Orgánica III Primer Semestre 2014 Referencias empleadas en esta presentación: McMurry, John. Química Orgánica. 8ª. Edición. CENGAGE. Wade, L.J. Química
ENLACE QUIMICO. Química General 2009
 ENLACE QUIMICO 1.- Prediga la estructura de Lewis de los siguientes compuestos: a.- BF 3 b.- CH 4 Para poder predecir la estructura de Lewis utilizamos la siguiente fórmula: E = I - R Donde: E representa
ENLACE QUIMICO 1.- Prediga la estructura de Lewis de los siguientes compuestos: a.- BF 3 b.- CH 4 Para poder predecir la estructura de Lewis utilizamos la siguiente fórmula: E = I - R Donde: E representa
El Átomo de Bohr. Descripción mecánico-cuántica de los electrones alrededor del núcleo: orbitales atómicos
 Descripción mecánico-cuántica de los electrones alrededor del núcleo: orbitales atómicos El Átomo de Bohr 1.Los electrones orbitan el átomo en niveles discretos y cuantizados de energía, es decir, no todas
Descripción mecánico-cuántica de los electrones alrededor del núcleo: orbitales atómicos El Átomo de Bohr 1.Los electrones orbitan el átomo en niveles discretos y cuantizados de energía, es decir, no todas
Átomos polielectrónicos Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas
 ESTRUCTURA ELECTRÓNICA Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas Átomos con un solo electrón: La energía depende solamente del
ESTRUCTURA ELECTRÓNICA Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas Átomos con un solo electrón: La energía depende solamente del
GEOMETRÍA MOLECULAR. TEORÍA DE LA REPULSIÓN DE LOS PARES ELECTRÓNICOS DE LA CAPA DE VALENCIA (RPECV).
 ENLAE QUÍMI. ENLAE VALENTE GEMETRÍA MLEULAR. TERÍA DE LA REULSIÓN DE LS ARES ELETRÓNIS DE LA AA DE VALENIA (REV). La teoría de la REV nos ayuda a ver la geometría de las moléculas y esta a su vez a entender
ENLAE QUÍMI. ENLAE VALENTE GEMETRÍA MLEULAR. TERÍA DE LA REULSIÓN DE LS ARES ELETRÓNIS DE LA AA DE VALENIA (REV). La teoría de la REV nos ayuda a ver la geometría de las moléculas y esta a su vez a entender
Teoría Básica de RMN. La RMN es otro tipo de Espectroscopía de Absorción
 Teoría Básica de RMN La RMN es otro tipo de Espectroscopía de Absorción Base de la RMN: Absorción de energía por un núcleo atómico que provoca transiciones entre niveles de energía nucleares (o entre distintos
Teoría Básica de RMN La RMN es otro tipo de Espectroscopía de Absorción Base de la RMN: Absorción de energía por un núcleo atómico que provoca transiciones entre niveles de energía nucleares (o entre distintos
FÍSICA 2º Bachillerato Ejercicios: Campo magnético y corriente eléctrica
 1(9) Ejercicio nº 1 Una partícula alfa se introduce en un campo cuya inducción magnética es 1200 T con una velocidad de 200 Km/s en dirección perpendicular al campo. Calcular la fuerza qué actúa sobre
1(9) Ejercicio nº 1 Una partícula alfa se introduce en un campo cuya inducción magnética es 1200 T con una velocidad de 200 Km/s en dirección perpendicular al campo. Calcular la fuerza qué actúa sobre
3.1. Estructura atómica
 3.1. Estructura atómica Átomo Protones (+) Núcleo Neutrones (sin carga) Corteza Electrones (-) *Z Número atómico = Número de protones. Cuando el átomo está en estado neutro, Z también es equivalente al
3.1. Estructura atómica Átomo Protones (+) Núcleo Neutrones (sin carga) Corteza Electrones (-) *Z Número atómico = Número de protones. Cuando el átomo está en estado neutro, Z también es equivalente al
ESPECTROSCOPIA DE RESONANCIA MAGNÉTICA NUCLEAR
 ESPECTROSCOPIA DE RESONANCIA MAGNÉTICA NUCLEAR La espectroscopia de resonancia magnética nuclear (RMN) se basa en la medida de la absorción de la radiación electromagnética en la región de las radiofrecuencias
ESPECTROSCOPIA DE RESONANCIA MAGNÉTICA NUCLEAR La espectroscopia de resonancia magnética nuclear (RMN) se basa en la medida de la absorción de la radiación electromagnética en la región de las radiofrecuencias
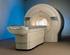
Resonancia Magnética en sistema musculoesquelético
 Resonancia Magnética en sistema musculoesquelético TR Gustavo Pérez Rodríguez 31 de enero 2010 LOGO Resonancia Magnética Se basa en la propiedad que poseen los núcleos de hidrógeno de absorber energía
Resonancia Magnética en sistema musculoesquelético TR Gustavo Pérez Rodríguez 31 de enero 2010 LOGO Resonancia Magnética Se basa en la propiedad que poseen los núcleos de hidrógeno de absorber energía
Espectrómetro de Resonancia Magnética Nuclear Descripción general y diseño del receptor
 PROYECTO FINAL DE CARRERA Espectrómetro de Resonancia Magnética Nuclear Descripción general y diseño del receptor LORENA PÉREZ MÉNDEZ Director: Pedro Martínez Cordero Ponente: Margarita Cabrera Bean Octubre
PROYECTO FINAL DE CARRERA Espectrómetro de Resonancia Magnética Nuclear Descripción general y diseño del receptor LORENA PÉREZ MÉNDEZ Director: Pedro Martínez Cordero Ponente: Margarita Cabrera Bean Octubre
Uniones Químicas. Iónicas Covalentes Metálicas
 Uniones Químicas Iónicas Covalentes Metálicas Unión iónica Propiedades de los Compuestos iónicos - Puntos de fusión y ebullición elevados - Sólidos duros y quebradizos - Baja conductividad eléctrica y
Uniones Químicas Iónicas Covalentes Metálicas Unión iónica Propiedades de los Compuestos iónicos - Puntos de fusión y ebullición elevados - Sólidos duros y quebradizos - Baja conductividad eléctrica y
INDICE 22. La carga eléctrica Resumen, preguntas, problemas 23. El campo eléctrico Resumen, preguntas, problemas Resumen, preguntas, problemas
 INDICE 22. La carga eléctrica 22-1. las propiedades de la materia con carga 646 22-2. la conservación y cuantización de la carga 652 22-3. la ley de Colulomb 654 22-4. las fuerzas en las que intervienen
INDICE 22. La carga eléctrica 22-1. las propiedades de la materia con carga 646 22-2. la conservación y cuantización de la carga 652 22-3. la ley de Colulomb 654 22-4. las fuerzas en las que intervienen
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica. Ing. Sol de María Jiménez González
 Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
CONTENIDOS. Contenidos. Presentación. xiii
 CONTENIDOS Contenidos Presentación v xiii 1. Campo eléctrico y propiedades eléctricas de la materia 1 1.1. Introducción histórica............................... 2 1.2. Estructura interna de la materia.........................
CONTENIDOS Contenidos Presentación v xiii 1. Campo eléctrico y propiedades eléctricas de la materia 1 1.1. Introducción histórica............................... 2 1.2. Estructura interna de la materia.........................
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
Preuniversitario Esperanza Joven Curso Física Intensivo, Módulo Común. Magnetismo
 Nombre: Campo magnético Preuniversitario Esperanza Joven Curso Física Intensivo, Módulo Común Guía 14 Magnetismo Fecha: Un imán genera en su entorno un campo magnético que es el espacio perturbado por
Nombre: Campo magnético Preuniversitario Esperanza Joven Curso Física Intensivo, Módulo Común Guía 14 Magnetismo Fecha: Un imán genera en su entorno un campo magnético que es el espacio perturbado por
TEMA 3 ENLACE QUÍMICO (PARTE 2)
 TEMA 3 ENLACE QUÍMICO (PARTE 2) Teoría de enlace valencia Se basa en la suposición de que los enlaces covalentes se producen por solapamiento (superposición) de los orbitales atómicos de distintos átomos
TEMA 3 ENLACE QUÍMICO (PARTE 2) Teoría de enlace valencia Se basa en la suposición de que los enlaces covalentes se producen por solapamiento (superposición) de los orbitales atómicos de distintos átomos
Materiales Y Dispositivos Electrónicos
 Materiales Y Dispositivos Electrónicos Guía De Estudio Nº 2 MODELOS ATÓMICOS DEFINICIONES GENERALES: Sugerimos repasar todos los conceptos asociados a las definiciones generales citadas a continuación:
Materiales Y Dispositivos Electrónicos Guía De Estudio Nº 2 MODELOS ATÓMICOS DEFINICIONES GENERALES: Sugerimos repasar todos los conceptos asociados a las definiciones generales citadas a continuación:
Práctica 6 ANÁLISIS DE CONTAMINANTES MEDIANTE TÉCNICAS DE RESONANCIA MAGNÉTICA NUCLEAR, GASES/MASAS E INFRARROJO
 Práctica 6 ANÁLISIS DE CONTAMINANTES MEDIANTE TÉCNICAS DE RESONANCIA MAGNÉTICA NUCLEAR, GASES/MASAS E INFRARROJO 1. Objetivo El objetivo de la presente práctica es la identificación cualitativa de compuestos
Práctica 6 ANÁLISIS DE CONTAMINANTES MEDIANTE TÉCNICAS DE RESONANCIA MAGNÉTICA NUCLEAR, GASES/MASAS E INFRARROJO 1. Objetivo El objetivo de la presente práctica es la identificación cualitativa de compuestos
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUÍMICA ORGÁNICA III ACIDOS CARBOXILICOS
 Nombre: Mayra Morales Carrera: Bioquímica y Farmacia ACIDEZ UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUÍMICA ORGÁNICA III ACIDOS CARBOXILICOS Los ácidos carboxílicos son compuestos
Nombre: Mayra Morales Carrera: Bioquímica y Farmacia ACIDEZ UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUÍMICA ORGÁNICA III ACIDOS CARBOXILICOS Los ácidos carboxílicos son compuestos
Práctica 6 IDENTIFICACIÓN DE CONTAMINANTES MEDIANTE ESPECTROSCOPÍA INFRARROJA
 Práctica 6 IDENTIFICACIÓN DE CONTAMINANTES MEDIANTE ESPECTROSCOPÍA INFRARROJA 1. Objetivo Familiarizarse con los fundamentos de la identificación de moléculas a partir de su espectro de absorción infrarrojo.
Práctica 6 IDENTIFICACIÓN DE CONTAMINANTES MEDIANTE ESPECTROSCOPÍA INFRARROJA 1. Objetivo Familiarizarse con los fundamentos de la identificación de moléculas a partir de su espectro de absorción infrarrojo.
Thompson (1898) Rutherford (1911) Bohr (1913) Schrödinger (1926) NUMEROS CUANTICOS
 Thompson (1898) Modelo Atómico Rutherford (1911) Bohr (1913) Propiedad corpuscular de las onda (PLANCK) Propiedad ondulatoria de las partículas (De Broglie) Schrödinger (1926) Números cuánticos 1 NUMEROS
Thompson (1898) Modelo Atómico Rutherford (1911) Bohr (1913) Propiedad corpuscular de las onda (PLANCK) Propiedad ondulatoria de las partículas (De Broglie) Schrödinger (1926) Números cuánticos 1 NUMEROS
Técnicas Avanzadas de Resonancia Magnética Nuclear GUÍA DOCENTE Curso
 Técnicas Avanzadas de Resonancia Magnética Nuclear GUÍA DOCENTE Curso 2009-2010 Titulación: Máster en Química Avanzada Código Asignatura: Técnicas Avanzadas de Resonancia Magnética Nuclear Código Materia:
Técnicas Avanzadas de Resonancia Magnética Nuclear GUÍA DOCENTE Curso 2009-2010 Titulación: Máster en Química Avanzada Código Asignatura: Técnicas Avanzadas de Resonancia Magnética Nuclear Código Materia:
INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3.
 El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
CURSO DE RESONANCIA MAGNETICA NUCLEAR
 CURSO DE RESONANCIA MAGNETICA NUCLEAR El espectro electromagnético y su aplicación en el diagnóstico por imágenes Lic. Carlos R. Sánchez Qué es el espectro electromagnético? Se conoce como espectro de
CURSO DE RESONANCIA MAGNETICA NUCLEAR El espectro electromagnético y su aplicación en el diagnóstico por imágenes Lic. Carlos R. Sánchez Qué es el espectro electromagnético? Se conoce como espectro de
ESTRUCTURAS DE RESONANCIA
 1 ESTRUCTURAS DE RESONANCIA HIBRIDOS DE RESONANCIA CUANDO SON POSIBLES DOS O MÁS ESTRUCTURAS PARA REPRESENTAR LOS ENLACES DE UNA MOLÉCULA Y SÓLO DIFIENREN EN LA COLOCACIÓN DE LOS ELECTRONES LA MOLÉCULA
1 ESTRUCTURAS DE RESONANCIA HIBRIDOS DE RESONANCIA CUANDO SON POSIBLES DOS O MÁS ESTRUCTURAS PARA REPRESENTAR LOS ENLACES DE UNA MOLÉCULA Y SÓLO DIFIENREN EN LA COLOCACIÓN DE LOS ELECTRONES LA MOLÉCULA
QUÍMICA LICENCIATURA DE INGENIERÍA EN ENERGÍAS RENOVABLES
 QUÍMICA LICENCIATURA DE INGENIERÍA EN ENERGÍAS RENOVABLES 2013-1 Teoría: Dra. Karina Cuentas Gallegos Martes y jueves 10-12 hrs. Laboratorio: M.C. Mirna Guevara García Jueves 12-14 hrs. Curso de Química
QUÍMICA LICENCIATURA DE INGENIERÍA EN ENERGÍAS RENOVABLES 2013-1 Teoría: Dra. Karina Cuentas Gallegos Martes y jueves 10-12 hrs. Laboratorio: M.C. Mirna Guevara García Jueves 12-14 hrs. Curso de Química
γ 13 C = C RMN H = ν = H o H 0 (T) ν 1 H RMN (MHz)* ν 13 C RMN (MHz)
 RMN I = 0 No observable en RMN I = ½ BSERVABLE EN RMN Abundancia natural del =.% Sensibilidad INTENSIDAD DE LAS SEÑALES RMN se basa en los mismos principios que RMN: utilizando una RF adecuada (o un pulso
RMN I = 0 No observable en RMN I = ½ BSERVABLE EN RMN Abundancia natural del =.% Sensibilidad INTENSIDAD DE LAS SEÑALES RMN se basa en los mismos principios que RMN: utilizando una RF adecuada (o un pulso
Problema Interferencia de N ranuras.
 Problema 9. 4. Interferencia de N ranuras. Considere un obstáculo con tres ranuras separadas por una distancia d e iluminado con una onda plana de longitud de onda λ. Emplee el método de los fasores para
Problema 9. 4. Interferencia de N ranuras. Considere un obstáculo con tres ranuras separadas por una distancia d e iluminado con una onda plana de longitud de onda λ. Emplee el método de los fasores para
Tema 3. CUESTIONES SOBRE ENLACE QUÍMICO
 Tema 3. CUESTIONES SOBRE ENLACE QUÍMICO Cuestión 1 Considere las siguientes propiedades de las las moléculas N 2, O 2 y F 2 : Energía de enlace (kj mol 1 ) Temperatura de ebullición (K) N 2 O 2 F 2 Energía
Tema 3. CUESTIONES SOBRE ENLACE QUÍMICO Cuestión 1 Considere las siguientes propiedades de las las moléculas N 2, O 2 y F 2 : Energía de enlace (kj mol 1 ) Temperatura de ebullición (K) N 2 O 2 F 2 Energía
UNIDAD 4. CAMPO MAGNÉTICO
 UNIDAD 4. CAMPO MAGNÉTICO P.IV- 1. Un protón se mueve con una velocidad de 3 10 7 m/s a través de un campo magnético de 1.2 T. Si la fuerza que experimenta es de 2 10 12 N, qué ángulo formaba su velocidad
UNIDAD 4. CAMPO MAGNÉTICO P.IV- 1. Un protón se mueve con una velocidad de 3 10 7 m/s a través de un campo magnético de 1.2 T. Si la fuerza que experimenta es de 2 10 12 N, qué ángulo formaba su velocidad
VARIACIONES PERIÓDICAS. Z = 53 Z = 53 Z = 53 Electrones = 54 Electrones = 53 Electrones = 52
 RESOLUCIÓN PRÁCTICO 13 VARIACIONES PERIÓDICAS 1 a) Las variaciones en el tamaño atómico e iónico son el resultado de la influencia del nivel n y de la carga nuclear efectiva (Z ef ). I > I > I Z = 53 Z
RESOLUCIÓN PRÁCTICO 13 VARIACIONES PERIÓDICAS 1 a) Las variaciones en el tamaño atómico e iónico son el resultado de la influencia del nivel n y de la carga nuclear efectiva (Z ef ). I > I > I Z = 53 Z
ENLACE COVALENTE. Z = 1 Hidrógeno H: 1s 1 Z = 6 Carbono C: 1s 2 2s 2 2p 2 Z = 7 Nitrógeno N: 1s 2 2s 2 2p 3 Z = 8 Oxígeno O: 1s 2 2s 2 2p 4 H H H 2
 ENLACE COVALENTE Si los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de los dos cederá electrones. Una manera de adquirir la configuración de gas noble en su última capa es
ENLACE COVALENTE Si los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de los dos cederá electrones. Una manera de adquirir la configuración de gas noble en su última capa es
GEOMETRÍA MOLECULAR. TEORÍA DE LA REPULSIÓN DE LOS PARES ELECTRÓNICOS DE LA CAPA DE VALENCIA (RPECV).
 ENLAE VALENTE GEMETRÍA MLEULAR. TERÍA DE LA REPULSIÓN DE LS PARES ELETRÓNIS DE LA APA DE VALENIA (RPEV). La teoría de la RPEV nos ayuda a ver la geometría de las moléculas y esta a su vez a entender algunas
ENLAE VALENTE GEMETRÍA MLEULAR. TERÍA DE LA REPULSIÓN DE LS PARES ELETRÓNIS DE LA APA DE VALENIA (RPEV). La teoría de la RPEV nos ayuda a ver la geometría de las moléculas y esta a su vez a entender algunas
Introducción. Fuerza ejercida por un campo magnético
 Introducción No se sabe cuándo fue apreciada por vez primera la existencia del magnetismo. Sin embargo, hace ya más de 2000 años que los griegos sabían que cierto mineral (llamado ahora magnetita) tenía
Introducción No se sabe cuándo fue apreciada por vez primera la existencia del magnetismo. Sin embargo, hace ya más de 2000 años que los griegos sabían que cierto mineral (llamado ahora magnetita) tenía
Espectroscopía vibracional y rotacional
 Espectroscopía vibracional y rotacional Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Ultima actualización 19 de marzo de 2015 Índice 1. Interacción de la radiación con la materia
Espectroscopía vibracional y rotacional Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Ultima actualización 19 de marzo de 2015 Índice 1. Interacción de la radiación con la materia
Enlace Químico. Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León
 Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I
 El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
ENLACE QUIMICO. Q.F. Luis José Torres Santillán
 ENLACE QUIMICO Q.F. Luis José Torres Santillán Enlace Químico Se define como la fuerza de unión que existe entre dos átomos, cualquiera que sea su naturaleza, debido a la transferencia total o parcial
ENLACE QUIMICO Q.F. Luis José Torres Santillán Enlace Químico Se define como la fuerza de unión que existe entre dos átomos, cualquiera que sea su naturaleza, debido a la transferencia total o parcial
E n 1946, dos grupos de investigadores
 1. INTRODUCCIÓN HISTÓRICA E n 1946, dos grupos de investigadores dirigidos por F. Bloch y E.M. Purcell observaron, por primera vez e independientemente, una señal de resonancia magnética nuclear. Bloch
1. INTRODUCCIÓN HISTÓRICA E n 1946, dos grupos de investigadores dirigidos por F. Bloch y E.M. Purcell observaron, por primera vez e independientemente, una señal de resonancia magnética nuclear. Bloch
MEDICIÓN DE LOS PRODUCTOS "CAMA AZUL"
 MEDICIÓN DE LOS PRODUCTOS "CAMA AZUL" MEDICIÓN DE LOS PRODUCTOS "CAMA AZUL" EI objeto de este informe es estudiar las características eléctricas, magnéticas y electromagnéticas del colchón, del protector
MEDICIÓN DE LOS PRODUCTOS "CAMA AZUL" MEDICIÓN DE LOS PRODUCTOS "CAMA AZUL" EI objeto de este informe es estudiar las características eléctricas, magnéticas y electromagnéticas del colchón, del protector
Apellidos... Nombre. 1. Indique el número de señales y la multiplicidad que presentarán los compuestos siguientes en 1 H-RMN. Justificar.
 DETERMINACIN ESTRUCTURAL (5 de julio de 2005) Grupo A. TIP A Apellidos.... Nombre 1. Indique el número de señales y la multiplicidad que presentarán los compuestos siguientes en 1 H-RMN. Justificar. CH3
DETERMINACIN ESTRUCTURAL (5 de julio de 2005) Grupo A. TIP A Apellidos.... Nombre 1. Indique el número de señales y la multiplicidad que presentarán los compuestos siguientes en 1 H-RMN. Justificar. CH3
LA TABLA PERIÓDICA. 1
 LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
Unidad Nº 10. Magnetismo
 Unidad Nº 10 Magnetismo 10.1. Definición y propiedades del campo magnético. Fuerza magnética en una corriente. Movimiento de cargas en un campo magnético. 10.2. Campos magnéticos creados por corrientes.
Unidad Nº 10 Magnetismo 10.1. Definición y propiedades del campo magnético. Fuerza magnética en una corriente. Movimiento de cargas en un campo magnético. 10.2. Campos magnéticos creados por corrientes.
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica
 Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
elementos reaccionan compuestos
 Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
TABLA 1- Desplazamientos químicos (δ) de protones de metilos, metilenos y metinos de alcanos monosustituidos con sustituyentes x en posición α
 TABLA 1- Desplazamientos químicos (δ) de protones de metilos, metilenos y metinos de alcanos monosustituidos con sustituyentes x en posición α alógeno N S --N X 3 X 2 X - 3,- 2-0,86 0,91 1,25 1,33 1,50
TABLA 1- Desplazamientos químicos (δ) de protones de metilos, metilenos y metinos de alcanos monosustituidos con sustituyentes x en posición α alógeno N S --N X 3 X 2 X - 3,- 2-0,86 0,91 1,25 1,33 1,50
Slide 1 / 33. Slide 2 / 33. Slide 3 / El número atómico es equivalente a cuál de los siguientes? A El número de neutrones del átomo.
 Slide 1 / 33 Slide 2 / 33 3 El número atómico es equivalente a cuál de los siguientes? Slide 3 / 33 A El número de neutrones del átomo. B El número de protones del átomo C El número de nucleones del átomo.
Slide 1 / 33 Slide 2 / 33 3 El número atómico es equivalente a cuál de los siguientes? Slide 3 / 33 A El número de neutrones del átomo. B El número de protones del átomo C El número de nucleones del átomo.
CAMPOS ELECTROMAGNÉTICOS DEPENDIENTES DEL TIEMPO
 CAMPOS ELECTROMAGNÉTICOS DEPENDIENTES DEL TIEMPO PROBLEMAS PROPUESTOS 1:.Se coloca una bobina de 200 vueltas y 0,1 m de radio perpendicular a un campo magnético uniforme de 0,2 T. Encontrar la fem inducida
CAMPOS ELECTROMAGNÉTICOS DEPENDIENTES DEL TIEMPO PROBLEMAS PROPUESTOS 1:.Se coloca una bobina de 200 vueltas y 0,1 m de radio perpendicular a un campo magnético uniforme de 0,2 T. Encontrar la fem inducida
2 o Bachillerato. Conceptos básicos
 Física 2 o Bachillerato Conceptos básicos Movimiento. Cambio de posición de un cuerpo respecto de un punto que se toma como referencia. Cinemática. Parte de la Física que estudia el movimiento de los cuerpos
Física 2 o Bachillerato Conceptos básicos Movimiento. Cambio de posición de un cuerpo respecto de un punto que se toma como referencia. Cinemática. Parte de la Física que estudia el movimiento de los cuerpos
PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS.
 PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS. PARTÍCULAS FUNDAMENTALES. CONCEPTOS PREVIOS De acuerdo con lo anterior, en un átomo hay tres partículas fundamentales: protones y neutrones,
PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS. PARTÍCULAS FUNDAMENTALES. CONCEPTOS PREVIOS De acuerdo con lo anterior, en un átomo hay tres partículas fundamentales: protones y neutrones,
La Molécula de agua y el efecto microondas
 La Molécula de agua y el efecto microondas Prof. Víctor J. García 1, Prof. Hernán Galindo, Br. Teobaldo Torres, Br. Eduardo de J. Rondón, Universidad de Los Andes, Departamento de Física, la Hechicera,
La Molécula de agua y el efecto microondas Prof. Víctor J. García 1, Prof. Hernán Galindo, Br. Teobaldo Torres, Br. Eduardo de J. Rondón, Universidad de Los Andes, Departamento de Física, la Hechicera,
11. FUERZAS INTERMOLECULARES
 Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
TRANSDUCTORES INDUCTIVOS.
 TRANSDUCTORES INDUCTIVOS. * La inductancia simple. La inductancia de una bobina depende: a).- Su geometría, b).- La permeabilidad del medio en que está localizada, c).- De su número de vueltas. La inductancia
TRANSDUCTORES INDUCTIVOS. * La inductancia simple. La inductancia de una bobina depende: a).- Su geometría, b).- La permeabilidad del medio en que está localizada, c).- De su número de vueltas. La inductancia
Inducción n electromagnética. tica. Física Sexta edición. Capítulo 31 31
 Inducción n electromagnética tica Capítulo 31 31 Física Sexta edición Paul PaulE. E. Tippens Ley de Faraday Fem inducida por un conductor en movimiento Ley de Lenz El generador de ca El generador de cc
Inducción n electromagnética tica Capítulo 31 31 Física Sexta edición Paul PaulE. E. Tippens Ley de Faraday Fem inducida por un conductor en movimiento Ley de Lenz El generador de ca El generador de cc
TEXTO: CIRCUITOS ELECTRICOS II, UN NUEVO ENFOQUE
 UNIVERSIDAD NACIONAL DEL CALLAO FACULTAD DE INGENIERÍA ELÉCTRICA Y ELECTRÓNICA INSTITUTO DE INVESTIGACIÓN INFORME FINAL DE TRABAJO DE INVESTIGACIÓN TEXTO: CIRCUITOS ELECTRICOS II, UN NUEVO ENFOQUE AUTOR:
UNIVERSIDAD NACIONAL DEL CALLAO FACULTAD DE INGENIERÍA ELÉCTRICA Y ELECTRÓNICA INSTITUTO DE INVESTIGACIÓN INFORME FINAL DE TRABAJO DE INVESTIGACIÓN TEXTO: CIRCUITOS ELECTRICOS II, UN NUEVO ENFOQUE AUTOR:
ESTRUCTURA DE LA MATERIA QCA 05 ANDALUCÍA
 1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
