+ R-L R-Nu + L: Las principales variables mecanísticas están asociadas con los cambios en el tiempo de estos dos procesos. Son imaginables tres vías:
|
|
|
- Blanca Fidalgo Palma
- hace 7 años
- Vistas:
Transcripción
1 Tema 3 Sustitución Nucleofílica a carbono saturado. Usos sintéticos. Química rgánica Avanzada 3.1 MEANISM Y ESTEREQUÍMIA. Todas las reacciones que encajan en esta clasificación se caracterizan por la presencia de un nucleófilo que reemplaza a un sustituyente (grupo saliente) sobre un átomo saturado. Nu RL RNu L Las principales variables mecanísticas están asociadas con los cambios en el tiempo de estos dos procesos. Son imaginables tres vías 1) Reacción en dos etapas Ruptura del viejo enlace y formación del nuevo. 2) Reacción en dos etapas Formación del nuevo enlace y ruptura del viejo. 3) Reacción en una etapa Formación y ruptura simultáneas o concertadas. ay que destacar que la primera y la tercera son posibles a carbono saturado. (1) RX R X (2) Nu R NuR S N 1 Etapa determinante de la velocidad es la ionización del sustrato, la formación del carbocatión Nu RX [Nu...R...X] = NuR X S N 2 Reacción concertada, no hay intermedios estado de transición En la segunda no es posible cuando hablamos de carbono saturado, ya que tiene su capa electrónica completa y para formar un nuevo enlace, primero tiene que producirse una ruptura, pero este proceso puede darse en el caso del boro trivalente. Nu BR 2 L NuBR 2 L NuBR 2 L 1
2 Química rgánica Avanzada Mecanismo S N 1. Un buen ejemplo sería la siguiente solvólisis ( 3 ) 3 l ( 3 ) 3 l ( 3 ) 3 2 ( 3 ) 3 2 l ( 3 ) 3 l S N 1 v = K 1 [tbul] La reacción se dice que es S N 1 es decir sustitución nucleofílica unimolecular, reacción de primer orden, reacción en dos pasos ionización y adición. Mecanismo S N 2. Un buen ejemplo sería la solvólisis del cloruro de etilo, es necesario en presencia de Na. S N l 3 2 l v = K 2 [Etl] [] La velocidad de reacción depende de la concentración de cloruro de etilo y de sosa lo que indica que la reacción es de segundo orden. Si el sustrato de partida es ópticamente activo, cuando la reacción se produce sobre el átomo de carbono asimétrico, tres cursos estereoquímicos son posibles retención, inversión o racemización. 2
3 Química rgánica Avanzada Nu Y X L Y X Nu L Retención Nu Y X Z L Nu Z X Y L Inversión Z Z Nu Y X L Y X Nu Nu X Y L Racemización Z Z (11) Z En la S N 2 la reacción es concertada lo que implica que en el estado de transición la formación y ruptura son simultáneas y por lo tanto son altamente estereoselectivas y van con inversión de configuración predominante. Nu Y X L Nu X Y L = Nu X Y L Z Z Z S N 2 Inversión En la S N 1 la reacción es en dos etapas, en las que intervienen carbocationes como intermedios. No siempre el curso estereoquímico es racemización. Ejemplos 3
4 Química rgánica Avanzada 3 2 Φ l 2 S (S)1fenil2propanol K Φ 3 (R)1fenil2propanol Py t.a. K 2 / 3 2 Φ S 2 3 Tosilato de (S)2fenil1metiletilo K S N 2 2 Φ Acetato de (R)2fenil1metiletilo Inversión K Ts N l Φ Br Br 3 (exceso) 3 S N 1 Racemización 3 Φ 3 3 carbocatión solvatado simétricamente Φ 3 3 (11) 73% 3 Φ 3 Φ S N 1 Br 3 3 Inversión 3 Φ 3 Br carbocatión solvatado asimétricamente 3 Φ 3 27% 4
5 Química rgánica Avanzada 3.2 REATIVIDAD RELATIVA. El curso de la sustitución nucleofílica sobre un carbono saturado se ve afectado por muchos factores La naturaleza del nucleófilo o del grupo saliente, el medio de reacción (disolvente) las condiciones (temperatura, concentración, ) pueden determinar a menudo la distribución de productos y el mecanismo por el cual transcurre la reacción. a) El grupo saliente. Los mejores grupos salientes son los más capaces de acomodar los electrones enlazantes originales. Ejemplo las bases conjugadas de ácidos fuertes (pka<5), muy estables, son los mejores grupos salientes. En las S N 1, donde el átomo de oxígeno pertenece al grupo saliente, este se compleja primero con un protón o ácido de Lewis, con lo que el grupo saliente es neutro. Grupo Saliente pka del ácido buenos conjugado p 3 ΦS 3 < 0 I ó Br ó l < 0 2 < 0 R 2 S < 0 F R R R BX 3 S N 1 S N 1 R R 2 X 3 B 2 P La catalisis electrofílica aumenta enormemente la velocidad de ionización lo que favorece la S N 1, (por ejemplo la ionización de alcoholes y éteres por ácidos de Lewis, ionización de haluros por uso de catión plata). R Br S Ag N 1 R BrAg 5
6 Química rgánica Avanzada b) El nucleófilo. Los buenos nucleófilos son buenos dadores de electrones y por lo tanto buenas bases de Lewis. La nucleofilidad y la basicidad van unidas dentro de la misma fila del sistema periódico. I > Br > l >> F ; RS > R Disminución de la reactividad. Ejemplo El oxígeno es más básico y el azufre es más nucleofílico. S S S ión ambidentado R S R La correlación de nucleofília con basicidad no es exacta, son dos reacciones distintas Basicidad, es un fenómeno de equilibrio que mide la reactividad frente a los protones (en 2 ). Nucleofília, es un fenómeno de velocidad de reacción con un átomo de carbono (cinética), generalmente en disolventes no acuosos. El tamaño y forma es otra variable importante tbutóxido 3 metóxido En el ejemplo, el primero es un mal nucleófilo ya que es voluminoso y se producen interacciones estéricas en la sustitución nucleofílica. 6
7 Química rgánica Avanzada c) El lugar de la sustitución. aciendo un estudio de las velocidades de reacción, los resultados indican que las reacciones S N 1 están favorecidas sobre sustratos terciarios ya que el paso determinante de la reacción es la formación del carbocatión. por efectos de resonancia donde las reacciones S N 2 están favorecidas sobre sustratos primarios ya que los efectos estéricos son importantes. Si el átomo de carbono sobre el que va a ocurrir la reacción, forma parte de un compuesto cíclico, hay que tener en cuenta, también factores conformacionales. Ejemplo S N 1 ó S N 2 sobre anillos de tres o cuatro miembros, se ven más desfavorecidos que sobre los análogos sustratos acíclicos, ya que aumenta la tensión angular. En anillos de cinco miembros La S N 2, idem a los análogos acíclicos, mintras que la S N 1, están favorecidas ya que al formar un carbocatión sobre el anillo, el ángulo de enlace aumenta a 120º, y disminuyen las interacciones. En anillos de seis miembros La S N 1, idem a análogos acíclicos, el anillo esta exento de tensión. En la S N 2, esta desfavorecida, el acercamiento del nucleófilo, aumenta las interacciones no enlazantes. En anillos de siete a diez miembros La S N 2, idem a análogos acíclicos. En la S N 1, esta favorecido al marcharse el grupo saliente por lo que disminuye las interacciones no enlazantes intramoleculares. d) Efectos del disolvente. La polaridad del disolvente indicará la facilidad del medio para acomodar cargas. Las S N 1 se ven favorecidas en disolventes polares, que estabilizan el carbocatión intermedio. En la S N 2 la polaridad también influye sobre el mecanismo, ya que se pueden dar a) Sustrato neutro y nucleófilo cargado, en el estado de transición se dispersa la carga y por lo tanto disminuye la polaridad del disolvente lo que favorece la reacción. 7
8 Química rgánica Avanzada b) Sustrato y nucleófilo neutros lo que implica estado de transición cargado por lo que el disolvente más polar favorece la reacción. c) Nucleófilo y sustrato cargados, es decir se destruye carga en el estado de transición por lo que hay una disminución de la polaridad y favorece la reacción. El que un disolvente sea prótico o aprótico infuye en la reactividad a) Los disolventes próticos (Me, Et,..) complejan a través del oxígeno, cationes; y a través del hidrógeno, aniones por formación de puentes de hidrógeno, ya que solvatan mejor al nucleófilo, y será más difícil que se libere de parte de la esfera de solvatación para reaccionar. b) Disolventes apróticos (DMS, DMF, MPT,..), solvatan iones pero no forman puentes de hidrógeno con aniones o bases de Lewis, es decir que el nucleófilo esta más libre para reaccionar, al estar menos solvatado se ven favorecidas las reacciones de sustitución nucleofílica. Mecanismo RL R Nu RNu S N 1 RL Nu RNu L S N 2 inética Primer rden Segundo orden Nucleofilia del reactivo No afecta a la velocidad Afecta a la velocidad Estructura del saturado Disolvente Estabilización por resonancia 3º > 2º > 1º Favorecida por disolventes polares Impedimento estérico desfavorable 1º > 2º > 3º Polaridad afecta poco. El enlace por puente de inhibe el Nu Estereoquímica Racemización Inversión ondiciones de reacción Generalmente ácidas Generalmente básicas Reacciones competitivas Eliminación y transposición Eliminación 8
9 3.3 PARTIIPAIÓN DE GRUPS VEINS Y ILAINES. Química rgánica Avanzada Si existe un segundo grupo funcional presente en la molécula sustrato, puede participar en la reacción de sustitución siempre que cumpla dos requerimientos El grupo debe poseer un par de electrones (Nu), y el átomo que porta el par de electrones debe estar a una distancia favorable del carbono donde ocurra la sustitución nucleofílica tres, cinco o seis átomos. Z (a) ciclación Z L S N 1 ó S N 2 Z L Nu Z Nu (b) SN1 ó SN2 3,5,6 eliminaciones, transposiciones El par de electrones del grupo funcional interno actúa de nucleófilo, para producir una sustitución nucleofílica intramolecular. En los siguientes casos podemos observar que en dos de ellos, la reacción transcurre con inversión, en otro la reacción no ocurre, mientras que en el cuarto caso, la reacción transcurre con retención, ya que tienen lugar dos sustituciones nucleofílicas consecutivas, ambas obligadas geométricamente a ser inversiones. Br S N 2 Br trans 9
10 Br Br S N 2 X Química rgánica Avanzada cis R Br R Br R R R Br 2bromopropionato Br S N 2 S N 2 R 2 inversiones = 100% retención lactato R Participación de un átomo de la misma molécula da lugar a una participación de grupos vecinos o asistencia anquimérica. Et EtS l S l 2 EtS S N 2 con asistencia anquimérica = 100% retención Et 3 Br Br 2 Et 3 Et 3 3 Et S N 2 con asistencia anquimérica 10
11 3.4 REAINES MPETITIVAS. Química rgánica Avanzada Junto con la sustitución nucleofílica pueden darse reacciones adicionales eliminación y transposición. Nu L Nu L eliminación Nu L sustitución La eliminación, es una reacción que compite con la sustitución, ocurre si el sustrato tiene en β al grupo saliente un hidrógeno lábil y además el nucleófilo, tiene mucho carácter básico, o el impedimento estérico favorece esta reacción frente al desplazamiento. Et Na 3 Br 3 Et t.a. 3 Br 3 21% 2 3 Las reacciones tipo S N 1 frecuentemente dan reagrupamientos, debido a consideraciones termodinámicas I 3 Ioduro de neopentilo AcAg Ac IAg 3 IAg T 1º Ac º Acetato de tamilo 11
12 3 2 l cloruro de crotilo l Química rgánica Avanzada alcohol crotilo 2 1buten3ol 3.5 USS SINTÉTIS FRMAIÓN DE ENLAES y S uando se utilizan para la sustitución nucleofílica, átomos de oxígeno o azufre como nucleófilos, sobre átomos de carbono saturado, abrimos una vía sintética hacia la obtención de alcoholes (R), éteres (RR ), ésteres (RR ), tioles (RS), sulfuros (RSR ), y otros compuestos. Sustitución por 2. Métodos para obtener R Reducción de carbonilos. Adición de organometálicos a carbonilos. Adición de 2 a dobles enlaces. También podría considerarse sustitución nucleofílica por 2 de grupos salientes como X; S 3 R, R (pero como estos derivan de los alcoholes, no tienen mucha utilidad). Industrialmente sólo se usan en la hidrólisis de haluros de alquilo que se preparan de forma barata de los hidrocarburos correspondientes. hν l l tolueno S N alcohol bencílico La S N 2 de halogenuros de alquilo primarios con 2 es muy lenta l 2 S N l 3 l 12
13 Química rgánica Avanzada Nucleófilos como el ion hidróxido en vez del agua, dan sustituciones nucleofílicas más rápidas, pero al ser buena base, compite la eliminación l Na = 2 S N 2 E2 (5%) La S N 1de halogenuros de alquilo terciarios con agua dan competencia de S N / eliminación. on ion hidróxido dan prácticamente eliminación Br Br % 36% 1% 99% Sustitución por R. Métodos de obtención de éteres. Aunque la reacción con R como nucleófilo, en condiciones neutras, suele ser satisfactoria, generalmente es preferible el uso de alcoxido sódico como nucleófilo, los cuales se forman fácilmente del alcohol con sodio metálico. El tratamiento de halogenuro de alquilo con alcóxido sódico da lugar de manera irreversible al correspondiente éter, Síntesis de Williamson Na npr 3 2 I (70%) 3 3 Na 3 DMS 3 (78%) 3 S
14 Química rgánica Avanzada Los disolventes polares apróticos DMS, DMF,., aumentan la nucleofilidad y aumentan el rendimiento de la sustitución nucleofílica. 3 ( 2 ) 5 2 S Na 3 ( 2 ) (90%) 3 ( 2 ) 5 2 ( 3 ) 3 3 ( 2 ) 5 2 S ( 3 ) 3 Na 3 ( 2 ) 4 = 2 (65%) (20%) Para obtener éteres fenólicos, no es necesario bases fuertes, con una débil es suficiente, dado que los fenoles son más ácidos que los alcoholes. Na S (92%) Para obtener éteres simétricos se utiliza la deshidratación de alcoholes en medio ácido y calor. 2 S (>95%) 2 2 () 2 pts 200º 2 (88%) Mecanismo Et 2 S 4 Et 2 S 4 Et Et 2 EtEt 2 Los éteres son muy estables, por eso reaccionan sólo on I o Br concentrado y calor. 3 Br 3 Br 3 Br 14
15 Química rgánica Avanzada Forman acetales y cetales (grupos protectores de carbonilos estables en medio básico, y eliminables en medio ácido). Sustitución por R. Método de obtención de ésteres. Alquilación de la sal del carboxílico con RX ó RS 3 R. 3 K 3 ( 2 ) 2 2 Br DMF 200º 3 2 ( 2 ) 2 3 KBr (98%) Se utilizan disolventes polares apróticos. Para obtener ésteres metílicos se utiliza el diazometano a partir del correspondiente ácido N N 2 N N éter 0º N N N 2 Alquilación del carboxilato en presencia de sales de plata, mediante S N Br Ag 3 2 BrAg BrAg Sustitución por nucleófilos de azufre. 15
16 Química rgánica Avanzada Los tioles (RS) son buenos nucleófilos para preparar sulfuros mediante una reacción similar a la de Williamson. EtNa S Br S Et (85%) Los sulfuros (RSR ) son buenos nucleófilos para preparar sales de sulfonio (sólidos). 3 S 3 I 3 ( 3 ) 3 S I Los sulfuros (RSR ) pueden oxidarse en presencia de 2 2 para dar sulfóxidos o sulfonas. 3 S 3 DMS ( 3 ) 2 S 2 ( 3 ) 2 S 2 ( 3 ) 2 S 3 ( 3 ) 2 S DMS ( 3 ) 2 S 3 Dimetilsulfona Nucleófilos inorgánicos de azufre dan sustitución nucleofílica para generar compuestos orgánicos de azufre. Na SS Na I 3 2 SS NaI Disulfuro sódico Disulfuro de dietilo Na S N ( 3 ) 2 Br Tiocianato sódico ( 3 ) 2 S N BrNa Tiocianato de isopropilo Nucleófilos tales como el 2 S en exceso se utilizan para preparar tioles (se pone exceso para evitar que el tiol resultante a su vez se alquile y de el sulfuro). 2 S (exceso) 3 2 Br EtNa Et 3 2 S 3.6 USS SINTÉTIS FRMAIÓN DE ENLAES X. 16
17 Química rgánica Avanzada Existen tres métodos de obtención de halogenuros de alquilo (RX) o Sustitución nucleofílica de alcoholes. o Adición de halógenos (X 2 ) o halogenuros de hidrógeno (X) a dobles enlaces. o A partir de hidrocarburos (R) por halogenación fotoquímica. El nucleófilo es X 3 ( 2 ) 2 2 Br 3 ( 2 ) Br S N 2 3 ( 2 ) 2 2 Br 2 (95%) ( 3 ) 3 Br Br S N 1 Br ( 3 ) 3 2 ( 3 ) 3 2 ( 3 ) 3 Br (35%) omo el l es un ácido más débil que el Br, a menudo la reacción de protonación se acelera en presencia de un ácido de Lewis. 3 ( 2 ) 2 2 l Znl 2 l 3 ( 2 ) 2 2 Znl 2 3 ( 2 ) 2 2 l (78%) El nucleófilo es l 2 S ó PX 3. Para preparar RX desde R el primer paso consiste en la transformación del R en un éster inorgánico y desplazamiento del mismo con el haluro. 3 ( 2 ) 2 2 PBr 3 3 ( 2 ) 2 2 PBr 2 Br Br 3 ( 2 ) 2 2 Br PBr 3 2 Sl S l 2 l S 2 (89%) 17
18 R (1º y 2º) S N2 R (3º) S N 1 RX (Inversión) RX (Racemización) Química rgánica Avanzada Sin embargo, con l 2 S, dependiendo de las condiciones de reacción puede variar el curso estereoquímico éter = Retención l 6 13 Sl 2 S 2 l S N interna (R)2octanol (R)2clorooctano S 6 13 l(éter) S 2 l l El éter es un disolvente poco polar, poco favorable a la separación de cargas, y el carbocatión y el haluro se atraen formando un par iónico (R)2octanol Sl 2 Py = Inversión S N 2 N l l l S S Nl (S)2clorooctano En este último caso, el ácido clorhídrico está como cloruro de piridinio y atacará por la cara posterior del clorosulfito, dando lugar al producto de inversión. 18
19 3.7 USS SINTÉTIS GENERAIÓN DE ENLAES N Y P. Química rgánica Avanzada Existen tres métodos de obtención de aminas o Sustitución nucleofílica mediante N 3 u otras aminas. o Reducción de amidas RN 2. o Reducción de nitrilos RN. El nucleófilo es N 3 y otras aminas. Para obtener aminas primarias N 3 RX RN 3 X N 3 RN 2 N 4 X Se añade un exceso para captar el l y evitar alquilación posterior de la amina obtenida. Si no añadimos exceso, tendremos una mezcla de aminas primarias, secundarias y terciarias. 3 N 2 3 l ( 3 ) 2 N 2 l N 3 ( 3 ) 2 N N 4 l ( 3 ) 3 N N 4 l N 3 ( 3 ) 3 N l 3 l N 3 (exceso) N Puede obtenerse una amina concreta, sin mezclas, sólo con poner en el medio una base que capte el exceso de ácido. N l Na N (87%) 19
20 Síntesis de Gabriel, permite obtener aminas primarias puras. Química rgánica Avanzada N KN 2 DMF N K Br DMF N 2 2 BrK K K N (97%) K/ 2 Aminas primarias aromáticas, tienen una importancia capital en la reacción de Sandmeyer, que implica la formación de las sales de diazonio para posteriormente producir reacciones de sustitución nucleofílica aromática. Aminas 1ª N 2 Ar N N Sal de diazonio Aminas 2ª N 2 R 2 N N Nitrosoamina Aminas 3ª RX R 4 N X Sal de amonio cuaternaria Aminas secundarias, dan lugar a nitrosoaminas, que son compuestos cancerígenos. Aminas terciarias pueden también actuar como nucleófilos frente a halogenuros de alquilo para generar sales de amonio cuaternarias, sólidas y neutras. Grasa animal Na n N 3 n N 2 n N( 3 ) 3 Jabón catiónico 3 3 l n N 2 2 n N 2 /Ni presión Existen otros compuestos con Nitrógeno, en los que este puede actuar como nucleófilo Azida Es una base débil y buen nucleófilo puede reaccionar con RX y generar aminas primarias sin mezclas y sin competencia de la eliminación. 20
21 Química rgánica Avanzada S N Azida RX Aminas 1ª 2 Ts Na N N Me 1) Li N 4 Al 2 N 3 2 N 2) 2 3 (94%) idrazina Se alquila con facilidad y controlando las cantidades de reactivo, podemos controlar el producto de alquilación. Na N 2 N 2 3 ( 2 ) 2 I ( 2 ) 2 NN 2 (exceso) Isocianato. Me permite la obtención de metilaminas secundarias. 1) Li4Al 3 2 I Na N 3 2 N 2) N 3 (78%) Fosfinas y fosfitos tricoordinados aromáticos. Son buenos nucleófilos y dan por sustitución nucleofílica sales de fosfonio útiles para la reacción de Wittig. ( 6 5 ) 3 P 2 Br ( 6 5 ) 3 P 2 Sal de fosfonio Br Si el fosfito es de alquilo se generarían fosfonatos. ( 2 5 ) 3 P 3 I S N 2 ( 2 5 ) 2 P I S N 2 Ión fosfonio Fosfonato ( 2 5 ) 2 P EtI USS SINTÉTIS FRMAIÓN DE ENLAES. onsistiría en la obtención de hidrocarburos, al final de una secuencia sintética por desplazamiento de un RX, RTs, u otro grupo saliente, con hidruro. 21
22 Química rgánica Avanzada idruro de aluminio y litio ( 4 AlLi). Es excelente fuente de hidruros y el proceso implica una vía S N 2 con inversión de la configuración. Li Al RL L= X, Ts... éter ó TF Al 3 R Li L LiAl 4 S N 2 1) Et 2 2) 3 (59%) Si existe en la molécula varios grupos que podrían reducirse, no es selectivo. Borohidruro sódico (B 4 Na). Es una fuente menos reactiva y por tanto, más selectiva, útil para halogenuros bencílicos y halogenuros terciarios. DME/ ( 6 5 ) 3 l NaB 2 4 ( 6 5 ) 3 Na (96%) Br N LiB4 /Li (RX impedidos) (88%) N 3 ( 2 ) 5 3 Ts LiEt 3 B/TF (Superhidruro) 3 ( 2 ) 6 3 idrogenolisis. Implica la ruptura del enlace carbonoheteroátomo por hidrógeno catalítico (no es en realidad una sustitución nucleofílica, pero el resultado lo parece). 22
23 Química rgánica Avanzada l /Pd Me/K (>99%) 3.9 USS SINTÉTIS FRMAIÓN DE ENLAES. La formación de enlaces es esencial en síntesis, y por tanto las reacciones de sustitución nucleofílica son uno de los mejores métodos. uando el nucleófilo es un organometálico (RLi, RMgX). Nu carbonados N 6 5 MgBr 6 5 MgBr uando el nucleófilo es cianuro, esto implica una extensión en un carbono de la cadena carbonada. NaN l N (90%) 2 /Ni N 2 (89%) 2 NaN Br( 2 ) 3 Br 2 N( 2 ) 3 N 3 (85%) uando el nucleófilo es acetiluro. 23
24 N 2 Na N 3 Na Br 30º N 3 /30º 2 Na 2 N 3 Fel 3 /N 3 2 Na N 2 2 Química rgánica Avanzada BrNa (90%) uando el nucleófilo son iones enolato. Los carbaniones estabilizados por grupos atractores (o por resonancia) adyacentes son los reactivos sintéticos más útiles. Grupos que estabilizan carbaniones adyacentes N > R > S R > R ó N > ó B B pka=20; Base= Na, Na N 2, LiNEt 2, ( 6 5 ) 3 Na ó tbuk en DME, N 3 ó DMF Si existen dos átomos de hidrógeno ácidos implica la posibilidad de mono o dialquilación, se logra con el control de los reactivos. 3 B 3 Et 3 Et pka= 515; Base= EtNa ó RNa en Et ó R 3 Et Et 3 7 Br 3 (70%) 3 7 Et La descarboxilación del producto alquilado abre una vía sintética aún más amplia. 24
25 3 3 7 Et l/ (90%) Química rgánica Avanzada btención de compuestos cíclicos por dialquilación. Et Et 1) EtNa/Et 2) Br( 2 ) 3 Br Et Et ( 2 ) 3 Br EtNa Et Et Et (67%) 2 (44%) 1) Na/ 2 2) Η, Si existen dos posiciones αadyacentes al grupo carbonilo aquella que posea el hidrógeno más ácido se enolizara más rápidamente y será la posición preferente a la alquilación ( 6 5 ) 3 DME I (>93%) (<1%) En caso de un enolato altamente estable (βcetoester), será necesario una base fuerte (KN 2 ) para convertir el compuesto en un dianión, el cual ahora podrá alquilarse por el lado menos ácido, ya que una vez formado ese enolato será más básico, más nucleofílico y reactivo. Ejemplo. 25
26 3 2 2 Et 1 2 EtNa Et Et 3 N 2 K N 3 2 Et 4 9 Br Química rgánica Avanzada 3 Et 4 9 (70%) 1) 3 I Et 2 2 Et 2) 3 Mayoritario alquilación/alquilación El anión enolato es ambidentado, la carga se acomoda entre dos átomos oxígeno y carbono (oxígeno mayoritariamente por ser más electronegativo). Por tanto, podría alquilarse por el oxígeno o por el carbono, existen distintos factores que justifican uno u otro curso de reacción arbono menos electronegativo implica que tiene sus electrones menos retenidos, los comparte más fácilmente con otro átomo con el que forma enlace en la sustitución nucleofílica. Disolventes próticos implica alquilación y por tanto solvatan mejor al oxígeno y pueden formar puentes de hidrógeno, dejando más libre al carbono para actuar como nucleófilo. Disolventes apróticos, polares da lugar a mezclas. 26
27 3 K Et 4 9 Br 3 Química rgánica Avanzada 4 9 Et Et Et 100% 0% Acetona 90% 10% DMS 53% 47% Si el electrófilo es muy reactivo con aniones enolato entonces alquilación preferentemente. Ejemplo el ltms reactivo usado para atrapar formas enólicas. Li Si( 3 ) 3 [( 3 ) 2 ] 2 N Li DME Li ltms (80%) alquilación/nalquilación La enaminas son nucleófilos ambidentados de utilidad sintética, son especies no cargadas N N La enamina se prepara de un compuesto carbonílico y una amina secundaria. La reacción de la enamina con un agente alquilante, va seguida de una hidrólisis, para poder recuperar el carbonilo original. La enamina enmascara al carbonilo, al tiempo que lo activa para la sustitución nucleofílica. 27
28 Química rgánica Avanzada N N 2 N Br 2 2 Et Me S N 2 Br N 2 2 Et (58%) 2 2 Et Br N 28
DERIVADOS HALOGENADOS. Estructura
 TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
Reacciones de reducción
 idrogenación catalítica: reactivos y condiciones eacciones de reducción 1. atalizadores: metales nobles (Pt) ó seminobles (Pd), Ni-raney, en matriz o soporte inerte (, sulfatos, carbonatos) que adsorbe
idrogenación catalítica: reactivos y condiciones eacciones de reducción 1. atalizadores: metales nobles (Pt) ó seminobles (Pd), Ni-raney, en matriz o soporte inerte (, sulfatos, carbonatos) que adsorbe
Reacciones de adición
 erramientas de la Química rgánica erramientas de la Química rgánica eacciones de adición en los alquenos : adición polar (I) eacciones de adición + + - δ+ δ- - 1 2 erramientas de la Química rgánica eacciones
erramientas de la Química rgánica erramientas de la Química rgánica eacciones de adición en los alquenos : adición polar (I) eacciones de adición + + - δ+ δ- - 1 2 erramientas de la Química rgánica eacciones
F FA AC C U ULTAD LTAD D D E
 FACULTAD DE QUÍMICA 4.1 Adición electrofílica a enlaces múltiples C-C 4.2 Adición de radicales libres a enlaces múltiples C-C 4.3 Adición nucleofílica a enlaces múltiples C-C 4.4 Adición nucleofílica a
FACULTAD DE QUÍMICA 4.1 Adición electrofílica a enlaces múltiples C-C 4.2 Adición de radicales libres a enlaces múltiples C-C 4.3 Adición nucleofílica a enlaces múltiples C-C 4.4 Adición nucleofílica a
Conceptos basicos (III)
 erramientas de la Química rgánica erramientas de la Química rgánica ompuestos carbonílicos onceptos basicos (III) δ δ plano 120 º = polar sp 2 Z Z Z Z = ó Ar Z = ó Ar aldehídos cetonas María Font. Dpto.
erramientas de la Química rgánica erramientas de la Química rgánica ompuestos carbonílicos onceptos basicos (III) δ δ plano 120 º = polar sp 2 Z Z Z Z = ó Ar Z = ó Ar aldehídos cetonas María Font. Dpto.
Estructura del grupo carbonilo
 TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
Reacciones de Eliminación 26/06/2012
 Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
Desconexión del cloruro de t-butilo
 Síntesis rgánica 1 Tema 1.- El método de la desconexión. Concepto de análisis retrosintético. Sintón y equivalente sintético. Desconexiones de un grupo C-X. Síntesis de ésteres y amidas. Síntesis de éteres
Síntesis rgánica 1 Tema 1.- El método de la desconexión. Concepto de análisis retrosintético. Sintón y equivalente sintético. Desconexiones de un grupo C-X. Síntesis de ésteres y amidas. Síntesis de éteres
REACTIVIDAD DE LOS COMPUESTOS ORGÁNICOS
 REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
Ecuación de Hammett 1
 Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
2. ACIDOS Y BASES, REACCIONES DE GRUPOS FUNCIONALES. (6 h)
 NOMBRE DE LA MATERIA: Síntesis Orgánica Avanzada CODIGO DE LA MATERIA: I6996 DEPARTAMENTO: Química CARGA TOTAL DE HORAS DE TEORIA: 68 CARGA TOTAL DE HORAS DE TRABAJO: INDEPENDIENTE: 64 TOTAL DE HORAS:
NOMBRE DE LA MATERIA: Síntesis Orgánica Avanzada CODIGO DE LA MATERIA: I6996 DEPARTAMENTO: Química CARGA TOTAL DE HORAS DE TEORIA: 68 CARGA TOTAL DE HORAS DE TRABAJO: INDEPENDIENTE: 64 TOTAL DE HORAS:
QUÍMICA. 2º Bachilerrato orgánica Estereoisomería:
 TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
REACTIVIDAD DE LOS COMPUESTOS DE CARBONO
 12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1. Explica el efecto inductivo de los siguientes compuestos: a) propil litio; b) etanol. a) Propil litio:
12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1. Explica el efecto inductivo de los siguientes compuestos: a) propil litio; b) etanol. a) Propil litio:
Ácido carboxílico Halogenuro de ácido Anhídrido de ácido Ester Amida O O R SR' O - R O O -
 X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
Reacciones de Sustitución Electrofílica Aromática (S E Ar) Halogenación: Bromación y Cloración. Alquilación de Friedel-Crafts
 TEMA 12.- Sustitución electrofílica aromática. Naturaleza y mecanismo de la reacción. Efecto de los sustituyentes sobre la reactividad y la orientación. Hidrocarburos condensados. Reacciones de Sustitución
TEMA 12.- Sustitución electrofílica aromática. Naturaleza y mecanismo de la reacción. Efecto de los sustituyentes sobre la reactividad y la orientación. Hidrocarburos condensados. Reacciones de Sustitución
Tema 11. CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA
 Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
2ª Parte: Estructura y reactividad de
 2ª Parte: Estructura y reactividad de los compuestos CMPUESTS orgánicos. CARBNÍLICS 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos
2ª Parte: Estructura y reactividad de los compuestos CMPUESTS orgánicos. CARBNÍLICS 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos
Química del Carbono, Curso /05/2014. Tema 9. Química del Carbono. El carbono: Z=6 A=12. C =1s 2 2s 2 p 2
 Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS
 TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS Tipos de reacciones orgánicas. Procesos homolíticos y heterolíticos. Reactivos nucleófilos y electrófilos. Estructura y estabilidad de los principales intermedios
TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS Tipos de reacciones orgánicas. Procesos homolíticos y heterolíticos. Reactivos nucleófilos y electrófilos. Estructura y estabilidad de los principales intermedios
los compuestos orgánicos.
 2ª Parte: Estructura y reactividad de los compuestos orgánicos. 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos aromáticos. -
2ª Parte: Estructura y reactividad de los compuestos orgánicos. 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos aromáticos. -
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
REACCIONES DE SÍNTESIS DE LOS ÁCIDOS CARBOXÍLICOS
 EAIES DE SÍTESIS DE LS ÁIDS ABXÍLIS 1.- xidación de los alcoholes primarios y aldehídos. En los temas anteriores ya se ha estudiado la oxidación de alcoholes primarios que mediante oxidantes fuertes se
EAIES DE SÍTESIS DE LS ÁIDS ABXÍLIS 1.- xidación de los alcoholes primarios y aldehídos. En los temas anteriores ya se ha estudiado la oxidación de alcoholes primarios que mediante oxidantes fuertes se
TEMAS/SUBTEMAS OBJETIVOS ESPECÍFICOS HORAS ACTIVIDADES TAREAS MATERIAL BIBLIOGRAFÍA SOFTWARE. 14 McMURRY, 6a. ED EJERCICIOS DE NOMENCLATURA
 DEPARTAMENTO DE QUÍMICA PLAN DE MATERIA POR SEMESTRE MATERIA: QUÍMICA ORGÁNICA AVANZADA ACADEMIA: QUÍMICA ORGÁNICA CLAVE: QM415 CARGA HORARIA DE TEORÍA: 68 VALOR EN CRÉDITOS: 9 (NUEVE) CARGA HORARIA DE
DEPARTAMENTO DE QUÍMICA PLAN DE MATERIA POR SEMESTRE MATERIA: QUÍMICA ORGÁNICA AVANZADA ACADEMIA: QUÍMICA ORGÁNICA CLAVE: QM415 CARGA HORARIA DE TEORÍA: 68 VALOR EN CRÉDITOS: 9 (NUEVE) CARGA HORARIA DE
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES
 GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
CONDENSACIONES. Nucleofilo O. O Reactante que sufre adición OH - C H. Reactante que sufre sustitución H 2 O C O -
 NDENSAINES En química orgánica, se conoce como reacciones de condensación a aquellas que se llevan a cabo entre dos compuestos, los cuales tienen el grupo funcional carbonilo dentro de su estructura (
NDENSAINES En química orgánica, se conoce como reacciones de condensación a aquellas que se llevan a cabo entre dos compuestos, los cuales tienen el grupo funcional carbonilo dentro de su estructura (
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre Fase específica OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
o 0.96A o 1.43A 0.96A O O H CH 3 H
 Química rgánica 1. Estructura. Nomenclatura de los alcoholes. Acidez de los alcoholes. xidación de alcoholes. Alcoholes como nucleófilos y electrófilos. Formación y uso de los ésteres de ácidos sulfónicos:
Química rgánica 1. Estructura. Nomenclatura de los alcoholes. Acidez de los alcoholes. xidación de alcoholes. Alcoholes como nucleófilos y electrófilos. Formación y uso de los ésteres de ácidos sulfónicos:
ORGÁNICA I. 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua.
 ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
3.4.3- Adición de agua. Hidratación. Ejemplo:
 Química rgánica Biología 3.4.3- Adición de agua. idratación. Ejemplo: En el caso de los alquinos la adición de agua ocurre de manera semejante a los alquenos con la única salvedad de que el producto que
Química rgánica Biología 3.4.3- Adición de agua. idratación. Ejemplo: En el caso de los alquinos la adición de agua ocurre de manera semejante a los alquenos con la única salvedad de que el producto que
Adición. Eliminación. Sustitución
 Adición Eliminación Sustitución Mitad de un enlace Enlace Unido con fuerza Mitad de un enlace Paso 1. Ataque del enlace en el electrófilo (un carbocatión) en el carbono más sustituído Paso 2. El ataque
Adición Eliminación Sustitución Mitad de un enlace Enlace Unido con fuerza Mitad de un enlace Paso 1. Ataque del enlace en el electrófilo (un carbocatión) en el carbono más sustituído Paso 2. El ataque
Reactividad de los compuestos orgánicos: Aspectos cinéticos y termodinámicos Tema 9
 2ª Parte: Estructura y reactividad de los compuestos orgánicos. Reactividad de los compuestos orgánicos: Aspectos cinéticos y termodinámicos Tema 9 - Mecanismos de reacción. Principales tipos de reacciones
2ª Parte: Estructura y reactividad de los compuestos orgánicos. Reactividad de los compuestos orgánicos: Aspectos cinéticos y termodinámicos Tema 9 - Mecanismos de reacción. Principales tipos de reacciones
Plan de Estudios Licenciatura en Química
 Plan de Estudios CONTENIDOS 1) Presentación 5) Objetivos 2) Requisitos 6) Cursos Obligatorios 3) Plan de Estudios / Duración 7) Cursos Sugeridos 4) Tabla de Créditos 1) Presentación Su programa de Licenciatura
Plan de Estudios CONTENIDOS 1) Presentación 5) Objetivos 2) Requisitos 6) Cursos Obligatorios 3) Plan de Estudios / Duración 7) Cursos Sugeridos 4) Tabla de Créditos 1) Presentación Su programa de Licenciatura
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA TANIA POZO CARRERA DE QUIMICA FARMACEUTICA ACIDEZ DE LOS ACIDOS CARBOXILICOS Los ácidos carboxílicos contienen el grupo carboxilo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA TANIA POZO CARRERA DE QUIMICA FARMACEUTICA ACIDEZ DE LOS ACIDOS CARBOXILICOS Los ácidos carboxílicos contienen el grupo carboxilo
QUÍMICA ORGÁNICA BÁSICA
 QUÍMICA ORGÁNICA BÁSICA 1. INTRODUCCIÓN: NATURALEZA DE LA QUÍMICA ORGÁNICA Panorama histórico y situación actual El carácter químico especial del carbono Fuentes y transformaciones de los compuestos orgánicos.
QUÍMICA ORGÁNICA BÁSICA 1. INTRODUCCIÓN: NATURALEZA DE LA QUÍMICA ORGÁNICA Panorama histórico y situación actual El carácter químico especial del carbono Fuentes y transformaciones de los compuestos orgánicos.
JUNIO FASE GENERAL QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos. Adición sigue la ley de Markovnikov No presenta estéreoselectividad.
 Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
Tema 9.- Aldehídos y cetonas. El grupo carbonilo
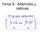 Tema 9.- Aldehídos y cetonas El grupo carbonilo Los aldehídos y cetonas son las funciones que vamos a estudiar en este Tema, probablemente uno de los más importantes de la asignatura. Nomenclatura propanal
Tema 9.- Aldehídos y cetonas El grupo carbonilo Los aldehídos y cetonas son las funciones que vamos a estudiar en este Tema, probablemente uno de los más importantes de la asignatura. Nomenclatura propanal
Especialista en Química Orgánica para Ciencias de la Salud
 Especialista en Química Orgánica para Ciencias de la Salud Titulación certificada por EUROINNOVA BUSINESS SCHOOL Especialista en Química Orgánica para Ciencias de la Salud Especialista en Química Orgánica
Especialista en Química Orgánica para Ciencias de la Salud Titulación certificada por EUROINNOVA BUSINESS SCHOOL Especialista en Química Orgánica para Ciencias de la Salud Especialista en Química Orgánica
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno
 Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno Química orgánica I Químicos Escuela de vacaciones junio 2016 Licda. Jaqueline Carrera. Propiedades de los éteres
Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno Química orgánica I Químicos Escuela de vacaciones junio 2016 Licda. Jaqueline Carrera. Propiedades de los éteres
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos. Adición sigue la ley de Markovnikov No presenta estéreoselectividad.
 Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2
 FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
LAS AMINAS. Se pueden considerar compuestos derivados del amoníaco (NH 3
 LAS AMIAS Se pueden considerar compuestos derivados del amoníaco ( 3 ) al sustituir uno, dos o tres de sus hidrógenos por radicales alquílicos o aromáticos. Según el número de hidrógenos que se substituyan
LAS AMIAS Se pueden considerar compuestos derivados del amoníaco ( 3 ) al sustituir uno, dos o tres de sus hidrógenos por radicales alquílicos o aromáticos. Según el número de hidrógenos que se substituyan
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA II NITO Y SULFOCOMPUESTOS: CAPITULO I: NITROCOMPUESTOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA II INTEGRANTES: Herrera Natalia Álvarez Santiago BIQUIMICA CLINICA QUIMICA NITO Y SULFOCOMPUESTOS: CAPITULO I: NITROCOMPUESTOS
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA II INTEGRANTES: Herrera Natalia Álvarez Santiago BIQUIMICA CLINICA QUIMICA NITO Y SULFOCOMPUESTOS: CAPITULO I: NITROCOMPUESTOS
ALCOHOLES. Estructura: grupo
 TEMA 16.- Alcoholes, fenoles y tioles. Clasificación y propiedades generales. Carácter ácido. Reacciones de desplazamiento y eliminación. Reacciones de oxidación. R- Ar- R-SH alcohol fenol tiol ALCOLES
TEMA 16.- Alcoholes, fenoles y tioles. Clasificación y propiedades generales. Carácter ácido. Reacciones de desplazamiento y eliminación. Reacciones de oxidación. R- Ar- R-SH alcohol fenol tiol ALCOLES
Química Inorgánica Bloque d 1. BLOQUE d
 Química Inorgánica Bloque d 1 BLOQUE d Los elementos del bloque d están ubicados entre los grupos 2 y 13 de la tabla periódica y se los suele llamar metales de transición. elemento de transición: es un
Química Inorgánica Bloque d 1 BLOQUE d Los elementos del bloque d están ubicados entre los grupos 2 y 13 de la tabla periódica y se los suele llamar metales de transición. elemento de transición: es un
Tema 12. PREPARACIÓN DE ALQUENOS
 Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
Tema 9. Química Orgánica
 Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
ESTRUCTURA DE COMPUESTOS ORGÁNICOS
 ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL
 Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL Nomenclatura de los alcoholes En el sistema de la IUPAC,los alcoholes se nombran añadiendo la terminación ol al hidrocarburo de referencia e, indicando
Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL Nomenclatura de los alcoholes En el sistema de la IUPAC,los alcoholes se nombran añadiendo la terminación ol al hidrocarburo de referencia e, indicando
Biopolímero s (4831)
 Biopolímero s (4831) 4.3. Conceptos de catálisis química. 4.3.3. Ejemplos de tipos de catálisis. Aplicación a la catálisis enzimática Los iones metálicos como catalizadores Como se dijo anteriormente los
Biopolímero s (4831) 4.3. Conceptos de catálisis química. 4.3.3. Ejemplos de tipos de catálisis. Aplicación a la catálisis enzimática Los iones metálicos como catalizadores Como se dijo anteriormente los
UNIVERSIDAD EMILIANO ZAPATA
 UNIVERSIDAD EMILIANO ZAPATA OBJETIVO DE LA MATERIA El estudiante describirá la importancia de la química en la ciencia y tecnología, a través del conocimiento de sus principios básicos, con el fin de explicar
UNIVERSIDAD EMILIANO ZAPATA OBJETIVO DE LA MATERIA El estudiante describirá la importancia de la química en la ciencia y tecnología, a través del conocimiento de sus principios básicos, con el fin de explicar
ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS.
 ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS. ESTRUCTURA La prueba constará de cuatro bloques, existiendo
ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS. ESTRUCTURA La prueba constará de cuatro bloques, existiendo
Identificar y desarrollar estructuras de compuestos químicos comunes y de los presentes en los problemas ambientales.
 Nombre de la asignatura: Química Ambiental I Créditos: 2 2-4 Aportación al perfil Ser analítico, ético, crítico y conciente de la importancia de su entorno para la vida y respetuoso de la misma, siendo
Nombre de la asignatura: Química Ambiental I Créditos: 2 2-4 Aportación al perfil Ser analítico, ético, crítico y conciente de la importancia de su entorno para la vida y respetuoso de la misma, siendo
TEMA 5. ESTRUCTURA Y PROPIEDADES MOLECULARES
 TEMA 5. ESTRUTURA Y PRPIEDADES MLEULARES 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la
TEMA 5. ESTRUTURA Y PRPIEDADES MLEULARES 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la
TEMA 4. ESTRUCTURA DE LAS MOLÉCULAS ORGÁNICAS
 W 0 J. Martínez y. Iriondo TEMA. ESTRUTURA DE LAS MLÉULAS RGÁIAS EJERIIS A. Estructuras. Dibuje las estructuras de Lewis correspondientes a los siguientes compuestos: Acetona 6 Acetonitrilo 7 Br loruro
W 0 J. Martínez y. Iriondo TEMA. ESTRUTURA DE LAS MLÉULAS RGÁIAS EJERIIS A. Estructuras. Dibuje las estructuras de Lewis correspondientes a los siguientes compuestos: Acetona 6 Acetonitrilo 7 Br loruro
, H 2 SO 4, HSO 4-. HClO 4, ClO 4-, H 2 O, H 3 O +, OH -, S =, H 2 S, HS -, NH 3, NH 4+, CO 3 =, HCO 3
 1 Aplicando la teoría de Bronsted y Lowry, razonar si son ciertas o falsas las siguientes afirmaciones a) Un ácido reacciona con su base conjugada dando lugar a una disolución neutra b) Un ácido reacciona
1 Aplicando la teoría de Bronsted y Lowry, razonar si son ciertas o falsas las siguientes afirmaciones a) Un ácido reacciona con su base conjugada dando lugar a una disolución neutra b) Un ácido reacciona
ÉTERES O H H H CH H 3 C
 Teoría de Química rgánica I ÉTERES Estructura y enlace en éteres y epóxidos Los éteres pueden considerarse derivados orgánicos del agua en el que los átomos de hidrógeno han sido reemplazados por fragmentos
Teoría de Química rgánica I ÉTERES Estructura y enlace en éteres y epóxidos Los éteres pueden considerarse derivados orgánicos del agua en el que los átomos de hidrógeno han sido reemplazados por fragmentos
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
Capítulo 4. Reacciones orgánicas.
 apítulo 4. Reacciones orgánicas. Una reacción química se puede definir como un proceso de interacción entre especies químicas en el que, como consecuencia de la ruptura y formación de enlaces, se origina
apítulo 4. Reacciones orgánicas. Una reacción química se puede definir como un proceso de interacción entre especies químicas en el que, como consecuencia de la ruptura y formación de enlaces, se origina
Elementos ordenados según su número atómico (Z, número de p + ) Hay 18 PERÍODOS
 TABLA PERIÓDICA Elementos ordenados según su número atómico (Z, número de p + ) Columnas Filas GRUPOS PERÍODOS Familias de elementos con propiedades comunes Hay 18 División principal Elementos representativos
TABLA PERIÓDICA Elementos ordenados según su número atómico (Z, número de p + ) Columnas Filas GRUPOS PERÍODOS Familias de elementos con propiedades comunes Hay 18 División principal Elementos representativos
OLIMPIADA DEPARTAMENTAL DE QUÍMICA NIVEL 2. iii. H 2 SO 3 iv. HF
 Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA NIVEL 2 NOMENCLATURA Y FORMULACIÓN (1) Nombre los siguientes compuestos (en una hoja aparte): i. NaBr ii. NaClO iii. H 2 SO 3 iv.
Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA NIVEL 2 NOMENCLATURA Y FORMULACIÓN (1) Nombre los siguientes compuestos (en una hoja aparte): i. NaBr ii. NaClO iii. H 2 SO 3 iv.
3.- Cuál de las siguientes formulaciones es la correcta para la sal trioxoclorato (V) de litio (clorato de litio)?
 UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
Síntesis química de Inhibidores enzimáticos de la Pared Celular
 BLQUE TEMÁTIC 6.- Inhibidores Enzimáticos de la Pared Celular íntesis química de Inhibidores enzimáticos de la Pared Celular Daniel Collado Martín Departamento de Química rgánica Facultad de Ciencias Penicilinas
BLQUE TEMÁTIC 6.- Inhibidores Enzimáticos de la Pared Celular íntesis química de Inhibidores enzimáticos de la Pared Celular Daniel Collado Martín Departamento de Química rgánica Facultad de Ciencias Penicilinas
Lección 11: HALUROS DE ALQUILO III
 Lección 11: HALUROS DE ALQUILO III 1. Reacciones de eliminación. 1.1. Mecanismos E2 y E1. 1.2. Regioselectividad y estereoquímica de las reacciones de eliminación. 2. Competencia entre sustituciones y
Lección 11: HALUROS DE ALQUILO III 1. Reacciones de eliminación. 1.1. Mecanismos E2 y E1. 1.2. Regioselectividad y estereoquímica de las reacciones de eliminación. 2. Competencia entre sustituciones y
1. ASIGNATURA / COURSE
 1. ASIGNATURA / COURSE 1.1. Nombre / Course Title COMPLEMENTOS DE QUÍMICA ORGÁNICA/COMPLEMENTS OF ORGANIC CHEMISTRY 1.2. Código / Course Code 12659 1.3. Tipo / Type of course Optativa / Optativa 1.4. Nivel
1. ASIGNATURA / COURSE 1.1. Nombre / Course Title COMPLEMENTOS DE QUÍMICA ORGÁNICA/COMPLEMENTS OF ORGANIC CHEMISTRY 1.2. Código / Course Code 12659 1.3. Tipo / Type of course Optativa / Optativa 1.4. Nivel
ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN INTRODUCCIÓN
 Revista de Química. Vol. X. No l. Junio de 1996 ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN Maribel Guzmán C.* INTRODUCCIÓN Los alquenos suelen comportarse como nucleófílos, dado
Revista de Química. Vol. X. No l. Junio de 1996 ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN Maribel Guzmán C.* INTRODUCCIÓN Los alquenos suelen comportarse como nucleófílos, dado
Colección de problemas Unidad 2
 Facultad de Química, UNAM Curso: Química General I Colección de problemas Unidad 2 1. Describe una contribución importante a la ciencia hecha por cada uno de los científicos siguientes: Dalton, Thomson,
Facultad de Química, UNAM Curso: Química General I Colección de problemas Unidad 2 1. Describe una contribución importante a la ciencia hecha por cada uno de los científicos siguientes: Dalton, Thomson,
C Cl 2sp 3 3p. C Br 2sp 3 4p C X = C X
 Química Orgánica Tema 2. aluros de alquilo 1 Tema 2. aluros de alquilo. Estructura. Nomenclatura. Reacciones de los compuestos orgánicos halogenados. oncepto de electrófilo y nucleófilo. Reacciones de
Química Orgánica Tema 2. aluros de alquilo 1 Tema 2. aluros de alquilo. Estructura. Nomenclatura. Reacciones de los compuestos orgánicos halogenados. oncepto de electrófilo y nucleófilo. Reacciones de
CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN
 CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN Curso: Química Analítica II Loreto Ascar 2012 Esquema de las bases de la separación en cromatografía de: (a)absorción, (b) partición, (c) Intercambio iónico y (d)
CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN Curso: Química Analítica II Loreto Ascar 2012 Esquema de las bases de la separación en cromatografía de: (a)absorción, (b) partición, (c) Intercambio iónico y (d)
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs.
 Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD
 TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
Colección de ejercicios UNIDAD 2
 Facultad de Química, UNAM Curso: Química General I, gpo 8 Colección de ejercicios UNIDAD 2 1. Describe cuál fue la contribución al conocimiento de la estructura atómica hecha por cada uno de los siguientes
Facultad de Química, UNAM Curso: Química General I, gpo 8 Colección de ejercicios UNIDAD 2 1. Describe cuál fue la contribución al conocimiento de la estructura atómica hecha por cada uno de los siguientes
Colegio Superior de Señoritas Tema: Formación de Compuestos Químicos Septiembre 2010 Prof.: NVM 8vo Nivel Departamento de Ciencias
 COMPUESTOS QUÍMICOS Y SU CLASIFICACIÓN El número de oxidación: representa la cantidad de electrones que puede ganar o perder un elemento. El hidrógeno tiene número de oxidación +1 y puede perder un electrón;
COMPUESTOS QUÍMICOS Y SU CLASIFICACIÓN El número de oxidación: representa la cantidad de electrones que puede ganar o perder un elemento. El hidrógeno tiene número de oxidación +1 y puede perder un electrón;
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Los elementos químicos
 Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2008 PRIMERA PARTE
 1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
La Química Analítica nos permite medir, monitorear o caracterizar una, varias especies o procesos químicos para la resolución de diversos problemas:
 QUÍMICA ANALÍTICA I Documento de apoyo (1) : Formación de soluciones analíticas. Dr. Alejandro Baeza. Semestre 2010-II. Antecedentes La Química Analítica nos permite medir, monitorear o caracterizar una,
QUÍMICA ANALÍTICA I Documento de apoyo (1) : Formación de soluciones analíticas. Dr. Alejandro Baeza. Semestre 2010-II. Antecedentes La Química Analítica nos permite medir, monitorear o caracterizar una,
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015)
 PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015) Serie A - RADIOS ATOMICOS, VOLUMENES ATÓMICOS, PROPIEDADES GENERALES Serie B - ENERGÍA DE IONIZACIÓN, AFINIDAD ELECTRÓNICA y ELECTRONEGATIVIDAD: Serie A:
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015) Serie A - RADIOS ATOMICOS, VOLUMENES ATÓMICOS, PROPIEDADES GENERALES Serie B - ENERGÍA DE IONIZACIÓN, AFINIDAD ELECTRÓNICA y ELECTRONEGATIVIDAD: Serie A:
Carrera: Ingeniero Químico Asignatura: Química Orgánica II. 781114 Licenciatura Ingeniero Químico. 3 (h/sem)
 Carrera: Ingeniero Químico Asignatura: Química Orgánica II Ciencias Básicas Generales de la Asignatura: Nombre de la Asignatura: Clave Asignatura: Nivel: Carrera: Frecuencia (h/semana): Teoría: Laboratorio:
Carrera: Ingeniero Químico Asignatura: Química Orgánica II Ciencias Básicas Generales de la Asignatura: Nombre de la Asignatura: Clave Asignatura: Nivel: Carrera: Frecuencia (h/semana): Teoría: Laboratorio:
CIENCIAS II CON ENFASIS EN QUIMICA
 CIENCIAS II CON ENFASIS EN QUIMICA P1-TEMA 2.2 Propiedades intensivas y extensivas de los materiales y Proyectos 1. Explica con tus propias palabras en que consiste un proyecto. 2. Explica brevemente en
CIENCIAS II CON ENFASIS EN QUIMICA P1-TEMA 2.2 Propiedades intensivas y extensivas de los materiales y Proyectos 1. Explica con tus propias palabras en que consiste un proyecto. 2. Explica brevemente en
INTRODUCCIÓN A LA QUÍMICA
 INTRODUCCIÓN A LA QUÍMICA TRABAJO PRÁCTICO N 1 4 Año A, B, C, D 2.015 Prof. María Laura Sepúlveda Broky INTRODUCCIÓN A LA QUÍMICA Prof. María Laura Sepúlveda Broky 1)A- Realizar un esquema de la Tabla
INTRODUCCIÓN A LA QUÍMICA TRABAJO PRÁCTICO N 1 4 Año A, B, C, D 2.015 Prof. María Laura Sepúlveda Broky INTRODUCCIÓN A LA QUÍMICA Prof. María Laura Sepúlveda Broky 1)A- Realizar un esquema de la Tabla
Modelo Pregunta 1A a) b) Septiembre Pregunta A1.- a) b) c) d) Junio Pregunta 1A a) b) c) d) Solución. Modelo Pregunta 1B.
 Modelo 2014. Pregunta 1A.- Cuando una muestra de átomos del elemento con Z = 19 se irradia con luz ultravioleta, se produce la emisión de electrones, formándose iones con carga +1. a) Escriba la configuración
Modelo 2014. Pregunta 1A.- Cuando una muestra de átomos del elemento con Z = 19 se irradia con luz ultravioleta, se produce la emisión de electrones, formándose iones con carga +1. a) Escriba la configuración
2.- Enuncie los principios o reglas que controlan el llenado de los niveles de energía atómicos permitidos.
 BLOQUE PRIMERO 1.- Un compuesto contiene 85,7% de carbono y 14,3% de hidrógeno y la masa de la molécula del mismo es 42. Calcule la fórmula del compuesto sabiendo que la masa atómica del carbono. 2.- Enuncie
BLOQUE PRIMERO 1.- Un compuesto contiene 85,7% de carbono y 14,3% de hidrógeno y la masa de la molécula del mismo es 42. Calcule la fórmula del compuesto sabiendo que la masa atómica del carbono. 2.- Enuncie
Clasificación de los alquenos. Nomenclatura de los alquenos. Nomenclatura de los alquenos, continuacion
 ALQUENOS Los alquenos son hidrocarburos insaturados que contienen uno o más dobles enlaces C = C. El nombre de los hidrocarburos insaturados se debe a que los carbonos que sostienen el doble enlace todavía
ALQUENOS Los alquenos son hidrocarburos insaturados que contienen uno o más dobles enlaces C = C. El nombre de los hidrocarburos insaturados se debe a que los carbonos que sostienen el doble enlace todavía
OTRAS REACCIONES DE LOS ALCOHOLES
 OTRAS REACCIONES DE LOS ALCOHOLES Reacciones Típicas de los Alcoholes La figura muestra cuatro modos típicos de reaccionar de los alcoholes. En cada uno de ellos, se rompe uno ómásde los cuatro enlaces
OTRAS REACCIONES DE LOS ALCOHOLES Reacciones Típicas de los Alcoholes La figura muestra cuatro modos típicos de reaccionar de los alcoholes. En cada uno de ellos, se rompe uno ómásde los cuatro enlaces
Química Orgánica General
 Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
LA QUÍMICA INORGÁNICA EN REACCIONES
 LA QUÍMICA INORGÁNICA EN REACCIONES PROYECTO EDITORIAL BIBLIOTECA DE QUÍMICAS Director: Carlos Seoane Prado Catedrático de Química Orgánica Universidad Complutense de Madrid Queda prohibida, salvo excepción
LA QUÍMICA INORGÁNICA EN REACCIONES PROYECTO EDITORIAL BIBLIOTECA DE QUÍMICAS Director: Carlos Seoane Prado Catedrático de Química Orgánica Universidad Complutense de Madrid Queda prohibida, salvo excepción
H 2 SO 4 + Cu CuSO 4 + SO 2 + H 2 O. SO H e - SO H 2 O. Cu Cu e - Cu Cu e - +
 1 Universidad de Castilla la Mancha Selectividad Junio 2.01 Opción A 1.- El ácido sulfúrico (tetraoxosulfato (VI) de hidrógeno) reacciona con el cobre para dar sulfato de cobre (II) (tetraoxosulfato (VI)
1 Universidad de Castilla la Mancha Selectividad Junio 2.01 Opción A 1.- El ácido sulfúrico (tetraoxosulfato (VI) de hidrógeno) reacciona con el cobre para dar sulfato de cobre (II) (tetraoxosulfato (VI)
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES
 TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
Hibridación de orbitales.
 Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
EJEMPLOS DE PREGUNTA. Prueba de QUÍMICA. febrero 2010
 EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II
 SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA Geometría molecular Nº Ejercicios PSU 1. La siguiente figura muestra la estructura del gas metano. C Al respecto, qué valor adopta el ángulo de enlace en este compuesto?
Programa Técnico Profesional QUÍMICA Geometría molecular Nº Ejercicios PSU 1. La siguiente figura muestra la estructura del gas metano. C Al respecto, qué valor adopta el ángulo de enlace en este compuesto?
CURSO DE NIVELACIÓN EN QUÍMICA INTRODUCCIÓN A LA QUÍMICA
 U.N.P.S.J.B. FACULTAD DE CIENCIAS NATURALES SEDE TRELEW CURSO DE NIVELACIÓN EN QUÍMICA INTRODUCCIÓN A LA QUÍMICA AÑO 2015 Lic. Maite L. Domínguez Ing. Sebastián Polacco LA MATERIA SE TRANSFORMA Reacciones
U.N.P.S.J.B. FACULTAD DE CIENCIAS NATURALES SEDE TRELEW CURSO DE NIVELACIÓN EN QUÍMICA INTRODUCCIÓN A LA QUÍMICA AÑO 2015 Lic. Maite L. Domínguez Ing. Sebastián Polacco LA MATERIA SE TRANSFORMA Reacciones
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2009 PRIMERA PARTE
 1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
