FICHA TÉCNICA PRIORIX-TETRA
|
|
|
- Soledad Ruiz Iglesias
- hace 6 años
- Vistas:
Transcripción
1 1. Denominación distintiva FICHA TÉCNICA 2. Denominación genérica Vacuna antisarampión, ant-iparotiditis, anti-varicela y anti-rubéola 3. Composición cualitativa y cuantitativa Virus vivo atenuado de Sarampión 1 (cepa Schwarz) no menos de DICC50 3 Virus vivo atenuado de Parotiditis 1 (cepa RIT 4385), no menos de DICC50 3 (derivada de la cepa Jeryl Lynn) Virus vivo atenuado de la Rubéola 2 (cepa Wistar RA 27/3) no menos de DICC50 3 Virus vivo atenuado de la varicela 2 (cepa OKA) no menos de UFP 4 Diluyente: Agua estéril para uso inyectable 0.5 ml 1 Producido en células de embrión de pollo 2 Producido en células diploides humanas (MRC-5) 3 Dosis infecciosa en cultivo celular 50% 4 Unidades formadoras de placas 4. Forma farmacéutica Suspensión 5. Datos clínicos 5.1. Indicaciones terapéuticas Priorix-Tetra está indicada para la vacunación activa de pacientes, a partir de la edad de 9 meses, hasta los 12 años inclusive, contra el sarampión, la parotiditis, la rubéola y la varicela Posología y vía de administración Sujetos entre 9 meses y 12 años de edad inclusive deberán recibir 2 dosis de Priorix-Tetra para asegurar que obtengan una protección óptima contra el sarampión, parotiditis, rubéola y varicela. (ver Farmacodinamia). Es preferible respetar un intervalo mínimo de seis semanas entre las dosis. En ningún caso este intervalo deberá ser inferior a cuatro semanas. Página 1 de 11
2 Alternativamente, y de conformidad con las recomendaciones oficiales correspondientes*: - Puede administrarse una sola dosis de Priorix-Tetra a niños que ya han recibido una sola dosis de otra vacuna antisarampionosa-antiparotidea-antirrubéolica (MMR) y/o una sola dosis de otra vacuna antivaricela - Puede administrarse una sola dosis de Priorix-Tetra seguida por una sola dosis de otra vacuna antisarampionosa-antiparotidea-antirrubéolica (MMR) y/o una sola dosis de otra vacuna antivaricela * Las recomendaciones oficiales aplicables pueden variar en lo que se refiere al intervalo entre dosis y a la necesidad de una o dos dosis de sarampión, parotiditis y rubéola y de vacunas que contenga varicela. Método de administración Para inyección subcutánea, preferiblemente en la cara externa del brazo. Para obtener información sobre las instrucciones para la preparación o la reconstitución, consulte la sección Instrucciones para el empleo/manejo Contraindicaciones Priorix-Tetra está contraindicada en las personas con hipersensibilidad conocida a la neomicina o a cualquier otro componente de la vacuna (para alergia al huevo ver Precauciones Generales). Un antecedente de dermatitis de contacto a la neomicina no es una contraindicación. Priorix-Tetra está contraindicada en las personas que han mostrado signos de hipersensibilidad después de la administración previa de las vacunas contra el sarampión, la parotiditis, la rubéola y/o la varicela. Está contraindicado administrar Priorix-Tetra a las embarazadas. Además, el embarazo deberá evitarse durante tres meses después de la vacunación (ver Embarazo y Lactancia). Priorix-Tetra no deberá administrarse a pacientes con disfunción inmune. Se incluyen en este caso los pacientes con inmunodeficiencia primaria o secundaria Advertencias y precauciones especiales de uso Al igual que con todas las vacunas inyectables, en caso de producirse algún episodio anafiláctico, Página 2 de 11
3 muy infrecuente, después de la administración de la vacuna, deberá disponerse inmediatamente de un tratamiento médico y supervisión adecuados. Al igual que con otras vacunas, la administración de Priorix-Tetra deberá posponerse en los pacientes que padecen una afección febril grave y aguda. Sin embargo, la presencia de una infección menor, por ejemplo un resfriado, no deberá causar la postergación de la vacunación. Puede presentarse síncope (desmayos) después, o incluso antes, de cualquier vacunación como una respuesta sicogénica a la inyección con aguja. Es importante que se tengan implementados los debidos procedimientos para evitar las lesiones por desmayos. Antes de inyectar la vacuna, debe dejarse que el alcohol y otros desinfectantes se evaporen de la piel, puesto que pueden inactivar los virus atenuados de la vacuna. Es posible que los lactantes en el primer año de vida no respondan de manera suficiente al componente antisarampión de la vacuna, debido a la posible persistencia de los anticuerpos antisarampión maternos. Deberán administrarse dosis adicionales de vacuna con componente antisarampión, de acuerdo a las recomendaciones oficiales. Existe un mayor riesgo de fiebre y convulsiones febriles entre 5 y 12 días después de la primera dosis de Priorix-Tetra en comparación con la administración de 2 inyecciones separadas de la vacuna MMR y la vacuna antivaricela (ver Reacciones adversas y Farmacodinamia). No hay indicios de un aumento del riesgo después de la segunda dosis. Las tasas de fiebre son habitualmente altas después de la primera dosis de vacunas contra el sarampión. Debe considerarse con precaución la vacunación de los sujetos con antecedentes de convulsiones febriles o antecedentes familiares de convulsiones. Debe considerarse un esquema de inmunización alternativo para estos sujetos, con inyecciones separadas de la vacuna MMR y la vacuna antivaricela para la primera dosis (ver Posología). En todos los casos, se debe monitorear a las personas vacunadas para detectar fiebre durante el período de riesgo. Los componentes antisarampión y antiparotiditis de la vacuna se producen en cultivo de células de embrión de pollo y, por lo tanto, pueden contener trazas de proteína de huevo. Las personas con antecedentes de reacciones anafilácticas, anafilactoides u otras reacciones inmediatas (por ejemplo, Página 3 de 11
4 urticaria generalizada, inflamación de la boca y la garganta, dificultad para respirar, hipotensión o choque) después de la ingestión de huevo, pueden tener un riesgo aumentado de reacciones de hipersensibilidad de tipo inmediato después de la vacunación, aunque se ha comprobado que estos tipos de reacciones son muy infrecuentes. Las personas que han sufrido anafilaxis después de la ingestión de huevo deberán ser vacunados con suma precaución, teniendo disponible un tratamiento adecuado de la anafilaxis a mano, en caso de producirse una reacción de este tipo. No se ha documentado nunca la transmisión de los virus del sarampión, la parotiditis y la rubéola desde los pacientes vacunados a los contactos sensibles, aunque se sabe que se produce la excreción faríngea del virus de la rubéola aproximadamente de 7 a 28 días después de la vacunación, con una excreción máxima alrededor del 11º día. La experiencia poscomercialización sugiere que puede producirse la transmisión del virus de la varicela en casos muy infrecuentes entre pacientes vacunados sanos que presentan un exantema de tipo varicela y contactos susceptibles. En ningún caso deberá administrarse Priorix-Tetra por vía intravascular o intradérmica. Al igual que con cualquier vacuna, es posible que no se desencadene una respuesta inmunitaria protectora en todos los vacunados. Se han comunicado casos de agravamiento de trombocitopenia y de recurrencia de la misma en sujetos que padecieron trombocitopenia tras la primera dosis después de la vacunación con vacunas vivas antisarampionosa, antiparotidea y antirrubéolica. En tales casos, el riesgo-beneficio de la inmunización con Priorix-Tetra deberá evaluarse cuidadosamente. No se ha estudiado el empleo de Priorix-Tetra en pacientes con infección asintomática por el VIH. Puede plantearse la administración de Priorix-Tetra con precaución en esta población cuando, en opinión del médico, la no administración de la vacuna acarrea un riesgo mayor Interacciones medicamentosas y de otro género Priorix-Tetra puede administrarse simultáneamente (pero en lugares de inyección separados) con cualquiera de las siguientes vacunas monovalentes o combinadas [incluidas las vacunas hexavalentes (DTPa-VHB-IPV/Hib)]: antidiftérica-antitetánica-antitosferínica acelular (DTPa), vacuna contra Haemophilus influenzae tipo b (Hib), vacuna antipolio inactivada (IPV), vacuna antihepatitis B (VHB). Si es preciso realizar la prueba de la tuberculina, deberá hacerse antes de la vacunación o simultáneamente a la misma, puesto que se ha descrito que las vacunas contra el sarampión, la Página 4 de 11
5 parotiditis y la rubéola combinadas pueden causar una depresión transitoria de la sensibilidad cutánea a la prueba de la tuberculina. Dado que esta anergia puede durar hasta seis semanas como máximo, no deberá realizarse la prueba de la tuberculina dentro de este período después de la vacunación, a fin de evitar resultados falsos negativos. En los pacientes que han recibido gammaglobulinas humanas o una transfusión de sangre, deberá retrasarse la vacunación durante tres meses como mínimo, debido a la probabilidad de fracaso de la vacunación a causa de la presencia de anticuerpos adquiridos de manera pasiva. Deberán evitarse los salicilatos durante seis semanas después de cada vacunación, ya que se ha descrito el síndrome de Reye después del uso de salicilatos durante la infección natural por varicela Manifestaciones y manejo de la sobredosis o ingesta accidental Los datos disponibles son insuficientes 5.7. Restricciones de uso durante el embarazo y la lactancia Embarazo Está contraindicado administrar Priorix-Tetra a las embarazadas. Además, el embarazo deberá evitarse durante tres meses después de la vacunación. No se dispone de datos suficientes en seres humanos sobre el empleo de Priorix-Tetra durante el embarazo, y no se han realizado estudios en animales sobre la toxicidad en el sistema reproductivo. Lactancia No se dispone de datos suficientes en seres humanos sobre el empleo de Priorix-Tetra durante el período de lactancia Efectos sobre la capacidad para conducir y utilizar máquinas N/A Reacciones secundarias y adversas. El perfil de seguridad que se presenta a continuación se basa en datos prevenientes de más de dosis administradas a niños de entre 9 y 27 meses de edad. Las reacciones se registraron hasta 42 días después de la vacunación. Las frecuencias notificadas son las siguientes: Página 5 de 11
6 Muy frecuentes ( 1/10) Frecuentes ( 1/100 a < 1/10) Poco frecuentes ( 1/1,000 a < 1/100) Infrecuentes ( 1/10,000 a < 1/1,000) FICHA TÉCNICA Infecciones e infestaciones Poco frecuentes: infección de las vías respiratorias altas Infrecuentes: otitis media Trastornos de la sangre y del sistema linfático Poco frecuentes: linfadenopatía Trastornos endocrinos: Poco frecuentes: inflamación de las parótidas Trastornos del metabolismo y la nutrición Poco frecuentes: anorexia Trastornos psiquiátricos Frecuentes: irritabilidad Poco frecuentes: llanto, nerviosismo, insomnio Trastornos del sistema nervioso Poco frecuentes: convulsiones febriles Trastornos respiratorios, torácicos y mediastínicos Poco frecuentes: rinitis Infrecuentes: tos, bronquitis Trastornos digestivos Poco frecuentes: diarrea, vómitos Trastornos de la piel y del tejido subcutáneo Frecuentes: erupción cutánea. Trastornos generales y alteraciones en el lugar de administración Muy frecuentes: dolor y enrojecimiento en el lugar de inyección, fiebre (rectal 38 C C; axilar / oral: 37.5 C - 39 C)* Frecuentes: inflamación en el lugar de inyección, fiebre (rectal > 39.5 C; axilar / oral > 39 C)* * Después de la administración de la primera dosis de la vacuna combinada frente al sarampiónparotiditis-rubéola-varicela, se observaron incidencias más altas de fiebre (de aproximadamente 1.5 veces) al compararse con la administración concomitante de vacunas de sarampión-parotiditisrubéola y varicela en sitios separados de inyección. Poco frecuentes: letargo, malestar, fatiga Página 6 de 11
7 Durante la vigilancia poscomercialización, se han descrito las siguientes reacciones adicionales en relación temporal con la vacuna contra el sarampión, la parotiditis, la rubéola y la varicela. Infecciones e infestaciones Meningitis, orquitis, epididimitis, síndrome pseudoparotidítico Trastornos de la sangre y del sistema linfático Trombocitopenia, púrpura trombocitopénica Trastornos del sistema inmunitario Reacciones alérgicas (incluidas las reacciones anafilácticas y anafilactoides) Trastornos del sistema nervioso Encefalitis, accidente cerebrovascular, cerebelitis, síntomas similares a los de cerebelitis, síndrome de Guillain-Barré, mielitis transversa, neuritis periférica Trastornos de la piel y del tejido subcutáneo Eritema multiforme Trastornos musculoesqueléticos y del tejido conectivo Artralgia, artritis Trastornos generales y alteraciones en el lugar de administración Síndrome de Kawasaki 6. Propiedades farmacológicas 6.1. Propiedades farmacodinámicas Eficacia y efectividad Los ensayos clínicos demostraron que la gran mayoría de las personas vacunadas contra la varicela, expuestas al virus silvestre estuvieron completamente protegidas contra la varicela o presentaron una forma más leve de la enfermedad (varicela modificada por vacunación). La eficacia de las vacunas contra la varicela Oka/RIT de GlaxoSmithKline en la prevención de la enfermedad confirmada de varicela (mediante reacción en cadena de la polimerasa [PCR] o exposición a un caso de varicela) se evaluó en un ensayo clínico controlado, en el que niños con edades comprendidas entre 12 y 22 meses recibieron dos dosis de Priorix-Tetra (N = 2279) o una dosis de la vacuna monovalente con Oka/RIT (N = 2263). La eficacia de la vacuna observada contra la varicela confirmada de cualquier nivel de gravedad y contra la varicela confirmada moderada o grave fue, respectivamente, del 94,9% (IC del 97,5%: 92,4-96,6%) y 99,5% (IC del 97,5%: 97,5- Página 7 de 11
8 99,9%) después de 2 dosis de Priorix-Tetra, y del 65,4% (IC del 97,5%: 57,2-72,1%) y 90,7% (IC del 97,5%: 85,9%-93,9%) después de una dosis de la vacuna monovalente con Oka/RIT (media del período de seguimiento: 35 meses). Los datos de efectividad sugieren que se obtiene un mayor nivel de protección y una disminución de la varicela modificada por vacunación después de dos dosis de la vacuna que contiene varicela que después de una dosis de la misma. En una situación de epidemia, la efectividad de dos dosis de Priorix-Tetra fue del 91% (IC del 95%: 65-98%) contra cualquier grado de la enfermedad, y del 94% (IC del 95%: 54-99%) contra la enfermedad moderada. Respuesta inmune En la siguiente tabla, se resumen los índices de seroconversión después de dos dosis de Priorix- Tetra administradas con un intervalo de seis semanas en aproximadamente niños no vacunados previamente, de 11 a 23 meses de edad: Anticuerpo Después de la 1ª dosis Prueba (umbral) Antisarampión ELISA (150 mui/ml) 96.4% 99.1% Antiparotiditis ELISA (231 UI/mL) Neutralizaciones (1:28) 91.3% 95.4% Después de la 2ª dosis 98.8% 99.4% Antirrubéola ELISA (4 UI/mL) 99.7% 99.9% Antivaricela IFA (1:4) ELISA (50mlU/ml) 97.2% 89,4% ELISA: enzimoinmunoanálisis de adsorción IFA: ensayo de inmunofluorescencia 99.8% 99,2% En un estudio de eficacia de gran envergadura, dos años después de la vacunación con dos dosis de Priorix-Tetra, las tasas de seropositividad para los anticuerpos contra la varicela fueron del 99,4% (ELISA) y 99,2% (IFA) y, respectivamente, del 99,1%, 90,5% y 100% para los anticuerpos contra el sarampión, la parotiditis y la rubéola (ELISA). Página 8 de 11
9 En niños de 9 a 10 meses de edad vacunados con 2 dosis de Priorix-Tetra, las tasas de seroconversión después de una primera dosis de Priorix-Tetra fueron similares para todos los antígenos, excepto para el sarampión, respecto de las tasas observadas en niños de 12 a 24 meses de edad en otros estudios clínicos. Al administrar Priorix-Tetra como segunda dosis de la vacuna MMR en niños de 24 meses a 6 años de edad, previamente inmunizados con una vacuna MMR o con la MMR coadministrada con una vacuna de virus vivos atenuados contra la varicela, se observó que todos los niños eran seropositivos para los anticuerpos contra el sarampión, la parotiditis y la rubéola. Las tasas de seropositividad para los anticuerpos contra la varicela fueron, respectivamente, del 98,1% (IFA) y 100% en los niños previamente vacunados con MMR o con la MMR coadministrada con una vacuna de virus vivos atenuados contra la varicela. Estudio observacional de vigilancia de la seguridad poscomercialización En un análisis retrospectivo de la base de datos, se evaluó el riesgo de convulsiones febriles luego de la vacunación con la primera dosis de Priorix-Tetra en niños de 9 a 30 meses de edad, en comparación con una cohorte correspondiente que recibió la vacuna MMR o que recibió la vacuna MMR y la vacuna antivaricela simultáneamente pero separadas. El estudio incluyó a niños vacunados con la MMRV (contra el sarampión, la parotiditis, la rubéola y la varicela), vacunados con la MMR y con inyecciones separadas de la vacuna MMR y la vacuna antivaricela. El riesgo atribuible de convulsiones febriles en las cohortes con factores de confusión correspondientes dentro del período de riesgo principal de 5 a 12 días luego de la primera dosis de Priorix-Tetra fue de 3,64/ (IC del 95%: 6,11; 8,30) Propiedades farmacocinéticas No se requiere la evaluación de las propiedades farmacocinéticas de las vacunas Datos preclínicos sobre seguridad Un estudio de toxicidad de dosis repetidas en animales no reveló ninguna toxicidad local o sistémica de la vacuna. 7. Datos farmacéuticos Página 9 de 11
10 7.1. Lista de aditivos Aminoácidos, lactosa anhidra, manitol, sorbitol, agua para inyectables. Presenta sulfato de neomicina como residuo del proceso de fabricación Incompatibilidades A falta de estudios de compatibilidad, este medicamento no debe mezclarse con otros medicamentos Plazo de caducidad 18 meses, debiendo expresar el año con número y el mes con letra Condiciones de conservación y almacenaje Conservar a una temperatura de 2 C a 8 C (en refrigerador). NO CONGELAR. Conservar en el envase original a fin de proteger el producto de la luz Presentaciones Caja con 1, 10 ó 20 frascos ámpula con liofilizado y 1, 10 ó 20 ampolletas con 0.5 ml de diluyente para una dosis. Caja con 1, 10 ó 20 frascos ámpula con liofilizado y 1, 10 ó 20 jeringas prellenadas con 0.5 ml de diluyente para una dosis Leyendas de advertencia y precautorias Información exclusiva para el médico. Agítese antes de usarse. Use exclusivamente la jeringa, ampolleta o frasco ámpula con el diluyente incluido para su reconstitución. Deséchese la jeringa después de su uso. Léase Instructivo anexo Hecha la mezcla, adminístrese de inmediato y deséchese el sobrante. No se administre si el cierre ha sido violado. No se administre este medicamento durante el embarazo y la lactancia. Evítese el embarazo tres meses después de la vacunación. Su venta requiere receta médica No se deje al alcance de los niños Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx Página 10 de 11
11 8. Razón social y domicilio del titular del registro GlaxoSmithKIine México, S. A. de C. V. Calz. México Xochimilco No. 4900, Col. San Lorenzo Huipulco, C. P , Deleg. Tlalpan, D.F., México. 9. Razón social y domicilio del fabricante del medicamento GlaxoSmithKline Biologicals, S.A. Rue de I lnstitut, 89, B-1330-Rixensart, Bélgica. 10. Razón social y domicilio del acondicionador GlaxoSmithKline Biologicals, S.A. Rue de I lnstitut, 89, B-1330-Rixensart, Bélgica. 11. Razón social y domicilio del distribuidor GlaxoSmithKIine México, S. A. de C. V. Calz. México Xochimilco No. 4900, Colonia San Lorenzo Huipulco, C. P , Deleg. Tlalpan, D.F., México. 12. Número de registro 060M2011 SSA 13. Fecha de vigencia 12 de Abril de Fecha de la última actualización 04 de agosto de Número de trámite asociado a dicha actualización J0043 Página 11 de 11
FICHA TÉCNICA. Nota: La utilización de Priorix debe realizarse de acuerdo a las recomendaciones oficiales.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
FICHA TÉCNICA. Virus de la gripe fraccionados*, inactivados, que contienen antígenos equivalentes a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
FICHA TÉCNICA. La vacuna MSD Antirrubéola cumple los requisitos de la OMS para productos biológicos y vacunas Antirrubéola.
 1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
K:\Jenner_Public\QSS\VACCINE QUALITY & REGULATION GROUP\Inserts\Spanish\esp_Insert measles rubella Vd2-rev.doc
 MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
600 U.I. 480 mg 95% Ig. 67,5 mg 9,0 mg 3 ml. Solución inyectable con inmunoglobulinas, principalmente inmunoglobulina G (IgG).
 1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
Contraindicaciones de las Vacunas
 Contraindicaciones de las Vacunas Alergias Los alérgicos a la levadura no deberían recibir la vacuna de la hepatitis B. Los que tienen una historia de anafilaxia (alergia grave) a la gelatina no deben
Contraindicaciones de las Vacunas Alergias Los alérgicos a la levadura no deberían recibir la vacuna de la hepatitis B. Los que tienen una historia de anafilaxia (alergia grave) a la gelatina no deben
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Boostrix está indicada para la vacunación de recuerdo frente a difteria, tétanos y tos ferina a partir de 4 años de edad (ver sección 4.2).
 1. NOMBRE DEL MEDICAMENTO Boostrix suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitosferina (componente acelular) (adsorbida, carga antigénica reducida) 2. COMPOSICIÓN
1. NOMBRE DEL MEDICAMENTO Boostrix suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitosferina (componente acelular) (adsorbida, carga antigénica reducida) 2. COMPOSICIÓN
II. ESQUEMA NACIONAL DE VACUNACIÓN Dosis y lugar de aplicación Hepatitis B. No de dosis Intervalo entre dosis
 II. ESQUEMA NACIONAL DE VACUNACIÓN 2009 Vacuna Edad a vacunar No de dosis Intervalo entre dosis Dosis y lugar de aplicación Recién Nacido 12 horas * 1 0.5cc IM, área del (antero lateral) 0.1CC ID, en la
II. ESQUEMA NACIONAL DE VACUNACIÓN 2009 Vacuna Edad a vacunar No de dosis Intervalo entre dosis Dosis y lugar de aplicación Recién Nacido 12 horas * 1 0.5cc IM, área del (antero lateral) 0.1CC ID, en la
Vacuna contra la poliomielitis. (Comentarios a las fichas técnicas)
 Vacuna contra la poliomielitis (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Composición
Vacuna contra la poliomielitis (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Composición
Cepa derivada de A/California/7/2009 (H1N1)pdm09: (NYMC X-181) 15 microgramos HA** Cepa derivada de A/Victoria/361/2011 (H3N2): (IVR-165)
 1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos
1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos
Vacuna triple vírica (sarampión, rubeola, parotiditis)
 Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
FICHA TÉCNICA FLUZACTAL TETRA
 1. Denominación distintiva Fluazactal Tetra 2. Denominación genérica Vacuna antiinfluenza tetravalente tipos A y B 3. Composición cualitativa y cuantitativa Cada dosis (0.5 ml) contiene: A/California/7/2009
1. Denominación distintiva Fluazactal Tetra 2. Denominación genérica Vacuna antiinfluenza tetravalente tipos A y B 3. Composición cualitativa y cuantitativa Cada dosis (0.5 ml) contiene: A/California/7/2009
Prospecto: información para el usuario Varilrix 10 3,3 UFP/0,5 ml polvo y disolvente para solución inyectable. Vacuna antivaricela (virus vivos)
 Prospecto: información para el usuario Varilrix 10 3,3 UFP/0,5 ml polvo y disolvente para solución inyectable Vacuna antivaricela (virus vivos) Lea todo el prospecto detenidamente antes de que usted/su
Prospecto: información para el usuario Varilrix 10 3,3 UFP/0,5 ml polvo y disolvente para solución inyectable Vacuna antivaricela (virus vivos) Lea todo el prospecto detenidamente antes de que usted/su
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
FICHA TÉCNICA VACUNA ADSORBIDA ANTIDIFTÉRICA, ANTITETÁNICA Y CONTRA LA TOS FERINA
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Toxoide Diftérico / Toxoide Tetánica / Vacuna Pertussis 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes Cada: Toxoide Diftérico Corynebacterium
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Toxoide Diftérico / Toxoide Tetánica / Vacuna Pertussis 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes Cada: Toxoide Diftérico Corynebacterium
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
3.0. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Antígeno del virus de la hepatitis A
 1.0. DENOMINACIÓN DISTINTIVA. Virohep A 2.0. DENOMINACIÓN GENÉRICA Vacuna Antihepatitis A 3.0. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Antígeno del virus de la hepatitis A 12 UI 4.0. FORMA FARMACÉUTICA.
1.0. DENOMINACIÓN DISTINTIVA. Virohep A 2.0. DENOMINACIÓN GENÉRICA Vacuna Antihepatitis A 3.0. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Antígeno del virus de la hepatitis A 12 UI 4.0. FORMA FARMACÉUTICA.
FICHA TÉCNICA. VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable
 FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
Pauta de vacunación frente a varicela en el calendario infantil de vacunación en España
 Pauta de vacunación frente a varicela en el calendario infantil de vacunación en España Recomendaciones de la Ponencia de Programas y Registro de Vacunaciones 15 julio 2015 Contenidos Contenidos... 1 1.
Pauta de vacunación frente a varicela en el calendario infantil de vacunación en España Recomendaciones de la Ponencia de Programas y Registro de Vacunaciones 15 julio 2015 Contenidos Contenidos... 1 1.
PENTAVALENTE DESCRIPCIÓN VÍA DE ADMINISTRACIÓN
 DESCRIPCIÓN Es una vacuna combinada que contiene; los toxoides diftérico y tetánico y toxoide Pertússico así como los tres tipos de virus inactivados de la poliomielitis. PRESENTACIÓN Jeringa prellenada
DESCRIPCIÓN Es una vacuna combinada que contiene; los toxoides diftérico y tetánico y toxoide Pertússico así como los tres tipos de virus inactivados de la poliomielitis. PRESENTACIÓN Jeringa prellenada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSIFEL FeLV suspensión inyectable para gatos 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSIFEL FeLV suspensión inyectable para gatos 2. COMPOSICIÓN
Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1.
 1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA
1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1.
 1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2014/2015) 2. COMPOSICIÓN CUALITATIVA
1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2014/2015) 2. COMPOSICIÓN CUALITATIVA
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
Anexo III. Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos
 Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
FICHA TÉCNICA VAQTA. 1. Denominación distintiva VAQTA. 2. Denominación genérica Vacuna antihepatitis A inactivada
 1. Denominación distintiva 2. Denominación genérica Vacuna antihepatitis A inactivada 3. Composición cualitativa y cuantitativa Un mililitro de la vacuna contiene aproximadamente: 50 unidades (U) de antígeno
1. Denominación distintiva 2. Denominación genérica Vacuna antihepatitis A inactivada 3. Composición cualitativa y cuantitativa Un mililitro de la vacuna contiene aproximadamente: 50 unidades (U) de antígeno
Secretaría de Salud Programa Ampliado de Inmunizaciones. Conceptos y principios generales de inmunización
 Secretaría de Salud Programa Ampliado de Inmunizaciones Conceptos y principios generales de inmunización Siguatepeque 27 de junio al 01 de julio de 2011 Contenido Conceptos básicos Principios generales
Secretaría de Salud Programa Ampliado de Inmunizaciones Conceptos y principios generales de inmunización Siguatepeque 27 de junio al 01 de julio de 2011 Contenido Conceptos básicos Principios generales
IM cara anterolateral del muslo en los lactantes o el músculo deltoides de la parte superior del brazo en los niños.
 ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
FICHA TÉCNICA M-M-R II
 1. Denominación distintiva FICHA TÉCNICA 2. Denominación genérica Vacuna de virus contra sarampión, parotiditis y rubéola 3. Composición cualitativa y cuantitativa Virus de Sarampión 1,000 DICC50 (1) Virus
1. Denominación distintiva FICHA TÉCNICA 2. Denominación genérica Vacuna de virus contra sarampión, parotiditis y rubéola 3. Composición cualitativa y cuantitativa Virus de Sarampión 1,000 DICC50 (1) Virus
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
DONDE SE APLICA. Región supra escapular izquierda. Peso Superior a 2000 gramos. Primeras 12 Horas de Vida.
 ESQUEMA ESQUEMA BASICO DE VACUNACION BCG VACUNA ENFERMEDAD PROTEGE Meningitis Tuberculosa EDAD DOSIS- REFUERZOS DE APLIACION Recién Nacido Dosis única HEPATITIS B Hepatitis B Recién nacido Muslo POLIO
ESQUEMA ESQUEMA BASICO DE VACUNACION BCG VACUNA ENFERMEDAD PROTEGE Meningitis Tuberculosa EDAD DOSIS- REFUERZOS DE APLIACION Recién Nacido Dosis única HEPATITIS B Hepatitis B Recién nacido Muslo POLIO
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Poulvac Marek CVI Suspensión y disolvente para suspensión inyectable para
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Poulvac Marek CVI Suspensión y disolvente para suspensión inyectable para
FICHA TÉCNICA. no menos de 20 Unidades Internaciones (UI) (5 Lf) 1adsorbidos en hidróxido de aluminio hidratado (Al(OH)3)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Boostrix suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Boostrix suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
INSTITUTO DE EDUCACIÓN SUPERIOR TECNOLÓGICO PRIVADO SANTA ROSA DE LIMA ENFERMERÍA Y VÍAS DE ADMINISTRACIÓN DE LAS VACUNAS
 INSTITUTO DE EDUCACIÓN SUPERIOR TECNOLÓGICO PRIVADO SANTA ROSA DE LIMA ENFERMERÍA Y VÍAS DE ADMINISTRACIÓN DE LAS VACUNAS LIC. JUDITH ISABEL POLO NICHO 1. PUNTOS CLAVE: Las vacunas deben administrarse
INSTITUTO DE EDUCACIÓN SUPERIOR TECNOLÓGICO PRIVADO SANTA ROSA DE LIMA ENFERMERÍA Y VÍAS DE ADMINISTRACIÓN DE LAS VACUNAS LIC. JUDITH ISABEL POLO NICHO 1. PUNTOS CLAVE: Las vacunas deben administrarse
FICHA TÉCNICA. ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Oncept IL-2 liofilizado y disolvente para suspensión inyectable para gatos. 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Oncept IL-2 liofilizado y disolvente para suspensión inyectable para gatos. 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Twinrix Adultos, suspensión inyectable Vacuna (HAB) (adsorbida) antihepatitis A (inactivada) y antihepatitis
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Twinrix Adultos, suspensión inyectable Vacuna (HAB) (adsorbida) antihepatitis A (inactivada) y antihepatitis
Vacuna frente a Haemophilus influenzae tipo b
 Vacuna frente a Haemophilus influenzae tipo b Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Previo al empleo sistemático
Vacuna frente a Haemophilus influenzae tipo b Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Previo al empleo sistemático
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
100 UI 80 mg 95% IgG
 1. NOMBRE DEL MEDICAMENTO IGANTIBE 200 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 100 UI/0,5 ml 600 UI/3 ml 1000 UI/5 ml Inmunoglobulina humana antihepatitis
1. NOMBRE DEL MEDICAMENTO IGANTIBE 200 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 100 UI/0,5 ml 600 UI/3 ml 1000 UI/5 ml Inmunoglobulina humana antihepatitis
VAQTA VACUNA ANTI-HEPATITIS A PURIFICADA E INACTIVADA Suspensión Inyectable Estéril de uso I.M.
 VAQTA VACUNA ANTI-HEPATITIS A PURIFICADA E INACTIVADA Suspensión Inyectable Estéril de uso I.M. INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FÓRMULA: Formulación para uso pediátrico y en adolescentes Cada
VAQTA VACUNA ANTI-HEPATITIS A PURIFICADA E INACTIVADA Suspensión Inyectable Estéril de uso I.M. INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FÓRMULA: Formulación para uso pediátrico y en adolescentes Cada
* producido en levadura Saccharomyces cerevisiae (cepa ) mediante tecnología recombinante de ADN.
 1. NOMBRE DEL MEDICAMENTO HBVAXPRO 40 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis (1 ml) contiene: Antígeno de superficie del virus
1. NOMBRE DEL MEDICAMENTO HBVAXPRO 40 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis (1 ml) contiene: Antígeno de superficie del virus
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela
 Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Vacunas Tosferina. Quién debe recibir la vacuna?
 Vacunas Tosferina Dos vacunas nuevas que contienen la vacuna acelular contra la tosferina fueron aprobadas en el 2005 por la FDA para uso en personas mayores. Estas vacunas son abreviadas Tdap. Una es
Vacunas Tosferina Dos vacunas nuevas que contienen la vacuna acelular contra la tosferina fueron aprobadas en el 2005 por la FDA para uso en personas mayores. Estas vacunas son abreviadas Tdap. Una es
Vacunación. Infantil
 Vacunación Infantil E N C A S T I L L A - L A M A N C H A Edición Dirección General de Salud Pública y Consumo Consejería de Sanidad Junta de Comunidades de Castilla-La Mancha Actualizado Febrero 2016
Vacunación Infantil E N C A S T I L L A - L A M A N C H A Edición Dirección General de Salud Pública y Consumo Consejería de Sanidad Junta de Comunidades de Castilla-La Mancha Actualizado Febrero 2016
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ProQuad polvo y disolvente para suspensión inyectable. ProQuad polvo y disolvente para suspensión inyectable
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ProQuad polvo y disolvente para suspensión inyectable. ProQuad polvo y disolvente para suspensión inyectable
VARIVAX polvo y disolvente para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 ANEXO 3 FICHA TÉCNICA DE VARIVAX FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO VARIVAX polvo y disolvente para suspensión inyectable [Vacuna antivaricela, de virus vivos] 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO 3 FICHA TÉCNICA DE VARIVAX FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO VARIVAX polvo y disolvente para suspensión inyectable [Vacuna antivaricela, de virus vivos] 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
PROSPECTO. CEFTRIAXONA REIG JOFRÉ 1 g IM. Polvo y disolvente para solución inyectable. E.F.G. Ceftriaxona (D.C.I.)
 PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
NÚMERO DE DOSIS RECOMENDADO DE CADA VACUNA SEGÚN LA EDAD Asociación Española de Pediatría 2015 Comité Asesor de Vacunas.
 1 de enero de 2015 Esta tabla indica el número de necesarias según la edad, para los niños y los adolescentes con el calendario de vacunación incompleto o que comienzan la vacunación tardíamente. No se
1 de enero de 2015 Esta tabla indica el número de necesarias según la edad, para los niños y los adolescentes con el calendario de vacunación incompleto o que comienzan la vacunación tardíamente. No se
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
VACUNAS. Generalidades y calendarios. C. S. San Blas, 21 de junio de 2006
 C. S. San Blas, 21 de junio de 2006 VACUNAS Generalidades y calendarios Dr. Manuel Merino Moína Pediatra C. S. El Greco Comité Asesor de Vacunas de Madrid Qué es una vacuna? Sustancia que, administrada
C. S. San Blas, 21 de junio de 2006 VACUNAS Generalidades y calendarios Dr. Manuel Merino Moína Pediatra C. S. El Greco Comité Asesor de Vacunas de Madrid Qué es una vacuna? Sustancia que, administrada
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA 3. FORMA FARMACÉUTICA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
VACUNACIÓN ANTIGRIPAL EN NIÑOS
 Servicio Canario de la Salud DIRECCIÓN GENERAL DE SALUD PÚBLICA VACUNACIÓN ANTIGRIPAL EN NIÑOS PROGRAMA DE VACUNAS SERVICIO DE EPIDEMIOLOGÍA Y PREVENCIÓN DIRECCIÓN GENERAL DE SALUD PÚBLICA OCTUBRE / DICIEMBRE-2008
Servicio Canario de la Salud DIRECCIÓN GENERAL DE SALUD PÚBLICA VACUNACIÓN ANTIGRIPAL EN NIÑOS PROGRAMA DE VACUNAS SERVICIO DE EPIDEMIOLOGÍA Y PREVENCIÓN DIRECCIÓN GENERAL DE SALUD PÚBLICA OCTUBRE / DICIEMBRE-2008
OISPOSICION N o 7 9 5
 ~ús«lmé S~ de P0titúa4. íl?~dóhe1~ A.n.??t.A. 7 OISPOSICION N o 7 9 5 BUENOS AIRES, Oir.B20 11 Visto el Expediente N0 1-0047-0000-025155-07-4 del Registro de esta Administración Nacionall de Medicamentos,
~ús«lmé S~ de P0titúa4. íl?~dóhe1~ A.n.??t.A. 7 OISPOSICION N o 7 9 5 BUENOS AIRES, Oir.B20 11 Visto el Expediente N0 1-0047-0000-025155-07-4 del Registro de esta Administración Nacionall de Medicamentos,
Prospecto: información para el usuario. LIZIPADOL 20 mg pastillas para chupar Ambroxol hidrocloruro
 Prospecto: información para el usuario LIZIPADOL 20 mg pastillas para chupar Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario LIZIPADOL 20 mg pastillas para chupar Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna Antipoliomielítica Trivalente Oral. 2.0. DENOMINACIÓN GENÉRICA Vacuna Antipoliomielítica Trivalente
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna Antipoliomielítica Trivalente Oral. 2.0. DENOMINACIÓN GENÉRICA Vacuna Antipoliomielítica Trivalente
PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
1. QUÉ ES VACUNA ANTIGRIPAL PASTEUR Y PARA QUÉ SE UTILIZA
 PROSPECTO: INFORMACIÓN PARA EL USUARIO VACUNA ANTIGRIPAL PASTEUR, suspensión inyectable en jeringa precargada Vacuna antigripal (virus fraccionados, inactivados) Lea todo el prospecto detenidamente antes
PROSPECTO: INFORMACIÓN PARA EL USUARIO VACUNA ANTIGRIPAL PASTEUR, suspensión inyectable en jeringa precargada Vacuna antigripal (virus fraccionados, inactivados) Lea todo el prospecto detenidamente antes
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA. Gotas Óticas. Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g.
 DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
Inmunizaciones. Vacunas Infantiles. Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Objetivo:
 Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2011/2012 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2011/2012 2. COMPOSICIÓN
INFLUENZA. Curso de Capacitación para Vacunadores. CHLA-EP Setiembre 2008
 INFLUENZA Curso de Capacitación para Vacunadores. CHLA-EP Setiembre 2008 Infecciones respiratorias agudas de potencial pandemico 1. Influenza estacional 2. Influenza aviar 3. SARS VIRUS INFLUENZA FAMILIA
INFLUENZA Curso de Capacitación para Vacunadores. CHLA-EP Setiembre 2008 Infecciones respiratorias agudas de potencial pandemico 1. Influenza estacional 2. Influenza aviar 3. SARS VIRUS INFLUENZA FAMILIA
3.9. SARAMPIÓN-RUBÉOLA- PAROTIDITIS
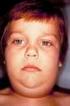 3.9. SARAMPIÓN-RUBÉOLA- PAROTIDITIS CARACTERÍSTICAS DE LAS ENFERMEDADES Sarampión: es una enfermedad exantemática muy contagiosa que comienza con fiebre, coriza, tos y pequeñas manchas eritematosas con
3.9. SARAMPIÓN-RUBÉOLA- PAROTIDITIS CARACTERÍSTICAS DE LAS ENFERMEDADES Sarampión: es una enfermedad exantemática muy contagiosa que comienza con fiebre, coriza, tos y pequeñas manchas eritematosas con
CALENDARIOS DE VACUNACIÓN INFANTIL DE ARAGÓN. Serie cronológica VPO VPO VPO DTP SRP VPO DTP HB* SRP. 0 m 2 m 4 m 6 m 15 m 18 m 6 a 11 a 14 a.
 CALENDARIOS DE VACUNACIÓN INFANTIL DE ARAGÓN 1984 1995 Serie cronológica Versión 21/03/2016 0 m 1 m 3 m 5 m 7 m 15 m 18 m 6 años 11 a 14 a DT T T * * * 1984: se incluye la vacuna de Polio atenuada trivalente
CALENDARIOS DE VACUNACIÓN INFANTIL DE ARAGÓN 1984 1995 Serie cronológica Versión 21/03/2016 0 m 1 m 3 m 5 m 7 m 15 m 18 m 6 años 11 a 14 a DT T T * * * 1984: se incluye la vacuna de Polio atenuada trivalente
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
El sistema inmune y las vacunas
 SESIÓN DE INFORMACIÓN SOBRE VACUNAS, Santiago, Chile 7 de mayo 9 mayo, 2014 El sistema inmune y las vacunas Dra. Juanita Zamorano R Pediatra- Infectóloga jzamorano@uandes.cl 1 Jenner: En 1796 inicia la
SESIÓN DE INFORMACIÓN SOBRE VACUNAS, Santiago, Chile 7 de mayo 9 mayo, 2014 El sistema inmune y las vacunas Dra. Juanita Zamorano R Pediatra- Infectóloga jzamorano@uandes.cl 1 Jenner: En 1796 inicia la
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. BRONCHI-SHIELD Liofilizado y disolvente para suspensión para gotas nasales para perros
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BRONCHI-SHIELD Liofilizado y disolvente para suspensión para gotas nasales
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BRONCHI-SHIELD Liofilizado y disolvente para suspensión para gotas nasales
La gripe o influenza es una enfermedad viral respiratoria que se presenta habitualmente en los meses más fríos del año.
 La gripe o influenza es una enfermedad viral respiratoria que se presenta habitualmente en los meses más fríos del año. Los síntomas suelen aparecer a las 48 horas de efectuado el contagio y la mayoría
La gripe o influenza es una enfermedad viral respiratoria que se presenta habitualmente en los meses más fríos del año. Los síntomas suelen aparecer a las 48 horas de efectuado el contagio y la mayoría
MENJUGATE KIT 10 microgramos polvo y disolvente para suspensión inyectable.
 1. NOMBRE DEL MEDICAMENTO MENJUGATE KIT 10 microgramos polvo y disolvente para suspensión inyectable. Vacuna conjugada frente al meningococo del grupo C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis
1. NOMBRE DEL MEDICAMENTO MENJUGATE KIT 10 microgramos polvo y disolvente para suspensión inyectable. Vacuna conjugada frente al meningococo del grupo C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis
FICHA TECNICA VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS (vacuna con
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS (vacuna con
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO VACUNA CONTRA SARAMPIÓN, PAPERA Y RUBÉOLA, VIVA ATENUADA
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: VACUNA CONTRA SARAMPIÓN, PAPERA Y RUBÉOLA, VIVA ATENUADA Polvo liofilizado para solución inyectable, SC.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: VACUNA CONTRA SARAMPIÓN, PAPERA Y RUBÉOLA, VIVA ATENUADA Polvo liofilizado para solución inyectable, SC.
1. NOMBRE DEL MEDICAMENTO. VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
Prospecto: información para el usuario
 Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
CALENDARIO DE VACUNACIONES DE LA ASOCIACIÓN ESPAÑOLA DE PEDIATRÍA Comité Asesor de Vacunas 2014
 1 Esta tabla indica el número de necesarias, según la edad, para los niños y los adolescentes con el calendario de vacunación incompleto o que comienzan la vacunación tardíamente. No se ha de reiniciar
1 Esta tabla indica el número de necesarias, según la edad, para los niños y los adolescentes con el calendario de vacunación incompleto o que comienzan la vacunación tardíamente. No se ha de reiniciar
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO MENJUGATE KIT 10 microgramos polvo y disolvente para suspensión inyectable. Vacuna conjugada frente al meningococo
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO MENJUGATE KIT 10 microgramos polvo y disolvente para suspensión inyectable. Vacuna conjugada frente al meningococo
OPE País Vasco CLASIFICACIONES
 VACUNAS CONCEPTOS CLASIFICACIONES 703. Cómo se denomina a la resistencia del organismo a una enfermedad específica, debido a la presencia en él de anticuerpos de la misma? a. Pasividad. b.inmunidad. c.
VACUNAS CONCEPTOS CLASIFICACIONES 703. Cómo se denomina a la resistencia del organismo a una enfermedad específica, debido a la presencia en él de anticuerpos de la misma? a. Pasividad. b.inmunidad. c.
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Rabipur Polvo y disolvente para solución inyectable Vacuna antirrábica inactivada
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Rabipur Polvo y disolvente para solución inyectable Vacuna antirrábica inactivada Lea todo el prospecto detenidamente antes de que usted o su hijo reciban Rabipur.
PROSPECTO: INFORMACIÓN PARA EL USUARIO Rabipur Polvo y disolvente para solución inyectable Vacuna antirrábica inactivada Lea todo el prospecto detenidamente antes de que usted o su hijo reciban Rabipur.
CENAVUL Suspensión inyectable
 Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Varicela 1. Agente inmunizante 2. Conservación
 Varicela 1. Agente inmunizante Es una vacuna viral atenuada, desarrollada en Japón en 1974; se utiliza el virus varicela-zoster cepa OKA atenuada (aceptada por OMS) obtenida en cultivos de células diploides
Varicela 1. Agente inmunizante Es una vacuna viral atenuada, desarrollada en Japón en 1974; se utiliza el virus varicela-zoster cepa OKA atenuada (aceptada por OMS) obtenida en cultivos de células diploides
CONCURSO PARA LA ADQUISICIÓN DE VACUNAS DEL PROGRAMA DE VACUNACIONES DE LA COMUNIDAD AUTÓNOMA DE BALEARES CORRESPONDIENTES AL AÑO 2.
 CONCURSO PARA LA ADQUISICIÓN DE VACUNAS DEL PROGRAMA DE VACUNACIONES DE LA COMUNIDAD AUTÓNOMA DE BALEARES CORRESPONDIENTES AL AÑO 2.010 PLIEGO PRESCRIPCIONES TÉCNICAS Condiciones generales El presente
CONCURSO PARA LA ADQUISICIÓN DE VACUNAS DEL PROGRAMA DE VACUNACIONES DE LA COMUNIDAD AUTÓNOMA DE BALEARES CORRESPONDIENTES AL AÑO 2.010 PLIEGO PRESCRIPCIONES TÉCNICAS Condiciones generales El presente
AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública
 Fiebre Amarilla AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública La fiebre amarilla es una infección aguda causada por un Arbovirus del género flavivirus, transmitida por la picadura
Fiebre Amarilla AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública La fiebre amarilla es una infección aguda causada por un Arbovirus del género flavivirus, transmitida por la picadura
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
CENTROS DE VACUNACIÓN
 Vacunación Infantil INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los ciudadanos, pero
Vacunación Infantil INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los ciudadanos, pero
Vaqta 25 U/0,5 ml ayuda a proteger a niños de 12 meses de edad hasta 17 años de edad frente a la enfermedad causada por el virus de la hepatitis A.
 Prospecto: Información para el usuario VAQTA 25 Unidades/0,5 ml Suspensión inyectable en jeringa precargada Vacuna antihepatitis A, inactivada, adsorbida Para niños y adolescentes Lea todo el prospecto
Prospecto: Información para el usuario VAQTA 25 Unidades/0,5 ml Suspensión inyectable en jeringa precargada Vacuna antihepatitis A, inactivada, adsorbida Para niños y adolescentes Lea todo el prospecto
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
La vacuna de virus vivos del sarampión es un agente de inmunización que se usa para prevenir la infección por el virus del sarampión.
 Vacuna Anti-Sarampión de Virus Vivos (Por Inyección) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL
Vacuna Anti-Sarampión de Virus Vivos (Por Inyección) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL
