GUÍA PARA LA ELABORACIÓN DEL CONSENTIMIENTO INFORMADO
|
|
|
- Lucas Rubio Luna
- hace 6 años
- Vistas:
Transcripción
1 GUÍA PARA LA ELABORACIÓN DEL CONSENTIMIENTO INFORMADO IMPORTANTE PARA EL INVESTIGADOR (A). Estos criterios se plantean específicamente para investigaciones clínicas. Sin embargo, usted como investigador (a) debe ajustarlos de acuerdo al tipo de investigación que va a proponer. Explique, siempre que sea posible, los términos en un lenguaje que sea comprensible para los participantes, si es necesario utilizar términos técnicos, escriba entre paréntesis los sinónimos coloquiales Ejemplo: se practicará una cirugía (operación). No redacte el documento en primera persona, utilice la segunda persona del singular. Este documento debe hacerse por duplicado, y debe remitirse una copia al sujeto de investigación o su representante legal. La Dirección de Investigación y Extensión de la Facultad de Salud (DIEF) y/o el Comité de Ética para la Investigación Científica de la Facultad de Salud (CEINCI) podrán requerir el documento que esté en posesión del investigador, el cual deberá ser conservado por el investigador responsable durante un mínimo de cinco años. MODELO DE REDACCIÓN DEL CONSENTIMIENTO INFORMADO Con base en los principios establecidos en la Resolución de 4 de Octubre de 1993 por la cual se establecen las normas para la investigación en salud en Colombia, específicamente en el Artículo 15, en lo relacionado con el Consentimiento Informado, usted deberá conocer acerca de esta investigación y aceptar participar en ella si lo considera conveniente. Por favor lea con cuidado y ha ga las preguntas que desee hasta su total comprensión. 1. El objetivo y la justificación de la investigación. Describa la razón de la inclusión de la persona en el protocolo así como el objetivo en palabras claras. Ejemplo 1: usted padece una enfermedad A y que se le propone participar en el proyecto para estudiar el tratamiento B como una posible alternativa para su padecimiento. Ejemplo 2: Su médico le ha diagnosticado leishmaniasis cutánea también llamada popularmente Guaral, Bejuco, Yateví o picadura de Pito una infección de la piel causada por parásitos llamados Leishmanias. Esta enfermedad es transmitida por la picadura de unos insectos pequeños similares a los jejenes llamados manta,
2 palomilla, arenilla o pringador. Se cree que estos insectos pican a animales silvestres, toman de ellos los parásitos y los transmiten al hombre. Sin embargo, existen áreas donde se encuentra leishmaniasis a pesar de que hay muy pocos animales silvestres. Su médico le está invitando a participar en una investigación para poder conocer si además de los animales silvestres, las personas con leishmaniasis pueden pasar la infección a los insectos y a través de ellos a otras personas. Esta información nos ayudará a tomar mejores decisiones para controlar la enfermedad. Para este estudio se espera que participen hasta (xx) personas con leishmaniasis. Su participación es absolutamente voluntaria y no afectará su atención médica. 2. Los procedimientos que vayan a usarse y su propósito, incluyendo la identificación de los procedimientos que son experimentales. Describa los procedimientos que involucran la razón del consentimiento, principalmente los que son adicionales al estudio/tratamiento del padecimiento y si representan riesgo o con posibles complicaciones. Ejemplo1: usted ha sido informado que se tomarán x muestras de sangre de tal cantidad, esta toma es adicional al estudio que requiere su enfermedad. Además se le practicarán mediciones corporales que son totalmente inofensivas. Ejemplo 2: Si usted acepta participar, antes de iniciar el tratamiento le serán tomados cuatro aspirados con aguja fina, similares a los que se le tomaron para el diagnóstico de su enfermedad, en un área cercana a una de las lesiones de leishmaniasis. Luego de esto, (paso por paso el procedimiento). Asimismo, se le tomará una muestra de sangre de 10 ml, lo que equivale a una jeringa llena de tamaño mediano. Una vez realizadas estas pruebas, usted recibirá su tratamiento con Glucantime en inyecciones en las nalgas durante 20 días, según lo recomendado por el Ministerio de Salud Y Protección Social de Colombia. Usted será valorado por un médico al mes, a los dos y a los tres meses después para ver su respuesta al tratamiento. En la visita a los tres meses, serán repetidas las mismas pruebas para saber su respuesta al tratamiento. 3. Las molestias o los riesgos esperados, cómo y quién las resolverá. Describa las posibles complicaciones y/o efectos secundarios, a corto y largo plazo, cuál sería el tratamiento y quién cubrirá los gastos. Ejemplo: A usted se le ha explicado que la toma de sangre de x ml (una jeringa pequeña) y que puede dar como resultado moretones, sangrados e infección, estos se resolverán con las indicaciones del médico en término de una o dos semanas. 4. Los beneficios que puedan observarse. Describa el aporte al conocimiento del estudio y posibles ventajas del tratamiento para el paciente. Ejemplo: Los resultados de este estudio ayudarán a determinar el mejor tratamiento de la enfermedad en su caso y el de otros pacientes. 5. Los procedimientos alternativos que pudieran ser ventajosos para el sujeto. En caso de estudios comparativos en los que el sujeto puede pertenecer a diferentes grupos de tratamiento o a un grupo control, aclarar al interesado que existen otras alternativas de estudio/tratamiento, en caso de que decida no participar en el mismo. Ejemplo: A usted se le explicado que dependiendo de un sorteo puede participar en un grupo que reciba el medicamento A que hace parte
3 del estudio o recibir un tratamiento que generalmente se aplica para estos casos, sin que esto afecte el curso de su enfermedad. 6. La garantía de recibir respuesta a cualquier pregunta y aclaración a cualquier duda. Garantice que se resolverá cualquier duda acerca de los procedimientos, riesgos, beneficios y otros asuntos relacionados con la investigación y el tratamiento del sujeto. Ejemplo: usted puede preguntar hasta su complacencia todo lo relacionado con el estudio y su participación. 7. La libertad de retirar su consentimiento en cualquier momento y dejar de participar en el estudio. Manifieste que puede retirarse en cualquier momento sin que por ello se creen prejuicios para continuar su cuidado y tratamiento; Ejemplo: A usted se le ha aclarado que puede abandonar el estudio en cuanto lo decida, sin que ello afecte su atención de parte del médico o del hospital 8. Privacidad y Anonimato. La seguridad de que no se identificará al sujeto y que se mantendrá la confidencialidad de la información relacionada con su privacidad, autorizando en su caso la publicación científica de los resultados. Ejemplo: si usted autoriza la publicación de los resultados del estudio a condición de que en todo momento se mantendrá el secreto profesional y que no se publicará su nombre o revelará su identidad. 9. El compromiso de proporcionarle información actualizada obtenida durante el estudio aunque ésta pudiera afectar la voluntad del sujeto para continuar participando. En caso de se presenten eventos negativos o suficiente evidencia de efectos positivos que no justifiquen continuar con el estudio, se informará oportunamente aunque esto represente el retiro prematuro de la investigación. Ejemplo: En caso de que presente algún malestar debido al medicamento, se le brindará lo oportunidad de cambiar a otro o en su caso abandonar el estudio y así poder recibir la mejor alternativa para su tratamiento. 10. La disponibilidad de tratamiento médico y la indemnización a que legalmente tendría derecho, por parte de la institución de atención a la salud, en el caso de daños que la ameriten, directamente causados por la investigación. En caso de que investigador brinde el tratamiento o medicamentos aclare si será gratuitamente y durante cuánto tiempo se hará, también describa la indemnización que se brindará en caso de que se presenten secuelas provocadas por el estudio. Ejemplo: Los antibióticos serán proporcionados gratuitamente por el laboratorio farmacéutico involucrado durante el tiempo que dure su enfermedad, se le aclara también que en caso de que presentara algún problema derivado del tratamiento de este estudio el laboratorio farmacéutico garantiza una indemnización o seguro médico por xxx cantidad. 11. Que si existen gastos adicionales, éstos serán absorbidos por el presupuesto de la investigación. Especifique si se cobrarán o no estudios correspondientes al estudio/tratamiento del paciente y si éstos son requeridos solo para efectos del estudio declare que no se cobrarán al paciente. Ejemplo: Los estudios de laboratorio que se practicaran serán cubiertos por el laboratorio farmacéutico.
4 12. Autorización para uso de las muestras y datos obtenidos en este estudio: se le solicita la autorización al participante para que las muestras y datos obtenidos en este estudio, puedan ser utilizados en otros estudios y laboratorios, previa aprobación del Comité de Ética para la Investigación Científica de la Facultad de Salud de la UIS para realizar dichos estudios. (Debe marcar con una X, si autoriza o no autoriza, y firmará en caso de autorizar). Si autoriza No autoriza de autorización 13. Aceptación: La Resolución /93 del Ministerio de Salud Nacional exige consignar el nombre del paciente o participante, su firma o huella digital, su identificación personal. Requiere también la firma de dos testigos con su nombre dirección y fecha de la firma, y que indique su parentesco con el paciente. El responsable de obtener el consentimiento informado debe firmar y consignar sus datos de identificación personal, lugar y fecha de obtención del consentimiento. Con fecha, habiendo comprendido lo anterior y una vez que se le aclararon todas las dudas que surgieron con respecto a su participación en la investigación, usted acepta participar en investigación titulada: ESCRIBA AQUÍ EL TÍTULO DE LA INVESTIGACIÓN Nombre del participante o su representante legal La firma puede ser sustituida por la huella digital en los casos que se amerite Huella digital Nombre del testigo 1 Dirección Tel/Cel.: Relación que guarda con el participante Fecha de la firma
5 Nombre del testigo 2 Dirección Tel/Cel.: Relación que guarda con el participante Fecha de la firma Nombre del Investigador principal Datos del investigador a donde los participantes se puedan comunicar: (Escriba el teléfono/celular/fax/correo electrónico/dirección, etc.) Contacto Comité de Ética: Para preguntas o aclaraciones acerca de los aspectos éticos de ésta investigación pueden comunicarse con Coordinador (a) del Comité de Ética para la Investigación Científica de la Facultad de Salud de la UIS, o con cualquiera de los miembros del Comité, al teléfono:
CONSENTIMIENTO INFORMADO PARA PARTICIPAR EN UN ESTUDIO DE INVESTIGACIÓN MÉDICA*
 CONSENTIMIENTO INFORMADO PARA PARTICIPAR EN UN ESTUDIO DE INVESTIGACIÓN MÉDICA* Título del protocolo: Investigador principal: Lugar donde se realizará el estudio: Nombre del paciente: A usted se le está
CONSENTIMIENTO INFORMADO PARA PARTICIPAR EN UN ESTUDIO DE INVESTIGACIÓN MÉDICA* Título del protocolo: Investigador principal: Lugar donde se realizará el estudio: Nombre del paciente: A usted se le está
HOMOCLAVE CARACTERÍSTICAS A CUMPLIR
 Hoja 1 de 6 Identificador AZUL MARINO HOMOCLAVE 09-012 INCLUSIÓN DE CENTRO DOCUMENTO CARACTERÍSTICAS A CUMPLIR Formato de Autorizaciones, Certificados y Visitas, solicitud de autorización de protocolo
Hoja 1 de 6 Identificador AZUL MARINO HOMOCLAVE 09-012 INCLUSIÓN DE CENTRO DOCUMENTO CARACTERÍSTICAS A CUMPLIR Formato de Autorizaciones, Certificados y Visitas, solicitud de autorización de protocolo
1 DOCUMENTO DE INFORMACIÓN PARA (*) BIOPSIA PERCUTÁNEA DE LESIONES DE MAMA (AGUJA GRUESA, SISTEMAS DE VACÍO)
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
1 DOCUMENTO DE INFORMACIÓN PARA (*) REALIZACION DE ESTUDIOS GENETICOS
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
TRABAJO FIN DE GRADO:
 COMISIÓN TRABAJO FIN DE GRADO. FACULTAD TERAPIA OCUPACIONAL, LOGOPEDIA Y ENFERMERÍA TRABAJO FIN DE GRADO: NORMAS ÉTICAS DEL TFG Curso 2011 2012 Página 1 Normas Éticos del Trabajo Fin de Grado NORMAS ÉTICAS
COMISIÓN TRABAJO FIN DE GRADO. FACULTAD TERAPIA OCUPACIONAL, LOGOPEDIA Y ENFERMERÍA TRABAJO FIN DE GRADO: NORMAS ÉTICAS DEL TFG Curso 2011 2012 Página 1 Normas Éticos del Trabajo Fin de Grado NORMAS ÉTICAS
OBTENCIÓN DEL CONSENTIMIENTO INFORMADO
 Hoja: 1 de 7 Elaboró: Revisó: Autorizó: Puesto Jefe de División Control del Dopaje Subdirector de Medicina del Deporte Director Médico Firma Hoja: 2 de 7 1. Propósito. Establecer los lineamientos necesarios
Hoja: 1 de 7 Elaboró: Revisó: Autorizó: Puesto Jefe de División Control del Dopaje Subdirector de Medicina del Deporte Director Médico Firma Hoja: 2 de 7 1. Propósito. Establecer los lineamientos necesarios
CONSENTIMIENTO INFORMADO
 CONSENTIMIENTO INFORMADO Según la Organización Panamericana de la Salud, en su Documento de las América de Buenas Practicas Clínicas Definición El Consentimiento Informado es un proceso mediante el cual
CONSENTIMIENTO INFORMADO Según la Organización Panamericana de la Salud, en su Documento de las América de Buenas Practicas Clínicas Definición El Consentimiento Informado es un proceso mediante el cual
1. DOCUMENTO DE INFORMACIÓN PARA (*) COLONOSCOPIA
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
: Universidad Nacional Autónoma de México. Nombre del paciente:
 : Modelando la obesidad y la diabetes mellitus tipo 2 como sistema complejo adaptativo Investigador principal: Christopher Rhodes Stephens Sede don : Universidad Nacional Autónoma de México Nombre del
: Modelando la obesidad y la diabetes mellitus tipo 2 como sistema complejo adaptativo Investigador principal: Christopher Rhodes Stephens Sede don : Universidad Nacional Autónoma de México Nombre del
Díganos si tiene alguna duda o necesita más información. Le atenderemos con mucho gusto.
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
1. DOCUMENTO DE INFORMACIÓN PARA (*)INSEMINACIÓN ARTIFICIAL
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
INSTITUTO NACIONAL DE PEDIATRÍA
 INSTITUTO NACIONAL DE PEDIATRÍA GUÍA PARA REALIZACIÓN DE CARTA DE CONSENTIMIENTO INFORMADO PARA PACIENTES PEDIÁTRICOS (Versión 1.0-jul2016) (TÍTULO COMPLETO DEL ESTUDIO) PARTE 1: FORMATO Lugar y fecha:.
INSTITUTO NACIONAL DE PEDIATRÍA GUÍA PARA REALIZACIÓN DE CARTA DE CONSENTIMIENTO INFORMADO PARA PACIENTES PEDIÁTRICOS (Versión 1.0-jul2016) (TÍTULO COMPLETO DEL ESTUDIO) PARTE 1: FORMATO Lugar y fecha:.
1. DOCUMENTO DE INFORMACIÓN PARA LA OBTENCIÓN Y CONSERVACIÓN DIRIGIDA DE SANGRE DE CORDÓN UMBILICAL (*)
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
Díganos si tiene alguna duda o necesita más información. Le atenderemos con mucho gusto.
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
CUESTIONARIO DE AUTO-EVALUACIÓN DEL CEI (Lista de verificación)
 CUESTIONARIO DE AUTO-EVALUACIÓN DEL CEI (Lista de verificación) Este cuestionario resulta de utilidad para verificar que los procedimientos operativos de un CEI se ajusten a la Ley 3301/2009 del GCBA 1.
CUESTIONARIO DE AUTO-EVALUACIÓN DEL CEI (Lista de verificación) Este cuestionario resulta de utilidad para verificar que los procedimientos operativos de un CEI se ajusten a la Ley 3301/2009 del GCBA 1.
HOJA DE INFORMACIÓN PARA EL SEGUIMIENTO DEL EMBARAZO
 HOJA DE INFORMACIÓN PARA EL SEGUIMIENTO DEL EMBARAZO Título: Estudio fase II multicéntrico de carfilzomib, lenalidomida y dexametasona (KRd) como inducción, seguido de melfalán a altas dosis y trasplante
HOJA DE INFORMACIÓN PARA EL SEGUIMIENTO DEL EMBARAZO Título: Estudio fase II multicéntrico de carfilzomib, lenalidomida y dexametasona (KRd) como inducción, seguido de melfalán a altas dosis y trasplante
Universidad de Chile Hospital Clínico "Dr. José Joaquín Aguirre"
 Universidad de Chile Hospital Clínico "Dr. José Joaquín Aguirre" COMITÉ DE ÉTICA SOLICITUD DE EVALUACIÓN DE PROYECTO DE INVESTIGACIÓN POR COMITÉ DE ÉTICA (LA INFORMACIÓN DEBE SER MECANOGRAFIADA) 1.- TÍTULO
Universidad de Chile Hospital Clínico "Dr. José Joaquín Aguirre" COMITÉ DE ÉTICA SOLICITUD DE EVALUACIÓN DE PROYECTO DE INVESTIGACIÓN POR COMITÉ DE ÉTICA (LA INFORMACIÓN DEBE SER MECANOGRAFIADA) 1.- TÍTULO
1 DOCUMENTO DE INFORMACIÓN PARA (*) ARTERIOGRAFÍA MEDULAR
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
CENTRO SANITARIO UNIDAD GESTION CLINICA BUJALANCE ATENCION PRIMARIA 1 DOCUMENTO DE INFORMACIÓN PARA (*) RETINOGRAFIA.
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
CENTRO SANITARIO HOSPITAL VIRGEN DE LA VICTORIA MEDICINA NUCLEAR 1 DOCUMENTO DE INFORMACIÓN PARA (*) TRATAMIENTO RADIOISOTÓPICO DEL HIPERTIROIDISMO
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
LISTADO DE AUTOEVALUACIÓN PARA PROTOCOLO INICIAL. Documento
 Número de Protocolo A) MÓDULO I: Presentación de la Información Formato de Solicitud de Predictamen a Protocolo Inicial Observaciones La solicitud está debidamente requisitada La información viene separada
Número de Protocolo A) MÓDULO I: Presentación de la Información Formato de Solicitud de Predictamen a Protocolo Inicial Observaciones La solicitud está debidamente requisitada La información viene separada
EN QUÉ LE BENEFICIARÁ: La ausencia de complicaciones derivadas de la patología que presenta.
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
1. DOCUMENTO DE INFORMACIÓN PARA (*) TEST DE FLECAINIDA
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMA DE CONSENTIMIENTO PARA INVESTIGACION
 Antecedentes FORMA DE CONSENTIMIENTO PARA INVESTIGACION Una línea de células es una muestra congelada de células blancas de su sangre, que han sido especialmente procesadas para que el Estudio del Corazón
Antecedentes FORMA DE CONSENTIMIENTO PARA INVESTIGACION Una línea de células es una muestra congelada de células blancas de su sangre, que han sido especialmente procesadas para que el Estudio del Corazón
Compromiso de Confidencialidad
 Compromiso de Confidencialidad Este documento le informa sobre cómo se utilizará o se comunicará información clínica y la forma en que usted puede tener acceso a esta información. Por favor léalo con atención.
Compromiso de Confidencialidad Este documento le informa sobre cómo se utilizará o se comunicará información clínica y la forma en que usted puede tener acceso a esta información. Por favor léalo con atención.
1. DOCUMENTO DE INFORMACIÓN PARA (*) TRATAMIENTO DE LA FÍSTULA ANAL
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
Consentimiento Informado para Estudios Observacionales
 Consentimiento Informado para Estudios bservacionales NTA: Si se considera que se trata de un estudio con mínimo o ningún riesgo para el participante, el CIE puede decidir su revisión expedita. Título
Consentimiento Informado para Estudios bservacionales NTA: Si se considera que se trata de un estudio con mínimo o ningún riesgo para el participante, el CIE puede decidir su revisión expedita. Título
GESTIÓN ASISTENCIAL INTEGRAL CONSENTIMIENTO INFORMADO CONSENTIMIENTO INFORMADO PARA MANGUITO ROTADOR INTRODUCCIÓN
 PÁGINA 1 DE 5 Apreciado Usuario: INTRODUCCIÓN Usted va a ser sometido a un procedimiento quirúrgico, invasivo no quirúrgico o terapéutico por el grupo de especialistas del Hospital Universitario San Ignacio.
PÁGINA 1 DE 5 Apreciado Usuario: INTRODUCCIÓN Usted va a ser sometido a un procedimiento quirúrgico, invasivo no quirúrgico o terapéutico por el grupo de especialistas del Hospital Universitario San Ignacio.
ASENTIMIENTO INFORMADO PARA COHORTES DE LA RED RIS
 ASENTIMIENTO INFORMADO PARA COHORTES DE LA RED RIS CONTROLADA Nº DESTINATARIO FECHA ENTREGA ENTREGADO POR Nombre Firma NO CONTROLADA REVISIÓN REALIZADO FECHA APROBADO FECHA ENTRADA EN VIGOR 01 Mª Ángeles
ASENTIMIENTO INFORMADO PARA COHORTES DE LA RED RIS CONTROLADA Nº DESTINATARIO FECHA ENTREGA ENTREGADO POR Nombre Firma NO CONTROLADA REVISIÓN REALIZADO FECHA APROBADO FECHA ENTRADA EN VIGOR 01 Mª Ángeles
PROYECTO DE INVESTIGACIÓN
 FACULTAD DE MEDICINA CLINICA ALEMANA UNIVERSIDAD DEL DESARROLLO CENTRO DE BIOÉTICA COMITÉ DE ÉTICA DE LA INVESTIGACIÓN Recepción: / / Código: (Uso Interno) PROYECTO DE INVESTIGACIÓN Título de Proyecto:.
FACULTAD DE MEDICINA CLINICA ALEMANA UNIVERSIDAD DEL DESARROLLO CENTRO DE BIOÉTICA COMITÉ DE ÉTICA DE LA INVESTIGACIÓN Recepción: / / Código: (Uso Interno) PROYECTO DE INVESTIGACIÓN Título de Proyecto:.
1. DOCUMENTO DE INFORMACIÓN PARA (*) RESECCIÓN DE BULLAS PULMONARES (quistes de aire formados en el pulmón) Y PLEURODESIS
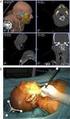 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
ASENTIMIENTO INFORMADO PARA LA COHORTE DE ENFERMEDADES RARAS
 - 1 - ASENTIMIENTO INFORMADO PARA LA COHORTE CONTROLADA Nº DESTINATARIO FECHA ENTREGA ENTREGADO POR Nombre Firma NO CONTROLADA REVISIÓN REALIZADO FECHA APROBADO FECHA ENTRADA EN VIGOR 00 Mª Ángeles Muñoz
- 1 - ASENTIMIENTO INFORMADO PARA LA COHORTE CONTROLADA Nº DESTINATARIO FECHA ENTREGA ENTREGADO POR Nombre Firma NO CONTROLADA REVISIÓN REALIZADO FECHA APROBADO FECHA ENTRADA EN VIGOR 00 Mª Ángeles Muñoz
REQUISITOS PARA LA REALIZACIÓN DE UN PROYECTO DE INVESTIGACION
 DEPARTAMENTO DE SALUD DE SAGUNTO Comisión de Investigación Av. Ramón y Cajal, s/n 46520 SAGUNTO (Valencia) REQUISITOS PARA LA REALIZACIÓN DE UN PROYECTO DE INVESTIGACION INDICE 1. Solicitud de realización.
DEPARTAMENTO DE SALUD DE SAGUNTO Comisión de Investigación Av. Ramón y Cajal, s/n 46520 SAGUNTO (Valencia) REQUISITOS PARA LA REALIZACIÓN DE UN PROYECTO DE INVESTIGACION INDICE 1. Solicitud de realización.
FORMATOS ESPECÍFICOS Consentimiento informado N
 INVESTIGADOR RESPONSABLE: Dra. Laurie Ann Ximénez-Fyvie. CLÍNICOS RESPONSABLES: MC. Adriana-Patricia Rodríguez-Hernández. Esp. Velia Jacobo-Soto. Dra. Gabriela Esthela-Tiznado. Dra. Ma. de Lourdes Márquez-Corona.
INVESTIGADOR RESPONSABLE: Dra. Laurie Ann Ximénez-Fyvie. CLÍNICOS RESPONSABLES: MC. Adriana-Patricia Rodríguez-Hernández. Esp. Velia Jacobo-Soto. Dra. Gabriela Esthela-Tiznado. Dra. Ma. de Lourdes Márquez-Corona.
Formato No. DINV-9: ACUERDO DE CONFIDENCIALIDAD Y DECLARACIÓN DE INEXISTENCIA
 Señor evaluador: En el ejercicio de su rol como evaluador de proyectos y/o productos de investigación que se le presentan a consideración y con el fin de sustentar la recomendación que será la base para
Señor evaluador: En el ejercicio de su rol como evaluador de proyectos y/o productos de investigación que se le presentan a consideración y con el fin de sustentar la recomendación que será la base para
PROCEDIMIENTO MINIMA CUANTIA
 PROCESO PÁGINA 1 DE 8 COORDINADOR (A) GRUPO GESTION 1. OBJETIVO Adquirir bienes y/o servicios que requiere la Unidad para el cumplimiento de las metas y objetivos cuyo valor no exceda del 10% de la menor
PROCESO PÁGINA 1 DE 8 COORDINADOR (A) GRUPO GESTION 1. OBJETIVO Adquirir bienes y/o servicios que requiere la Unidad para el cumplimiento de las metas y objetivos cuyo valor no exceda del 10% de la menor
Universidad de Arizona Tucson, AZ, EE.UU.
 Universidad de Arizona Tucson, AZ, EE.UU. Los ejemplos del consentimiento forman para la investigación del tema humano. La primera forma está en la "primera persona" y la forma siguiente está en la "segunda
Universidad de Arizona Tucson, AZ, EE.UU. Los ejemplos del consentimiento forman para la investigación del tema humano. La primera forma está en la "primera persona" y la forma siguiente está en la "segunda
SERVICIO NACIONAL DE APRENDIZAJE- SENA PROCESO GESTION DE FORMACIÓN PROFESIONAL INTEGRAL
 SERVICIO NACIONAL DE APRENDIZAJE- SENA PROCESO GESTION DE FORMACIÓN PROFESIONAL INTEGRAL GUIA ORIENTACIONES PARA LA REALIZACION DE GIRAS TECNICAS COMO ESTRATEGIA EN EL PROCESO FORMATIVO 2014 GFPI-G-005
SERVICIO NACIONAL DE APRENDIZAJE- SENA PROCESO GESTION DE FORMACIÓN PROFESIONAL INTEGRAL GUIA ORIENTACIONES PARA LA REALIZACION DE GIRAS TECNICAS COMO ESTRATEGIA EN EL PROCESO FORMATIVO 2014 GFPI-G-005
DESCRIPCIÓN DE ACTIVIDADES. PRE SOMETIMIENTO A COFEPRIS IDENTIFICACIÓN DEL TIPO DE INVESTIGACIÓN
 1 OBJETIVO: Describir los requisitos para la Solicitud de Modificación o Enmienda a la Autorización de Protocolo de Investigación, enmienda a Información Clínica y/o Preclínica previa (Enmienda de seguridad)"
1 OBJETIVO: Describir los requisitos para la Solicitud de Modificación o Enmienda a la Autorización de Protocolo de Investigación, enmienda a Información Clínica y/o Preclínica previa (Enmienda de seguridad)"
UNIVERSIDAD AUTÓNOMA DE ASUNCIÓN FACULTAD DE CIENCIAS DE LA SALUD CARRERA ODONTOLOGÍA CÓDIGO DE ÉTICA PARA INVESTIGACIONES EN SALUD
 UNIVERSIDAD AUTÓNOMA DE ASUNCIÓN FACULTAD DE CIENCIAS DE LA SALUD CARRERA ODONTOLOGÍA CÓDIGO DE ÉTICA PARA INVESTIGACIONES EN SALUD 2011 PRÓLOGO Los principios éticos descritos en el presente código, deben
UNIVERSIDAD AUTÓNOMA DE ASUNCIÓN FACULTAD DE CIENCIAS DE LA SALUD CARRERA ODONTOLOGÍA CÓDIGO DE ÉTICA PARA INVESTIGACIONES EN SALUD 2011 PRÓLOGO Los principios éticos descritos en el presente código, deben
INFORMACIÓN REFERENTE AL PODER MÉDICO
 INFORMACIÓN REFERENTE AL PODER MÉDICO ÉSTE ES UN DOCUMENTO LEGAL IMPORTANTE. ANTES DE FIRMAR ESTE DOCUMENTO DEBE SABER ESTA INFORMACIÓN IMPORTANTE: Salvo los límites que usted imponga, este documento le
INFORMACIÓN REFERENTE AL PODER MÉDICO ÉSTE ES UN DOCUMENTO LEGAL IMPORTANTE. ANTES DE FIRMAR ESTE DOCUMENTO DEBE SABER ESTA INFORMACIÓN IMPORTANTE: Salvo los límites que usted imponga, este documento le
LEY DERECHOS Y DEBERES DE LOS PACIENTES EN SU ATENCIÓN EN SALUD
 LEY 20.584 DERECHOS Y DEBERES DE LOS PACIENTES EN SU ATENCIÓN EN SALUD Objetivo Regular los derechos y deberes de las personas y su aplicación a los casos concretos que se producen en las atenciones de
LEY 20.584 DERECHOS Y DEBERES DE LOS PACIENTES EN SU ATENCIÓN EN SALUD Objetivo Regular los derechos y deberes de las personas y su aplicación a los casos concretos que se producen en las atenciones de
NORMA DE AUDITORÍA 260 COMUNICACIONES DE ASUNTOS DE AUDITORÍA CON LOS ENCARGADOS DEL MANDO (GOBIERNO CORPORATIVO) CONTENIDO
 NORMA DE AUDITORÍA 260 COMUNICACIONES DE ASUNTOS DE AUDITORÍA CON LOS CONTENIDO Párrafos Introducción 1-4 Personas relevantes 5-10 Asuntos de auditoría de interés del mando por comunicar 11-12 Oportunidad
NORMA DE AUDITORÍA 260 COMUNICACIONES DE ASUNTOS DE AUDITORÍA CON LOS CONTENIDO Párrafos Introducción 1-4 Personas relevantes 5-10 Asuntos de auditoría de interés del mando por comunicar 11-12 Oportunidad
2.2 PROFESIONALES QUE INTERVIENEN EN EL PROCESO DE INFORMACIÓN Y/O CONSENTIMIENTO APELLIDOS Y NOMBRE FECHA FIRMA
 CENTRO SANITARIO SERVICIO DE UNIDAD GESTION CLINICA : BUJALANCE ATENCION PRIMARIA 2 CONSENTIMIENTO INFORMADO : RETIRADA del IMPLANTE ANTICONCEPTIVO 2.1 DATOS DEL/DE LA PACIENTE Y DE SU REPRESENTANTE (sólo
CENTRO SANITARIO SERVICIO DE UNIDAD GESTION CLINICA : BUJALANCE ATENCION PRIMARIA 2 CONSENTIMIENTO INFORMADO : RETIRADA del IMPLANTE ANTICONCEPTIVO 2.1 DATOS DEL/DE LA PACIENTE Y DE SU REPRESENTANTE (sólo
1. DOCUMENTO DE INFORMACIÓN PARA (*) MAMOPLASTIA DE REDUCCIÓN
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
Qué es un ensayo clínico?
 Qué es un ensayo clínico? Un ensayo clínico es un estudio que permite a los médicos determinar si un nuevo tratamiento, medicamento o dispositivo contribuirá a prevenir, detectar o tratar una enfermedad.
Qué es un ensayo clínico? Un ensayo clínico es un estudio que permite a los médicos determinar si un nuevo tratamiento, medicamento o dispositivo contribuirá a prevenir, detectar o tratar una enfermedad.
FORMULARIO CORTO DE CONSENTIMIENTO Consentimiento para participar en investigación - Formulario corto
 ESTE DOCUMENTO DEBE ESTAR ESCRITO EN SU IDIOMA FORMULARIO CORTO DE CONSENTIMIENTO Consentimiento para participar en investigación - Formulario corto Introducción En Seattle Children s se llevan a cabo
ESTE DOCUMENTO DEBE ESTAR ESCRITO EN SU IDIOMA FORMULARIO CORTO DE CONSENTIMIENTO Consentimiento para participar en investigación - Formulario corto Introducción En Seattle Children s se llevan a cabo
IMAGEN EN ACCIÓN PROTOCOLO PARA LA REALIZACIÓN DE PROYECTOS
 Imagen en Acción - Protocolo para la realización de proyectos - 1/6 IMAGEN EN ACCIÓN PROTOCOLO PARA LA REALIZACIÓN DE PROYECTOS El objetivo del presente documento es: - Servir de ayuda y guía práctica
Imagen en Acción - Protocolo para la realización de proyectos - 1/6 IMAGEN EN ACCIÓN PROTOCOLO PARA LA REALIZACIÓN DE PROYECTOS El objetivo del presente documento es: - Servir de ayuda y guía práctica
REGLAMENTO INTERNO Y MANUAL DE ORGANIZACIÓN COMITÉ DE ÉTICA EN INVESTIGACIÓN EN INVESTIGACION INSTITUTO DE NEUROBIOLOGÍA-UNAM
 REGLAMENTO INTERNO Y MANUAL DE ORGANIZACIÓN COMITÉ DE ÉTICA EN INVESTIGACIÓN EN INVESTIGACION INSTITUTO DE NEUROBIOLOGÍA-UNAM l. INTRODUCCIÓN El presente Comité se establece con base en la Norma Oficial
REGLAMENTO INTERNO Y MANUAL DE ORGANIZACIÓN COMITÉ DE ÉTICA EN INVESTIGACIÓN EN INVESTIGACION INSTITUTO DE NEUROBIOLOGÍA-UNAM l. INTRODUCCIÓN El presente Comité se establece con base en la Norma Oficial
GESTIÓN ASISTENCIAL INTEGRAL CONSENTIMIENTO INFORMADO CONSENTIMIENTO INFORMADO PARA LEGRADO OBSTETRICO INTRODUCCIÓN
 PÁGINA 1 DE 5 Apreciado Usuario: INTRODUCCIÓN Usted va a ser sometido a un procedimiento quirúrgico, invasivo no quirúrgico o terapéutico por el grupo de especialistas del Hospital Universitario San Ignacio.
PÁGINA 1 DE 5 Apreciado Usuario: INTRODUCCIÓN Usted va a ser sometido a un procedimiento quirúrgico, invasivo no quirúrgico o terapéutico por el grupo de especialistas del Hospital Universitario San Ignacio.
Deberes y derechos de los pacientes. Ley
 Deberes y derechos de los pacientes Ley 20.584 LEY N 20.584 Regula los derechos y deberes que tienen las personas en relación con acciones vinculadas a su atención en salud I. ASPECTOS GENERALES DE LA
Deberes y derechos de los pacientes Ley 20.584 LEY N 20.584 Regula los derechos y deberes que tienen las personas en relación con acciones vinculadas a su atención en salud I. ASPECTOS GENERALES DE LA
GUÍA DE LLENADO DE LA CARTA DE CONSENTIMIENTO INFORMADO PARA ACTOS GINECOLÓGICOS Y OBSTÉTRICOS.
 GUÍA DE LLENADO DE LA CARTA DE CONSENTIMIENTO INFORMADO PARA ACTOS GINECOLÓGICOS Y OBSTÉTRICOS. Fundamento Legal de la Carta de Consentimiento Informado. La Carta de Consentimiento informado se rige en
GUÍA DE LLENADO DE LA CARTA DE CONSENTIMIENTO INFORMADO PARA ACTOS GINECOLÓGICOS Y OBSTÉTRICOS. Fundamento Legal de la Carta de Consentimiento Informado. La Carta de Consentimiento informado se rige en
LA ÉTICA DE LA INVESTIGACIÓN. Vicente Medina Arana Julio José Galiano García Ana M. Perdomo Hernández M. Elisa de Castro Peraza
 LA ÉTICA DE LA INVESTIGACIÓN Vicente Medina Arana Julio José Galiano García Ana M. Perdomo Hernández M. Elisa de Castro Peraza La investigación es la vida de la Ciencia, pero en el mundo hay otros valores
LA ÉTICA DE LA INVESTIGACIÓN Vicente Medina Arana Julio José Galiano García Ana M. Perdomo Hernández M. Elisa de Castro Peraza La investigación es la vida de la Ciencia, pero en el mundo hay otros valores
Díganos si tiene alguna duda o necesita más información. Le atenderemos con mucho gusto.
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
CÓDIGO DE ÉTICA PARA LA INVESTIGACIÓN
 www.uladech.edu.pe RECTORADO CÓDIGO DE ÉTICA PARA LA INVESTIGACIÓN VERSIÓN 001 Aprobado por acuerdo del Consejo Universitario con Resolución N 0108-2016-CU-ULADECH Católica, de fecha 25 de enero de 2016
www.uladech.edu.pe RECTORADO CÓDIGO DE ÉTICA PARA LA INVESTIGACIÓN VERSIÓN 001 Aprobado por acuerdo del Consejo Universitario con Resolución N 0108-2016-CU-ULADECH Católica, de fecha 25 de enero de 2016
1. DOCUMENTO DE INFORMACIÓN PARA (*) LA REALIZACIÓN DE ENDOSCOPIA DIGESTIVA ALTA (ESÓFAGO-GASTRO-DUODENOSCOPIA)
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
CONSENTIMIENTO INFORMADO
 CONSENTIMIENTO INFORMADO CONTROLADA Nº DESTINATARIO FECHA ENTREGA ENTREGADO POR Nombre Firma NO CONTROLADA REVISIÓN REALIZADO FECHA APROBADO FECHA 00 Mª Ángeles Muñoz Diciembre 2007 Modificaciones: Dirección
CONSENTIMIENTO INFORMADO CONTROLADA Nº DESTINATARIO FECHA ENTREGA ENTREGADO POR Nombre Firma NO CONTROLADA REVISIÓN REALIZADO FECHA APROBADO FECHA 00 Mª Ángeles Muñoz Diciembre 2007 Modificaciones: Dirección
COMITÉ DE ÉTICA DE LA INVESTIGACIÓN
 COMITÉ DE ÉTICA DE LA INVESTIGACIÓN La apertura y financiación de proyectos de investigación es una promesa pública que hace la Universidad con la comunidad en general, para crear conocimiento que propicie
COMITÉ DE ÉTICA DE LA INVESTIGACIÓN La apertura y financiación de proyectos de investigación es una promesa pública que hace la Universidad con la comunidad en general, para crear conocimiento que propicie
1. DOCUMENTO DE INFORMACIÓN PARA (*) CANALIZACIÓN DE VÍAS CENTRALES
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
Qué es un Ensayo Clínico?
 Qué es un Ensayo Clínico? E.U, MSc Macarena Manríquez Mimica Coordinadora Estudios Clínicos ISP, Novartis, MSD Profesora Instructor Universidad de los Andes Tópicos a tratar Definición de un Ensayo Clínico
Qué es un Ensayo Clínico? E.U, MSc Macarena Manríquez Mimica Coordinadora Estudios Clínicos ISP, Novartis, MSD Profesora Instructor Universidad de los Andes Tópicos a tratar Definición de un Ensayo Clínico
Centro de Control Estatal de Equipos Médicos
 Ministerio de Salud Pública Centro de Control Estatal de Equipos Médicos C C E E M GUIA G E - 5 1996-12 12-27 GUÍA PARA LA APLICACIÓN DE LAS BUENAS PRÁCTICAS CLÍNICAS EN LA EJECUCIÓN DE LAS INVESTIGACIONES
Ministerio de Salud Pública Centro de Control Estatal de Equipos Médicos C C E E M GUIA G E - 5 1996-12 12-27 GUÍA PARA LA APLICACIÓN DE LAS BUENAS PRÁCTICAS CLÍNICAS EN LA EJECUCIÓN DE LAS INVESTIGACIONES
Centrales de Riesgos
 Centrales de Riesgos Qué es la Central de Riesgos? La Central de Riesgos (Central de Información Crediticia), es el sistema administrado por la Comisión Nacional de Bancos y Seguros, mediante el cual se
Centrales de Riesgos Qué es la Central de Riesgos? La Central de Riesgos (Central de Información Crediticia), es el sistema administrado por la Comisión Nacional de Bancos y Seguros, mediante el cual se
PROCEDIMIENTO OPERATIVO DE ACCESO AL COMITÉ ÉTICO CIENTÍFICO. Servicio de Salud Talcahuano
 PROCEDIMIENTO OPERATIVO DE ACCESO AL COMITÉ ÉTICO CIENTÍFICO Servicio de Salud Talcahuano INDICE I- MARCO LEGAL II- DOCUMENTACIÓN REQUERIDA PARA PRESENTAR AL COMITÉ ÉTICO CIENTÍFICO III- REVISIÓN Y RESPUESTAS
PROCEDIMIENTO OPERATIVO DE ACCESO AL COMITÉ ÉTICO CIENTÍFICO Servicio de Salud Talcahuano INDICE I- MARCO LEGAL II- DOCUMENTACIÓN REQUERIDA PARA PRESENTAR AL COMITÉ ÉTICO CIENTÍFICO III- REVISIÓN Y RESPUESTAS
Objetivos Internacionales para la Seguridad del Paciente
 Objetivos Internacionales para la Seguridad del Paciente Eliminar los Riesgos es nuestra META Con el propósito de resguardar la seguridad del paciente y de acuerdo a la acreditación y certificación en
Objetivos Internacionales para la Seguridad del Paciente Eliminar los Riesgos es nuestra META Con el propósito de resguardar la seguridad del paciente y de acuerdo a la acreditación y certificación en
ANEXO III Sección de Genética Molecular
 ANEXO III Sección de Genética Molecular ÍNDICE Hoja de consentimiento informado para la realización de pruebas genéticas diagnósticas. Hoja de consentimiento informado para guardar muestras excedentes
ANEXO III Sección de Genética Molecular ÍNDICE Hoja de consentimiento informado para la realización de pruebas genéticas diagnósticas. Hoja de consentimiento informado para guardar muestras excedentes
ASENTIMIENTO INFORMADO
 ASENTIMIENTO INFORMADO CONTROLADA Nº DESTINATARIO FECHA ENTREGA ENTREGADO POR Nombre Firma NO CONTROLADA REVISIÓN REALIZADO FECHA 00 Mª Ángeles Muñoz Enero 2009 Modificaciones: APROBADO Dirección Comité
ASENTIMIENTO INFORMADO CONTROLADA Nº DESTINATARIO FECHA ENTREGA ENTREGADO POR Nombre Firma NO CONTROLADA REVISIÓN REALIZADO FECHA 00 Mª Ángeles Muñoz Enero 2009 Modificaciones: APROBADO Dirección Comité
CONSENTIMIENTO INFORMADO PARA ALMACENAMIENTO DE MUESTRAS BIOLÓGICAS EN BIOBANCOS PARA SU UTILIZACIÓN EN INVESTIGACIÓN
 CONSENTIMIENTO INFORMADO PARA ALMACENAMIENTO DE MUESTRAS BIOLÓGICAS EN BIOBANCOS PARA SU UTILIZACIÓN EN INVESTIGACIÓN Obtención de líquido cefalorraquídeo (LCR): Desde el diagnóstico de su enfermedad y
CONSENTIMIENTO INFORMADO PARA ALMACENAMIENTO DE MUESTRAS BIOLÓGICAS EN BIOBANCOS PARA SU UTILIZACIÓN EN INVESTIGACIÓN Obtención de líquido cefalorraquídeo (LCR): Desde el diagnóstico de su enfermedad y
CENTRO MÉDICO POLK MANUAL DE POLITICA Y PROCEDIMIENTO SERVICIOS FINANCIEROS PARA PACIENTES
 CENTRO MÉDICO POLK MANUAL DE POLITICA Y PROCEDIMIENTO SERVICIOS FINANCIEROS PARA PACIENTES FLOYD Polk Medical Center TITULO: Política de Facturación y Colecciones PROPÓSITO: Es el objetivo de esta política
CENTRO MÉDICO POLK MANUAL DE POLITICA Y PROCEDIMIENTO SERVICIOS FINANCIEROS PARA PACIENTES FLOYD Polk Medical Center TITULO: Política de Facturación y Colecciones PROPÓSITO: Es el objetivo de esta política
GESTIÓN ASISTENCIAL INTEGRAL CONSENTIMIENTO INFORMADO CONSENTIMIENTO INFORMADO PARA FRACTURA DEL RADIO INTRODUCCIÓN
 PÁGINA 1 DE 5 Apreciado Usuario: INTRODUCCIÓN Usted va a ser sometido a un procedimiento quirúrgico, invasivo no quirúrgico o terapéutico por el grupo de especialistas del Hospital Universitario San Ignacio.
PÁGINA 1 DE 5 Apreciado Usuario: INTRODUCCIÓN Usted va a ser sometido a un procedimiento quirúrgico, invasivo no quirúrgico o terapéutico por el grupo de especialistas del Hospital Universitario San Ignacio.
CONVOCATORIA. Premio Especial XXX Aniversario de FUNSALUD, en Investigación en Salud Pública
 La Fundación Mexicana para la Salud, A. C., tiene por objeto contribuir al fortalecimiento científico y tecnológico en materia de salud, mediante el impulso a la investigación, a la formación de recursos
La Fundación Mexicana para la Salud, A. C., tiene por objeto contribuir al fortalecimiento científico y tecnológico en materia de salud, mediante el impulso a la investigación, a la formación de recursos
Sociedad Universitaria de Neurociencias SUN DIRECCIÓN DE INVESTIGACIÓN
 Universidad Nacional Autónoma de Honduras, UNAH Sociedad Universitaria de Neurociencias SUN DIRECCIÓN DE INVESTIGACIÓN SOLICITUD DE LA SUN PARA EFECTUAR INVESTIGACIONES I. INFORMACIÓN GENERAL I-A. Título
Universidad Nacional Autónoma de Honduras, UNAH Sociedad Universitaria de Neurociencias SUN DIRECCIÓN DE INVESTIGACIÓN SOLICITUD DE LA SUN PARA EFECTUAR INVESTIGACIONES I. INFORMACIÓN GENERAL I-A. Título
Díganos si tiene alguna duda o necesita más información. Le atenderemos con mucho gusto.
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
Día Efectivo / / Número del Seguro Social del Asegurado - -
 Medical Record # INFORMACION DEL PACIENTE Centro Avanzado de Cuidado Perinatal A service of Lehigh Valley Hospital Medicina Maternal Fetal A practice of Lehigh Valley Physician Group Información del Contacto
Medical Record # INFORMACION DEL PACIENTE Centro Avanzado de Cuidado Perinatal A service of Lehigh Valley Hospital Medicina Maternal Fetal A practice of Lehigh Valley Physician Group Información del Contacto
Reglamento del Comité de Ética en Investigación Hospital San José Callao JUNIO
 RGLAMENTO DEL COMITÉ DE ÉTICA EN INVESTIGACIÓN HOSPITAL SAN JOSÉ - CALLAO CARMEN DE LA LEGUA REYNOSO CALLAO PERÚ 2008 JUNIO - 2008 1 ÍNDICE PÁG. INTRODUCCIÓN 4 TÍTULO I 5 Composición, Finalidad, Objetivos,
RGLAMENTO DEL COMITÉ DE ÉTICA EN INVESTIGACIÓN HOSPITAL SAN JOSÉ - CALLAO CARMEN DE LA LEGUA REYNOSO CALLAO PERÚ 2008 JUNIO - 2008 1 ÍNDICE PÁG. INTRODUCCIÓN 4 TÍTULO I 5 Composición, Finalidad, Objetivos,
MODULO 8. INVESTIGACION EN EL ICTUS
 MODULO 8. INVESTIGACION EN EL ICTUS Dr. Jose Mª Ramírez Moreno Unidad de Ictus. Hospital Universitario Infanta Cristina. Badajoz INDICE: 1. Significado y participación en estudios de investigación en el
MODULO 8. INVESTIGACION EN EL ICTUS Dr. Jose Mª Ramírez Moreno Unidad de Ictus. Hospital Universitario Infanta Cristina. Badajoz INDICE: 1. Significado y participación en estudios de investigación en el
ELABORACIÓN DE PROTOCOLOS DE INVESTIGACIÓN
 DIRECCIÓN DE Fecha: JUN 15 Hoja: 1 de 5 Elaboró: Revisó: Autorizó: Puesto Encargada de la Mesa de Control del Comité de Investigación Secretaria del Comité de Investigación Director de Investigación Firma
DIRECCIÓN DE Fecha: JUN 15 Hoja: 1 de 5 Elaboró: Revisó: Autorizó: Puesto Encargada de la Mesa de Control del Comité de Investigación Secretaria del Comité de Investigación Director de Investigación Firma
Ángela María Cabrera Solarte Trabajadora Social Coordinadora SIAU
 E.S.E HOSPITAL DEPARTAMENTAL SAN ANTONIO VILLAMARIA DERECHOS Y DEBERES DE LOS USUARIOS Ángela María Cabrera Solarte Trabajadora Social Coordinadora SIAU POLITICA DE DERECHOS Y DEBERES DE LOS USUARIOS La
E.S.E HOSPITAL DEPARTAMENTAL SAN ANTONIO VILLAMARIA DERECHOS Y DEBERES DE LOS USUARIOS Ángela María Cabrera Solarte Trabajadora Social Coordinadora SIAU POLITICA DE DERECHOS Y DEBERES DE LOS USUARIOS La
Derechos y Responsabilidades del Paciente
 Derechos y Responsabilidades del Paciente El Centro Médico Broadlawns se ha comprometido a respetar y proteger los derechos de sus pacientes. Honrar y Respetar estos derechos es una parte importante para
Derechos y Responsabilidades del Paciente El Centro Médico Broadlawns se ha comprometido a respetar y proteger los derechos de sus pacientes. Honrar y Respetar estos derechos es una parte importante para
GUÍA DE AUTOAYUDA # 1: Cómo solicitar una audiencia con Medi-Cal?
 GUÍA DE AUTOAYUDA # 1: Cómo solicitar una audiencia con Medi-Cal? Las 5 cosas más importantes que usted debe saber Medi-Cal debe enviarle una notificación de acción por lo menos 10 días antes de que cambien
GUÍA DE AUTOAYUDA # 1: Cómo solicitar una audiencia con Medi-Cal? Las 5 cosas más importantes que usted debe saber Medi-Cal debe enviarle una notificación de acción por lo menos 10 días antes de que cambien
1. DOCUMENTO DE INFORMACIÓN PARA (*) TRATAMIENTO ENDOVASCULAR DEL ANEURISMA DE AORTA ABDOMINAL
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
Carta de derechos y deberes. de los pacientes y usuarios de Asepeyo en relación con la salud y la atención sanitaria
 Carta de derechos y deberes de los pacientes y usuarios de Asepeyo en relación con la salud y la atención sanitaria Asepeyo, Mutua Colaboradora con la Seguridad Social nº 151 Autor Dirección de Asistencia
Carta de derechos y deberes de los pacientes y usuarios de Asepeyo en relación con la salud y la atención sanitaria Asepeyo, Mutua Colaboradora con la Seguridad Social nº 151 Autor Dirección de Asistencia
Taller: Comités Hospitalarios de Bioética. DR. JOSÉ TORRES MEJÍA Director Operativo Comisión Nacional de Bioética
 Taller: Comités Hospitalarios de Bioética DR. JOSÉ TORRES MEJÍA Director Operativo Comisión Nacional de Bioética Antecedentes COMISIÓN NACIONAL Caso Karen Quinlan 1976 (New Jersey, EUA) Coma profundo por
Taller: Comités Hospitalarios de Bioética DR. JOSÉ TORRES MEJÍA Director Operativo Comisión Nacional de Bioética Antecedentes COMISIÓN NACIONAL Caso Karen Quinlan 1976 (New Jersey, EUA) Coma profundo por
CRÉDITO FAMILIAR S.A. DE C.V., SOCIEDAD FINANCIERA DE OBJETO MÚLTIPLE, ENTIDAD REGULADA, GRUPO FINANCIERO SCOTIABANK INVERLAT.
 MANDATO DEL COMITÉ DE RIESGOS DEL CONSEJO DE ADMINISTRACIÓN DE GRUPO FINANCIERO SCOTIABANK INVERLAT, S.A. DE C.V. (el Grupo) SCOTIABANK INVERLAT, S.A., INSTITUCIÓN DE BANCA MÚLTIPLE, GRUPO FINANCIERO SCOTIABANK
MANDATO DEL COMITÉ DE RIESGOS DEL CONSEJO DE ADMINISTRACIÓN DE GRUPO FINANCIERO SCOTIABANK INVERLAT, S.A. DE C.V. (el Grupo) SCOTIABANK INVERLAT, S.A., INSTITUCIÓN DE BANCA MÚLTIPLE, GRUPO FINANCIERO SCOTIABANK
UNIDAD DE REHABILITACION E INTEGRACION SOCIAL EXPEDIENTE CLINICO NOMBRE DEL PACIENTE.
 UNIDAD DE REHABILITACION E INTEGRACION SOCIAL EXPEDIENTE CLINICO NOMBRE DEL PACIENTE. No. DE EXPEDIENTE / 2013 SISTEMA NACIONAL PARA EL DESARROLLO INTEGRAL DE LA FAMILIA DIRECCIÓN DE REHABILITACIÓN Y ASISTENCIA
UNIDAD DE REHABILITACION E INTEGRACION SOCIAL EXPEDIENTE CLINICO NOMBRE DEL PACIENTE. No. DE EXPEDIENTE / 2013 SISTEMA NACIONAL PARA EL DESARROLLO INTEGRAL DE LA FAMILIA DIRECCIÓN DE REHABILITACIÓN Y ASISTENCIA
CONSENTIMIENTO PARA BIOPSIA TESTICULAR CON FINALIDAD REPRODUCTIVA
 CONSENTIMIENTO PARA BIOPSIA TESTICULAR CON FINALIDAD REPRODUCTIVA FECHA NOMBRE DEL PACIENTE DOCUMENTO DE IDENTIDAD EDAD DOMICILIO TEL NOMBRE DE LA PAREJA DOCUMENTO DE IDENTIDAD Cobertura.- Por el presente
CONSENTIMIENTO PARA BIOPSIA TESTICULAR CON FINALIDAD REPRODUCTIVA FECHA NOMBRE DEL PACIENTE DOCUMENTO DE IDENTIDAD EDAD DOMICILIO TEL NOMBRE DE LA PAREJA DOCUMENTO DE IDENTIDAD Cobertura.- Por el presente
Rechazo a las actuaciones médicas.
 Rechazo a las actuaciones médicas. Dr. Gregorio Jesús Palacios García-Cervigón. Servicio de Medicina Interna HUFA Instituto de ética médica Francisco Vallés. Universidad Europea de Madrid. gpalacios @fhalcorcon.es
Rechazo a las actuaciones médicas. Dr. Gregorio Jesús Palacios García-Cervigón. Servicio de Medicina Interna HUFA Instituto de ética médica Francisco Vallés. Universidad Europea de Madrid. gpalacios @fhalcorcon.es
Prevención del Dolor en Miembro Fantasma Tras Amputación Transtibial (MFTAT)
 Apéndice 2A Prevención del Dolor en Miembro Fantasma Tras Amputación Transtibial (MFTAT) Ensayo multicéntrico, controlado, doble ciego, aleatorizado que compara terapia intravenosa óptima versus terapia
Apéndice 2A Prevención del Dolor en Miembro Fantasma Tras Amputación Transtibial (MFTAT) Ensayo multicéntrico, controlado, doble ciego, aleatorizado que compara terapia intravenosa óptima versus terapia
GUÍA PARA LA ELABORACIÓN DE INFORMES TECNICOS DE INSPECCION
 GUÍA PARA LA ELABORACIÓN DE INFORMES TECNICOS DE INSPECCION (Artículos 40 y 41 Ley N 41 del 1 de Julio 1998) 1 ANAM AUTORIDAD NACIONAL DEL AMBIENTE Ministra encargada de Asuntos Relacionados Con el Ambiente.
GUÍA PARA LA ELABORACIÓN DE INFORMES TECNICOS DE INSPECCION (Artículos 40 y 41 Ley N 41 del 1 de Julio 1998) 1 ANAM AUTORIDAD NACIONAL DEL AMBIENTE Ministra encargada de Asuntos Relacionados Con el Ambiente.
PARA SOMETER A EVALUACIÓN UN PROYECTO DE INVESTIGACIÓN SE REQUIERE: 1) PROTOCOLO: el cual debe tener la siguiente información:
 PARA SOMETER A EVALUACIÓN UN PROYECTO DE INVESTIGACIÓN SE REQUIERE: 1) PROTOCOLO: el cual debe tener la siguiente información: I) DATOS GENERALES: a) Título, el cual deberá estar acorde con el objetivo
PARA SOMETER A EVALUACIÓN UN PROYECTO DE INVESTIGACIÓN SE REQUIERE: 1) PROTOCOLO: el cual debe tener la siguiente información: I) DATOS GENERALES: a) Título, el cual deberá estar acorde con el objetivo
1. DOCUMENTO DE INFORMACIÓN PARA (*) HIDROCELECTOMIA, EXTIRPACIÓN DE QUISTE DE EPIDIDIMO Y/O QUISTE DE CORDÓN ESPERMATICO
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
TERCERA CONVOCATORIA PARA ASESORÍA PERSONALIZADA MENTORING EN REDACCIÓN DE ARTÍCULOS CIENTÍFICOS PARA INVESTIGADORES DE ESSALUD
 TERCERA CONVOCATORIA PARA ASESORÍA PERSONALIZADA MENTORING EN REDACCIÓN DE ARTÍCULOS CIENTÍFICOS PARA INVESTIGADORES DE ESSALUD I. OBJETIVO Fomentar la producción de publicaciones científicas en EsSalud,
TERCERA CONVOCATORIA PARA ASESORÍA PERSONALIZADA MENTORING EN REDACCIÓN DE ARTÍCULOS CIENTÍFICOS PARA INVESTIGADORES DE ESSALUD I. OBJETIVO Fomentar la producción de publicaciones científicas en EsSalud,
Protocolo Manejo de Accidentes Cortopunzantes y exposición a fluidos corporales de riesgo.
 1 PROCEDIMIENTO SEGURO DE TRABAJO PREVENCIÓN DE RIESGOS MANEJO DE ACCIDENTES CORTOPUNZANTES Y EXPOSICIÓN A FLUIDOS CORPORALES DE RIESGO Protocolo Manejo de Accidentes Cortopunzantes y exposición a fluidos
1 PROCEDIMIENTO SEGURO DE TRABAJO PREVENCIÓN DE RIESGOS MANEJO DE ACCIDENTES CORTOPUNZANTES Y EXPOSICIÓN A FLUIDOS CORPORALES DE RIESGO Protocolo Manejo de Accidentes Cortopunzantes y exposición a fluidos
BIENVENIDO AL HOSPITAL SANITAS LA MORALEJA
 BIENVENIDO AL HOSPITAL SANITAS LA MORALEJA Un hospital que desde ahora se pone a su entera disposición para ofrecerle, no sólo los mejores cuidados médicos, sino también un servicio destinado a hacerle
BIENVENIDO AL HOSPITAL SANITAS LA MORALEJA Un hospital que desde ahora se pone a su entera disposición para ofrecerle, no sólo los mejores cuidados médicos, sino también un servicio destinado a hacerle
GESTIÓN DE MEDICAMENTOS
 GESTIÓN DE MEDICAMENTOS 1 OBJETIVO ASEGURAR LA EXISTENCIA Y PROVISIÓN DE LOS MEDICAMENTOS MÁS ADECUADOS A LAS NECESIDADES DEL HOSPITAL Y PRESTAR UNA ATENCIÓN FARMACÉUTICA DE CALIDAD PARA CONSEGUIR UNA
GESTIÓN DE MEDICAMENTOS 1 OBJETIVO ASEGURAR LA EXISTENCIA Y PROVISIÓN DE LOS MEDICAMENTOS MÁS ADECUADOS A LAS NECESIDADES DEL HOSPITAL Y PRESTAR UNA ATENCIÓN FARMACÉUTICA DE CALIDAD PARA CONSEGUIR UNA
CONSENTIMIENTO INFORMADO PARA LA COHORTE DE ENFERMEDADES RARAS (DONANTES)
 - 1 - CONSENTIMIENTO INFORMADO PARA LA COHORTE DE ENFERMEDADES RARAS (DONANTES) CONTROLADA Nº DESTINATARIO FECHA ENTREGA ENTREGADO POR Nombre Firma NO CONTROLADA REVISIÓN REALIZADO FECHA APROBADO FECHA
- 1 - CONSENTIMIENTO INFORMADO PARA LA COHORTE DE ENFERMEDADES RARAS (DONANTES) CONTROLADA Nº DESTINATARIO FECHA ENTREGA ENTREGADO POR Nombre Firma NO CONTROLADA REVISIÓN REALIZADO FECHA APROBADO FECHA
Columbia St. Mary's, Inc.
 Columbia St. Mary's, Inc. CONSENTIMIENTO PARA PARTICIPAR EN UN ESTUDIO DE INVESTIGACIÓN y AUTORIZACIÓN PARA USAR O DIVULGAR INFORMACIÓN MÉDICA PROTEGIDA PARA INVESTIGACION (HIPAA) Título: Curar sin daños:
Columbia St. Mary's, Inc. CONSENTIMIENTO PARA PARTICIPAR EN UN ESTUDIO DE INVESTIGACIÓN y AUTORIZACIÓN PARA USAR O DIVULGAR INFORMACIÓN MÉDICA PROTEGIDA PARA INVESTIGACION (HIPAA) Título: Curar sin daños:
2. El investigador principal, y la mayoría de los miembros del equipo investigador, deben trabajar activamente en Atención Primaria en España.
 La Red Española de Atención Primaria (REAP) abre la convocatoria de sus becas para presentar los proyectos de investigación. La cuantía de las becas será de 5.000 euros para la solicitud o solicitudes
La Red Española de Atención Primaria (REAP) abre la convocatoria de sus becas para presentar los proyectos de investigación. La cuantía de las becas será de 5.000 euros para la solicitud o solicitudes
Bases Postura Online
 Descripción del Servicio Bases Postura Online Postura Online es un servicio que permite realizar posturas (ofertas) en remates judiciales de propiedades a través de Internet, con el objetivo de adquirir
Descripción del Servicio Bases Postura Online Postura Online es un servicio que permite realizar posturas (ofertas) en remates judiciales de propiedades a través de Internet, con el objetivo de adquirir
FORMATO PARA LA PRESENTACIÓN DE PROYECTOS PARA EVALUACIÓN DEL COMITÉ DE BIOÉTICA
 FACULTAD DE MEDICINA VETERINARIA Y DE ZOOTECNIA COMITÉ DE BIOÉTICA FORMATO PARA LA PRESENTACIÓN DE PROYECTOS PARA EVALUACIÓN DEL COMITÉ DE BIOÉTICA ***FAVOR DILIGENCIAR EL FORMATO EN SU TOTALIDAD, SI HAY
FACULTAD DE MEDICINA VETERINARIA Y DE ZOOTECNIA COMITÉ DE BIOÉTICA FORMATO PARA LA PRESENTACIÓN DE PROYECTOS PARA EVALUACIÓN DEL COMITÉ DE BIOÉTICA ***FAVOR DILIGENCIAR EL FORMATO EN SU TOTALIDAD, SI HAY
ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN
 Universidad Ricardo Palma Facultad de Medicina Humana ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN Esquema de presentación para la elaboración del proyecto de trabajo de los Residentes del Segundo Año.
Universidad Ricardo Palma Facultad de Medicina Humana ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN Esquema de presentación para la elaboración del proyecto de trabajo de los Residentes del Segundo Año.
