FUNDAMENTOS TEÓRICOS PROPIEDADES FÍSICAS
|
|
|
- María Ponce Córdoba
- hace 6 años
- Vistas:
Transcripción
1 Trabajo Práctico de Laboratorio N 1 Tema: Hidrocarburos OBJETIVOS Caracterizar los distintos tipos de hidrocarburos (alcanos, alquenos, alquinos y aromáticos) mediante sus propiedades físicas. Diferenciarlos, basándose en sus propiedades químicas. Justificar los comportamientos observados sobre la base de la estructura de los mismos. FUNDAMENTOS TEÓRICOS PROPIEDADES FÍSICAS Las propiedades físicas de los alcanos, cicloalcanos, alquenos y alquinos son consecuencia del hecho de que sus moléculas sólo presentan enlaces covalentes no polares, razón por la cual se mantienen unidas por medio de fuerzas débiles (fuerzas de Van der Waals) y de alcance limitado; sólo actúan entre partes de moléculas diferentes en contacto íntimo es decir, entre las superficies moleculares. Por lo cual esperaríamos que, dentro de una familia, cuanto mayor sea la molécula, y por consiguiente su superficie, más intensas son las fuerzas intermoleculares. Los procesos de ebullición y de fusión requieren vencer las fuerzas intermoleculares de un líquido y un sólido, las cuales se incrementan al crecer el tamaño molecular. Por lo tanto los puntos de fusión y de ebullición suben al aumentar el peso molecular de los hidrocarburos mencionados. Salvo para los homólogos más pequeños, el punto de ebullición aumenta de 20 a 30 grados por cada carbono que se agrega a la cadena. Sin embargo, una ramificación disminuye el punto de ebullición con respecto al isómero de cadena recta. Cuanto más numerosas son las ramificaciones, menor es el punto de ebullición correspondiente. Ilustración Los hidrocarburos 1 Los hidrocarburos extraídos extraídos directamente directamente de de formaciones geológicas en en estado estado líquido líquido se conocen se conocen comúnmente comúnmente con el nombre con el de petróleo, nombre de mientras petróleo, que mientras los que que se encuentran los que en estado se gaseoso encuentran se les conoce en estado como gaseoso gas se natural. les conoce La explotación como gas natural. comercial La explotación de los hidrocarburos comercial constituye de una actividad los económica de primera importancia, hidrocarburos constituye una pues forman parte de los principales actividad económica de primera combustibles fósiles (petróleo y gas natural), importancia, así como pues de todo forman tipo de parte plásticos, de ceras y los lubricantes. principales combustibles fósiles (petróleo y gas natural), así como de todo tipo de plásticos, ceras y lubricantes. Guía de Trabajos Prácticos de Laboratorio Catedra Química Orgánica y Biológica-Año
2 En particular, los cuatro primeros n-alcanos son gases, los trece siguientes (C 5 C 17 ) son líquidos y los de 18 átomos de carbono o más son sólidos. En lo que respecta a los alquenos y alquinos, en general, los cuatro primeros son gases y los de 5 a 10 átomos de carbono son líquidos. En cuanto a la solubilidad, siguiendo la regla empírica: una sustancia disuelve a otra similar, los hidrocarburos son solubles en disolventes no polares como benceno, éter y cloroformo, e insolubles en agua y otros disolventes fuertemente polares. Todos son menos densos que el agua. Los puntos de ebullición de muchos derivados del benceno se relacionan con sus momentos dipolares. Por ejemplo, el p-diclorobenceno simétrico tiene momento dipolar cero y el punto de ebullición más bajo, en comparación con sus isómeros meta y orto. Los derivados del benceno tienden a ser más simétricos que los compuestos alifáticos semejantes y, por lo tanto, se empacan mejor en los cristales y tienen puntos de fusión más elevados. El benceno y los demás hidrocarburos aromáticos son ligeramente más densos que sus análogos no aromáticos, pero son menos densos que el agua. Por lo general, los hidrocarburos aromáticos y los derivados halogenados son insolubles en agua, aunque algunos de los derivados con grupos funcionales muy polares (fenol, ácido benzoico, etc.) son moderadamente solubles en ella. PROPIEDADES QUÍMICAS Los alcanos son la clase menos reactiva de los compuestos orgánicos. No reaccionan con ácidos ni bases fuertes y son inertes frente a oxidantes como el permanganato de potasio y el dicromato de sodio. De allí el nombre de parafinas, atribuido antiguamente a estos hidrocarburos (nombre que proviene del latín: parum affinis sin afinidad suficiente ). Los alcanos solo dan reacciones de COMBUSTIÓN, con el O 2, y de SUSTITUCIÓN de uno o varios de sus hidrógenos por halógenos; reacción que se lleva a cabo a través de la generación de radicales libres, bajo condiciones vigorosas y da generalmente mezclas de productos. La reacción típica de los alquenos y los alquinos es la ADICIÓN ELECTROFÍLICA. En la misma se combinan dos moléculas para producir una Guía de Trabajos Prácticos de Laboratorio Catedra Química Orgánica y Biológica-Año
3 sola (por eso es una adición). Los electrones π de los dobles y triples enlaces están espacialmente más disponibles para reactivos buscadores de electrones (reactivos electrófílicos), que los electrones del enlace σ (por eso la adición es electrofílica). Así, entre otros reactivos, adicionan H 2, halógenos (X 2 ), halogenuros de hidrógeno (HX), H 2 O, etc. Como ejemplo práctico de este tipo de reacciones veremos la adición de halógenos. El Cloro o el Bromo convierten fácilmente a los alquenos en compuestos saturados que contienen dos átomos de halógeno unidos a carbonos adyacentes; generalmente el yodo no reacciona. La adición de bromo es sumamente útil para detectar el doble enlace carbonocarbono. Una solución de bromo en tetracloruro de carbono es roja; el dihalogenuro, al igual que el alqueno, es incoloro. La decoloración rápida del bromo en tetracloruro de carbono es característica de los compuestos con dobles y triples enlaces. Sin embargo los hidrocarburos aromáticos no la dan. Otra reacción de los hidrocarburos insaturados, que también permite diferenciarlos de los saturados y de los aromáticos, es la formación de glicoles, con permanganato de potasio (Reacción de Baeyer). KMnO 4 (dil) alcalino, frío 1,2-diol Cuando un alqueno se agrega a una solución acuosa de permanganato de potasio (color morado intenso), la misma cambia su color al café opaco del MnO 2. Los alcanos y los hidrocarburos aromáticos no dan esta reacción. Las reacciones características del benceno y de los compuestos que lo contengan implican sustitución, en la cual se conserva el sistema anular estabilizado por resonancia. Debido a la misma, los electrones π (que se encuentran por arriba y por debajo del anillo) están más involucrados en mantener unidos los núcleos de los átomos de carbono, que los electrones π de un doble enlace C C alifático; razón por la cual no dan reacciones de adición como los alquenos. De todas formas, y en comparación con los electrones σ, estos electrones π están relativamente sueltos y disponibles para un reactivo que busca electrones o Guía de Trabajos Prácticos de Laboratorio Catedra Química Orgánica y Biológica-Año
4 electrofílico. Por lo tanto las reacciones típicas del anillo bencénico son de SUSTITUCIÓN ELECTROFÍLICA AROMATICA. La sustitución electrofílica aromática incluye una amplia gama de reacciones: nitración, halogenación, sulfonación y reacciones de Friedel-Crafts, las cuales las experimentan casi todos los anillos aromáticos. Por otro lado los derivados hidroxilados del benceno dan una reacción particular con el FeCl 3 con el cual forman complejos coloreados que van del verde hasta el azul y del violeta al rojo, y estructuras inespecíficas; reacción que no dan los alcanos ni los hidrocarburos insaturados. PARTE EXPERIMENTAL Para llevar a cabo el presente práctico se usarán: Como fuentes de hidrocarburos saturados: - Gas natural: solo contiene los alcanos más volátiles, es decir, los de bajo peso molecular. Su composición aproximada es: 70% de metano, 10% de etano, 15% de propano y pequeñas cantidades de alcanos superiores. Sin embargo la misma varía dependiendo de la fuente de la cual se obtenga el gas natural. - Aceite lubricante: La fuente principal de alcanos es el petróleo del cual, por destilación, se obtienen diferentes fracciones de composición distinta, de acuerdo a su peso molecular. La fracción de aceite lubricante a menudo contiene grandes cantidades de alcanos de cadena larga (C 16 -C 34 ), con puntos de ebullición entre ºC. A veces se les llama aceites minerales porque se derivan del petróleo, al cual se considera un mineral. - Parafina: Es una mezcla purificada de alcanos de alto peso molecular con puntos de fusión muy superiores a la temperatura ambiente. Normalmente se la obtiene junto con el aceite lubricante del cual se la separa por enfriamiento. De esta manera cristaliza, precipita y se la separa por filtración. Si la misma permaneciera en el aceite, en días fríos podría cristalizar y obstruir los oleoductos. Hidrocarburos insaturados: - Isobutileno: Un alcohol se convierte en un alqueno por deshidratación: la eliminación de una molécula de agua. Esta reacción requiere la presencia de un ácido y calor como catalizadores. Guía de Trabajos Prácticos de Laboratorio Catedra Química Orgánica y Biológica-Año
5 ácido calor H 2 O alcohol alqueno agua Obtendremos el Isobutileno, en el medio de reacción, a partir de alcohol terbutílico el cual se deshidrata con mucha facilidad. - Acetileno: lo obtendremos en el medio de reacción a partir de carburo de calcio. CaC H 2 O H - C C - H + Ca(OH) 2 Carburo de calcio Acetileno cal hidratada - Aceite comestible: se lo usará para visualizar la presencia de compuestos con dobles enlaces, en una sustancia de uso común en nuestra vida diaria. La composición correcta de los aceites vegetales se estudiará más adelante en la asignatura. Hidrocarburos aromáticos: - Benceno y Resorcina (un derivado dihidroxilado del benceno) MATERIAL NECESARIO (POR GRUPO) REACTIVOS A USAR * Gradilla con 15 tubos de ensayos. * Sol. de KMnO 4 al 3%. * 9 pipetas de 5 ml (una por cada reactivo líquido). * Sol. de Br 2 en CCl 4. * Vaso de ppdos pequeño con parafina. * Sol. 0,5% de I 2 en etanol. * Vaso de ppdos pequeño con aceite lubricante * Sol. sobresat. de FeCl 3. * Vaso de ppdos pequeño con aceite comestible. * Alcohol ter-butilico. * 2 espátulas. * Ácido Sulfúrico. * 2 pinzas de madera. * CaC 2. * Benceno, Resorcina. TÉCNICAS Propiedades físicas A) Puntos de Fusión y de Ebullición Observe el estado físico de las sustancias provistas por la cátedra y, en cada caso, relaciónelo con la estructura molecular de los compuestos que las forman. Guía de Trabajos Prácticos de Laboratorio Catedra Química Orgánica y Biológica-Año
6 Consulte los datos de puntos de ebullición y de fusión que figuran en las tablas anexas y, en base a ellos, deduzca si esos estados físicos son los esperados. B) Solubilidad Tome una gradilla con 4 tubos de ensayos. En uno coloque 1 ml de aceite lubricante, en otro unos trocitos de parafina, en un tercero 1 ml de aceite de cocina y, en el último, 1 ml de benceno. Agregue 2 ml de agua a cada tubo. Agite y observe si alguna de las sustancias logra disolverse. Repita el ensayo usando como disolvente benceno, éter, cloroformo o CCl 4. Propiedades Químicas 1. Reacción de Baeyer: tome una gradilla con 5 tubos de ensayos conteniendo, cada uno, unos 3 ml de solución de KMnO 4 al 3%. Proceda con los mismos de acuerdo al siguiente detalle: Tubo 1: agregue, aproximadamente,1 ml de aceite lubricante. Tubo 2: agregue trozos pequeños de parafina. Tubo 3: agregue 1 ml de alcohol ter-butílico y luego LENTAMENTE unas gotas de ácido sulfúrico. Tubo 4: agregue un pequeño trozo de CaC 2. Tubo 5: agregue 1 ml de Benceno. En todos los casos explique y fundamente los resultados observados. 2. Reacción con Yodo: tome una gradilla con 5 tubos de ensayos conteniendo, cada uno de ellos, unos 2 ml de solución de Yodo en etanol al 0,5 %. Proceda con los mismos de acuerdo al siguiente detalle: Tubo 1: agregue 1 ml de aceite lubricante. Tubo 2: agregue trozos pequeños de parafina. Tubo 3: agregue 1 ml de alcohol ter-butílico y luego, LENTAMENTE, unas gotas de ácido sulfúrico. Tubo 4: agregue un pequeño trozo de CaC 2 y luego, LENTAMENTE, unas gotas de agua. Tubo 5: agregue 1 ml de Benceno. En todos los casos explique y fundamente los resultados observados. Guía de Trabajos Prácticos de Laboratorio Catedra Química Orgánica y Biológica-Año
7 3. Reacción con Bromo en CCl 4 : tome una gradilla con 3 tubos de ensayos conteniendo: Tubo 1: 2 ml de aceite lubricante. Tubo 2: 2 ml de aceite comestible. Tubo 3: 2 ml de benceno. Añada a cada uno 2 o 3 gotas de la solución de Bromo en CCl 4. Explique y fundamente los resultados obtenidos. 4. Reacción con FeCl 3 : tome una gradilla con 4 tubos de ensayos conteniendo: Tubo 1: 2 ml de aceite lubricante, aproximadamente. Tubo 2: 2 ml de aceite comestible, aproximadamente. Tubo 3: 2 ml de benceno. Tubo 4: unos cristales de resorcina + 1 ml de agua. Añada a cada uno unas 2 o 3 gotas de solución de FeCl 3. Explique y fundamente lo observado. ACTIVIDADES PARA EL ALUMNO 1 Elabore un cuadro comparativo de las propiedades físicas y químicas de los distintos tipos de hidrocarburos. 2 Qué reacción usaría para diferenciar los alcanos de los hidrocarburos insaturados? 3 Cuál reacción emplearía para diferenciar un hidrocarburo insaturado de uno aromático? Apéndice Preparación de solución de Br 2 en CCl 4 : Disolver 2 gr de Br 2 en 100 ml de CCl 4. PRECAUCIÓN! El bromo produce graves quemaduras. Preparación de solución de I 2 /KI: Adicionar 200 g de Yoduro de potasio y 100 g de Yodo a 800 ml de agua destilada, agitar hasta solubilizar los reactivos. Guía de Trabajos Prácticos de Laboratorio Catedra Química Orgánica y Biológica-Año
ESTRUCTURA DE COMPUESTOS ORGÁNICOS
 ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
Tema 9. Química Orgánica
 Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN
 PRACTICAS DE LABORATORIO QUIMICA 2010 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN I. INTRODUCCIÓN Los compuestos orgánicos que se presentan en la
PRACTICAS DE LABORATORIO QUIMICA 2010 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN I. INTRODUCCIÓN Los compuestos orgánicos que se presentan en la
Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento conteste las siguientes preguntas.
 EXPERIMENTO 3 Reacción de Hidrocarburos Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento conteste
EXPERIMENTO 3 Reacción de Hidrocarburos Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento conteste
Clasificación de los alquenos. Nomenclatura de los alquenos. Nomenclatura de los alquenos, continuacion
 ALQUENOS Los alquenos son hidrocarburos insaturados que contienen uno o más dobles enlaces C = C. El nombre de los hidrocarburos insaturados se debe a que los carbonos que sostienen el doble enlace todavía
ALQUENOS Los alquenos son hidrocarburos insaturados que contienen uno o más dobles enlaces C = C. El nombre de los hidrocarburos insaturados se debe a que los carbonos que sostienen el doble enlace todavía
ENLACE QUÍMICO 2º BACH EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. H-CHO H C = O : CH 3 OH H C O H H H H C O C H H H CH 3 OCH 3
 EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
CUÁLES SON LAS REACCIONES PRINCIPALES Y LOS MÉTODOS DE OBTENCIÓN MÁS COMUNES DE LOS COMPUESTOS ORGÁNICOS?
 CUÁLES SON LAS REACCIONES PRINCIPALES Y LOS MÉTODOS DE OBTENCIÓN MÁS COMUNES DE LOS COMPUESTOS ORGÁNICOS? Desempeño Esperado: El estudiante reconoce, identifica y completa algunos métodos de obtención
CUÁLES SON LAS REACCIONES PRINCIPALES Y LOS MÉTODOS DE OBTENCIÓN MÁS COMUNES DE LOS COMPUESTOS ORGÁNICOS? Desempeño Esperado: El estudiante reconoce, identifica y completa algunos métodos de obtención
19 Y 20 ALCOHOLES FENOLES, TIOLES Y ETERES. Licda. Lilian Judith Guzmán Melgar ALCOHOLES
 ALCOHOLES FENOLES, TIOLES Y ETERES Licda. Lilian Judith Guzmán Melgar 2016 19 Y 20 ALCOHOLES CLASIFICACIÓN Los alcoholes se pueden clasificar en tres clases Los alcoholes pueden considerarse los derivados
ALCOHOLES FENOLES, TIOLES Y ETERES Licda. Lilian Judith Guzmán Melgar 2016 19 Y 20 ALCOHOLES CLASIFICACIÓN Los alcoholes se pueden clasificar en tres clases Los alcoholes pueden considerarse los derivados
19 y20/13 ALCOHOLES, FENOLES, ÉTERES, TIOÉTERES Y
 19 y20/13 ALCOHOLES, FENOLES, ÉTERES, TIOÉTERES Y TIOLES Licda. Lilian Judith Guzmán Melgar ALCOHOLES Los alcoholes pueden considerarse los derivados orgánicos del agua, donde uno de los hidrógenos es
19 y20/13 ALCOHOLES, FENOLES, ÉTERES, TIOÉTERES Y TIOLES Licda. Lilian Judith Guzmán Melgar ALCOHOLES Los alcoholes pueden considerarse los derivados orgánicos del agua, donde uno de los hidrógenos es
JUNIO FASE GENERAL QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
QUÍMICA. 2º Bachilerrato orgánica Estereoisomería:
 TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López.
 Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Práctica 6. Propiedades físicas y enlace químico
 Práctica 6. Propiedades físicas y enlace químico Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué tipo de enlace predomina
Práctica 6. Propiedades físicas y enlace químico Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué tipo de enlace predomina
EJEMPLOS DE PREGUNTA. Prueba de QUÍMICA. febrero 2010
 EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
Guía del docente. 1. Descripción curricular:
 Guía del docente. 1. Descripción curricular: - Nivel: 3º medio. - Subsector: Ciencias Químicas. - Unidad temática: Reactividad en química orgánica, hidrocarburos. - Palabras claves: reacciones orgánicas,
Guía del docente. 1. Descripción curricular: - Nivel: 3º medio. - Subsector: Ciencias Químicas. - Unidad temática: Reactividad en química orgánica, hidrocarburos. - Palabras claves: reacciones orgánicas,
Quimica orgánica básica
 Quimica orgánica básica Química orgánica básica La química orgánica es el estudio de los compuestos de carbono. Los átomos de carbono son únicos en su habilidad de formar cadenas muy estables y anillos,
Quimica orgánica básica Química orgánica básica La química orgánica es el estudio de los compuestos de carbono. Los átomos de carbono son únicos en su habilidad de formar cadenas muy estables y anillos,
ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN INTRODUCCIÓN
 Revista de Química. Vol. X. No l. Junio de 1996 ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN Maribel Guzmán C.* INTRODUCCIÓN Los alquenos suelen comportarse como nucleófílos, dado
Revista de Química. Vol. X. No l. Junio de 1996 ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN Maribel Guzmán C.* INTRODUCCIÓN Los alquenos suelen comportarse como nucleófílos, dado
UNIDAD IV ALCOHOLES. Alcoholes: Usos, propiedades y aplicaciones. Pte. M. en C.Q. Macaria Hernández Chávez
 UNIDAD IV ALCOHOLES Alcoholes: Usos, propiedades y aplicaciones Pte. M. en C.Q. Macaria Hernández Chávez ALCOHOLES Introducción. La mayor parte de los alcoholes comunes, hasta con 11 ó 12 átomos de carbono,
UNIDAD IV ALCOHOLES Alcoholes: Usos, propiedades y aplicaciones Pte. M. en C.Q. Macaria Hernández Chávez ALCOHOLES Introducción. La mayor parte de los alcoholes comunes, hasta con 11 ó 12 átomos de carbono,
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Práctica 2 IDENTIFICACION Y REACCIÓN DE ALCOHOLES
 Práctica 2 IDENTIFICACION Y REACCIÓN DE ALCOHOLES OBJETIVOS: 1. Identificar las propiedades físicas y químicas que presentan los alcoholes. 2. Aprender a reconocer entre los alcoholes primarios, secundarios
Práctica 2 IDENTIFICACION Y REACCIÓN DE ALCOHOLES OBJETIVOS: 1. Identificar las propiedades físicas y químicas que presentan los alcoholes. 2. Aprender a reconocer entre los alcoholes primarios, secundarios
Disoluciones. Química General II 2011
 Disoluciones Química General II 2011 Disolución Es una mezcla homogénea de dos o mas sustancias. Componentes: Soluto: Sustancia (s) presente (s) en menor cantidad en una disolución, son las sustancias
Disoluciones Química General II 2011 Disolución Es una mezcla homogénea de dos o mas sustancias. Componentes: Soluto: Sustancia (s) presente (s) en menor cantidad en una disolución, son las sustancias
Introducción. Los alcoholes son grupos de compuestos que tienen el radical OH. Química Orgánica
 UNIDAD IV. COMPUESTOS ORGÁNICOS QUE CONTIENEN OXÍGENO Objetivo de la unidad: El alumno determinará las propiedades de los hidrocarburos que contienen oxígeno, a partir de sus fórmulas estructurales y técnicas
UNIDAD IV. COMPUESTOS ORGÁNICOS QUE CONTIENEN OXÍGENO Objetivo de la unidad: El alumno determinará las propiedades de los hidrocarburos que contienen oxígeno, a partir de sus fórmulas estructurales y técnicas
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1)
 PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g)
![QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g) QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g)](/thumbs/49/25837773.jpg) OPCIÓN A QUÍMICA. 1. (2,5 puntos) Construya el ciclo de Born-aber y calcule la energía de red (Δ red ) del KCl(s) a partir de los siguientes datos: Entalpía estándar de formación del KCl(s) [Δ f (KCl)]
OPCIÓN A QUÍMICA. 1. (2,5 puntos) Construya el ciclo de Born-aber y calcule la energía de red (Δ red ) del KCl(s) a partir de los siguientes datos: Entalpía estándar de formación del KCl(s) [Δ f (KCl)]
Química orgánica. Cuarto Medio 25/06
 Química orgánica Cuarto Medio 25/06 CARBONO Es el elemento principal de las moléculas orgánicas. Debido a que este átomo, presenta una gran estabilidad. Dado que, tiene una baja tendencia a donar y quitar
Química orgánica Cuarto Medio 25/06 CARBONO Es el elemento principal de las moléculas orgánicas. Debido a que este átomo, presenta una gran estabilidad. Dado que, tiene una baja tendencia a donar y quitar
ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) GUÍA N 7: DETERMINACIÓN DE GRUPOS FUNCIONALES EN MOLECULAS ORGÁNICAS
 ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) GUÍA N 7: DETERMINACIÓN DE GRUPOS FUNCIONALES EN MOLECULAS ORGÁNICAS I. Presentación de la guía: Competencia: El alumno será capaz de reconocer e identificar los
ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) GUÍA N 7: DETERMINACIÓN DE GRUPOS FUNCIONALES EN MOLECULAS ORGÁNICAS I. Presentación de la guía: Competencia: El alumno será capaz de reconocer e identificar los
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
COLEGIO ROSARIO SANTO DOMINGO BANCO DE PREGUNTAS III PERIODO DOCENTE LAURA VERGARA GRADO 11
 COLEGIO ROSARIO SANTO DOMINGO BANCO DE PREGUNTAS III PERIODO DOCENTE LAURA VERGARA GRADO 11 1. Clasifica las siguientes reacciones orgánicas y completa los reactivos o productos que falten e indica en
COLEGIO ROSARIO SANTO DOMINGO BANCO DE PREGUNTAS III PERIODO DOCENTE LAURA VERGARA GRADO 11 1. Clasifica las siguientes reacciones orgánicas y completa los reactivos o productos que falten e indica en
Química del Carbono, Curso /05/2014. Tema 9. Química del Carbono. El carbono: Z=6 A=12. C =1s 2 2s 2 p 2
 Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
Los elementos químicos
 Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE QUIMICA GENERAL
 UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE QUIMICA GENERAL ESTUDIO DE LA SOLUBILIDAD Y LOS FACTORES QUE LA AFECTAN OBJETIVOS 1. Interpretar
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE QUIMICA GENERAL ESTUDIO DE LA SOLUBILIDAD Y LOS FACTORES QUE LA AFECTAN OBJETIVOS 1. Interpretar
APÉNDICE II DESECACIÓN Y AGENTES DESECANTES DESECACIÓN
 259 APÉNDICE II DESECACIÓN Y AGENTES DESECANTES DESECACIÓN La desecación se emplea para extraer la humedad de los líquidos, soluciones y sustancias sólidas. El grado de desecación de una sustancia depende
259 APÉNDICE II DESECACIÓN Y AGENTES DESECANTES DESECACIÓN La desecación se emplea para extraer la humedad de los líquidos, soluciones y sustancias sólidas. El grado de desecación de una sustancia depende
OBTENCIÓN DE INDICADORES DEL TIPO DE LAS FTALEÍNAS FENOLFTALEÍNA Y FLUORESCEINA
 EXPERIMENT No. 8 BTENCIÓN DE INDICADRES DEL TIP DE LAS FTALEÍNAS FENLFTALEÍNA Y FLURESCEINA BJETIVS a) El alumno aprenda los métodos de síntesis de colorantes del tipo de las ftaleínas, por condensación
EXPERIMENT No. 8 BTENCIÓN DE INDICADRES DEL TIP DE LAS FTALEÍNAS FENLFTALEÍNA Y FLURESCEINA BJETIVS a) El alumno aprenda los métodos de síntesis de colorantes del tipo de las ftaleínas, por condensación
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
itzamri12.blogspot.com
 Las transformaciones químicas de los hidrocarburos se relacionan con el tipo de enlace que presentan. Esta enorme cantidad de compuestos se pueden dividir en dos grandes grupos: compuestos saturados y
Las transformaciones químicas de los hidrocarburos se relacionan con el tipo de enlace que presentan. Esta enorme cantidad de compuestos se pueden dividir en dos grandes grupos: compuestos saturados y
19 y 20 ALCOHOLES. CLASIFICACIÓN Los alcoholes se pueden clasificar en tres clases
 ALCOHOLES, FENOLES, TIOLES, ETERES ALCOHOLES Licda. Lilian Judith Guzmán Melgar 2015 19 y 20 CLASIFICACIÓN Los alcoholes se pueden clasificar en tres clases Los alcoholes pueden considerarse los derivados
ALCOHOLES, FENOLES, TIOLES, ETERES ALCOHOLES Licda. Lilian Judith Guzmán Melgar 2015 19 y 20 CLASIFICACIÓN Los alcoholes se pueden clasificar en tres clases Los alcoholes pueden considerarse los derivados
La Química Analítica nos permite medir, monitorear o caracterizar una, varias especies o procesos químicos para la resolución de diversos problemas:
 QUÍMICA ANALÍTICA I Documento de apoyo (1) : Formación de soluciones analíticas. Dr. Alejandro Baeza. Semestre 2010-II. Antecedentes La Química Analítica nos permite medir, monitorear o caracterizar una,
QUÍMICA ANALÍTICA I Documento de apoyo (1) : Formación de soluciones analíticas. Dr. Alejandro Baeza. Semestre 2010-II. Antecedentes La Química Analítica nos permite medir, monitorear o caracterizar una,
SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado por: Licda. Vivian Margarita Sánchez Garrido
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS-CUM UNIDAD DIDÁCTICA QUÍMICA- PRIMER AÑO PRÁCTICAS DE LABORATORIO 2016 SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS-CUM UNIDAD DIDÁCTICA QUÍMICA- PRIMER AÑO PRÁCTICAS DE LABORATORIO 2016 SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado
EXTRACCION SIMPLE Y MULTIPLE Y DEL PRINCIPIO ACTIVO DEL CLORASEPTIC
 PRACTICA X EXTRACCION SIMPLE Y MULTIPLE Y DEL PRINCIPIO ACTIVO DEL CLORASEPTIC I. OBJETIVOS II MATERIAL a) Conocer la técnica de extracción como método de separación y purificación de las sustancias integrantes
PRACTICA X EXTRACCION SIMPLE Y MULTIPLE Y DEL PRINCIPIO ACTIVO DEL CLORASEPTIC I. OBJETIVOS II MATERIAL a) Conocer la técnica de extracción como método de separación y purificación de las sustancias integrantes
CRISTALIZACIÓN: PURIFICACIÓN DEL ÁCIDO BENZOICO. Purificar un compuesto orgánico mediante cristalización y determinar su punto de fusión
 EXPERIMENTO 1 CRISTALIZACIÓN: PURIFICACIÓN DEL ÁCIDO BENZOICO Objetivo general Purificar un compuesto orgánico mediante cristalización y determinar su punto de fusión Objetivos específicos 1.- Determinar
EXPERIMENTO 1 CRISTALIZACIÓN: PURIFICACIÓN DEL ÁCIDO BENZOICO Objetivo general Purificar un compuesto orgánico mediante cristalización y determinar su punto de fusión Objetivos específicos 1.- Determinar
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs.
 Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Capitulo 8 Fuerzas intermoleculares.
 Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
UNIVERSIDAD NACIONAL DEL CALLAO FACULTAD DE INGENIERIA QUIMICA AÑO 2009 AMINAS AROMATICAS
 AMINAS AROMATICAS I. OBJETIVOS Identificación de la anilina. Reconocimiento de la anilina con las diferentes pruebas. II. FUNDAMENTO TEORICO Amina, nombre que reciben los compuestos producidos a menudo
AMINAS AROMATICAS I. OBJETIVOS Identificación de la anilina. Reconocimiento de la anilina con las diferentes pruebas. II. FUNDAMENTO TEORICO Amina, nombre que reciben los compuestos producidos a menudo
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
JUNIO FASE ESPECÍFICA. QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Disponemos de los pares redox (Fe 2+ /Fe) y (O 2 /H 2 O), con potenciales estándar de reducción 0,44 V y +1,23 V, respectivamente. Con ellos
JUNIO 2011. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Disponemos de los pares redox (Fe 2+ /Fe) y (O 2 /H 2 O), con potenciales estándar de reducción 0,44 V y +1,23 V, respectivamente. Con ellos
DISOLUCIONES UNIDAD IV. Licda. Miriam Marroquín Leiva
 DISOLUCIONES UNIDAD IV 1 DISOLUCIÓN Es una mezcla homogénea de dos o más sustancias; el soluto y el disolvente. Es un término utilizado para describir un sistema en el cual una o más sustancias están mezcladas
DISOLUCIONES UNIDAD IV 1 DISOLUCIÓN Es una mezcla homogénea de dos o más sustancias; el soluto y el disolvente. Es un término utilizado para describir un sistema en el cual una o más sustancias están mezcladas
Informe del trabajo práctico nº7
 Informe del trabajo práctico nº7 Profesora : Lic. Graciela. Lic. Mariana. Alumnas: Romina. María Luján. Graciela. Mariana. Curso: Química orgánica 63.14 turno 1 OBJETIVOS Mostrar las propiedades que presentan
Informe del trabajo práctico nº7 Profesora : Lic. Graciela. Lic. Mariana. Alumnas: Romina. María Luján. Graciela. Mariana. Curso: Química orgánica 63.14 turno 1 OBJETIVOS Mostrar las propiedades que presentan
QUÍMICA DEL ARSÉNICO, ANTIMONIO Y BISMUTO
 QUÍMICA DEL ARSÉNICO, ANTIMONIO Y BISMUTO Los tres elementos que se estudiarán en esta práctica corresponden al grupo 15 de la Tabla Periódica. El arsénico cuya toxicidad es bien conocida se encuentra
QUÍMICA DEL ARSÉNICO, ANTIMONIO Y BISMUTO Los tres elementos que se estudiarán en esta práctica corresponden al grupo 15 de la Tabla Periódica. El arsénico cuya toxicidad es bien conocida se encuentra
Tema 11. CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA
 Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las siguientes preguntas.
 EXPERIMENTO 4 ALCOHOLES Y FENOLES Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las
EXPERIMENTO 4 ALCOHOLES Y FENOLES Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las
IDENTIFICACIÓN DE GRUPOS FUNCIONALES ORGÁNICOS
 IDENTIFICACIÓN DE GRUPOS FUNCIONALES ORGÁNICOS Objetivo El alumno aprenderá a identificar los grupos funcionales que se encuentran en compuestos orgánicos de origen natural o sintético mediante pruebas
IDENTIFICACIÓN DE GRUPOS FUNCIONALES ORGÁNICOS Objetivo El alumno aprenderá a identificar los grupos funcionales que se encuentran en compuestos orgánicos de origen natural o sintético mediante pruebas
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2008 PRIMERA PARTE
 1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
Estructura del grupo carbonilo
 TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
Unidad 2. La materia
 Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
Prefacio... ix COMO UTILIZAR ESTE LIBRO... 1 QUE ES LA QUIMICA... 2 EL METODO CIENTIFICO... 3 LAS RAMAS DE LA QUIMICA... 3
 ÍNDICE Prefacio... ix 1 introducción a la química... 1 COMO UTILIZAR ESTE LIBRO... 1 QUE ES LA QUIMICA... 2 EL METODO CIENTIFICO... 3 LAS RAMAS DE LA QUIMICA... 3 2 el sistema métrico y la medición científica...
ÍNDICE Prefacio... ix 1 introducción a la química... 1 COMO UTILIZAR ESTE LIBRO... 1 QUE ES LA QUIMICA... 2 EL METODO CIENTIFICO... 3 LAS RAMAS DE LA QUIMICA... 3 2 el sistema métrico y la medición científica...
TEMA 8 SISTEMA PERIÓDICO Y ENLACES
 TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS
 TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
ORGÁNICA I. 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua.
 ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
PRÁCTICO N 4 CARBOHIDRATOS
 PRÁCTICO N 4 CARBOHIDRATOS I. INTRODUCCIÓN. Los compuestos químicos de la célula se clasifican en dos grandes grupos: moléculas inorgánicas y moléculas orgánicas. Las primeras se caracterizan por la ausencia
PRÁCTICO N 4 CARBOHIDRATOS I. INTRODUCCIÓN. Los compuestos químicos de la célula se clasifican en dos grandes grupos: moléculas inorgánicas y moléculas orgánicas. Las primeras se caracterizan por la ausencia
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
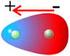 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos
 QUÍMICA ORGÁNICA La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos que ningún otro elemento, por tener la capacidad de unirse entre sí formando cadenas
QUÍMICA ORGÁNICA La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos que ningún otro elemento, por tener la capacidad de unirse entre sí formando cadenas
Química del carbono: estudio de algunas funciones orgánicas
 Química del carbono: estudio de algunas funciones orgánicas Contenidos Estructura y enlaces en moléculas orgánicas: geometría y polaridad. Isomería geométrica. Relación entre fuerzas intermoleculares y
Química del carbono: estudio de algunas funciones orgánicas Contenidos Estructura y enlaces en moléculas orgánicas: geometría y polaridad. Isomería geométrica. Relación entre fuerzas intermoleculares y
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
EJERCICIOS DE LA PAU CYL TEMA
 EJERCICIOS DE LA PAU CYL TEMA 0 2007-13 CONCEPTO DE MOL: 1. (16-S07) Calcule la masa de cada uno de los elementos presentes en: a) 2,5 moles de Ca. (0,6 puntos) b) 2,0 10 23 átomos de Al. (0,7 puntos)
EJERCICIOS DE LA PAU CYL TEMA 0 2007-13 CONCEPTO DE MOL: 1. (16-S07) Calcule la masa de cada uno de los elementos presentes en: a) 2,5 moles de Ca. (0,6 puntos) b) 2,0 10 23 átomos de Al. (0,7 puntos)
MANUAL DE PRÁCTICAS DE LABORATORIO
 MANUAL DE PRÁCTICAS DE LABORATORIO IBT QUÍMICA ORGÁNICA FICHA TECNICA FICHA TÉCNICA QUIMICA ORGÁNICA Fecha: 12 Abril 2012 Nombre del catedrático: Edith Ponce Recinos Nombre de la práctica: Identificación
MANUAL DE PRÁCTICAS DE LABORATORIO IBT QUÍMICA ORGÁNICA FICHA TECNICA FICHA TÉCNICA QUIMICA ORGÁNICA Fecha: 12 Abril 2012 Nombre del catedrático: Edith Ponce Recinos Nombre de la práctica: Identificación
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
EQUILIBRIO QUIMICO. Equilibrio en soluciones. FUNDAMENTO TEORICO (principio de Lechatelier) Objetivos
 Departamento de Química Practica Nº 5-2 EQUILIBRIO QUIMICO Equilibrio en soluciones Objetivos 1. Observar la reversibilidad de un equilibrio químico por efecto de la temperatura. 2. Estudiar las reacciones
Departamento de Química Practica Nº 5-2 EQUILIBRIO QUIMICO Equilibrio en soluciones Objetivos 1. Observar la reversibilidad de un equilibrio químico por efecto de la temperatura. 2. Estudiar las reacciones
Trabajo Práctico N 3. Reconocimiento de sustancias ácidas, básicas y neutras. mediante el empleo de indicadores químicos.
 Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II
 SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
Dar a conocer la capacidad de disolución del agua frente a otras sustancias.
 MINISTERIO DE EDUCACION Actividad 1: Agua en la vida II. Laboratorio: Solubilidad del agua 1. Tema: AGUA DISOLVENTE UNIVERSAL 2. Objetivo: Dar a conocer la capacidad de disolución del agua frente a otras
MINISTERIO DE EDUCACION Actividad 1: Agua en la vida II. Laboratorio: Solubilidad del agua 1. Tema: AGUA DISOLVENTE UNIVERSAL 2. Objetivo: Dar a conocer la capacidad de disolución del agua frente a otras
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA
 PRÁCTICA Nº 3 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de diversas muestras problema. I. FUNDAMENTOS
PRÁCTICA Nº 3 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de diversas muestras problema. I. FUNDAMENTOS
Tema 7. Las mezclas. Introducción
 Tema 7. Las mezclas Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las sustancias puras son los elementos y los compuestos que
Tema 7. Las mezclas Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las sustancias puras son los elementos y los compuestos que
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO
 PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES
 GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
Química del carbono: estudio de algunas funciones orgánicas
 Química del carbono: estudio de algunas funciones orgánicas Contenidos Estructura y enlaces en moléculas orgánicas: geometría y polaridad. Isomería geométrica. Relación entre fuerzas intermoleculares y
Química del carbono: estudio de algunas funciones orgánicas Contenidos Estructura y enlaces en moléculas orgánicas: geometría y polaridad. Isomería geométrica. Relación entre fuerzas intermoleculares y
QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO
 QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
LABORATORIO 6. TITULO : Propiedades de los Gases
 37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las siguientes preguntas.
 EXPERIMENTO 5 ALDEHIDOS Y CETONAS Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las
EXPERIMENTO 5 ALDEHIDOS Y CETONAS Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las
Química Orgánica General
 Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
GUÍA DE LABORATORIO Nº 1 PROPIEDADES FÍSICO QUÍMICAS DE LOS COMPUESTOS ORGÁNICOS
 GUÍA DE LABORATORIO Nº PROPIEDADES FÍSICO QUÍMICAS DE LOS COMPUESTOS ORGÁNICOS OBJETIVOS Reconocer experimentalmente las características más importantes de los compuestos orgánicos. Identificar si la muestra
GUÍA DE LABORATORIO Nº PROPIEDADES FÍSICO QUÍMICAS DE LOS COMPUESTOS ORGÁNICOS OBJETIVOS Reconocer experimentalmente las características más importantes de los compuestos orgánicos. Identificar si la muestra
c) Falsa. La reacción que tiene lugar es: CH 3 CH CH CH 3 + H 2 CH 3 CH 2 CH 2 CH 3 Es una reacción de adición al doble enlace y no de eliminación.
 1. Dado el siguiente compuesto, diga, justificando la respuesta, si las siguientes afirmaciones son verdaderas o falsas: CH 3 CH CH CH 3 a) El compuesto reacciona con para dar dos compuestos isómeros geométricos.
1. Dado el siguiente compuesto, diga, justificando la respuesta, si las siguientes afirmaciones son verdaderas o falsas: CH 3 CH CH CH 3 a) El compuesto reacciona con para dar dos compuestos isómeros geométricos.
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
INFORME DE LABORATORIO N 5 ESTEQUIOMETRÌA I
 UNIVERSIDAD DE CIENCIAS E INFORMATICA FACULTAD DE CIENCIAS DE LA SALUD ESCUELA DE KINESIOLOGIA INFORME DE LABORATORIO N 5 ESTEQUIOMETRÌA I Asignatura Profesor Alumno :Química general : José Gabriel Martínez
UNIVERSIDAD DE CIENCIAS E INFORMATICA FACULTAD DE CIENCIAS DE LA SALUD ESCUELA DE KINESIOLOGIA INFORME DE LABORATORIO N 5 ESTEQUIOMETRÌA I Asignatura Profesor Alumno :Química general : José Gabriel Martínez
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO.
 LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
PURIFICACION DE LOS SÓLIDOS POR CRISTALIZACION
 PURIFICACION DE LOS SÓLIDOS POR CRISTALIZACION I. OBJETIVOS Poder lograr la purificación de la muestra experimentales. utilizada reconociendo procedimientos Obtener cristales de acetanilida. II. FUNDAMENTO
PURIFICACION DE LOS SÓLIDOS POR CRISTALIZACION I. OBJETIVOS Poder lograr la purificación de la muestra experimentales. utilizada reconociendo procedimientos Obtener cristales de acetanilida. II. FUNDAMENTO
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 CARBOHIDRATOS ELABORADO POR: LICDA. LUCRECIA CASASOLA DE LEIVA
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 CARBOHIDRATOS ELABORADO POR: LICDA. LUCRECIA CASASOLA DE LEIVA
 TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
PRÁCTICAS DE QUÍMICA ORGÁNICA I
 SEP SNEST DGEST INSTITUTO TECNOLÓGICO DE TOLUCA INGENIERÍA QUÍMICA PRÁCTICAS DE QUÍMICA ORGÁNICA I Q.F.I. BENJAMÍN PORTILLO ALVA I.B.Q. LETICIA E. COLÓN IZQUIERDO METEPEC, MÉXICO, AGOSTO DE 2005. PRÁCTICA
SEP SNEST DGEST INSTITUTO TECNOLÓGICO DE TOLUCA INGENIERÍA QUÍMICA PRÁCTICAS DE QUÍMICA ORGÁNICA I Q.F.I. BENJAMÍN PORTILLO ALVA I.B.Q. LETICIA E. COLÓN IZQUIERDO METEPEC, MÉXICO, AGOSTO DE 2005. PRÁCTICA
DERIVADOS HALOGENADOS. Estructura
 TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
CÁTEDRA DE QUÍMICA II BIOINGENIERÍA
 Departamento de Electrónica y Automática Facultad de Ingeniería CÁTEDRA DE QUÍMICA II BIOINGENIERÍA GUÍA DE TRABAJOS PRÁCTICOS DE LABORAORIO Nº 3 LIPIDOS Apellido y Nombre Registro SOLUBILIDAD DE LAS GRASAS
Departamento de Electrónica y Automática Facultad de Ingeniería CÁTEDRA DE QUÍMICA II BIOINGENIERÍA GUÍA DE TRABAJOS PRÁCTICOS DE LABORAORIO Nº 3 LIPIDOS Apellido y Nombre Registro SOLUBILIDAD DE LAS GRASAS
ESTRUCTURA DE LA MATERIA QCA 01 ANDALUCÍA. 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad.
 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
Longitud y energía de enlace
 Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
