PROTEÍNAS. Constituyen alrededor del 50% del peso de un ser humano, una vez eliminada el agua de su cuerpo.
|
|
|
- José Tebar Franco
- hace 6 años
- Vistas:
Transcripción
1 TEMA 8 PROTEÍNAS GUIÓN. (4 sesiones) 1.- CONCEPTO DE PROTEÍNA. - Unidades básicas: aminoácidos. - Enlace peptídico. 2.- ESTRUCTURA DE LAS PROTEÍNAS. - Estructura primaria de las proteínas. - Estructura secundaria. - Estructura terciaria. - Estructura cuaternaria. - Concepto de estructura nativa y desnaturalización. 3.- IMPORTANCIA BIOLÓGICA DE LAS PROTEÍNAS. - Componentes estructurales: membranas, tejidos de sostén. - Transportadores: hemoglobina. - Defensa del organismo. - Enzimas. - Carácter tamponador. - Función contráctil. 1.- CONCEPTO DE PROTEÍNA. Constituyen alrededor del 50% del peso de un ser humano, una vez eliminada el agua de su cuerpo. Químicamente están constituidas por átomos de carbono, hidrógeno, oxígeno y nitrógeno (éste último elemento las caracteriza). También son frecuentes, aunque en menor cantidad, azufre y fósforo. Las proteínas son macromoléculas, formadas por la unión de unidades sencillas llamadas aminoácidos. Una proteína tiene al menos 100 aminoácidos. Son las sustancias que realmente realizan el trabajo de construcción de las células y del organismo. Podemos considerar que las proteínas son los sirvientes biológicos que ejecutan las órdenes de sus señores, los ácidos nucleicos. Realizan 2 trabajos fundamentales: En primer lugar, actúan como los catalizadores (enzimas) que hacen que todas las reacciones químicas de la célula tengan lugar. Se encargan de producir, procesar y también destruir a los lípidos, glúcidos y los otros componentes celulares. En segundo lugar, las proteínas sirven de unidades estructurales que mantienen la unidad de los organismos y les dan la forma y la capacidad de moverse. 1
2 A) UNIDADES BÁSICAS: AMINOÁCIDOS. CARÁCTER UNIVERSAL DE LOS AMINOÁCIDOS.- Es sorprendente que las diferentes proteínas que constituyen todos los seres vivos estén formadas por la combinación de tan sólo 20 aminoácidos, conocidos como aminoácidos comunes. El hecho de que estos 20 aminoácidos se presenten una y otra vez en todas las proteínas, incluidas las producidas por las bacterias, las plantas y los animales, es probablemente una consecuencia del proceso evolutivo y puede constituir una prueba del origen común de todos los seres vivos. Además de estos aminoácidos, en las proteínas se pueden encontrar aminoácidos derivados, obtenidos por la modificación de uno de los aminoácidos comunes gracias a la participación de alguna enzima. ESTRUCTURA BÁSICA.- Los aminoácidos (aa s ) tienen en común un átomo de carbono central (alfa) al que están unidos covalentemente un grupo ácido carboxílico, un grupo amino y un átomo de hidrógeno. Además de ello, al átomo de carbono alfa se une una cadena lateral, designada R, que es diferente para cada uno de los 20 aminoácidos comunes. H R C COOH NH 2 Un aminoácido disuelto en una solución a ph 7 se encuentra en forma ionizada: el grupo amino unido al carbono alfa, está protonado en su forma de ión amonio; el grupo ácido carboxílico se encuentra en su forma desprotonada o carboxilato. TIPOS DE AMINOÁCIDOS. La clasificación de los aminoácidos se hace en función del tipo de cadena lateral "R" que posee cada uno de ellos: Aminoácidos alifáticos. El radical R es una cadena abierta y lineal derivada de la unión de grupos: -CH 2 -CH 3. Se subdividen en: A. Neutros (con igual número de grupos carboxílo que de grupos amino). A. Ácidos (con mayor número de grupos carboxilo que de grupos amino). A. Básicos (con mayor número de grupos amino que de grupos carboxilo). Aminoácidos aromáticos. El radical es una cadena cerrada, generalmente relacionada con el ciclo del benceno. Aminoácidos heterocíclicos. El radical es una cadena cerrada, generalmente compleja y con algunos átomos distintos del de carbono. Cuando se estudia la estructura de las proteínas, es importante tener una idea de la hidrofobicidad de las cadenas laterales de los aminoácidos que la forman. Para este fin, la siguiente clasificación tiene más utilidad: Aminoácidos con grupo R no polar. Aminoácidos con grupo R polar. Aminoácidos ácidos. Aminoácidos básicos. 2
3 PROPIEDADES DE LOS AMINOÁCIDOS.- Los aminoácidos son compuestos sólidos cristalinos, solubles en agua. Además, presentan: Propiedades ÓPTICAS.- Todos los aminoácidos excepto la glicina o glicocola poseen un carbono asimétrico, el carbono a, el cual presenta 4 radicales diferentes: un grupo amino, un grupo carboxilo, un radical R y un hidrógeno. Debido a esta característica, los aminoácidos presentan actividad óptica, es decir, son capaces de desviar el plano de la luz polarizada que atraviese una disolución de aminoácidos. Se dice que son dextrógiros, si giran dicho plano hacia la derecha y levógiros si lo giran hacia la izquierda. Independientemente de lo dicho, y por convenio, se acepta que un aminoácido tiene configuración D, si el grupo -NH 2 se halla situado a la derecha, mientras que si se encuentra a la izquierda, poseerá una configuración L. En la naturaleza, la forma L es la más abundante. Propiedades ÁCIDO-BASE.- Cuando los aminoácidos se encuentran en soluciones cuyo ph esté próximo a 7, los aminoácidos están ionizados. En este caso, el grupo amino se comporta como base y capta un protón, mientras que el grupo carboxilo actúa como ácido y pierde un protón. En este estado, los aminoácidos forman dipolos (forma dipolar o "zwitterion"). Cuando los aminoácidos se encuentran en una solución ácida (elevado número de protones en el medio), el aminoácido tiende a captarlos y se carga positivamente: actúa como una base. Si el medio es básico, el aminoácido libera protones y queda cargado negativamente, comportándose como un ácido. Este peculiar comportamiento de los aminoácidos se conoce como COMPORTAMIENTO ANFÓTERO (son tanto ácidos como bases). SOLUBILIDAD.- La bipolaridad de los aminoácidos, similar a la del agua, explica que la solubilidad de estos en el agua sea mayor de lo que cabría esperar de acuerdo con su masa molecular y su estructura. Elevado PUNTO de FUSIÓN.- El punto de fusión de los aminoácidos es bastante elevado, al existir atracciones iónicas entre ellos. Estas atracciones iónicas poseen más energía de enlace que los enlaces de Van der Waals. AMINOÁCIDOS ESENCIALES. Muchos de los aminoácidos con los que se forman las proteínas proceden de las proteínas de la dieta, las cuales, tras la digestión, se descomponen en aminoácidos libres que son absorbidos por el intestino delgado. Sin embargo, cuando las necesidades así lo requieren, hay aminoácidos que se sintetizan en el interior de las células a partir de otros componentes metabólicos. Aquellos aminoácidos que pueden ser producidos por el metabolismo humano, se conocen como aminoácidos no esenciales, mientras que los aminoácidos esenciales son aquellos que no pueden ser sintetizados por las células del cuerpo humano porque éstas carecen de los enzimas biosintéticos necesarios. Los aminoácidos esenciales son: Fenilalanina, Triptófano, Metionina, Isoleucina, Treonina, Valina, Leucina e Histidina. La Arginina se sintetiza en los tejidos de los mamíferos, pero a una velocidad insuficiente para satisfacer las necesidades durante el crecimiento. La Fenilalanina es esencial debido a que se necesitan grandes cantidades para formar la tirosina, del mismo modo que la metionina se necesita en grandes cantidades para producir cisteína. 3
4 B) ENLACE PEPTÍDICO. Los aminoácidos se polimerizan formando moléculas más complejas conocidas como PÉPTIDOS. FORMACIÓN DEL ENLACE PEPTÍDICO.- Los aminoácidos se unen unos a otros mediante enlaces de tipo amídico (-CO-HN-) llamados enlaces peptídicos. Estos enlaces, de naturaleza covalente, se establecen entre el grupo carboxilo de un aminoácido y el grupo amino de otro. La unión peptídica es una reacción de condensación (combinación de dos moléculas, en este caso aminoácidos, para dar un producto, en este caso dipéptido, y agua). Debido a que esta reacción se produce en medio acuoso, la tendencia natural seria a que la reacción se desplazara en sentido contrario, pero no es así debido a que intervienen ciertos agentes denominados condensantes como el ATP. 2.- ESTRUCTURA DE LAS PROTEÍNAS. Entre las cadenas polipeptídicas naturales más grandes en el hombre se encuentra la del procolágeno que contiene aproximadamente unos 1200 restos aminoácidos por cadena polipeptídica. Al otro lado del espectro se encuentran muchos polipéptidos pequeños que contienen menos de 10 aminoácidos. Teóricamente, podrían existir un elevado número de proteínas diferentes, ya que con los 20 aminoácidos disponibles en los seres vivos, estos se podrían ordenar de innumerables maneras y cada combinación produciría una proteína distinta. Las proteínas se diferencian entre si, por el número y tipo de los aminoácidos que los forman, y por el orden (secuencia) de estos aminoácidos. Esto queda de manifiesto si consideramos que se pueden formar 20 2 = 400 dipéptidos distintos. 100 aminoácidos, pueden combinarse formando secuencias distintas, siendo cada una de ellas una proteína diferente. Sin embargo, la existencia de un elevado número de proteínas sería incompatible con el necesario orden que impone la vida celular. Debido a ello, tan sólo una pequeña cantidad del total de posibles proteínas ha sido seleccionada para llevar alguna función en los seres vivos. Cada ser vivo, posee varios miles de proteínas que le son específicas. La estructura de las mismas es tan importante, que en algunos casos, el cambio de un único aminoácido puede alterar su función y causar problemas graves al individuo. A medida que se sintetiza la proteína en los ribosomas, las cadenas laterales de los aminoácidos reaccionan entre ellas o con el medio en el que se encuentran. Así, aquellos cadenas hidrofóbicas tienden a agruparse en el interior de la molécula, evitando de este modo el medio acuoso. Por el contrario, la mayoría de restos polares se sitúan en la parte externa de la molécula, donde forman puentes de hidrógeno con el agua. Los enlaces peptídicos, también son polares y reaccionan entre sí y con otros restos polares, estableciendo enlaces por puente de hidrógeno. Todas estas interacciones hacen que la molécula se pliegue de una determinada forma, adoptando una estructura tridimensional especifica, una conformación característica. ESTUDIO DE UNA PROTEÍNA. Conocer los aminoácidos que forman una proteína y el orden que mantienen en ella (secuencia de aminoácidos), es un requisito básico para comprender la estructura de la proteína. Pero también debe conocerse si la proteína está formada por varias cadenas polipeptídicas unidas entre sí. Por ejemplo, la hemoglobina está formada por 4 cadenas polipeptídicas, 4
5 la cubierta del virus de la polio contiene 60 y la proteína del virus del mosaico del tabaco contiene Además, debe estudiarse la organización de las cadenas y la conformación de cada una de ellas. Para evitar probables confusiones, el estudio de la estructura de cualquier proteína se realiza a 4 niveles: A) ESTRUCTURA PRIMARIA. Toda cadena polipeptídica a nivel primario está formada por: Una secuencia de aminoácidos característica Un esqueleto constituido por la serie de enlaces peptídicos resultantes de la unión de los aminoácidos. y por cadenas laterales que son los radicales de cada aminoácido. El enlace peptídico tiene carácter parcial de doble enlace, debido a que presenta una resonancia estabilizada entre dos formas, que hace que sus átomos de N, O y C compartan sus electrones. O O(-) (+) - C - N - - C = N - H H Esta propiedad del enlace peptídico impone ciertas restricciones; así, aunque los péptidos son estructuras flexibles capaces de efectuar rotaciones alrededor de los enlaces N - C (alfa) y C - C (alfa), no pueden sin embargo efectuar torsiones alrededor de los enlaces peptídicos, y esta circunstancia determina que los átomos de cada enlace se encuentren en el mismo plano. Consecuencia de esto, es que el esqueleto de la cadena polipeptídica se asemeja más a una sucesión de placas articuladas que a un rosario de cuentas. Aunque estos aspectos son interesantes, lo importante cuando se estudia a nivel primario una proteína es conocer la secuencia de aminoácidos que la componen, ya que ésta determina la estructura tridimensional de la misma.una cadena polipeptídica que haya perdido su típica estructura tridimensional carece de actividad biológica, ya que es ésta, la que determina su función específica dentro del ser vivo. Dése cuenta, que la conformación característica de una proteína es el resultado de la peculiar organización de sus átomos y en última instancia, de su secuencia de aminoácidos. Por ejemplo: Se determinó la estructura primaria de la hemoglobina normal y la de un tipo de hemoglobina no normal que es la responsable de la anemia falciforme. El estudio reveló que en una de las cadenas polipeptídicas que forman esta proteína (la cadena ß) en la posición sexta, la hemoglobina normal (A) presenta un resto de ácido glutámico mientras que en la hemoglobina no normal (S) esta posición está ocupada por la valina. En consecuencia, los individuos con Hb S tienen reemplazado un grupo de cadena lateral polar por un grupo no polar hidrofóbico. Esto provoca que las moléculas de Hb S se polimerizen con otras, produciendo una precipitación de las mismas dentro del eritrocito. La precipitación de la hemoglobina S comunica a los hematies un aspecto falciforme, que los hace más vulnerables a la lisis y con mayor probabilidad de quedar en los capilares sanguíneos obstruyendo el paso de la sangre. 5
6 Las proteínas suelen ser distintas en cada especie. Esta ESPECIFICIDAD de especie es debida a la distinta situación de uno o varios aminoácidos de los que componen estas moléculas. Así, aunque desempeñan la misma función en especies diferentes, son específicas para cada una de ellas. Esta variabilidad en la estructura primaria hace que, en ocasiones, aparezcan diferencias entre proteínas pertenecientes a individuos de la misma especie (especificidad individual). Al ser recibidas tales moléculas por otro individuo de la misma especie (transfusiones de sangre, injertos de piel, trasplante de órganos, etc), su organismo las considera como extrañas y responde con reacciones de rechazo (reacciones antígeno-anticuerpo). Este efecto que, en general, resulta beneficioso pues rechaza todo agente que sea extraño al individuo, produce en este caso un efecto perjudicial (no olvidemos que la evolución no contempla la posibilidad de un trasplante ni siquiera entre individuos de la misma especie). Si la cadena polipeptídica tiene aminoácidos que puedan establecer entre ellos enlaces por puente disulfuro, estos se estudian dentro de la estructura primaria. Por lo tanto, como conclusión podemos decir que la estructura primaria se refiere a la secuencia de aminoácidos y la localización de los puentes disulfuro, si los hubiere. Así pues, la estructura primaria comprende la uniones covalentes de la proteína. B) ESTRUCTURA SECUNDARIA. Los enlaces peptídicos son polares y reaccionan entre sí y con otros restos polares, estableciendo enlaces por puente de hidrógeno. Debido a esto y a las posibilidades de giro de los enlaces vecinos al enlace peptídico, el esqueleto polipeptídico se enrosca formando la parte interior de la molécula, y las cadenas laterales de los aminoácidos se extiende hacia afuera en una disposición helicoidal. El resultado es una estructura semejante a un cilindro, conocida como hélice alfa, que queda estabilizada por los enlaces de hidrógeno establecidos entre los grupos NH y CO de la cadena principal. Las cadenas polipeptídicas pueden adoptar otra estructura, conocida como hoja plegada ß. En este caso, la cadena principal está casi completamente extendida y queda estabilizada por enlaces de hidrógeno que se establecen entre los grupos NH y CO de filamentos polipeptídicos diferentes. Las cadenas adyacentes en una hoja plegada ß pueden orientarse en la misma dirección (hoja ß paralela) o en direcciones opuestas (hoja ß antiparalela). Un tercer tipo de estructura secundaria lo constituye la hélice del colágeno, la cual es responsable de la gran fuerza tensil de éste. C) ESTRUCTURA TERCIARIA. Este nivel corresponde a la conformación espacial definitiva que adoptan las diferentes regiones de la cadena polipeptídica (cada una con su correspondiente estructura secundaria), como consecuencia de las interacciones establecidas entre las cadenas laterales de los aminoácidos de diferentes puntos de la cadena. A este nivel, son dos las conformaciones más frecuentes en las proteínas: Conformación globular, en la que la estructura se pliega adoptando formas que, en ocasiones, parecen esféricas. Generalmente, en los tramos rectos, la cadena polipeptídica posee una estructura secundaria de tipo alfa-hélice y en los codos presenta una estructura secundaria tipo ß o ninguna. Estas formas se mantienen estables debido a la existencia de enlaces entre los radicales R de los diferentes aminoácidos (puentes de hidrógeno, fuerzas de Van der Waals, puentes salinos...). 6
7 Las proteínas con esta conformación son solubles en agua y en disoluciones salinas, difundiéndose además con facilidad en estos medios. La conformación filamentosa es una forma lineal en la que la estructura secundaria es de alfa-hélice en toda su longitud. Las proteínas que poseen esta conformación son insolubles en agua y en disoluciones salinas. D) ESTRUCTURA CUATERNARIA. Las proteínas que poseen más de una cadena polipeptídica pueden presentar un nuevo nivel de organización estructural. A cada cadena polipeptídica de una proteína así se le denomina subunidad. La estructura cuaternaria se refiere al ordenamiento espacial de tales subunidades y a la naturaleza de sus contactos mutuos. Resumen: Estructura primaria.- Esqueleto covalente (enlaces peptídicos y puentes S-S). Estructura secundaria.- Puentes de H. Estructura terciaria y cuaternaria.- Enlaces de Van der Waals E) ESTRUCTURA NATIVA Y DESNATURALIZACIÓN. La existencia de enlaces en la cadena polipeptídica que permiten la libre rotación de sus átomos, posibilita que, en teoría, cualquier proteína pueda adoptar un elevado número de formas o conformaciones. Sin embargo, de todas estas estructuras posibles, sólo una es la funcional y permite a la proteína realizar la acción para la que está destinada. Esta estructura funcional se conoce como conformación nativa. La conformación nativa puede alterarse si por algún proceso se rompen los enlaces por puente de hidrógeno u otras interacciones, y con ello desaparecen las estructuras secundarias y terciarias originales. A este proceso se le conoce como desnaturalización. La rotura de los enlaces de hidrógeno se puede producir por medio físicos (irradiación ultravioleta, calor, etc) o químicos (disolventes orgánicos, detergentes, urea o variaciones del ph). Por ejemplo: un aumento del ph por encima de 8.0 supone la rotura de la mayor parte de los enlaces por puente de hidrógeno. La desnaturalización es un proceso cooperativo de forma, que la rotura de un enlace de hidrógeno favorece la del siguiente. Por ejemplo, la leche se "corta" y la caseína de la leche (antes soluble) precipita formando yogur, cuando determinadas bacterias convierten la lactosa en ácido láctico, provocando un descenso en el ph. Un aumento moderado de la temperatura también rompe los enlaces por puente de hidrógeno. Si la temperatura es superior a 60ºC se destruye la estructura helicoidal; esto es lo que ocurre cuando se coagula la albúmina de la clara de huevo al freír este. 7
8 La desnaturalización provoca generalmente una disminución de la solubilidad de las proteínas, las cuales pueden precipitar. Ello se debe a la pérdida de la estructura globular que pasa a filamentosa, entonces, la capa de moléculas de agua no recubre totalmente a las moléculas proteicas y estas se unen dando lugar a grandes partículas que precipitan. Si la desnaturalización es suave, se puede obtener de nuevo la conformación original al reinstaurar las condiciones iniciales del medio, ya que como sabemos, toda la información relativa a la conformación nativa está contenida en la secuencia de aminoácidos. A ese proceso se le denomina renaturalización. Este proceso no siempre es reversible, habrá por lo tanto, desnaturalización reversible e irreversible). La desnaturalización provoca la perdida de la función proteica; aunque la perdida de la función proteica, que puede ser debida a sólo un pequeño cambio de conformación, no es necesariamente sinónimo de desnaturalización. La perdida de un solo puente de hidrógeno estructuralmente esencial, o de una interacción electrostática o hidrofóbica, puede llevar a la desnaturalización de una estructura plegada. 3.- IMPORTANCIA BIOLÓGICA DE LAS PROTEÍNAS Entre la diversidad de proteínas existentes, podemos distinguir dos tipos: las NO ACTIVAS, fibrosas, que realizan funciones estructurales, y las ACTIVAS, globulares, que participan en la dinámica celular, en la que desempeñan funciones de transporte, catalíticas, de defensa, etc. Estas segundas, son capaces de reconocer otras sustancias denominadas ligandos, a las que pueden unirse. En ocasiones, una sola molécula de proteína puede desempeñar al mismo tiempo un papel estructural y catalítico. PROTEÍNAS ESTRUCTURALES. Se dice de las proteínas que son los edificios que mantienen la materia viva.así, realizan este tipo de función las proteínas que constituyen las membranas celulares, (glucoproteínas y proteínas estructurales de membrana), los microtúbulos, los cilios, los flagelos. A nivel de tejidos, se pueden citar las fibras del tejido reticular (con la proteína reticulina) y las formaciones epidérmicas (como pelo, uñas, plumas, caparazón de las tortugas), secreciones mucosas (mucoproteínas) y el colágeno de los cartílagos y huesos. PROTEÍNAS TRANSPORTADORAS.Las permeasas regulan el paso de moléculas a través de las membranas celulares. La hemoglobina transporta el O 2 a través del torrente circulatorio. La mioglobina transporta el 0 2 a nivel del músculo. La hemocianina se encarga del transporte de este gas en los invertebrados. La seroalbúmina transporta compuestos químicos por la sangre. PROTEÍNAS DE DEFENSA. Las γ-globulinas o inmunoglobulinas constituyen los anticuerpos que se sintetizan cuando en el organismo aparecen sustancias extrañas (antígenos). ENZIMAS. Los prótidos con estas funciones se denominan biocatalizadores ya que aceleran las reacciones biológicas. PROTEÍNAS CON CARÁCTER TAMPONADOR. Las proteínas juegan un papel 8
9 fundamental en el control de iones hidrógeno (regulación del ph). Este propiedad por la cual se evitan las variaciones bruscas de ph (amortiguación o carácter tamponador) se debe a los grupos aminos y ácidos terminales y a otros que, formando parte de las cadenas laterales de los aminoácidos, son ionizables. La hemoglobina es el tampón no carbónico más importante de la sangre. También contribuyen a evitar el cambio de ph de manera significativa las proteínas plasmáticas. PROTEÍNAS CONTRÁCTILES.Son de gran importancia la actina y la miosina que funcionan en la contracción muscular. * En las fibras musculares estriadas, los microfilamentos de actina se asocian con proteínas como la miosina, la troponina y la tropomiosina, formando paquetes de filamentos conocidos como miofilamentos. Estos miofilamentos son de 2 tipos: los miofilamentos gruesos, formados exclusivamente por haces de miosina. y los miofilamentos delgados, constituidos por moléculas de actina, troponina y tropomiosina. Los miofilamentos gruesos y delgados se organizan, formando unas estructuras denominadas miofibrillas. El ordenamiento regular de las moléculas hace que en las miofibrillas vistas al microscopio, se observen una serie de bandas características. banda I banda A banda I línea Z línea Z Los filamentos gruesos de miosina, poseen numerosos brazos laterales mediante los cuales entran en contacto con los filamentos adyacentes de actina. Durante la contracción muscular, estos brazos actúan como diminutos remos empujando a los filamentos de actina, los cuales se deslizan sobre los filamentos gruesos. Para que ocurra la contracción muscular se requiere energía suministrada por el ATP. * En las fibras musculares lisas, también hay filamentos gruesos y delgados, alineados al eje longitudinal de la célula. Sin embargo, estos filamentos no están dispuestos según el diseño que se observa en los músculos estriados. PROTEÍNAS REGULADORAS. Muchas hormonas son proteínas. Entre las hormonas proteicas se encuentran la insulina, tirotropina, somatotropina (hormona del crecimiento), hormona luteinizante y hormona estimulante de los folículos. Aquellas hormonas que tienen un peso molecular bajo (< 5.000) se denominan péptidos. Son hormonas peptídicas la adrenocorticotropina, la hormona antidiurética, glucagón y calcitonina. PROTEÍNAS DE RESERVA. La ovoalbúmina de la clara de huevo y la caseína de la leche actúan como proteínas de reserva. 9
Proteínas. Características generales
 Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
Estructura y propiedades de las proteínas
 Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Profesor(a): C.D. María Isabel Pérez Aguilar
 Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Niveles de organización biológica. La composición de los seres vivos
 Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de
 Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
TEORIA CELULAR. En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS
 TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
PROTEÍNAS. Las proteínas están constituidas por la unión de numerosas moléculas sencillas (monómeros) denominados aminoácidos.
 PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS.
 REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
Biología General y Metodología de las Ciencias 2016 BIOMOLÉCULAS
 BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
Proteínas. Tabla 1: Funciones de las proteínas
 Colegio Lectura Hispano Complementaria Americano Depto. de Ciencias - Biología Nivel: 4to medio Unidad I Proteínas 1 En las células, son las proteínas las macromoléculas más abundantes y las que constituyen
Colegio Lectura Hispano Complementaria Americano Depto. de Ciencias - Biología Nivel: 4to medio Unidad I Proteínas 1 En las células, son las proteínas las macromoléculas más abundantes y las que constituyen
BIOMOLÉCULAS. Son moléculas fundamentales para la constitución y funcionamiento de todo ser vivo. Se clasifican en dos grupos:
 FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA
 BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
Repaso: Química celular (biomoléculas)
 Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Biomoléculas orgánicas: Carbohidratos y Lípidos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
Holoproteínas (sólo contienen aa)
 TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
Aminoácidos. Los aminoácidos se agrupan en la figura según las propiedades de sus cadenas
 Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Figura 1: Esquema de polímero
 Eje temático: Química: Fenómenos nucleares Polímeros Procesos químicos industriales Contenido: Tipos de polímeros y polimerización Nivel: Cuarto medio Polímeros. Polímeros sintéticos y naturales Polímeros
Eje temático: Química: Fenómenos nucleares Polímeros Procesos químicos industriales Contenido: Tipos de polímeros y polimerización Nivel: Cuarto medio Polímeros. Polímeros sintéticos y naturales Polímeros
OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo.
 1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
Repaso Opción múltiple Macromoléculas Biológicas
 Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Aminoácidos y péptidos
 Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Glúcidos o hidratos de carbono.
 Glúcidos o hidratos de carbono. Son también denominados carbohidratos, hidratos de carbono, glúcido o azúcares. Los componentes químicos estructurales de los glúcidos son los azúcares simples o monosacáridos.
Glúcidos o hidratos de carbono. Son también denominados carbohidratos, hidratos de carbono, glúcido o azúcares. Los componentes químicos estructurales de los glúcidos son los azúcares simples o monosacáridos.
 Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
CLASIFICACIÓN SEGÚN SU POLARIDAD NO POLARES POLARES NEUTROS ACIDOS BASICOS
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2015 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2015 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
01. INTRODUCCION. Conceptos previos. Verónica González Núñez Universidad de Salamanca
 01. INTRODUCCION. Conceptos previos Verónica González Núñez Universidad de Salamanca ESQUEMA. Introducción. Conceptos previos I. Principales grupos funcionales en Bioquímica II. Formación de compuestos
01. INTRODUCCION. Conceptos previos Verónica González Núñez Universidad de Salamanca ESQUEMA. Introducción. Conceptos previos I. Principales grupos funcionales en Bioquímica II. Formación de compuestos
Proteínas fibrosas. α-queratinas
 Hélices α entrecruzadas por puentes disulfuro Proteínas fibrosas α-queratinas Estructura Características Localización Estructuras resistentes e insolubles de dureza y flexibilidad variables Estructura
Hélices α entrecruzadas por puentes disulfuro Proteínas fibrosas α-queratinas Estructura Características Localización Estructuras resistentes e insolubles de dureza y flexibilidad variables Estructura
Actividad introductoria: Aplicación en la industria de las fuerzas intermoleculares.
 Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR
 INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
Concepto de Lípido. Es un grupo de sustancias muy heterogéneas que sólo tienen en común estas dos características:
 Lípidos Sesión 01 Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden
Lípidos Sesión 01 Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden
La célula. Unidad Los seres vivos están formados por células
 La célula Unidad Los seres vivos están formados por células Definición de célula. Es la unidad anatómico y funcional de todo ser vivo. Tiene función de autoconservación y autorreproducción. Es por esto,
La célula Unidad Los seres vivos están formados por células Definición de célula. Es la unidad anatómico y funcional de todo ser vivo. Tiene función de autoconservación y autorreproducción. Es por esto,
Polímero corto Monómero. síntesis. degradación
 Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Biomoléculas Orgánicas II
 Biomoléculas Orgánicas II INTRODUCCIÓN Tal como se vio en la clase anterior, los elementos químicos se organizan de tal forma que aumentan su complejidad y desarrollan funciones que son específicas. En
Biomoléculas Orgánicas II INTRODUCCIÓN Tal como se vio en la clase anterior, los elementos químicos se organizan de tal forma que aumentan su complejidad y desarrollan funciones que son específicas. En
Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M.
 COLEGIO SAN CRISTOBAL Av. Diego Portales N 1.520. La Florida Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M. MOLÉCULAS ORGANICAS. Los componentes orgánicos de la materia
COLEGIO SAN CRISTOBAL Av. Diego Portales N 1.520. La Florida Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M. MOLÉCULAS ORGANICAS. Los componentes orgánicos de la materia
Tema 5: aminoácidos y proteínas
 1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
Tema 1: Los seres vivos: composición y función
 Tema 1: Los seres vivos: composición y función https://www.youtube.com/watch?v=-s28cydwauo El nivel atómico El nivel atómico Bioelementos: elementos que constituyen la materia viva Fundamentales: C, H,
Tema 1: Los seres vivos: composición y función https://www.youtube.com/watch?v=-s28cydwauo El nivel atómico El nivel atómico Bioelementos: elementos que constituyen la materia viva Fundamentales: C, H,
1. Citosol 2. Citoesqueleto 3. Cilios y flagelos 4. El centrosoma. 1. El Citosol
 1. Citosol 2. Citoesqueleto 3. Cilios y flagelos 4. El centrosoma 1. El Citosol El Citosol, también denominado hialoplasma es el medio acuoso del citoplasma en el que se encuentran inmersos los orgánulos
1. Citosol 2. Citoesqueleto 3. Cilios y flagelos 4. El centrosoma 1. El Citosol El Citosol, también denominado hialoplasma es el medio acuoso del citoplasma en el que se encuentran inmersos los orgánulos
Actividades de los lípidos Tema 1
 Actividades de los lípidos Tema 1 parte 3 BLOQUE 1: TEST 1. Qué tipo de lípidos son los más abundantes en la membrana plasmática de la mayoría de las células? a) Fosfolípidos b) Acidos grasos esenciales
Actividades de los lípidos Tema 1 parte 3 BLOQUE 1: TEST 1. Qué tipo de lípidos son los más abundantes en la membrana plasmática de la mayoría de las células? a) Fosfolípidos b) Acidos grasos esenciales
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas.
 La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
UNIVERSIDAD DEL QUINDÍO UNIDAD 3: LÍPIDOS
 UNIVERSIDAD DEL QUINDÍO ASIGNATURA: Bioquímica DOCENTE: Edwin David Morales Álvarez Correo Electrónico: davidmorales@uniquindio.edu.co UNIDAD 3: LÍPIDOS Los lípidos son biomoléculas orgánicas formadas
UNIVERSIDAD DEL QUINDÍO ASIGNATURA: Bioquímica DOCENTE: Edwin David Morales Álvarez Correo Electrónico: davidmorales@uniquindio.edu.co UNIDAD 3: LÍPIDOS Los lípidos son biomoléculas orgánicas formadas
Agua, carbohidratos y Lípidos
 Agua, carbohidratos y Lípidos Biomoléculas Inorgánicas Características del agua El agua es el principal e imprescindible componente del cuerpo humano. Aproximadamente el 60 % de este agua se encuentra
Agua, carbohidratos y Lípidos Biomoléculas Inorgánicas Características del agua El agua es el principal e imprescindible componente del cuerpo humano. Aproximadamente el 60 % de este agua se encuentra
1. TEORÍA CELULAR 2. ORGANIZACIÓN CELULAR PROCARIOTA 3. ORGANIZACIÓN CELULAR EUCARIOTA: ANIMAL Y VEGETAL
 LAS CÉLULAS INDICE: 1. TEORÍA CELULAR 2. ORGANIZACIÓN CELULAR PROCARIOTA 3. ORGANIZACIÓN CELULAR EUCARIOTA: ANIMAL Y VEGETAL 1º.- TEORÍA CELULAR Los principios básicos de la teoría celular son: La célula
LAS CÉLULAS INDICE: 1. TEORÍA CELULAR 2. ORGANIZACIÓN CELULAR PROCARIOTA 3. ORGANIZACIÓN CELULAR EUCARIOTA: ANIMAL Y VEGETAL 1º.- TEORÍA CELULAR Los principios básicos de la teoría celular son: La célula
ESTRUCTURA Y FUNCION CELULAR
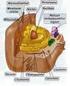 ESTRUCTURA Y FUNCION CELULAR Sumario Historia de la teoría celular Estructura y función celular 1. El núcleo 2. Los organelos citoplásmicos 3. Los organelos de células vegetales Transporte celular Métodos
ESTRUCTURA Y FUNCION CELULAR Sumario Historia de la teoría celular Estructura y función celular 1. El núcleo 2. Los organelos citoplásmicos 3. Los organelos de células vegetales Transporte celular Métodos
HISTORIA DE SU DESCUBRIMIENTO
 1 HISTORIA DE SU DESCUBRIMIENTO La primera referencia histórica escrita acerca del hidrógeno procede de Paracelso, célebre alquimista, quien en el s. XVI observó un aire (que se desprendía al hacer reaccionar
1 HISTORIA DE SU DESCUBRIMIENTO La primera referencia histórica escrita acerca del hidrógeno procede de Paracelso, célebre alquimista, quien en el s. XVI observó un aire (que se desprendía al hacer reaccionar
LA LA ESTRUCTURA DE LA MATERIA. 1.-Desarrollo histórico del concepto de átomo. Teoría de Demócrito. Teoría de Dalton. Componentes del átomo
 ANEXO AL TEMA 4 LA LA ESTRUCTURA DE LA MATERIA 1.-Desarrollo histórico del concepto de átomo Teoría de Demócrito Teoría de Dalton Modelo actual Componentes del átomo Concepto de ión 2.-Elememtos y compuestos
ANEXO AL TEMA 4 LA LA ESTRUCTURA DE LA MATERIA 1.-Desarrollo histórico del concepto de átomo Teoría de Demócrito Teoría de Dalton Modelo actual Componentes del átomo Concepto de ión 2.-Elememtos y compuestos
Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas
 Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas por miles, o millones de átomos. MACROMOLÉCULAS Son
Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas por miles, o millones de átomos. MACROMOLÉCULAS Son
I) Biomoléculas 6) Proteínas I-6 PROTEÍNAS
 I-6 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
I-6 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO
 COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO NOMBRE: PJE. TOTAL: FECHA: CURSO: 1 MEDIO PJE. OBTENIDO: CALIFICACION: ASIGNATURA: BIOLOGIA UNIDAD: I - II OBJETIVO (S): CONTENIDO
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO NOMBRE: PJE. TOTAL: FECHA: CURSO: 1 MEDIO PJE. OBTENIDO: CALIFICACION: ASIGNATURA: BIOLOGIA UNIDAD: I - II OBJETIVO (S): CONTENIDO
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR ESQUEMA - Composición iónica de los medios corporales - Capacidad tampón - Mantenimiento
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR ESQUEMA - Composición iónica de los medios corporales - Capacidad tampón - Mantenimiento
Tema 4. Fuerzas intermoleculares
 Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
UNIDAD 1. D. Borja Blanco Vives. Profesor de Biología y Geología 4ºESO
 UNIDAD 1. D. Borja Blanco Vives. Profesor de Biología y Geología 4ºESO 1. LA COMPOSICIÓN DE LOS SERES VIVOS. Todos los seres vivos están formados por: - materia inorgánica: agua y sales minerales - materia
UNIDAD 1. D. Borja Blanco Vives. Profesor de Biología y Geología 4ºESO 1. LA COMPOSICIÓN DE LOS SERES VIVOS. Todos los seres vivos están formados por: - materia inorgánica: agua y sales minerales - materia
Estructura tridimensional de proteínas
 Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Interacciones químicas de no enlace. Fuerzas de van der Waals
 Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
INTRODUCCION A LA ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS
 INTRODUCCION A LA ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS Lic. Claudio Vidos Departamento de investigación de DEMIK Electromedicina Director del INSTITUTO CAV Rehabilitación Departamento de investigación
INTRODUCCION A LA ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS Lic. Claudio Vidos Departamento de investigación de DEMIK Electromedicina Director del INSTITUTO CAV Rehabilitación Departamento de investigación
Estructura celular. Teoría Celular. Cap. 4. Los organismos se componen de una o más células. La célula es la unidad más pequeña de la vida.
 Estructura celular Cap. 4 Teoría Celular Los organismos se componen de una o más células. Procesos metabólicos y de la herencia ocurren dentro de la célula. La célula es la unidad más pequeña de la vida.
Estructura celular Cap. 4 Teoría Celular Los organismos se componen de una o más células. Procesos metabólicos y de la herencia ocurren dentro de la célula. La célula es la unidad más pequeña de la vida.
Biología. 2º Bachillerato LAS MOLÉCULAS DE LA VIDA. Los lípidos
 I. LAS MOLÉCULAS DE LA VIDA 3 Los lípidos 1. Los lípidos: propiedades generales 2. Ácidos grasos 3. Triacilglicéridos 4. Ceras 5. Lípidos de membrana 6. Lípidos sin ácidos grasos 1. Los lípidos: propiedades
I. LAS MOLÉCULAS DE LA VIDA 3 Los lípidos 1. Los lípidos: propiedades generales 2. Ácidos grasos 3. Triacilglicéridos 4. Ceras 5. Lípidos de membrana 6. Lípidos sin ácidos grasos 1. Los lípidos: propiedades
Fuerzas Intermoleculares. Materia Condensada.
 Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares.
 Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
ESTRUCTURA 4ª. áá ESENCIAL
 PROTEINAS COMPOSICIÓN AMINOÁCIDOS ENLACE PEPTÍDICO ESTRUCTURA CLASIFICACIÓN áá ESENCIAL PROPIEDADES NO POLARES POLARES S/CARGA POLARES C/CARGA OPTICAS ACIDO-BASE (Anfóteras) SOLUBILIDAD PUNTO DE FUSIÓN
PROTEINAS COMPOSICIÓN AMINOÁCIDOS ENLACE PEPTÍDICO ESTRUCTURA CLASIFICACIÓN áá ESENCIAL PROPIEDADES NO POLARES POLARES S/CARGA POLARES C/CARGA OPTICAS ACIDO-BASE (Anfóteras) SOLUBILIDAD PUNTO DE FUSIÓN
Textos de refuerzo. 2. Formación de ADN y ARN. 1. Principios de bioquímica. Proteínas. 1 Unidad 3
 1. Principios de bioquímica 2. Formación de ADN y ARN 1. Principios de bioquímica La bioquímica estudia los componentes químicos de los seres vivos: proteínas, carbohidratos, lípidos y ácidos nucleicos.
1. Principios de bioquímica 2. Formación de ADN y ARN 1. Principios de bioquímica La bioquímica estudia los componentes químicos de los seres vivos: proteínas, carbohidratos, lípidos y ácidos nucleicos.
En un organismo unicelular, como una bacteria o un protista, la célula única debe realizar todas las funciones necesarias para la vida.
 HISTOLOGIA ANIMAL En un organismo unicelular, como una bacteria o un protista, la célula única debe realizar todas las funciones necesarias para la vida. Tejidos Los animales pueden alcanzar grandes tallas
HISTOLOGIA ANIMAL En un organismo unicelular, como una bacteria o un protista, la célula única debe realizar todas las funciones necesarias para la vida. Tejidos Los animales pueden alcanzar grandes tallas
EL A.D.N. Existen 2 tipos de Acidos Nucleicos : ADN (Acido Desoxirribonucleico) y ARN (Acido Ribonucleico) Diferencias entre ADN y ARN
 EL A.D.N Existen 2 tipos de Acidos Nucleicos : ADN (Acido Desoxirribonucleico) y ARN (Acido Ribonucleico) Diferencias entre ADN y ARN Hay tres tipos netamente diferenciados de ARN, tanto en su estructura
EL A.D.N Existen 2 tipos de Acidos Nucleicos : ADN (Acido Desoxirribonucleico) y ARN (Acido Ribonucleico) Diferencias entre ADN y ARN Hay tres tipos netamente diferenciados de ARN, tanto en su estructura
- Las proteínas son esenciales para la formación y el mantenimiento de los tejidos corporales.
 TEMA 6. PROTEÍNAS - Las proteínas son esenciales para la formación y el mantenimiento de los tejidos corporales. - Los aa son los elementos estructurales de las proteínas. Las proteínas de plantas y animales
TEMA 6. PROTEÍNAS - Las proteínas son esenciales para la formación y el mantenimiento de los tejidos corporales. - Los aa son los elementos estructurales de las proteínas. Las proteínas de plantas y animales
Metabolismo y uso de Proteínas. Jorge Ml. Sánchez Centro de Inv. en Nutrición Animal Escuela de Zootecnia Universidad de Costa Rica
 Metabolismo y uso de Proteínas Jorge Ml. Sánchez Centro de Inv. en Nutrición Animal Escuela de Zootecnia Universidad de Costa Rica Metabolismo de las Proteínas Funciones en el organismo 1. Constituyen
Metabolismo y uso de Proteínas Jorge Ml. Sánchez Centro de Inv. en Nutrición Animal Escuela de Zootecnia Universidad de Costa Rica Metabolismo de las Proteínas Funciones en el organismo 1. Constituyen
UNIDAD II ANATOMÍA Y FISIOLOGÍA DE LA CÉLULA. Prof. Glamil Acevedo Anatomía y Fisiología
 UNIDAD II ANATOMÍA Y FISIOLOGÍA DE LA CÉLULA Prof. Glamil Acevedo Anatomía y Fisiología La Célula Es la unidad funcional y estructural más pequeña de los organismos vivos. Se compone de partes características,
UNIDAD II ANATOMÍA Y FISIOLOGÍA DE LA CÉLULA Prof. Glamil Acevedo Anatomía y Fisiología La Célula Es la unidad funcional y estructural más pequeña de los organismos vivos. Se compone de partes características,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
Metabolismo de AMINOÁCIDOS
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Metabolismo de AMINOÁCIDOS Dr. Mynor A. Leiva Enríquez Fuente:
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Metabolismo de AMINOÁCIDOS Dr. Mynor A. Leiva Enríquez Fuente:
Pág ª) Qué es un ser vivo? Un ser formado por células que es capaz de desempeñar las tres funciones vitales:
 TEMA 1 Pág. 160 1ª) Qué es un ser vivo? Un ser formado por células que es capaz de desempeñar las tres funciones vitales: Pág. 10 2ª ) Qué reinos de seres vivos habitan en la tierra? Moneras, protoctistas,
TEMA 1 Pág. 160 1ª) Qué es un ser vivo? Un ser formado por células que es capaz de desempeñar las tres funciones vitales: Pág. 10 2ª ) Qué reinos de seres vivos habitan en la tierra? Moneras, protoctistas,
Funciones biológicas de las proteínas. 1.- Enzimas. Las proteínas más variadas y de mayor especialización son aquéllas con actividad catalítica.
 Funciones biológicas de las proteínas 1.- Enzimas. Las proteínas más variadas y de mayor especialización son aquéllas con actividad catalítica. 2.- Proteínas de transporte. Proteínas de transporte en el
Funciones biológicas de las proteínas 1.- Enzimas. Las proteínas más variadas y de mayor especialización son aquéllas con actividad catalítica. 2.- Proteínas de transporte. Proteínas de transporte en el
En un organismo unicelular, como una bacteria o un protista, la célula única debe realizar todas las funciones necesarias para la vida.
 HISTOLOGIA HUMANA OBJETIVOS: Conocer los diferentes tipos de tejido que posee el cuerpo humano. Aprender a diferenciar los 4 tipos de tejidos fundamentales y conocer sus funciones. Conocer superficialmente
HISTOLOGIA HUMANA OBJETIVOS: Conocer los diferentes tipos de tejido que posee el cuerpo humano. Aprender a diferenciar los 4 tipos de tejidos fundamentales y conocer sus funciones. Conocer superficialmente
LA CÉLULA Y SUS ORGANELOS. Colegio Internacional Montessori Ciencias Naturales-1ro Básico Walter Moscoso Zschech
 LA CÉLULA Y SUS ORGANELOS Colegio Internacional Montessori Ciencias Naturales-1ro Básico Walter Moscoso Zschech LA CÉLULA Es la unidad básica de la vida. Según la teoría celular todos los organismos vivos:
LA CÉLULA Y SUS ORGANELOS Colegio Internacional Montessori Ciencias Naturales-1ro Básico Walter Moscoso Zschech LA CÉLULA Es la unidad básica de la vida. Según la teoría celular todos los organismos vivos:
METABOLISMO DE LIPIDOS
 METABOLISMO DE LIPIDOS Al igual que en el metabolismo de los carbohidratos, el metabolismo de lípidos consiste en: Digestión Transporte Almacenamiento Degradación Biosíntesis DIGESTIÓN DE LIPIDOS Los lípidos
METABOLISMO DE LIPIDOS Al igual que en el metabolismo de los carbohidratos, el metabolismo de lípidos consiste en: Digestión Transporte Almacenamiento Degradación Biosíntesis DIGESTIÓN DE LIPIDOS Los lípidos
DOGMA CENTRAL DE LA BIOLOGIA
 La única diferencia entre las moléculas de ADN de distintos individuos es el orden en el que se disponen sus nucleótidos; lo que se denomina secuencia. Los nucleótidos se ordenan a modo de palabras que
La única diferencia entre las moléculas de ADN de distintos individuos es el orden en el que se disponen sus nucleótidos; lo que se denomina secuencia. Los nucleótidos se ordenan a modo de palabras que
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
Resultado de aprendizaje:
 Objetivo: Describir composición y arquitectura de las membranas biológicas Resultado de aprendizaje: Explicar la dinámica de las membranas biologicas y su implicación funcional. INTRODUCCION La mayoría
Objetivo: Describir composición y arquitectura de las membranas biológicas Resultado de aprendizaje: Explicar la dinámica de las membranas biologicas y su implicación funcional. INTRODUCCION La mayoría
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO PRUEBA DE REFORZAMIENTO 1 MEDIO EXAMENES LIBRES
 COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO PRUEBA DE REFORZAMIENTO 1 MEDIO EXAMENES LIBRES ASIGNATURA: UNIDAD: OBJETIVO (S): CONTENIDO (S): BIOLOGIA I - II Reconocer los elementos principales de la célula
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO PRUEBA DE REFORZAMIENTO 1 MEDIO EXAMENES LIBRES ASIGNATURA: UNIDAD: OBJETIVO (S): CONTENIDO (S): BIOLOGIA I - II Reconocer los elementos principales de la célula
Tema 4b Estructura tridimensional de las proteínas. Estructura supersecundaria y terciaria.
 Tema 4b Estructura tridimensional de las proteínas. Estructura supersecundaria y terciaria. Estructura supersecundaria Motivos Dominios Estructura terciaria Fuerzas que la estabilizan Plegamiento de proteínas
Tema 4b Estructura tridimensional de las proteínas. Estructura supersecundaria y terciaria. Estructura supersecundaria Motivos Dominios Estructura terciaria Fuerzas que la estabilizan Plegamiento de proteínas
TEMA 1. ORGANIZACIÓN DEL CUERPO HUMANO
 TEMA 1. ORGANIZACIÓN DEL CUERPO HUMANO I.- NIVELES DE ORGANIZACIÓN DE LOS SERES HUMANOS. Elementos o átomos C H O N P S Moléculas sencillas H 2 O O 2 Aminoácido Monosacárido Moléculas complejas Células
TEMA 1. ORGANIZACIÓN DEL CUERPO HUMANO I.- NIVELES DE ORGANIZACIÓN DE LOS SERES HUMANOS. Elementos o átomos C H O N P S Moléculas sencillas H 2 O O 2 Aminoácido Monosacárido Moléculas complejas Células
Proteínas. José Seijo Ramil
 P.1. Aminoácidos: P.1.1. Concepto y fórmula general. P.1.2. Estereoisomería y actividad óptica P.1.3. Propiedades de los aminoácidos: Comportamiento anfótero. Punto isoeléctrico P.1.4 Clasificación P.2.
P.1. Aminoácidos: P.1.1. Concepto y fórmula general. P.1.2. Estereoisomería y actividad óptica P.1.3. Propiedades de los aminoácidos: Comportamiento anfótero. Punto isoeléctrico P.1.4 Clasificación P.2.
Bloque II: Estructura y fisiología de la célula TEMA 10: LA CÉLULA EUCARIOTA: ESTRUCTURAS Y ORGÁNULOS NO MEMBRANOSOS.
 Bloque II: Estructura y fisiología de la célula TEMA 10: LA CÉLULA EUCARIOTA: ESTRUCTURAS Y ORGÁNULOS NO MEMBRANOSOS. PARED CELULAR Envoltura gruesa y rígida. En plantas, hongos, algas y bacterias. LA
Bloque II: Estructura y fisiología de la célula TEMA 10: LA CÉLULA EUCARIOTA: ESTRUCTURAS Y ORGÁNULOS NO MEMBRANOSOS. PARED CELULAR Envoltura gruesa y rígida. En plantas, hongos, algas y bacterias. LA
Energía y metabolismo
 Energía y metabolismo Sesión 17 Introducción a la Biología Prof. Nelson A. Lagos Los sistemas vivos son abiertos y requieren energía para mantenerse La energía es la capacidad de hacer trabajo. Cinético
Energía y metabolismo Sesión 17 Introducción a la Biología Prof. Nelson A. Lagos Los sistemas vivos son abiertos y requieren energía para mantenerse La energía es la capacidad de hacer trabajo. Cinético
QUÍMICA DE PROTEÍNAS
 QUÍMICA DE PROTEÍNAS COMPOSICIÓN ALIMENTO VOLATIL POR SECADO (AGUA o HUMEDAD) MATERIA SECA ORGANICA INORGANICA (CENIZAS) SOLUBLE EN DISOLVENTES ORGANICOS (GRASA O LIPIDOS) CON NITROGENO (PROTEINAS) NO
QUÍMICA DE PROTEÍNAS COMPOSICIÓN ALIMENTO VOLATIL POR SECADO (AGUA o HUMEDAD) MATERIA SECA ORGANICA INORGANICA (CENIZAS) SOLUBLE EN DISOLVENTES ORGANICOS (GRASA O LIPIDOS) CON NITROGENO (PROTEINAS) NO
Los elementos químicos
 Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
11. FUERZAS INTERMOLECULARES
 Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Tema 2. El agua, el ph y los equilibrios iónicos
 Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
Sistema Integrado de Gestión RECONOCIMIENTO Y PROPIEDADES DE LAS PROTEINAS PROGRAMAS DE DEPORTE Y FISIOTERAPIA GUIA PRÁCTICA N 6
 Sistema Integrado de Gestión RECONOCIMIENTO Y PROGRAMAS DE DEPORTE Y Versión 3 Proceso: Investigación - IV Octubre de 2013 Página 2 de 10 1. OBJETIVOS Reconocer algunas propiedades de las proteínas Determinar
Sistema Integrado de Gestión RECONOCIMIENTO Y PROGRAMAS DE DEPORTE Y Versión 3 Proceso: Investigación - IV Octubre de 2013 Página 2 de 10 1. OBJETIVOS Reconocer algunas propiedades de las proteínas Determinar
Departamento de Química Física Facultad de Ciencias
 Interacciones electrostáticas. Interacciones electrostáticas. Los fenómenos de interacción con el disolvente y cosolventes. Interacciones electrostáticas. El origen de las cargas en proteínas. Fuentes
Interacciones electrostáticas. Interacciones electrostáticas. Los fenómenos de interacción con el disolvente y cosolventes. Interacciones electrostáticas. El origen de las cargas en proteínas. Fuentes
Selectividad: ANATOMÍA CELULAR
 Selectividad: ANATOMÍA CELULAR Jun09.3.- La figura siguiente muestra un orgánulo celular importante. a.- Cómo se llama este orgánulo? b.- En qué tipo de células se encuentra? c.- Indica qué estructura
Selectividad: ANATOMÍA CELULAR Jun09.3.- La figura siguiente muestra un orgánulo celular importante. a.- Cómo se llama este orgánulo? b.- En qué tipo de células se encuentra? c.- Indica qué estructura
I) Biomoléculas 2) El agua I-2 EL AGUA
 I-2 EL AGUA IMPRTANCIA DEL AGUA PARA LS SERES VIVS El agua es el líquido más abundante de la corteza y uno de los pocos líquidos naturales. No es de extrañar entonces que el agua sea una sustancia esencial
I-2 EL AGUA IMPRTANCIA DEL AGUA PARA LS SERES VIVS El agua es el líquido más abundante de la corteza y uno de los pocos líquidos naturales. No es de extrañar entonces que el agua sea una sustancia esencial
TRABAJO PRACTICO Nº2 RECONOCIMIENTO Y PROPIEDADES DE LAS PROTEINAS
 1 TRABAJO PRACTICO Nº2 RECONOCIMIENTO Y PROPIEDADES DE LAS PROTEINAS I) Péptidos Los aminoácidos pueden condesarse entre sí, uniéndose a través del grupo carboxilo de un aminoácido al grupo amino de otro
1 TRABAJO PRACTICO Nº2 RECONOCIMIENTO Y PROPIEDADES DE LAS PROTEINAS I) Péptidos Los aminoácidos pueden condesarse entre sí, uniéndose a través del grupo carboxilo de un aminoácido al grupo amino de otro
Proteínas: Leche y caseína
 Proteínas: Leche y caseína El papel de la leche en la naturaleza es para alimentar y proporcionar una protección inmunológica para los mamíferos jóvenes. La leche ha sido una fuente de alimento para los
Proteínas: Leche y caseína El papel de la leche en la naturaleza es para alimentar y proporcionar una protección inmunológica para los mamíferos jóvenes. La leche ha sido una fuente de alimento para los
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López.
 Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
PROTEÍNAS Y ÁCIDOS NUCLEICOS
 DESAFÍO Nº 10 Profesor Mauricio Hernández Fonseca Biología 1 Medio Nombre del Estudiante : Curso : PROTEÍNAS Y ÁCIDOS NUCLEICOS TIMBRE PROTEÍNAS Las proteínas son macromoléculas de elevada masa molecular.
DESAFÍO Nº 10 Profesor Mauricio Hernández Fonseca Biología 1 Medio Nombre del Estudiante : Curso : PROTEÍNAS Y ÁCIDOS NUCLEICOS TIMBRE PROTEÍNAS Las proteínas son macromoléculas de elevada masa molecular.
