INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA LUCENTIS (RANIBIZUMAB) (1/10/2007)
|
|
|
- Ana Soto Fernández
- hace 6 años
- Vistas:
Transcripción
1 Centro de Información de Medicamentos Servicio de Farmacia INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA LUCENTIS (RANIBIZUMAB) (1/10/2007) Datos del solicitante El Dr.Juan Lopez Moya, Jefe de Servicio de Oftalmología solicita Lucentis (Ranibizumab) como tratamiento de elección en las membranas neovasculares subretinianas de la Degeneración Macular Asociada a la Edad (DAME) húmeda. Datos del medicamento DCI: RANIBIZUMAB Grupo terapéutico: S01LA AGENTES ANTINEOVASCULARIZACIÓN Presentaciones comerciales: Forma Farmacéutica Dosificación Nombre comercial Laboratorio PVP + IVA Vial 10 mg/ml 0,3 ml LUCENTIS Novartis Farmacología Acción farmacológica: Ranibizumab es un fragmento de anticuerpo monoclonal recombinante humanizado dirigido contra el factor de crecimiento endotelial vascular A (VEGF-A) humano. Se une con alta afinidad a las isoformas del VEGFA (p. ej. VEGF110, VEGF121 y VEGF165), impidiendo, por tanto, la unión del VEGF-A a sus receptores VEGFR-1 y VEGFR-2. La unión del VEGF-A a sus receptores conduce a la proliferación de las células endoteliales y la neovascularización, así como a la exudación vascular, todo lo cual se cree que contribuye a la progresión de la forma neovascular de la degeneración macular asociada a la edad. Farmacocinética : Tras la administración intravítrea mensual, las concentraciones séricas de ranibizumab fueron en general bajas, con niveles máximos (Cmax) por debajo de la concentración de ranibizumab necesaria para inhibir la actividad biológica del VEGF en un 50%. En base al análisis farmacocinético poblacional y a la desaparición sérica de ranibizumab en pacientes tratados con la dosis de 0,5 mg, el promedio de la vida media de eliminación vítrea de ranibizumab es de 10 días aproximadamente. Tras la administración intravítrea la Cmax de ranibizumab sérica se prevé alcanzar en aproximadamente 1 día. Se prevé que las concentraciones séricas de ranibizumab sean aproximadamente veces inferiores a las concentraciones vítreas de ranibizumab. Indicaciones clínicas: Tratamiento de la degeneración macular asociada a la edad neovascular (exudativa). Posología y forma de administración: -Vía intravítrea: La dosis recomendada es 0,5 mg (0,05 ml). CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 1
2 -El tratamiento con ranibizumab se inicia con una fase de carga, que consiste en una inyección al mes durante tres meses consecutivos, seguida de una fase de mantenimiento en la cual se deberá controlar la agudeza visual de los pacientes mensualmente. Si el paciente experimenta una pérdida de agudeza visual superior a 5 letras (ETDRS o equivalente a una línea Snellen), se le deberá administrar ranibizumab. - El intervalo entre dos dosis no debe ser inferior a 1 mes. Embarazo y lactancia : No existen datos sobre la utilización de ranibizumab en mujeres embarazadas. No existen estudios en animales. Cabe esperar que la exposición sistémica a ranibizumab tras la administración ocular sea muy baja, pero debido a su mecanismo de acción, ranibizumab debe considerarse como potencialmente teratogénico y embrio/fetotóxico. Por ello ranibizumab no se deberá usar durante el embarazo salvo que el beneficio esperado supere el riesgo potencial para el feto. Las mujeres en edad fértil deberán utilizar un método anticonceptivo eficaz durante el tratamiento. Se desconoce si ranibizumab se excreta en la leche materna. No se recomienda la lactancia durante el uso de este medicamento. Ancianos : No se requiere ningún ajuste de la dosis en pacientes de edad avanzada. Reacciones adversas : Los efectos adversos se listan con un sistema de clasificación de órganos y frecuencia usando el siguiente criterio: muy frecuentes (>=1/10), frecuentes (>=1/100, <1/10), poco frecuentes (>=1/1.000, <1/100), raras (>=1/10.000, <1/1.000), muy raras (<1/10.000), no conocidas (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se presentan en orden decreciente de gravedad dentro de cada intervalo frecuencia. - Trastornos cardiacos Poco frecuentes: [FIBRILACION AURICULAR] - Trastornos oculares Muy frecuente: [HEMORRAGIA RETINIANA], [DOLOR OCULAR], partículas flotantes en el vítreo, aumento de la presión intraocular, desprendimiento de vítreo, inflamación intraocular, irritación ocular, [CATARATAS], sensación de cuerpo extraño en los ojos, alteración visual, [BLEFARITIS], fibrosis subretiniana, hiperemia ocular, agudeza visual borrosa/disminuída, [SEQUEDAD DE OJOS], vitritis. Frecuentes: Molestia ocular, hiperemia conjuntival, opacificación de la cápsula posterior, exudados retinianos, reacciones en el lugar de inyección, lacrimación aumentada, prurito ocular, [CONJUNTIVITIS], maculopatía, desprendimiento del epitelio pigmentario retiniano. Poco frecuentes Degeneración retiniana, [IRITIS], iridociclitis, queratitis punctata, queratopatía, dellen, estrías corneales, trastorno retiniano, trastorno del cuerpo vítreo, [FOTOFOBIA], catarata nuclear, células flotantes en la cámara anterior, abrasión corneal, [GLAUCOMA EN ANGULO ESTRECHO], hemorragia vítrea, [UVEITIS], endoftalmitis, desprendimiento de retina, desgarro retiniano, hemorragia ocular, edema palpebral, irritación palpebral, [CEGUERA], edema corneal, hipopion. - Trastornos respiratorios, torácicos y mediastínicos Poco frecuentes: [TOS], [SIBILANCIAS], aumento de la secreción de las vías respiratorias altas - Trastornos gastrointestinales Frecuente: [NAUSEAS] - Trastornos de la piel y del tejido subcutáneo Poco frecuentes: Queratosis liquenoide - Trastornos musculoesqueléticos y del tejido conjuntivo Frecuentes: [ARTRALGIA], dolor de espalda - Infecciones e infestaciones Frecuentes: [BRONQUITIS], [ANEMIA] - Trastornos vasculares Muy frecuentes: [HIPERTENSION ARTERIAL] - Trastornos del sistema nervioso La disponibilidad sistémica de inhibidores del VEGF Muy frecuentes: [CEFALEA] (factor de crecimiento endotelial vascular) muy potentes se ha relacionado con acontecimientos CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 2
3 tromboembólicos arteriales, según define la Antiplatelet Trialists' Collaboration, que incluyen muertes vasculares, infartos de miocardio no mortales, accidentes cerebrovasculares isquémicos no mortales y accidentes cerebrovasculares hemorrágicos no mortales. Cuando se combinaron los datos del primer año de los tres ensayos fase III (MARINA, ANCHOR y PIER), la incidencia global de acontecimientos tromboembólicos arteriales fue mayor para los pacientes tratados con ranibizumab 0,5 mg (2,5%) en comparación con el brazo control (1,1%). Sin embargo, en el segundo año del ensayo MARINA, el índice de acontecimientos tromboembólicos arteriales fue similar en los pacientes tratados con ranibizumab 0,5 mg (2,6%) comparado con los pacientes incluidos en el brazo control (3,2%). Evaluación de la eficacia y seguridad Población: Se incluyeron un total de 423 pacientes con Los ensayos clínicos comparativos tras revisar la DMAE con neovascularización coroidea (en subfóvea) bibliografía han sido: Se incluyeron todos los subtipos de lesiones ESTUDIO MARINA(1) angiográficas. Si eran del tipo de las clásicas, la lesión debía ser<50% del tamaño total de la lesión área, Diseño: Estudio prospectivo, randomizado, doble-ciego, multicéntrico y comparado con placebo. Población: Se incluyeron un total de 716 pacientes con DMAE con neovascularización coroidea (en subfóvea) siendo el mayor tamaño de lesión permitido de hasta 5400µm en su diámetro mayor. Se incluyeron todos los subtipos de lesiones Ranibizumab: 0.3mg ó 0.5mg, o verteprofin, cada mes angiográficas. Si eran del tipo de las clásicas, la lesión debía ser<50% del tamaño total de la lesión área, siendo el mayor tamaño de lesión permitido de hasta y durante 48 semanas como máximo. Resultados: El 96,4% de los sujetos tratados con ranibizumab 0,5 mg perdieron menos de 15 letras. El 12 discos ópticos (1 disco=2.54 mm2). 64,3% de los pacientes tratados con terapia fotodinámica perdieron menos de 15 letras. Ranibizumab: 0.3mg ó 0.5mg, o placebo, cada mes y durante 48 semanas como máximo. Variable principal: % pacientes que perdían <15 letras de agudeza visual desde el inicio hasta los primeros 12 meses. Resultados: El 90% de los pacientes que recibieron ranibizumab 0,5 mg perdieron menos de 15 letras a los 24 meses de tratamiento. El 52,9% de los pacientes del grupo de inyección simulada perdieron menos de 15 El 40,3% de los pacientes tratados con Lucentis 0,5 mg presentaron una ganancia de 15 letras o más en comparación con el 5,6% de los pacientes tratados con terapia fotodinámica. ESTUDIO PIER(3) Diseño: Estudio prospectivo, randomizado, simple ciego, multicéntrico y comparado con placebo Población: Se incluyeron un total de 184 pacientes con DMAE con neovascularización coroidea (en subfóvea) letras a los 24 meses. El 33,3% de los pacientes Se incluyeron todos los subtipos de lesiones tratados con Lucentis 0,5 mg presentaron una ganancia de 15 letras o más en comparación con el 3,8% de los pacientes que recibieron el tratamiento simulado a los 24 meses. angiográficas Ranibizumab: 0.3mg ó 0.5mg, o placebo, cada mes durante los primeros 3 meses, y después cada 4 ESTUDIO ANCHOR(2) meses Diseño: Estudio prospectivo, randomizado, simple ciego, multicéntrico y comparado con verteporfin Variable principal: % pacientes que perdían <15 letras de agudeza visual desde el inicio hasta los primeros 12 meses. CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 3
4 Resultados: Casi todos los pacientes tratados con Lucentis (90%) mantuvieron su agudeza visual en el mes 12. También disponemos ahora de los resultados a 2 años del estudio MARINA, que reflejan una eficacia mantenida a lo largo del tiempo, con ligeros mejores resultados en la dosis de 0.5mg vs 0.3mg. Los efectos adversos graves relacionados con el procedimiento de inyección y que ocurrieron en <0,1% de las inyecciones intravítreas incluyeron endoftalmitis, desprendimiento de retina regmatógeno, desgarro retiniano y catarata traumática iatrogénica. Otros acontecimientos oculares graves observados en pacientes tratados con Ranibizumab y que ocurrieron en <1% de los pacientes incluyeron inflamación intraocular y aumento de la presión intraocular. En los tres ensayos fase III controlados FVF2598g (MARINA), FVF2587g (ANCHOR) y FVF3192g (PIER), los efectos adversos listados a continuación ocurrieron con una frecuencia superior (como mínimo 3 puntos porcentuales) en los pacientes que recibieron el tratamiento con Ranibizumab 0,5 mg respecto a los que recibieron el tratamiento control (tratamiento simulado (sham) o TFD con verteporfina). Por ello fueron considerados reacciones adversas (RAs) potenciales. Los datos de seguridad que se describen a continuación también incluyen todos los efectos adversos con sospecha de estar al menos potencialmente relacionados con el procedimiento de inyección o con el medicamento, en el análisis combinado de los 440 pacientes de los grupos de tratamiento que recibieron 0,5 mg. Las reacciones adversas se presentan en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Trastornos cardiacos: Poco frecuentes: Fibrilación atrial Trastornos del sistema nervioso: Muy frecuentes: Cefalea Trastornos oculares: Muy frecuentes: Hemorragia conjuntival, dolor ocular, partículas flotantes en el vítreo, hemorragia retiniana, aumento de la presión intraocular, desprendimiento de vítreo, inflamación intraocular, irritación ocular, catarata, sensación de cuerpo extraño en los ojos, alteración visual, blefaritis, fibrosis subretiniana, hiperemia ocular, agudeza visual borrosa/disminuída, ojo seco, vitritisfrecuentes: Molestia ocular, hiperemia conjuntival, opacificación de la cápsula posterior, exudados retinianos, reacciones en el lugar de inyección, lacrimación aumentada, prurito ocular, conjuntivitis, maculopatía, desprendimiento del epitelio pigmentario retiniano Poco frecuentes: Degeneración retiniana, iritis, iridociclitis, queratitis punctata, queratopatía, dellen, estrías corneales, trastorno retiniano, trastorno del cuerpo vítreo, fotofobia, catarata nuclear, células flotantes en la cámara anterior, abrasión corneal, glaucoma de ángulo cerrado, hemorragia vítrea, uveitis, endoftalmitis, desprendimiento de retina, desgarro retiniano, hemorragia ocular, edema palpebral, irritación palpebral, ceguera, edema corneal, hipopion Trastornos respiratorios, torácicos y mediastínicos: Poco frecuentes: Tos, sibilancias, aumento de la secreción de las vías respiratorias altas Trastornos gastrointestinales: Frecuentes: Náuseas Trastornos de la piel y del tejido subcutáneo: Poco frecuentes: Queratosis liquenoide Trastornos musculoesqueléticos y del tejido conjuntivo: Frecuentes: Artralgia, dolor de espalda Infecciones e infestaciones: Frecuentes: Bronquitis, anemia Trastornos vasculares: Muy frecuentes: Hipertensión/presión sanguínea elevada Notificaciones recientes de seguridad Genentech realizó un comunicado advirtiendo del análisis intermedio de seguridad llevado a cabo en el estudio SAILOR. Este estudio, aún en marcha, se evaluaban las dosis de 0.3 y 0.5mg. En el análisis realizado, la incidencia de infarto cerebral fue superior en el brazo de la dosis de 0.5mg: 0.2% vs 0.3%, p=0.02). En pacientes con algún antecedente el riesgo era aún mayor. En el caso de muerte vascular, infarto de miocardio y accidentes tromboembólicos no hubo diferencias CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 4
5 Evaluación económica * Las 3 primeras dosis. Después, valorar según evolución mensual. Según algunas publicaciones, posteriormente puede administrase cada 4 meses Conclusiones La eficacia de Ranibizumab, demostrada en los ensayos clínicos, es superior a la obtenida con terapia fotodinámica con Verteporin, Pegaptanib e incluso a la de Bevacizumab, por lo que sería aconsejable incluirlo en el hospital como fármaco de elección en el tratamiento de membranas neovasculares subretinianas de la Degeneración Macular Asociada a la Edad (DAME) húmeda. Bibliografía 1.- Rosenfeld PJ, Brown DM, Heier JS et al (MARINA Study Group). Ranibizumab for neovascular age-related macular degeneration. N Eng J Med 2006; 355 (14): Brown DM, Kaiser PK, Michels M et al (ANCHOR Study Group). Ranibizumab versus Verteporfin for neovascular age-related macular degeneration. N Eng J Med 2006; 355 (14): Brown DM, for the PIER study group. A phase IIIb, double masked, randomized clinical trials of ranibizumab in neovascular AMD. Presented at the 2006 Retinal Physician Symposium in the Bahamas; June 2, CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 5
4.5 Características comparadas con otros medicamentos con la misma indicación disponibles en el Hospital
 RANIBIZUMAB Degeneración macular asociada a la edad (Informe para la Comisión de Farmacia y Terapéutica del Hospital Universitario Central de Asturias) Fecha 01/08/2007 1.- IDENTIFICACIÓN DEL FÁRMACO Y
RANIBIZUMAB Degeneración macular asociada a la edad (Informe para la Comisión de Farmacia y Terapéutica del Hospital Universitario Central de Asturias) Fecha 01/08/2007 1.- IDENTIFICACIÓN DEL FÁRMACO Y
*Ranibizumab es un fragmento de anticuerpo monoclonal humanizado producido en células de Escherichia coli mediante tecnología de ADN recombinante.
 NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable Lucentis 10 mg/ml solución inyectable en jeringa precargada COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*. *Ranibizumab
NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable Lucentis 10 mg/ml solución inyectable en jeringa precargada COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*. *Ranibizumab
INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA. MACUGEN ( Pegaptanib de sodio ) (04/12/2006)
 Centro de Información de Medicamentos Servicio de Farmacia INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA MACUGEN ( Pegaptanib de sodio ) (04/12/2006) Datos del solicitante El Dr. Juan López Moya del
Centro de Información de Medicamentos Servicio de Farmacia INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA MACUGEN ( Pegaptanib de sodio ) (04/12/2006) Datos del solicitante El Dr. Juan López Moya del
RANIBIZUMAB. (Novartis) LUCENTIS?
 RANIBIZUMAB LUCENTIS? (Novartis) DEGENERACIÓN MACULAR ASOCIADA A LA EDAD (DMAE) Es una enfermedad que afecta la mácula, la zona central de la retina que tiene un mayor poder de discriminación de la visión
RANIBIZUMAB LUCENTIS? (Novartis) DEGENERACIÓN MACULAR ASOCIADA A LA EDAD (DMAE) Es una enfermedad que afecta la mácula, la zona central de la retina que tiene un mayor poder de discriminación de la visión
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab.
Comisión de Evaluación de Medicamentos RANIBIZUMAB. Degeneración macular asociada a la edad (DMAE) neovascular (exudativa)
 Comisión de Evaluación de Medicamentos RANIBIZUMAB Degeneración macular asociada a la edad (DMAE) neovascular (exudativa) 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Ranibizumab (Lucentis
Comisión de Evaluación de Medicamentos RANIBIZUMAB Degeneración macular asociada a la edad (DMAE) neovascular (exudativa) 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Ranibizumab (Lucentis
Eylea debe ser administrado únicamente por un médico cualificado con experiencia en la administración de inyecciones intravítreas.
 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*.
INFORME TÉCNICO UTILIZACIÓN DE FÁRMACOS INHIBIDORES DEL FACTOR DE CRECIMIENTO DEL ENDOTELIO VASCULAR POR VÍA INTRAVÍTREA
 INFORME TÉCNICO UTILIZACIÓN DE FÁRMACOS INHIBIDORES DEL FACTOR DE CRECIMIENTO DEL ENDOTELIO VASCULAR POR VÍA INTRAVÍTREA 2012 UTILIZACIÓN DE FÁRMACOS INHIBIDORES DEL FACTOR DE CRECIMIENTO DEL ENDOTELIO
INFORME TÉCNICO UTILIZACIÓN DE FÁRMACOS INHIBIDORES DEL FACTOR DE CRECIMIENTO DEL ENDOTELIO VASCULAR POR VÍA INTRAVÍTREA 2012 UTILIZACIÓN DE FÁRMACOS INHIBIDORES DEL FACTOR DE CRECIMIENTO DEL ENDOTELIO
INFORME FINAL RESULTADOS VISUALES EN PACIENTES
 INFORME FINAL RESULTADOS VISUALES EN PACIENTES CON MEMBRANA NEOVASCULAR ASOCIADA A LA EDAD TRATADOS CON BEVACIZUMAB EN EL INSTITUTO NACIONAL DE OFTALMOLOGIA JULIO A DICIEMBRE DEL 2011 TRABAJO PRESENTADO
INFORME FINAL RESULTADOS VISUALES EN PACIENTES CON MEMBRANA NEOVASCULAR ASOCIADA A LA EDAD TRATADOS CON BEVACIZUMAB EN EL INSTITUTO NACIONAL DE OFTALMOLOGIA JULIO A DICIEMBRE DEL 2011 TRABAJO PRESENTADO
URGENCIAS EN OFTALMOLOGÍA
 URGENCIAS EN OFTALMOLOGÍA OJO ROJO NO DOLOROSO 99% de casos: HEMORRAGIA SUBCONJUNTIVAL. NIVEL 1 Actitud: Control de TA por su médico de cabecera; si se repite varias veces en poco tiempo, búsqueda sistémica
URGENCIAS EN OFTALMOLOGÍA OJO ROJO NO DOLOROSO 99% de casos: HEMORRAGIA SUBCONJUNTIVAL. NIVEL 1 Actitud: Control de TA por su médico de cabecera; si se repite varias veces en poco tiempo, búsqueda sistémica
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea
 FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
DOS OJOS PARA TODA LA VIDA
 DOS OJOS PARA TODA LA VIDA ENFERMEDADES OCULARES SERVICIO DE OFTALMOLOGIA HOSPITAL UNIVERSITARIO PUERTA DE HIERRO MAJADAHONDA Dra. Mercedes Vaquero 16 / OCTUBRE / 2014 DOS OJOS PARA TODA LA VIDA PREVENIR
DOS OJOS PARA TODA LA VIDA ENFERMEDADES OCULARES SERVICIO DE OFTALMOLOGIA HOSPITAL UNIVERSITARIO PUERTA DE HIERRO MAJADAHONDA Dra. Mercedes Vaquero 16 / OCTUBRE / 2014 DOS OJOS PARA TODA LA VIDA PREVENIR
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
FICHA TÉCNICA. Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012)
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012)
INFORMACIÓN DE SEGURIDAD PARA EL PROFESIONAL SANITARIO
 INFORMACIÓN DE SEGURIDAD PARA EL PROFESIONAL SANITARIO RECOMENDACIONES PARA EL TRATAMIENTO MEDIANTE INYECCIÓN INTRAVÍTREA (aflibercept) Material informativo autorizado por la Agencia Española de Medicamentos
INFORMACIÓN DE SEGURIDAD PARA EL PROFESIONAL SANITARIO RECOMENDACIONES PARA EL TRATAMIENTO MEDIANTE INYECCIÓN INTRAVÍTREA (aflibercept) Material informativo autorizado por la Agencia Española de Medicamentos
AMBOS SEXOS - De H00 a H59
 H00. Orzuelo y calacio H01. Otras inflamaciones del párpado H02. Otros trastornos de los párpados H04. Trastornos del aparato lagrimal H05. Trastornos de la órbita H10. Conjuntivitis H11. Otros trastornos
H00. Orzuelo y calacio H01. Otras inflamaciones del párpado H02. Otros trastornos de los párpados H04. Trastornos del aparato lagrimal H05. Trastornos de la órbita H10. Conjuntivitis H11. Otros trastornos
Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad.
 Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad. (Adaptado de la plantilla Doc.Ref. EMEA/192632/2006) 1 Objeto Definir el plan
Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad. (Adaptado de la plantilla Doc.Ref. EMEA/192632/2006) 1 Objeto Definir el plan
DG de Farmacia y Productos Sanitarios PAISE
 Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad, edema macular diabético, edema macular secundario a la oclusión de la vena retiniana,
Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad, edema macular diabético, edema macular secundario a la oclusión de la vena retiniana,
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
LUCENTIS RANIBIZUMAB Solución Inyectable Venta bajo receta
 Novartis LUCENTIS RANIBIZUMAB Solución Inyectable Venta bajo receta FÓRMULA Cada Vial de 0,23 ml contiene: Ranibizumab.......2,3 mg Excipientes: α,α-trehalosa dihidrato 23 mg; clorhidrato de L-histidina
Novartis LUCENTIS RANIBIZUMAB Solución Inyectable Venta bajo receta FÓRMULA Cada Vial de 0,23 ml contiene: Ranibizumab.......2,3 mg Excipientes: α,α-trehalosa dihidrato 23 mg; clorhidrato de L-histidina
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Cellufresh 5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Cellufresh 5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
FOLLETO DE INFORMACIÓN AL PROFESIONAL OSMOLUB SOLUCIÓN OFTÁLMICA 0,1% OSMOLUB Solución oftálmica 0,1% FOLLETO DE INFORMACIÓN AL PROFESIONAL
 OSMOLUB Solución oftálmica 0,1% Cada ml contiene Hialuronato de Sodio.1,0 mg Excipientes: Fosfato de sodio monobasico dihidrato, Cloruro de Sodio, Sodio Fosfato dibásico de Sodio anhidro, Perborato de
OSMOLUB Solución oftálmica 0,1% Cada ml contiene Hialuronato de Sodio.1,0 mg Excipientes: Fosfato de sodio monobasico dihidrato, Cloruro de Sodio, Sodio Fosfato dibásico de Sodio anhidro, Perborato de
Dra. Jaysi Pastrana Arias Oftalmología Especialista en Retina y Vítreo
 Dra. Jaysi Pastrana Arias Oftalmología Especialista en Retina y Vítreo Medicina Oftalmología Retina y Vítreo Universidad de Cartagena Universidad de Panamá Caja del Seguro Social Universidad Autónoma de
Dra. Jaysi Pastrana Arias Oftalmología Especialista en Retina y Vítreo Medicina Oftalmología Retina y Vítreo Universidad de Cartagena Universidad de Panamá Caja del Seguro Social Universidad Autónoma de
Manual CTO de Medicina y Cirugía. 9.ª edición. Oftalmología. Autor. Julio González Martín-Moro
 Manual CTO de Medicina y Cirugía 9.ª edición Oftalmología Autor Julio González Martín-Moro NOTA La medicina es una ciencia sometida a un cambio constante. A medida que la investigación y la experiencia
Manual CTO de Medicina y Cirugía 9.ª edición Oftalmología Autor Julio González Martín-Moro NOTA La medicina es una ciencia sometida a un cambio constante. A medida que la investigación y la experiencia
MONOGRAFÍA DE PRODUCTO
 MONOGRAFÍA DE PRODUCTO UNA NUEVA MIRADA EN OFTALMOLOGÍA CONTENIDOS I. resumen ejecutivo 04 II. fundamentos 08 A) Información general sobre la enfermedad DMAE húmeda 09 A) El peso de la enfermedad (ceguera,
MONOGRAFÍA DE PRODUCTO UNA NUEVA MIRADA EN OFTALMOLOGÍA CONTENIDOS I. resumen ejecutivo 04 II. fundamentos 08 A) Información general sobre la enfermedad DMAE húmeda 09 A) El peso de la enfermedad (ceguera,
Eylea debe ser administrado únicamente por un médico cualificado con experiencia en la administración de inyecciones intravítreas.
 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
Protocolo de uso de agentes antiangiogénicos y corticoides intravítreos en patología ocular
 2015 Protocolo de uso de agentes antiangiogénicos y corticoides intravítreos en patología ocular [Escriba aquí una descripción breve del documento. Una descripción breve es un resumen corto del contenido
2015 Protocolo de uso de agentes antiangiogénicos y corticoides intravítreos en patología ocular [Escriba aquí una descripción breve del documento. Una descripción breve es un resumen corto del contenido
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Levocabastina (como hidrocloruro) equivalente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Levocabastina (como hidrocloruro) equivalente
Dr. Felipe Centeno Rodríguez Oftalmología Hospital San Vicente de Paúl Oftalmología Hospital México Profesor Posgrado Oftalmología UCR
 Emergencias en Oftalmología Dr. Felipe Centeno Rodríguez Oftalmología Hospital San Vicente de Paúl Oftalmología Hospital México Profesor Posgrado Oftalmología UCR Es cualquier condición aguda que, de no
Emergencias en Oftalmología Dr. Felipe Centeno Rodríguez Oftalmología Hospital San Vicente de Paúl Oftalmología Hospital México Profesor Posgrado Oftalmología UCR Es cualquier condición aguda que, de no
Prospecto: información para el paciente. Lucentis 10 mg/ml solución inyectable Ranibizumab
 Prospecto: información para el paciente Lucentis 10 mg/ml solución inyectable Ranibizumab Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque contiene información importante
Prospecto: información para el paciente Lucentis 10 mg/ml solución inyectable Ranibizumab Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque contiene información importante
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Taller de Oftalmología. Exploración oftalmológica en la consulta de Pediatría; anomalías de la visión, fondo de ojo y urgencias oftalmológicas
 MADRID 16 A 18 DE OCTUBRE DE 2003 Taller OFTALMOLOGÍA Exploración oftalmológica en la consulta de Pediatría; anomalías de la visión, fondo de ojo y urgencias oftalmológicas Moderador: Ramón Ugarte Libano
MADRID 16 A 18 DE OCTUBRE DE 2003 Taller OFTALMOLOGÍA Exploración oftalmológica en la consulta de Pediatría; anomalías de la visión, fondo de ojo y urgencias oftalmológicas Moderador: Ramón Ugarte Libano
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN LA DEGENERACIÓN MACULAR RELACIONADA CON LA EDAD EXUDATIVA ó HÚMEDA
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN LA DEGENERACIÓN MACULAR RELACIONADA CON LA EDAD EXUDATIVA ó HÚMEDA (Leyes 26.529 y 26742 y Decreto Reglamentario 1089/2012)
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN LA DEGENERACIÓN MACULAR RELACIONADA CON LA EDAD EXUDATIVA ó HÚMEDA (Leyes 26.529 y 26742 y Decreto Reglamentario 1089/2012)
deterioro de la visión causado por un edema macular provocado por la diabetes;
 EMA/677928/2015 EMA/H/C/002392 Resumen del EPAR para el público general aflibercept El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de Medicamentos
EMA/677928/2015 EMA/H/C/002392 Resumen del EPAR para el público general aflibercept El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de Medicamentos
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Macugen 0,3 mg solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una jeringa precargada proporciona
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Macugen 0,3 mg solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una jeringa precargada proporciona
PROTOCOLO DE TRABECULECTOMÍA
 PROTOCOLO DE TRABECULECTOMÍA ÍNDICE 1. Objetivos Ámbito 2. Definición 3. Diagnóstico y evaluación 4. Indicaciones 5. Técnica quirúrgicas 6. Complicaciones 7. Cuidados postoperatorios 1. OBJETIVOS DEL PROTOCOLO
PROTOCOLO DE TRABECULECTOMÍA ÍNDICE 1. Objetivos Ámbito 2. Definición 3. Diagnóstico y evaluación 4. Indicaciones 5. Técnica quirúrgicas 6. Complicaciones 7. Cuidados postoperatorios 1. OBJETIVOS DEL PROTOCOLO
GENESIS-SEFH. Informe Base Página: 1
 GENESISSEFH Versión: 4. Programa MADRE versión 4. Fecha: 711213 Informe Base Página: 1 AFLIIBERCEPT DEGENERACIÓN MACULAR ASOCIADA A LA EDAD (Informe para la Comisión Regional de Farmacia y Terapéutica
GENESISSEFH Versión: 4. Programa MADRE versión 4. Fecha: 711213 Informe Base Página: 1 AFLIIBERCEPT DEGENERACIÓN MACULAR ASOCIADA A LA EDAD (Informe para la Comisión Regional de Farmacia y Terapéutica
Precio adquisición: Precio final= /40mg Grupo Terapéutico: S01LA05: Agentes oftalmoógicos. Agentes antineovascularización
 Aflibercept - EN DEGENERACIÓN MACULAR ASOCIADA A LA EDAD - EDEMA MACULAR SECUNDARIO A OCLUSIÓN DE VENA CENTRAL RETINIANA INFORME CFT- HOSPITAL REINA SOFÍA CÓRDOBA 1.- Identificación del fármaco: Nombre
Aflibercept - EN DEGENERACIÓN MACULAR ASOCIADA A LA EDAD - EDEMA MACULAR SECUNDARIO A OCLUSIÓN DE VENA CENTRAL RETINIANA INFORME CFT- HOSPITAL REINA SOFÍA CÓRDOBA 1.- Identificación del fármaco: Nombre
Tratamientos para la Degeneración Macular
 Tratamientos para la Degeneración Macular La mayoría de los tratamientos más comunes que se describen aquí impactan la degeneración macular húmeda relacionada a la edad (DMRE). Es importante señalar que
Tratamientos para la Degeneración Macular La mayoría de los tratamientos más comunes que se describen aquí impactan la degeneración macular húmeda relacionada a la edad (DMRE). Es importante señalar que
Prospecto: información para el usuario. Voltarén 1 mg/ml colirio en solución Diclofenaco (DOE) sódico
 Prospecto: información para el usuario Voltarén 1 mg/ml colirio en solución Diclofenaco (DOE) sódico Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto,
Prospecto: información para el usuario Voltarén 1 mg/ml colirio en solución Diclofenaco (DOE) sódico Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto,
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
GPC. Guía de Referencia Rápida. Diagnóstico y Tratamiento del Trauma de Conjuntiva y Abrasión Corneal. Guía de Práctica Clínica
 Guía de Referencia Rápida Diagnóstico y Tratamiento del Trauma de Conjuntiva y Abrasión Corneal GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-520-11 Guía de Referencia
Guía de Referencia Rápida Diagnóstico y Tratamiento del Trauma de Conjuntiva y Abrasión Corneal GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-520-11 Guía de Referencia
FICHA TÉCNICA. HEMIDEXA ANTIHISTAMÍNICO (colirio)
 1 FICHA TÉCNICA HEMIDEXA ANTIHISTAMÍNICO (colirio) 1 NOMBRE DEL MEDICAMENTO HEMIDEXA- ANTIHISTAMÍNICO 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por 100 ml: Principios activos: -... 0,1 g - Maleato de clorfenamina...
1 FICHA TÉCNICA HEMIDEXA ANTIHISTAMÍNICO (colirio) 1 NOMBRE DEL MEDICAMENTO HEMIDEXA- ANTIHISTAMÍNICO 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por 100 ml: Principios activos: -... 0,1 g - Maleato de clorfenamina...
(Leyes y Decreto Reglamentario 1089 / 2012)
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN DE UN DISPOSITIVO INTRAVÍTREO DE LIBERACIÓN DE CORTICOIDE EN EL EDEMA MACULAR SECUNDARIO A LA OCLUSIÓN DE LA VENA CENTRAL DE LA RETINA. ( OZURDEX - DEXAMETASONA-)
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN DE UN DISPOSITIVO INTRAVÍTREO DE LIBERACIÓN DE CORTICOIDE EN EL EDEMA MACULAR SECUNDARIO A LA OCLUSIÓN DE LA VENA CENTRAL DE LA RETINA. ( OZURDEX - DEXAMETASONA-)
(Leyes y Decreto Reglamentario 1089 / 2012)
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN DE UN DISPOSITIVO INTRAVÍTREO DE LIBERACIÓN DE CORTICOIDE EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN DE RAMA VENOSA DE LA RETINA. ( OZURDEX - DEXAMETASONA-)
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN DE UN DISPOSITIVO INTRAVÍTREO DE LIBERACIÓN DE CORTICOIDE EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN DE RAMA VENOSA DE LA RETINA. ( OZURDEX - DEXAMETASONA-)
PROTOCOLO CONSENSO DE TRATAMIENTO DEL EDEMA MACULAR SECUNDARIO A OCLUSIÓN DE LA VENA DE LA RETINA. COMUNIDAD VALENCIANA Noviembre 2012
 PROTOCOLO CONSENSO DE TRATAMIENTO DEL EDEMA MACULAR SECUNDARIO A OCLUSIÓN DE LA VENA DE LA RETINA COMUNIDAD VALENCIANA Noviembre 2012 PROTOCOLO CONSENSO DE TRATAMIENTO DEL EDEMA MACULAR SECUNDARIO A OCLUSIÓN
PROTOCOLO CONSENSO DE TRATAMIENTO DEL EDEMA MACULAR SECUNDARIO A OCLUSIÓN DE LA VENA DE LA RETINA COMUNIDAD VALENCIANA Noviembre 2012 PROTOCOLO CONSENSO DE TRATAMIENTO DEL EDEMA MACULAR SECUNDARIO A OCLUSIÓN
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
INDICACIONES Tratamiento local sintomático de la caída del cabello de origen androgénico.
 REGAINE GEL Minoxidil COMPOSICIÓN Composición por gramo: Principio activo: Minoxidil (D.C.I.)...20 mg Excipientes: Etanol 0,4 g Propilenglicol Carbomero 934 P Diisopropanolamina Agua purificada, c.s. FORMA
REGAINE GEL Minoxidil COMPOSICIÓN Composición por gramo: Principio activo: Minoxidil (D.C.I.)...20 mg Excipientes: Etanol 0,4 g Propilenglicol Carbomero 934 P Diisopropanolamina Agua purificada, c.s. FORMA
Patología Ocular en la Atención Primaria I
 Patología Ocular en la Atención Primaria I Depto Oftalmología, Facultad de Medicina Universidad Católica de Chile XVIII Curso Problemas Frecuentes en la Atención Primaria del Adulto 2008 Anamnesis y Examen
Patología Ocular en la Atención Primaria I Depto Oftalmología, Facultad de Medicina Universidad Católica de Chile XVIII Curso Problemas Frecuentes en la Atención Primaria del Adulto 2008 Anamnesis y Examen
FICHA TÉCNICA. Vispring 500 microgramos/ml colirio en solución en envases unidosis
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
PROGRAMA DE LECCIONES TEÓRICAS: OFTALMOLOGIA (4º) curso BASES ANATOMOFISIOLOGICAS DEL SISTEMA VISUAL
 PROGRAMA DE LECCIONES TEÓRICAS: OFTALMOLOGIA (4º) curso 2013-14 Las clases se impartirán en el AULA 6. BASES ANATOMOFISIOLOGICAS DEL SISTEMA VISUAL 1. PRESENTACION DEL CURSO El globo ocular. (I) Lunes,
PROGRAMA DE LECCIONES TEÓRICAS: OFTALMOLOGIA (4º) curso 2013-14 Las clases se impartirán en el AULA 6. BASES ANATOMOFISIOLOGICAS DEL SISTEMA VISUAL 1. PRESENTACION DEL CURSO El globo ocular. (I) Lunes,
FICHA TÉCNICA. Sorbitol líquido (no cristalizante); 1 ml de jarabe contiene 495,6 mg de sorbitol (E 420).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
FICHA TÉCNICA. Alivio a corto plazo (de dos o tres meses) del edema y síntomas relacionados con la insuficiencia venosa crónica.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Troxerutina NORMON 1000 mg granulado para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Excipientes: Isomaltosa,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Troxerutina NORMON 1000 mg granulado para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Excipientes: Isomaltosa,
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
GPC. Guía de Referencia Rápida. Diagnóstico y Manejo del Orzuelo y Chalazión
 Guía de Referencia Rápida Diagnóstico y Manejo del Orzuelo y Chalazión GPC Guía de Práctica Clínica Número de Registro ESPACIO PARA SER LLENADO POR CENETEC Guía de Referencia Rápida H00 Orzuelo y Chalazión
Guía de Referencia Rápida Diagnóstico y Manejo del Orzuelo y Chalazión GPC Guía de Práctica Clínica Número de Registro ESPACIO PARA SER LLENADO POR CENETEC Guía de Referencia Rápida H00 Orzuelo y Chalazión
Fondo de Ojos. Examen de Fondo de Ojos
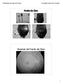 Fondo de Ojos Examen de Fondo de Ojos 1 Retina Fondo de Ojos Papila Mácula Vena retinal Arteríola retinal Fondo de Ojos: Papila Excavada por Glaucoma 2 Fondo de Ojos: Edema de Papila Fondo de Ojos: Edema
Fondo de Ojos Examen de Fondo de Ojos 1 Retina Fondo de Ojos Papila Mácula Vena retinal Arteríola retinal Fondo de Ojos: Papila Excavada por Glaucoma 2 Fondo de Ojos: Edema de Papila Fondo de Ojos: Edema
GPC. Guía de Referencia Rápida. Diagnóstico y Tratamiento de la Degeneración Macular Relacionada con la Edad. Guía de Práctica Clínica
 Guía de Referencia Rápida Diagnóstico y Tratamiento de la Degeneración Macular Relacionada con la Edad GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-401-10 Guía de Referencia
Guía de Referencia Rápida Diagnóstico y Tratamiento de la Degeneración Macular Relacionada con la Edad GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-401-10 Guía de Referencia
La importancia social y económica de esta enfermedad queda resumida en algunos datos:
 Domingo, 14 de marzo de 2010 De 11:30 a 13:00 horas Auditorio (N-103+N-104) La degeneración macular asociada a la edad (DMAE) es una enfermedad frecuente y grave, con un elevado coste social, económico
Domingo, 14 de marzo de 2010 De 11:30 a 13:00 horas Auditorio (N-103+N-104) La degeneración macular asociada a la edad (DMAE) es una enfermedad frecuente y grave, con un elevado coste social, económico
OPTISPRING 0,5 mg/ml colirio en solución en envases unidosis
 1. NOMBRE DEL MEDICAMENTO OPTISPRING 0,5 mg/ml colirio en solución en envases unidosis 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada envase de 0,5 ml de colirio en solución contiene: Tetrizolina hidrocloruro.250
1. NOMBRE DEL MEDICAMENTO OPTISPRING 0,5 mg/ml colirio en solución en envases unidosis 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada envase de 0,5 ml de colirio en solución contiene: Tetrizolina hidrocloruro.250
El reto de la Salud Ocular en la Farmacia
 NOTA DE PRENSA El reto de la Salud Ocular en la Farmacia Madrid 11 de marzo de 2016. Día a día el farmacéutico comunitario puede ratificar la importancia creciente del servicio de las patologías oftalmológicas.
NOTA DE PRENSA El reto de la Salud Ocular en la Farmacia Madrid 11 de marzo de 2016. Día a día el farmacéutico comunitario puede ratificar la importancia creciente del servicio de las patologías oftalmológicas.
MUCOSEC Ambroxol clorhidrato 300 mg Jarabe
 MUCOSEC Ambroxol clorhidrato 300 mg Jarabe MUCOSEC PEDIÁTRICO 15 mg / 5 ml JARABE Ambroxol clorhidrato EXPECTORANTE MUCOLÍTICO COMPOSICIÓN: Cada 100 ml contiene: Ambroxol clorhidrato...300 mg Excipientes...c.s.p.
MUCOSEC Ambroxol clorhidrato 300 mg Jarabe MUCOSEC PEDIÁTRICO 15 mg / 5 ml JARABE Ambroxol clorhidrato EXPECTORANTE MUCOLÍTICO COMPOSICIÓN: Cada 100 ml contiene: Ambroxol clorhidrato...300 mg Excipientes...c.s.p.
UBICACIÓN GUÍA ADAPTACIÓN SUGERIDA OBSERVACIONES
 Depresión DEP UBICACIÓN GUÍA ADAPTACIÓN SUGERIDA OBSERVACIONES 1. Pág. 11, primer Busque enfermedades médicas Busque enfermedades médicas concomitantes, Se incluye en la columna, último concomitantes,
Depresión DEP UBICACIÓN GUÍA ADAPTACIÓN SUGERIDA OBSERVACIONES 1. Pág. 11, primer Busque enfermedades médicas Busque enfermedades médicas concomitantes, Se incluye en la columna, último concomitantes,
DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA Comunicación sobre cambios en la información de seguridad de Sibutramina para profesionales sanitarios Mayo de 2010 NOTA INFORMATIVA
DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA Comunicación sobre cambios en la información de seguridad de Sibutramina para profesionales sanitarios Mayo de 2010 NOTA INFORMATIVA
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
INFORME DE EVALUACIÓN
 INFORME DE EVALUACIÓN Principio activo: bimatoprost+timolol Nombre comercial y presentaciones: Ganfort (5 mg/ml + 0,3 mg/ml) 3 ml colirio (23,21 ) Condiciones de dispensación: receta médica Fecha de evaluación:
INFORME DE EVALUACIÓN Principio activo: bimatoprost+timolol Nombre comercial y presentaciones: Ganfort (5 mg/ml + 0,3 mg/ml) 3 ml colirio (23,21 ) Condiciones de dispensación: receta médica Fecha de evaluación:
FICHA TÉCNICA. LORATADINA KERN PHARMA está indicado para el tratamiento sintomático de rinitis alérgica y urticaria idiopática crónica.
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO LORATADINA KERN PHARMA 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Lista de excipientes,
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO LORATADINA KERN PHARMA 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Lista de excipientes,
VISPRING 500 microgramos/ml colirio en solución Tetrizolina Hidrocloruro
 VISPRING 500 microgramos/ml colirio en solución Tetrizolina Hidrocloruro Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta.
VISPRING 500 microgramos/ml colirio en solución Tetrizolina Hidrocloruro Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta.
Conjuntiva: Tarsal. Cuerpo Extraño Tarsal + Ulcera Corneal. Conjuntiva: Hemorragia Sub-Conjuntival
 Conjuntiva: Tarsal Cuerpo Extraño Tarsal + Ulcera Corneal Conjuntiva: Hemorragia Sub-Conjuntival 1 Conjuntiva: Ojo Rojo Superficial indica inflamación de la conjuntiva Ojo Rojo Profundo indica inflamación
Conjuntiva: Tarsal Cuerpo Extraño Tarsal + Ulcera Corneal Conjuntiva: Hemorragia Sub-Conjuntival 1 Conjuntiva: Ojo Rojo Superficial indica inflamación de la conjuntiva Ojo Rojo Profundo indica inflamación
Posología Adultos y adolescentes mayores de 12 años: administrar 30 ml (195 mg) cada 4 horas. La dosis máxima mg / 24 h.
 1. NOMBRE DEL MEDICAMENTO Frispec 6,5 mg/ ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Guaifenesina 6,5 mg Excipientes con efecto conocido: Parahidroxibenzoato de metilo
1. NOMBRE DEL MEDICAMENTO Frispec 6,5 mg/ ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Guaifenesina 6,5 mg Excipientes con efecto conocido: Parahidroxibenzoato de metilo
Titulación(es) Titulación Centro Curso Periodo 1204 - Grado de Medicina FACULTAT DE MEDICINA I ODONTOLOGIA
 FICHA IDENTIFICATIVA Datos de la Asignatura Código 34485 Nombre Oftalmología Ciclo Grado Créditos ECTS 4.5 Curso académico 2015-2016 Titulación(es) Titulación Centro Curso Periodo 1204 - Grado de Medicina
FICHA IDENTIFICATIVA Datos de la Asignatura Código 34485 Nombre Oftalmología Ciclo Grado Créditos ECTS 4.5 Curso académico 2015-2016 Titulación(es) Titulación Centro Curso Periodo 1204 - Grado de Medicina
KLOSARTAN LOSARTÁN POTÁSICO 50/100 mg
 KLOSARTAN LOSARTÁN POTÁSICO 50/100 mg Venta bajo receta Industria Argentina Comprimidos recubiertos FÓRMULA CUALICUANTITATIVA: Cada comprimido recubierto de 50 mg contiene: Losartán potásico 50 mg Excipientes:
KLOSARTAN LOSARTÁN POTÁSICO 50/100 mg Venta bajo receta Industria Argentina Comprimidos recubiertos FÓRMULA CUALICUANTITATIVA: Cada comprimido recubierto de 50 mg contiene: Losartán potásico 50 mg Excipientes:
Composición Cada 100 ml de solución oftálmica de liberación prolongada contiene:
 CARTENS 1% y 2% Clorhidrato de Carteolol Solución Oftálmica de Liberación Prolongada Industria Argentina Venta bajo receta Composición Cada 100 ml de solución oftálmica de liberación prolongada contiene:
CARTENS 1% y 2% Clorhidrato de Carteolol Solución Oftálmica de Liberación Prolongada Industria Argentina Venta bajo receta Composición Cada 100 ml de solución oftálmica de liberación prolongada contiene:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento veterinario MODERIN 4 mg 2. Composición cualitativa y cuantitativa 2.1 composición cualitativa: Nombre del ingrediente Referencias
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento veterinario MODERIN 4 mg 2. Composición cualitativa y cuantitativa 2.1 composición cualitativa: Nombre del ingrediente Referencias
FICHA TÉCNICA. La ranura sirve únicamente para fraccionar y facilitar la deglución pero no para dividir en dosis iguales.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO LORATADINA KORHISPANA 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Excipientes: Lactosa, 75,50 mg.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO LORATADINA KORHISPANA 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Excipientes: Lactosa, 75,50 mg.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
Valor del examen 28 puntos, nota mínima para acreditar 20 puntos
 COD. NOMBRE DEL PARTICIPANTE: 27 DE ABRIL 2013 NOMBRE DE LA ACTIVIDAD: SEMINARIO DE OFTALMOLOGIA FECHA: NÚMERO DE PREGUNTAS CORRECTAS APROBÓ SÍ NO Valor del examen 28 puntos, nota mínima para acreditar
COD. NOMBRE DEL PARTICIPANTE: 27 DE ABRIL 2013 NOMBRE DE LA ACTIVIDAD: SEMINARIO DE OFTALMOLOGIA FECHA: NÚMERO DE PREGUNTAS CORRECTAS APROBÓ SÍ NO Valor del examen 28 puntos, nota mínima para acreditar
Guía Farmacoterapéutica de Hospital Sistema Sanitario Público de Andalucía GRUPO S
 Guía Farmacoterapéutica de Hospital Sistema Sanitario Público de Andalucía GRUPO S ÓRGANOS DE LOS SENTIDOS S S01 S01AA ÓRGANOS DE LOS SENTIDOS OFTALMOLÓGICOS ANTIBIÓTICOS S01AA11 GENTAMICINA Blefaritis,
Guía Farmacoterapéutica de Hospital Sistema Sanitario Público de Andalucía GRUPO S ÓRGANOS DE LOS SENTIDOS S S01 S01AA ÓRGANOS DE LOS SENTIDOS OFTALMOLÓGICOS ANTIBIÓTICOS S01AA11 GENTAMICINA Blefaritis,
ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO
 ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO Estas modificaciones del SPC (ficha técnica) y prospecto entran en vigor en el momento de la Decisión de la Comisión.
ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO Estas modificaciones del SPC (ficha técnica) y prospecto entran en vigor en el momento de la Decisión de la Comisión.
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CLORANFENICOL 500 mg CÁPSULA ANTIINFECCIOSO Página 1 CLORANFENICOL 500 mg Cápsula Principio Activo Cloranfenicol
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CLORANFENICOL 500 mg CÁPSULA ANTIINFECCIOSO Página 1 CLORANFENICOL 500 mg Cápsula Principio Activo Cloranfenicol
PROGRAMA DE OftalmoLOGIA DEL INTERNADO HOSPITALARIO DE CIRUGIA
 PROGRAMA DE medicina República bolivariana de Venezuela Universidad Rómulo gallegos Área ciencias de la salud Asignatura: PROGRAMA DE OftalmoLOGIA DEL INTERNADO HOSPITALARIO DE CIRUGIA Profesor: Dr.Ruben
PROGRAMA DE medicina República bolivariana de Venezuela Universidad Rómulo gallegos Área ciencias de la salud Asignatura: PROGRAMA DE OftalmoLOGIA DEL INTERNADO HOSPITALARIO DE CIRUGIA Profesor: Dr.Ruben
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
CAPÍTULO 2. Retinopatía diabética
 CAPÍTULO 2. Retinopatía diabética 2.1. Aspectos preliminares Antes de comenzar a describir el trabajo realizado en este proyecto es conveniente que se haga una breve descripción de la diabetes y cómo afecta
CAPÍTULO 2. Retinopatía diabética 2.1. Aspectos preliminares Antes de comenzar a describir el trabajo realizado en este proyecto es conveniente que se haga una breve descripción de la diabetes y cómo afecta
(Leyes y y Decreto Reglamentario 1089/2012)
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN DE UN DISPOSITIVO INTRAVÍTREO DE LIBERACIÓN DE CORTICOIDE EN UVEÍTIS NO INFECCIOSAS INTERMEDIAS Y POSTERIORES ( OZURDEX - DEXAMETASONA-) (Leyes 26.529 y 26742
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN DE UN DISPOSITIVO INTRAVÍTREO DE LIBERACIÓN DE CORTICOIDE EN UVEÍTIS NO INFECCIOSAS INTERMEDIAS Y POSTERIORES ( OZURDEX - DEXAMETASONA-) (Leyes 26.529 y 26742
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DICLOABAK 1 mg/ml, colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DICLOABAK 1 mg/ml, colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Diclofenaco de sodio.1mg/ml Excipiente con efecto conocido: ricinoleato de macrogolglicerol
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DICLOABAK 1 mg/ml, colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Diclofenaco de sodio.1mg/ml Excipiente con efecto conocido: ricinoleato de macrogolglicerol
Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina.
 1. NOMBRE DEL MEDICAMENTO Bilina 0,5 mg/ml colirio en suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina. Excipiente
1. NOMBRE DEL MEDICAMENTO Bilina 0,5 mg/ml colirio en suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina. Excipiente
Criterios de utilización de Bevacizumab y Ranibizumab en pacientes con Degeneración Macular Asociada a la Edad (DMAE) exudativa
 Noviembre 2012 Nº 4 1 Criterios de utilización de Bevacizumab y Ranibizumab en pacientes con Degeneración Macular Asociada a la Edad (DMAE) exudativa c r i t e r i o s Introducción Objetivo Resumen de
Noviembre 2012 Nº 4 1 Criterios de utilización de Bevacizumab y Ranibizumab en pacientes con Degeneración Macular Asociada a la Edad (DMAE) exudativa c r i t e r i o s Introducción Objetivo Resumen de
ARCHIVOS DE LA SOCIEDAD ESPAÑOLA DE OFTALMOLOGÍA
 Vol. 9 Marzo 215 Extraordinario 1 Aflibercept: nuevas perspectivas en el abordaje de las enfermedades de la retina Introducción Papel del factor de crecimiento del endotelio vascular en las enfermedades
Vol. 9 Marzo 215 Extraordinario 1 Aflibercept: nuevas perspectivas en el abordaje de las enfermedades de la retina Introducción Papel del factor de crecimiento del endotelio vascular en las enfermedades
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp
 Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
2013 GUIA DE MANEJO OJO ROJO CLINICA OFTALMOLÓGICADE TULUÁ ALFONSO MONDRAGÓN GIRALDO GERENTE GENERAL
 2013 GUIA DE MANEJO OJO ROJO CLINICA OFTALMOLÓGICADE TULUÁ ALFONSO MONDRAGÓN GIRALDO GERENTE GENERAL Páginas: 1 de 5 DEFINICION El ojo rojo es uno de los problemas oftalmológicos más frecuentes. Dentro
2013 GUIA DE MANEJO OJO ROJO CLINICA OFTALMOLÓGICADE TULUÁ ALFONSO MONDRAGÓN GIRALDO GERENTE GENERAL Páginas: 1 de 5 DEFINICION El ojo rojo es uno de los problemas oftalmológicos más frecuentes. Dentro
CAÍDA DE CENIZA VOLCÁNICA
 CAÍDA DE CENIZA VOLCÁNICA La ceniza volcánica se compone de finas partículas de roca volcánica fragmentada (de menos de 2 mm de diámetro). La lluvia de cenizas produce pocos efectos adversos sobre la salud,
CAÍDA DE CENIZA VOLCÁNICA La ceniza volcánica se compone de finas partículas de roca volcánica fragmentada (de menos de 2 mm de diámetro). La lluvia de cenizas produce pocos efectos adversos sobre la salud,
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
FICHA DE INFORMACIÓN AL PACIENTE: MIANSERINA
 FICHA DE INFORMACIÓN AL PACIENTE: MIANSERINA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antidepresivo, con intensa actividad sedante, ligera antihistamínica H-1 y escasa anticolinérgica. 1.2 Cómo actúa
FICHA DE INFORMACIÓN AL PACIENTE: MIANSERINA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antidepresivo, con intensa actividad sedante, ligera antihistamínica H-1 y escasa anticolinérgica. 1.2 Cómo actúa
TRATAMIENTO DEL EDEMA MACULAR PROVOCADO POR OCLUSIÓN VENOSA RETINIANA OZURDEX LUCENTIS
 TRTMIENTO DEL EDEM MCULR PROVOCDO POR OCLUSIÓN VENOS RETININ OZURDEX LUCENTIS Informe de evaluación de tecnologías sanitarias elaborado por el Servicio de Evaluación y Planificación a petición de la Dirección
TRTMIENTO DEL EDEM MCULR PROVOCDO POR OCLUSIÓN VENOS RETININ OZURDEX LUCENTIS Informe de evaluación de tecnologías sanitarias elaborado por el Servicio de Evaluación y Planificación a petición de la Dirección
Prospecto: información para el usuario OPTISPRING 0,5 mg/ml colirio en solución en envases unidosis Tetrizolina Hidrocloruro
 Prospecto: información para el usuario OPTISPRING 0,5 mg/ml colirio en solución en envases unidosis Tetrizolina Hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento,
Prospecto: información para el usuario OPTISPRING 0,5 mg/ml colirio en solución en envases unidosis Tetrizolina Hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento,
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
Prospecto: información para el usuario. TAUTOSS 6 mg/ml jarabe Levodropropizina
 Prospecto: información para el usuario TAUTOSS 6 mg/ml jarabe Levodropropizina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
Prospecto: información para el usuario TAUTOSS 6 mg/ml jarabe Levodropropizina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
Informe Ultrarrápido de Evaluación de Tecnología Sanitaria (IURETS)
 Informe Ultrarrápido de Evaluación de Tecnología Sanitaria (IURETS) Título Bevacizumab en el tratamiento de la retinopatía del prematuro (ROP) Autor/es Programa ETS Fecha de Inicio 16-02-2016 Fecha de
Informe Ultrarrápido de Evaluación de Tecnología Sanitaria (IURETS) Título Bevacizumab en el tratamiento de la retinopatía del prematuro (ROP) Autor/es Programa ETS Fecha de Inicio 16-02-2016 Fecha de
Máster en Investigación en Ciencias de la Visión
 Máster en Investigación en Ciencias de la Visión Eficacia y Seguridad del tratamiento con ranibizumab intravítreo en pacientes con Degeneración Macular Asociada a la Edad (DMAE) húmeda y edema macular
Máster en Investigación en Ciencias de la Visión Eficacia y Seguridad del tratamiento con ranibizumab intravítreo en pacientes con Degeneración Macular Asociada a la Edad (DMAE) húmeda y edema macular
