Guía rápida sobre Medicamentos biológicos y biosimilares
|
|
|
- María Rosa Casado González
- hace 7 años
- Vistas:
Transcripción
1 Guía rápida sobre Medicamentos biológicos y biosimilares
2 Tabla de contenidos Introducción 3 Qué son los medicamentos biológicos y biosimilares? 3 Por qué son importantes los medicamentos biológicos y biosimilares? 3 Qué deben tener en cuenta los pacientes cuando toman los medicamentos biológicos? 4 Nuestros agradecimientos IAPO agradece a todas las personas que participaron en la preparación y desarrollo de esta Guía rápida. La lista completa de agradecimientos se puede encontrar al final del Boletín informativo, que forma parte del Conjunto de herramientas de información y orientación sobre medicamentos biológicos y biosimilares de IAPO. El proyecto de IAPO sobre medicamentos biosimilares fue posible gracias a los subsidios de educación de Amgen and Lilly USA, LLC (para el Conjunto de herramientas) y Merck Serono y Pharmaceutical Research and Manufacturers of America (PhRMA) (para el Taller sobre medicamentos biosimilares de IAPO, 2013). noviembre de 2013 IAPO. Todos los derechos reservados. IAPO está registrado como Asociación en los Países Bajos. Número de registro: Esta publicación es propiedad de IAPO y está prohibida su reproducción sin autorización previa por escrito. Las opiniones expresadas en este Conjunto de herramientas pertenecen a los participantes y no reflejan necesariamente las de los miembros de IAPO. La referencia a cualquier persona u organización en este Conjunto de herramientas no implica que dicha persona haya sido aprobada o recomendada por IAPO. Diseñado y producido por Postscript Communications Ltd Cómo afectan a los pacientes las diferencias entre los medicamentos biológicos y químicos? 5 En qué se diferencian los medicamentos biosimilares de los los medicamentos biológicos de referencia? 7 Cómo se aprueban los medicamentos? 7 Qué deben saber los pacientes sobre la seguridad de los medicamentos biológicos? 9 Qué información deben reportar los pacientes en caso de sufrir un efecto adverso? 10 Qué aspectos deben tener en cuenta los pacientes en cuanto al medicamento biológico que se les ha recetado y han recibido? 11 Los pacientes pueden estar seguros de que las regulaciones de todo el mundo garantizarán la calidad, la seguridad y la eficacia de los medicamentos biológicos? 12 Quién puede acceder a los medicamentos biológicos? 13 Qué información y apoyo necesitan los pacientes? 15 Referencias 16
3 Definiciones claves Medicamento o fármaco químico (también denominado medicamento de molécula pequeña): Medicamento que se fabrica sin utilizar organismos vivos. Contiene compuestos químicos con estructuras y características definidas. Medicamento genérico: Un medicamento genérico contiene el mismo ingrediente farmacéutico activo que un medicamento de marca original y también es bioequivalente a éste. Los medicamentos genéricos son idénticos en lo relativo a la sustancia farmacéutica activa, dosis, potencia, vía de administración, seguridad, eficacia y uso previsto, y por lo tanto pueden sustituir al medicamento de marca original. Biotecnología: La Convención sobre la Diversidad Biológica de las Naciones Unidas define a la biotecnología como "toda aplicación tecnológica que utiliza sistemas biológicos, organismos vivos o sus derivados, para hacer o modificar productos o procesos para un uso específico". Medicamento biológico (también denominado medicamento biofarmacéutico, medicamento biotecnológico o producto medicinal bioterapéutico): La sustancia activa de un producto medicinal biológico es una sustancia biológica. Una sustancia biológica es una sustancia que se produce por una fuente biológica, o se extrae de ella. Se necesita de una combinación de pruebas fisico-químicas y biológicas, el proceso y control de su producción para caracterizarla y determinar su calidad. Medicamento biosimilar: Un medicamento biosimilar es una versión muy similar de un medicamento biológico aprobado previamente. Definición de la Organización Mundial de la Salud (también se lo denomina producto bioterapéutico similar): Producto bioterapéutico que es similar en términos de calidad, seguridad y eficacia a un producto bioterapéutico de referencia autorizado previamente. Definición de la Agencia Europea de Medicamentos: Medicamento biológico que se desarrolla para que sea similar a un medicamento biológico existente. Cuando se aprueba, se ha demostrado que su variabilidad y las diferencias entre éste y su medicamento de referencia no afectan la seguridad o efectividad. Definición de la Administración de Alimentos y Medicamentos de EE. UU.: Producto biológico que es muy similar a un producto biológico de referencia con autorización de EE. UU., independientemente de las diferencias menores entre el producto biológico y el producto de referencia en términos de seguridad, pureza y concentración del producto. Farmacovigilancia: La ciencia y las actividades relativas a la detección, evaluación, comprensión y prevención de los efectos adversos o cualquier otro problema relacionado con el fármaco. Introducción Esta Guía rápida le ofrece al lector una introducción a los medicamentos biológicos y biosimilares, por qué son importantes, en qué se diferencian los biosimilares del medicamento biológico original (conocido como el producto de referencia) y también de los medicamentos genéricos, y qué deben saber los pacientes para utilizarlos de manera segura y efectiva. Forma parte de un Conjunto de herramientas de información y orientación sobre medicamentos biológicos y biosimilares para las organizaciones de pacientes que contiene un Boletín informativo con información más detallada sobre estos medicamentos, hojas de datos, información sobre lo que las organizaciones de pacientes pueden hacer y los enlaces a diferentes recursos adicionales. Qué son los medicamentos biológicos y biosimilares? Un medicamento biológico se hace a partir de un organismo vivo. Esto es lo que lo diferencia de los medicamentos químicos tradicionales, que se hacen a partir de la combinación de ingredientes químicos. Para hacer medicamentos biológicos se utilizan técnicas biotecnológicas (es decir, aquellas que modifican los organismos vivos para producir un producto o realizar una función). Desde su introducción en los ochenta, los medicamentos biológicos se han convertido en los tratamientos principales de muchas enfermedades, como los carcinomas, la diabetes, la esclerosis múltiple, los ataques cardíacos, los accidentes cerebrovasculares y las enfermedades autoinmunitarias como la artritis reumatoidea. Un medicamento biosimilar se desarrolla con el fin de ser muy similar al medicamento biológico que ya se ha aprobado. Es legal fabricar un medicamento biosimilar en base al mismo principio activo que el medicamento biológico original después del vencimiento de la patente. Un medicamento genérico se considera como una versión idéntica al medicamento químico original de marca. Un medicamento biosimilar es una versión muy similar, pero no idéntica, al medicamento biológico. Sin embargo, se ha demostrado que las diferencias entre el biosimilar y su medicamento de referencia no afectan la calidad, la seguridad o la eficacia. Por qué los medicamentos biológicos y biosimilares son importantes? Los medicamentos biológicos se utilizan en el tratamiento de una cantidad de enfermedades. Algunos trastornos se originan en las deficiencias de proteínas específicas, como: 1 3 la hormona de crecimiento (que conduce a una estatura baja y otros síntomas) insulina (que causa diabetes) factores de coagulación (que causan hemofilia y otros desórdenes sanguíneos) eritropoyetina (que causa anemia) factor estimulante de colonias de granulocitos (que causa infecciones y otros trastornos) 2 3
4 una gran variedad de enzimas de almacenamiento lisosómico (que causan las enfermedades de Gaucher, Fabry, Pompe y otras enfermedades por almacenamiento lisosómico). Los medicamentos biológicos se hacen a partir de proteínas que se producen naturalmente en el cuerpo. Cuando un paciente recibe un medicamento biológico, éste funciona como una proteína natural, resuelve los síntomas y previene o retarda la progresión de la enfermedad. Las vacunas también son un tipo de medicamento biológico. Los pacientes deben enfrentar diversas barreras para acceder a los nuevos medicamentos, y una de ellas es el costo. Cuando se descubre un nuevo medicamento, se le proporciona al fabricante original un período de protección de la patente para estimular la innovación y permitir la recuperación de los costos de investigación y desarrollo. Si bien los medicamentos biológicos han revolucionado el tratamiento de numerosas enfermedades que no se podían tratar con anterioridad, el acceso para los pacientes de todo el mundo puede verse limitado o resultar dificultoso dado su alto precio inicial. El desarrollo de los medicamentos biológicos tiende a ser mucho más costoso que el de los medicamentos químicos por los elevados costos de desarrollo, materiales y fabricación y, por lo tanto, es posible que sean más costosos y menos accesibles durante el período de la patente. 4 Uno de los factores que impulsan la producción de los medicamentos biosimilares es hacerlos accesibles a más pacientes y proporcionar más opciones de tratamientos. De la misma manera que los medicamentos genéricos, los medicamentos biosimilares se pueden producir una vez vencida la patente del producto de referencia. Qué deben tener en cuenta los pacientes cuando toman los medicamentos biológicos? Los medicamentos biológicos no se pueden tomar por vía oral dado que las proteínas con las que están hechos no se digieren o no se absorben. A menudo, se inyectan o infunden en una vena o debajo de la piel. Los pacientes pueden tener algunas reacciones, como enrojecimiento, hinchazón o inflamación, en el lugar de la inyección. La intensidad y la frecuencia de estas reacciones pueden variar. Los medicamentos biológicos son más grandes y complejos que los medicamentos químicos, como una aspirina (un analgésico), y es más probable que el cuerpo los trate como productos extraños y que causen una reacción inmunitaria como alergia o hipersensibilidad. 5 Estas reacciones son a menudo leves y desaparecen con el tiempo. Sin embargo, puede ocurrir una reacción poco frecuente pero grave cuando el cuerpo produce anticuerpos neutralizantes. Estos anticuerpos no sólo destruyen la proteína en el medicamento biológico sino también todas las proteínas propias del cuerpo que ese medicamento reemplace o complemente. Esto puede ser una situación que ponga en riesgo la vida, dado que puede hacer que no quede ninguna proteína en el cuerpo. 6 Cómo afectan a los pacientes las diferencias entre los medicamentos biológicos y químicos? La variabilidad en el proceso de fabricación Para elaborar los medicamentos químicos tradicionales, como el paracetamol o la aspirina, se hacen reacciones químicas que se pueden reproducir y controlar fácilmente. 7 Por lo general, son moléculas pequeñas y estables, por eso es posible caracterizar su estructura por completo a través de métodos analíticos relativamente simples. 3 El proceso de fabricación de un medicamento biológico es más complejo y sensible que el de los medicamentos químicos. La mayor parte de los medicamentos biológicos se producen con células cuyos genes se han modificado para producir una determinada proteína. Así funciona: 1,7 1. En primer lugar, se identifica el código genético (una secuencia de ADN) de una proteína elegida (por ejemplo, una hormona, un anticuerpo, un producto sanguíneo) y se crea una secuencia de ADN funcional. 2. El código genético se inserta en varias líneas de células huésped (por ejemplo, bacterias o levaduras), de manera que las células huésped produzcan esta proteína. 3. Se elige la línea de células huésped que produce la proteína de manera más efectiva. 4. Luego, se hace crecer la línea de células en máquinas llamadas biorreactores; este proceso se denomina fermentación. 5. La proteína se separa del biorreactor (por ejemplo, mediante filtración). 6. La proteína se purifica, estabiliza y procesa en un medicamento (por ejemplo, inyecciones de insulina). Fuente ADN Objetivo ADN Secuencia genética de la proteína deseada identificada Droga purificada a granel Proteína purificada, estabilizada y procesada en un medicamento Secuencia de ADN funcional creada Proteína separada de las células mediante filtrado/centrifugado Secuencia de ADN insertada en una célula huésped, por ejemplo, bacteria La línea celular que produce la proteína de manera más efectiva se selecciona y cultiva en un biorreactor Figura 1. Pasos en la producción de un medicamento biológico. 4 5
5 Incluso pequeñas variaciones en el proceso de fabricación, como la línea de célula huésped que se utiliza, las condiciones de crecimiento, los compuestos utilizados para estabilizar la proteína y las condiciones de fabricación, pueden producir cambios en el medicamento final. Nunca dos lotes de un medicamento biológico (incluso de un mismo fabricante) son exactamente iguales. Moléculas más grandes y complejas Los medicamentos biológicos tienden a ser más grandes y tener una estructura más compleja que los medicamentos químicos. 8 Para los pacientes, esto tiene varias consecuencias importantes. Los medicamentos biológicos pueden degradarse según cómo se manipulan y almacenan y, por lo tanto, deben transportarse y almacenarse muy cuidadosamente para evitar que se deterioren. 6 La mayoría de los medicamentos químicos se pueden utilizar en establecimientos de atención primaria y secundaria, y también se pueden autoadministrar (es decir, tomarse en forma de comprimidos en el hogar). Dado que los medicamentos biológicos se utilizan para tratar enfermedades más graves, generalmente son recetados por especialistas y se administran en el hospital. Por último, es más probable que el cuerpo reconozca estos medicamentos más grandes y de estructura más compleja como algo extraño y que estos causen una reacción inmunitaria. 3 La capacidad de ocasionar una reacción inmunitaria se denomina inmunogenicidad. Tabla 1. Principales diferencias entre los medicamentos químicos tradicionales y los medicamentos biológicos En qué se diferencian los medicamentos biosimilares de los medicamentos biológicos de referencia? Resulta relativamente fácil fabricar una copia genérica exacta de un medicamento químico de marca a través de una serie de reacciones químicas. Este no es el caso de los medicamentos biosimilares. Como su nombre lo implica, un medicamento biosimilar se desarrolla como una versión muy similar de un medicamento biológico que ya ha sido aprobado. El medicamento que ya ha sido aprobado se denomina generalmente producto de referencia o producto originador. Es casi imposible realizar una copia exacta de un medicamento biológico dado, incluidos los medicamentos biosimilares, por tres razones: En primer lugar, dado que los medicamentos biológicos están hechos en organismos vivos, siempre habrá alguna diferencia en sus características y estructura, incluso si esto no afecta el funcionamiento del medicamento. En segundo lugar, son grandes y tienen una estructura compleja, lo que hace difícil descifrar su estructura por completo En tercer lugar, el medicamento final depende en gran medida del proceso de fabricación. Cuando vence la patente del medicamento biológico de referencia, el fabricante no está obligado a divulgar los detalles precisos del proceso de fabricación. 9 Por lo tanto, cada fabricante de medicamentos biosimilares tiene que tomar sus propias decisiones en cuanto a la elección de la línea celular utilizada, la condición bajo la cual se cultivan las células, los compuestos estabilizadores utilizados, y el acondicionamiento y almacenamiento del medicamento. Medicamentos químicos tradicionales Es improbable que provoquen una reacción inmunitaria en el cuerpo por su pequeño tamaño Frecuentemente se toman en forma de comprimidos o cápsulas Generalmente los receta el médico de cabecera o un médico de atención primaria A menudo se pueden autoadministrar en el hogar Medicamentos biológicos Es más probable que provoquen una reacción inmunitaria en el cuerpo por su gran tamaño molecular y su composición A menudo se administran en forma de inyección o infusión Generalmente se utilizan para el tratamiento de enfermedades más graves y con frecuencia los recetan los especialistas A menudo se administran en el hospital con la ayuda del personal médico o se autoadministran mediante inyecciones subcutáneas Es importante notar que los biosimilares se desarrollan intencionalmente para que coincidan con toda variabilidad presente en los productos de referencia. Cómo se aprueban los medicamentos? Medicamentos genéricos Un medicamento genérico se hace a partir de los mismos compuestos químicos y tiene la misma estructura química que el medicamento de marca original. Para su aprobación, no es necesario someter a los genéricos a ensayos clínicos (probarse en pacientes para demostrar la eficacia y la seguridad) dado que los ensayos se llevan a cabo para el medicamento de marca original. El medicamento genérico sólo debe demostrar que el principio activo está disponible para el cuerpo en la misma relación y en la misma medida que lo está con el medicamento original. Un genérico generalmente se considera como bioequivalente (es decir, funciona en el cuerpo de la misma manera) que el medicamento de marca original. 6 7
6 Medicamentos biosimilares Un biosimilar no es una copia genérica del medicamento biológico de referencia. Para ser aprobado, un medicamento biosimilar debe demostrar que es comparable con el producto de referencia en términos de calidad, seguridad y eficacia mediante un ejercicio de comparabilidad del biosimilar. Las primeras directrices fueron desarrolladas por la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) en 2005, 10 y la Organización Mundial de la Salud (OMS) publicó sus directrices en 2010, 9 seguidas por los proyectos de directrices de la Administración de Medicamentos y Alimentos de EE. UU. (FDA, por sus siglas en inglés) en Los tres indican que, para que cualquier producto biológico se diseñe como un biosimilar, se debe aprobar mediante un proceso regulador estricto. 9 Las directrices de la OMS se desarrollaron con el fin de orientar a las autoridades reguladoras en el desarrollo de sus normas nacionales para evaluar la calidad, seguridad y eficacia de los medicamentos biosimilares. La EMA ha desarrollado, desde entonces, directrices específicas para comparar el biosimilar propuesto con el producto de referencia, que comprenden la calidad, la consistencia, el proceso de fabricación, la seguridad y la eficacia según el tipo de medicamento biosimilar. Qué deben saber los pacientes sobre la seguridad de los medicamentos biológicos? Todos los medicamentos tienen un riesgo de causar una reacción inmunitaria por el hecho de que el cuerpo lo reconoce como un producto extraño y crea anticuerpos contra éste. Dado que los anticuerpos atacan al medicamento, su efectividad puede verse afectada con el tiempo. Si bien los medicamentos biológicos y biosimilares deben cumplir normas reguladoras de seguridad antes de ser aprobados, después de su aprobación, su uso por parte de los pacientes plantea riesgos continuos. Los medicamentos biológicos, incluidos los biosimilares, son más propensos a provocar una reacción inmunitaria en el cuerpo que los medicamentos químicos. Con mayor frecuencia, los anticuerpos producidos en una reacción inmunitaria al medicamento biológico pueden reducir la eficacia del medicamento, y provocar reacciones alérgicas que pueden ser de leves a más graves, como la anafilaxis. 2 En casos extremos, los anticuerpos pueden neutralizar el medicamento biológico, eliminando su eficacia por completo. En el caso de medicamentos biosimilares, se requieren estudios de calidad, estudios no clínicos y estudios clínicos en seres humanos, así como también un monitoreo posterior a la aprobación y un plan de gestión de riesgos en el momento de la presentación para su aprobación. Los datos requeridos para cada medicamento biosimilar pueden diferir; en todos los casos serán diferentes de los requisitos para los medicamentos biológicos de referencia. El propósito del ejercicio de comparabilidad no es evaluar los beneficios del medicamento biosimilar, sino demostrar que es muy similar al producto de referencia y que tiene una calidad, una seguridad y una eficacia comparables con el producto de referencia. 8 Resumen de los biosimilares Los medicamentos biológicos son moléculas complejas y grandes que se producen en los organismos vivos. Un medicamento biosimilar es una versión muy similar de un producto de referencia con calidad, seguridad, y eficacia comparables. Esto se demuestra mediante un ejercicio de comparabilidad del biosimilar que incluye estudios de calidad, estudios no clínicos y ensayos clínicos en seres humanos. Para la aprobación, también se requiere el monitoreo posterior a la aprobación y un plan para gestionar los riesgos con el fin de asegurar la eficacia y seguridad en el uso. Los biosimilares se desarrollan para ofrecer productos alternativos generalmente a un costo inferior y para incrementar las opciones para los clínicos, las personas que deben pagarlos y los sistemas de atención de la salud en general. En algunos casos, los anticuerpos también pueden atacar la proteína propia del cuerpo (que se supone que el medicamento biológico complementará), una alteración conocida como autoinmunidad que es altamente peligrosa. 6 Para los hemofílicos, si se presenta la autoinmunidad al medicamento biológico, los anticuerpos producidos no solo destruirán el factor de coagulación sintético que se administra al paciente sino también el factor de coagulación natural que el cuerpo produce. El caso de EPREX La eritropoyetina (EPO) es una hormona natural que estimula la producción de eritrocitos. La versión de un medicamento biológico de la eritropoyetina, a menudo llamada EPO, puede tener un riesgo pequeño pero muy peligroso de provocar una reacción inmunitaria conocida como aplasia eritrocitaria pura adquirida (PRCA, por sus siglas en inglés). Los pacientes con PRCA desarrollan anticuerpos que atacan no solo la EPO de la versión del medicamento biológico, sino también la eritropoyetina natural del cuerpo, provocando un tipo potencialmente mortal de anemia. Entre 2000 y 2002 hubo un incremento marcado de los casos de PRCA entre pacientes que utilizaban una versión determinada de EPO (es decir, Eprex, un producto originador). Una minuciosa investigación condujo al descubrimiento de que el aumento de los casos de PRCA se debió a un cambio pequeño en la fabricación de la fórmula de Eprex. 6 El caso anterior muestra cómo un cambio muy pequeño en el proceso de fabricación de un medicamento biológico puede aumentar el riesgo de una reacción inmunitaria. Más aún, incluso los pacientes que han estado tomando un medicamento biológico durante un período prolongado pueden desarrollar una reacción inmunitaria, que aún puede persistir 8 9
7 después de la interrupción del medicamento. 12 No obstante, las reacciones inmunitarias pueden ser difíciles de predecir. Si bien puede ser posible identificar el riesgo de las reacciones inmunológicas al medicamento biológico antes de los ensayos clínicos, estas ocurrencias son a menudo poco frecuentes. Por lo tanto, es muy improbable que se detecten en un estudio clínico, que generalmente incluye sólo una cantidad limitada de pacientes en un período limitado de tiempo. 6,13,14 Para recolectar la información sobre los efectos adversos de un fármaco, incluidas las reacciones inmunitarias, en entornos de la vida real, es necesario contar con un plan para el monitoreo continuo, conocido como farmacovigilancia. 15 La Organización Mundial de la Salud (OMS) define la farmacovigilancia como la ciencia y las actividades relativas a la detección, evaluación, comprensión y prevención de los efectos adversos o cualquier otro problema relacionado con ellos. 15 Se les exige a todas las empresas farmacéuticas contar con planes de farmacovigilancia para monitorear y responder a los efectos adversos potenciales de cada medicamento que fabrican. La mayoría de las autoridades reguladoras exigen que todos los fabricantes de medicamentos biológicos, incluidos los fabricantes de biosimilares, proporcionen un plan de farmacovigilancia que sea específico a cada medicamento biosimilar. Qué información deben reportar los pacientes en caso de sufrir un efecto adverso? Todos los medicamentos biológicos son diferentes unos de otros, pueden sufrir cambios de fabricación durante su ciclo de vida, y tener el potencial de provocar efectos adversos. Por lo tanto, resulta importante que todos los medicamentos biológicos, incluidos los medicamentos biosimilares, se puedan identificar y controlar por separado. Esto puede representar un desafío dado que el producto de referencia y el medicamento biosimilar pueden recibir la misma Denominación común internacional (DCI). Una DCI es el nombre asignado por la OMS al principio activo que se encuentra en el medicamento. 16 Es diferente del nombre de la marca con el fin de evitar confusiones y garantizar la seguridad del paciente. Por ejemplo, en Europa hay tres eritropoyetinas biosimilares (utilizadas para aumentar los eritrocitos) cuyos nombres de marca son Binocrit, Epoetin alfa Hexal y Abseamed. La DCI para estas tres eritropoyetinas biosimilares es epoetina alfa. La DCI para Eprex, la eritropoyetina de referencia, también es epoetina alfa. Si el profesional de la salud receta un medicamento sólo con la DCI y no con el nombre de marca, es posible que ni el profesional de la salud ni el paciente conozcan exactamente qué producto se ha dado. Por lo tanto, si ocurre un efecto adverso, resulta difícil saber qué medicamento lo ocasionó. La Agencia Reguladora de Medicamentos y Productos para el Cuidado de la Salud del Reino Unido (MHRA, por sus siglas en inglés) recomienda que los profesionales de la salud utilicen el nombre de marca cuando recetan medicamentos biológicos, incluidos los biosimilares, indicando que, si bien los medicamentos de referencia y biosimilares pueden tener la misma DCI, esto no significa que sean idénticos. 17 De modo similar, la EMA recomienda utilizar el nombre de marca, el nombre del fabricante y el número de lote a la hora de reportar cualquier efecto adverso de cualquier medicamento biológico. 18 Dado que puede haber diferencias entre lotes de los medicamentos biológicos, es importante que se utilice el número de lote cuando se reporten los efectos adversos. Cómo se recetan los medicamentos en su país? Cuando se les receta un medicamento biológico o biosimilar, los pacientes deben asegurarse de conocer el nombre de la marca y dónde encontrar el número de lote de su medicamento. Qué aspectos deben tener en cuenta los pacientes en cuanto al medicamento biológico que se les ha recetado y han recibido? Los pacientes deben saber qué medicamento biológico (si es un medicamento de referencia o biosimilar) se les ha recetado y han recibido. En cambio, dado que la mayoría de los medicamentos genéricos tienen el mismo efecto en el cuerpo que su medicamento de marca original (también conocido como bioequivalencia), los pacientes pueden cambiar entre ellos sin que haya ningún cambio en la eficacia o la seguridad. 13 En otras palabras, dado que los medicamentos genéricos pueden ser bioequivalentes, también se pueden utilizar de manera intercambiable. 1 Si bien los medicamentos biosimilares son muy similares a su producto de referencia en términos de calidad, seguridad y eficacia, en la mayoría de los países no se consideran como intercambiables, es decir sustituibles. En el caso de medicamentos biológicos, la cuestión es ser capaz de rastrear los efectos adversos hasta el medicamento exacto, ya sea un producto de referencia o uno biosimilar. Es posible que esto resulte difícil si se han dispensado diferentes versiones sin el conocimiento de la persona que receta el medicamento o del paciente. Esto puede ocurrir cuando un farmacéutico decide sustituir un medicamento por otro, generalmente porque es más económico, o cuando el farmacéutico debe sustituir un fármaco por otro porque así lo dispone la ley. Esto se denomina sustitución automática. 18 Donde se permite esta sustitución automática, los farmacéuticos están acostumbrados a cambiar el medicamento químico de marca por un medicamento genérico, y esta práctica se podría extender a la sustitución de un medicamento biosimilar por el producto de referencia
8 Para asegurar la recolección de información precisa y la seguridad del paciente, los médicos y los pacientes deberían ser plenamente conscientes del medicamento exacto que están utilizando. Las reacciones inmunitarias a un medicamento biológico pueden presentarse después de que el paciente lo haya estado tomado durante un tiempo prolongado. Si ha ocurrido una sustitución automática o un intercambio repetido entre medicamentos durante el tratamiento, es posible que resulte muy difícil saber qué producto es el responsable del efecto adverso. 1,18,19 En general se acuerda que se requiera un ejercicio completo de comparabilidad del biosimilar según lo describen las directrices de la OMS para que un producto se pueda llamar biosimilar. Las copias de los medicamentos biosimilares autorizados sin un ejercicio completo de comparabilidad del biosimilar generalmente se conocen como biológicos subsiguientes no comparables. 23 Un ejemplo es Reditux, un medicamento subsiguiente no comparable del rituximab, un anticuerpo monoclonal, utilizado para el tratamiento de artritis reumatoidea y algunas formas de cáncer. Se aprobó en la India en 2007 sobre la base de menos datos comparables que los necesarios para solicitar la aprobación en Europa o los Estados Unidos, y se desconoce si fue sujeto a estudios clínicos Un desafío consiste en qué hacer con los biológicos subsiguientes no comparables que se aprueban antes de la introducción de las vías reguladoras para la aprobación de medicamentos biosimilares. Esta es la situación en la India, que publicó sus lineamientos para biológicos similares en 2012, así como también en algunos países latinoamericanos como Perú, Chile y Colombia. 20,27 Los pacientes pueden estar seguros de que las regulaciones de todo el mundo garantizarán la calidad, la seguridad y la eficacia de los medicamentos biológicos? Se acepta, por lo general, que los lineamientos de la OMS, EMA y FDA deberían proporcionar una base sólida y completa para la aprobación de los medicamentos biosimilares. En el ámbito mundial, las autoridades reguladoras están desarrollando los lineamientos y vías de aprobación de los medicamentos biosimilares para aprovechar las oportunidades y hacer frente a los desafíos emergentes. A medida que la biotecnología avanza y vencen cada vez más patentes de medicamentos biológicos, una gran cantidad de fabricantes en más países recurren a las copias de los medicamentos biológicos como una manera de incrementar la disponibilidad de medicamentos biológicos a los pacientes. Muchos países se encuentran en el proceso de desarrollar lineamientos para los medicamentos biológicos y biosimilares. Si bien algunas autoridades reguladoras utilizan las directrices de la EMA o de la OMS como referencia, no todas estas pautas cumplen con todos los requisitos de la OMS, y por lo tanto se compromete potencialmente la seguridad del paciente. Por ejemplo, en algunos países, los lineamientos no requieren un ejercicio de comparabilidad completo para su aprobación. 20 De manera similar, existe la preocupación de que, en algunos países en desarrollo, el proceso de aprobación y el control de calidad posterior a la aprobación no sean lo suficientemente estrictos. Más aún, algunos países como Brasil, que toman las directrices de la OMS como referencia, cuentan con dos vías de aprobación con diferentes niveles de datos requeridos. 21 Si bien esto puede alentar la producción local de los medicamentos biológicos y reducir los costos de estos medicamento, es difícil estar seguros de que los medicamentos que se aprueban sean de alta calidad, seguridad y eficacia. 22 Si bien ha habido avances en términos de regulación, es necesario trabajar aún más para armonizar las normas reguladoras de los medicamentos biosimilares a nivel mundial con aquellos de los entes reguladores más estrictos como la OMS, EMA o FDA. Así se podrá asegurar que todos los pacientes reciban productos de alta calidad, seguridad y eficacia. Consulte el cuadernillo Lo que las organizaciones de pacientes pueden hacer que se encuentra en el Conjunto de herramientas de información y orientación sobre medicamentos biológicos y biosimilares para conocer más sobre cómo las organizaciones de pacientes pueden abogar por una regulación más sólida. Quién puede acceder a los medicamentos biológicos? La mayoría de los medicamentos biológicos son más costosos que los medicamentos químicos tradicionales y, por lo tanto, no están disponibles para todos los pacientes. Como las copias genéricas de los medicamentos químicos de marca, las versiones biosimilares de los medicamentos biológicos de referencia se desarrollan para proporcionar medicamentos alternativos, generalmente a un costo inferior, y así se incrementan las opciones para los clínicos, las personas que deben pagarlos y los sistemas de atención de la salud. Se espera que los medicamentos biosimilares reduzcan el precio en un 15 a 30% en comparación con el producto de referencia. 28 Sin embargo, los fabricantes de medicamentos biosimilares deben invertir en ensayos clínicos, fabricación y programas de monitoreo de la seguridad posterior a la aprobación, del mismo modo que lo hacen los fabricantes de los nuevos medicamentos biológicos. Por estos motivos, cuesta alrededor de US$ 75 a 250 millones obtener la aprobación de un medicamento biosimilar, en comparación con los US$ 2 a 3 millones para los medicamentos genéricos. 29 Por lo tanto, si bien se logran reducciones del 80 al 90 % generalmente para los genéricos, este no es el caso para los biosimilares
9 La reducción real de los costos de un medicamento biosimilar puede depender de cómo se decide el precio y el reembolso de un medicamento en un país en particular. 25 En Europa, cada país decide de manera independiente el valor terapéutico de un medicamento, su precio y cómo será reembolsado. 30 Sin embargo, si bien son más económicos que su medicamento de referencia, los medicamentos biosimilares siguen siendo inaccesibles en varios países en desarrollo. Algunos fabricantes de medicamentos tanto biológicos originales como biosimilares ofrecen precios diferenciales a países de ingresos bajos e ingresos altos para mejorar la disponibilidad. Por último, el acceso de los pacientes a los medicamentos biosimilares no es automático, incluso si están disponibles y pueden costearlo. Todas las partes interesadas pertinentes deben emprender acciones proactivas. 31 Los factores culturales y geográficos también afectan la disponibilidad de los medicamentos biosimilares. Por ejemplo, en algunos países o regiones en desarrollo, las prácticas de prescripción y dispensación no son ampliamente aceptadas. Esto significa que generalmente se recetan y dispensan marcas más costosas en lugar de versiones más económicas que podrían permitir que más pacientes tengan acceso a estos medicamentos. 30 Las barreras de acceso a los medicamentos biológicos y biosimilares que cumplen con las normas de la EMA, OMS o FDA incluyen: precio elevado de los medicamentos pocos conocimientos y comprensión escasa de lo que son los medicamentos biológicos y su valor terapéutico por parte de los gobiernos, médicos y pacientes poca o ninguna regulación de los medicamentos biológicos y biosimilares poca o ninguna voluntad política para garantizar el acceso métodos de administración más complejos diagnósticos, selección y pruebas insuficientes. Qué información y apoyo necesitan los pacientes? Poder tomar una decisión completamente fundada para tomar o recetar un medicamento biosimilar es esencial para pacientes, médicos, enfermeras y farmacéuticos. Los pacientes deben participar, junto con su equipo de atención de la salud, de la decisión sobre el tratamiento a realizar. Con ese fin en mente, los pacientes deben contar con la información completa, en un idioma comprensible, sobre los beneficios y riesgos de todas las opciones de los medicamentos, los requisitos para un uso seguro y efectivo, los efectos adversos potenciales, cómo reconocerlos y cómo reportarlos, y cómo saber si el medicamento está funcionando según lo esperado. La información debe brindarla un intermediario confiable, como un médico, una enfermera, un farmacéutico o una organización de pacientes. El desafío para todas las partes interesadas, incluidos los proveedores de servicios de atención de salud, los pacientes y las organizaciones de pacientes, es la falta de la información adecuada así como la desinformación y las percepciones erróneas sobre los medicamentos biosimilares. Muchos médicos dudan en considerar a los medicamentos biosimilares como una opción de tratamiento para sus pacientes por sentirse preocupados en cuanto a su seguridad, calidad, eficacia y su capacidad de ser intercambiables. 8 Los médicos y las enfermeras necesitan información objetiva y actual sobre la ciencia y los procesos reguladores de los medicamentos biosimilares. De ser así, podrán comprender que, en entornos regulados de manera estricta, los medicamentos biosimilares proporcionan medicamentos alternativos de alta calidad, seguridad y eficacia que pueden incrementar las opciones de tratamiento para los pacientes y mejorar el acceso a los tratamientos. Se destacó que la falta de conocimientos y educación entre las enfermeras podría llevar a errores graves de medicación y retrasos en los beneficios terapéuticos para el paciente. 32 Todas las partes interesadas cumplen un rol en proporcionar la información y existe un gran potencial para ejercer esfuerzos en conjunto. Las empresas y asociaciones de atención de la salud, los entes reguladores, los profesionales médicos e investigadores científicos pueden reunir los datos técnicos, científicos y médicos. Las organizaciones de pacientes y los pacientes pueden aportar conocimientos sobre la mejor manera de presentar la información, comunicar los riesgos e involucrar a los pacientes en las decisiones que afectan a su salud. Si desea conocer más sobre la biotecnología o los medicamentos biológicos y biosimilares, podrá encontrar más información en el Boletín informativo sobre medicamentos biológicos y biosimilares y en otras secciones del Conjunto de herramientas de información y orientación
10 Referencias bibliográficas 1. Mellstedt, H., Niederwieser, D. & Ludwig, H. The challenge of biosimilars. Annals of Oncology: official journal of the European Society for Medical Oncology / ESMO 19, (2008) 2. Büttel, I.C. et al. Taking immunogenicity assessment of therapeutic proteins to the next level. Biologicals: journal of the International Association of Biological Standardization 39, (2011) 3. Crommelin, D.J.A. et al. Shifting paradigms: biopharmaceuticals versus low molecular weight drugs. International Journal of Pharmaceutics 266, 3 16 (2003) 4. Kozlowski, S., Woodcock, J., Midthun, K. & Sherman, R. B. Developing the Nation s Biosimilars Program. The New England Journal of Medicine 365, (2011) 5. Kessler, M., Goldsmith, D. & Schellekens, H. Immunogenicity of biopharmaceuticals. Nephrology, dialysis, transplantation: official publication of the European Dialysis and Transplant Association. European Renal Association 21 Suppl 5, 9 12 (2006) 6. Schellekens, H. Biosimilar therapeutics what do we need to consider? NDT plus 2, i27 i36 (2009) 7. Simoens, S. A European perspective on the market accessibility of biosimilars. Biosimilars 2, (2012) 8. Weise, M. et al. Biosimilars: what clinicians should know. Blood 120, (2012) 9. World Health Organization. Guidelines on evaluation of similar biotherpeutic products (SBPs). Expert Committe on Biological Standardization. Geneva (2009) 10. European Medicines Agency. Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: quality issues (2005). Accessed at: Scientific_guideline/2009/09/WC pdf 11. Kay, J. Biosimilars: a regulatory perspective from America. Arthritis Research & Therapy 13 (2011) 12. European Generic Medicines Association. Biosimilars Handbook (2011) 13. EuropaBio. Guide to Biosimilars: A Focus on Biosimilar Medicines (2011) 14. Medicines and Healthcare Products Regulatory Agency. Medicines safety monitoring (2013). Accessed at: Howwemonitorthesafetyofproducts/Medicines/Pharmacovigilance/index.htm 15. World Health Organization. Pharmacovigilance (2013). Accessed at: Zuñiga, L. & Calvo, B. Biosimilars: pharmacovigilance and risk management. Pharmacoepidemiology and Drug Safety 19, (2010) 17. Medicines and Healthcare Products Regulatory Agency. Biosimilar products (2008). Accessed at: EuropaBio. EuropaBio & Biosimilar Medicines (2008) 19. Ebbers, H.C., Crow, S.A, Vulto, A.G. & Schellekens, H. Interchangeability, immunogenicity and biosimilars. Nature Biotechnology 30, (2012) 20. Garcia, R. Biological Drug Regulation. Presentation at the Alianza Latina 7th Forum (2012) 21. Castanheira, L.G., Barbano, D.B.A. & Rech, N. Current development in regulation of similar biotherapeutic products in Brazil. Biologicals: Journal of the International Association of Biological Standardization 39, (2011) 22. Generics and Biosimilars Initative. Prospects for producing follow-on biological products in Brazil (2013). Accessed at: Prospects-for-producing-follow-on-biological-products-in-Brazil 23. Weise, M. et al. Biosimilars why terminology matters. Nature Biotechnology 29, (2011) 24. Generics and Biosimilars Initative. Dr Reddy s plans EU launch for biosimilar rituximab (2012). Accessed at: IMS Health. Shaping the biosimilars opportunity: A global perspective on the evolving biosimilars landscape (2011) 26. Generics and Biosimilars Initative. Similar biologics approved and marketed in India (2012). Accessed at: Rathore, A. Guidelines on similar biologics: regulatory requirements for marketing authorization in India. PDA Journal of Pharmaceutical Science and Technology / PDA 66, 393 (2012) 28. Mellstedt, H. The future of biosimilars. Hospital Pharmacy Europe (2010). Accessed at: biosimilars_&page=article.display&article.id= Sandoz. Biosimilar Development (2013). Accessed at: International Alliance of Patients Organizations. Briefing Paper on Biosimilar Medicines (2006) 31. European Generic Medicines Association. Frequently asked questions about biosimilar medicines (2011). Accessed at: Salem, L. & Harvie, B. Biosimilar medicines and their use: the nurse s role and responsibility. Renal Society of Australasia Journal 6, (2010) 16 17
11 49 51 East Road, London N1 6AH, United Kingdom Tel: Fax:
Medicamentos bioterapéuticos
 International Federation of Pharmaceutical Manufacturers & Associations Medicamentos bioterapéuticos Comprendiendo la nueva generación de tratamientos Los medicamentos bioterapéuticos son una parte integral
International Federation of Pharmaceutical Manufacturers & Associations Medicamentos bioterapéuticos Comprendiendo la nueva generación de tratamientos Los medicamentos bioterapéuticos son una parte integral
Medicamentos biológicos y biosimilares
 Medicamentos biológicos y biosimilares folleto biosimilares FILMAR.indd 1 24/10/12 10:09 En qué se diferencian los medicamentos biológicos de los medicamentos tradicionales? Introducción Gracias a la investigación
Medicamentos biológicos y biosimilares folleto biosimilares FILMAR.indd 1 24/10/12 10:09 En qué se diferencian los medicamentos biológicos de los medicamentos tradicionales? Introducción Gracias a la investigación
Biosimilars: una alternativa segura i eficaç
 JORNADA CONJUNTA DE LES SOCIETATS CATALANES DE FARMÀCIA CLÍNIC, GESTIÓ SANITÀRIA I REUMATOLOGIA Biosimilars: una alternativa segura i eficaç Fernando de Mora Dpt. de Farmacologia, de Terapèutica i de Toxicologia
JORNADA CONJUNTA DE LES SOCIETATS CATALANES DE FARMÀCIA CLÍNIC, GESTIÓ SANITÀRIA I REUMATOLOGIA Biosimilars: una alternativa segura i eficaç Fernando de Mora Dpt. de Farmacologia, de Terapèutica i de Toxicologia
MEDICAMENTOS GENERICOS
 MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
Boletín informativo sobre Medicamentos biológicos y biosimilares
 Boletín informativo sobre Medicamentos biológicos y biosimilares Tabla de contenidos Nuestros agradecimientos IAPO agradece a todas las personas que participaron en la planificación de este Conjunto de
Boletín informativo sobre Medicamentos biológicos y biosimilares Tabla de contenidos Nuestros agradecimientos IAPO agradece a todas las personas que participaron en la planificación de este Conjunto de
Índice INGENIERÍA GENÉTICA
 INGENIERÍA GENÉTICA Índice Ingeniería y manipulación genética: aplicaciones, repercusiones y desafíos más importantes. - Los alimentos transgénicos. La clonación. El genoma humano. Implicaciones ecológicas,
INGENIERÍA GENÉTICA Índice Ingeniería y manipulación genética: aplicaciones, repercusiones y desafíos más importantes. - Los alimentos transgénicos. La clonación. El genoma humano. Implicaciones ecológicas,
Declaración de Política
 Declaración de Política Productos Bioterapéuticos no Comparables Qué es un «producto bioterapéutico no comparable»? 24 de Julio de 2014 A los fines de este documento, utilizaremos el término «producto
Declaración de Política Productos Bioterapéuticos no Comparables Qué es un «producto bioterapéutico no comparable»? 24 de Julio de 2014 A los fines de este documento, utilizaremos el término «producto
Productos Bioterapéuticos Similares
 International Federation of Pharmaceutical Manufacturers & Associations Productos Bioterapéuticos Similares Consideraciones científicas y regulatorias Índice Presentación de los 1 medicamentos bioterapéuticos
International Federation of Pharmaceutical Manufacturers & Associations Productos Bioterapéuticos Similares Consideraciones científicas y regulatorias Índice Presentación de los 1 medicamentos bioterapéuticos
SITUACIÓN DEL CÁNCER EN LAS AMÉRICAS
 Publicaciones de la OPS/OMS sobre Control y Prevención del Cáncer Las publicaciones están disponibles en la página web de la OPS: www.paho.org/cancer SITUACIÓN DEL CÁNCER EN LAS AMÉRICAS Cáncer en las
Publicaciones de la OPS/OMS sobre Control y Prevención del Cáncer Las publicaciones están disponibles en la página web de la OPS: www.paho.org/cancer SITUACIÓN DEL CÁNCER EN LAS AMÉRICAS Cáncer en las
POSICIONAMIENTO SOBRE IDENTIFICACIÓN, INTERCAMBIABILIDAD Y SUSTITUCIÓN DE MEDICAMENTOS BIOSIMILARES
 POSICIONAMIENTO SOBRE IDENTIFICACIÓN, INTERCAMBIABILIDAD Y SUSTITUCIÓN DE MEDICAMENTOS BIOSIMILARES La SEFC valora muy positivamente la introducción de biosimilares en el Sistema Nacional de Salud (SNS)
POSICIONAMIENTO SOBRE IDENTIFICACIÓN, INTERCAMBIABILIDAD Y SUSTITUCIÓN DE MEDICAMENTOS BIOSIMILARES La SEFC valora muy positivamente la introducción de biosimilares en el Sistema Nacional de Salud (SNS)
INTRODUCCIÓN: SEGURIDAD Y MEDICAMENTOS
 INTRODUCCIÓN: SEGURIDAD Y MEDICAMENTOS Qué es un medicamento? Una sustancia que pueden consumir las personas con distintos fines 1) Prevenir o tratar enfermedades 2) Aliviar síntomas 3) Realizar un diagnóstico
INTRODUCCIÓN: SEGURIDAD Y MEDICAMENTOS Qué es un medicamento? Una sustancia que pueden consumir las personas con distintos fines 1) Prevenir o tratar enfermedades 2) Aliviar síntomas 3) Realizar un diagnóstico
Pero el Colegio Americano de Médicos afirma que los cambios en la dieta y en el ejercicio se deben comenzar antes que los fármacos
 Pero el Colegio Americano de Médicos afirma que los cambios en la dieta y en el ejercicio se deben comenzar antes que los fármacos Diabetes tipo 2 Medicinas para la diabetes LUNES, 6 de febrero (HealthDay
Pero el Colegio Americano de Médicos afirma que los cambios en la dieta y en el ejercicio se deben comenzar antes que los fármacos Diabetes tipo 2 Medicinas para la diabetes LUNES, 6 de febrero (HealthDay
Qué es la artritis reumatoide?
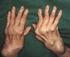 Qué es la artritis reumatoide? La artritis reumatoide es una enfermedad que afecta las articulaciones o coyunturas. Causa dolor, hinchazón y rigidez. Si una rodilla o mano tiene artritis reumatoide, usualmente
Qué es la artritis reumatoide? La artritis reumatoide es una enfermedad que afecta las articulaciones o coyunturas. Causa dolor, hinchazón y rigidez. Si una rodilla o mano tiene artritis reumatoide, usualmente
DIRECCION GENERAL DE MEDICAMENTOS, INSUMOS Y DROGAS ( DIGEMID -PERU) PRODUCTOS BIOLOGICOS SITUACION ACTUAL
 DIGEMID DIRECCION GENERAL DE MEDICAMENTOS, INSUMOS Y DROGAS ( DIGEMID -PERU) PRODUCTOS BIOLOGICOS SITUACION ACTUAL DRA. AMANDA MARTINEZ ROJO EQUIPO DE REGISTRO DE PRODUCTOS FARMACEUTICOS JUNIO - 2008 SITUACION
DIGEMID DIRECCION GENERAL DE MEDICAMENTOS, INSUMOS Y DROGAS ( DIGEMID -PERU) PRODUCTOS BIOLOGICOS SITUACION ACTUAL DRA. AMANDA MARTINEZ ROJO EQUIPO DE REGISTRO DE PRODUCTOS FARMACEUTICOS JUNIO - 2008 SITUACION
Professor Francisco Zaragozá, PhD, Spain
 GaBI Scientific Meetings ROUNDTABLE ON BIOSIMILARS Pharmacovigilance, Traceability, Immunogenicity 15 November 2016, Real Academia Nacional de Farmacia, Madrid, Spain Professor Francisco Zaragozá, PhD,
GaBI Scientific Meetings ROUNDTABLE ON BIOSIMILARS Pharmacovigilance, Traceability, Immunogenicity 15 November 2016, Real Academia Nacional de Farmacia, Madrid, Spain Professor Francisco Zaragozá, PhD,
Mercado de Medicamentos
 Mercado de Medicamentos Políticas para asegurar el acceso, incrementar la eficiencia y controlar el gasto DEPARTAMENTO DE ECONOMÍA DE LA SALUD SERGIO POBLETE VARGAS 10 DE OCTUBRE Estructura Contexto Características
Mercado de Medicamentos Políticas para asegurar el acceso, incrementar la eficiencia y controlar el gasto DEPARTAMENTO DE ECONOMÍA DE LA SALUD SERGIO POBLETE VARGAS 10 DE OCTUBRE Estructura Contexto Características
Sesión 13: Precalificación en el Contexto de las Adquisiciones del Fondo Mundial
 Sesión 13: Precalificación en el Contexto de las Adquisiciones del Fondo Mundial Creado el año 2002 Fondo Mundial Atrae y desembolsa recursos adicionales para prevenir y tratar el SIDA, tuberculosis (TB)
Sesión 13: Precalificación en el Contexto de las Adquisiciones del Fondo Mundial Creado el año 2002 Fondo Mundial Atrae y desembolsa recursos adicionales para prevenir y tratar el SIDA, tuberculosis (TB)
COMITÉS DE FARMACOTERÁPIA. Unidad de Asistencia Técnica y Logística Farmacéutica Ministerio de Salud Pública y Asistencia Social
 COMITÉS DE FARMACOTERÁPIA Unidad de Asistencia Técnica y Logística Farmacéutica Ministerio de Salud Pública y Asistencia Social DEFINICIÓN COMITÉ DE FARMACOTERÁPIA El Comité de Farmacoterápia es un ente
COMITÉS DE FARMACOTERÁPIA Unidad de Asistencia Técnica y Logística Farmacéutica Ministerio de Salud Pública y Asistencia Social DEFINICIÓN COMITÉ DE FARMACOTERÁPIA El Comité de Farmacoterápia es un ente
PREGUNTAS Y RESPUESTAS SOBRE MEDICAMENTOS BIOLÓGICOS - BIOSIMILARES MARZO 2015
 PREGUNTAS Y RESPUESTAS SOBRE MEDICAMENTOS BIOLÓGICOS - BIOSIMILARES MARZO 2015 1. Qué es un medicamento biológico, y en qué se diferencia de los productos químicos? Los fármacos biológicos son medicamentos
PREGUNTAS Y RESPUESTAS SOBRE MEDICAMENTOS BIOLÓGICOS - BIOSIMILARES MARZO 2015 1. Qué es un medicamento biológico, y en qué se diferencia de los productos químicos? Los fármacos biológicos son medicamentos
USO DE MEDICAMENTOS GENERICOS EN EL SECTOR PUBLICO Y PRIVADO. Dr. Enrique Granizo Universidad Central del Ecuador
 USO DE MEDICAMENTOS GENERICOS EN EL SECTOR PUBLICO Y PRIVADO Dr. Enrique Granizo Universidad Central del Ecuador 9no Seminario Internacional: IV Tecnología y Regulación de Mercado: Mercado de Fármacos
USO DE MEDICAMENTOS GENERICOS EN EL SECTOR PUBLICO Y PRIVADO Dr. Enrique Granizo Universidad Central del Ecuador 9no Seminario Internacional: IV Tecnología y Regulación de Mercado: Mercado de Fármacos
Medicamentos Biosimilares Marco Regulatorio: Agencia Europea de Medicamentos (EMA)
 INDICE Diferencias entre Medicamento Biológico y Medicamento Genérico Marco Regulatorio Marco Regulatorio EMA (Agencia Europea del Medicamento) Aspectos científicos y de fabricación Aspectos Científicos:
INDICE Diferencias entre Medicamento Biológico y Medicamento Genérico Marco Regulatorio Marco Regulatorio EMA (Agencia Europea del Medicamento) Aspectos científicos y de fabricación Aspectos Científicos:
ricos. Medicamentos genéricos: Seguros. Efectivos. Aprobados por la FDA.
 Lo que usted quiere saber sobre los medicamentos genéricos ricos. Medicamentos genéricos: Seguros. Efectivos. Aprobados por la FDA. Qué quiere saber sobre los medicamentos que usa tanto los genéricos como
Lo que usted quiere saber sobre los medicamentos genéricos ricos. Medicamentos genéricos: Seguros. Efectivos. Aprobados por la FDA. Qué quiere saber sobre los medicamentos que usa tanto los genéricos como
ISO 9001 Auditing Practices Group Guidance on:
 International Organization for Standardization International Accreditation Forum ISO 9001 Auditing Practices Group Guidance on: Auditando el proceso de Diseño y Desarrollo 1. Introducción El objetivo de
International Organization for Standardization International Accreditation Forum ISO 9001 Auditing Practices Group Guidance on: Auditando el proceso de Diseño y Desarrollo 1. Introducción El objetivo de
Atención Farmacéutica
 Atención Farmacéutica Los farmacéuticos, como parte del Sistema Nacional de Salud, comparten con los pacientes, los médicos, otros profesionales de la salud, y las Autoridades Sanitarias, la misión de
Atención Farmacéutica Los farmacéuticos, como parte del Sistema Nacional de Salud, comparten con los pacientes, los médicos, otros profesionales de la salud, y las Autoridades Sanitarias, la misión de
Redacción de Reivindicaciones de Patentes de Productos Agroquímicos
 Redacción de Reivindicaciones de Patentes de Productos Agroquímicos Maria Carmen S. Brito Dannemann, Siemsen, Bigler & Ipanema Moreira ASIPI Asunción 17.03.2015 1 Temas tratados: - Reivindicaciones habituales
Redacción de Reivindicaciones de Patentes de Productos Agroquímicos Maria Carmen S. Brito Dannemann, Siemsen, Bigler & Ipanema Moreira ASIPI Asunción 17.03.2015 1 Temas tratados: - Reivindicaciones habituales
Equivalentes terapéuticos
 Versión 1 10 Oct 2006 Equivalentes terapéuticos Por qué surge el concepto de equivalentes terapéuticos? El sistema de autorización de medicamentos por parte de las Agencias Reguladoras provoca que en el
Versión 1 10 Oct 2006 Equivalentes terapéuticos Por qué surge el concepto de equivalentes terapéuticos? El sistema de autorización de medicamentos por parte de las Agencias Reguladoras provoca que en el
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
Gestión de los Riesgos del Proyecto
 Áreas del conocimiento para la AP III Gestión de los Riesgos del Proyecto Basado en los estándares del PMI Ing. Fausto Fernández Martínez, MSc, MAP San José, Costa Rica - 2013 Controlar los Riesgos del
Áreas del conocimiento para la AP III Gestión de los Riesgos del Proyecto Basado en los estándares del PMI Ing. Fausto Fernández Martínez, MSc, MAP San José, Costa Rica - 2013 Controlar los Riesgos del
Qué es la artritis juvenil?
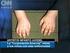 Qué es la artritis juvenil? Los niños pueden padecer de artritis al igual que los adultos. La artritis es causada por la inflamación de las articulaciones, lo cual ocasiona dolor, inflamación, rigidez
Qué es la artritis juvenil? Los niños pueden padecer de artritis al igual que los adultos. La artritis es causada por la inflamación de las articulaciones, lo cual ocasiona dolor, inflamación, rigidez
la asignación de un hígado
 HABLANDO DE TRASPLANTES Preguntas y respuestas para Candidatos a trasplantes sobre la asignación de un hígado Preguntas y respuestas para los candidatos a trasplantes sobre el Sistema de Asignación de
HABLANDO DE TRASPLANTES Preguntas y respuestas para Candidatos a trasplantes sobre la asignación de un hígado Preguntas y respuestas para los candidatos a trasplantes sobre el Sistema de Asignación de
OBJETIVO ESPECIFICO. Identificar peligros asociados a cada fase o etapa del trabajo y la posterior evaluación de los riesgos.
 ANALISIS DE RIESGO OBJETIVO ESPECIFICO Identificar peligros asociados a cada fase o etapa del trabajo y la posterior evaluación de los riesgos. ADMINISTRACIÓN DEL RIESGO = PREVENCIÓN CONTROL DE ACCIDENTES/
ANALISIS DE RIESGO OBJETIVO ESPECIFICO Identificar peligros asociados a cada fase o etapa del trabajo y la posterior evaluación de los riesgos. ADMINISTRACIÓN DEL RIESGO = PREVENCIÓN CONTROL DE ACCIDENTES/
cómo entender sus beneficios de farmacia healthnet.com
 Health Net cómo entender sus beneficios de farmacia healthnet.com Informarse Sobre Sus Beneficios Ahora que conoce estas definiciones, aquí se explica cómo funcionan sus beneficios. Cómo puedo estar seguro
Health Net cómo entender sus beneficios de farmacia healthnet.com Informarse Sobre Sus Beneficios Ahora que conoce estas definiciones, aquí se explica cómo funcionan sus beneficios. Cómo puedo estar seguro
Ainhoa Quintana Servicio de Farmacia. Hospital Universitario de Álava Txagorritxu. Vitoria Gasteiz
 Ainhoa Quintana Servicio de Farmacia. Hospital Universitario de Álava Txagorritxu. Vitoria Gasteiz Necesidad de establecer equivalentes terapéuticos Los sistemas sanitarios deben buscar la máxima calidad
Ainhoa Quintana Servicio de Farmacia. Hospital Universitario de Álava Txagorritxu. Vitoria Gasteiz Necesidad de establecer equivalentes terapéuticos Los sistemas sanitarios deben buscar la máxima calidad
TÍTULO REGLAMENTO TÉCNICO PARA EL REGISTRO SANITARIO DE MEDICAMENTOS BIOTECNOLÓGICOS INNOVADORES Y NO INNOVADORES PARA USO HUMANO
 TÍTULO REGLAMENTO TÉCNICO PARA EL REGISTRO SANITARIO DE MEDICAMENTOS BIOTECNOLÓGICOS INNOVADORES Y NO INNOVADORES PARA USO HUMANO UNIDAD RESPONSABLE DIRECCIÓN GENERAL DE MEDICAMENTOS, ALIMENTOS Y PRODUCTOS
TÍTULO REGLAMENTO TÉCNICO PARA EL REGISTRO SANITARIO DE MEDICAMENTOS BIOTECNOLÓGICOS INNOVADORES Y NO INNOVADORES PARA USO HUMANO UNIDAD RESPONSABLE DIRECCIÓN GENERAL DE MEDICAMENTOS, ALIMENTOS Y PRODUCTOS
ANTIBIOTICOS. Futuro de su utilización en la producción industrial. Miguel Ángel HIGUERA Director ANPROGAPOR
 ANTIBIOTICOS. Futuro de su utilización en la producción industrial Miguel Ángel HIGUERA Director ANPROGAPOR Enfermedad Libre de enfermedad? (utópico) Bioseguridad Profilaxis (Metafilaxis) Terapia Antibióticos
ANTIBIOTICOS. Futuro de su utilización en la producción industrial Miguel Ángel HIGUERA Director ANPROGAPOR Enfermedad Libre de enfermedad? (utópico) Bioseguridad Profilaxis (Metafilaxis) Terapia Antibióticos
Clones Transgénicos Ejemplo
 EQUIPO TRES Clones Transgénicos Ejemplo La clonación puede definirse como el proceso por el que se consiguen copias idénticas de un organismo ya desarrollado, de forma asexual. Estas dos características
EQUIPO TRES Clones Transgénicos Ejemplo La clonación puede definirse como el proceso por el que se consiguen copias idénticas de un organismo ya desarrollado, de forma asexual. Estas dos características
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)_Agosto_2016
 KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
MEDICAMENTOS GENERICOS, SUPERGENERICOS Y BIOSIMILARES
 ESAME MBA Pharma Biotech MEDICAMENTOS GENERICOS, SUPERGENERICOS Y BIOSIMILARES José Javier Muruzábal Tipos de fármacos: Tendencias Biológicos / Biosimilares Nuevas formas farmacéuticas: vectorización Genéricos
ESAME MBA Pharma Biotech MEDICAMENTOS GENERICOS, SUPERGENERICOS Y BIOSIMILARES José Javier Muruzábal Tipos de fármacos: Tendencias Biológicos / Biosimilares Nuevas formas farmacéuticas: vectorización Genéricos
Qué es el viagra? Cómo funciona el viagra?
 Descubierto por accidente el citrato de Sildenafil (viagra) usado primeramente como tratamiento contra la angina de pecho también se usa como tratamiento eficaz contra la impotencia sexual. Pero qué es
Descubierto por accidente el citrato de Sildenafil (viagra) usado primeramente como tratamiento contra la angina de pecho también se usa como tratamiento eficaz contra la impotencia sexual. Pero qué es
Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo Propuesta de Acción Estratégica para la Convocatoria 2017
 Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo Propuesta de Acción Estratégica para la Convocatoria 2017 Área de Salud: Investigación en diabetes, sobrepeso y obesidad en Iberoamérica:
Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo Propuesta de Acción Estratégica para la Convocatoria 2017 Área de Salud: Investigación en diabetes, sobrepeso y obesidad en Iberoamérica:
PÍLDORA DEL DÍA DESPUÉS
 Programa Nacional de Salud Sexual y Procreación Responsable PÍLDORA DEL DÍA DESPUÉS Anticoncepción Hormonal de Emergencia AHE Guía de Usuarias MÉTODOS ANTICONCEPTIVOS La salud sexual y reproductiva es
Programa Nacional de Salud Sexual y Procreación Responsable PÍLDORA DEL DÍA DESPUÉS Anticoncepción Hormonal de Emergencia AHE Guía de Usuarias MÉTODOS ANTICONCEPTIVOS La salud sexual y reproductiva es
PRINCIPIOS PARA EL ACCESO A LA ATENCIÓN MÉDICA DE BROOKE DIAGNOSTICADA EN 2009 ALTA CALIDAD EN LA EM
 PRINCIPIOS PARA EL ACCESO A LA ATENCIÓN MÉDICA DE BROOKE DIAGNOSTICADA EN 2009 ALTA CALIDAD EN LA EM JOE DIAGNOSTICADO EN 2010 Acceso a la atención médica asequible y de alta calidad es esencial para que
PRINCIPIOS PARA EL ACCESO A LA ATENCIÓN MÉDICA DE BROOKE DIAGNOSTICADA EN 2009 ALTA CALIDAD EN LA EM JOE DIAGNOSTICADO EN 2010 Acceso a la atención médica asequible y de alta calidad es esencial para que
CUIDADOS DE ENFERMERIA EN LA ADMINISTRACIÓN DE MEDICAMENTOS LIC. ELIZABETH VALERIO SOLARI CLINICA MAISON DE SANTE ESTE
 CUIDADOS DE ENFERMERIA EN LA ADMINISTRACIÓN DE MEDICAMENTOS LIC. ELIZABETH VALERIO SOLARI CLINICA MAISON DE SANTE ESTE Introducción La administración de medicamento es uno de los procedimientos que exige
CUIDADOS DE ENFERMERIA EN LA ADMINISTRACIÓN DE MEDICAMENTOS LIC. ELIZABETH VALERIO SOLARI CLINICA MAISON DE SANTE ESTE Introducción La administración de medicamento es uno de los procedimientos que exige
La adicción a la nicotina
 La adicción a la nicotina Haciendo una diferencia hoy La nicotina, una de las drogas adictivas más usadas en los Estados Unidos, trae consigo a altos costos para los que son adictos a ella, para aquellos
La adicción a la nicotina Haciendo una diferencia hoy La nicotina, una de las drogas adictivas más usadas en los Estados Unidos, trae consigo a altos costos para los que son adictos a ella, para aquellos
SUBDIRECCIÓN DE REGISTRO SANITARIO GRUPO DE MEDICAMENTOS IN IMA
 SUBDIRECCIÓN DE GRUPO DE MEDICAMENTOS IN IMA Bogotá, Junio 2008 DECRETO 677 DE 1995 ARTICULO 27 COMISION REVISORA De la evaluación farmacológica Comprende el procedimiento mediante el cual la autoridad
SUBDIRECCIÓN DE GRUPO DE MEDICAMENTOS IN IMA Bogotá, Junio 2008 DECRETO 677 DE 1995 ARTICULO 27 COMISION REVISORA De la evaluación farmacológica Comprende el procedimiento mediante el cual la autoridad
11/30/2010. IV Congreso de Farmacovigilancia Asociación Mexicana de Farmacovigilancia, A.C. Noviembre 2010.
 FARMACOVIGILANCIA EN GUATEMALA. Dr. Helbert Saenz Castillo. Coordinador del Programa Nacional de Farmacovigilancia. Departamento de Regulación y Control de Productos Farmacéuticos y Afines. Ministerio
FARMACOVIGILANCIA EN GUATEMALA. Dr. Helbert Saenz Castillo. Coordinador del Programa Nacional de Farmacovigilancia. Departamento de Regulación y Control de Productos Farmacéuticos y Afines. Ministerio
Evaluación de campañas antitabaco en los medios masivos de comunicación: Marc Boulay, PhD
 Objetivos de aprendizaje Comprender los objetivos de la evaluación de la campaña en los medios masivos de comunicación Comprender el proceso para desarrollar la evaluación de la campaña antitabaco en los
Objetivos de aprendizaje Comprender los objetivos de la evaluación de la campaña en los medios masivos de comunicación Comprender el proceso para desarrollar la evaluación de la campaña antitabaco en los
CAPITULO III Metodología
 CAPITULO III Metodología 3.1 Investigación de mercados Al desarrollar el presente Plan de Negocios para llevar a cabo el establecimiento del DAY SPA en la Cd. de Veracruz, es necesario realizar una investigación
CAPITULO III Metodología 3.1 Investigación de mercados Al desarrollar el presente Plan de Negocios para llevar a cabo el establecimiento del DAY SPA en la Cd. de Veracruz, es necesario realizar una investigación
1. Quién encomienda a los poderes Públicos, velar por la seguridad e higiene en el trabajo?
 Tema 1 (medidas generales) Las respuestas correctas se encuentran marcadas al final 1. Quién encomienda a los poderes Públicos, velar por la seguridad e higiene en el trabajo? a) La Constitución Española
Tema 1 (medidas generales) Las respuestas correctas se encuentran marcadas al final 1. Quién encomienda a los poderes Públicos, velar por la seguridad e higiene en el trabajo? a) La Constitución Española
TASIGNA (NILOTINIB) INFORMACIÓN DE SEGURIDAD PARA EL PACIENTE
 TASIGNA (NILOTINIB) INFORMACIÓN DE SEGURIDAD PARA EL PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), julio 2015 Índice
TASIGNA (NILOTINIB) INFORMACIÓN DE SEGURIDAD PARA EL PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), julio 2015 Índice
Ing. José Luis Alfonso Barreto & Jorge Luis Blanco Ramos
 Ing. José Luis Alfonso Barreto & Jorge Luis Blanco Ramos Constitución Política de la República del Ecuador. Ley de Defensa contra incendios (Publicada en Registro Oficial No.81 del 19 de Abril 2009). Reglamento
Ing. José Luis Alfonso Barreto & Jorge Luis Blanco Ramos Constitución Política de la República del Ecuador. Ley de Defensa contra incendios (Publicada en Registro Oficial No.81 del 19 de Abril 2009). Reglamento
Cómo puedo aumentar la confianza en un organismo de inspección? Necesitan certificación según ISO 9001 o acreditación según ISO/IEC 17020?
 un organismo de inspección? Necesitan certificación según ISO 9001 o Qué debería buscar cuando necesito realizar una inspección? 3 Cómo puedo aumentar la confianza en una entidad de inspección? 4 Cómo
un organismo de inspección? Necesitan certificación según ISO 9001 o Qué debería buscar cuando necesito realizar una inspección? 3 Cómo puedo aumentar la confianza en una entidad de inspección? 4 Cómo
ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN
 Universidad Ricardo Palma Facultad de Medicina Humana ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN Esquema de presentación para la elaboración del proyecto de trabajo de los Residentes del Segundo Año.
Universidad Ricardo Palma Facultad de Medicina Humana ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN Esquema de presentación para la elaboración del proyecto de trabajo de los Residentes del Segundo Año.
Presupuestos públicos: Cómo los gobiernos deberían invertir el dinero a favor de los derechos de niñas y niños
 Observación General No. 19 Organización de las Naciones Unidas PUESTO DE SALUD BIBLIOTECA Heal POLICIA SERVICIO DE PROTECCIÓN CORTE DE JUSTICIA ESCUELA HOSPITAL Presupuestos públicos: Cómo los gobiernos
Observación General No. 19 Organización de las Naciones Unidas PUESTO DE SALUD BIBLIOTECA Heal POLICIA SERVICIO DE PROTECCIÓN CORTE DE JUSTICIA ESCUELA HOSPITAL Presupuestos públicos: Cómo los gobiernos
Autoevaluación del liderazgo en materia de SST
 Autoevaluación del liderazgo en materia de SST Extraído de la Guía Práctica sobre Liderazgo en la gestión de la prevención en materia de seguridad y salud en el trabajo Al igual que no se construye una
Autoevaluación del liderazgo en materia de SST Extraído de la Guía Práctica sobre Liderazgo en la gestión de la prevención en materia de seguridad y salud en el trabajo Al igual que no se construye una
Programa de las Naciones Unidas para El Medio Ambiente
 NACIONES UNIDAS Programa de las Naciones Unidas para El Medio Ambiente Distr. LIMITADA EP UNEP(DEPI)/CAR WG.31/INF.6 27 de junio de 2008 Original: INGLÉS Cuarta Reunión del Comité Asesor Científico y Técnico
NACIONES UNIDAS Programa de las Naciones Unidas para El Medio Ambiente Distr. LIMITADA EP UNEP(DEPI)/CAR WG.31/INF.6 27 de junio de 2008 Original: INGLÉS Cuarta Reunión del Comité Asesor Científico y Técnico
Medicamentos Biotecnológicos: Requisitos Exigidos para el Desarrollo y Aprobación de Biosimilares
 Información Tecnológica Vol. Medicamentos 21(6), 125-132 Biotecnológicos: (2010) Requisitos Exigidos para el Desarrollo y Aprobación doi:10.1612/inf.tecnol.4399it.09 Medicamentos Biotecnológicos: Requisitos
Información Tecnológica Vol. Medicamentos 21(6), 125-132 Biotecnológicos: (2010) Requisitos Exigidos para el Desarrollo y Aprobación doi:10.1612/inf.tecnol.4399it.09 Medicamentos Biotecnológicos: Requisitos
Respuestas sobre la investigación de las vacunas contra el VIH
 Hispanos/Latinos Respuestas sobre la investigación de las vacunas contra el VIH bethegeneration.nih.gov Qué es una vacuna? Una vacuna es una sustancia que ayuda al cuerpo a defenderse de infecciones como
Hispanos/Latinos Respuestas sobre la investigación de las vacunas contra el VIH bethegeneration.nih.gov Qué es una vacuna? Una vacuna es una sustancia que ayuda al cuerpo a defenderse de infecciones como
RECONOCIMIENTO DE LAS BUENAS PRÁCTICAS GRUPO DE TRABAJO: PROTECCIÓN Y CALIDAD DEL SERVICIO AL USUARIO
 RECONOCIMIENTO DE LAS BUENAS PRÁCTICAS 2016 - GRUPO DE TRABAJO: PROTECCIÓN Y CALIDAD DEL SERVICIO AL USUARIO Bases Foro Latinoamericano de Entes Reguladores de Telecomunicaciones - REGULATEL I. Presentación
RECONOCIMIENTO DE LAS BUENAS PRÁCTICAS 2016 - GRUPO DE TRABAJO: PROTECCIÓN Y CALIDAD DEL SERVICIO AL USUARIO Bases Foro Latinoamericano de Entes Reguladores de Telecomunicaciones - REGULATEL I. Presentación
Guía del bronceado responsable
 CONSEJOS PARA LOS USUARIOS Guía del bronceado responsable Regulación de los centros de bronceado artificial SI TE BRONCEAS, HAZLO CON GARANTÍAS Establecimiento: SI TE BRONCEAS, HAZLO CON GARANTÍAS INTRODUCCIÓN
CONSEJOS PARA LOS USUARIOS Guía del bronceado responsable Regulación de los centros de bronceado artificial SI TE BRONCEAS, HAZLO CON GARANTÍAS Establecimiento: SI TE BRONCEAS, HAZLO CON GARANTÍAS INTRODUCCIÓN
MODULO 8. INVESTIGACION EN EL ICTUS
 MODULO 8. INVESTIGACION EN EL ICTUS Dr. Jose Mª Ramírez Moreno Unidad de Ictus. Hospital Universitario Infanta Cristina. Badajoz INDICE: 1. Significado y participación en estudios de investigación en el
MODULO 8. INVESTIGACION EN EL ICTUS Dr. Jose Mª Ramírez Moreno Unidad de Ictus. Hospital Universitario Infanta Cristina. Badajoz INDICE: 1. Significado y participación en estudios de investigación en el
SISTEMA LOGISTICO DE INSUMOS MEDICOS. Dr. Javier Zamora Carrión Dpto. de Salud Publica
 SISTEMA LOGISTICO DE INSUMOS MEDICOS Dr. Javier Zamora Carrión Dpto. de Salud Publica Competencias Aplica los 6 correctos de la logística para contribuir la disponibilidad. Caracteriza las principales
SISTEMA LOGISTICO DE INSUMOS MEDICOS Dr. Javier Zamora Carrión Dpto. de Salud Publica Competencias Aplica los 6 correctos de la logística para contribuir la disponibilidad. Caracteriza las principales
POR QUÉ INCLUIR AL FARMACÉUTICO EN EL EQUIPO DE SALUD? V CONGRESO NACIONAL DE FARMACOVIGILANCIA
 POR QUÉ INCLUIR AL FARMACÉUTICO EN EL EQUIPO DE SALUD? V CONGRESO NACIONAL DE FARMACOVIGILANCIA SITUACIÓN ACTUAL Incremento en el número de medicamentos,así como en el volumen y la complejidad de la literatura
POR QUÉ INCLUIR AL FARMACÉUTICO EN EL EQUIPO DE SALUD? V CONGRESO NACIONAL DE FARMACOVIGILANCIA SITUACIÓN ACTUAL Incremento en el número de medicamentos,así como en el volumen y la complejidad de la literatura
DIÁLISIS EXTRACORPÓREA (HEMODIÁLISIS)
 Hoja: 1 de 8 (HEMODIÁLISIS) Elaboró: Revisó: Autorizó: Puesto Encargada de Admisión, Choque y Agudos Subdirector de Quemados Director Quirurgico Firma Hoja: 2 de 8 1. Propósito Identificar e iniciar tratamiento
Hoja: 1 de 8 (HEMODIÁLISIS) Elaboró: Revisó: Autorizó: Puesto Encargada de Admisión, Choque y Agudos Subdirector de Quemados Director Quirurgico Firma Hoja: 2 de 8 1. Propósito Identificar e iniciar tratamiento
LA NUEVA BIOTECNOLOGÍA
 LA NUEVA BIOTECNOLOGÍA Ingeniería genética: técnicas que permiten manipular la información genética de un ser vivo. TECNOLOGÍA TRADICIONAL DEL ADN RECOMBINANTE CLONACIÓN DE GENES: Obtención de muchas copias
LA NUEVA BIOTECNOLOGÍA Ingeniería genética: técnicas que permiten manipular la información genética de un ser vivo. TECNOLOGÍA TRADICIONAL DEL ADN RECOMBINANTE CLONACIÓN DE GENES: Obtención de muchas copias
Anexo I. Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
CAPITULO 1: GENERALIDADES SOBRE LOS ESTADOS FINANCIEROS.
 CAPITULO 1: GENERALIDADES SOBRE LOS ESTADOS FINANCIEROS. TEMA 1: ESTADOS FINANCIEROS CONTENIDO: Objetivos, clasificación. Estados financieros básicos y secundarios; normales y especiales, estáticos y dinámicos,
CAPITULO 1: GENERALIDADES SOBRE LOS ESTADOS FINANCIEROS. TEMA 1: ESTADOS FINANCIEROS CONTENIDO: Objetivos, clasificación. Estados financieros básicos y secundarios; normales y especiales, estáticos y dinámicos,
Aproximación a la Gestión del Riesgo de Desastres
 AGENCIA DE LOS ESTADOS UNIDOS PARA EL DESARROLLO INTERNACIONAL OFICINA DE ASISTENCIA PARA DESASTRES EN EL EXTRANJERO USAID/OFDA USAID/OFDA Aproximación a la Gestión del Riesgo de Desastres Msc. Sergio
AGENCIA DE LOS ESTADOS UNIDOS PARA EL DESARROLLO INTERNACIONAL OFICINA DE ASISTENCIA PARA DESASTRES EN EL EXTRANJERO USAID/OFDA USAID/OFDA Aproximación a la Gestión del Riesgo de Desastres Msc. Sergio
Fármaco y Aditivos. Dictaminadores Especializados DIRECCIÓN EJECUTIVA DE AUTORIZACIÓN DE PRODUCTOS Y ESTABLECIMIENTOS
 Fármaco y Aditivos Silvia Reyes Chalico Dictaminadores Especializados Jaime O. Juárez Solís DIRECCIÓN EJECUTIVA DE AUTORIZACIÓN DE PRODUCTOS Y ESTABLECIMIENTOS 1 Toda substancia natural, sintética o biotecnológica
Fármaco y Aditivos Silvia Reyes Chalico Dictaminadores Especializados Jaime O. Juárez Solís DIRECCIÓN EJECUTIVA DE AUTORIZACIÓN DE PRODUCTOS Y ESTABLECIMIENTOS 1 Toda substancia natural, sintética o biotecnológica
VISIÓN DE LA AUTORIDAD: PROTECCIÓN PARA BIOTECNOLÓGICOS. Nahanny Canal Reyes. Directora Divisional de Patentes. 23 de Febrero de 2015
 VISIÓN DE LA AUTORIDAD: PROTECCIÓN PARA BIOTECNOLÓGICOS Nahanny Canal Reyes Directora Divisional de Patentes 23 de Febrero de 2015 QUÉ NO PUEDE SER PATENTADO EN MÉXICO? Las invenciones contrarias al orden
VISIÓN DE LA AUTORIDAD: PROTECCIÓN PARA BIOTECNOLÓGICOS Nahanny Canal Reyes Directora Divisional de Patentes 23 de Febrero de 2015 QUÉ NO PUEDE SER PATENTADO EN MÉXICO? Las invenciones contrarias al orden
La severidad de la hemofilia depende del nivel plasmático del FVIII (hemofilia A) / FIX (hemofilia B): <1% de factor Entre el 1% al 5% >5% de factor
 La hemofilia es un desorden hemorrágico hereditario y congénito, originado por mutaciones en el cromosoma X y que se caracteriza por la disminución o ausencia de actividad funcional de los factores de
La hemofilia es un desorden hemorrágico hereditario y congénito, originado por mutaciones en el cromosoma X y que se caracteriza por la disminución o ausencia de actividad funcional de los factores de
Facultad de Ciencias Naturales e Ingenierías Tecnología en Desarrollo de Sistemas Informáticos Selección y Evaluación de Tecnologías ITIL
 Página 1 de 6 ITIL (Information Technology Infrastructure Library): Biblioteca de Infraestructura de Tecnologías de la Información. Fue creada a finales de la década de los 80 s por Central Computer and
Página 1 de 6 ITIL (Information Technology Infrastructure Library): Biblioteca de Infraestructura de Tecnologías de la Información. Fue creada a finales de la década de los 80 s por Central Computer and
REGLAMENTO DE DISTRIBUCIÓN Y COMERCIALIZACIÓN
 REGLAMENTO DE DISTRIBUCIÓN Y COMERCIALIZACIÓN ANEXO IV Anexo B: CONTENIDO INDICATIVO DEL PLAN DE EMERGENCIAS DE LAS EMPRESAS DE DISTRIBUCION DE ENERGÍA ELECTRICA NOVIEMBRE DE 2009 Anexo al Título VII Página
REGLAMENTO DE DISTRIBUCIÓN Y COMERCIALIZACIÓN ANEXO IV Anexo B: CONTENIDO INDICATIVO DEL PLAN DE EMERGENCIAS DE LAS EMPRESAS DE DISTRIBUCION DE ENERGÍA ELECTRICA NOVIEMBRE DE 2009 Anexo al Título VII Página
Guía para el educador sobre la malaria. (Información sobre herramientas) FINANCIADO POR AUTORES
 Guía para el educador sobre la malaria (Información sobre s) AUTORES FINANCIADO POR Índice Índice... 2 I. Introducción... 3 II. Las s... 3 1. Juego en vídeo: Ponle freno a la malaria... 4 2. Vídeo 1 Trabajar
Guía para el educador sobre la malaria (Información sobre s) AUTORES FINANCIADO POR Índice Índice... 2 I. Introducción... 3 II. Las s... 3 1. Juego en vídeo: Ponle freno a la malaria... 4 2. Vídeo 1 Trabajar
GESTIÓN DE PRODUCTOS Y ESTRATEGIA DE PRECIOS
 APARTADO : 5 DIAPOSITIVA Nº: 1 El significado del precio para los consumidores TRUCO Nº 1: Reglas para la fijación de precios Reglas para la fijación de precios CONOCER LOS COSTOS Si bien ya dijimos que
APARTADO : 5 DIAPOSITIVA Nº: 1 El significado del precio para los consumidores TRUCO Nº 1: Reglas para la fijación de precios Reglas para la fijación de precios CONOCER LOS COSTOS Si bien ya dijimos que
FORMULARIO PARA EL REGISTRO DE INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR MÉTODOS BIOTECNOLÓGICOS
 FORMULARIO PARA EL REGISTRO DE INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR MÉTODOS BIOTECNOLÓGICOS FORMULARIO DE INSCRIPCIÓN PARA INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR VIA BIOTECNOLÓGICA. FECHA: 1.- NOMBRE
FORMULARIO PARA EL REGISTRO DE INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR MÉTODOS BIOTECNOLÓGICOS FORMULARIO DE INSCRIPCIÓN PARA INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR VIA BIOTECNOLÓGICA. FECHA: 1.- NOMBRE
Lista de verificación de gestión fiscal para asociaciones
 Lista de verificación de gestión fiscal para asociaciones La lista de verificación identifica cuestiones clave que n de abordarse sobre los aspectos fiscales de los proyectos en cuidado y educación del
Lista de verificación de gestión fiscal para asociaciones La lista de verificación identifica cuestiones clave que n de abordarse sobre los aspectos fiscales de los proyectos en cuidado y educación del
FUNCIONES BÁSICAS DE LA GERENCIA DE PROYECTOS
 FUNCIONES BÁSICAS DE LA GERENCIA DE PROYECTOS CONTENIDO FUNCIONES BÁSICAS DE LA GERENCIA DE PROYECTOS Integración Alcance Tiempo Costo Calidad Recursos humanos Comunicaciones Manejo de riesgos Procura
FUNCIONES BÁSICAS DE LA GERENCIA DE PROYECTOS CONTENIDO FUNCIONES BÁSICAS DE LA GERENCIA DE PROYECTOS Integración Alcance Tiempo Costo Calidad Recursos humanos Comunicaciones Manejo de riesgos Procura
CIE-10. Clasificación Estadística Internacional de Enfermedades y Problemas Relacionados con la Salud. Décima Revisión
 CIE-10 Clasificación Estadística Internacional de Enfermedades y Problemas Relacionados con la Salud Décima Revisión Volumen 2 Manual de instrucciones Publicación Científica No. 554 ORGANIZACIÓN PANAMERICANA
CIE-10 Clasificación Estadística Internacional de Enfermedades y Problemas Relacionados con la Salud Décima Revisión Volumen 2 Manual de instrucciones Publicación Científica No. 554 ORGANIZACIÓN PANAMERICANA
Resumen Ejecutivo. Generar ahorros a través de mejores prácticas ambientales
 Resumen Ejecutivo Contenido Introducción... 2 ISO 14001 versión 2015... 2 Esquema de la nueva versión... 3 Índice de la versión 2015... 4 Matriz de correlación 2004 vs. 2015... 5 Cambios estructurales...
Resumen Ejecutivo Contenido Introducción... 2 ISO 14001 versión 2015... 2 Esquema de la nueva versión... 3 Índice de la versión 2015... 4 Matriz de correlación 2004 vs. 2015... 5 Cambios estructurales...
NTE INEN-ISO Primera edición
 Quito Ecuador NORMA TÉCNICA ECUATORIANA NTE INEN-ISO 50002 Primera edición AUDITORÍAS ENERGÉTICAS - REQUISITOS CON GUÍA PARA SU USO (ISO 50002:2014, IDT) ENERGY AUDITS REQUIREMENTS WITH GUIDANCE FOR USE
Quito Ecuador NORMA TÉCNICA ECUATORIANA NTE INEN-ISO 50002 Primera edición AUDITORÍAS ENERGÉTICAS - REQUISITOS CON GUÍA PARA SU USO (ISO 50002:2014, IDT) ENERGY AUDITS REQUIREMENTS WITH GUIDANCE FOR USE
Expositor Q.F. Alfredo A. Castillo Calle
 Expositor Q.F. Alfredo A. Castillo Calle Elaborado por: Q.F. Vicky Flores Valenzuela Mayo 2010 ANTECEDENTES La Ley General de Salud Ley Nº 26842 se aprobó en 1997, Título II incluye: Capítulo III referido
Expositor Q.F. Alfredo A. Castillo Calle Elaborado por: Q.F. Vicky Flores Valenzuela Mayo 2010 ANTECEDENTES La Ley General de Salud Ley Nº 26842 se aprobó en 1997, Título II incluye: Capítulo III referido
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
 INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1. NOMBRE DEL MEDICAMENTO Disolgas 257,5 mg cápsulas blandas 2. PRINCIPIO(S) ACTIVO(S) 3. LISTA DE EXCIPIENTES Amarillo anaranjado S (E 110), azorrubina
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1. NOMBRE DEL MEDICAMENTO Disolgas 257,5 mg cápsulas blandas 2. PRINCIPIO(S) ACTIVO(S) 3. LISTA DE EXCIPIENTES Amarillo anaranjado S (E 110), azorrubina
PROGRAMA SALUD RENAL UNA GUÍA PARA LOS PACIENTES Y SUS FAMILIAS. Síntomas Insuficiencia Renal // Una Guía para los pacientes y sus familias 1
 PROGRAMA SALUD RENAL UNA GUÍA PARA LOS PACIENTES Y SUS FAMILIAS Síntomas Insuficiencia Renal // Una Guía para los pacientes y sus familias 1 ACERCA DE LA ENFERMEDAD RENAL CRÓNICA Qué son los riñones y
PROGRAMA SALUD RENAL UNA GUÍA PARA LOS PACIENTES Y SUS FAMILIAS Síntomas Insuficiencia Renal // Una Guía para los pacientes y sus familias 1 ACERCA DE LA ENFERMEDAD RENAL CRÓNICA Qué son los riñones y
International Laboratory Accreditation Cooperation. Por qué utilizar una entidad de inspección acreditada? global trust Testing Calibration Inspection
 International Laboratory Accreditation Cooperation Por qué utilizar una entidad de inspección acreditada? Por qué una entidad de inspección acreditada? Existen numerosas empresas que prestan servicios
International Laboratory Accreditation Cooperation Por qué utilizar una entidad de inspección acreditada? Por qué una entidad de inspección acreditada? Existen numerosas empresas que prestan servicios
GENÉTICAMENTE MODIFICADOS
 INTRODUCCIÓN A LOS ORGANISMOS GENÉTICAMENTE MODIFICADOS (OGM) Taller sobre los criterios de evaluación de riesgo ambiental de cultivos genéticamente modificados y su contexto en el Protocolo de Cartagena
INTRODUCCIÓN A LOS ORGANISMOS GENÉTICAMENTE MODIFICADOS (OGM) Taller sobre los criterios de evaluación de riesgo ambiental de cultivos genéticamente modificados y su contexto en el Protocolo de Cartagena
Mejorando la Calidad de Atención
 COMITÉ DE MEJORAMIENTO DE LA CALIDAD DE LA SALUD MENTAL DEL CONDADO DE MENDOCINO Mejorando la Calidad de Atención Evaluar Comunicarse Identifica Planea Aplicar Mejorar Los consumidores son bienvenidos
COMITÉ DE MEJORAMIENTO DE LA CALIDAD DE LA SALUD MENTAL DEL CONDADO DE MENDOCINO Mejorando la Calidad de Atención Evaluar Comunicarse Identifica Planea Aplicar Mejorar Los consumidores son bienvenidos
PLAN ESTRATÉGICO DE RESPONSABILIDAD SOCIAL CORPORATIVA BMC TRAVEL 2015
 PLAN ESTRATÉGICO DE RESPONSABILIDAD SOCIAL CORPORATIVA BMC TRAVEL 2015 1.1 Metodología La empresa BMC Travel ha ido incorporando aspectos ambientales y de Responsabilidad Social a través de varias acciones
PLAN ESTRATÉGICO DE RESPONSABILIDAD SOCIAL CORPORATIVA BMC TRAVEL 2015 1.1 Metodología La empresa BMC Travel ha ido incorporando aspectos ambientales y de Responsabilidad Social a través de varias acciones
Preguntas de Selectividad sobre inmunología.
 Preguntas de Selectividad sobre inmunología. 1. Existen virus que producen en los humanos enfermedades mortales por inmunodeficiencia. Sin embargo, la muerte del individuo no es provocada directamente
Preguntas de Selectividad sobre inmunología. 1. Existen virus que producen en los humanos enfermedades mortales por inmunodeficiencia. Sin embargo, la muerte del individuo no es provocada directamente
Manual de uso óptimo de la sangre: análisis del contenido
 Manual de uso óptimo de la sangre: análisis del contenido Dr. Miguel Lozano Molero Servicio de Hemoterapia y Hemostasia Hospital Clínico Universitario Barcelona Organizaciones Europeas Consejo de Europa
Manual de uso óptimo de la sangre: análisis del contenido Dr. Miguel Lozano Molero Servicio de Hemoterapia y Hemostasia Hospital Clínico Universitario Barcelona Organizaciones Europeas Consejo de Europa
PBS 8 Gestión de Riesgos y Controles Internos
 PBS 8 Gestión de Riesgos y Controles Internos Seminario de Capacitación en Seguros ASSAL - IAIS San José, Costa Rica 29 de Noviembre de 2016 M. Fernanda Plaza Superintendencia de Valores y Seguros - Chile
PBS 8 Gestión de Riesgos y Controles Internos Seminario de Capacitación en Seguros ASSAL - IAIS San José, Costa Rica 29 de Noviembre de 2016 M. Fernanda Plaza Superintendencia de Valores y Seguros - Chile
PROYECTO DE INVESTIGACIÓN
 FACULTAD DE MEDICINA CLINICA ALEMANA UNIVERSIDAD DEL DESARROLLO CENTRO DE BIOÉTICA COMITÉ DE ÉTICA DE LA INVESTIGACIÓN Recepción: / / Código: (Uso Interno) PROYECTO DE INVESTIGACIÓN Título de Proyecto:.
FACULTAD DE MEDICINA CLINICA ALEMANA UNIVERSIDAD DEL DESARROLLO CENTRO DE BIOÉTICA COMITÉ DE ÉTICA DE LA INVESTIGACIÓN Recepción: / / Código: (Uso Interno) PROYECTO DE INVESTIGACIÓN Título de Proyecto:.
Título I Escolar-Póliza De Participación De Los Padres Escuela de Golden Valley
 Título I Escolar-Póliza De Participación De Los Padres Escuela de Golden Valley Golden Valley ha desarrolló un escrito Título I póliza de participación de los padres con la contribución de los padres de
Título I Escolar-Póliza De Participación De Los Padres Escuela de Golden Valley Golden Valley ha desarrolló un escrito Título I póliza de participación de los padres con la contribución de los padres de
La Empresa. PSST Control Operacional de la SST Norma OHSAS 18001:2007
 5.3.7 PSST 4.4.6 01 Control Operacional de la SST La Empresa PSST 4.4.6 01 Control Operacional de la SST Norma OHSAS 18001:2007 REGISTRO DE REVISIONES DE ESTE PROCEDIMIENTO Fecha Revisión Descripción de
5.3.7 PSST 4.4.6 01 Control Operacional de la SST La Empresa PSST 4.4.6 01 Control Operacional de la SST Norma OHSAS 18001:2007 REGISTRO DE REVISIONES DE ESTE PROCEDIMIENTO Fecha Revisión Descripción de
CUESTIONARIO DE AUTO-EVALUACIÓN DEL CEI (Lista de verificación)
 CUESTIONARIO DE AUTO-EVALUACIÓN DEL CEI (Lista de verificación) Este cuestionario resulta de utilidad para verificar que los procedimientos operativos de un CEI se ajusten a la Ley 3301/2009 del GCBA 1.
CUESTIONARIO DE AUTO-EVALUACIÓN DEL CEI (Lista de verificación) Este cuestionario resulta de utilidad para verificar que los procedimientos operativos de un CEI se ajusten a la Ley 3301/2009 del GCBA 1.
PODER PARA CUIDADOS DE SALUD DE MASSACHUSETTS
 450 Brookline Ave. Boston, MA 02215 www.dana-farber.org PODER PARA CUIDADOS DE SALUD DE MASSACHUSETTS Cómo expresar sus deseos sobre su cuidado y tratamiento Decisiones para cuidados de salud: planificación
450 Brookline Ave. Boston, MA 02215 www.dana-farber.org PODER PARA CUIDADOS DE SALUD DE MASSACHUSETTS Cómo expresar sus deseos sobre su cuidado y tratamiento Decisiones para cuidados de salud: planificación
PRINCIPIOS GENERALES PARA LA ADICION DE NUTRIENTES ESENCIALES A LOS ALIMENTOS CAC/GL Adoptado en Enmiendas: 1989 y Revisión: 2015.
 PRINCIPIOS GENERALES PARA LA ADICION DE NUTRIENTES ESENCIALES A LOS ALIMENTOS CAC/GL 9-1987 Adoptado en 1987. Enmiendas: 1989 y 1991. Revisión: 2015. CAC/GL 9-1987 2 INTRODUCCIÓN Los Principios para la
PRINCIPIOS GENERALES PARA LA ADICION DE NUTRIENTES ESENCIALES A LOS ALIMENTOS CAC/GL 9-1987 Adoptado en 1987. Enmiendas: 1989 y 1991. Revisión: 2015. CAC/GL 9-1987 2 INTRODUCCIÓN Los Principios para la
1. Denominación: 2. Justificación
 BORRADOR DE ORDEN MINISTERIAL POR LA QUE SE ESTABLECEN LOS REQUISITOS PARA LA VERIFICACIÓN DE LOS TÍTULOS QUE HABILITEN PARA EL EJERCICIO DE LA PROFESIÓN DE FARMACÉUTICO. Para la verificación positiva
BORRADOR DE ORDEN MINISTERIAL POR LA QUE SE ESTABLECEN LOS REQUISITOS PARA LA VERIFICACIÓN DE LOS TÍTULOS QUE HABILITEN PARA EL EJERCICIO DE LA PROFESIÓN DE FARMACÉUTICO. Para la verificación positiva
Biotecnología y su aplicación a las ciencias agropecuarias. Oris Sanjur Instituto Smithsonian de Investigaciones Tropicales
 Biotecnología y su aplicación a las ciencias agropecuarias Oris Sanjur Instituto Smithsonian de Investigaciones Tropicales Niveles de organización en seres vivos Organismo Organo Tejido Celula La Célula:
Biotecnología y su aplicación a las ciencias agropecuarias Oris Sanjur Instituto Smithsonian de Investigaciones Tropicales Niveles de organización en seres vivos Organismo Organo Tejido Celula La Célula:
EVALUACIÓN DE RIESGOS
 EVALUACIÓN DE RIESGOS Introducción La, la primera de las fases del Análisis de Riesgos, se basa en hechos científicos para, de una forma sistemática, estimar la probabilidad de que ocurra un efecto adverso
EVALUACIÓN DE RIESGOS Introducción La, la primera de las fases del Análisis de Riesgos, se basa en hechos científicos para, de una forma sistemática, estimar la probabilidad de que ocurra un efecto adverso
