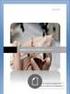
(A) (B) AgNO F. SSI 0.5 ml. NaCl. SSI 0.5 ml. Operaciones analíticas a realizar en el aula:
|
|
|
- Dolores Salas Parra
- hace 6 años
- Vistas:
Transcripción
1 QUÍMICA ANALÍTICA I (1504). Sem II. Experiencia de cátedra: Microtitulación potenciométrica de NaCl conag(i). Dr. Alejandro Baeza, QFB Adrian de Santiago Operaciones analíticas a realizar en el aula: (A): Titulación con monitoreo por indicador visual 1.0 Llenar una microbureta de 1 ml (1) con AgNO 3 0.1mol/L. 2.0 En un matraz de Erlen-Meyer de 5 ml verter 0.5 ml de NaCl 0.1mol/L o SSI. 3.0 Adicionar unos cristales de K 2 CrO Titular al vire del indicador. (B): Titulación con monitoreo por micropotenciometría (2). 1.0 Llenar una microbureta de 1 ml (1) con AgNO 3 0.1mol/L. 2.0 Colocar en una minicelda los microelectros de trabajo de Ag y de microreferencia de Cu H 2 O. 3.0 Verter 0.5 ml de NaCl 0.1mol/L y agua destilada hasta cubrir los electrodos. 4.0 Conectar los microelectrodos al voltímetro (el microelectrodo de referencia a la tierra ). 5.0 Medir el potencial después de adicionar alícuotas de 0.1mL hasta 1 ml total. (A) (B) AgNO F AgNO F K 2 CrO 4 NaCl SSI 0.5 ml SSI 0.5 ml _
2 DATOS ADICIONALES: AgCl pks = 9.5; Ag 2 CrO 4 pks = 12; log Co = -2 log [Ag + ] pag vire log [Cl - ] log [CrO 4 2- ] f log Co Δf = (f-1) error de indicador por exceso
3 Preguntas 1.0 Determinar la concentración exacta de la disolución de Ag(I) del experimento (A). 2.0 Calcular el parámetro adimensional pe =(E/0.06V). 3.0 Efectuar la gráfica pe = f(volumen). 4.0 Efectuar las gráficas de primera,( pe/ v), y segunda derivada, [( pe/ v)/ v prom ], de acuerdo al ejemplo de la referencia (3). 5.0 Determinar la concentración exacta de la disolución de Ag(I) con el volumen de punto de equivalencia experimental determinado en el inciso (4). 6.0 Trazar la curva de titulación teórica por medio de un diagrama acoplado log[i]=pag=f(f) de una mezcla de NaCl, KCl y KBr Co = 0.1 mol/l c/u. 7.0 Encontrar la relación para calcular pag a partir de los valores de pe o E. Bibliografía (1) Alejandro Baeza Microbureta a Microescala Total para Titulometría Rev. Chil. Educ. Cient. 1[2](2003)4-7 (2) Alejandro Baeza, Adrián de Santiago, Eduardo Galicia. Titulaciones de halogenuros a Microescala Total con microsensores de Ag y de Microreferencia de bajo costo sin Puente Salino Rev. Chil. Educ. Cient. 3[1](2004)29-39 (3) Adrian de Santiago. AMYD. Q.A. I: Documento_ de_apoyo:_derivadas_datos_ph (4) Alejandro Baeza Química Analítica. Representación Gráfica de las Reacciones Químicas S. y G. Editores
4 LABORATORIO DE QUIMICA ANALITICA I 2009-II TP: Precipitación de haluros de plata. Monitoreo micropotenciométrico Documento de apoyo anexo: Procesamiento de datos. Dr. Alejandro Baeza, QFB Adrián de Santiago, Q. Arturo García Se ejemplifica con la precipitación de AgCl. La gráfica experimental obtenida así como su primera y segunda derivadas es la siguiente: (325µL,45.7mV) 1.0 Primero se calcula el pe a partir de los valores de potencial medido: pe = E medido mv 60 La gráfica obtenida es la siguiente:
5 2.0 Se localizan los datos de pe y de volumen para la mitad y para el doble del volumen a la equivalencia determinado de la primera gráfica: pe 1.5 pe 0.5 v eq v 0.5 v El par redox responsable del potencial y su ecuación de pe al 50% titulado son: Ag + Cl - == AgCl + 1e - Kd 1 = e pe = pkd 1 log Cl Al 50% titulado la concentración de cloruros es: Cl 0.5 = CoVo v 0.5(0.1M) Vo+v % la ecuación de pe es: Cl pe 0.5 = pkd 1 log CoVo v 0.5(0.1M) 4.0 El par redox responsable del potencial y su ecuación de pe al 150% titulado son: Ag == Ag + + 1e - Kd 2 = Ag + e pe = pkd 2 + log Ag + 1, por lo tanto al Al 150% titulado la concentración de Ag + en exceso es: Ag = v M CoVo Vo+v 1.5 tanto al 150% la ecuación de pe es: pe 1.5 = pkd 2 + log v M CoVo, por lo
6 5.0 Si se restan las ecuaciones de pe para el 150% y el 50% titulado se obtiene: pe 1.5 pe 0.5 = pkd 2 + log v M CoVo pkd 1 + log CoVo v 0.5(0.1M) pe 1.5 pe 0.5 = pkd 2 pkd 1 + log v M CoVo + log CoVo v 0.5(0.1M) 6.0 La relación entre pkd 2 y pkd 1 es la siguiente: AgCl + 1e - == Ag + Cl - (Kd 1 ) -1 Ag - == Ag + + 1e - Kd 2 AgCl == Ag + + Cl - Ks = Kd 2 Kd 1 pks = pkd 2 pkd 1, por lo tanto pkd 1 = pkd 2 - pks, al sustituir en la ecuación del inciso anterior: pe 1.5 pe 0.5 = pkd 2 pkd 2 pks + log v M CoVo + log CoVo v 0.5(0.1M) pe 1.5 pe 0.5 = pks + log v M CoVo + log CoVo v 0.5(0.1M) 7.0 De la expresión anterior se despeja el pks del AgCl y se sustituyen los datos experimentales de pe y v al 50 y 150 titulados: pks AgCl = pe 1.5 pe 0.5 log v M CoVo log CoVo v 0.5(0.1M) 8.0 De igual manera se calculan los valores de pks AgBr y pks AgI. 9.0 De la curva de titulación de la mezcla de haluros se identifican las especies responsables de cada zona característica de la curva. 10. Con los valores de pks determinados se elabora una escala de reactividad de los tres haluros en función de pag.
QUÍMICA ANALÍTICA I. Experiencia de cátedra: Formación de soluciones. Disolución y solubilidad de yodo. Dr. Alejandro Baeza. Sem 2010-II.
 QUÍMICA ANALÍTICA I. Experiencia de cátedra: Formación de soluciones. Disolución y solubilidad de yodo. Dr. Alejandro Baeza. Sem 2010-II. CON_ RESOLUCIÓN BREVE: Objetivo Demostrar que el yodo se disuelve
QUÍMICA ANALÍTICA I. Experiencia de cátedra: Formación de soluciones. Disolución y solubilidad de yodo. Dr. Alejandro Baeza. Sem 2010-II. CON_ RESOLUCIÓN BREVE: Objetivo Demostrar que el yodo se disuelve
Complejometría en medio amortiguado- Yodometría de Cu(0). Caracterización de complejos poco solubles. Haluros de plata.
 1 LABORATORIO DE QUÍMICA ANALÍTICA I GUÍA DE TRABAJO EXPERIMENTAL. Dr. Alejandro Baeza, pq Alejandro Marín Sem. 2014- II. Contenido: TP1 TP2 TP3 TP4 TP5 TP6 Reactividad ácido- base: Control de soluciones
1 LABORATORIO DE QUÍMICA ANALÍTICA I GUÍA DE TRABAJO EXPERIMENTAL. Dr. Alejandro Baeza, pq Alejandro Marín Sem. 2014- II. Contenido: TP1 TP2 TP3 TP4 TP5 TP6 Reactividad ácido- base: Control de soluciones
Resumen. Abstract. Introducción
 MICROPOTENCIOMETRIA ANALITICA: CAPTURA DE DATOS CON SMART-PHONES Y VIDEO APPS EMPLEANDO INSTRUMENTACIÓN CONSTRUIDA CON MATERIALES DE BAJO COSTO Y ADQUISICIÓN LOCAL. Francisco Javier Olvera-García, Arturo
MICROPOTENCIOMETRIA ANALITICA: CAPTURA DE DATOS CON SMART-PHONES Y VIDEO APPS EMPLEANDO INSTRUMENTACIÓN CONSTRUIDA CON MATERIALES DE BAJO COSTO Y ADQUISICIÓN LOCAL. Francisco Javier Olvera-García, Arturo
QUÍMICA ANALÍTICA I (1402) TRABAJOS PRÁCTICOS Y DIRIGIDOS
 2010-II Facultad de Química. UNAM 0 Dr. Alejandro Baeza Laboratorio 3E anexo. Tel. 56-22-37-50 baeza@servidor.unam.mx baezareyes@hotmail.com http://mx.geocities.com/electroquimika QUÍMICA ANALÍTICA I (1402)
2010-II Facultad de Química. UNAM 0 Dr. Alejandro Baeza Laboratorio 3E anexo. Tel. 56-22-37-50 baeza@servidor.unam.mx baezareyes@hotmail.com http://mx.geocities.com/electroquimika QUÍMICA ANALÍTICA I (1402)
FQ. UNAM. Alejandro Baeza Página 1
 QUÍMICA ANALÍTICA I Justificación y trazo de la curva teórica de titulación de una solución de ácido oxálico (F=0.1 mol L -1 ) con NaH (F=0.1 mol L -1 ). Ejercicio de Clase, 2008-II Arturo de Jesús García
QUÍMICA ANALÍTICA I Justificación y trazo de la curva teórica de titulación de una solución de ácido oxálico (F=0.1 mol L -1 ) con NaH (F=0.1 mol L -1 ). Ejercicio de Clase, 2008-II Arturo de Jesús García
QUÍMICA ANALÍTICA A MICROESCALA TOTAL Facultad de Química - U.N.A.M. Alejandro Baeza, Adrián de Santiago, Arturo García
 QUÍMICA ANALÍTICA A MICROESCALA TOTAL Facultad de Química - U.N.A.M. Alejandro Baeza, Adrián de Santiago, Arturo García Introducción 19 CONFERENCIA DE QUIMICA Santiago de Cuba, Teatro Heredia Taller
QUÍMICA ANALÍTICA A MICROESCALA TOTAL Facultad de Química - U.N.A.M. Alejandro Baeza, Adrián de Santiago, Arturo García Introducción 19 CONFERENCIA DE QUIMICA Santiago de Cuba, Teatro Heredia Taller
QUÍMICA ANALÍTICA I (1402) Sem 2008-I Ejercicio de control: Equilibrios redox. Dr. Alejandro Baeza
 QUÍMICA ANALÍTICA I (1402) Sem 2008-I Ejercicio de control: Equilibrios redox. Planteamiento del sistema en estudio. Se mezclan 1mmol de Ti 3+ en 25 ml de una solución a ph = 0. Se sabe que: Preguntas:
QUÍMICA ANALÍTICA I (1402) Sem 2008-I Ejercicio de control: Equilibrios redox. Planteamiento del sistema en estudio. Se mezclan 1mmol de Ti 3+ en 25 ml de una solución a ph = 0. Se sabe que: Preguntas:
Caracterización de sistemas electroactivos. Sem 2011-I Tarea1: Reactividad ácido-base. Caso del dicromato. Dr. Alejandrito Baeza.
 log [i] Caracterización de sistemas electroactivos. Sem 2011-I Tarea1: Reactividad ácido-base. Caso del dicromato. Dr. Alejandrito Baeza. Planteamiento del sistema en estudio En la figura proporcionada
log [i] Caracterización de sistemas electroactivos. Sem 2011-I Tarea1: Reactividad ácido-base. Caso del dicromato. Dr. Alejandrito Baeza. Planteamiento del sistema en estudio En la figura proporcionada
QUIMICA ANALITICA I VOLUMETRIAS DE PRECIPITACION Y COMPLEJOS
 QUIMICA ANALITICA I VOLUMETRIAS DE PRECIPITACION Y COMPLEJOS 2016 VOLUMETRÍA DE PRECIPITACIÓN Y COMPLEJOS - QA I 2016 Nota: A continuación de la resolución de estos problemas se enumeran los métodos más
QUIMICA ANALITICA I VOLUMETRIAS DE PRECIPITACION Y COMPLEJOS 2016 VOLUMETRÍA DE PRECIPITACIÓN Y COMPLEJOS - QA I 2016 Nota: A continuación de la resolución de estos problemas se enumeran los métodos más
Cuantificación potenciométrica de fluoruro en sal de mesa mediante electrodos ión selectivos (ISE)
 Cuantificación potenciométrica de fluoruro en sal de mesa mediante electrodos ión selectivos (ISE) ELABORARON: Gloria García R., Juan Manuel Martínez N. OBJETIVOS: Estudiar y utilizar la técnica electroanalítica
Cuantificación potenciométrica de fluoruro en sal de mesa mediante electrodos ión selectivos (ISE) ELABORARON: Gloria García R., Juan Manuel Martínez N. OBJETIVOS: Estudiar y utilizar la técnica electroanalítica
TITULACIONES ÁCIDO-BASE A MICROESCALA QUÍMICA USANDO MICROSENSORES DE ph Y MICROELECTRODO DE REFERENCIA: ADQUISICIÓN DE DATOS CON NUEVAS TECNOLOGÍAS
 TITULACIONES ÁCIDO-BASE A MICROESCALA QUÍMICA USANDO MICROSENSORES DE ph Y MICROELECTRODO DE REFERENCIA: ADQUISICIÓN DE DATOS CON NUEVAS TECNOLOGÍAS Juan Vargas M., Alejandro Baeza (*)., Tatiana Urzúa
TITULACIONES ÁCIDO-BASE A MICROESCALA QUÍMICA USANDO MICROSENSORES DE ph Y MICROELECTRODO DE REFERENCIA: ADQUISICIÓN DE DATOS CON NUEVAS TECNOLOGÍAS Juan Vargas M., Alejandro Baeza (*)., Tatiana Urzúa
QUÍMICA ANALÍTICA I. Serie de problemas Reactividad Química. DR. ALEJANDRO BAEZA
 1 QUÍMICA ANALÍTICA I Serie de problemas Reactividad Química DR. 2004 http://mx.geocities.com/electroquimika 2 QUIMICA ANALITICA I Ejercicio de clase, REAC(1): Pares conjugados, escalas de reactividad
1 QUÍMICA ANALÍTICA I Serie de problemas Reactividad Química DR. 2004 http://mx.geocities.com/electroquimika 2 QUIMICA ANALITICA I Ejercicio de clase, REAC(1): Pares conjugados, escalas de reactividad
M M M M S. Precipitación selectiva: V F Equilibrio. Inicio. % de solubilidad límite:
 M N 0 0 M N sat eq M M Total M N N Total % de solubilidad límite: V 0 Inicio VF % SL 100 V % de precipitación límite: 0 0 M M sat 0 0 % PL 100 % SL V F Equilibrio M M S eq sat V 0 N N eq 0 V F M Si logramos
M N 0 0 M N sat eq M M Total M N N Total % de solubilidad límite: V 0 Inicio VF % SL 100 V % de precipitación límite: 0 0 M M sat 0 0 % PL 100 % SL V F Equilibrio M M S eq sat V 0 N N eq 0 V F M Si logramos
Figura 1. Secuencia de reacciones electroquímicas y químicas acopladas en el microtitulación coulombimétrica sin necesidad de puente salino.
 TITULACIONES REDOX COULOMBIMETRICAS DE MÍNIMA INSTRUMENTACIÓN DE BAJO COSTO Y MATERIALES LOCALES CON MONITOREO VISUAL Y MICROPOTENCIOMÉTRICO DEL TIEMPO DE VIRE SIN PUENTE SALINO. APROXIMACIÓN METROLÓGICA.
TITULACIONES REDOX COULOMBIMETRICAS DE MÍNIMA INSTRUMENTACIÓN DE BAJO COSTO Y MATERIALES LOCALES CON MONITOREO VISUAL Y MICROPOTENCIOMÉTRICO DEL TIEMPO DE VIRE SIN PUENTE SALINO. APROXIMACIÓN METROLÓGICA.
LABORATORIO DE QUÍMICA ANALÍTICA II Dr. Alejandro Baeza
 (DOS VECES) Facultad de Química UNAM 2003 LABORATORIO DE QUÍMICA ANALÍTICA II Dr. Alejandro Baeza Contenido 0.0 Programa, evaluación, calificación y observaciones. 1.0 Acidez-complejos. Determinación de
(DOS VECES) Facultad de Química UNAM 2003 LABORATORIO DE QUÍMICA ANALÍTICA II Dr. Alejandro Baeza Contenido 0.0 Programa, evaluación, calificación y observaciones. 1.0 Acidez-complejos. Determinación de
Volumetrías de precipitación
 Volumetrías de precipitación El fundamento es una reacción de precipitación: Analito + valorante (agente precipitante) Precipitado A diferencia de las gravimetrías, el precipitado normalmente no se aisla
Volumetrías de precipitación El fundamento es una reacción de precipitación: Analito + valorante (agente precipitante) Precipitado A diferencia de las gravimetrías, el precipitado normalmente no se aisla
4.0 Efectuar una dilución 1/10 de una muestra de SSI. Medir la diferencia de potencial.
 QUIMICA ANALITICA INSTRUMENTAL I. Experiencia de cátedra. ISE a Microescala Total. Dr. Planteamiento del sistema en estudio Los primeros electrodos sensores selectivos, conocidos por sus siglas en ingles,
QUIMICA ANALITICA INSTRUMENTAL I. Experiencia de cátedra. ISE a Microescala Total. Dr. Planteamiento del sistema en estudio Los primeros electrodos sensores selectivos, conocidos por sus siglas en ingles,
Los métodos potenciométricos se basan en la medida del potencial eléctrico (respecto a una referencia) de un electrodo sumergido en la disolución
 Potenciometrias Los métodos potenciométricos se basan en la medida del potencial eléctrico (respecto a una referencia) de un electrodo sumergido en la disolución problema, a partir de la cual es posible
Potenciometrias Los métodos potenciométricos se basan en la medida del potencial eléctrico (respecto a una referencia) de un electrodo sumergido en la disolución problema, a partir de la cual es posible
TÉCNICAS DE MUESTREO, ANÁLISIS E INTERPRETACIÓN. Ingeniería Ambiental
 TÉCNICAS DE MUESTREO, ANÁLISIS E INTERPRETACIÓN Ingeniería Ambiental UNIDAD Nº3 VOLUMETRÍAS Problema Elección del método analítico Toma de muestra Tratamiento de la muestra Proceso de medida Tratamiento
TÉCNICAS DE MUESTREO, ANÁLISIS E INTERPRETACIÓN Ingeniería Ambiental UNIDAD Nº3 VOLUMETRÍAS Problema Elección del método analítico Toma de muestra Tratamiento de la muestra Proceso de medida Tratamiento
QUÍMICA ANALÍTICA II. Sem I Documento de apoyo : Acidez-complejos (2). Titulacion de bórax en medio manitolado. Dr. Alejandro Baeza.
 QUÍMICA ANALÍTICA II. Sem. 2010I Documento de apoyo : Acidezcomplejos (2). Titulacion de bórax en medio manitolado. Dr.. Planteamiento del sistema en estudio: El bórax, tetraborato de sodio decahidratado,
QUÍMICA ANALÍTICA II. Sem. 2010I Documento de apoyo : Acidezcomplejos (2). Titulacion de bórax en medio manitolado. Dr.. Planteamiento del sistema en estudio: El bórax, tetraborato de sodio decahidratado,
Electroquímica. Cátedra de Geoquímica
 Electroquímica Cátedra de Geoquímica 1 ELECTROQUÍMICA: Parte de la Química que estudia las reacciones en las que hay transferencia de electrones, conocidas como REDOX Dada una reacción: Identificar el
Electroquímica Cátedra de Geoquímica 1 ELECTROQUÍMICA: Parte de la Química que estudia las reacciones en las que hay transferencia de electrones, conocidas como REDOX Dada una reacción: Identificar el
Práctica 4: Termoquímica: Valoraciones
 Práctica 4: Termoquímica: Valoraciones Ingeniería agrónoma grado en hortofruticultura y jardinería Jorge Cerezo Martínez Objetivos Comprender el fundamento de las valoraciones químicas. Aplicar la metodología
Práctica 4: Termoquímica: Valoraciones Ingeniería agrónoma grado en hortofruticultura y jardinería Jorge Cerezo Martínez Objetivos Comprender el fundamento de las valoraciones químicas. Aplicar la metodología
QUIMICA ANALITICA III Documento de Apoyo: Acidez-precipitación. Casos generales: HA/MA y H 2 A/HA - /MA. Dr. Alejandro Baeza.
 QUIMICA ANALITICA III Documento de Apoyo: Acidez-precipitación. Casos generales: A/MA y A/A - /MA. Dr.. Planteamiento del sistema en estudio Las propiedades ácido-base de un par conjugado cambian en presencia
QUIMICA ANALITICA III Documento de Apoyo: Acidez-precipitación. Casos generales: A/MA y A/A - /MA. Dr.. Planteamiento del sistema en estudio Las propiedades ácido-base de un par conjugado cambian en presencia
La fracción disociada dependerá del valor del Ka y de Co: HCl. El nuevo estado de equilibrio dependerá de la cantidad adicionada de HCl.
 QUÍMICA ANALÍTICA I Documento de apoyo (4b): Reactividad Química. Equilibrio forzado. Diagramas Unidimensionales de Predominio de Especies, DUZP. Dr. Alejandro Baeza. Semestre 2010-II. Equilibrio forzado
QUÍMICA ANALÍTICA I Documento de apoyo (4b): Reactividad Química. Equilibrio forzado. Diagramas Unidimensionales de Predominio de Especies, DUZP. Dr. Alejandro Baeza. Semestre 2010-II. Equilibrio forzado
CAPITULO VIII VOLUMETRÍA DE PRECIPITACIÓN Curvas de valoración Métodos Analíticos
 CAPITULO VIII VOLUMETRÍA DE PRECIPITACIÓN 8.1. Volumetría de precipitación 8.2. Curvas de valoración 8.3. Métodos Analíticos 8.1 VOLUMETRÍA DE PRECIPITACIÓN: Es similar a la Valoración ácido base, los
CAPITULO VIII VOLUMETRÍA DE PRECIPITACIÓN 8.1. Volumetría de precipitación 8.2. Curvas de valoración 8.3. Métodos Analíticos 8.1 VOLUMETRÍA DE PRECIPITACIÓN: Es similar a la Valoración ácido base, los
Así, multiplicando por 3 el par redox del Sn y sumando con el par redox del cromo, se obtiene:
 Ejercicio resuelto: Valoración de Sn (II) Co molar con Cr (VI) de concentración C usando indicador a ph ácido. Se valoran 50.0 ml de solución acuosa de perclorato estanoso 0.00 M con dicromato de potasio
Ejercicio resuelto: Valoración de Sn (II) Co molar con Cr (VI) de concentración C usando indicador a ph ácido. Se valoran 50.0 ml de solución acuosa de perclorato estanoso 0.00 M con dicromato de potasio
Concentración de cloruro en el suero fisiológico comercial
 Concentración de cloruro en el suero fisiológico comercial Integrantes: María Rosales 20.394298 Hécmaris Bellorin 20.263.962 Marvic Navas 20.432.075 José Escalante 19.046.898 Volumetría de precipitación
Concentración de cloruro en el suero fisiológico comercial Integrantes: María Rosales 20.394298 Hécmaris Bellorin 20.263.962 Marvic Navas 20.432.075 José Escalante 19.046.898 Volumetría de precipitación
TRABAJO PRÁCTICO N 1 VOLUMETRÍA I. 1. Determinación de cloruros mediante volumetría de precipitación (método de Mohr)
 TRABAJO PRÁCTICO N 1 VOLUMETRÍA I 1. Determinación de cloruros mediante volumetría de precipitación (método de Mohr) 1.1 Introducción Los cloruros constituyen las principales sales presentes en el agua,
TRABAJO PRÁCTICO N 1 VOLUMETRÍA I 1. Determinación de cloruros mediante volumetría de precipitación (método de Mohr) 1.1 Introducción Los cloruros constituyen las principales sales presentes en el agua,
ANALISIS DE CLORUROS. Figueroa, V.; Ocampo, M.; Departamento de Química, Facultad de Ciencias, Universidad del Valle, Cali Colombia,
 ANALISIS DE CLORUROS Figueroa, V.; Ocampo, M.; Departamento de Química, Facultad de Ciencias, Universidad del Valle, Cali Colombia, Resumen: Se estandarizo el AgNO 3, pesando 0.0612 g NaCl, y diluyendo
ANALISIS DE CLORUROS Figueroa, V.; Ocampo, M.; Departamento de Química, Facultad de Ciencias, Universidad del Valle, Cali Colombia, Resumen: Se estandarizo el AgNO 3, pesando 0.0612 g NaCl, y diluyendo
FQ UNAM 2013 Alejandro Baeza
 QUÍMICA ANALÍTICA I Evolución de la reacvidad de HCl y AgNO =.M por NH NH HCl =.mol/l AgNO =.mol/l FQ UNAM Alejandro Baeza Predicción de la reacvidad: NH Ag(NH ) NH da Ag ra H pnh FQ UNAM Alejandro Baeza
QUÍMICA ANALÍTICA I Evolución de la reacvidad de HCl y AgNO =.M por NH NH HCl =.mol/l AgNO =.mol/l FQ UNAM Alejandro Baeza Predicción de la reacvidad: NH Ag(NH ) NH da Ag ra H pnh FQ UNAM Alejandro Baeza
Curvas de titulación ácido-base. Titulación de un ácido fuerte y un ácido débil, con una base fuerte.
 10. Curvas de titulación ácido-base. Titulación de un ácido fuerte y un ácido débil, con una base fuerte. Problemas 1.- Determinar la concentración de dos soluciones de distintos ácidos mediante curvas
10. Curvas de titulación ácido-base. Titulación de un ácido fuerte y un ácido débil, con una base fuerte. Problemas 1.- Determinar la concentración de dos soluciones de distintos ácidos mediante curvas
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción B Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio 5, Opción A
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción B Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio 5, Opción A
Práctica 10. Curvas de titulación ácido-base
 Práctica 10. Curvas de titulación ácido-base PREGUNTAS A RESPONDER AL FINAL DE LA PRÁCTICA Cómo se construye una curva de titulación ácido-base? Qué especie química determina los cambios de ph antes y
Práctica 10. Curvas de titulación ácido-base PREGUNTAS A RESPONDER AL FINAL DE LA PRÁCTICA Cómo se construye una curva de titulación ácido-base? Qué especie química determina los cambios de ph antes y
QUÍMICA ANALÍTICA I. Etapa analítica. Análisis volumétrico : Titulaciones de óxido-reducción
 QUÍMICA ANALÍTICA I Etapa analítica Análisis volumétrico : Titulaciones de óxido-reducción Equilibrio Redox Ce(IV) Ce 4+ + Fe 2+ Ce 3+ + Fe 3+ Otra reacción: MnO 2-4 + 5 Fe 2+ + 8 H + Mn 2+ + 5 Fe 3+ +
QUÍMICA ANALÍTICA I Etapa analítica Análisis volumétrico : Titulaciones de óxido-reducción Equilibrio Redox Ce(IV) Ce 4+ + Fe 2+ Ce 3+ + Fe 3+ Otra reacción: MnO 2-4 + 5 Fe 2+ + 8 H + Mn 2+ + 5 Fe 3+ +
LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218. Práctica de Laboratorio No. 9
 UNIVERSIDAD NACIONAL AUTÓNOMA DE HONDURAS FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA DEPARTAMENTO DE QUÍMICA LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218 Práctica de Laboratorio No. 9 COMPETENCIAS A LOGRAR:
UNIVERSIDAD NACIONAL AUTÓNOMA DE HONDURAS FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA DEPARTAMENTO DE QUÍMICA LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218 Práctica de Laboratorio No. 9 COMPETENCIAS A LOGRAR:
Equilibrios ácido-base y equilibrios de solubilidad
 Equilibrios ácido-base y equilibrios de solubilidad Capítulo 16 El efecto del ión común es el cambio en equilibrio causado por el añadir un compuesto que tiene un ión común con la sustancia disuelta. La
Equilibrios ácido-base y equilibrios de solubilidad Capítulo 16 El efecto del ión común es el cambio en equilibrio causado por el añadir un compuesto que tiene un ión común con la sustancia disuelta. La
ANÁLISIS INSTRUMENTAL A MICROESCALA PARA LA DOCENCIA
 1 ANÁLISIS INSTRUMENTAL A MICROESCALA PARA LA DOCENCIA Alejandro Baeza. Facultad de Química UNAM. CU Delegación Coyoacán CP 04510. Tel. 5622-37-50. baeza@servidor.unam.mx. Resumen En este trabajo se presentan
1 ANÁLISIS INSTRUMENTAL A MICROESCALA PARA LA DOCENCIA Alejandro Baeza. Facultad de Química UNAM. CU Delegación Coyoacán CP 04510. Tel. 5622-37-50. baeza@servidor.unam.mx. Resumen En este trabajo se presentan
QUÍMICA ANALÍTICA III. Examen: Diagramas log [i] = f(ph) para sistemas hidróxido insolubles. Dr. Alejandrito Baeza.
![QUÍMICA ANALÍTICA III. Examen: Diagramas log [i] = f(ph) para sistemas hidróxido insolubles. Dr. Alejandrito Baeza. QUÍMICA ANALÍTICA III. Examen: Diagramas log [i] = f(ph) para sistemas hidróxido insolubles. Dr. Alejandrito Baeza.](/thumbs/62/47859290.jpg) QUÍMICA ANALÍTICA III. Examen: Diagramas log [i] = f(ph) para sistemas hidróxido insolubles. Dr. Alejandrito Baeza. Planteamiento del sistema en estudio Se necesita realizar una separación de As(III) 10
QUÍMICA ANALÍTICA III. Examen: Diagramas log [i] = f(ph) para sistemas hidróxido insolubles. Dr. Alejandrito Baeza. Planteamiento del sistema en estudio Se necesita realizar una separación de As(III) 10
FACULTAD DE QUIMICA UNAM
 1 FACULTAD DE QUIMICA UNAM QUÍMICA ANALÍTICA INSTRUMENTAL I Serie de problemas Potenciometría iónica selectiva Sensores y biosensores Dr. 2004 2 QUIMICA ANALITICA INSTRUMENTAL I Serie de problemas: Sensores
1 FACULTAD DE QUIMICA UNAM QUÍMICA ANALÍTICA INSTRUMENTAL I Serie de problemas Potenciometría iónica selectiva Sensores y biosensores Dr. 2004 2 QUIMICA ANALITICA INSTRUMENTAL I Serie de problemas: Sensores
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II Grupo: Equipo: Nombre: Nombre: Nombre: Nombre: Nombre:
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II Grupo: Equipo: 1 Práctica 10 Curvas de titulación ácido-base. Titulación de un ácido fuerte y un ácido débil,
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II Grupo: Equipo: 1 Práctica 10 Curvas de titulación ácido-base. Titulación de un ácido fuerte y un ácido débil,
a) La solubilidad será la concentración de las especies iónicas en disolución: [ ] [ ]
![a) La solubilidad será la concentración de las especies iónicas en disolución: [ ] [ ] a) La solubilidad será la concentración de las especies iónicas en disolución: [ ] [ ]](/thumbs/86/93842402.jpg) 1) Calcular la solubilidad del bromuro de plata en: a) ausencia NaBr 0,001 M b) presencia de NaBr 0,001 M La reacción de precipitación es: a) La solubilidad será la concentración de las especies iónicas
1) Calcular la solubilidad del bromuro de plata en: a) ausencia NaBr 0,001 M b) presencia de NaBr 0,001 M La reacción de precipitación es: a) La solubilidad será la concentración de las especies iónicas
Práctica 6. Reactivo limitante
 Práctica 6. Reactivo limitante PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué especie actúa como reactivo limitante en el siguiente proceso químico? CaCl 2 (ac) + K 2 CO 3 (ac) CaCO 3 + 2 KCl (ac) PRIMERA
Práctica 6. Reactivo limitante PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué especie actúa como reactivo limitante en el siguiente proceso químico? CaCl 2 (ac) + K 2 CO 3 (ac) CaCO 3 + 2 KCl (ac) PRIMERA
Química A.B.A.U. SOLUBILIDAD 1 SOLUBILIDAD
 Química A.B.A.U. SOLUBILIDAD 1 SOLUBILIDAD PROBLEMAS 1. a) Calcula la solubilidad en agua pura, expresada en g/dm³, del sulfato de plomo(ii). Datos: Kₚₛ (PbSO₄, 25 C)) = 1,8 10 ⁸ (A.B.A.U. Sep. 18) Rta.:
Química A.B.A.U. SOLUBILIDAD 1 SOLUBILIDAD PROBLEMAS 1. a) Calcula la solubilidad en agua pura, expresada en g/dm³, del sulfato de plomo(ii). Datos: Kₚₛ (PbSO₄, 25 C)) = 1,8 10 ⁸ (A.B.A.U. Sep. 18) Rta.:
Química Analítica II: Separación de Ni (II) y Cd(II) a ph impuesto
 Química Analítica II: Separación de Ni (II) y Cd(II) a ph impuesto Estudio gráfico. Dr. Alejandro Baeza Fac. Química. UNAM FQ UNAM Alejandro Baeza 2010-I 1 Porqué separar Ni(II) y Cd(II)?: Nano, coche
Química Analítica II: Separación de Ni (II) y Cd(II) a ph impuesto Estudio gráfico. Dr. Alejandro Baeza Fac. Química. UNAM FQ UNAM Alejandro Baeza 2010-I 1 Porqué separar Ni(II) y Cd(II)?: Nano, coche
Un equilibrio heterogéneo muy especial: Equilibrio de Precipitación
 Un equilibrio heterogéneo muy especial: Equilibrio de Precipitación Los equilibrios heterogéneos son aquellos en los cuales los reactivos y productos se presentan en distintos estados de agregación (sólido,
Un equilibrio heterogéneo muy especial: Equilibrio de Precipitación Los equilibrios heterogéneos son aquellos en los cuales los reactivos y productos se presentan en distintos estados de agregación (sólido,
Reacciones de precipitación Solubilidad y producto de solubilidad
 Reacciones de precipitación Recibe el nombre de precipitación la aparición de una fase sólida en el seno de un líquido, bien por adición de un reactivo que forme un producto insoluble con alguno de los
Reacciones de precipitación Recibe el nombre de precipitación la aparición de una fase sólida en el seno de un líquido, bien por adición de un reactivo que forme un producto insoluble con alguno de los
Coulombimetría ácido-base de mínima instrumentación
 Coulombimetría ácido-base de mínima instrumentación (locally produced low cost equipment) Marín Medina Alejandro, Baeza Reyes Alejandro* Universidad Nacional Autónoma de México, Facultad de Química, Departamento
Coulombimetría ácido-base de mínima instrumentación (locally produced low cost equipment) Marín Medina Alejandro, Baeza Reyes Alejandro* Universidad Nacional Autónoma de México, Facultad de Química, Departamento
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 6, Opción A Reserva, Ejercicio, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 6, Opción A Reserva, Ejercicio, Opción B
Desarrollo de un protocolo de análisis químico
 Desarrollo de un protocolo de análisis químico Técnica: TITULACIONES ÁCIDOBASE 441 Materiales y reactivos disponibles: Pipetas aforadas: Volumen nominal (ml): 1,00;,00; 3,00; 5,00;,00; 0,00; 5,00; 50,00.
Desarrollo de un protocolo de análisis químico Técnica: TITULACIONES ÁCIDOBASE 441 Materiales y reactivos disponibles: Pipetas aforadas: Volumen nominal (ml): 1,00;,00; 3,00; 5,00;,00; 0,00; 5,00; 50,00.
QG II Reactivo limitante Página 1
 6. Problema Reactivo limitante Modificaciones realizadas por: QFB Rosario Velázquez Miranda Q. Brenda Lizette Ruiz Herrera Dr. Víctor Manuel Ugalde Saldívar Qué especie actúa como reactivo limitante en
6. Problema Reactivo limitante Modificaciones realizadas por: QFB Rosario Velázquez Miranda Q. Brenda Lizette Ruiz Herrera Dr. Víctor Manuel Ugalde Saldívar Qué especie actúa como reactivo limitante en
Capítulo 8 VOLUMETRÍA DE PRECIPITACIÓN
 Capítulo 8 VOLUMETRÍA DE PRECIPITACIÓN 8.1 Introducción En este curso se han visto numerosos ejemplos de reacciones de precipitación; muchas sirven para la identificación o separación de iones metálicos
Capítulo 8 VOLUMETRÍA DE PRECIPITACIÓN 8.1 Introducción En este curso se han visto numerosos ejemplos de reacciones de precipitación; muchas sirven para la identificación o separación de iones metálicos
ANALISIS VOLUMETRICO
 ANALISIS VOLUMETRICO FUNDAMENTO La concentración de la sustancia de interés (analito) se determina a través de una medición de volumen. PROCEDIMIENTO GENERAL Preparar un patrón de referencia. Disolver
ANALISIS VOLUMETRICO FUNDAMENTO La concentración de la sustancia de interés (analito) se determina a través de una medición de volumen. PROCEDIMIENTO GENERAL Preparar un patrón de referencia. Disolver
CÁLCULOS SOBRE PREPARACIÓN DE SOLUCIONES Y EXPRESIÓN DE RESULTADOS
 CÁLCULOS SOBRE PREPARACIÓN DE SOLUCIONES Y EXPRESIÓN DE RESULTADOS 1- Calcule el número de moles presentes en cada uno de los siguientes ejemplos: a) 148,2 g de Ca(HO) 2 b) 50 g de CuSO 4.5 H 2 O c) 57
CÁLCULOS SOBRE PREPARACIÓN DE SOLUCIONES Y EXPRESIÓN DE RESULTADOS 1- Calcule el número de moles presentes en cada uno de los siguientes ejemplos: a) 148,2 g de Ca(HO) 2 b) 50 g de CuSO 4.5 H 2 O c) 57
PRÁCTICO 11: CELDAS GALVÁNICAS
 Página: 1/8 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 11: CELDAS GALVÁNICAS Bibliografía: Química, La Ciencia Central, T.L.Brown, H.E.LeMay, Jr., B.Bursten; Ed. Prentice-Hall Hispanoamericana, México, 7 a
Página: 1/8 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 11: CELDAS GALVÁNICAS Bibliografía: Química, La Ciencia Central, T.L.Brown, H.E.LeMay, Jr., B.Bursten; Ed. Prentice-Hall Hispanoamericana, México, 7 a
Práctica 3. Aplicación de las titulaciones ácido base.
 Nombre: Nombre: Nombre: Nombre: Nombre: UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II Grupo: Equipo: 1 Práctica 3. Aplicación de las titulaciones ácido base.
Nombre: Nombre: Nombre: Nombre: Nombre: UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II Grupo: Equipo: 1 Práctica 3. Aplicación de las titulaciones ácido base.
Determinación del contenido de carbonato de calcio (CaCO 3 ) en una muestra comercial
 Determinación del contenido de carbonato de calcio (CaCO 3 ) en una muestra comercial Autores: Olivia Zamora Martínez y Alberto Colín Segundo Revisores 1. INTRODUCCIÓN Los equilibrios ácido-base son bastante
Determinación del contenido de carbonato de calcio (CaCO 3 ) en una muestra comercial Autores: Olivia Zamora Martínez y Alberto Colín Segundo Revisores 1. INTRODUCCIÓN Los equilibrios ácido-base son bastante
REACCIONES DE OXIDACIÓN-REDUCCIÓN
 10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
POTENCIOMETRIA KCL. Cl - CELDAS GALVANICAS DEPOSITO DE COBRE SOBRE UNA LAMINA DE ZINC CELDA GALVANICA POTENCIALES REDOX CELDA GALVANICA
 POTENCIOMETRIA TOPICOS: Celdas galvánicas Potenciales estándar de electrodo Ecuación de Nernst Electrodos de referencia: primario y secundario Medición de ph Celdas electrolíticas Titulaciones potenciométricas
POTENCIOMETRIA TOPICOS: Celdas galvánicas Potenciales estándar de electrodo Ecuación de Nernst Electrodos de referencia: primario y secundario Medición de ph Celdas electrolíticas Titulaciones potenciométricas
Multímetro como sistema de medición alternativo en las valoraciones potenciométricas
 Multímetro como sistema de medición alternativo en las valoraciones potenciométricas Multimeter as Alternative Measurement System in the Potentiometric Titrations José de Jesús Pérez-Saavedra 1, Sonia
Multímetro como sistema de medición alternativo en las valoraciones potenciométricas Multimeter as Alternative Measurement System in the Potentiometric Titrations José de Jesús Pérez-Saavedra 1, Sonia
Equilibrio Químico - Redox. Por: Rolando Oyola Martínez Derechos 1
 quilibrio Químico - Redox Por: Rolando Oyola Martínez Derechos Reservados@216-17 1 Proceso Redox: Conceptos Generales 2 Proceso de oxidación de metal: 2 Fe() s 2Fe + + 2e O( g) + 4H + 4e 2HO + 2 2 Notación
quilibrio Químico - Redox Por: Rolando Oyola Martínez Derechos Reservados@216-17 1 Proceso Redox: Conceptos Generales 2 Proceso de oxidación de metal: 2 Fe() s 2Fe + + 2e O( g) + 4H + 4e 2HO + 2 2 Notación
Valoración de halogenuros
 1 Valoración de halogenuros Objetivo Valorar una disolución de bromuro de potasio con una disolución de concentración conocida de nitrato de plata siguiendo la valoración mediante las variaciones del potencial
1 Valoración de halogenuros Objetivo Valorar una disolución de bromuro de potasio con una disolución de concentración conocida de nitrato de plata siguiendo la valoración mediante las variaciones del potencial
7. Práctica 5: Celdas galvánicas.
 7. Práctica 5: Celdas galvánicas. 7.1. Fundamento teórico En esta práctica se construirán varias celdas voltaicas o galvánicas, a partir de dos semiceldas y de las conexiones apropiadas (circuito externo
7. Práctica 5: Celdas galvánicas. 7.1. Fundamento teórico En esta práctica se construirán varias celdas voltaicas o galvánicas, a partir de dos semiceldas y de las conexiones apropiadas (circuito externo
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 6, Opción A Reserva, Ejercicio 3, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 6, Opción A Reserva, Ejercicio 3, Opción
1. Qué es una curva de titulación o de valoración? 2. A qué se le llama el punto de equivalencia en una curva de titulación?
 Equipo: Nombre: Nombre: Nombre: Práctica 9: Curvas de titulación ácido-base. Titulación de un ácido fuerte y un ácido débil, con una base fuerte. Problemas Determinar la concentración de dos disoluciones
Equipo: Nombre: Nombre: Nombre: Práctica 9: Curvas de titulación ácido-base. Titulación de un ácido fuerte y un ácido débil, con una base fuerte. Problemas Determinar la concentración de dos disoluciones
Ejercicios 2 (Estequiometría) 3) Calcule la masa, en gramos, de 0,433 mol de nitrato de calcio. R: 71,1 g Ca(NO 3 ) 2
 Profesor Bernardo Leal Química El Mol y número de Avogadro: Ejercicios 2 (Estequiometría) 1) Calcule el número de moles de glucosa (C 6 H 12 O 6 ) que hay en 5,38 g de esta sustancia R: 0,03 mol C 6 H
Profesor Bernardo Leal Química El Mol y número de Avogadro: Ejercicios 2 (Estequiometría) 1) Calcule el número de moles de glucosa (C 6 H 12 O 6 ) que hay en 5,38 g de esta sustancia R: 0,03 mol C 6 H
a) Sistema de tres electrodos: Se utiliza en siguiente arreglo instrumental: P/G:
 QUÍMICA ANALÍTICA INSTRUMENTAL I. Experiencia de cátedra: Voltamperometría lineal. (Videograbación). Dr. Alejandro Baeza, Q. Arturo García. Planteamiento del experimento en estudio Obtener las curvas I/E,
QUÍMICA ANALÍTICA INSTRUMENTAL I. Experiencia de cátedra: Voltamperometría lineal. (Videograbación). Dr. Alejandro Baeza, Q. Arturo García. Planteamiento del experimento en estudio Obtener las curvas I/E,
Química III. Universidad Central de Venezuela Facultad de Agronomía Dpto. Química y Tecnología Cátedra de Química III
 Universidad Central de Venezuela Facultad de Agronomía Dpto. Química y Tecnología Cátedra de Química III Clase N Solubilidad y 1. Conceptos 1.1. Solución 1.. Componentes de una solución 1..1. Soluto 1...
Universidad Central de Venezuela Facultad de Agronomía Dpto. Química y Tecnología Cátedra de Química III Clase N Solubilidad y 1. Conceptos 1.1. Solución 1.. Componentes de una solución 1..1. Soluto 1...
ENSEÑANZA EXPERIMENTAL DEPARTAMENTO DE QUÍMICA ANALÍTICA ASIGNATURA: QUÍMICA ANALÍTICA INSTRUMENTAL 1 (1556) FACULTAD DE QUÍMICA. UNAM.
 ENSEÑANZA EXPERIMENTAL DEPARTAMENTO DE QUÍMICA ANALÍTICA ASIGNATURA: QUÍMICA ANALÍTICA INSTRUMENTAL 1 (1556) FACULTAD DE QUÍMICA. UNAM. Polarografía Clásica. Análisis de Pb y Bi. Fundamentos para el desarrollo
ENSEÑANZA EXPERIMENTAL DEPARTAMENTO DE QUÍMICA ANALÍTICA ASIGNATURA: QUÍMICA ANALÍTICA INSTRUMENTAL 1 (1556) FACULTAD DE QUÍMICA. UNAM. Polarografía Clásica. Análisis de Pb y Bi. Fundamentos para el desarrollo
6. Reacciones de precipitación
 6. Reacciones de precipitación Las reacciones de precipitación son aquellas en las que el producto es un sólido; se utilizan en los métodos gravimétricos de análisis y en las titulaciones por precipitación.
6. Reacciones de precipitación Las reacciones de precipitación son aquellas en las que el producto es un sólido; se utilizan en los métodos gravimétricos de análisis y en las titulaciones por precipitación.
9.-REACCIONES DE PRECIPITACIÓN
 Equilibrio Químico-15 9.-REACCIONES DE PRECIPITACIÓN 9.1.- Producto de solubilidad Como ya se vio en el Tema 2, las sustancias iónicas se disuelven en disolvente polares como el agua, mediante un proceso
Equilibrio Químico-15 9.-REACCIONES DE PRECIPITACIÓN 9.1.- Producto de solubilidad Como ya se vio en el Tema 2, las sustancias iónicas se disuelven en disolvente polares como el agua, mediante un proceso
CaCl 2(ac) + K 2 CO 3(ac) CaCO KCl (ac)
 Equipo: Nombre: Nombre: Nombre: Práctica 5. Reactivo Limitante Problema Qué especie actúa como reactivo limitante en la siguiente reacción química? CaCl 2(ac) + K 2 CO 3(ac) CaCO 3 + 2 KCl (ac) Tarea previa.
Equipo: Nombre: Nombre: Nombre: Práctica 5. Reactivo Limitante Problema Qué especie actúa como reactivo limitante en la siguiente reacción química? CaCl 2(ac) + K 2 CO 3(ac) CaCO 3 + 2 KCl (ac) Tarea previa.
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA ALUMNOS DE BACHILLERATO LOE
 A 1000 º C, K p = 1,65 atm para la reacción CO 2 (g) + C (s) 2 CO (g). Si en el equilibrio la presión total es de 5 atm, calcula el tanto por ciento de dióxido de carbono que ha reaccionado. J 01 A 800
A 1000 º C, K p = 1,65 atm para la reacción CO 2 (g) + C (s) 2 CO (g). Si en el equilibrio la presión total es de 5 atm, calcula el tanto por ciento de dióxido de carbono que ha reaccionado. J 01 A 800
QUÍMICA ANALÍTICA I Documento de Apoyo. Reactividad Química (9): Equilibrios químicos en las interfases Dr. Alejandro Baeza II.
 QUÍMICA ANALÍTICA I Documento de Apoyo. Reactividad Química (9): Equilibrios químicos en las interfases Dr. Alejandro Baeza. 21-II. Los equilibrios químicos que se establecen en las interfases pueden estudiarse
QUÍMICA ANALÍTICA I Documento de Apoyo. Reactividad Química (9): Equilibrios químicos en las interfases Dr. Alejandro Baeza. 21-II. Los equilibrios químicos que se establecen en las interfases pueden estudiarse
Física y Química 1ºBachillerato Ejemplo Examen. Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Ioduro de Calcio:
 Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
Equilibrios de solubilidad
 Equilibrios de solubilidad Apellidos, nombre Departamento Centro Atienza Boronat, Julia (matien@qim.upv.es) Morais Ezquerro, Sergi (smorais@qim.upv.es) Departamento de Química ETSIAMN (Universitat Politècnica
Equilibrios de solubilidad Apellidos, nombre Departamento Centro Atienza Boronat, Julia (matien@qim.upv.es) Morais Ezquerro, Sergi (smorais@qim.upv.es) Departamento de Química ETSIAMN (Universitat Politècnica
Práctica 6. Reactivo Limitante. NOTA: Para esta práctica deberás llevar al laboratorio una regla con graduación en milímetros
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II 1 Nombre: Grupo: Equipo: Nombre: Nombre: Nombre: Nombre: Problema Práctica 6. Reactivo Limitante Qué especie
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II 1 Nombre: Grupo: Equipo: Nombre: Nombre: Nombre: Nombre: Problema Práctica 6. Reactivo Limitante Qué especie
2(OH) (aq) + Co 2+ (aq) Co(OH) 2 (s) 3) Ec. Molecular. Cu(SO 4 )(aq) + 2Na(OH) (aq) Cu(OH) 2 (s) + Na 2 (SO 4 ) (aq) Ec. Ionica.
 QUIMICA (63.01) TRABAJO PRACTICO N :2 RELACCIONES DE DOBLE DESCOMPOSICION CON FORMACIÓN DE UNA FASE SOLIDA. INTEGRANTES: REACTIVOS UTILIZADOS FORMULA NOMECLATURA COLOR KCl Cloruro de Potasio Transparente
QUIMICA (63.01) TRABAJO PRACTICO N :2 RELACCIONES DE DOBLE DESCOMPOSICION CON FORMACIÓN DE UNA FASE SOLIDA. INTEGRANTES: REACTIVOS UTILIZADOS FORMULA NOMECLATURA COLOR KCl Cloruro de Potasio Transparente
Práctica 11. Disoluciones Amortiguadoras
 Práctica 11. Disoluciones Amortiguadoras PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué es una disolución amortiguadora de ph? Cuáles son los componentes de una disolución amortiguadora de ph? TAREA
Práctica 11. Disoluciones Amortiguadoras PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué es una disolución amortiguadora de ph? Cuáles son los componentes de una disolución amortiguadora de ph? TAREA
La Química Analítica nos permite medir, monitorear o caracterizar una, varias especies o procesos químicos para la resolución de diversos problemas:
 QUÍMICA ANALÍTICA I Documento de apoyo (1) : Formación de soluciones analíticas. Dr. Alejandro Baeza. Semestre 2010-II. Antecedentes La Química Analítica nos permite medir, monitorear o caracterizar una,
QUÍMICA ANALÍTICA I Documento de apoyo (1) : Formación de soluciones analíticas. Dr. Alejandro Baeza. Semestre 2010-II. Antecedentes La Química Analítica nos permite medir, monitorear o caracterizar una,
Método de las tangentes para la determinación del punto final en valoraciones potenciométricas
 Método de las tangentes para la determinación del punto final en valoraciones potenciométricas Apellidos, nombre Muñoz Portero, María José (mjmunoz@iqn.upv.es) Departamento Centro Ingeniería Química y
Método de las tangentes para la determinación del punto final en valoraciones potenciométricas Apellidos, nombre Muñoz Portero, María José (mjmunoz@iqn.upv.es) Departamento Centro Ingeniería Química y
Problemas del Tema 1: Aspectos cuantitativos en Química
 Problemas del Tema 1: Aspectos cuantitativos en Química 1.- Se dispone de una botella de ácido sulfúrico cuya etiqueta aporta los siguientes datos: densidad 1 84 g/ml y riqueza en masa 96 %. Calcule: La
Problemas del Tema 1: Aspectos cuantitativos en Química 1.- Se dispone de una botella de ácido sulfúrico cuya etiqueta aporta los siguientes datos: densidad 1 84 g/ml y riqueza en masa 96 %. Calcule: La
El DUZP respectivo con respecto al ph con respecto a las especies estables es:
 QUÍMICA ANALÍTICA II-III. DOCUMENTO DE APOYO: Trazo rápido del DLC del pirofosfato, L 5-. Dr. Alejandro Baeza. Sem 217-II. Ya que:!"# log β! = Σ pk (!!!)! El DUZP respectivo con respecto al ph con respecto
QUÍMICA ANALÍTICA II-III. DOCUMENTO DE APOYO: Trazo rápido del DLC del pirofosfato, L 5-. Dr. Alejandro Baeza. Sem 217-II. Ya que:!"# log β! = Σ pk (!!!)! El DUZP respectivo con respecto al ph con respecto
PRÁCTICO 3: SOLUCIONES
 Curso de Laboratorio Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 3: SOLUCIONES Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten; Ed. Prentice-Hall Hispanoamericana,
Curso de Laboratorio Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 3: SOLUCIONES Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten; Ed. Prentice-Hall Hispanoamericana,
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA ALUMNOS DE BACHILLERATO LOE
 A 1000 º C, K p = 1,65 atm para la reacción CO 2 (g) + C (s) 2 CO (g). Si en el equilibrio la presión total es de 5 atm, calcula el tanto por ciento de dióxido de carbono que ha reaccionado. J 01 A 800
A 1000 º C, K p = 1,65 atm para la reacción CO 2 (g) + C (s) 2 CO (g). Si en el equilibrio la presión total es de 5 atm, calcula el tanto por ciento de dióxido de carbono que ha reaccionado. J 01 A 800
Equilibrios de solubilidad Problemas
 Equilibrios de solubilidad 16.39. Utilice BaSO 4 para describir la diferencia entre solubilidad, solubilidad molar y producto de solubilidad. 16.40. Por qué normalmente no se calculan los valores de K
Equilibrios de solubilidad 16.39. Utilice BaSO 4 para describir la diferencia entre solubilidad, solubilidad molar y producto de solubilidad. 16.40. Por qué normalmente no se calculan los valores de K
Elaboración y prueba de un electrodo para la cuantificación de cloruro de potasio y bromuro de potasio
 Elaboración y prueba de un electrodo para la cuantificación de cloruro de potasio y bromuro de potasio Development and testing of an electrode for determination of potassium chloride and potassium bromide
Elaboración y prueba de un electrodo para la cuantificación de cloruro de potasio y bromuro de potasio Development and testing of an electrode for determination of potassium chloride and potassium bromide
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2016 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 016 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 3, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 016 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 3, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción
Práctica 5: Termoquímica: Celdas galvánicas
 Práctica 5: Termoquímica: Celdas galvánicas Ingeniería agrónoma grado en hortofruticultura y jardinería Jorge Cerezo Martínez Objetivos Construir, varias celdas galvánicas o voltaicas y medir el potencial
Práctica 5: Termoquímica: Celdas galvánicas Ingeniería agrónoma grado en hortofruticultura y jardinería Jorge Cerezo Martínez Objetivos Construir, varias celdas galvánicas o voltaicas y medir el potencial
Lic. Alejandro Marín-Medina, Dr. Arturo García-Mendoza, MSc. Adrián de Santiago-Zarate, Dr. Alejandro Baeza-Reyes
 Recepción: abril 2014 Aceptación/publicación: mayo/junio 2014 Diseño, construcción y caracterización de titulaciones microcoulombimétricas ácido-base con monitoreo visual y micropotencimétrico: Aproximación
Recepción: abril 2014 Aceptación/publicación: mayo/junio 2014 Diseño, construcción y caracterización de titulaciones microcoulombimétricas ácido-base con monitoreo visual y micropotencimétrico: Aproximación
