FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
|
|
|
- Miguel Ángel Salinas Carrasco
- hace 6 años
- Vistas:
Transcripción
1 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Indio ( 111 In) oxina Mallinckrodt 37 MBq/ml precursor radiofarmacéutico en solución. 2. COMPOSICIÓN CUALI Y CUANTITATIVA 1 ml de solución inyectable contiene 37 MBq de indio ( 111 In) oxina en la fecha y hora de calibración El vial contiene 37 MBq en la fecha y hora de calibración. Para consultar la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Precursor radiofarmacéutico en solución. Solución incolora 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Este medicamento es únicamente para uso diagnóstico. El indio ( 111 In) oxina está indicado para radiomarcaje in vitro de células sanguíneas aisladas que son posteriormente administradas por vía intravenosa para los siguientes objetivos médicos utilizando técnicas de imagen y contaje apropiadas: - Estudios con leucocitos o granulocitos marcados con indio ( 111 In): Evaluación de focos inflamatorios y abscesos, complementaria a otras exploraciones de imagen. Por ejemplo, localización de focos infecciosos como un absceso abdominal, confirmación de infección ósea después de colocar una prótesis, evaluación de fiebre de origen desconocido y evaluación de patologías inflamatorias no asociadas con infección como la enfermedad inflamatoria intestinal. En regiones del esqueleto con médula ósea roja puede presentarse osteomielitis como áreas de menor captación de leucocitos marcados con indio ( 111 In). La captación pulmonar difusa o local de leucocitos marcados con indio ( 111 In) debe interpretarse con precaución porque puede corresponder a localización fisiológica marginal. - Estudios con plaquetas (trombocitos) marcadas con indio ( 111 In): Determinación de la supervivencia y biodistribución plaquetaria, especialmente la captación hepática y esplénica en casos de trombocitopenia, trombosis arterial o vascular, y aneurismas y zonas de inflamación en el rechazo de un transplante (por ejemplo renal y pancreático). - Estudios con hematíes marcados con indio ( 111 In): Evaluación de zonas de hemorragia gastrointestinal /10
2 4.2 Posología y forma de administración Posología Adultos: Estudios con leucocitos o granulocitos marcados con indio ( 111 In): La actividad recomendada para adultos es de 7,4-30 MBq en administración intravenosa Estudios con plaquetas marcadas con indio ( 111 In): La actividad recomendada para adultos es de 1,85-3,7 MBq, para los estudios de supervivencia plaquetaria, y de 3,7-18,5 MBq para los estudios de biodistribución plaquetaria. En ambos casos, las plaquetas marcadas son administradas por vía intravenosa. Estudios con hematíes marcados con indio ( 111 In): La actividad recomendada para adultos es de 3,7-18,5 MBq administrado por vía intravenosa. Pacientes de edad avanzada (población mayor de 65 años de edad): No se requiere un esquema de dosificación especial. Población pediátrica (menor de 18 años de edad): Debe administrarse una fracción de la actividad recomendada para los adultos en función del peso corporal, superficie corporal o la edad. En recién nacidos y niños muy pequeños (hasta 1 año de edad) debe tenerse en cuenta el tamaño del órgano diana en relación a su tamaño corporal. En este grupo de edad, es necesaria una dosis mínima del 10% de la dosis recomendada para adultos con el fin de obtener imágenes de calidad suficiente. Método de administración de Indio ( 111 In) oxina Mallinckrodt y exploración diagnóstica Este medicamento no está autorizado para su administración directa al paciente. El vial contiene una solución para el radiomarcaje in vitro de leucocitos, trombocitos y eritrocitos que posteriormente se administran al paciente por vía intravenosa. Estudios con leucocitos o granulocitos marcados con indio ( 111 In): Los estudios gammagráficos para detectar acúmulos focales de leucocitos marcados con indio ( 111 In) pueden iniciarse a partir de las 3-6 horas de la administración. Sin embargo, el acúmulo relativo en las lesiones inflamatorias es mucho más marcado en las imágenes adquiridas 24 horas después de la inyección. Estudios con plaquetas marcadas con indio ( 111 In): En los estudios de supervivencia plaquetaria, el momento de la toma de muestras y el número de muestras tomadas dependerán del objetivo del estudio y de la supervivencia media prevista. Se recomienda que se obtengan muestras por lo menos a los 20 minutos y a las 2, 3 y 4 horas de la inyección y después diariamente durante 10 días. Los estudios gammagráficos para detectar depósitos de plaquetas marcadas pueden comenzar a las 2-6 horas después de la administración. Se recomienda que la adquisición de imágenes se realice de forma seriada hasta 48 ó 72 horas después de la inyección. Para instrucciones detalladas sobre la correcta administración/uso de Indio ( 111 In) oxina Mallinckrodt ver sección Contraindicaciones - Hipersensibilidad al principio activo o a alguno de los excipientes /10
3 4.4 Advertencias y precauciones especiales de empleo Indicación de la exploración Para todos los pacientes: la exposición a la radiación ionizante debe estar justificada en función del objetivo médico esperado, obtenido con la mínima dosis posible de radiación recibida por el paciente. En población pediátrica (menor de 18 años de edad): debe tenerse en cuenta que la dosis efectiva por MBq es mayor que en adultos (ver sección 11. Dosimetría ). Advertencias generales Los radiofármacos deben ser recibidos, utilizados y administrados exclusivamente por personal cualificado, que esté debidamente autorizado para el uso y manipulación de radionucleidos, en centros asistenciales autorizados. Su recepción, almacenamiento, uso, transporte y eliminación están sujetos a las normas y/o licencias correspondientes de los organismos oficiales competentes. Los radiofármacos destinados a la administración a pacientes deben ser preparados por el usuario de manera que cumplan tanto los requisitos de seguridad radiológica como de calidad farmacéutica. Se deben tomar las precauciones asépticas apropiadas de acuerdo con las Normas de Correcta Fabricación y Uso de Radiofármacos. Otras advertencias Las referencias bibliográficas referentes al uso clínico de células sanguíneas marcadas con indio ( 111 In) se refieren fundamentalmente a la utilización de células sanguíneas autólogas. Obviamente existen riesgos relacionados con la administración de células de un donante Interacción con otros medicamentos y otras formas de interacción Se ha observado una disminución de la captación de leucocitos marcados con indio ( 111 In) en los abscesos por efecto de corticoesteroides y antibióticos, pero la evidencia dista de ser clara. Es de esperar que los antibióticos efectivos como tratamiento impidan la migración de leucocitos mediante la reducción del estímulo quimiotáctico. 4.6 Embarazo y lactancia Mujeres en edad fértil: Cuando sea necesario administrar radiofármacos a mujeres en edad fértil, deben buscarse siempre indicios sobre un posible embarazo. Toda mujer que presente un retraso en la menstruación debe considerarse que está embarazada mientras no se demuestre lo contrario. En caso de duda, es fundamental que la exposición a la radiación sea la mínima necesaria para obtener la información clínica deseada. Debe considerarse la posibilidad de realizar técnicas alternativas que no impliquen el uso de radiaciones ionizantes. Se debe aconsejar a las mujeres en edad fértil que eviten un embarazo hasta que la dosis calculada de radiación al útero sea menor de 0,5 mgy. Mujeres embarazadas: No existen datos disponibles sobre el uso de células sanguíneas marcadas con indio ( 111 In) oxina en mujeres embarazadas. Existe evidencia de teratogeneicidad del indio a partir de experimentos en animales. Los procedimientos con radionucleidos llevados a cabo en mujeres embarazadas suponen además dosis de radiación para el feto. El indio ( 111 In) oxina no debe administrarse durante el embarazo a menos que sea estrictamente necesario o cuando el beneficio para la madre supere el riesgo del feto /10
4 La dosis absorbida por el útero después de la administración de 30 MBq de leucocitos marcados con indio ( 111 In), y preparadas mediante marcaje radiactivo con indio ( 111 In) oxina, es de 3,6 mgy. La administración de 18,5 MBq de plaquetas marcadas con indio ( 111 In) supone una dosis de radiación al útero de 1,8 mgy. Las dosis superiores a 0,5 mgy deben ser consideradas como un riesgo potencial para el feto. Lactancia: Antes de administrar indio ( 111 In) oxina a una madre que está amamantando a su hijo/a. debe considerarse la posibilidad de retrasar razonablemente la exploración hasta que la madre haya suspendido la lactancia y plantearse si se ha seleccionado el radiofármaco más adecuado, teniendo en cuenta la secreción de actividad en la leche materna. Debe considerarse la posibilidad de extraer leche antes de la administración de este producto y almacenarla para su uso posterior. La lactancia puede reanudarse cuando el nivel de radiactividad en la leche materna no suponga una dosis de radiación para el hijo/a superior a 1 msv Efectos sobre la capacidad para conducir y utilizar máquinas No se han realizado estudios sobre la capacidad para conducir y utilizar máquinas. 4.8 Reacciones adversas Para todos los pacientes: la exposición a la radiación ionizante debe estar justificada en función del objetivo médico esperado, obtenido con la mínima dosis posible de radiación recibida por el paciente. La exposición a la radiación ionizante está vinculada a la inducción de cáncer y a la posibilidad de desarrollar defectos hereditarios. Después de la administración de la máxima actividad recomendada de este producto, la dosis efectiva es de aproximadamente 17,7 msv para los leucocitos marcados, de aproximadamente 12,95 msv para las plaquetas marcadas y de 7,4 msv para los hematíes marcados. En población pediátrica (menor de 18 años de edad): debe tenerse en cuenta que la dosis efectiva por MBq es mayor que en adultos (ver sección 11. Dosimetría ). Reacciones adversas Se han recibido muy pocos informes acerca de hipersensibilidad, demostrada en reacciones cutáneas y en reacciones generalizadas, probablemente de carácter anafiláctico, después de la administración de células sanguíneas marcadas con indio ( 111 In). También hay que tener en cuenta que los materiales utilizados en la separación de las células pueden causar reacciones de hipersensibilidad. Es imprescindible que las células sean lavadas de cualquier agente de sedimentación antes de reinyectarlas al paciente 4.9 Sobredosis En caso de administración accidental de una sobredosis de células sanguíneas marcadas con indio ( 111 In), el tratamiento de soporte es muy escaso dado que la eliminación del radionucleido depende completamente de la ruptura fisiológica normal de las células. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: compuestos de indio ( 111 In), código ATC: V09HB01. A las actividades utilizadas para las exploraciones diagnósticas no parece que el indio ( 111 In) oxina tenga actividad farmacodinámica /10
5 5.2. Propiedades farmacocinéticas El indio forma un complejo saturado (1:3) con la 8-hidroxiquinolina (oxina). El complejo es neutro y liposoluble, lo que le permite penetrar a través de la membrana celular. Dentro de la célula, el indio se une firmemente a los componentes citoplasmáticos. La hidroxiquinolina liberada es expulsada por la célula. Se considera probable que el mecanismo de marcaje celular con indio (In111) oxina implique una reacción de intercambio entre el transportador de hidroquinolina y los componentes subcelulares, que realizan la quelación del indio con más fuerza que la hidroxiquinolina. La baja constante de estabilidad del complejo indio oxina, estimada en aproximadamente 10 10, apoya esta teoría. Las células sanguíneas marcadas con indio ( 111 In) siguen el camino de las células no marcadas después de la reinyección, y permiten así visualizar las áreas de acumulación. Después de la inyección de los leucocitos marcados en voluntarios sanos, aproximadamente el 60% de la dosis es inmediatamente captada por el hígado, bazo, médula ósea y otros tejidos. Sólo hay retención pasajera muy breve en los pulmones. El resto muestra un aclaramiento exponencial desde el torrente circulatorio con una vida media entre 5 y 10 horas, que se traduce en una captación final de aproximadamente 20% en el hígado, 25% en el bazo, 30% en la médula ósea y 25% en otros órganos. El aclaramiento de la sangre total y la distribución biológica pueden variar considerablemente en función del individuo, de las características de las células inyectadas y de las técnicas de marcaje utilizadas. Los leucocitos marcados con indio ( 111 In) se acumularán en áreas de inflamación y abscesos. Los hematíes (glóbulos rojos) marcados con indio ( 111 In) son resistentes y en su reinyección se comportan como las células no marcadas. Se mantienen dentro del sistema vascular y sólo lo abandonan si son destruidos o si se pierden por una hemorragia. El indio ( 111 In) se une fuertemente a las células y no tiene prácticamente secreción gastrointestinal en el intestino normal, permitiendo así visualizar el sistema vascular hasta 72 horas después. Los glóbulos rojos marcados muestran la presencia y/o la localización de hemorragias gastrointestinales ocultas. Después de una inyección intravenosa de plaquetas marcadas con indio ( 111 In) administradas a individuos sanos, algunas son captadas rápidamente por el hígado y por el bazo debido al equilibrio con el pool celular marginal de dichos órganos. Las células residuales se mantienen en la circulación durante un período que viene determinado por la vida restante de las plaquetas. Aproximadamente el 30% de la dosis inyectada se distribuye inmediatamente en el bazo y aproximadamente el 10% en el hígado. La actividad restante se elimina de la circulación con una vida media de aproximadamente 4 días y se distribuye en el bazo (5%), el hígado (20%), la médula ósea (25%) y otros tejidos (10%). Normalmente, las plaquetas sobreviven en la sangre durante aproximadamente 9 días y después son destruidas en función de la edad, fundamentalmente en el bazo y la médula ósea. Los períodos de supervivencia cortos se asocian con varias patologías, como la trombocitopenia. Las plaquetas marcadas con indio ( 111 In) se acumularán también en sitios de formación activa de trombos y de rechazo inminente de un trasplante. El aclaramiento de la actividad de los leucocitos y plaquetas marcadas por el hígado y el bazo es muy lento. Además, la excreción de la actividad por la orina o las heces es muy baja. Es probable que la eliminación corporal se produzca principalmente a través de su desintegración a cadmio estable pero se asume que el aclaramiento corporal es análogo al del indio iónico (vida media de 70 días) para los cálculos de dosimetría Datos preclínicos sobre seguridad Se ha observado que las células sanguíneas marcadas con indio ( 111 In), preparadas utilizando indio ( 111 In) oxina, resultan viables después del marcaje y participan en la circulación celular corporal normal. Se han descrito algunas aberraciones cromosómicas en linfocitos humanos marcados con indio ( 111 In) oxina /10
6 Después del marcaje, se supone que la 8-hidroxiquinolina es liberada de las células marcadas, y que ésta y cualquier oxina de indio ( 111 In) que no haya reaccionado, serán eliminadas durante el procesamiento previo a la administración. Sin embargo, se han llevado a cabo estudios para demostrar que no se ha observado ningún signo de toxicidad que pudiera atribuirse a la administración cuando se administró indio ( 111 In) oxina (equivalente a 0,3 mg de oxina/kg) a ratas. 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Indio ( 111 In) oxina: Acetato de sodio (para ajuste de ph) Cloruro de sodio Cloruro de hierro (III) Ácido clorhídrico Agua para preparaciones inyectables Tampón Tris: Tris (hidroximetil) aminometano Ácido clorhídrico Agua para preparaciones inyectables 6.2 Incompatibilidades Este medicamento no debe mezclarse con otros excepto con los mencionados en la sección 6.6. El indio ( 111 In) oxina es un marcador inespecífico de las células sanguíneas y que en presencia de sangre total forma rápidamente transferrina marcada con indio ( 111 In). Por tanto, deben adoptarse precauciones en la preparación de las células sanguíneas aisladas que vayan a marcarse con el fin de asegurar la separación de las células sanguíneas no deseadas y de otras proteínas sanguíneas. 6.3 Periodo de validez El periodo de validez es de 24 horas a partir de la fecha y hora de calibración. La fecha de caducidad se indica en el embalaje exterior y en cada envase. 6.4 Precauciones especiales de conservación Antes de abrir el envase por primera vez: Conservar a temperatura entre 15ºC y 25ºC. El almacenamiento debe realizarse conforme a la normativa nacional sobre materiales radiactivos. 6.5 Naturaleza y contenido del envase Indio ( 111 In) oxina Mallinckrodt se suministra en viales monodosis de vidrio neutro tipo I de la Ph.Eur. de 10 ml, sellados con tapón de goma de bromobutilo recubierto de teflón y con sobresello de aluminio que contienen una actividad de 37 MBq en la fecha y hora de calibración. Se incluye 1 vial de vidrio neutro tipo I de la Ph. Eur., de 10 ml, sellado con tapón de goma de bromobutilo y con sobresello de aluminio amarillo que contiene 3 ml de solución tampón /10
7 Cada vial de Indio ( 111 In) oxina Mallinckrodt se coloca dentro de un contenedor plomado de espesor apropiado. 6.6 Precauciones especiales de eliminación y otras manipulaciones Los residuos radiactivos deben eliminarse conforme a la normativa nacional e internacional vigente. La eliminación del material no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. La administración de radiofármacos supone un riesgo para otras personas por la radiación externa o la contaminación por derrames de orina, vómitos, etc. Por lo tanto, deben adoptarse las medidas de protección radiológica conforme a la legislación nacional. Las extracciones deben realizarse en condiciones asépticas. El envase no debe abrirse. Tras desinfectarse el tapón, la solución debe extraerse a través del tapón utilizando una jeringa de un solo uso con blindaje protector adecuado y agujas estériles de un solo uso. Todo el material utilizado para el marcaje de una molécula con cloruro de indio ( 111 In) debe estar completamente limpio con el fin de garantizar que se encuentra libre de trazas de impurezas metálicas, porque el marcado radiactivo de macromoléculas con este precursor es muy susceptible a la presencia de dichas trazas. Sólo pueden utilizarse agujas con resistencia probada al ácido de dilución (p.ej. agujas no metálicas) con el fin de minimizar los niveles de trazas de impurezas metálicas. Es importantísimo el uso de cristal completamente limpio para evitar la introducción de trazas de impurezas que pueden interferir con el procedimiento de marcaje. Algunos plásticos pueden interferir por absorción de cantidades excesivas de actividad de indio ( 111 In). 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Mallinckrodt Spain S.L. World Trade Center Almeda Park. Plaça de la Pau s/n. Edificio 7, 3er piso Cornellá de Llobregat. España 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN 9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN Octubre FECHA DE LA REVISIÓN DEL TEXTO 11. DOSIMETRÍA La siguiente tabla muestra la dosimetría interna de la radiación calculada de acuerdo con la publicación nº 60 de la ICRP (International Commission on Radiological Protection Radiation) titulada Radiation Dose to Patients from Radiopharmaceuticals (addendum 1 de la publicación nº 53) y la publicación nº 80 de la ICRP titulada Radiation Dose to Patients from /10
8 Radiopharmaceuticals (addendum 2 de la publicación nº 53). Leucocitos marcados con Indio ( 111 In) oxina Dosis absorbida por unidad de actividad administrada (mgy/mbq) Órgano Adulto 15 años 10 años 5 años 1 año Glándulas adrenales 0,31 0,4 0,59 0,82 1,4 Vejiga 0,072 0,1 0,16 0,24 0,41 Superficies óseas 0,35 0,5 0,8 1,4 2,9 Mamas 0,09 0,09 0,15 0,23 0,39 Tracto gastrointestinal Estómago 0,28 0,33 0,49 0,68 1,1 Intestino delgado 0,16 0,19 0,29 0,43 0,71 Intestino grueso ascendente 0,16 0,19 0,3 0,47 0,78 Intestino grueso descendente 0,13 0,16 0,24 0,33 0,54 Corazón 0,17 0,21 0,3 0,43 0,73 Riñones 0,33 0,39 0,6 0,87 1,4 Hígado 0,71 0,88 1,3 1,8 3,2 Pulmones 0,16 0,21 0,31 0,46 0,81 Ovarios 0,12 0,17 0,24 0,35 0,56 Páncreas 0,52 0,61 0,91 1,3 2,1 Médula ósea roja 0,69 0,88 1,3 23 4,5 Bazo 5,5 7, Testículos 0,045 0,064 0,099 0,15 0,28 Tiroides 0,061 0,09 0,13 0,21 0,38 Útero 0,12 0,14 0,21 0,3 0,5 Resto del organismo 0,11 0,14 0,2 0,3 0,53 Dosis efectiva (msv/mbq) 0,59 0,79 1,2 1,8 3,2 Plaquetas marcadas con indio ( 111 In) oxina Dosis absorbida por unidad de actividad administrada (mgy/mbq) Órgano Adulto 15 años 10 años 5 años 1 año Glándulas adrenales 0,37 0,47 0,72 1,0 1,8 Vejiga 0,066 0,092 0,14 0,22 0,39 Superficies óseas 0,23 0,32 0,51 0,87 1,8 Mamas 0,1 0,11 0,18 0,29 0,49 Tracto gastrointestinal Estómago 0,35 0,41 0,6 0,83 1,4 Intestino delgado 0,14 0,17 0,27 0,42 0,74 Intestino grueso ascendente 0,14 0,18 0,29 0,47 0,8 Intestino grueso descendente 0,097 0,13 0,2 0,29 0,5 Corazón 0,39 0,48 0,71 1,0 1,8 Riñones 0,39 0,5 0,76 1,1 1,8 Hígado 0,41 0,91 1,3 1,9 3,4 Pulmones 0,73 0,36 0,55 0,85 1,5 Ovarios 0,28 0,13 0,2 0,31 0,53 Páncreas 0,098 0,75 1,1 1,6 2,6 Médula ósea roja 0,66 0,46 0,68 1,1 2,1 Bazo 7, Testículos 0,043 0,06 0,091 0,14 0,27 Tiroides 0,081 0,11 0,18 0,29 0,54 Útero 0,095 0,12 0,18 0,28 0,49 Resto del organismo 0,12 0,14 0,21 0,31 0,56 Dosis efectiva (msv/mbq) 0,7 0,93 1,4 2,1 3,7 La dosis efectiva resultante de la administración de una actividad de 30 MBq de leucocitos marcados /10
9 111 con indio ( In) oxina es de 17,7 msv (para un adulto de 70 kg de peso). La administración de 3 MBq de leucocitos marcados con indio ( 111 In) oxina a niños muy pequeños (de hasta 1 año de edad) supone una dosis absorbida por el bazo de 90 mgy y una dosis efectiva de 9,6 msv La dosis efectiva resultante de la administración de una actividad de 18,5 MBq de plaquetas marcadas con indio ( 111 In) oxina es de 13 msv (para un adulto de 70 kg de peso). La administración de 1,85 MBq de plaquetas marcadas con indio ( 111 In) oxina a niños muy pequeños (de hasta 1 año de edad) supone una dosis absorbida por el bazo de 76 mgy y una dosis efectiva de 6,8 msv El indio ( 114m In) puede encontrarse presente como impureza radionucleidica en el indio ( 111 In). Este isótopo tiene un periodo de desintegración más prolongado (49,5 días) que el indio ( 111 In) (2,8 días) y, por lo tanto, su contribución a la dosis de radiación será mayor con el tiempo. Las células sanguíneas marcadas con indio ( 111 In) preparadas mediante radiomarcaje con indio ( 111 In) oxina no deben administrarse en un periodo después de la fecha de referencia del indio ( 111 In) oxina con el fin de garantizar que el nivel de indio ( 114m In) presente sea inferior al 0,2%. La dosis efectiva equivalente de los leucocitos y las plaquetas marcados con indio ( 114m In) tal como aparece en el ICRP 53 es la siguiente: Dosis Efectiva Equivalente Adulto 15 años 10 años 5 años 1 año (msv/mbq) Leucocitos marcados con indio ( 114m In) 0,69 0,93 0,015 0,025 0,049 Plaquetas marcados con indio ( 114m In) 0,83 0,012 0,02 0,032 0,062 No hay datos disponibles en el ICRP 53 sobre la dosimetría de la radiación de hematíes marcados con indio ( 111 In). Sin embargo, basándose en la misma metodología, se ha calculado la siguiente dosis efectiva equivalente: Adulto 15 años 10 años 5 años 1 año Dosis Efectiva Equivalente 0,4 0,4 0,7 1,1 2,0 (msv/mbq) La dosis efectiva equivalente resultante de la administración de eritrocitos marcados con 18,5 MBq de indio ( 111 In) es de 7,4 msv. El indio ( 111 In) decae a cadmio ( 111 Cd) mediante captura electrónica con un período de semidesintegración de aproximadamente 67 horas (2,8 días) y emite radiación gamma con una energía principal de 172 kev (91%) y 246 kev (94%). También se emiten rayos X por conversión interna de 23 kev y 26 kev. 12. INSTRUCCIONES PARA LA PREPARACIÓN DE RADIOFÁRMACOS La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. Los procedimientos recomendados para la separación de las células sanguíneas y el radiomarcaje dependerán de las células utilizadas. Marcaje de leucocitos: 1. en jeringas de 50 ml añadir: 4,5 ml ACD (anticoagulante) /10
10 30 ml sangre 3 ml hidroxietil almidón 2. mezclar suavemente, dejar reposar verticalmente en un baño durante minutos 3. transferir plasma rico en plaquetas (PLRP) por sistema mariposa en tubos /viales estériles. Evitar la contaminación por eritrocitos 4. centrifugar el PLRP a g durante 5-10 minutos 5. retirar todo el plasma sobrenadante y transferir a tubos/viales estériles 6. resuspender el pellet celular en 2 ml de suero salino (tamponado, p.e. PBS) 6a. centrifugar el plasma sobrenadante a 1000 g durante 10 minutos 7 transferir el sobrenadante a un vial estéril 7a. añadir 0,4 ml de tampón Tris a 1 ml de indio oxina 8. incubar 4-37 MBq de indio ( 111 In) oxina durante 15 minutos con la suspensión celular 8a. acidificar el plasma a ph 6,5 (0,8 ml ACD por 10 ml de plasma) 9. añadir 5 ml de plasma-acd a la suspensión celular marcada 10. centrifugar a 170 g durante 5 minutos, guardar el sobrenadante para medir la actividad (=A) 11. resuspender en 2-5 ml plasma-acd y medir la actividad (=B) 12. calcular el porcentaje de marcaje (=B/A+B) Marcaje de trombocitos Recoger un volumen de 42,5 ml de sangre en 7,5 ml de ACD y centrifugar durante 15 minutos a 200 g. El plasma rico en plaquetas (PRP) sobrenadante es recogido con una jeringa y acidificado con ACD. 0,1 ml por ml de PRP. El PRP se centrífuga a 640 g. Después de retirar el plasma pobre en plaquetas (PPP) sobrenadante, el pellet es resuspendido en 3 ml de suero salino. Añadir 0,4 ml de tampón Tris a 1 ml de indio ( 111 In) oxina Marcar la suspensión de trombocitos con 4-37 MBq de indio ( 111 In) oxina. Incubar a temperatura ambiente durante 20 minutos. Una vez completada la incubación, el PPP se añade a un volumen de 5 ml y se mide la radiactividad. El Indio libre (no unido) se retira (como sobrenadante) por centrifugación a 1000 g durante 15 minutos. Los trombocitos son resuspendidos en 3 ml de PPP. El PPP se añade a un volumen de 5 ml y se mide la radiactividad de nuevo para el cálculo de la eficiencia de marcaje. La suspensión está ahora lista para inyección /10
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Citrato de galio ( 67 Ga) CIS bio international 74 MBq/ml solución inyectable Referencia: GA-67-MM-1 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Citrato de galio ( 67 Ga) CIS bio international 74 MBq/ml solución inyectable Referencia: GA-67-MM-1 2. COMPOSICIÓN
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
PENTACIS. 9,1 mg equipo de reactivos para preparación radiofarmacéutica FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 PENTACIS 9,1 mg equipo de reactivos para preparación radiofarmacéutica FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO T0615nF 02/2011 CIS bio international, member of IBA group 1. NOMBRE DEL
PENTACIS 9,1 mg equipo de reactivos para preparación radiofarmacéutica FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO T0615nF 02/2011 CIS bio international, member of IBA group 1. NOMBRE DEL
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Citrato de galio ( 67 Ga) Mallinckrodt 37 MBq/ml solución inyectable
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Citrato de galio ( 67 Ga) Mallinckrodt 37 MBq/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución inyectable contiene 37 MBq de citrato
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Citrato de galio ( 67 Ga) Mallinckrodt 37 MBq/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución inyectable contiene 37 MBq de citrato
- Como disolvente de medicamentos en polvo o liofilizados, previamente a su administración. - Como diluyente de soluciones y/o medicamentos.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Citrato de ytrio ( 90 Y) coloidal CIS bio international 37-370 MBq/ml suspensión inyectable 2. COMPOSICIÓN CUALI Y
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Citrato de ytrio ( 90 Y) coloidal CIS bio international 37-370 MBq/ml suspensión inyectable 2. COMPOSICIÓN CUALI Y
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
FICHA TECNICA O RESUMEN DE LAS CARACTERISTICAS DEP PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERISTICAS DEP PRODUCTO 1. NOMBRE DEL MEDICAMENTO Norcolesterol iodado ( 131 I) CIS bio international 7,5-15 MBq/ml solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y
FICHA TECNICA O RESUMEN DE LAS CARACTERISTICAS DEP PRODUCTO 1. NOMBRE DEL MEDICAMENTO Norcolesterol iodado ( 131 I) CIS bio international 7,5-15 MBq/ml solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. en la fecha y hora de calibración
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO DRYTEC 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA El nucleido padre se presenta como: Molibdato ( 99 Mo) de sodio 2,5-100GBq/generador
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO DRYTEC 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA El nucleido padre se presenta como: Molibdato ( 99 Mo) de sodio 2,5-100GBq/generador
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
4.2 Indicaciones de uso, especificando las especies a las que va destinado
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ioduro ( 131 I) de sodio CIS bio international 111 MBq/ml solución inyectable Referencia: I-131-S-2 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ioduro ( 131 I) de sodio CIS bio international 111 MBq/ml solución inyectable Referencia: I-131-S-2 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA 3. FORMA FARMACÉUTICA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Citrato de erbio ( 169 Er) CIS bio international 111 MBq/ml suspensión para inyección local Referencia: ERMM-1 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Citrato
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Citrato de erbio ( 169 Er) CIS bio international 111 MBq/ml suspensión para inyección local Referencia: ERMM-1 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Citrato
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HALOCUR 0,5 mg/ml solución oral para terneros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HALOCUR 0,5 mg/ml solución oral para terneros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
FICHA TÉCNICA. ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
Para la lista completa de excipientes, véase la sección Indicaciones de uso, especificando las especies de destino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
FICHA TÉCNICA. Por sobre: Acetato de calcio, 2,5 g (equivale a 635 mg de calcio), almidón de maíz, manitol (E421)
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Poulvac Marek CVI Suspensión y disolvente para suspensión inyectable para
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Poulvac Marek CVI Suspensión y disolvente para suspensión inyectable para
100 UI 80 mg 95% IgG
 1. NOMBRE DEL MEDICAMENTO IGANTIBE 200 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 100 UI/0,5 ml 600 UI/3 ml 1000 UI/5 ml Inmunoglobulina humana antihepatitis
1. NOMBRE DEL MEDICAMENTO IGANTIBE 200 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 100 UI/0,5 ml 600 UI/3 ml 1000 UI/5 ml Inmunoglobulina humana antihepatitis
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Dopacis 90 MBq/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Dopacis 90 MBq/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene 90 MBq de fluorodopa ( 18 F) en la fecha y hora de calibración. La
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Dopacis 90 MBq/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene 90 MBq de fluorodopa ( 18 F) en la fecha y hora de calibración. La
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. DECCOX 60 mg/g PREMEZCLA MEDICAMENTOSA PARA BOVINO Y OVINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DECCOX 60 mg/g PREMEZCLA MEDICAMENTOSA PARA BOVINO Y OVINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DECCOX 60 mg/g PREMEZCLA MEDICAMENTOSA PARA BOVINO Y OVINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene:
Ceretec Exametazima(D.C.I.)
 Ceretec Exametazima(D.C.I.) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Exametazima 0,5mg 3. FORMA FARMACEUTICA Polvo para inyección en vial. 4. DATOS CLINICOS 4.1 Indicaciones terapéuticas (i) (ii) La Exametazima
Ceretec Exametazima(D.C.I.) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Exametazima 0,5mg 3. FORMA FARMACEUTICA Polvo para inyección en vial. 4. DATOS CLINICOS 4.1 Indicaciones terapéuticas (i) (ii) La Exametazima
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO EDERAL 150 mg/ml SOLUCIÓN INYECTABLE PARA BOVINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de medicamento
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO EDERAL 150 mg/ml SOLUCIÓN INYECTABLE PARA BOVINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de medicamento
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
3. FORMA FARMACÉUTICA Solución oral. La solución es transparente, de color marrón y con olor característico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FERPLEX 40 mg Solución Oral 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada vial de 15 ml de solución oral contiene: Hierro proteinsuccinilato 800 mg, equivalente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FERPLEX 40 mg Solución Oral 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada vial de 15 ml de solución oral contiene: Hierro proteinsuccinilato 800 mg, equivalente
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. ANTISHMANIA 300 mg/ml solución inyectable para perros
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMACIÓN DEL MEDICAMENTO VETERINARIO ANTISHMANIA 300 mg/ml solución inyectable para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA (ES,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMACIÓN DEL MEDICAMENTO VETERINARIO ANTISHMANIA 300 mg/ml solución inyectable para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA (ES,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. FLUORSCAN 3000 MBq/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FLUORSCAN 3000 MBq/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene 3000 MBq de fludesoxiglucosa ( 18 F) en la fecha y hora de calibración.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FLUORSCAN 3000 MBq/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene 3000 MBq de fludesoxiglucosa ( 18 F) en la fecha y hora de calibración.
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
La osmolaridad calculada de la solución es de 307 mosm/l y el ph de 4,5-7,0. El contenido teórico en sodio y en cloruro es de 154 mmol/l.
 1. NOMBRE DEL MEDICAMENTO Fleboflex Salina Fisiológica Grifols Solución para perfusión Cloruro de sodio 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio (D.C.I.),
1. NOMBRE DEL MEDICAMENTO Fleboflex Salina Fisiológica Grifols Solución para perfusión Cloruro de sodio 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio (D.C.I.),
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
CENAVUL Suspensión inyectable
 Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO IMIZOL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO IMIZOL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO. URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Oncept IL-2 liofilizado y disolvente para suspensión inyectable para gatos. 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Oncept IL-2 liofilizado y disolvente para suspensión inyectable para gatos. 2. COMPOSICIÓN
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO MILTEFORAN 20 mg/ml SOLUCIÓN ORAL PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO MILTEFORAN 20 mg/ml SOLUCIÓN ORAL PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
PROSPECTO: INFORMACIÓN PARA EL USUARIO. CITICOLINA Normon 1000 mg solución inyectable EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PORCEPTAL 4 microgramos/ml Solución inyectable para porcino
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PORCEPTAL 4 microgramos/ml Solución inyectable para porcino
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DECCOX 60 mg/g Premezcla medicamentosa para bovinos y ovinos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DECCOX 60 mg/g Premezcla medicamentosa para bovinos y ovinos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio
Composición Líquido Elementos formes
 Composición Líquido Elementos formes Plasma Glóbulos blancos Glóbulos rojos Plaquetas Transporte de sustancias Homeostasis de los líquidos l corporales Protección TRANSPORTE O 2 desde los pulmones a los
Composición Líquido Elementos formes Plasma Glóbulos blancos Glóbulos rojos Plaquetas Transporte de sustancias Homeostasis de los líquidos l corporales Protección TRANSPORTE O 2 desde los pulmones a los
Olanzapina en polvo y disolvente para suspensión inyectable de liberación prolongada
 ZYPADHERA Olanzapina en polvo y disolvente para suspensión inyectable de liberación prolongada Instrucciones para la reconstitución y administración dirigido a Profesionales Sanitarios Información sobre
ZYPADHERA Olanzapina en polvo y disolvente para suspensión inyectable de liberación prolongada Instrucciones para la reconstitución y administración dirigido a Profesionales Sanitarios Información sobre
PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Flexicam 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Flexicam 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
FICHA TÉCNICA. VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable
 FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1.- DENOMINACIÓN DEL MEDICAMENTO VETERINARIO APSAMIX ZINC 1000 mg/g premezcla medicamentosa para porcino 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1.- DENOMINACIÓN DEL MEDICAMENTO VETERINARIO APSAMIX ZINC 1000 mg/g premezcla medicamentosa para porcino 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo
PROSPECTO: INFORMACIÓN PARA EL USUARIO. ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
PROSPECTO: INFORMACIÓN PARA EL USUARIO ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS ND CLONE 30 Liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS ND CLONE 30 Liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. ÓXIDO DE ZINC CALIER 1000 mg/g PREMEZCLA MEDICAMENTOSA PARA CERDOS
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ÓXIDO DE ZINC CALIER 1000 mg/g PREMEZCLA MEDICAMENTOSA PARA CERDOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ÓXIDO DE ZINC CALIER 1000 mg/g PREMEZCLA MEDICAMENTOSA PARA CERDOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
DANAGENE BLOOD DNA KIT
 Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
Prospecto: información para el usuario. Atosiban SUN 6,75 mg/0,9 ml solución inyectable EFG. atosiban
 Prospecto: información para el usuario Atosiban SUN 6,75 mg/0,9 ml solución inyectable EFG atosiban Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque contiene información
Prospecto: información para el usuario Atosiban SUN 6,75 mg/0,9 ml solución inyectable EFG atosiban Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque contiene información
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Lactofilus polvo oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lactofilus polvo oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por gramo: Principio activo: Lactobacilos acidófilos 120 millones de unidades formadoras
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lactofilus polvo oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por gramo: Principio activo: Lactobacilos acidófilos 120 millones de unidades formadoras
PROSPECTO. CEFTRIAXONA REIG JOFRÉ 1 g IM. Polvo y disolvente para solución inyectable. E.F.G. Ceftriaxona (D.C.I.)
 PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Levocabastina (como hidrocloruro) equivalente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Levocabastina (como hidrocloruro) equivalente
FICHA TÉCNICA. Albutein 5% es una solución que contiene 50 g/l de proteína total, de las cuales al menos un 95% es albúmina humana.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Albutein 5% solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Albutein 5% es una solución que contiene 50 g/l de proteína total,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Albutein 5% solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Albutein 5% es una solución que contiene 50 g/l de proteína total,
FICHA TÉCNICA. Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA. Equipo reactivo para la preparación de una suspensión inyectable de macroagregados de albúmina humana y de tecnecio ( 99m Tc)
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO TECHNESCAN LYOMAA Equipo reactivo para la preparación de una suspensión inyectable de macroagregados de albúmina humana y de tecnecio ( 99m Tc) 2. COMPOSICIÓN
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO TECHNESCAN LYOMAA Equipo reactivo para la preparación de una suspensión inyectable de macroagregados de albúmina humana y de tecnecio ( 99m Tc) 2. COMPOSICIÓN
Enfermedad de Kawasaki
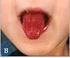 www.printo.it/pediatric-rheumatology/ar/intro Enfermedad de Kawasaki Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? El diagnóstico de la enfermedad de Kawasaki se realiza en base
www.printo.it/pediatric-rheumatology/ar/intro Enfermedad de Kawasaki Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? El diagnóstico de la enfermedad de Kawasaki se realiza en base
Este medicamento contiene pequeñas cantidades de etanol (alcohol), máximo 2,5 g/l. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO GLUSCAN 500 MBq/ml, solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de la solución inyectable contiene 500 MBq de fludesoxiglucosa ( 18 F) en la fecha y hora
1. NOMBRE DEL MEDICAMENTO GLUSCAN 500 MBq/ml, solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de la solución inyectable contiene 500 MBq de fludesoxiglucosa ( 18 F) en la fecha y hora
ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO
 Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
WITNESS RELAXIN (plasma, serum) RLX RLX u d 9 n n ersio V X RLX L R -W IO B S
 WITNESS RELAXIN (plasma, serum) SBIO-W Version n 9 du 28.07.2010 WITNESS RELAXIN WITNESS RELAXIN GENERALIDADES El kit WITNESS RELAXIN permite diagnosticar la gestación en la perra y en la gata, y permite
WITNESS RELAXIN (plasma, serum) SBIO-W Version n 9 du 28.07.2010 WITNESS RELAXIN WITNESS RELAXIN GENERALIDADES El kit WITNESS RELAXIN permite diagnosticar la gestación en la perra y en la gata, y permite
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 64 mg de magnesio (en forma de 550 mg de cloruro de magnesio,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 64 mg de magnesio (en forma de 550 mg de cloruro de magnesio,
FICHA TECNICA. (1) Equivalente a 185,2 mg de hidróxido de magnesio.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION Por 5 ml: Principios activos: Gel de hidróxido alumínico... 350 mg Hidróxido magnésico... 20 mg Por comprimido: Principio activo: Hidróxido alumínico...
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION Por 5 ml: Principios activos: Gel de hidróxido alumínico... 350 mg Hidróxido magnésico... 20 mg Por comprimido: Principio activo: Hidróxido alumínico...
LABORATORIOS NORMON, S.A.
 1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO GLUSCAN 500 MBq/ml solución inyectable, Fludesoxiglucosa ( 18 F)
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO GLUSCAN 500 MBq/ml solución inyectable, Fludesoxiglucosa ( 18 F) 1 NOMBRE DEL MEDICAMENTO GLUSCAN 500 MBq/ml solución inyectable 2 COMPOSICIÓN CUALITATIVA Y
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO GLUSCAN 500 MBq/ml solución inyectable, Fludesoxiglucosa ( 18 F) 1 NOMBRE DEL MEDICAMENTO GLUSCAN 500 MBq/ml solución inyectable 2 COMPOSICIÓN CUALITATIVA Y
FICHA TÉCNICA. KETOISDIN 400 mg óvulos está indicado en adultos para el tratamiento local de
 1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Tekcis 2-50 GBq generador de radionucleido 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tekcis 2-50 GBq generador de radionucleido 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La inyección de pertecnetato ( 99m Tc) de sodio se produce por medio del generador
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tekcis 2-50 GBq generador de radionucleido 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La inyección de pertecnetato ( 99m Tc) de sodio se produce por medio del generador
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
 INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1. NOMBRE DEL MEDICAMENTO Disolgas 257,5 mg cápsulas blandas 2. PRINCIPIO(S) ACTIVO(S) 3. LISTA DE EXCIPIENTES Amarillo anaranjado S (E 110), azorrubina
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1. NOMBRE DEL MEDICAMENTO Disolgas 257,5 mg cápsulas blandas 2. PRINCIPIO(S) ACTIVO(S) 3. LISTA DE EXCIPIENTES Amarillo anaranjado S (E 110), azorrubina
Medicina nuclear. Recomendaciones del ICRP 84. Di Trano, J.L.
 Medicina nuclear Recomendaciones del ICRP 84 Di Trano, J.L. Presentado en las Jornadas de la Sociedad Argentina de Radioprotección sobre Exposición Prenatal a las Radiaciones Ionizantes, Buenos Aires,
Medicina nuclear Recomendaciones del ICRP 84 Di Trano, J.L. Presentado en las Jornadas de la Sociedad Argentina de Radioprotección sobre Exposición Prenatal a las Radiaciones Ionizantes, Buenos Aires,
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO GLUSCAN 500 MBq/ml solución inyectable, Fludesoxiglucosa ( 18 F)
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO GLUSCAN 500 MBq/ml solución inyectable, Fludesoxiglucosa ( 18 F) 1 NOMBRE DEL MEDICAMENTO GLUSCAN 500 MBq/ml solución inyectable 2 COMPOSICIÓN CUALITATIVA Y
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO GLUSCAN 500 MBq/ml solución inyectable, Fludesoxiglucosa ( 18 F) 1 NOMBRE DEL MEDICAMENTO GLUSCAN 500 MBq/ml solución inyectable 2 COMPOSICIÓN CUALITATIVA Y
FORMULARIO PARA EL REGISTRO DE INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR MÉTODOS BIOTECNOLÓGICOS
 FORMULARIO PARA EL REGISTRO DE INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR MÉTODOS BIOTECNOLÓGICOS FORMULARIO DE INSCRIPCIÓN PARA INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR VIA BIOTECNOLÓGICA. FECHA: 1.- NOMBRE
FORMULARIO PARA EL REGISTRO DE INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR MÉTODOS BIOTECNOLÓGICOS FORMULARIO DE INSCRIPCIÓN PARA INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR VIA BIOTECNOLÓGICA. FECHA: 1.- NOMBRE
FICHA TÉCNICA. La dosis debe ajustarse según los requerimientos individuales de agua y electrolitos:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Suero Fisiológico Vitulia 0,9 % solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición Principio Activo Cloruro de sodio Por 100 ml 0,9 g
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Suero Fisiológico Vitulia 0,9 % solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición Principio Activo Cloruro de sodio Por 100 ml 0,9 g
PROSPECTO: INFORMACIÓN PARA EL USUARIO GLUSCAN 500 MBq/ml Soluciόn inyectable, Fludesoxiglucosa ( 18 F)
 PRSPECT: INFRMACIÓN PARA EL USUARI GLUSCAN 500 MBq/ml Soluciόn inyectable, Fludesoxiglucosa ( 18 F) Lea todo el prospecto detenidamente antes de que va a ser administrado este medicamento, porque contiene
PRSPECT: INFRMACIÓN PARA EL USUARI GLUSCAN 500 MBq/ml Soluciόn inyectable, Fludesoxiglucosa ( 18 F) Lea todo el prospecto detenidamente antes de que va a ser administrado este medicamento, porque contiene
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA
