EGFR pharmdx. Nº de catálogo K pruebas para uso en el Dako Autostainer Edición 05/2015. Uso previsto Para uso en diagnóstico in vitro.
|
|
|
- Adolfo Caballero Ávila
- hace 5 años
- Vistas:
Transcripción
1 EGFR pharmdx Nº de catálogo K pruebas para uso en el Dako Autostainer Edición 05/2015 Uso previsto Para uso en diagnóstico in vitro. El ensayo EGFR pharmdx es un kit inmunohistoquímico (IHQ) para identificar la expresión del receptor del factor de crecimiento epidérmico (EGFR) en tejidos normales y neoplásicos fijados de la forma habitual para su evaluación histológica. EGFR pharmdx detecta específicamente la proteína EGFR (HER1) en células que expresan el EGFR. EGFR pharmdx está indicado como una ayuda en la identificación de pacientes con cáncer colorrectal con criterios para recibir tratamiento con ERBITUX (cetuximab) o Vectibix (panitumumab). Resumen y explicación Introducción El receptor del factor de crecimiento epidérmico es un receptor transmembranal de 170 kd codificado por el gen HER1 humano. La proteína EGFR contiene un dominio extracelular de unión al ligando, una región transmembranal y un dominio intracelular con actividad tirosinquinasa intrínseca. La proteína EGFR es homóloga a otros miembros de la familia erbb/receptor EGF entre los que se incluyen el HER2/erbB2 o neu, HER3/erbB3 y HER4/erbB4 1,2. Una variedad de células normales expresa la proteína EGFR entre las que se incluyen muchos tipos de células epiteliales y tumores derivados de estos tipos celulares 3-9. Entre los tipos celulares no epiteliales que expresan el EGFR se incluye: músculo liso, fibroblastos y nervio 10. Especificidad Mouse monoclonal anti-human EGFR, clon 2-18C9 se proporciona como sobrenadante de cultivo de tejido hibridoma obtenido de un ratón inmunizado con EGFR inmunoprecipitado de la línea de células A431 (carcinoma de epidemoide humana). Los estudios de mapeo de epítopos indican que el anticuerpo reconoce un epítopo en la zona extracelular rica en cisteína del subdominio S2 de la molécula, y proximal al dominio transmembranal. Un mapeo más detallado de los aminoácidos críticos indica que el epítopo es conformacional y depende del puente de disulfido en la molécula nativa 11. Se ha demostrado que este clon de anticuerpo monoclonal no tiene una reacción cruzada con HER2, HER3 ni HER4, ni con el vector tag, myc. La tinción citoplásmica es común. Sin embargo, la prueba debe repetirse si una tinción citoplásmica significativa dificulta la lectura de la tinción diagnóstica de la membrana y la interpretación de los resultados. Principio del procedimiento El kit EGFR pharmdx IHC contiene reactivos necesarios para completar un procedimiento de tinción IHQ de muestras incluidas en parafina, fijadas de la forma habitual. Tras la incubación con el anticuerpo monoclonal primario anti-proteína EGFR humana, clon 2-18C9, este kit utiliza un reactivo de visualización listo para usar basado en la tecnología del dextrano. Este reactivo está compuesto por moléculas de anticuerpo secundario de cabra anti-ratón y moléculas de peroxidasa de rábano unidas a un esqueleto del polímero de dextrano común, eliminando así la necesidad de la aplicación secuencial de conjugado de peroxidasa y anticuerpo de enlace. La conversión enzimática del cromógeno añadido posteriormente produce la formación de un producto de la reacción visible en la zona del antígeno. La muestra puede contrateñirse y ponerse en un cubreobjetos. Los resultados se interpretan con un microscopio óptico. Se suministran portaobjetos de control que contienen dos líneas de células humanas incluidas en parafina, fijadas en formol, con una valoración de la intensidad de tinción de 2+ y 0 para control de calidad de la eficacia del reactivo del kit. Reactivos El nº de catálogo K1494 es para tinción automática con el DAKO Autostainer. Los materiales indicados son suficientes para 50 pruebas (50 portaobjetos incubados con anticuerpo primario anti-proteína EGFR y 50 portaobjetos incubados con el reactivo de control negativo correspondiente). El número de pruebas está basado en el uso del protocolo de EGFR pharmdx Autostainer con todos los reactivos listos para usar. El kit contiene material suficiente para un máximo de 10 ciclos de tinción individuales. ( ) P04036ES_01/K1494/ p. 1/14
2 Material suministrado Cantidad Descripción 2x11 ml Proteinase K < 0,1 % Enzima proteolítica Proteinase K diluida en un tampón Tris-HCl que contiene azida sódica 0,015 mol/l. 2x11 ml Peroxidase Block Peróxido de hidrógeno al 3 %. 1x12 ml EGFR pharmdx Monoclonal Mouse IgG 1 Antibody Sobrenadante de cultivo de tejido de anticuerpo de ratón anti EGFR humana (clon 2-18C9) IgG 1, en un tampón Tris-HCl, que contiene proteína estabilizante y 0,015 mol/l de azida sódica. 1x11 ml Mouse IgG 1 Negative Control Reagent Sobrenadante de cultivo de tejido de anticuerpo de IgG 1 monoclonal de ratón en un tampón Tris-HCl, que contiene proteína estabilizante y 0,015 mol/l de azida sódica. 2x11 ml Labelled Polymer, HRP Polímero de dextrano conjugado con peroxidasa de rábano e inmunoglobulinas de cabra anti-ratón aisladas por afinidad. Se suministra en tampón Tris-HCl que contiene proteína estabilizante y un antibiótico. 10x11 ml DAB+ Substrate Buffer Solución de tampón sustrato, ph 7,5 que contiene <0,1 % peróxido de hidrógeno, estabilizantes, estimuladores y un antibiótico. 2x3 ml Liquid DAB+ Chromogen 5 % 3,3'-diaminobenzidina en solución cromogénica. 2x1 l Wash Buffer 10x Solución salina tamponada con tampón Tris que contiene Tween 20, ph 7,6. 2x5 portaobjetos EGFR pharmdx Control Slides Cada portaobjetos contiene cortes de dos líneas celulares humanas en forma de sedimento, fijadas en formol e incluidas en parafina, que representan un nivel moderado de expresión de la proteína EGFR y ninguna expresión de EGFR. Las intensidades de tinción IHQ de los sedimentos celulares son 2+ y 0. Línea de células: CAMA-1 Nivel de expresión: 0 Línea de células: HT-29 Nivel de expresión: 2+ ( ) P04036ES_01/K1494/ p. 2/14
3 Material necesario pero no suministrado Hidróxido de amonio, 15 mol/l diluido hasta 0,037 mol/l. Contratinción: Hematoxilina, alcohólica o basada en agua, como Hematoxylin de Dako (nº de catálogo S3302) o Automation Hematoxylin de Dako (nº de catálogo S3301) Cubreobjetos Agua destilada o desionizada (agua de grado reactivo) Horno de secado, capaz de mantener una temperatura de C Etanol, puro y al 95% Microscopio óptico (objetivo de 4x 40x aumentos) Medio de montaje, como Faramount de Dako (nº de catálogo S3025) o Glycergel de Dako (nº de catálogo C0563), o Ultramount de Dako (nº de catálogo S1964) Tejidos positivo y negativo para utilizar como controles del proceso (véase Control de calidad ) Portaobjetos, SuperFrost Plus de Fisher, portaobjetos recubiertos de poli-l-lisina, portaobjetos cargados o Silanized Slides de Dako (nº de catálogo S3003) (véase Preparación de las muestras ) Baños o recipientes de tinción Cronómetro (capaz de medir intervalos de 2 30 minutos) Frasco de lavado Xileno, tolueno o sustitutos de xileno Pipeta de 1 ml Dako Autostainer Universal Staining System (nº de catálogo S3400) o Autostainer Plus (nº de catálogo S3800) con software Dako Autostainer, versión o superior (Consulte la Guía del usuario del Dako Autostainer para ver los componentes necesarios). Nota: Todos los reactivos incluidos o comercializados por separado como Wash Buffer de Dako (nº de catálogo S3006) están formulados específicamente para utilizarse con esta prueba. Para realizar la prueba según lo especificado, no puede hacerse ninguna sustitución. Preparación de las muestras Las muestras de biopsia deben manipularse de forma que se conserve el tejido para su tinción IHQ. Deben utilizarse los métodos habituales de procesamiento del tejido para todas las muestras 13. Las muestras conservadas en formol neutro tamponado al 10% (v/v), formol sin tamponar al 10% (v/v), formol sin tamponar al 25% (v/v), AFA (alcohol formol acético), Pen-fix de Richard-Allen Scientific y fijador de Bouin pueden analizarse con EGFR pharmdx. Los tejidos fijados en PreFer de Anatech no son adecuados para analizar con EGFR pharmdx. El uso de EGFR pharmdx con tejidos fijados con PreFer resulta en una conservación no satisfactoria de la morfología, y puede generar resultados equívocos 14. Cortes incluidos en parafina Está indicado el uso de tejidos incluidos en parafina y procesados de la forma habitual. Las muestras de la biopsia deben colocarse en bloques de un espesor de 3 ó 4 mm y fijarse durante el período correspondiente al fijador. A continuación, los tejidos son deshidratados y secados en una serie de alcoholes y xileno, seguido por infiltración mediante parafina fundida. La temperatura de la parafina no debe superar los 60 C. Los bloques de tejido incluidos y fijados adecuadamente que expresen la proteína EGFR, se podrán mantener indefinidamente antes de cortarse y montarse en portaobjetos si se conservan en un lugar frío (15 25 C) 13,15. Las muestras de tejido deben cortarse en secciones de 3 5 µm. Después de cortarlo, los tejidos deben montarse en portaobjetos y colocarse en rejillas de secado. Se recomiendan los siguientes portaobjetos: Portaobjetos SuperFrost Plus de Fisher, Silanized Slides de Dako (nº de catálogo S3003), cargados o recubiertos de poli-l-lisina. Las rejillas de portaobjetos deben sacudirse suavemente en una toalla absorbente para eliminar el agua atrapada debajo de la parafina y el cristal, después deben secarse a temperatura ambiente durante una hora, secándolos durante una hora más en un incubador a ºC. Cualquier resto de agua en los portaobjetos después de su eliminación con el incubador, debe eliminarse sacudiendo los portaobjetos en una toalla y secándolos durante una hora más en el incubador. Después de sacar los portaobjetos del incubador, deben mantenerse a temperatura ambiente hasta que se enfríen y la parafina se haya endurecido. Para conservar la antigenicidad, los cortes de tejido, montados en portaobjetos (SuperFrost Plus de Fisher, portaobjetos con poli-l-lisina, cargados o Silanized Slides de Dako (nº de catálogo S3003), deben teñirse dentro de un período de 2 meses tras ser cortados si se mantienen a temperatura ambiente (20 25 C) 14 (consulte el manual de Dako: Immunochemical Staining Methods 16 o las referencias 13 y 15, para obtener más detalles sobre la preparación de las muestras). El uso de esta prueba en tejidos descalcificados no ha sido validado, por lo que no puede recomendarse. Los portaobjetos necesarios para la evaluación EGFR y verificación de presencia de tumores, deben prepararse al mismo tiempo. Se recomienda un mínimo de 5 portaobjetos, uno para determinar la presencia de tumores, dos para evaluar la proteína EGFR (uno para el anticuerpo primario y otro para el reactivo de control negativo), y dos de seguridad. ( ) P04036ES_01/K1494/ p. 3/14
4 Precauciones 1. Para usuarios profesionales. 2. Este producto contiene azida sódica (NaN 3), un compuesto químico altamente tóxico en su forma pura. Aunque a las concentraciones del producto no está clasificado como peligroso, las acumulaciones de NaN 3 pueden reaccionar con cañerías de plomo y cobre formando azidas metálicas altamente explosivas. Después de desecharlo, deje correr abundante cantidad de agua para evitar acumulaciones de azida en las cañerías Al igual que con cualquier producto derivado de fuentes biológicas, deberán aplicarse procedimientos adecuados al manejar las muestras y los reactivos. 4. Minimice la contaminación microbiana de los reactivos para evitar una tinción inespecífica. 5. El uso de tiempos de incubación, temperaturas o métodos diferentes a los especificados puede producir resultados erróneos. 6. Los reactivos están diluidos de forma óptima. Una dilución mayor puede provocar la pérdida de tinción del antígeno. 7. No intercambie anticuerpos primarios o reactivos de control negativo con otros de lotes de fabricación diferentes (los números de lote aparecen en las etiquetas de los viales), ni con reactivos de otros fabricantes. 8. El polímero marcado, Liquid DAB+ Chromogen y la solución DAB+ Substrate-Chromogen preparada pueden verse afectados de forma negativa si se exponen a niveles excesivos de luz. No almacene los componentes del sistema ni realice tinciones en presencia de luz intensa, como la luz solar directa. 9. Utilice el equipo adecuado para protección personal a fin de evitar el contacto con los ojos y la piel 18. La solución no utilizada debe desecharse con arreglo a las normativas locales, provinciales y nacionales. 10. Puede solicitar la hoja de datos de seguridad que se encuentra disponible para usuarios profesionales. 11. Como norma general, no se permite a los menores de 18 años utilizar este producto. Los usuarios deben ser instruidos meticulosamente en los procedimientos laborales adecuados, las propiedades peligrosas del producto y las instrucciones de seguridad necesarias. Consulte la ficha de datos de seguridad para obtener más información. Peligro DAB+ Chromogen: 1-5% biphenyl-3,3',4,4'-tetrayltetraammonium tetrachloride H350 Puede provocar cáncer. H341 Se sospecha que provoca defectos genéticos. P201 Procurarse las instrucciones antes del uso. P202 No manipular antes de haber leído y comprendido todas las precauciones de seguridad. P281 Utilizar el equipo de protección individual obligatorio. P308 + P313 EN CASO DE exposición manifiesta o presunta: Consultar a un médico. P405 Guardar bajo llave. P501 Eliminar el contenido y el recipiente de acuerdo con las normativas locales, regionales, nacionales e internacionales. Atención Wash Buffer (10X): 5-10% Sodium chloride, 5-10% 2-Amino-2-(hydroxymethyl)propane-1,3-diol hydrochloride H319 Provoca irritación ocular grave. P280 Llevar guantes de protección. Llevar gafas o máscara de protección. Llevar prendas de protección. P264 Lavarse las manos cuidadosamente después de la manipulación. P305 + P351 + P338 EN CASO DE CONTACTO CON LOS OJOS: Enjuagar con agua cuidadosamente durante varios minutos. Quitar las lentes de contacto cuando estén presentes y pueda hacerse con facilidad. Proseguir con el lavado. P337 + P313 Si la irritación ocular persiste, consultar a un médico. Almacenamiento Almacene el sistema EGFR pharmdx entre 2 y 8 ºC. Los portaobjetos de control también deben almacenarse entre 2 y 8 ºC. La Substrate-Chromogen Solution (DAB) preparada permanece estable durante aproximadamente 5 días cuando se almacena entre 2 y 8 C. No utilice el kit después de la fecha de caducidad impresa en la parte externa del envase. No hay signos obvios que indiquen la inestabilidad de este producto, por lo que los controles positivo y negativo deben ejecutarse simultáneamente con las muestras de pacientes. Si los reactivos se almacenan bajo condiciones diferentes a las especificadas en el prospecto del envase, dichas condiciones deben ser validadas por el usuario 12. Instrucciones de uso Preparación de los reactivos Los siguientes reactivos deben prepararse antes de la tinción: Solución de tampón de lavado Prepare una cantidad suficiente de tampón de lavado diluyendo tampón de lavado 10x en una proporción 1:10 con agua destilada o desionizada (agua de grado reactivo) para los pasos de lavado. Deseche el tampón si está turbio. Substrate-Chromogen Solution (DAB+) ( ) P04036ES_01/K1494/ p. 4/14
5 Esta solución debe mezclarse bien antes de usar. Cualquier precipitado que se desarrolle en la solución no afecta a la calidad de la tinción. Para preparar la solución DAB+ Substrate-Chromogen, añada 11 gotas de Liquid DAB+ Chromogen a un vial de DAB+ Substrate Buffer y mézclelo. Deseche la solución no utilizada. Nota importante: El color del Liquid DAB+ Chromogen en el frasco puede variar de transparente a color marrón-lavanda claro. Esto no afectará a la eficacia de este producto. Diluya según las indicaciones anteriores. La adición de un exceso de Liquid DAB+ Chromogen al DAB+ Substrate Buffer causará el deterioro de la señal positiva. Contratinción Prepare el agua amoniacal para teñir de azul la contratinción si es necesario. El agua amoniacal (0,037 mol/l) se prepara mezclando 2,5 (±0,5) ml de hidróxido de amoniaco 15 mol/l (concentrado) con 1 litro de agua de grado reactivo. El agua amoniacal 0,037 mol/l no utilizada puede almacenarse a temperatura ambiente (20 25 C) en un frasco herméticamente cerrado durante un máximo de 12 meses. Medio de montaje Se recomiendan medios de montaje como Faramount Aqueous Mounting Medium, Ready-to-use de Dako (nº de catálogo S3025) o Glycergel Mounting Medium de Dako (nº de catálogo C0563) para el montaje acuoso. Licúe Glycergel calentándolo a aproximadamente 40 (±5) C antes de usar. También puede utilizarse medio de montaje permanente, no acuoso, como Ultramount de Dako (nº de catálogo S1964). Procedimiento de tinción en el Dako Autostainer Notas sobre el procedimiento El usuario debe leer atentamente estas instrucciones y familiarizarse con todos los componentes antes de utilizarlos (véase Precauciones ). Consulte DAKO Autostainer, Universal Staining System, User Guide. Todos los reactivos deben equilibrarse a temperatura ambiente (20 25 C) antes de la inmunotinción. As imismo, todas las incubaciones deben realizarse a temperatura ambiente. No deje que los cortes de tejido se sequen durante el procedimiento de tinción. Los cortes de tejido secos pueden presentar un aumento de tinción inespecífica. Eliminación de la parafina y rehidratación Antes de la tinción, los portaobjetos de tejido deben desparafinarse para eliminar el medio de inclusión y volverse a hidratar. Trate de no dejar restos de parafina. El medio residual de inclusión producirá un aumento de la tinción inespecífica. PASO 1. Coloque los portaobjetos en un baño con xileno e incube durante 5 (±1) minutos. Cambie los baños y repita el paso una vez más. PASO 2. Elimine el exceso de líquido y coloque los portaobjetos en etanol puro durante 3 (±1) minutos. Cambie los baños y repita el paso una vez más. PASO 3. Elimine el exceso de líquido y coloque los portaobjetos en etanol al 95 % durante 3 (±1) minutos. Cambie los baños y repita el paso una vez más. PASO 4. Elimine el exceso de líquido y coloque los portaobjetos en agua de grado reactivo durante 5 (±1) minutos. PASO 5. Elimine el exceso de líquido y coloque los portaobjetos en tampón de lavado. Empiece el procedimiento de tinción como se indicó en la sección Protocolo de tinción. Las soluciones de xileno y alcohol deben cambiarse después de 40 portaobjetos. En lugar de xileno, pueden utilizarse sustitutos del tolueno y del xileno, como Histoclear. EGFR pharmdx incluye el tratamiento previo por medio de un paso de digestión con una enzima proteolítica. Los cortes de tejido pueden en ocasiones haberse digerido excesivamente, causando la disociación de las membranas celulares y de la arquitectura global del tejido. Realice el ensayo prestando atención a la duración del paso de digestión proteolítica. Nota: Si la digestión excesiva es un problema constante, los tejidos fijados en formol tamponado neutro al 10% pueden fijarse posteriormente en formol tamponado neutro al 10% durante 10 minutos después de la eliminación de la parafina. Vea el siguiente procedimiento: Procedimiento de posfijación 1. Desparafine los cortes y sumérjalos en agua de grado reactivo. 2. Sumerja los portaobjetos en formol tamponado neutro al 10 % durante 10 minutos. 3. Lave los portaobjetos dos veces en agua desionizada o destilada. 4. Continúe con el procedimiento de tinción EGFR pharmdx. Protocolo de tinción automática Consulte DAKO Autostainer, Universal Staining System, User Guide. PASO 1. Seleccione el protocolo y programe el ciclo de tinción. PASO 2. Utilice programas automáticos para configurar el programa e inicie el programa de EGFR pharmdx. PASO 3. Coloque los viales de reactivo en la rejilla de reactivo DAKO Autostainer, de acuerdo con el mapa de reactivos generado por el ordenador. PASO 4. Cargue los portaobjetos en el DAKO Autostainer de acuerdo con el mapa de portaobjetos generado por el ordenador. PASO 5. Inicie el ciclo. PASO 6. Retire los portaobjetos del DAKO Autostainer. ( ) P04036ES_01/K1494/ p. 5/14
6 Proceda con la contratinción y el montaje. Nota: Aclare los portaobjetos en agua de grado reactivo después del paso en la solución DAB+ Substrate-Chromogen. (El equipo DAKO Autostainer, versiones 02 y 03 lava los portaobjetos en agua de grado reactivo después del paso con sustrato-cromógeno. La versión 01 del equipo DAKO Autostainer lava los portaobjetos en tampón. Por lo tanto, los portaobjetos que se tiñen en el equipo 01 deben lavarse con agua de grado reactivo después de sacarlos del Autostainer.) Figura 1. Tabla para programación del Autostainer Representación del ciclo de programa en el DAKO Autostainer. La tabla de programación (arriba) es una plantilla del protocolo maestro que contiene elementos del protocolo para ejecutar todos los sistemas de detección junto con el kit EGFR pharmdx. En esta tabla de ejemplo sólo se muestran los reactivos EGFR. Contratinción (instrucciones para Hematoxylin) El producto final coloreado de la reacción de tinción es insoluble en alcohol y en agua. Puede utilizarse hematoxilina, basada en alcohol o en agua como Hematoxylin de Dako (nº de catálogo S3302) o Automation Hematoxylin de Dako (nº de catálogo S3301). No utilice contratinciones regresivas. PASO 1. Retire los portaobjetos del Dako Autostainer y realice la contratinción en hematoxilina como se describe a continuación. PASO 2. Sumerja los portaobjetos en un baño de hematoxilina. Incube durante 2 5 minutos, en función de la concentración de hematoxilina utilizada. PASO 3. Aclare suavemente en un baño con agua de grado reactivo. Asegúrese de que se han eliminado todos los restos de hematoxilina. Opcional: Sumerja los portaobjetos 10 veces en un baño de agua amoniacal 0,037 mol/l (véase Preparación de los reactivos ). No se necesita el paso con agua amoniacal cuando se utiliza Hematoxylin de Dako (nº de catálogo S3302) o Automation Hematoxylin de Dako (nº de catálogo S3301). Nota: Se recomienda encarecidamente el uso de Automation Hematoxylin de Dako (nº de catálogo S3301). Después de un período de incubación de 5 minutos, esta contratinción genera un producto final azul o púrpura claro que no oscurece la inmunotinción específica. Una contratinción fuerte puede enmascarar la expresión débil de EGFR. PASO 4. Aclare suavemente en un baño con agua de grado reactivo durante 2 5 minutos. Montaje Se recomiendan medios de montaje como Faramount Aqueous Mounting Medium, listo para usar de Dako (nº de catálogo S3025) o Glycergel Mounting Medium de Dako (nº de catálogo C0563) para el montaje acuoso. Licúe Glycergel calentándolo a aproximadamente 40 (±5) C antes de usar. También puede utilizarse medio de montaje permanente, no acuoso, como Ultramount de Dako (nº de catálogo S1964). Nota: Los portaobjetos pueden leerse cuando sea necesario. Sin embargo, puede producirse alguna decoloración si los portaobjetos se cubren con un cubreobjetos con medio de montaje acuoso y se exponen a luz intensa. Para minimizar la decoloración, almacene los portaobjetos en la oscuridad a temperatura ambiente (20 25 C). ( ) P04036ES_01/K1494/ p. 6/14
7 Control de calidad Las desviaciones de los procedimientos recomendados para la fijación, inclusión y procesamiento del tejido en el laboratorio del usuario pueden producir una variabilidad importante de los resultados, necesitándose un uso regular de los controles en cada laboratorio además de los portaobjetos de control suministrados por Dako. En EE.UU., consulte las pautas de control de calidad del programa de certificación del College of American Pathologists (CAP) Certification Program for Immunohistochemistry (Colegio de Patólogos Americanos (CAP) para inmunohistoquímica). Véase también la directriz Quality Assurance for Immunocytochemistry Approved Guideline 19 del CLSI (Garantía de calidad del CLSI para las directivas aprobadas para inmunohistoquímica) y las referencias 20 23, para obtener información adicional. Portaobjetos de control EGFR pharmdx (suministrados) Cada uno de los portaobjetos de control suministrados contiene dos líneas celulares humanas incluidas en parafina, fijadas en formol con valoraciones de intensidad de tinción de 2+ y 0. En cada procedimiento de tinción debe teñirse un portaobjetos. La evaluación de las líneas celulares del portaobjetos de control suministradas por Dako indica la validez del ciclo de tinción. No deben utilizarse como ayuda para interpretar resultados de pacientes. Tejidos de control positivo Los controles deben ser muestras frescas de autopsia/biopsia/quirúrgicas fijadas, procesadas e incluidas tan pronto como sea posible de la misma manera que la muestra o las muestras del paciente. Los controles de tejido positivo indican tejidos preparados correctamente y técnicas de tinción adecuadas. Debe incluirse un control de tejido positivo por cada conjunto de condiciones de la prueba en cada ejecución de tinción. Los tejidos utilizados para los controles de tejido positivo deben dar una débil tinción positiva de forma que puedan detectarse cambios sutiles en la sensibilidad del anticuerpo primario. Los portaobjetos de control suministrados con este sistema o las muestras procesadas de forma diferente de las muestras del paciente, sólo validan la eficacia del reactivo y no verifican la preparación del tejido. Los controles de tejido positivo conocidos deben utilizarse sólo para monitorizar el correcto funcionamiento de los tejidos procesados y los reactivos de la prueba, NO como ayuda para formular un diagnóstico específico de las muestras del paciente. Si los controles de tejido positivo no pueden demostrar una tinción positiva apropiada, los resultados de las muestras de la prueba deben considerarse como no válidos. Las células normales que pueden utilizarse como EGFR positivo débil, incluyen células epiteliales de la próstata y epitelio bronquial pulmonar normal. Debido a que el patrón de tinción de EGFR es heterógeno, los elementos de tejido con tinción débil pueden dar resultados negativos. El perineurio es un tejido fuerte de control positivo. Entre las células normales que presentan una tinción EGFR positiva moderada se encuentran las células epiteliales del cuello uterino y de la piel. Tejidos de control negativo Utilice un tejido de control negativo (negativo para la proteína EGFR) fijado, procesado e incluido de manera idéntica a la muestra o muestras del paciente con cada proceso de tinción, para verificar la especificidad del anticuerpo primario y proporcionar un índice de la tinción específica de fondo. La variedad de los diferentes tipos de células presentes en la mayoría de los cortes de tejido muestra zonas de control negativo internas (esto debe ser verificado por el usuario). Si se produce tinción específica en el tejido de control negativo, los resultados de las muestras del paciente deben considerarse no válidos. Entre los elementos de tejido que pueden utilizarse como control negativo, se incluyen los miocitos cardiacos. Las células acinares pancreáticas son también negativas para EGFR, mientras que el epitelio pancreático de la vesícula biliar tiñe positivamente. Los linfocitos, cuando están presentes, no se tiñen con EGFR pharmdx y pueden utilizarse como control negativo interno. Reactivo de control negativo no específico Use el reactivo de control negativo suministrado en lugar del anticuerpo primario con un corte de cada muestra del paciente, para evaluar la tinción inespecífica y permitir una mejor interpretación de la tinción específica en la zona del antígeno. El período de incubación del reactivo de control negativo debe corresponderse con el del anticuerpo primario. Verificación del ensayo Antes del uso inicial de un sistema de tinción en un procedimiento diagnóstico, el usuario debe verificar los resultados del ensayo, analizando una serie de tejidos con características de resultados IHQ conocidas que representen tejidos positivos y negativos conocidos. Estos procedimientos de verificación deben repetirse con cada lote de ensayo nuevo. Consulte los procedimientos de control de calidad indicados anteriormente en esta sección del prospecto del producto y los requisitos de control de calidad del programa de certificación del CAP para inmunohistoquímica, y la directriz CLSI Quality Assurance for Immunocytochemistry, Approved Guideline 19 (Garantía de calidad del CLSI para inmunohistoquímica, pautas aprobadas). Los carcinomas con intensidades de tinción de la proteína EGFR conocidas y con tejidos negativos son adecuados para la verificación del ensayo. ( ) P04036ES_01/K1494/ p. 7/14
8 Tabla 1: El propósito del control de calidad diario Tejido: Fijado y procesado como la muestra del paciente Portaobjetos de control suministrado por Dako. Control positivo: Tejido o células que contienen el antígeno diana que se va a detectar (podría encontrarse en el tejido del paciente). El control ideal es un tejido con una tinción positiva débil para que sea más sensible al anticuerpo o a la degradación del antígeno. Control negativo: Tejidos o células que se espera que presenten resultados negativos (podrían encontrarse en el tejido del paciente o en el tejido de control positivo). Anticuerpo específico y sistema de detección Controla el procedimiento de tinción solamente. La evaluación de las líneas celulares del portaobjetos de control suministradas por Dako indica la validez del ciclo de tinción. Controla todos los pasos del análisis. Valida el reactivo y los procedimientos utilizados para la tinción del EGFR. Detección de reactividad cruzada no deseada del anticuerpo con componentes celulares o células. Fondo: Anticuerpo inespecífico (IgG de ratón, reactivo de control negativo) Detección de tinción de fondo inespecífica. Detección de tinción de fondo inespecífica. Tejido del paciente. Detección de tinción específica. Detección de tinción de fondo inespecífica. Interpretación del procedimiento de tinción La evaluación de los portaobjetos debe ser realizada por un patólogo, con un microscopio óptico. Todas las evaluaciones tienen que realizarse en la región del tumor de la muestra. Un objetivo de 10X o 20X aumentos es apropiado para evaluar la intensidad y la tinción inmunohistoquímica. Utilice células intactas para interpretar los resultados de la tinción. Las células necróticas o degeneradas a menudo se tiñen de forma inespecífica 19. Cada kit de EGFR pharmdx incluye líneas de células positivas y negativas, para validar los procesos de tinción cada vez que se realiza el ensayo. Una tinción adecuada de las líneas de células de control proporciona evidencia de que el ensayo EGFR pharmdx funciona correctamente. Ninguna tinción de la membrana de la línea de células de control CAMA-1 (0), ni una tinción de color marrón moderada o incompleta de la membrana en la línea de células de control HT-29 (2+), indican que la tinción es válida. Si la intensidad de la tinción de la línea de células de control positivo es demasiado débil o demasiado fuerte, podría producir un resultado negativo falso o positivo falso y la prueba deberá repetirse. La Guía de interpretación de EGFR pharmdx contiene imágenes de referencia. EGFR pharmdx tiñe principalmente las membranas celulares, demostrando una tinción circunferencial completa e incompleta. Frecuentemente, el patrón de inmunotinción es heterogéneo, mostrando varias intensidades de tinción en una única neoplasia. También se ha observado tinción en el citoplasma y en los espacios extracelulares. La tinción citoplásmica es común. Sin embargo, la prueba debe repetirse si una tinción citoplásmica significativa dificulta la lectura de la tinción de la membrana y la interpretación de los resultados. Los tumores deben comunicarse como positivos o negativos para el EGFR utilizando la tinción de la membrana como la estructura evaluable. Una célula tumoral es positiva para el EGFR si se produce la tinción de la membrana por encima del fondo, tanto si es completamente circunferencial como si no lo es. Un tumor que no presenta tinción de la membrana por encima del fondo en cualquier célula tumoral se comunica como un tumor negativo para el EGFR. Según el período de la incubación y la potencia de la hematoxilina utilizada, la contratinción puede producir una coloración de los núcleos de las células que va de azul claro a azul oscuro. Una contratinción excesiva o incompleta puede comprometer la interpretación de los resultados. Tabla 2: Resultados de la tinción con EGFR pharmdx Informe al médico tratante Tumor negativo para EGFR Tumor positivo para EGFR Definición Ausencia de tinción de la membrana por encima del fondo en todas las células tumorales. La tinción positiva para el EGFR se define como cualquier tinción IHQ de las membranas de las células tumorales, por encima del nivel del fondo, tanto si se trata de una tinción circunferencial completa como incompleta. Intensidad de la tinción Porcentaje de tinción de las células tumorales 1+, 2+ o 3+ > 0% Estas definiciones de resultados positivo y negativo son conformes a la bibliografía publicada 24, pero es posible que sea necesario modificarlas en función del contexto específico (Consulte la sección Limitaciones específicas del producto). Limitaciones Limitaciones generales IHQ es un proceso de diagnóstico de múltiples pasos que requiere una formación especializada en la selección de los reactivos apropiados; selección, fijación y procesamiento del tejido; preparación del portaobjetos de IHQ e interpretación de los resultados de la tinción. ( ) P04036ES_01/K1494/ p. 8/14
9 La tinción del tejido depende de la manipulación y del procesamiento del mismo antes de la tinción. Los procedimientos incorrectos de fijación, congelación, descongelación, lavado, secado, calentamiento, corte o contaminación con otros tejidos o fluidos, pueden producir artefactos, el atrapamiento de anticuerpos o resultados negativos falsos. Los resultados incoherentes pueden deberse a variaciones en los métodos de fijación e inclusión, o a irregularidades inherentes al tejido. Una contratinción excesiva o incompleta puede comprometer la interpretación de los resultados. La interpretación clínica de cualquier tinción positiva, o la ausencia de la misma, debe hacerse en el contexto de la presentación clínica, la morfología y otros criterios histopatológicos. La interpretación clínica de cualquier tinción, o la ausencia de la misma, deberá ser complementada con estudios morfológicos y controles adecuados, además de otras pruebas de diagnóstico. Un patólogo cualificado y familiarizado con los anticuerpos, reactivos y métodos utilizados es quien debe interpretar la preparación teñida. La tinción debe ser realizada por un laboratorio autorizado certificado, bajo la supervisión de un patólogo responsable de revisar los portaobjetos teñidos y que se asegure de la idoneidad de los controles positivo y negativo. Los tejidos de personas infectadas con el virus de la hepatitis B y que contienen el antígeno de superficie del virus de la hepatitis B (HBsAg), pueden mostrar tinción inespecífica con la peroxidasa de rábano 25. Los reactivos pueden mostrar reacciones inesperadas en tejidos no analizados previamente. No puede descartarse completamente la posibilidad de reacciones inesperadas, incluso en grupos de tejidos analizados previamente, debido a la variabilidad biológica de la expresión del antígeno en neoplasmas u otros tejidos patológicos 22. En caso de obtener resultados inesperados, póngase en contacto con el servicio de asistencia técnica de Dako. Pueden observarse resultados negativos falsos debido a la unión no inmunológica de proteínas o productos de reacción del sustrato. También pueden producirse por la actividad de la pseudoperoxidasa (eritrocitos) y la actividad de la peroxidasa endógena (citocromo C) 21. Nota: Los reactivos y las instrucciones suministrados con este sistema han sido diseñados para obtener resultados óptimos. Una mayor dilución de los reactivos o la modificación de los tiempos de incubación o de las temperaturas, pueden producir resultados erróneos o incoherentes. Limitaciones específicas del producto Se desconoce el índice de respuesta de cetuximab de pacientes negativos para el EGFR y de pacientes con tinción positiva para el EGFR en menos del 1% de las células tumorales, ya que estos pacientes no participaron en las pruebas clínicas del fármaco. Se considera que los tumores con tinción positiva para el EGFR en >1% de las células expresan el EGFR en relación con las indicaciones actuales del cetuximab. Los pacientes con tinción en la membrana de EGFR en menos del 1% de las células tumorales no se incluyeron en el estudio de control aleatorio del panitumumab y, por lo tanto, se desconoce la actividad del panitumumab en esta población de pacientes. Se considera que los tumores con tinción positiva de EGFR en >1% de sus células expresan EGFR con respecto a las indicaciones actuales de uso del panitumumab. Los resultados negativos falsos podrían ser causados por la degradación del antígeno en los tejidos con el transcurso del tiempo. Las muestras deben teñirse dentro de los 2 meses siguientes al montaje de los tejidos en los portaobjetos, cuando se almacenan a temperatura ambiente (20 25 C) 14,26. Para obtener resultados óptimos y reproducibles, la proteína EGFR requiere la digestión proteolítica cuando los tejidos se fijan de manera estándar y se incluyen en parafina. Características de resultados Especificidad Se ha analizado la reactividad del anticuerpo anti-egfr, clon 2-18C9 (2-18C9) contra las líneas celulares que expresan EGFR, HER2, HER3 y HER4. En la inmunotinción "western de SKBR3 y los lisados de células A431, 2-18C9 reconoció una banda de 170 kd que es coherente con el peso molecular conocido de EGFR. También se ha encontrado que el clon 2-18C9 reconoce la forma EGFRvIII (145 kd) del receptor en inmunohistoquímica, citometría de flujo e inmunotinción western de las líneas celulares transfectadas con EGFRvIII. En los experimentos de inmunotinción western, 2-18C9 no reaccionó con los lisados de células CAMA-1 positivas para HER2, con los extractos de la proteína BL-21 de E. coli transformados con HER3, y con los lisados de células transfectadas con CHO-HER4. Además, los transfectantes de ovario de hámster chino (CHO) que expresan myc (vector tag), solo o coexpresado con uno de los miembros de la familia HER, crecieron en portaobjetos de cámara que se habían incluido en parafina, fijados en formol y teñidos con anti-myc y 2-18C9. El anticuerpo anti-myc tiñó los cinco transfectantes CHO, mientras que 2-18C9 tiñó solamente las células CHO transfectadas con HER1. Ensayos clínicos Ensayos clínicos con cetuximab Se han realizado tres estudios con cetuximab (EMD , IMCL CP e IMCL CP ) con carcinomas colorrectales (CRC) donde se utilizaron los resultados de la prueba de tinción inmunohistoquímica (IHQ) Dako que expresan el EGFR como uno de los criterios de inclusión en el estudio. En 2 de 3 estudios, incluyendo el estudio esencial (EMD ), el umbral de los tumores que expresan el EGFR fue establecido en 1+ sobre un posible resultado de 0 a 3+ para la intensidad de tinción positiva del EGFR en 1% para el porcentaje de células tumorales teñidas. Este umbral fue seleccionado debido a que el subgrupo de análisis de un intervalo completo de diferentes umbrales de criterios de tinción de membranas y otros criterios de diferenciación no pueden detectar una diferencia significativa en los resultados clínicos. Ensayo esencial con cetuximab El ensayo esencial (EMD ) permitió la inscripción de pacientes con tumores en los que se detectaron células positivas del EGFR con la prueba Dako EGFR pharmdx. Dichos tumores encontrados en el estudio tuvieron como mínimo un 1% de células positivas del EGFR y se designaron como tumores que expresaron el EGFR. Los pacientes con tumores que expresaron el EGFR fueron tratados con irinotecán más cetuximab o con cetuximab solo. Se analizaron 577 muestras tumorales. De las 577, 474 (82%, 95% Cl = 78,1%, 86,1%) de ( ) P04036ES_01/K1494/ p. 9/14
10 las muestras de CRC analizadas expresaron el EGFR. 329 pacientes con EGFR pharmdx estaban disponibles para una aleatorización de 2:1 para los dos brazos del ensayo esencial del fármaco. En este estudio, los pacientes que recibieron irinotecán más cetuximab obtuvieron un índice de respuesta de 50/218 (22,9%; 95% CI = 17,5%; 29,1%). Los pacientes que recibieron sólo cetuximab alcanzaron un índice de respuesta de 12/111 (10,8%; 95% CI = 5,7%; 18,1%). Sólo las personas que dieron positivo para Dako EGFR, como se describió anteriormente, recibieron tratamiento con cetuximab. Se desconoce el índice de respuesta de personas negativas con EGFR, por lo que no se puede realizar una comparación. No hubo correlación entre el grado de respuesta del tumor y el porcentaje de las células positivas con EGFR ni la intensidad de tinción de EGFR. (Consulte la tabla 3) Tabla 3: Índices de respuesta del ensayo esencial con cetuximab (EMD ) Número total de pacientes estudiados Índice de respuesta # de los casos tratados con cetuximab e irinotecán Índice de respuesta # de los casos tratados sólo con cetuximab EGFR pharmdx + ( 1%) 474* 50/218 (22,9%, 95% CI = 17,5%; 29,1%) EGFR pharmdx No se ha tratado ninguno No se ha tratado ninguno 12/111 (10,8%, 95% CI = 5,7%; 18,1%) *329 pacientes estaban disponibles para una aleatorización de 2:1 para los dos brazos del ensayo del fármaco. # El índice de respuesta era la proporción de los pacientes del estudio entero, con un decremento de 50 % en el total del diámetro perpendicular del tumor medible (es decir, un decremento del 50 % o más del área de la superficie del tumor) que persistió durante al menos 28 días. Estudios de apoyo con cetuximab El estudio EGFR pharmdx sirvió para reclutar pacientes para el ensayo esencial (EMD ) y para un estudio de apoyo (IMCL CP ) durante la fase de desarrollo de cetuximab. En el estudio IMCL CP se analizaron 140 muestras. De estas muestras, 105/140 (75%, 95% Cl = 66,9%; 83,1%) tenían tumores que expresaron el EGFR. Este estudio contó con un total de 61 pacientes, 57 de los cuales recibieron cetuximab. En un estudio de apoyo adicional (IMCL CP ), se utilizó un prototipo de EGFR pharmdx (compuesto del mismo antígeno primario y sistema de detección anteriores) para reclutar pacientes. Se analizaron un total de 412 muestras procedentes de 401 pacientes. 292/401 (72,8%; 95% CI = 68,0%; 77,6%) pacientes dieron resultados positivos. Se reclutaron 139 pacientes, 138 de los cuales recibieron cetuximab más irinotecán. Tabla 4: Resumen del porcentaje de expresión del EGFR en pacientes con cáncer de colon ID del estudio Ensayo esencial EMD Estudio de apoyo IMCL CP Estudio prototipo EGFR IMCL CP Ratio de expresión del EGFR (nº expresado/ nº estudiado) % de expresión del EGFR 95 % de intervalos de confianza 474/577 82,1% 78,1 86,1% 105/140 75,0% 66,9 83,1% 292/401 72,8% 68,0 77,6% Estudios clínicos con panitumumab Los datos sobre la eficacia que apoyan el uso del panitumumab en el tratamiento del cáncer colorrectal metastásico refractario (mcrc) se obtuvieron de estudios de pacientes con tumores que expresan EGFR, como se determinó con el ensayo Dako EGFR pharmdx. Ensayo controlado aleatorio con panitumumab En este estudio multicéntrico, aleatorio, abierto y comparativo del panitumumab ( , estudio de extensión de guía ) y mejor cuidado de apoyo (BSC) en comparación con sólo BSC participaron pacientes con mcrc que no respondieron a los tratamientos de quimioterapia con oxaliplatina e irinotecán y cuyos tumores presentaron tinción de la membrana de EGFR en = 1% de las células tumorales evaluadas. En ambos grupos de tratamiento el porcentaje medio de células tumorales con tinción positiva de la membrana de EGFR fue del 20% (intervalo: 1% a 100%). En el estudio , se observó una mejora significativa estadísticamente en el criterio principal de valoración de la supervivencia sin progresión (PFS) en el grupo tratado con panitumumab y BSC en comparación con el grupo tratado sólo con BSC (p < 0,0001, prueba del orden logarítmico estratificado). En este ensayo controlado aleatorio, el índice de respuesta fue del 8,3% (19/229, 95% CI: 5,1%, 12,6%) y se definió como una respuesta completa o parcial (RECIST modificado) con una duración confirmada de al menos 4 semanas. El índice de respuesta correspondiente en los 174 pacientes que pasaron de BSC a panitumumab en el estudio de extensión de guía fue del 9,8% (17/174, 95% CI: 5,8%,15,2%). No hubo correlación alguna entre el efecto del tratamiento en la PFS y el porcentaje de la tinción de la membrana tumoral de EGFR o la intensidad de la tinción de EGFR. (Consulte la tabla 5 siguiente) ( ) P04036ES_01/K1494/ p. 10/14
11 Tabla 5: Efecto del tratamiento en la supervivencia sin progresión mediante la tinción de EGFR a Estudio Nº de pacientes/ eventos Relación de riesgos instantáneos a 95% de intervalo de confianza de la relación de riesgos instantáneos Todo aleatorio 463 / 401 0,54 (0,44, 0,66) <0,0001 % de tinción de la membrana de EGFR b 1-<10% 114 / 91 0,46 (0,30, 0,71) 0, % 182 / 157 0,55 (0,40, 0,76) 0,0004 >35% 164 / 150 0,56 (0,40, 0,78) 0,0007 Intensidad máxima de la tinción de la membrana de EGFR c / 113 0,61 (0,41, 0,90) 0, / 206 0,49 (0,37, 0,65) <0, / 80 0,61 (0,39, 0,97) 0,0379 Valor p Las relaciones de riesgo instantáneo para panitumumab y BSC en relación con BSC sólo son una estimación de un modelo de riesgos proporcionales de Cox ajustado en función de la puntuación de rendimiento de ECOG y la región geográfica. Un valor < 1,0 indica un índice de eventos inferior a la media y un período más prolongado para el grupo de panitumumab y BSC comparado con el grupo sólo de BSC. b Se excluyó a 3 pacientes cuyos tumores expresaron una tinción de la membrana de EGFR < 1 % (violaciones del protocolo). c Se excluyó a 2 pacientes cuyos tumores expresaron una tinción de la membrana de EGFR < 1 % y una tinción de la membrana de EGFR con intensidad máxima < 1+ (violaciones del protocolo). Tabla 6: Resumen del porcentaje de expresión de EGFR en pacientes con cáncer de colon ID del estudio Ensayo esencial Índice de expresión de EGFR (nº expresión/nº estudiado) % de expresión de EGFR 95% de intervalos de confianza 735/ ,2% 70,4 75,9% Reproducibilidad Reproducibilidad interensayo La reproducibilidad interensayo fue analizada con métodos manuales en dos laboratorios, por dos técnicos en cada uno, durante 3 días con 5 muestras (4 positivas y 1 negativa en cada laboratorio) de diferentes valoraciones de intensidad de tinción aleatorizadas y enmascaradas. Se observó una excelente reproducibilidad (100 %) para los resultados positivos para el EGFR frente a los negativos para el EGFR (0 vs. 1+, 2+ y 3+). La intensidad de tinción varió 1+ en dos muestras positivas, y 2+ en una muestra (en uno de los ensayos, casi todo el elemento positivo se había perdido durante el lavado del portaobjetos). Las dos muestras negativas permanecieron negativas. Reproducibilidad interlaboratorio de la tinción La reproducibilidad interlaboratorio se analizó en tres laboratorios separados geográficamente con 30 muestras aleatorias y enmascaradas con varias valoraciones de intensidad de tinción IHQ. Se enviaron portaobjetos con cortes recientes a cada laboratorio para su tinción manual y automática, y su posterior evaluación por un patólogo. El porcentaje de coincidencia interlaboratorio fue del 100 % para una determinación dicotómica positiva/negativa donde 0 fue negativo y 1+, 2+ y 3+ fueron positivos para la expresión de la proteína EGFR para los procedimientos de análisis automático y manual. Inmunorreactividad En la tabla 7 se presenta un resumen de la inmunorreactividad de EGFR pharmdx en el panel recomendado de tejidos normales. Todos los tejidos estaban incluidos en parafina y fijados con formol. ( ) P04036ES_01/K1494/ p. 11/14
12 Tabla 7: Evaluación de tinción de tejido normal mediante EGFR pharmdx* Tipo de tejido (Nº analizado) Suprarrenal (2) Médula ósea (3) Mamas (2) Encéfalo, cerebelo (3) Encéfalo/cerebrum (3) Cuello uterino (3) Colon (3) Esófago (2) Corazón (3) Riñón (3) Hígado (3) Pulmón (3) Células mesoteliales (3) Ovario (3) Páncreas (3) Paratiroides (1) Nervio periférico (3) Pituitaria (3) Próstata (3) Glándula salival (3) Músculo esquelético (3) Piel (3) Intestino delgado (3) Bazo (3) Estómago (3) Testículo (3) Timo (3) Tiroides (3) Amígdala (3) Útero (3) Tinción de elemento tisular positivo para el EGFR y patrón de tinción Células corticales (2+): citoplasma Células epiteliales lobulares (2+): membrana y citoplasma Capa molecular (1+): extracelular Células epiteliales escamosas basales (2+): membrana ** Células epiteliales escamosas basales (2+): membrana Túbulos (1+): tinción citoplásmica (granular) Hepatocitos (sinusoides) (3+); vías biliares (3+): membrana y citoplasma Células del epitelio alveolar/células bronquiales basales (células mioepiteliales) (2+): membrana y citoplasma Células mesoteliales (2+): membrana y citoplasma Conductos (2+): membrana Procesos de células nerviosas (1+): fibroso Células epiteliales glandulares (2+): membrana Elementos ductales (1+): citoplasma Células escamosas, estructuras anexiales (2+): membrana y citoplasma Epitelio escamoso (3+): membrana y citoplasma Epitelio de la glándula endometrial (2+): membrana y citoplasma Células del estroma endometrial (2+): membrana y citoplasma Miometrio: *La mayoría de los tejidos analizados dieron una tinción de fibroblastos en tejido del estroma (1+, fibroso) así como los fibroblastos perineurales y las células mioepiteliales. Ocasionalmente, se observó la tinción de eosinófilos inducida por la peroxidasa endógena. **Se ha observado una inmunotinción variable del epitelio colónico normal. ( ) P04036ES_01/K1494/ p. 12/14
13 Solución de problemas Tabla 8: Solución de problemas Problema Causa probable Solución sugerida 1. Los portaobjetos no se tiñen. 2. Los portaobjetos se tiñen débilmente. 3. Tinción excesiva de fondo de los portaobjetos. 4. El tejido se desprende de los portaobjetos. 5. Tinción específica excesivamente intensa. 6. Tinción débil de la línea celular del portaobjetos de control 2+. 1a. Error de programación. Los reactivos no se han usado en el orden correcto. 1b. Los viales de reactivos no estaban cargados en las posiciones correctas en las gradillas. 1c. No hay suficiente reactivo en el vial. 1d. Hay azida sódica en el baño de tampón de lavado. 2a. Tiempos de incubación de reactivos inadecuados. 2b. Se utilizó un método de fijación inapropiado. 2c. Incubación excesiva con Proteinase K. 3a. No se eliminó completamente la parafina. 3b. Se utilizaron aditivos con almidón para montar los cortes en los portaobjetos. 3c. No se aclararon bien los portaobjetos. 3d. Los cortes se secaron durante el procedimiento de tinción. 3e. Los portaobjetos se secaron durante la carga en el Autostainer. 3f. Unión inespecífica de los reactivos al corte de tejido. 4a. Se utilizaron los portaobjetos incorrectos. 5a. Se utilizó un método de fijación inapropiado. 5b. Tiempo de incubación del reactivo demasiado largo. 5c. Se utilizó una solución de lavado inadecuada. 6a. Digestión proteolítica inadecuada con Proteinase K. 6b. Tiempos de incubación de reactivos, inadecuados. 6c. Degradación del portaobjetos de control. 1a. Revise la programación para asegurarse de que la tinción fue programada correctamente. 1b. Compruebe el mapa de reactivos para asegurarse de la ubicación correcta de los viales de reactivos. 1c. Asegúrese de que los viales tengan suficiente reactivo antes de empezar el proceso. Consulte los volúmenes necesarios en el mapa de reactivos. 1d. Utilice el tampón de lavado nuevo sin azida suministrado en el kit. 2a. Revise las instrucciones del procedimiento de tinción. 2b. Asegúrese de que el tejido del paciente no esté excesivamente fijado y que se está utilizando un fijador aprobado (Consulte la sección Preparación de las muestras). 2c. Asegúrese de que el tiempo de incubación de la solución Proteinase K no supere los 5 minutos. 3a. Utilice soluciones limpiadoras frescas y siga el procedimiento indicado en la sección Desparafinización y rehidratación. 3b. Evite utilizar aditivos para adherir los cortes a los portaobjetos de vidrio. Muchos de ellos son inmunorreactivos. 3c. Asegúrese de cebar bien el Autostainer antes del proceso. Asegúrese de que haya suficiente solución tampón para todo el proceso. Puede añadir solución de lavado adicional después del paso de visualización, si es necesario. 3d. Asegúrese de aplicar el volumen correcto de reactivo a los portaobjetos. Asegúrese de utilizar el Autostainer con la tapa cerrada, y que no esté expuesto a fuentes de calor excesivo ni a corrientes de aire. 3e. Asegúrese de que los portaobjetos permanezcan húmedos durante la carga, y antes de empezar el proceso. 3f. Compruebe que se ha fijado bien la muestra y/o la presencia de necrosis. 4a. Utilice portaobjetos cargados (SuperFrost Plus de Fisher) o silanizados como Silanized Slides de Dako (nº de catálogo S3003). 5a. Asegúrese de utilizar sólo fijadores y métodos de fijación aprobados (Consulte la sección Preparación de las muestras). 5b. Revise las instrucciones del protocolo de tinción. 5c. Utilice sólo el tampón de lavado diluido que se suministra con el kit. 6a. Verifique que el tiempo de incubación de la solución de Proteinase K esté programado para 5 minutos. 6b. Asegúrese de programar los tiempos de incubación exactos. 6c. Compruebe la fecha de caducidad y las condiciones de almacenamiento del kit. 7. Digestión excesiva del tejido. 7a. Incubación excesiva con Proteinase K. 7b. Fijación inadecuada. 7a. Asegúrese de que el tiempo de incubación de la solución Proteinase K no supere los 5 minutos. 7b. Utilice el procedimiento de posfijación indicado en la sección de protocolo de tinción en los portaobjetos nuevos, y tíñalos con el procedimiento normal. Nota: Consulte la sección Solución de problemas en el manual de Dako: Immunochemical Staining Methods, 3rd Edition 16, el Atlas of Immunohistology 23, o Immunoperoxidase Techniques. A Practical Approach to Tumor Diagnosis 20. Póngase en contacto con el servicio técnico de Dako para comunicar una tinción poco habitual. ( ) P04036ES_01/K1494/ p. 13/14
14 Referencias 1. Carpenter G, Cohen S. Epidermal growth factor. J Biol Chem 1990; 265: Riese DJ, Stern DF. Specificity within the EGF family/erbb receptor family signaling network. Bioessays 1998; 20:41 3. Coussens L, Yang-Feng TL, Liao Y-C, Chen E, Gray A, McGrath J, Seeburg PH, Libermann TA, Schlessinger J, Francke U, Levinson A, Ullrich A. Tyrosine kinase receptor with extensive homology to EGF receptor shares chromosomal location with neu oncogene. Science 1985; 230: Yamamoto T, Ikawa S, Akiyama T, Semba K, Nomura N, Miyajima N, Saito T, Toyoshima K. Similarity of protein encoded by the human c-erb-b-2 gene to epidermal growth factor receptor. Nature 1986; 319: Schechter AL, Hung M-C, Vaidyanathan L, Weinberg RA, Yang-Feng TL, Francke U, Ullrich A, Coussens L. The neu gene: An erbbhomologous gene distinct from and unlinked to the gene encoding the EGF receptor. Science 1985; 229: Gusterson B, Cowley G, Smith JA, Ozanne B. Cellular localization of human epidermal growth factor receptor. Cell Biol Intl Rpts 1984; 8(8): Gullick WJ. Prevalence of aberrant expression of the epidermal growth factor receptor in human cancers. Br Med Bull 1991; 47(1):87 8. Sainsbury JRC, Farndon JR, Sherbet GV, Harris AL. Epidermal-growth-factor receptors and oestrogen receptors in human breast cancer. Lancet 1985; 1(8425): Ozanne B, Richards CS, Hendler F, Burns D, Gusterson B. Over-expression of the EGF receptor is a hallmark of squamous cell carcinomas. J Pathol 1986; 149:9 10. Werner MH, Nanney LB, Stoscheck CM, King LE. Localization of immunoreactive epidermal growth factor receptors in human nervous system. J Histochem Cytochem 1988; 36:81 11.Pii K, Andersen FG, Jensen S, Spaulding B. Characterization of a new monoclonal antibody, clone 2-18C9, for the measurement of Epidermal Growth Factor Receptor expression in solid tumors. Am Assoc Canc Res 95 th annual meeting, Abst #5029 Orlando, Fl Mar Clinical Laboratory Improvement Amendments of 1988: Final Rule, 57 FR7163, February 28, Sheehan DC, Hrapchak BB. Theory and practice of histotechnology. St. Louis: The C. V. Mosby Co Atkins D, Reiffen KA, Tegtmeier CL, Winther H, Bonato MS and Störkel S. Immunohistochemical detection of EGFR in paraffinembedded tumor tissues: Variation in staining intensity due to choice of fixative and storage time of tissue sections. J Histochem Cytochem 2004; 52: Kiernan JA. Histological and histochemical methods: Theory and practice. New York: Pergamon Press Boenisch T, Farmilo AJ, Stead RH. Handbook: Immunochemical Staining Methods. 3rd Edition. Dako Department of Health, Education and Welfare, National Institute for Occupational Safety and Health, Rockville, MD. Procedures for the decontamination of plumbing systems containing copper and/or lead azides. DHHS (NIOSH) Publ. No , Current 13. August 16, CLSI (formerly NCCLS (National Committee for Clinical Laboratory Standards)). Protection of laboratory workers from occupationally acquired infections; Approved guideline. Villanova, PA Order code M29-A2 19. CLSI (formerly NCCLS (National Committee for Clinical Laboratory Standards)). Quality assurance for immunocytochemistry; Approved guideline. Villanova, PA Order code MM4-A. 20. Nadji M, Morales AR. Immunoperoxidase techniques. A practical approach to tumor diagnosis. Chicago: Amer Soc Clin Pathol Press Elias JM, Gown AM, Nakamura RM, Wilbur DC, Herman GE, Jaffe ES, Battifora H, Brigati DJ. Special report: quality control in immunohistochemistry. Amer J Clin Pathol 1989; 92: Herman GE, Elfont EA. The taming of immunohistochemistry: The new era of quality control. Biotech Histochem 1991; 66: Tubbs RR, Gephardt GN, Petras RE. Specimen processing and quality assurance. In: Atlas of immuno-histology. Chicago: Amer Soc Clin Pathol Press 1986; Goldstein NS, Armin M. Epidermal growth factor receptor immunohistochemical reactivity in patients with American Joint Committee on Cancer Stage IV colon adenocarcinoma: implications for a standardized scoring system. Cancer 2001; 92: Omata M, Liew CT, Ashcavai M, Peters RL. Nonimmunologic binding of horseradish peroxidase to hepatitis B surface antigen: A possible source of error in immunohistochemistry. Amer J Clin Pathol 1980; 73: Press MF, Hung G, Godolphin W, Slamon DJ. Sensitivity of HER-2/neu antibodies in archival tissue samples: Potential source of error in immunohistochemical studies of oncogene expression. Cancer Res 1994; 54:2771 ( ) P04036ES_01/K1494/ p. 14/14
EnVision FLEX+, Mouse, High ph, (Link)
 EnVision FLEX+, Mouse, High ph, (Link) Código K8002 5ª edición El kit contiene reactivos suficientes para 400 600 pruebas. Para instrumentos Autostainer Link. Reactivos opcionales: Código Nombre del producto
EnVision FLEX+, Mouse, High ph, (Link) Código K8002 5ª edición El kit contiene reactivos suficientes para 400 600 pruebas. Para instrumentos Autostainer Link. Reactivos opcionales: Código Nombre del producto
EnVision FLEX, High ph, (Dako Autostainer/Autostainer Plus)
 EnVision FLEX, High ph, (Dako Autostainer/Autostainer Plus) Código K8010 6ª edición El kit contiene reactivos suficientes para 400 600 pruebas. Para Dako Autostainer/Autostainer Plus. Reactivos opcionales:
EnVision FLEX, High ph, (Dako Autostainer/Autostainer Plus) Código K8010 6ª edición El kit contiene reactivos suficientes para 400 600 pruebas. Para Dako Autostainer/Autostainer Plus. Reactivos opcionales:
EnVision FLEX Mini Kit, High ph (Dako Omnis)
 EnVision FLEX Mini Kit, High ph (Dako Omnis) Nº de catálogo GV8232ª edición El kit contiene reactivos suficientes para 150 pruebas. Para instrumentos Dako Omnis. Reactivos opcionales: N.º de catálogo GV804
EnVision FLEX Mini Kit, High ph (Dako Omnis) Nº de catálogo GV8232ª edición El kit contiene reactivos suficientes para 150 pruebas. Para instrumentos Dako Omnis. Reactivos opcionales: N.º de catálogo GV804
Dako REAL Detection System, Peroxidase/DAB+, Rabbit/Mouse
 Dako REAL Detection System, Peroxidase/DAB+, Rabbit/Mouse Código K5001 6ª edición Para su uso con instrumentos de inmunotinción automatizada de Dako. El kit contiene reactivos suficientes para 500 pruebas.
Dako REAL Detection System, Peroxidase/DAB+, Rabbit/Mouse Código K5001 6ª edición Para su uso con instrumentos de inmunotinción automatizada de Dako. El kit contiene reactivos suficientes para 500 pruebas.
EGFR pharmdx. Nº de catálogo K1494 50 pruebas para uso en el Dako Autostainer Edición 9/27/2006. Uso previsto Para uso en diagnóstico in vitro.
 EGFR pharmdx Nº de catálogo K1494 50 pruebas para uso en el Dako Autostainer Edición 9/27/2006 Uso previsto Para uso en diagnóstico in vitro. El ensayo EGFR pharmdx es un kit inmunohistoquímico (IHQ) para
EGFR pharmdx Nº de catálogo K1494 50 pruebas para uso en el Dako Autostainer Edición 9/27/2006 Uso previsto Para uso en diagnóstico in vitro. El ensayo EGFR pharmdx es un kit inmunohistoquímico (IHQ) para
EnVision DuoFLEX Doublestain System, (Link)
 EnVision DuoFLEX Doublestain System, (Link) N.º de catálogo SK110 Edición 06/15 Este kit contiene reactivos suficientes para 100 150 pruebas. Para instrumentos Autostainer Link. (127843-001) P04070ES_01/SK110/2015.06
EnVision DuoFLEX Doublestain System, (Link) N.º de catálogo SK110 Edición 06/15 Este kit contiene reactivos suficientes para 100 150 pruebas. Para instrumentos Autostainer Link. (127843-001) P04070ES_01/SK110/2015.06
c-kit pharmdx Código K para uso en el Dako Autostainer Uso previsto Para uso en diagnóstico in vitro.
 c-kit pharmdx Código K1907 35 para uso en el Dako Autostainer Uso previsto Para uso en diagnóstico in vitro. El ensayo c-kit pharmdx es un kit inmunohistoquímico (IHQ) cualitativo usado en el Dako Autostainer
c-kit pharmdx Código K1907 35 para uso en el Dako Autostainer Uso previsto Para uso en diagnóstico in vitro. El ensayo c-kit pharmdx es un kit inmunohistoquímico (IHQ) cualitativo usado en el Dako Autostainer
HercepTest for Automated Link Platforms
 HercepTest for Automated Link Platforms Nº de catálogo SK001 22ª edición (129282-001) P04456ES_01_SK00121-2/2016.05 p. 1/40 Índice Página/ Uso previsto...3 Resumen y explicación - Mama...4 Principio del
HercepTest for Automated Link Platforms Nº de catálogo SK001 22ª edición (129282-001) P04456ES_01_SK00121-2/2016.05 p. 1/40 Índice Página/ Uso previsto...3 Resumen y explicación - Mama...4 Principio del
HercepTest for Dako Autostainer
 HercepTest for Dako Autostainer N de catálogo K5207 20ª edición Para tinción inmunocitoquímica. El kit es para 50 pruebas (100 portaobjetos). (129269-001) P04455ES_01_K520721-2/2016.05 p. 1/53 Índice Página
HercepTest for Dako Autostainer N de catálogo K5207 20ª edición Para tinción inmunocitoquímica. El kit es para 50 pruebas (100 portaobjetos). (129269-001) P04455ES_01_K520721-2/2016.05 p. 1/53 Índice Página
HercepTest N de catálogo K5204
 HercepTest N de catálogo K5204 21ª edición Para tinción inmunocitoquímica. El kit es para 35 pruebas (70 portaobjetos). (129254-001) P04454ES_01_K520421-2/2016.05 p. 1/55 Índice Página Indicaciones de
HercepTest N de catálogo K5204 21ª edición Para tinción inmunocitoquímica. El kit es para 35 pruebas (70 portaobjetos). (129254-001) P04454ES_01_K520421-2/2016.05 p. 1/55 Índice Página Indicaciones de
PNA ISH Detection Kit N de código K5201
 PNA ISH Detection Kit N de código K5201 9a edición Para la hibridación in situ mediante sondas PNA conjugadas con fluoresceína. El kit contiene reactivos para un mínimo de 40 pruebas*. * Número de pruebas
PNA ISH Detection Kit N de código K5201 9a edición Para la hibridación in situ mediante sondas PNA conjugadas con fluoresceína. El kit contiene reactivos para un mínimo de 40 pruebas*. * Número de pruebas
Estas instrucciones corresponden a Dako EnVision+ Dual Link System-HRP (DAB+).
 Dako EnVision + Dual Link System-HRP (DAB+) Nº de catálogo K4065 Uso previsto Para uso en diagnóstico in vitro. Estas instrucciones corresponden a Dako EnVision+ Dual Link System-HRP (DAB+). Este kit está
Dako EnVision + Dual Link System-HRP (DAB+) Nº de catálogo K4065 Uso previsto Para uso en diagnóstico in vitro. Estas instrucciones corresponden a Dako EnVision+ Dual Link System-HRP (DAB+). Este kit está
Estas instrucciones se aplican a Dako EnVision+, Peroxidase (Dako EnVision+, HRP).
 Dako EnVision+ System- HRP Labelled Polymer Anti-ratón Nº de catálogo K4000 15 ml Nº de catálogo K4001 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican a Dako EnVision+,
Dako EnVision+ System- HRP Labelled Polymer Anti-ratón Nº de catálogo K4000 15 ml Nº de catálogo K4001 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican a Dako EnVision+,
Instrucciones: Número de laboratorios participantes: Remitidos: 88 Contestados: 84 GCP (95.45 %) y 83(94.31%) Control Local
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología MÓDULO DE IHQ GENERAL RONDA 35 Antígeno probado: HMB45 Tejido probado: ü
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología MÓDULO DE IHQ GENERAL RONDA 35 Antígeno probado: HMB45 Tejido probado: ü
Heat Shock Protein 27 (G3.1)
 Identificación del Producto N.º de ref. Descripción 46946 HSP27 0,1 M (G3.1) 46947 HSP27 1 M (G3.1) 46945 HSP27 RTU M (G3.1) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 46946 HSP27 0,1 M (G3.1) 46947 HSP27 1 M (G3.1) 46945 HSP27 RTU M (G3.1) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Inmunohistoquímica antígenos anticuerpos
 Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Metas Demostrar la presencia real
Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Metas Demostrar la presencia real
Módulo de IHQ GENERAL. 34ª Ronda. control local es tumoral, correspondiendo la mayoría de los casos a Tumores
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de IHQ GENERAL 34ª Ronda Antígeno probado: CD117(C-Kit) Tejido probado:
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de IHQ GENERAL 34ª Ronda Antígeno probado: CD117(C-Kit) Tejido probado:
Cytokeratin 20 (Ks20.8)
 Identificación del Producto N.º de ref. Descripción 44559 Cytokeratin 20 0,1 M (Ks20.8) 44560 Cytokeratin 20 1 M (Ks20.8) 44269 Cytokeratin 20 RTU M (Ks20.8) Definiciones De Los Símbolos P C A E S DIL
Identificación del Producto N.º de ref. Descripción 44559 Cytokeratin 20 0,1 M (Ks20.8) 44560 Cytokeratin 20 1 M (Ks20.8) 44269 Cytokeratin 20 RTU M (Ks20.8) Definiciones De Los Símbolos P C A E S DIL
Biología Celular e Histología. Prácticas de Biología Celular. Cultivos celulares y Procesamiento de tejidos.
 Biología Celular e Histología Prácticas de Biología Celular Cultivos celulares y Procesamiento de tejidos. Suspensiones celulares. Inmunodetección directa. Identificación celular tras cultivo. Manejo del
Biología Celular e Histología Prácticas de Biología Celular Cultivos celulares y Procesamiento de tejidos. Suspensiones celulares. Inmunodetección directa. Identificación celular tras cultivo. Manejo del
Solución tamponada que contiene peróxido de hidrógeno, detergente y 0,015 mol/l de azida sódica.
 PD-L1 IHC 22C3 pharmdx SK006 50 pruebas para uso con Autostainer Link 48 Uso previsto Para uso en diagnóstico in vitro. PD-L1 IHC 22C3 pharmdx es un ensayo inmunohistoquímico cualitativo que utiliza Monoclonal
PD-L1 IHC 22C3 pharmdx SK006 50 pruebas para uso con Autostainer Link 48 Uso previsto Para uso en diagnóstico in vitro. PD-L1 IHC 22C3 pharmdx es un ensayo inmunohistoquímico cualitativo que utiliza Monoclonal
Cytokeratin 20 (Ks20.8)
 Identificación del Producto N.º de ref. Descripción 45139 IMPATH Cytokeratin 20 RTU M (Ks20.8) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número
Identificación del Producto N.º de ref. Descripción 45139 IMPATH Cytokeratin 20 RTU M (Ks20.8) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número
Positive Control (ORG ) Negative Control (ORG ) Instrucciones para el uso 10/2009
 ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Positive Control (ORG 310-24) Negative Control (ORG 311-24) Instrucciones para el uso 10/2009 1/7 alegria-control-0910-04-es
ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Positive Control (ORG 310-24) Negative Control (ORG 311-24) Instrucciones para el uso 10/2009 1/7 alegria-control-0910-04-es
Herpes Simplex Virus II (Polyclonal)
 Identificación del Producto N.º de ref. Descripción 44640 Herpes simplex virus II 0,1 R (Poly) 44641 Herpes simplex virus II 1 R (Poly) 44309 Herpes simplex virus II RTU R (Poly) Definiciones De Los Símbolos
Identificación del Producto N.º de ref. Descripción 44640 Herpes simplex virus II 0,1 R (Poly) 44641 Herpes simplex virus II 1 R (Poly) 44309 Herpes simplex virus II RTU R (Poly) Definiciones De Los Símbolos
Módulo de PATOLOGÍA QUIRÚRGICA GENERAL. Ronda nº 6
 SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 6 Antígeno probado: HMB4 Tejido
SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 6 Antígeno probado: HMB4 Tejido
PD-L1 IHC 28-8 pharmdx. SK pruebas para uso con Autostainer Link 48
 PD-L1 IHC 28-8 pharmdx SK005 50 pruebas para uso con Autostainer Link 48 Índice 1. Uso previsto...2 2. Resumen y explicación...2 2.1 NSCLC no escamoso...2 2.2 Carcinoma de células escamosas de cabeza y
PD-L1 IHC 28-8 pharmdx SK005 50 pruebas para uso con Autostainer Link 48 Índice 1. Uso previsto...2 2. Resumen y explicación...2 2.1 NSCLC no escamoso...2 2.2 Carcinoma de células escamosas de cabeza y
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 45608 Cadherin-17 0,1 R (SP183) 45609 Cadherin-17 1 R (SP183) 45632 Cadherin-17 RTU R (SP183) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo
Identificación del Producto N.º de ref. Descripción 45608 Cadherin-17 0,1 R (SP183) 45609 Cadherin-17 1 R (SP183) 45632 Cadherin-17 RTU R (SP183) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo
Cytokeratin 5 + Cytokeratin 14 (EP1601Y + LL002)
 Cytokeratin 5 + Cytokeratin 14 (EP1601Y Identificación del Producto N.º de ref. Descripción 44203 CK5 + CK14 RTU M (EP1601Y & LL002) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Cytokeratin 5 + Cytokeratin 14 (EP1601Y Identificación del Producto N.º de ref. Descripción 44203 CK5 + CK14 RTU M (EP1601Y & LL002) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Adenovirus (20/11 & 2/6)
 Identificación del Producto N.º de ref. Descripción 45606 Adenovirus 0,1 M (20/11 & 2/6) 45607 Adenovirus 1 M (20/11 & 2/6) 45631 Adenovirus RTU M (20/11 & 2/6) Definiciones De Los Símbolos P C A E S DIL
Identificación del Producto N.º de ref. Descripción 45606 Adenovirus 0,1 M (20/11 & 2/6) 45607 Adenovirus 1 M (20/11 & 2/6) 45631 Adenovirus RTU M (20/11 & 2/6) Definiciones De Los Símbolos P C A E S DIL
Módulo de MAMA. Ronda nº 2
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de MAMA Ronda nº 2 Antígeno probado: P63 Tejido probado: Tejido mamario
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de MAMA Ronda nº 2 Antígeno probado: P63 Tejido probado: Tejido mamario
FluoroSpheres Code No. K0110
 FluoroSpheres Code No. K0110 6a edición Perlas de calibración para monitoreo diario del citómetro de flujo. Contiene reactivos para 40 calibraciones. (105798-004) SSK0110CE_02/ES/2015.12 p. 1/8 Contenidos
FluoroSpheres Code No. K0110 6a edición Perlas de calibración para monitoreo diario del citómetro de flujo. Contiene reactivos para 40 calibraciones. (105798-004) SSK0110CE_02/ES/2015.12 p. 1/8 Contenidos
INSTRUCCIONES DE USO PARASITE SUSPENSIONS. n Parasite Suspensions en formalina USO PREVISTO RESUMEN Y EXPLICACIÓN PRINCIPIOS COMPOSICIÓN
 INSTRUCCIONES DE USO n Parasite Suspensions en formalina USO PREVISTO Microbiologics Parasite Suspensions sirve de ayuda a los programas de control de calidad al utilizarse como muestras comparativas para
INSTRUCCIONES DE USO n Parasite Suspensions en formalina USO PREVISTO Microbiologics Parasite Suspensions sirve de ayuda a los programas de control de calidad al utilizarse como muestras comparativas para
Módulo de Patología de Mama. Ronda 6ª. Tejido probado: Adenocarcinoma ductal infiltrante de mama
 SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de Patología de Mama Ronda 6ª Antígeno probado: Receptores de Estrógenos
SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de Patología de Mama Ronda 6ª Antígeno probado: Receptores de Estrógenos
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 45622 GATA3 0,1 M (L50-823) 45623 GATA3 1 M (L50-823) 45639 GATA3 RTU M (L50-823) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Identificación del Producto N.º de ref. Descripción 45622 GATA3 0,1 M (L50-823) 45623 GATA3 1 M (L50-823) 45639 GATA3 RTU M (L50-823) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Inmunohistoquímica. Páncreas.
 Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Páncreas. Metas Demostrar la presencia
Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Páncreas. Metas Demostrar la presencia
CD138/syndecan-1 (B-A38)
 Identificación del Producto N.º de ref. Descripción 44463 CD138 0,1 M (B-A38) 44464 CD138 1 M (B-A38) 44220 CD138 RTU M (B-A38) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 44463 CD138 0,1 M (B-A38) 44464 CD138 1 M (B-A38) 44220 CD138 RTU M (B-A38) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Módulo de PATOLOGÍA QUIRÚRGICA GENERAL. Ronda nº 4
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 4 Antígeno probado: CROMOGRANINA
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 4 Antígeno probado: CROMOGRANINA
Módulo de PATOLOGÍA LINFOIDE. Ronda nº 9
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA LINFOIDE Ronda nº 9 Antígeno probado: CD79a Tejido probado:
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA LINFOIDE Ronda nº 9 Antígeno probado: CD79a Tejido probado:
Monoclonal Rabbit Anti-Human Cytokeratin 8/18 Clone EP17/EP30. N.º de catálogo M3652. Uso previsto
 Monoclonal Rabbit Anti-Human Cytokeratin 8/18 Clone EP17/EP30 N.º de catálogo M3652 Uso previsto Para uso en diagnóstico in vitro. Monoclonal Rabbit Anti-Human Cytokeratin 8/18, Clone EP17/EP30 se utiliza
Monoclonal Rabbit Anti-Human Cytokeratin 8/18 Clone EP17/EP30 N.º de catálogo M3652 Uso previsto Para uso en diagnóstico in vitro. Monoclonal Rabbit Anti-Human Cytokeratin 8/18, Clone EP17/EP30 se utiliza
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 46949 Langerin 0,1 M (12D6) 46950 Langerin 1 M (12D6) 46948 Langerin RTU M (12D6) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Identificación del Producto N.º de ref. Descripción 46949 Langerin 0,1 M (12D6) 46950 Langerin 1 M (12D6) 46948 Langerin RTU M (12D6) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de ratón
 Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de ratón Código K4006 15 ml Código K4007 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican al
Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de ratón Código K4006 15 ml Código K4007 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican al
Cytokeratin (34betaE12)
 Identificación del Producto N.º de ref. Descripción 44549 Cytokeratin 0,1 M (34betaE12) 44550 Cytokeratin 1 M (34betaE12) 44264 Cytokeratin RTU M (34betaE12) Definiciones De Los Símbolos P C A E S DIL
Identificación del Producto N.º de ref. Descripción 44549 Cytokeratin 0,1 M (34betaE12) 44550 Cytokeratin 1 M (34betaE12) 44264 Cytokeratin RTU M (34betaE12) Definiciones De Los Símbolos P C A E S DIL
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 47353 IMPATH GLUT3 RTU R (Poly) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido
Identificación del Producto N.º de ref. Descripción 47353 IMPATH GLUT3 RTU R (Poly) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido
Actin, Muscle Specific (HHF35)
 Identificación del Producto N.º de ref. Descripción 45235 IMPATH Actin Muscle Specific RTU M (HHF35) Definiciones De Los Símbolos grupos de músculos. Las células no musculares como las células vasculares
Identificación del Producto N.º de ref. Descripción 45235 IMPATH Actin Muscle Specific RTU M (HHF35) Definiciones De Los Símbolos grupos de músculos. Las células no musculares como las células vasculares
Carmín al 1% (laca de alumbre C.I ), cloruro de aluminio (anhídrido) al 1% y alcohol etílico al 50% en agua desionizada
 Artisan Mucicarmine Stain Kit Nº de catálogo AR168 Uso previsto Para uso en diagnóstico in vitro. Mucicarmine Stain Kit ha sido diseñado para su uso en laboratorio con objeto de identificar las mucinas
Artisan Mucicarmine Stain Kit Nº de catálogo AR168 Uso previsto Para uso en diagnóstico in vitro. Mucicarmine Stain Kit ha sido diseñado para su uso en laboratorio con objeto de identificar las mucinas
Módulo de PATOLOGÍA LINFOIDE. Ronda nº 2
 SEAP Calle Ancora, 3, º B MADRID Tfno. y Fax 9 39 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Antígeno probado: bcl Tejido probado: Amígdala Módulo de PATOLOGÍA LINFOIDE Ronda nº Instrucciones:
SEAP Calle Ancora, 3, º B MADRID Tfno. y Fax 9 39 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Antígeno probado: bcl Tejido probado: Amígdala Módulo de PATOLOGÍA LINFOIDE Ronda nº Instrucciones:
Dako EnVision+ System- HRP Labelled Polymer Anti-Rabbit. Código K ml Código K ml. Indicaciones de uso. Para uso diagnóstico in vitro.
 Dako EnVision+ System- HRP Labelled Polymer Anti-Rabbit Código K4002 15 ml Código K4003 110 ml Indicaciones de uso Para uso diagnóstico in vitro. These instructions se aplican al sistema Dako EnVision
Dako EnVision+ System- HRP Labelled Polymer Anti-Rabbit Código K4002 15 ml Código K4003 110 ml Indicaciones de uso Para uso diagnóstico in vitro. These instructions se aplican al sistema Dako EnVision
TECNICA DE INMUNOHISTOQUIMICA *IHQ*
 Hospital General ISSS TECNICA DE INMUNOHISTOQUIMICA *IHQ* Tec. Delmy de Chávez Sep/2010 Estufa EQUIPO BASICO Baño de María EQUIPO BASICO Microscopio EQUIPO BASICO Medidor de ph. EQUIPO BASICO Refrigeradora
Hospital General ISSS TECNICA DE INMUNOHISTOQUIMICA *IHQ* Tec. Delmy de Chávez Sep/2010 Estufa EQUIPO BASICO Baño de María EQUIPO BASICO Microscopio EQUIPO BASICO Medidor de ph. EQUIPO BASICO Refrigeradora
Inmunohistoquímica. Páncreas.
 Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Páncreas. Metas Demostrar la presencia
Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Páncreas. Metas Demostrar la presencia
Estreptavidina conjugada con peroxidasa de rábano en PBS que contiene proteína estabilizante y agentes antimicrobianos.
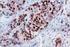 Dako LSAB2 System-HRP Nº de catálogo K0672 15 ml Nº de catálogo K0673 15 ml Nº de catálogo K0675 110 ml Uso previsto Para uso en diagnóstico in vitro. Estas instrucciones se aplican al Dako Labelled Streptavidin-Biotin2
Dako LSAB2 System-HRP Nº de catálogo K0672 15 ml Nº de catálogo K0673 15 ml Nº de catálogo K0675 110 ml Uso previsto Para uso en diagnóstico in vitro. Estas instrucciones se aplican al Dako Labelled Streptavidin-Biotin2
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS
 HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS INTERES CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS INTERES CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
Chromogranin A (LK2H10)
 Identificación del Producto N.º de ref. Descripción 45195 IMPATH Chromogranin A RTU M (LK2H10) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número
Identificación del Producto N.º de ref. Descripción 45195 IMPATH Chromogranin A RTU M (LK2H10) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número
Androgen Receptor (SP107)
 Identificación del Producto N.º de ref. Descripción 44425 Androgen Receptor 0,1 M (SP107) 44426 Androgen Receptor 1 M (SP107) 44199 Androgen Receptor RTU M (SP107) Definiciones De Los Símbolos P C A E
Identificación del Producto N.º de ref. Descripción 44425 Androgen Receptor 0,1 M (SP107) 44426 Androgen Receptor 1 M (SP107) 44199 Androgen Receptor RTU M (SP107) Definiciones De Los Símbolos P C A E
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44460 CD117 0,1 R (YR145) 44461 CD117 1 R (YR145) 44218 CD117 RTU R (YR145) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 44460 CD117 0,1 R (YR145) 44461 CD117 1 R (YR145) 44218 CD117 RTU R (YR145) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
lo que hace este anticuerpo un buen indicador de una buena respuesta a la quimioterapia. Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 45261 IMPATH TdT RTU R (Poly) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido por
Identificación del Producto N.º de ref. Descripción 45261 IMPATH TdT RTU R (Poly) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido por
Artisan Jones Basement Membrane Stain Kit. Nº de catálogo AR180. Uso previsto Para uso en diagnóstico in vitro.
 Artisan Jones Basement Membrane Stain Kit Nº de catálogo AR180 Uso previsto Para uso en diagnóstico in vitro. El Jones Basement Membrane Stain Kit ha sido diseñado para su uso en laboratorio con objeto
Artisan Jones Basement Membrane Stain Kit Nº de catálogo AR180 Uso previsto Para uso en diagnóstico in vitro. El Jones Basement Membrane Stain Kit ha sido diseñado para su uso en laboratorio con objeto
Módulo de PATOLOGÍA QUIRÚRGICA GENERAL. Ronda nº 8
 SEAP Calle Ancora, 3, 2º B 2 MADRID Tfno. y Fax 91 39 2 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº Antígeno probado: CD Tejido probado:
SEAP Calle Ancora, 3, 2º B 2 MADRID Tfno. y Fax 91 39 2 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº Antígeno probado: CD Tejido probado:
INMUNOHISTOQUIMICA. Laboratorio de Inmunología Clínica Facultad de Ciencias Químicas - UNA
 INMUNOHISTOQUIMICA Laboratorio de Inmunología Clínica Facultad de Ciencias Químicas - UNA INMUNOHISTOQUIMICA Objetivo identificar Ag dentro de un corte tisular. Mediante la utilización de Anticuerpos monoclonales
INMUNOHISTOQUIMICA Laboratorio de Inmunología Clínica Facultad de Ciencias Químicas - UNA INMUNOHISTOQUIMICA Objetivo identificar Ag dentro de un corte tisular. Mediante la utilización de Anticuerpos monoclonales
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 46928 c-myc 0,1 R (EP121) 46929 c-myc 1 R (EP121) 46927 c-myc RTU R (EP121) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 46928 c-myc 0,1 R (EP121) 46929 c-myc 1 R (EP121) 46927 c-myc RTU R (EP121) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
PD-L1 IHC 22C3 pharmdx. SK pruebas para uso con Autostainer Link 48. Índice
 PD-L1 IHC 22C3 pharmdx SK006 50 pruebas para uso con Autostainer Link 48 Índice 1. Uso previsto... 2 2. Resumen y explicación... 2 2.1 NSCLC...2 2.2 Melanoma...2 3. Principio del procedimiento... 2 4.
PD-L1 IHC 22C3 pharmdx SK006 50 pruebas para uso con Autostainer Link 48 Índice 1. Uso previsto... 2 2. Resumen y explicación... 2 2.1 NSCLC...2 2.2 Melanoma...2 3. Principio del procedimiento... 2 4.
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44742 p53 0,1 M (DO7) 44743 p53 1 M (DO7) 44361 p53 RTU M (DO7) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado ascitis
Identificación del Producto N.º de ref. Descripción 44742 p53 0,1 M (DO7) 44743 p53 1 M (DO7) 44361 p53 RTU M (DO7) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado ascitis
MÓDULO LINFOIDE. Ronda nº 9
 SEAP Calle Ancora,, º B 05 MADRID Tfno. y Fax 9 59 6 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología MÓDULO LINFOIDE. Ronda nº 9 Antígeno probado: TdT Introducción La desoxinucleotidil-transferasa
SEAP Calle Ancora,, º B 05 MADRID Tfno. y Fax 9 59 6 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología MÓDULO LINFOIDE. Ronda nº 9 Antígeno probado: TdT Introducción La desoxinucleotidil-transferasa
Reactivos suministrados El Reticulin-No Counterstain Kit está compuesto por siete cartuchos de dispensador listos para su uso, cada uno con:
 Artisan Reticulin-No Counterstain Kit Nº de catálogo AR182 Uso previsto Para uso en diagnóstico in vitro. Reticulin-No Counterstain Kit ha sido diseñado para su uso en laboratorio con objeto de identificar,
Artisan Reticulin-No Counterstain Kit Nº de catálogo AR182 Uso previsto Para uso en diagnóstico in vitro. Reticulin-No Counterstain Kit ha sido diseñado para su uso en laboratorio con objeto de identificar,
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44837 Vimentin 0,1 M (V9) 44838 Vimentin 1 M (V9) 44409 Vimentin RTU M (V9) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 44837 Vimentin 0,1 M (V9) 44838 Vimentin 1 M (V9) 44409 Vimentin RTU M (V9) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44437 BCL6 0,1 M (GI191E/A8) 44438 BCL6 1 M (GI191E/A8) 44206 BCL6 RTU M (GI191E/A8) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Identificación del Producto N.º de ref. Descripción 44437 BCL6 0,1 M (GI191E/A8) 44438 BCL6 1 M (GI191E/A8) 44206 BCL6 RTU M (GI191E/A8) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Actin, Smooth Muscle (1A4)
 Identificación del Producto N.º de ref. Descripción 44419 Actin Smooth Muscle 0,1 M (1A4) 45040 Actin Smooth Muscle 1 M (1A4) 44196 Actin Smooth Muscle RTU M (1A4) Definiciones De Los Símbolos P C A E
Identificación del Producto N.º de ref. Descripción 44419 Actin Smooth Muscle 0,1 M (1A4) 45040 Actin Smooth Muscle 1 M (1A4) 44196 Actin Smooth Muscle RTU M (1A4) Definiciones De Los Símbolos P C A E
Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de conejo
 Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de conejo Código K4010 15 ml Código K4011 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican
Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de conejo Código K4010 15 ml Código K4011 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican
Módulo de PATOLOGÍA LINFOIDE. Ronda nº 7
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA LINFOIDE Ronda nº 7 Antígeno probado: CD4 Tejido probado:
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA LINFOIDE Ronda nº 7 Antígeno probado: CD4 Tejido probado:
Collagen Type IV (CIV22)
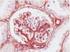 Identificación del Producto N.º de ref. Descripción 44543 Collagen Type IV 0,1 M (CIV22) 44544 Collagen Type IV 1 M (CIV22) 44261 Collagen Type IV RTU M (CIV22) Definiciones De Los Símbolos P C A E S DIL
Identificación del Producto N.º de ref. Descripción 44543 Collagen Type IV 0,1 M (CIV22) 44544 Collagen Type IV 1 M (CIV22) 44261 Collagen Type IV RTU M (CIV22) Definiciones De Los Símbolos P C A E S DIL
complementar PSA en un contexto clínico correcto. Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 45255 IMPATH PSAP RTU M (PASE/4LJ) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido
Identificación del Producto N.º de ref. Descripción 45255 IMPATH PSAP RTU M (PASE/4LJ) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44238 CD4 RTU R (EP204) 44498 CD4 0,1 R (EP204) 44499 CD4 1 R (EP204) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 44238 CD4 RTU R (EP204) 44498 CD4 0,1 R (EP204) 44499 CD4 1 R (EP204) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44726 NSE 0,1 M (MRQ-55) 44727 NSE 1 M (MRQ-55) 44353 NSE RTU M (MRQ-55) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 44726 NSE 0,1 M (MRQ-55) 44727 NSE 1 M (MRQ-55) 44353 NSE RTU M (MRQ-55) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
A. 1-5 El adenocarcinoma pulmonar con
 Identificación del Producto N.º de ref. Descripción 44723 Napsin A 1 M (MRQ-60) 44351 Napsin A RTU M (MRQ-60) 44722 Napsin A 0,1 M (MRQ-60) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para
Identificación del Producto N.º de ref. Descripción 44723 Napsin A 1 M (MRQ-60) 44351 Napsin A RTU M (MRQ-60) 44722 Napsin A 0,1 M (MRQ-60) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para
DANAGENE microspin DNA KIT
 Ref. 0607.1 50 extracciones Ref. 0607.2 250 extracciones 1.INTRODUCCION DANAGENE microspin DNA KIT Este kit permite una eficiente extracción de ADN genómico y mitocondrial a partir de muestras de pequeño
Ref. 0607.1 50 extracciones Ref. 0607.2 250 extracciones 1.INTRODUCCION DANAGENE microspin DNA KIT Este kit permite una eficiente extracción de ADN genómico y mitocondrial a partir de muestras de pequeño
HBsAg CONFIRMATORY TEST INTERÉS CLÍNICO
 HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS. INTERÉS CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS. INTERÉS CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
Adipophilin (Polyclonal)
 Identificación del Producto N.º de ref. Descripción 47345 IMPATH Adipophilin RTU R (Poly) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido
Identificación del Producto N.º de ref. Descripción 47345 IMPATH Adipophilin RTU R (Poly) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido
Módulo de PATOLOGÍA QUIRÚRGICA GENERAL. Ronda nº 6. Antígeno probado: BhCG (Gonadotrofina coriónica, subunidad beta).
 SEAP Calle Ancora,, 2º B 284 MADRID Tfno. y Fax 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 6 Antígeno probado: BhCG (Gonadotrofina
SEAP Calle Ancora,, 2º B 284 MADRID Tfno. y Fax 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 6 Antígeno probado: BhCG (Gonadotrofina
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44734 p120 Catenin 0,1 M (MRQ-5) 44735 p120 Catenin 1 M (MRQ-5) 44357 p120 Catenin RTU M (MRQ-5) Definiciones De Los Símbolos P C A E S DIL DOC# DIS
Identificación del Producto N.º de ref. Descripción 44734 p120 Catenin 0,1 M (MRQ-5) 44735 p120 Catenin 1 M (MRQ-5) 44357 p120 Catenin RTU M (MRQ-5) Definiciones De Los Símbolos P C A E S DIL DOC# DIS
Guía de evaluación: Cada uno de los asesores calificó la muestra con una puntación de 0-5 (valor máximo de 20 puntos).
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología MÓDULO DE MAMA Ronda n 19 Antígeno probado: Receptor de Progesterona Tejido
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología MÓDULO DE MAMA Ronda n 19 Antígeno probado: Receptor de Progesterona Tejido
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 45311 IMPATH HGAL RTU M (MRQ-49) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido
Identificación del Producto N.º de ref. Descripción 45311 IMPATH HGAL RTU M (MRQ-49) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido
Las técnicas de tinción inmunoenzimáticas/inmunhistoquímicas (IHQ) permiten la visualización de los antígenos en tejidos (células).
 Dako LSAB 2 System-AP Catálogo K0674 110 ml Catálogo K0676 15 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican al sistema Universal Dako LSAB 2 System, Alkaline Phosphatase
Dako LSAB 2 System-AP Catálogo K0674 110 ml Catálogo K0676 15 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican al sistema Universal Dako LSAB 2 System, Alkaline Phosphatase
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44531 CD99 0,1 R (EPR3097Y) 44532 CD99 1 R (EPR3097Y) 44255 CD99 RTU R (EPR3097Y) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Identificación del Producto N.º de ref. Descripción 44531 CD99 0,1 R (EPR3097Y) 44532 CD99 1 R (EPR3097Y) 44255 CD99 RTU R (EPR3097Y) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
INDICACIONES TRADOS. Orina. control hcg. Juego de. hcg Orina. etapas de embarazo. temprano. Cuando se. hcg Orina. tamponada con.
 Instrucciones para uso profesional INDICACIONES El Juego de control hcg Orina se utiliza con la prueba de QuickVue+ hcg Combo, prueba de QuickVue hcg Orina o Combo y prueba de RapidVue hcg. Estos controles
Instrucciones para uso profesional INDICACIONES El Juego de control hcg Orina se utiliza con la prueba de QuickVue+ hcg Combo, prueba de QuickVue hcg Orina o Combo y prueba de RapidVue hcg. Estos controles
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 46934 EZH2 0,1 M (11) 46935 EZH2 1 M (11) 46933 EZH2 RTU M (11) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado ascitis
Identificación del Producto N.º de ref. Descripción 46934 EZH2 0,1 M (11) 46935 EZH2 1 M (11) 46933 EZH2 RTU M (11) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado ascitis
Human Placental Lactogen (hpl) (Polyclonal)
 Identificación del Producto N.º de ref. Descripción 44650 hpl 0,1 R (Poly) 44651 hpl 1 R (Poly) 44314 hpl RTU R (Poly) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado ascitis
Identificación del Producto N.º de ref. Descripción 44650 hpl 0,1 R (Poly) 44651 hpl 1 R (Poly) 44314 hpl RTU R (Poly) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado ascitis
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44668 Kappa Light Chain 0,1 M (L1C1) 44669 Kappa Light Chain 1 M (L1C1) 44323 Kappa Light Chain RTU M (L1C1) Definiciones De Los Símbolos P C A E S DIL
Identificación del Producto N.º de ref. Descripción 44668 Kappa Light Chain 0,1 M (L1C1) 44669 Kappa Light Chain 1 M (L1C1) 44323 Kappa Light Chain RTU M (L1C1) Definiciones De Los Símbolos P C A E S DIL
Factor XIIIa (EP3372)
 Identificación del Producto N.º de ref. Descripción 44596 Factor XIIIa 0,1 R (EP3372) 44597 Factor XIIIa 1 R (EP3372) 44287 Factor XIIIa RTU R (EP3372) Definiciones De Los Símbolos P C A E S DIL DOC# DIS
Identificación del Producto N.º de ref. Descripción 44596 Factor XIIIa 0,1 R (EP3372) 44597 Factor XIIIa 1 R (EP3372) 44287 Factor XIIIa RTU R (EP3372) Definiciones De Los Símbolos P C A E S DIL DOC# DIS
QUANTA Chek ANA Panel
 QUANTA Chek ANA Panel 708111 Uso previsto El QUANTA Chek TM ANA Panel se utiliza como control de calidad de los procedimientos IFA y ELISA para anticuerpos antinucleares. Cada suero sirve como control
QUANTA Chek ANA Panel 708111 Uso previsto El QUANTA Chek TM ANA Panel se utiliza como control de calidad de los procedimientos IFA y ELISA para anticuerpos antinucleares. Cada suero sirve como control
Varicella Zoster Virus (SG1-1, SG1- SG4, NCP-1 & IE-62)
 Varicella Zoster Virus (SG1-1, SG1- SG4, Identificación del Producto N.º de ref. Descripción 44833 Varicella-zoster virus 0,1 M (Monoclonal CKT) 44834 Varicella-zoster virus 1 M (MONOCLONAL CKT) 44407
Varicella Zoster Virus (SG1-1, SG1- SG4, Identificación del Producto N.º de ref. Descripción 44833 Varicella-zoster virus 0,1 M (Monoclonal CKT) 44834 Varicella-zoster virus 1 M (MONOCLONAL CKT) 44407
GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES. Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé
 GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé Esquema de investigación en pruebas fallidas Revisar el procedimiento y determinar
GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé Esquema de investigación en pruebas fallidas Revisar el procedimiento y determinar
Beta-Catenin (Polyclonal)
 Identificación del Producto N.º de ref. Descripción 44439 Beta-Catenin 0,1 R (Poly) 44440 Beta-Catenin 1 R (Poly) 44207 Beta-Catenin RTU R (Poly) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo
Identificación del Producto N.º de ref. Descripción 44439 Beta-Catenin 0,1 R (Poly) 44440 Beta-Catenin 1 R (Poly) 44207 Beta-Catenin RTU R (Poly) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44445 C4d 0,1 R (SP91) 44446 C4d 1 R (SP91) 44210 C4d RTU R (SP91) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado ascitis
Identificación del Producto N.º de ref. Descripción 44445 C4d 0,1 R (SP91) 44446 C4d 1 R (SP91) 44210 C4d RTU R (SP91) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado ascitis
diferenciar el mesotelioma epitelioide del carcinoma papilar seroso del ovario. Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44452 Caldesmon 0,1 R (E89) 44453 Caldesmon 1 R (E89) 44214 Caldesmon RTU R (E89) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Identificación del Producto N.º de ref. Descripción 44452 Caldesmon 0,1 R (E89) 44453 Caldesmon 1 R (E89) 44214 Caldesmon RTU R (E89) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
