HercepTest N de catálogo K5204
|
|
|
- Julián Ferreyra Segura
- hace 6 años
- Vistas:
Transcripción
1 HercepTest N de catálogo K ª edición Para tinción inmunocitoquímica. El kit es para 35 pruebas (70 portaobjetos). ( ) P04454ES_01_K / p. 1/55
2 Índice Página Indicaciones de uso... 4 Resumen y explicación - Mama... 5 Antecedentes... 5 Características... 5 Principio del procedimiento - Mama... 5 Reactivos - Mama... 6 Materiales suministrados... 6 Materiales necesarios que no se suministran... 7 Almacenamiento - Mama... 8 Preparación de las muestras - Mama... 8 Secciones incluidas en parafina... 8 Tratamiento de los tejidos antes de la tinción... 8 Precauciones - Mama... 9 INSTRUCCIONES DE USO - Mama A. Preparación del reactivo A.1 Epitope Retrieval Solution A.2 Wash Buffer A.3 Substrate-Chromogen Solution (DAB) A.4 Contratinción A.5 Medio de montaje B Procedimiento de tinción B.1 Notas referentes al procedimiento B.2 Protocolo de tinción Control de calidad - Mama Interpretación de la tinción - Mama Limitaciones: mamalimitaciones generales Limitaciones específicas del producto Características de resultados - Mama Antecedentes Estudios comparativos Comparación con el ensayo clínico (CTA) Precisión Reproducibilidad Inmunorreactividad Solución de problemas - Mama Resumen y explicación - Gástrico Antecedentes Características Principio del procedimiento - Gástrico Reactivos - Gástrico Materiales suministrados Materiales necesarios que no se suministran Almacenamiento - Gástrico ( ) P04454ES_01_K / p. 2/55
3 Preparación de las muestras - Gástrico Secciones incluidas en parafina Tratamiento de los tejidos antes de la tinción Precauciones - Gástrico INSTRUCCIONES DE USO - Gástrico A. Preparación del reactivo A.1 Epitope Retrieval Solution A.2 Wash Buffer A.3 Substrate-Chromogen Solution (DAB) A.4 Contratinción A.5 Medio de montaje B Procedimiento de tinción B.1 Notas referentes al procedimiento B.2 Protocolo de tinción Control de calidad - Gástrico Interpretación de la tinción - Gástrico Limitaciones - Gástrico Limitaciones generales Limitaciones específicas del producto Características de resultados - Gástrico Antecedentes Reproducibilidad Inmunorreactividad Solución de problemas - Gástrico Referencias Explicación de símbolos ( ) P04454ES_01_K / p. 3/55
4 Indicaciones de uso Para uso diagnóstico in vitro. HercepTest es un ensayo inmunocitoquímico semicuantitativo para determinar la sobreexpresión de la proteína HER2 en tejidos mamarios cancerosos procesados de forma rutinaria para su evaluación histológica y tejidos cancerosos fijados con formol e incluidos en parafina procedentes de pacientes con adenocarcinoma de estómago incluido el de la unión gastroesofágica. HercepTest está indicado como ayuda en la evaluación de pacientes para los que se está considerando un tratamiento con Herceptin (trastuzumab) (véase el prospecto de Herceptin ). NOTA sólo para el cáncer de mama: todos los pacientes de los ensayos clínicos con Herceptin se seleccionaron mediante un ensayo clínico (CTA, por sus siglas en inglés) inmunocitoquímico de investigación. de los pacientes de estos ensayos se seleccionó utilizando la prueba HercepTest. HercepTest se comparó con el CTA en un grupo independiente de muestras y se determinó que ofrecía resultados concordantes aceptables. La correlación real de HercepTest y Herceptin en el resultado clínico todavía no se ha determinado. NOTA sólo para el cáncer gástrico: Todos los pacientes del estudio BO18255 (ToGA) de fase III, patrocinado por Hoffmann-La Roche, se seleccionaron utilizando el kit Dako HercepTest (IHC) y Dako HER2 FISH pharmdx (FISH). El estudio demostró la utilidad clínica de ambas pruebas para la evaluación del estado en cuanto a la HER2 en pacientes con adenocarcinoma inoperable localmente avanzado, recurrente y/o metastásico de estómago o de la unión gastroesofágica. El adenocarcinoma de estómago, incluida la unión gastroesofágica, también recibe el nombre de cáncer gástrico en este documento. Consulte las páginas 5-27 para obtener información sobre su aplicación para el cáncer de mama Consulte las páginas para obtener información sobre su aplicación para el cáncer gástrico Importante: Obsérvense las diferencias para el tejido de cáncer de mama y el tejido de cáncer gástrico especialmente en la interpretación de las Secciones de Tinción. ( ) P04454ES_01_K / p. 4/55
5 Cáncer de mama Resumen y explicación - Mama Antecedentes El gen humano HER2 (también conocido como ERBB2 o NEU) codifica una proteína a menudo llamada proteína HER2 o p185 HER2. La proteína HER2 es una tirosinquinasa del receptor de membrana homóloga con el receptor del factor de crecimiento epidérmico (EGFR o HER1) (1 8). La proteína HER2 es un componente normal expresado por una variedad de tipos de células epiteliales (8). En una parte de los pacientes con cáncer de mama, la proteína HER2 aparece sobreexpresada, como parte del proceso de transformación maligna y de progresión tumoral (9). La sobreexpresión de la proteína HER2 en la superficie de las células con cáncer de mama sugería que podría tratarse de un objetivo de una terapia con anticuerpos. Herceptin (trastuzumab) es un anticuerpo monoclonal humanizado (10) que se liga con gran afinidad a la proteína HER2 y que ha demostrado ser un inhibidor de la proliferación de células tumorales humanas que sobreexpresan la proteína HER2 in vitro e in vivo (11-13). Características HercepTest se desarrolló para ofrecer una alternativa al CTA de investigación utilizado en los estudios clínicos de Herceptin. El rendimiento de HercepTest en la determinación de la sobreexpresión de la proteína HER2 se evaluó en un estudio independiente comparando los resultados de HercepTest con los del CTA en 548 especímenes de cáncer de mama, ninguno de los cuales se obtuvo de pacientes de los estudios clínicos de Herceptin. Los resultados indicaron una concordancia del 79% entre los resultados de los dos ensayos en estos especímenes de tejido. Los datos de concordancia también muestran que es muy probable que una lectura de 3+ con HercepTest corresponda con una lectura positiva en el CTA, lo que se ajustaría a los criterios de entrada del ensayo (2+ ó 3+). Los resultados de 2+ en HercepTest no mostraron una correlación tan buena con los resultados del CTA. Alrededor de un 42% (53 de los 126 casos) de los resultados 2+ del HercepTest resultaron negativos en el CTA (0-1+), lo que no habría posibilitado la entrada en los ensayos clínicos de Herceptin. HercepTest se interpreta como negativo para la sobreexpresión de la proteína HER2 (con intensidad de tinción 0 y 1+), débilmente positivo (con intensidad de tinción 2+) y altamente positivo (con intensidad de tinción 3+). HercepTest no está pensado para ofrecer información de pronóstico a los pacientes y médicos y no se ha validado a este efecto. Principio del procedimiento - Mama HercepTest contiene los reactivos necesarios para completar un procedimiento de tinción inmunocitoquímica en dos pasos con especímenes procesados de forma rutinaria e incluidos en parafina. Después de la incubación con el anticuerpo primario de conejo de la proteína HER2 humana, este kit utiliza un reactivo de visualización listo para su uso basado en tecnología de dextrano. Este reactivo consta tanto de moléculas secundarias de inmunoglobulina de cabra anti-inmunoglobulinas de conejo como de moléculas de peroxidasa de rábano rusticano ligadas a un esqueleto de polímero de dextrano común, lo que elimina la necesidad de una aplicación secuencial de anticuerpos de enlace y anticuerpos conjugados con peroxidasa. La reacción cruzada del reactivo de visualización con las inmunoglobulinas humanas y el suero fetal bovino se ha eliminado por absorción en fase sólida. La conversión enzimática del cromógeno añadido posteriormente provoca la formación de un producto de reacción visible en el lugar del antígeno. Entonces, el espécimen puede someterse a contratinción y se puede colocar el cubreobjetos. Los resultados se interpretan utilizando un microscopio óptico. Los portaobjetos de control que contienen tres líneas celulares humanas con cáncer de mama incluidas en parafina y fijadas en formol con puntuaciones de intensidad de tinción de 0, 1+ y 3+ se suministran para validar las secuencias de tinción. La intensidad de tinción de estas líneas celulares se ha relacionado con el número de receptores por célula. ( ) P04454ES_01_K / p. 5/55
6 Cáncer de mama HercepTest, Nº de catálogo K5204, se puede aplicar tanto en tinción manual como automática, utilizando el Autostainer. Reactivos - Mama Materiales suministrados Los materiales enumerados a continuación son suficientes para 35 pruebas (35 portaobjetos incubados con anticuerpo primario de proteína HER2 y 35 portaobjetos incubados con el reactivo de control negativo correspondiente). El número de pruebas se basa en la utilización de 3 gotas (100 µl) por corte de tejido de los viales núm. 1, 2, 3 y 4 y de la solución Substrate-Chromogen Solution (DAB). El kit suministra material suficiente para un máximo de 5 secuencias individuales de tinción. Núm. vial Cantidad 1 1 x 7 ml 2 1 x 3,5 ml 3 1 x 7 ml 4 1 x 3,5 ml 5 1 x 10 ml 6 1 x 0,5 ml 7 1 x 500 ml Descripción Peroxidase-Blocking Reagent: peróxido de hidrógeno al 3% con azida sódica (NaN 3 ) a 15 mmol/l. Rabbit Anti-Human HER2 Protein: anticuerpo aislado por afinidad listo para su uso. Suministrado en Tris/HCl a 0,05 mol/l, NaCl a 0,1 mol/l, NaN 3 a 15 mmol/l, a ph 7,2 con proteína estabilizadora. Inmunógeno: fragmento sintético de la terminación C (parte intracitoplasmática) de la proteína HER2 enlazado con hemocianina de lapa californiana. Especificidad: proteína HER2 Método de purificación: el anticuerpo se aísla por afinidad utilizando un péptido de la proteína HER2 inmovilizado. Visualization Reagent: polímero de dextrano conjugado con peroxidasa de rábano rusticano e inmunoglobulinas de cabra anti-inmunoglobulinas de conejo aisladas por afinidad. Suministrado en tampón Tris/HCl con proteína estabilizadora y agente antimicrobiano. Negative Control Reagent: fracción de inmunoglobulina de suero de conejo normal a una concentración de proteína equivalente a la del anticuerpo de la proteína HER2. Suministrado en Tris/HCl a 0,05 mol/l, NaCl a 0,1 mol/l, NaN 3 a 15 mmol/l, a ph 7,2 con proteína estabilizadora. DAB Buffered Substrate: solución tampón de sustrato, a ph 7,5, con <0,1% peróxido de hidrógeno, estabilizadores, incrementadores y agente antimicrobiano. DAB Chromogen: solución cromógeno de tetraclorhidrato de 3,3 '- diaminobenzidina al 5%. ( ) P04454ES_01_K / p. 6/55
7 Cáncer de mama 8 1 x 250 ml 5 portaobjetos Epitope Retrieval Solution (Containing Detergent) (10x): tampón citrato a 0,1 mol/l con detergente. Wash Buffer (10x): tampón Tris/HCl con detergente y agente antimicrobiano. Control Slides: cada portaobjetos contiene cortes de tres líneas celulares de carcinoma de mama incluidos en parafina y fijados con formol que representan diferentes niveles de expresión de la proteína HER2. MDA-231 (0), MDA-175 (1+) y SK-BR-3 (3+). Los portaobjetos de control se han tratado con calor para mejorar la adherencia de los cortes a los portaobjetos. Cualquier otro tratamiento por calor de los portaobjetos de control realizado para mejorar la adherencia de los cortes a los portaobjetos puede afectar a los resultados de la tinción. NOTA: todos los reactivos, incluidos Epitope Retrieval Solution y Wash Buffer, están formulados para utilizarse específicamente en esta prueba. Para que la prueba pueda realizarse según las especificaciones, no deben realizarse sustituciones, salvo en el caso de Wash Buffer, cuando pueda utilizarse el Nº de catálogo de Dako S3006. Materiales necesarios que no se suministran Paños absorbentes Hidróxido amónico, a 15 mol/l diluido a 37 mmol/l Contratinción: Hematoxilina, como la solución acuosa Mayer's Hematoxylin, Nº de catálogo de Dako S3301 (véanse INSTRUCCIONES DE USO, A.4) Cubreobjetos Bolígrafo delimitador, como el Dako Pen, Nº de catálogo S2002 Agua destilada o desionizada (agua de lavado) Horno de secado, capaz de mantener una temperatura de 60 C o inferior Etanol, absoluto y al 95% Cámara húmeda (opcional) Microscopio óptico (aumento del objetivo de 4 40x) Medio de montaje, como Dako Faramount, Nº de catálogo S3025, o Glycergel, Nº de catálogo C0563 Tejidos positivos y negativos para utilizar como controles de proceso (véase la sección Control de calidad) Portaobjetos, SuperFrost Plus, portaobjetos recubiertos de poli-l-lisina o Dako Silanized Slides, Nº de catálogo S3003 (véase Preparación del espécimen) Jarras o baños de tinción Cronómetro (capaz de cronometrar intervalos de 2 40 minutos) Frascos de lavado Baño de agua con tapa (capaz de conservar la Epitope Retrieval Solution entre 95 y 99 C). Xileno, tolueno o sustitutos de xileno ( ) P04454ES_01_K / p. 7/55
8 Almacenamiento - Mama Almacénelo a una temperatura de 2 a 8 C. Cáncer de mama No utilice el kit después de la fecha de caducidad impresa en la parte exterior del embalaje. Si los reactivos se almacenan en condiciones diferentes de las especificadas en este prospecto, deben recibir la validación del usuario (14a, 14b). Obsérvese que los portaobjetos de control también deben almacenarse a una temperatura de entre 2 y 8 C. No existen signos obvios que indiquen que este producto sea inestable. Por lo tanto, deben llevarse a cabo controles positivos y negativos en simultaneidad con el ensayo en los especímenes de los pacientes. En caso de que se observen tinciones imprevistas que no puedan explicarse por variaciones en los procedimientos del laboratorio y se sospeche que existe un problema con HercepTest, póngase en contacto inmediatamente con los Servicios de asistencia técnica de Dako. Preparación de las muestras - Mama Los especímenes de biopsia deben manipularse de forma que se conserve el tejido para la tinción inmunocitoquímica. Deben utilizarse los métodos estándar de procesamiento de tejidos para todos los especímenes (15). Secciones incluidas en parafina Los tejidos conservados en formol tamponado neutro o fijados con Bouin para su procesamiento rutinario y la inclusión en parafina son adecuados para el uso. Por ejemplo, con los especímenes de biopsia deben hacerse bloques de un grosor de 3 ó 4 mm y fijarse durante horas en formol tamponado neutro. Los tejidos se deshidratan en una serie de alcoholes y xileno, y luego se realiza una infiltración con parafina fundida a no menos de 60 C. Los tejidos correctamente fijados e incluidos que expresan la proteína HER2 se conservarán indefinidamente antes de su corte y montaje en portaobjetos si se almacenan en un sitio fresco (15 25 C) (15, 16). En EE.UU., la Ley de Mejoras de Laboratorio Clínico de 1988 exige en el apartado 42 CFR (b) que El laboratorio debe conservar los portaobjetos teñidos como mínimo durante diez años a partir de la fecha del análisis y los bloques de espécimen como mínimo durante dos años a partir de la fecha del análisis (16). Las muestras de tejido se deben cortar en secciones de 4 5 µm, montar en portaobjetos y dejarlas secar al aire a temperatura ambiente por un mínimo de 12 horas (o hasta que estén secas) o a 37 C durante toda la noche o a 60 C du rante una hora. CUIDADO: El calentamiento excesivo durante más de una hora a 60 C puede causar una disminución significativa o la pérdida de la inmunorreactividad para HER2 asociada a la membrana específica (17). Para conservar la antigenicidad, los cortes de tejido, montados en portaobjetos (portaobjetos SuperFrost Plus, con Poli-L-lysine o silanizados) deben teñirse dentro de un período de 4 a 6 semanas tras ser cortados si se mantienen a temperatura ambiente (20 25 C) (18). Los portaobjetos necesarios para la evaluación de la proteína HER2 y la verificación de la presencia tumoral deben prepararse simultáneamente. Se recomienda un mínimo de 5 portaobjetos: 1 para la presencia tumoral, 2 para la evaluación de la proteína HER2 (1 para la incubación con el vial núm. 2 y 1 para la incubación con el vial núm. 4) y 2 portaobjetos de reserva. La utilización de HercepTest en tejidos decalcificados no se ha validado y no se recomienda. Consultar la Education Guide: Immunohistochemical Staining Methods (19) de Dako y con las referencias 15 y 16 para más detalles sobre la preparación de muestras. Tratamiento de los tejidos antes de la tinción Para un rendimiento óptimo del ensayo, debe utilizarse un método específico de recuperación de epítopo: La Epitope Retrieval Solution se suministra con el kit HercepTest. Este método implica el calentamiento de los cortes de tejido montados en portaobjetos sumergidos en tampón citrato a 10 mmol/l (20) en un baño de agua calibrado capaz de mantener la Epitope Retrieval Solution a la temperatura necesaria (95 99 C). Los laboratorios situados en zonas elevadas deben determinar el ( ) P04454ES_01_K / p. 8/55
9 Cáncer de mama mejor método para mantener la temperatura necesaria del baño de agua. La recuperación de epítopo debe realizarse en un baño de agua. Se han probado otros métodos de calentamiento que no han arrojado resultados reproducibles. Inmediatamente después de la recuperación de epítopo, inicie el procedimiento de tinción. Una desviación del procedimiento descrito puede alterar los resultados. Precauciones - Mama 1. Para uso diagnóstico in vitro. 2. Para uso por profesionales. 3. El vial 1, Peroxidase-Blocking Reagent, contiene un peróxido de hidrógeno al 3%. Hoja de datos sobre seguridad de los materiales disponible previa solicitud para usuarios profesionales. 4. El vial 6, DAB Chromogen, contiene 5-<10% tetracloruro de bifenil-3,3,4,4 -tetrailtetraamonio y está etiquetado como: H350 H341 P201 P280 Peligro P308 + P313 P405 P501 Puede provocar cáncer. Se sospecha que provoca defectos genéticos. Pedir instrucciones especiales antes del uso. Llevar guantes de protección. Llevar gafas o máscara de protección. Llevar prendas de protección. EN CASO DE exposición manifiesta o presunta: Consultar a un médico. Guardar bajo llave. Eliminar el contenido y el recipiente de acuerdo con las normativas locales, regionales, nacionales e internacionales. Es una regla general que los menores de 18 años tienen prohibido trabajar con este producto. Los usuarios deben recibir formación detallada sobre el procedimiento de trabajo adecuado, las propiedades peligrosas del producto y las instrucciones de seguridad necesarias. Para obtener información adicional, consulte la hoja de datos sobre seguridad de los materiales. 5. El vial 8, Wash Buffer (10x), contiene 5-<10% 2-Amino-2-(hidroximetil) propano-1,3-diol, clorhidrato y 0.1-<0.2% 5-bromo-5-nitro-1,3-dioxano. Puede provocar una reacción alérgica. Wash Buffer (10x) tiene la etiqueta: Atención H319 P280 P264 P305 + P351 + P338 Provoca irritación ocular grave. Llevar gafas o máscara de protección. Lavarse las manos concienzudamente tras la manipulación. EN CASO DE CONTACTO CON LOS OJOS: Aclarar cuidadosamente con agua durante varios minutos. Quitar las lentes de contacto, si lleva y resulta fácil. Seguir aclarando. 6. Este producto contiene azida sódica (NaN 3 ), un producto químico muy tóxico en su forma pura. A las concentraciones en las que está presente en el producto, aunque no se clasifican como peligrosas, la azida sódica puede reaccionar con las cañerías de plomo y cobre, lo que formará acumulaciones de azidas metálicas muy explosivas. En el momento de su desecho, aclare con agua abundante, para impedir que la azida metálica se acumule en las tuberías (21, 22). 7. Los viales 2, 3 y 4 contienen material de origen animal. Como con cualquier producto derivado de fuentes biológicas, deben utilizarse los procedimientos de manipulación apropiados. ( ) P04454ES_01_K / p. 9/55
10 Cáncer de mama 8. Los portaobjetos de control y los especímenes, antes y después de la fijación, y todos los materiales expuestos a ellos, deben manipularse como si pudieran transmitir una infección y deben desecharse tomando las precauciones adecuadas (23). Nunca pipetee los reactivos con la boca y evite el contacto de la piel y las membranas mucosas con los reactivos y las muestras. Si los reactivos entran en contacto con zonas sensibles, lávelas con abundante agua. 9. Minimice la contaminación microbiana de los reactivos para evitar una tinción no específica. 10. Los tiempos, las temperaturas o los métodos de incubación diferentes de los especificados pueden producir resultados erróneos. El secado excesivo durante más de una hora a 60 C puede causar una disminución significativa o pérdida de la inmunorreactividad para HER2 asociada a la membrana específica (17). 11. Los reactivos se suministran a la dilución óptima. Una nueva dilución puede ocasionar la pérdida de la tinción antigénica. 12. Todos los reactivos, incluidos Epitope Retrieval Solution y Wash Buffer, están formulados para utilizarse específicamente en esta prueba. Para que la prueba pueda realizarse según las especificaciones, no deben realizarse sustituciones salvo en el caso del Wash Buffer, cuando pueda utilizarse el Nº de catálogo S El Visualization Reagent y DAB Chromogen pueden verse perjudicados si quedan expuestos a niveles de luz demasiado intensos. No almacene componentes del sistema ni realice la tinción bajo una luz demasiado intensa, como la luz solar directa. 14. Lleve puesto equipo protector personal apropiado a fin de evitar que el producto entre en contacto con los ojos y la piel. Para obtener información adicional, consulte la Hoja de datos sobre seguridad de los materiales (SDS, por sus siglas en inglés). 15. Los residuos de parafina pueden dar lugar a falsos negativos. 16. El uso de volúmenes de reactivo distintos de los recomendados puede dar lugar a una pérdida de inmunoreactividad visible a HER2. Si el corte de tejido delimitado no está totalmente cubierto por 3 gotas (100 µl) de reactivo, deben añadirse otras 3 gotas. ( ) P04454ES_01_K / p. 10/55
11 Cáncer de mama INSTRUCCIONES DE USO - Mama A. Preparación del reactivo Es conveniente preparar los siguientes reactivos antes de realizar la tinción: A.1 Epitope Retrieval Solution Diluya una cantidad suficiente del vial 7 (Epitope Retrieval Solution 10x) a 1:10 utilizando agua destilada o desionizada para el procedimiento de tinción previsto. La solución diluida sin usar puede almacenarse a 2 8 C durante un mes. Si la so lución diluida presenta un aspecto turbio, deséchela. A.2 Wash Buffer Diluya una cantidad suficiente del vial 8 (Wash Buffer 10x) a 1:10 utilizando agua destilada o desionizada para los pasos del lavado. El tampón diluido sin usar puede almacenarse a 2 8 C durante un mes. Deseche la solución tampón si tiene un aspecto turbio. Puede utilizarse agua destilada o desionizada para el aclarado después de las incubaciones en Peroxidase-Blocking Reagent, Substrate-Chromogen Solution y hematoxilina. El resto de pasos de aclarado requieren el uso del Wash Buffer. A.3 Substrate-Chromogen Solution (DAB) Con el procedimiento que sigue se obtiene 1 ml de Substrate-Chromogen Solution. Una porción alícuota de 1 ml es suficiente para diez cortes de tejido. Paso 1: Transfiera 1 ml de DAB Buffered Substrate del vial 5 a un tubo de ensayo. Paso 2: Añada una gota (25 30 µl) de DAB Chromogen del vial 6. Mézclela y aplíquela a los cortes de tejido con una pipeta. La solución preparada Substrate-Chromogen Solution (DAB) se mantiene estable aproximadamente unos 5 días si se almacena a entre 2 y 8 C. Esta solución debe mezclarse minuciosamente antes de su utilización. La calidad de la tinción no se verá afectada por la formación de precipitado en la solución. NOTA: el color del DAB Chromogen del vial 6 puede variar de un marrón-azul lavanda claro a uno suave. Esto no alterará el rendimiento de este producto. Realice la dilución con arreglo a las pautas de este prospecto. La adición excesiva de DAB Chromogen al DAB Buffered Substrate ocasionará el deterioro de la señal positiva. A.4 Contratinción El producto final teñido resultante de la reacción de tinción de DAB es insoluble en alcohol y agua. Utilice una contratinción de hematoxilina y ajuste la intensidad de tinción de la hematoxilina a un nivel similar al mostrado en el HercepTest Interpretation Manual Breast Cancer de Dako. Puede utilizarse hematoxilina, ya sea en solución acuosa o de alcohol, como Dako Mayer's Hematoxylin, Nº de catálogo S3301. Tras la contratinción con hematoxilina, realice un aclarado intenso en agua destilada o desionizada y, seguidamente, sumerja los cortes de tejido en un baño de agua de amoníaco a 37 mmol/l (véase el paso 6 de la sección B.2). El agua de amoníaco (37 mmol/l) se prepara mezclando 2,5 ml de hidróxido amónico a 15 mol/l (concentrado) con 1 litro de agua destilada o desionizada. El agua de amoníaco a 37 mmol/l que no se utilice puede conservarse a temperatura ambiente (20 25 C) en un frasco tapado herméticamente hasta 12 meses. A.5 Medio de montaje Se recomienda un medio de montaje no acuoso y permanente. No obstante, el montaje acuoso también resulta aceptable. Se recomienda la utilización de Dako Faramount Aqueous Mounting ( ) P04454ES_01_K / p. 11/55
12 Cáncer de mama Medium, Ready-to-Use, Nº de catálogo S3025 o Glycergel Mounting Medium, Nº de catálogo C0563 para un montaje acuoso. Licue Glycergel calentándolo a aproximadamente 40 (±5) C antes de su uso. B Procedimiento de tinción B.1 Notas referentes al procedimiento El usuario debe leer detenidamente estas instrucciones y familiarizarse con todos los componentes antes de su uso (consulte la sección Precauciones). Todos los reactivos deben equilibrarse a temperatura ambiente (20 25 C) antes de la inmunotinción. De forma similar, todas las incubaciones deben realizarse a temperatura ambiente. No deje que los cortes de tejido se sequen durante el procedimiento de tinción. Los cortes de tejido secos pueden mostrar una mayor tinción no específica. Cubra los portaobjetos expuestos a corrientes. Si se utilizan incubaciones prolongadas, coloque los tejidos en un ambiente húmedo. Si debe interrumpirse el procedimiento de tinción, los portaobjetos pueden guardarse en un baño de tampón después de la incubación del anticuerpo primario (paso 3) como máximo una hora a temperatura ambiente (20 25 C) sin que afecte al r endimiento de la tinción. Desparafinado y rehidratación: antes de la tinción, los portaobjetos con los tejidos deben desparafinarse, para eliminar el medio de inclusión, y rehidratarse. Evite una retirada incompleta de la parafina. Cualquier residuo del medio de inclusión provocaría un aumento de la tinción no específica. Este paso debe realizarse a temperatura ambiente (20 25 C). 1. Coloque los portaobjetos en un baño de xileno e incube durante 5 (±1) minutos. Cambie los baños y repita una vez. 2. Elimine el exceso de líquido golpeando suavemente los portaobjetos e introdúzcalos en etanol absoluto durante 3 (±1) minutos. Cambie los baños y repita una vez. 3. Golpee suavemente para eliminar el exceso de líquido e introduzca los portaobjetos en etanol al 95% durante 3 (±1) minutos. Cambie los baños y repita una vez. 4. Elimine el exceso de líquido golpeando suavemente los portaobjetos e introdúzcalos en agua destilada o desionizada un mínimo de 30 segundos. Inicie el proceso de tinción tal y como se expone en el paso 1 Recuperación de epítopo de la sección B.2. Las soluciones de xileno y alcohol deben cambiarse después de 40 portaobjetos. En lugar de xileno, pueden utilizarse sustitutos de tolueno o xileno, como Histoclear. NOTA: los reactivos y las instrucciones suministradas en este kit han sido diseñados para una eficacia óptima. Una mayor dilución de los reactivos o la alteración de las temperaturas de incubación puede conducir a resultados erróneos o discordantes. Las diferencias en el procesamiento de tejidos y los procedimientos técnicos en el laboratorio del usuario pueden invalidar los resultados del ensayo para su utilización en la selección de pacientes para la terapia de Herceptin. B.2 Protocolo de tinción Realizado a temperatura ambiente, C. Paso 1: Recuperación de epítopo Llene los recipientes de tinción, por ejemplo, cubetas de Coplin, con la Epitope Retrieval Solution diluida (consulte las INSTRUCCIONES DE USO en la sección A.1). Coloque los recipientes de tinción con Epitope Retrieval Solution en un baño de agua. Caliente el baño de agua y la Epitope Retrieval Solution a una temperatura de C. La Epitope Retrieval Solution adquiere un aspecto turbio al calentarla. Cubra los recipientes con tapas para estabilizar la temperatura y evitar la evaporación. Sumerja los cortes desparafinizados a temperatura ambiente en la Epitope Retrieval Solution precalentada de los recipientes de tinción. VUELVA A SITUAR LA ( ) P04454ES_01_K / p. 12/55
13 Cáncer de mama TEMPERATURA DEL BAÑO DE AGUA Y LA EPITOPE RETRIEVAL SOLUTION DE NUEVO A C. Incúbela durante 40 (±1) minutos a C. Saque la jarra entera con los portaobjetos del baño de agua. Deje que los portaobjetos se enfríen en la Epitope Retrieval Solution durante 20 (±1) minutos a temperatura ambiente. Decante la Epitope Retrieval Solution y aclare los portaobjetos en el Wash Buffer diluido (consulte las INSTRUCCIONES DE USO de la sección A.2). Para un rendimiento óptimo, empape los cortes en Wash Buffer entre 5 y 20 minutos después de la recuperación de epítopo y antes de la tinción. NOTA: la Epitope Retrieval Solution está pensada para una aplicación de un solo uso. No la reutilice. Paso 2: Peroxidase-Blocking Reagent Golpee suavemente para eliminar el exceso de tampón. Con la ayuda de una tela sin hilas (como una toallita Kimwipe o una gasa), limpie alrededor del espécimen para eliminar cualquier líquido presente y conservar los reactivos dentro del área especificada. Rodee el corte de tejido con un bolígrafo Dako. Aplique 3 gotas (100 µl) de Peroxidase-Blocking Reagent para cubrir el espécimen. Incúbelo durante 5 (±1) minutos. Aclárelo suavemente con agua destilada o desionizada o Wash Buffer de un frasco de lavado (no aplique el flujo directamente sobre el tejido) y colóquelo en un baño de tampón. Paso 3: Primary Antibody or Negative Control Elimine el exceso de líquido golpeando suavemente los portaobjetos y límpielos de la forma indicada anteriormente. Cubra el espécimen con 3 gotas (100 µl) de Anti-HER2 Protein o Negative Control Reagent. Incúbelo durante 30 (±1) minutos. Aclárelo suavemente con Wash Buffer de un frasco de lavado (no aplique el flujo directamente sobre el tejido) y colóquelo en un baño de tampón. Si debe interrumpirse el procedimiento de tinción, los portaobjetos pueden guardarse en Wash Buffer después del paso 3 hasta una hora a temperatura ambiente (20 25 C) sin que afecte al rendimiento de la tinción. Paso 4: Visualization Reagent Elimine el exceso de líquido golpeando suavemente los portaobjetos y límpielos de la forma indicada anteriormente. Cubra el espécimen con 3 gotas (100 µl) de Visualization Reagent. Incúbelo durante 30 (±1) minutos. Aclare los portaobjetos como en el paso 3. Paso 5: Substrate-Chromogen Solution (DAB) Limpie los portaobjetos como se indica anteriormente. Cubra el espécimen con 3 gotas (100 µl) de Substrate-Chromogen Solution (DAB). Incúbelo durante 10 (±1) minutos. Aclárelo suavemente con agua destilada o desionizada de un frasco de lavado (no aplique el flujo directamente sobre el tejido). Coloque los residuos de Substrate- Chromogen Solution (DAB) en un contenedor para materiales peligrosos para desecharlos de forma apropiada. ( ) P04454ES_01_K / p. 13/55
14 Paso 6: Contratinción (instrucciones válidas para la hematoxilina) Cáncer de mama Sumerja los portaobjetos en un baño de hematoxilina. Incúbelos entre 2 y 5 minutos, en función de la potencia de la hematoxilina utilizada. Aclárelos suavemente en un baño de agua destilada o desionizada. Asegúrese de que se han eliminado todos los residuos de hematoxilina. Opcional: introduzca los portaobjetos 10 veces en un baño de agua de amoníaco a 37 mmol/l (véase la sección A.4). Aclare los portaobjetos suavemente en un baño de agua destilada o desionizada entre 2 y 5 minutos. NOTA: en función de la duración de la incubación y la potencia de la hematoxilina utilizada, la contratinción dará como resultado una coloración entre azul pálido y azul oscuro de los núcleos celulares. Una contratinción excesiva o incompleta puede invalidar la interpretación correcta de los resultados. Paso 7: Montaje Se recomienda un medio de montaje no acuoso y permanente. De todas formas, un medio de montaje acuoso también resulta aceptable. Los especímenes pueden montarse y taparse con cubreobjetos con un medio de montaje acuoso como Dako Faramount, Nº de catálogo S3025, o Glycergel, Nº de catálogo C0563. NOTA: los portaobjetos pueden leerse cuando resulte apropiado. No obstante, puede que se pierda el color si los portaobjetos se cubren con un medio de montaje acuoso y se exponen a una luz intensa durante una semana. Para minimizar la pérdida de tinte, almacene los portaobjetos en un lugar oscuro a temperatura ambiente (20 25 C). Control de calidad - Mama Las diferencias en la fijación, el procesamiento y la inclusión de tejidos en el laboratorio del usuario pueden generar una variabilidad significativa de los resultados, lo que requeriría un rendimiento regular de los controles internos además de los portaobjetos de control suministrados por Dako. En EE.UU., consulte las indicaciones de control de calidad del Programa de certificación de inmunocitoquímica del Colegio de patólogos americanos (CAP, por sus siglas en inglés), así como la Quality Assurance for Immunocytochemestry, Approved Guideline del CLSI (anteriormente NCCLS) (24) y la referencia 25 para obtener información adicional. Tabla 1. Finalidad del control de calidad diario. Tejido: muestra equivalente a paciente fijada y procesada Anticuerpo específico y anticuerpo secundario Anticuerpo no específico* o tampón más el mismo anticuerpo secundario al utilizado con el anticuerpo específico Control positivo: El tejido o las células que contengan el antígeno objetivo que deba detectarse (puede estar situado en el tejido del paciente). El control ideal es un tejido con una tinción ligeramente positiva, ya que de este modo es más sensible a la degradación del anticuerpo o el antígeno. Controla todos los pasos del análisis. Valida el reactivo y los procedimientos utilizados para la tinción de la proteína HER2. Detección de tinción de fondo no específica. Control negativo: Tejidos o células que se prevén negativos (pueden estar situados en el tejido del paciente o el tejido de control positivo) Detección de reactividad cruzada no buscada del anticuerpo con las células o componentes celulares. Detección de tinción de fondo no específica. Tejido de paciente Detección de tinción específica Detección de tinción de fondo no específica. ( ) P04454ES_01_K / p. 14/55
15 Cáncer de mama Portaobjeto de control suministrado por Dako Controla solamente el procedimiento de tinción * El suero es de la misma especie que el anticuerpo específico, pero no va dirigido al mismo antígeno objetivo. Para detectar un ligamiento de anticuerpo no específico, por ejemplo, ligamiento de la porción Fc del anticuerpo al tejido. Portaobjeto de control (suministrado): cada uno de los portaobjetos de control contiene tres líneas celulares con cáncer de mama humano en pellet, incluidas en parafina y fijadas en formol con unas puntuaciones de intensidad de tinción de 0, 1+ y 3+. En cada secuencia de tinción debe teñirse sólo un portaobjeto. La evaluación de las líneas celulares del portaobjeto de control suministrado por Dako indica la validez de la secuencia de tinción. Tejido de control positivo: los controles deben ser especímenes procedentes de autopsia, biopsia o quirúrgicos fijados, procesados e incluidos tan rápido como sea posible de la misma forma que las muestras de pacientes. Los controles de tejido positivos indican si los tejidos se han preparado correctamente y si se han utilizado las técnicas de tinción oportunas. Debe incluirse un tejido de control positivo para cada conjunto de condiciones de prueba en cada secuencia de tinción. Los tejidos de control positivo deben mostrar una tinción positiva débil para que puedan detectar cambios leves en la sensibilidad del anticuerpo primario. Los portaobjetos de control suministrados con este kit o los especímenes procesados de forma diferente de la(s) muestra(s) del paciente validan sólo el rendimiento del reactivo y no verifican la preparación del tejido. Utilice la proteína HER2 2+ determinada con anterioridad que sobreexprese tejido de carcinoma de mama humano invasivo (infiltrado) para un control de tejido positivo óptimo. NOTA: el tejido de control positivo conocido sólo debe utilizarse para realizar el seguimiento del rendimiento correcto de los tejidos procesados y los reactivos de la prueba y NO como una ayuda para formular un diagnóstico específico de las muestras de paciente. Si el tejido de control positivo no consigue demostrar una tinción positiva apropiada, los resultados de los especímenes de paciente deberán considerarse inválidos. Tejido de control negativo: utilice un tejido de control negativo (que se haya demostrado negativo para la proteína HER2) fijado, procesado e incluido de idéntica forma a la muestra o las muestras de paciente de cada secuencia de tinción para verificar la especificidad del anticuerpo primario y ofrecer una indicación de una tinción de fondo específica. El colon, el hígado o el tiroides son apropiados como tejido de control negativo. La variedad de tipos celulares diferentes presentes en la mayoría de cortes de tejido ofrece puntos de control negativo internos (debe verificarlo el usuario). Los conductos mamarios normales pueden actuar como controles negativos internos. Si se produce una tinción específica en el tejido de control negativo o en el tejido de control negativo interno, los resultados de los especímenes de pacientes deben considerarse inválidos y debe repetirse la prueba. Reactivo de control negativo no específico: utilice el reactivo de control negativo suministrado en lugar del anticuerpo primario con un corte de cada espécimen de paciente para evaluar la tinción no específica y permitir una mejor interpretación de la tinción específica en la zona del antígeno. El periodo de incubación para el reactivo de control negativo debe corresponderse con el del anticuerpo primario. Verificación del ensayo: antes del uso inicial de un anticuerpo o un sistema de tinción en un procedimiento de diagnóstico, el usuario debe verificar la especificidad del anticuerpo sometiéndolo a una prueba en un conjunto de tejidos internos con unas características de rendimiento inmunocitoquímico demostradas que representen tejidos positivos y negativos conocidos. Consulte los procedimientos de control de calidad descritos anteriormente en esta sección del prospecto y los requisitos de control de calidad del Programa de certificación del CAP respecto a la inmunocitoquímica y/o la Quality Assurance for Immunocytochemestry, Approved Guideline (24) del CLSI (anteriormente NCCLS). Estos procedimientos de control de calidad deben repetirse para cada nuevo lote de anticuerpos o siempre que se produzca un cambio en los parámetros de ensayo. Los carcinomas de mama con intensidades demostradas de tinción de la ( ) P04454ES_01_K / p. 15/55
16 Cáncer de mama proteína HER2 de entre 0 y 3+ y los tejidos negativos, como el colon, el hígado o el tiroides, son válidos para la verificación del ensayo. Interpretación de la tinción - Mama En la determinación de la sobreexpresión de la proteína HER2, sólo deben evaluarse la intensidad y el patrón de tinción de la membrana, utilizando la escala presentada en la tabla 2. La evaluación del portaobjetos debe realizarla un patólogo con la ayuda de un microscopio óptico. Para la evaluación de la tinción y la puntuación inmunocitoquímicas, resulta apropiado un objetivo de aumento 10x. La utilización de un objetivo de aumento 20 40x puede resultar de utilidad para confirmar la puntuación. La tinción citoplasmática debe considerarse como tinción no específica y no se incluirá en la evaluación de la intensidad de tinción de la membrana (8). Para obtener ayuda con la diferenciación de la tinción de 0, 1+, 2+ y 3+, consulte el HercepTest Interpretation Manual Breast Cancer de Dako en el que hallará fotografías representativas de las intensidades de tinción. Sólo deben contabilizarse los especímenes de pacientes con carcinoma de mama invasivo. En los casos con carcinoma in situ y carcinoma invasivo en la misma muestra, sólo debe puntuar el componente invasivo. ( ) P04454ES_01_K / p. 16/55
17 Cáncer de mama Tabla 2. Criterios de intensidad de tinción de la membrana celular. Patrón de tinción Puntuación (Comunicar al médico responsable del tratamiento) Evaluación de la sobreexpresión de la proteína HER2 (Comunicar al médico responsable del tratamiento) No se observa tinción o la tinción de la membrana se observa en menos de un 10% de las células tumorales 0 Negativa Se detecta una tinción de la membrana débil o prácticamente imperceptible en más de un 10% de las células tumorales. Las células sólo presentan tinción en parte de su membrana 1+ Negativa Se observa una tinción de membrana completa entre débil y moderada en más de un 10% de las células tumorales Se observa una tinción de membrana completa fuerte en más de un 10% de las células tumorales Ligeramente positiva Notablemente positiva HercepTest se interpreta como negativo para la sobreexpresión de la proteína HER2 (con intensidad de tinción 0 y 1+), débilmente positivo (con intensidad de tinción 2+) y altamente positivo (con intensidad de tinción 3+). HercepTest no está pensado para ofrecer información de pronóstico a los pacientes y médicos y no se ha validado a este efecto. Para cada secuencia de tinción, deben examinarse los portaobjetos del modo presentado en la tabla 3 para determinar la validez de la secuencia de tinción y permitir una evaluación semicuantitativa de la intensidad de tinción del tejido muestra. ( ) P04454ES_01_K / p. 17/55
18 Cáncer de mama Tabla 3. Orden de evaluación de los portaobjetos. Orden de lectura de los portaobjetos Exposición de motivos 1. Portaobjetos de control con tres líneas celulares La presencia de tinción marrón 3+ en la membrana celular (desoxidación) en la línea celular de control 3+ SK-BR-3, desoxidación marrón parcial en la línea celular de control 1+ MDA-175 y la ausencia de tinción en la línea celular de control 0 MDA-231 indican la validez del ensayo. Se observa tinción de membrana punteada y discontinua en un número de pequeño a moderado de las células de la línea de células de control 1+ MDA-175 que presentan tinción levemente positiva, así como una inmunotinción punteada de la región de Golgi del citoplasma en esta misma línea de células. La presencia de tinción marrón en la línea celular de control 0 MDA-231 (negativa para la tinción de la proteína HER2) indica que no se produjo tinción no específica durante el ensayo. Los resultados del ensayo pueden quedar invalidados debido a la sobretinción. 2. Portaobjetos de tejido de control positivo Debe observarse presencia de tinción marrón en la membrana. La tinción del citoplasma y los tejidos negativos no debe ser superior a Portaobjetos de tejido de control negativo La AUSENCIA de tinción específica en el portaobjeto de tejido de control negativo confirma la inexistencia de reactividad cruzada del kit con las células o los componentes celulares. Si se produce tinción de una membrana específica en el portaobjeto de tejido de control negativo, los resultados del espécimen del paciente deben considerarse inválidos. 4. Portaobjetos con tejido de paciente teñido con reactivo de control negativo 5. Portaobjetos con tejido de paciente teñido utilizando el anticuerpo primario La ausencia de tinción de una membrana específica verifica el marcado específico del antígeno de objetivo por parte del anticuerpo primario. La tinción oscura o marrón que pueda producirse en el citoplasma del espécimen tratado con el reactivo de control negativo, como en el tejido conjuntivo, los leucocitos, eritrocitos o tejido necrótico, debe considerarse como tinción de fondo no específica e incluirse en la sección de comentarios de la hoja de datos. Cuando se detecta sobreexposición de la proteína HER2 en el espécimen, aparecerá como desoxidación marrón localizada en la membrana celular de las células tumorales tratadas con el anticuerpo primario. 1. Portaobjeto de control (suministrado): el portaobjeto de control teñido con HercepTest debe examinarse en primer lugar para determinar que todos los reactivos funcionan correctamente. La presencia de un producto de reacción marrón (3,3 '- diaminobenzidina, DAB) en la membrana celular indica una reactividad positiva. La presencia de tinción marrón en circunferencia en la membrana celular (desoxidación) en la línea celular de control 3+ SK-BR-3, desoxidación marrón parcial en la línea celular de control 1+ MDA-175 y la ausencia de tinción en la línea celular de control 0 MDA-231 indican la validez del ensayo. Si alguna de las líneas celulares de control muestran comportamientos diferentes a los señalados, todos los resultados de los especímenes de pacientes deberán considerarse inválidos. 2. Tejido de control positivo: el portaobjeto del tejido de control positivo deberá examinarse a continuación. Este portaobjeto verifica que el método de fijación y el proceso de recuperación de epítopo son efectivos. Utilice células intactas para la interpretación de los resultados de tinción, puesto que las células necróticas o degeneradas a menudo muestran tinción no específica (26). La tinción debe observarse en el tejido tumoral como una tinción marrón en la membrana celular. La tinción marrón del citoplasma y los tejidos negativos del espécimen no debe superar la puntuación de intensidad de tinción de 1+ correspondiente. 3. Tejido de control negativo: el portaobjeto con tejido de control negativo debe examinarse después del tejido de control positivo para verificar la especificidad del etiquetado del antígeno objetivo por parte del anticuerpo primario. La ausencia de tinción específica en el tejido de control ( ) P04454ES_01_K / p. 18/55
19 Cáncer de mama negativo confirma la inexistencia de reactividad cruzada del kit con las células o los componentes celulares. Si se produce tinción específica en el tejido de control negativo, los resultados del espécimen del paciente deben considerarse inválidos. De forma alternativa, las porciones negativas del tejido de control positivo pueden funcionar igual que el tejido de control negativo, aunque debe verificarlo el usuario. Debe tenerse en cuenta que es posible observar una reacción débil (intensidad de tinción de 0 a 1+) en la mayor parte del tejido epitelial normal. Los posibles tejidos de control negativo incluyen: colon, hígado y tiroides. La tinción no específica, en su caso, tendrá una apariencia difusa. También es posible que se observe una tinción esporádica del tejido conjuntivo en cortes de tejido excesivamente fijados con formol Tejido de paciente: examine en último lugar los especímenes de pacientes teñidos con HercepTest. Debe evaluarse la intensidad de tinción positiva dentro del contexto de una tinción de fondo no específica del reactivo de control negativo. Igual que con cualquier prueba inmunocitoquímica, un resultado negativo significa que el antígeno no se ha detectado, y no que esté ausente de las células o el tejido sometido a ensayo. Consulte los apartados Resumen y explicación, Limitaciones y Características de rendimiento para obtener información específica respecto a la inmunorreactividad de HercepTest. Recomendaciones adicionales para la interpretación de la tinción con HercepTest La mayoría de carcinomas metastásicos de mama sometidos a prueba para determinar la sobreexpresión de la proteína HER2 reciben una puntuación de 0 ó 3+. Aunque la mayoría de estos casos están perfectamente definidos, un pequeño porcentaje de las muestras 1+ y 2+ restantes pueden resultar más difíciles de interpretar. Utilice las siguientes indicaciones para la interpretación de la tinción de HercepTest en su laboratorio. Evalúe las líneas celulares de control para validar el rendimiento del ensayo. Evalúe los portaobjetos de control negativo y positivo. Se recomienda una tinción de hematoxilina y eosina del espécimen del tejido para la primera evaluación. (Puede que el tumor no parezca evidente al observar la muestra teñida con HercepTest. Se requiere un portaobjeto teñido con hematoxilina y eosina para que el patólogo pueda verificar la presencia del tumor.) HercepTest debe realizarse en un corte emparejado (corte estándar) del mismo bloque de parafina del espécimen. Evalúe en primer lugar los cortes teñidos para la sobreexpresión de la proteína HER2 a baja potencia. La mayoría de casos positivos serán evidentes con aumento a baja potencia. Las áreas preservadas y teñidas correctamente del espécimen deben utilizarse para realizar una determinación del porcentaje de células tumorales positivas. En general, la puntuación de los casos debería mostrarse evidente con un aumento bajo. Si la determinación de los casos a caballo entre 1+ y 2+ resulta difícil con un aumento bajo, la puntuación suele ser 1+. Para verificar la tinción de la membrana, utilice un objetivo de 20 40x aumentos. Si la mayoría de las células tumorales muestran una tinción completa de la membrana, la tinción será 2+ ó 3+. Recurra al objetivo de 20 40x aumentos para confirmar la puntuación. En la mayoría de los casos de 3+, por lo menos un 80% de las células tumorales presentan tinción, y la tinción de la membrana es intensa. Si el espécimen se halla cerca del punto de corte del 10% de las células tumorales positivas, se recomienda realizar un recuento de un mínimo de 100 células tumorales para determinar el porcentaje de células teñidas. Si existe una tinción completa de la membrana con una intensidad entre débil y moderada en un porcentaje de células tumorales superior al 10%, la puntuación del espécimen es 2+. Esto suele venir acompañado de una tinción incompleta de la membrana en la mayoría de las células tumorales restantes. ( ) P04454ES_01_K / p. 19/55
20 Cáncer de mama Si menos de un 10% de las células tumorales presenta tinción circunferencial completa de la membrana, aunque otras células tumorales puedan mostrar una tinción completa de la membrana, la puntuación es 1+. Si menos de un 10% de las células tumorales presenta tinción circunferencial completa o incompleta de la membrana, la puntuación es 0. Limitaciones: mama Limitaciones generales 1. La inmunocitoquímica es un proceso de diagnóstico de varias etapas que requiere formación especializada en la selección de los reactivos apropiados; la selección, la fijación y el procesamiento de tejidos; la preparación del portaobjeto de inmunocitoquímica, y la interpretación de los resultados de la tinción. 2. El resultado de la tinción de tejidos depende de la manipulación y el procesamiento que se haga del tejido antes de su tinción. Si el tejido se fija, congela, descongela, lava, seca, calienta o corta incorrectamente, o si se contamina por contacto con otros tejidos o líquidos, pueden producirse artefactos, atrapamiento de anticuerpos o resultados falso negativos. La aparición de resultados no coherentes puede deberse a variaciones en los métodos de fijación y de inclusión, o a irregularidades inherentes al tejido. 3. Una contratinción excesiva o incompleta puede invalidar la interpretación correcta de los resultados. 4. La interpretación clínica de toda tinción positiva o de su ausencia debe evaluarse en el contexto de la presentación clínica, la morfología y otros criterios histopatológicos. La interpretación clínica de toda tinción, o de su ausencia, debe complementarse con estudios morfológicos y controles adecuados, así como con otras pruebas diagnósticas. Un patólogo certificado y familiarizado con los anticuerpos, reactivos y métodos utilizados, debe responsabilizarse de interpretar la preparación teñida. La tinción debe realizarse en un laboratorio certificado y con licencia, bajo la supervisión de un patólogo responsable de la revisión de los portaobjetos teñidos y de garantizar la corrección de los controles positivos y negativos. 5. Es posible que los tejidos de las personas infectadas con el virus de la hepatitis B y con antígeno de superficie de hepatitis B (HBsAg) muestren tinción no específica con peroxidasa de rábano rusticano (27). 6. Los reactivos pueden mostrar reacciones imprevistas en tipos de tejidos no probados previamente. La posibilidad de reacciones imprevistas incluso en tipos de tejido probados no puede eliminarse por completo, debido a la variabilidad de la expresión del antígeno en las neoplasias u otros tejidos patológicos (28). Póngase en contacto con los Servicios técnicos de Dako con pruebas documentales de la reacción imprevista. 7. Pueden observarse resultados falso positivos debidos a un ligamiento no inmunológico de las proteínas o de los productos de reacción del sustrato. También pueden estar provocados por la actividad de la pseudoperoxidasa (eritrocitos) y la actividad de la peroxidasa endógena (citocromo C) (28). 8. El procedimiento de tinción debe realizarse a una temperatura ambiente de entre 20 y 25 C. ( ) P04454ES_01_K / p. 20/55
21 Cáncer de mama Limitaciones específicas del producto 1. El antígeno presente en la línea celular de control 1+ MDA-175 se degradará con el tiempo. Evalúe los resultados del portaobjeto de control teniendo en cuenta la fecha de caducidad del mismo. Una tinción negativa de las células MDA-175 puede indicar que el portaobjeto de control se ha degradado. Los portaobjetos de control deben almacenarse a una temperatura de entre 2 y 8 C. 2. Es posible que la degradación del antígeno en los tejidos provocase con el tiempo resultados falso negativos. Cuando se almacenan a temperatura ambiente (20 25 C), los especímenes deben teñirse antes de que transcurran de 4 a 6 semanas desde el montaje de los tejidos en los portaobjetos (29). 3. Para obtener unos resultados óptimos y reproducibles, la proteína HER2 exige una recuperación de epítopo por calor cuando los tejidos se fijan de la forma rutinaria (formol tamponado neutro o fijador de Bouin) y se incluyen en parafina. Este pretratamiento debe completarse al principio de todo el proceso de tinción. Consulte la sección Preparación del espécimen. Tratamiento de los tejidos antes de la tinción, para obtener instrucciones. 4. La recuperación de epítopo por calor de la proteína HER2 sólo debe realizarse mediante un baño de agua calibrado. Se han probado otros métodos de calentamiento que no han arrojado resultados reproducibles. 5. No sustituya los reactivos del kit por reactivos con otros números de lote o con reactivos de otros fabricantes. La única excepción es el tampón de lavado, que puede reemplazarse por el tampón de lavado Dako con Nº de catálogo S Pueden obtenerse resultados falsos de la evaluación de la tinción citoplasmática. Al interpretar los resultados, tenga sólo en cuenta la intensidad de la tinción de la membrana celular. 7. Los portaobjetos de control de tinción deben utilizarse exclusivamente para validar la secuencia de tinción y no como guía para registrar la reacción de tinción en secciones de tejidos. 8. En ocasiones puede observarse una tinción focal fuerte (3+), es decir, puntos calientes. Este resultado puede deberse a una fijación o a un procesamiento irregular del tejido. En este caso, se recomienda la inmunotinción de un segundo bloque de tejidos del mismo espécimen. 9. No se ha validado el uso de HercepTest en especímenes fijados con fijadores distintos del formol tamponado neutro o el fijador de Bouin. 10. El epitelio normal del tejido mamario debe producir una tinción de entre 0 y 1+. Si se observa una tinción del epitelio normal superior a 1+, debe repetirse la prueba. Tenga en cuenta que los epitelios normales de las amígdalas y el esófago pueden ofrecer una intensidad de tinción superior a 2+. Características de resultados - Mama Antecedentes El ensayo clínico (CTA) utilizado para identificar a los pacientes idóneos para participar en los estudios clínicos de Herceptin estaba destinado a usos en investigación y ya no se encuentra disponible. El HercepTest se desarrolló para ofrecer una alternativa comparable al CTA. Se evaluaron la seguridad y la efectividad de Herceptin en un ensayo clínico controlado y aleatorizado y en un ensayo abierto de dimensiones considerables (véase el prospecto de Herceptin ). Todos los pacientes seleccionados para los ensayos clínicos de Herceptin mostraron una sobreexpresión de la proteína HER2 en pruebas inmunocitoquímicas realizadas con el CTA en un laboratorio central. Se consideraba que los pacientes eran idóneos para el tratamiento con Herceptin si presentaban un tumor con niveles 2+ ó 3+ de sobreexpresión de proteína HER2 (conforme a una escala de 0 a 3+, en la que 3+ representaba el nivel más alto). ( ) P04454ES_01_K / p. 21/55
22 Cáncer de mama El análisis de subgrupo de los resultados de estos estudios indica que los pacientes cuyos tejidos muestran una sobreexpresión de proteína HER2 fuertemente positiva (3+) pueden obtener mayores beneficios de Herceptin que aquellos con resultados menos positivos (2+). Así pues, el grado de sobreexpresión de la proteína HER2 puede ser un factor de predicción importante del efecto del tratamiento con Herceptin. Puesto que ninguno de los pacientes de los estudios de Herceptin se seleccionó a través del HercepTest, se desconoce la correlación entre el grado de positividad y la probabilidad de beneficio clínico del tratamiento con Herceptin. Estudios comparativos Se realizaron dos estudios para caracterizar el HercepTest. 1) Comparación con el ensayo clínico (CTA). 2) Precisión al compararlo con otros cinco ensayos. Comparación con el ensayo clínico (CTA) Se comparó el HercepTest con el CTA utilizado para identificar a los pacientes idóneos para la terapia con Herceptin mediante 274 especímenes con sobreexpresión de proteína HER2 positiva (2+ ó 3+) y un número igual de especímenes de tejido mamario canceroso con sobreexpresión de proteína HER2 negativa. En la tabla 4 se incluyen los resultados en un diagrama 2 x 2, en el que 0 y 1+ se consideraron resultados negativos y 2+ y 3+, resultados positivos. Tabla 4. Concordancia 2 x 2 del HercepTest comparado con el CTA (número de especímenes). Ensayo de pruebas clínicas Positivo Negativa Total HercepTest Positivo Negativa Total Concordancia: 79%, intervalo de confianza al 95% (76 82%). La concordancia binaria total del HercepTest comparado con el CTA fue de un 79% (431 de los 548 casos), con un intervalo de confianza 2 x 2 al 95% de 76 82%. El veintiuno por ciento (21%) de los resultados eran discordantes entre los dos métodos. Los resultados del HercepTest se registraron en una escala de 0 a 3+, en la que la intensidad de tinción 0 a 1+ representaba una sobreexpresión negativa de la proteína HER2; la intensidad de tinción 2+, una sobreexpresión ligeramente positiva, y la intensidad de tinción 3+, una sobreexpresión fuertemente positiva. Tabla 5. Concordancia 3 x 3 del HercepTest y el CTA. Ensayo de pruebas clínicas Total HercepTest Total ( ) P04454ES_01_K / p. 22/55
23 Cáncer de mama Esta presentación 3 x 3 del estudio de concordancia indica que una lectura de 3+ en el HercepTest tiene una alta probabilidad de corresponderse con un resultado positivo en el CTA, lo que habría satisfecho los criterios de entrada del ensayo de Herceptin (2+ ó 3+). Los resultados de 2+ en HercepTest no mostraron una correlación tan buena con los resultados del CTA. Alrededor de un 42% (53 de los 126 casos) de los resultados 2+ del HercepTest resultaron negativos en el CTA (0-1+), lo que no habría posibilitado la entrada en los ensayos clínicos de Herceptin. Precisión También se realizó una prueba del HercepTest con 2 portaobjetos de microscopio que contenían cortes de tejido incluidos en parafina procedentes de 168 tumores de mama. Estos tumores ya se habían caracterizado anteriormente con otros cinco métodos de determinación de la amplificación del gen HER2 y de sobreexpresión de la proteína HER2, como el Southern blot in situ, la hibridación in situ fluorescente (FISH) para la amplificación de ADN, el análisis de ARN de Northern blot, Western blot e inmunocitoquímica en tejidos congelados (29). Los resultados se muestran en la tabla 6. Tabla 6. Comparación del HercepTest con los resultados combinados (OE) de las pruebas de amplificación de genes y de sobreexpresión de proteína HER2. Clasificación de la referencia OE + - Total HercepTest Coincidencia positiva: 43/69 = 62% Coincidencia negativa: 99/99 = 100% Total Los resultados mostraban un nivel de confianza del 85% (142 de los 168 casos; intervalo de confianza al 95% de 78 89%) entre la intensidad de tinción positiva (2+ y 3+) y negativa (0 y 1+) en el HercepTest. Ninguna de las muestras negativas en los otros cinco métodos resultaron positivas en el HercepTest, aunque los resultados combinados de los otros cinco métodos presentaban un mayor número de casos positivos. Reproducibilidad Reproducibilidad interna: la reproducibilidad interna se probó en un laboratorio con 5 especímenes con diferentes intensidades de tinción en inmunocitoquímica. Cada espécimen se probó por triplicado en formato aleatorio enmascarado. Este mismo protocolo se empleó en la tinción manual y en la tinción automática. Todos los especímenes dieron un 100% de resultados reproducibles. Reproducibilidad entre secuencias: la reproducibilidad entre secuencias se probó en tres laboratorios durante un periodo de 4 días con 5 especímenes con diferentes intensidades de tinción en inmunocitoquímica aleatorizados y enmascarados, utilizando una metodología automatizada. Uno de los laboratorios repitió el protocolo empleando una metodología manual. Se observó una reproducibilidad excelente para los resultados positivos en comparación con los resultados negativos (0 y 1+ frente a 2+ y 3+), con la excepción de dos muestras de un laboratorio que empleó la metodología automatizada, que variaban entre 1+ y 2+. Hubo un 100% de reproducibilidad de las muestras con 2+ y 3+. Reproducibilidad entre laboratorios: se probó la reproducibilidad entre laboratorios en tres laboratorios separados geográficamente con 40 especímenes idénticos aleatorizados y enmascarados con diferentes intensidades de tinción en inmunocitoquímica. Se enviaron portaobjetos recién cortados a cada uno de los laboratorios para que un patólogo los tiñera manual y automáticamente y evaluara los resultados. El porcentaje de coincidencia entre laboratorios iba de un 82% a un 90% en el caso de la determinación dicotómica positivo/negativo, ( ) P04454ES_01_K / p. 23/55
24 Cáncer de mama en la que 0 y 1+ eran resultados negativos y 2+ y 3+ eran resultados positivos de la sobreexpresión de la proteína HER2. En comparación con los resultados obtenidos en el laboratorio de referencia que había realizado el CTA, un 12,5% (15 de los 120 casos) de los resultados comparados discrepaban en cuanto a la determinación de resultado negativo (0 y 1+) y positivo (2+ y 3+). Además, otro 10% (12 de los 120 casos) de los resultados discrepaba en cuanto a la clasificación en 2+ o en 3+. Inmunorreactividad En la tabla 7 aparece un resumen de la inmunorreactividad del HercepTest junto con el panel recomendado de tejidos normales. Todos los tejidos estaban fijados con formol e incluidos en parafina y se habían teñido con el HercepTest de acuerdo con las instrucciones del prospecto. Tabla 7. Resumen de la reactividad de tejido normal en el HercepTest. Tipo de tejido (N.º analizado) Suprarrenal (3) Medula ósea (3) Encefálico/cerebral (3) Encefálico/cerebral (3) Mamario (3) Cuello uterino (3) Colónico (3) Esofágico (3) Cardiaco (3) Renal (3) Hepático (3) Pulmonar (3) Mesotelial (3) Ovárico (3) Pancreático (3) Paratiroideo (3) Nervio periférico (3) Hipófisis (3) Prostático (3) Glándula salivar (3) Músculo esquelético (3) Cutáneo (3) Intestino delgado (3) Esplénico (3) Gástrico (3) Testicular (3) Tímico (3) Tiroideo (3) Amigdalino (3) Uterino (3) Tinción de elemento tisular positivo y patrón de tinción Glándula mamaria (2/3 tejidos, intensidad de tinción 1+, <5% de las células) Células epiteliales (1/3 tejidos, intensidad de tinción 1+, <5% de las células, membrana y citoplasma, granular) Células epiteliales foliculares (1/3 tejidos, intensidad de tinción 1+, <5% de las células, membrana y citoplasma) Epitelio escamoso (1/3 tejidos, intensidad de tinción 1+, 5% de las células. 2/3 tejidos, intensidad de tinción 2+, 10-20% de las células. Membrana y citoplasma) Tejido endometrial (2/3 tejidos, intensidad de tinción 1+, 30-60% de las células, citoplasma, granular) La tinción registrada en todos los tejidos se refiere a la membrana, a menos que se indique lo contrario. Los tres especímenes de cada tipo de tejido presentaron la misma intensidad de tinción a menos que se especifique lo contrario. Solución de problemas - Mama Consulte la sección de resolución de problemas del manual de Dako indicado anteriormente (19) para encontrar una solución o póngase en contacto con el Departamento de servicio técnico de Dako para informar de la tinción inusual. ( ) P04454ES_01_K / p. 24/55
25 Cáncer de mama Problema Causa probable Acción sugerida 1. Los portaobjetos no se tiñeron 1a. Los reactivos no se utilizaron en el orden correcto 1a. Revisar la aplicación de reactivos 2. Tinción débil de los portaobjetos 1b. Presencia de azida sódica en la solución de lavado 1c. Es probable que el calentamiento excesivo de los cortes de tejido montados antes de la desparafinización y la recuperación del antígeno inducida por calor causen la pérdida de la inmunorreactividad visible para HER2. 2a. Recuperación de epítopo insuficiente 2b. Incubación incorrecta del reactivo 2c. Método de fijación no apropiado 2d. Es probable que el calentamiento excesivo de los cortes de tejido montados antes de la desparafinización y la recuperación del antígeno inducida por calor causen una disminución significativa de la inmunorreactividad visible para HER2. 2e. Aplicado un volumen insuficiente de reactivo. 1b. Utilice una preparación reciente del Wash Buffer suministrado en el kit 1c. Seque los cortes de tejido a temperatura ambiente durante un mínimo de 12 horas o hasta que estén secos. Como alternativa, seque a 37 C durante toda la noche o bien seque a 60 C durante un máximo de una hora. El secado de cortes de tejidos a temperaturas altas solo debe efectuarse en un horno calibrado con distribución uniforme del calor (17). 2a. Compruebe que la Epitope Retrieval Solution alcanza los C durante 40 minutos y que se deja enfriar durante 20 minutos 2b. Revise las instrucciones del procedimiento de tinción 2c. Asegúrese de que el tejido del paciente no está sobrefijado y de que no se ha utilizado otro fijador 2d. Seque los cortes de tejido a temperatura ambiente durante un mínimo de 12 horas o hasta que estén secos. Como alternativa, seque a 37 C durante toda la noche o bien seque a 60 C durante un máximo de una hora. El secado de cortes de tejidos a temperaturas altas solo debe efectuarse en un horno calibrado con distribución uniforme del calor (17). 2e. Compruebe el volumen de reactivo aplicado. ( ) P04454ES_01_K / p. 25/55
26 Cáncer de mama Problema Causa probable Acción sugerida 3. Tinción de fondo de portaobjetos excesiva 3a. No se ha retirado por completo la parafina 3a. Utilice soluciones de eliminación recientes y siga el procedimiento tal y como se indica en la sección B.1 4. El tejido se despega del portaobjeto 5. Tinción específica excesivamente fuerte 3b. Se han utilizado aditivos de almidón al montar los cortes en los portaobjetos 3c. No se han aclarado los portaobjetos correctamente 3d. Las secciones se han secado durante el procedimiento de tinción 3e. Método de fijación no apropiado 3f. Enlace no específico de los reactivos con el tejido 4a. Se han utilizado portaobjetos inadecuados 5a. Método de fijación no apropiado 5b. Utilización de una fuente de calor no adecuada para la recuperación de epítopo, como un vaporizador, un horno microondas o un autoclave 5c. Incubación del reactivo demasiado prolongada 5d. Solución de lavado no adecuada 3b. No utilice aditivos de almidón para adherir los cortes al portaobjeto. Muchos aditivos son inmunorreactivos 3c. Utilice una solución reciente en los baños de tampón y en los frascos de lavado 3d. Utilice una cámara húmeda. Limpie sólo de tres a cuatro portaobjetos a la vez antes de aplicar el reactivo 3e. Asegúrese de que se ha utilizado un fijador aprobado. Los fijadores alternativos pueden producir un exceso de tinción de fondo 3f. Compruebe el método de fijación del espécimen y la presencia de necrosis 4a. Utilice portaobjetos silinizados, como los Dako Silanized Slides, Nº de catálogo S3003, los portaobjetos SuperFrost Plus o portaobjetos recubiertos de poli-l-lisina 5a. Asegúrese de que sólo se emplearon fijadores y métodos de fijación aprobados 5b. Asegúrese de que sólo se utiliza un baño de agua para la recuperación de epítopo 5c. Revise las instrucciones del procedimiento de tinción 5d. Utilice únicamente el tampón de lavado recomendado para el kit ( ) P04454ES_01_K / p. 26/55
27 Cáncer de mama Problema Causa probable Acción sugerida 6. Tinción débil de la línea celular del portaobjeto de control 1+ 6a. No se ha seguido el protocolo de recuperación de epítopo correcto 6a. Sumerja los portaobjetos en la solución de recuperación de epítopo precalentada. Haga que la Epitope Retrieval Solution vuelva a alcanzar los C y precaliente durante 40 minutos 6b. No hay reacción con la Substrate Chromogen Solution (DAB) 6b. Asegúrese de que la incubación dura 10 minutos. Asegúrese de que sólo se agregó una gota de cromógeno DAB a 1 ml de DAB Buffered Substrate 7. Epitope Retrieval Solution adquiere un aspecto turbio cuando se calienta 8. Epitope Retrieval Solution adquiere un aspecto turbio cuando se almacena (antes de calentarla) 6c. Degradación del portaobjeto de control 7. La solución adquiere un aspecto turbio cuando se calienta 8. La solución se ha almacenado incorrectamente o ha pasado la fecha de caducidad de la solución 6c. Compruebe la fecha de caducidad del kit y las condiciones de almacenamiento del mismo en la parte exterior del paquete 7. Esto es normal y no influye en la tinción 8. Compruebe la fecha de caducidad y las condiciones de almacenamiento del kit, que se indican en el exterior del paquete. Deseche la Epitope Retrieval Solution. NOTA: si el problema no puede atribuirse a ninguna de las causas expuestas anteriormente o si la medida de corrección que se sugiere no resuelve el problema, llame a los Servicios técnicos de Dako para obtener más ayuda. Puede encontrar información adicional sobre las técnicas de tinción y sobre la preparación de especímenes en el manual de Dako citado anteriormente (19) (disponible en Dako), en Atlas of Immunohistology (30) y en Immunoperoxidase Techniques. A Practical Approach to Tumor Diagnosis (31). ( ) P04454ES_01_K / p. 27/55
28 Cáncer gástrico Resumen y explicación - Gástrico Antecedentes El gen humano HER2 (también conocido como ERBB2 o NEU) codifica una proteína a menudo llamada proteína HER2 o p185 HER2. La proteína HER2 es una tirosinquinasa del receptor de membrana homóloga con el receptor del factor de crecimiento epidérmico (EGFR o HER1) (1 8). La proteína HER2 es un componente normal expresado por una variedad de tipos de células epiteliales (8). La sobreexpresión de la proteína HER2 y la amplificación del gen HER2 en el cáncer gástrico se ha puesto de manifiesto en un gran número de estudios. La positividad para HER2 se puede detectar en aproximadamente el 20% de los pacientes mediante IHC o FISH (32). Estudios preclínicos in vitro e in vivo han puesto de manifiesto que trastuzumab (Herceptin ) es eficaz en diferentes tipos de cáncer gástrico lo que conduce al inicio de estudios clínicos (32-36). En un estudio de fase III BO18255, denominado como ToGA Trial, se aleatorizaron pacientes con adenocarcinoma inoperable localmente avanzado, recurrente y/o metastásico de estómago o de la unión gastroesofágica con HER2 positivo para que recibieran tratamiento con 5-FU o capecitabina y cisplatino en monoterapia o en combinación con trastuzumab. En los pacientes que recibieron el tratamiento combinado de trastuzumab y quimioterapia se observó un aumento estadísticamente significativo de la supervivencia global (SG) (37, 38). Trastuzumab es un anticuerpo monoclonal humanizado que se une con gran afinidad a la proteína HER2 y que ha demostrado ser un inhibidor de la proliferación de células tumorales humanas que sobreexpresan la proteína HER2 in vitro e in vivo (33-36). Características Se ha cribado a pacientes para detectar su estado de HER2 para la participación en el estudio ToGA. En este estudio se detectó tanto la sobreexpresión de la proteína HER2 mediante IHQ (HercepTest, Dako) y de la amplificación del gen HER2 mediante FISH (HER2 FISH pharmdx, Dako). Se obtuvieron resultados de prueba válidos en muestras con pruebas de IHQ o FISH y en muestras con ambas pruebas. Los resultados correspondientes al estudio ToGA mostraron que el 22,1% de los pacientes con cáncer gástrico avanzado dieron positivo para HER2 mediante IHQ o FISH de acuerdo con la definición de los criterios de selección de HER2 de ToGA (38). Con respecto al uso de HercepTest en la evaluación de pacientes para los que se está considerando un tratamiento con trastuzumab, véase el prospecto de Herceptin para obtener más información. Principio del procedimiento - Gástrico HercepTest contiene los reactivos necesarios para completar un procedimiento de tinción inmunocitoquímica en dos pasos con especímenes procesados de forma rutinaria e incluidos en parafina. Después de la incubación con el anticuerpo primario de conejo de la proteína HER2 humana, este kit utiliza un reactivo de visualización listo para su uso basado en tecnología de dextrano. Este reactivo consta tanto de moléculas secundarias de inmunoglobulina de cabra anti-inmunoglobulinas de conejo como de moléculas de peroxidasa de rábano rusticano ligadas a un esqueleto de polímero de dextrano común, lo que elimina la necesidad de una aplicación secuencial de anticuerpos de enlace y anticuerpos conjugados con peroxidasa. La reacción cruzada del reactivo de visualización con las inmunoglobulinas humanas y el suero fetal bovino se ha eliminado por absorción en fase sólida. La conversión enzimática del cromógeno añadido posteriormente provoca la formación de un producto de reacción visible en el lugar del antígeno. Entonces, el espécimen puede someterse a contratinción y se puede colocar el cubreobjetos. Los resultados se interpretan utilizando un microscopio óptico. Los portaobjetos de control que contienen tres líneas celulares humanas con cáncer de mama incluidas en parafina y fijadas en formol con puntuaciones de intensidad de tinción de 0, 1+ y 3+ se suministran para validar las secuencias de tinción. La intensidad de tinción de estas líneas celulares se ha relacionado con el número de receptores por célula. HercepTest, Nº de catálogo K5204, se puede aplicar tanto en tinción manual como automática, utilizando el Autostainer. ( ) P04454ES_01_K / p. 28/55
29 Cáncer gástrico Reactivos - Gástrico Materiales suministrados Los materiales enumerados a continuación son suficientes para 35 pruebas (35 portaobjetos incubados con anticuerpo primario de proteína HER2 y 35 portaobjetos incubados con el reactivo de control negativo correspondiente). El número de pruebas se basa en la utilización de 3 gotas (100 µl) por corte de tejido de los viales núm. 1, 2, 3 y 4 y de la solución Substrate-Chromogen Solution (DAB). El kit suministra material suficiente para un máximo de 5 secuencias individuales de tinción. Núm. vial Cantidad 1 1 x 7 ml 2 1 x 3,5 ml 3 1 x 7 ml 4 1 x 3,5 ml 5 1 x 10 ml 6 1 x 0,5 ml 7 1 x 500 ml Descripción Peroxidase-Blocking Reagent: peróxido de hidrógeno al 3% con azida sódica (NaN 3 ) a 15 mmol/l. Rabbit Anti-Human HER2 Protein: anticuerpo aislado por afinidad listo para su uso. Suministrado en Tris/HCl a 0,05 mol/l, NaCl a 0,1 mol/l, NaN 3 a 15 mmol/l, a ph 7,2 con proteína estabilizadora. Inmunógeno: fragmento sintético de la terminación C (parte intracitoplasmática) de la proteína HER2 enlazado con hemocianina de lapa californiana. Especificidad: proteína HER2 Método de purificación: el anticuerpo se aísla por afinidad utilizando un péptido de la proteína HER2 inmovilizado. Visualization Reagent: polímero de dextrano conjugado con peroxidasa de rábano rusticano e inmunoglobulinas de cabra antiinmunoglobulinas de conejo aisladas por afinidad. Suministrado en tampón Tris/HCl con proteína estabilizadora y agente antimicrobiano. Negative Control Reagent: fracción de inmunoglobulina de suero de conejo normal a una concentración de proteína equivalente a la del anticuerpo de la proteína HER2. Suministrado en Tris/HCl a 0,05 mol/l, NaCl a 0,1 mol/l, NaN 3 a 15 mmol/l, a ph 7,2 con proteína estabilizadora. DAB Buffered Substrate: solución tampón de sustrato, a ph 7,5, con <0,1% peróxido de hidrógeno, estabilizadores, incrementadores y agente antimicrobiano. DAB Chromogen: solución cromógeno de tetraclorhidrato de 3,3 '- diaminobenzidina al 5%. Epitope Retrieval Solution (Containing Detergent) (10x): tampón citrato a 0,1 mol/l con detergente. ( ) P04454ES_01_K / p. 29/55
30 Cáncer gástrico 8 1 x 250 ml 5 portaobjetos Wash Buffer (10x): tampón Tris/HCl con detergente y agente antimicrobiano. Control Slides: cada portaobjetos contiene cortes de tres líneas celulares de carcinoma de mama incluidos en parafina y fijados con formol que representan diferentes niveles de expresión de la proteína HER2. MDA-231 (0), MDA-175 (1+) y SK-BR-3 (3+). Los portaobjetos de control se han tratado con calor para mejorar la adherencia de los cortes a los portaobjetos. Cualquier otro tratamiento por calor de los portaobjetos de control realizado para mejorar la adherencia de los cortes a los portaobjetos puede afectar a los resultados de la tinción. NOTA: Todos los reactivos, incluidos Epitope Retrieval Solution y Wash Buffer, están formulados para utilizarse específicamente en esta prueba. Para que la prueba pueda realizarse según las especificaciones, no deben realizarse sustituciones, salvo en el caso de Wash Buffer, cuando pueda utilizarse el Nº de catálogo de Dako S3006. Materiales necesarios que no se suministran Paños absorbentes Hidróxido amónico, a 15 mol/l diluido a 37 mmol/l Contratinción: hematoxilina, como la solución acuosa Mayer's Hematoxylin, Dako Nº de catálogo S3301 (véanse INSTRUCCIONES DE USO, A.4) Cubreobjetos Bolígrafo delimitador, como el Dako Pen, Nº de catálogo S2002 Agua destilada o desionizada (agua de lavado) Horno de secado, capaz de mantener una temperatura de 60 C o inferior Etanol, absoluto y al 95% Cámara húmeda (opcional) Microscopio óptico (aumento del objetivo de 4 40x) Medio de montaje, como Dako Faramount, Nº de catálogo S3025, o Glycergel, Nº de catálogo C0563 Tejidos positivos y negativos para utilizar como controles de proceso (véase la sección Control de calidad) Portaobjetos, SuperFrost Plus, portaobjetos recubiertos de poli-l-lisina o Dako Silanized Slides, Nº de catálogo S3003 (véase Preparación del espécimen) Jarras o baños de tinción Cronómetro (capaz de cronometrar intervalos de 2 40 minutos) Frascos de lavado Baño de agua con tapa (capaz de conservar la Epitope Retrieval Solution entre 95 y 99 C). Xileno, tolueno o sustitutos de xileno ( ) P04454ES_01_K / p. 30/55
31 Cáncer gástrico Almacenamiento - Gástrico Almacénelo a una temperatura de 2 a 8 C. No utilice el kit después de la fecha de caducidad impresa en la parte exterior del embalaje. Si los reactivos se almacenan en condiciones diferentes de las especificadas en este prospecto, deben recibir la validación del usuario (14a, 14b). Obsérvese que los portaobjetos de control también deben almacenarse a una temperatura de entre 2 y 8 C. No existen signos obvios que indiquen que este producto sea inestable. Por lo tanto, deben llevarse a cabo controles positivos y negativos en simultaneidad con el ensayo en los especímenes de los pacientes. En caso de que se observen tinciones imprevistas que no puedan explicarse por variaciones en los procedimientos del laboratorio y se sospeche que existe un problema con HercepTest, póngase en contacto inmediatamente con los Servicios de asistencia técnica de Dako. Preparación de las muestras - Gástrico Las muestras de adenocarcinoma de las biopsias, escisiones o resecciones del estómago, incluida la unión gastroesofágica, deben manipularse correctamente para conservar el tejido para la tinción inmunocitoquímica. Deben utilizarse los métodos estándar de procesamiento de tejidos para todos los especímenes (15). Cuando se analicen muestras pequeñas de biopsia, se determinará con precisión la morfología intacta del tumor y la presencia de células tumorales suficientes para realizar la evaluación mediante ICH. Si el análisis HercepTest se realiza en una muestra de biopsia, para garantizar una determinación fiable del estado en cuanto a HER2 se deberán analizar varias (7-8) muestras de biopsia de diferentes regiones del tumor. Secciones incluidas en parafina Debe utilizarse tejido conservado en formol tamponado neutro e incluido en parafina. Las muestras deben, por ejemplo, cortarse en bloques de 3 ó 4 mm de espesor y fijarse durante horas en formol tamponado neutro. Las muestras de biopsia se fijaron durante 6-8 horas en el ToGA Trial (para obtener información sobre el estudio, consulte el punto (37)). Los tejidos se deshidratan en una serie de alcoholes y xileno, y luego se realiza una infiltración con parafina fundida a no menos de 60 C. Los tejidos correctamente fijados e inclu idos que expresan la proteína HER2, se conservarán indefinidamente antes de su corte y montaje en portaobjetos si se almacenan en un sitio fresco 25 C) (15, 16). En EE.UU., la Ley de Mejoras de Laboratorio Clínico de 1988 exige en el apartado 42 CFR (b) que El laboratorio debe conservar los portaobjetos teñidos como mínimo durante diez años a partir de la fecha del análisis y los bloques de espécimen como mínimo durante dos años a partir de la fecha del análisis (16). Las muestras de tejido se deben cortar en secciones de 4 5 µm, montar en portaobjetos y dejarlas secar al aire a temperatura ambiente por un mínimo de 12 horas (o hasta que estén secas) o a 37 C durante toda la noche o a 60 C du rante una hora. CUIDADO: El calentamiento excesivo durante más de una hora a 60 C puede causar una disminución significativa o la pérdida de la inmunorreactividad para HER2 asociada a la membrana específica (17). Para conservar la antigenicidad, los cortes de tejido, montados en portaobjetos (portaobjetos SuperFrost Plus, con Poli-L-lysine o silanizados) deben teñirse dentro de un período de 4 a 6 semanas tras ser cortados si se mantienen a temperatura ambiente (20 25 C) (18). Los portaobjetos necesarios para la evaluación de la proteína HER2 y la verificación de la presencia tumoral deben prepararse simultáneamente. Se recomienda un mínimo de 5 portaobjetos: 1 para la presencia tumoral, 2 para la evaluación de la proteína HER2 (1 para la incubación con el vial núm. 2 y 1 para la incubación con el vial núm. 4) y 2 portaobjetos de reserva. La utilización de HercepTest en tejidos decalcificados no se ha validado y no se recomienda. Consultar la Education Guide: Immunohistochemical Staining Methods (19) de Dako y con las referencias 15 y 16 para más detalles sobre la preparación de muestras. ( ) P04454ES_01_K / p. 31/55
32 Cáncer gástrico Tratamiento de los tejidos antes de la tinción Para un rendimiento óptimo del ensayo, debe utilizarse un método específico de recuperación de epítopo: La Epitope Retrieval Solution se suministra con el kit HercepTest. Este método implica el calentamiento de los cortes de tejido montados en portaobjetos sumergidos en tampón citrato a 10 mmol/l (20) en un baño de agua calibrado capaz de mantener la Epitope Retrieval Solution a la temperatura necesaria (95 99 C). Los laboratorios situados en zonas elevadas deben determinar el mejor método para mantener la temperatura necesaria del baño de agua. La recuperación de epítopo debe realizarse en un baño de agua. Se han probado otros métodos de calentamiento que no han arrojado resultados reproducibles. Inmediatamente después de la recuperación de epítopo, inicie el procedimiento de tinción. Una desviación del procedimiento descrito puede alterar los resultados. Precauciones - Gástrico 1. Para uso diagnóstico in vitro. 2. Para uso por profesionales. 3. El vial 1, Peroxidase-Blocking Reagent, contiene un peróxido de hidrógeno al 3%. Hoja de datos sobre seguridad de los materiales disponible previa solicitud para usuarios profesionales. 4. El vial 6, DAB Chromogen, contiene 5-<10% tetracloruro de bifenil-3,3,4,4 -tetrailtetraamonio y está etiquetado como: H350 H341 P201 P280 Peligro P308 + P313 P405 P501 Puede provocar cáncer. Se sospecha que provoca defectos genéticos. Pedir instrucciones especiales antes del uso. Llevar guantes de protección. Llevar gafas o máscara de protección. Llevar prendas de protección. EN CASO DE exposición manifiesta o presunta: Consultar a un médico. Guardar bajo llave. Eliminar el contenido y el recipiente de acuerdo con las normativas locales, regionales, nacionales e internacionales. Es una regla general que los menores de 18 años tienen prohibido trabajar con este producto. Los usuarios deben recibir formación detallada sobre el procedimiento de trabajo adecuado, las propiedades peligrosas del producto y las instrucciones de seguridad necesarias. Para obtener información adicional, consulte la hoja de datos sobre seguridad de los materiales. 5. El vial 8, Wash Buffer (10x), contiene 5-<10% 2-Amino-2-(hidroximetil) propano-1,3-diol, clorhidrato y 0.1-<0.2% 5-bromo-5-nitro-1,3-dioxano. Puede provocar una reacción alérgica. Wash Buffer (10x) tiene la etiqueta: Atención H319 P280 P264 P305 + P351 + P338 Provoca irritación ocular grave. Llevar gafas o máscara de protección. Lavarse las manos concienzudamente tras la manipulación. EN CASO DE CONTACTO CON LOS OJOS: Aclarar cuidadosamente con agua durante varios minutos. Quitar las lentes de contacto, si lleva y resulta fácil. Seguir aclarando. 6. Este producto contiene azida sódica (NaN 3 ), un producto químico muy tóxico en su forma pura. A las concentraciones en las que está presente en el producto, aunque no se clasifican como peligrosas, la azida sódica puede reaccionar con las cañerías de plomo y cobre, lo que formará ( ) P04454ES_01_K / p. 32/55
33 Cáncer gástrico acumulaciones de azidas metálicas muy explosivas. En el momento de su desecho, aclare con agua abundante, para impedir que la azida metálica se acumule en las tuberías (21, 22). 7. Los viales 2, 3 y 4 contienen material de origen animal. Como con cualquier producto derivado de fuentes biológicas, deben utilizarse los procedimientos de manipulación apropiados. 8. Los portaobjetos de control y los especímenes, antes y después de la fijación, y todos los materiales expuestos a ellos, deben manipularse como si pudieran transmitir una infección y deben desecharse tomando las precauciones adecuadas (23). Nunca pipetee los reactivos con la boca y evite el contacto de la piel y las membranas mucosas con los reactivos y las muestras. Si los reactivos entran en contacto con zonas sensibles, lávelas con abundante agua. 9. Minimice la contaminación microbiana de los reactivos para evitar una tinción no específica. 10. Los tiempos, las temperaturas o los métodos de incubación diferentes de los especificados pueden producir resultados erróneos. El secado excesivo durante más de una hora a 60 C puede causar una disminución significativa o pérdida de la inmunorreactividad para HER2 asociada a la membrana específica (17). 11. Los reactivos se suministran a la dilución óptima. Una nueva dilución puede ocasionar la pérdida de la tinción antigénica. 12. Todos los reactivos, incluidos Epitope Retrieval Solution y Wash Buffer, están formulados para utilizarse específicamente en esta prueba. Para que la prueba pueda realizarse según las especificaciones, no deben realizarse sustituciones salvo en el caso del Wash Buffer, cuando pueda utilizarse el Nº de catálogo S El Visualization Reagent y DAB Chromogen pueden verse perjudicados si quedan expuestos a niveles de luz demasiado intensos. No almacene componentes del sistema ni realice la tinción bajo una luz demasiado intensa, como la luz solar directa. 14. Lleve puesto equipo protector personal apropiado a fin de evitar que el producto entre en contacto con los ojos y la piel. Para obtener información adicional, consulte la Hoja de datos sobre seguridad de los materiales (SDS, por sus siglas en inglés). 15. Los residuos de parafina pueden dar lugar a falsos negativos. 16. Para la interpretación exacta de los resultados del HercepTest en muestras teñidas de biopsia de adenocarcinoma de estómago, incluida la unión gastroesofágica, se recomienda utilizar un grupo de al menos 5 células tumorales teñidas. Un grupo de al menos 5 células tumorales teñidas consta de 5 células tumorales conectadas teñidas para HER Debido a la naturaleza heterogénea de las muestras de biopsia de cáncer gástrico, para obtener un resultado fiable, es importante realizar las pruebas IHC de la HER2 en varias piezas (7-8) de biopsia de diferentes regiones del tumor. 18. El uso de volúmenes de reactivo distintos de los recomendados puede dar lugar a una pérdida de inmunoreactividad visible a HER2. Si el corte de tejido delimitado no está totalmente cubierto por 3 gotas (100 µl) de reactivo, deben añadirse otras 3 gotas. 19. Se recomienda comprobar más de un bloque de tejido de resecciones de cáncer gástrico si la muestra presenta un alto nivel de heterogeneidad (41). INSTRUCCIONES DE USO - Gástrico A. Preparación del reactivo Es conveniente preparar los siguientes reactivos antes de realizar la tinción: ( ) P04454ES_01_K / p. 33/55
34 Cáncer gástrico A.1 Epitope Retrieval Solution Diluya una cantidad suficiente del vial 7 (Epitope Retrieval Solution 10x) a 1:10 utilizando agua destilada o desionizada para el procedimiento de tinción previsto. La solución diluida sin usar puede almacenarse a 2 8 C durante un mes. Si la solución diluida presenta un aspecto turbio, deséchela. A.2 Wash Buffer Diluya una cantidad suficiente del vial 8 (Wash Buffer 10x) a 1:10 utilizando agua destilada o desionizada para los pasos del lavado. El tampón diluido sin usar puede almacenarse a 2 8 C durante un mes. Deseche la solución tampón si tiene un aspecto turbio. Puede utilizarse agua destilada o desionizada para el aclarado después de las incubaciones en Peroxidase-Blocking Reagent, Substrate-Chromogen Solution y hematoxilina. El resto de pasos de aclarado requieren el uso del Wash Buffer. A.3 Substrate-Chromogen Solution (DAB) Con el procedimiento que sigue se obtiene 1 ml de Substrate-Chromogen Solution. Una porción alícuota de 1 ml es suficiente para diez cortes de tejido. Paso 1: Transfiera 1 ml de DAB Buffered Substrate del vial 5 a un tubo de ensayo. Paso 2: Añada una gota (25 30 µl) de DAB Chromogen del vial 6. Mézclela y aplíquela a los cortes de tejido con una pipeta. La solución preparada Substrate-Chromogen Solution (DAB) se mantiene estable aproximadamente unos 5 días si se almacena a entre 2 y 8 C. Esta solución debe mezclarse minuciosamente antes de su utilización. La calidad de la tinción no se verá afectada por la formación de precipitado en la solución. NOTA: el color del DAB Chromogen del vial 6 puede variar de un marrón-azul lavanda claro a uno suave. Esto no alterará el rendimiento de este producto. Realice la dilución con arreglo a las pautas de este prospecto. La adición excesiva de DAB Chromogen al DAB Buffered Substrate ocasionará el deterioro de la señal positiva. A.4 Contratinción El producto final teñido resultante de la reacción de tinción de DAB es insoluble en alcohol y agua. Utilice una contratinción de hematoxilina y ajuste la intensidad de tinción de la hematoxilina a un nivel similar al mostrado en el HercepTest Interpretation Manual Gastric Cancer de Dako. Puede utilizarse hematoxilina, ya sea en solución acuosa o de alcohol, como Dako Mayer's Hematoxylin, Nº de catálogo S3301. Tras la contratinción con hematoxilina, realice un aclarado intenso en agua destilada o desionizada y, seguidamente, sumerja los cortes de tejido en un baño de agua de amoníaco a 37 mmol/l (véase el paso 6 de la sección B.2). El agua de amoníaco (37 mmol/l) se prepara mezclando 2,5 ml de hidróxido amónico a 15 mol/l (concentrado) con 1 litro de agua destilada o desionizada. El agua de amoníaco a 37 mmol/l que no se utilice puede conservarse a temperatura ambiente (20 25 C) en un frasco tapado herméticamente hasta 12 meses. A.5 Medio de montaje Se recomienda un medio de montaje no acuoso y permanente. No obstante, el montaje acuoso también resulta aceptable. Se recomienda la utilización de Dako Faramount Aqueous Mounting Medium, Ready-to-Use, Nº de catálogo S3025 o Glycergel Mounting Medium, Nº de catálogo C0563 para un montaje acuoso. Licue Glycergel calentándolo a aproximadamente 40 (±5) C antes de su uso. ( ) P04454ES_01_K / p. 34/55
35 Cáncer gástrico B Procedimiento de tinción B.1 Notas referentes al procedimiento El usuario debe leer detenidamente estas instrucciones y familiarizarse con todos los componentes antes de su uso (consulte la sección Precauciones). Todos los reactivos deben equilibrarse a temperatura ambiente (20 25 C) antes de la inmunotinción. De forma similar, todas las incubaciones deben realizarse a temperatura ambiente. No deje que los cortes de tejido se sequen durante el procedimiento de tinción. Los cortes de tejido secos pueden mostrar una mayor tinción no específica. Cubra los portaobjetos expuestos a corrientes. Si se utilizan incubaciones prolongadas, coloque los tejidos en un ambiente húmedo. Si debe interrumpirse el procedimiento de tinción, los portaobjetos pueden guardarse en un baño de tampón después de la incubación del anticuerpo primario (paso 3) como máximo una hora a temperatura ambiente (20 25 C) sin que afecte al r endimiento de la tinción. Desparafinado y rehidratación: antes de la tinción, los portaobjetos con los tejidos deben desparafinarse, para eliminar el medio de inclusión, y rehidratarse. Evite una retirada incompleta de la parafina. Cualquier residuo del medio de inclusión provocaría un aumento de la tinción no específica. Este paso debe realizarse a temperatura ambiente (20 25 C). 1. Coloque los portaobjetos en un baño de xileno e incube durante 5 (±1) minutos. Cambie los baños y repita una vez. 2. Elimine el exceso de líquido golpeando suavemente los portaobjetos e introdúzcalos en etanol absoluto durante 3 (±1) minutos. Cambie los baños y repita una vez. 3. Golpee suavemente para eliminar el exceso de líquido e introduzca los portaobjetos en etanol al 95% durante 3 (±1) minutos. Cambie los baños y repita una vez. 4. Elimine el exceso de líquido golpeando suavemente los portaobjetos e introdúzcalos en agua destilada o desionizada un mínimo de 30 segundos. Inicie el proceso de tinción tal y como se expone en el paso 1 Recuperación de epítopo de la sección B.2. Las soluciones de xileno y alcohol deben cambiarse después de 40 portaobjetos. En lugar de xileno, pueden utilizarse sustitutos de tolueno o xileno, como Histoclear. NOTA: los reactivos y las instrucciones suministradas en este kit han sido diseñados para una eficacia óptima. Una mayor dilución de los reactivos o la alteración de las temperaturas de incubación puede conducir a resultados erróneos o discordantes. Las diferencias en el procesamiento de tejidos y los procedimientos técnicos en el laboratorio del usuario pueden invalidar los resultados del ensayo para su utilización en la selección de pacientes para la terapia de Herceptin. ( ) P04454ES_01_K / p. 35/55
36 B.2 Protocolo de tinción Realizado a temperatura ambiente, C. Paso 1: Recuperación de epítopo Cáncer gástrico Llene los recipientes de tinción, por ejemplo, cubetas de Coplin, con la Epitope Retrieval Solution diluida (consulte las INSTRUCCIONES DE USO en la sección A.1). Coloque los recipientes de tinción con Epitope Retrieval Solution en un baño de agua. Caliente el baño de agua y la Epitope Retrieval Solution a una temperatura de C. La Epitope Retrieval Solution adquiere un aspecto turbio al calentarla. Cubra los recipientes con tapas para estabilizar la temperatura y evitar la evaporación. Sumerja los cortes desparafinizados a temperatura ambiente en la Epitope Retrieval Solution precalentada de los recipientes de tinción. VUELVA A SITUAR LA TEMPERATURA DEL BAÑO DE AGUA Y LA EPITOPE RETRIEVAL SOLUTION DE NUEVO A C. Incúbela durante 40 (±1) minutos a C. Saque la jarra entera con los portaobjetos del baño de agua. Deje que los portaobjetos se enfríen en la Epitope Retrieval Solution durante 20 (±1) minutos a temperatura ambiente. Decante la Epitope Retrieval Solution y aclare los portaobjetos en el Wash Buffer diluido (consulte las INSTRUCCIONES DE USO de la sección A.2). Para un rendimiento óptimo, empape los cortes en Wash Buffer entre 5 y 20 minutos después de la recuperación de epítopo y antes de la tinción. NOTA: la Epitope Retrieval Solution está pensada para una aplicación de un solo uso. No la reutilice. Paso 2: Peroxidase-Blocking Reagent Golpee suavemente para eliminar el exceso de tampón. Con la ayuda de una tela sin hilas (como una toallita Kimwipe o una gasa), limpie alrededor del espécimen para eliminar cualquier líquido presente y conservar los reactivos dentro del área especificada. Rodee el corte de tejido con un bolígrafo Dako. Aplique 3 gotas (100 µl) de Peroxidase-Blocking Reagent para cubrir el espécimen. Incúbelo durante 5 (±1) minutos. Aclárelo suavemente con agua destilada o desionizada o Wash Buffer de un frasco de lavado (no aplique el flujo directamente sobre el tejido) y colóquelo en un baño de tampón. Paso 3: Primary Antibody or Negative Control Elimine el exceso de líquido golpeando suavemente los portaobjetos y límpielos de la forma indicada anteriormente. Cubra el espécimen con 3 gotas (100 µl) de Anti-HER2 Protein o Negative Control Reagent. Incúbelo durante 30 (±1) minutos. Aclárelo suavemente con Wash Buffer de un frasco de lavado (no aplique el flujo directamente sobre el tejido) y colóquelo en un baño de tampón. Si debe interrumpirse el procedimiento de tinción, los portaobjetos pueden guardarse en Wash Buffer después del paso 3 hasta una hora a temperatura ambiente (20 25 C) sin que afecte al rendimiento de la tinción. ( ) P04454ES_01_K / p. 36/55
37 Paso 4: Visualization Reagent Cáncer gástrico Elimine el exceso de líquido golpeando suavemente los portaobjetos y límpielos de la forma indicada anteriormente. Cubra el espécimen con 3 gotas (100 µl) de Visualization Reagent. Incúbelo durante 30 (±1) minutos. Aclare los portaobjetos como en el paso 3. Paso 5: Substrate-Chromogen Solution (DAB) Limpie los portaobjetos como se indica anteriormente. Cubra el espécimen con 3 gotas (100 µl) de Substrate-Chromogen Solution (DAB). Incúbelo durante 10 (±1) minutos. Aclárelo suavemente con agua destilada o desionizada de un frasco de lavado (no aplique el flujo directamente sobre el tejido). Coloque los residuos de Substrate- Chromogen Solution (DAB) en un contenedor para materiales peligrosos para desecharlos de forma apropiada. Paso 6: Contratinción (instrucciones válidas para la hematoxilina) Sumerja los portaobjetos en un baño de hematoxilina. Incúbelos entre 2 y 5 minutos, en función de la potencia de la hematoxilina utilizada. Aclárelos suavemente en un baño de agua destilada o desionizada. Asegúrese de que se han eliminado todos los residuos de hematoxilina. Opcional: introduzca los portaobjetos 10 veces en un baño de agua de amoníaco a 37 mmol/l (véase la sección A.4). Aclare los portaobjetos suavemente en un baño de agua destilada o desionizada entre 2 y 5 minutos. NOTA: en función de la duración de la incubación y la potencia de la hematoxilina utilizada, la contratinción dará como resultado una coloración entre azul pálido y azul oscuro de los núcleos celulares. Una contratinción excesiva o incompleta puede invalidar la interpretación correcta de los resultados. Paso 7: Montaje Se recomienda un medio de montaje no acuoso y permanente. De todas formas, un medio de montaje acuoso también resulta aceptable. Los especímenes pueden montarse y taparse con cubreobjetos con un medio de montaje acuoso como Dako Faramount, Nº de catálogo S3025, o Glycergel, Nº de catálogo C0563. NOTA: los portaobjetos pueden leerse cuando resulte apropiado. No obstante, puede que se pierda el color si los portaobjetos se cubren con un medio de montaje acuoso y se exponen a una luz intensa durante una semana. Para minimizar la pérdida de tinte, almacene los portaobjetos en un lugar oscuro a temperatura ambiente (20 25 C). ( ) P04454ES_01_K / p. 37/55
38 Cáncer gástrico Control de calidad - Gástrico Las diferencias en la fijación, el procesamiento y la inclusión de tejidos en el laboratorio del usuario pueden generar una variabilidad significativa de los resultados, lo que requeriría un rendimiento regular de los controles internos además de los portaobjetos de control suministrados por Dako. En EE.UU., consulte las indicaciones de control de calidad del Programa de certificación de inmunocitoquímica del Colegio de patólogos americanos (CAP, por sus siglas en inglés), así como la Quality Assurance for Immunocytochemestry, Approved Guideline del CLSI (anteriormente NCCLS) (24) y la referencia 25 para obtener información adicional. Tabla 8. Finalidad del control de calidad diario. Tejido: muestra equivalente a paciente fijada y procesada Control positivo: El tejido o las células que contengan el antígeno objetivo que deba detectarse (puede estar situado en el tejido del paciente). El control ideal es un tejido con una tinción ligeramente positiva, ya que de este modo es más sensible a la degradación del anticuerpo o el antígeno. Anticuerpo específico y anticuerpo secundario Controla todos los pasos del análisis. Valida el reactivo y los procedimientos utilizados para la tinción de la proteína HER2. Anticuerpo no específico* o tampón más el mismo anticuerpo secundario al utilizado con el anticuerpo específico Detección de tinción de fondo no específica. Control negativo: Tejidos o células que se prevén negativos (pueden estar situados en el tejido del paciente o el tejido de control positivo) Detección de reactividad cruzada no buscada del anticuerpo con las células o componentes celulares. Detección de tinción de fondo no específica. Tejido de paciente Detección de tinción específica Detección de tinción de fondo no específica. Portaobjeto de control suministrado por Dako Controla solamente el procedimiento de tinción * El suero es de la misma especie que el anticuerpo específico, pero no va dirigido al mismo antígeno objetivo. Para detectar un ligamiento de anticuerpo no específico, por ejemplo, ligamiento de la porción Fc del anticuerpo al tejido. Portaobjeto de control (suministrado): cada uno de los portaobjetos de control contiene tres líneas celulares con cáncer de mama humano en pellet, incluidas en parafina y fijadas en formol con unas puntuaciones de intensidad de tinción de 0, 1+ y 3+. En cada secuencia de tinción debe teñirse sólo un portaobjeto. La evaluación de las líneas celulares del portaobjeto de control suministrado por Dako indica la validez de la secuencia de tinción. Tejido de control positivo: los controles deben ser especímenes procedentes de autopsia, biopsia o quirúrgicos fijados, procesados e incluidos tan rápido como sea posible de la misma forma que las muestras de pacientes. Los controles de tejido positivos indican si los tejidos se han preparado correctamente y si se han utilizado las técnicas de tinción oportunas. Debe incluirse un tejido de control positivo para cada conjunto de condiciones de prueba en cada secuencia de tinción. Los tejidos de control positivo deben mostrar una tinción positiva débil para que puedan detectar cambios leves en la sensibilidad del anticuerpo primario. Los portaobjetos de control suministrados con este kit o los especímenes procesados de forma diferente de la(s) muestra(s) del paciente validan sólo el rendimiento del reactivo y no verifican la preparación del tejido. Utilice la proteína HER2 2+ determinada con anterioridad que sobreexprese tejido de adenocarcinoma de estómago o unión gastroesofágica para un control de tejido positivo óptimo. NOTA: el tejido de control positivo conocido sólo debe utilizarse para realizar el seguimiento del rendimiento correcto de los tejidos procesados y los reactivos de la prueba y NO como una ayuda para formular un diagnóstico específico de las muestras de paciente. Si el tejido de control positivo ( ) P04454ES_01_K / p. 38/55
39 Cáncer gástrico no consigue demostrar una tinción positiva apropiada, los resultados de los especímenes de paciente deberán considerarse inválidos. Tejido de control negativo: utilice un tejido de control negativo (que se haya demostrado negativo para la proteína HER2) fijado, procesado e incluido de idéntica forma a la muestra o las muestras de paciente de cada secuencia de tinción para verificar la especificidad del anticuerpo primario y ofrecer una indicación de una tinción de fondo específica. El colon, el hígado o el tiroides son apropiados como tejido de control negativo. La variedad de tipos celulares diferentes presentes en la mayoría de cortes de tejido ofrece puntos de control negativo internos (debe verificarlo el usuario). Si se produce tinción específica en el tejido de control negativo, los resultados de la muestra del paciente deben considerarse no válidos y debe repetirse la prueba. Reactivo de control negativo no específico: utilice el reactivo de control negativo suministrado en lugar del anticuerpo primario con un corte de cada espécimen de paciente para evaluar la tinción no específica y permitir una mejor interpretación de la tinción específica en la zona del antígeno. El periodo de incubación para el reactivo de control negativo debe corresponderse con el del anticuerpo primario. Verificación del ensayo: antes del uso inicial de un anticuerpo o un sistema de tinción en un procedimiento de diagnóstico, el usuario debe verificar la especificidad del anticuerpo sometiéndolo a una prueba en un conjunto de tejidos internos con unas características de rendimiento inmunocitoquímico demostradas que representen tejidos positivos y negativos conocidos. Consulte los procedimientos de control de calidad descritos anteriormente en esta sección del prospecto y los requisitos de control de calidad del Programa de certificación del CAP respecto a la inmunocitoquímica y/o la Quality Assurance for Immunocytochemestry, Approved Guideline (24) del CLSI (anteriormente NCCLS). Estos procedimientos de control de calidad deben repetirse para cada nuevo lote de anticuerpos o siempre que se produzca un cambio en los parámetros de ensayo. El adenocarcinoma de estómago, incluida la unión gastroesofágica, con intensidades demostradas de tinción de la proteína HER2 de entre 0 y 3+ y los tejidos negativos, como el colon, el hígado o la tiroides, son válidos para la verificación del ensayo. Interpretación de la tinción - Gástrico En la determinación de la expresión de la proteína HER2, sólo deben evaluarse la intensidad y el patrón de tinción de la membrana, utilizando la escala presentada en la tabla 9. La evaluación del portaobjetos debe realizarla un patólogo con la ayuda de un microscopio óptico. Para la evaluación de la tinción y la puntuación inmunohistoquímicas, resulta apropiado un objetivo de aumento 10x. La utilización de un objetivo de aumento 5 40x puede resultar de utilidad para confirmar la puntuación. La tinción citoplasmática debe considerarse como tinción no específica y no se incluirá en la evaluación de la intensidad de tinción de la membrana (8). Para obtener ayuda con la diferenciación de tinciones 0, 1+, 2+ y 3+, consulte el HercepTest Interpretation Manual Gastric Cancer de Dako, en el que hallará fotografías representativas de las intensidades y patrones de tinción. Sólo deben contabilizarse las muestras de pacientes con adenocarcinoma de estómago, incluida la unión gastroesofágica. En los casos con metaplasia intestinal y adenocarcinoma gástrico en la misma muestra, sólo debe contabilizarse el componente de adenocarcinoma gástrico. Para la interpretación de las biopsias teñidas con HercepTest se recomienda utilizar un grupo de al menos 5 células tumorales teñidas. Un grupo de al menos 5 células tumorales teñidas consta de 5 células tumorales conectadas teñidas para HER2. ( ) P04454ES_01_K / p. 39/55
40 Cáncer gástrico Tabla 9. Interpretación y puntuación de la tinción inmunohistoquímica de HER2 Puntuación Muestras quirúrgicas Patrón de tinción Muestras de biopsia Patrón de tinción Evaluación de la sobreexpresión de HER2 0 Sin reactividad o reactividad membranosa en < 10% de las células tumorales Sin reactividad o sin reactividad membranosa en ninguna (o < 5 en grupo) de las células tumorales Negativa 1+ Reactividad membranosa débil o prácticamente imperceptible en 10% de las células tumorales; las células son reactivas sólo en parte de su membrana Grupos de células tumorales ( 5 células) con una reactividad membranosa débil o prácticamente imperceptible con independencia del porcentaje de células tumorales teñidas Negativa 2+ Reactividad membranosa completa, basolateral o lateral de débil a moderada en 10% de las células tumorales Grupos de células tumorales ( 5 células) con una reactividad membranosa completa, basolateral o lateral de débil a moderada con independencia del porcentaje de células tumorales teñidas Ambigua 3+ Reactividad membranosa completa, basolateral o lateral fuerte en 10% de las células tumorales Grupos de células tumorales ( 5 células) con una reactividad membranosa completa, basolateral o lateral fuerte con independencia del porcentaje de células tumorales teñidas Positivo Indicaciones según Hofmann et al. (40). HercepTest se interpreta para la sobreexpresión de la proteína HER2 como negativo (con puntuación 0 y 1+), ambiguo (con puntuación 2+) y positivo (con puntuación 3+). HercepTest no está destinado a proporcionar información sobre el pronóstico al paciente ni al médico, y no ha sido validado para este fin. Para cada secuencia de tinción, deben examinarse los portaobjetos del modo presentado en la tabla 10 para determinar la validez de la secuencia de tinción y permitir una evaluación semicuantitativa de la intensidad de tinción del tejido muestra. ( ) P04454ES_01_K / p. 40/55
41 Cáncer gástrico Tabla 10. Orden de evaluación de los portaobjetos. Orden de lectura de los portaobjetos Exposición de motivos 1. Portaobjetos de control con tres líneas celulares La presencia de tinción marrón 3+ en la membrana celular (desoxidación) en la línea celular de control 3+ SK-BR-3, desoxidación marrón parcial en la línea celular de control 1+ MDA-175 y la ausencia de tinción en la línea celular de control 0 MDA-231 indican la validez del ensayo. Se observa tinción de membrana punteada y discontinua en un número de pequeño a moderado de las células de la línea de células de control 1+ MDA-175, así como una inmunotinción punteada de la región de Golgi del citoplasma en esta misma línea de células La presencia de tinción marrón en la línea celular de control 0 MDA-231 (negativa para la tinción de la proteína HER2) indica que no se produjo tinción no específica durante el ensayo. Los resultados del ensayo pueden quedar invalidados debido a la sobretinción. 2. Portaobjetos de tejido de control positivo Debe observarse presencia de tinción marrón en la membrana. La tinción del citoplasma y los tejidos negativos no debe ser superior a Portaobjetos de tejido de control negativo La AUSENCIA de tinción específica en el portaobjeto de tejido de control negativo confirma la inexistencia de reactividad cruzada del kit con las células o los componentes celulares. Si se produce tinción de una membrana específica en el portaobjeto de tejido de control negativo, los resultados del espécimen del paciente deben considerarse inválidos. 4. Portaobjetos con tejido de paciente teñido con control negativo Reactivo 5. Portaobjetos con tejido de paciente teñido utilizando el anticuerpo primario La ausencia de tinción de una membrana específica verifica el marcado específico del antígeno de objetivo por parte del anticuerpo primario. La tinción oscura o marrón que pueda producirse en el citoplasma del espécimen tratado con el reactivo de control negativo, como en el tejido conjuntivo, los leucocitos, eritrocitos o tejido necrótico, debe considerarse como tinción de fondo no específica e incluirse en la sección de comentarios de la hoja de datos. Cuando se detecta sobreexposición de la proteína HER2 en el espécimen, aparecerá como desoxidación marrón localizada en la membrana celular de las células tumorales tratadas con el anticuerpo primario. 1. Portaobjeto de control (suministrado): el portaobjeto de control teñido con HercepTest debe examinarse en primer lugar para determinar que todos los reactivos funcionan correctamente. La presencia de un producto de reacción marrón (3,3 '- diaminobenzidina, DAB) en la membrana celular indica una reactividad positiva. La presencia de tinción marrón en circunferencia en la membrana celular (desoxidación) en la línea celular de control 3+ SK-BR-3, desoxidación marrón parcial en la línea celular de control 1+ MDA-175 y la ausencia de tinción en la línea celular de control 0 MDA-231 indican la validez del ensayo. Si alguna de las líneas celulares de control muestran comportamientos diferentes a los señalados, todos los resultados de los especímenes de pacientes deberán considerarse inválidos. 2. Tejido de control positivo: el portaobjeto del tejido de control positivo deberá examinarse a continuación. Este portaobjeto verifica que el método de fijación y el proceso de recuperación de epítopo son efectivos. Utilice células intactas para la interpretación de los resultados de tinción, puesto que las células necróticas o degeneradas a menudo muestran tinción no específica (26). La tinción debe observarse en el tejido tumoral como una tinción marrón en la membrana celular. La tinción marrón del citoplasma y los tejidos negativos del espécimen no debe superar la puntuación de intensidad de tinción de 1+ correspondiente. ( ) P04454ES_01_K / p. 41/55
42 Cáncer gástrico 3. Tejido de control negativo: el portaobjeto con tejido de control negativo debe examinarse después del tejido de control positivo para verificar la especificidad del etiquetado del antígeno objetivo por parte del anticuerpo primario. La ausencia de tinción específica en el tejido de control negativo confirma la inexistencia de reactividad cruzada del kit con las células o los componentes celulares. Si se produce tinción específica en el tejido de control negativo, los resultados del espécimen del paciente deben considerarse inválidos. De forma alternativa, las porciones negativas del tejido de control positivo pueden funcionar igual que el tejido de control negativo, aunque debe verificarlo el usuario. Debe tenerse en cuenta que es posible observar una reacción débil (intensidad de tinción de 0 a 1+) en la mayor parte del tejido epitelial normal. Los posibles tejidos de control negativo incluyen: colon, hígado y tiroides. La tinción no específica, en su caso, tendrá una apariencia difusa. También es posible que se observe una tinción esporádica del tejido conjuntivo en cortes de tejido excesivamente fijados con formol Tejido de paciente: examine en último lugar los especímenes de pacientes teñidos con HercepTest. Debe evaluarse la intensidad de tinción positiva dentro del contexto de una tinción de fondo no específica del reactivo de control negativo. Igual que con cualquier prueba inmunocitoquímica, un resultado negativo significa que el antígeno no se ha detectado, y no que esté ausente de las células o el tejido sometido a ensayo. Consulte los apartados Resumen y explicación, Limitaciones y Características de rendimiento para obtener información específica respecto a la inmunorreactividad de HercepTest. Recomendaciones adicionales para la interpretación de la tinción con HercepTest Los adenocarcinomas de estómago, incluida la unión gastroesofágica, analizados para la sobreexpresión de la proteína HER2 se puntúan de 0 a 3+. Aunque los casos 0 y 3+ están perfectamente definidos, un pequeño porcentaje de las muestras 1+ y 2+ restantes pueden resultar más difíciles de interpretar. Utilice las siguientes indicaciones para la interpretación de la tinción de HercepTest en su laboratorio. Evalúe las líneas celulares de control para validar el rendimiento del ensayo. Evalúe los portaobjetos de control negativo y positivo. Se recomienda una tinción de hematoxilina y eosina del espécimen del tejido para la primera evaluación. (Puede que el tumor no parezca evidente al observar la muestra teñida con HercepTest. Se requiere un portaobjeto teñido con hematoxilina y eosina para que el patólogo pueda verificar la presencia del tumor.) HercepTest debe realizarse en un corte emparejado (corte estándar) del mismo bloque de parafina del espécimen. Evalúe en primer lugar los cortes teñidos para la sobreexpresión de la proteína HER2 a baja potencia. La mayoría de casos positivos serán evidentes con aumento a baja potencia. Para los casos 1+, utilice un objetivo de 40x aumentos para verificar la tinción de la membrana. Para los casos 2+, utilice un objetivo de 10 a 20x aumentos para verificar la tinción de la membrana. Muestras quirúrgicas Las áreas conservadas y teñidas correctamente de la muestra deben utilizarse para realizar una determinación del porcentaje de células tumorales positivas. Si la mayoría de las células tumorales muestran una tinción completa, basolateral o lateral de la membrana, la tinción será 2+ o 3+. Si hay una tinción completa, basolateral o lateral de la membrana de intensidad fuerte en el 10% o más de las células tumorales de las muestras quirúrgicas, la puntuación de la muestra será 3+. Si hay una tinción completa, basolateral, lateral de la membrana de intensidad débil a moderada en el 10% o más de las células tumorales de las muestras quirúrgicas, la puntuación de la muestra será 2+. ( ) P04454ES_01_K / p. 42/55
43 Cáncer gástrico Si el 10% o más de las células tumorales de las muestras quirúrgicas, con tinción sólo en parte de la membrana, tienen una intensidad débil o prácticamente imperceptible, la puntuación de la muestra será de 1+. Si menos del 10% de las células tumorales de las muestras quirúrgicas presentan tinción, independientemente del patrón de tinción (p. ej. completa, basolateral o lateral o en parte de la membrana), la puntuación será 0. Si no se observa tinción alguna la muestra quirúrgica es 0. Muestras de biopsia Un grupo de al menos 5 células tumorales teñidas consta de 5 células tumorales conectadas teñidas para HER2. Si hay un grupo de células tumorales de al menos 5 células tumorales teñidas con una intensidad de la membrana completa, basolateral o lateral fuerte, la puntuación de la muestra de biopsia es 3+, con independencia del porcentaje de células tumorales teñidas. Si hay un grupo de células tumorales de al menos 5 células tumorales teñidas con una intensidad de la membrana completa, basolateral o lateral de débil a moderada, la puntuación de la muestra de biopsia es 2+, con independencia del porcentaje de células tumorales teñidas. Si hay un grupo de células tumorales de al menos 5 células tumorales teñidas con una tinción de la membrana débil o prácticamente imperceptible y las células sólo están teñidas en parte de la membrana, la puntuación de la muestra de biopsia es 1+, con independencia del porcentaje de células tumorales teñidas. Si no se observa tinción o tinción de la membrana en menos de 5 células tumorales, la puntuación de la muestra de biopsia es 0. Limitaciones - Gástrico Limitaciones generales 1. La inmunocitoquímica es un proceso de diagnóstico de varias etapas que requiere formación especializada en la selección de los reactivos apropiados; la selección, la fijación y el procesamiento de tejidos; la preparación del portaobjeto de inmunocitoquímica, y la interpretación de los resultados de la tinción. 2. El resultado de la tinción de tejidos depende de la manipulación y el procesamiento que se haga del tejido antes de su tinción. Si el tejido se fija, congela, descongela, lava, seca, calienta o corta incorrectamente, o si se contamina por contacto con otros tejidos o líquidos, pueden producirse artefactos, atrapamiento de anticuerpos o resultados falso negativos. La aparición de resultados no coherentes puede deberse a variaciones en los métodos de fijación y de inclusión, o a irregularidades inherentes al tejido. 3. Una contratinción excesiva o incompleta puede invalidar la interpretación correcta de los resultados. 4. La interpretación clínica de toda tinción positiva o de su ausencia debe evaluarse en el contexto de la presentación clínica, la morfología y otros criterios histopatológicos. La interpretación clínica de toda tinción, o de su ausencia, debe complementarse con estudios morfológicos y controles adecuados, así como con otras pruebas diagnósticas. Un patólogo certificado y familiarizado con los anticuerpos, reactivos y métodos utilizados, debe responsabilizarse de interpretar la preparación teñida. La tinción debe realizarse en un laboratorio certificado y con licencia, bajo la supervisión de un patólogo responsable de la revisión de los portaobjetos teñidos y de garantizar la corrección de los controles positivos y negativos. 5. Es posible que los tejidos de las personas infectadas con el virus de la hepatitis B y con antígeno de superficie de hepatitis B (HBsAg) muestren tinción no específica con peroxidasa de rábano rusticano (27). ( ) P04454ES_01_K / p. 43/55
44 Cáncer gástrico 6. Los reactivos pueden mostrar reacciones imprevistas en tipos de tejidos no probados previamente. La posibilidad de reacciones imprevistas incluso en tipos de tejido probados no puede eliminarse por completo, debido a la variabilidad de la expresión del antígeno en las neoplasias u otros tejidos patológicos (28). Póngase en contacto con los Servicios técnicos de Dako con pruebas documentales de la reacción imprevista. 7. Pueden observarse resultados falso positivos debidos a un ligamiento no inmunológico de las proteínas o de los productos de reacción del sustrato. También pueden estar provocados por la actividad de la pseudoperoxidasa (eritrocitos) y la actividad de la peroxidasa endógena (citocromo C) (28). 8. El procedimiento de tinción debe realizarse a una temperatura ambiente de entre 20 y 25 C. Limitaciones específicas del producto 1. El antígeno presente en la línea celular de control 1+ MDA-175 se degradará con el tiempo. Evalúe los resultados del portaobjeto de control teniendo en cuenta la fecha de caducidad del mismo. Una tinción negativa de las células MDA-175 puede indicar que el portaobjeto de control se ha degradado. Los portaobjetos de control deben almacenarse a una temperatura de entre 2 y 8 C. 2. Es posible que la degradación del antígeno en los tejidos provocase con el tiempo resultados falso negativos. Cuando se almacenan a temperatura ambiente (20 25 C), las muestras deben teñirse antes de que transcurran de 4 a 6 semanas desde el montaje de los tejidos en los portaobjetos (29). 3. Para obtener unos resultados óptimos y reproducibles, la proteína HER2 exige una recuperación de epítopo por calor cuando los tejidos se fijan de la forma rutinaria (formol tamponado neutro) y se incluyen en parafina. Este pretratamiento debe completarse al principio de todo el proceso de tinción. Consulte la sección Preparación del espécimen. Tratamiento de los tejidos antes de la tinción, para obtener instrucciones. 4. La recuperación de epítopo por calor de la proteína HER2 sólo debe realizarse mediante un baño de agua calibrado. Se han probado otros métodos de calentamiento que no han arrojado resultados reproducibles. 5. No sustituya los reactivos del kit por reactivos con otros números de lote o con reactivos de otros fabricantes. La única excepción es el tampón de lavado, que puede reemplazarse por el tampón de lavado Dako con Nº de catálogo S Pueden obtenerse resultados falsos de la evaluación de la tinción citoplasmática. Al interpretar los resultados, tenga sólo en cuenta la intensidad de la tinción de la membrana celular. 7. Los portaobjetos de control de tinción deben utilizarse exclusivamente para validar la secuencia de tinción y no como guía para registrar la reacción de tinción en secciones de tejidos. 8. En ocasiones puede observarse una tinción focal fuerte (3+), es decir, puntos calientes. Este resultado puede deberse a una fijación o a un procesamiento irregular del tejido. En este caso, se recomienda la inmunotinción de un segundo bloque de tejidos del mismo espécimen. 9. No se ha validado el uso de HercepTest en muestras fijadas con fijadores distintos del formol tamponado neutro. 10. Tenga en cuenta que los epitelios normales de las amígdalas y el esófago pueden ofrecer una intensidad de tinción de hasta Deben evitarse tanto el uso de muestras de cáncer gástrico trituradas como la interpretación de tinciones de artefacto alrededor de los contornos de una biopsia. ( ) P04454ES_01_K / p. 44/55
45 Cáncer gástrico Características de resultados - Gástrico Antecedentes La seguridad y eficacia de trastuzumab (Herceptin ) se ha demostrado en un estudio clínico (el ToGA Trial) (38, 39). El estudio fue diseñado como un estudio multicéntrico de fase III, abierto, aleatorizado realizado en pacientes con HER2 positivo con adenocarcinoma inoperable localmente avanzado, recurrente y/o metastásico de estómago o de la unión gastroesofágica. La positividad para HER2 en el ToGA Trial se definió según si era positiva con IHC (3+) (HercepTest de Dako) y/o positiva con HER2 FISH (HER2/CEN17 2.0) (HER2 FISH pharmdx Kit de Dako). Después de la inclusión en el estudio, los pacientes fueron aleatorizados para que recibieran quimioterapia (5-FU o capecitabina y cisplatino) o quimioterapia más trastuzumab. El criterio de valoración principal del estudio fue la supervivencia global (SG). En el estudio se aleatorizaron 594 pacientes y 584 recibieron la medicación objeto del estudio y fueron incluidos en el conjunto de análisis completo (FAS). Para el criterio de valoración principal la combinación de quimioterapia más trastuzumab mostró ser superior estadísticamente que la quimioterapia sola. La mediana de la SG aumentó de 11,1 a 13,8 meses (p=0,0046) con un índice de riesgo de 0,74 (IC 95%: 0,60 0,91). Las curvas de Kaplan-Meier para la SG se muestran en la figura 1. Probabilidad de supervivencia 1,0 0,9 0,8 0,7 0,6 Prueba de rangos logarítmicos P = 0,0046 0,5 0,4 0,3 0,2 0,1 0 11,1 13,8 Tiempo (meses) Nº restante Fluoro/Cisp Tras/Fluoro/Cisp Grupo de tratamiento Fluoro/Cisp Tras/Fluoro/Cisp Figura 1. Curva de SG de Kaplan-Meier (n=584). Se realizaron análisis de subgrupo exploratorio con HER2 preespecificados una vez disponibles los datos. Se definieron dos nuevos subgrupos de HER2 con posterioridad, basándose en la puntuación de IHC: Grupo 1 ( grupo de baja expresión de HER2 ): Grupo 2 ( grupo de alta expresión de HER2 ): IHC 0/FISH+ e IHC 1+/FISH+ (n=131) IHC 2+/FISH+ y IHC 3+ (FISH+ o FISH- o FISH sin resultado (n=446) Cuando se repitió el análisis principal de la SG con posterioridad para el grupo de alta expresión de HER2 (n = 446) el beneficio a favor del tratamiento combinado fue incluso mayor. La mediana de la ( ) P04454ES_01_K / p. 45/55
46 Cáncer gástrico SG del grupo de pacientes que habían recibido quimioterapia más trastuzumab aumentó a 16,0 meses en comparación con 11,8 meses de los pacientes que solamente recibieron quimioterapia. El índice de riesgo de este análisis disminuyó a 0,65 (IC 95%: 0,51 0,83). Las curvas de SG de Kaplan-Meier para el grupo de alta expresión de HER2 se muestran en la figura 2. Probabilidad de supervivencia 1,0 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 11,8 16,0 Tiempo (meses) Nº restante Fluoro/Cisp Tras/Fluoro/Cisp Grupo de tratamiento Fluoro/Cisp Tras/Fluoro/Cisp Figura 2.Curva de SG de Kaplan-Meier para el grupo de alta expresión de HER2 (n=446). El ToGA Trial ha demostrado que la combinación de las pruebas de ICH y FISH son predictivas para el efecto del tratamiento combinado de quimioterapia y trastuzumab; no obstante, los análisis exploratorios posteriores parecen indicar que los pacientes con altos niveles de expresión de la proteína HER2 (IHC2+/FISH+ y IHC3+) experimentan un beneficio mayor. Esto puede explicarse por el hecho de que la proteína es la diana de trastuzumab. Si desea obtener más información sobre el ToGA Trial, consulte el prospecto de Herceptin. ( ) P04454ES_01_K / p. 46/55
47 Cáncer gástrico Reproducibilidad Reproducibilidad interna: la reproducibilidad interna se probó en un laboratorio con 11 muestras con diferentes intensidades de tinción en IHC. Cada muestra se probó por triplicado. Este protocolo se utilizó con tinción manual. Todos los especímenes dieron un 100% de resultados reproducibles. la reproducibilidad interna se probó en un laboratorio con 3 muestras con diferentes intensidades de tinción en IHC. Cada muestra se probó por triplicado. Este protocolo se utilizó con tinción automática. Todos los especímenes dieron un 100% de resultados reproducibles. Reproducibilidad entre secuencias y entre laboratorios: Se realizaron los análisis con HercepTest de 60 muestras de cáncer gástrico diferentes, obtenidas de áreas del estómago y de la unión gastroesofágica que representaban resecciones y biopsias quirúrgicas, en cinco días alternos en tres centros de estudio. Las 60 muestras del estudio se distribuyeron equitativamente en las tres categorías de estado en cuanto a HER2. Seis patólogos realizaron un total de puntuaciones de la HER2. Cada día el consenso (negativo, ambiguo, positivo) variaba del 83,1% al 98,3%. En 47 de 60 comparaciones posibles, los consensos fueron del 90,0% o superior. En Tabla 11, se muestran los ejemplos específicos de las comparaciones realizadas cada día con una media de consensos del 91,2%, 92,5% y 92,5% para los tres centros. Los consensos entre todos los centros fueron del 82,7%, 75,0% y 88,0%, respectivamente para la comparación en los centros por pares (consulte la Tabla 12). Según la prueba exacta de Fisher, los resultados fueron los mismos entre los centros. Los consensos de todos los observadores entre los patólogos en cada centro fueron del 88,0%, 83,6% y 81,0% para los tres centros de estudio, respectivamente (tabla 13). En conclusión los análisis realizados con HercepTest de las muestras de cáncer gástrico en los tres centros de estudio demostraron un buen consenso entre observaciones en cuanto a los días, centros y observadores. Tabla 11. Consensos totales diarios en porcentaje - Subconjunto de 12 de 60 comparaciones Centro 1 Centro 2 Centro 3 Observador 1 Observador 2 Promedio Consenso CI95 LL 1 Consenso CI95 LL 1 Consenso Día 1 vs. Día 2 85,0 74,4 93,3 84,9 91,2 Día 3 vs. Día 4 93,3 84,9 93,3 84,9 Día 1 vs. Día 2 95,0 87,3 83,1 72,0 92,5 Día 3 vs. Día 4 96,7 89,7 95,0 87,3 Día 1 vs. Día 2 90,0 80,5 91,7 82,7 92,5 Día 3 vs. Día 4 96,7 89,7 91,7 82,7 1 CI95 LL: Intervalo de confianza límite inferior al 95%. ( ) P04454ES_01_K / p. 47/55
48 Cáncer gástrico Tabla 12. Consensos totales entre los centros en porcentaje Consenso CI95 LL 1 Consenso medio Centro 1 vs. Centro 2 Centro 1 vs. Centro 3 Centro 2 vs. Centro 3 Día 1 vs. Día 1 83,3 72,4 Día 2 vs. Día 2 85,0 74,4 Día 3 vs. Día 3 85,0 74,4 Día 4 vs. Día 4 81,7 70,5 Día 5 vs. Día 5 78,3 66,7 Día 1 vs. Día 1 80,0 68,6 Día 2 vs. Día 2 73,3 61,2 Día 3 vs. Día 3 78,3 66,7 Día 4 vs. Día 4 68,3 55,9 Día 5 vs. Día 5 75,0 63,0 Día 1 vs. Día 1 88,3 78,5 Día 2 vs. Día 2 86,7 76,4 Día 3 vs. Día 3 90,0 80,5 Día 4 vs. Día 4 86,7 76,4 Día 5 vs. Día 5 88,3 78,5 82,7 75,0 88,0 1 CI95 LL: Intervalo de confianza límite inferior al 95%. Tabla 13. Consensos entre Observadores en porcentaje Consenso CI 95 LL 1 Consenso medio Centro 1 Centro 2 Centro 3 Día 1 91,7 82,7 Día 2 91,7 82,7 Día 3 93,3 84,9 Día 4 83,3 72,4 Día 5 80,0 68,6 Día 1 86,4 76,0 Día 2 83,3 72,4 Día 3 83,3 72,4 Día 4 83,3 72,4 Día 5 81,7 70,5 Día 1 80,0 68,6 Día 2 78,3 66,7 Día 3 80,0 68,6 Día 4 78,3 66,7 Día 5 90,0 80,5 88,0 83,6 81,0 1 CI95 LL: Intervalo de confianza límite inferior al 95%. ( ) P04454ES_01_K / p. 48/55
49 Cáncer gástrico Inmunorreactividad En la tabla 14 aparece un resumen de la inmunorreactividad del HercepTest junto con el panel recomendado de tejidos normales. Todos los tejidos estaban fijados con formol e incluidos en parafina y se habían teñido con el HercepTest de acuerdo con las instrucciones del prospecto. Tabla 14. Resumen de la reactividad de tejido normal en el HercepTest. Tipo de tejido (N.º analizado) Suprarrenal (3) Medula ósea (3) Encefálico/cerebral (3) Encefálico/cerebral (3) Mamario (3) Cuello uterino (3) Colónico (3) Esofágico (3) Cardiaco (3) Renal (3) Hepático (3) Pulmonar (3) Mesotelial (3) Ovárico (3) Pancreático (3) Paratiroideo (3) Nervio periférico (3) Hipófisis (3) Prostático (3) Glándula salivar (3) Músculo esquelético (3) Cutáneo (3) Intestino delgado (3) Esplénico (3) Gástrico (3) Testicular (3) Tímico (3) Tiroideo (3) Amigdalino (3) Uterino (3) Tinción de elemento tisular positivo y patrón de tinción Glándula mamaria (2/3 tejidos, intensidad de tinción 1+, <5% de las células) Células epiteliales (1/3 tejidos, intensidad de tinción 1+, <5% de las células, membrana y citoplasma, granular) Células epiteliales foliculares (1/3 tejidos, intensidad de tinción 1+, <5% de las células, membrana y citoplasma) Epitelio escamoso (1/3 tejidos, intensidad de tinción 1+, 5% de las células. 2/3 tejidos, intensidad de tinción 2+, 10-20% de las células. Membrana y citoplasma) Tejido endometrial (2/3 tejidos, intensidad de tinción 1+, 30-60% de las células, citoplasma, granular) La tinción registrada en todos los tejidos se refiere a la membrana, a menos que se indique lo contrario. Los tres especímenes de cada tipo de tejido presentaron la misma intensidad de tinción a menos que se especifique lo contrario. ( ) P04454ES_01_K / p. 49/55
50 Cáncer gástrico Solución de problemas - Gástrico Consulte la sección de resolución de problemas del manual de Dako indicado anteriormente (19) para encontrar una solución o póngase en contacto con el Departamento de servicio técnico de Dako para informar de la tinción inusual. Problema Causa probable Acción sugerida 1. Los portaobjetos no se tiñeron 1a. Los reactivos no se utilizaron en el orden correcto 1b. Presencia de azida sódica en la solución de lavado 1a. Revisar la aplicación de reactivos 1b. Utilice una preparación reciente del Wash Buffer suministrado en el kit 2. Tinción débil de los portaobjetos 1c. Es probable que el calentamiento excesivo de los cortes de tejido montados antes de la desparafinización y la recuperación del antígeno inducida por calor causen la pérdida de la inmunorreactividad visible para HER2. 2a. Recuperación de epítopo insuficiente 2b. Incubación incorrecta del reactivo 2c. Método de fijación no apropiado 2d. Es probable que el calentamiento excesivo de los cortes de tejido montados antes de la desparafinización y la recuperación del antígeno inducida por calor causen una disminución significativa de la inmunorreactividad visible para HER2. 2e. Aplicado un volumen insuficiente de reactivo. 1c. Seque los cortes de tejido a temperatura ambiente durante un mínimo de 12 horas o hasta que estén secos. Como alternativa, seque a 37 C durante toda la noche o bien seque a 60 C durante un máximo de una hora. El secado de cortes de tejidos a temperaturas altas solo debe efectuarse en un horno calibrado con distribución uniforme del calor (17). 2a. Compruebe que la Epitope Retrieval Solution alcanza los C durante 40 minutos y que se deja enfriar durante 20 minutos 2b. Revise las instrucciones del procedimiento de tinción 2c. Asegúrese de que el tejido del paciente no está sobrefijado y de que no se ha utilizado otro fijador 2d. Seque los cortes de tejido a temperatura ambiente durante un mínimo de 12 horas o hasta que estén secos. Como alternativa, seque a 37 C durante toda la noche o bien seque a 60 C durante un máximo de una hora. El secado de cortes de tejidos a temperaturas altas solo debe efectuarse en un horno calibrado con distribución uniforme del calor (17). 2e. Compruebe el volumen de reactivo aplicado. ( ) P04454ES_01_K / p. 50/55
51 Cáncer gástrico Problema Causa probable Acción sugerida 3. Tinción de fondo de portaobjetos excesiva 3a. No se ha retirado por completo la parafina 3a. Utilice soluciones de eliminación recientes y siga el procedimiento tal y como se indica en la sección B.1 4. El tejido se despega del portaobjeto 5. Tinción específica excesivamente fuerte 3b. Se han utilizado aditivos de almidón al montar los cortes en los portaobjetos 3c. No se han aclarado los portaobjetos correctamente 3d. Las secciones se han secado durante el procedimiento de tinción 3e. Método de fijación no apropiado 3f. Enlace no específico de los reactivos con el tejido 4a. Se han utilizado portaobjetos inadecuados 5a. Método de fijación no apropiado 5b. Utilización de una fuente de calor no adecuada para la recuperación de epítopo, como un vaporizador, un horno microondas o un autoclave 5c. Incubación del reactivo demasiado prolongada 5d. Solución de lavado no adecuada 3b. No utilice aditivos de almidón para adherir los cortes al portaobjeto. Muchos aditivos son inmunorreactivos 3c. Utilice una solución reciente en los baños de tampón y en los frascos de lavado 3d. Utilice una cámara húmeda. Limpie sólo de tres a cuatro portaobjetos a la vez antes de aplicar el reactivo 3e. Asegúrese de que se ha utilizado un fijador aprobado. Los fijadores alternativos pueden producir un exceso de tinción de fondo 3f. Compruebe el método de fijación del espécimen y la presencia de necrosis 4a. Utilice portaobjetos silinizados, como los Dako Silanized Slides, Nº de catálogo S3003, los portaobjetos SuperFrost Plus o portaobjetos recubiertos de poli-l-lisina 5a. Asegúrese de que sólo se emplearon fijadores y métodos de fijación aprobados 5b. Asegúrese de que sólo se utiliza un baño de agua para la recuperación de epítopo 5c. Revise las instrucciones del procedimiento de tinción 5d. Utilice únicamente el tampón de lavado recomendado para el kit ( ) P04454ES_01_K / p. 51/55
52 Cáncer gástrico Problema Causa probable Acción sugerida 6. Tinción débil de la línea celular del portaobjeto de control 1+ 6a. No se ha seguido el protocolo de recuperación de epítopo correcto 6a. Sumerja los portaobjetos en la solución de recuperación de epítopo precalentada. Haga que la Epitope Retrieval Solution vuelva a alcanzar los C y precaliente durante 40 minutos 6b. No hay reacción con la Substrate Chromogen Solution (DAB) 6b. Asegúrese de que la incubación dura 10 minutos. Asegúrese de que sólo se agregó una gota de cromógeno DAB a 1 ml de DAB Buffered Substrate 7. Epitope Retrieval Solution adquiere un aspecto turbio cuando se calienta 8. Epitope Retrieval Solution adquiere un aspecto turbio cuando se almacena (antes de calentarla) 6c. Degradación del portaobjeto de control 7. La solución adquiere un aspecto turbio cuando se calienta 8. La solución se ha almacenado incorrectamente o ha pasado la fecha de caducidad de la solución 6c. Compruebe la fecha de caducidad del kit y las condiciones de almacenamiento del mismo en la parte exterior del paquete 7. Esto es normal y no influye en la tinción 8. Compruebe la fecha de caducidad y las condiciones de almacenamiento del kit, que se indican en el exterior del paquete. Deseche la Epitope Retrieval Solution. NOTA: si el problema no puede atribuirse a ninguna de las causas expuestas anteriormente o si la medida de corrección que se sugiere no resuelve el problema, llame a los Servicios técnicos de Dako para obtener más ayuda. Puede encontrar información adicional sobre las técnicas de tinción y sobre la preparación de especímenes en el manual de Dako citado anteriormente (19) (disponible en Dako), en Atlas of Immunohistology (30) y en Immunoperoxidase Techniques. A Practical Approach to Tumor Diagnosis (31). ( ) P04454ES_01_K / p. 52/55
53 Referencias 1. Coussens L, Yang-Feng TL, Liao Y-C, Chen E, Gray A, McGrath J, et al. Tyrosine kinase receptor with extensive homology to EGF receptor shares chromosomal location with neu oncogene. Science 1985;230: King CR, Kraus MH, Aaronson SA. Amplification of a novel v-erbb-related gene in a human mammary carcinoma. Science 1985;229: Semba K, Kamata N, Toyoshima K, Yamamoto T. A v-erbb-related protooncogene, c-erbb-2, is distinct from the c-erbb-1/epidermal growth factor-receptor gene and is amplified in a human salivary gland adenocarcinoma. Proc Natl Acad Sci USA 1985;82: Yamamoto T, Ikawa S, Akiyama T, Semba K, Nomura N, Miyajima N, et al. Similarity of protein encoded by the human c-erb-b-2 gene to epidermal growth factor receptor. Nature 1986;319: Schechter AL, Hung M-C, Vaidyanathan L, Weinberg RA, Yang-Feng TL, Francke U, et al. The neu gene: an erbb-homologous gene distinct from and unlinked to the gene encoding the EGF receptor. Science 1985;229: Bargmann CI, Hung M-C, Weinberg RA. The neu oncogene encodes an epidermal growth factor receptor-related protein. Nature 1986;319: Natali PG, Nicotra MR, Bigotti A, Venturo I, Slamon DJ, Fendly BM, et al. Expression of the p185 encoded by HER2 oncogene in normal and transformed human tissues. Int J Cancer 1990;45: Press MF, Cordon-Cardo C, Slamon DJ. Expression of the HER-2/neu proto-oncogene in normal human adult and fetal tissues. Oncogene 1990;5: Lonardo F, Di Marco E, King CR, Pierce JH, Segatto O, Aaronson SA, et al. The normal erbb-2 product is an atypical receptor-like tyrosine kinase with constitutive activity in the absence of ligand. New Biologist 1990;2: Carter P, Presta L, Gorman CM, Ridgway JBB, Henner D, Wong WLT, et al. Humanization of an antip185 HER2 antibody for human cancer therapy. Proc Natl Acad Sci USA 1992;89: Hudziak RM, Lewis GD, Winget M, Fendly BM, Shepard HM, Ullrich A. p185 HER2 monoclonal antibody has antiproliferative effects in vitro and sensitizes human breast tumor cells to tumor necrosis factor. Mol Cell Biol 1989;9: Lewis GD, Figari I, Fendly B, Wong WL, Carter P, Gorman C, et al. Differential responses of human tumor cell lines to anti-p185 HER2 monoclonal antibodies. Cancer Immunol Immunother 1993;37: Baselga J, Norton L, Albanell J, Kim Y-M, Mendelsohn J. Recombinant humanized anti-her2 antibody (Herceptin ) enhances the antitumor activity of paclitaxel and doxorubicin against HER2/neu overexpressing human breast cancer xenografts. Cancer Res 1998;58: a. Medical Laboratories Particular requirements for quality and competence, ISO 15189:2003. b. Clinical Laboratory Improvement Amendments of 1988: Final Rule, 57CFR7163, February 28, Sheehan DC, Hrapchak BB. Theory and practice of histotechnology. St. Louis: The C. V. Mosby Company; Kiernan JA. Histological and histochemical methods: theory & practice. New York: Pergamon Press; Lundgaard Hansen B, Winther H, Moller K. Excessive section drying of breast cancer tissue prior to deparaffinisation and antigen retrieval causes a loss in HER2 immunoreactivity, Immunocytochemistry 2008;6, DakoCytomation California Inc., Data on file. 19. Key M. Education Guide: Immunohistochemical Staining Methods. Fifth Edition. Dako, Carpinteria, California; Leong AS-Y, Milios J, Leong FJ. Epitope retrieval with microwaves. A comparison of citrate buffer and EDTA with three commercial retrieval solutions. Appl Immunohistochem 1996;4: Procedures for decontamination of plumbing systems containing copper and/or lead azides, Department of Health, Education, and Welfare, National Institute for Occupational Safety and Health, Rockville, MD, Decontamination of laboratory sink drains to remove azide salts. Center for Disease Control Manual Guide: Safety Management, No. CDC-22, Atlanta, GA, April 30, Clinical and Laboratory Standards Institute (formerly NCCLS). Protection of Laboratory Workers From Occupationally Acquired Infections; Approved Guideline Third Edition. CLSI document M29-A3 [ISBN ]. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania USA, Clinical and Laboratory Standards Institute (formerly NCCLS). Quality assurance for immunocytochemistry; Approved guideline. CLSI document MM4-A ( ) CLSI, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania USA; ( ) P04454ES_01_K / p. 53/55
54 25. Elias JM, Gown AM, Nakamura RM, Wilbur DC, Herman GE, Jaffe ES, et al. Special report: quality control in immunohistochemistry. Am J Clin Pathol 1989;92: Nadji M, Morales AR. Immunoperoxidase: Part I. The technique and its pitfalls. Lab Med 1983;14: Omata M, Liew C-T, Ashcavai M, Peters RL. Nonimmunologic binding of horseradish peroxidase to hepatitis B surface antigen: a possible source of error in immunohistochemistry. Am J Clin Path 1980;73: Herman GE, Elfont EA. The taming of immunohistochemistry: the new era of quality control. Biotech & Histochem 1991; 66: Press MF, Hung G, Godolphin W, Slamon DJ. Sensitivity of HER-2/neu antibodies in archival tissue samples: potential source of error in immunohistochemical studies of oncogene expression. Cancer Res 1994;54: Tubbs RR, Gephardt GN, Petras RE. Specimen processing and quality assurance. In: Atlas of immunohistology. Chicago: Amer Soc Clin Pathol Press; 1986: Nadji M, Morales AR. Immunoperoxidase techniques. A practical approach to tumor diagnosis. Chicago: Amer Soc Clin Pathol Press; Jørgensen JT. Targeted HER2 Treatment in Advanced Gastric Cancer. Oncology 2010 (in press). 33. Tanner M, Hollmén M, Junttila TT, Kapanen AI, Tomola S, SoiniY et al. Amplification of HER-2 in gastric carcinoma: association with Topoisomerase II alpha gene amplification, intestinal type, poor prognosis and sensitivity to trastuzumab. Ann Oncol 2005;16: Matsui Y, Inomata M, Tojigamori M, Sonoda K, Shiraishi N, Kitano S. Suppression of tumor growth in human gastric cancer with HER2 overexpression by an anti-her2 antibody in a murine model. Int J Oncol 2005; 27: Fujimoto-Ouchi K, Sekiguchi F, Yasuno H, Moriya Y, Mor K, Tanaka Y. Antitumor activity of trastuzumab in combination with chemotherapy in human gastric cancer xenograft models. Cancer Chemother Pharmacol 2007; 59: Kim SY, Kim HP, Kim YJ, Oh DY, Im S-A, Lee D et al. Trastuzumab inhibits the growth of human gastric cancer cell lines with HER2 amplification synergistically with cisplatin. Int J Oncol 2008; 32: Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-esophageal junction cancer (ToGA): a phase 3, open-label, randomized controlled trial. Lancet Bang Y, Chung J, Xu J, Lordick F, Sawaki A, Lipatov O et al. Pathological features of advanced Gastric Cancer (GC): Relationship to human epidermal growth factor receptor 2 (HER2) positivity in the global screening programme of the ToGA trial. J Clin Oncol 2009; 27:15s (suppl; abstr 4556). 39. Van Cutsem E, Kang YK, Chung HC, Shen L, Sawaki A, Lordick F, et al. Efficacy results from the ToGA trial: a phase III study of trastuzumab added to standard chemotherapy in first-line human epidermal growth factor receptor 2 (HER2)-positive advanced gastric cancer. (presentation ASCO 2009). 40. Hofmann M, Stoss O, Shi D, Büttner R, van de Vijver M, Kim W, et al. Assessment of a HER2 scoring system for gastric cancer: results from a validation study. Histopath 2008;52: Asioli S, Maletta F, Verdun di Cantogno L, Satolli MA, Schena M, Pecchioni C, et al. Approaching heterogeneity of human epidermal growth factor receptor 2 in surgical specimens of gastric cancer. Human Pathol 2012; 43;11: ( ) P04454ES_01_K / p. 54/55
55 Explicación de símbolos Número de catálogo Límite de temperatura Código de lote Pictograma GHS (consulte el apartado de precauciones) Producto sanitario para diagnóstico in vitro. Frágil, manipular con precaución Fecha de caducidad Pictograma GHS (consulte el apartado de precauciones) Consulte las instrucciones de uso Contenido suficiente para <n> ensayos Fabricante Fabricado por: Distribuido en EE.UU. por: Dako Denmark A/S Produktionsvej 42 DK-2600 Glostrup Dinamarca Tel Fax Dako North America, Inc Via Real Carpinteria, California 93013, EE.UU. Tel. 805/ , gratuito: 800/ Información para pedidos: Tel. 800/ Fax: 805/ Servicios técnicos: Tel. 800/ HercepTest y Herceptin son marcas comerciales de Genentech, Inc. sujetas a licencias propiedad de Dako Denmark A/S y F. Hoffmann-La Roche Ltd. ( ) P04454ES_01_K / p. 55/55
HercepTest for Dako Autostainer
 HercepTest for Dako Autostainer N de catálogo K5207 20ª edición Para tinción inmunocitoquímica. El kit es para 50 pruebas (100 portaobjetos). (129269-001) P04455ES_01_K520721-2/2016.05 p. 1/53 Índice Página
HercepTest for Dako Autostainer N de catálogo K5207 20ª edición Para tinción inmunocitoquímica. El kit es para 50 pruebas (100 portaobjetos). (129269-001) P04455ES_01_K520721-2/2016.05 p. 1/53 Índice Página
HercepTest for Automated Link Platforms
 HercepTest for Automated Link Platforms Nº de catálogo SK001 22ª edición (129282-001) P04456ES_01_SK00121-2/2016.05 p. 1/40 Índice Página/ Uso previsto...3 Resumen y explicación - Mama...4 Principio del
HercepTest for Automated Link Platforms Nº de catálogo SK001 22ª edición (129282-001) P04456ES_01_SK00121-2/2016.05 p. 1/40 Índice Página/ Uso previsto...3 Resumen y explicación - Mama...4 Principio del
Dako REAL Detection System, Peroxidase/DAB+, Rabbit/Mouse
 Dako REAL Detection System, Peroxidase/DAB+, Rabbit/Mouse Código K5001 6ª edición Para su uso con instrumentos de inmunotinción automatizada de Dako. El kit contiene reactivos suficientes para 500 pruebas.
Dako REAL Detection System, Peroxidase/DAB+, Rabbit/Mouse Código K5001 6ª edición Para su uso con instrumentos de inmunotinción automatizada de Dako. El kit contiene reactivos suficientes para 500 pruebas.
PNA ISH Detection Kit N de código K5201
 PNA ISH Detection Kit N de código K5201 9a edición Para la hibridación in situ mediante sondas PNA conjugadas con fluoresceína. El kit contiene reactivos para un mínimo de 40 pruebas*. * Número de pruebas
PNA ISH Detection Kit N de código K5201 9a edición Para la hibridación in situ mediante sondas PNA conjugadas con fluoresceína. El kit contiene reactivos para un mínimo de 40 pruebas*. * Número de pruebas
TECNICA DE INMUNOHISTOQUIMICA *IHQ*
 Hospital General ISSS TECNICA DE INMUNOHISTOQUIMICA *IHQ* Tec. Delmy de Chávez Sep/2010 Estufa EQUIPO BASICO Baño de María EQUIPO BASICO Microscopio EQUIPO BASICO Medidor de ph. EQUIPO BASICO Refrigeradora
Hospital General ISSS TECNICA DE INMUNOHISTOQUIMICA *IHQ* Tec. Delmy de Chávez Sep/2010 Estufa EQUIPO BASICO Baño de María EQUIPO BASICO Microscopio EQUIPO BASICO Medidor de ph. EQUIPO BASICO Refrigeradora
Módulo de MAMA. Ronda nº 2
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de MAMA Ronda nº 2 Antígeno probado: P63 Tejido probado: Tejido mamario
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de MAMA Ronda nº 2 Antígeno probado: P63 Tejido probado: Tejido mamario
Positive Control (ORG ) Negative Control (ORG ) Instrucciones para el uso 10/2009
 ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Positive Control (ORG 310-24) Negative Control (ORG 311-24) Instrucciones para el uso 10/2009 1/7 alegria-control-0910-04-es
ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Positive Control (ORG 310-24) Negative Control (ORG 311-24) Instrucciones para el uso 10/2009 1/7 alegria-control-0910-04-es
Módulo de PATOLOGÍA QUIRÚRGICA GENERAL. Ronda nº 6
 SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 6 Antígeno probado: HMB4 Tejido
SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 6 Antígeno probado: HMB4 Tejido
INDICACIONES TRADOS. Orina. control hcg. Juego de. hcg Orina. etapas de embarazo. temprano. Cuando se. hcg Orina. tamponada con.
 Instrucciones para uso profesional INDICACIONES El Juego de control hcg Orina se utiliza con la prueba de QuickVue+ hcg Combo, prueba de QuickVue hcg Orina o Combo y prueba de RapidVue hcg. Estos controles
Instrucciones para uso profesional INDICACIONES El Juego de control hcg Orina se utiliza con la prueba de QuickVue+ hcg Combo, prueba de QuickVue hcg Orina o Combo y prueba de RapidVue hcg. Estos controles
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS
 HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS INTERES CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS INTERES CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de conejo
 Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de conejo Código K4010 15 ml Código K4011 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican
Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de conejo Código K4010 15 ml Código K4011 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican
Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de ratón
 Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de ratón Código K4006 15 ml Código K4007 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican al
Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de ratón Código K4006 15 ml Código K4007 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican al
FluoroSpheres Code No. K0110
 FluoroSpheres Code No. K0110 6a edición Perlas de calibración para monitoreo diario del citómetro de flujo. Contiene reactivos para 40 calibraciones. (105798-004) SSK0110CE_02/ES/2015.12 p. 1/8 Contenidos
FluoroSpheres Code No. K0110 6a edición Perlas de calibración para monitoreo diario del citómetro de flujo. Contiene reactivos para 40 calibraciones. (105798-004) SSK0110CE_02/ES/2015.12 p. 1/8 Contenidos
c-kit pharmdx Código K para uso en el Dako Autostainer Uso previsto Para uso en diagnóstico in vitro.
 c-kit pharmdx Código K1907 35 para uso en el Dako Autostainer Uso previsto Para uso en diagnóstico in vitro. El ensayo c-kit pharmdx es un kit inmunohistoquímico (IHQ) cualitativo usado en el Dako Autostainer
c-kit pharmdx Código K1907 35 para uso en el Dako Autostainer Uso previsto Para uso en diagnóstico in vitro. El ensayo c-kit pharmdx es un kit inmunohistoquímico (IHQ) cualitativo usado en el Dako Autostainer
Módulo de PATOLOGÍA LINFOIDE. Ronda nº 2
 SEAP Calle Ancora, 3, º B MADRID Tfno. y Fax 9 39 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Antígeno probado: bcl Tejido probado: Amígdala Módulo de PATOLOGÍA LINFOIDE Ronda nº Instrucciones:
SEAP Calle Ancora, 3, º B MADRID Tfno. y Fax 9 39 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Antígeno probado: bcl Tejido probado: Amígdala Módulo de PATOLOGÍA LINFOIDE Ronda nº Instrucciones:
HBsAg CONFIRMATORY TEST INTERÉS CLÍNICO
 HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS. INTERÉS CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS. INTERÉS CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
Instrucciones: Número de laboratorios participantes: Remitidos: 88 Contestados: 84 GCP (95.45 %) y 83(94.31%) Control Local
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología MÓDULO DE IHQ GENERAL RONDA 35 Antígeno probado: HMB45 Tejido probado: ü
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología MÓDULO DE IHQ GENERAL RONDA 35 Antígeno probado: HMB45 Tejido probado: ü
Cytology FISH Accessory Kit Nº de catálogo K 5499
 Cytology FISH Accessory Kit Nº de catálogo K 5499 2ª edición Para hibridación in situ fluorescente (FISH, por sus siglas en inglés) con muestras de citología. El kit contiene reactivos suficientes para
Cytology FISH Accessory Kit Nº de catálogo K 5499 2ª edición Para hibridación in situ fluorescente (FISH, por sus siglas en inglés) con muestras de citología. El kit contiene reactivos suficientes para
A: Protocolo de Actuación para trabajos con Bromuro de Etidio.
 TRABAJOS CON BROMURO DE ETIDIO Y ACRILAMIDA. 1 A: Protocolo de Actuación para trabajos con Bromuro de Etidio. Objeto: Dar instrucciones de seguridad para todos los procedimientos que utilicen Bromuro de
TRABAJOS CON BROMURO DE ETIDIO Y ACRILAMIDA. 1 A: Protocolo de Actuación para trabajos con Bromuro de Etidio. Objeto: Dar instrucciones de seguridad para todos los procedimientos que utilicen Bromuro de
11. MÉTODOS PARA LA DETECCIÓN DEL ROTAVIRUS. Actualmente existen diversos métodos en el mercado que pueden utilizarse
 11. MÉTODOS PARA LA DETECCIÓN DEL ROTAVIRUS Actualmente existen diversos métodos en el mercado que pueden utilizarse para el diagnóstico de rotavirus, las cuales pueden realizarse directamente a partir
11. MÉTODOS PARA LA DETECCIÓN DEL ROTAVIRUS Actualmente existen diversos métodos en el mercado que pueden utilizarse para el diagnóstico de rotavirus, las cuales pueden realizarse directamente a partir
Biología Celular e Histología. Prácticas de Biología Celular. Cultivos celulares y Procesamiento de tejidos.
 Biología Celular e Histología Prácticas de Biología Celular Cultivos celulares y Procesamiento de tejidos. Suspensiones celulares. Inmunodetección directa. Identificación celular tras cultivo. Manejo del
Biología Celular e Histología Prácticas de Biología Celular Cultivos celulares y Procesamiento de tejidos. Suspensiones celulares. Inmunodetección directa. Identificación celular tras cultivo. Manejo del
HER2 IQFISH pharmdx Nº de catálogo K5731
 HER2 IQFISH pharmdx Nº de catálogo K5731 3ª edición HER2 IQFISH pharmdx es un ensayo de hibridación in situ fluorescente (FISH) directo para la determinación cuantitativa de la amplificación del gen HER2
HER2 IQFISH pharmdx Nº de catálogo K5731 3ª edición HER2 IQFISH pharmdx es un ensayo de hibridación in situ fluorescente (FISH) directo para la determinación cuantitativa de la amplificación del gen HER2
Módulo de PATOLOGÍA LINFOIDE. Ronda nº 7
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA LINFOIDE Ronda nº 7 Antígeno probado: CD4 Tejido probado:
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA LINFOIDE Ronda nº 7 Antígeno probado: CD4 Tejido probado:
PROTOCOLO OPCIONAL TITULACIÓN DE SALINIDAD
 PROTOCOLO OPCIONAL TITULACIÓN DE SALINIDAD Objetivo General Medir la salinidad del agua utilizando un kit de titulación. Visión General El alumnado usará un kit de titulación para medir la salinidad del
PROTOCOLO OPCIONAL TITULACIÓN DE SALINIDAD Objetivo General Medir la salinidad del agua utilizando un kit de titulación. Visión General El alumnado usará un kit de titulación para medir la salinidad del
INMUNOHISTOQUIMICA. Laboratorio de Inmunología Clínica Facultad de Ciencias Químicas - UNA
 INMUNOHISTOQUIMICA Laboratorio de Inmunología Clínica Facultad de Ciencias Químicas - UNA INMUNOHISTOQUIMICA Objetivo identificar Ag dentro de un corte tisular. Mediante la utilización de Anticuerpos monoclonales
INMUNOHISTOQUIMICA Laboratorio de Inmunología Clínica Facultad de Ciencias Químicas - UNA INMUNOHISTOQUIMICA Objetivo identificar Ag dentro de un corte tisular. Mediante la utilización de Anticuerpos monoclonales
MANUAL DE OPERACIONES DE ANATOMÍA PATOLÓGICA
 Hoja: 1 de 6 MANUAL DE OPERACIONES DE ANATOMÍA PATOLÓGICA Elaboró: Autorizó: Puesto Responsable del Laboratorio de Anatomía Patológica Subdirector de Investigación Biomédica Firma Hoja: 2 de 6 Propósito
Hoja: 1 de 6 MANUAL DE OPERACIONES DE ANATOMÍA PATOLÓGICA Elaboró: Autorizó: Puesto Responsable del Laboratorio de Anatomía Patológica Subdirector de Investigación Biomédica Firma Hoja: 2 de 6 Propósito
Catalyzed Signal Amplification (CSA) System Para su uso con anticuerpos primarios de ratón
 Catalyzed Signal Amplification (CSA) System Para su uso con anticuerpos primarios de ratón Código K1500 15 ml Licencia de uso limitado Este producto se distribuye y vende al usuario final conforme con
Catalyzed Signal Amplification (CSA) System Para su uso con anticuerpos primarios de ratón Código K1500 15 ml Licencia de uso limitado Este producto se distribuye y vende al usuario final conforme con
ZytoLight SPEC FGFR1/CEN 8 Dual Color Probe
 ZytoLight SPEC FGFR1/CEN 8 Dual Color Probe Z-2072-200 Z-2072-50 20 (0,2 ml) 5 (0,05 ml) Para la detección del gen humano FGFR1 y el satélite alfa del cromosoma 8 mediante hibridación in situ con fluorescencia
ZytoLight SPEC FGFR1/CEN 8 Dual Color Probe Z-2072-200 Z-2072-50 20 (0,2 ml) 5 (0,05 ml) Para la detección del gen humano FGFR1 y el satélite alfa del cromosoma 8 mediante hibridación in situ con fluorescencia
Estreptavidina conjugada con peroxidasa de rábano en PBS que contiene proteína estabilizante y agentes antimicrobianos.
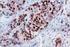 Dako LSAB2 System-HRP Nº de catálogo K0672 15 ml Nº de catálogo K0673 15 ml Nº de catálogo K0675 110 ml Uso previsto Para uso en diagnóstico in vitro. Estas instrucciones se aplican al Dako Labelled Streptavidin-Biotin2
Dako LSAB2 System-HRP Nº de catálogo K0672 15 ml Nº de catálogo K0673 15 ml Nº de catálogo K0675 110 ml Uso previsto Para uso en diagnóstico in vitro. Estas instrucciones se aplican al Dako Labelled Streptavidin-Biotin2
INTRODUCCIÓN AL ELISA
 INTRODUCCIÓN AL ELISA 10 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es aportar a los estudiantes el conocimiento y metodología de la técnica del ELISA 2. COMPONENTES
INTRODUCCIÓN AL ELISA 10 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es aportar a los estudiantes el conocimiento y metodología de la técnica del ELISA 2. COMPONENTES
QUANTA Chek ANA Panel
 QUANTA Chek ANA Panel 708111 Uso previsto El QUANTA Chek TM ANA Panel se utiliza como control de calidad de los procedimientos IFA y ELISA para anticuerpos antinucleares. Cada suero sirve como control
QUANTA Chek ANA Panel 708111 Uso previsto El QUANTA Chek TM ANA Panel se utiliza como control de calidad de los procedimientos IFA y ELISA para anticuerpos antinucleares. Cada suero sirve como control
Módulo de PATOLOGÍA QUIRÚRGICA GENERAL. Ronda nº 6. Antígeno probado: BhCG (Gonadotrofina coriónica, subunidad beta).
 SEAP Calle Ancora,, 2º B 284 MADRID Tfno. y Fax 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 6 Antígeno probado: BhCG (Gonadotrofina
SEAP Calle Ancora,, 2º B 284 MADRID Tfno. y Fax 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 6 Antígeno probado: BhCG (Gonadotrofina
VERSIÓN PARA EQUIPOS COBAS c501/c502 DE ROCHE
 VERSIÓN PARA EQUIPOS COBAS c501/c502 DE ROCHE EQUIPO ADICIONAL NO SUMINISTRADO: La preparación de los reactivos requiere el empleo de micropipetas o sistemas que permitan dispensar los volúmenes especificados.
VERSIÓN PARA EQUIPOS COBAS c501/c502 DE ROCHE EQUIPO ADICIONAL NO SUMINISTRADO: La preparación de los reactivos requiere el empleo de micropipetas o sistemas que permitan dispensar los volúmenes especificados.
Laboratorio Nacional de Salud Pública
 1. Tinción de Gram 2. Objeto y campo de aplicación La técnica de tinción de Gram se utiliza para la tinción de bacterias, levaduras y actinomicetos aerobios. Este procedimiento operativo estándar es aplicable
1. Tinción de Gram 2. Objeto y campo de aplicación La técnica de tinción de Gram se utiliza para la tinción de bacterias, levaduras y actinomicetos aerobios. Este procedimiento operativo estándar es aplicable
50 kits de recolección de muestras con torunda multitest Aptima (N.º de catálogo PRD-03546) Cada kit contiene:
 Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
ZytoLight SPEC RET Dual Color Break Apart Probe
 ZytoLight SPEC RET Dual Color Break Apart Probe Z-2148-200 Z-2148-50 20 (0,2 ml) 5 (0,05 ml) Para la detección de translocaciones que involucran al gen RET en 10q11.21 mediante hibridación in situ con
ZytoLight SPEC RET Dual Color Break Apart Probe Z-2148-200 Z-2148-50 20 (0,2 ml) 5 (0,05 ml) Para la detección de translocaciones que involucran al gen RET en 10q11.21 mediante hibridación in situ con
GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES. Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé
 GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé Esquema de investigación en pruebas fallidas Revisar el procedimiento y determinar
GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé Esquema de investigación en pruebas fallidas Revisar el procedimiento y determinar
HOJA DE INFORMACIÓN Y SEGURIDAD
 HOJA DE INFORMACIÓN Y SEGURIDAD 1. IDENTIFICACIÓN DEL PRODUCTO Nombre del producto: Neozime Código de identificación interno: NZ Fabricante: Labnews Industrias Químicas Ltda. Dirección: Rua Ademar Bombo,
HOJA DE INFORMACIÓN Y SEGURIDAD 1. IDENTIFICACIÓN DEL PRODUCTO Nombre del producto: Neozime Código de identificación interno: NZ Fabricante: Labnews Industrias Químicas Ltda. Dirección: Rua Ademar Bombo,
50 kits de recolección de muestras con torunda multitest Aptima (N.º de catálogo PRD-03546) Cada kit contiene:
 Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
INSTRUCCIONES PARA EL ENVÍO DE MUESTRAS AL SERVICIO DE ANATOMÍA PATOLÓGICA
 DE MUESTRAS AL SERVICIO DE Citología Ginecológica PAAF Convencional Citología General Biopsia Diagnóstica Biopsia Quirúrgica Biopsia Intraoperatoria Tipo de muestra/prueba Citología exfoliativa ginecológica
DE MUESTRAS AL SERVICIO DE Citología Ginecológica PAAF Convencional Citología General Biopsia Diagnóstica Biopsia Quirúrgica Biopsia Intraoperatoria Tipo de muestra/prueba Citología exfoliativa ginecológica
Tenga en cuenta el espacio pequeño. Me pareció que el espacio aéreo más, un CDS más débiles se produjo. Tanto como el 50% menos!
 Cómo preparo CDS a través del "Shot Glass" Método Cómo preparar un litro o cuarto de galón de solución de 25 ppm de dióxido de cloro - 26 de septiembre 212 Descargo de responsabilidad: Este procedimiento
Cómo preparo CDS a través del "Shot Glass" Método Cómo preparar un litro o cuarto de galón de solución de 25 ppm de dióxido de cloro - 26 de septiembre 212 Descargo de responsabilidad: Este procedimiento
Estas instrucciones se aplican a Dako EnVision+, Peroxidase (Dako EnVision+, HRP).
 Dako EnVision+ System- HRP Labelled Polymer Anti-ratón Nº de catálogo K4000 15 ml Nº de catálogo K4001 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican a Dako EnVision+,
Dako EnVision+ System- HRP Labelled Polymer Anti-ratón Nº de catálogo K4000 15 ml Nº de catálogo K4001 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican a Dako EnVision+,
WITNESS RELAXIN (plasma, serum) RLX RLX u d 9 n n ersio V X RLX L R -W IO B S
 WITNESS RELAXIN (plasma, serum) SBIO-W Version n 9 du 28.07.2010 WITNESS RELAXIN WITNESS RELAXIN GENERALIDADES El kit WITNESS RELAXIN permite diagnosticar la gestación en la perra y en la gata, y permite
WITNESS RELAXIN (plasma, serum) SBIO-W Version n 9 du 28.07.2010 WITNESS RELAXIN WITNESS RELAXIN GENERALIDADES El kit WITNESS RELAXIN permite diagnosticar la gestación en la perra y en la gata, y permite
Heat Shock Protein 27 (G3.1)
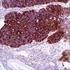 Identificación del Producto N.º de ref. Descripción 46946 HSP27 0,1 M (G3.1) 46947 HSP27 1 M (G3.1) 46945 HSP27 RTU M (G3.1) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 46946 HSP27 0,1 M (G3.1) 46947 HSP27 1 M (G3.1) 46945 HSP27 RTU M (G3.1) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Preparación de muestras para microscopía confocal
 Preparación de muestras para microscopía confocal Andrés Esteban Cantos y Covadonga Alonso Martí Laboratorio de Interacción virus-célula Departamento de Biotecnología del INIA Preparación de muestras La
Preparación de muestras para microscopía confocal Andrés Esteban Cantos y Covadonga Alonso Martí Laboratorio de Interacción virus-célula Departamento de Biotecnología del INIA Preparación de muestras La
DANAGENE BLOOD DNA KIT
 Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
Número de laboratorios participantes:
 SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de Patología de Mama Ronda 3ª Antígeno probado: Receptor de Progesterona
SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de Patología de Mama Ronda 3ª Antígeno probado: Receptor de Progesterona
Fortel PROSTATE (PSA)
 Fortel PROSTATE (PSA) Test para Screening Simple, realizable y confidencial [Seleccione la fecha] Un test visual fácil, para detectar niveles anormales del Antígeno Prostático Específico (PSA), sobre rango
Fortel PROSTATE (PSA) Test para Screening Simple, realizable y confidencial [Seleccione la fecha] Un test visual fácil, para detectar niveles anormales del Antígeno Prostático Específico (PSA), sobre rango
BVPro - Instrucciones de uso
 No de Catálogo de Mologic: 5 unidades, MBVP15; 25 unidades, MBVP125 BVPro - Instrucciones de uso BVPro Prueba Rápida para el Diagnóstico de Vaginosis Bacteriana (VB). Para uso profesional WHAT IS BVPro?
No de Catálogo de Mologic: 5 unidades, MBVP15; 25 unidades, MBVP125 BVPro - Instrucciones de uso BVPro Prueba Rápida para el Diagnóstico de Vaginosis Bacteriana (VB). Para uso profesional WHAT IS BVPro?
Ficha de Datos de Seguridad (MSDS) Fecha de elaboración 26/11/2013 Versión 01
 1. PRODUCTO Nombre: ÁCIDO ÚRICO Clasificación: NFPA SGA Código: Presentación: 00172 50 ml 00173 100 ml 00175 200 ml 005793 500 ml Fórmula: No aplica. Teléfono de emergencia: CISTEMA (Emergencia con productos
1. PRODUCTO Nombre: ÁCIDO ÚRICO Clasificación: NFPA SGA Código: Presentación: 00172 50 ml 00173 100 ml 00175 200 ml 005793 500 ml Fórmula: No aplica. Teléfono de emergencia: CISTEMA (Emergencia con productos
La Patología a Molecular y el Control de Calidad
 UNIDAD DIDÁCTICA 7: LOS PROCESOS EN ANATOMÍA PATOLÓGICA La Patología a Molecular y el Control de Calidad Asunción n Olmo Sevilla Master Diagnóstica S. L. Patología Molecular: Patología del futuro X Personal:
UNIDAD DIDÁCTICA 7: LOS PROCESOS EN ANATOMÍA PATOLÓGICA La Patología a Molecular y el Control de Calidad Asunción n Olmo Sevilla Master Diagnóstica S. L. Patología Molecular: Patología del futuro X Personal:
PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN DE LAS COMPETENCIAS PROFESIONALES TRANSVERSAL
 MINISTERIO DE EDUCACIÓN, CULTURA Y DEPORTE SECRETARÍA DE ESTADO DE EDUCACIÓN, FORMACIÓN PROFESIONAL Y UNIVERSIDADES DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES
MINISTERIO DE EDUCACIÓN, CULTURA Y DEPORTE SECRETARÍA DE ESTADO DE EDUCACIÓN, FORMACIÓN PROFESIONAL Y UNIVERSIDADES DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES
sulfa versión 4 (método almohadas en polvo o ampollas vac ACCU); USEPA aceptado para la presentación de informes de análisis de aguas residuales
 sulfato (0 a 70 mg/l) Método 8051 para agua, aguas residuales, agua de mar Elaborado por Kenny Miranda. Rdo: Manuel Caballero, 22/11. sulfa versión 4 (método almohadas en polvo o ampollas vac ACCU); USEPA
sulfato (0 a 70 mg/l) Método 8051 para agua, aguas residuales, agua de mar Elaborado por Kenny Miranda. Rdo: Manuel Caballero, 22/11. sulfa versión 4 (método almohadas en polvo o ampollas vac ACCU); USEPA
La preparación de su hogar
 INTRODUCCIÓN Cómo guardar y manipular sus suministros Cuando se autoadministra una infusión IV de medicamentos, las infecciones son una preocupación importante. Los gérmenes están en todos lados, tanto
INTRODUCCIÓN Cómo guardar y manipular sus suministros Cuando se autoadministra una infusión IV de medicamentos, las infecciones son una preocupación importante. Los gérmenes están en todos lados, tanto
Histology FISH Accessory Kit N.º de catálogo K5799
 Histology FISH Accessory Kit N.º de catálogo K5799 4ª edición Auflage Para hibridación in situ fluorescente (FISH) con cortes de tejidos fijados con formol e incluidos en parafina. El kit contiene reactivos
Histology FISH Accessory Kit N.º de catálogo K5799 4ª edición Auflage Para hibridación in situ fluorescente (FISH) con cortes de tejidos fijados con formol e incluidos en parafina. El kit contiene reactivos
Inmunohistoquímica antígenos anticuerpos
 Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Metas Demostrar la presencia real
Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Metas Demostrar la presencia real
INSTRUCCIONES DE USO
 INSTRUCCIONES DE USO Microorganismos Epower USO PREVISTO Los microorganismos Epower son preparaciones cuantitativas liofilizadas de microorganismos para realizar controles de calidad en laboratorios industriales.
INSTRUCCIONES DE USO Microorganismos Epower USO PREVISTO Los microorganismos Epower son preparaciones cuantitativas liofilizadas de microorganismos para realizar controles de calidad en laboratorios industriales.
EGFR pharmdx. Nº de catálogo K1494 50 pruebas para uso en el Dako Autostainer Edición 9/27/2006. Uso previsto Para uso en diagnóstico in vitro.
 EGFR pharmdx Nº de catálogo K1494 50 pruebas para uso en el Dako Autostainer Edición 9/27/2006 Uso previsto Para uso en diagnóstico in vitro. El ensayo EGFR pharmdx es un kit inmunohistoquímico (IHQ) para
EGFR pharmdx Nº de catálogo K1494 50 pruebas para uso en el Dako Autostainer Edición 9/27/2006 Uso previsto Para uso en diagnóstico in vitro. El ensayo EGFR pharmdx es un kit inmunohistoquímico (IHQ) para
pruebas Circulating Tumor Cell Control Kit
 7900003 24 pruebas Circulating Tumor Cell Control Kit 1 USO PREVISTO Para uso en diagnóstico in vitro. CELLSEARCH Circulating Tumor Cell Control Kit está pensado para su uso como ensayo de control, para
7900003 24 pruebas Circulating Tumor Cell Control Kit 1 USO PREVISTO Para uso en diagnóstico in vitro. CELLSEARCH Circulating Tumor Cell Control Kit está pensado para su uso como ensayo de control, para
LLAVES: Protocolo de predesinfección/limpieza manual y esterilización de las llaves SATELEC
 LLAVES: Protocolo de predesinfección/limpieza manual y esterilización de las llaves SATELEC Advertencias: No utilice estropajos de acero ni productos de limpieza abrasivos. Evite las soluciones que contengan
LLAVES: Protocolo de predesinfección/limpieza manual y esterilización de las llaves SATELEC Advertencias: No utilice estropajos de acero ni productos de limpieza abrasivos. Evite las soluciones que contengan
HOJA DE SEGURIDAD Según NCh 2245 Of 2003 Nombre Comercial :
 Página 1 de 5 SECCION 1: Identificación del producto y del proveedor Identificación de fabricante: Fabricante / distribuidor PAREX CHILE LTDA. Dirección Puerto Montt 3235 Renca Ciudad Santiago País Chile
Página 1 de 5 SECCION 1: Identificación del producto y del proveedor Identificación de fabricante: Fabricante / distribuidor PAREX CHILE LTDA. Dirección Puerto Montt 3235 Renca Ciudad Santiago País Chile
QuickVue Dipstick Strep A test
 USO PREVISTO El Ensayo de Estreptococos A Dipstick QuickVue está diseñado para la detección cualitativa rápida del antígeno de los estreptococos del grupo A en muestras de exudados (torundas) o para confirmar
USO PREVISTO El Ensayo de Estreptococos A Dipstick QuickVue está diseñado para la detección cualitativa rápida del antígeno de los estreptococos del grupo A en muestras de exudados (torundas) o para confirmar
ANALISIS DE ph. MEDIDOR DE ph
 ANALISIS DE ph El medidor de ph digital Barnant está diseñado con elementos electrónicos del estado sólido, y la pantalla LCD permite una fácil lectura, aún bajo condiciones ambientales de luz brillante.
ANALISIS DE ph El medidor de ph digital Barnant está diseñado con elementos electrónicos del estado sólido, y la pantalla LCD permite una fácil lectura, aún bajo condiciones ambientales de luz brillante.
Herpes Simplex Virus II (Polyclonal)
 Identificación del Producto N.º de ref. Descripción 44640 Herpes simplex virus II 0,1 R (Poly) 44641 Herpes simplex virus II 1 R (Poly) 44309 Herpes simplex virus II RTU R (Poly) Definiciones De Los Símbolos
Identificación del Producto N.º de ref. Descripción 44640 Herpes simplex virus II 0,1 R (Poly) 44641 Herpes simplex virus II 1 R (Poly) 44309 Herpes simplex virus II RTU R (Poly) Definiciones De Los Símbolos
Métodos para Inmunidad Viral
 Métodos para Inmunidad Viral Radioinmunoensayo (RIA) Técnica muy sensible basada en la competencia de unión al anticuerpo específico entre el antígeno a cuantificar y cantidades conocidas del antígeno
Métodos para Inmunidad Viral Radioinmunoensayo (RIA) Técnica muy sensible basada en la competencia de unión al anticuerpo específico entre el antígeno a cuantificar y cantidades conocidas del antígeno
HER2 IQFISH pharmdx (Dako Omnis) N.º de catálogo GM333
 HER2 IQFISH pharmdx (Dako Omnis) N.º de catálogo GM333 2ª edición HER2 IQFISH pharmdx (Dako Omnis) es un ensayo de hibridación in situ fluorescente (FISH) directo diseñado para la determinación cuantitativa
HER2 IQFISH pharmdx (Dako Omnis) N.º de catálogo GM333 2ª edición HER2 IQFISH pharmdx (Dako Omnis) es un ensayo de hibridación in situ fluorescente (FISH) directo diseñado para la determinación cuantitativa
Módulo de PATOLOGÍA LINFOIDE. Ronda 10
 SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA LINFOIDE Ronda 1 Antígeno probado: CD Tejido probado: matriz
SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA LINFOIDE Ronda 1 Antígeno probado: CD Tejido probado: matriz
DIRECTRICES QUALANOD HOJA DE ACTUALIZACIÓN Nº 16 Edición Página 1 de 5 INSPECCIONES RUTINARIAS A LICENCIATARIOS
 Página 1 de 5 INSPECCIONES RUTINARIAS A LICENCIATARIOS Propuesta: Comité Técnico Decisión de QUALANOD: Reunión noviembre 2012 Fecha de aplicación: 1 de julio de 2013 Parte de las Directrices a la que afecta:
Página 1 de 5 INSPECCIONES RUTINARIAS A LICENCIATARIOS Propuesta: Comité Técnico Decisión de QUALANOD: Reunión noviembre 2012 Fecha de aplicación: 1 de julio de 2013 Parte de las Directrices a la que afecta:
Preparación de agua de dilución :
 La determinación de la Demanda Bioquímica de Oxígeno es una prueba en la que se determina los requerimientos relativos de oxígeno en aguas contaminadas tal como aguas residuales domésticas e industriales,,
La determinación de la Demanda Bioquímica de Oxígeno es una prueba en la que se determina los requerimientos relativos de oxígeno en aguas contaminadas tal como aguas residuales domésticas e industriales,,
1. Preparación de disoluciones y determinación de la concentración de una disolución por medio de una valoración.
 1. Preparación de disoluciones y determinación de la concentración de una disolución por medio de una valoración. Primera parte Preparar una disolución de NaH 0.1M Preparar disoluciones 0.1M de ácido clorhídrico,
1. Preparación de disoluciones y determinación de la concentración de una disolución por medio de una valoración. Primera parte Preparar una disolución de NaH 0.1M Preparar disoluciones 0.1M de ácido clorhídrico,
HISTOLOGÍA. Ciencia que estudia las células, tejidos y órganos, desde el punto de vista microscópico, relacionando la estructura con la función.
 HISTOLOGÍA HISTOLOGÍA Ciencia que estudia las células, tejidos y órganos, desde el punto de vista microscópico, relacionando la estructura con la función. MICROSCOPIOS TÉCNICAS HISTOLÓGICAS 1.Pie Microscopio
HISTOLOGÍA HISTOLOGÍA Ciencia que estudia las células, tejidos y órganos, desde el punto de vista microscópico, relacionando la estructura con la función. MICROSCOPIOS TÉCNICAS HISTOLÓGICAS 1.Pie Microscopio
REFRACTOMETRO R Manual del usuario
 Fecha edición 10/2011 N Versión 01 REFRACTOMETRO R0056007 Manual del usuario MANUAL DE OPERACIONES PARA REFRACTÓMETRO MANUAL La serie RHB fue desarrollada para trabajar con líquidos relacionados con el
Fecha edición 10/2011 N Versión 01 REFRACTOMETRO R0056007 Manual del usuario MANUAL DE OPERACIONES PARA REFRACTÓMETRO MANUAL La serie RHB fue desarrollada para trabajar con líquidos relacionados con el
Indicadores Químicos y Biológicos para la esterilización térmica de cargas líquidas
 Indicadores Químicos y Biológicos para la esterilización térmica de cargas líquidas Terragene ofrece un método simple y eficaz para controlar con precisión el proceso de esterilización en la industria
Indicadores Químicos y Biológicos para la esterilización térmica de cargas líquidas Terragene ofrece un método simple y eficaz para controlar con precisión el proceso de esterilización en la industria
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 46949 Langerin 0,1 M (12D6) 46950 Langerin 1 M (12D6) 46948 Langerin RTU M (12D6) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Identificación del Producto N.º de ref. Descripción 46949 Langerin 0,1 M (12D6) 46950 Langerin 1 M (12D6) 46948 Langerin RTU M (12D6) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Ficha de Datos de Seguridad Conforme al Reglamento (CE) Nº 1907/2006 (REACH)
 Ficha de Datos de Seguridad Conforme al Reglamento (CE) Nº 1907/2006 (REACH) PROGESTERONA.FDS ACOFARMA 1.- Identificación de la sustancia o del preparado y de la sociedad o empresa Identificación de la
Ficha de Datos de Seguridad Conforme al Reglamento (CE) Nº 1907/2006 (REACH) PROGESTERONA.FDS ACOFARMA 1.- Identificación de la sustancia o del preparado y de la sociedad o empresa Identificación de la
TEMA 14 NUEVAS TECNOLOGÍAS PARA EL ESTUDIO DE LAS ENFERMEDADES INFECCIOSAS: MÉTODOS GENÉTICOS
 TEMA 14 NUEVAS TECNOLOGÍAS PARA EL ESTUDIO DE LAS ENFERMEDADES INFECCIOSAS: MÉTODOS GENÉTICOS Tema 14. Nuevas tecnologías para el estudio de enfermedades infecciosas: métodos genéticos Métodos genéticos
TEMA 14 NUEVAS TECNOLOGÍAS PARA EL ESTUDIO DE LAS ENFERMEDADES INFECCIOSAS: MÉTODOS GENÉTICOS Tema 14. Nuevas tecnologías para el estudio de enfermedades infecciosas: métodos genéticos Métodos genéticos
ANÁLISIS DE CLORO RESIDUAL
 Página 1 de 7 1. OBJETIVO Realizar el análisis de Cloro residual en los tanques de almacenamiento de la planta de potabilización y en los puntos fijos de la red de distribución verificando la eficacia
Página 1 de 7 1. OBJETIVO Realizar el análisis de Cloro residual en los tanques de almacenamiento de la planta de potabilización y en los puntos fijos de la red de distribución verificando la eficacia
Módulo de PATOLOGÍA QUIRÚRGICA GENERAL. Ronda nº 8
 SEAP Calle Ancora, 3, 2º B 2 MADRID Tfno. y Fax 91 39 2 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº Antígeno probado: CD Tejido probado:
SEAP Calle Ancora, 3, 2º B 2 MADRID Tfno. y Fax 91 39 2 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº Antígeno probado: CD Tejido probado:
Instrucciones para el uso 10/2009. ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße Mainz Tel.: Fax:
 ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Instrucciones para el uso 10/2009 1/8 alegria-0910-04-e ÍNDICE DESCRIPCIÓN BREVE... 3 METODOLOGÍA... 3 INDICACIONES
ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Instrucciones para el uso 10/2009 1/8 alegria-0910-04-e ÍNDICE DESCRIPCIÓN BREVE... 3 METODOLOGÍA... 3 INDICACIONES
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO
 RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
FICHA DE DATOS DE SEGURIDAD (MSDS) KIT CLART STIs B
 1. Identificación de la sustancia y proveedor Nombre comercial CLART STIs B Referencias: Extracción y purificación 16 determinaciones Ref.: CS-1113-16 48 determinaciones Ref.: CS-1113-48 Amplificación
1. Identificación de la sustancia y proveedor Nombre comercial CLART STIs B Referencias: Extracción y purificación 16 determinaciones Ref.: CS-1113-16 48 determinaciones Ref.: CS-1113-48 Amplificación
pruebas Circulating Tumor Cell Control Kit
 7900003 24 pruebas Circulating Tumor Cell Control Kit 1 USO PREVISTO Para uso en diagnóstico in vitro. CELLSEARCH Circulating Tumor Cell Control Kit está pensado para su uso como ensayo de control, para
7900003 24 pruebas Circulating Tumor Cell Control Kit 1 USO PREVISTO Para uso en diagnóstico in vitro. CELLSEARCH Circulating Tumor Cell Control Kit está pensado para su uso como ensayo de control, para
INSTRUCCIONES DE REFERENCIA RÁPIDA Uso exclusivo con el Analizador Sofia.
 Analizador y FIA INSTRUCCIONES DE REFERENCIA RÁPIDA Uso exclusivo con el Analizador Sofia. Procedimiento de prueba Lea el Prospecto y el Manual del usuario detenidamente antes de usar las Instrucciones
Analizador y FIA INSTRUCCIONES DE REFERENCIA RÁPIDA Uso exclusivo con el Analizador Sofia. Procedimiento de prueba Lea el Prospecto y el Manual del usuario detenidamente antes de usar las Instrucciones
TEMA 14. Métodos inmunológicos para la identificación microbiana
 TEMA 14 Métodos inmunológicos para la identificación microbiana Tema 14. Métodos inmunológicos para la identificación microbiana 1. Introducción 2. Detección de antígenos 2.1. Obtención de anticuerpos
TEMA 14 Métodos inmunológicos para la identificación microbiana Tema 14. Métodos inmunológicos para la identificación microbiana 1. Introducción 2. Detección de antígenos 2.1. Obtención de anticuerpos
PD-L1 IHC 22C3 pharmdx está indicado como ayuda para la identificación de pacientes con NSCLC para recibir tratamiento con KEYTRUDA (pembrolizumab).
 PD-L1 IHC 22C3 pharmdx SK006 50 pruebas para uso con Autostainer Link 48 Uso previsto Para uso en diagnóstico in vitro. PD-L1 IHC 22C3 pharmdx es un ensayo inmunohistoquímico cualitativo que utiliza Monoclonal
PD-L1 IHC 22C3 pharmdx SK006 50 pruebas para uso con Autostainer Link 48 Uso previsto Para uso en diagnóstico in vitro. PD-L1 IHC 22C3 pharmdx es un ensayo inmunohistoquímico cualitativo que utiliza Monoclonal
PRÁCTICA NÚMERO 2 DETERMINACIÓN DE DENSIDAD: MÉTODO DEL PICNÓMETRO
 PRÁCTICA NÚMERO 2 DETERMINACIÓN DE DENSIDAD: MÉTODO DEL PICNÓMETRO I. Objetivo Haciendo uso del picnómetro: 1. Determinar la densidad absoluta del agua. 2. Determinar la variación de la densidad con la
PRÁCTICA NÚMERO 2 DETERMINACIÓN DE DENSIDAD: MÉTODO DEL PICNÓMETRO I. Objetivo Haciendo uso del picnómetro: 1. Determinar la densidad absoluta del agua. 2. Determinar la variación de la densidad con la
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 45608 Cadherin-17 0,1 R (SP183) 45609 Cadherin-17 1 R (SP183) 45632 Cadherin-17 RTU R (SP183) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo
Identificación del Producto N.º de ref. Descripción 45608 Cadherin-17 0,1 R (SP183) 45609 Cadherin-17 1 R (SP183) 45632 Cadherin-17 RTU R (SP183) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo
EL EQUIPO MULTIDISCIPLINAR XXVI CONGRESO DE LA SEAP/IAP PAPEL DEL PATOLOGO EN LOS TUMORES DEL APARATO DIGESTIVO BIOMARCADORES PREDICTIVOS
 XXVI CONGRESO DE LA SEAP/IAP PAPEL DEL PATOLOGO EN LOS TUMORES DEL APARATO DIGESTIVO ACTUALIZACION EN BIOMARCADORES Y GUIA DE RECOMENDACIONES EN TUMORES DEL APARATO DIGESTIVO # DIAGNOSTICO # APORTACION
XXVI CONGRESO DE LA SEAP/IAP PAPEL DEL PATOLOGO EN LOS TUMORES DEL APARATO DIGESTIVO ACTUALIZACION EN BIOMARCADORES Y GUIA DE RECOMENDACIONES EN TUMORES DEL APARATO DIGESTIVO # DIAGNOSTICO # APORTACION
Mantenimiento. Impresora a color Phaser 8400
 Mantenimiento Este tema incluye: "Carga de tinta en la página 4-20 "Vaciado de la bandeja de desechos en la página 4-23 "Sustitución del kit de mantenimiento en la página 4-25 "Limpieza de la Cuchilla
Mantenimiento Este tema incluye: "Carga de tinta en la página 4-20 "Vaciado de la bandeja de desechos en la página 4-23 "Sustitución del kit de mantenimiento en la página 4-25 "Limpieza de la Cuchilla
SOLDADURA PATERNIT FICHA DE DATOS DE SEGURIDAD. 1. Identificación del producto y de la empresa
 1. Identificación del producto y de la empresa Identificación del producto: Nombre comercial: Soldadura Paternit FABRICANTE: Industria Paternit SA DIRECCION: Carrera 17F 23-01 CIUDAD: Cali PAIS: Colombia
1. Identificación del producto y de la empresa Identificación del producto: Nombre comercial: Soldadura Paternit FABRICANTE: Industria Paternit SA DIRECCION: Carrera 17F 23-01 CIUDAD: Cali PAIS: Colombia
TRABAJO PRÁCTICO N 8 CINÉTICA QUÍMICA
 TRABAJO PRÁCTICO N 8 CINÉTICA QUÍMICA Objetivos de las experiencias: a. Determinar el orden de reacción de una sustancia en una reacción química. b. Observar y determinar la variación de la velocidad de
TRABAJO PRÁCTICO N 8 CINÉTICA QUÍMICA Objetivos de las experiencias: a. Determinar el orden de reacción de una sustancia en una reacción química. b. Observar y determinar la variación de la velocidad de
SSI IMMUVIEW LEGIONELLA BLOOD TEST ANÁLISIS DE SANGRE IMMUVIEW LEGIONELLA
 SSI IMMUVIEW LEGIONELLA BLOOD TEST ANÁLISIS DE SANGRE IMMUVIEW LEGIONELLA Aplicación El análisis de sangre ImmuView Legionella de Statens Serum Institute se ha creado para el diagnóstico de una infección
SSI IMMUVIEW LEGIONELLA BLOOD TEST ANÁLISIS DE SANGRE IMMUVIEW LEGIONELLA Aplicación El análisis de sangre ImmuView Legionella de Statens Serum Institute se ha creado para el diagnóstico de una infección
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
Adenovirus (20/11 & 2/6)
 Identificación del Producto N.º de ref. Descripción 45606 Adenovirus 0,1 M (20/11 & 2/6) 45607 Adenovirus 1 M (20/11 & 2/6) 45631 Adenovirus RTU M (20/11 & 2/6) Definiciones De Los Símbolos P C A E S DIL
Identificación del Producto N.º de ref. Descripción 45606 Adenovirus 0,1 M (20/11 & 2/6) 45607 Adenovirus 1 M (20/11 & 2/6) 45631 Adenovirus RTU M (20/11 & 2/6) Definiciones De Los Símbolos P C A E S DIL
Información de Producto
 GLOBAL REFINISH SYSTEM Enero 2008 Información de Producto ENVIROBASE Envirobase base color al agua T4xx Disolvente T494 Disolvente lento T495 PRODUCTOS Envirobase s una pintura de base bicacpa al agua
GLOBAL REFINISH SYSTEM Enero 2008 Información de Producto ENVIROBASE Envirobase base color al agua T4xx Disolvente T494 Disolvente lento T495 PRODUCTOS Envirobase s una pintura de base bicacpa al agua
Perla King, Rdo Manuel Caballero 10/11
 Perla King, Rdo Manuel Caballero 10/11 PCB EN EL SUELO (1 ó 10 ppm de agua) Método de Inmunoensayo Fase 1: Extracción del Suelo 1- Llenar el vial de extracción a la línea de 0.75-oz con solución de extractante
Perla King, Rdo Manuel Caballero 10/11 PCB EN EL SUELO (1 ó 10 ppm de agua) Método de Inmunoensayo Fase 1: Extracción del Suelo 1- Llenar el vial de extracción a la línea de 0.75-oz con solución de extractante
Albúmina 22 % I.- Introducción. II.- Características. III.- Presentación
 Albúmina 22 % I.- Introducción En 1945 Cameron y Diamond establecieron que ciertos sueros anti-d(anti-rh) podían aglutinar glóbulos rojos Rho positivos en presencia de albúmina de bovino pero no aglutinaban
Albúmina 22 % I.- Introducción En 1945 Cameron y Diamond establecieron que ciertos sueros anti-d(anti-rh) podían aglutinar glóbulos rojos Rho positivos en presencia de albúmina de bovino pero no aglutinaban
: Puede provocar quemazón e irritación. Puede presentarse trastornos a nivel de esófago, dolor abdominal, náuseas, vómitos. Levemente tóxico.
 MONTAFOL CALCIO BORO F Abono Foliar Hoja de Seguridad Fecha: 10/09/14 Versión : 01 Elaborado por: H. Landívar Aprobado por: F. Graos 1. IDENTIFICACIÓN DE LA SUSTANCIA Y LA COMPAÑIA Nombre del Producto
MONTAFOL CALCIO BORO F Abono Foliar Hoja de Seguridad Fecha: 10/09/14 Versión : 01 Elaborado por: H. Landívar Aprobado por: F. Graos 1. IDENTIFICACIÓN DE LA SUSTANCIA Y LA COMPAÑIA Nombre del Producto
