nutrientes moléculas sencillas Acetil Coa ciclo de Krebs metabolismo Obtener energía precursores biosintéticos biosíntesis de macromoléculas
|
|
|
- Josefina Giménez Olivera
- hace 8 años
- Vistas:
Transcripción
1 TEMA 1: METABOLISMO Todos los nutrientes (grasas, polisacáridos y proteínas) pasan por un proceso llamado digestión para convertirse en moléculas sencillas (ácidos grasos, azúcares y aminoácidos), que pasarán por otro proceso para convertirse en Acetil Coa, el cual entra en el ciclo de Krebs para conseguir energía (ATP). El metabolismo es la red de reacciones químicas que sirven para: Obtener energía a través de fuentes de energía como los nutrientes, la luz, etc. Conseguir que los nutrientes se transformen en precursores biosintéticos (aminoácidos, lípidos, glúcidos, etc). Conseguir la biosíntesis de macromoléculas. El metabolismo está compuesto por vías metabólicas, vías de síntesis químicas producidas por enzimas que aceleran el proceso de transformación de un compuesto en otro (pasando por compuestos intermedios). Estas vías metabólicas pueden ser generales para todas las células o específicas. Las vías metabólicas pueden ser vías catabólicas (partiendo de moléculas reducidas que se transforman en moléculas sencillas mediante oxidaciones, produciendo energía) o vías anabólicas (partiendo de precursores biosintéticos que se transforman en macromoléculas mediante reducciones, consumiendo energía. Las vías metabólicas (anabólica o catabólica) no se pueden regular fácilmente, pero tienen que serlo, así que para ello es necesario que algunas de las reacciones esté alejada del equilibrio:. Una reacción cercana al equilibrio tiene un incremento de la energía de Gibbs superior o igual a cero ( G 0), como la, sin embargo, una reacción lejana al equilibrio tiene una G << 0, lo que determina la direccionalidad de la vía metabólica (catabólica o anabólica). Cuando una célula necesita de sus compuestos imposibles (como B una vez llegado a D) se deben usar otros caminos que seguramente gastarán energía, otras reacciones diferentes catalizadas por otros enzimas diferentes. Para controlar artificialmente las vías metabólicas hay que tener una regulación de los enzimas que catalizan las reacciones lejanas al equilibrio y las reacciones de los otros caminos. La Km es la afinidad de la enzima por el sustrato. Para que el enzima sea el que regula la reacción (y no el sustrato), la concentración de sustrato debe ser muy superior a la Km; por lo tanto, es muy importante saber regular los enzimas.
2 Existen una infinidad de vías anabólicas y vías catabólicas. El ciclo de Krebs, es una vía amfibólica (anabólica y catabólica a la vez). Niveles de regulación: La cantidad de los catalizados (enzimas) se pueden controlar mediante la regulación de la transcripción del gen que codifica el enzima (mecanismo muy importante), mediante la regulación de la eficiencia de los ribosomas que traducen y sintetizan proteínas, y mediante la regulación de los degradadores (proteasas) de las proteínas. La actividad de los catalizadores (enzimas) se pueden controlar mediante la regulación de moléculas alostéricas que interaccionan físicamente con el enzima en el centro alostérico ( y no el centro activo) de forma covalente para aumentar o disminuir su actividad, mediante la regulación covalente reversible a base de fosforilaciones, y mediante la regulación de proteínas que interaccionan entre ellas para activarse o desactivarse. La disponibilidad de sustratos se puede controlar mediante los transportadores de sustratos necesarios de una vía metabólica (MAP). Estos métodos no son excluyentes, sino que suelen ser mecanismos complementarios en el tiempo y en el espacio. Por ejemplo, el control alostérico tiene muy poco radio de actuación, mientras que las modificaciones covalentes reversibles son procedimientos que permiten responder ante aquello que hay incluso fuera de la célula, ambos son procesos rápidos; la transcripción es un mecanismo lento. Así que estos tres mecanismos son complementarios. La carga energética de una célula es la suma de la energía disponible en forma de ATP y ADP, la cual oscila normalmente entre 0,8 y 0,9. Para que una célula sepa cuanta energía almacena y cuanta requiere se utilizan las concentraciones de ATP, ADP y AMP, que actúan como controladores alostéricos para los enzimas. Cuando hay mucha cantidad de ATP en el citoplasma, este actúa como inhibidor alostérico, evitando así que los enzimas pongan en marcha algunas vías metabólicas que produzcan energía; mientras que cuando hay mucha cantidad de AMP o ADP, estos actúan como activadores, provocando así que los enzimas pongan en marcha algunas vías metabólicas que produzcan energía.
3 TEMA 2: GLUCÓLISIS La glucólisis es el conjunto de vías metabólicas que convierten la glucosa en piruvato. La ciencia de la bioquímica nació con el descubrimiento de Buchner cuando machacó las células de la levadura y las reacciones enzimáticas que ellas producían se continuaban produciendo fuera de la célula gracias a las enzimas que transformaban la glucosa en piruvato o ácido pirúvico. La glucosa entra en las células a partir de la digestión, y sufre una serie de transformaciones dentro del citoplasma. La glucosa (anillo de 6C, piranosa) es transformada por la hexoquinasa, fosforilando el C6, obteniéndose Glucosa 6-P en una reacción lejana al equilibrio ( G=-4,0 Kcal/mol) que consigue que esta glucosa no pueda atravesar de nuevo la bicapa lipídica y escapar, debido a las cargas negativas. La glucosa 6-P es transformada por la fosfoglucosa isomerasa, isomerizándola estructuralmente, obteniéndose Fructosa 6-P (anillo de 5C, furanosa) en una reacción cercana al equilibrio ( G=0,4 Kcal/mol). La fructosa 6-P es transformada por la Fosfofructoquinasa-1, fosforilando el C1, obteniéndose Fructosa 1,6-bisfosfato en una reacción lejana al equilibrio ( G=-3,4 Kcal/mol). En esta primera fase se consumen 2 ATP. El anillo fructosa 1,6 P2 se abre y se cierra manteniéndose en equilibrio cuando está en forma de cadena, la aldolasa puede capturarlo y empezar la segunda fase de la glucólisis.
4 La fructosa 1,6-P2 en forma de cadena es transformada pro la aldolasa, disociando los C3-C4, obteniéndose dihidroxi acetona fosfato y gliceraldehido 3-fosfato (isómeros) en un equilibrio a favor de la dihidroxiacetona (90%) regulado por la triosafosfato isomerasa. La dihidroxi acetona fosfato se va consumiendo en el proceso; el gliceraldehido 3-P es transformado por la Gliceraldehido 3-P deshidrogenasa, fosforilando el C1 (que se oxida más), obteniéndose 1-3-bisfosfoglicerato en una reacción cercana al equilibrio ( G=1,5 Kcal/mol) en la que se ha reducido un NAD + (NADH) y en la que se ha formado un enlace fosfo-anhídrido de alta energía entre el C1 (que se oxida) y el Pi (fosforilación a nivel de sustratos). El 1,3-bisfosfoglicerato es transformado por la fosfoglicerato quinasa, desfosforilando el C1, obteniéndose 3-fosfoglicerato en una reacción lejana al equilibrio ( G=-4,5 Kcal/mol) en la que se obtiene ATP. El 3-fosfoglicerato es transformado por la fosfoglicerato mutasa, isomerizandolo (cambiando el P desde el C3 al C2), obteniéndose 2-fosfoglicerato en una reacción lejana al equilibrio ( G=-1,1 Kcal/mol) en la que se obtiene ATP. El 2-fosfoglicerato es transformado por la enolasa, deshidratándose (perdiendo un agua), obteniéndose fosfoenolpiruvato en una reacción cercana al equilibrio ( G=0,4 Kcal/mol). El fosfoenol piruvato es transformado por la piruvato quinasa, desfosforilando el C2, obteniéndose piruvato (ácido pirúvico) en una reacción en la que se forma un grupo cetona ( ) que es más estable ya que tiene resonancia y en la que se obtiene ATP. En la glucólisis no se obtiene gran energía, el piruvato es solo un poco más oxidado que la glucosa; se obtiene un NADH que será una futura fuente de energía cuando pase por la mitocondria, y se pierde un NAD + cuya regeneración es importante para el funcionamiento de la glucólisis. En resumen la reacción empírica resulta así: Glucosa + 2Pi + 2ADP+ 2 NAD + 2 piruvatos + 2ATP + 2NADH + 2H + + 2H 2 O El metabolismo de los otros sacáridos también se realiza por glucólisis finalmente, pero para ello, la célula ha de dirigir los diferentes sacáridos a un eje común al de la glucólisis de la glucosa. KIT KAT
5 El metabolismo de la fructosa: La fructosa pasa por un proceso distinto según sea captada por el hígado o por el tejido adiposo (adipocitos). En el hígado, la fructosa es transformada por la fructoquinasa fosforilando el C1, obteniéndose fructosa 1- P en una reacción lejana al equilibrio que consigue que esta fructosa no pueda escapar de allí y en la que se consume un ATP. La fructosa 1-P es transformada por la aldolasa, disociando los C3-C4, obteniéndose dihidroxi acetona fosfato y gliceraldehído. La dihidroxi acetona es transformada por la triosa fosfato isomerasa, obteniéndose Gliceraldehído 3-P en una reacción cercana al equilibrio ( G=+1,5 Kcal/mol); y el Gliceraldheído es transformado por la Triosa Quinasa, fosforilando el C3, obteniéndose Gliceraldheido 3-P que entrará en el ciclo normal de la glucólisis. Esto se da así, no porque en el hígado no hayan Hexoquinasas, sino porque esta fosforila varias hexosas pero no pueden con todas. Su afinidad por la glucosa es mayor que por la fructosa, no recibe Hexoquinasas y no queda fosforilada. En las células adiposas, la concentración de glucosa es inferior y no se produce esa gran competencia, por lo que la Hexoquinasa puede fosforilar también a la Fructosa. Metabolismo de la galactosa: La galactosa es un isómero de la glucosa, con un único centro asimétrico diferente, lo que las hace ser epímeros, estereoisómeros y enantiómeros a la vez. Al entrar en la célula, la Galactosa es transformada por la Galactoquinasa, fosforilando el C1, obteniéndose Galactosa 1-P en una reacción en la que se consume ATP. La Galactosa 1-P es transformada por la Galactosa 1-P uridil transferasa, añadiendo una molécula de UDP-Glucosa (originada a partir de una Glucosa 6-P), obteniéndose UDP-Galactosa y Glucosa 1-P, en una reacción de intercambio de moléculas (UDP-Glucosa y Galactosa 1-P intercambian su UDP y su 1-P respectivamente). La glucosa 1-P es transformada por la Fosfoglucomutasa (PGM), isomerizándolo (cambiando el P desde 1-P a 6-P), obteniéndose Glucosa 6-P que entrará en el ciclo normal de la glucólisis; y la UDP-Galactosa es transformada por la Epimerasa, isomerizándolo (cambiando la posición vertical del H y el OH del C4), obteniéndose UDP-Glucosa que regenerará el ciclo. Así, con una sola molécula de Glucosa 6-P que pueda convertirse en UDP-Glucosa, se empieza el ciclo inacabable mientras haya Galactosas que convertir en Glucosa 6-P.
6 Puntos de control de la Glucólisis: Hay 3 puntos sensibles para la el control de la glucólisis: 1). Glucosa (Hexoquinasa) Glucosa 6-P (fosforilación). Este punto es muy arriesgado ya que la Glucosa 6-P se utiliza para otros muchos procesos (como la fabricación de glucógeno), por lo que no es muy sólido y acertado bloquearlo. Aun así, la Hexoquinasa sufre un feedback (-) (contra más creas más te bloqueas), por lo que en concentraciones muy elevadas de Glucosa 6-P se disminuye la actividad. 2). Fructosa 6-P (Fosfofructoquinasa-1) Fructosa 1,6-P 2 (fosforilación). Este punto de control es el más importante, está controlado por moduladores alostéricos de la Fosfofructoquinsa-1 (PFK-1), es decir, ATP y Citrato que la inhiben, y AMP y Fructosa 2,6-P 2 que la activan. Sin embargo, la llave de control más importante de la PFK-1 es la concentración citosólica de Fructosa 2,6- P 2, que se forma a partir de Fructosa 6-P gracias a la PFK-2. El paso para formar Fructosa 2,6-P 2 no es una rama de la glucólisis utilizada como ruta metabólica, sino que se utiliza como una reacción reguladora. Cuando haya poca glucosa en el medio, las células del páncreas segregan mucho glucagón, éste se une a unos receptores que activan desde el exterior una serie de señales que ativan a la S/T Quinasa (PKA), la cual activa la acción de la FBPasa (Fosfatasa) y hace que la concentración de Frutosa 2,6-P 2 disminuya convirtiéndola en Fructosa 6-P, haciendo que el activador alostérico más potente de la PFK-1 no esté, provocando la desactivación de la glucólisis bloqueando la reacción de Fructosa 6-P a Fructosa 1,6-P 2 ; cuando hay exceso de glucosa y falta de glucagón, la PFK-2 se activa y hace que la Fructosa 6-P se convierta en Fructosa 2,6-P 2, haciendo que el activador alostérico de la PFK-1 esté, provocando la activación de la glucólisis. Por otro lado el ATP actúa como inhibidor alostérico, el comportamiento de la enzima PFK-1 actúa de diferente manera sobre el F 6-P según la cantidad de ATP que haya en el medio. Con poca concentración de ATP, la actividad de PFK-1 aumenta hasta casi llegar a la Vmáx sin haber demasiada cantidad de F 6-P; sin embargo, cuando la concentración de ATP es elevada, la PFK-1 casi ni interfiere con la F 6-P. 3). Fosfoenolpiruvato (PEP) (Piruvato quinasa) Piruvato (desfosforilación). Este punto no es un punto regulador real, ya que el único destino del PEP es trasformarse en Piruvato. La Piruvato Quinsa (PyrK) se regula mediante ATP, el cual actúa de nuevo como inhibidor alostérico, aunque no es el único, el aminoácido Alanina también actúa del mismo modo, sin embargo, la propia F 1,6-P2 actúa como activador alostérico para evitar su cúmulo en exceso en caso de que la reacción estuviera bloqueada. La PyrK también se encuentra
7 inhibida al ser fosforilada por la PKA (en células hepáticas), la cual inhibe la glucólisis en dos niveles como ya hemos visto (aquí y al activar la Fosfatasa de la Fructosa 2,6-P2), o por otra sustancia fosforilante (en células musculares). La concentración de Pyrk también está regulada por la expresión génica cuando es necesario debido a una dieta rica en azúcares. Cuando normalmente una célula tiene reservas de Piruvato y es necesario frenar la glucólisis aunque haya glucosa en exceso, el primer proceso que se bloquea es la reacción de Fructosa 6-P a Fructosa 1,6-P2, con lo que se acumulan Fructosa 6-P y Glucosa 6-P que se mantienen en equilibrio; la propia Glucosa 6-P actúa como inhibidor alostérico en la reacción Glucosa a Glucosa 6-P. Sin embargo, los hepatocitos no pueden permitirse esta detención de creación de Glucosa 6-P debido a que lo utilizan para otro tipo de reacción, la obtención de Glucógeno. La glucosa en sangre suele tener una concentración de 5 mm. Para solucionar su problema, los hepatocitos tienen un enzima propio llamado Glucoquinasa, cuya Km (afinidad) por la glucosa es de 5 mm (la Km de la Hexoquinasa es de 0,1 mm), por lo que cuando se acumula MUCHA glucosa en la célula (que no pasa a G 6-P por lo explicado anteriormente), la Glucoquinasa empieza a funcionar y no es inhibida por la G 6-P. Transporte y acumulación de glucosa: La glucosa siempre entra en la célula a favor de gradiente a través de las proteínas GLUT que se encuentran en la bicapa lipídica. Las GLUT 1 y GLUT 3 son unas proteínas ubicuas (están en todas las células) y tienen una Km = 1 mm, así que tienen mucha afinidad por la Glucosa y la dejan entrar muy bien; sin embargo, la GLUT 2 es una proteína expresada únicamente en células del hígado y páncreas, por lo que es especializada (no obicua), y tiene una Km = mm, por lo que solo dejará entrar Glucosa cuando se encuentre en casos de altísimas concentraciones, cuando entra Glucosa al hígado en grandes cantidades a través de la vena Porta. El páncreas secretará Glucagon o Insulina según la información que le aporten las GLUT 2. Utilizaciones del Piruvato: El Piruvato creado se utiliza de diferentes modos según el tipo de organismo que seas. En las levaduras el piruvato es transformado por la Piruvato descarboxilasa, descarboxilando el C1, obteniéndose Acetaldehído. El Acetaldehído es transformado por la Alcohol Deshidrogenasa, reduciendo rápidamente el C1 a alcohol, obteniéndose Etanol en una reacción en la que se ha oxidado un NADH ( NAD+), regenerándose el NAD + gastado muy anteriormente. En los animales, en condiciones anaerobias (cuando has consumido todo el oxigeno), el piruvato es transformado por la Lactato Deshidrogenasa, reduciendo la cetona del C2 a alcohol, obteniéndose Lactato o Ácido Láctico en una reacción en la que se ha oxidado un NADH ( NAD+), regenerándose el NAD + gastado muy anteriormente.
8 TEMA 3: CICLO DE KREBS La transformación más común debido a su indispensabilidad es a Acetil CoA, el cual será incorporado en el ciclo de Krebs. El equilibrio entre Piruvato y Acetil Coa solo es posible en plantas. El ciclo de Krebs es el paso más importante del metabolismo aerobio. El enzima que regula el proceso Piruvato Acetil CoA es la Piruvato Deshidrogenasa. La Piruvato Deshidrogenasa es un complejo multienzimático (E1, E2 y E3) que reside en la matriz mitocondrial (por lo que el Piruvato tendrá que entrar desde el citoplasma). El Piruvato es transformado por la Piruvato Deshidrogenasa (E1), descarboxilándolo, obteniéndose Hidroxietilo TPP que queda enganchado al grupo prostético del E1. El Hidroxietilo TPP es transformado por la Dihidrolipoil Transacetilasa (E2), oxidandolo y extrayéndolo del grupo prostético TPP y uniéndolo a su grupo prostético Lipoamida que es quien se reduce, obteniéndose Dihidrolipoamida acetil. El acetildihidrolipoamida es transformado por la E2, transfiriendo el grupo acetil a un grupo CoA, obteniendose Acetil CoA en una reacción en que la Lipoamida ha quedado reducida y no puede rehacer su función. La Lipoamida es transformada por la E3, reoxidándola a partir del FAD ( FADH2) que hay en su grupo prostético, obteniéndose E2 con Lipoamida oxidada de nuevo. La E3 se reoxida a partir de NAD + ( NADH) que hay en el medio.
9 El Hidroxietilo es transferido al Ácido Lipoico de la Lipoamida. KIT KAT Vitaminas: Las vitaminas que influyen en todo el proceso de la Piruvato Deshidrogenasa debido a que forman parte de los enzimas de esta reacción son: Ácido Pantoténico (componente del CoA), Tiamina (vitamina B1) con otras vitaminas B, Nicotinamida (componente del NAD) y Riboflavina (componente del FAD). Ciclo de Krebs: El ciclo de Krebs es un proceso en función general oxidativo. Todo empieza con el Acetil CoA que ha llegado a través de la glucólisis. El Acetil CoA es transformado por la Citrato Sintasa, incorporándolo sobre el Oxalacetato, obteniéndose Citrato en una reacción lejana al equilibrio a favor del citrato que libera CoA para su reutilización. El Citrato es transformado por la Aconitasa, transfiriendo el grupo Alcohol del C3 al C4, obteniéndose Isocitrato en una reacción doble en la que se ha deshidratado el Citrato (obteniéndose como producto intermedio el cis Aconitato) y luego se ha vuelto a hidratar. El Isocitrato es transformado por la Isocitrato deshidrogenasa, oxidándolo y descarboxilándolo (por este orden), obteniéndose α-cetoglutarato en una reacción en la que se reduce un NAD + ( NADH) y se pierde un CO 2. El α-cetoglutarato es transformado por la α-cetoglutaratodeshidrogenada (muy parecida a la Piruvato deshidrogenasa antes vista), oxidándolo y descarboxilándolo del mismo modo que se obtenía Acetil CoA a partir de Piruvato, obteniendóse Succinil CoA en una reacción en la que se reduce un NAD + ( NADH), se pierde un CO2 y se añade CoA. El Succinil CoA es transformado por la SuccinilCoA sintetasa obteniéndose Succinato en una reacción compleja donde se fosforila un GDP ( GTP) y se libera CoA para su reutilización. El Succinato es transfomado por la Succinato deshidrogenasa, oxidando sus C2 y C3, obteniéndose Fumarato en una reacción en la que se reduce un FAD ( FADH 2 ). El Fumarato es transformado por la Fumarasa, hidratando el doble enlace entre C2=C3, obteniéndose L- malato es transformado por la Malato deshidrogenasa, oxidándolo, obteniéndose Oxalacetato en una reacción en la que se reduce un NAD + ( NADH). Este oxalacetato reinicia el ciclo cuando un Acetil CoA se le une. En resumen, la reacción empírica resultaría así: Acetil CoA + 3NAD + + FAD + GDP + Pi +2H2O 2CO 2 + 3NADH + FADH 2 + GTP + 2H + El potencial energético provendrá de los 3 NADH, FADH y GTP.
10 Vías anabólicas: A pesar de que en conjunto el Ciclo de Krebs es una vía metabólica, hay algunos componentes que son punto de partida para vías anabólicas para formar compuestos más complejos; lo que convierte al Ciclo de Krebs en una vía anfibólica. Por ejemplo, el α-cetoglutarato se utiliza para la creación de aminoácidos y purinas, el Succinil CoA se utiliza para la creación de porfirinas (grupo hemo), el Fumarato se utiliza para aminoácidos y pirimidinas, el Oxalacetato se utiliza para glucosa y aminoácidos Como se puede prever, no se puede tirar de ellos gratuitamente para conseguir el sustrato de esas vías anabólicas porque dejaríamos el Ciclo de Krebs sin productos intermedios, sin las piezas de la máquina oxidativa, por lo que se tiene que proveer al ciclo con más compuestos de carbono que provienen de unas reacciones llamadas reacciones anapleróticas. Hay 2 reacciones anapleróticas: una que transforma el piruvato en oxalacetato y otra que transforma el fosfoenolpiruvato (PEP) en oxalacetato. En la primera reacción, el piruvato es transformado por la Piruvato carboxilasa y su cofactor Biotina, añadiendóle un carbono (grupo ácido carboxílico), obteniéndose oxalacetato en una reacción en la que colaboran CO 2, H2O y una molécula de ATP que se transforma en ADP, por lo que se consume energía; en la segunda reacción, el PEP es transformado por la Fosfoenolpiruvatocarboxiquinasa (PEPCK), desforforilándolo y añadiéndole un carbono (grupo ácido carboxílico), obteniéndose oxalacetato en una reacción equilibrada en la que colaboran CO2 y GDP, que se transforma en GTP, por lo que se crea energía. En resumen las dos reacciones quedan así: Pyr + CO 2 + H 2 O + ATP OAA + ADP + Pi + 2H + + 2e - + /// PEP + CO 2 + GDP OAA + GTP La suma de estas reacciones consigue lo imposible de la segunda fase de la glucólisis, obtener PEP a partir de Piruvato. Esta suma lo consigue en una reacción energéticamente desfavorable: Pyr (+ATP) OAA (+ADP), OAA (+GTP) PEP (+GDP) *4 Regulación del Ciclo de Krebs: La enzima que dirige la transformación del Piruvato del Piruvato a Acetil CoA, la piruvato deshidrogenasa, está regulada por la concentración de sus propios productos, el Acetil CoA inhibe los componentes E2 y el NADH inhibe los componentes E3; aunque también está regulada alostéricamente a la carga energética de la célula, el GTP la inhibe y el AMP la activa. Hay que recordar que en la reacción equilibrada GTP + ADP se obtiene ATP y GDP. También hay otras enzimas reguladas por diversas moléculas. La enzima que dirige la transformación del Oxalacetato a Citrato, la Citrato Sintasa, está regulada alostéricamente por el ADP que la activa y por el NADH y el ATP que la inhiben. La enzima que dirige la trasnfomación del Isocitrato a α-cetoglutarato, la Isocitrato deshidrogenasa, está regulada alostéricamente por el ADP y el Ca 2+ que activan y por el ATP que la inhibe. La enzima que dirige la transformación del α-cetoglutarato a Succinil CoA, la α- Cetoglutaratodeshidrogenasa, está regulada alostéricamente por la Ca 2+ que la activa y por el NADH y su propio producto que la inhiben.
11 TEMA 4: CADENA DE TRANSPORT ELECTRÓNIC & FOSFORILACIÓN OXIDATIVA Los NADH y FADH 2 obtenidos en los procesos vistos anteriormente (1NADH en la glucólisis, 3 NADH y un FADH 2 en el Ciclo de Krebs) se utilizan para transferir electrones, que servirán finalmente para obtener ATP. Esto es la fosforilación oxidativa. En la CTE, los 8e - obtenidos en el Ciclo de Krebs pasarán por la membrana mitocondrial interna donde se transfieren a 2 oxigenos, obteniéndose 4H 2 O y un gradiente de H + fuera de la membrana mitocondrial, que servirá para conseguir ATP. Las moléculas NADH y FADH 2 son muy favorables a dar e -, mientras que el oxigeno es muy favorable a recibirlos. Debido al diferencial redox este NADH y O 2, se obtiene la energía suficiente para hacer pagar los H + en contra gradiente. Una sustancia que tiende a dar electrones tiene un potencial redox negativo, una sustancia que tiende a recibirlos tiene un potencial redox positivo. Por ejemplo. En la reacción anaerobia Pyr Lactato, colabora un NAD + que se reduce a NADH. La reacción se puede dividir en dos: a) Pyr + 2H + +2e - lactato (- 0,19 voltios). b) NAD + + H + + 2e - NADH (inversa) (-0,32 voltios). La Eo de la reacción global se obtiene así: A B = - 0,17 v (0,32) = + 0,13 v. La relación entre la AGº y el potencial redox se obtiene mediante la fórmula: AG 0 = -nf E o, F=constante de Faraday=23,06 kcal/voltaje mol, donde n=número de electrónes y que son las Kcal que se liberan en una reacción redox cuando 1 mol de electrones 1 volt de energía.
12 Este valor de G o ( G o < 0) nos indica que es una reacción exergónica (término termodinámico, indica la dirección que seguirá la reacción), lo cual no significa que necesariamente tenga que ser una reacción espontánea (a la cual nos referimos cuando buscamos la G y no la G o ). Saliendo de ejemplos, veamos el proceso que realmente nos interesa, el que ocurre en la mitocondria ½ O 2 + NADH + H + H 2 O + NAD +. La reacción se puede dividir en dos: a) ½ O 2 + 2H + + 2e - H 2 O (E o =0,82 V). b) NAD + + H + + 2e - NADH (inversa) (E 0 =-0,32 V). Cada semireacción tiene un potencial redox específico (E 0 ), resultando ser el de la reacción final 0,82 (0,32) = 1,14 V. Aplicando la fórmula: AG 0 = -nf E o = -2 23,06 kcal/v mol 1,14V=-52,6 Kcal/mol. Esta es la energía que se libera en la reacción de liberación de electrones del NADH al O 2. Sabiendo que por cada ATP obtenido se consume 7 Kcal /mol, con esta energía conseguiríamos idealmente 7 ATP, pero debido a ciertos consumos, solo conseguimos 2,5 ATP por cada NADH que cede sus electrones al oxigeno. Los electrones del NADH no pasan directamente al oxigeno, sino que van saltando de un compuesto de mayor potencial redox a otro de menor potencial a través de la Cadena de Transporte Electrónico, realizado en la membrana interna del mitocondrio. Esta cadena está organizada por 3 complementos enzimáticos: NADH-Q oxireductasa, citocromo reductasa y citocromo C oxidasa. El NADH cede sus 2 electrones al FMN oxidado que forma parte de la NADH-Q reductasa, obteniéndose NAD + (oxidado) y FMNH 2 (reducido).
13 Dos complejos Fe-S (oxidados) adoptan los 2 electrones del FMNH 2 (reducido), obteniéndose 2 Fe-S (reducidos) y FMN (oxidado de nuevo). Los complejos Fe-S (reducido) ( clustera ) ceden sus 2 electrones a la Ubiquinona (coenzima Q10) (oxidada) que actúa como sustrato, obteniéndose Fe-S (oxidados de nuevo) y QH 2 (reducida) que es un producto. La Q es el único componente que no es una parte proteica o proteína; tiene una cadena hidrofóbica de 10 bloques (6 en plantas) de isoprenos que la permiten insertarse en la membrana mitocondrial. Sus 2 cetonas pasan a alcoholes cuando se reducen, por lo que la QH 2 se llama ubiquinol. Cuando es el FADH 2 el que tiene que oxidarse le pasa 2 electrones directamente a la Q, saltándose los dos pasos anteriores que son necesarios para conseguir la energía suficiente para bombear H +. El QH 2 cede uno de los electrones a un complejo Fe-S (oxidado), obteniéndose Fe-S (reducidos) y QH a medio oxidar. El hierro hemo del citocromo 1 (oxidado) adoptará el electrón del complejo Fe-S (reducido) obteniéndose un simple cambio redox. El C1 (reducido) cede el electrón al hierro del citocromo C (+3) (proteína con grupo hemo muy conservada evolutivamente), obteniéndose c1 (oxidado) y citocromo C (+2). El electrón que queda en la QH que no se puede pasar al C1 por falta de potencia, es cedido a otra QH en el mismo estado obteniéndose Q y QH2 en una reacción llamada dismutación debido a que el oxidante y el reductor son exactamente iguales.
14 El oxigeno atmosférico será reducido por 4H + obteniéndose 2 aguas en diversos pasos con productos intermedios peligrosamente reactivos y que puedan escaparse (O 2 - ). Para su completa transformación se necesitan 4e - que hay que sacar del citocromo C (+2). Los saltos electrónicos permiten la migración de H + desde la matriz al espacio intermembranoso, siendo energía potencial. El acumulo de H + es utilizado por la ATPsintasa. El H + entra a favor de gradiente desde el espacio intermembrana a la matriz porque hay una diferencia de 1,4 unidades de ph entre un lugar y el otro, o lo que es lo mismo, una concentración 20 veces menos de H + en la matriz (ph matriz > ph espacio). El potencial redox total de la CTE, si se parte de NADH, da suficiente energía como para bombear 6 H + aproximadamente. Antiguamente, para calcular la relación entre la CTE y la síntesis de ATP se utilizaba un cociente llamado P:O, que relacionaba el Pi y el O 2 consumidos en la CTE. La cantidad de Pi consumido corresponde a la cantidad de ATP sintetizado. Diferentes compuestos tienen diferentes cocientes P:O, el NADH de 3, el FADH de 2 y el ácido ascórbico da 1. A mayor P:O, mayor es el rendimiento de la CTE.
15 De estos inhibidores: rotenona y amital en el primer piso, Antimicina A en el segundo piso y CN -, N 2 - y CO en el tercero. Los que provocarían un peor efecto a la CTE serían las del primer piso, porque bloquean toda la cadena, impidiendo crear un mínimo de gradiente de H +. La ATP sintasa está formada por 2 partes principales de la subunidad F1 (α, β, γ, δ, ε) que es el componente catalítico para la síntesis de ATP, y la subunidad Fo que es el canal iónico de H +. Cuando la F1 y la Fo se separan in vitro la F1 cataliza la reacción opuesta, es decir, actúa como una ATPasa, desfosforilando y hidrolizando el ATP. Físicamente, las subunidades α-h giran alrededor de γ que actúa como eje de rotación. Según la posición, cada subunidad tiene unas propiedades físicas y químicas propias. A hacerlas girar por el paso de H +, su posición va rotando 120º. El cambio de posición hace que la afinidad por el ATP, el ADP y el Pi sea diferente. El proceso se conoce como fosforilación oxidativa.
16 El NADH que hay en el citosol también debe hacerse que transfiera sus 2 e - para formar ATP. Este NADH es el proveniente de la glucólisis. Hay 2 métodos para transferir sus 2 e- a la matriz mitocondrial. Lanzadera del glicerol fosfato. El NADH transfiere sus e - a la dihidroxi acetona, obteniéndose NAD + oxidado y glicerol 3-P reducido, gracias a la Glicerol 3-P deshidrogenasa citosólica. El glicerol 3-P cederá los al E-FAD N, obteniéndose de nuevo dihidroxiacetona y E-FADH 2, gracias a la acción la Glicerol 3-P deshidrogenasa mitocondrial, que se encuentra sumergida en la membrana mitocondrial. El E-FADH 2 se oxida de nuevo a E-FAD al dar sus e - a la ubiquinona que se reduce a ubiquinol, el cual ya puede integrarse en la CTE normal. Si las dos Glicerol 3-P deshidrogenasas fueran iguales, la reacción estaría a las leyes de equilibrio. Al ser diferentes pueden seguir la reacción aunque la concentración de NADH sea muy baja; el precio que se paga es que partiremos de FADH 2 en la CTE. Lanzadera malato-aspartato: Está reacción, en cambio, si está ligada a las leyes de equilibrio. En el citosol, un oxalacetato captará los electrones del NADH, obteniéndose malato y NAD +. Este malato podrá entrar en la matriz y en el Ciclo de Krebs, que lo hará pasar de nuevo a oxalacetato mientras un NAD + se reduce a NADH habiendo captado los electrones. El oxalacetato pasa a aspartato para salir otra vez al citosol. El grupo amino del glutamato pasará al oxalacetato, el cual pasará su cetoácido al glutamato, obteniéndose aspartato (con el grupo amino) y α-cetoglutarato (con el grupo cetoácido). Esta reacción es una transaminación.
17 Finalmente, una vez obtenido ATP, este debe ser transferido al citosol, pero para ello no puede atravesar la membrana mitocondrial por si solo al igual que el ADP que hay que transferir a la matriz mitocondrial. Por lo tanto el transporte de ADP a la matriz es un regulador de la fosforilación oxidativa. El sistema de transporte de ATP va unido al sistema de importación de ADP. La translocasa es una proteína de membrana con un centro activo con afinidad variable entre ATP y ADP, cuando el centro activo está de cara al citosol tienen afinidad por el ADP, que una vez unido provoca la translocación de la proteína, introduciendo el ADP en la matriz mitocondrial y provocando que el centro activo tenga afinidad por el ATP. Para que la translocasa sufra una eversión, es necesario la molécula ATP o ADP según la posición, es decir, el ATP no puede salir si la proteína no ha transportado antes un ADP y viceversa. La UCP-1 es una proteína de membrana que permite también, el paso de H + a favor de gradiente, compitiendo por ellos con la ATPsintasa, por lo que se considera una proteína desacopladora. El paso de H + por la termogenina genera calor. Esta proteína se expresa en los mitocondrios de los recién nacidos y de los animales que hibernan para mantener un mínimo calor corporal. Estas mitocondrias residen sobretodo en el tejido adiposo pardo. Resumen y síntesis final: Por cada mol de glucosa que entra en la glucólisis se obtienen 2ATP y 2NADH que actuarán como 2FADH 2 al provenir del exterior de la mitocondria, por cada Piruvato que pasa a Acetil CoA se obtienen 2NADH, y por cada Ciclo de Krebs (con 1 mol de glucosa como origen) se obtienen 6NADH, 2FADH 2 y 2GTP. En equivalencias, 1 NADH = 2,5 ATP, 1 FADH 2 = 1,5 ATP, 1GTP = 1 ATP; así, sumando todos los compuestos obtendremos 30 ATP, que consiguen un G o =219 Kcal/mol. Sin embargo, el proceso de Glucosa 6O 2 + 6CO 2 + 6H2O tienen un G o = -686Kcal/mol.
18 TEMA 5: GLUCONEOGÉNESIS La gluconeogénesis es el conjunto de vías anabólicas que sintetiza glucosa a partir de compuestos que no son carbohidratos (más sencillos). Mantener un nivel mínimo de glucemia en sangre es esencial para la vida animal, por lo que se debe poder crear glucosa cuando es necesario. Se puede formar glucosa a partir de piruvato, lactato, glicerol, aminoácidos y intermedios del Ciclo de Krebs; este conjunto de moléculas se denominan precursores gluconeogénicos. La glucogénesis necesita de enzimas adicionales que solo se encuentran en el hígado y en la corteza renal. Los rumiantes necesitan reconstruir mucha glucosa debido a que los enzimas de su estómago la destruyen formando ácidos grasos volátiles de cadena corta; es a partir de estos la fabricación de glucosa (sobre todo a partir del ácido propiónico). Los carnívoros sintetizan la glucosa a partir de los aminoácidos de la dieta, sobretodo. La vía metabólica de la glucogénesis es muy parecida a la vía de la glucólisis, los intermediarios son los mismos y comparten 7 enzimas que catalizan a ambas, sin embargo, la glucólisis tiene 3 enzimas que catalizan reacciones irreversibles por lo que la glucogénesis tendrá que usar enzimas y caminos propios que solo se encuentran en el hígado y en la corteza renal.
19 La primera reacción irreversible que encontramos es la fabricación de piruvato a partir de fosfoenol piruvato por lo que la reacción que interesa en la glucogénesis será diferente. El piruvato en el interior de la mitocondria es transformado por la piruvato carboxilasa, añadiendo un C, obteniéndose un ATP ( ADP+Pi). Este oxalacetato no puede salir de la mitocondria si no es transformado en malato, en una reacción catalizada por la Malato Deshidrogenasa mitocondrial en la que se oxida un NADH ( NAD + ). La cantidad elevada de NADH en el interior de la mitocondria favorece el sentido de la reacción. El malato en el exterior sufre la reacción inversa a la que acaba de sufrir, y se obtienen oxalacetato de nuevo. El oxalacetato es transformado por la Fosfoenol piruvato carboxiquinas, obteniéndose fosfoenolpiruvato en una reacción en la que se consume un GTP ( GDP+Pi) y se pierde un C. Este proceso total es muy caro para la célula, ya que se consumen 1 ATP y 1 GTP cuyos Pi se pierden por el citosol. Una vez obtenido el PEP, se transforma fácilmente en Fructosa 1-6 P 2 en unas reacciones de equilibrio si el PEP se encuentra en altas concentraciones, pasando por el 2 Fosfoglicerato 3 Fosfoglicerato 1,3- Bisfosfoglicerato Gliceraldehido 3-P Fructosa 1,6-P 2. Luego, la Fructosa 1,6-P 2 es transformada por la Fructosa 1,6-bisfosfatasa, desfosforilandola, obteniéndose Fructosa 6-P en una reacción en que se suelta el Pi y no se acopla a ninguna molécula de ADP ni GDP. Una vez obtenido el F6P, se transforma fácilmente en Glucosa 6-P en una reacción de equlilibrio que manda la concentración de F6P. Luego, la F6P es transformada por la Glucosa 6-fosfatasa, desfosforliándola, obteniéndose Glucosa en una reacción en que se suelta Pi que no se aprovecha inmediatamente. La Glucosa 6-P se almacena en el hígado, el cual es el único órgano que permite el paso de Glucosa y su futura expulsión. En el músculo esquelético no se da esta reacción, por lo tanto, solo se da la glucólisis. El balance energético de la gluconeogénesis resulta así: 2Pyr + 4ATP + 2GTP + 2NADH + 6H 2 O Glucosa + 4ADP + 2GDP + 6Pi + 2NAD + + 2H + Esta reacción podemos que nos cuesta 6 enlaces de alta energía por cada glucosa, por lo que no es una reacción rentable y no se utilizará la gluconeogénesis si no es necesario.
20 El glicerol se obtiene a partir de la hidrólisis de triglicéridos almacenados en los adipocitos, en la que se obtienen ácidos grasos y glicerol que irá a la sangre y será captado y almacenado en el citosol de las células hepáticas. El glicerol es transformado por la Glicerol quinasa, fosforilándolo, obteniéndose Glicerol P en una reacción en la que se consume ATP ( ADP). El glicerol P es transformado por la Glicerol fosfato deshidrogenasa, oxidándolo, obteniéndose Dihidroxiacetona P que es un intermedio de la glucogénesis, en una reacción en la que se reduce un NAD +. Cualquier molécula intermedia del Ciclo de Krebs es potencialmente material que puede dar Oxalacetato, y en consecuencia, Fosfoenolpiruvato y finalmente Glucosa. También hay muchos aminoácidos aprovechables (todos excepto la Leucina y la Lisina) para convertirse en intermedios del Ciclo de Krebs a partir de ciertas reacciones que puedan modificarlos (transaminaciones ). Por ejemplo: la Alanina puede pasar a Piruvato, el Aspartato puede pasar a Oxalacetato, y el Glutamato puede pasar a α-cetoglutarato a partir de una transaminación y una oxidación.
21 El lactato se forma en los músculos esqueléticos a partir del piruvato cuando la demanda de oxigeno de un músculo es mayor que la cantidad de oxigeno que puede aportar la sangre (agujetas). En los músculos, no sirven de nada, así que pasan a la sangre para llegar al hígado. En el hígado el lactato es transformado en piruvato, que podrá llegar a ser de nuevo glucosa la cual volverá al músculo mediante la circulación sanguínea. Este es el Ciclo de Cori. El paso del Piruvato a Lactato se produce en condiciones anaerobias, el piruvato se reduce mientras que un NADH se oxida ( NAD + ). La regulación de la glucólisis-gluconeogénesis se hace en dos etapas: 1) En la reacción, los niveles de Acetil CoA son los que controlan la actividad de la Piruvato deshidrogenasa, inhibiéndola cuando su producto se encuentra en elevadas concentraciones y se gasta poco porque por algún motivo no se puede introducir todo en el Ciclo de Krebs, posiblemente porque no haya oxalacetato disponible, por lo que actuará la síntesis de este el propio Acetil CoA. El glucagón provoca un aumento de PK-A el cual inhibirá la Piruvato Quinasa que no podrá terminar la glucolisis (el paso Fosfoenolpiruvato piruvato), y activará la Fructosa 2,6 Pasa y inhibirá la PFK-2, provocando la disminución de F2,6-P2, que dejará de activar la PFK-1, por lo que disminuirá la glucólisis, y dejará de inhibir la F1,6P2asa, por lo que aumentará la gluconeogénesis.
22 Los rumiantes sufren una predigestión de la glucosa por los microorganismos, los cuales obtienen básicamente ácidos grasos de cadena corta, de los cuales solo es aprovechable para la glucogénesis el propionato, también se forma lactato. El propionato es transformado en propionil CoA, consumiéndose pirofosfatos (ATP AMP). El propionil CoA sufre una carboxilación que da D-metilmalonil CoA, del cual se obtiene L-metilmalonil CoA, que se convierte finalmente en Succinil CoA que es un intermedio del Ciclo de Krebs. La metilmalonil CoA mutasa es uno de los pocos enzimas que usa vitamina B-12 como cofactor. TEMA 6 PENTOSAS FOSFATO La utilización oxidativa de la G-6P inicia la vía de la pentosa fosfato. Esta vía metabólica se utiliza para conseguir NADPH y/o pentosas-p, en general ribosa-5p. Esta vía se realiza en el citosol. (Los NADH y los NADPH tienen un potencial redox idéntico; solo se diferencian en un P que tiene el NADPH, que el permite ser usado para reducir moléculas de vías biosintéticas)
23 El NADPH se utiliza para muchísimas reacciones biosintéticas que necesitan de un reductor. Síntesis de ácidos grasos, colesterol, neurotransmisores y nucleótidos; y detoxificación. Los NADPH se sintetizan en la primera fase de la ruta de las pentosas fosfato, la fase oxidativa. La fase oxidativa que en resumen es así, Glucosa-6P + 2NADP + + 2H 2 O Ribosa-5P + 2NADPH + CO 2 + 2H + se completa en diferentes pasos: La G-6P es transformada por la Glucosa-6P deshidrogenasa, oxidando el C1, obteniéndose 6-fosfoglucono-δ-lactona en una reacción en la que se reduce un NADP + ( NADPH); el término lactona hace referencia al éster cíclico. La 6-fosfoglucono-δ-lactona es transformada por la Lactonasa, hidratándola, obteniéndose 6- fosfogluconato. El 6-fosfogluconato es transformado por la 6-P Gluconato deshidrogenasa, oxidándolo y descarboxilándolo, obteniéndose Ribulosa-5P en una reacción en la que se desprende un CO 2 y un NADP + se reduce (NADPH). La ribulosa-5p es transformada por la Fosfopentosa isomerasa, isomerizándolo, obteniéndose Ribosa-5P. Este proceso se regula por la Glucosa-6P deshidrogenasa que solo cataliza la reacción hacia el sentido de la ribulosa-5p, aunque actúa en función de la necesidad de NADPH, el cual inhibe la Glucosa-6P deshidrogenasa si está en altas concentraciones.
24 Las transcetolasas mueven bloques de 2C, mientras que la transaldolasa mueve bloques de 3C. Mientras la fase oxidativa es unidireccional, las reacciones de la fase no oxidativa se encuentran en equilibrio. Lo cual permite que sustratos intermedios de la glucólisi / gluconeogénesis, la Fructosa-6P y el Gliceralde hido-3p, puedan conseguir ser elementos de esta ruta. La fase no oxidativa se resumen así: 3 moléculas de 5C se transforman en 2 moléculas de 6C y una de 3C mediante reacciones no oxidativas. La ribulosa-5p (5C) también puede ser transformada por la Fosfopentosa epimerasa, isomerizándo la posición de un solo grupo de H-C-OH, obteniéndose Xilulosa-5P, un efímero, en una reacción en que cambia únicamente la dirección del carbono quiral. Luego, las xilulosas-5p y la ribosa-5p (procedente de la ribulosa-5p) son transformadas por la Transcetolasa, traspasando 2C, obteniéndose Gliceraldehido-3P y Sedoheptulosa-7P. Los gliceraldehido-3p y Sedoheptulosa-7P son transformados por la Transaldolasa, transfiriendo 3C, obteniéndose Fructosa-6P y Eritrosa-4P.
25 La fructosa-6p (6C) obtenida es uno de los 3 compuestos de carbono esperados. Luego, la eritrosa-4p recién obtenida y la xilulosa-5p procedente de una tercera ribulosa-5p, son transformadas por la Transcetolasa, traspasando 2C, obteniéndose fructosa-6p (6C) y gliceraldehido-3p (3C), los 2 compuestos de carbono esperados que faltaban para completar el ciclo. Todo este conjunto de reacciones no oxidativas se encuentran en equilibrio y son reversibles según sea la concentración citosólica de ribulosas y fructosas. Opción A) Mayor necesidad de ribosa que de NADPH: Se procude ribosa-5p a partir de glucosa-6p mediante la fase no oxidativa. La fructosa-6p y el gliceraldehido-3p se extraen de la glucólisis para reconstruir la ribosa-5p sin utilizar el poder oxidante de los NADP + que se convertirían en NADPH cuando no son necesarios. Opción B) Necesidad de ribosa y NADPH simultáneamente: Se produce ribosa-5p a partir de glucosa-6p mediante únicamente la fase oxidativa.
26 Opción C) Mayor necesidad de NADPH que de ribosa: Se produce NADPH a partir de glucosa-6p mediante la fase oxidativa; sin embargo, los residuos de ribosa-5p pasan a ser fructosa-6p y gliceraldehido-3p mediante la fase no oxidativa. El gliceraldehido-3p entra en la gluconeogénesis para recuperar la glucosa-6p. La repetición del ciclo oxida todos los carbonos a CO 2 fabricando solo NADPH. Opción D) Necesidad de NADPH y ATP: Se produce NADPH a partir de G-6P mediante la fase oxidativa; los residuos de ribosa-5p pasan a ser fructosa-6p y gliceraldehído mediante la fase no oxidativa. Éstos entrarán en la glucólisis para convertirse en piruvato obteniendo ATP. Ésta reacción se da en los adipositos, donde se fabrican ácidos grasos a partir de Acetol CoA, lo que necesita gran poder reductor. La glucosa-1p es transformada por una serie de enzimas, obteniéndose UDP glucosa, UDP glucorónico, ácido D-glucorónico, D-gulonato y finalmente ácido ascórbico. El ácido D-glucorónico es un componente muy importante en el metabolismo. Es precursor de algunas moléculas como la heparina, y actúa como detoxificador vía orina. Es un compuesto muy hidrófilo. Muchos animales tienen los enzimas necesarios para completar esta reacción, sin embardo, otros como los primates o las cobayas no disponen de la última, la Lactono-oxidasa, que crea el ácido ascórbico, por lo que éstos tendrán que incorporarlo a través de la dieta.
27 TEMA 7 METABOLISMO GLUCÓGENO La glucosa como tal no puede ser almacenada, así que forma una estructura especial de reserva: el glucógeno. Las glucosas que se van extrayendo del glucógeno salen en forma de G-1P que rápidamente pasan a G-6P. Ésta G-6P, en el hígado puede ser desfosforilada, obteniéndose Glucosa que pasará a la sangre; sin embargo, en el músculo no se da esta reacción, así que la G-6P debe entrar en la glucólisis para pasar a piruvato dentro del mismo músculo. Las glucosas lineales se unen mediante enlaces α-1,4, mientras que las glucosas de una ramificación se unen mediante enlaces α-1,6. La molécula tiene dos extremos, uno reductor con el aldehído libre, y otro no reductor donde el aldehído está ligado a otra glucosa. La degradación se empieza por el extremo no reductor, cuanto mas haya debido a ramificaciones, mas rápida será su degradación; las ramificaciones también aumentan la hidrosolubilidad. La degradación se hace mediante la enzima glucógeno fosforilasa. Empezando por el extremo no reductor, la enzima fosforiliza la glucosa de ese extremo y la separa del glucógeno. La reacción es reversible, pero in vivo, la dirección de la reacción tiende a la liberación de G-1P debido a la gran cantidad de Pi que hay en el citoplasma. La glucógeno fosforilasa utiliza la vitamina B-12 como cofactor.
28 La glucógeno fosforilasa va avanzando hasta que cerca de una ramificación, se detiene ya que no puede atacar los enlaces α-1,6. Para conseguir la coninuación de la degradación, actúa un enzima desramificante que actúa con actividad transferasa haciendo que los 3 residuos más lejanos de la ramificación se unan al extremo no reductor de la molécula lineal, y con actividad α-1,6-glucosidasa liberando la glucosa iniciadora de la ramificación. En el hígado encontramos dos tipos de fosforilasa, la fosforilasa b inactiva, y la fosforilasa a activa; la diferencia entre ellas es la fosforilación que tiene la fosforilasa a en la serina14, provocada por la fosforilasa quinasa. Sin embargo, la fosforilasa b puede activarse cuando hay alta concentración de AMP, y la fosforilasa a puede inhibirse cuando hay alta concentración de ATP y G-6P; estas activaciones y inhibiciones alostéricas se dan poco a menudo. Por lo tanto, la fosforilasa quinasa regula el proceso; sin embrago, ésta está regulada por la protein quinasa A (PKA) y por las concentraciones de Ca 2+. Entonces, la fosforilasa quinasa está regulada por la PKA y por las concentraciones de Ca 2+. La PKA la activa fosforilándola; el Ca 2+ la activa cuando se encuentra en altas concentraciones. La regulación por Ca 2+ se da por la estructura de la fosforilasa quinasa; está formada por cuatro repeticiones de cuatro subunidades: α, β (subunidad catalítica), γ, δ, de la cuales, la δ es una calmodulina, la cual tiene afinidad por el Ca 2+ que sale en altas concentraciones del retículo endoplasmático cuando es necesaria la contracción muscular. En definitiva, la activación de la Fosforilasa a es una cascada de reacciones (puntos de control) que tienen su inicio en una hormona, por lo que es un control hormonal. El receptor adrenérgico con 7 partes transmembrana, es sensible a la adrenalina (epinefrina); cuando hay altas concentraciones de adrenalina en el medio, mediante una proteína G, se activa la adenilato ciclasa que produce camp a partir de ATP; las altas concentraciones de camp interaccionarán con las subunidades reguladoras (represoras) de las Proteínas quinasa A (PKA) disociándolas de las subunidades catalizadoras, que provocarán la fosforilación y activación de las Fosforilasa quinasa (PK), las cuales como ya hemos dicho, fosforilarán la Fosforilasa B para obtener Fosforilasa A que podrá degradar el glucógeno y obtener glucosa.
29 La glucógeno sintasa une un UDP-glucosa al extremo no reductor de una cadena de glucógeno, obteniéndose un glucógeno con un residuo más y UDP. Para este simple proceso, debe haber una cadena de glucógeno preexistente. La glucogenina es la que se encarga de empezar una cadena de glucógeno desde 0: une un UDP-glucosa a su residuo de tirosina (propietario de un grupo OH) mediante un enlace α-1,4. A partir de aquí, añade glucosas a partir de UDP-glucosas en el residuo Tirosina, hasta llegar a cierta longitud de la cadena donde puede actuar la glucógeno sintasa. Así, cada glucógeno tiene un núcleo formado por la glucogenina. UDP-Glucosa-Tirosina + 5 Glucosas UDP-Glucosa-Tirosina-G-G-G-G-G UDP-Glucosa-Tirosina + G-G-G-G-G El enzima ramificante es la que se encarga de ramificar la molécula: a partir de una cadena preformada, arranca un conjunto de residuos y los enlaza a unos 8-10 residuos de distancia respecto al anterior inicio de una ramificación, mediante enlaces α-1,6. El coste de crear glucógeno sale barato para la célula. Se gasta un ATP cuando hay que fosforilar el UDP ( UTP) para que se enlace de nuevo a una glucosa, sin embargo, ahorramos el consumo de ATP cuando disociamos las glucosas-1p del glucñogeno porque no es actividad hidrolítica, sino que se añade un Pi del medio; además, ya sacamos las glucosas fosforilada y no necesitamos la accion de la glucosa fosfatasa. Regulación de la Glucógeno sintasa (y a la vez de la Glucógeno fosforilasa): Viendo el apartado anterior, podemos partir de la activación de la PKA por el aumento de concentración citosòlica de camp provocado por el control hormonal de Glucógeno o Adrenalina. La PKA va a iniciar 4 caminos distintos para conseguir un aumento de Glucosa: 1) La PKA activa, fosforila la Fosforilasa quinasa (inactiva), obteniéndose Fosforilasa quinasa (activa), en una reacción en la que se consume ATP ( ADP); la fosforilasa quinasa también puede ser activada por altas concentraciones de Ca 2+. La Fosforilasa quinasa (activa), fosforila la Glucógeno Fosforilasa b, obteniéndose Glucógeno Fosforilasa a, en una reacción en la que se cede el Pi; la Glucógeno fosforilasa también puede ser activada por altas concentraciones de AMP (excepto en el hígado que no es sensible a AMP, mientras que el músculo esquelético si lo es), mientras que altas concentraciones de G-6P y ATP la inhiben. Finalmente, la Glucógeno Fosforilasa a realizará la degradación de glucógeno. 2) La PKA activa, fosforila la Glucógeno sintasa (activa), obteniéndose Glucógeno sintasa (inactivo), en una reacción en la que la Glucógeno sintasa puede ser fosforilada en varios residuos; la Glucógeno sintasa (activa) también puede ser desactivada por otras quinasa, altas concentraciones de Ca 2+, GSK-3, mientras que altas concentraciones de G-6P la activan. Finalmente, la Glucógeno sintasa (inactiva) no podrá realizar la síntesis de glucógeno. Hasta aquí, hemos podido comprobar el mecanismo del control concertado, en el que la activación de la Glucógeno fosforilasa implica la desactivación de la Glucógeno sintasa. Por otra parte, existen unas Proteínas fosfatasas 1 (hay de varios tipos: 1, 2A, 2B, 2C, aunque las que actúan en el metabolismo del glucógeno solo son la 1 y la 2A) que pueden deshacer las fosforilaciones de la Glucógeno fosforilasa a (activa) y de la Glucógeno sintasa (inactiva) provocando la síntesis de glucógeno y la detención de la degradación de glucógeno, todo lo contrario a lo que está realizando la PKA.
30 3) Para evitar que ocurra lo explicado en este último párrafo cuando es necesaria glucosa en el citoplasma, la propia PKA activa. Fosforila el inhibidor 1 (inactivo), obteniéndose el inhibidor 1 (activo). El inhibidor 1 (activo), inactiva la Proteína fosfatasa 1 (activa), obteniéndose Proteína fosfatasa 1 (inactiva) que no podrá activar la Glucógeno sintasa ni desactivar la Fosforilasa a. Cuando sea el momento adecuado, la concentración de PKA disminuirá, por lo que la Proteína fosfatasa 1 podrá realizar su función, cuando llegue el momento. 4) Por otros lados, la PKA activa provocará el aumento de la gluconeogénesis del hígado y la disminución de glucólisis. TEMA 8 Y 9: METABOLISMO TRIGLICÉRIDOS Los ácidos grasos son moléculas muy reducidas, por lo que su oxidación libera mucha energía, y anhidras, no contienen agua. Están casi siempre formados por cadenas par de C. Estas cadenas pueden ser saturadas (sin enlaces dobles) o insaturadas (con uno o más enlaces dobles, generalmente cis). Las insaturaciones afectan las propiedades físicas, por ejemplo, disminuyen el puesto de fusión. Se almacenan en los adipocitos en forma de triglicéridos. Pueden almacenar hasta 6 veces la energía que almacena el glucógeno. Los ácidos grasos pueden actuar estructuralmente, como mensajeros secundarios o como hormonas.
31 Un ácido Ω3 o Ω6 da a entender que tiene un doble enlace en el C3 o el C6 empezando por el final de la cadena. Las enzimas que regulan el paso de triglicéridos a ácidos grasos son las lipasas. Por cada triglicérido que se hidroliza, se obtienen 3 ácidos grasos y un glicerol, el cual es fosforilado por la glicerol quinasa, obteniéndose L-glicerolfosfato, el cual es oxidado por la glicerol fosfato deshidrogenasa obteniéndose deshidroxiacetona-p que se intercalará en la glucólisis cuando se convierte en la Gliceraldheido-3P. Las lipasas se activan por adrenalina, glucagón La degradación de los ácidos grasos se realiza en la mitocondria, pero su poca hidrosolubilidad impide la entrada por difusión. Así, los ácidos grasos se transforman en Acetil CoA a través de esta reacción: R COO ATP CoA SH R COO S CoA AMP PP AcilCoA sintasa i pirofosfato Regulada por la acetil CoA sintasa; así es activado el ácido graso. Para que la proteína translocasa introduzca el ácido graso, el acetil CoA debe perder el CoA y unirse a una carnitina; unidos, podrán pasar al interior de la mitocondria como acil carnitina, la cual se restaurará en carnitina y acil CoA que entrará en el ciclo de β-oxidación. Activación y entrada de ácidos grasos: La reacción en la que la carnitina se une al acil CoA está regulada por el enzima Carnitina Acil Transferasa I (CAT I), enzima citosòlica que se encarga de disfrazar el ácido graso para que sea transferido a la mitocondria. Una vez dentro, la Carnitina Acil Transferasa II, enzima mitocondrial, se encarga de regular la reacción inversa, en la que se obtiene de nuevo Acil CoA y la carnitina se reutiliza. La β-oxidación es un proceso que oxida la posición β de los carbonos del acil CoA repetitivamente: El acil CoA es transformado por la Acil CoA deshidrogenasa, oxidándolo, obteniéndose Enoil CoA en una reacción en la que se reduce un FAD ( FADH 2 ) y se obtiene un doble enlace
32 El Acil CoA es transformado por la Acil CoA Deshidrogenasa, oxidando el carbono β, obteniéndose Enoil CoA en una reacción en la que se reduce un FAD ( FADH 2 ) y se obtiene un doble enlace. El Enoil CoA es transformado por la Enoil CoA Hidratasa, hidratándolo, obteniéndose L-3-hidroxiacil CoA en una reacción en la que se ha añadido un H 2 O y se obtiene un alcohol en la posición β. El L-3-hidroxiacil es transformado por la L-3-hidroxiacil CoA deshidrogenasa, oxidando el carbono β, obteniéndose 3-cetoacil CoA, en una reacción en la que se reduce un NAD ( NADH) y se obtiene un grupo cetona en la posición β. El 3-cetoacil CoA es transformado por la β-cetotiolasa disociándolo, obteniéndose Acetil CoA y un Acil CoA con 2 carbonos menos que el que empezó el ciclo, en una reacción en la que se añade un grupo CoA-SH. El Acil CoA vuelve a entrar al ciclo hasta que se consiguen oxidar todos los carbonos del ácido carboxílico. Se consiguen tantos Acetil CoA como parejas de carbono menos 1 haya en el ácido. Por ejemplo: del ácido palmítico (16 C) se obtienen 7 Acetil CoA, los cuales entrarán en el ciclo de Krebs. El balance energético del ciclo de la β oxidación mas el de los ciclos de Krebs a los que entran los acetil CoA resultaría así (con este ejemplo): Palmitil CoA + 7 FAD + 7 NAD + 7 CoA + 7 H 2 O 8 Acetil CoA + 7 FADH NADH + 7 H + El rendimiento energético que se obtiene es el siguiente: 8 Acetil CoA 10 ATP por cada Ciclo de Krebs = 80 ATP, 7 FADH ATP por cada FADH 2 = 10 5 ATP, 7 NADH 2 5 ATP por cada NADH = 17 5 ATP; la suma total es de 108 ATP, menos 2 ATP que se han utilizado en la adición de CoA en el ácido graso resultan 106 ATP como cantidad neta de ATP obtenido, un rendimiento realmente elevado. Con la entrada de ácidos grasos insaturados, nos encontramos con dos casos que resultan necesitar mecanismos especiales para su degradación: 1) Cuando encontramos una insaturación en un carbono impar (como el 9 ), la Enoil CoA hidratasa no lo reconoce como sustituto. Para ello, cuando se llega al doble enlace mal posicionado después de las β- oxidaciones necesarias (3 en el caso del Palamitoleil CoA cis 9 ), el cis- 3 -enoil CoA es transformado por la cis- 3 - enoil CoA isomerasa, cambiando la posición del doble enlace, obteniéndose trans- 2 -enoil CoA que puede seguir la β-oxidación. 2) Cuando encontramos una insaturación en un carbono par pero en posición cis, la Enoil CoA hidratasa sí lo reconoce como sustrato, pero origina un D-3-hidroxiacil CoA que no es reconocido por la L-3-hidroxiacil CoA deshidrogenasa. Para ello, el D-3-hidroxiacil CoA es transformado por la Epimerasa, epimerizándolo, obteniéndose C-3-hidroxiacil CoA que puede seguir la β-oxidación.
33 Degradación de ácidos grasos de cadena impar: La degradación de ácidos grasos de cadena impar produce al finalizar un ácido graso de 3 carbonos, el propionil CoA, el cual se puede transformar en Succinil y entrar al Ciclo de Krebs. Cuando se crean tantos Acetil CoA que no puedan ser fusionados al oxalacetato, se producen los cuerpos cetónicos. Síntesis y aprovechamiento de cuerpos cetónicos: Cuando se crean tantos Acetil CoA y no hay oxalacetatos suficientes (por falta de glucosa) con los que poderse fusionar, el hígado empaqueta Acetil CoA en forma de cuerpos cetónicos para distribuirlos a través de la sangre a los músculos, al cerebro para cubrir las necesidades energéticas. El proceso de creación incluye varios pasos: Dos acetil CoA son transformados por la Cetotiolasa, fusionándolos, obteniéndose Acetoacetil CoA en una reacción equilibrada en la que se pierde un CoA. El Acetoacetil CoA es transformado por la Hidroximetilglutaril CoA sintasa (HMGCoA sintasa), añadiéndole otro Acetil CoA, obteniéndose 3-hidroxi-3-metil-glutaril CoA, en una reacción equilibrada en la que se pierde otro CoA. El 3-hidroxi-3-metil-glutaril CoA es transformado por si mismo, expulsando un Acetil CoA, obteniéndose Acetoacetato, es decir, un cuerpo cetónico. Los cuerpos cetónicos, una vez creados y establecidos en órganos diana donde no hay tanta sobrecarga de Acetil CoA, tiene 3 caminos a seguir: Si hay alta concentración de NADH en el medio, el acetoacetato es reducido a D-3-hidroxibutarato; por otro lado, el acetoacetato se puede autodescarboxilar a acetona, la cual es muy volátil y se exhala por los pulmones (aliento a acetona), pero que sirve para movilizar moléculas de acetil CoA cuando las células no pueden alimentarse de azúcares; finalmente, el Acetoacetato puede ser transformado por la CoA transferasa, añadiéndole un CoA a partir de un succinil CoA ( Succinato), obteniéndose Acetoacetil CoA, el cual puede ser nuevamente transformado por la tiolasa, añadiéndole un CoA y disociándolo, obteniéndose dos Acetil CoA. La síntesis de ácidos grasos se produce de la manera inversa a su degradación, por la adición de bloques de 2 carbonos hasta conseguir una cadena de máximo 16 carbonos. Esta síntesis se realiza en el citosol, gracias a un complejo multienzimático llamado ácido graso sintasa. Para distinguir los ácidos grasos que se han de sintetizar de los que hay que degradar, se cambia el CoA por ACP, marcación destinada a la síntesis. El dador de bloques de 2 carbonos es el malonil-coa, y no el acetil CoA el Acetil CoA destinado se transforma en malonil CoA mediante una croboxilación regulada por la acetil CoA carboxilasa. Reacción de la acetil CoA carboxilasa: CH 3 -CO-S-CoA + ATP + CO 3 H - (acetil CoA carboxilasa) COO - -CH 2 -CO-S-CoA + ADP + Pi
34 Tanto el acetil ACP, obtenido por la reacción de la acetil transacilasa, como el malonil ACP, obtenido por la reacción de la Acetil CoA carboxilasa y la malonil transacilasa, son los precursores de los ácidos grasos. Síntesis de ácidos grasos: El acetil ACP y el malonil ACP son transformados por la β-cetoacil sintasa, fusionándolos, descarboxilándolos y quitando un grupo ACP, obteniéndose acetoacetil ACP, en una reacción en la que hemos añadido un bloque de 2 C al acetil ACP. El acetoacil ACP es trasformado por la β-cetoacil ACP reductasa, reduciendo el C β, obteniéndose D-3-hidroxi butiril ACP, en una reacción en la que se oxida un NADPH ( NADP + ). El D-3-hidroxi butiril ACP es transformado poa la 3-hidroxi acil ACP deshidratasa, deshidratándolo, obteniéndose Crotonil ACP, en una reacción en la que se pierde un H 2 O y se consigue un doble enlace en el C β. El crotonil ACP es transformado por la enoil ACP reductasa, reduciéndo el C β de nuevo, obteniéndose butiril ACP, en una reacción en la que se oxida un NADPH ( NADP + ). El butiril es el fin de la primera vuelta del ciclo; este ciclo se repetirá varias veces, añadiendo carbonos de 2 en 2 al ácido, hasta llegar como mucho al palmitoil ACP de 16 C, el cual será transformado por la tioesterasa, hidratándolo y separando el grupo ACP, obteniéndose palmitato que se liberará finalmente de la acido graso sintasa. Para conseguir el palmitato, son necesarios 8 acetil CoA, 7 de los cuales se agregan en forma de malonil CoA conseguidos por esta reacción: 7 acetil CoA + 7 ATP + 7 CO 2 7 malonil CoA + 7 ADP + 7 Pi + 7 H + ; luego, esos 7 malonil CoA y el acetil CoA (precursores de los ácidos grasos) se unen mediante esta reacción: Acetil CoA + 7 malonil CoA + 14 NADPH + 7 H + Palmitato + 7 CO NADP CoA + 6 H 2 O (7 H 2 O menos una que se utiliza en la separación del ACP mediante la tioesterasa). Podemos observar pues, que almacenar una molécula de palmitato como ácido graso nos cuesta mucho poder reductor (NADPH) y mucho Acetil CoA. Al darse esta reacción en un amplio lugar, el citoplasma, es necesario que los compuestos intermedios no sean libres, por ello, todas las reacciones se dan en el complejo multienzimático, y no se libera el producto hasta no haber acabado completamente. Para conseguir tanto Acetil CoA Acetil CoA y NADPH en el citosol, se utiliza el citrato que excede en la mitocondria, y se exporta el Acetil CoA y el NADPH desde la mitocondria. El citrato es transformado por la citratoliasa, añadiéndole CoA, obteniéndose Acetil CoA y oxalacetato en una reacción en la que se consume ATP. El oxalacetato es transformado por la malato deshidrogenasa, reduciéndolo, obteniéndose malato en una reacción en la que se oxida NADH. El malato es transformado por el enzima málico dep. NADP +, descarboxilandolo y oxidándolo, obteniéndose piruvato en una reacción en la que se reduce un NADP + ( NADPH). El piruvato entra en el mitocondrio y vuelve a transformarse en citrato. En 8 ciclos hemos obtenido los 8 acetil CoA esenciales, sin embargo, faltan 6 NADPH de los 14 necesarios, por lo que se obtienen a través del ciclo pentosas fosfato (fase oxidativa). Una vez formado el palmitato, la elongación de la cadena se realiza en relación con el retículo endoplasmático, aunque el método es similar, se añaden bloques de 2 carbonos.
35 La generación de dobles enlaces (insaturación) se cataliza por una cadena de transporte de electrones que provienen de un NADH y de un oxigeno (dos electrones por cada molécula) que se transmiten al ácido graso saturado, el cual se oxida a ácidos grasos insaturados que han de ser incorporados por la dieta, ya que son exenciales para el funcionamiento del organismo. Regulación del metabolismo de ácidos grasos: Para la degradación de los ácidos, el control inicial está a nivel de las lipasas que movilizan los triglicéridos y que se regulan por niveles de camp, cuya concentración aumenta en presencia de la hormona glucagón. El segundo control se realiza en la entrada en la mitocondria, es decir, el paso de carnitina + acil CoA a acil carnitina catalizado por la CAT I, la cual responde al nivel citosólico de malonil CoA, que la inhibe en elevadas concentraciones porque el malonil CoA es (casi) exclusivo para la síntesis de ácidos, y no para su degradación. El tercer control se realiza a nivel de la β oxidación a través de la concentración de NADH (producto de la oxidación), el cual inhibe en altas concentraciones las deshidrogenasas para que dejen de reducir más NAD + y conseguir aún mas NADH. Para la síntesis de los ácidos, se controla fundamentalmente el paso de la acetil CoA carboxilasa (acetil CoA malonil CoA), que es inhibida por el palmitoil CoA si se encuentra en muy altas concentraciones, lo que significa que no hacer falta sintetizar más (además se inhibe por la presencia de glucagón, epinefrina ). El segundo control se realiza a nivel también de la acetil CoA carboxilasa, la cual es activada por el citrato citosólico (además de insulina ), el cual proviene del excedente mitocondrial que se produce cuando hay mucho acetil CoA y oxalacetato, por lo que conviene disminuir los niveles de Acetil CoA, transformándolos en malonil CoA; el citrato, a la vez inhibe la glucólisis, ya que cuando se produce la síntesis de ácidos grasos es porque hay carbohidratos y energía suficiente, por lo que no hace falta degradar glucosa en esos momentos.
36 TEMA 10: ESTEROIDES
37 Dos acetil-coa son transformados por la Acetil CoA transferasa, condensándolas, obteniéndose Acetil- CoA en una reacción en la que se pierde un grupo SH-CoA. El Acetil-CoA es transformado por la HMG-CoA sintasa, condensándolo con otro Acetil CoA, obteniéndose 3-hidroxi-3-metil Glutamil CoA en una reacción enla que se libera otro grupo SH-CoA. El HMG-CoA es transformado por la HMG-CoA reductasa, reduciéndolo doblemente, obteniéndose mevalonato en una reacción en la que se libera el último grupo SH-CoA y se oxidan dos NADPH ( NADP + ). El mevalonato es transformado por la quinasa, fosforilándola hasta tres veces, obteniéndose 3-fosfo-5- pirofosfomevalonato en tres reacciones en las que se consume ATP y se obtiene Fosfomevalonato y pirofosfato mevalonato como compuestos intermedios. El Fosfopirofosfomevalonato es transformado espontáneamente, descarboxilándose y desfosforilándose, obteniéndose isopentenil pirofosfato. El isopentenil pirofosfato es transformado por la isomerasa isomerizándolo, obteniéndose dimetilalil pirofosfato. Ambos isómeros son precursores activados del colesterol ya que están altamente activados. Ambos isómeros dimetilalil pirofosfato y isopentenil pirofosfato son transformados por la prenil transferasa, condensándolos (cabeza cola), obteniéndose Geranil pirofosfato en una reacción en la que se pierde un PPi. El Geranil pirofosfato es transformado por otra prenil transferasa, uniéndole otro isoprenil pirofosfato de igual forma que antes, obteniéndose Farnesil pirofosfato en una reacción en la que se libera un PPi. En
38 animales, este compuesto seguirá la ruta de síntesis de colesterol; en cambio en plantas seguirá la ruta de síntesis de carotenos. Dos Farnesil pirofosfato son transformados por la Escualeno sintasa, condensándolos (cabeza cabeza) y reduciéndolos, obteniéndose Escualeno en una reacción en la que un NADPH es oxidado ( NADP + ) y se liberan 2 PPi. Esta reacción es propio de organismo eucariotas no de plantas. El escualeno es el precursor inmediato de la molécula de 4 anillos. El escualeno es transformado por la escualeno monoxigenasa, reduciéndolo, obteniéndose Epóxido de escualeno, en una reacción en la que se oxida un NADPH ( NADP + ). Su grupo epóxido produce una tensión intrínseca elevada, la cual tiende a romperse formando un alcohol y provocando entonces la aparición de un carbocatión tras otro que se van corrigiendo con la formación de enlaces simples extraidos de los electrones de undoble enlace adyacente. Este efecto dominó llega a formar el Lanosterol, una molécula con el esqueleto de cuatro anillos del colesterol.
39 El Lanosterol es transformado por múltiples enzimas del R.E, reduciéndolo, oxidándolo, descarboxilándolo e isomerizándolo, obteniéndose colesterol en 19 reacciones. Para introducir tanto colesterol como intermediarios al RE, debido a su gran insolubilidad, deben ser transportados por proteínas especiales, las Sterol Carrier Proteins.
40 El Farnesil pirofosfato (C15) es transformado por la Prenil transferasa, uniéndole otro isoprenil pirofosfato, obteniéndose Geranil Geranil Pirofosfato (C20). Dos Geranil Geranil Pirofosfato son transformados, condensándose (cabeza cabeza), obteniéndose fitoeno (C40). El Fitoeno es transformado, oxidándose múltiples veces, obteniéndose Licopeno. El Licopeno es transformado, ciclando sus extremos, obteniéndose β-caroteno, precursor de la vitamina A.
41 Los ácidos biliares actúan como jabones que disuelven lípidos, solubilizándolos en soluciones acuosas. Se sintetizar en el hígado y se almacenan en la vesícula biliar. Los pregestágenos son los precursores de los glucocorticoides (cortisol), de los Mineralocorticoides (aldosterona) y de los andrógenos (hormonas sexuales masculinas); de los andrógenos derivan los estrógenos (hormonas sexuales femeninas). Las hormonas esteroideas son hidrofóbicas y liposolubles, por lo que pueden penetrar la membrana plasmática sin necesidad de receptores. Una vez dentro, la hormona se une a una proteína transportadora citosólica que la arrastra dentro del núcleo; el complejo puede reconocer promotores de genes diana para esa hormona y engancharse a la cadena de DNA para gobernar la expresión de los genes.
42 La regulación de los niveles de colesterol se realiza sobre muchos puntos diferentes relacionados con la actividad de la HMG-CoA reductasa (HMG-CoA Mevalonato). La HMG-CoA reductasa es inhibida alostéricamente por sus productos finales por feed-back (-). También es inhibida por la fosforilación de la AMPK, que actúa cuando hay glucagón. Genéticamente, el propio colesterol inhibe la expresión de los genes de la HMG-CoA reductasa, al igual que el mevalonato y derivados. Por otra parte, estos mismos favorecen la degradación de la enzima, uniéndose una ubiquitina.
43
44 TEMA 11: LIPOPROTEÍNAS El tráfico de moléculas lipídicas se hace por medio de la asociación de los lípidos con las proteínas, lo que los permite distribuir por la sangre y la linfa. La corteza de las LP (colesterol libre + fosfolípidos + apoproteína) en anfifílica, y el interior (ester de colesterol) es hidrofóbico. Según la densidad, las LP se pueden clasificar en quilomicrones (relación 99:1, bajísima densidad), VLDL (relación 90:10, baja densidad), IDL (relación 85:10, media densidad), LDL (relación 80:20, alta densidad) y HDL (relación 50:50, altísima densidad). A mayor densidad, más proteínas. Mientras las VLDL, IDL y LDL van distribuyendo triglicéridos, mantienen el colesterol, por lo que el LDL se queda con esos residuos que serán llevados al hígado de nuevo.
45 Provoca la maduración de los HDL transformando su colesterol (polar) en ester de colesterol (apolar). La lecitina es transformada por la LCAT sustituyendo la cadena 2 del glicerol por un OH, obteniéndose Lisolecitina en una reacción en la que el colesterol ha donado ese OH y ha realizado un enlace ester con la cadena 2 del glicerol, obteniéndose un ester de colesterol. Esterifica el colesterol de la dieta en el interior de las células de la mucosa intestinal.
46
47 TEMA 12: LÍPIDOS COMPLEJOS
48 El L-Glicerol 3-P es transformado por dos Acil Transferasas, transfiriéndole dos ácidos carboxílicos, obteniéndose Ácido Fosfatidico en dos reacciones en las que se liberan 2 CoA-SH. El ácido fosfatídico puede ser transformado por la fosfatidato fosfatasa, desfosforilándolo, obteniéndose un diacilglicérido, el cual puede ser transformado, transfiriendo otro ácido carboxílico obteniéndose un triácilglicerido. Esta reacción se produce en el hígado.
49 Para activar el fosfoglicérido hay que actuar sobre dos posibles opciones: 1) Activar mediante CDP el OH de C3 del diacilglicerol obteniéndose CDP-diacilglicerol, el cual puede recibir el grupo polar, obteniéndose el fosfoglicérido. 2) o activar mediante CDP el OH del grupo polar, el cual puede transformarse al diacilglicerol, obteniéndose el fosfoglicérido. La segunda opción solo ocurre en procariotas. Para transferir la etanolamina ha tenido que ser activada por la CTP ( CDP Etanoamina), obteniéndose Fosfatidiletanolamina.
50 La fosfatidiletanolamina es 3 veces carboxilada en el grupo N, obteniéndose Lecitina. El SAM (S-adenosil metionina) es el donador de grupos metilo. Para renovar los SAM se utiliza metionina, que se integra a través de la dieta (esencial). También se puede obtener fosfotidilcolina a través de colina libre de la misma forma que se integró la etanolamina. El ácido fosfatídico es activado, obteniéndose CDP-diacilglicerol, el cual es transformado por la PS sintasa, transfiriéndole la serina, obteniéndose Fosfatidilserina. Los mamíferos tienen otra opción, en la que intercambian el grupo etanolamina de la Fosfotidil etanolamina por la serina, obteniéndose fosfatidilserina.
51 El CDP-diacilglicerol es transformado por la PI sintasa, transfiriéndole el inositol, obteniéndose fosfatidil inositol. Tanto el DAG como el Inositol 1,4,5 P3 son moléculas con actividad biológica. Las fosfolipasas son las enzimas que degradan los fosfolípidos. De ellas hay muchos tipos en función del enlace que hidrolizan. La PLC es la que interviene en el Ciclo de recambio de fosfatidil inositol, está regulada por hormonas.
52 Lípidos que derivan de la esfingosina. Tanto la degradación de fosfolípidos como esfingolípidos se produce gracias a las fosfolipasas en los lisosomas.
53 El ácido araquidónico procedente de los esfingolípidos puede transformarse en hormonas paracrinas como las prostaglandinas, los leucotrienos
54 TEMA 13: DEGRADACIÓN DE AMINOÁCIOS Los aminoácidos, aparte de utilizarse para la creación de proteínas, pueden utilizarse para generar compuestos carbonados utilizables para obtener energía; sin embargo, al contario de las glucosas y los lípidos, no son almacenables, y solo puede degradar aminoácidos almacenados de proteínas del músculo esquelético en caso de urgencia. Para su degradación, es exclusivamente necesario eliminar el grupo amino, si no, no se podrá degradar. Sin embargo, la eliminación del grupo amino no se puede tomar a la ligera, ya que en forma de amoníaco es tóxico (desequilibra la homeostasis). La desaminación del aminoácido tiene varios caminos. La transaminación con transferencia a glutamato o alanina es un sistema muy común. El AA es transformado por la glutamato transferasa, eliminándole el grupo amonio, obteniéndose el α- cetoácido en una reacción en la que el grupo amonio ha sido transformado al α-cetoglutarato ( glutamato). Con la Alanina transaminasa ocurre lo mismo, pero el grupo amonio se transfiere a un piruvato ( alanina). El carbono al que se le arranca el grupo NH3 sufre una oxidación.
55 La transaminación por la reacción de la glutamato deshidrogenasa pretende liberar el grupo amonio en forma de NH 4 -, recuperando el α-cetoglutarato, por lo que es una reacción de regeneración. El glutamato obtenido en la reacción anterior (transferencia de glutamato) es oxidado e hidratado, obteniéndose α-cetoglutarato de nuevo, en una reacción en la que se ha reducido un NAD + o NADPH + ( NADH o NADPH). El NH 4 - entrará en el ciclo de la urea. La otra desaminación directa, mediada por deshidratasas utiliza únicamente la serina y la Threonina. La serina (por ejemplo) es transformada por la Deshidratasa, deshidratándola y oxidándola, y rehidratándola de nuevo desaminándola, obteniéndose piruvato. La misma reacción con la Threonina se obtendría α-cetobutirato. Hay otra desaminación por oxidaciones directas.
56 Otra desaminación por el ciclo de los purinonucleótidos, utilizado para la desamaniación de varios aminoácidos. El AMP, requerido para el ciclo, libera el grupo NH3 de su anillo, obteniéndose Inosina Monofosfato, el cual, se une a un aspártico que acaba de adueñarse del grupo amino de un aminoácido cualquiera, habiéndolo convertido en α-cetoácido gracias a la acción de la Aspartato transaminasa. La unión de la IMP con el aspártico requiere GTP ( GDP + Pi), obteniéndose adenil succinato que será disociado, obteniéndose AMP que entra de nuevo en el ciclo, y fumarato que se convertirá en malato y posteriormente en oxalacetato listo para arrebatarle el grupo amino a cualquier aminoácido. Los grupos NH 4 + extraídos de los aminoácidos son moléculas peligrosas que deberán ser neutralizadas y expulsadas del organismo. Para ello, los mamíferos (uricotélicos) crean urea, los reptiles y las aves (uricotélicos) crean ácido úrico, y los peces (amoniotélicos) utilizan el amoníaco. La urea creada por los mamíferos es obtenida en el ciclo de la urea, en el cual, por cada vuelta se liminan dos amonios, la urea es muy nitrogenada, pero no es tóxica y se disuelve muy fácilmente en agua. En el mitocondrio, un NH 4 - es transformado por la Carbamoil fosfato sintetasa, que utiliza CO 2, H2O y 2 ATP, obteniéndose carbamoil-p en una reacción en la que se consumen 2 ATP ( 2ADP) para asegurar la eliminación del NH 4 - por poco que haya. El carbamoil-p es transformado por la Ornitina transcarbamilasa, uniéndole una Ornitina entrada en el mitocondrio, obteniéndose citrulina. La citrolina saldrá entonces al citosol. Reacciones del ciclo de la urea (en el citosol): En el citosol, la Citrulina es transformada por la Argininsuccinato sintetasa, uniéndole un Aspartato (con el segundo grupo amino que entra en el ciclo), obteniéndose Arginino succinato, en una reacción cara en la que se consumen dos enlaces de alta energía de un ATP ( AMP + PPi). El Arginino succinato es transformado por la Arginin succinasa, separando de nuevo el Aspartato, obteniéndose Arginina en una reacción en la que el Aspartato ha sido disociado sin el grupo amino que traía consigo anteriormente, por lo que es considerado Fumarato. La Arginina es transformada por la Arginasa, rompiéndola, obteniéndose Ornitina en una reacción en la que se ha separando la urea que contenía la Arginina en el extremo. La Ornitina cerrará el círculo cuando de nuevo entre en la mitocondria para unirse al Carbamoil-P.
57 Todo el ciclo se produce en el citosol y en las mitocondrias de las células hepáticas, aunque también se lleva a cabo (en menor proporción) en el riñón. Los carnívoros, debido al gran uso que hacen de los aminoácidos como fuente energética, tienen un ciclo de la urea muy veloz. Todos los intermedios de los ciclos son necesarios para el éxito del mismo. Uno de los intermedios mas integrados desde la dieta es la Arginina, por lo que sobretodo en carnívoros es imprescindible una dieta rica en Arginina, para así no detener la importante actividad del Ciclo de la Urea. En cada vuelta del ciclo se consumen 3 ATP. El fumarato obtenido en el ciclo de la Urea, al separarse del Arginino Succinato, es introducido en el Ciclo de Krebs, así, el ciclo de Krebs y el Ciclo de la Urea están conectados. El fumarato en el Ciclo de Krebs acaba convirtiéndose en Aspartato, que puede entrar en el ciclo de la Urea para donar su grupo amino a la urea. Todos los aminoácidos desaminados darán lugar a Acetil CoA, acetoacetil CoA o precursores de la gluconeogénesis. Todos los aminoácidos se dividen en 3 grupos: Cetogénicos, Mixtos o Glucogénicos. Los cetogénicos son aquellos que dan lugar a acetil CoA y/o acetoacetil CoA: Lisina y Leucina. Los mixtos son aquellos que dan lugar a acetil CoA y/o acetoacetil CoA y a precursores gluconeogénicos: triptófano, isoleucina, fenilalanina y tirosina. Los glucogénicos son aquellos que solo dan lugar a precursores gluconeogénicos: alanina, cisteína, glicina, serina, threonina, arginina, glutamato, glutamina, histidina, prolina, metionina, valina, aspartato y asparranina.
58 Los aminoácidos que producen piruvato son la Alanina, Cisteína, Glicina, Serina, Threonina y Triptófano (mixto). En períodos de ayuno prolongado, la glucosa del músculo se degrada y pasa a piruvato para después pasar a Alanina en la glucólisis anaeróbia, que llega al hígado para entrar en el ciclo de la urea, siendo el cetoácido correspondiente del piruvato. La glicina puede ser transformada por la serina transhidroxi metilasa, metilenándola, obteniéndose serina que puede dar lugar a piruvato; también puede ser transformada por la Glicina sintasa, desmetilenándola y rompiéndola, obteniéndose un TFH metilado, NH 4 - y CO2. La serina puede ser transformada por la serina deshidratasa, deshidratándola y desaminándola, obteniéndose piruvato o puede ser desmetilenada, obteniéndose de nuevo glicina, que será transformada por la Glicina Sintasa. La cisteína puede ser desaminada, obteniéndose mercapto piruvato, el cual puede perder el grupo tiol por las sulfotransferrasas, obteniéndose piruvato; también puede ser transformada directamente por la cisdesulfhidratasa, desaminándola y destiolándola en un paso, obteniéndose piruvato cuando la cisteína se oxida puede dar taurina, precursora de ácidos biliares. Los aminoácidos que producen oxalacetato o ácido aspártico puede ser introducido en el Ciclo de la Urea o de los purinucleótidos, obteniéndose Fumarato; pero también puede ser desaminado, obteniéndose oxalacetato que es su α-cetoácido correspondiente. La asparragina es transformada por la Asparragina, hidratándola y desaminandola, obteniéndose Aspartato que pasará procesos típicos. Los aminoácidos que producen α-cetoglutarato son la Arginina, el Glutamato, Glutamina, Histidina y Prolina. El Glutamato puede ser transaminado, obteniéndose α-cetoglutarato que es su α-cetoácido correspondiente; o puede ser transformado por la Glutamato deshidrogenasa, desaminándola directamente, obteniéndose de igual forma el α-cetoglutamato. La glutamina es transformada por la Glutaminasa, hidratándola y desaminándola, obteniéndose el ácido glutámico o glutamato.
59 La histidina es muchas veces transformada, desaminándose, isomerizándose, dihidratándose, desformininandose, hasta obtenerse Glutamato que pasará por sus procesos típicos. La arginina puede ser transformada por la arginasa del ciclo de la urea, rompiéndose en urea y ornitina, que será desaminado y posteriormente oxidado, obteniéndose glutamato. La arginina también intervienen en la formación de creatina. La prolina es transformada por la prolina oxidasa, oxidando su anillo que se rompe y el grupo aldehído obteniéndose el Glutamato. Los aminoácidos que producen succinil-coa son la metionina, threonina, valina y isoleucina (mixta). La metionina es parecida a la cisteína, por lo que sufre el mismo problema con el grupo tiol, así que es muchas veces transformada, desmetilándose, desaminándose y destiolándose, descarboxilandose y uniéndose a un grupo CoA, obteniéndose propionil CoA, que es un precursor directo del succinil CoA, también puede unirse a un AMP, obteniéndose el SAM, que cede el metilo obteniéndose L-homocisteína que dará lugar a succinil CoA. La Threonina puede ser transformada por la Serina deshidrogenasa, desaminándola, obteniéndose 2- cetobutirato, punto de encuentro entre la transformación de la Metionina y la de la Threonina, del cual, a través de varias transformaciones se obtiene Succinil CoA. Si la Threonina sufre una descarboxilación y una desaminación, se obtiene Piruvato.
60 Los aminoácidos de cadena ramificada, la valina ( succinil CoA), la Isoleucina ( acetil CoA y succinil CoA), y la Leucina ( acetil CoA y acetoacetil CoA), dan problemas adicionales por su esqueleto. La solución es similar para los tres. La Valina (glucogénico) sufre muchas transformaciones, es desaminada, oxidada y con la adición de una CoA, otra vez oxidada y hidratada obteniéndose succinil CoA. La Isoleucina (mixto) sufre muchas transformaciones hasta obtenerse succinil CoA y acetil CoA. Y la Leucina (cetogénico) también sufre muchas transformaciones hasta obtenerse 3-HMG CoA; que se dividirá en Acetoacetil CoA y Acetil CoA. Los aminoácidos aromáticos, el triptófano (mixto), la Phenilalanina (mixto) y la tirosina (mixto) son tratados de manera particular para obtener de los tres, 2 productos de cada uno (un producto acetilado y un producto glucogénico). El triptófano es transformado por la Dioxigenasa, oxidándolo y rompiéndole el anillo penteno, obteniéndose N-formilquinurenína, que dará lugar a la alanina ( piruvato) y al acetoacetil CoA. La tirosina es muchas veces transformada, desaminándose, oxidándose, oxidándose de nuevo, isomerizándose y rompiéndose, obteniéndose acetoacetato ( acetoacetil CoA) y fumarato. La Phenilalanina es transformada por la Phenilalanina hidroxilasa, oxidándola y deshidratándola, obteniéndose Tirosina, que será transformada muchas veces hasta obtenerse acetil CoA y fumarato.
61 TEMA 15: SÍNTESIS DE AMINOÁCIDOS Las plantas y las bacterias pueden sintetizar todos los aminoácidos a partir de moléculas de Glutamato; incluso algunos pueden absorber directamente el N 2 atmosférico y transformarlo en NH 3. El N 2 es uno de los elementos más abundantes de la atmósfera, pero los animales no son capaces de fijarlo como compuesto orgánico. La fijación del N 2 requiere grandiosa cantidad de enzimas, por lo que es muy difícil de reproducir; in vitro, se requieren 500ºC de temperatura y 300 atmosferas de presión, cuando in vivo, lo hacen a temperatura ambiente y bajo presión atmosférica.
62 Los mamíferos (no rumiantes) tienen una gran cantidad de aminoácidos esenciales que han de ser ingeridos a través de la dieta porque el propio organismo no los puede sintetizar. Lo mismo pasa con las aves, aunque en mayor cantidad. En cambio, los rumiantes tienen la ventaja de poseer una microflora ruminal capacitada para crear todos los tipos de aminoácidos a partir simplemente de la absorción de N en forma de sales de amonio o urea. La deficiencia de aminoácidos esenciales es fatal para el organismo. En resumen, el N 2 es fijado por bacterias Rhizobium en forma de NH 3 ; que luego es transformado en nitratos para facilitar su absorción para las plantas. Estas desnitrificarán el nitrato para rehacer NH 3 y utilizarlo para formar aminoácidos, que serán ingeridos por los animales. La fijación del nitrógeno es la capacidad de asimilar el N 2 en forma de NH 3. El complejo Nitrogenasa está formado por dos subunidades: la subunidad reductasa aporta electrones con elevado poder reductor, y la subunidad nitrogenasa en si utiliza los electrones para reducir el N=N a N-H 3. Los electrones proceden originalmente de NADH ( NAD + ), el cual reduce una ferredoxina que pasará los electrones a la reductasa. La reductasa reducida incorporará ATP s ; todo lo de la reductasa pasará a la nitrogenasa en forma de energía (ATP ADP+Pi) y poder reductor (electrones).
63 Se estima que 1/5 parte del ATP generado por la planta, se consume en esta reacción (fijación de nitrógeno atmosférico). Por cada ciclo de transformación de N 2 a 2NH 3 o 2NH 4 +, se consume el poder reductor de 4 NADH (8 electrones), 8 o 10 protones (para NH 3 o NH 4 + respectivamente) y el poder energético de 16 ATP ( 16ADP+Pi). El proceso de intercambio iónico para la reducción de N 2 puede ser interrumpido por la presencia de O 2 o agentes oxidantes. Las leguminosas fijan y retienen el O 2 para crear un microambiente con poco O 2 gracias a la proteína leghemoglobina. Su centro activo contiene Molibdeno, Hierro y Azufre.
64 El NH + 4 puede ser incorporado a los aminoácidos de distintas formas: en forma de glutamato o glutamina. a) Un α-cetoglutamato es transformado por la Glutamato deshidrogenasa, deshidratándolo, incorporándole el NH4 + y reduciéndolo, obteniéndose glutamato en una reacción en la que se oxida un NADH (NADP + ). b) El glutamato puede incorporarse ya en la producción de aminoácidos o ser transformado por la glutamina sintasa, fosforilandolo y añadiéndole un NH 3 desfosforilándose de nuevo, obteniéndose Glutamina en una reacción en la que se consume un ATP ( ADP). c) La glutamina puede incorporarse ya en la producción de aminoácidos o puede ser transformada por la glutamato sintasa, reduciéndola y agrupándole un α-cetoglutamato, obteniéndose 2 Glutamatos. Cuando el NH 4 + escasea, se crea L-Glutamato a partir de α-cetoglutamato, NH 4 +, NADPH que se oxida y ATP que se desfosforila. La creación de los aminoácidos a partir de sus precursores, podemos observar cómo se complica mayormente en aminoácidos esenciales.
65 El oxalacetato es precursor del aspartato; a su vez, el aspartato es precursor de la asparagina, metionina, threonina y lisina; y a su vez, la threonina es precursora de la isoleucina. El piruvato es precursor de la alanina, valina, leucina e isoleucina. La ribosa 5-p es precursor de la histidina. El Fosfoenol piruvato + Eritrosa 4-P son precursores de la fenilalanina, tirosina y triptófano; a su vez, la fenilalanina es precursora de la tirosina. El α-cetoglutamato es precursor de glutamato; a su vez el Glutamato es precursor de la glutamina, prolina y arginina. El 3-fosfoglicerato es precursor de la serina; a su vez, la serina es precursora de la cisteína y glicina. El piridoxal fosfato es un coezima necesario para la reacción de transaminación. Para las reacciones de transferencia de compuestos de 1 carbono se utilizan como coenzimas la biotina, el SAM y el tetrahidrofolato.
66 El Tetrahidrofolato puede transferir casi todas las formas del carbono: -CH 3, - CH 2 -, -CH=O, -CH- NH, -CH= El α-cetoglutamato es precursor del glutamato; a su vez, el glutamato es precursor de la glutamina, prolina y arginina. El 3-fosfoglicerato es precursor de la serina; a su vez, la serina es precursor de la cisteína y la glicina.
67 El oxalacetato es precursor aspartato; a su vez, el aspartato es precursor asparagina, metionina, threonina y lisina; y a su vez, threonina es precursora isoleucina. El piruvato es precursor de la alanina, valina, leucina e isoleucina. La unión de Eritrosa 4-P con el fosfoenol piruvato forman el corismato, el precursor de los 3 aminoácidos aromáticos: fenilalanina, tirosina y triptófano; a su vez, la fenilalanina puede ser también precursora de la tirosina.
68 La ribosa 5-P es el precursor de la histidina.
69 El paso de glutamato a glutamina dirigido por la glutamina sintasa puede ser inhibido alostéricamente por altas concentraciones de AMP, triptófano, carbamoil-p, CTP, histidina, glucosamina 6-P, glicina y alanina. Bloqueando esta ruta, se bloquea la ruta principal de entrada para el nitrógeno reducido (NH 3 ). TEMA 16: METABOLISMO DE PORFIRINAS Las moléculas que derivan de los aminoácidos son muchas: precursores de DNA, RNA y coenzimas, esfingosina, histamina (vasodilatador), hormonas (tiroxina, adrenalina, ), neurotransmisores (serotonina), NAD + y tetrapirroles. Los tetrapirroles son estructuras compuestas de 4 anillos de pirrol unidos entre si por los carbonos en posición α; con frecuencia se encuentran unidos a un metal mediante enlaces de coordinación. Incluye las porfirinas, clorofilas, ficobilinas y cobalaminas. Las porfirinas están compuestas por un anillo tetrapirrolico con sustituyentes R laterales y un átomo metálico en el centro unido mediante 4 enlaces de coordinación. Se clasifican basándose en los substituyentes R y R laterales del anillo: uroporfirinas, coproporfirinas y protoporfirinas.
70 La glicina es transformada por la δ-aminolevulinato sintasa, fusionándola a un subcinil CoA, obteniéndose δ-aminolevulinato en una reacción en la que se elimina un CO 2 y el grupo CoA. Esta reacción está inhibida por el grupo hemo. 2 δ-aminolevulinatos son transformados por la δ-aminolevulinato deshidratasa, uniéndolos y deshidratándolos, obteniéndose porfobilinógeno; esta reacción es inhibida por grupos hemos y el propio porfobilinógeno. 4 porfobilinógenos son transformados por la porfobilinógeno desaminasa, uniéndolos y desaminandolos, obteniéndose una cadena de hidroximetilbilano, con radicales acetato y propionato unidos a las pentosas. El hidroximetilbilano es transformado por la uroporfirinógeno I sintasa, obteniéndose uroporfirinógeno I; si a la vez, actúa la uroporfirinógeno III sintasa con la I sintasa, se obtiene uroporfirinógeno III (asimétrico), con acetatos y propionatos.
71 El uroporfirinógeno III puede derivar en vitamina B12, clorofila, pero puede ser transformado también por la URO descarboxilasa, descarboxilando los acetatos, obteniéndose coproporfirinógeno III, con metilos y propionatos. El coproporfirinógeno III es transformado por la COPRO oxidasa, descarboxilando 2 de los 4 propionatos, obteniéndose protoporfirinógeno IX, con metilos, propionatos y vinilos. El protoporfirinógeno IX es transformado por la PROTO oxidasa, oxidándolo, obteniéndose protoporfirina IX. La protoporfirina IX es transformada por la ferroquelatasa (hemo sintasa), añadiéndole Fe +++ traído por transferrina, obteniéndose el grupo hemo (Fe ++ ). El grupo hemo Fe ++ es el grupo prostético de la hemoglobina, mioglobina, citocromos, peroxidasa, catalasa La deficiencia de las enzimas que intervienen en el proceso del grupo hemo, puede provocar la aparición de una gran variedad de porfirias, causantes de enfermedades catabólicas.
72 Los grupos hemo son transformados en el bazo por la hemo oxigenasa, obteniéndose biliverdina en una reacción en la que se extrae el Fe +++ y un carbono que se convierte en CO gracias a la oxidación de un NADPH. Este grupo CO es peligroso porque compite con el O 2 por la hemoglobina y puede ser letal. La biliverdina es reducida por la biliverdina reductasa, obteniéndose bilirrubina, que se unirá con un ácido glucoronico. Las porfirinas pueden ser expulsadas del organismo por vía rectal en forma de estercobilina o por via urinaria en forma de urobilina.
73 El grupo hemo y la fabricación de hemoglobina se dan en la médula osea, donde se integra en los eritrocitos. Los eritrocitos resisten durante unos 120 días, momento en el que mueren y la hemoglobina va directamente al bazo a degradarse. La degradación se hace separando el grupo hemo y la globina. La globina se degradará en aminoácidos; el grupo hemo se separará del Fe +++ y se convertirá en biliverdina, luego en bilirrubina no conjugada, y finalmente en bilirrubina conjugada. El Fe +++ será transportado por la transferrina de nuevo a la médula ósea, pasando por el hígado. La bilirrubina conjugada será transportada también al hígado por la arteria hepática, donde se convierte en bilirrubina diglucuronido, la cual pasará a las heces a través del conducto biliar en forma de bilis. TEMA 17: METABOLISMO DE NUCLEÓTIDOS Los nucleótidos son moléculas orgánicas formadas por la unión covalente de un monosacárido de 5 C (pentosa) una base nitrogenada (adenina, guanina, citosina, timina o uracil) y un grupo fosfato. Forman parte de muchas estructuras. Los nucleótidos se dividen en purinas y pirimidinas. Las purinas tienen como bases nitrogenadas adenina o guanina, compuestos heterocíclicos aromáticos; las pirimidinas tienen como bases nitrogenadas uracil, timina o citosina, compuesto con un anillo heterocíclico. Los nucleótidos se sintetizan a través de vías de recuperación o de vías de novo.
74 La via de recuperación utiliza la ribosa activada y la base nitrogenada libre que se recicla. La base nitrogenada y la ribosa activada son fusionadas por la X fosforibosiltransferasa (X = nombre de la base nitrogenada), obteniéndose el nucleótido en una reacción en que se libera un pirifosfato (PPi). La via de novo utiliza la ribosa activada y los compuestos sencillos precursores de la base nitrogenada. Las purinas sintetizas de novo se forman a través de la unión de CO 2, glicina, N-formil THF, glutamina y aspartato. Cuando este anillo de purinas se ensambla a la ribosa fosfato, podrá ser modificado para convertirse en ATP o GTP (nucleótidos del RNA), o en datp o dgtp (nucleótidos del DNA).
75 La obtención de la ribosa activada o PRPP es necesaria para la obtención de terpeno e histidina. La ribosa 5-P es transformada por la ribosa 5-P pirofosfoquinasa o PRPP sintasa, pirofosforilandola, obteniéndose 5-fosforibosil-1-pirofosfato (PRPP) en una reacción en la que se consume ATP. La PRPP es transformada por la glutamina fosforibosilamido transferasa, aminándolo y desfosforilándolo, obteniéndose 5-fosforibosil-1-amina en una reacción en la que se libera pirofosfato (PPi). Con una vida media de 30 segundos, el 5-fosforibosil-1-amida se une a una glicina, se formila, se amina y se deshidrata provocando la ciclación de la cadena carbonada, obteniéndose 5-amino-imidazol ribonucleotido (AIR). El AIR se bicarbonata, se isomeriza, se une a un aspartato, se desprende de un pumarato, se formila y se deshidrata provocando la ciclación de las cadenas obteniéndose inosinato (IMP).
76 El inosinato (IMP) puede ser transformado por la adenil succinato sintasa, uniéndole un aspartato, obteniéndose adenil succinato, que es transformado por la adenil succinato liasa, quitándole un fumarato, obteniéndose adenilato (AMP). También puede ser transformado por la IMP deshidrogenasa, hidratándolo y oxidándolo obteniéndose xantilato, que es transformado por la XMP-glutamina amidotransferasa, aminándolo con el grupo amino de una glutamina ( glutamato), obteniéndose guanilato (GMP). Las pirimidinas sintetizadas de novo se forman a través de la unión de aspartato y carbamoil fosfato. Cuando este anillo de pirimidinas se ensambla a la ribosa-p, podrá ser modificado para convertirse en UTP (nucleótido del RNA), del cual se forman el TMP (nucleótido del DNA) y el CMP (nucleótido del RNA) que podrá ser modificado en dctp (nucleótido del DNA). Todo empieza cuando una glutamina es bicarbonatada por la carbamilfosfato sintasa II, obteniéndose carbamilfosfato y glutámico (reacción inhibida por el UTP). El carbamilfosfato se une a un aspartato (reacción inhibida por el CTP) y se desfosforila, se deshidrata provocando su ciclación, y se oxida y deshidrogena, obteniéndose orotato gracias al complejo enzimático CAD.
77 El orotato se une a un PRPP y se despirofosforila, se descarboxila, y se fosforila dos veces, obteniéndose UTP. El UTP es transformado por la citidinlato sintasa, aminándolo con el grupo amino de una glutamina ( glutamato) y fosforilandolo, obteniéndose CTP. El ribonucleosido difosfato (ADP por ejemplo) es transformado por la ribonucleotido reductasa, reduciéndolo, obteniéndose desoxinucleosido difosfato (dadp por ejemplo) en una reacción en la que se oxida un NADH ( NAD + ). El desoxinucleosido difosfato es fosforilado, obteniéndose desoxinucleosido trifosfato (datp por ejemplo), el cual inhibe la reacción de la ribonucleotido reductasa. La timidina monofosfato es necesaria para el DNA y se obtiene a partir de CDP o UDP. El CDP o UDP se reduce, se fosforila y en caso de empezar con CDP, se desamina, obteniéndose de ambos dutp. El dupt es transformado por la dutpasa, obteniéndose dump, el cual es transformado por la timidilato sintasa (inhibida por fluorouracilo), obteniéndose dtmp.
78 La Timidilato sintasa transforma el dump en dtmp gracias a la donación de un metilo por parte del 5,10- metilen tetrahidrofolato que se transforma en dihidrofolato. El 5,10-metilen tetrahidrofolato se regenera por la acción de la dihidrofolato reductasa (inhibida por la aminopterina y el metotrexato) y la donación de un metilo por parte de una serina ( glicina) posteriormente. La purina AMP se desfosforila y desamina, se desprende de la ribosa y se oxida (reacción inhibida por el alopurinol), obteniéndose Xantina; la purina GTP se transforma en guanina por un sistema similar y se desamina, obteniéndose igualmente Xantina. La xantina se oxida (reacción inhibida por el alopurinol que en los dos casos actua sobre la xantina oxidasa), obteniéndose ácido úrico o urato. Según la especie animal, el producto final de la degradación de purinas puede ser el ácido úrico (primates, aves, reptiles e insectos), alantoina (mamíferos excepto dálmatas), alantoato (peces teleósteros), urea + glioxilato (peces y amfibios) o NH CO 2 (invertebrados marinos).
En las células aerobias distintas vías catabólicas convergen en el ciclo de Krebs
 CICLO DE KREBS Material elaborado por: J. Monza, S. Doldán y S. Signorelli. En las células aerobias distintas vías catabólicas convergen en el ciclo de Krebs El ciclo de Krebs (de los ácidos tricarboxílicos
CICLO DE KREBS Material elaborado por: J. Monza, S. Doldán y S. Signorelli. En las células aerobias distintas vías catabólicas convergen en el ciclo de Krebs El ciclo de Krebs (de los ácidos tricarboxílicos
TEMA 16. Glucolisis. e - ATP. BIOQUÍMICA-1º de Medicina Departamento de Biología Molecular M. Dolores Delgado CO 2 O 2 H 2. Lípidos.
 TEMA 16. Glucolisis. Digestión de glúcidos de la dieta. Absorción de monosacáridos. Transportadores de glucosa. Importancia y destinos de la glucosa. Fases de la glucolisis: esquema general y reacciones.
TEMA 16. Glucolisis. Digestión de glúcidos de la dieta. Absorción de monosacáridos. Transportadores de glucosa. Importancia y destinos de la glucosa. Fases de la glucolisis: esquema general y reacciones.
Tutoría 4: Unidad 2, Capítulos 2 y 3
 Tutoría 4: Unidad 2, Capítulos 2 y 3 Una de las alternativas que, desde, te ofrecemos para acompañarte en el estudio de esta materia, son las tutorías presenciales. En el campus encontrarás el Cronograma
Tutoría 4: Unidad 2, Capítulos 2 y 3 Una de las alternativas que, desde, te ofrecemos para acompañarte en el estudio de esta materia, son las tutorías presenciales. En el campus encontrarás el Cronograma
2. CICLO DE KREBS. RUTA DE LAS PENTOSAS-P
 Departamento de Bioquímica y Biología Molecular PROCESOS bioquimicos Y METABOLICOS 2. CICLO DE KREBS. RUTA DE LAS PENTOSAS-P ESQUEMA - Ciclo de Krebs Generalidades Reacciones del ciclo de Krebs Balance
Departamento de Bioquímica y Biología Molecular PROCESOS bioquimicos Y METABOLICOS 2. CICLO DE KREBS. RUTA DE LAS PENTOSAS-P ESQUEMA - Ciclo de Krebs Generalidades Reacciones del ciclo de Krebs Balance
Vias alternativas de oxidación de Glucosa: Ruta de las pentosas fosfato
 Vias alternativas de oxidación de Glucosa: Ruta de las pentosas fosfato Ruta alternativa de oxidación de glucosa: Ruta de las Pentosas Fosfato Productos primarios: NADPH: agente reductor en biosíntesis.
Vias alternativas de oxidación de Glucosa: Ruta de las pentosas fosfato Ruta alternativa de oxidación de glucosa: Ruta de las Pentosas Fosfato Productos primarios: NADPH: agente reductor en biosíntesis.
Ruta de las pentosas fosfato
 Ruta de las pentosas fosfato La ruta predominante del catabolismo de la glucosa es la glucólisis para dar piruvato, seguida por la oxidación a CO 2 en el ciclo del ácido cítrico. Un proceso alternativo,
Ruta de las pentosas fosfato La ruta predominante del catabolismo de la glucosa es la glucólisis para dar piruvato, seguida por la oxidación a CO 2 en el ciclo del ácido cítrico. Un proceso alternativo,
METABOLISMO CELULAR. Es el conjunto de reacciones químicas a través de las cuales el organismo intercambia materia y energía con el medio
 METABOLISMO CELULAR Es el conjunto de reacciones químicas a través de las cuales el organismo intercambia materia y energía con el medio Reacciones Celulares Básicas. Los sistemas vivos convierten la energía
METABOLISMO CELULAR Es el conjunto de reacciones químicas a través de las cuales el organismo intercambia materia y energía con el medio Reacciones Celulares Básicas. Los sistemas vivos convierten la energía
Catabolismo de la glucosa Ocurre en cuatro etapas:
 1 Catabolismo de la glucosa Ocurre en cuatro etapas: 1.- Glucólisis 2.- Descarboxilación oxidativa 3.- Ciclo de Krebs 4.- Cadena respiratoria o fosforilación oxidativa 1.- GLUCÓLISIS Ocurre en el citoplasma.
1 Catabolismo de la glucosa Ocurre en cuatro etapas: 1.- Glucólisis 2.- Descarboxilación oxidativa 3.- Ciclo de Krebs 4.- Cadena respiratoria o fosforilación oxidativa 1.- GLUCÓLISIS Ocurre en el citoplasma.
FISIOLOGÍA GENERAL Jesús Merino Pérez y María José Noriega Borge
 VIAS METABÓLICAS DE DEGRADACIÓN GLÚCIDOS INTRODUCCIÓN La molécula de glucosa es el principal combustible para la mayoría de los organismos, y en el metabolismo ocupa una de las posiciones centrales más
VIAS METABÓLICAS DE DEGRADACIÓN GLÚCIDOS INTRODUCCIÓN La molécula de glucosa es el principal combustible para la mayoría de los organismos, y en el metabolismo ocupa una de las posiciones centrales más
Metabolismo metabolismo rutas metabólicas. dos fases anabolismo ATP NADPH catabolismo ATP NADH NADPH convergente interconectados
 Metabolismo El metabolismo es el conjunto de procesos, intercambios y transformaciones que tienen lugar en el interior de la célula, catalizados por enzimas. Estos procesos se organizan en rutas metabólicas.
Metabolismo El metabolismo es el conjunto de procesos, intercambios y transformaciones que tienen lugar en el interior de la célula, catalizados por enzimas. Estos procesos se organizan en rutas metabólicas.
TEMA 13. EL METABOLISMO CELULAR 5. PROCESOS DE OXIDO-REDUCCIO E EL METABOLISMO
 TEMA 13. EL METABOLISMO CELULAR 1. METABOLISMO CELULAR: GE ERALIDADES. 2. RUTAS METABÓLICAS. 3. TIPOS DE PROCESOS METABÓLICOS. 4. TIPOS METABOLICOS DE SERES VIVOS. 5. PROCESOS DE OXIDO-REDUCCIO E EL METABOLISMO
TEMA 13. EL METABOLISMO CELULAR 1. METABOLISMO CELULAR: GE ERALIDADES. 2. RUTAS METABÓLICAS. 3. TIPOS DE PROCESOS METABÓLICOS. 4. TIPOS METABOLICOS DE SERES VIVOS. 5. PROCESOS DE OXIDO-REDUCCIO E EL METABOLISMO
Principal vía de catabolismo de Glucosa. Permite la obtención de E metabólica. Obtención de ATP por Fosforilación a nivel de sustrato
 Principal vía de catabolismo de Glucosa Permite la obtención de E metabólica IMPORTANCIA FISIOLÓGICA: ATP Obtención de ATP por Fosforilación a nivel de sustrato 1 En condiciones aeróbicas En condiciones
Principal vía de catabolismo de Glucosa Permite la obtención de E metabólica IMPORTANCIA FISIOLÓGICA: ATP Obtención de ATP por Fosforilación a nivel de sustrato 1 En condiciones aeróbicas En condiciones
DEGRADACIÓN del glucógeno o GLUCOGENOLISIS. Fosforólisis de los enlaces α 1,4-glucosídicos
 Bioquímica-2010-11 (T 23)-1 Tema 23.- Metabolismo del glucógeno: Metabolismo de polisacáridos de reserva. Degradación y Síntesis del glucógeno. Regulación metabólica y hormonal de la glucogenolisis y glucogénesis.
Bioquímica-2010-11 (T 23)-1 Tema 23.- Metabolismo del glucógeno: Metabolismo de polisacáridos de reserva. Degradación y Síntesis del glucógeno. Regulación metabólica y hormonal de la glucogenolisis y glucogénesis.
EL CATABOLISMO. donde tiene lugar, c) qué se genera y d) para qué sirven.
 Concepto de catabolismo y mecanismo general de obtención de energía (ATP, respiración, fermentación). Panorámica general del catabolismo (glúcidos, lípidos y aminoácidos). Glucólisis, ciclo de Krebs, β-oxidación
Concepto de catabolismo y mecanismo general de obtención de energía (ATP, respiración, fermentación). Panorámica general del catabolismo (glúcidos, lípidos y aminoácidos). Glucólisis, ciclo de Krebs, β-oxidación
FUNCIONES DE LA RUTA DE LAS PENTOSAS FOSFATO
 FUNCIONES DE LA RUTA DE LAS La ruta de las pentosas fosfato es una vía de oxidación de la G6P, cuyas funciones son: Generar poder reductor en forma de NADPH. Suministrar esqueletos carbonados de 3, 4,
FUNCIONES DE LA RUTA DE LAS La ruta de las pentosas fosfato es una vía de oxidación de la G6P, cuyas funciones son: Generar poder reductor en forma de NADPH. Suministrar esqueletos carbonados de 3, 4,
BIOQUÍMICA TEMA 3. METABOLISMO CELULAR
 BIOQUÍMICA TEMA 3. METABOLISMO CELULAR D. Ph. Daniel Díaz Plascencia. Contacto: dplascencia@uach.mx www.lebas.com.mx QUÉ ES EL METABOLISMO CELULAR? El metabolismo se podría definir como el conjunto de
BIOQUÍMICA TEMA 3. METABOLISMO CELULAR D. Ph. Daniel Díaz Plascencia. Contacto: dplascencia@uach.mx www.lebas.com.mx QUÉ ES EL METABOLISMO CELULAR? El metabolismo se podría definir como el conjunto de
Principales funciones del hígado. Metabolismo de carbohidratos
 Principales funciones del hígado Metabolismo de carbohidratos Homeostasis de la glucosa sérica Síntesis, almacenamiento y movilización del glucógeno Gluconeogénesis a partir de otros precursores (lactato,
Principales funciones del hígado Metabolismo de carbohidratos Homeostasis de la glucosa sérica Síntesis, almacenamiento y movilización del glucógeno Gluconeogénesis a partir de otros precursores (lactato,
BIOENERGÉTICA CUESTIONARIO
 BIOENERGÉTICA CUESTIONARIO 1) a) El esquema representa una mitocondria con diferentes detalles de su estructura. Identifique las estructuras numeradas del 1 al 8. b) Indique dos procesos de las células
BIOENERGÉTICA CUESTIONARIO 1) a) El esquema representa una mitocondria con diferentes detalles de su estructura. Identifique las estructuras numeradas del 1 al 8. b) Indique dos procesos de las células
En el APOENZIMA se distinguen tres tipos de aminoácidos:
 1. Concepto de biocatalizador. Son sustancias que consiguen que las reacciones se realicen a gran velocidad a bajas temperaturas, ya que disminuyen la energía de activación de los reactivos. Pueden ser:
1. Concepto de biocatalizador. Son sustancias que consiguen que las reacciones se realicen a gran velocidad a bajas temperaturas, ya que disminuyen la energía de activación de los reactivos. Pueden ser:
Objetivos de Aprendizaje:
 Objetivos de Aprendizaje: Resultados de Aprendizaje: METABOLISMO El metabolismo es el conjunto de reacciones y procesos físico-químicos que ocurren en una célula, necesarios para su supervivencia. Estos
Objetivos de Aprendizaje: Resultados de Aprendizaje: METABOLISMO El metabolismo es el conjunto de reacciones y procesos físico-químicos que ocurren en una célula, necesarios para su supervivencia. Estos
2.-FISIOLOGÍA CELULAR
 2.-FISIOLOGÍA CELULAR METABOLISMO CELULAR Metabolismo. Conjunto de reacciones químicas que se dan en un organismo vivo. Se pueden clasificar en dos grandes grupos. Catabolismo: Reacciones degradativas
2.-FISIOLOGÍA CELULAR METABOLISMO CELULAR Metabolismo. Conjunto de reacciones químicas que se dan en un organismo vivo. Se pueden clasificar en dos grandes grupos. Catabolismo: Reacciones degradativas
Biología I. Bioenergética. Examen resuelto del bloque 4: Luis Antonio Mendoza Sierra y Enrique Mendoza Sierra Editorial Trillas ISBN 978-607-17-0640-9
 Biología I Luis Antonio Mendoza Sierra y Enrique Mendoza Sierra Editorial Trillas ISBN 978-607-17-0640-9 Examen resuelto del bloque 4: Bioenergética D.R. 2011, Luis Antonio Mendoza Sierra Este documento
Biología I Luis Antonio Mendoza Sierra y Enrique Mendoza Sierra Editorial Trillas ISBN 978-607-17-0640-9 Examen resuelto del bloque 4: Bioenergética D.R. 2011, Luis Antonio Mendoza Sierra Este documento
Las moléculas de los seres vivos Control de la actividad celular Fuente de energía para las células:
 Las moléculas de los seres vivos Control de la actividad celular Fuente de energía para las células: 1. ATP 2. La respiración celular 3. La fermentación Proceso de fotosíntesis La fuente principal de energía
Las moléculas de los seres vivos Control de la actividad celular Fuente de energía para las células: 1. ATP 2. La respiración celular 3. La fermentación Proceso de fotosíntesis La fuente principal de energía
Cuestiones Selectividad sobre METABOLISMO
 Cuestiones Selectividad sobre METABOLISMO 1.- Con referencia al ciclo de Krebs o ciclo de los ácidos tricarboxílicos de una célula eucariótica: a) Indique el compartimento celular en el que transcurre
Cuestiones Selectividad sobre METABOLISMO 1.- Con referencia al ciclo de Krebs o ciclo de los ácidos tricarboxílicos de una célula eucariótica: a) Indique el compartimento celular en el que transcurre
http://www.biologia54paternal.blogspot.com Unidad 7: Respiración Celular
 1 La energía lumínica es capturada por las plantas verdes y otros organismos fotosintéticos, que la transforman en energía química fijada en moléculas como la glucosa. Estas moléculas son luego degradadas
1 La energía lumínica es capturada por las plantas verdes y otros organismos fotosintéticos, que la transforman en energía química fijada en moléculas como la glucosa. Estas moléculas son luego degradadas
I. IDENTIFICA LA VÍA METABÓLICA QUE CORRESPONDE A LA ECUACIÓN BALANCEADA
 I. IDENTIFICA LA VÍA METABÓLICA QUE CORRESPONDE A LA ECUACIÓN BALANCEADA En la diapositiva número seis anote la letra que corresponda a la ecuación balanceada de cada vía. A) Glucosa + 2 ADP + 2 Pi 2 Lactato
I. IDENTIFICA LA VÍA METABÓLICA QUE CORRESPONDE A LA ECUACIÓN BALANCEADA En la diapositiva número seis anote la letra que corresponda a la ecuación balanceada de cada vía. A) Glucosa + 2 ADP + 2 Pi 2 Lactato
Ciclo de Krebbs, de los ácidos tricarboxílicos o del ácido cítrico
 Catabolismo Es un metabolismo descendente : confluye en un punto común, que va de macromoléculas (complejas) a compuestos sencillos. Se diferencian en tres etapas: Las grandes macromoléculas ingieren se
Catabolismo Es un metabolismo descendente : confluye en un punto común, que va de macromoléculas (complejas) a compuestos sencillos. Se diferencian en tres etapas: Las grandes macromoléculas ingieren se
Presentación organizada por José Antonio Pascual Trillo
 Presentación organizada por José Antonio Pascual Trillo La fotosíntesis es un proceso que se desarrolla en dos etapas: Reacciones lumínicas: es un proceso dependiente de la luz (etapa clara), requiere
Presentación organizada por José Antonio Pascual Trillo La fotosíntesis es un proceso que se desarrolla en dos etapas: Reacciones lumínicas: es un proceso dependiente de la luz (etapa clara), requiere
METABOLISMO ENERGETICO
 METABOLISMO ENERGETICO DESCARBOXILACION OXIDATIVA DEL PIRUVATO Dra. Carmen Aída Martínez Destino del piruvato Puente entre los hidratos de carbono y en ATC PIRUVATO Producto final de glucólisis aeróbica
METABOLISMO ENERGETICO DESCARBOXILACION OXIDATIVA DEL PIRUVATO Dra. Carmen Aída Martínez Destino del piruvato Puente entre los hidratos de carbono y en ATC PIRUVATO Producto final de glucólisis aeróbica
MORFOFISIOLOGIA III VIDEOCONFERENCIA 3 METABOLISMO Y SU REGULACION. METABOLISMO DE LOS TRIACILGLICERIDOS
 MORFOFISIOLOGIA III VIDEOCONFERENCIA 3 METABOLISMO Y SU REGULACION. METABOLISMO DE LOS TRIACILGLICERIDOS LIPOGENESIS La lipogénesis es el proceso de síntesis de los triacilglicéridos; su estructura esta
MORFOFISIOLOGIA III VIDEOCONFERENCIA 3 METABOLISMO Y SU REGULACION. METABOLISMO DE LOS TRIACILGLICERIDOS LIPOGENESIS La lipogénesis es el proceso de síntesis de los triacilglicéridos; su estructura esta
METABOLISMO CELULAR Y FUENTES BIOQUÍMICAS DE ENERGÍA DURANTE EL EJERCICIO AGUDO. Prof. Edgar Lopategui Corsino M.A., Fisiología del Ejercicio
 METABOLISMO CELULAR Y FUENTES BIOQUÍMICAS DE ENERGÍA DURANTE EL EJERCICIO AGUDO Prof. Edgar Lopategui Corsino M.A., Fisiología del Ejercicio TERMODINÁMICA MICA Primera Ley La Energía ni se Crea ni se
METABOLISMO CELULAR Y FUENTES BIOQUÍMICAS DE ENERGÍA DURANTE EL EJERCICIO AGUDO Prof. Edgar Lopategui Corsino M.A., Fisiología del Ejercicio TERMODINÁMICA MICA Primera Ley La Energía ni se Crea ni se
TEMA 19. Ciclo del ácido cítrico (ciclo de los ácidos tricarboxílicos o de Krebs)
 . Ciclo del ácido cítrico (ciclo de los ácidos tricarboxílicos o de Krebs) Importancia del ciclo de Krebs como encrucijada metabólica. Formación del acetil-coenzima-a: el complejo piruvato deshidrogenasa.
. Ciclo del ácido cítrico (ciclo de los ácidos tricarboxílicos o de Krebs) Importancia del ciclo de Krebs como encrucijada metabólica. Formación del acetil-coenzima-a: el complejo piruvato deshidrogenasa.
LA INSULINA DE ACCION EN EL HIPERTIROIDISMO: UN ENFOQUE EN LOS MUSCULOS Y TEJIDO ADIPOSO.
 LA INSULINA DE ACCION EN EL HIPERTIROIDISMO: UN ENFOQUE EN LOS MUSCULOS Y TEJIDO ADIPOSO. INTRODUCCION Las hormonas tiroideas pueden influir en un número de procesos en el cuerpo. Los cambios en sus niveles
LA INSULINA DE ACCION EN EL HIPERTIROIDISMO: UN ENFOQUE EN LOS MUSCULOS Y TEJIDO ADIPOSO. INTRODUCCION Las hormonas tiroideas pueden influir en un número de procesos en el cuerpo. Los cambios en sus niveles
OXIDACIÓN DEL PIRUVATO Y CICLO DE KREBS. Dra. Carmen Aída Martínez
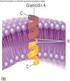 OXIDACIÓN DEL PIRUVATO Y CICLO DE KREBS Dra. Carmen Aída Martínez Fuentes de Acetil CoA Metabolismo del Piruvato Descarboxilación oxidativa del piruvato Puente entre los hidratos de carbono y en ATC
OXIDACIÓN DEL PIRUVATO Y CICLO DE KREBS Dra. Carmen Aída Martínez Fuentes de Acetil CoA Metabolismo del Piruvato Descarboxilación oxidativa del piruvato Puente entre los hidratos de carbono y en ATC
Tema 23.-Biosíntesis de hidratos de carbono. Gluconeogénesis: precursores y regulación. Otras vías gluconeogénicas: ciclo del glioxilato.
 Tema 23.-Biosíntesis de hidratos de carbono. Gluconeogénesis: precursores y regulación. Otras vías gluconeogénicas: ciclo del glioxilato. Síntesis y degradación del glucógeno: enzimas implicadas. Regulación
Tema 23.-Biosíntesis de hidratos de carbono. Gluconeogénesis: precursores y regulación. Otras vías gluconeogénicas: ciclo del glioxilato. Síntesis y degradación del glucógeno: enzimas implicadas. Regulación
Universidad Católica Agropecuaria del Trópico Seco Pbro. Francisco Luis Espinoza Pineda Fundación 1968-2011
 Universidad Católica Agropecuaria del Trópico Seco Pbro. Francisco Luis Espinoza Pineda Fundación 1968-2011 Carrera: Medicina Veterinaria y Zootecnia Asignatura: Bioquímica Oxidaciones Biológicas Introducción
Universidad Católica Agropecuaria del Trópico Seco Pbro. Francisco Luis Espinoza Pineda Fundación 1968-2011 Carrera: Medicina Veterinaria y Zootecnia Asignatura: Bioquímica Oxidaciones Biológicas Introducción
TEMA 15: METABOLISMO: ASPECTOS GENERALES.
 1 TEMA 15: METABOLISMO: ASPECTOS GENERALES. 1.-CONCEPTO DE METABOLISMO. Se denomina metabolismo (o también metabolismo intermediario) al conjunto de reacciones químicas enzimáticamente catalizadas que
1 TEMA 15: METABOLISMO: ASPECTOS GENERALES. 1.-CONCEPTO DE METABOLISMO. Se denomina metabolismo (o también metabolismo intermediario) al conjunto de reacciones químicas enzimáticamente catalizadas que
TEMA 16: EL CATABOLISMO.
 TEMA 16: EL CATABOLISMO. 1 Entre los distintos tipos de biomoléculas orgánicas que forman parte de las células vivas hay que distinguir por un lado a las proteínas y los ácidos nucleicos, cuya misión fundamental
TEMA 16: EL CATABOLISMO. 1 Entre los distintos tipos de biomoléculas orgánicas que forman parte de las células vivas hay que distinguir por un lado a las proteínas y los ácidos nucleicos, cuya misión fundamental
La fosforilación oxidativa
 La fosforilación oxidativa arriba ) Bioenergética del transporte de electrones Transportadores de electrones en la mitocondria 4. Hierro. La reacción redox es la siguiente: Fe 2+ Fe 3+ + e - El átomo
La fosforilación oxidativa arriba ) Bioenergética del transporte de electrones Transportadores de electrones en la mitocondria 4. Hierro. La reacción redox es la siguiente: Fe 2+ Fe 3+ + e - El átomo
Bioquímica Estructural y Metabólica. TEMA 9. Glucólisis
 . Diges(ón de glúcidos de la dieta. Transportadores de glucosa. Importancia y des(nos de la glucosa. Fases de la glucólisis: reacciones. Des(nos del piruvato. Fermentación. Ciclo de Cori. Regulación de
. Diges(ón de glúcidos de la dieta. Transportadores de glucosa. Importancia y des(nos de la glucosa. Fases de la glucólisis: reacciones. Des(nos del piruvato. Fermentación. Ciclo de Cori. Regulación de
OXIDACIÓN DEL PIRUVATO Y CICLO DE KREBS (o ciclo del ácido cítrico, o ciclo de los ácidos tricarboxílicos)
 OXIDACIÓN DEL IRUVATO Y CICLO DE KREBS (o ciclo del ácido cítrico, o ciclo de los ácidos tricarboxílicos) Estos procesos oxidan completamente el piruvato hasta CO 2, es decir completan la oxidación total
OXIDACIÓN DEL IRUVATO Y CICLO DE KREBS (o ciclo del ácido cítrico, o ciclo de los ácidos tricarboxílicos) Estos procesos oxidan completamente el piruvato hasta CO 2, es decir completan la oxidación total
Fundación H.A. Barceló Facultad de Medicina. Licenciatura en Nutrición Bioquímica Primer año Módulo 14 Lección 1
 Fundación H.A. Barceló Facultad de Medicina Licenciatura en Nutrición Bioquímica Primer año Módulo 14 Lección 1 1 Gluconeogénesis La glucosa tiene un papel central en el metabolismo, como combustible y
Fundación H.A. Barceló Facultad de Medicina Licenciatura en Nutrición Bioquímica Primer año Módulo 14 Lección 1 1 Gluconeogénesis La glucosa tiene un papel central en el metabolismo, como combustible y
CICLO DE KREBS. Destinos metabólicos del piruvato 12/04/2012. Colesterol Ácidos Grasos. citrato. citrato. Acetil CoA
 CICLO DE KREBS Destinos metabólicos del piruvato Colesterol Ácidos Grasos citrato citrato Acetil CoA Esqueleto carbonado de Aminoácidos 1 Estructura de la mitocondria Membrana externa Membrana interna
CICLO DE KREBS Destinos metabólicos del piruvato Colesterol Ácidos Grasos citrato citrato Acetil CoA Esqueleto carbonado de Aminoácidos 1 Estructura de la mitocondria Membrana externa Membrana interna
Clasificación de los mecanismos de transporte de solutos a través de membranas
 Clasificación de los mecanismos de transporte de solutos a través de membranas 1. Transporte no mediado o difusión simple (Bicapa lipídica) ( G < 0) 2. Transporte mediado (Proteínas de membrana) 2.1. T.
Clasificación de los mecanismos de transporte de solutos a través de membranas 1. Transporte no mediado o difusión simple (Bicapa lipídica) ( G < 0) 2. Transporte mediado (Proteínas de membrana) 2.1. T.
1- De acuerdo a los datos del gráfico podemos afirmar que :
 Se estudia la cinética de una enzima en presencia y en ausencia de una sustancia X. A continuación se muestra un gráfico de doble recíprocas con la misma cantidad de enzima y en ausencia (0) o, en presencia
Se estudia la cinética de una enzima en presencia y en ausencia de una sustancia X. A continuación se muestra un gráfico de doble recíprocas con la misma cantidad de enzima y en ausencia (0) o, en presencia
Metabolismo de glúcidos
 UT II.- Metabolismo de glúcidos T 18-glicolisis Tema 3.- Degradación n de glúcidos Digestión n de glúcidos de la dieta Degradación n de glucosa por GLUCOLISIS: Características y reacciones Balance químico
UT II.- Metabolismo de glúcidos T 18-glicolisis Tema 3.- Degradación n de glúcidos Digestión n de glúcidos de la dieta Degradación n de glucosa por GLUCOLISIS: Características y reacciones Balance químico
Los mecanismos de las reacciones de la glucólisis son, en general, sustituciones nucleofílicas. Veamos algunos ejemplos:
 METABLISM DE AZÚAES III. Mecanismos de reacción Los mecanismos de las reacciones de la glucólisis son, en general, sustituciones nucleofílicas. Veamos algunos ejemplos:. Transferencia de grupo fosforilo
METABLISM DE AZÚAES III. Mecanismos de reacción Los mecanismos de las reacciones de la glucólisis son, en general, sustituciones nucleofílicas. Veamos algunos ejemplos:. Transferencia de grupo fosforilo
Proceso de Oxidación de la Glucosa
 Proceso de Oxidación de la Glucosa La mitocondria: Tiene como función la realización de procesos de síntesis de energía en forma de ATP. Ocurre en la Matriz mitocondrial: 1. Ciclo de Krebs 2. Fosforilación
Proceso de Oxidación de la Glucosa La mitocondria: Tiene como función la realización de procesos de síntesis de energía en forma de ATP. Ocurre en la Matriz mitocondrial: 1. Ciclo de Krebs 2. Fosforilación
5) EL METABOLISMO CELULAR: GENERALIDADES. ENZIMAS
 5) EL METABOLISMO CELULAR: GENERALIDADES. ENZIMAS EL METABOLISMO: CONCEPTO La nutrición de las células supone una serie de complejos procesos químicos catalizados por enzimas que tienen como finalidad
5) EL METABOLISMO CELULAR: GENERALIDADES. ENZIMAS EL METABOLISMO: CONCEPTO La nutrición de las células supone una serie de complejos procesos químicos catalizados por enzimas que tienen como finalidad
Glicólisis. (citosol)
 Glicólisis (citosol) GLUCÓGENO Glucogénolisis Glucogénesis GLUCOSA Glucólisis Gluconeogénesis LACTATO Glicólisis D-glucosa Piruvato deshidrogenasa 2 Piruvato 2 Acetil CoA Ciclo de Krebs 2 Lactato El
Glicólisis (citosol) GLUCÓGENO Glucogénolisis Glucogénesis GLUCOSA Glucólisis Gluconeogénesis LACTATO Glicólisis D-glucosa Piruvato deshidrogenasa 2 Piruvato 2 Acetil CoA Ciclo de Krebs 2 Lactato El
Metabolismo de carbohidratos 2 (PirDH y ciclo de Krebs) Marijose Artolozaga Sustacha, MSc
 Metabolismo de carbohidratos 2 (PirDH y ciclo de Krebs) Marijose Artolozaga Sustacha, MSc Descarboxilación oxidativa Descarboxilación oxidativa En la matriz mitocondrial Irreversible O 2 Complejo Piruvato
Metabolismo de carbohidratos 2 (PirDH y ciclo de Krebs) Marijose Artolozaga Sustacha, MSc Descarboxilación oxidativa Descarboxilación oxidativa En la matriz mitocondrial Irreversible O 2 Complejo Piruvato
TEMA 5: Nutrición y metabolismo
 TEMA 5: Nutrición y metabolismo 5.1 Concepto de nutrición. Nutrición autótrofa y heterótrofa. Los seres vivos son sistemas abiertos, esto quiere decir que hay un intercambio continuo de materia y energía.
TEMA 5: Nutrición y metabolismo 5.1 Concepto de nutrición. Nutrición autótrofa y heterótrofa. Los seres vivos son sistemas abiertos, esto quiere decir que hay un intercambio continuo de materia y energía.
CONTROL DE LA ACTIVIDAD CELULAR
 CONTROL DE LA ACTIVIDAD CELULAR Sumario Las Moléculas de los Seres Vivos Control de la actividad celular 1. Las reacciones celulares básicas 2. El control de las reacciones celulares 3. Los modelos de
CONTROL DE LA ACTIVIDAD CELULAR Sumario Las Moléculas de los Seres Vivos Control de la actividad celular 1. Las reacciones celulares básicas 2. El control de las reacciones celulares 3. Los modelos de
GLUCO-NEO. NEO-GÉNESIS: NESIS: esquema general Ruta anabólica que se produce en hígado y riñón
 T 6-gluconeogénesis GLUCO-NEO NEO-GÉNESIS: NESIS: esquema general Ruta anabólica que se produce en hígado y riñón Glucosa6- fosfatasa La gluconeogénesis convierte dos moléculas de piruvato en una de glucosa
T 6-gluconeogénesis GLUCO-NEO NEO-GÉNESIS: NESIS: esquema general Ruta anabólica que se produce en hígado y riñón Glucosa6- fosfatasa La gluconeogénesis convierte dos moléculas de piruvato en una de glucosa
Metabolismo de Hidratos de. Parte II
 Metabolismo de Hidratos de Carbono Parte II GLUCONEOGENESIS: Cómo se la define?: Es la síntesis de glucosa a partir de compuestos no glucídicos, como: aminoácidos, piruvato proveniente de la transaminación
Metabolismo de Hidratos de Carbono Parte II GLUCONEOGENESIS: Cómo se la define?: Es la síntesis de glucosa a partir de compuestos no glucídicos, como: aminoácidos, piruvato proveniente de la transaminación
TRABAJO PRÁCTICO 12 Puntos de fuga Reacciones anapleróticas - Lanzaderas
 TRABAJO PRÁCTICO 12 Puntos de fuga Reacciones anapleróticas - Lanzaderas Puntos de fuga y reacciones anapleróticas El ciclo de Krebs o ciclo de los ácidos tricarboxílicos (CAT) es una vía anfibólica, eso
TRABAJO PRÁCTICO 12 Puntos de fuga Reacciones anapleróticas - Lanzaderas Puntos de fuga y reacciones anapleróticas El ciclo de Krebs o ciclo de los ácidos tricarboxílicos (CAT) es una vía anfibólica, eso
Reacciones de oxidación y reducción
 METABOLISMO Reacciones de oxidación y reducción (deshidrogenación) (hidrogenación) Oxidación-Reducción biológica Oxidación H H + e- Molécula orgánica Coenzima NAD+ Molécula orgánica oxidada NADH + H +
METABOLISMO Reacciones de oxidación y reducción (deshidrogenación) (hidrogenación) Oxidación-Reducción biológica Oxidación H H + e- Molécula orgánica Coenzima NAD+ Molécula orgánica oxidada NADH + H +
Oxidación de ácidos grasos y ciclo de Krebs Departamento de Bioquímica Noviembre de 2005
 U.T.I. Biología Celular Oxidación de ácidos grasos y ciclo de Krebs Departamento de Bioquímica Noviembre de 2005 Fases de la respiración celular 1. La oxidación de ácidos grasos, glucosa y algunos aminoácidos
U.T.I. Biología Celular Oxidación de ácidos grasos y ciclo de Krebs Departamento de Bioquímica Noviembre de 2005 Fases de la respiración celular 1. La oxidación de ácidos grasos, glucosa y algunos aminoácidos
Bioquímica. Tema 7 Regulación hormonal e integración del metabolismo. Lic. Alejandro Llanes Mazón thyngum@gmail.com
 Bioquímica Tema 7 Regulación hormonal e integración del metabolismo Lic. Alejandro Llanes Mazón thyngum@gmail.com Regulación hormonal La regulación hormonal del metabolismo de los carbohidratos está orientada
Bioquímica Tema 7 Regulación hormonal e integración del metabolismo Lic. Alejandro Llanes Mazón thyngum@gmail.com Regulación hormonal La regulación hormonal del metabolismo de los carbohidratos está orientada
Fosforilación a nivel de sustrato. Fosforilación Oxidativa (Fosforilación a nivel de Cadena Respiratoria).
 Fosforilación a nivel de sustrato Fosforilación Oxidativa (Fosforilación a nivel de Cadena Respiratoria). La Fosforilación a nivel de sustrato es un mecanismo poco habitual de formación de ATP FOSFOGLICERATO
Fosforilación a nivel de sustrato Fosforilación Oxidativa (Fosforilación a nivel de Cadena Respiratoria). La Fosforilación a nivel de sustrato es un mecanismo poco habitual de formación de ATP FOSFOGLICERATO
CADENA RESPIRATORIA O CADENA DE TRANSPORTE DE ELECTRONES
 CADENA RESPIRATORIA O CADENA DE TRANSPORTE DE ELECTRONES El NADH y FADH2 obtenidos contienen un par de electrones que se transfieren al O2 con liberación de energía. La cadena respiratoria transporta los
CADENA RESPIRATORIA O CADENA DE TRANSPORTE DE ELECTRONES El NADH y FADH2 obtenidos contienen un par de electrones que se transfieren al O2 con liberación de energía. La cadena respiratoria transporta los
TEMA V. GLUCONEOGÉNESIS. 1.Generalidades 2.Regulación
 TEMA V. GLUCONEOGÉNESIS 1.Generalidades 2.Regulación CONDICIONES DE AYUNO PROLONGADO, ENTRE COMIDAS, DESPUÉS DEL EJERCICIO VIGOROSO LA RESERVA DE GLUCOSA SE AGOTA (GLUCÓGENO) SE REQUIERE SINTETIZAR GLUCOSA
TEMA V. GLUCONEOGÉNESIS 1.Generalidades 2.Regulación CONDICIONES DE AYUNO PROLONGADO, ENTRE COMIDAS, DESPUÉS DEL EJERCICIO VIGOROSO LA RESERVA DE GLUCOSA SE AGOTA (GLUCÓGENO) SE REQUIERE SINTETIZAR GLUCOSA
La célula vegetal: aspectos estructurales y metabólicos diferenciados
 La célula vegetal: aspectos estructurales y metabólicos diferenciados Descripción de la célula vegetal La célula vegetal presenta algunas diferenciaciones morfológicas respecto a la célula animal: a) Tienen
La célula vegetal: aspectos estructurales y metabólicos diferenciados Descripción de la célula vegetal La célula vegetal presenta algunas diferenciaciones morfológicas respecto a la célula animal: a) Tienen
FISIOLOGÍA GENERAL Jesús Merino Pérez y María José Noriega Borge
 BIOENERGÉTICA Y METABOLISMO INTRODUCCIÓN Los seres vivos son sistemas químicos autónomos que se autopropagan. Están construidos por un conjunto limitado de moléculas basadas en el carbono. Los organismos,
BIOENERGÉTICA Y METABOLISMO INTRODUCCIÓN Los seres vivos son sistemas químicos autónomos que se autopropagan. Están construidos por un conjunto limitado de moléculas basadas en el carbono. Los organismos,
METABOLISMO INTEGRATIVO Parte 2. Concentración circulante de glucosa (glicemia) se regula por acción coordinada de insulina y glucagón.
 Universidad de Chile Facultad Ciencias Químicas y Farmacéuticas Química Fisiológica y Patología Integrada I 2015 METABOLISMO INTEGRATIVO Parte 2 Sergio Lavandero, PhD PRINCIPALES REGULADORES DEL METABOLISMO
Universidad de Chile Facultad Ciencias Químicas y Farmacéuticas Química Fisiológica y Patología Integrada I 2015 METABOLISMO INTEGRATIVO Parte 2 Sergio Lavandero, PhD PRINCIPALES REGULADORES DEL METABOLISMO
CONSUMO DE FRUCTOSA Y OBESIDAD
 CONSUMO DE FRUCTOSA Y OBESIDAD IX Curso Internacional de Actualización en Nutrición Las grasas y Aceites en la Alimentación Sociedad Peruana de Nutrición Emilio Guija Poma Universidad Científica del Sur
CONSUMO DE FRUCTOSA Y OBESIDAD IX Curso Internacional de Actualización en Nutrición Las grasas y Aceites en la Alimentación Sociedad Peruana de Nutrición Emilio Guija Poma Universidad Científica del Sur
Dra. Carmen Aída Martínez
 Dra. Carmen Aída Martínez Fosforilación a nivel de sustrato Fosforilación Oxidativa (Fosforilación a nivel de Cadena Respiratoria). La Fosforilación a nivel de sustrato es un mecanismo poco habitual de
Dra. Carmen Aída Martínez Fosforilación a nivel de sustrato Fosforilación Oxidativa (Fosforilación a nivel de Cadena Respiratoria). La Fosforilación a nivel de sustrato es un mecanismo poco habitual de
Biología(Celular(y(Molecular0(CBCC(10(Facultad(de(Medicina(
 Biología(Celular(y(Molecular0(CBCC(10(Facultad(de(Medicina( LEA$$ATENTAMENTE$$ESTAS$$INSTRUCCIONES$ $ PORDISPOSICIÓNDELCONSEJODEFACULTADDEMEDICINAESTAPROHIBIDOTENER TELEFONOSCELULARESENCENDIDOS.Encasodetenerunoverifiquequeesté
Biología(Celular(y(Molecular0(CBCC(10(Facultad(de(Medicina( LEA$$ATENTAMENTE$$ESTAS$$INSTRUCCIONES$ $ PORDISPOSICIÓNDELCONSEJODEFACULTADDEMEDICINAESTAPROHIBIDOTENER TELEFONOSCELULARESENCENDIDOS.Encasodetenerunoverifiquequeesté
Mecanismo de reacción de la citrato sintasa
 Reacción 1. Citrato sintasa: Condensación del acetilo y el oxalacetato. Es una reacción muy exergónica (-32,2 Kj/mol). Mecanismo de reacción de la citrato sintasa La reacción es semejante a una condensación
Reacción 1. Citrato sintasa: Condensación del acetilo y el oxalacetato. Es una reacción muy exergónica (-32,2 Kj/mol). Mecanismo de reacción de la citrato sintasa La reacción es semejante a una condensación
BIOQUÍMICA-1º de Medicina Departamento de Biología Molecular M. Dolores Delgado IMPORTANCIA Y FUNCIÓN DEL GLUCÓGENO
 . Metabolismo del glucógeno. Imortancia y función del glucógeno. Degradación del glucógeno: glucógeno, enzima desramificante. Biosíntesis del glucógeno: glucógeno, enzima ramificante. Regulación hormonal
. Metabolismo del glucógeno. Imortancia y función del glucógeno. Degradación del glucógeno: glucógeno, enzima desramificante. Biosíntesis del glucógeno: glucógeno, enzima ramificante. Regulación hormonal
www.selectividadfacil.com
 10.- ANABOLISMO Es la parte del metabolismo encargada de transformar la materia inorgánica en materia orgánica. Solo se lleva a cabo en células autótrofas mediante la fotosíntesis y la quimiosíntesis.
10.- ANABOLISMO Es la parte del metabolismo encargada de transformar la materia inorgánica en materia orgánica. Solo se lleva a cabo en células autótrofas mediante la fotosíntesis y la quimiosíntesis.
CONCEPTOS BÁSICOS Y VISIÓN GENERAL DEL METABOLISMO
 CNCEPTS BÁSICS Y VISIÓN GENERAL DEL METABLISM Meta: después de, junto a, mas allá Bole: lanzamiento, acción de arrojar Metabolismo: cambio, capacidad que tienen los seres vivos de transformar las substancias.
CNCEPTS BÁSICS Y VISIÓN GENERAL DEL METABLISM Meta: después de, junto a, mas allá Bole: lanzamiento, acción de arrojar Metabolismo: cambio, capacidad que tienen los seres vivos de transformar las substancias.
(NADH, FADH 2 ) (FAD +, NAD)
 GLUCÓLISIS GNG Proteínas Polisacáridos Lípidos Aminoácidos Monosacáridos Glicerol Ác. Grasos Gliceraldehído 3-P Acetil CoA CICLO DE KREBS CO 2 (NADH, FADH 2 ) Ruta catabólica NH 3 ADP Transporte electrónico
GLUCÓLISIS GNG Proteínas Polisacáridos Lípidos Aminoácidos Monosacáridos Glicerol Ác. Grasos Gliceraldehído 3-P Acetil CoA CICLO DE KREBS CO 2 (NADH, FADH 2 ) Ruta catabólica NH 3 ADP Transporte electrónico
CURSO PATOLOGIAS CRONICAS. Dra Lilian Pelzer
 CURSO PATOLOGIAS CRONICAS Dra Lilian Pelzer 2014 MODULO II 1 objetivo del Modulo: Recordar y reforzar los conocimientos basicos del sistema metabolico Diabetes 2 objetivo: Abordar Diabetes ( diferentes
CURSO PATOLOGIAS CRONICAS Dra Lilian Pelzer 2014 MODULO II 1 objetivo del Modulo: Recordar y reforzar los conocimientos basicos del sistema metabolico Diabetes 2 objetivo: Abordar Diabetes ( diferentes
Glucógeno, almidón, sacarosa. almacenamiento. Glucosa. Oxidación vía glucólisis. Oxidación ruta de las pentosas fosfato
 GLUCÓLISIS CO 2 NH 4 H 2 O Glucógeno, almidón, sacarosa almacenamiento Oxidación ruta de las pentosas fosfato Glucosa Oxidación vía glucólisis Ribosa 5-fosfato Piruvato del griego Glykos = dulce Lysis
GLUCÓLISIS CO 2 NH 4 H 2 O Glucógeno, almidón, sacarosa almacenamiento Oxidación ruta de las pentosas fosfato Glucosa Oxidación vía glucólisis Ribosa 5-fosfato Piruvato del griego Glykos = dulce Lysis
PROCESO: el sistema cambia de estado
 UNIVERSO UNIVERSO ENTORNO SISTEMA estado A PROCESO: el sistema cambia de estado ENTORNO SISTEMA estado B La energía total del universo no cambia durante el proceso, pero generalmente habrá un INTERCAMBIO
UNIVERSO UNIVERSO ENTORNO SISTEMA estado A PROCESO: el sistema cambia de estado ENTORNO SISTEMA estado B La energía total del universo no cambia durante el proceso, pero generalmente habrá un INTERCAMBIO
(Vía aerobia) Pág. 177
 (Vía aerobia) Pág. 177 Dos vías: 1.- Aerobia (Respiración Celular) 2.- Anaerobia (Fermentaciones) VÍA AEROBIA Es un proceso aerobio que consiste en degradar G-6-P en CO 2, H 2 O y ATP, cuyo balance es:
(Vía aerobia) Pág. 177 Dos vías: 1.- Aerobia (Respiración Celular) 2.- Anaerobia (Fermentaciones) VÍA AEROBIA Es un proceso aerobio que consiste en degradar G-6-P en CO 2, H 2 O y ATP, cuyo balance es:
Bioquímica Estructural y Metabólica. TEMA 10. Gluconeogénesis
 y ruta de las pentosas fosfato. Gluconeogénesis, principales sustratos. Reacciones enzimá7cas. Balance energé7co. Regulación recíproca de la glucólisis y la gluconeogénesis. Ruta de las pentosas fosfato.
y ruta de las pentosas fosfato. Gluconeogénesis, principales sustratos. Reacciones enzimá7cas. Balance energé7co. Regulación recíproca de la glucólisis y la gluconeogénesis. Ruta de las pentosas fosfato.
TREHALASA( 2"x" Glucosa"
 Las preguntas a 5 refieren a la actividad de la enzima Trehalasa. La trehalosa es un disacárido NO reductor formado por 2 moléculas de glucosa. En el intestino es hidrolizado por la enzima TREHALASA. TREHALASA(
Las preguntas a 5 refieren a la actividad de la enzima Trehalasa. La trehalosa es un disacárido NO reductor formado por 2 moléculas de glucosa. En el intestino es hidrolizado por la enzima TREHALASA. TREHALASA(
Biología I. Biología I. Tema 6. Respiración celular. Explicar en qué consiste la respiración aeróbica y las etapas que la conforman.
 Biología I Tema 6. Respiración celular 1 Objetivo de aprendizaje del tema Al finalizar el tema serás capaz de: Explicar en qué consiste la respiración aeróbica y las etapas que la conforman. Explicar en
Biología I Tema 6. Respiración celular 1 Objetivo de aprendizaje del tema Al finalizar el tema serás capaz de: Explicar en qué consiste la respiración aeróbica y las etapas que la conforman. Explicar en
ESTRATEGIAS DEL METABOLISMO ENERGÉTICO.
 PRINCIPALES VÍAS Y ESTRATEGIAS DEL METABOLISMO ENERGÉTICO. RODRIGUEZ PAVIA BLANCA ISABEL BELTRAN LARA CRESCENCIO JIMENEZ MESINAS CESAR ULISES Todas las unidades biológicas se alimentan, con la finalidad
PRINCIPALES VÍAS Y ESTRATEGIAS DEL METABOLISMO ENERGÉTICO. RODRIGUEZ PAVIA BLANCA ISABEL BELTRAN LARA CRESCENCIO JIMENEZ MESINAS CESAR ULISES Todas las unidades biológicas se alimentan, con la finalidad
Metabolismo de carbohidratos 4 (Gluconeogénesis) Marijose Artolozaga Sustacha, MSc
 Metabolismo de carbohidratos 4 (Gluconeogénesis) Marijose Artolozaga Sustacha, MSc GLUCONEOGÉNESIS Gluconeogénesis Cerebro necesita 120 g de glucosa / día Cuerpo completo: 160 g / día No siempre alcanzan
Metabolismo de carbohidratos 4 (Gluconeogénesis) Marijose Artolozaga Sustacha, MSc GLUCONEOGÉNESIS Gluconeogénesis Cerebro necesita 120 g de glucosa / día Cuerpo completo: 160 g / día No siempre alcanzan
TEMA 10 EL METABOLISMO CELULAR. CATABOLISMO. 1. Características del metabolismo celular
 TEMA 10 EL METABOLISMO CELULAR. CATABOLISMO 1. Características del metabolismo celular - El Metabolismo celular es el conjunto de reacciones químicas que se produce en el interior de las células para obtener
TEMA 10 EL METABOLISMO CELULAR. CATABOLISMO 1. Características del metabolismo celular - El Metabolismo celular es el conjunto de reacciones químicas que se produce en el interior de las células para obtener
Metabolismo de carbohidratos 4 (Gluconeogénesis) Marijose Artolozaga Sustacha, MSc
 Metabolismo de carbohidratos 4 (Gluconeogénesis) Marijose Artolozaga Sustacha, MSc GLUCONEOGÉNESIS Gluconeogénesis Cerebro necesita 120 g de glucosa / día Cuerpo completo: 160 g / día No siempre alcanzan
Metabolismo de carbohidratos 4 (Gluconeogénesis) Marijose Artolozaga Sustacha, MSc GLUCONEOGÉNESIS Gluconeogénesis Cerebro necesita 120 g de glucosa / día Cuerpo completo: 160 g / día No siempre alcanzan
Metabolismo II. Anabolismo
 Metabolismo II. Anabolismo I. Definición II. Tipos de anabolismo III. Anabolismo Heterótrofo A. Gluconeogénesis B. Glucogenogénesis C. Amilogénesis D. Anabolismo de lípidos E. Anabolismo de proteínas F.
Metabolismo II. Anabolismo I. Definición II. Tipos de anabolismo III. Anabolismo Heterótrofo A. Gluconeogénesis B. Glucogenogénesis C. Amilogénesis D. Anabolismo de lípidos E. Anabolismo de proteínas F.
FOSFOLIPASAS. Las fosfolipasas son moléculas capaces de romper los fosfolípidos
 FOSFOLIPASAS Las fosfolipasas son moléculas capaces de romper los fosfolípidos de membrana. Se nombran dependiendo del punto en que cortan a ese fosfolípido. Las fosfolipasas de tipo C serán capaces de
FOSFOLIPASAS Las fosfolipasas son moléculas capaces de romper los fosfolípidos de membrana. Se nombran dependiendo del punto en que cortan a ese fosfolípido. Las fosfolipasas de tipo C serán capaces de
Metabolismo de carbohidratos 4. Marijose Artolozaga Sustacha, MSc
 Metabolismo de carbohidratos 4 Marijose Artolozaga Sustacha, MSc GLUCONEOGÉNESIS Gluconeogénesis Cerebro necesita 120 g de glucosa / día Cuerpo completo: 160 g / día No siempre alcanzan las reservas en
Metabolismo de carbohidratos 4 Marijose Artolozaga Sustacha, MSc GLUCONEOGÉNESIS Gluconeogénesis Cerebro necesita 120 g de glucosa / día Cuerpo completo: 160 g / día No siempre alcanzan las reservas en
DEPARTAMENTO DE BIOQUÍMICA ESFUNO - EUTM CICLO DE KREBS CADENA RESPIRATORIA FOSFORILACION OXIDATIVA
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO - EUTM CICLO DE KREBS CADENA RESPIRATORIA FOSFORILACION OXIDATIVA MITOCONDRIA Central energética celular El metabolismo aeróbico tiene 3 fases: I. Oxidación de glucosa,
DEPARTAMENTO DE BIOQUÍMICA ESFUNO - EUTM CICLO DE KREBS CADENA RESPIRATORIA FOSFORILACION OXIDATIVA MITOCONDRIA Central energética celular El metabolismo aeróbico tiene 3 fases: I. Oxidación de glucosa,
Introducción. vlocalizado en las mitocondrias. varranca los e- de los HC, AG y proteínas
 Ciclo de los TCA Introducción vlocalizado en las mitocondrias varranca los e- de los HC, AG y proteínas vgenera NADH y FAHD2 que se usan para la producción de energía vrequiere O2 de forma indirecta Introducción
Ciclo de los TCA Introducción vlocalizado en las mitocondrias varranca los e- de los HC, AG y proteínas vgenera NADH y FAHD2 que se usan para la producción de energía vrequiere O2 de forma indirecta Introducción
Funciones de la membrana plasmática. Tipos de células. Células emisoras
 Funciones de la membrana plasmática. Podemos señalar dos funciones principales: Intercambio de sustancias. La membrana va a dejar pasar hacia el citoplasma determinados nutrientes. Para poder llevar a
Funciones de la membrana plasmática. Podemos señalar dos funciones principales: Intercambio de sustancias. La membrana va a dejar pasar hacia el citoplasma determinados nutrientes. Para poder llevar a
Ciclo del ácido cítrico (Krebs o Ciclo de los ácidos tricarboxílicos
 Ciclo del ácido cítrico (Krebs o Ciclo de los ácidos tricarboxílicos Oxidación de los derivados de la glucosa para dar CO 2 Dentro de la mitocondria (eucariotas) Eje central del metabolismo celular Vía
Ciclo del ácido cítrico (Krebs o Ciclo de los ácidos tricarboxílicos Oxidación de los derivados de la glucosa para dar CO 2 Dentro de la mitocondria (eucariotas) Eje central del metabolismo celular Vía
CONCEPTOS DE LA FUERZA
 CONCEPTOS DE LA FUERZA PAPEL DE LA FUERZA EN EL RENDIMIENTO DEPORTIVO La mejora de la fuerza es un factor importante en todas las actividades deportivas, y en algunos casos determinantes (en el arbitraje
CONCEPTOS DE LA FUERZA PAPEL DE LA FUERZA EN EL RENDIMIENTO DEPORTIVO La mejora de la fuerza es un factor importante en todas las actividades deportivas, y en algunos casos determinantes (en el arbitraje
Metabolismo de carbohidratos 2
 Metabolismo de carbohidratos 2 Ciclo de Krebs Marijose Artolozaga Sustacha, MSc CICLO DE KREBS Ciclo de Krebs: En la mitocondria En todas las células Excepto eritrocitos: no tienen mitocondrias En condiciones
Metabolismo de carbohidratos 2 Ciclo de Krebs Marijose Artolozaga Sustacha, MSc CICLO DE KREBS Ciclo de Krebs: En la mitocondria En todas las células Excepto eritrocitos: no tienen mitocondrias En condiciones
Integración del metabolismo
 Integración del metabolismo Estrategias importantes del catabolismo 1. El ATP es la unidad biológica universal de energía. La hidrólisis del ATP cambia el cociente de equilibrio por un factor de 108. La
Integración del metabolismo Estrategias importantes del catabolismo 1. El ATP es la unidad biológica universal de energía. La hidrólisis del ATP cambia el cociente de equilibrio por un factor de 108. La
